Kapitel 12: ELEKTRISCHE POTENTIALE AN MEMBRANEN
Werbung

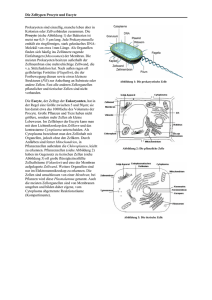
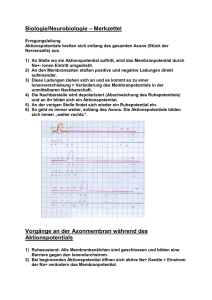
Kapitel 12: ELEKTRISCHE POTENTIALE AN MEMBRANEN Inhalt: EINLEITUNG ............................................................................................................................ 181 PHYSIKOCHEMISCHE GRUNDLAGEN DES MEMBRANPOTENTIALS .................................................... 181 DAS MEMBRANPOTENTIAL ........................................................................................................ 192 LITERATUR .............................................................................................................................. 199 LINKS ..................................................................................................................................... 200 Einleitung An der Zellmembran fast aller lebender Zellen lassen sich elektrische Spannungen ableiten (sog. Transmembranpotentiale), die sich z.T. auch sehr schnell zeitlich ändern. Man spricht z.B. von • Ruhepotential bei (fast) allen lebende Zellen • Aktionspotentialen bei Nerven-, Muskel- und Drüsenzellen • Rezeptorpotentialen bei Sinneszellen • Synaptischen Potentialen zur funktionellen Kopplung von Nerven u. Muskeln untereinander Physikochemische Grundlagen des Membranpotentials Elektrochemische Potentiale Taucht man zwei Platten aus unterschiedlichem Metall in eine Lösung ihrer Salze und verbindet diese leitend, so lässt sich zwischen den Platten eine Spannung messen. 181 ELEKTRISCHE POTENTIALE AN MEMBRANEN U Zn Cu 1 M CuSO4 1 M ZnSO4 Abb. 135: Galvanische Zelle Die gemessene Spannung ist dabei umso größer, je edler das eine Metall und je unedler das andere Metall ist. Zn ↔ Zn2+ + 2e- Cl + e- ↔ Cl- Solche Redoxpaare werden nach den Halbzellenpotentialen unter Standardbedingungen in der elektrochemische Spannungsreihe angeordnet. Diese Normalpotentiale werden gegen die Normalwasserstoffelektrode gemessen. Das tatsächliche Halbzellenpotential ergibt sich nach dem Nernstschen Gesetz: Ψ = E = Eo + RT c ox ln zF c red E0: Normalpotential; R: Gaskonstante T: absolute Temperatur; z: Wertigkeit Feststoffe haben dabei die Konzentration 1. Die elektrochemische Potentialdifferenz (also eine elektrische Spannung!) zweier Redoxpaare ergibt sich aus der Summe ihrer Halbzellenpotentiale d.h.: RT c aA c bB U = ∆E = ∆E + ln zF c cC c dD 0 182 BIOPHYSIK DER ZELLE Der Term c Aa c Bb entspricht hier der Gleichgewichtskonstanten K der Reaktion. Mit dieser cCc c Dd Form der Nernstgleichung lassen sich also nur Potentialdifferenzen im chemischen Gleichgewicht bestimmen. U Cu Cu 1 M CuSO4 10 mM CuSO4 Abb. 136: Konzentrationszelle Taucht man zwei gleiche Metallplatten in Salzlösungen unterschiedlicher Konzentration, so ergibt sich für die gemessene Spannung: U = ∆Ψ = RT c1 ln zF c 2 Nernst für Biologen Transport von Ionen im elektrischen Feld Elektrolytische Leitung Elektrolyte sind Stoffe, deren Moleküle zu Ionen dissoziieren können und daher elektrischen Strom leiten. Elektrolyte sind z.B. wässrige Lösungen von Säuren und Basen sowie deren Salze, aber auch Salzschmelzen. Taucht man Drähte oder Platten ("Elektroden") aus einem Metall (z.B. Platin, Silber) in einen Elektrolyten ein, so fließt beim Anlegen einer Gleichspannung U ein elektrischer Strom I. Dieser Ladungstransport kommt dadurch zustande, dass in der wässrigen Lösung positive Ionen (Kationen) zur einen Elektrode (Kathode), negative Ionen (Anionen) zur anderen Elektrode (Anode) wandern. 183 ELEKTRISCHE POTENTIALE AN MEMBRANEN - + + H2 - + Cl - - H + - I + - + + + + - Cl2 + - + - -wässrige HCl-Lösung - + Abb. 137: Elektrolyse und elektrolytische Leitung Im Gegensatz zur elektrolytischen "Ionenwanderung" werden in metallischen Leitern die Ladungen über die Elektronen (e-) transportiert. An der Grenzfläche Elektrode/Lösung findet also ein Übergang von einem "elektronischen" zu einem "ionischen" Leitungsmechanismus statt. Dieser ist mit einer chemischen Reaktion an den Elektroden ("Elektrolyse") verbunden. In einem solchen System (Abb. 137) laufen folgende Reaktionen ab: Kathode : 2 H (+gelöst ) + 2e (−Metall) Anode : 2 Cl (−gelöst ) → H 2 ( gasförmig ) ↑ → 2e (−Metall) + Cl 2 ( gasförmig ) ↑ Fließt während der Zeit t ein konstanter Strom I, so wird insgesamt die Ladung Q = I t transportiert. Q wird in der Einheit Coulomb angegeben (1 C = 1 As). Die an den Elektroden umgesetzten Stoffmengen sind proportional zur transportierten Ladung Q. Für die Abscheidung von 1 Mol einer einwertigen Ionensorte benötigt man 96500 C; diese Zahl bezeichnet man als FARADAY-Konstante: F = e0 N A = 96500 C mol wobei e0 = 1,602 10-19As (Elementarladung) NA = 6,023 1023 mol-1 (Avogadrokonstante) 184 BIOPHYSIK DER ZELLE Für eine Ionensorte der Wertigkeit z benötigt man zur Abscheidung von N mol die Ladung Q=N z F Faradysches Gesetz Wird an einen Elektrolyten von außen eine Spannung U angelegt, so baut sich im Elektrolyt ein Elektrisches Feld der Feldstärke E E= dΨ = konst. dx Dieses Feld wird die Ionen des Elektrolyts zunächst beschleunigen bis sie durch innere Reibung eine konstante Wanderungsgeschwindigkeit annehmen mit r dΨ v=u dx u ist die Beweglichkeit des Ions und abhängig vom Reibungskoeffizienten fi und der Ladung des Ions u=− z e0 fi cm 2 V sec Nach Einstein ist der Reibungskoeffizient mit der Diffusionskonstanten verknüpft nach RT kT = N A f i 6πηr D= d.h. ze 0 N A D RT zF = −D RT u=− Der Beitrag einer Ionensorte am Gesamtstrom durch den Elektrolyten ist dann: I ion = dN ion dQ = e0 dt dt mit 185 ELEKTRISCHE POTENTIALE AN MEMBRANEN dN r = A v cion dt d.h. I ion = A z F u cion E Elektrodiffusion Analog zum Diffusionsflux lässt sich im elektrischen Feld auch ein Ladungsflux definieren J el , x = r dN = cion v A dt mit einer Flussdichte φ x , el = Jx A = − z u cx dψ dx Ionen in Lösung werden sich bei angelegtem Feld sowohl diffus (d.h. ungerichtet) als auch entlang des Feldes (also gerichtet) bewegen. Betrachtet man den Gesamtflux so erhält man die Nernst-Planck Gleichung φx , ges = φx , diff + φx , el = −D dc dψ − z ucx dx dx dc zF dψ = − D + cx dx dx RT Diffusionspotentiale Eine Anwendung für die Nernst-Planck Gleichung stellt die Ableitung der Größe von Diffusionspotentialen dar. Diffusionspotentiale entstehen immer dann, wenn zwei Lösungen eines Elektrolyten mit unterschiedlichen Konzentrationen aneinandergrenzen. Im Normalfall sind positive und negative Ionen in einer Lösung in gleicher Anzahl vorhanden und gleichmäßig verteilt. Die Lösung erscheint nach außen hin neutral. Ist allerdings ein Konzentrationsgradient vorhanden, so werden die Ionen in den weniger konzentrierten Raum einwandern und einen Ausgleich der Konzentrationsdifferenz herbeiführen. 186 BIOPHYSIK DER ZELLE Sind jedoch die mittleren Diffusionsgeschwindigkeiten von Anionen und Kationen unterschiedlich, so werden die beweglicheren Ionen schneller in das Gebiet der kleineren Konzentration wandern. Es kommt zur Ladungstrennung. Dadurch baut sich aber entlang des Konzentrationsgradienten ein elektrischer Potentialgradient auf, der dieser Ladungstrennung entgegenwirkt und das schnellere Ion "abbremst". Diffusionspotentiale werden gemessen, indem man Gefäße mit unterschiedlich konzentrierten Elektrolytlösungen durch eine dünne Kapillare als Diffusionsstrecke verbindet. Die Lösungen in den Vorratsgefäßen werden durch Rührer gut durchmischt, ihre Konzentration verändert sich also über den Messzeitraum nicht merklich. + - + + + - + - - - + - - + + + + +- - - - + - + - + + - + + + - - + - + - + - + Abb. 138: Entstehung eines Diffusionspotentials D − DAnion RT c1 ln U Diff = Kation DKation + DAnion zF c2 u − u Anion RT c1 = Kation ln u Kation + u Anion zF c2 Für 18°C und z = 1 gilt: 187 ELEKTRISCHE POTENTIALE AN MEMBRANEN Kationen Anionen cm 2 Vsec cm 2 Vsec u in u in H+ Na+ K+ 31,80 × 10-4 4,35 × 10-4 6,47 × 10-4 OHCl- 17,40 6,54 Für ein Konzentrationsverhältnis von 10 : 1 ergibt sich dann z.B. für HCl UDiff = 38 mV, für NaCl UDiff = -12 mV und für KCl UDiff = -3 mV ! Ideal selektive Membran Ein Spezialfall eines Diffusionspotentials tritt auf, wenn man zwei Räume V1 und V2 durch eine ideal selektiv permeable Membran trennt, die z.B. nur für eine Ionensorte z.B. K+ durchlässig ist (z.B. Bilayermembran mit Valinomycin, einem K+Carrier, dotiert). Hier ersetzen wir die Diffusionsstrecke (die Kapillare) durch die Membran. - + + + + - + + - + + + - - + + + - - - - + + - - - + - + - + - + - + - + + - + + - +- - + - + + - + + + + - + + + + Abb. 139: Ideal selektiv permeable Membran Füllt man die beiden Räume mit einer Elektrolytlösung z.B. KCl unterschiedlicher Konzentration c1 und c2, so wird sich nach kurzer Zeit eine Spannung (Potentialdifferenz ∆Ψ ) messen lassen. Diese Potentialdifferenz ergibt sich dadurch, dass die Ionen entlang ihrem 188 BIOPHYSIK DER ZELLE Konzentrationsgefälle von der Lösung höherer Konzentration zur niedrigeren Konzentration wandern. Hierbei wird osmotische Arbeit verrichtet. Da die Membran für Chloridionen aber nicht durchlässig ist, kommt es zu einer Ladungstrennung über die Membran. Es baut sich ein elektrisches Feld auf, das dem "Diffusionsdruck" entgegen wirkt. Da die Membran für Cl- nicht durchlässig ist, ist uAnion = 0 (keine Beweglichkeit des Anions in der Membran). Somit ist u − 0 RT c1 U = Kation ln u + 0 Kation zF c2 RT c1 ln zF c2 = und wir erhalten das Membranpotential als die Gleichgewichtsspannung nach Nernst für das permeable Ion. Gibbs-Donnan Gleichgewicht Ein weiterer Spezialfall stellt sich ein, wenn die Membran für alle bis auf eine der beteiligten Ionensorten permeabel ist. In einer lebenden Zelle liegt der pH-Wert des Cytosols in der Regel um 7. Da der isoelektrische Punkt der Zellproteine in der Regel ca. bei pH 5 liegt, kommen diese in der Zelle vorwiegend als Anionen (Pr-) vor. Die Zellmembran ist in erster Näherung für die großen Proteinmoleküle (Pr -) impermeabel, für die kleineren Kationen und Anionen (z.B. K+, Cl -) aber weitgehend permeabel. Wir können diese Situation nachstellen, indem wir auf eine Seite einer Dialysemembran eine Salzlösung wie z.B. 100 mM KCl geben und auf die andere Seite eine äquimolare Lösung eines Proteins mit seinen Gegenionen. ∆ϕ = 0 ∆π = 0 Osmolarität 200 mOsM - 100 + + + + + + 100 mM +K + + ±0 Ladung + + + 100 - 200 mOsM - 100 mM P + - + - + innen - + + 100 + - + + - + Cl 100 mM - + - - + 100 + mM K + + + + + + - + + 100 - - + - + ±0 aussen Abb. 140: Ausgangsbedingungen für die Einstellung eines Donnangleichgewichts Das permeable Anion Cl- wird nun seinem Konzentrationsgradienten folgen und in das andere Kompartiment hineindiffundieren, da die Dialysemembran ja für kleine Teilchen 189 ELEKTRISCHE POTENTIALE AN MEMBRANEN durchlässig ist. Da innerhalb einer Elektrolytlösung stets Elektroneutralität herrschen muss (d.h. es müssen im Mittel gleichviele positiven wie negativen Teilchen da sein), müssen die K+-Kationen diesem Cl --Einstrom folgen. K+ wird also gegen seinen Konzentrationsgradienten wandern. Der unidirektionale Flux für diese Anionen-Kationenpaare über die Membran ist [ ] [M ] r J = −P A − + 1 1 [ ] [M ] w J = −P A − + 2 2 Im Gleichgewicht heben sich diese Fluxe gerade auf, d.h. für die Konzentration der permeablen Anionen [A-] und Kationen [M+] im Raum V1 und V2 gilt dann die folgende Beziehung: r w J=J [A ] [M ] = [A ] [M ] − + 1 1 − + 2 2 Diesen Fall bezeichnet man auch als Donnan-Gleichgewicht. Dieses Gleichgewicht ist charakterisiert durch den sog. Donnankoeffizienten g [M ] = [A ] [M ] [A ] + + − 1 − 2 2 =g 1 Wäre die Membran für alle beteiligten Ionensorten permeabel, würde sich mit der Zeit ein Konzentrationsausgleich einstellen und der Donnankoeffizient wäre g = 1. Im oben gezeigten Experiment ist dies jedoch nicht der Fall. [ ] [ ] Setzen wir Pr − = X und die ausgewanderten Cl- Ionen A − 1= n dann ergeben sich die Konzentrationen zu [Pr ] = X [M ] = X + n [A ] = n [M ] = X − n [A ] = X − n − + − + − oder 190 1 1 2 2 BIOPHYSIK DER ZELLE [M ] [M ] + + 1 2 [ ] [ ] − X+n A = = − X−n A 2 X−n =g n = 1 Im Gleichgewichtszustand wird daher die Gesamtkonzentration der freibeweglichen intrazellulären Ionen größer sein als die der freibeweglichen extrazellulären Ionen. In lebenden Zellen gilt daher stets g < 1. ∆ϕ < 0 ∆π > 0 Osmolarität 266 mOsM + + + + 33 - 100 ±0 Ladung + mM Cl - - + 33 + - + + - + - + + + + 67 - 67 mM Cl- - - 67 + + - - + + + + + - - 100 mM P 67 mM K + + - - + + + + + 133 -mM K+ + 134 mOsM - + + 133 + -18 mV - + ±0 aussen innen Abb. 141: Ionenverteilung beim Donnangleichgewicht Dieses Ungleichgewicht der Ionen hat ein Transmembranpotential, das sog Donnan-Potential UD zur Folge, das sich mit der Nernst-Gleichung für z-wertige Ionen quantitativ angeben lässt: UD = [ ] [ ] RT M + ln + zF M 1 = 2 [ ] [ ] RT A − ln − zF A 2 = 1 RT ln g zF Definitionsgemäß ist der extrazelluläre Raum auf Potential 0 gelegt, damit ist der intrazelluläre Raum für alle g < 1 auf negativem Potential. Für Zimmertemperatur und monovalente Ionen gilt die Abschätzung: U D = 59mV log g Das Donnan-Gleichgewicht ist ein thermodynamisches Gleichgewicht, das durch reine Diffusion ohne äußere Energiezufuhr zustandekommt. Für die jeweiligen Gesamtkonzentrationen O1 und O2 an osmotisch wirksamen Teilchen gilt: [ ] [ ] + [Pr ] O1 = M + 1 + A − 1 [ ] + [A ] O2 = M+ 2 − − 1 2 Es gibt also im Zellinneren (Pr - + n) mehr Ionen als außerhalb der Zelle. Der Konzentrationsunterschied bewirkt einen höheren osmotischen Druck in der Zelle: 191 ELEKTRISCHE POTENTIALE AN MEMBRANEN ∆π = RT ∆O = RT ∆n Dieser kolloidosmotische Druck wird nicht von den Proteinmolekülen, sondern nur von den Gegenionen verursacht. Tierische Zellen verfügen über keine Zellwand, die diesem osmotischen Druck entgegenwirken kann. Bei tierischen Zellen darf sich daher nie ein echtes Donnan-Gleichgewicht ausbilden, da die Zellen dann Wasser aufnehmen und platzen würden. Lebende Zellen sind daher auf die Aufrechterhaltung eines Fliessgleichgewichts (steady-state) unter Aufwendung von metabolischer Energie (Na+/K+-ATPase) angewiesen. Dies ist auch der Grund, weshalb alle tierische Zellen ein negative Membranpotential aufweisen, da dieses einem Chlorideinstrom und so dem Erreichen des DonnanGleichgewichtes entgegenwirkt. Das Membranpotential Bei praktisch allen lebenden Zellen besteht zwischen Zellinnenraum und dem Außenmedium eine Potentialdifferenz, das Membranpotential. Unter normalen Bedingungen ist dabei das Zellinnere gegenüber dem Außenmedium negativ geladen. Dem Außenmedium wird außerdem per Konvention das Potential Null (also Erde) zugeordnet. Durch die Na+/K+Pumpe befinden sich die Ionen nicht im Gleichgewicht (s. Tabelle 4). Tabelle 4. Konzentrationsverteilung und Permeabilität der wichtigsten Ionen an der Nervenzellmembran Ionen + K Na+ Cl- Außen Innen E κ 4,5 mM 145 mM 100 mM 160 mM 15 mM 5 mM -94 mV +60 mV -80 mV 1,0 0,02 0,2 κ Permeabilität des Ions X relativ zum K+ Ion. An der Entstehung des Membranpotentials sind also mehrere Ionensorten beteiligt, die aber unterschiedlich zum Gesamtpotential beitragen. Wie wir schon beim Diffusionspotential und bei der ideal selektiv permeablen Membran gesehen haben, ist dabei der Beitrag der einzelnen Ionenspecies umso größer, je größer ihre Beweglichkeit bzw. ihre Permeabilität ist. Für geladene Teilchen ist die Permeabilität außerdem direkt proportional zur Leitfähigkeit G. Dies lässt sich daher in einem Ersatzschaltbild veranschaulichen: 192 BIOPHYSIK DER ZELLE Aussen K Cl - Na EK ECl ENa + + + - CMem + Innen Abb. 142: Ersatzschaltbild für eine Nervenmembran oder anders in der sog. Goldmann-Gleichung U Mem [ ] [ ] [ ] [ ] [ ] [ ] + + − RT PK + K a + PNa + Na a + PCl − Cl ln = zF P + K + i + P + Na + i + P − Cl − K Na Cl [ ] [ ] [ ] [ ] [ ] [ ] + + − RT K a + κ Na + Na a + κ Cl− Cl = ln + zF K i + κ Na + Na + i + κ Cl− Cl − i a i a Das Ruhepotential Wie aus der Tabelle 4 oben zu entnehmen ist, verhalten sich die Leitwerte unter Ruhebedingungen wie GK+:GCl-:GNa+ = 1 : 0.2 : 0.02 Die Strom-Spannungskennlinie für dieses Ersatzschaltbild sieht dann so aus: 193 ELEKTRISCHE POTENTIALE AN MEMBRANEN K Na+ ClGesamt Strom 300 + 250 200 150 100 50 0 -100 -80 -60 -40 -20 0 20 40 -50 60 80 Spannung 100 -100 Abb. 143: Strom-Spannungskennlinie einer Modellmembran im Ruhezustand Unter Ruhebedingungen ist das K+-Ion das bei weitem durchgängigste Ion, bestimmt daher das Gesamtpotential. Zur Schätzung des Ruhepotentials einer Zelle kann daher in erster Näherung das Gleichgewichtspotential für K+ nach Nernst herangezogen werden U Mem ≈ [ ] [ ] R T K+ ln + zF K aussen innen Zähler und Nenner des Konzentrationsverhältnisses ergeben sich daher, dass bei elektrophysiologischen Messungen immer gegen das Badmedium als Referenz gemessen wird. Das Potential des Extrazellulärraumes wird daher per Konvention dem Erdpotential gleichgesetzt d.h. es hat das Potential 0. Da das Membranpotential innen negativ ist, muss der Bruch einen Wert kleiner als 1 ergeben. Da außerdem die Kaliumkonzentration im Innern höher ist als Außen, ergibt sich, dass für Kationen stets das Verhältnis [Aussen ] [Innen ] , für Anionen stets [Innen ] [Aussen ] eingesetzt wird. Das Aktionspotential (AP) Bei einigen Zellen ist das Membranpotential zeitlich nicht konstant, man spricht dann von erregbaren Zellen. Nervenaktionspotential Insbesondere bei Nervenfasern kann sich das Membranpotential sprunghaft ändern, mit einem charakteristischen Zeitverlauf. 194 BIOPHYSIK DER ZELLE relative Refraktärperiode absolute 40 Repolarisation 0 Aufstrich, Depolarisation -50 Schwellwert Schwellwert “Overshoot” Reiz -100 0 1 2 3 4 t / msec Abb. 144: Zeitverlauf eines Nervenaktionspotentials Aktionspotentiale folgen einem Alles oder Nichts Gesetz, d.h. wenn ein bestimmter Schwellwert überschritten wird, läuft der Vorgang immer und ganz stereotyp ab. Während des Aktionspotentials kommt es durch Aktivierung spannungsgesteuerter Na+Kanäle kurzfristig zu einem Anstieg der Na+-Leitfähigkeit, die wiederum eine Depolarisation bewirkt und sich so selbst verstärkt. U GNa G GK t Abb. 145: Leitfähigkeitsänderungen beim Nervenaktionspotential Im Peak des Aktionspotentials ist daher die Na+-Leitfähigkeit bestimmend und die StromSpannungskennlinie der Membran ließe sich etwa so modellhaft darstellen 195 ELEKTRISCHE POTENTIALE AN MEMBRANEN Strom K+ Na+ ClGesamt 300 250 200 150 100 50 0 -100 -80 -60 -40 -20 0 20 -50 40 60 80 100 Spannung -100 Abb. 146: Strom-Spannungskennlinie einer Modellmembran am Peak des Aktionspotentials Nach einiger Zeit inaktivieren diese Kanäle und schließen dann wieder. Gleichzeitig kommt es zu einem verzögerten Anstieg der K+-Leitfähigkeit (durch Aktivierung sog. delayed rectifier K+Kanäle), die das Membranpotential wieder auf seinen ursprünglichen Wert oder sogar darüber hinaus zurückregulieren. Nach Ablauf des Aktionspotentials kann kurzfristig kein neues Aktionspotential mehr ausgelöst werden. Die Dauer dieser Periode nennt man absolute Refraktärzeit. Sie beträgt ca. 1 ms. Danach ist die Auslösung eines neuen Aktionspotentials abhängig von der Reizstärke. Die wird dadurch verursacht, dass die spannungsgesteuerten Na+-Kanäle ja noch inaktiviert sind und einige Zeit benötigen, um wieder in den aktivierbaren Zustand zurückzukehren. Diese Refraktärzeit stellt sicher, dass sich das Aktionspotential gerichtet im Axon ausbreitet. Refraktäre Zone Kreisströmchen Abb. 147: Erregungsausbreitung entlang eines nicht myellinisierten Axons Die Ausbreitungsgeschwindigkeit ist abhängig von der Längskonstanten der Membran, d.h. vom Axondurchmesser bzw. vom Querwiderstand. Bei Vertebraten sind Nervenfasern daher mit einer isolierenden Myelinscheide aus Schwannschen Zellen umgeben. Bei myelinisierten Fasern sind nur die Membranen im Bereich der Ranvierschen Schnürringe erregbar (der Rest ist isoliert) => saltatorische Erregungsleitung 196 BIOPHYSIK DER ZELLE Herzaktionspotential In Cardiomyocyten findet man eine besondere Form des Aktionspotentials. Viele Herzzellen sind autorhythmisch, d.h. sie erzeugen sich den Reiz für die Auslösung eines Aktionspotentials selbst. Solche Zellen findet man in den sog. Schrittmacherzentren des Herzens (z.B. im AV-Knoten). Sie fallen besonders dadurch auf, dass sie eine hohe Na+Leckleitfähigkeit besitzen und daher spontan depolarisieren. 40 Plateau 0 -50 Schwellwert spontane Depolarisation -100 0 500 1000 t / msec Abb. 148: Herzaktionspotential Ein weiteres Merkmal von Herzaktionspotentialen ist eine extrem lange Plateauphase, die durch eine Ca2+ Leitfähigkeit erzeugt wird. Diese erzeugt den Ca2+ Einstrom, der für die Kontraktion der Muskelfasern benötigt wird. Herzzellen haben auch eine sehr lange Refraktärperiode, was die maximale Schlagfrequenz beschränkt. Herzaktionspotentiale mit Refraktärperiode dauern ca. 300-1000 ms, die normale Herzfrequenz beträgt also ca. 1 oder 1 s Hertz´. Das Rezeptorpotential Rezeptoren sind spezielle Zellen, die es uns ermöglichen, Umweltreize aufzunehmen und zu verarbeiten (z.B. Stäbchen und Zapfen in der Retina, Chemorezeptoren auf der Zunge, Schmerzrezeptoren in der Haut). Diese Zellen besitzen einen Sensormechanismus, der äußere Signale wie z.B. Licht in eine Änderung des Membranpotentials umwandelt, das Rezeptorpotential. Im Gegensatz zum Axon, bei dem die Information über die Frequenz der Abfolge von Aktionspotentialen kodiert wird (Frequenzmodulation) ist die Information über die Stärke z.B. eines Lichtreizes bei Rezeptorpotentialen direkt in der Potentialänderung enthalten, die er auslöst. Rezeptorpotentiale sind also amplitudenmoduliert. 197 ELEKTRISCHE POTENTIALE AN MEMBRANEN Synaptische Potentiale und Informationsverarbeitung an Nervenzellen Eine besondere Form des Rezeptorpotentials findet man an den Verbindungspunkten zweier Nervenzellen, den sog. Synapsen. Präsynapse synaptische Bläschen mit Neurotransmitter Aktionspotential excitatorisches postsynaptisches Potential (EPSP) synaptischer Spalt postsynaptische Membran Postsynapse inhibitorisches postsynaptisches Potential (IPSP) Abb. 149: Aufbau und Funktion einer chemischen Synapse Bei chemischen Synapsen löst ein Aktionspotential an der präsynaptischen Membran die Freisetzung einer Botensubstanz (dem sog. Neurotransmitter) aus synaptischen Vesikeln aus. Dieser Transmitter diffundiert über den synaptischen Spalt, d.h. den Interzellulärraum, der an dieser Stelle nur ca. 200 nm breit ist. An der postsynaptischen Membran bindet der Transmitter an chemische Rezeptoren, die dann eine Leitfähigkeitsänderung für bestimmte Ionen und damit eine (zunächst lokale) Änderung des Membranpotentials zur Folge hat, das postsynaptischen Potential. Dieses dauert nur sehr kurz, da der Neurotransmitter im synaptischen Spalt sofort deaktiviert wird, indem er z.B. enzymatisch gespalten wird. Abhängig davon, welche Leitfähigkeiten verändert werden können diese postsynaptischen Potentiale depolarisierend (d.h. erregend = excitatorisch) oder hyperpolarisierend (d.h. hemmend = inhibitorisch) sein. Entsprechend spricht man dann von hemmenden bzw. erregenden Synapsen. Ob eine Synapse erregend oder hemmend wirkt, hängt vornehmlich von ihren Neurotransmittern bzw. deren Rezeptoren ab z.B.: Acetylcholin (Neuromuskuläre Endplatte, erregend) Glutamat (ZNS, erregend) GABA ( γ - Aminobuttersäure, ZNS, hemmend) Die Wirkung eines Neurotransmitters auf die Membranleitfähigkeit kann entweder indirekt oder direkt erfolgen. Bei einer direkten Wirkung ist der Rezeptor und der Effektor identisch. Man spricht dann von einem ionotropen Rezeptoren oder einem ligandengesteuerte Ionenkanal (z.B. der nikotinische Acetylcholinrezeptor). 198 BIOPHYSIK DER ZELLE Bei einer indirekten Wirkung sind Rezeptor und Effektor nicht identisch. Man spricht dann von metabotropen Rezeptoren (z.B. der muscarinische Acetylcholinrezeptor). Diese wirken dann z.B. über G-Protein Kaskaden auf second Messenger gesteuerte Ionenkanäle. Generatorpotential Postsynaptische Potentiale breiten sich auf dem Zellleib einer Nervenzelle elektroton aus und summieren sich dort zum sog. Generatorpotential. Überschreitet dieses Generatorpotential am Axonhügel wieder den Schwellwert, kann dort ein neues Aktionspotential ausgelöst werden. Da eine Nervenzelle sehr viele synaptische Eingänge besitzt, die zudem noch in unterschiedlichem Abstand zum Axonhügel ankommen, werden diese Eingänge zeitlich und räumlich gewichtet aufsummiert und verrechnet. Man spricht von einer räumlichen und zeitlichen Summation. Σ Schwellwert überschritten ? Abb. 150: Signalverarbeitung am Neuron Literatur 1. Molecular Biology of the Cell B. Alberts, D. Bray, J. Lewis, M. Raff, K. Roberts, J.D. Watson Garland Publishing Inc., New Jork & London, 1994 (3. Auflage) (auch auf deutsch bei VCH) 2. Physikalische Chemie und Biophysik G. Adam, P. Läuger, G. Stark Springer-Verlag, Berlin - Heidelberg - New York, 1995 (3. Auflage) 3. Neurobiologie H. Reichert Georg Thieme Verlag Stuttgart - New York, 2000 (2. Auflage) 4. Cell Physiology Source Book N. Sperelakis (ed.) Academic Press, New York 2001 (3. Auflage) 5. Ionic Channels of Excitable Membranes B. Hille Sinauer Associates, Sunderland MA, 1992 (2. Auflage) 199 ELEKTRISCHE POTENTIALE AN MEMBRANEN Links 200 • Biophysics Textbook online der Biophysical Society () • The Nerve Impulse. (F. Bezanilla; )