KW37/Platin Prof. Mathias S. Wickleder
Werbung

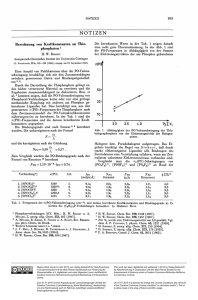
KW37/Platin Prof. Mathias S. Wickleder Vom „kleinen Silber“ zur technologischen Bedeutung Das Element Platin (Pt) ist schon den indigenen Völkern Südamerikas bekannt gewesen. Die spanischen Eroberer Südamerikas konnten mit dem Metall zunächst wenig anfangen. Es war weniger glänzend als das begehrte Silber und aufgrund seines hohen Schmelzpunktes zu jener Zeit auch nicht schmiedbar. Die Spanier nannten das Metall daher etwas abwertend platina, was in Anlehnung an das spanische Wort für Silber, plata, soviel wie kleines Silber heißt. Trotzdem wurde das Metall im ausgehenden 18. Jahrhundert in Madrid intensiv von dem französischen Chemiker Chabaneau untersucht. Diese Untersuchungen waren der Ausgangspunkt für die Entdeckung der Elemente Palladium (Pd), Rhodium (Rh), Iridium (Ir), Ruthenium (Ru) und Osmium (Os), die schließlich unter dem Begriff Platinmetalle zusammengefasst wurden. Seine besondere Bedeutung in der öffentlichen Wahrnehmung erhielt Platin Ende des 19. Jahrhunderts durch seinen zunehmenden Einsatz in der Schmuckanfertigung, denn aufgrund seiner - verglichen mit Gold und Silber - viel größeren Härte konnte es hervorragend zum Einfassen schwerer Edelsteine verwendet werden. Zur selben Zeit wuchs auch die technologische Bedeutung des Elements. Hierzu trug besonders die Erkenntnis von Wilhelm Ostwald bei, dass sich in Gegenwart des Metalls Ammoniak (NH3) zu Stickstoffdioxid (NO2) oxidieren ließ, aus dem schließlich Salpetersäure gewonnen wurde (Ostwald-Prozess). Diese katalytische Reaktion ist deshalb so bedeutsam, weil der Bedarf an Nitraten zu Beginn des 20. Jahrhunderts erheblich war, zur Darstellung von Düngemitteln ebenso wie für militärische Zwecke. Ammoniak war zunächst als Abfallprodukt der Kokereien und später durch das Haber-Bosch-Verfahren verfügbar. Aufgrund ihrer großen chemischen Beständigkeit werden die Platinmetalle und die benachbarten Elemente Gold (Au) und Silber (Ag) unter dem Begriff Edelmetalle zusammengefasst. Diese Beständigkeit führt nach wie vor zu vielen Anwendungen, nicht nur in der Fertigung von Wertgegenständen wie Schmuck und Münzen, sondern auch im medizinischen und vor allem zahnmedizinischen Bereich. Auch im chemischen Labor sind Geräte und Apparaturen aus Edelmetallen nicht mehr wegzudenken und der Platintiegel zur Durchführung saurer Aufschlüsse ist jedem Chemiker ab dem ersten Semester ein Begriff. Oxidationsstufenvielfalt Trotz der chemischen Reaktionsträgheit von Platin sind mittlerweile viele Verbindungen des Metalls bekannt. Es zeichnet sich dabei durch eine große Vielzahl von Oxidationsstufen aus, die in diesen Verbindungen auftreten. So sind die Fluoride PtF6 und PtF5 einzigartig innerhalb der Gruppe 10 des Periodensystems, zumal die Elemente Pd und Ni maximal bis zur Vierwertigkeit oxidiert werden können [1,2]. PtF6 hat als außerordentlich starkes Oxidationsmittel Berühmtheit erlangt, da mit dieser Verbindung erstmalig die Oxidation des Edelgases Xenon gelang, womit der Beginn der Edelgaschemie eingeläutet wurde. Das Auftreten der höchsten Oxidationsstufen bei www.Aktuelle-Wochenschau.de dem jeweils schwersten Gruppenhomologen beobachtet man auch in den Nachbargruppen 9 und 11, in denen Iridium und Gold die Oxidationsstufen +IX und +V einnehmen können [3,4]. Diese Beobachtung wird auf die sogenannten relativistischen Effekte zurückgeführt (siehe Kasten), die insbesondere bei den Elementen Platin und Gold sehr ausgeprägt sind [5]. Neben den hohen Oxidationsstufen ist vor allem das Auftreten negativer Oxidationsstufen für das Element Platin eine bemerkenswerte Auswirkung der relativistischen Effekte. Ein besonders prägnantes Beispiel ist das rote, salzartige Cs2Pt, das aus den Elementen erhalten werden kann (Abb. 1) [6]. Abbildung 1 Kristallstruktur von Cs2Pt. Die rote Verbindung kristallisiert in einer salzartigen Struktur mit den Pt2-Ionen (rot) und neunfacher Koordination von Cs+-Kationen (grau). Neben dem oben erwähnten Fluoriden PtF6 und PtF5 führt die Oxidation von Platin häufig zu zwei- und vierwertigen Verbindungen. In der Oxidationsstufe +II zeigen diese Verbindungen fast ausschließlich eine quadratisch-planare Umgebung des Metalls, während in Strukturen mit vierwertigem Platin vornehmend oktaedrische Metallkoordination beobachtet wird. Strukturchemisch spannend sind vor allem Verbindungen des dreiwertigen Platins. Die elektronische d7-Konfiguration führt zu einem ungepaarten Elektron, welches in Pt(III)Salzen nahezu immer zum Auftreten von besonders stabilen Metall-Metall-Bindungen führt. Die hierbei gebildeten hantelförmigen [Pt2]6+-Ionen können besonders gut von chelatisierenden Liganden koordiniert werden. Vor allem mit den tetraedrischen SO42--Ionen wurden viele Verbindungen beschrieben, in denen die [Pt2]-Hanteln von vier Sulfatgruppen in Form des typischen paddlewheel-Motivs umgeben sind (Abb. 2) [7]. www.Aktuelle-Wochenschau.de Abbildung 2 In den Strukturen von Sulfaten des dreiwertigen Platins treten [Pt2]-Hanteln auf (schwarz hervorgehoben), die von vier chelatisierenden, tetraedrischen [SO4]2- -Gruppen umgeben sind (paddlewheelMotiv). Die terminalen Positionen der Hanteln können von weiteren tetraedrischen Anionen besetzt werden, z.B. wie hier gezeigt von [HSO4]- -Gruppen. Ein schönes Beispiel für das Auftreten dieses Strukturmotivs ist die Kristallstruktur von Pt2(SO4)2(HSO4)2. Dieses Sulfat-Hydrogensulfat des dreiwertigen Platins ist nicht nur aufgrund der besonderen Struktur bemerkenswert, sondern auch hinsichtlich seiner Synthese. Die Verbindung kann durch Umsetzung von elementarem Platin mit konzentrierter Schwefelsäure bei erhöhter Temperatur erhalten werden [8]. Die Reaktion zeigt, dass das vermeintlich inerte Metall, das für viele Laborapparaturen genutzt wird, nicht gänzlich unreaktiv ist und dass gerade in Gegenwart starker Säuren Vorsicht geboten ist. www.Aktuelle-Wochenschau.de Literatur [1] R. Marx, K. Seppelt, R. M. Ibberson, J. Chem. Phys. 1996, 104, 7658. [2] B. G. Müller, M. Serafin, Eur. J. Solid State Inorg. Chem. 1992, 29, 625. [3] G.-J. Wang, M.-F. Zhou, J. T. Goettel, G. J. Schrobilgen, J. Su, J. Li, T. Schlöder, S. Riedel, Nature 2014, 514, 475. [4] I.-C. Hwang, K. Seppelt, Angew. Chem. Int. Ed. 2001, 40, 3690. [5] P. Pyykkö, Adv. Quantum Chem. 1978, 11, 353; Chem. Rev. 1997, 97, 597; Angew. Chem., Int. Ed. 2004, 43, 4412; Annu. Rev. Phys. Chem. 2012, 63, 45; Chem. Rev. 2012, 112, 371. [6] A. Karpov, J. Nuss, U. Wedig, M. Jansen, Angew. Chemie Int. Ed. 2003, 42, 4818. [7] G. S. Muraveiskaya, V. S. Orlova, O. N. Evstaf'eva, Russ. J. Inorg. Chem. 1974, 19, 1030; M. Pley, M. S. Wickleder, Eur. J. Inorg. Chem. 2005, 529; A. Arndt, M. S. Wickleder, Anorg. Allg. Chem. 2008, 634, 369. [8] M. Pley, M. S. Wickleder, Z. Anorg. Allg. Chem. 2004, 630, 1036-1039. www.Aktuelle-Wochenschau.de