Exkurs Chemische Bindungen
Werbung
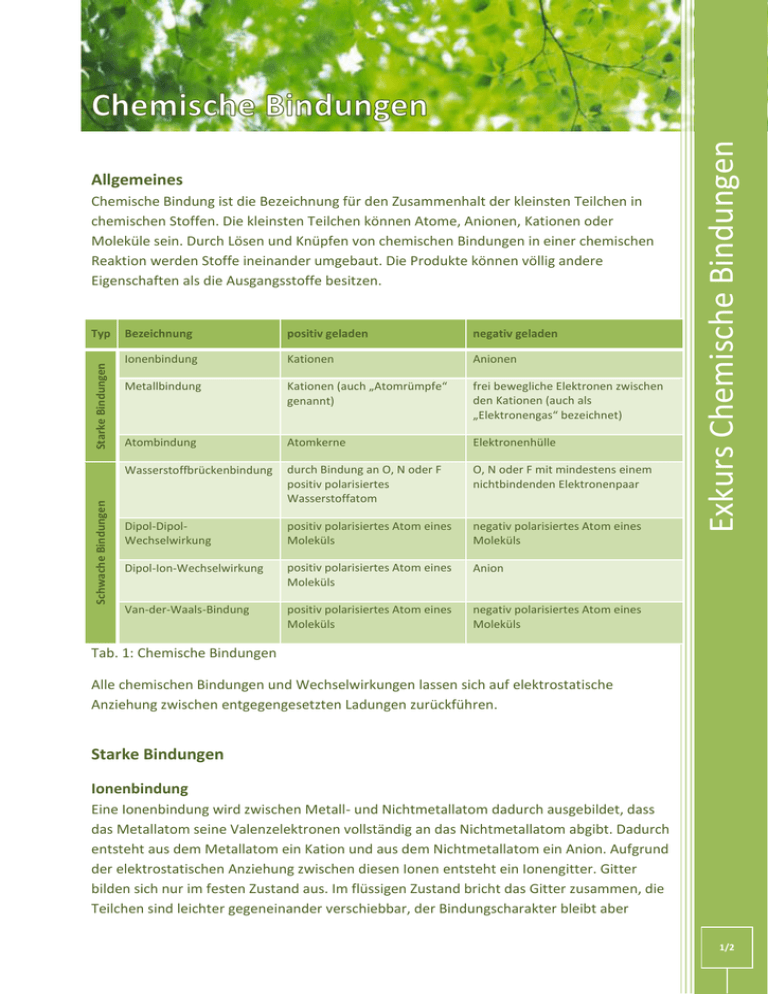
Chemische Bindung ist die Bezeichnung für den Zusammenhalt der kleinsten Teilchen in chemischen Stoffen. Die kleinsten Teilchen können Atome, Anionen, Kationen oder Moleküle sein. Durch Lösen und Knüpfen von chemischen Bindungen in einer chemischen Reaktion werden Stoffe ineinander umgebaut. Die Produkte können völlig andere Eigenschaften als die Ausgangsstoffe besitzen. Schwache Bindungen Starke Bindungen Typ Bezeichnung positiv geladen negativ geladen Ionenbindung Kationen Anionen Metallbindung Kationen (auch „Atomrümpfe“ genannt) frei bewegliche Elektronen zwischen den Kationen (auch als „Elektronengas“ bezeichnet) Atombindung Atomkerne Elektronenhülle Wasserstoffbrückenbindung durch Bindung an O, N oder F positiv polarisiertes Wasserstoffatom O, N oder F mit mindestens einem nichtbindenden Elektronenpaar Dipol-DipolWechselwirkung positiv polarisiertes Atom eines Moleküls negativ polarisiertes Atom eines Moleküls Dipol-Ion-Wechselwirkung positiv polarisiertes Atom eines Moleküls Anion Van-der-Waals-Bindung positiv polarisiertes Atom eines Moleküls negativ polarisiertes Atom eines Moleküls Exkurs Chemische Bindungen Allgemeines Tab. 1: Chemische Bindungen Alle chemischen Bindungen und Wechselwirkungen lassen sich auf elektrostatische Anziehung zwischen entgegengesetzten Ladungen zurückführen. Starke Bindungen Ionenbindung Eine Ionenbindung wird zwischen Metall- und Nichtmetallatom dadurch ausgebildet, dass das Metallatom seine Valenzelektronen vollständig an das Nichtmetallatom abgibt. Dadurch entsteht aus dem Metallatom ein Kation und aus dem Nichtmetallatom ein Anion. Aufgrund der elektrostatischen Anziehung zwischen diesen Ionen entsteht ein Ionengitter. Gitter bilden sich nur im festen Zustand aus. Im flüssigen Zustand bricht das Gitter zusammen, die Teilchen sind leichter gegeneinander verschiebbar, der Bindungscharakter bleibt aber 1/2 Metallbindung Da bei einer Metallbindung alle Bindungspartner Metalle sind, geben auch alle Atome Valenzelektronen ab. Die dadurch entstandenen Metallkationen werden durch die jetzt frei beweglichen Elektronen (das sog. Elektronengas) zusammengehalten, es entsteht ein Metallgitter. Metalle sind allesamt elektrisch leitfähig (Leiter 1. Ordnung), gute Wärmeleiter Atombindung Da bei einer Atombindung (auch Kovalenzbindung, kovalente Bindung oder Elektronenpaarbindung) alle Bindungspartner Nichtmetalle sind, nehmen auch alle Atome Valenzelektronen auf. Dadurch entstehen Moleküle oder Atomgitter, die durch bindende Elektronenpaare zusammengehalten werden. Molekulare Stoffe sind elektrische Nichtleiter (Isolatoren) und liegen entweder in flüchtiger Form vor (kleine Moleküle, Beispiel: Wasser, Sauerstoff, Chlorwasserstoff) oder kunststoffund diamantartig (Riesenmoleküle, Polymere, Beispiel: Polyethylen, Stärke). Schwache Bindungen Exkurs Chemische Bindungen erhalten. Ionische Verbindungen haben auf Grund der hohen elektrischen Anziehungskräfte zwischen ihren Teilchen salzartigen Charakter. Sie leiten den elektrischen Strom nur in Schmelze und Lösung (Leiter 2. Ordnung, Elektrolyte) und sind sehr spröde. Schwache Bindungen (Synonym: Van-der-Waals-Wechselwirkung im weiteren Sinne) bilden sich in der Regel zwischen Molekülen aus und beeinflussen die spezifischen physikalischen Eigenschaften wie Siede- und Festpunkt. In Makromolekülen (zum Beispiel Polypeptide) treten sie auch als innermolekulare Bindungen auf. Bei sehr schwachen Bindungen wird statt des Begriffs Bindung der Begriff Wechselwirkung oder Zwischenmolekulare Kraft verwendet. 2/2
