downloaden
Werbung

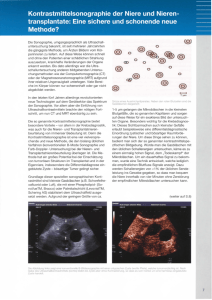
Urologische De Novo Malignome nach Nierentransplantation L. Franzaring, S. Melchior Urologische Klinik / Transplantationszentrum Klinikum-Bremen - Mitte Patienten mit funktionierendem Nierentransplantat 120000 100000 80000 60000 40000 20000 SRTR Annual Report 2007 20 05 20 04 20 03 20 02 20 01 20 00 19 99 19 98 19 97 0 DeNovo solide Tumore nach Nierentransplantation 6 5 4,9 5 4,5 4,3 3,8 4 2,8 3 2,4 1,8 2 1 1 0,4 06 20 20 05 04 20 20 03 20 02 01 20 20 00 19 99 19 98 19 97 0 SRTR Annual Report 2007 Todesursache nach Nierentransplant. - USA % • kardiovaskulär 25 • Infektion 20 • Myokardinfarkt 13 • Malignom 13 • zerebrovaskulär 7 • andere 21 Entstehung von Krebs beim Empfänger • Transmission von Tumorzellen eines malignen Tumors im Spenderorgan • Transmission von Metastasen mit dem Spenderorgan • De Novo-Wachstum im Spenderorgan nach Transplantation • De Novo-Wachstum in einem anderen Organ des Empfängers Risikofaktoren für de Novo Malignome nach Transplanation • Immunsuppression (kumulativer Effekt) • Alter (> 60 Jahre) • Nikotin • Onkoviren • UV-Strahlung 3-5 facher Anstieg des Tumorrisikos ! Marsh, AUA 2009 Kumuliertes Krebsrisiko nach 1. Transpla mit funktionierendem Graft Chapman & Webster, ANZDATA Registry 2004 Häufige Tumore nach Organtransplantation Tumor Haut Lymphat. System Leber Niere Lunge Gyn. Mamma Colon % 35 13,5 11,8 4,7 4,7 2,7 2,2 2,1 Penn ITTR 1969 - 2001 Krebsinzidenz nach Nierentransplantation Regionale Unterschiede • USA 6% • Europa 1- 9 % • Australien 18 % Marsh, AUA 2009 Cancer incidence and survival in kidney transplant patients Navarro et al., Transplantation Proceedings, 2008 n = 1017 nierentransplantierte Patienten (79 -´07) solide Tumore häufigster Tu: Transplantierte + Ca Spender Empfänger 61,2 J. 44,5 J. 4,9 % (n= 50) Nierenzell-Ca (n= 8) Transplantierte ohne Ca 53,2 J. 40,3 J. Alter sowohl des Spenders als auch des Empfängers von Bedeutung deNovo-Malignome nach Nierentransplant. - Risikofaktoren multivariate Analyse • Empfängeralter • Tacro vs. CsA • Anzahl Transpla. (>1) • Zeit nach Transpla. • Geschlecht • Dialysedauer • kalte Ischämie • akute Abstoßung < 0.01 0.35 0.02 0.01 ns ns ns ns Navarro, Transplant. Proc., 2008 Figure 10.2 Standardised Incidence Ratios for Cancer Risk (excluding non-melanocytic skin cancer) Experienced by Patients Undergoing at Least One Kidney Transplant in Australia and New Zealand 1980 - 2003 Analysis of 13,077 Patients (110,395 person years), Standardised for Age, Gender and Calendar Year with Australian Population Site of Cancer All Registrable Cancers Observed Cancer Expected Cancer S. Incidence Ratio 95% Confidence Interval 1545 495.08 3.12 2.97 3.28 Head, Neck and Lip Oesophagus 63 29 22.77 6.14 2.77 4.73 2.16 3.28 3.54 6.80 Stomach Small Intestine Colorectal Liver Gallbladder 15 3 141 19 8 12.07 1.49 72.76 3.97 3.21 1.24 2.01 1.94 4.78 2.49 0.75 0.65 1.64 3.05 1.25 2.06 6.23 2.29 7.49 4.98 Pancreas Nasal Cavity Larynx Trachea, Bronchus and Lung Other Thoracic Organs 16 5 11 108 6 9.30 0.92 5.54 53.85 0.57 1.72 5.41 1.99 2.01 10.60 1.05 2.25 1.10 1.66 4.76 2.81 13.00 3.59 2.42 23.60 Bone and Articular Cartilage Melanoma Mesothelioma Kaposi's Sarcoma Connective and Other Soft Tissue 5 183 4 28 12 1.01 57.64 2.97 1.06 3.80 4.94 3.18 1.35 26.44 3.16 2.06 2.75 0.51 18.26 1.79 11.87 3.67 3.59 38.29 5.56 Breast Vulva Vagina Cervix Uteri Corpus Uteri Ovary 87 41 12 46 18 8 69.52 0.90 0.33 6.97 9.75 7.56 1.25 45.60 36.02 6.60 1.85 1.06 1.01 33.58 20.46 4.94 1.16 0.53 1.54 61.93 63.43 8.81 2.93 2.12 Other Female Genital Organs Penis and Other Male Genital Organs Prostate Testis Kidney, Ureter and Urethra 0 11 53 0 125 0.32 0.62 54.72 4.36 14.73 0.00 17.81 0.97 0.00 8.49 9.86 0.74 7.12 32.16 1.27 10.12 Bladder Eye Brain and Central Nervous System Thyroid Gland Other Endocrine Glands 82 4 16 27 4 15.97 1.50 9.59 5.96 0.43 5.14 2.67 1.67 4.53 9.37 4.14 1.00 1.02 3.11 3.52 Unknown Primary Site All Lymphomas Immunoproliferative Neoplasms Multiple Myeloma Leukaemia 70 231 3 15 32 16.74 22.74 0.29 5.62 12.28 4.18 10.16 10.23 2.67 2.61 3.31 8.93 3.30 1.61 1.84 6.38 7.12 2.72 6.61 24.97 5.28 11.55 31.73 4.42 3.69 Karzinom •Penis •Niere •Blase •Prostata •Hoden SIR 17,49 8,49 5,14 0,97 0 ANZDATA Registry 2004 Inzidenz urologischer Tumore (USA) 1-3 Jahre nach Nieren-Transplantation Tumor 1. Jahr 2. Jahr 3.Jahr pro 100.000 Personenjahre von Transplantierten Blase 0,16 0,26 0,32 Niere 0,54 0,82 1,01 Prostata 0,70 1,28 1,74 Hoden 0,02 0,04 0,06 Kasiske, Transplantation 2004 Urologische Tumore nach Nierentransplant. - USA Risikoerhöhung • Nierenzell-Ca 16fach • Blase / Hoden 3fach • Prostata 2fach Karsiske, Transplantation 2004 Urologische DeNovo Malignome nach Nierentransplantation UK Transplant Registry n =10847 Organ n % • Niere 87 40,6 • Blase 48 22,4 • Prostata 41 19,2 • Hoden 28 13,1 • Penis 10 4,6 Vergleich: • IPITTR (Israel Penn International Transplant Tumor Registry), 1980 – 2007: 635 Organtransplantierte mit De Novo Malignomen (Colon, Lunge, Mamma, Melanom, Blase, Niere, Prostata) • SEER (Surveillance, Epidemiology, and End Results) Datenbank, 1988 - 2004 1.282 984 Erwachsene der US-Bevölkerung • Malignome bei Transplantierten Jahre früher ! • Tumore im späteren Stadium festgestellt • negativer Überlebensprädiktor: Transplantation, T-Stadium (Multivariatanalyse) Transplantierte mit De Novo-Tumoren haben schlechtere Prognose ! Miao, Transplantation 2009 Urologische De Novo Malignome nach Nierentransplantation • Problem für jeden Urologen • Überweisung an transplantierende Urologen • komplexe Fälle interdisziplinär chirurgische Herausforderung Nierenzell-Ca nach Nierentransplantation häufigster urologischer Tumor • native Niere (90 %) • transplantierte Niere (10 %) vom Spender ? vom Empfänger ? Chambade, J. Urol., 2008 Nierenzell-Ca nach Nierentransplantation - native Niere Risikofaktoren: • Analgetikanephropathie • Acquired Cystic Kidney Disease (ACKD) Nierenzell-Ca nach Nierentransplantation - native Niere Acquired Cystic Kidney Disease (ACKD) • • • • bis 20 % nach 3 Jahren HD bis 90 % nach 5-10 Jahren Potential für maligne Transformation auch nach erfolgreicher Transpla Assoziation mit Cyclosporin ? typisch: älterer männl. Patient nach langer Dialyse Nierenzell-Ca nach Nierentransplantation häufigster urologischer Tumor • native Niere (90 %) • transplantierte Niere (10 %) vom Spender ? vom Empfänger ? Chambade, J. Urol., 2008 Fallbericht: 58, männl. RCC im Transplantat 14 Jahre nach Transpla Mikrosatellitenanalyse: Tumorzellen stammen vom Empfänger Kasuistik R.N., 62 J., männl. • Diagnosen: – TNI unklarer Genese seit 06/90 – Z.n. Nierenallotransplantation rechts 10/91 mit konsekutiv chron. Transplantatversagen, Transplantatentfernung 06/95 • Therapie: – Re-Transplantation einer rechten allogenen Spenderniere in die linke Fossa illiaca 06/02 – ATG-Prophylaxe, MP, MMF, Tac, Cytotect, Ganciclovir – Gute Primärfunktion Kasuistik • Verlauf: – Kreatininanstieg bei V.a. nephrotoxisch-bedingte Transplantatfunktionsverschlechterung – Transplantatbiopsie 06 /02 Histo: keine Abstoßung, aber proliferativ hochaktiver wenig differenzierter, großzelliger Tumor Immunhistochemie: „proliferative hochaktive Tumorzellen, fokal über 50% der Zellkerne mit dem KI 67 Epitop markiert. Schwache Immunreaktivität mit Antikörpern gegen CD31. Vimentin-Expression in Tumorzellen.“ Kasuistik Verlauf: 09/02 10/02 11/02 11/02 Transplantatnephrektomie Revision der Resektionshöhle, PE-Entnahme: anaplastisches Karzinom Chemotherapie (Cisplatin, Etoposid, Bleomycin) Exitus letalis Empfänger der Gegenniere (München): • Tumor in der Transplantatniere • Nephrektomie und ausgedehnte Lymphadenektomie • Chemotherapie (Gemcitabine) Kasuistik Nephrektomiepräparat Kasuistik Nephrektomiepräparat Tumor vom Spender oder vom Empfänger? • Molekulargenetische Untersuchung – Untersuchungsmaterial • A) Gewebe aus Spenderniere: frei von Tumor • B) Haut mit Fettgewebe (Empfänger R.N.) • C) Tumor aus Spenderniere • Methodik – Untersuchung der DNA: ausgewählte Genorte mittels PCR vervielfältigt, kapillarelektrophoretisch der Größe nach getrennt u. laseroptisch sichtbar gemacht Tumor vom Spender oder vom Empfänger? 100 % Übereinstimmung der 8 Genorte zwischen Spenderniere und Tumor Tumor stammt vom Spender Nierenzell-Ca nach Nierentransplantation - transplantierte Niere Transplantat-Nephrektomie oder organerhaltende Tumorresektion ? Transplantationsnachsorge: Tumore werden früh erkannt ! Operative Technik Konusresektion Operative Technik Konusresektion Operative Technik Konusresektion 15 Jahre postop.: S.Kreat. 1.2mg /dl, kein Zeichen für Rezidiv bzw. Metastasen Blasen-Ca nach Nierentransplantation • Standardtherapie (TURB ±Instillationstherapie) analog zu Nichttransplantierten • Allograft selten mitbefallen • alle Formen der Harnableitung möglich (Ausnahme: Uretersigmoideostomie) Master J. Urol 2004 Lang, J.Urol 2005 Kamal, BJU 2007 Prostata-Ca nach Nierentransplantation Französiche Urologengesellschaft: 2004 - 2006: n= 8500 Nierentransplant. (19 Zentren) mind. 1 Jahr nach Tx • Diagnose Prostata-Ca: n = 62 (0.73 %) Kleinclauss, Nephrol. Dial Transplant 2008 Prostata-Ca nach Nierentransplantation • Zeit zwischen Tx und Diagnose: 67 Mon. • Diagnosestellung: • PSA 59% (mittl. PSA: 7,6) suspekte DRE 11,3 % inzidentell 19,3 % sympt. 11,3 % pT-Stadium 34 % T3 ! Kleinclauss, Nephrol. Dial Transplant 2008 Prostata-Ca nach Nierentransplantation Kontroverse Datenlage bezüglich PCa-Risiko (erhöht, unverändert, vermindert) • Breyer et al: „... keine Evidenz, daß PCa-Inzidenz nach Transpla erhöht.“ Breyer, J. Urol. 2009 Radikal-Op ? Bestrahlung ? HormonTx ? Watchful Waiting? Therapie des lokalisierten PCa nach Nierentransplantation Pro perineale Prostatektomie • geringes Verletzungsrisiko für Transplantat • virgineller Op-Situs Contra externe Radiatio • Strahlenschaden für Harnleiter ? Kleinclauss, Nephrol. Dial Transplant 2008 PSA und Nierentransplantation Gesamt-PSA • Werte ähnlich bei Transplantierten und Nicht-Transplantierten (unklar % freies PSA) • unbeeinflußt durch Cyclosporin oder Nierenfunktion • vermindert durch Sirolimus Kleinclauss, Nephrol. Dial Transplant 2008 de Novo Malignomen und Immunsuppression neue Ära mit neuen Substanzen • Vielzahl von Protokollen • niedrige Abstoßungsraten • Reduktion / Vermeidung von Steroiden mTOR-Inhibitoren Immunsuppression Tumortherapie Therapie von de Novo Malignomen durch individualisierte Immunsuppression ? • RMR-Studie (SRL vs. SRL+CsA) niedrigere Tumorinzidenz im SRL-Arm • CONVERT-Studie (SRL statt Calcineurin-Inhib.) Hauttumore 7% 2% solide Tumore 3 % 1% Wechsel auf mTOR Inhibitoren ? Campistol 2006; Alberu 2006 Conclusio de Novo Malignome nach Nierentransplantation • verbessertes Transplantatüberleben + steigendes Spender / Empfängeralter + obligate Immunsuppression erhöhtes Tumorrisiko beim Empfänger ! • • • • urologische Tumor häufig (NZ-Ca !) urologische Therapieprinzipien gültig auch bei Transplantierten cave Immunsuppression, Komorbiditäten etc ! chirurgische Versatilität notwendig Vielen Dank Transplantationszentrum Bremen 1988-2009 800 Nierentransplantationen De Novo Tumore n=27 (3,4) n (%) Niere 11 (40,7) Eigenniere 8 (29,6) Allograft 3 (11,1) Prostata 7 (25,9) Blase 5 (18,5) Nierenbecken 2 ( 7,4) Hoden 2 ( 7,4) Latenz (mo) 46,1 53,7 25,6 89,4 26,6 37,5 41,5 3 Patienten mit Doppelkarzinomen Transplantationszentrum Bremen 1988-2009 800 Nierentransplantationen De Novo Tumore Eigenniere Allograft n (%) 8 (29,6) 3 (11,1) Prostata 7 (25,9) Blase 5 (18,5) Nierenbecken 2 ( 7,4) Hoden 2 ( 7,4) n=27 (3,4) Therapie Nx NSS Nx RPx RTx Horm TUR NUX Ox, RTx 8 2 1 3 3 1 5 2 2 Radikale Radikale Perineale Perineale Prostatektomie Prostatektomie Zugang I. Young II. Belt III. Hudson Zur Anzeige wird der QuickTime™ Dekompressor „TIFF (LZW)“ benötigt. Operative Technik Konusresektion Operative Technik Koagulation: Infrarot / Argon Beamer Prostata-Ca Penis-Ca Copyright restrictions may apply. SIR 0,95 15,7 Vajdic, JAMA 2006 Überlebensraten mit funktionierendem Allograft Urologische Tumore gesunde Männer (USA) vs. Transplantierte Normalpopulation 1 Blase Niere Prostata Hoden 38,3 16,0 162,0 5,5 148,9 671,0 477,4 21,3 Jahre nach Transplant. 2 3 80,2 236,3 360,5 16,3 60,9 226,1 265,8 20,4 Bild ACKD Krebsinzidenz vor und nach Nierentransplantation Risk of Cancers Frequently Known to Cause ESKD in Australian Patients With ESKD N = 28855 Nierentransplantierte (ANZDATA) Vajdic, JAMA 2006 Urologische DeNovo Malignome nach Nierentransplantation TZ Bremen (1988 -2009) DeNovo Malignome Organ • Niere • Blase • Nierenbecken • Prostata • Hoden • Penis n = 789 n = 27 (3,4 %) n 11 7 2 5 2 0 % 40,7 25,9 7,4 18,5 7,2 0 Blasen-Ca nach Nierentransplantation • Standardtherapie (TURB ±Instillationstherapie) analog zu Nichttransplantierten • Allograft selten mitbefallen • alle Formen der Harnableitung möglich (Ausnahme MainzII Pouch) Master J. Urol 2004 Lang, J.Urol 2005 Kamal, BJU 2007 Blasen-Ca nach Nierentransplantation 51 J., T2GIII Urothela-Ca Blase (2 Jahre nach Transpla) Tx: rad. Zystektomie + Mainz Pouch Patient tumorfrei nach 54 Mon. S - Crea: 1,1 mg/dl Implantation des Allografts in das Ileocoecalreservoir Vergleich: • IPITTR (Israel Penn International Transplant Tumor Registry), 1980 – 2007: 635 Organtransplantierte mit De Novo Malignomen (Colon, Lunge, Mamma, Melanom, Blase, Niere, Prostata) • SEER (Surveillance, Epidemiology, and End Results) Datenbank, 1988 - 2004 1.282 984 Erwachsene der US-Bevölkerung • • • • • • • Colon Lunge Mamma Melanom Blase Niere Prostata % 11 28 15 7 8 13 17 Prostata-Ca vor Nierentransplantation (Israel Penn International Transplant Tumor Registry) • • Zeit zwischen Diagnose und Tx: follow-up nach Tx: Rezidiv Zeit zum Rezidiv Mortalität DoD • mediane ÜR mit PCa: 19 Mon. 20 Mon. 17 % 10,6 Mon. 28 % 7% 49 Mon. Woodle, Trans Proc, 2005