Oberflächenhyperthermie in der klinischen Onkologie
Werbung

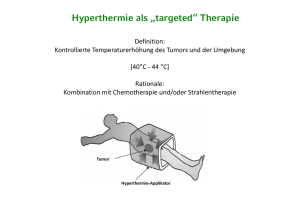
Oberflächenhyperthermie in der klinischen Onkologie Hyperthermie Für die supportive Hyperthermie-Behandlung von Tumoren, die dicht unter der Hautoberfläche liegen, hat BSD Medical Corporation, der führende Hersteller für Hyperthermie-Systeme, ein spezielles System entwickelt – inklusive der zugehörigen Applikatoren, die nahezu jeder Körperkontur gerecht werden. Sie bieten hohen Behandlungskomfort und stellen damit einen weiteren großen Fortschritt in der Überwärmungstherapie von Tumoren dar. Für welche Indikationen ist die Oberflächenhyperthermie geeignet? Die Oberflächenhyperthermie eignet sich für die Überwärmung von rezidivierenden oder progredienten Tumoren, die nicht mehr als drei Zentimeter unter der Haut liegen - vor allem von nicht operablen Kopf-Hals-Tumoren und Melanomen. Für die Wärmetherapie von Brustwandrezidiven des Mamma-Karzinoms hat BSD Medical einen speziellen Applikator entwickelt. 2 Wie wirkt die Hyperthermie? Die Hyperthermie verbessert die Perfusion und die Zirkulation in den überwärmten Tumorarealen und potenziert dadurch die Wirkung von Strahlen- und Chemotherapie. Deshalb wird sie stets in Kombination mit diesen etablierten Behandlungsformen eingesetzt. Außerdem entstehen durch die gezielte Überwärmung im Tumorgewebe Hitzeschockproteine, die das Immunsystem stimulieren. Da maligne Zellen hitzeempfindlicher sind als gesunde Zellen, sterben viele allein durch die Hitze ab, andere werden durch die plötzlich aktiv gewordenen Abwehrzellen vernichtet. 3 Welche wissenschaftlichen Studien belegen die Wirksamkeit der lokalen Hyperthermie bei oberflächlichen Tumoren? PREVIOUSLY IRRADIATED PATIENTS Mamma-Karzinome und andere oberflächliche Tumoren PREVIOUSLY IRRADIATED PATIENTS Eine viel beachtete klinische Studie zur Therapie von rezidivierenden Karzinomen führte Ellen Jones von der Duke-Universität in North Carolina, USA durch. Untersucht wurden 109 Patienten mit oberflächlichen Tumoren. Die meisten litten an Brustwandrezidiven eines Mamma-Karzinoms, einige an Kopf-Hals-Tumoren und malignen Melanomen. Bereits vorbestrahlte Patienten, die eine zweite Radiotherapie in Kombination mit Hyperthermie erhielten, sprachen signifikant besser auf diese Therapie an: Bei 68 Prozent konnte eine komplette Remission erzielt werden. In der Vergleichsgruppe ohne Hyperthermie konnte dies nur bei 24 Prozent der Patienten beobachtet werden. „Die kombinierte Therapie gibt Frauen, deren Krebs an der Brustwand erneut aufgetreten ist, aber noch keine Metastasen gestreut hat, die beste Möglichkeit, ihren Tumor für lange Zeit unter Kontrolle zu bringen“, so die Schlussfolgerung von Ellen Jones zu den Ergebnissen ihrer Untersuchung. Diese Studie veranlasste das NCCN - National Cancer Center Network, ein Netzwerk der 30 renommiertesten Tumorzentren der Vereinigten Staaten, die Hyperthermiebehandlung in ihre weltweit publizierten Leitlinien zur Therapie von Rezidiven des Mamma-Karzinoms aufzunehmen. (Jones, E.: A Randomized Trial of Hyperthermia and Radiation for Superficial Tumors. Journal of Clinical Oncology. 2005, Vol. 23, No. 13, 3079-3085) PREVIOUSLY IRRADIATED PATIENTS VORBESTRAHLTE PATIENTEN KLINISCHE VOLLREMISSION CLINICAL COMPLETE RESPONSE RATE CLINICAL COMPLETE RESPONSE RATE LOCAL CONTROL CLINICAL COMPLETE RESPONSE RATE 4 LOCAL CONTROL LOCAL CONTROL Kopf-Hals-Tumoren Maligne Melanome Die Wirksamkeit der Hyperthermie bei fortgeschrittenen Kopf-Hals-Tumoren wiesen Riccardo Valdagni und Maurizio Amichetti vom Centro Oncologico, Trento, Italien in einer Studie nach. Mit Strahlentherapie alleine erreichten die beiden Radioonkologen bei 41 Prozent der Patienten eine komplette Remission, mit Strahlentherapie und zusätzlicher Hyperthermie lag dieser Wert bei 83 Prozent. Die 5-Jahres-Überlebensrate konnte sogar von null auf 53 Prozent gesteigert werden. Jens Overgaard vom der Universitätsklinik in Aarhus, Dänemark, untersuchte in einer randomisierten multizentrischen Studie 134 Rezidive oder Metastasen von malignen Melanomen bei insgesamt 70 Patienten. Die eine Hälfte wurde ausschließlich mit Radiotherapie behandelt, die andere erhielt zusätzlich eine Oberflächenhyperthermie. Die Auswertung zeigte einen signifikant positiven Effekt der Wärmetherapie: Tumoren, die nur bestrahlt wurden, konnten zu 28 Prozent unter lokale Kontrolle gebracht werden, bei jenen, die zusätzlich hyperthermiert wurden, gelang dies bei 46 Prozent. (Valdagni, R., Amichetti, M.: Report of long-term follow-up in a randomized trial comparing radiation therapy and radiation therapy plus hyperthermia to metastatic lymphnodes in stage IV head and neck patients. International Journal of Radiation Oncology Biology Physics. 1994, Vol. 28, No. 1, 163-169) (Overgaard, J., Gonzalez-Gonzalez, D., Hulshof, M. C. C., Arcangeli, G., Dahl., O., Mella, O., Bentzen, S. M.: Ramdomized trial of hyperthermia as adjuvant to radiotherapy for recurrent or metastatic malignant melanoma. The Lancet. 1995, Vol. 345, No. 8849, 540 – 543) Neben beeindruckenden Tumorremissionen zeigen diese Studien einen zusätzlichen positiven Effekt: Auch wenn keine Remission erzielt werden konnte, wurde es durch den Einsatz der Hyperthermie möglich, die Nebenwirkungen von Strahlen- und Chemotherapie in vielen Fällen erheblich zu mildern und die Lebensqualität der Patienten entscheidend zu verbessern. 5 Oberflächenhyperthermie Wie funktioniert die Oberflächenhyperthermie? Bei der Oberflächenhyperthermie wird das Tumorareal ca. eine Stunde lang mittels elekromagnetischer Wellen auf 42 bis 44 Grad C erwärmt. Die lokale Erwärmung steigert die Perfusion des Tumors. So kann die Hyperthermie die Wirkung von Strahlentherapie und/oder Chemotherapie potenzieren. Das umliegende, gesunde Gewebe ist in der Lage, die hohen Temperaturen zu tolerieren. Die Behandlung Die Bedienung Jeder Applikator besitzt einen Bolus, mit dem er auf die Patientenoberfläche aufgebracht und fixiert wird. Dieser Bolus wird zur Behandlung mit Wasser gefüllt, welches in einem geschlossenen Kreislauf zirkuliert und je nach Bedarf temperiert werden kann. Physikalisch gesehen dient der Bolus der Ankopplung der elektromagnetischen Wellen an den Körper des Patienten. Die Temperatur, die im Tumor erreicht wird, wird während der Therapie über Mess-Sonden kontrolliert. Sie wird durch computergesteuerte Anpassung der Applikatorleistung laufend optimiert. Die Vorbereitungs- und Aufwärmphase beträgt etwa 30 Minuten. Die Thermotherapie selbst dauert 60 Minuten. Die Hyperthermie-Behandlungen finden je nach Indikation ein bis zwei Mal in der Woche statt. Die Anzahl der Sitzungen hängt von der Tumorentität ab und liegt im Durchschnitt zwischen 5 und 10 pro Patient. Im Falle einer kombinierten Chemotherapie wird diese während der Hyperthermie verabreicht, eine Strahlentherapie muss zeitnah (bis zu 120 Minuten) vor oder nach der Überwärmung erfolgen. Die Anwendung der Oberflächenhyperthermie ist vergleichsweise einfach. Die Bedienung des Systems erfolgt weitestgehend automatisch über den Computer, der wahlweise über einen Touch-Screen oder mit Maus und Tastatur bedient werden kann. Zunächst wird der Patient oder die Patientin auf einer Liege positioniert. Die Temperatursensoren werden auf der Haut über dem Tumorareal fixiert oder über implantierbare Katheter in das Gewebe eingeführt. Die Zahl der Sensoren richtet sich dabei nach der Ausdehnung des Tumors. Der Applikator, dessen Auswahl von Größe und Lage der Tumorläsion abhängt, wird mit Hilfe eines Haltearms oder durch Befestigungsriemen in Therapieposition gebracht. 7 Die Technik Die Applikatoren Um für jede Form und Größe eines Tumors die bestmögliche Hyperthermie anbieten zu können, stehen drei verschiedene Applikatoren für die Oberflächenhyperthermie zur Verfügung. Der 24-Antennen-Applikator wurde speziell für die Therapie von ausgedehnten Brustwandrezidiven entwickelt. 24 Spiral-Antennen sind auf einem rechteckigen flexiblen Silikonträger montiert und werden von einem 8 Kanal-Mikrowellengenerator gespeist. So kann sich der Applikator nicht nur gut an die jeweilige Körperkontur – speziell der Brustwand – anpassen. Die 24 Spiral-Antennen können auch selektiv angesteuert werden, um eine individuelle Temperaturverteilung zu ermöglichen. Die Spiral-Applikatoren in Tellerform unterschiedlichen Durchmessers eignen sich zur Therapie von Tumorläsionen nahe der Hautoberfläche. Auch hier kann jede Spiral-Antenne einzeln angesteuert werden. Dadurch lässt sich die Temperaturverteilung im Tumor individuell steuern. Drei Applikatorvarianten bieten eine optimale Anpassung an Tumorkontur und Körperregion: Der SA-812 hat einen Durchmesser von 12 cm und ist mit acht Spiral-Antennen bestückt. Bei einem Durchmesser von 10 cm verfügt der SA-510 über fünf Spiral-Antennen. Für kleine Läsionen ist der SA-308 mit drei Spiral-Antennen und einem Durchmesser von 8 cm geeignet. Alle Spiral-Applikatoren zeichnen sich durch ein geringes Eigengewicht aus. Sie sind aus transparentem Material gefertigt und lassen sich daher einfach positionieren. Für die Hyperthermie von kleinen Läsionen im KopfHals-Bereich wird der Hohlleiter-Applikator MA-151 eingesetzt. Durch seine schlanke Bauform lässt sich dieser Applikator auch an schlecht zugänglichen Stellen platzieren. 8 Der Hochfrequenz-Generator Das BSD 500 Mikrowellen-Hyperthermie-System verfügt über einen 915 MHz-Generator mit acht Kanälen, von denen jeder einzeln in Phasenlage und Amplitude eingestellt werden kann. Mit dem Dreifach-Splitter des Acht-Kanal-Generators können bis zu 24 Antennen angesteuert werden. Die acht Signale der einzelnen Kanäle von bis zu 50 Watt können zusammengefasst werden und stehen als Gesamtleistung von bis zu 400 Watt zur Verfügung. Welche Voraussetzungen braucht man für die Oberflächenhyperthermie mit dem BSD 500 System? Das BSD 500 System ist ein so genanntes „Rollwagen-Steckdosengerät“. Ähnlich wie eine Ultraschalleinheit kann es in jeden beliebigen Raum transportiert und ohne Abschirmung betrieben werden. Mit Hilfe eines zusätzlichen Moduls ist das System auch für die interstitielle Hyperthermie in Verbindung mit der Brachytherapie geeignet. Die Technik 9 Qualität Wie wird die Qualität der HyperthermieBehandlungen mit den BSD-Systemen gesichert? 10 Qualität „Nur die tatsächlich erwärmten Tumorzellen werden empfindlicher auf eine Strahlen- oder Chemotherapie reagieren können. Daher ist die Qualitätssicherung, insbesondere die Temperaturerfassung in der Tumorregion und in den Normalgeweben ein unverzichtbarer Bestandteil der Hyperthermie.“ Dr. Oliver Ott, Strahlenklinik der Universität Erlangen 11 Qualität Getreu diesem Plädoyer gilt für alle BSD Medical-Hyperthermie Systeme, dass sie nicht nur eine CE-Zulassung besitzen, sondern auch den Leitlinien der Deutschen Gesellschaft für Radioonkologie (DEGRO) und der European Society for Hyperthermic Oncology (ESHO) entsprechen. Nur durch die verantwortungsvolle und qualitätsgesicherte Anwendung der Hyperthermie in Kombination mit Chemo- und/oder Strahlentherapie ist es möglich, den Anteil lokaler Remissionen bei Krebspatienten zu erhöhen sowie das krankheitsfreie Intervall und teilweise auch das Gesamtüberleben zu verbessern. Hinzu kommt die für die Patienten ausgesprochen wertvolle Linderung von Schmerzen und die allgemeine Verbesserung der Lebensqualität. Diese Tatsache ist für BSD Medical täglicher Ansporn, die Hyperthermie-Systeme in Zusammenarbeit mit Medizinern, Physikern und Ingenieuren weiter zu entwickeln und zu verbessern. 12 13 12 Kontakt Haben Sie noch Fragen? Nehmen Sie doch mit uns Kontakt auf! Ihre Ansprechpartner Vertrieb: Martin Wadepohl Tel.: 089 54214310 [email protected] Unternehmenskommunikation: Monica Sennewald Tel.: 089 54214325 [email protected] Technik: Günter Futschik Tel. 089 54214331 [email protected] Unsere Adresse Dr. Sennewald Medizintechnik GmbH Schatzbogen 86 81829 München Deutschland Weitere Informationen finden Sie auch auf unserer Website www.sennewald.de www.sennewald.de