In-vitro-Bioassays: Das Tier in der Flasche?
Werbung
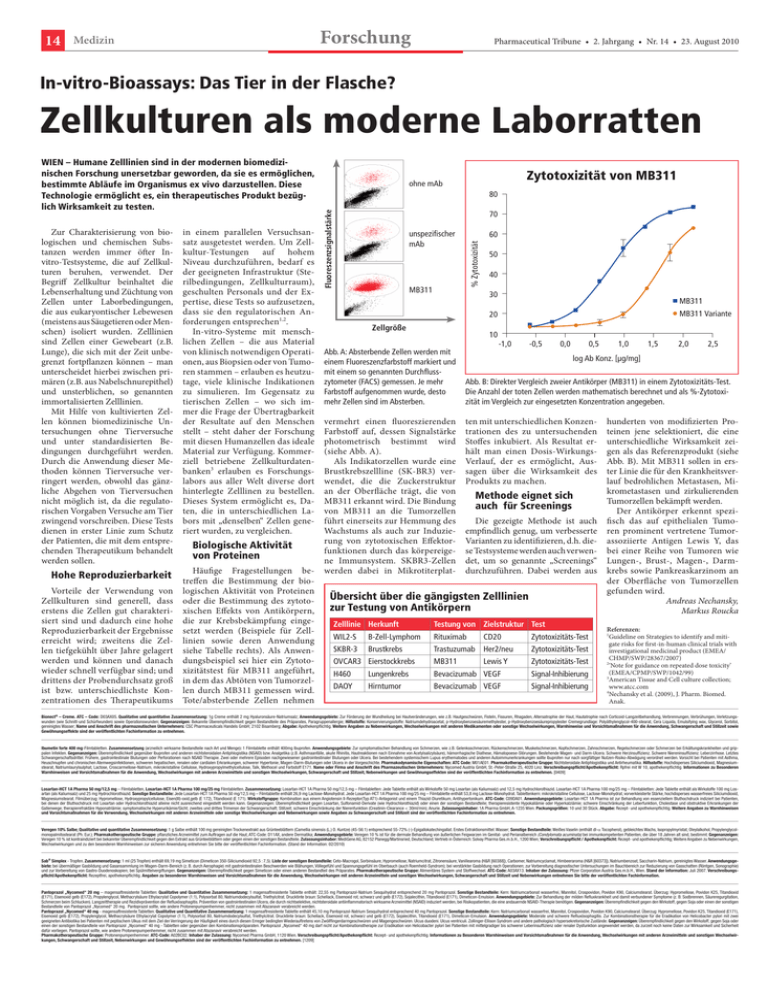
14 Forschung Medizin Pharmaceutical Tribune • 2. Jahrgang • Nr. 14 • 23. August 2010 In-vitro-Bioassays: Das Tier in der Flasche? Zellkulturen als moderne Laborratten Hohe Reproduzierbarkeit Vorteile der Verwendung von Zellkulturen sind generell, dass erstens die Zellen gut charakteri­ siert sind und dadurch eine hohe Reproduzierbarkeit der Ergebnisse erreicht wird; zweitens die Zel­ len tiefgekühlt über Jahre gelagert werden und können und danach wieder schnell verfügbar sind; und drittens der Probendurchsatz groß ist bzw. unterschiedlichste Kon­ zentrationen des Therapeutikums in einem parallelen Versuchsan­ satz ausgetestet werden. Um Zell­ kultur-Testungen auf hohem Niveau durchzuführen, bedarf es der geeigneten Infrastruktur (Ste­ rilbedingungen, Zellkulturraum), geschulten Personals und der Ex­ pertise, diese Tests so aufzusetzen, dass sie den regulatorischen An­ forderungen entsprechen1,2. In-vitro-Systeme mit mensch­ lichen Zellen – die aus Mate­rial von klinisch notwendigen Operati­ onen, aus Bio­p­sien oder von Tumo­ ren stammen – erlauben es heutzu­ tage, viele klinische Indikationen zu simulieren. Im Gegensatz zu tierischen Zellen – wo sich im­ mer die Frage der Übertragbarkeit der Resultate auf den Menschen stellt – steht daher der Forschung mit diesen Humanzellen das ideale Material zur Verfügung. Kommer­ ziell betriebene Zellkulturdaten­ banken3 erlauben es Forschungs­ labors aus aller Welt diverse dort hinterlegte Zelllinen zu bestellen. Dieses System ermöglicht es, Da­ ten, die in unterschiedlichen La­ bors mit „denselben“ Zellen gene­ riert wurden, zu vergleichen. Biologische Aktivität von Proteinen Häufige Fragestellungen be­ treffen die Bestimmung der bio­ logischen Aktivität von Proteinen oder die Bestimmung des zytoto­ xischen Effekts von Antikörpern, die zur Krebsbekämpfung einge­ setzt werden (Beispiele für Zell­ linien sowie deren Anwendung siehe Tabelle rechts). Als Anwen­ dungsbeispiel sei hier ein Zytoto­ xizitätstest für MB311 angeführt, in dem das Abtöten von Tumorzel­ len durch MB311 gemessen wird. Tote/absterbende Zellen nehmen 80 70 unspezifischer mAb 60 % Zytotoxizität Zur Charakterisierung von bio­ logischen und chemischen Subs­ tanzen werden immer öfter Invitro-Testsysteme, die auf Zellkul­ turen beruhen, verwendet. Der Begriff Zellkultur beinhaltet die Lebenserhaltung und Züchtung von Zellen unter Labor­bedingungen, die aus eukaryontischer Lebewesen (meistens aus Säugetieren oder Men­ schen) isoliert wurden. Zelllinien sind Zellen einer Gewebeart (z.B. Lunge), die sich mit der Zeit unbe­ grenzt fortpflanzen können – man unterscheidet hierbei zwischen pri­ mären (z.B. aus Nabelschnur­epithel) und unsterblichen, so genannten immortalisierten Zell­linien. Mit Hilfe von kultivierten Zel­ len können biomedizinische Un­ tersuchungen ohne Tierversuche und unter standardisierten Be­ dingungen durchgeführt werden. Durch die Anwendung dieser Me­ thoden können Tierversuche ver­ ringert werden, obwohl das gänz­ liche Abgehen von Tierversuchen nicht möglich ist, da die regulato­ rischen Vorgaben Versuche am Tier zwingend vorschreiben. Diese Tests dienen in erster Linie zum Schutz der Patienten, die mit dem entspre­ chenden Therapeutikum behandelt werden sollen. Zytotoxizität von MB311 ohne mAb Fluoreszenzsignalstärke WIEN – Humane Zelllinien sind in der modernen biomedizinischen Forschung unersetzbar geworden, da sie es ermöglichen, bestimmte Abläufe im Organismus ex vivo darzustellen. Diese Technologie ermöglicht es, ein therapeutisches Produkt bezüglich Wirksamkeit zu testen. MB311 50 40 30 MB311 MB311 Variante 20 Zellgröße 10 Abb. A: Absterbende Zellen werden mit einem Fluoreszenzfarbstoff markiert und mit einem so genannten Durchflusszytometer (FACS) gemessen. Je mehr Farbstoff aufgenommen wurde, desto mehr Zellen sind im Absterben. vermehrt einen fluoreszierenden Farbstoff auf, dessen Signal­stärke photometrisch bestimmt wird (siehe Abb. A). Als Indikatorzellen wurde eine Brustkrebszellline (SK-BR3) ver­ wendet, die die Zuckerstruktur an der Oberfläche trägt, die von MB311 erkannt wird. Die Bindung von MB311 an die Tumorzellen führt einerseits zur Hemmung des Wachstums als auch zur Induzie­ rung von zytotoxischen Effektor­ funktionen durch das körpereige­ ne Immunsystem. SKBR3-Zellen werden dabei in Mikrotiterplat­ -1,0 -0,5 0,0 0,5 1,0 1,5 2,0 2,5 log Ab Konz. [μg/mg] Abb. B: Direkter Vergleich zweier Antikörper (MB311) in einem Zytotoxizitäts-Test. Die An­zahl der toten Zellen werden mathematisch berechnet und als %-Zytotoxi­ zität im Vergleich zur eingesetzten Konzentration angegeben. ten mit unterschiedlichen Konzen­ trationen des zu untersuchenden Stoffes inkubiert. Als Resultat er­ hält man einen Dosis-WirkungsVerlauf, der es ermöglicht, Aus­ sagen über die Wirksamkeit des Produkts zu machen. Methode eignet sich auch für Screenings Die gezeigte Methode ist auch empfindlich genug, um verbesserte Varianten zu identifizieren, d.h. die­ se Testsysteme werden auch verwen­ det, um so genannte „Screenings“ durchzuführen. Dabei werden aus Übersicht über die gängigsten Zelllinien zur Testung von Antikörpern Zelllinie Herkunft Testung von Zielstruktur Test WIL2-S B-Zell-Lymphom Rituximab SKBR-3 Brustkrebs Trastuzumab Her2/neu Zytotoxizitäts-Test OVCAR3 Eierstockkrebs MB311 Zytotoxizitäts-Test H460 Lungenkrebs Bevacizumab VEGF Signal-Inhibierung DAOY Hirntumor Bevacizumab VEGF Signal-Inhibierung CD20 Lewis Y Zytotoxizitäts-Test hunderten von modifizierten Pro­ teinen jene selektioniert, die eine unterschiedliche Wirksamkeit zei­ gen als das Referenzprodukt (siehe Abb. B). Mit MB311 sollen in ers­ ter Linie die für den Krankheitsver­ lauf bedrohlichen Metastasen, Mi­ krometastasen und zirkulierenden Tumorzellen bekämpft werden. Der Antikörper erkennt spezi­ fisch das auf epithelialen Tumo­ ren prominent vertretene Tumorassoziierte Antigen Lewis Y, das bei einer Reihe von Tumoren wie Lungen-, Brust-, Magen-, Darm­ krebs sowie Pankreaskarzinom an der Oberfläche von Tumorzellen gefunden wird. Andreas Nechansky, Markus Roucka Referenzen: 1 Guideline on Strategies to identify and miti­ gate risks for first-in-human clinical trials with investigational medicinal product (EMEA/ CHMP/SWP/28367/2007) 2 ‘Note for guidance on repeated dose toxicity’ (EMEA/CPMP/SWP/1042/99) 3 American Tissue and Cell culture collection; www.atcc.com 4 Nechansky et al. (2009), J. Pharm. Biomed. Anak. Bionect® – Creme. ATC – Code: D03AX05. Qualitative und quantitative Zusammensetzung: 1g Creme enthält 2 mg Hyaluronsäure-Natriumsalz; Anwendungsgebiete: Zur Förderung der Wundheilung bei Hautveränderungen, wie z.B. Hautgeschwüren, Fisteln, Fissuren, Rhagaden, Altersatrophie der Haut, Hautatrophie nach Corticoid-Langzeitbehandlung, Verbrennungen, Verbrühungen, Verletzungswunden (wie Schnitt-und Schürfwunden) sowie Operationswunden; Gegenanzeigen: Bekannte Überempfindlichkeit gegen Bestandteile des Präparates, Paragruppenallergie; Hilfsstoffe: Konservierungsstoffe: Natriumdehydroacetat, p-Hydroxybenzoesäuremethylester, p-Hydroxybenzoesäurepropylester Cremegrundlage: Polyäthylenglycol-400-stearat, Cera Liquida, Emulsifying wax, Glycerol, Sorbitol, gereinigtes Wasser; Name und Anschrift des pharmazeutischen Unternehmers: CSC Pharmaceuticals Handels GmbH; 2102 Bisamberg; Abgabe: Apothekenpflichtig. Weitere Angaben zu Nebenwirkungen, Wechselwirkungen mit anderen Medikamenten oder sonstige Wechselwirkungen, Warnhinweise und Vorsichtsmaßnahmen für die Anwendung, Schwangerschaft und Stillzeit sowie Gewöhnungseffekte sind der veröffentlichten Fachinformation zu entnehmen. Ibumetin forte 400 mg-Filmtabletten. Zusammensetzung (arzneilich wirksame Bestandteile nach Art und Menge): 1 Filmtablette enthält 400mg Ibuprofen. Anwendungsgebiete: Zur symptomatischen Behandlung von Schmerzen, wie z.B. Gelenksschmerzen, Rückenschmerzen, Muskelschmerzen, Kopfschmerzen, Zahnschmerzen, Regelschmerzen oder Schmerzen bei Erkältungskrankheiten und grippalen Infekten. Gegenanzeigen: Überempfindlichkeit gegenüber Ibuprofen und anderen nichtsteroidalen Antiphlogistika (NSAID) bzw. Analgetika (z.B. Asthmaanfälle, akute Rhinitis, Hautreaktionen nach Einnahme von Acetylsalizylsäure), hämorrhagische Diathese, Hämatopoese-Störungen. Bestehende Magen- und Darm-Ulcera. Schwere Herzinsuffizienz. Schwere Niereninsuffizienz. Leberzirrhose. Letztes Schwangerschaftsdrittel. Frühere, gastrointestinale Blutungen oder Perforationen nach NSAID Therapie. Zwei oder mehrere Episoden nachgewiesener gastrointestinaler Blutungen oder Ulcera. Bei bestehendem systemischem Lupus erythematodes und anderen Autoimmunerkrankungen sollte Ibuprofen nur nach sorgfältiger Nutzen-Risiko-Abwägung verordnet werden. Vorsicht bei Patienten mit Asthma, Heuschnupfen und chronischen Atemwegsinfektionen, schweren hepatischen, renalen oder cardialen Erkrankungen, schwerer Hypertonie, Magen-Darm-Blutungen oder Ulcera in der Vorgeschichte. Pharmakodynamische Eigenschaften: ATC Code: M01AE01. Pharmakotherapeutische Gruppe: Nichtsteroidale Antiphlogistika und Antirheumatika. Hilfsstoffe: Hochdisperses Siliciumdioxid, Magnesiumstearat, Natriumlaurylsulphat, Lactose, Croscarmellose-Natrium, mikrokristalline Cellulose, Hydroxypropylmethylcellulose, Talk, Methocel und Farbstoff E171. Name oder Firma und Anschrift des Pharmazeutischen Unternehmers: Nycomed Austria GmbH, St.-Peter-Straße 25, 4020 Linz. Verschreibungspflicht/Apothekenpflicht: Rpfrei mit W 10, apothekenpflichtig. Informationen zu Besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen und Gewöhnungseffekten sind der veröffentlichten Fachinformation zu entnehmen. [0409] Losartan-HCT 1A Pharma 50 mg/12,5 mg – Filmtabletten, Losartan-HCT 1A Pharma 100 mg/25 mg Filmtabletten. Zusammensetzung: Losartan-HCT 1A Pharma 50 mg/12,5 mg – Filmtabletten: Jede Tablette enthält als Wirkstoffe 50 mg Losartan (als Kaliumsalz) und 12,5 mg Hydrochlorothiazid. Losartan-HCT 1A Pharma 100 mg/25 mg – Filmtabletten: Jede Tablette enthält als Wirkstoffe 100 mg Losartan (als Kaliumsalz) und 25 mg Hydrochlorothiazid. Sonstige Bestandteile: Jede Losartan-HCT 1A Pharma 50 mg/12,5 mg – Filmtablette enthält 26,9 mg Lactose-Monohydrat. Jede Losartan-HCT 1A Pharma 100 mg/25 mg – Filmtablette enthält 53,8 mg Lactose-Monohydrat. Tablettenkern: mikrokristalline Cellulose, Lactose-Monohydrat, vorverkleisterte Stärke, hochdisperses wasserfreies Siliciumdioxid, Magnesiumstearat. Filmüberzug: Hypromellose, Hydroxypropylcellulose, Eisen(III)-oxid,gelb (E 172), Titandioxid (E 171). Wirkstoffgruppe: Kombination aus einem Angiotensin II-Rezeptor(Typ AT1)-Antagonist und einem Thiazid-Diuretikum, Antihypertonikum. ATC-Code: C09DA01. Anwendungsgebiete: Losartan-HCT 1A Pharma ist zur Behandlung von essenziellem Bluthochdruck indiziert bei Patienten, bei denen der Bluthochdruck mit Losartan oder Hydrochlorothiazid alleine nicht ausreichend eingestellt werden kann. Gegenanzeigen: Überempfindlichkeit gegen Losartan, Sulfonamid-Derivate (wie Hydrochlorothiazid) oder einen der sonstigen Bestandteile; therapieresistente Hypokaliämie oder Hyperkalziämie; schwere Einschränkung der Leberfunktion, Cholestase und obstruktive Erkrankungen der Gallenwege; therapierefraktäre Hyponatriämie; symptomatische Hyperurikämie/Gicht; zweites und drittes Trimenon der Schwangerschaft; Stillzeit; schwere Einschränkung der Nierenfunktion (Creatinin-Clearance < 30ml/min); Anurie. Zulassungsinhaber: 1A Pharma GmbH, A-1235 Wien. Packungsgrößen: 10 und 30 Stück. Abgabe: Rezept- und apothekenpflichtig. Weitere Angaben zu Warnhinweisen und Vorsichtsmaßnahmen für die Verwendung, Wechselwirkungen mit anderen Arzneimitteln oder sonstige Wechselwirkungen und Nebenwirkungen sowie Angaben zu Schwangerschaft und Stillzeit sind der veröffentlichten Fachinformation zu entnehmen. Veregen 10% Salbe; Qualitative und quantitative Zusammensetzung: 1 g Salbe enthält 100 mg gereinigten Trockenextrakt aus Grünteeblättern (Camellia sinensis (L.) O. Kuntze) (45-56:1) entsprechend 55-72% (-)-Epigallokatechingallat. Erstes Extraktionsmittel: Wasser; Sonstige Bestandteile: Weißes Vaselin (enthält dl-α Tocopherol), gebleichtes Wachs, Isopropylmyristat, Oleylalkohol, Propylenglycolmonopalmitostearat (Ph. Eur.); Pharmakotherapeutische Gruppe: pflanzliches Arzneimittel zum Auftragen auf die Haut, ATC-Code: D11AX, andere Dermatika; Anwendungsgebiete: Veregen 10 % ist für die dermale Behandlung von äußerlichen Feigwarzen im Genital- und Perianalbereich (Condylomata acuminata) bei immunkompetenten Patienten, die über 18 Jahren alt sind, bestimmt. Gegenanzeigen: Veregen 10 % ist kontraindiziert bei bekannter Überempfindlichkeit gegen den Extrakt aus Grünteeblättern oder gegen einen der sonstigen Bestandteile. Zulassungsinhaber: MediGene AG, 82152 Planegg/Martinsried, Deutschland; Vertrieb in Österreich: Solvay Pharma Ges.m.b.H., 1200 Wien; Verschreibungspflicht / Apothekenpflicht: Rezept- und apothekenpflichtig; Weitere Angaben zu Nebenwirkungen, Wechselwirkungen und zu den besonderen Warnhinweisen zur sicheren Anwendung entnehmen Sie bitte der veröffentlichten Fachinformation. (Stand der Information: 02/2010) Sab® Simplex - Tropfen. Zusammensetzung: 1 ml (25 Tropfen) enthält 69,19 mg Simeticon (Dimeticon 350-Siliciumdioxid 92,5 : 7,5). Liste der sonstigen Bestandteile: Ceto-Macrogol, Sorbinsäure, Hypromellose, Natriumcitrat, Zitronensäure, Vanillearoma (H&R [60388]), Carbomer, Natriumcyclamat, Himbeeraroma (H&R [60373]), Natriumbenzoat, Saccharin-Natrium, gereinigtes Wasser. Anwendungsgebiete: bei übermäßiger Gasbildung und Gasansammlung im Magen-Darm-Bereich (z. B. durch Aerophagie) mit gastrointestinalen Beschwerden wie Blähungen, Völlegefühl und Spannungsgefühl im Oberbauch (auch Roemheld-Syndrom); bei verstärkter Gasbildung nach Operationen; zur Vorbereitung diagnostischer Untersuchungen im Bauchbereich zur Reduzierung von Gasschatten (Röntgen, Sonographie) und zur Vorbereitung von Gastro-Duodenoskopien; bei Spülmittelvergiftungen. Gegenanzeigen: Überempfindlichkeit gegen Simeticon oder einen anderen Bestandteil des Präparates. Pharmakotherapeutische Gruppe: Alimentäres System und Stoffwechsel. ATC-Code: A03AX13. Inhaber der Zulassung: Pfizer Corporation Austria Ges.m.b.H., Wien. Stand der Information: Juli 2007. Verschreibungspflicht/Apothekenpflicht: Rezeptfrei, apothekenpflichtig. Angaben zu besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit und Nebenwirkungen entnehmen Sie bitte der veröffentlichten Fachinformation. Pantoprazol „Nycomed“ 20 mg – magensaftresistente Tabletten: Qualitative und Quantitative Zusammensetzung: 1 magensaftresistente Tablette enthält: 22,55 mg Pantoprazol-Natrium Sesquihydrat entsprechend 20 mg Pantoprazol. Sonstige Bestandteile: Kern: Natriumcarbonat wasserfrei, Mannitol, Crospovidon, Povidon K90, Calciumstearat. Überzug: Hypromellose, Povidon K25, Titandioxid (E171), Eisenoxid gelb (E172), Propylenglycol, Methacrylsäure Ethylacrylat Copolymer (1:1), Polysorbat 80, Natriumdodecylsulfat, Triethylcitrat. Drucktinte braun: Schellack, Eisenoxid rot, schwarz und gelb (E172), Sojalecithin, Titandioxid (E171), Dimeticon-Emulsion. Anwendungsgebiete: Zur Behandlung der milden Refluxkrankheit und damit verbundener Symptome (z. B: Sodbrennen, Säureregurgitation, Schmerzen beim Schlucken). Langzeittherapie und Rezidivprävention der Refluxösophagitis. Prävention von gastrointestinalen Ulcera, die durch nichtselektive, nichtsteroidale antiinflammatorisch wirksame Arzneimittel (NSAID) induziert werden, bei Risikopatienten, die eine andauernde NSAID-Therapie benötigen. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff, gegen Soja oder einen der sonstigen Bestandteile von Pantoprazol „Nycomed“ 20 mg. Pantoprazol sollte, wie andere Protonenpumpenhemmer, nicht zusammen mit Atazanavir verabreicht werden. Pantoprazol „Nycomed“ 40 mg - magensaftresistente Tabletten: Qualitative und Quantitative Zusammensetzung: 1 magensaftresistente Tablette enthält 45,10 mg Pantoprazol-Natrium Sesquihydrat entsprechend 40 mg Pantoprazol. Sonstige Bestandteile: Kern: Natriumcarbonat wasserfrei, Mannitol, Crospovidon, Povidon K90, Calciumstearat. Überzug: Hypromellose, Povidon K25, Titandioxid (E171), Eisenoxid gelb (E172), Propylenglycol, Methacrylsäure Ethylacrylat Copolymer (1:1), Polysorbat 80, Natriumdodecylsulfat, Triethylcitrat. Drucktinte braun: Schellack, Eisenoxid rot, schwarz und gelb (E172), Sojalecithin, Titandioxid (E171), Dimeticon-Emulsion. Anwendungsgebiete: Moderate und schwere Refluxösophagitis. Zur Kombinationstherapie für die Eradikation von Helicobacter pylori mit zwei geeigneten Antibiotika bei Patienten mit peptischem Ulkus mit dem Ziel der Verringerung der Häufigkeit eines durch diesen Erreger bedingten Wiederauftretens von Zwölffingerdarmgeschwüren und Magengeschwüren. Ulcus duodeni. Ulcus ventriculi. Zollinger-Ellison Syndrom und andere pathologisch hypersekretorische Zustände. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff, gegen Soja oder einen der sonstigen Bestandteile von Pantoprazol „Nycomed“ 40 mg - Tabletten oder gegenüber den Kombinationspräparaten. Pantoprazol „Nycomed“ 40 mg darf nicht zur Kombinationstherapie zur Eradikation von Helicobacter pylori bei Patienten mit mittelgradiger bis schwerer Leberinsuffizienz oder renaler Dysfunktion angewendet werden, da zurzeit noch keine Daten zur Wirksamkeit und Sicherheit dafür vorliegen. Pantoprazol sollte, wie andere Protonenpumpenhemmer, nicht zusammen mit Atazanavir verabreicht werden. Pharmakotherapeutische Gruppe: Protonenpumpenhemmer. ATC-Code: A02BC02. Inhaber der Zulassung: Nycomed Pharma GmbH, 1120 Wien. Verschreibungspflicht/Apothekenpflicht: Rezept- und apothekenpflichtig. Informationen zu Besonderen Warnhinweisen und Vorsichtsmaßnahmen für die Anwendung, Wechselwirkungen mit anderen Arzneimitteln und sonstigen Wechselwirkungen, Schwangerschaft und Stillzeit, Nebenwirkungen und Gewöhnungseffekten sind der veröffentlichten Fachinformation zu entnehmen. [1209]











