Grundwissen der 10.Klasse NTG - Donau
Werbung

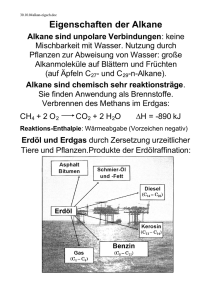
Grundwissen der 10.Klasse NTG 1. Kohlenwasserstoffe 1.1 Alkane 1.1.1 Organische Stoffe = Verbindungen, die Kohlenstoffatome enthalten Ausnahme: Kohlenstoffoxide, Kohlensäure, Carbonate 1.1.2 Kohlenwasserstoffe = Verbindungen aus Molekülen, die ausschließlich Kohlenstoff- und Wasserstoffatome enthalten 1.1.3 Alkane = Gesättigte Kohlenwasserstoffe mit Einfachbindungen Molekülformel CnH2n+2 1.1.4 Homologe Reihe der Alkane = Methan, Ethan, Propan, Butan, Pentan, Hexan, Heptan, Octan, Nonan und Decan bilden die ersten zehn Glieder der homologen Alkanreihe, die sich durch den Mehrgehalt einer CH2Gruppe (Methylengruppe) unterscheiden 1.1.5 Isomere = Moleküle mit gleicher Molekülformel, aber mit einem anderen räumlichen Aufbau Moleküle mit gleicher Valenzstrichformel aber unterschiedlicher räumlicher Anordnung werden Konformationsisomere genannt Moleküle mit unterschiedlichem Name, verschiedener Valenzstrichformel und Struktur werden Konstitutionsisomere genannt 1.1.6 Nomenklatur der Alkane nach IUPAC-Regeln = Bestimmung der Hauptkette (längste Kette von C-Atomen), welche den Stammnamen des Alkans angibt; Das C-Atom, welches einer Verzweigung am nächsten steht wird als Nummer 1 der Hauptkette nummeriert; die benannten Seitenketten C (Alkylreste) werden in alphabetischer Reihenfolge dem Stammnamen vorangestellt; arabische Zahlen geben die Verknüpfungen zwischen Haupt- und Seitenketten an; griechische Zahlenworte (di, tri, tetra, usw.) geben die Anzahl gleichartiger Alkylreste an und werden vor dem Namen des jeweiligen Alkyl-Restes geschrieben 1.1.7 Zusammenhang von Molekülstruktur und Physikalischen Eigenschaften der Alkane = Zwischen den unpolaren Alkanmolekülen wirken ausschließlich van-der-Waals-Kräfte, welche mit der Länge der Kette an C-Atomen stärker werden. Die van-der-Waals-Kräfte sind zwischen linearen Isomeren stärker als zwischen verzweigten Isomeren. Schmelz- und Siedetemperaturen der Stoffe sind umso höher, je größer diese zwischenmolekularen Kräfte sind. Aufgrund stärkerer Kräfte, wie Dipol-Wechselwirkungen, Wasserstoffbrücken und Ionenbindungen, die zwischen polare Teilchen bzw. Ionen wirken, können unpolare Moleküle nur schwer zwischen diese eingelagert werden. Alkane lösen sich gut in lipophilen (unpolaren) Stoffen aber schlecht ind hydrophoben Stoffen wie Wasser. 1.1.8 Chemische Eigenschaften der Alkane = Allen Alkanen gemeinsam ist ihre Brennbarkeit, wobei bei der vollständigen Verbrennung Wasser und Kohlenstoffdioxid entstehen. Mit Halogenen kommt es zu einer Austauschreaktion (radikalische Substitution), während derer das Halogenmolekül mittels Licht homolytisch gespalten wird und sich zwei Halogenradikale bilden. Eines reagiert mit einem Wasserstoffatom des Alkans zu Wasserstoffbromid, während das zweite Radikal mit dem verbleibenden Alkylradikal zu einem Halogenalkanmolekül reagiert. 1.1.9 Radikal = Teilchen, die aufgrund eines ungepaarten Elektrons sehr reaktiv sind 1.2 Alkene & Alkine 1.2.1 Alkene = Kohlenwasserstoffe, die mindestens eine Doppelbindung besitzen, werden als ungesättigt bezeichnet Molekülformel CnH2n 1.2.2 Alkine Kohlenwasserstoffe mit mindestens einer Dreifachbindung Molekülformel: CnH2n-2 1.2.3 Nomenklatur der Alkene/ Alkine Alkene besitzen die Endung –en Alkine die Endung –in die Lage der Mehrfachbindung wird durch eine Zahl vor der Endung angegeben die Anzahl der Mehrfachbindungen zeigt ein griechisches Zahlenwort vor der Endung an mit dem C-Atom, dass näher an der ersten Mehrfachbindung liegt wird bei der Durchnummerierung begonnen 1.2.4 E / Z – Isomerie der Alkene Molekülteile einer Doppelbindung sind nicht frei beweglich. Die Teile können entgegengesetzt oder zusammen stehen. 1.2.5 Physikalische Eigenschaften der Alkene / Alkine Ähnlich der der Alkane, weil Alken- und Alkinmoleküle ebenso unpolare Moleküle sind. 1.2.6 Chemische Eigenschaften von Alkene / Alkine reaktionsfähiger als Alkane sind alle brennbar reagieren mit Halogen nach der Elektrophieren Addition Nachweis durch Baeyerprobe (Entfärbung schwefelsaurer Kaliumpermanganatlösung) 2. Sauerstoffhaltige organische Verbindungen 2.1 Alkohole 2.1.1 Alkohole Funktionelle Gruppe: OH-Gruppe Molekülformel: CnH2n+1OH 2.1.2 Homologe Reihe und Nomenklatur der Alkohole Alkan erhält Endung -ol Methanol, Ethanol, Propanol, Butanol, … 2.1.3 Isomerie der Alkohole OH-Gruppe kann ab Propanol in der homologen Reihe an unterschiedliche Kohlenstoffatome gebunden sein Arabische Ziffer gibt vor der Endung –ol die Stellung der OH-Gruppe an 2.1.4 Primäre, sekundäre, tertiäre Alkohole Primärer Alkohol: OH-Gruppe befindet sich an C-Atom mit zwei H-Atomen Sekundärer Alkohol: OH-Gruppe befindet sich an C-Atom mit einem Wasserstoffatom Tertiärer Alkohol: OH-Gruppe befindet sich an C-Atom ohne Wasserstoffatom 2.1.5 Diole, Triole, Polyole Ein Diol enthält zwei, ein Triol drei und ein Polyol mehrere OH-Gruppen. Ein C-Atom kann jedoch nur eine OH-Gruppe besitzen. 2.1.6 Zusammenhang: Molekülstruktur – Physikalische Eigenschaften der Alkanole unpolarer Kohlenwasserstoffrest kann V.d.W.-Kräfte zu anderen Molekülen ausbilden polare OH-Gruppe kann Wasserstoffbrückenbindungen zu Molekülen bilden Siede- und Schmelztemperatur sind höher als bei Alkanen, da höhere Energie nötig ist um die H-Brücken aufzubrechen 2.1.7 Chemische Eigenschaften der Alkanole brennbar, wobei H2O und CO2 entsteht primäre Alkohole lassen sich zu Aldehyden oxidieren sekundäre Alkohole zu Ketonmolekülen tertiäre Alkohole lassen sich nicht oxidieren 2.2 Aldehyde und Ketone 2.2.1 Aldehyde (Alkanale) & Ketone (Alkanone) Aldehyd: Molekül mit Carbonylgruppe (C=O) an einem Kettenende Keton: Molekül mit Carbonylgruppe in der Kette 2.2.3 Homologe Reihe und Nomenklatur der Ketone und Aldehyde Alkanale: Methanal, Ethanal, Propanal, … Alkan erhält Endung –al Alkanole: Propanon, Butanon, Pentanon, … Alkan erhält Endung –on; Stellung der Carbonylgruppe wird durch Zahl vor –ol angegeben 2.2.3 Zusammenhang: Molekülstruktur – Physikalische Eigenschaften von Aldehyden / Ketonen: unpolarer Kohlenwasserstoffrest -> V.d.W.-Kräfte zu anderen Molekülen polare Carbonylgruppe -> Dipol-Dipol-Wechselwirkungen zu anderen Molekülen & HBrücken zu Wassermolekülen Siede- und Schmelztemperatur liegt höher als die der Alkane, jedoch niedriger als die der Alkohole 2.2.4 Chemische Eigenschaften der Aldehyde und Ketone brennbar, wobei Wasser und Kohlenstoffdioxid entsteht Aldehyde wirken reduzierend, d.h. können durch entsprechende Oxidationsmittel zu Carbonsäuren oxidiert werden (Ketone nicht!) Nachweisreaktion für Aldehyde: Fehlingprobe, Silberspiegelprobe Nukleophile Addition: Carbonylgruppe kann von Nukleophilen (= Teilchen, die positive Ladung suchen) angegriffen werden -> Addition an die Doppelbindung 2.3 Carbonsäuren 2.3.1 Carbonsäuren An einem Kettenende steht eine Carbonsäuregruppe (= Carboxylgruppe R-COOH) 2.3.2 Nomenklatur der Carbonsäuren Dem Alkannamen wird die Endung –säure angehängt. 2.3.3 Zusammenhang: Molekülstruktur – Physikalische Eigenschaften von Carbonsäuren unpolarer Kohlenwasserstoffrest -> Ausbildung von V.d.W.-Kräften zu anderen Molekülen polare Carboxylgruppe -> Ausbildung von Dipol-Dipol-Wechselwirkungen und H-Brücken zu Molekülen Siede- und Schmelztemperatur ist höher als die der Alkane 2.3.4 Chemische Eigenschaften von Carbonsäuren verbrennen zu Wasser und Kohlenstoffdioxid Carboxylgruppen können Protonen abspalten -> Bei einer Reaktion mit Wasser bilden sich Oxoniumionen und Carboxylationen Es gilt: Je stärker die OH-Bindung der Carboxylgruppe ist, desto leichter wird das Proton abgespalten und desto stärker ist die Säure 2.3.5 Carbonsäureester Esterbildung: Alkoholmoleküle bilden mit Carbonsäuren Ester und Wasser aus. (= Kondensationsreaktion; Verbindung zweier Moleküle unter Abspaltung von kleineren) Ester kann mit Laugen und Wasser wieder gespalten werden, wobei Alkohol und die entsprechenden Fettsäureanionen entstehen Esterbindung: R1COOR2 (R1: Kohlenwasserstoffrest Carbonsäure; R2: Kohlenwasserstoffrest Alkohol) 3. Biomoleküle 3.1 Fette 3.1.1 Fettmoleküle = Triester aus Propan-1,2,3-triol-Molekül und drei Fettsäuren Ch2-O-CO-R Ch -O-CO-R Ch2-O-CO-R 3.1.2 Eigenschaften von Fetten lange Fettsäurereste -> wasserunlöslich (hydrophob / lipophil) Dichte ist geringer als die von Wasser Es gilt: Je ungesättigter die Fettsäurereste sind, desto niedriger ist die Schmelztemperatur 3.2 Aminosäuremoleküle 3.2.1 Aminosäuren Kohlenstoffatom bindet eine Carbonsäure, ein Wasserstoffatom, eine Aminogruppe und einen organischen Rest salzartiger Charakter: In Kristallen und wässrigen Lösungen mit entsprechenden pH-Wert liegen Aminosäuren als Zwitterionen (Carboxylatgruppe (-COO-) und Ammoniumgruppe (NH3+)) vor 3.2.2 Peptidbindung Eine Peptidbindung entsteht durch die Kondensationsreaktion einer Carboxylgruppe der einern Aminosäure mit einer Aminogruppe der anderen Aminosäure. 3.3 Proteinmoleküle Verbindungen aus mehr als 100 Aminosäuren Primärstruktur: Aminosäuresequenz (Reihenfolge der Bausteine), die Struktur und Funktion bestimmt. (Codiert in DNA) Sekundärstruktur: Räumliche Struktur, die den Bau bestimmt. Sie entsteht hauptsächlich durch H-Brücken. Man unterscheidet zwischen Helix- und Faltblattstruktur Tertiärstruktur: Räumliche Anordnung der Sekundärstruktur 3.4 Kohlenhydrate 3.4.1 Monosaccharide z.B. Glucose, Fructose 3.4.2 Disaccharide z.B. Saccharose, Maltose 3.4.3 Polysaccharide z.B. Stärke, Cellulose 3.4.5 Glucosemolekül Formel: C6H12O6 Kettenform: 2,3,4,5,6-Pentahydroxyhexanal Ringschluss: nukleophile Addition der Hydroxylgruppe des C5-Atoms an Aldehydgruppe 3.4.6 Stärkemolekül Makromolekül aus bis zu 1 Millionen Glucosemonomeren mit Helixstruktur Verknüpfung durch Kondensationsreaktion zwischen der OH-Gruppe von dem C1-Atoms des einen und der OH-Gruppe des C4-Atoms des anderen Glucosemoleküls 3.4.7 Eigenschaften der Kohlenhydrate gut wasserlöslich Zersetzung beim Erhitzen aufgrund der Hydroxylgruppen