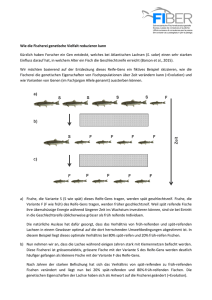
Theorieskript
Werbung

INTERNATIONAL ZEBRAFISH AND MEDAKA COURSE European Zebrafish Resource Centre (EZRC) Karlsruhe Institute of Technology (KIT) Heidelberg University <°(((>< <°(((>< <°(((>< DEUTSCH International Zebrafish Medaka Course IZMC International Zebrafish/Medaka Course (IZMC) European Zebrafish Resource Centre (EZRC) Karlsruhe Institute of Technology (KIT) Heidelberg University 1 International Zebrafish Medaka Course IZMC Einführung Fisch-Modelle haben in den vergangenen Jahrzehnten für die biomedizinische Forschung zunehmend an Bedeutung gewonnen. Insbesondere die beiden TeleostierSpezies Zebrafisch (Danio rerio) und Medaka (Oryzias latipes) haben sich zu unverzichtbaren Modellsystemen für die Untersuchung von Genfunktionen bei Vertebraten entwickelt. Ihre Verfügbarkeit für eine zukunftsorientierte Genetik, insbesondere ihre geringe Körpergröße, die Transparenz ihrer Embryos und deren extra-uterine Entwicklung macht sie zu idealen Systemen für systematische Untersuchungen von Entwicklungsprozessen. Inzwischen ist es offensichtlich, dass diese Fischarten für die biomedizinische Forschung eine Vielzahl von Krankheitsmodellen bereithalten, die das Studium pathophysiologischer Prozesse am intakten Embryo in Echtzeit und unter hoher zellulärer Auflösung ermöglichen. Die Direktive 2010/63/EU des Europäischen Parlamentes und des Europarates gibt vor, dass Personen, die tierexperimentell arbeiten, über die erforderlichen Fachkenntnisse verfügen müssen. Derzeit wird in Deutschland von Universitäten und anderen Forschungseinrichtungen eine Vielzahl Lehrveranstaltungen angeboten, die thematisch sämtlich dem FELASA B Konzept entsprechen. Diese Kurse befassen sich hauptsächlich mit der Forschung an Mäusen und Ratten, das Arbeiten mit Fischen wird nicht gelehrt. Das Europäische Zebrafisch Resourcenzentrum am Karlsruhe Institut für Technologie (KIT) bietet nun erstmals eine umfassende Lehrveranstaltung für die Arbeit mit Zebrafischen und Medakas an, Zielgruppen sind v.a. Techniker, Studenten, Doktoranden und Wissenschaftler. Der Kurs wird – entsprechend den jeweiligen Erfordernissen – in englischer oder deutscher Sprache gehalten werden. Die Theorieteile werden den Kursteilnehmern als online-Material über die Webseite der ICMZ zur Verfügung stehen, und zwar grundsätzlich zweisprachig. Lehrinhalte des Theorieteils sind u.a. die tierschutzrechtlichen Regelungen in Deutschland, die Ethik des Tierversuches wie auch das 3R-Komzept und Alternativverfahren. Wichtige Themen sind zudem die Biologie, Zucht, Haltung und Ernährung von Zebrafisch und Medaka, aber auch Fragen der Gesundheitsüberwachung der Tiere sowie relevante Erkrankungen. Andere Fischmodelle und ihre Bedeutung für die Toxikologie und die biomedizinische Forschung sollen besprochen werden. Die Praxisteile werden in den Fischanlagen des EZRC und in Zusammenarbeit mit dem Institut für Toxikologie und Genetik des KIT durchgeführt. Dabei werden Kenntnisse vermittelt zum Handling der Tiere, zu Haltung, Zucht, Anästhesie, Entnahme von Flossengewebe (fin clipping) und zur tierschutzgerechten Tötung von Zebrafisch und Medaka. Der Kurs wird mit einer Erfolgskontrolle in Form einer Multiple-Choice-Form Prüfung abgeschlossen. Teilnehmer, die sowohl den Kurs als auch die Prüfung erfolgreich absolviert haben, werden eine Bescheinigung erhalten, in der ihnen das notwendige Wissen zu Zebrafisch und Medaka, aber auch ihre Fähigkeit zum Umgang mit diesen Tieren bestätigt wird, so dass sie damit den gesetzlichen Erfordernissen zur Arbeit mit Fischen genügen. 2 International Zebrafish Medaka Course IZMC Inhalt 1. Geschichte der experimentellen Medizin und Ethik ......................................................... 5 2. Alternativmethoden und das 3R-Konzept ...................................................................... 10 2.1 Schmerzen, Leiden und Schäden bei Fischen............................................................... 14 3. Gesetzliche Regelung und die Bewilligungspraxis von Tierversuchen ........................... 17 3.1 Tierschutzrechtliche Regelung für tierexperimentelles Arbeiten in Deutschland .......... 17 3.1.1 Der rechtliche Rahmen.................................................................................................. 17 3.1.3 Verwaltungsverfahren ................................................................................................... 18 3.1.4 Genehmigungspflichtige Versuchsvorhaben ................................................................. 18 3.1.5 Leiter, Stellvertreter ....................................................................................................... 20 3.1.6 Mitarbeiter ..................................................................................................................... 20 3.1.7 Anzeigepflichtige Versuchsvorhaben ............................................................................. 21 3.1.8 Töten von Tieren zu wissenschaftlichen Zwecken ......................................................... 21 3.1.9 Genehmigungsvorbehalt für belastete genetisch veränderte Zuchten ........................... 21 3.1.10 Verwendung von Larven ............................................................................................... 22 3.1.11 Aufzeichnungspflicht ..................................................................................................... 22 3.1.12 Jährliche Versuchstiermeldung ..................................................................................... 23 3.1.13 Nationaler Tierschutz-Ausschuss .................................................................................. 23 3.1.14 Direktive 2010/63/EU .................................................................................................... 23 3.2 Rechtliche Aspekte zum Versand von Fischen, Fischeiern und Sperma-Proben, die ....... für wissenschaftliche Untersuchungen bestimmt sind.................................................... 27 3.2.1 Zusätzliche Vorschriften beim Versand von Fischen (über 5 Tage post fertilisation)..... 29 3.2.2 Zusätzliche Vorschriften beim Versand von Fischen, die als genetisch veränderte .......... Organismen einzustufen sind ........................................................................................ 30 4. Zebrafisch und Medaka als experimentelle Modelle ...................................................... 33 4.1 Die Biologie des Zebrabärblings (Danio rerio) ............................................................... 35 4.2 Die Biologie des Medakas (Oryzias latipes) .................................................................. 43 5. Haltung, Züchtung und Fütterung .................................................................................. 47 5.1 Zebrabärbling ................................................................................................................ 47 5.2 Medaka Haltung und Züchtung .................................................................................... 50 6. Anästhesie, Analgesie und Euthanasie von Fischen ..................................................... 54 6.1 Stress und Schmerz in Fischen ..................................................................................... 54 6.2 Definitionen ................................................................................................................... 55 6.3 Allgemeine Überlegungen bei der Wahl der Betäubungsmethode ................................. 56 6.4 Stadien der Anästhesie ................................................................................................. 60 6.5 Arten der Anästhesie ..................................................................................................... 61 6.6 Dosierung von Inhalationsanästhetika ........................................................................... 65 3 International Zebrafish Medaka Course IZMC 6.7 Nicht chemische Betäubungsmittel................................................................................ 67 6.7.1 Hypothermie (rasches Kühlen) ...................................................................................... 67 6.7.2 Elektro-Betäubung ........................................................................................................ 68 6.8 Injektion von Betäubungsmitteln .................................................................................... 69 6.9 Andauernde Betäubung und deren Überwachung ......................................................... 70 6.10 Euthanasie .................................................................................................................... 71 6.11 Anästhesie und Euthanasie beim Zebrabärbling ........................................................... 72 7. Verfahren zur Gewährleistung der Gesundheit, dem Wohlergehen und der Pflege .......... von Zebrafischen (Danio rerio) und Medakas (Oryzias latipes) ..................................... 74 7.1 Fischkrankheiten ........................................................................................................... 74 7.1.1 Erkennen von typischen Krankheitssymptomen und Krankheitserregern ...................... 74 7.1.2 Beschreibung der wichtigsten, relevanten Erkrankungen .............................................. 75 7.1.3 Behandlungen ............................................................................................................... 78 7.1.5 Probezahlen für Gesundheitsüberwachung ................................................................... 81 7.2 Liste von potentielle Gesundheitsrisiken beim Kontakt mit Zebrafischen oder Medaka 81 8. Statistische Analyse ...................................................................................................... 83 9. Abkürzungen ................................................................................................................ 86 10. Fische in der Toxikologie und Ökotoxikologie ................................................................ 90 10.1 Fischtests in der Abwasserüberprüfung......................................................................... 90 10.2 Fischtests für die Chemikalienuntersuchung: akute Fischtests mit adulten Fischen ......... und der Fischembryotest als Alternativmethode ............................................................ 91 10.3 Rechtliche Bestimmungen für Fischtests außer akuten Toxizitätstests .......................... 95 10.4 Fische, die üblicherweise in der (Öko)Toxikologie verwendet werden ......................... 102 10.4.1 Zebrabärbling (Danio rerio) ......................................................................................... 102 10.4.2 Medaka (Oryzias latipes) ............................................................................................. 102 10.4.3 Dickkopfelritze (Pimephales promelas)........................................................................ 102 10.4.4 Regenbogenforelle (Oncorhynchus mykiss) ................................................................ 104 10.4.5 Edelsteinkärpfling (Cyprinodon variegatus) ................................................................. 105 10.4.6 Guppy (Poecilia reticulata)……………………………… ......... ……………………………106 10.4.7 Goldorfe (Leuciscus idus melanotus) .......................................................................... 107 10.5 Diversität von Fischarten in alternativen Testmethoden .............................................. 108 10.6 Alternativmethoden für Fischtoxizitätstests, die nicht auf Embryonen basieren ........... 111 11. Zebrafischembryos als Modellorganismen in der Chemischen Biologie und Genetik... 112 4 International Zebrafish Medaka Course IZMC 1. Geschichte der experimentellen Medizin und Ethik (Almut Köhler, Jürgen Weiss) Eine kurze Geschichte der experimentellen Medizin Die Entwicklung des Tierexperimentes als Modell für den Menschen hat weitgehend parallel zur Entwicklung der Medizinwissenschaft selbst stattgefunden. Die fundamentalen Ursprünge der westlichen Medizin liegen im klassischen Griechenland. Tatsächlich gehörten griechische Philosophen zu den Ersten, die Vivisektionen 1 für wissenschaftliche Zwecke durchführten. Im ersten medizinischen Werk, dem “Corpus Hippocraticum” sind einige Beispiele hierfür beschrieben. Beim „Corpus Hippocraticum” handelt es sich um eine Sammlung klassischer medizinischer Texte, die vom 5. vorchristlichen bis zum 2. Jhdt. nach Christus zusammen-getragen wurden. Grundsätzlich wird das Corpus dem Hippocrates von Kos zugeschrieben (Abb. 1), vermutlich hat er aber nur einige wenige Teile zum Corpus beigetragen. Zur damaligen Zeit war die medizinische Wissenschaft vor allem deskriptiv und auf Fragen der Anatomie ausgerichtet. Galen von Pergamon lebte im 2. Jhdt. nach Christus und war – nach Hippokrates – der bedeutendste Arzt der antiken Welt. Er war Arzt, Anatom und Physiologe und verwendete für Abb. 1: Hippocrates von Kos (460 seine Forschung Schweine, Affen und Hunde. Er legte die – 370 vor Christus), “Vater der Medizin als Wissenschaft” Grundlagen der Medizin für seine Zeit wie auch die nachfolgenden Jahrhunderte. Die Kultur der Römer bot keine Unterstützung für die weitere Entwicklung der Medizin und der Biologie. Mit der Ausbreitung des Christentums ging dann ein fast völliges Verschwinden der medizinisch-biologischen Wissenschaften einher, das mehr als tausend Jahre andauerte. Zu dieser Zeit begann das so genannte Goldene Zeitalter des Islam, das etwa vom 8. bis zum 13. Jhdt. dauerte und das enorme Fortschritte für die Medizin und die Natur-wissenschaften brachte. Die Bedeutung der Naturwissenschaften in dieser Zeit lässt sich an der arabischen Vorsilbe “Al-“ erkennen, die Begriffe wie Algebra, Alchemie, Alkohol und Alkalien enthalten. Abu Ali ibn Sina aus Chorasan im heutigen Iran, bekannt eher mit seinem latinisierten Namen “Avicenna”, war einer der bekanntesten Repräsentanten dieser Zeit. Er studierte zahlreiche Fächer wie z.B. Medizin, Naturwissenschaften und Philosophie. Avicenna beschrieb ausführlich über die Heilwirkung ätherischer Öle und verfasste fast hundert Bücher, darunter auch den “Kanon der Medizin”, der bis zum 17ten Jhdt. mit Abstand das wichtigste 1 Arbeit am lebenden Organismus 5 Fig. 2: Andreas Vesalius (15141564), Gründer der modernen Anatomie und des morphologischen Denkens International Zebrafish Medaka Course IZMC Werk über die Kunst des Heilens blieb. Mit der Renaissance zu Beginn des 15ten Jhdts. kam es in Mitteleuropa zu einem Wiederaufleben der experimentellen Biologie und Medizin, der Empirismus gewann an Bedeutung. Vesalius (Abb. 2), ein Anatom aus Flandern und Vertreter dieser Zeit, gilt als Gründer der modernen Anatomie und des “morphologischen Denkens” in der Medizin. Mit dem frühen 17ten Jhdt. stellte sich ein wachsendes Interesse an physiologischen Prozessen ein. So beschrieb z.B. William Harvey (1578-1657) als Erster den Prozess der Blutzirkulation und Johann C. Brunner (1653-1727) führte Tierexperimente zur Funktion der Bauchspeicheldrüse durch. Brunner’s Forschung führte zur Entdeckung eines Systems von Drüsen, die am Eingang zum Dünndarm die Magensäure neutralisiert. Diese Drüsen tragen bis heute seinen Namen, die Brunner’schen Drüsen. Im Jahr 1859 veröffentlichte Charles Darwin sein Hauptwerk “On the Origin of the Species”2. Dieses wurde zur Grundlage der Theorie der Evolution. Die Annahme, dass Ähnlichkeiten zwischen Menschen und Tieren auf Homologie basieren, stellte eine vernünftige Grundlage für die Verwendung von Tieren als Modell für den Menschen dar. Homologie meint in diesem Zusammenhang, dass bestimmte übereinstimmende Merkmale unterschiedlicher Tiergruppen sich nicht unabhängig voneinander entwickelt haben, sondern gemeinsame Ursprünge haben. 1865 veröffentlichte Claude Bernard (Abb. 3) die “Introduction to Experimental Medicine“ 3 , in der er die Methodologie für die Entwicklung physiologischer Experimente beschrieb. Bernard, der oft als Vater der experimentellen Medizin bezeichnet wurde, untersuchte die Bedeutung des Pankreas für die Verdauung, die Regulierung der Glukosekonzentration im Blut durch die Leber und die Steuerung der Kontraktion und Expansion der Blutgefäße durch das vasomotorische System. Zum Ende des 19. Jhdts. hatte das Aufkommen neuer Wissenschaftsdisziplinen wie z.B. der Pharmakologie, Toxikologie, Virologie und Immunologie wie auch die Entstehung Fig. 3: Claude Bernard der industriellen Entwicklung neuer Arzneimittel einen raschen (1813-1878), french physician and physiologist Anstieg der Zahl der Tierexperimente zur Folge. Bis zum Ende des 19. Jhdts. waren dabei vorwiegend Haustiere für experimentelle Zwecke eingesetzt worden. Später wurden andere Tierarten für diese Verwendung eingeführt und in der weiteren Entwicklung schließlich entstanden Tiermodelle. Mit dem Beginn des 20ten Jhdts. leitete die Genetik eine neue dynamische Periode ein. Die Genetiker griffen dabei auf eine Vielzahl von Mausvarianten zurück, die damals als Liebhabertiere gehalten wurden. Gleichwohl begannen Wissenschaftler bald mit der Zucht der ersten Stämme von Labormäusen (z.B. DBA, C57BL/6), aber auch von Laborraten (z.B. Wistar, Sprague Dawley). 2 3 „Über die Entstehung der Arten“ „Einführung in die Experimentelle Medizin“ 6 International Zebrafish Medaka Course IZMC Gleichzeitig mit der Entwicklung neuer In- und Auszuchtstämme von Labornagern begannen die Wissenschaftler auch damit, die Haltungsbedingungen ihrer Versuchstiere wie auch die eingesetzten experimentellen Verfahrensweisen kritisch zu hinterfragen. Ausgangspunkt dafür war die Erkenntnis, dass die Standardisierung möglichst vieler Parameter eine Grundvoraussetzung für die Reproduzierbarkeit von Versuchsergebnissen ist. Die Versuchstierkunde ist der Wissenschaftszweig, der sich mit diesen Fragen befasst. Ethische Aspekte Die Philosophie hat sich über viele Jahrhunderte mit der Frage der Verantwortung des Menschen für nicht-menschliche Wesen beschäftigt. Heute gibt es eine Reihe grundlegender Konzepte, die sich mit der komplexen Beziehung zwischen Mensch und Tier befassen. Der klassische Anthropozentrismus geht davon aus, dass Tiere keinen ihnen innewohnenden Wert besitzen. Dies war traditionell die Auffassung aller wichtigen Philosophen von Aristoteles bis Kant, einschließlich der christlichen Moraltheologie. Der Anthropozentrismus basiert auf der Annahme, dass Menschen schützenswert sind, weil nur sie vernunftbegabte Wesen und ein Ebenbild Gottes sind. Bis in die zweite Hälfte des 17. Jhdts. war man davon ausgegangen, dass Tiere gefühllose Kreaturen seien. Der Philosoph R. Descartes (1596-1659) hatte die Auffassung vertreten, Tiere hätten weder Seele noch Bewusstsein, nur der Mensch könne denken und fühlen. Im 18. Jhdt. wurde das Konzept des Utilitarismus entwickelt. Kurz gesagt fordert uns dieses Konzept auf, uns so zu verhalten, dass ein Höchstmaß an Glück aus unserem Handeln entsteht. Jeremy Bentham (1748-1832), ein bekannter Repräsentant des Utilitarismus, stellte den klassischen Anthropozentrismus als “gruppenegoistisches Konzept” in Frage. Er stellte fest, dass die traditionalistische Vorstellung von Tieren als nicht-denkenden und nicht-fühlenden Wesen nicht mehr länger aufrechterhalten werden könne. Bentham forderte, stattdessen die Fähigkeit zur Schmerzempfindung von Tieren zum Kriterium für den Umgang mit ihnen zu machen. Seine Schlüsselfrage war nicht, ob ein Tier denken oder sprechen, sondern ob es Schmerzen oder Leiden empfinden könne. Spätestens, nachdem Darwin’s Evolutionstheorie ab Mitte des 19. Jhdts. von der Wissenschaft weitestgehend übernommen worden war, konnte die Annahme der biologischen Einzigartigkeit des Menschen nicht länger aufrechterhalten werden. Beim “Holismus” handelt es sich um ein Konzept, das für die gesamte Welt, einschließlich Berge und Flüsse, ein unabhängiges Existenzrecht einfordert, das jeglichen Eingriff untersagt. Der Holismus geht von strikten metaphysischen Voraussetzungen aus, die kein Bestandteil derzeitiger philosophischer oder religiöser Strömungen sind wie z.B. der Beseeltheit der Natur im Allgemeinen. Insgesamt dürfte es sich beim Holismus um ein eher unrealistisches Konzept handeln. 7 International Zebrafish Medaka Course IZMC Nobelpreisträger Albert Schweitzer entwarf das Konzept des “Radikalen Biozentrismus” 4 , das davon ausgeht, dass alle lebenden Organismen einer „moralischen Gemeinschaft“ angehören. Diese Variante des Biozentrismus verbietet die Beeinträchtigung jeder Art von Leben; gleichgültig, ob es sich um ein Tier, eine Pflanze oder ein Bakterium handelt. Tatsächlich bezeichnete sich Schweitzer selbst als Massenmörder, da er als Arzt, z.B. infolge der Impfung eines Patienten, zwangsläufig Millionen von Bakterien töten würde. Das Konzept des „Radikalen Biozentrismus“ dürfte in der Praxis des Lebens kaum umsetzbar sein. Der australische Philosoph Peter Singer 5 steht, wie viele andere Tierschutzaktivisten auch, für den „Pathozentrismus“. Dieser gesteht nur solchen Tiergruppen einen inherenten moralischen Wert zu, die über ein intaktes Zentralnervensystem verfügen; auch wenn nicht zwingend klar ist, warum nur diese Tiergruppen. Zahlreiche Repräsentanten des Pathozentrismus betrachten die Mitglieder einiger Tierarten als „Personen“, während sie diese Eigenschaft bestimmten menschlichen Vertretern absprechen. So sind gemäß Peter Singer Menschenaffen, Wale und Delphine definitiv “Personen”. Auch die Angehörigen einiger anderer Säugetierspezies sollen „Personen“ sein, wenigstens mit hoher Wahrscheinlichkeit. Im Gegensatz dazu sind – nach Singer – menschliche Neugeborene, schwachsinnige oder komatöse Menschen zwar Angehörige der Spezies „Homo sapiens“, nicht aber wirkliche Personen. Das Konzept des moderaten Biozentrismus gilt in jüngerer Zeit als eine moralische Theorie, die umfassender als andere umsetzbar erscheint. Das Konzept billigt allen Lebewesen einen bestimmten moralischen Status zu. Gleichwohl ist der intrinsische Wert eines Lebewesens durch seine Stellung in der ursprünglich von Aristoteles beschriebenen Hierarchie der Organismen (Scala naturae) bestimmt. Aus heutiger Sicht bedeutet dies, dass z.B. die Gesundheit eines Hundes schützenswerter ist als die einer Ratte oder eines Käfers. In jedem Fall nehmen Menschen eine herausgehobene Stellung als „Personen“ ein. Wenn man die Konsequenzen abwägt, die sich aus der Umsetzung eines der oben skizzierten Konzepte ergibt, erscheint für einen Durchschnittsmenschen nur der moderate Biozentrismus ein pragmatisches und vertretbares Konzept zu sein. Gleichwohl bedeutet die Einschätzung eines Insektes als weniger wertvoll als eines Hundes keineswegs, dass ein Insekt als Lebewesen keinen ihm innewohnenden Wert besitzt. Vielmehr verfügen auch Insekten über einen intrinsischen Wert und diese Tatsache sollte anerkannt werden. Was bedeutet dies für die Praxis des Alltagslebens? Zum Beispiel die Invasion eines Hauses durch Schaben sollte unbedingt bekämpft werden, wobei die Tötung der Tiere schnell und möglichst schmerzfrei erfolgen sollte. Das Risiko potentieller Infektionen für die Bewohner des Hauses oder gar dessen Unbewohnbarkeit stellt einen hinreichenden vernünftigen Grund für die Bekämpfung der Insekten dar. Im Gegensatz dazu kann man eine einzelne Maus, die irgendwie ihren Weg in das Haus gefunden hat, vermutlich leicht mit einer Lebendfalle fangen und irgendwo im Freien wieder freilassen. Es ist die ethische Verpflichtung des Menschen, solche Begegnungen mit Tieren sorgfältig 4 Albert Schweitzer, Die Ehrfurcht vor dem Leben: Grundtexte aus fünf Jahrzehnten, Hrsg. v. Bähr, H.W. (1991), 6.Aufl., München 5 Peter Singer: Practical Ethics. Cambridge University Press, Cambridge 1979; 2nd edition, 1993; 3rd edition, 2011, ISBN 9780521707688 8 International Zebrafish Medaka Course IZMC abzuwägen und einen geeigneten Weg der Lösung des Problems zu finden, wobei die „Interessen“ der Tiere angemessen berücksichtigt werden müssen. Nach den Kriterien des moderaten Biozentrismus erscheint der Einsatz von Versuchstieren für wissenschaftliche Zwecke ethisch vertretbar. Dies allerdings nur unter der Voraussetzung, dass das Prinzip der 3R in vollem Umfang berücksichtigt wird, um jede unnötige Belastung für die Tiere zu vermeiden. Gleichwohl ist die Einschätzung des Einsatzes von Tieren für wissenschaftliche Zwecke in der Öffentlichkeit mitunter durch eine skeptische, wenn nicht ablehnende oder sogar feindselige Haltung gekennzeichnet. Viele Menschen erleben eine Maus, eine Katze oder einen Hund sehr emotional als geliebtes Spielzeug, wenn nicht sogar als engen Freund. Diese Menschen können nicht verstehen, wie ein Wissenschaftler ein solches Tier einfach nur als Organismus betrachten kann, dessen Funktionsweise oder Fehlfunktion er verstehen möchte. Der Einsatz von Tieren für experimentelle Zwecke ist ein extrem komplexes Thema und Menschen, die keine Beziehung zur Wissenschaft haben, haben große Schwierigkeiten, die Arbeit in diesem Bereich zu verstehen. Daraus folgt, dass Wissenschaftler offen sein sollten, mit Laien über diese Themen zu sprechen und die Hintergründe verständlich zu machen. Allerdings sollte dies auf besonders sorgfältige Weise geschehen und mit dem notwendigen Verständnis und der Empathie für die Bedenken dieser Menschen. Es ist sinnvoll, solche Aufklärungsarbeit so früh wie möglich zu beginnen. So können Wissenschaftler zum Beispiel Schulklassen besuchen und dort erläutern, was tierexperimentelles Arbeiten bedeutet und welcher Wert sich daraus für die Gesellschaft ergibt. Trotz alledem ist davon auszugehen, dass die Verwendung von Tieren für wissenschaftliche Zwecke auch in der heute absehbaren Zukunft von der überwiegenden Mehrheit der Bevölkerung mindestens kritisch eingeschätzt werden wird. Andererseits steht die biomedizinische Forschung noch einer Vielzahl von Fragestellungen und ungelösten Problemen gegenüber. Die Beantwortung dieser Fragen und die notwendigen Problemlösungen werden noch viele Jahre an Forschungsarbeit erfordern, bis die Biomedizin möglicherweise eines Tages auf tierexperimentelle Forschung wird verzichten können. 9 International Zebrafish Medaka Course IZMC 2. Alternativmethoden und das 3R-Konzept (Almut Köhler, Jürgen Weiss) Tierschutz Seit der Domestikation der Haustiere in der Phase der Jungsteinzeit vor wenigstens 10.000 Jahren hat den Menschen stets die Sorge um das Wohlergehen seiner Tiere begleitet. Letztlich hat die Wertschätzung von und der Respekt vor Tieren zum Prozess der Domestikation, zu Ackerbau und Viehhaltung geführt. Die während dieser Zeit entwickelte Art einer Tierschutzethik verpflichtete den Menschen, sich um das Wohlbefinden seiner Tiere zu kümmern, dies gleichzeitig aber im eigenen Interesse zu tun. Das daraus resultierende Prinzip lautete in etwa: „wenn wir uns um unsere Tiere kümmern, werden die Tiere auch etwas für uns tun“. Eine ganz besondere Beziehung, die man heute als Mensch-Tier-Bindung bezeichnet. Wie kann man aber Tierschutz heute definieren? Tatsächlich unterliegen die Standards eines „guten“ Tierschutzes einer ständigen Überprüfung, sie werden von Tierschutzgruppierungen, Gesetzgebern und Akademikern weltweit diskutiert und auch immer wieder angepasst oder revidiert. Im einfachsten Fall könnte man sagen, einem Tier geht es gut, solange es gesund ist und sich erfolgreich fortpflanzt. Gleichwohl erweist sich eine solche Beurteilung nur aufgrund körperlicher Merkmale als zu begrenzt. Ein solcher Aspekt ist, dass einerseits genetische Faktoren und Umweltgegebenheiten durchaus die erwünschten physischen Ziele für ein Tier gewährleisten können, während andererseits sein mentaler Status beeinträchtigt ist. So könnte zum Beispiel der Champion einer Hundezucht einen hervorragenden Körperbau haben und absolut gesund sein, sich aber in seiner häuslichen Umgebung ausgesprochen ängstlich verhalten. Ein weiteres Problem ist, dass die Interpretation einiger physiologischer Parameter, wie z.B. Herzfrequenz oder die Konzentration des Plasmakortisols, schwierig ist, weil sie sowohl infolge positiver wie auch negativer Erfahrungen erhöht sein können. Auslöser kann die Anwesenheit eines Zuchtpartners des jeweils anderen Geschlechtes einerseits oder aber die Anwesenheit eines Fressfeindes andererseits sein. Dies legt nahe, dass der Komplex Tierschutz nicht nur den Zustand des Körpers eines Tieres sondern auch dessen Gefühlszustand einschließen muss. In heutiger Zeit dürften die meisten Menschen der Auffassung zustimmen, dass Tiere Gefühle (z.B. Furcht, Missmut) haben. Manche vertreten sogar die Auffassung, dass Tierschutz sich ausschließlich auf die Gefühle eines Tieres bezieht und dass dieses Gefühlsleben sich entwickelt hat, um die wichtigsten Bedürfnisse eines Tieres zu befriedigen. Daraus folgt, wenn ein Tier sich wohl fühlt, geht es ihm auch gut. Infolgedessen bedient sich die gefühlsbasierte Tierschutzforschung typischerweise der Messung von Verhaltensparametern. So z.B. die Bereitschaft eines Tieres, “zu arbeiten”, indem es eine schwere Tür öffnen soll, oder aber Verhaltensmuster der Furcht oder Frustration. Diese Art der Forschung hat zu der Erkenntnis geführt, dass Tiere fundamentale Verhaltensbedürfnisse haben, deren Befriedigung ihnen aus Gründen der Humanität ermöglicht werden muss. 10 International Zebrafish Medaka Course IZMC Ein weiterer Aspekt des Wohlbefindens, im engen Zusammenhang mit der gefühlsbasierten Herangehensweise, ist die Annahme, dass es Tieren am besten geht, wenn sie entsprechend ihrer angeborenen Eigenschaften leben können und ihr volles Verhaltensspektrum ausleben können. Vor diesem Hintergrund wären konsequenterweise auch körperliche Empfindungen wie z.B. Kälte oder mentale Empfindungen wie z.B. die Furcht vor Fressfeinden natürlicher Teil des Befindens eines Tieres. Zusammenfassend ist festzustellen, dass das Wohlbefinden eines Tieres den Zustand seines Körpers wie auch seiner Gefühle umfasst, aber auch das Ausmaß, in dem seine Bedürfnisse (genetische Merkmale manifestieren sich in Rasse und Temperament) befriedigt werden. Gleichwohl ist anzuerkennen, dass die verschiedenen Aspekte des Wohlbefindens mitunter in Konflikt geraten und sich daraus praktische und ethische Herausforderungen ergeben. Der Tierschutzgedanke, insbesondere in Bezug auf das Tierexperiment, gewann in der öffentlichen Diskussion in Großbritannien schon im 19. Jhdt. zunehmend an Bedeutung. Die von Frances Power Cobbes 1875 gegründete “Society for the Protection of Animals Liable to Vivisection (SPALV)” war weltweit die erste Organisation gegen Tierversuche. Diese Gründung ergab sich, weil immer mehr Menschen gegen den Einsatz der ständig steigenden Anzahl von für Forschungszwecke eingesetzten Tieren protestierten. Claude Berdard (1813-1878), ein bedeutender Physiologe und Tierexperimentator, wurde zum ersten Zielobjekt von Tierschutzaktivisten. Seit dieser Zeit haben sich zwei grundsätzlich verschiedene Auffassungen von Tierschutz in den westlichen Gesellschaften entwickelt. So kämpfen auf der einen Seite sogenannte Tierschutzaktivisten grundsätzlich gegen Tierexperimente und nehmen für sich allein in Anspruch, den Tierschutzgedanken zu vertreten. Andererseits ist tierexperimentelles Arbeiten bis ins Detail gesetzlich geregelt. Tierexperimentell arbeitende Wissenschaftler sind verpflichtet, alle gesetzlichen Bestimmungen einzuhalten, alle Aspekte des Tierschutzes zu beachten und die Konzepte der 3R wie auch der sog. „Five Freedoms“ zu berücksichtigen. In Deutschland muss jede Einrichtung, in der tierexperimentell gearbeitet wird, einen (bei Bedarf mehrere) Tierschutzbeauftragte berufen, die die Wissenschaftler beraten und ihre Arbeit mit den Tieren überwachen. Die Direktive 2010/63 EU bestimmt in Bezug auf den Tierschutz im wissenschaftlichen Kontext, dass für wissenschaftliche Zwecke eingesetzte Tiere die erforderliche Pflege und Versorgung erhalten müssen. Alle Personen, die mit den Tieren Umgang haben, sollten unter Anleitung einer Aufsichtsperson ein geeignetes Training erhalten und Erfahrung sammeln. Die Tiere müssen in Käfigen geeigneter Größe und mit tierartgerechter Ausgestaltung gehalten werden. Wann immer möglich, sollten die Tiere in Gruppen gehalten werden 6 . Es sollten Techniken der Haltungsanreicherung eingesetzt werden, um die Tiere zu physischer Aktivität, Bewegung, Erkundung und kognitiven Aktivitäten anzuregen 7 . Eingesetzte Tötungsmethoden müssen gewährleisten, dass Schmerzen, Leiden und Distress der Tiere, soweit möglich, 6 7 Dies gilt ausdrücklich nicht z.B. für die Haltung männlicher Mäuse, die zuvor verpaart worden waren Stellt bei der Haltung von Zebrafisch und Medaka eine besondere Herausforderung dar 11 International Zebrafish Medaka Course IZMC vermieden werden. Tiere sollten nur von Personen getötet werden, die über die nötigen fachlichen Voraussetzungen dazu verfügen. Das Konzept der 3 R und der “Five Freedoms” Die Directive 2010/63/EU des Europäischen Parlamentes und des Rates, wie auch die meisten nationalen Gesetze in Europa geben vor, dass die 3 R bei der Planung und Durchführung von Tierversuchen berücksichtigt werden müssen. Die 3R stehen für die englischen Begriffe Reduction, Refinement und Replacement. Das Konzept wurde von William Russel, einem Zoologen, Psychologen und klassischem Gelehrten und dem Mikrobiologen Rex Birch entwickelt. Im Jahr 1954 erhielten Russel und Birch von der englischen „Universities Federation of Animal Welfare (UFAW)“ den Auftrag, eine systematische Untersuchung zur Ethik tierexperimentellen Arbeitens anzufertigen. 1956 überreichten sie der UFAW einen umfassenden Bericht, im Jahr 1959 schließlich wurde das 3R–Konzept veröffentlicht 8. Wie kann nun das Konzept der 3R in der Praxis umgesetzt werden? „Reduction“, also eigentlich Reduzierung der Zahl der eingesetzten Versuchstiere, lässt sich in vielen Fällen durch sorgfältige Planung der Experimente wie auch der statistisch berechneten Fallzahlen erreichen. Zum „Refinement“ können vielfältige Maßnahmen beitragen: z.B. besonders geeignete Analgesie- und Anästhesieverfahren, die Verbesserung der allgemeinen Vorgehensweise wie auch die Entwicklung neuer weniger oder nichtinvasiver Methoden. „Replacement“ ließe sich verhältnismäßig einfach erreichen im Bereich gesetzlich vorgeschriebener Verfahren. So schreiben zum Beispiel international geltende Richtlinien den sog. LD50-Test für die Ermittlung der akuten Toxizität einer neuen Substanz vor. Dieser Test steht in der Kritik, insbesondere weil er sehr große Tierzahlen erfordert und zweifellos mit erheblichen Belastungen für die dabei eingesetzten Tiere verbunden ist. Es sollte ernsthaft geprüft werden, ob der LD50Test – zumindest in einigen Bereichen – nicht durch alternative Verfahren ersetzt werden und auf diese Weise die Zahl eingesetzter Tiere reduziert werden kann. Das Konzept der sog. “Five Freedoms”9 definiert fünf Aspekte des Schutzes von Tieren unter menschlicher Obhut. Obwohl dieses Konzept ursprünglich vor allem für den Schutz landwirtschaftlich genutzter Tiere entwickelt worden ist, lässt es sich bis zu einem gewissen Grad auch auf Haltung und Einsatz von Versuchstieren anwenden. Die “Five freedoms” fordern: ∗ Sicherheit vor Hunger und Durst durch ständigen Zugang zu frischem Wasser und Futter zur Gewährleistung von Gesundheit und Körperkraft ∗ Bereitstellung geeigneter Haltungsbedingungen einschließlich eines Unterstandes und eines tierartgerechten Ruhebereiches ∗ Vorsorge oder schnelle Diagnose im Falle von Verletzungen oder Krankheit ∗ Bereitstellung ausreichend großer und tierartgerechter Haltungseinrichtungen sowie der notwendigen Gruppenhaltung von Tieren ∗ Vermeidung von Angst- und Stressbedingungen für die betroffenen Tiere 8 9 http://altweb.jhsph.edu/pubs/books/humane_exp/het-toc http://webarchive.nationalarchives.gov.uk/20121007104210/http:/www.fawc.org.uk/freedoms.htm 12 International Zebrafish Medaka Course IZMC Tierexperimentelles Arbeiten unter strikter Beachtung der 3R und der „Five Freedoms“ stellt nicht nur eine ethische, sondern auch eine wissenschaftliche Erfordernis dar. So wird man von Versuchstieren, die wegen ungeeigneter Haltungsbedingungen oder infolge der Anwendung belastender experimenteller Methoden i.d.R. keine reproduzierbaren Versuchsergebnisse erhalten können. Alternativmethoden Tierversuche stellen einen besonders problematischen Aspekt in den Mensch-TierBeziehungen dar. Aus diesem Grund gibt es in den westlichen Gesellschaften die zunehmende Tendenz, Tierexperimente durch Alternativmethoden 10 zu ersetzen. Häufig angeführte Alternativmethoden sind die In vitro Zellkulturtechniken. Bei in vitro Verfahren werden üblicherweise Zellen oder biologische Moleküle außerhalb ihrer normalen biologischen Umgebung untersucht. So werden z.B. Proteine in bestimmten Lösungen oder Zellen in einem künstlichen Kulturmedium untersucht. In vitro Untersuchungen sind z.B. die Isolierung, Wachstum und Identifizierung von Mikroorganismen oder von Zellen, die aus vielzelligen Organismen (Zell- oder Gewebekultur) gewonnen wurden, subzelluläre Komponenten (z.B. Mitochondrien oder Ribosomen), zelluläre oder subzelluläre Extrakte (z.B. Weizenkeime oder Retikulozytenextrakte), aufgereinigte Moleküle (Proteine, DNA, RNA) und Pyrogenitätstests. Der wichtigste Vorteil von in vitro Verfahren ist einerseits die Möglichkeit der Reduktion der Komplexität des untersuchten Systems, so dass sich die Wissenschaftler auf eine überschaubare Anzahl von Komponenten konzentrieren können. Die größte Schwierigkeit bei in vitro Verfahren andererseits ist die Transformation und Einordnung der Ergebnisse in die Biologie eines vollständigen Systems oder Organismus mit seinen vielfach interagierenden Bestandteilen. Wissenschaftler, die mit in vitro Verfahren arbeiten, müssen sehr darauf bedacht sein, die Bedeutung ihrer Ergebnisse nicht überzubewerten, was dann unter Umständen zu falschen Rückschlüssen auf die Bedeutung der Ergebnisse für die Biologie des Organismus und seiner Systeme führen kann. Gleichwohl dürften bei den meisten biomedizinischen Fragestellungen nur die anfänglichen experimentellen Phasen mit in vitro Verfahren bearbeitet werden können, so z.B. die Testung des Effektes eines Toxins auf verschiedene Zelltypen. Eine zuverlässige Aussage über die Wirkung des Toxins auf den Gesamtorganismus erfordert zwingend ein in vivo Verfahren. Insgesamt werden Alternativmethoden die in vivo Verfahren vermutlich niemals vollständig ersetzen können, wohl aber können sie diese ergänzen und zur Reduktion von Versuchstierzahlen beitragen. Die „Zentralstelle zur Erfassung und Bewertung von Ersatz- und Ergänzungsmethoden (ZEBET)“ 11 am „Bundesinstitut für Risikobewertung (BfR)“ in Berlin wie auch des „European Center for Validation of Alternative Methods (ECVAM)“ 12 in Ispra (Italien) 10 http://www.bfr.bund.de/de/center_for_alternatives_to_animal_testing__caat_-4296.html http://www.bfr.bund.de/de/zebet-1433.html 12 http://ihcp.jrc.ec.europa.eu/our_labs/eurl-ecvam 11 13 International Zebrafish Medaka Course IZMC haben die Aufgabe, Alternativmethoden zu bewerten und im Eignungsfall ihre Verbreitung zu fördern. Weitere Informationen zum Thema lassen sich im Internet finden, z.B. unter: EURL ECVAM Search Guide (http://bookshop.europa.eu/de/the-eurl-ecvam-searchguide-pbLBN124391/), EURL-Data Pool (http://www.eurl-pesticides-test.eu/), Medline (https://www.dimdi.de/static/de/db/dbinfo/me66.htm), PubMed (http://www.ncbi.nlm.nih.gov/pubmed), Go3Rs (http://www.gopubmed.org/web/go3r/) 2.1 Schmerzen, Leiden und Schäden bei Fischen (Almut Köhler) Das deutsche Tierschutzgesetz und die EU-Direktive 2010/63/EU für die Verwendung von Tieren für wissenschaftliche Zwecke verlangen, dass Schmerzen, Leiden oder Schäden für Tiere minimiert werden müssen. Alle Personen, die mit den Versuchstieren umgehen, müssen Anzeichen für Schmerzen, Leiden oder Schäden kennen und Kenntnisse über die Möglichkeiten zur Reduktion haben. Neben den rechtlichen Aspekten ist es auch aus Versuchsgründen sinnvoll, Schmerzen, Leiden oder Schäden soweit möglich zu reduzieren. Physiologische und psychologische Reaktionen durch Schmerz können Versuchsergebnisse vielfältig beeinflussen und erhöhen die Varianz in den Ergebnissen, was die Interpretation schwierig macht. Das Feststellen von Schmerzen, Leiden oder Schäden bei Fischen gestaltet sich schwierig, wobei oft auch noch die die Fähigkeit zur Schmerzempfindung bei Fischen diskutiert wird. Der schwierigste Aspekt dabei ist die Definition von Schmerz und wie diese auf Tiere angewendet werden kann. Schmerz ist nicht nur das Ergebnis einer Aktivierung von Nozizeptoren, welche eine Reizleitung auslösen, die in Rückenmark und Stammhirn verarbeitet wird. Er beinhaltet auch die Modulation dieser Reize auf diesen Ebenen durch Integration von verstärkenden oder hemmenden Signalen. Bis heute ist dieser Prozess nicht vollständig verstanden. Man weiß aber von Menschen, dass der gleiche Stimulus sehr unterschiedlich schmerzhafte Empfindungen in Abhängigkeit von individuellen Umständen hervorrufen kann. Zusätzlich wird die Nozizeption auch in höheren Gehirnbereichen bewertet und kann zu unterschiedlicher Schmerzwahrnehmung führen je nach Individuum und dessen früheren Erfahrungen. So kann der gleiche Stimulus für eine Person schmerzhaft sein, für eine andere Person dagegen nicht. Der Unterschied zwischen Nozizeption und Schmerz wird deutlich bei anästhesierten Personen: die Nozizeptoren werden durch chirurgische Maßnahmen immer noch aktiviert, aber es erfolgt keine Schmerzwahrnehmung. Bewusstsein ist damit eine Grundvoraussetzung für Schmerzwahrnehmung. 14 International Zebrafish Medaka Course IZMC Um Schmerz bei Tieren zu messen, müssen mehrere Kriterien erfüllt sein. Anatomische Strukturen und physiologische Prozesse sollten sich ähneln. Das Auftreten von Vermeidungsverhalten nach dem Anwenden eines schmerzhaften Stimulus und die Wirksamkeit von Analgetika in der Reduktion dieses Vermeidungsverhaltens sind weitere Anzeichen für Schmerzwahrnehmung. Aufgrund der großen Vielfalt an Fischarten im Vergleich zu Säugetieren und der große evolutionäre Abstand zwischen Fischen und Säugern ist die Datenlage in der Literatur hinsichtlich der Interpretation von Versuchsergebnissen von unterschiedlichen Fischspezies kritisch. Viele Versuche werden mit Salmoniden durchgeführt und die daraus gewonnenen Daten werden ohne wissenschaftlichen Nachweis auf andere Spezies extrapoliert. Zusätzlich führt der große evolutionäre Abstand zwischen Fischen und Säugern auch zu vielen physiologischen Unterschieden, wodurch eine Übertragung von menschlichen Erfahrungen auf die Situation der Fische schwierig ist. Schmerz wird durch die Stimulierung von freien Nervenendigungen eines Nozizeptors ausgelöst. Dieses Signal wird überwiegend mittels A𝛅𝛅- (schnell) und C- (langsam) Fasern zum Dorsalhorn des Rückenmarks weitergeleitet. Dort wird es moduliert und zum Stammhirn und höheren Gehirnregionen wie dem Cortex weitergeleitet. In den unterschiedlichen Regionen des Säuger-Cortex wird das Signal einerseits interpretiert nach Qualität, Lokalisation und Intensität. Andererseits erfolgt eine emotionale Bewertung, hauptsächlich durch die Signale von den C-Fasern. Im Stammhirn werden schnelle Reflexantworten aktiviert. Diese Reaktionen finden auch noch statt, wenn Personen ohne Funktion des Cortex sind. Schmerzempfindung als emotionales Erlebnis dagegen scheint vom Bewusstsein abhängig zu sein. Mechanorezeptoren und verschiedene Nozizeptor-Typen wurden in Fischen identifiziert, allerdings unterscheiden sie sich in Zusammensetzung und Lokalisation je nach Spezies. Hinsichtlich der Signalweiterleitung wurden nur Knochenfische näher untersucht, während für Knorpelfische fast keine Daten vorliegen. In Knochenfischen wird das Signal im Hirnstamm verarbeitet, und es existieren nur wenige C-Fasern. Höhere Gehirnregionen, die mit dem Cortex der Säuger vergleichbar sind, wurden bisher nicht identifiziert. Homologe Strukturen zum limbischen System, dem emotionalen Zentrum im Säuger-Gehirn, sind auf Grundlage der Ähnlichkeit von Neurotransmitter-Verteilungen und Feuerungsmustern von Neuronen möglicherweise vorhanden. Allerdings scheinen diese mit anderen Gehirnregionen verknüpft zu sein als beim Säuger. Da Schmerzwahrnehmung in Säugern vom Bewusstsein abhängig ist, wird auch das Bewusstsein bei Tieren wie Fischen immer wieder diskutiert. Einige Fische zeigen die Fähigkeit zur räumlichen Orientierung und können individuelle Artgenossen erkennen. Daher scheint ein primäres Bewusstsein vorhanden. Einige Spezies entwickeln bei bestimmten Versuchsaufbauten ein Vermeidungsverhalten, andere nicht. Das Vermeidungsverhalten ist abhängig vom Experiment und der untersuchten Spezies. Auf diesen Ergebnissen beruht die Annahme, dass eine Art Selbst-Bewusstsein existieren kann. Allerdings wurden die klassischen Verhaltenstests darauf bisher nicht erfolgreich auf Fische übertragen. L. Sneddon hat mittels Injektion von reizenden Substanzen in die Lippen von Regenbogenforellen die Schmerzwahrnehmung untersucht. Während einige Verhaltensparameter unverändert blieben, wurden teilweise komplexe Verhaltensmuster zusätzlich entwickelt wie das Schaukeln oder das Reiben der Lippen 15 International Zebrafish Medaka Course IZMC an der Aquariumswand. Diese Verhaltensweisen konnte durch Gabe von Morphin vor dem Stimulus reduziert werden. Das Ergebnis der Studie wird aber nicht von allen Seiten als Nachweis für Schmerzen bei Fischen anerkannt, da die verabreichte Morphindosis dabei 15-30x höher war als die letale Dosis bei Menschen und die Verhaltensmuster nur selten bei den behandelten Tieren beobachtet werden konnten. Zusammenfassend kann man sicherlich davon ausgehen, dass Nozizeption in Fischen vorhanden ist und das Signal zum Hirnstamm weitergeleitet wird. Ob es nachfolgend durch das Tier als „Schmerz“ interpretiert wird, ist unklar. Für jede Annahme gibt es Hinweise und Ablehnungsgründe. Die Entwicklung eines Schmerzempfindens kann als evolutionärer Vorteil verstanden werden, da es die Überlebenswahrscheinlichkeit eines Tieres erhöht. Außerdem können sich funktionell ähnliche Systeme durchaus morphologisch unterschiedlich entwickeln. Daher können wir ein Schmerzempfinden bei Fischen nicht ausschließen. Auf alle Fälle sollten Fische vorsichtig behandelt werden, da jeder Stress das Experiment beeinflussen kann, unabhängig davon, ob das Tier Schmerz in gleichem Maß wie der Mensch wahrnimmt. Daher sollten Versuche bestmöglich vorbereitet werden und etwaige Schwierigkeiten vorhergesehen werden. Der Forscher sollte auf solche Situationen vorbereitet sein. Wenn mitten im Experiment die Notwendigkeit eines Instrumentes oder einer Substanz auffällt, sollten diese unmittelbar zur Verfügung stehen. Das Ausmaß der Belastung des Tieres durch das Experiment sollte berücksichtigt werden. Von der EU-Direktive werden 4 Kategorien an Belastung angegeben und für jede Kategorie werden im Anhang VIII der Direktive Beispiele genannt. Diese Beispiele stellen eine Grundlage für die Beurteilung der Belastung dar, aber jedes Experiment muss kritisch hinterfragt werden in Bezug auf die gesamte Belastung des Tieres. Die Kosten-Nutzen-Analyse der ethischen Bewertung zwischen Belastung für das Tier und Nutzen durch das Ergebnis sollte sorgfältig geführt werden. Wenn sich die Balance zwischen den beiden Kriterien hin zu einer stärkeren Bedeutung der Belastung des Tieres verschiebt, ohne dass ein akzeptabler Erkenntnisgewinn dadurch erreicht wird, sollte das Experiment beendet werden. Dieses Vorgehen wird durch das Prinzip der „humanen Endpunkte“ beschrieben. Grundsätzlich gilt die Aussage: „So früh wie möglich (die Belastung des Tieres stoppen), so spät wie nötig (um den Erkenntnisgewinn zu erlangen, der die Belastung des Tieres rechtfertigt). Werden Experimente zu früh abgebrochen und dadurch der nötige Erkenntnisgewinn nicht erreicht, werden mehr Tiere benötigt oder eine Belastung der Tiere ohne nachfolgenden Nutzen. Die humanen Endpunkte müssen möglichst objektiv vor dem Versuch definiert werden. Daher müssen auch die Parameter und wie sie beurteilt werden, vorher festgelegt werden. Sogenannte Score Sheets können eine wertvolle Hilfe darstellen, um die Bewertung so objektiv wie möglich durchzuführen und die Behandlung der Tiere innerhalb des Versuchs zu vereinheitlichen. In Fischen ist die Möglichkeit, Schmerzen, Leiden oder Schäden feststellen zu können, begrenzt. Es ist schwierig zwischen Auswirkungen des Versuchs und „normaler“ Krankheit, welche zufällig gleichzeitig auftritt, zu unterscheiden. Es gibt Verhaltensparameter wie Schwimmverhalten, aber auch physiologische Auffälligkeiten, die aufzeigen können, dass ein Fisch nicht gesund ist. Obwohl dieser UrsacheWirkungs-Zusammenhang nicht immer klar ist, sollte Humanität immer Grundlage der Handlung sein. 16 International Zebrafish Medaka Course IZMC 3. Gesetzliche Regelung und die Bewilligungspraxis von Tierversuchen (Almut Köhler) 3.1 Tierschutzrechtliche Regelung für tierexperimentelles Arbeiten in Deutschland 3.1.1 Der rechtliche Rahmen Am 9. November 2010 trat die Richtlinie 2010/63/EU 13 in Kraft, die von den Mitgliedern der Europäischen Union in nationales Recht umzusetzen war. In Deutschland geschah dies mit dem Dritten Gesetz zur Änderung des Tierschutzgesetzes (TierSchG) in der Bekanntmachung vom 04.Juli 2013 (Drittes Gesetz zur Änderung des Tierschutzgesetzes (TierSchG), BGBL I S. 2182 (Nr. 36)) 14 . Das Tierschutzgesetz umfasst insgesamt zwölf Abschnitte: im § 4 (3) des Dritten Abschnittes wird die Tötung von Tieren für wissenschaftliche Zwecke geregelt, die §§ 7 – 9 des fünften Abschnittes befassen sich mit Tierversuchen und der § 10 des sechsten Abschnittes mit dem Tierschutzbeauftragten (TierSchB). Mit der „Verordnung zur Umsetzung der Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere“ 15 (Tierschutzversuchsverordnung) wurden zudem die Rahmenbedingungen für die Anwendung des novellierten TierSchG definiert. Die Verordnung regelt in 48 §§ in 4 Abschnitten nebst Unterabschnitten die eigentliche Umsetzung des TierSchG. Für die Meldung von Versuchstieren existiert darüber hinaus noch die VersuchstierMeldeverordnung (VersTierMeldV). Aktuelle Versionen der relevanten Gesetzestexte findet man immer unter: Gesetz TierSchG TierSchVersV VersTierMeldV Quelle http://www.gesetze-im-internet.de/tierschg/ http://www.gesetze-im-internet.de/tierschversv/index.html http://www.gesetze-im-internet.de/verstiermeldv_2013/index.html In der Folge sind die wichtigsten tierschutzrechtlichen Vorschriften und die Antragsformulare für den Kreis Karlsruhe aufgeführt, die für das Halten, die Zucht und das Arbeiten mit Tieren zu wissenschaftlichen Zwecken zu berücksichtigen sind. Es ist aber davon auszugehen, dass es in den kommenden Monaten noch zu Änderungen in der Anwendung des neuen Tierschutzrechtes kommen wird. 13 DIRECTIVE 2010/63/EU OF THE EUROPEAN PARLIAMENT AND OF THE COUNCIL of 22 September 2010 on the protection of animals used for scientific purposes (izmc.ezrc.kit.edu/documents/<DIR_2010-63-EU_en_de> ) 14 Drittes Gesetz zur Änderung des Tierschutzgesetzes (TierSchG), BGBL I S. 2182 (Nr. 36) (izmc.ezrc.kit.edu/documents/<Aenderung_TierSchG> ) 15 Verordnung zur Umsetzung der Richtlinie 2010/63/EU des Europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere (izmc.ezrc.kit.edu/documents/<tierschutzversuchsvo> ) 17 International Zebrafish Medaka Course IZMC 3.1.2 Pflichten der Einrichtung Der Träger/Leiter einer Einrichtung, in der Wirbeltiere oder Kopffüßer gehalten werden, die zur Verwendung in Tierversuchen bestimmt sind oder deren Gewebe oder Organe dazu bestimmt sind, zu wissenschaftlichen Zwecken verwendet zu werden, hat die Einhaltung der im TierSchG und der TierSchVersV enthaltenen Vorschriften jederzeit sicherzustellen. Ein Versuchstier-erfahrener Tierarzt sollte bei Bedarf verfügbar sein. Derartige Einrichtungen sind verpflichtet, vor Aufnahme der Tätigkeit einen oder mehrere Tierschutzbeauftrage (TierSchB) zu bestellen und die Bestellung der zuständigen Behörde anzuzeigen. Die Voraussetzungen für die Bestellung wie auch die Tätigkeit der TierSchB sind im § 5 TierSchVersV beschrieben. Die Einrichtung ist zudem verpflichtet, einen Tierschutzausschuss einzurichten, dessen Zusammensetzung und Aufgaben im § 6 TierSchVersV definiert sind. 3.1.3 Verwaltungsverfahren In Deutschland wird die Erlaubnis für die Verwendung von Tieren im Rahmen von unterschiedlichen Verwaltungsverfahren erteilt. Abhängig vom primären Zweck der Verwendung der Tiere, muss demnach ein Vorhaben einer der folgenden 3 Kategorien zugeordnet und entsprechend beantragt und genehmigt werden (siehe auch Tabelle 1): 1. Genehmigungspflichtige Versuchsvorhaben („Antrag auf Genehmigung eines Versuchsvorhabens an Tieren“) 2. Anzeigepflichtige Versuchsvorhaben („Anzeige von Eingriffen und Behandlungen an Tieren“) 3. Tötung zu wissenschaftlichen Zwecken (interne Anmeldung der Tötung) 3.1.4 Genehmigungspflichtige Versuchsvorhaben Wer plant, lebende Tiere für eine wissenschaftliche Fragestellung einzusetzen, sollte sich frühzeitig mit dem für ihn zuständigen TierSchB in Verbindung setzen. Dabei sollte das geplante Versuchsvorhaben besprochen und geprüft werden, ob die Voraussetzungen für seine Durchführung in der betreffenden Einrichtung gegeben sind. Im Anschluss daran sollte der Antragsteller seine Versuchsplanung mit einem fachlich versierten Biometriker durchgehen, um sich von diesem, insbesondere hinsichtlich der Gruppengrößen und die für die Testung der Ergebnisse einzusetzenden statistischen Verfahren, Rat einzuholen. Wenn möglich, sollte dem Antrag für die Weiterleitung an die Behörde ein kurzes Fachgutachten des Biometrikers beigefügt werden. Der Antrag sollte noch im Entwurfsstadium zur Prüfung an den TierSchB gegeben werden, so dass dieser den Antragsteller bei Bedarf entsprechend beraten kann. Dem fertigen Antrag müssen schließlich folgende Dokumente beigegeben werden: • • eine Stellungnahme des TierSchB; eine nichttechnische Projektzusammenfassung (NTP); • eine Liste der Literaturzitate; • ggf. Datenblätter für genetisch veränderte Tiere; 18 International Zebrafish Medaka Course IZMC • das “Formblatt Angaben zur biometrischen Planung” oder das Gutachten eines Statistikers; • die ausgefüllten Personenbögen der im Versuch mitarbeitenden Personen; • ein Verzeichnis der im Antrag verwendeten Abkürzungen. Es ist sicherzustellen, dass der Antrag mit sämtlichen Anlagen in sechsfacher Ausfertigung an die Behörde geht. Tabelle 1: Kategorisierung von Verfahren (Verwendung der Tiere) nach primärem Zweck und Verwaltungsverfahren 19 International Zebrafish Medaka Course IZMC Die Genehmigungsbehörde ist verpflichtet, dem Antragsteller binnen 40 Arbeitstagen ab vollständigem Eingang der Antragsunterlagen ihre Entscheidung über den Antrag mitzuteilen. Unter Nennung triftiger Gründe kann diese Frist jedoch um bis zu 15 Arbeitstage verlängert werden. Die Genehmigungsdauer für ein tierexperimentelles Versuchsvorhaben beträgt maximal 5 Jahre. Verlängerungen darüber hinaus sind nicht möglich. 3.1.5 Leiter, Stellvertreter Wer als Leiter oder Stellvertretender Leiter eines tierexperimentellen Versuchsvorhabens fungieren möchte, muss ein abgeschlossenes Hochschulstudium der Veterinärmedizin, der Medizin, der Zahnmedizin, oder der Naturwissenschaften vorweisen können. Er muss über die entsprechenden tierexperimentellen Fachkenntnisse verfügen und für mindestens 3 Jahre in einem tierexperimentellen Versuchsvorhaben mitgearbeitet haben. Alternativ können die Fachkenntnisse bzw. die dreijährige Erfahrung durch die erfolgreiche Teilnahme an einem versuchstierkundlichen Kurs gemäß FELASA C (80 h) erworben werden. 3.1.6 Mitarbeiter Alle Mitarbeiter eines geplanten Versuchsvorhabens müssen im Antrag und unter Vorlage der Personenbögen namentlich benannt werden, ihre Fachkenntnisse, falls vorhanden, müssen nachgewiesen werden. Mitarbeiter mit einem unter 3.1.4 genannten Hochschulabschluss und den notwendigen tierexperimentellen Fachkenntnissen können im Rahmen eines Versuchsvorhabens grundsätzlich selbstständig arbeiten. Mitarbeiter ohne Hochschulabschluss bedürfen für selbstständiges Arbeiten einer Ausnahmegenehmigung, für deren Beantragung u.a. die Fachkenntnisse belegt werden müssen. Die Ausnahmegenehmigung wird für die Anwendung bestimmter tierexperimenteller Techniken erteilt und ist nicht auf ein aktuelles Versuchsvorhaben beschränkt. Beim Wechsel der Einrichtung wird die Ausnahmegenehmigung jedoch unwirksam. Personen ohne Hochschulabschluss, bei denen das Arbeiten mit Versuchstieren Bestandteil ihrer Ausbildung war, wie z.B. bei Biologielaboranten und VMTAs, dürfen ohne Ausnahmegenehmigung selbstständig arbeiten. Mitarbeiter ohne Hochschulabschluss oder Ausnahmegenehmigung, die über keinen der vorgenannten Abschlüsse verfügen, dürfen grundsätzlich nur unter Aufsicht arbeiten, d.h., dass eine entsprechend erfahrene Person tatsächlich unmittelbar zugegen sein und die Aufsicht führen muss. Für das Arbeiten unter Aufsicht muss im Genehmigungsantrag unter Punkt 1.2.1 zusätzlich zur Angabe des Versuchszweckes die Option „Aus-, Fort- und Weiterbildung“ angekreuzt werden. Das Arbeiten an Tieren „unter Aufsicht“ ist innerhalb eines „normalen“ genehmigungspflichtigen Versuchsvorhabens allerdings nur möglich, soweit es sich um kleinere Eingriffe wie z.B. Blutentnahmen o.ä. handelt. Sollen schwierigere, also belastendere Eingriffe erlernt werden und/oder werden zusätzliche Tiere für die Einarbeitung benötigt, ist eine separate Anzeige zur Aus-, Fort- und Weiterbildung erforderlich. 20 International Zebrafish Medaka Course IZMC 3.1.7 Anzeigepflichtige Versuchsvorhaben In § 8a (3a) TierSchG sind die verschiedenen Rechtsgrundlagen aufgeführt, gemäß derer ein Versuchsvorhaben mit Wirbeltieren oder Kopffüßern von der Behörde als Anzeige behandelt werden kann. Zutreffendes ist unter Punkt 1.1.4 des Antragsformulares anzukreuzen. Zum Beispiel die Gewinnung von Antikörpern durch Immunisierung von Versuchstieren ist auch nach dem neuen Tierschutzrecht nur anzeigepflichtig, sofern die gewonnenen Antikörper nicht in einem weiteren Tierversuch eingesetzt werden, sondern ausschließlich labormäßig weiter verarbeitet werden. Das für die Anzeige zu verwendende Formular ist identisch mit dem Formular für einen Genehmigungsantrag. Der Anzeige muss allerdings keine nichttechnische Projektzusammenfassung (NTP) sowie ggf. kein biometrisches Gutachten beigefügt werden, sie muss auch nicht der § 15 Kommission vorgelegt werden. Versuchsvorhaben, die für die betroffenen Tiere mit erheblichen Belastungen verbunden sind, können grundsätzlich nicht als Anzeige behandelt werden, sie unterliegen der Genehmigungspflicht. Der Eingang der Anzeige muss von der Genehmigungsbehörde bestätigt werden, sobald ihr alle erforderlichen Unterlagen vorliegen. Nach 20 Arbeitstagen ab Eingang der vollständigen Anzeige bei der Behörde kann das Versuchsvorhaben begonnen werden, auch wenn die Behörde bis dahin noch keine Freigabe übermittelt hat. Die maximal mögliche Laufzeit eines anzeigepflichtigen Vorhabens beträgt 5 Jahre. Verlängerungen darüber hinaus sind nicht möglich. Die Bestimmungen des neuen Tierschutzrechtes gelten nicht für Versuchsvorhaben, die vor dem Inkrafttreten des novellierten TierSchG angezeigt oder genehmigt worden sind. Ausnahme: bei der Nachmeldung neuer Mitarbeiter für solche „Altvorhaben“ müssen bereits heute die neu eingeführten Personenbögen verwendet werden. Ab dem 01.01.2018 wird ausschließlich und ohne Einschränkung das neue Tierschutzrecht in Deutschland gelten. 3.1.8 Töten von Tieren zu wissenschaftlichen Zwecken Wie bisher schon bedürfen Tötungen von Wirbeltieren für wissenschaftliche Zwecke (ohne jegliche Vorbehandlung!) nur der sog. Internen Tötungsanmeldung. Die meisten Einrichtungen verfügen hierfür über ein eigenes Formular das vom Antragsteller auszufüllen und an den zuständigen TierSchB zu leiten ist. Dieser hat die Tötungsanmeldung zu prüfen und sicher zu stellen, dass das einzusetzende Tötungsverfahren mit der Anlage 2 der TierSchVersV vereinbar ist, dass die ausführenden Personen über die entsprechende Sachkunde gemäß Anlage 1, Abschnitt 2 verfügen und das die sonstigen Voraussetzungen für das Vorhaben gegeben sind. Bedauerlicherweise sind die in Anlage 2 der TierSchVersV aufgeführten Tötungsverfahren nicht wirklich umfassend dargestellt. So fehlt dort z.B. die Anwendung der Hypothermie bei Zebrafischen und ihren Larven. Dessen ungeachtet wird die Anwendung dieses Verfahrens vom Regierungspräsidium Karlsruhe akzeptiert. 3.1.9 Genehmigungsvorbehalt für belastete genetisch veränderte Zuchten Die Erlaubnis für die Haltung und Zucht von Versuchstieren wird von der Genehmigungsbehörde gemäß § 11 TierSchG einer Einrichtung grundsätzlich erteilt. 21 International Zebrafish Medaka Course IZMC Nach dem neuen Tierschutzrecht unterliegt jedoch die Haltung und Zucht genetisch veränderter Tierlinien einer zusätzlichen Genehmigungspflicht, wenn die Individuen dieser Linien aufgrund ihrer genetischen Veränderungen u.U. Schmerzen, Leiden oder Schäden erfahren können. Diese gesonderte Genehmigungspflicht gilt für alle durch embryonale Manipulation (Transgenese, homologe Rekombination, Enzym-mediierte Mutation, Transduktion usw.) oder durch Bestrahlung oder die Behandlung mit mutagenen Substanzen neu generierten genetisch veränderten Linien. Sie gilt ferner bei der Erzeugung neuer Linien durch Kreuzung von zwei nicht belasteten Linien, die noch nicht ausreichend charakterisiert sind, für Spontanmutationen, die gezielt weiter gezüchtet werden sollen und bei denen Belastungen erwartet werden. Die Haltung und Zucht von Linien, die aufgrund einer genetischen Veränderung belastende Tumoren entwickeln, unterliegen grundsätzlich der Genehmigungspflicht; also auch dann, wenn die Tumoren erst ab einem bestimmten Alter auftreten. Einrichtungen, die bisher schon genetisch veränderte Tiere halten, sind verpflichtet, alle bereits vorhandenen Linien im Hinblick auf ihre potentielle oder tatsächliche Belastung zu charakterisieren und – wo nötig – bei der Behörde die entsprechenden Genehmigungen für die weitere Haltung und Zucht einzuholen. 3.1.10 Verwendung von Larven Gemäß § 14 TierSchVersV gelten die Vorschriften der §§ 7 bis 9 sowie die §§ 15 bis 43 TierSchG, einschließlich der Genehmigungs- bzw. Anzeigepflicht, auch für die Durchführung von Tierversuchen, bei denen Larven von Wirbeltieren verwendet werden, soweit diese in der Lage sind, selbstständig Nahrung aufzunehmen. Diese Pflicht gilt auch bei der Verwendung von Föten von Säugetieren ab dem letzten Drittel ihrer normalen Entwicklung. Zebrafischlarven bis einschließlich Tag 5 unterliegen demzufolge nicht diesen Vorschriften. 3.1.11 Aufzeichnungspflicht Gemäß § 9 (5) TierSchG sind über Tierversuche Aufzeichnungen zu machen, in denen u.a. der Zweck des Versuchsvorhabens, die Art und Zahl der verwendeten Tiere, die Art und Durchführung des Versuchsvorhabens sowie die Namen der am Versuch beteiligten Personen enthalten sind. Die Aufzeichnungen können auf einem speziellen Formblatt vorgenommen werden oder aber in Laborbüchern, wenn diese entsprechend strukturiert und geführt sind. Leiter und stellvertretende Versuchsleiter sind verpflichtet, die Einhaltung der Aufzeichnungspflicht sicherzustellen. Die Meldung kann durch die Behörde oder den zuständigen TierSchB kontrolliert werden. Zusätzlich sollten auch alle Daten für das Projekt dem Tierhausleiter gemeldet werden, um die richtige Behandlung und die ordnungsgemäße Kontrolle des Wohlbefindens sicherzustellen. Falls ein Mitarbeiter eine Belastung des Tieres feststellt, die eine Tötung oder Behandlung des Tieres oder seine Entfernung aus dem Versuch notwendig macht, sollte die verantwortliche Person informiert werden und entsprechende Aufzeichnungen sollten darüber gemacht werden. Die Kriterien über diese Entscheidung sollten im Vorfeld des Versuchs festgelegt werden (s. Prinzip der „humanen Endpunkte“ in der Vorlesung „Schmerzen, Leiden, Schäden bei Fischen“) 22 International Zebrafish Medaka Course IZMC 3.1.12 Jährliche Versuchstiermeldung Gemäß der Versuchstiermeldeverordnung (VersTierMeldV) ist der Leiter eines Versuchsvorhabens verpflichtet, kalenderjährlich folgende Angaben zu machen: Tierspezies, Tierschutzrechtliche Zuordnung des Verfahrens, Angabe der Zahl der erstmals im Versuch verwendeten Tiere, Anteil transgener Tiere, Angabe der Zahl der erneut verwendeten Tiere, Bezugsquelle der Tiere, Angaben zum Verwendungs-zweck und der Zusammenhang mit bestimmten Erkrankungen. Üblicherweise werden diese Angaben in einer Einrichtung zum jeweiligen Jahres-ende zentral erfasst und dann an die Behörde weitergegeben. 3.1.13 Nationaler Tierschutz-Ausschuss Neben dem Tierschutz-Ausschuss der jeweiligen Einrichtung wurde im September 2015 ein nationaler Ausschuss (www.bf3r.de) nach Art 49 der EU-Direktive 2010/63/EU und § 15a TierSchG ins Leben gerufen. Dieser Ausschuss berät die lokalen Behörden und die Tierschutz-Ausschüsse der Einrichtungen bezüglich Beschaffung, Zucht, Haltung und Pflege von Vertebraten und Kopffüßern oder zu deren Verwendung zu wissenschaftlichen Zwecken. Der nationale Ausschuss erleichtert den Wissenstransfer über moderne Versuchstier-Forschung zwischen den Einrichtungen und den nationalen Ausschüssen der anderen EU-Mitgliedsstaaten. 3.1.14 Direktive 2010/63/EU Einleitung Die Direktive 2010/63/EU des Europäischen Rates zum Schutz von Tieren, die für wissenschaftliche Zwecke eingesetzt werden, ersetzt die alte Direktive 86/609/EEC16, welche rechtliche Voraussetzungen geschaffen hatte, die nationalen Rechtsgrundlagen zum Tierschutz bei Versuchstieren in der EU zu harmonisieren. Die Direktive 86/609/EEC bestand aus 27 Artikeln plus Anhang und definierte die Benutzung von Tieren auf 7 Seiten in einer sehr allgemeingültigen Form. Sie trat am 24. November 1986 in Kraft. Interessanterweise wurden im Jahr 2007 die „Empfehlungen der (jetzt) EU-Kommission für die Haltung und Pflege von Versuchstieren“ zu Anhang A (2007/526/EC) der Direktive 86/609/EEC. Die Direktive 2010/63/EU wurde am 22. September 2010 angenommen und trat am 1. Januar 2013 in Kraft. Die Direktive basiert auf dem 3R Prinzip, um Tierversuche zu ersetzen, zu reduzieren oder zu verfeinern. Die Zielsetzung ist jetzt weiter gefasst und schließt auch Säuger-Feten im letzten Drittel der Trächtigkeit und Kopffüßer ein. Sie beinhaltet die minimalen Standards für Haltung und Pflege, regelt die Verwendung von Tieren mittels einer systematischen Projekt-Evaluierung unter Berücksichtigung von Schmerzen, Leiden oder Schäden für die Tiere. Sie ordnet regelmäßige Risikobezogenen Begehungen an und erhöht die Transparenz durch Maßnahmen wie die Veröffentlichung von nicht-technischen Projektzusammen-fassungen (NTP) und retrospektive Beurteilungen. Die Entwicklung, Validierung und Anwendung von EEC = Europäische Wirtschaftsgemeinschaft, gegründet 1957 durch Belgien, Frankreich, Italien, Luxemburg, Niederlande, West-Deutschland als regionale Organisation zur wirtschaftlichen Integration einschließlich eines gemeinsamen Marktes und einer Handelsunion. 16 23 International Zebrafish Medaka Course IZMC Alternativmethoden wird durch die Einrichtung eines EU-Referenz-Labors für die Validierung von Alternativmethoden gefördert, welches von nationalen Laboren unterstützt wird. Die Mitgliedsstaaten müssen auf nationaler Ebene Alternativmethoden fördern. Die Direktive 2010/63/EU hat 47 Seiten und ist in 24 Sprachen veröffentlicht, von Bulgarisch bis Schwedisch unter. <http://eur-lex.europa.eu/legal-content/EN/TXT/?uri=CELEX:32010L0063> Die Direktive beginnt mit 56 einleitenden Punkten und besteht aus 66 Artikeln in 6 Kapiteln. Gemäß Artikel 61 der Direktive mussten die Mitgliedsstaaten die Direktive in ihre nationale Gesetzgebung implementieren und Gesetze, Verordnungen und Verwaltungsrichtlinien bis zum 10. November 2012 anpassen. Diese Maßnahmen mussten der EU-Kommission berichtet werden. Die nationalen Gesetzgeber entwickelten daher sogenannte „National Implementing Measures“ (NIM), die die Verwendung von Tieren zu wissenschaftlichen Zwecken regeln. In einigen Mitgliedsstaaten wie Italien, Österreich, Portugal und Großbritannien resultierte die Implementierung nur in 1 NIM, während in Litauen 10 und in Schweden 20 NIM notwendig waren. Ziel der Direktive Das hauptsächliche Ziel ist es, Maßnahmen zum Schutz von Versuchstieren festzulegen, besonders in der Grundlagen- und der angewandten Forschung, für die Produktion von medizinischen Produkten und auch für Tiere zu Lehrzwecken. Die Direktive schließt alle nicht-menschlichen Vertebraten sowie auch einige Invertebraten, die wahrscheinlich Schmerz empfinden können (Tintenfische, Kraken), ein Die Verwendung von nicht-menschlichen Primaten ist stark limitiert und die Verwendung von Menschenaffen (Schimpansen, Bonobos, Gorillas, Orang-Utans) ist verboten. Erlaubte Zwecke für Tierversuche: • • • • • • • Grundlagenforschung Translationale und angewandte Forschung zum Schutz, zur Verhinderung, Diagnose oder Behandlung von menschlichen oder tierischen Erkrankungen Entwicklung, Herstellung oder Prüfung der Qualität, Wirksamkeit und Sicherheit von Substanzen, Nahrungsmittels oder Futter für einen der oben genannten Gründe Schutz der Umwelt im Interesse der menschlichen oder tierischen Gesundheit Forschung zur Arterhaltung Aus-, Fort- und Weiterbildung Forensische Untersuchungen Evaluierung von Projekten mit Tierversuchen Die Verwendung von Tieren zu wissenschaftlichen Zwecken darf nur genehmigt werden, wenn keine zufriedenstellende Ersatzmethode existiert. Projekte mit Tierversuche müssen durch die zuständige Behörde überprüft werden, ob sie den gültigen rechtlichen Vorgaben entsprechen. Ist das gegeben, erteilt die Behörde die Erlaubnis. 24 International Zebrafish Medaka Course IZMC Die Überprüfung basiert auf einem schriftlichen Antrag, der darlegt dass die Verwendung von Tieren gerechtfertigt ist und die erwarteten Vorteile gegen den Schaden für das Tier abwägt. Die Anzahl der in einem Projekt verwendeten Tiere muss so weit wie möglich minimiert werden, ohne die Ziele des Projektes zu gefährden. Die Haltungsbedingungen und angewendeten Methoden müssen unnötige Schmerzen, Leiden oder Schäden für das Tier reduzieren. Experimente dürfen nicht begonnen werden, bevor der Antragsteller die Genehmigung durch die Behörde erhalten hat. Tierschutz Die Direktive enthält darüber hinaus Betrachtungen zum Tierschutz: Tiere, die zu wissenschaftlichen Zwecken verwendet werden, müssen angemessene Pflege und Behandlung erfahren. Alle Personen, die mit den Tieren in Kontakt kommen, müssen entsprechend durch einen Betreuer ausgebildet sein. Tiere müssen in Käfigen ausreichender Größe in einer artgerechten Umgebung gehalten werden. Environmental Enrichment sollte eingesetzt werden, um physische Aktivitäten, Bewegung, Explorationsverhalten und kognitive Aktivitäten zu stimulieren. Anhang III der Direktive gibt detaillierte Informationen über Käfiggrößen, Besatzdichten und andere Haltungsparameter für eine große Anzahl an Arten. Sogar Zebrafinken werden dort erwähnt, aber nicht Zebrabärblinge oder Medakas. Tötungsmethoden für Versuchstiere müssen Schmerzen, Leiden oder Schäden für die Tiere limitieren – gemäß der Direktive. Tiere dürfen nur von Personen mit der notwendigen Sachkunde getötet werden. Tabelle 3 des Anhangs IV der Direktive listet die folgenden Tötungsmethoden als akzeptabel für Fische auf: Überdosis eines Betäubungsmittels, Gehirnerschütterung, Betäubungsschlag, elektrische Betäubung. Die Überdosis eines Betäubungsmittels würde die MS-222-Priozedur einschließen, aber die anderen Methoden sind nicht für die Tötung von Zebrabärblingen oder Medakas geeignet. Hypothermie wird nicht erwähnt. Prozeduren Gemäß Direktive sind nur solche Verfahren statthaft, die im Rahmen eines Projektes genehmigt wurden. Diese Prozeduren werden nach ihrem Schweregrad gemäß Anhang VIII der Direktive eingestuft. Sie reichen von Nicht-Wiederherstellung der Lebensfunktionen über gering und mittelgradig bis schwer. Prozeduren müssen unter Betäubung, Analgesie oder anderen geeigneten Maßnahmen stattfinden. Es gibt Ausnahmen, wenn eine Betäubung als belastender angesehen wird als die Prozedur selbst oder falls sie nicht anwendbar ist. Prozeduren sollen zum Tod möglichst weniger Tiere führen und Dauer und Grad des Leidens müssen minimiert werden. Das Leben des Tieres muss so gut es geht geschützt werden. Die Wiederverwendung von Tieren ist eine Möglichkeit, die Anzahl von Versuchstieren zu reduzieren. Allerdings sollten vor der Wiederverwendung die Schwere der summierten Belastungen, die Gesundheit des Tieres und die Meinung eines Tierarztes berücksichtigt werden. Überlebende Tiere sollten angemessene Pflege und Unterbringung gemäß Anhang III erfahren. Genehmigung Züchter, Verkäufer und Benutzer sowie ihre Einrichtungen bedürfen der Genehmigung durch die zuständige Behörde und müssen bei ihr registriert werden. Genehmigte Einrichtungen müssen gemäß den gehaltenen Tierarten und den experimentellen Verfahren (sofern sie dort angewendet werden) eingerichtet sein. Einrichtungen müssen 25 International Zebrafish Medaka Course IZMC Buch führen, in dem alle Informationen zu den Tieren, ihre Herkunft und ihr Zweck vermerkt werden. Die Aufzeichnungen sind 5 Jahre aufzubewahren und müssen der Öffentlichkeit zur Verfügung gestellt werden. Alle Hunde, Katzen und nichtmenschlichen Primaten müssen individuell markiert sein und es muss zu jedem Individuum ein protokollarischer Lebenslauf geführt werden. Dieser Lebenslauf muss relevante Daten enthalten über Reproduktion, medizinische Behandlungen und Sozialverhalten des einzelnen Tieres und über die Projekte, in denen es eingesetzt wird. Begehungen Zuständige Behörden müssen regelmäßige Kontrollbegehungen aller Züchter, Verkäufer und Halter sowie ihrer Einrichtungen durchführen, um die Einhaltung der Vorschriften der Direktive zu kontrollieren. Die Häufigkeit der Begehungen ist abhängig vom individuellen Risiko der Einrichtung. Mindestens 1/3 der Einrichtungen muss jährlich begangen werden. Ein entsprechender Anteil der Begehungen hat unangekündigt zu erfolgen. Züchter, Verkäufer und Halter von nicht-menschlichen Primaten müssen jährlich kontrolliert werden. Schlussbemerkungen Die Direktive 2010/63/EU ersetzt die Direktive 86/609/EEC und steht im Kontext mit der EU-Politik, Tierversuche soweit wie möglich zu limitieren und zu eliminieren, wenn sie nicht unbedingt nötig sind. Tierversuche für die Herstellung von Kosmetik, die nicht in dieser Direktive erfasst werden, sind daher seit 2009 vollständig verboten (Verordnung (EC) Nr. 1223/2009). 26 International Zebrafish Medaka Course IZMC 3.2 Rechtliche Aspekte zum Versand von Fischen, Fischeiern und SpermaProben, die für wissenschaftliche Untersuchungen bestimmt sind (Jana Maier, Robert Geisler) Der Versand von Fischen, Eiern und Sperma von Fischen mit einem gewerblichen Transportunternehmen unterliegt einer Reihe von Vorschriften und Gesetzen. Ziel ist die Vermeidung und Eingrenzung von übertragbaren Krankheiten, der Schutz lebender Tiere beim Transport und die Vermeidung einer ungewollten Freisetzung gentechnisch veränderter Organismen in die Natur. Die Grundlagen werden durch die folgenden EURichtlinien und Verordnungen zur Durchführung der Richtlinien sowie entsprechende nationale Gesetze gelegt: Tierseuchenschutz: - Richtlinie 2006/88/EG des Rates vom 24. Oktober 2006 mit Gesundheits- und Hygienevorschriften für Tiere in Aquakultur und Aquakulturerzeugnisse und zur Verhütung und Bekämpfung bestimmter Wassertierkrankheiten 17 - Verordnung (EG) Nr. 1251/2008 der Kommission vom 12. Dezember 2008 zur Durchführung der Richtlinie 2006/88/EG des Rates hinsichtlich der Bedingungen und Bescheinigungsvorschriften für das Inverkehrbringen und die Einfuhr in die Gemeinschaft von Tieren in Aquakultur und Aquakulturerzeugnissen sowie zur Festlegung einer Liste von Überträgerarten 18 - Binnenmarkt-Tierseuchenschutzverordnung – BmTierSSchV – Verordnung über das innergemeinschaftliche Verbringen sowie die Einfuhr und Durchfuhr von Tieren und Waren 19 Biologische Sicherheit: - Verordnung (EG) Nr. 1946/2003 des europäischen Parlaments und des Rates vom 15. Juli 2013 über grenzüberschreitende Verbringungen von genetisch veränderten Organismen 20 - Richtlinie 2001/18/EG des europäischen Parlaments und des Rates vom 12. März 2001 über die absichtliche Freisetzung genetisch veränderter Organismen in die Umwelt und zur Aufhebung der Richtlinie 90/220/EWG des Rates 21 Tierschutz: - Verordnung (EG) Nr. 1/2005 des Rates vom 22. Dezember 2004 über den Schutz von Tieren beim Transport und damit zusammenhängenden Vorgängen 22 - Tierschutztransportverordnung – TSchTrV – Verordnung zum Schutz von Tieren beim Transport 23 - Richtlinie 2010/63/EU des europäischen Parlaments und des Rates vom 22. September 2010 zum Schutz der für wissenschaftliche Zwecke verwendeten Tiere 24 - IATA Richtlinien für den Transport von lebenden Tieren (IATA-LAR) 25 17 izmc.ezrc.kit.edu/documents/<DIR_206-88-EC_en_de> izmc.ezrc.kit.edu/documents/<COM_REG_1251-2008_en_de> 19 izmc.ezrc.kit.edu/documents/<tierseuchschbmvo_de> 20 izmc.ezrc.kit.edu/documents/<REG_1946-2003_en_de> 21 izmc.ezrc.kit.edu/documents/<freisetzungGVO_DIR_2001-18-EG_en_de> 22 izmc.ezrc.kit.edu/documents/<COUNC_REG_1-2005_en_de> 23 izmc.ezrc.kit.edu/documents/<tierschtrvo> 24 izmc.ezrc.kit.edu/documents/<DIR_2010-63-EU_en_de > izmc.ezrc.kit.edu/documents/<DIR_2010-63-EU_en_de> 25 https://www.iata.org/publications/Pages/live-animals.aspx 18 27 International Zebrafish Medaka Course IZMC Beförderung gefährlicher Güter: - Das Europäische Übereinkommen über die internationale Beförderung gefährlicher Güter auf der Straße (ADR) 26 - Ordnung für internationale Eisenbahnbeförderung gefährlicher Güter (RID) 27 - IATA Gefahrgutvorschriften (IATA-DGR) 28 Obwohl der Sendungsinhalt und Verwendungszweck für Sperma-Proben, Fischeier oder Fischen im hier beschriebenen Fall derselbe ist (ungefährliche, nicht-infektiöse biologische Proben für wissenschaftliche Zwecke) können sich unterschiedliche Anforderungen für die notwendigen Transportpapiere ergeben, je nachdem was zu versenden ist und je nach Ursprungs- und Bestimmungsland. Diese Anforderungen sollen hier für die Einfuhr in EU-Mitgliedstaaten und die Verbringung innerhalb der EU kurz vorgestellt werden. EINFUHR: Die Richtlinie 2006/88/EG behandelt die Gesundheits- und Hygienevorschriften für das Inverkehrbringen von Tieren in Aquakultur und ihren Erzeugnissen sowie für ihre Einfuhr und ihre Durchfuhr durch die Staaten der Europäischen Union. Gemäß der Richtlinie bezeichnet der Begriff “Tier in Aquakultur” jedes Wassertier, einschließlich Wassertieren zu Zierzwecken, in allen Lebensstadien, einschließlich der Eier und des Samens. Die RL 2006/88/EG, sowie die VO Nr. 1251/2008 und die BmTerSSchV sehen vor, dass die Einfuhr von Fischen, Fischeiern und Sperma in ein EU-Mitgliedstaat und die Verbringung innerhalb der EU von der Vorlage einer Tiergesundheitsbescheinigung abhängig gemacht wird. Das hat zur Folge, dass jede Sendung aus einem Land außerhalb der EU von einem Gesundheitszeugnis nach VO Nr. 1251/2008 bzw. Nr. 1012/2012, Annex IV B begleitet werden muss (“Muster der Tiergesundheitsbescheinigung für die Einfuhr von Wassertieren zu Zierzwecken, die für geschlossene Einrichtungen für Ziertiere bestimmt sind, in die Europäische Union” 29 ). Dieses Zeugnis muss vom entsprechenden amtlichen Inspektor unterschrieben sein und im Original bei der Grenzkontrollstelle (bzw. beim zuständigen Veterinäramt) vorgelegt werden. ALTERNATIVE: Alternativ, kann bei spezifisch-pathogenfreien bzw. für bestimmte Krankheiten unempfänglichen Tieren und Waren auf das genannte Zeugnis verzichtet werden, und der Empfänger besorgt sich eine tierseuchenrechtliche Einfuhrgenehmigung. In Deutschland ist diese beim für die Grenzkontrollstelle zuständigen Ministerium zu beantragen. Für die Grenzkontrollstelle Köln/Bonn ist das Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen zuständig, das einen Antragsvordruck verwendet, der auszufüllen und per E-Mail ([email protected]) oder FAX (02361/305-59902) einzureichen ist. Dabei können Einzelsendungen oder Jahresgenehmigungen beantragt werden. Werden mehrere Sendungen aus unterschiedlichen Herkunftsorten beantragt, sollte die Liste mit der Adresse der einzelnen Institute als Anlage dem Antrag beigefügt werden. Für die Grenzkontrollstelle Flughafen Frankfurt a. M. ist das Hessische Ministerium für Umwelt, Energie, Landwirtschaft und Verbraucherschutz zuständig. Hier ist der Antrag formlos zu stellen und an [email protected] zu schicken, wobei der bzw. die 26 http://www.unece.org/trans/danger/publi/adr/adr2013/13contentse.html http://www.cit-rail.org/en/rail-transport-law/cotif/ 28 http://www.iata.org/publications/dgr/Pages/index.aspx 29 izmc.ezrc.kit.edu/documents/<REG_COM_1012-2012_en_de> 27 28 International Zebrafish Medaka Course IZMC Herkunftsorte, die Gesamtzahl der Fische, Fischeier bzw. Proben, die Tierspezies und der gewünschte Genehmigungszeitraum anzugeben ist. Jeder Sendung muss dann die in der Genehmigung geforderte Bescheinigung des amtlichen Tierarztes oder den Bestand betreuenden Tierarztes beiliegen. Aus der Bescheinigung muss hervorgehen, dass der Herkunftsbestand der Fische keinen Sperrmaßnahmen bzgl. Fischseuchen unterliegt und dass die Fische keine Anzeichen einer auf Fische übertragbaren Krankheit aufweisen. Wir empfehlen eine Bescheinigung nach Vorgaben des Aquatic Animal Health Codes des Office of Epizootic diseases (OIE) 30 zu verwenden. AUSFUHR: Sendungen in Länder außerhalb der Europäischen Union ist gleichfalls eine Bescheinigung des amtlichen Tierarztes bzw. den Bestand betreuenden Tierarztes beizulegen, des Weiteren eine Zollrechnung mit Nachweis für die wissenschaftliche Nutzung 31 . Die Einfuhrgenehmigung muss vom Empfänger bei den zuständigen nationalen Behörden beantragt werden. VERSAND INNERHALB DER EU: Beim Versand spezifisch-pathogenfreier Fische, Fischeier und Spermien innerhalb der Europäischen Union ist keine Einfuhrgenehmigung und keine Zollrechnung erforderlich, allerdings ist es auch in diesem Fall sinnvoll, eine Bescheinigung des betreuenden Tierarztes in das Paket zu legen. Die beim Export in Länder außerhalb der EU sind die entsprechenden Regelungen je nach Bestimmungsland unterschiedlich, und sind deshalb am besten über das Transportunternehmen zu erfragen. 3.2.1 Zusätzliche Vorschriften beim Versand von Fischen (über 5 Tage post fertilisation) Kommen Fischeier nach Tag 5 post fertilisation beim Empfänger an oder werden Fische älterer Entwicklungsstadien versendet, sind die Bestimmungen für den Lufttransport von Tieren der IATA (International Air Transport Association) sowie der Richtlinie 2010/63/EU zum Schutz der für wissenschaftlich verwendeten Tiere zu beachten. Demnach müssen diese Sendungen als Tiertransport deklariert und die relevanten Anforderungen an Verpackung und Kennzeichnung müssen eingehalten werden. Die Sendung muss zusätzlich zu dem oben genannten Zeugnis bzw. Bescheinigung und Zollrechnung von folgenden Dokumenten begleitet werden: • • • • 30 31 Shipper’s Certificate for Live Animals (leeres Formular wird vom Transportunternehmen bereit gestellt) Transporterklärung (erforderlich bei deutschen Versendern laut Tierschutztransportverordnung; leeres Formular wird vom Transportunternehmen bereitgestellt) Luftfrachtbrief (wird vom Transportunternehmen ausgefüllt) Tierschutzrechtliche Einfuhrgenehmigung (erforderlich bei der Einfuhr nach Deutschland; für das KIT bzw. Landkreis Karlsruhe ist diese beim zuständigen Amt für Veterinärwesen und Lebensmittelüberwachung formlos per E-Mail zu beantragen ([email protected])) http://www.oie.int/index.php?id=171&L=0&htmfile=chapitre_1.5.11.htm izmc.ezrc.kit.edu/documents/<customsinvoice 29 International Zebrafish Medaka Course IZMC Wie beim Transport von Fischeiern und Sperma-Proben sind auch hier beim Export in Länder außerhalb der EU die erforderlichen Transportdokumente je nach Bestimmungsland unterschiedlich, und sind deshalb am besten über das Transportunternehmen zu erfragen. 3.2.2 Zusätzliche Vorschriften beim Versand von Fischen, die als genetisch veränderte Organismen einzustufen sind Gentechnikrechtliche Bestimmungen: Im Sinne des deutschen Gentechnikgesetzes (GenTG) 32, der EU Richtlinie 2001/18/EC33 und der Verordnung (EG) Nr. 1946/2003 34, ist ein genetisch veränderter Organismus ein Organismus, mit Ausnahme des Menschen, dessen genetisches Material in einer Weise verändert worden ist, wie sie unter natürlichen Bedingungen durch Kreuzen oder natürliche Rekombination nicht vorkommt (GenTG, §3, Absatz 3 bzw. RL 2001/18/EG Artikel 2 Nr. 2). Dazu zählen Verfahren, bei denen in einen Organismus direkt Erbgut eingebracht wird, welches außerhalb des Organismus hergestellt wurde und natürlicherweise nicht darin vorkommt, einschließlich Mikroinjektion (GenTG §3, Absatz 3a bzw. RL 2001/18/EG Anhang IA Teil I). Nicht als Verfahren der Veränderung genetischen Materials gilt die Mutagenese, es sei denn, es werden gentechnisch veränderte Organismen als Spender oder Empfänger verwendet (GenTG, §3, Absatz 3b bzw. RL 2001/18/EG Anhang IA Teil 2). Im Sinn der oben genannten rechtlichen Bestimmungen ist die Abgabe oder Bereitstellung von GVO für Dritte ein „Inverkehrbringen“ und bedarf einer Genehmigung der zuständigen Behörde (für Deutschland: Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL)” 35 ), es sei denn, die GVO sind für gentechnisches Arbeiten an gentechnischen Anlagen bestimmt, da in so genannten „geschlossenen Anlagen“ spezifische Einschließungsmaßnahmen angewendet werden, um den Kontakt der GVO mit Menschen und Umwelt zu begrenzen und ein dem Gefährdungspotenzial angemessenes Sicherheitsniveau zu gewährleisten (GenTG §3 Absatz 6 und GenTG §14 Abs. 1a Nr.2 und RL 2001/18/EG Artikel 2 Nr 4). In diesem Fall sind die GVO mit dem Hinweis „Dieses Produkt enthält genetisch veränderte Organismen“ zu kennzeichnen, weitere Dokumente sind für die Weitergabe nicht erforderlich (GenTG §17b Abs. 2). Der Versender von transgenen Fischen sollte sich im eigenen Interesse beim Empfänger versichern, dass dieser über eine zugelassene gentechnische Anlage der entsprechenden Sicherheitsstufe zur Haltung von GVO verfügt. Sind diese Voraussetzungen nicht gegeben, würde es sich um ein nicht genehmigtes und damit unerlaubtes Inverkehrbringen von GVO handeln, das als Ordnungswidrigkeit mit einer Geldbuße bis zu 50.000 EURO geahndet werden kann (GenTG § 38 Abs. 1 Nr.7 und Abs. 2). 32 Gentechnikgesetz in der Fassung der Bekanntmachung vom 16. Dezember 1993 (BGBl. I S. 2066), das durch Artikel 4 Absatz 14 des Gesetzes vom 7. August 2013 (BGBl. I S. 3154) geändert worden ist (izmc.ezrc.kit.edu/documents/<GenTG>) 33 Directive 2001/18/EC of the European Parliament and of the Council of 12 March 2001 on the deliberate release into the environment of genetically modified organisms and repealing Council Directive 90/220/EEC (izmc.ezrc.kit.edu/documents/<freisetzungGVO_DIR_2001-18-EG_en_de>) 34 Regulation (EC) No 1946/2003 of the European Parliament and of the Council of 15 July 2003 on transboundary movements of genetically modified organisms (izmc.ezrc.kit.edu/documents/<REG_1946-2003_en_de>) 35 The Federal Office of Consumer Protection and Food Safety (BVL) (http://www.bvl.bund.de/DE/Home/homepage_node.html) 30 International Zebrafish Medaka Course IZMC Abb. 5: Rautensymbol UN 3245; Das Kennzeichen muss die Form eines auf die Spitze gestellten Quadrats (Raute) mit einer Mindestabmessung von 50 mm × 50 mm haben; die Linie muss mindestens 2 mm breit sein und die Buchstaben und Ziffern müssen eine Zeichenhöhe von mindestens 6 mm haben. Gefahrgutrechtliche Bestimmungen: Werden GMO transportiert, die nicht giftig und nicht infektiös sind, die aber in der Lage sind, ihre genetischen Veränderungen an ihre Nachkommen weiterzugeben und beim Entkommen in die Natur zu überleben, sind nach den Vorschriften des ADR/RID (Straßen- und Schienenbeförderung) und IATA-DGR (Lufttransport) der Klasse 9 und UN 3245 zuzuordnen und müssen entsprechend deklariert und verpackt werden. Correct Shipping name: “GENETICALLY MODIFIED ORGANISMS” Verpackung und Kennzeichnung der Verpackung: Transport Straße/Eisenbahn: Dreifachverpackung mit Absorptionsmaterial gemäß ADR Verpackungsanweisung 904 ist erforderlich 36 (Abb. 4). Lufttransport: Dreifachverpackung mit Absorptionsmaterial gemäß IATA Verpackungsvorschrift 959 ist erforderlich 37 (Abb.4). Kennzeichnung: Die Außenverpackung muss mit dem Rautesymbol „UN 3245“ (Abb.5) und Kennzeichnung des Versenders und des Empfängers (Name und Adresse) NEBEN dem Rautesymbol versehen sein. Sondervorschriften und Dokumente: GMO, die in Übereinstimmung mit den Verpackungsvorschriften 904 bzw. 959 verpackt und markiert worden unterliegen keinen weiteren ADR/RID und IATA-DGR Vorschriften. Eine „Shipper’s Declaration for Dangerous Goods“ wird nicht benötigt. Hinweise zum Versand von Sperma: Zum Versand von gefrorenen Sperma-Proben eignen sich spezielle Sicherheits-Kryo-Behälter (Abb.6), die den Transport bei Temperaturen zwischen -150 und -180°C erlauben (als cryogenic Dry Shipper bezeichnet, da sie keinen Flüssigstickstoff enthalten). 36 37 izmc.ezrc.kit.edu/documents/<p904_en_de> izmc.ezrc.kit.edu/documents/<p959_en_de> 31 International Zebrafish Medaka Course IZMC Abb. 6: Sicherheits-Kryo-Behälter für den Transport von Sperma-Proben, Quelle: CryoService Limited, UK Sie können bei einem geeigneten Transportunternehmen, das den Versand übernimmt, geliehen werden (z.B. World Courier, FedEx) oder vom Hersteller gekauft (z.B. Thermo Scientific) und vom Transportunternehmen befördert werden (z.B. Biocare). Die Kennzeichnungsvorschriften sind je nach Transportweg unterschiedlich und deshalb am besten beim Transportunternehmen zu erfragen. 32 International Zebrafish Medaka Course IZMC Zebrafisch und Medaka als experimentelle Modelle 38 (Nicholas Foulkes) Die kleinen Süßwasserfische Zebrabärbling („Zebrafisch“, Danio rerio), (Abb.7) und Medaka (Oryzias latipes) (Abb.8) werden in zunehmendem Maße als Modellsysteme für die biomedizinische Forschung benutzt. Sie bieten sequenzierte Genome und ein großes Repertoire an genetischen molekularen und zellulären Methoden. Eine einzigartige Kombination von Eigenschaften (kleine Körpergröße, zahlreiche Nachkommen, optische Transparenz der Embryonen, Zugänglichkeit für Abb. 7: Zebrabärbling, Weibchen genetische und chemische Screens) hat diese Wirbeltiermodelle unter den biomedizinischen Forschern populär gemacht. Der Vorteil dieser Fischmodelle im Vergleich zu konventionellen Modellen wie z. B. Maus und Ratte ist die Möglichkeit, im großen Maßstab phänotypische Screens durchzuführen und die Funktion von Genen oder den Effekt kleiner Moleküle zu charakterisieren. Zusätzlich zu den klassisch genetischen Ansätzen erlaubt ein weites Spektrum an Methoden von der Transgenese bis zum gezielten Gen-Knockout, in diesen Tieren Genfunktionen im Zusammenhang des ganzen Organismus zu untersuchen, häufig unter Einsatz nichtinvasiver Bildgebungsverfahren. Zebrabärblinge und Medaka können daher signifikant dazu beitragen, die Herausforderung der modernen Biologie in Angriff zu nehmen, Genfunktionen in einem globalen Maßstab zu verstehen. Ihr Wert als Modelle wird weiterhin signifikant durch parallele Fortschritte in der Mikroskoptechnik gesteigert, die es jetzt erlauben, ganze lebende Embryonen mit subzellulärer Auflösung zu analysieren (Abb. 9, 10) 4. Es ist auch klar geworden, dass das Potential dieser Fischmodelle weit über das Gebiet der Zellund Entwicklungsbiologie hinausgeht und dass ihre Nutzung zu Innovationen in nahezu allen Bereichen der biomedizinischen Forschung führen kann. Das wurde von Wissenschaftlern und Wissenschaftsförderern weltweit erkannt und Abb. 8: Medaka, Southern Cab Stamm; oben: beträchtliche Abb. 9: Transgener Zebrabärbling, der ein Weibchen; unten Männchen. Mit freundlicher Transgen (shh:gfp) in retinalen Ganglionzellen Genehmigung von Jochen Wittbrodt finanzielle exprimiert Ressourcen wurden zur Entwicklung fischrelevanter Technologien und Infrastruktur zur Verfügung gestellt 39 . Zebrafischmodelle wurden z. B. für polyzystische Nierenerkrankungen, Arrythmien des Herzens, Kardiomyopathien und Myopathien der Skelettmuskulatur, Anämien, Cholesterinverarbeitung, Glaukom, Krebs (besonders Melanom und Leukämie), . 38 Lieschke GJ and Currie PD (2007) Animal models of human disease: zebrafish swim into view. Nat. Rev. Genet. 8, 353-67 Zon LI and Peterson RT (2005) In vivo drug discovery in the zebrafish. Nature Reviews Drug Discovery 4, 35-44. 39 Zebrafish – A Practical Approach, Dahm and Nüsslein-Volhard eds. OUP 2002, 2005 33 International Zebrafish Medaka Course IZMC Suchterkrankungen, Geweberegeneration, Hörschädigungen, Nervenund Retinaldegeneration sowie Infektionskrankheiten beschrieben. In manchen Fällen wurde ein neues Krankheitsgen zuerst im Zebrabärbling entdeckt und dann erst als Ursache einer menschlichen Krankheit erkannt, wie z.B. der Eisentransporter Ferroprotein in Hämochromatosis Typ 4, einer Anämie im Menschen. Der Zebrabärbling zieht auch in zunehmendem Maße als Modell für die pharmazeutische Industrie Aufmerksamkeit auf sich – sowohl mit dem Ziel, neue Wirkstoffe zu entdecken, als auch um den Zebrabärblingsembryo als ein Ganztiersystem für toxikologische Studien zu verwenden. Die ersten Beispiele dafür, in denen Chemikalien erfolgreich darauf gescreent wurden, genetische Defekte zu unterdrücken, sind bereits in der Literatur erschienen 40 . Die ersten Pharmastoff-Kandidaten, die an Zebrabärblingsembryonen entwickelt wurden, sind in der klinischen Testphase 41 (Len Zon, pers. comm.). In Deutschland ist der Zebrabärblingsembryo-Toxizitätstest ein DINAbb. 10: Ein kdrl::mCherry-CAAX transgenerZebrabärblingsembryo mit durch das Standard zur Prüfung der Wasserqualität aus Transgen markierten Blutgefäßen. Oben, Klärwerken geworden 42 . Weiterhin zeigten Rückenansicht, unten Seitenansicht. molekulare Studien, dass der Zebrabärblingsembryo ein geeignetes Modell für die systematische Testung von Chemikalien im Rahmen des Europäischen REACH-Programms 43 und anderer systematischer Toxizitätsstudien ist, die das Ziel haben, Toxizitätsmechanismen zu verstehen 44. Aufgrund evolutionärer Divergenz von Medaka und Zebrabärling komplementieren genetische Studien in Medaka häufig jene in Zebrabärblingen 45. Z. B. gibt es aufgrund seiner langen Geschichte als ein genetisches Modellsystem eine große Zahl von Pigmentationsmutanten im Medaka, die neue Einblicke in menschliche Erkrankungen, wie z. B. den okulokutanen Albinismus (OCA), eröffnet haben. Ähnlich gaben klassischgenetische Ansätze in Medaka neue Einsichten in Knochen- und Knorpelbildung, Geschlechtsbestimmung und Gonadenentwicklung. Weiterhin wurde von KeimbahnStammzellen in den Ovarien von Medaka berichtet. Daher repräsentiert Medaka auch ein aufstrebendes Modell, um Stammzellnischen, die für die Reproduktionsbiologie relevant sind, zu studieren. 40 Peterson, R.T., et al., Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nature biotechnology, 2004. 22(5): p. 595-9. 41 Martin, C.S., A. Moriyama, and L.I. Zon, Hematopoietic stem cells, hematopoiesis and disease: lessons from the zebrafish model. Genome medicine, 2011. 3(12): p. 83. 42 DIN (2001) German standard methods for the examination of water, waste water and sludge – Subanimal testing (group T) – Part 6: Toxicity to fish. Determination of the non-acute-poisonous effect of waste water to fish eggs by dilution limits (T 6). DIN 38415-6; German Standardization Organization. Lammer, E., et al., Is the fish embryo toxicity test (FET) with the zebrafish (Danio rerio) a potential alternative for the fish acute toxicity test? Comparative biochemistry and physiology. Toxicology & pharmacology : CBP, 2009. 149(2): p. 196-209. 43 Yang, L., et al., Zebrafish embryos as models for embryotoxic and teratological effects of chemicals. Reproductive toxicology, 2009. 28(2): p. 245-53. 44 http://www.epa.gov/ncct/download_files/chemical_prioritization/padillaSept28presentation.pdf 45 Takeda, H. and Shimada, A. (2010). The art of medaka genetics and genomics: what makes them so unique? Annu Rev Genet 44, 217–241. 34 International Zebrafish Medaka Course IZMC 4.1 Die Biologie des Zebrabärblings (Danio rerio) 46 (Thomas Dickmeis) Der Zebrabärbling ist ein populärer Süßwasser-Aquarienfisch, der vom indischen Subkontinent stammt. Er ist leicht zu züchten und sehr widerstandsfähig, was ihn besonders für Aquarienanfänger geeignet macht. Diese Eigenschaften haben auch dazu beigetragen, dass der Zebrabärbling in zunehmendem Maße in der Forschung als Tiermodell eingesetzt wurde. Sie ergänzen seine experimentellen Vorteile, wie die geringe Größe und die Durchsichtigkeit seiner Embryonen und Larven sowie ein wachsendes Repertoire an Methoden für genetische Studien. Morphologie Erwachsene Zebrabärblinge sind ungefähr 3 – 5 cm lang und zeigen ein charakteristisches Muster von blau-schwarzen horizontalen Streifen, die entlang des Körpers und der Anal- und Schwanzflossen verlaufen (daher der Name, Abb. 7). Diese schwarz-blauen Streifen werden durch melaninhaltige Melanophorenzellen gebildet. Die Streifen sind voneinander durch Xanthophoren getrennt, die Pteridin- und CarotinoidPigmente enthalten und eine orangegelbe Farbe bewirken. Der dritte Typ von Pigmentzellen, die Iridophoren, enthält guaninreiche Plättchen, die eine irisierende Erscheinung bewirken. Zebrabärblinge zeigen einen sexuellen Dimorphismus. Das Weibchen ist durch einen dickeren Bauch und das Männchen durch eine im Vergleich schlankere Körperstruktur sowie eine gelblichere Färbung charakterisiert. Als ein strahlenflossiger Fisch zeigt der Zebrabärbling den typischen Grundbauplan dieser Wirbeltiergruppe, der durch einige charakteristische Merkmale gekennzeichnet ist. Dazu gehören zum Beispiel vom Ansatz der Flossen ausgehende und diese stützende Knochenstrahlen; in durch Kiemendeckel abgedeckten Hohlräumen befindliche Kiemen an beiden Körperseiten; und eine Schwimmblase, die den Auftrieb des Fisches im Wasser reguliert. Ein interessanter Aspekt der Neuroanatomie ist das Vorhandensein eines „evertierten“ Gehirns, welches das Ergebnis eines Ausstülpungsprozesses während der Entwicklung ist. Dieser führt dazu, dass der Ventrikel über die dorsale und lateral Oberfläche des Gehirns ausgebreitet wird (Wullimann and Mueller, 2004). Einige anatomische Merkmale des Zebrabärblings sind typisch für die Elritzen, die systematische Familie, zu der der Zebrabärbling gehört. So haben Zebrabärblinge keine Zähne im Kiefer. Stattdessen besitzen sie sogenannte „Pharyngealzähne“ im hinteren Schlund. Elritzen besitzen auch keine Fettflosse auf dem Rücken (Nüsslein-Volhard, 2002). Der Zebrabärbling teilt viele Merkmale der Physiologie mit anderen Wirbeltieren, was einen Teil seiner Anziehungskraft als Modellorganismus für die biomedizinische Forschung ausmacht. So sind Zebrabärblinge in Studien zur Muskel- und Herzphysiologie, zu neuralen Funktionen und synaptischer Transmission sowie zur Endokrinologie eingesetzt worden (Asnani and Peterson, 2014; Gibbs et al., 2013; Leung et al., 2013; Lohr and Hammerschmidt, 2011). Zebrabärblinge waren auch nützlich für die Untersuchung von fischspezifischen Aspekten der Physiologie mit Bezug auf ihr aquatisches Habitat, wie der Osmoregulation durch Ionozyten der Kiemen (Guh et al., 2015). Mechanosensorische Systeme des Zebrabärblings sind das Seitenlinienorgan und das Ohr. Das Seitenelinienorgan besteht aus einer Serie von mechanosensorischen Rezeptoren (Haarzellen) auf dem Kopf und entlang der 46 Nüsslein-Volhard, C. and Dahm R., 2002, Zebrafish , A practical approach Spence R et al., 2008; The behavior and ecology of the zebrafish, Danio rerio Westerfield M., 1993; The Zebrafish Book, A guide for the laboratory use of zebrafish 35 International Zebrafish Medaka Course IZMC Körperachse, die z.B. Schwingungen im Wasser detektieren (Nüsslein-Volhard, 2002; Ostrander, 2000). Das Ohr besteht nur aus dem Innenohr. Die Maculaorgane mit ihren Haarzellen in diesem Ohr dienen sowohl als Gleichgewichtsorgane, wie in Säugern, als auch zusätzlich zum Hören. Weil der Zebrabärbling Teil der Otophysi-Gruppe der Fische ist, ist sein Innenohr mit der Schwimmblase über kleine Knochen verbunden, die Weber-Knöchelchen. Dies verbessert das Hören und macht den Zebrabärbling zu einem der „Hörspezialisten“ unter den Fischen (Nicolson, 2005; Whitfield, 2002).. Zebrafische können Farben sehen, und zusätzlich zu den Zapfen-Typen der Netzhaut spezifisch für die drei Farben, die auch von Menschen wahrgenommen werden, haben sie noch UV-sensitive Zapfen (Slijkerman et al., 2015). Auch der Geruchssinn spielt eine wichtige sensorische Rolle, da Zebrabärblinge Nährstoffe (Aminosäuren), Verwandschaft anzeigende Stoffe, die Eireifung veranlassende Pheromone (Steroidglucuronide) und einen „Schreckstoff“, das Glycosamin Chondroitin, riechen können. Letzteres wird bei Verletzungen freigesetzt und erregt heftige Fluchtreaktionen (Gerlach and Lysiak, 2006; Koide et al., 2009; Mathuru et al., 2012; van den Hurk et al., 1987). Systematik Wie die meisten Knochenfische gehören die Zebrabärblinge zu den Teleostei oder Echten Knochenfischen und sind damit Teil der größten Gruppe innerhalb der strahlenflossigen Fische oder Actinopterygii. Zebrabärblinge sind Cypriniden, d.h. sie zählen zu der Familie Cyprinidae (Elritzen und Karpfen), die eine der größten Familien der Teleostei und daher der Vertebraten im Allgemeinen sind 47 . Auch der gemeine Karpfen und der Goldfisch gehören zu dieser Familie. Von seinem Entdecker Hamilton im Jahre 1822 ursprünglich „Danio rerio“ benannt 48 , war der Zebrabärbling für viele Jahre als Brachydanio rerio in der Wissenschaftsliteratur bekannt, bevor er aufgrund neuerer phylogenetischer Analysen unter Einschluss von DNA-Sequenzdaten wieder der Gattung Danio zugeordnet wurde 49. Heute werden ungefähr 45 Arten zur Gattung Danio gerechnet 50. Der Name Danio kommt vom bengalische Wort ‚Dhani‘, das sich auf grüne Reisfelder bezieht. Laborstämme und Varianten Mehrere Forschungslabors haben eine Reihe von verschiedenen WildtypLaborstämmen etabliert, die in Gefangenschaft bereits über längere Zeiträume gezüchtet worden sind. Populäre Stämme sind z.B. der AB- und der Tübingen (TÜ) Stamm, die auch in den ersten großen Mutagenese-Screens benutzt wurden 51. 47 Nelson JS. 2006. Fishes of the World. John Wiley and sons, New York, NY. Hamilton F. 1822. An Account of the Fishes Found in the River Ganges and its Branches. Archibald Constable and Co., Edinburgh and London. 49 Mayden RL, Tang KL, Conway KW, Freyhof J, Chamberlain S, Haskins M, Schneider L, Sudkamp M, Wood RM, Agnew M et al. 2007. Phylogenetic relationships of Danio within the order Cypriniformes: a framework for comparative and evolutionary studies of a model species. J Exp Zool B Mol Dev Evol 308: 642-654. 50 Fang F, Douglas ME. 2003. Phylogenetic Analysis of the Asian Cyprinid Genus Danio (Teleostei, Cyprinidae). Copeia 2003: 714-728. 51 Driever W, Solnica-Krezel L, Schier AF, Neuhauss SC, Malicki J, Stemple DL, Stainier DY, Zwartkruis F, Abdelilah S, Rangini Z et al. 1996. A genetic screen for mutations affecting embryogenesis in zebrafish. Development 123: 3746. Haffter P, Granato M, Brand M, Mullins MC, Hammerschmidt M, Kane DA, Odenthal J, van Eeden FJ, Jiang YJ, Heisenberg CP et al. 1996. The identification of genes with unique and essential functions in the development of the zebrafish, Danio rerio. Development 123: 1-36. 48 36 International Zebrafish Medaka Course IZMC Der AB-Stamm wurde von G. Streisinger in Eugene, Oregon, USA, etabliert, während der Tübingen-Stamm im Laboratorium von C. Nüsslein-Vollhard, Tübingen, Deutschland, generiert wurde 52. Diese Stämme wurden ausgehend von Fischen, die in Zoohandlungen gekauft wurden, gezüchtet, während ein anderer wichtiger Stamm, WIK, 53 direkt von einem Wildfang in Indien abstammt (daher sein Name: „Wild-type India Kolkata“ oder „Wild Indian Karyotype“). Dieser Stamm diente als ein hochpolymorpher Referenzstamm für die Kartierung von Mutationen, die im TÜHintergrund erzeugt wurden 54. Genomsequenzdaten haben gezeigt, dass die verschiedenen Zebrabärblings-WildtypStämme ein hohes Niveau an genetischer Diversität zeigen, sowohl innerhalb als auch zwischen den Stämmen. Einzelnukleotid-Polymorphismen („Single nucleotide polymorphisms“, SNPs) scheinen zum Beispiel mehr als vierfach häufiger in Zebrabärblingen als in Menschen aufzutreten (Howe et al., 2013; LaFave et al., 2014; Parichy, 2015; Patowary et al., 2013). Es ist größtenteils unbekannt, in welchem Maße diese genetische Heterogeneität zur Variabilität von experimentellen Ergebnissen beiträgt. Zusätzlich zu den Wildtyp-Stämmen werden in Kreuzungsexperimenten häufig Fische genutzt, die Pigmentierungsmutationen tragen oder andere morphologische Variationen zeigen. Diese Fische eigenen sich auch gut als leicht erkennbare Tankgenossen in der Gruppenhaltung und können so die Einzelhaltung von Fischen vermeiden. Ein Beispiel für eine Pigmentierungsmutante ist die rezessive Mutation Leopard (leo), die zu einer Unterbrechung des Streifenmusters in homozygoten Fischen führt 55 (Abb. 11). Abb. 11: Die Leopard-Mutante des ZebraBärblings Diese Fische wurden ursprünglich als eine eigene Art beschrieben (Danio frankei) 56. Fische, die homozygot für die golden-Mutation sind, haben stark reduzierte Melaninspiegel in ihren Melanophoren und erscheinen daher gelblich 57. Das Gen, das in golden-Fischen mutiert ist, ist ein mutmaßlicher Kationenaustauscher, der ebenfalls mit Pigmentunterschieden im Menschen in Verbindung gebracht wurde 58. 52 Dahm R, Geisler R, Nüsslein-Volhard C. 2006. Zebrafish (Danio rerio) Genome and Genetics. in Encyclopedia of Molecular Cell Biology and Molecular Medicine. Wiley-VCH Verlag GmbH & Co. KGaA. 53 Rauch GJ, Granato M, Haffter P. 1997. A polymorphic zebrafish line for genetic mapping using SSLPs on highpercentage agarosegels. Technical Tips Online T01208. 54 Geisler R, Rauch GJ, Geiger-Rudolph S, Albrecht A, van Bebber F, Berger A, Busch-Nentwich E, Dahm R, Dekens MP, Dooley C et al. 2007. Large-scale mapping of mutations affecting zebrafish development. BMC Genomics 8: 11. 55 Kirschbaum F. 1975. Untersuchungen über das Farbmuster der Zebrabarbe Brachdanio rerio (Cyprinidae, Teleostei). Wilhelm Roux's Archives 177: 129-152. Watanabe M, Iwashita M, Ishii M, Kurachi Y, Kawakami A, Kondo S, Okada N. 2006. Spot pattern of leopard Danio is caused by mutation in the zebrafish connexin41.8 gene. EMBO Rep 7: 893-897. 56 Meinken H. 1963. Mitteilungen der Fischbestimmungsstelle des VDA XLII: Brachydanio frankei spec. nov., der Leopard-Danio. . Monatsschrift für Ornithologie und Vivarienkunde 42: 39-43. Spence R, Gerlach G, Lawrence C, Smith C. 2008. The behaviour and ecology of the zebrafish, Danio rerio. Biol Rev Camb Philos Soc 83: 13-34. 57 Lamason RL, Mohideen MA, Mest JR, Wong AC, Norton HL, Aros MC, Jurynec MJ, Mao X, Humphreville VR, Humbert JE et al. 2005. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science 310: 1782-1786. Streisinger G, Walker C, Dower N, Knauber D, Singer F. 1981. Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature 291: 293-296. 37 International Zebrafish Medaka Course IZMC Der „Tübingen (auch Tüpfel“) Langflossen“-(TL)-Stamm 59 trägt sowohl die leo t1Mutation als auch eine dominante Mutation lof dt2 (Longfin) 60 , die übermäßiges Wachstum der Flossen verursacht. Die casper-Mutanten 61, die eine Doppelmutante im nacre/mitfa 62-Locus sowie im roy (Roy Orbison)-Locus sind, haben keine Melanozyten und Iridophoren. Deshalb sind sie selbst als Adulte transparent, was sie sehr gut für die Anwendung bildgebender Verfahren im lebenden Tier geeignet macht. Habitat und Ökologie Zebrabärblinge kommen in ganz Indien in einer Reihe von Habitaten vor 63 . Gemeinsame typische Eigenschaften dieser Habitate sind geringer Wasserfluss, ein Bodengrund mit Sand, Schlamm oder Kieseln, sowie überhängende Vegetation. Solche Habitate werden häufig in Sekundär- und Tertiär-Zuläufen eines Flusses oder angrenzend an Sumpfland und Reisfelder gefunden. Physikalische und chemische Parameter dieser Habitate variieren sehr: In zwei kürzlich erschienenen Studien wurden ein Temperaturbereich von 12,3°C bis 38,6°C, pH-Werte von 5,9 bis 9,8 und Leitfähigkeiten von 10 µS bis 271 µS gefunden 64 . Diese Befunde passen zu der großen Toleranz gegenüber Umweltbedingungen, die Zebrabärblinge in Gefangenschaft zeigen. In Forschungsfischanlagen werden Zebrabärblinge generell in Aquarien ohne zusätzliche Strukturen gehalten, um Inspektion und Reinigung zu erleichtern. Experimente mit zusätzlichen Tankstrukturen, die „natürlichere“ Umgebungen nachahmen sollten, haben zu unterschiedlichen Ergebnissen bezüglich der tiergerechten Haltung geführt. Zum Beispiele beobachteten einige Studien reduziertes (Basquill and Grant, 1998) oder gleichbleibendes (Hamilton and Dill, 2002; Kistler et al., 2011) aggressives Verhalten in Tanks mit Vegetation, während andere feststellten, das Vegetation oder das Vorhandensein von leicht zu reinigenden Glasstab-Strukturen eher aggressives Verhalten stimulierte (Bhat et al., 2015; Wilkes et al., 2012). Hierbei ist wichtig, dass viele der vorgeschlagenen Umgebungsanreicherungen ein Risiko für das Gesundheitsmanagement in der Anlage darstellen können, indem sie die Sicht auf die Fische behindern und die Reinigung der Tanks erschweren. Da die soziale Umgebung eine wichtigere Rolle für das normale Verhalten des Zebrabärblings zu spielen scheint 58 Lamason RL, Mohideen MA, Mest JR, Wong AC, Norton HL, Aros MC, Jurynec MJ, Mao X, Humphreville VR, Humbert JE et al. 2005. SLC24A5, a putative cation exchanger, affects pigmentation in zebrafish and humans. Science 310: 1782-1786. 59 Dahm R, Geisler R, Nüsslein-Volhard C. 2006. Zebrafish (Danio rerio) Genome and Genetics. in Encyclopedia of Molecular Cell Biology and Molecular Medicine. Wiley-VCH Verlag GmbH & Co. KGaA. 60 Iovine MK, Johnson SL. 2002. A genetic, deletion, physical, and human homology map of the long fin region on zebrafish linkage group 2. Genomics 79: 756-759 Tresnake I. 1981. the long-finned zebra Danio. Trop Fish Hobby 29: 43-56. van Eeden FJ, Granato M, Schach U, Brand M, Furutani-Seiki M, Haffter P, Hammerschmidt M, Heisenberg CP, Jiang YJ, Kane DA et al. 1996. Genetic analysis of fin formation in the zebrafish, Danio rerio. Development 123: 25561 White RM, Sessa A, Burke C, Bowman T, LeBlanc J, Ceol C, Bourque C, Dovey M, Goessling W, Burns CE et al. 2008. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell 2: 183-189. 62 Lister JA, Robertson CP, Lepage T, Johnson SL, Raible DW. 1999. nacre encodes a zebrafish microphthalmiarelated protein that regulates neural-crest-derived pigment cell fate. Development 126: 3757-3767. 63 Arunachalam M, Raja M, Vijayakumar C, Malaiammal P, Mayden RL. 2013. Natural history of zebrafish (Danio rerio) in India. Zebrafish 10: 1-14. Engeszer RE, Patterson LB, Rao AA, Parichy DM. 2007. Zebrafish in the wild: a review of natural history and new notes from the field. Zebrafish 4: 21-40. Spence R, Gerlach G, Lawrence C, Smith C. 2008. The behaviour and ecology of the zebrafish, Danio rerio. Biol Rev Camb Philos Soc 83: 13-34. 64 Engeszer RE, Patterson LB, Rao AA, Parichy DM. 2007. Zebrafish in the wild: a review of natural history and new notes from the field. Zebrafish 4: 21-40. 38 International Zebrafish Medaka Course IZMC (siehe auch unten, Verhalten), könnte der Gebrauch von Umgebungsanreicherungselementen nur in bestimmten Situationen empfehlenswert sein, z.B. wenn für eine Getrennthaltung einzelner Fische kein Zusammensetzen mit anders pigmentierten Tankgenossen möglich ist (Collymore et al., 2015). Zebrabärblinge teilen ihr Habitat mit einer Reihe von anderen Fischen, die Konkurrenten um Futter sein können; dazu gehören andere Cypriniden wie Puntiusbarben, andere Danio-Spezies und besonders Esomus danricus, der eine ähnliche Größe und Maulspannweite hat und in ähnlichen Wassertiefen vorkommt. Die Analyse von Darminhalten deutet darauf hin, dass Zebrabärblinge hauptsächlich Futter fressen, das nicht aus ihrem Habitat stammt (sog. „allochtones“ Material), wie z.B. rote Ameisen oder andere Insekten, die in das Wasser gefallen sind, sich aber auch von aquatischen Insektenlarven und Krebsen, sowie von Zooplankton und Phytoplankton ernähren 65 . Das nach oben gerichtete Maul von Zebrabärblingen deutet darauf hin, dass das Futter hauptsächlich an der Wasseroberfläche aufgenommen wird 66, wie es auch im Aquarium beobachtet werden kann; jedoch wird auch Lebendfutter wie z. B. Artemienlarven eifrig aktiv gejagt. Lebendfutter stellt daher ein leicht einzusetzendes Umgebungsanreicherungselement dar, welches das natürliche Beutefangverhalten von Larven und adulten Zebrabärblingen stimuliert. Vögel, wie Reiher und Eisvögel, aber auch größere Fischarten, wie Schlangenkopffische (Channa sp.) oder der SüßwasserHornhecht (Xenentodon cancila), die in denselben Habitaten vorkommen, könnten adulte Zebrabärblinge fressen, während Libellenlarven Zebrafischlarven jagen könnten 67. Verhalten Zebrabärblinge sind Tagtiere und zeigen daher die höchste Aktivität während des Tages. Bei Nacht erhöhen sich die Häufigkeit und die Dauer von Ruhephasen. Schlafphasen können wenige Minuten dauern und zeichnen sich oft durch eine charakteristische Position mit hängenden Schwanzflossen der Fische aus, die dabei entweder nahe an der Wasseroberfläche oder am Grund des Aquariums ruhen 68 . Interessanterweise ist das Paarungsverhalten auf den Beginn der Lichtphase begrenzt 69. Indem Verhaltenstests aus Nagermodellen auf Adulte und sogar Larven des Zebrabärblings angewandt werden, wird jetzt auch zunehmend das Verhalten dieser Tiere untersucht, insbesondere bezüglich Lernen und Belohnung, aber auch im Zusammenhang mit Aggression und Furcht. 70. Wenn Zebrabärblinge zum Beispiel in einen neuen Tank gesetzt werden, tauchen sie zunächst zum Boden ab und bleiben 65 Spence R, Gerlach G, Lawrence C, Smith C. 2008. The behaviour and ecology of the zebrafish, Danio rerio. Biol Rev Camb Philos Soc 83: 13-34. Arunachalam M, Raja M, Vijayakumar C, Malaiammal P, Mayden RL. 2013. Natural history of zebrafish (Danio rerio) in India. Zebrafish 10: 1-14. McClure MM, McIntyre PB, McCune AR. 2006. Notes on the natural diet and habitat of eight danionin fishes, including the zebrafish Danio rerio. Journal of Fish Biology 69: 553-570. 66 Gerlai R. 2013. Antipredatory behavior of zebrafish: adaptive function and a tool for translational research. Evol Psychol 11: 591-605. 67 Spence R, Gerlach G, Lawrence C, Smith C. 2008. The behaviour and ecology of the zebrafish, Danio rerio. Biol Rev Camb Philos Soc 83: 13-34. Engeszer RE, Patterson LB, Rao AA, Parichy DM. 2007. Zebrafish in the wild: a review of natural history and new notes from the field. Zebrafish 4: 21-40. 68 Yokogawa T, Marin W, Faraco J, Pezeron G, Appelbaum L, Zhang J, Rosa F, Mourrain P, Mignot E. 2007. Characterization of sleep in zebrafish and insomnia in hypocretin receptor mutants. PLoS Biol 5: e277. 69 Darrow KO, Harris WA. 2004. Characterization and development of courtship in zebrafish, Danio rerio. Zebrafish 1: 40-45. 70 Norton W, Bally-Cuif L. 2010. Adult zebrafish as a model organism for behavioural genetics. BMC Neurosci 11: 90. 39 International Zebrafish Medaka Course IZMC dort, bevor sie beginnen, den offenen Raum des Tanks zu erkunden. Beunruhigte Fische benötigen eine längere Zeit für diese Verhaltenswechsel. Beunruhigte Fische können auch ein Starre-Verhalten zeigen, oder im Gegenteil länger anhaltende Phasen erhöhter Bewegung (z.B. schnelles Zickzack-Schwimmen am Tankboden)(Maximino et al., 2010). Bemerkenswerterweise scheint es stammspezifische Unterschiede in diesen Verhaltensantworten zu geben. Zebrabärblinge sind soziale Tiere, die mit ihren Artgenossen Schwärme bilden. In der Wildnis wurden Schwärme verschiedener Größe beobachtet, von 4 bis zu 300 Individuen, je nach Habitat (Suriyampola et al., 2016). Auch Schwarmbildung mit einer anderen Art, Rasbora spp., wurde berichtet. Dieses Schwarmverhalten wird bei vielen Teleostiern gefunden und erhöht die Wahrscheinlichkeit eines Individuums, Futterquellen und Räuber zu entdecken („viele Augen sehen mehr als zwei“). Es erhöht auch die Entkommenschance bei der Flucht vor einer Räuberattacke, aufgrund einer Verwirrung des Räubers durch den Schwarm oder einer „Verdünnung“ des Individuums in der Masse 71 . Die Signale, die für die Bildung von Zebrabärblingsschwärmen verantwortlich sind, sind noch wenig verstanden, aber sie scheinen sowohl visuelle als auch Geruchsmerkmale zu beinhalten. Zebrabärblinge bevorzugen bei der Schwarmbildung Artgenossen gegenüber anderen Arten, verwandte Zebrabärblinge gegenüber nichtverwandten und bekannte gegenüber nichtbekannten Partnern 72. Zebrabärblinge zeigen auch hierarchisches und territoriales Verhalten. In einer kürzlich erschienenen Studie wurde interessanterweise gefunden, dass dominante Unterordnungsbeziehungen mit zunehmender Zahl der Fische in einem Tank aufgehoben werden 73. Die Zahl der Attacken reduzierte sich, wenn die Dichte von zwei auf sechs Männchen pro Liter erhöht wurde und keine Attacken wurden beobachtet, wenn zehn Individuen in einem Liter gehalten wurden. Weiterhin waren die Cortisolspiegel am niedrigsten bei einer relativ hohen Dichte (5 Fische pro Liter) in diesem Experiment, was auf reduzierte Stressniveaus hindeutete. Übereinstimmend mit diesen Ergebnissen untersuchte eine kürzlich erschienene Laborstudie den Effekt der Besatzdichte auf das Reproduktionsverhalten, das ebenfalls durch Stress beeinflusst werden kann. Kein negativer Effekt war bei Besatzdichten von bis zu 12 Fischen pro Liter zu beobachten 74. Somit hat Schwarmbildung offensichtlich einen positiven Effekt sowohl in der Interaktion mit der Umgebung als auch mit Artgenossen. Paarungsverhalten Zebrafische sind Gruppenlaicher, bei denen mehrere Männchen und Weibchen in das Fortpflanzungsverhalten eingebunden sind 75 . In der Natur scheint die Fortpflanzung saisonal unterschiedlich zu sein, wobei die Paarungszeit mit der Monsunperiode einhergeht. Jedoch kommen bei in freier Wildbahn gefangenen Weibchen reife Eier über das ganze Jahr hinweg vor, was darauf hindeutet, dass die beobachtete 71 Miller NY, Gerlai R. 2011. Shoaling in zebrafish: what we don't know. Rev Neurosci 22: 17-25. Miller NY, Gerlai R. 2011. Shoaling in zebrafish: what we don't know. Rev Neurosci 22: 17-25. Spence R, Gerlach G, Lawrence C, Smith C. 2008. The behaviour and ecology of the zebrafish, Danio rerio. Biol Rev Camb Philos Soc 83: 13-34. 73 Pavlidis M, Digka N, Theodoridi A, Campo A, Barsakis K, Skouradakis G, Samaras A, Tsalafouta A. 2013. Husbandry of zebrafish, Danio rerio, and the cortisol stress response. Zebrafish 10: 524-531. 74 Castranova D, Lawton A, Lawrence C, Baumann DP, Best J, Coscolla J, Doherty A, Ramos J, Hakkesteeg J, Wang C et al. 2011. The effect of stocking densities on reproductive performance in laboratory zebrafish (Danio rerio). Zebrafish 8: 141-146. 75 Spence R, Gerlach G, Lawrence C, Smith C. 2008. The behaviour and ecology of the zebrafish, Danio rerio. Biol Rev Camb Philos Soc 83: 13-34. 72 40 International Zebrafish Medaka Course IZMC Saisonalität des Paarungsverhaltens eher mit dem zur Verfügung stehenden Futter zu tun hat und nicht ein endogenes saisonales Verhalten reflektiert. In Übereinstimmung damit legen Zebrabärblinge in Gefangenschaft Eier das ganze Jahr hindurch unter verschiedenen Photoperioden (12-14 Stunden Licht). Während es nach wie vor wenig verstanden ist, welche Signale die Wahl des Paarungspartners beeinflussen, wurde eine typische Abfolge von Verhaltungsmustern während der Paarung beschrieben 76 . Dementsprechend schwimmen Männchen und Weibchen in der gesamten Wassersäule „auf und nieder“, und das Männchen „jagt“ das Weibchen, indem es dieses häufig mit der Schnauze berührt. Es „eskortiert“ es dann zur Laichstelle, wo sie „umeinander herumschwimmen“ in einer Kopf- zu Schwanzorientierung. Das Männchen fängt dann an zu „zittern“, d. h. sein Körper oszilliert mit hoher Frequenz und niedriger Amplitude in der Nähe des Weibchens im Laichbereich. Er kann auch seinen Körper um das Weibchen herumschlingen. Die Eiablage geschieht dann in Schüben von 5 bis 20 Eiern. Beobachtungen in der Wildbahn deuten darauf hin, dass Zebrabärblinge bevorzugt im flachen Uferbereich ihres Habitats laichen und dass sie Kiesuntergrund Schlamm vorziehen – wahrscheinlich, weil die Eier besser vor Räubern geschützt werden (inklusive Kannibalismus), wenn sie zwischen die Spalten eines Kiessubstrats fallen 77. Dieses Verhalten kann man zur Eiproduktion in Gefangenschaft ausnutzen. Eine klassische Methode für die kontinuierliche Eierproduktion in Aquarien besteht darin, mit Murmeln gefüllte Schachteln in den Tank zu stellen. Die Fische paaren dann bevorzugt über dem Murmeleinsatz und die Eier können leicht jeden Morgen nach Entfernen der Murmeln geerntet werden. Eine andere Methode benutzt die Präferenz für sehr flaches Wasser, um die Eierproduktion zu erhöhen 78 . Typische Legekästen für einzelne Pärchen oder Gruppen zur Paarung bestehen in der Regel aus einem Tank mit einem Einsatz, dessen Boden durch ein Netz gebildet wird. Die Eier fallen durch das Netz in das untere Kompartiment und können daher von den Fischen nicht gefressen werden. Wenn die Einsätze nun so gekippt werden, dass sie einen Gradienten an Wassertiefe produzieren, bevorzugen die Fische die flacheren Bereiche für die Paarung. Von Bedeutung ist, dass diese Methode, die auch als „Sex-am-Strand“-Methode bezeichnet wurde, signifikant die Eiproduktion im Vergleich mit nicht geneigten Einsätzen erhöhte. Es wurden Apparate entwickelt, die diese Stimulation der Eiablage und des Paarungsverhaltens durch flaches Wasser benutzen, um sich synchron entwickelnde Eier im großen Maßstab zu gewinnen. 79. Lebenszyklus und Geschlechtsdetermination Ein Grund für die Popularität des Zebrabärblings unter Entwicklungsbiologen ist die schnelle Entwicklung der transparenten Embryonen. Bald nach Befruchtung beginnen die Teilungen der Blastodisc (Keimscheibe), die auf der großen Dotterzelle sitzt. Es folgen morphogenetische Bewegungen wie Epibolie, Gastrulation und Konvergenz76 Darrow KO, Harris WA. 2004. Characterization and development of courtship in zebrafish, Danio rerio. Zebrafish 1: 40-45. Sessa AK, White R, Houvras Y, Burke C, Pugach E, Baker B, Gilbert R, Thomas Look A, Zon LI. 2008. The effect of a depth gradient on the mating behavior, oviposition site preference, and embryo production in the zebrafish, Danio rerio. Zebrafish 5: 335-339. 77 Spence R, Ashton R, Smith C. 2007. Oviposition Decisions Are Mediated by Spawning Site Quality in Wild and Domesticated Zebrafish, Danio rerio. Behaviour 144: 953-966 78 Sessa AK, White R, Houvras Y, Burke C, Pugach E, Baker B, Gilbert R, Thomas Look A, Zon LI. 2008. The effect of a depth gradient on the mating behavior, oviposition site preference, and embryo 79 Adatto I, Lawrence C, Thompson M, Zon LI. 2011. A new system for the rapid collection of large numbers of developmentally staged zebrafish embryos. PLoS ONE 6: e21715. 41 International Zebrafish Medaka Course IZMC Extension, die die Hauptachsen des Embryos bis ungefähr 10 Stunden nach der Befruchtung geformt haben 80. Die hauptsächlichen Organsysteme bilden sich über die nächsten 24 bis 36 Stunden, und nach 48 bis 72 Stunden erfolgt das Schlüpfen. Die geschlüpften Embryonen, die nun als Eleuthero-Embryonen bezeichnet werden, beziehen nach wie vor ihre Nahrung aus dem Dotter 81. Nach 120 Stunden (5 Tage nach Befruchtung, TnB) beginnt aktives Fressverhalten, und das frei fressende Larvenstadium ist erreicht. Nach weiteren 25 Tagen (30 TnB) ist die Metamorphose erfolgt 82 . Die Flossenfalten der Larve wurden in das adulte Flossenschema umgewandelt und auch das Pigmentmuster entspricht nun dem eines erwachsenen Zebrabärblings. Dieses Stadium wird als das Juvenil-Stadium bezeichnet. Ungefähr zur gleichen Zeit (23 bis 25 TnB) gibt es die ersten Anzeichen von sexueller Differenzierung auf histologischem Niveau in den Gonaden. Die juvenile Gonade beginnt sich bei den Männchen von einem sogenannten „juvenilen Eierstock“-Stadium in den Hoden umzuwandeln 83. 3 Monate nach der Befruchtung (in der Wildnis kann dies auch bis zu 6 Monate dauern 84) ist die sexuelle Reife erreicht und der Fisch ist ein voll ausgewachsenes adultes Tier geworden. Die maximale Lebensspanne unter Laborbedingungen kann zwischen 4 und 6 Jahren betragen, in Abhängigkeit vom Stamm 85. Jüngere Analysen mit mehreren verschiedenen Laborstämmen, von denen einige erst kürzlich aus Wildfängen gewonnen wurden, konnten eine geschlechtsbestimmende Region auf dem Chromosom 4 lokalisieren (Wilson et al., 2014). Diese Region scheint die Grundlage für ein Geschlechstbestimmungssystem vom Typ WZ/ZZ zu bilden, in dem das heterogametische Geschlecht (WZ) weiblich ist (im Gegensatz zum bekannten XY-System, wo das heterogametische Geschlecht männlich ist). Interessanterweise ging diese Chromosomregion in mehreren klassischen Laborstämmen verloren, darunter TÜ und AB (aber nicht in WIK). In diesen haben alternative Geschlechtsbestimmungsmechanismen ihre Funktion ersetzt. Es ist noch unbekannt, wie diese alternativen Mechanismen aussehen, ob sie auch eine Funktion in Wildpopulationen haben, und wie sie das Fortpflanzungsverhalten oder andere Aspekte der Biologie in diesen Laborstämmen beeinflussen könnten. 80 Kimmel CB, Ballard WW, Kimmel SR, Ullmann B, Schilling TF. 1995. Stages of embryonic development of the zebrafish. Dev Dyn 203: 253-310. 81 Strahle U, Scholz S, Geisler R, Greiner P, Hollert H, Rastegar S, Schumacher A, Selderslaghs I, Weiss C, Witters H et al. 2012. Zebrafish embryos as an alternative to animal experiments--a commentary on the definition of the onset of protected life stages in animal welfare regulations. Reprod Toxicol 33: 128-132. 82 Parichy DM. 2003. Pigment patterns: fish in stripes and spots. Curr Biol 13: R947 950. 83 Orban L, Sreenivasan R, Olsson PE. 2009. Long and winding roads: testis differentiation in zebrafish. Mol Cell Endocrinol 312: 35-41. Takahashi H. 1977. Juvenile Hermaphroditism in the Zebrafish, Brachydanio rerio. Bull Fac Fish Hokkaido Univ 28: 57-65. 84 Engeszer RE, Patterson LB, Rao AA, Parichy DM. 2007. Zebrafish in the wild: a review of natural history and new notes from the field. Zebrafish 4: 21-40. 85 Gerhard, G.S., et al., Life spans and senescent phenotypes in two strains of Zebrafish (Danio rerio). Experimental gerontology, 2002. 37(8-9): p. 1055-68 42 International Zebrafish Medaka Course IZMC 4.2 Die Biologie des Medakas (Oryzias latipes)86 (Felix Loosli) Medaka ist ein kleiner Süßwasserfisch, der in Japan, Taiwan und Korea und China beheimatet ist. Als ein Mitglied der Familie Adrianichthyidae in der Klasse Beloniformes ist der Medaka eng mit dem Pufferfisch (Tetraodon und Fugu) und Stichling verwandt. Zebrafisch und Medaka sind circa 150 Millionen Jahre vom letzten gemeinsamen Vorfahren getrennt - einer evolutionären Distanz, die ungefähr der Distanz zwischen Mensch und Hühnchen entspricht. Die Gattung Oryzias umfasst mehr als 20 Spezies, die weit über Südost- und Westasien verteilt sind und in vielen verschiedenen tropischen und gemäßigten Habitate heimisch sind. Medaka gehört zur Klasse der Actinopterygii (Strahlenflosser) und besitzt daher knöcherne Strahlenflossen welche die Flossen stabilisieren. Diese Flossenstrahlen sind direkt mit dem Flossenbasisskelett verbunden. Medaka besitzt eine Schwanzflosse eine Rückenflosse, paarige Bauchflossen welche als homolog zu den Hinterbeinen der Tetrapoden gelten, sowie paarige Brustflossen. Die Physiologie von Medaka ist in vieler Hinsicht vergleichbar mit der anderer Wirbeltiere (Iwahashi et al. 2009). Deshalb wird Medaka oft als Modelsystem für Toxizitätstests von Chemikalien verwendet. Habitat und Biologie Medaka ist in ganz Japan verbreitet mit Ausnahme der Hokkaido-Insel und lebt in kleinen Flüssen, Bächen und Reisfeldern. Medaka kann auch Brackwasser vertragen. In Japan ist der Medaka in zwei unterschiedlichen Gruppen unterteilt: die nördliche Population der nördlichen Region der Insel Honshu und die südliche Population der südlichen Region von Honshu sowie der Inseln Kyushu, Chikugo und Okinawa. Die Trennung in eine nördliche und eine südliche Population erfolgte vor ungefähr 4 Millionen Jahren. Aufgrund von morphologischen Kriterien wurde die nördliche Population als eine unabhängige Art klassifiziert (Oryzias sakaizumii). Die Divergenz von Oryzias latipes und Oryzias sakaizumii wird auf 4mya geschätzt. Dies widerspiegelt sich auch in der hohen Rate von Polymorphismen von 1-4% (Spivakov et al. 2014). Unter Laborbedingungen paaren sich Oryzias latipes und Oryzias sakaizumii. Die Männchen und Weibchen der F2 Hybride, die von einer solchen Kreuzung stammen, sind vollständig fertil. Das ist für genetische Zwecke besonders bedeutsam, da es erlaubt, Polymorphismen in einen anderen genetischen Hintergrund einzukreuzen. Dieser Ansatz der Kreuzung von südlichen und nördlichen Inzuchtlinien wird häufig genutzt, um Mutationen oder ein spezifisch phänotypisches Merkmal genetisch zu kartieren. Die Grenze, welche die nördliche und südliche Population trennt, korreliert mit der geografischen Schranke. Daher sind die zwei Gruppen nicht sympatrisch (d. h. ihre Habitate überlappen nicht). Jedoch wurde Anzeichen von Introgression (Genfluss) zwischen diesen Gruppen entlang der gemeinsamen Grenze gefunden. Medaka hat einen diploiden Karyotyp mit 48 Chromosomen. Die haploide Genomgröße beträgt ungefähr 700 Mb, die Hälfte des Genoms des Zebrafisches. Adulte können eine 86 An excellent source of information is the book ‘A laboratory manual for medaka biology’, Wiley-Blackwell 2009. Takeda, H. and Shimada, A. (2010). The art of medaka genetics and genomics: what makes them so unique? Annu Rev Genet 44, 217–241. Shima, A. and Mitani, H. (2004). Medaka as a research organism: past, present and future. Mech Dev 121, 599–604. Wittbrodt, J., Shima, A. and Schartl, M. (2002). Medaka--a model organism from the far East. Nat Rev Genet 3, 53– 64. 43 International Zebrafish Medaka Course IZMC Länge von bis zu 4 cm erreichen. Medaka - wie viele andere Knochenfische - hat 4 Typen von Pigmentzellen (Chromatophoren), schwarze Melanophoren, weiße Leukophoren, rot-gelbe Xantophoren und silbrige Iridophoren. Die natürliche Pigmentation ist grau-braun. Der japanische Medaka lebt in gemäßigten Zonen mit ausgeprägten Jahreszeiten und kann einen weiten Bereich von Temperaturen (4 bis 40°C) ertragen. Daher kann die Rate der Embryonalentwicklung durch die Umgebungstemperatur kontrolliert werden. Embryonen tolerieren 4°C, obgleich ihre Entwicklung bei dieser Temperatur fast vollständig arretiert ist. Die Lebensspanne von Medaka unter konstanten Zuchtbedingungen im Labor ist ungefähr 12 Monate. Diese kann auf 2 Jahre verlängert werden unter Lichtbedingungen, wo die Fische sich nicht paaren, in Kombination mit einer reduzierten Temperatur (z. B. 10 Stunden Licht, 14 Stunden Nacht bei 19°C, s.u.). Verhalten Medaka ist tagaktiv mit hoher locomotor (Schwimm-) Aktivität während der Hellphase. Die Fressaktivität ist auch tagsüber und gleichmässig über die ganze Hellphase verteilt. Medaka paaren sich hauptsächlich zu Beginn der Hellphase. Medaka ist in einer gemässigten Zone mit ausgeprägten Jahreszeiten heimisch und zeigt saisonales Paarungsverhalten wobei die Hellphase deutlicher länger als die Dunkelphase sein muss damit sich Medakas paaren. Die Temperatur hat nur einen schwachen Einfluss auf das Paarungsverhalten (Koger et al. 1999). Medaka ist ein soziales Tier und sollten aus diesem Grund nicht über längere Zeit als isolierte Einzeltiere gehalten werden. Medaka toleriert jedoch kurze Phasen der Isolation ohne Stress oder Anzeichen von Leiden. Medaka wird auch in Verhaltensstudien als Modelsystem untersucht. Verschiedene Verhaltenstests wurden etabliert um die zugrundeliegende Genetik dieser komplexen Eigenschaften zu analysieren (Okuyama et al. 2014; Tsuboko et al. 2014). Medaka, ein genetischer Modellorganismus Die Medaka-Zucht ist ein traditionelles Hobby in Japan, die bis in das 16. und 17. Jahrhundert zurückdatiert. Dementsprechend gibt es natürliche Pigmentationsmutationen, die über die Jahrhunderte isoliert wurden und die Grundlage für genetische Studien legten. In 1921 wurde die Mendelsche Vererbung dieser Merkmale nachgewiesen inklusive der geschlechtsgekoppelten Vererbung. Da Medaka einen klaren Geschlechtsdimorphismus zeigt, ist die Medaka-Geschlechtsbestimmung in großen Details studiert worden und führte zur Entdeckung des männlichen Determinationsgens DMY. Medaka ist sehr tolerant im Hinblick auf Inzucht. Über die Jahrzehnte wurde eine große Zahl von Wildfängen gesammelt und als Laborstämme und hoch-ingezüchtete Stämme etabliert, die in manchen Fällen über mehr als 80 Generationen durch Bruder/Schwester-Kreuzung ingezüchtet wurden und deshalb isogen sind. Gegenwärtig gibt es ungefähr 14 Inzuchtstämme und mehr als 60 Wildtypstämme aus den Nord- und Süd-Populationen (NBRP Zentrum für Medaka Stämme in Okazaki, Japan; http://www.shigen.nig.ac.jp). Medaka als Modellsystem ist daher besonders geeignet für genom- und populationsgenetische Studien. Die etablierten Medaka Inzuchtstämme unterscheiden sich in Morphologie, Verhalten und Physiologie (Takeda and Shimada 2010; Tsuboko et al. 2014). Diese Unterschiede sind subtil und erfordern deshalb keine speziellen Anforderungen bezüglich Zucht und Haltung. Es ist jedoch wichtig, dass man potentielle Einflüsse auf wissenschaftliche Studien in Betracht sieht und sie deshalb bei der Planung von Experimenten berücksichtigt. Die Verbreitung von Medaka über ein grosses Gebiet das leicht zugänglich ist erlaubt es Forschern, neue Wildfänge zu 44 International Zebrafish Medaka Course IZMC sammeln, zu analysieren und zu evaluieren, wie z.B. um die Interaktion einer Population mit ihrem Habitat zu untersuchen. Beschaffung und Transport Wie oben beschrieben sind über das Medaka Resourcenzenter in Okazaki eine grosse Anzahl von Wild- und Inzuchtstämme erhältlich. Deshalb sind ausser für Populationsgenetische Feldstudien in den meisten Fällen keine Wildfänge nötig. Medaka sind sehr anspruchslose Fische und einfach zu züchten. Die Generationszeit ist für die meisten Stämme bei 280C. Somit ist es einfach eine ausreichende Zahl von adulten Fische zu halten, wodurch in vielen Fällen der Versand von Medaka unnötig ist. Adulte Medaka lassen sich ohne Probleme transportieren; aus diesem Grund wurden sie auch als Knochenfisch Model für Weltraumflüge gewählt (siehe unten). Adulte Medaka sollten in passenden Behältern transportiert werden, welche die Fische schützen und Temperaturschwankungen verhindern, wie zum Beispiel geschlossene Kunststoffbehälter in Styroporschachteln. Der Behälter (2 Liter für bis zu 5 adulte Medaka) sollte bloss zur Hälfte gefüllte werden um ausreichende Sauerstoffversorgung zu gewährleisten. Vor dem Transport sollten die Fische 24 Stunden nicht gefüttert werden, ansonsten werden Fäkalien das Wasser unnötig belasten. In den meisten Fällen ist es jedoch nicht notwendig agulte Medaka zu verschicken. Die externe Befruchtung und die extrauterine Entwicklung der dotterreichen Eier ermöglichen einen unproblematische Transport von befruchteten Eiern. Der Embryo ist gut geschützt durch das harte Chorion. Zudem schlüpfen Medaka Larven erst nach 7 bis 10 Tage bei 280C. Somit sind auch längere Transportzeiten möglich bevor die empfindlichen Medaka Larven schlüpfen. 1994 wurden 4 Medaka-Fische an Bord des Space Shuttle Columbia in einer 14-Tage Raumexpedition mitgenommen. Die Fische paarten sich im Weltall und produzierten gesunde Nachkommen, die im Orbit schlüpften. Somit war gezeigt, dass Schwerkraft nicht notwendig ist für die Embryonalentwicklung. Somit repräsentiert Medaka den ersten Vertebraten, der sich im Weltall gepaart hat. In 2012 kehrte Medaka zurück ins Weltall an Bord der Sojus TMA-06M Raumschiffes und wurde in der internationalen Space-Station ISS Raumstation gehalten. Dieses Mal lag der Fokus auf dem Studium des Einflusses von Schwerkraft auf die Knochenbildung. Paarung und Frühentwicklung Medaka legen Eier entsprechend der Photoperiode, d. h. in der freien Wildbahn findet die Reproduktion im Sommer statt. Daher werden sich Medaka nur paaren wenn die tägliche Lichtperiode länger ist als die Nachtperiode. Im Labor, wie auch in der freien Wildbahn werden sich Medaka unter 14 Stunden Licht- und 10 Stunden Dunkel Bedingungen jeden Tag paaren. Jedoch wird kontinuierliche Paarung für mehr als 2 Monate die Fische erschöpfen. Männchen und Weibchen sollten für mehrere Wochen getrennt werden, um eine zu hohe Belastung zu vermeiden und wenn möglich unter Nicht-Reproduktionsbedingungen (d. h. 10 Stunden Licht, 14 Stunden Dunkel) gehalten werden. Wie im Zebrabärbling paaren sich Medaka bei Beginn der Lichtperiode. Das Paarungsverhalten besteht aus einer festen Sequenz von Verhaltensmustern, in denen das Männchen sich dem Weibchen der Wahl nähert und versucht dieses zur Paarung zu bewegen. Diese Sequenz beinhaltet die Annäherung an das Weibchen und das Schwimmen im Kreis unter dem Weibchen. Wenn das Weibchen positiv auf den männlichen Tanz antwortet, erlaubt sie diesem die Annäherung. Das Paar schwimmt dann Seite an Seite, woraufhin das Männchen mit seiner dorsalen Flosse das Weibchen umfasst. Das Weibchen scheidet dann die Oozyten aus, die anschliessend 45 International Zebrafish Medaka Course IZMC vom Männchen befruchtet werden während sie noch am Weibchen hängen. Das Weibchen trägt die Eier für mehrere Stunden mit sich bevor sie abgestreift werden. Das Gelege ist normalerweise 10 bis 40 Eier groß – abhängig von der Größe und dem Alter des Weibchens. Unter Laborbedingungen kann sich ein Männchen mit mehreren Weibchen pro Tag paaren. Die Eigröße von Medaka ist ungefähr 1,2 mm. Unbefruchtete Eier sind anfänglich weisslich trübe und undurchsichtig und werden erst nach der Befruchtung vollständig transparent; daher ist es leicht, unbefruchtete Eier in einem Gelege zu erkennen. Bei 28°C beginnt die Gastrulation ungefähr nach 10 Stunden, die Neurulation nach 20 Stunden und Organogenese nach ungefähr 1,4 Tagen. Medaka schlüpft nach 7 bis 8 Tage als voll entwickelter Jungfisch. 46 International Zebrafish Medaka Course IZMC 5. Haltung, Züchtung und Fütterung 5.1 Zebrabärbling (Thomas Dickmeis) Herkunft und Transport Zebrabärblinge können leicht im Labor gehalten und gezüchtet werden. Deshalb ist es im Allgemeinen nicht notwendig, Wildfänge zu erwerben, und die EU-Direktive 2010/63/EU verlangt, das Zebrabärblinge zu Forschungszwecken gezüchtet werden müssen. Der Transport von Fischen zwischen Anlagen ist z.B. nötig für die Verteilung von Mutanten oder transgenen Linien. Von Experimenten mit simuliertem Transport wurde berichtet, dass die Fische sowohl unmittelbar nach dem Verpacken als auch bei der „Ankunft“ erhöhte Werte von Cortisol und anderen Stressmarkern aufwiesen (Dhanasiri et al., 2013). Dieselbe Studie zeigte an, dass die Anwendung eines nitrifizierenden bakteriellen Konsortiums während des simulierten Transports die Akklimatisierung beschleunigen könnte, allerdings steht eine weitergehende Bewertung der möglichen Vorteile einer solchen Behandlung noch aus. Wenn man der etablierten Praxis folgt, scheinen Zebrabärblinge sogar auf Langstreckenflügen gut zu reisen und zeigen ein gesundes Aussehen bei der Ankunft Abb. 12: Schema eines Zirkulierenden (Reed and Jennings, 2011). Eine dem Versenden Wassersystems (freundlich zu Verfügung gestellt von Aqua Schwarz, Göttingen) von adulten Tieren oft vorzuziehende Alternative ist das Verschicken von gebleichten Embryos, die während des Transports schlüpfen. Das vermeidet mögliche Bedenken bezüglich eines tiergerechten Transports und reduziert das Risiko einer Verbreitung von Krankheiten in die empfangenden Labore. Zucht und Pflege Für Forschung, die Fische in kleinen Kolonien benötigt, können Fischtanksysteme (inklusive 13: Das Tanksystem des “European Filtersystem, Lichtund Hitzeregulation) Abb. Zebrafish Resource Centre” am KIT. kommerziell erworben werden. Ein professionelles Aquariumssystem ist von Nöten, wenn größere Mengen an Mutanten und transgenen Fischen gehalten werden sollen. Es gibt einige Firmen, die solche Systeme vertreiben (siehe auch unten, 5.2). Diese Systeme können auf fest installierten Aquarienboxen beruhen, aber auch flexible Elemente einsetzen, bei denen Plastiktanks auf Regalen an das Wassersystem angeschlossen werden können. Alle diese Systeme besitzen einen zirkulierenden Wasserfluss, bei dem das Wasser in die Aquarienboxen geleitet und über einen Überlauf gesammelt wird. Abfälle wie Fäkalien, Ammoniak und Nitrit werden über einen biologischen Filter entfernt. Das so gereinigte Wasser wird wieder in die Tanks geleitet. 47 International Zebrafish Medaka Course IZMC In diesen Systemen wird das Wasser, bevor es wieder in das Reservoir geleitet wird, auch regelmäßig mit UV-Licht bestrahlt, um Pathogene und Algenwuchs zu minimieren. Normalerweise wird pro Tag 5% frisches Wasser hinzugefügt, um Verdunstung zu kompensieren und Abfälle zu verdünnen. Zirkulierende Wassersysteme brauchen keine speziellen Vorkehrungen zur Sauerstoffzufuhr, da die permanente Wasserbewegung und die Passage über einen Trockenfilter dafür sorgen, dass genug Sauerstoff gelöst wird. Je nach örtlicher Wasserqualität benutzen einige Labore Leitungswasser ohne spezielle Aufbereitung. Allerdings sind Spuren von Chlor in Leitungswasser sehr giftig für Fische. Meistens ist es daher notwendig, Chlor durch einen Aktivkohlefilter großer Kapazität zu entfernen. Falls das Wasser zu viel Kalziumkarbonat enthält, muss es mit entsalztem Wasser gemischt werden. Mit dem System verbundene Rohre sollten nicht galvanisiert oder aus Kupfer sein, da herausgelöste Schwermetalle toxisch für die Fische sind. Für optimale Wasserbedingungen wird eine Leitfähigkeit von 250 bis 600 µS und ein pHWert von 6,5 bis 8 (Tab.2) gebraucht. Alternativ setzen einige Einrichtungen deionisiertes Wasser ein, dem eine definierte Salzmischung zugesetzt ist. Eine wöchentliche Überwachung dieser Parameter (Leitfähigkeit, pH-Wert, Nitrit und Nitrat) ist zu empfehlen. Der Zebrafisch stammt aus den Tropen, daher sollte die Wassertemperatur zwischen 26 und 29°C liegen. Um die Wassertemperatur aufrechtzuerhalten, ist es ausreichend, den Raum zu heizen. Alternativ können auch Heizstäbe in den Wasserreservoirs eingesetzt werden. Normalerweise kommt es zu einem Gradienten der Wassertemperatur zwischen den oberen und den unteren Tanks. Des Weiteren erhöht die Zirkulation des Wassers im Regal die Wassertemperatur leicht. Daher müssen Temperaturmessungen an verschiedenen Stellen des Systems durchgeführt werden. Da Zebrabärblinge Schwarmfische sind, hält man gewöhnlich 5 Fische pro Liter Wasser, aber eine höhere Anzahl von Fischen ist auch möglich, ohne dass diese Zeichen von Stress zeigen (s. Kapitel 4.1). Zebrafische können auch einzeln und in Paaren gehalten werden. Dies kann aus experimentellen Gründen notwendig sein, da geeignete Markierungsmethoden nicht existieren (Reed and Jennings, 2011).Geschieht dies jedoch über einen längeren Zeitraum, können sie in der Isolation Fett ansetzen und ihre Fruchtbarkeit verlieren. Gruppenhaltung mit verschieden pigmentierten Stämmen ist ein einfaches Mittel, den Fisch von Interesse im Schwarm zu erkennen und ihm gleichzeitig Tankgenossen für das Schwarmverhalten zu bieten. Es gibt momentan keine klaren Hinweise, dass Umgebungsanreicherungselemente wir künstliche Pflanzen zur tiergerechten Haltung von Zebrabärblingen beitragen (siehe Kapitel 4.1). Solche Elemente scheinen eher das Gesundheitsmanagement zu behindern, indem sie die Inspektion der Fische und Reinigung der Anlage erschweren. 48 International Zebrafish Medaka Course IZMC Zebrafische werden im Allgemeinen unter einem 14 Stunden Licht-/ 10 Stunden Dunkelheit- Zyklus gehalten. Sie laichen problemlos in Gefangenschaft. Das Laichen wird gewöhnlich initiiert, sobald morgens das Licht angeht, und dauert ein paar Stunden. Da Zebrafische oft ihre eigenen Eier auffressen, Abb. 14: Laichschale sammelt man befruchtete Eier am besten in einer Laichschale (Abb.14). Diese enthält ein Bodengitter, durch das die Eier in den unteren Teil des Tanks fallen können. Dort können sie von den Eltern nicht mehr erreicht werden. In diesen Tanks können die Fische paarweise oder in Gruppen verpaart werden. Durch das Sammeln der Eier in festgelegten Zeitintervallen für bis zu zwei Stunden nach dem Lichteinschalten erhält man so leicht mehrere Gruppen sich synchron entwickelnder Eier. Um die Fruchtbarkeit zu erhalten, wird angeraten, für längere Zeitperioden nicht öfter Abb. 15: “Posthornschnecke” als einmal alle 1-2 Wochen zu kreuzen (Reed and Jennings, Planorbarius corneus halten die Tanks sauber. 2011). Die Zebrafische am EZRC werden zweimal täglich mit Flockenfutter, Pellets und frisch geschlüpften Artemienlarven (Nauplii) gefüttert. Zebrabärblinge bevorzugen an der Oberfläche schwimmendes Futter oder Futter im Wasser. Allerdings werden die Artemienlarven auch eifrig in der gesamten Wassersäule gejagt, und dieses durch das Lebendfutter stimulierte Beutefangverhalten kann als eine effektive Form von Umgebungsanreicherung angesehen werden. Generell muss man darauf achten, nicht zu überfüttern, da dies zu Pilzbefall am Tankboden führen kann. Daher müssen Futterreste und Ausscheidungen regelmäßig entfernt werden. Alternativ können auch Schnecken (z.B. Posthornschnecke, Planorbarius corneus) in die Tanks eingesetzt werden (Abb.15). Diese setzen das Futter in granulare Reste um, die leicht aus dem Tank entfernt werden können. Zusätzlich beseitigen die Schnecken Algen, die auf den Tankwänden wachsen. Posthornschnecken können in Tierhandlungen oder über das EZRC erworben werden. Sie können schon als Eier dem System zugeführt werden, diese müssen vorher jedoch gebleicht werden (siehe Praktischer Teil, Kapitel 8), um Krankheitserreger abzutöten Zebrafische erreichen ihre Geschlechtsreife bei einem Alter von 2,5 bis 3 Monaten und können leicht 3 Jahre alt werden. Ihre Wachstumsrate hängt von der Anzahl der Tiere im Tank ab. Auch die sexuelle Differenzierung von Jungtieren wird dadurch beeinflusst. Bei einer geringeren Anzahl von Fischen entwickeln sich die Fische eher zu Weibchen, während eine größere Anzahl männliche Ausprägung begünstigt. Mit zunehmendem Alter erreichen die Fische eine Seneszenzphase, die durch charakteristische Veränderungen der Körperform gekennzeichnet ist. Ältere Fische, die nicht mehr fruchtbar sind, können Krankheiten übertragen und sollten mit den im Kapitel 6 beschriebenen Methoden entfernt werden. 49 International Zebrafish Medaka Course IZMC 5.2 Medaka Haltung und Züchtung 87 (Felix Loosli) Medaka kann in handelsüblichen Aquarien ohne Wasserzirkulation gezüchtet werden. Unter diesen Bedingungen können die Fische bis zu einer Dichte von 1-2 Fischen pro Liter gehalten werden. Für optimale Bedingungen sollte ein Aquariensystem mit Wasserzirkulation benutzt werden, bei dem bis zu 5 Medaka pro Liter eingesetzt werden können. Wird eine Belegungsdichte von 5 adulten Medaka pro Liter in einem Zirkulationssytem überschritten kann das Stress der Fische zur Folge haben was Wachstum und Fekundität negativ beeinflusst. Optimale Paarungsbedingungen erhält man, wenn ein Männchen mit vier bis sechs Weibchen in 4-6 Liter-Tanks gehalten werden. Medaka sind soziale Tiere und Haltung einzelner Adulter in Isolation über längere Zeiträume (mehrere Wochen) sollte deshalb vermieden werden. Verschiedene Firmen bieten Aquariensystem mit Wasserzirkulation an: Müller & Pfleger, Rockenhausen/Deutschland; AquaSchwarz, Göttingen/Deutschland; Techniplast, Buguggiate/Italien; AquaticHabitats, Apopka/USA. Ein zirkulierender Wasserfluss ist allen diesen Systemen gemeinsam. Dieser wird mit biologischen Filtern zur Aufrechterhaltung der Wasserqualität und der Anreicherung von Sauerstoff kombiniert Fig. 19). Zusätzlich kann das Wasser durch den Einsatz von UV- Bestrahlung sterilisiert werden. Die Tankgröße für Medaka kann von 3 bis zu 15 Liter variieren, ja nachdem, ob die Tanks für die Aufzucht von Jungtieren (3l) für die Paarung (6l) oder die Haltung erwachsener Tiere für den Bestand gebraucht werden. Die Standardbedingungen für Medaka-Haltung sind eine Wassertemperatur von 26°C, ein pH-Wert von 6,8-7,2, Ammoniak und Nitrit < 2ppm, Nitrat <50ppm. Medaka tolerieren eine weite Spanne von Salzkonzentration im Wasser von 200-600 µS/cm. Reverse Osmose kann für die Erhaltung einer guten Wasserqualität eingesetzt werden. Zum Wasser wird dann soviel Mineralsalz hinzugegeben, dass die Konzentration 0.3-0.5% beträgt. Alternativ kann Abb.16: Medaka Tanks am EZRC deionisiertes Wasser, gemischt mit Leitungswasser benutzt werden, z.B. 70% entsalztes Wasser und 30% Leitungswasser. Dadurch erhält man eine gesteigerte Karbonat-Pufferkapazität des Wassers, je nach Wasserhärte. Falls nötig sollte Chlor mit Kohlefiltern entfernt werden. Zusätzlich kann das Wasser mit Spurenelementen angereichert werden (z.B. MikroSal, 100 ml/1000l). Beim EZRC werden Leitungswasser und deionisiertes Wasser zu einer Endkonzentration 300 µS/cm (Leitfähigkeit) gemischt, dann 8 g/1000 l Mineralsalz und 100 mg/l Spurenelemente hinzugefügt. Das führt zu einem Wasser mit einem pH-Wert von 7 und einer Leitfähigkeit von 300-320 µS/cm. Es ist wichtig, dass keine plötzlichen Änderungen der Wasserbedingungen auftreten. Daher sollte ein Wasseraustausch nicht mehr als 30% der Gesamtmenge betragen. Es ist besser, kleinere Volumen Wasser in kürzeren Zeitabständen auszutauschen, wie z.B. 10% jede Woche. Mit stabilen Wasserbedingungen, angepasster Fütterung und Schnecken, die den Algenbewuchs reduzieren und Reste des Futters beseitigen, ist eine Tankreinigung alle 3-4 Wochen 87 Details: ‘A Laboratory Manual for Medaka Biology’, Eds. Kinoshita, Murata, Naruse and Tanaka; Wiley-Blackwell 2009. ISBN 978-0-8138-0871-0 50 International Zebrafish Medaka Course IZMC nötig (z.B. Entfernen von Algen und Abfällen auf dem Tankboden, Säubern der biologischen Filter, 20% Wasseraustausch). Die Wasserparameter wie pH-Wert, Leitfähigkeit, Wasserhärte, Nitrit und Nitrat sollten jede Woche einmal kontrolliert werden. In den meisten Fällen können Medaka zusammen mit Zebrafischen im System gehalten werden, da die Anforderungen an Wasser, Licht und Futter sich sehr ähneln. Mit den in der Tabelle 2 beschriebenen Parametern, beträgt die Lebensspanne eines Medaka rund 1 Jahr. Medaka können auch unter 10 Stunden hell/14 Stunden dunkel Zyklen gehalten werden, (10L:14D), aber unter diesen Bedingungen findet keine Paarung statt und der Lebenszyklus verlängert sich auf bis zu 2 Jahre. In Medaka Fischzuchtanlagen wird auf die Verwendung von Pflanzen und Objekten zur Bereicherung der Aquarien verzichtet. Dies kann zu grossen Probleme durch Kontamination führen. Besonders Pflanzen lassen sich nicht sterilisieren. Zudem sind solche Bereicherungen ein Hindernis bei der Reinigung und führen dadurch zu zusätzlichen Stress für die Fische da sie die Reinigung unnötig behindern. Lichtzyklus 14h Licht/ 10 Stunden dunkel Medaka sind Kälte/Wärmezonen empfindlich und zeigen ein photoperiodisches Verhalten. Für die Paarung sind lange Tage und kurze Nächte notwendig. Wasseraufbereitung Zirkulierendes Wassersystem, mit Filter, Biofilter und UVEinheit Alle 3-4 Wochen ist ein Wasseraustausch von 20% erforderlich (nicht 30% auf einmal Austauschen) Wasserqualität 26°C, pH: 6,8-7,2, Ammoniak und Nitrit <2ppm, Nitrat <50ppm, 200-600 µS/cm Medaka tolerieren ein breites Spektrum von Salzkonzentrationen, plötzliche Änderungen sollten jedoch vermieden werden Besetzung 5 erwachsene Fische pro Liter Wasser (hängt von den Filterbedingungen und Tankgröße ab) Ausgestaltung wird nicht als wichtig angesehen (Pflanzen etc..) Gestaltung des Aquariums Fütterung Mischung aus trockenem Futter und frisch geschlüpften Artemien Medaka, die 10h im Licht und 14 h im Dunkeln gehalten werden, paaren sich nicht. Diese Zyklen können für die Erhaltung des Bestanden genutzt werden, da Medaka unter diesen Bedingungen auch älter werden. pH-Wert, Nitrat, Nitrit und Leitfähigkeit müssen regelmäßig (1x die Woche) überprüft und plötzliche Schwankungen vermieden werden In gerade angesetzten Aquariensystemen öfters überprüfen, sonst in längeren Abständen Die Belegungsdichte hängt vom Aquarientyp und Filteranlage ab. Es gibt keine Hinweise, dass die Fische von einer Ausgestaltung des Aquariums profitieren und diese wahrnehmen Junge Fische sollten in der ersten Woche nach dem Schlüpfen nur mit Trockenfutter gefüttert werden 51 Eine Ausgestaltung der Tanks z.B. mit natürlichen oder künstlichen Pflanzen kann hygienische Probleme hervorrufen Erwachsene Tiere und Jungtiere sollten 2-4 mal pro Tag mit kleineren Mengen gefüttert werden. Überfütterung beeinflusst die Wasserqualität International Zebrafish Medaka Course IZMC Temperatur 25-28°C für alle Fischstadien, um die Fortpflanzungsaktivität von Medaka zu erhalten Einzelhaltung Akzeptabel Laichen Medaka paaren sich unter guten Bedingungen täglich (14/10h Lichtzyklus, 2528°C) Kürzere Tage und niedrigere Temperaturen verringern die Paarungsrate Medaka (eurythermal) können Temperaturen zwischen 4-40°C aushalten. Tiefe Temperaturen verlangsamen die Entwicklung, sind aber nicht schädlich Ein Männchen kann sich mit 4-6 Weibchen innerhalb von 30 min paaren, auch wenn die Fische vorher getrennt waren (Faulprozesse) Medaka sind in der Wildnis großen Temperaturschwankungen ausgesetzt (4-40°C) Medaka sind soziale Tiere und längere Haltung in Gruppen von 4 Fischen in reduziert Stress (Einzelhaltung kann vorkommen, da man einzelne Fische oft nicht auseinanderhalten kann) Wenn Männchen und Weibchen zusammen gehalten werden, findet die Paarung bei Tagesbeginn statt Tabelle 2: Medaka Züchtungsbedingungen Fütterung Die Wachstumsrate ist von der Anzahl der Fische pro Tank und der Futterbereitstellung abhängig. Medaka sollten mehrmals am Tag mit kleinen Mengen gefüttert werden, die innerhalb 5-10 min gefressen werden können. Überfütterung führt zu einer Verschlechterung der Wasserqualität und löst verstärktes Wachstum der Schnecken aus. Eine Kombination von Salinenkrebsen und Trockenfutter (z.B. TetraMin Flocken) ist optimal. Wir füttern Flocken am Morgen und Abend und Krebse um die Mittagszeit. Krebse können auch an Jungtiere ab zwei Wochen nach dem Schlüpfen verfüttert werden. Die Fütterung mit lebenden Salinenkrebsen wird als Bereicherung betrachtet, da dies das natürliche Fress- und Jagdverhalten stimuliert. Medaka-Verpaarung, Sammeln der Eier: Ein Männchen wird im zirkulierenden Wassersystem zusammen mit bis zu vier Weibchen in einen Tank (~6 l) gesetzt. Das kann entweder am Tag vor dem Eiersammeln oder am selben Tag geschehen. Für die Gewinnung von befruchteten Eiern eines bestimmten Stadiums, wie zum Beispiel für Mikroinjektion im 1-2 Zellstadium werden die Fische am besten während der ersten drei Stunden der Lichtperiode verpaart (z.B. 8.00-11.00 Uhr, wenn das Licht von 8.00- 22.00 Uhr an ist). Medaka paaren sich, sobald das Licht angeht, oder 15-30 min nachdem man sie zusammengesetzt hat. Weibchen tragen die befruchteten Eier für einige Stunden an ihrem Körper. Daher müssen die Weibchen mit einem kleinen Netz gefangen werden, um mit einem rostfreien Metallhaken die Eier vorsichtig abzustreifen. Das Weibchen muss so schnell wie möglich, spätestens aber nach 3-5 Minuten zurück in den Tank gebracht werden 52 International Zebrafish Medaka Course IZMC um unnötigen Stress oder gar Erstickung zu verhindern. Die Eier kleben aneinander, da sie Haare auf dem Chorion besitzen, und formen so kleine Haufen. Man muss den Haken vorsichtig vom Kopf zum Schwanz unter dem Körper des Weibchen bewegen, um nicht die Kiemen zu verletzen. Der abgestreifte Eierhaufen wird in eine Schale mit Embryo-Medium (ERM Embryo raising medium) überführt (maximal 30 Eier in 6 cmSchalen oder 100 Eier in 9 cm-Schalen) Frisch befruchtete Eier sehen milchig aus, werden aber innerhalb von wenigen Minuten klar. Gleichzeitig härtet auch das Chorion aus, deshalb sind frisch gelegte Eier zunächst sehr weich. Die Eiklumpen müssen vereinzelt werden (um die Sauerstoffzufuhr sicherzustellen), indem man die Eier vorsichtig mit dem Finger durch die Schale rollt. Das reißt die Haare ab und löst somit den Klumpen auf. Für die Mikroinjektion ist es besser, die Eier auf einem nassen Filterpapier zu rollen, da so mehr Haare entfernt werden. Unbefruchtete (milchig trübe) Eier werden entfernt und die Schale im Inkubator (28°C und 14/10h Lichtzyklus) inkubiert. Medaka schlüpfen unter diesen Bedingungen nach 7-8 Tagen und sind nach 8-12 Wochen geschlechtsreif, je nach Stamm und Haltungsdichte/Fütterungsweise. 88 89 90 91 92 93 88 Iwahashi H1, Kishi K, Kitagawa E, Suzuki K, Hayashi Y., Evaluation of the physiology of Medaka as a model animal for standardized toxicity tests of chemicals by using mRNA expression profiling. Environ Sci Technol. 2009 May 15;43(10):3913-8. 89 C. S. Koger, S. J. Teh, and D. E. Hinton, “Variations of light and temperature regimes and resulting effects on reproductive parameters in medaka (Oryzias latipes).,” Biol. Reprod., vol. 61, no. 5, pp. 1287–1293, Nov. 1999. 90 M. Spivakov, T. O. Auer, R. Peravali, I. Dunham, D. Dolle, A. Fujiyama, A. Toyoda, T. Aizu, Y. Minakuchi, F. Loosli, K. Naruse, E. Birney, and J. Wittbrodt, “Genomic and phenotypic characterization of a wild medaka population: towards the establishment of an isogenic population genetic resource in sh.,” G3 (Bethesda), vol. 4, no. 3, pp. 433–445, Mar. 2014. 91 T. Okuyama, S. Yokoi, H. Abe, Y. Isoe, Y. Suehiro, H. Imada, M. Tanaka, T. Kawasaki, S. Yuba, Y. Taniguchi, Y. Kamei, K. Okubo, A. Shimada, K. Naruse, H. Takeda, Y. Oka, T. Kubo, and H. Takeuchi, “A neural mechanism underlying mating preferences for familiar individuals in medaka sh.,” Science, vol. 343, no. 6166, pp. 91–94, Jan. 2014. 92 S. Tsuboko, T. Kimura, M. Shinya, Y. Suehiro, T. Okuyama, A. Shimada, H. Takeda, K. Naruse, T. Kubo, and H. Takeuchi, “Genetic control of startle behavior in medaka sh.,” PLoS ONE, vol. 9, no. 11, p. e112527, 2014. 93 H. Takeda and A. Shimada, “The art of medaka genetics and genomics: what makes them so unique?,” Annu Rev Genet, vol. 44, pp. 217–241, 2010. 53 International Zebrafish Medaka Course IZMC 6. Anästhesie, Analgesie und Euthanasie von Fischen (Thomas Braunbeck) Gemäß § 4(1) des aktuellen deutschen Tierschutzgesetztes (BGBl. I S. 1206, 1313), darf ein Wirbeltier nicht ohne wirksame Schmerzausschaltung (Anästhesie, Definition siehe unten) getötet werden. Ebenso darf jeglicher experimenteller Eingriff nicht ohne geeignete Betäubung (§§ 7, 7a) vorgenommen werden. Im Fall, dass eine geeignete Betäubung nicht möglich ist, muss der Schmerz auf ein Minimum reduziert werden (Analgesie, Definition siehe unten). Während die Betäubung von warmblütigen Wirbeltieren, Amphibien und Reptilien generell nur von einem Tierarzt vorgenommen werden darf, können experimentelle Eingriffe bei Fischen durch entsprechend geschulte und trainierte Wissenschaftler erfolgen 94 . Die Integration humaner Endpunkte in Vorschriften für Anästhesie und Euthanasie von Fischen sind ebenso wie die Diskussionen um Schmerz, Leiden und Stress bei Fischen ein aktueller, dynamischer Prozess (siehe unten). Eine aktuelle Literaturrecherche ist daher vor der Planung von Experimenten mit Fischen grundsätzlich unabdingbar. 6.1 Stress und Schmerz in Fischen Stress: Jede Handhabung und Manipulation induziert Stress bei Fischen. Die am häufigsten eingesetzten Fischarten wie Zebrabärbling, Medaka und Dickkopfelritze sind Schwarmfische, so dass bereits eine Haltung in größeren Gruppen Stresserscheinungen im Zuge der normalen Haltung oder von Manipulationen reduzieren kann. Äußere Anzeichen von Stress beinhalten Ataxie (Bewegungsstörungen) und Tachypnoea (Kurzatmigkeit, Hyperventilation). Ataxische Fische schwimmen unkoordiniert, in kurzen, sehr schnellen Schwimmstößen und ändern dabei ständig ihre Schwimmrichtung. Kurzatmige Fische zeigen eine erhöhte Ventilation der Kiemendeckel (Opercula). Weitere typische Anzeichen für chronischen Stress sind Farbänderungen sowie Veränderungen der Körperhaltung beim Schwimmen und der Raumnutzung innerhalb der Wassersäule. Fortgeschrittene Stadien der Narkose (Definition siehe unten) bringen im Allgemeinen einen Atemstillstand mit sich. Der Gasaustausch wird reduziert und führt folglich zu Hypoxie und respiratorischer Acidose, da der Sauerstoffgehalt im Blut abnimmt und gleichzeitig der CO2-Gehalt im Blut ansteigt. Als Folge des Atemstillstandes kann bei Behandlung mit fast allen Anästhetika ein Anstieg von Adrenalin und Cortisol im Blut der Fische gezeigt werden. In den meisten Fällen führt eine verlängerte 94 For general reading on anesthesia in fish, see: Carter, K.M., Woodley, C.M., Brown, R.G. (2011) A review of tricaine methanesulfonate for anesthesia of fish. Rev. Fish Biol. Fisheries 21: 51-59. Fish, R.E., Brown, M.J., Danneman, P.J., Karas, A.Z. (2008) Anesthesia and analgesia in laboratory animals, 2nd edition. Academic Press, New York. Iwama, G.K., Ackerman, P.A. (1994) Anaesthetics. In: Biochemistry and molecular biology of fishes, vol. 3 (Hochachka, P. Mommsen, T.; eds.). Elsevier Publ., pp. 1-15. Neiffer, D.L., Stamper, M.A. (2009) Fish sedation, anesthesia, analgesia, and euthanasia: considerations, methods, and types of drugs. ILAR J. 50: 343-360. Ross, L., Ross, B. (2008) Anaesthetic and sedative techniques for aquatic animals, 3rd ed. John Wiley & Sons; 240 pp. Sneddon, L.U. (2012) Clinical anesthesia and analgesia in fish. J. Exot. Pet Med. 21: 32-43. Stoskopf, M., Posner, L.P. (2008) Anesthesia and restraint of laboratory fish. In: Fish, R.E., Brown, M.J., Danneman, P.J., Karas, A.Z. (eds.) Anesthesia and analgesia in laboratory animals, 2nd ed. Academic Press, New York, pp. 519534. 54 International Zebrafish Medaka Course IZMC Aufrechterhaltung eines fortgeschrittenen Narkosestadiums Umspülen der Kiemen zum Tod (siehe unten: Euthanasie). ohne permanentes Schmerz: Seit mehr als 2 Jahrzehnten wird die Frage, ob Fische zur zentralen Schmerzverarbeitung befähigt sind, diskutiert. Zumindest jedoch exprimieren Fische sowohl Schmerz- als auch Opioidrezeptoren (mu, delta, kappa), und im Lachs konnten β-Endorphine gefunden werden, was darauf hinweist, dass Fische über eine Schmerzempfindung und die Möglichkeit zu leiden verfügen 95. 6.2 Definitionen Anästhesie (griech. αν-, an-, “ohne”; und αἴσθησις, aisthēsis, “Wahrnehmung”), beschreibt den Zustand, in dem die Wahrnehmung (inklusiv der Schmerzwahrnehmung) komplett blockiert oder temporär genommen wird (Narkose). Traditionell ist eine Anästhesie eine durch Arzneimittel hervorgerufene, reversible Form der Amnesie (Gedächtnislücke), der Analgesie (zentralnervöse Schmerzausschaltung), des Verlusts der Reaktionsfähigkeit (Relaxation), des Verlusts der Skelettmuskel-Reflexe, einer herabgesetzten Stress-Antwort, oder all dies gleichzeitig (Triade der Anästhesie). Dies kann durch die Gabe eines einzelnen Medikaments erreicht werden, das die gewünschte Kombination an Effekte herbeiführt (ausbalancierte Anästhesie). Mitunter wird eine Kombination von verschiedenen Medikamenten wie Schlafmitteln, Sedativa (Beruhigungsmitteln), Muskelrelaxanzien und Analgetika (Schmerzmitteln) verabreicht, um eine ganz spezielle Kombination von Effekten zu erhalten. Die Anästhesie erlaubt für Tiere vergleichsweise schmerz- und stressfreie Eingriffe, Operationen und andere Maßnahmen. Alternativ könnte Anästhesie daher als „reversibler Bewusstseinsverlust“ definiert werden, der die totale Bewusstlosigkeit (bspw. eine Allgemeinanästhesie oder Narkose) oder den teilweisen Bewusstseinsverlust eines bestimmten Körperteils (z.B. durch Spinalanästhesie) beinhaltet. Die schon früher existierende Bezeichnung Anästhesie wurde 1846 von Sir Oliver Wendell Holmes vorgeschlagen, um genau diesen Zustand zu beschreiben. Analgesie (griech. αν-, an-, “ohne”; und ἄλγος álgos „Schmerz” bezeichnet die Befreiung von Schmerzen, üblicherweise erzielt durch die Gabe von Medikamenten, die als Analgetikum (Schmerzmittel) wirken. Im Gegensatz zu Betäubungsmitteln unterdrücken Analgetika die Schmerzwahrnehmung, ohne dabei Bewusstsein, Sinneswahrnehmung oder andere primäre Funktionen des Zentralnervensystems zu 95 For general reading on anesthesia in fish, see: Carter, K.M., Woodley, C.M., Brown, R.G. (2011) A review of tricaine methanesulfonate for anesthesia of fish. Rev. Fish Biol. Fisheries 21: 51-59. Fish, R.E., Brown, M.J., Danneman, P.J., Karas, A.Z. (2008) Anesthesia and analgesia in laboratory animals, 2nd edition. Academic Press, New York. Iwama, G.K., Ackerman, P.A. (1994) Anaesthetics. In: Biochemistry and molecular biology of fishes, vol. 3 (Hochachka, P. Mommsen, T.; eds.). Elsevier Publ., pp. 1-15. Neiffer, D.L., Stamper, M.A. (2009) Fish sedation, anesthesia, analgesia, and euthanasia: considerations, methods, and types of drugs. ILAR J. 50: 343-360. Ross, L., Ross, B. (2008) Anaesthetic and sedative techniques for aquatic animals, 3rd ed. John Wiley & Sons; 240 pp. Sneddon, L.U. (2012) Clinical anesthesia and analgesia in fish. J. Exot. Pet Med. 21: 32-43. Stoskopf, M., Posner, L.P. (2008) Anesthesia and restraint of laboratory fish. In: Fish, R.E., Brown, M.J., Danneman, P.J., Karas, A.Z. (eds.) Anesthesia and analgesia in laboratory animals, 2nd ed. Academic Press, New York, pp. 519534. 55 International Zebrafish Medaka Course IZMC beeinträchtigen. Zudem Analgetika nicht blockiert. werden Aktionspotenziale afferenter Neuronen durch Amnesie (griech. ἀμνησία, ἀ “ohne” und μνησία “Gedächtnis”) bezeichnet eine Gedächtnisstörung, die durch Schädigungen des Gehirns, Krankheiten oder psychologische Traumata entstehen kann. Auch verschiedene Sedativa (Beruhigungsmittel) und Schlafmittel können eine kurzzeitige Amnesie auslösen. Im Wesentlichen ist eine Amnesie der Verlust des Gedächtnisses, welches – je nach Schwere – entweder komplett oder nur teilweise durch Schädigungen oder Eingriffe verloren geht. Sedierung (Beruhigung) ist eine milde Form der Anästhesie, die ausreicht, um kleinere nicht-invasive bzw. nicht-schmerzhafte Eingriffe wie Handling, Wiegen, einfaches Markieren und Bildaufnahmen durchzuführen. Aufgrund der hohen Empfindlichkeit der Haut von Fischen und der starken Produktion von Schleim durch die Epidermis unter Stressbedingungen kann sogar für normale Handlingprozeduren eine milde Sedierung notwendig werden. Ein leichtes Beruhigungsmittel in niedrigen Konzentrationen eines Betäubungsmittels wie MS-222 kann auch den Stress minimieren, der während einem Transport der Fische entsteht. Bei Eingriffen sollten Beruhigungsmittel nur in Verbindung mit Lokalanästhetika und Analgetika (Schmerzmittel) gegeben werden. Euthanasie (griech. εὐθανασία: “guter Tod”; εὖ, eu: “richtig” oder “gut”; θάνατος, thanatos: “Tod”) bezeichnet das beabsichtigte Beenden eines Lebens, um Schmerz und Leiden zu lindern. Im Zusammenhang mit Tierversuchen ist die Euthanasie der Akt des humanen Tötens oder des Sterbenlassens durch die Unterlassung von umfassenden medizinischen Maßnahmen. Gründe für eine Euthanasie können unheilbare und besonders schmerzhafte Zustände oder Krankheiten, der Mangel an Mitteln, um ein Lebewesen weiterhin am Leben zu erhalten oder geplante Versuchsabläufe sein. Der Sinn von Euthanasie besteht darin, Stress, Schmerz und Leiden zu minimieren. Man unterscheidet Euthanasie von Tierschlachtung und Schädlingsbekämpfung, die zum Teil zwar gleich ablaufen, jedoch aus anderen Gründen als aus Mitleid ausgeführt werden. Bei Haustieren werden häufig beschönigende Begriffe wie „einschläfern“ oder „erlösen“ benutzt. Anästhesie vs. Analgesie: Da Fische vermutliche ebenfalls in der Lage sind, Schmerz zu empfinden (siehe oben), sollte bei jedem Verfahren mit invasiven Methoden, die in einem gewissen Maß Schmerzen auslösen können, Vorkehrungen getroffen werden, um diese zu lindern. In den meisten Fällen beinhalten chemische Anästhetika schmerzlindernde Inhaltsstoffe, sodass eine Anwendung eines geeigneten Anästhetikums ebenfalls das Schmerzempfinden reduziert. 6.3 Allgemeine Überlegungen bei der Wahl der Betäubungsmethode Das ideale Betäubungsmittel sorgt für einen komplett reversiblen und kontrollierten Verlust des Bewusstseins, ohne dabei Mortalität hervorzurufen. Es sollte in der Anwendung für Tier und Anwender sicher sein. Anästhetika sollten die Physiologie nur minimal beeinträchtigen, die Homöostase sollte während der gesamten Anwendung aufrecht erhalten bleiben. Zusätzlich sollten Stress, Schmerz und Leid für das Tier auf ein Minimum reduziert werden. Beweggründe für den Einsatz von Betäubungsmitteln 56 International Zebrafish Medaka Course IZMC sind zum einen ethische Erwägungen, zum anderen die Absicht, die Zustände bei experimentellen Manipulationen von Fischen zu optimieren. Bei der Wahl der Betäubungsmethode sind folgende Kriterien zu berücksichtigen: (1) Ein Anästhetikum soll innerhalb von weniger als 3 Minuten wirken und die Erholung sollte sich innerhalb von 5 Minuten nach Überführung in reines Wasser einstellen. (2) Das gewählte Betäubungsmittel sollte weder für Fisch noch für Anwender toxische Begleiterscheinungen haben. (3) Das Anästhetikum sollte biologisch abbaubar sein und Eigenschaften aufweisen, die es dem Körper nach der Exposition erlaubt, es vollständig aus allen Körpergeweben auszuscheiden. (4) Das Anästhetikum sollte keine bleibenden Auswirkungen auf Physiologie, Immunologie oder Verhalten aufweisen, die die Überlebenschancen verringern oder die spätere Messungen stören und das Wohlbefinden des Fisches beeinträchtigen können. (5) Neben dem Preis-Leistungs-Verhältnis sowie der Verfügbarkeit sollten bei der Wahl des Anästhetikums Eigenschaften wie Schaumbildung berücksichtigt werden, da diese den Gas-Transport in und aus dem Wasser verringern können. (6) Da die Wirksamkeit der meisten Anästhetika artspezifisch ist und von Parametern wie Körpergröße, Körperdichte des Fisches wie auch der Wasserqualität (bspw. Härte, Temperatur und Salinität) beeinflusst wird, ist es zwingend notwendig, in Vorversuchen mit einer geringen Anzahl von Fischen die optimale Dosis und Einwirkdauer herauszufinden. (7) Besondere Aufmerksamkeit sollte der Kontrolle des gewünschten Anästhetikums zukommen. Dies kann durch eine Betäubungsmittelkonzentration sowie eine genaue Beobachtung während der Anästhesie erreicht werden, da diese verschiedene Betäubung (s.u.) durchlaufen. Levels des geeignete der Fische Stufen der (8) Wie aus zahlreichen Hinweisen in der Literatur hervorgeht, gibt es kein ideales allgemeines Anästhesie-Protokoll, da alle derzeit angewandten Methoden in einem gewissen Maß zu Nebeneffekten führen. Die Wahl des passenden Anästhesie-Protokolls wird in erster Linie vom Ziel des Experimentes bestimmt. Einige Nebeneffekte können ‒ je nach Zielsetzung ‒ nicht toleriert werden. Die folgenden allgemeinen Überlegungen sollten unabhängig vom jeweiligen Protokoll berücksichtigt werden: (1) Gute Planung ist die halbe Arbeit: Optimale Vorbereitung von Fischen, Medikamenten, Räumlichkeiten und Personal erleichtert die Arbeit. (2) Um eine optimale Reproduzierbarkeit von Befunden sicherzustellen, sollten alle Anästhesieschritte streng einer Standard Operation Procedure (SOP) folgen. 57 International Zebrafish Medaka Course IZMC (3) Bei neuen Anästhesieprotokollen oder Fischarten sollte ein Vorversuch mit wenigen Fischen durchgeführt werden, bei dem die komplette Erholungszeit überwacht wird, um sicherzugehen, dass die Dosis und Methode sicher sind und eine geeignete Betäubungstiefe für die geplanten Behandlungen erreicht wird. (4) Bei die Auswahl von Art und Dosierung der Anästhesie sollten der Gesundheits- und physiologische Zustand der Fische berücksichtigt werden. (5) Die Haut von Fischen sollte nicht beschädigt werden. Bei der Arbeit mit diesen Tieren sollten nicht-gepuderte, befeuchtete Handschuhe getragen werden und auf den Gebrauch von Detergenzien oder Lösungsmitteln verzichtet werden. Der Gebrauch von scheuernden Materialien, bspw. trockenen Papierhandtücher, sollte auf ein Minimum reduziert sein. (6) Um die Wahrscheinlichkeit von Komplikationen bei der nachfolgenden Anästhesie zu vermeiden, sollten bereits vor der Einleitung der Narkose Maßnahmen zur Reduktion von Stress getroffen werden. (7) Vor der Anästhesie sollten größere Fische wie Forellen je nach Körpergröße für bis zu 48 Stunden nicht mehr gefüttert werden. Dies verringert das Risiko einer Verunreinigung durch Fäzes und das Erbrechen. (8) Für den Transport, die Anästhesie und die Erholung sollte Wasser aus dem ursprünglichen Aquarium genommen werden. Falls anderes Wasser genommen wird, müssen die Wasserparameter (z.B. Chlorgehalt, Temperatur, pH und Ammoniumgehalt) angepasst werden. (9) Bei größeren Fischen muss die ausreichende Sauerstoffversorgung während der Einleitung, der Anästhesie und der Erholung über Luftpumpen, Belüftungssteine, Ausströmer o.ä. gewährleitet sein. (10) Die Wassertemperatur sollte während der Behandlung und Erholung an das Optimum der Tierart angepasst sein. (11) Eine ausreichende Dosis des Betäubungsmittels im Tier sollte über den gesamten geplanten Eingriff sichergestellt sein. (12) Während der Behandlung sollte die Fischhaut feucht gehalten und die Kiemen unter Wasser liegen oder regelmäßig mit sauerstoffreichem Wasser gespült werden. (13) Überwachung von Atemfrequenz und Kiemenfarbe während der gesamten Betäubung: a. Beobachtung der Bewegungen der Kiemendeckel- (Opercula = feste Falte, die die Kiemen bedeckt), um die Atemfrequenz festzustellen; b. die Kiemen sollten dunkel-pink bis hellrot gefärbt sein; c. bei extrem schwacher oder aussetzender Atmung sollte der Fisch in betäubungsmittelfreies Wasser überführt werden, bis die Atmung wieder einsetzt. 58 International Zebrafish Medaka Course IZMC (14) Behandlungen nach der Betäubung: Überführung des Fisches in ein Aquarium mit gut belüftetem unbehandeltem Wasser. a. Um die Erholung zu unterstützen und zu beschleunigen, sollte ein Fluss von sauerstoffreichem Wasser an den Kiemen vorbei erfolgen. Dies kann durch (a) Hin- und Herbewegung des Fisches im Wasser oder, vor allem bei größeren Fischarten, durch (b) das Öffnen und Schließen des Mauls erfolgen. b. Während der Erholung sollte die Wassertemperatur auf das benötigte normale Optimum der Fischart eingestellt werden. c. Im Fall von invasiven Methoden sollte die Gabe von Antibiotika bedacht werden. (15) In den meisten Gesetzgebungen ist die Entnahme von Blut aus dem Herzen nur bei betäubten Tieren erlaubt, die im Anschluss getötet werden. (16) Bei der Arbeit mit Tieren sollte entsprechende Schutzkleidung getragen werden. Auf Ausrüstung, geeignete Hygiene und die Kenntnis von möglichen Allergien, Zoonosen und Verletzungsmöglichkeiten ist zu achten. (17) Sicherheitshinweise für Anästhetika: a. Alle Betäubungsmittel sollten sorgfältig genutzt werden und das dazugehörige Sicherheitsdatenblatt (MSDS) für weitere Sicherheitshinweise für den Anwender hinzugezogen werden. b. Bei der Anwendung von Betäubungsmitteln soll Schutzkleidung, Handschuhe und Schutzbrille getragen werden. Handschuhe auch bei der Behandlung von betäubten Tieren tragen. c. Falls nötig/möglich, sollte eine hoch konzentrierte Stammlösung der Betäubungsmittel unter dem Abzug angesetzt werden. Dabei sollte die benötigte Menge an Betäubungsmittel in etwas Wasser gelöst werden. Hierbei Handschuhe tragen und die Stammlösung so lange rühren, bis sich alles aufgelöst hat. Für die spezifische Anwendung wird die Stammlösung entsprechend verdünnt. d. Die Entsorgung von biologisch abbaubaren Betäubungsmitteln erfolgt mit einem Überschuss an Wasser über das kommunale Abwassersystem. Betäubungsmittel dürfen jedoch nicht direkt in Oberflächengewässer, Regenwasserleitungen oder Auffangbecken entsorgt werden. 59 International Zebrafish Medaka Course IZMC 6.4 Stadien der Anästhesie Bei Fischen kann die Tiefe bzw. die Stufen der Anästhesie in verschiedene Stadien kategorisiert werden (Nummerierung variiert je nach Autor; Tab.3). Tabelle 3: Stufen der Anästhesie im Fisch Stadiu Beschreibung m Verhalten des Fischs Versuch 0 Normal Aktives Schwimmen; Reaktion auf externe Reize; normales Gleichgewicht; normaler Muskeltonus I.1 Leichte Sedierung Andauerndes selbstbestimmtes Schwimmen; leichter Verlust auf visuelle und taktile Reize; normale Atemfrequenz; normaler Muskeltonus I.2 Tiefe Sedierung Verlangsamung und Einstellung des selbstbestimmten Schwimmens; unkoordinierte Bewegungen; kompletter Verlust der Reaktion auf visuelle und taktile Reize; normales Gleichgewicht; normales Muskeltonus; Reaktion auf Lage-Veränderungen. II.1 Leichte Narkose Eine Phase erhöhter Erregung kann sich in erhöhter Atemfrequenz, nachlassendem Muskeltonus manifestieren; Fische reagieren noch auf Lageveränderungen II.2 Tiefe Narkose, ToleranzStadium Keine Antwort auf Lageveränderungen; Abnahme der Atemfrequenz auf den ungefähren Normalzustand; kompletter Verlust des Gleichgewichts; kein selbstständiges Aufrichten; verringerter Muskeltonus; schwache Reizantwort auf starke taktile und schwingende Reize. externe Probenahme, Flossen- und Kiemenbiospien III.1 Leichte Anästhesie Kompletter Verlust des Muskeltonus; Reaktion auf starken Druck; weitere Abnahme der Atmungsfrequenz kleinere chirurgische Eingriffe III.2 Chirurgisches Stadium: chirurgische Anästhesie Kompletter Verlust von Schmerzsinn und Reaktionsfähigkeit, komplette Muskelentspannung, verlangsamte Atmung und Herzfrequenz, totaler Verlust der Reizantwort (→ um Reaktion auf Reize zu ermitteln, kräftiger Druck auf Schwanzbasis) für jeden chirurgischen Eingriff geeignet IV Medullärer Zusammenbruc h Irreversibles Stadium, Überdosis führt letztendlich zum Tod Euthanasie Da diese Stadien von der Akkumulation des Anästhetikums abhängen, können die unterschiedlichen Stadien (a) mit einer erhöhten Dosis oder (b) mit einer erhöhten Anwendungsdauer beobachtet werden. Die Tiefe der Anästhesie kann leicht anhand der Kiemendeckel-Frequenz (Atmungsfrequenz) überwacht werden. Die Kiemen sollten während des gesamten Verfahrens pink bis leicht rot gefärbt sein. Blasse Kiemen sind ein Zeichen für Sauerstoffmangel, Hypotonie und/oder Anämie. Die Erholung kann in folgende Stadien eingeteilt werden: (1) Stadium I: Körper unbeweglich, allerdings setzt die Kiemendeckelbewegung langsam ein; (2) Stadium II: regelmäßige Kiemendeckelbewegungen und beginnende Körperbewegungen; (3) Stadium III: Gleichgewicht und Zustand vor der Anästhesie ist wieder hergestellt. 60 International Zebrafish Medaka Course IZMC 6.5 Arten der Anästhesie Anästhesie kann durch verschiedene Behandlungen hervorgerufen werden: (1) Inhalation; (2) nicht-chemische Anästhesie -Methoden; (3) Injektion des Anästhetikums. Inhalation Die am häufigsten genutzte Betäubungstechnik ist die Zugabe eines Anästhetikums zum Wasser. Dies ist mit der Inhalationsanästhesie bei terrestrischen Tieren vergleichbar, da das Mittel über das umgebende Medium aufgenommen wird, in den arteriellen Blutkreislauf eintritt und der Rest bzw. die Metaboliten über Kiemen, Nieren, Verdauungstrakt und Haut ausgeschieden werden. Nachdem die Fische in das Erholungsbecken überführt wurden, wird das Betäubungsmittel aus dem Blut ausgeschieden und die Effekte lassen nach. Inhalation ist definitiv die einfachste, schnellste und sicherste Methode um Fische zu betäuben. Fig.18:.Chemische Struktur von bei Fischen häufig gebrauchten Immersionsanästhetika Gebräuchliche Betäubungsmittel sind Benzocain, MS-222, Eugenol, 2-Phenoxyethanol (Bakterizid) oder Quinaldin (Fig. 18). Bei Speisefischen ist vor der Weiterverarbeitung der Fische ein für den Abbau der Mittel ausreichender Zeitraum obligatorisch, weshalb großes Interesse an weniger persistenten und natürlicheren Anästhetika wie Nelkenöl besteht. Parameter, die zur Auswahl des Betäubungsmittel und der Betäubungszeit herangezogen sollen sind (a) Fischart, (b) Konzentration (je höher, desto schneller/länger), (c) Körpergewicht (kleinere Kiemenoberfläche steht in Korrelation zum Körpergewicht, Kiemenpermeabilität), und (d) Wassertemperatur (höhere Temperatur → höherer Metabolismus → höherer Sauerstoffverbrauch → höhere Betäubungsmittel-Aufnahme). Für manche Fischarten wie den Aal (Anguilla spec.) funktioniert die Inhalation nicht besonders gut. Benzocain wird nicht nur als Betäubungsmittel bei Fischen benutzt, sondern findet auch als Lokalanästhetikum beim Menschen, als Oberflächenschmerzmittel oder in Hustenmitteln Anwendung. In vielen freiverkäuflichen Betäubungssalben sowie 61 International Zebrafish Medaka Course IZMC Produkten gegen Mundhöhlengeschwüre ist Benzocain der aktive Bestandteil. In Kombination mit Antipyrinen wird es als A/B-Ohrtropfen gegen Ohrschmerzen und Ohrschmalz eingesetzt. Benzocain wirkt als Inhibitor von spannungsabhängigen Natriumkanälen (VDSCs) in Nervenzellmembranen (Verhinderung der Depolarisierung mittels Blockade des Natrium-Einstroms) und verhindert so die Weiterleitung von Aktionspotenzialen. Gelöstes Benzocain ist neutral (pH 7) und löst demnach weniger Hyperaktivität und Anfangsstress aus als gepuffertes MS-222. Allerdings können einige Fischarten (z.B. der Aal) während niedrigen Stadien der Anästhesie ihre Bewegungsfunktionen beibehalten, was es in diesen Fällen zu einem ungeeigneten Betäubungsmittel für operative Eingriffe macht. Benzocain ist in einer ähnlichen Dosis wie Tricain (MS-222, 25 - 100 mg/L) wirksam. Benzocain ist ein relatives sicheres Betäubungsmittel, obwohl die Wirkung bei höheren Temperaturen nachzulassen scheint. Eine Anwendung über einen Zeitraum länger als 15 Minuten gilt als nicht sicher. Die Wirksamkeit wird nicht von pH oder Wasserhärte beeinflusst. Benzocain ist kaum wasserlöslich (0,4 g/L bei 5 °C; 1,1 g/L bei 30 °C; meistens ausreichend für Anästhesie), jedoch löslich in Aceton und Ethanol. Benzocain ist in den USA nach Angaben der FDA bei Fischen für den menschlichen Konsum nicht zugelassen. MS-222 (Tricain, Metacain, Tricain Mesylat, Tricainmethansulfonat, TMS, Finquel) ist ein weißes Pulver, welches häufig für Anästhesie, Sedierung oder Euthanasie bei Fischen eingesetzt wird. TMS ist in den U.S. als einziges Betäubungsmittel für Speisefische zugelassen, wurde jedoch in Kanada verboten. Dieses Mittel kann eine selektive Toxizität für poikilotherme Tiere aufweisen, da diese eine niedrigere Metabolisierungsrate in der Leber aufweisen. TMS ist ein Muskelrelaxanz welches Aktionspotenziale verhindert (Blockierung von Natrium- und in einem kleineren Maß Kalium-Strömen in Nervenmembranen). Durch das Ausschalten von Aktionspotenzialen und spontanen Muskelkontraktionen, sowie von Sinneswahrnehmungen und Reflexen, kann kein Signal zwischen Gehirn und den Extremitäten ausgetauscht werden. MS-222-Lösungen sollten gepuffert werden, die optimale Konzentration ist 50 70 mg/L. Allerdings variiert dieses Optimum je nach Körpergröße und Fischart sowie anderen Variablen. MS-222 ist bis zu 1250 g/L gut wasserlöslich. Für ein Review zu MS-222 siehe 96. Sowohl die Sedierung, als auch die Erholung danach verläuft ziemlich schnell. Der Sicherheitsfaktor von TMS-222 ist gut. Es ist besonders gut wirksam in Warmwasser mit niedriger Härte. MS-222 wird innerhalb von 24 Stunden im Fischurin ausgeschieden und in der gleichen Zeit sinkt der Level innerhalb des Gewebes gegen Null. Einer der Haupt-Nachteile von MS-222 ist, dass trotz einer tiefen Anästhesie der Fische die Werte für Stressindikatoren im Cortisol, Glukose und Laktat im Plasma infolge der Behandlung ansteigen. Eugenol (4-Allyl-2-methoxyphenol, 4-Prop-2-enyl-2-methoxyphenol, 4-Allylbrenzcatechin-2-methylether, 5-Allylguajacol) ist der aktive Bestandteil des Nelkenöls; der Name stammt vom wissenschaftlichen Namen der Nelke, Eugenia aromaticum oder Eugenia caryophyllata. Eugenol ist verantwortlich für das Nelkenaroma; außerdem ist es der Hauptbestandteil (72 - 90 %) des ätherischen Nelkenöls. Eugenol wird bei der 96 Carter, K.M., Woodley, C.M., Brown, R.G. (2011) A review of tricaine methanesulfonate for anesthesia of fish. Rev. Fish Biol. Fisheries 21: 51-59. 62 International Zebrafish Medaka Course IZMC Herstellung von Parfums, Aromastoffen und ätherischen Ölen gebraucht. Des Weiteren findet es als lokales Desinfektions- und Betäubungsmittel in der (Zahn-) Medizin Anwendung. Derivate des Eugenols werden bei der Herstellung von Insektenlockstoffen, UVAbsorbern, Analgetika, Bioziden sowie Antiseptika eingesetzt. Es hat antibakterielle, antifungale, apifugale Wirkung und wird als Insektizid, Nematozid und Akarizid verwendet. Auch in technischen Bereichen findet Eugenol mit seinen Derivaten häufig Anwendung. Besonders in den Vereinigten Staaten erfreut sich das Nelkenöl einer wachsenden Popularität als Betäubungsmittel bei Aquarienfischen sowie bei der Beprobung von Wildfängen für Forschungs- und Bewirtschaftungszwecke. Rezeptfrei in Apotheken erhältlich, stellt es eine tiergerechte Methode zur Betäubung kranker und von Parasiten befallener Fische dar. Dies kann entweder durch direkte Überdosierung geschehen oder durch das Versetzten in einen künstlichen Schlaf, bevor den Fischen eine Überdosis an Ethanol verabreicht wird. Nelkenöl hat einen sehr hohen Sicherheitsfaktor; es benötigt jedoch im Vergleich mit MS-222 auch eine relativ lange Erholungszeit. Der Hauptvorteil des Nelkenöls ist sein geringer Preis, und das sich angenehm damit arbeiten lässt. Bekannte Nebeneffekte sind die Inhibierung der TumorNekrose-Faktoren COX-1 und COX-2, sowie von Cytochrom P450. Gentoxizität kann auf Grund einer Aktivierung von Cytochrom P450 auftreten. Dennoch ist Eugenol (oder das Nelkenöl) vom US FDA-Zentrum für Tiermedizin (FDA/CVM) für Fische als unbedenklich zugelassen. Für Fische, die für den menschlichen Verzehr bestimmt sind, ist Nelkenöl jedoch in den USA nicht zugelassen, da vor allem Methyleugenol im Verdacht steht, kanzerogen zu sein. 2-Phenoxyethanol (2-Phenoxy-1-ethanol, Phenylcellosolve, Phenylglykol, Monophenylglykol, Ethylenglykolmonophenylether) ist ein Bakterizid, das häufig als Fischbetäubungsmittel und in dermatologischen Produkten in Konzentrationen bis 1 % eingesetzt wird. Technische Anwendungen reichen von Lösungsmitteln für Färbemittel und Tinten, über Konservierungsmittel für Printmedien und Insektenrepellents bis hin zu Fixierungsmitteln in Parfums und Seifen. In der Wissenschaft wird 2-Phenoxyethanol in biologischen Puffern und Impfstoffen oft als Ersatz für Natriumazid verwendet, weil es weniger toxisch ist und keine Verbindungen mit Kupfer und Blei eingeht. 2Phenoxyethanol hat einen relativ großen Sicherheitsfaktor, und es sind Effekte von leichter Sedierung bis hin zu operativer Betäubung bei Konzentrationen zwischen 100 600 mg/L berichtet worden. Konzentrationen zwischen 300 und 400 mg/L sind für kurzfristige Untersuchungen gebräuchlich, wohingegen geringere Konzentrationen zwischen 100 und 200 mg/L für längeres Ruhigstellung, z.B. während des Transports, geeignet sind. Phenoxyethanol ist relativ gut wasserlöslich (26,7 g/L), aber leicht löslich in Ethanol. 2-Phenoxyehtanol ist von der FDA in den USA für den Gebrauch bei Fischen, die für den menschlichen Verzehr bestimmt sind, nicht freigegeben. Quinaldin (2-Methylquinolin) ist ein einfaches Derivat der heterozyklischen Verbindung Quinolin (Chinolin). Quinaldin wird in Antimalariamitteln, sowie bei der Herstellung von Färbemitteln und Farbstoffen (z.B. Quinolin Gelb WS), pharmazeutischen Erzeugnissen und pH-Indikatoren verwende. Quinaldinsulfonat ist ein Betäubungsmittel, das relativ häufig beim Transport von Fischen Anwendung findet. Auf einigen karibischen Inseln wird es zum Sammeln von tropischen Rifffischen eingesetzt. Obwohl es ein effektives Anästhetikum ist, wirkt es auf den Fisch als Reizmittel, hat einen unangenehmen Geruch und ist kanzerogen. Quinaldin-Lösungen sind sauer und werden daher gewöhnlich mit Natriumbikarbonat gepuffert. Die Induktion der Narkose dauert 1 bis 4 Minuten und kann leichte Muskelkontraktionen hervorrufen. Die Erholung ist für 63 International Zebrafish Medaka Course IZMC gewöhnlich sehr schnell. Die effektive Behandlungskonzentration von QuinaldinLösungen ist artspezifisch, liegt aber generell zwischen 15 und 60 mg/L. Durch Behandlung mit Quinaldin kann nicht die tiefe Betäubung erreicht werden, die für Operationen benötigt wird, da gewöhnlich Reflexe erhalten bleiben. Fische, die mit Quinaldin betäubt wurden, hören nicht auf, ihre Kiemen zu ventilieren. Daher sind sie nicht so anfällig für Aphyxie (Erstickung) wie bei der Behandlung mit MS-222. Quinaldin selbst ist praktisch unlöslich in Wasser, kann aber in Ethanol und Aceton gelöst werden. Quinaldinsulfonat hingegen kann direkt bis 1040 g/L in Wasser gelöst werden. Metomidat (Methyl-1-(1-phenylethyl)-1H-imidazol-5-carboxylat) wurde extensiv in der Humanmedizin eingesetzt. Es betäubt Fische ohne den Stress einer erhöhten Herzfrequenz. Die Induktion ist sehr schnell (1 - 2 Minuten), und auch die Erholung ist schneller als mit MS-222. Es betäubt Salmoniden bereits in sehr geringen Dosen (2 - 6 mg/L), die auch beim Wels anwendbar sind. Es ist bekannt, dass Metomidat auf große, Salzwasser gewohnte Salmoniden stärker wirkt als bei Süßwasser-Fingerlingen oder Parrs. Metomidat ist in den Vereinigten Staaten nicht zugelassen für den Gebrauch bei Nahrungsmitteln, die für den menschlichen Verzehr bestimmt sind. In Kanada ist Metomidat dagegen für tiermedizinische Zwecke zugelassen. Neben diesen häufig verwendeten Anästhetika wurden auch exotischere Betäubungsmittel erfolgreich zur Sedierung und Narkotisierung von Fischen angewendet; dazu zählen 2-Amino-4-phenylthiazol, Kohlenstoffdioxid (Karbonsäure; schwer kontrollierbar!), Natriumbikarbonat, Lidocain-Natriumbikarbonat, Chloralhydrat, Zyanid, Tabakextrakte, Rotenon, Etomidat, Fluothan, Halothan, Phenthiazaminhydrobromid, Propanidid und Tetraethylenglykoldibutylether. Viele Betäubungsmittel sind unter verschiedenen Markennamen kommerziell erhältlich (Tab. 4). Tabelle 4: Häufig verwendete Fischbetäubungsmittel, die unter Markennamen kommerziell erhältlich sind Produkt Dosisleistung Benzocain Eugenol Metomedat MS-222 2-Phenoxyethanol Anesthesin , Anesthone , Americaine , Orthesin , Parathesin TM AQUI-S TM TM TM TM TM TM Aquacal , Marinil , Methomidate , Methoxynol , Hypnomidate , Amidate TM TM Tricaine-S , Finquel TM TM TM Phenyl cellosolve , Phenoxethol , Phenoxetol , ethylene glycol monophenyl ether, and ß-hydroxyethyl phenyl ether TM TM Epontol , Sombrevin TM Quinate Propanidid Quinaldin TM TM TM TM TM Zudem existiert eine Anzahl an Betäubungsmitteln, die häufig bei terrestrischen Vertebraten eingesetzt werden, jedoch für Fische nicht zu empfehlen sind. Hierzu zählen z.B. Chloralhydrat, Chlorbutanol, Diethylether, Halothan, Methylpentynol und Urethan. 64 International Zebrafish Medaka Course IZMC 6.6 Dosierung von Inhalationsanästhetika Bei der Auswahl von Typ und Dosierung des Betäubungsmittels sollten der Gesundheits- und physiologische Zustand der zu betäubenden Fische berücksichtigt werden. Tabelle 5: Empfehlungen für die Dosierung von Inhalationsanästhetika bei Fischen, für artspezifische Informationen siehe , 98, 99, 100 Wirkstoff Benzocain (hydrochlorid) Ethyl-4-aminobenzoat Kohlenstoffdioxid Nelkenöl (Eugenol) TM Aqui-S Koi Calm TM Nelkenöl-Stammlösung Etomidat Halothan Isofluran Lignocain (Xylocain, Lidocain) 2-(Diethylamino)-N-(2,6dimethyl phenyl) acetimid Metomidat Methyl-1-(1-phenylethyl)1H-imidazole-5-carboxylat MS-222 Tricainmethansulfonat (TMS) Konzentration Art Kommentar 25 - 200 mg/L 25 - 50 mg/L 100 mg/L 40 mg/L 55 – 85 mg/L 50 – 100 mg/L Allgemein Salmoniden Tilapia, Wels Kabeljau Felsenbarsch Karpfen Pufferlösung mit Natriumbikarbonat um neutralen pH zu erhalten; guter Sicherheitsfaktor zwischen effektiver und letaler Dosis 200 – 1500 mg/L (1:1 CO2 : O2) 290 - 460 ml/min 6 - 20 mg/L Salmoniden 20 - 100 mg/L 25 - 120 mg/L 100 - 150 mg/L 40 - 100 mg/L 1 - 7 mg/L 2 - 7 mg/L 1.3 – 2.2 mg/L 1 mg/L 0.5 - 2.0 ml/L 0.4 - 0.75 ml/L andere Karpfen Gabelwels Allgemein Salmoniden tropische Arten Wels Felsenbarsch andere Karpfen 0.4 - 0.75 ml/L 0.25 - 0.4 ml/L 100 – 250 mg/L 250 mg/L 350 mg/L 100 - 150 mg/L 2 - 25 mg/L 5 - 20 mg/L 7.5 - 10 mg/L 10 – 60 mg/L 5 mg/L 25 - 50 mg/L 80 - 200 mg/L 20 - 85 mg/L 250 - 480 mg/L 150 mg/L Induktion Hälterung Karpfen, Forelle Wels Tilapia andere Allgemein Kabeljau felsenbarsch Atlant. Heilbutt Regenbogenforelle Salmoniden Tilapia, Wels, Karpfen, Atlant. Heilbutt, Felsenbarsch, 97 Karpfen alle 97 sehr hoher Sicherheitsfaktor besser löslich in heißem Wasser direkt ins Wasser geben (Injektion unter die Oberfläche mit einer 25G Nadel) oder über Zerstäuber siehe oben 1 – 2 mg/kg Gesamtdosis nicht überschreiten breiter Sicherheits-faktor; mit gleicher Menge an Natrium- Iwama, G.K., Ackerman, P.A. (1994) Anaesthetics. In: Biochemistry and molecular biology of fishes, vol. 3 (Hochachka, P. Mommsen, T.; eds.). Elsevier Publ., pp. 1-15. 98 Neiffer, D.L., Stamper, M.A. (2009) Fish sedation, anesthesia, analgesia, and euthanasia: considerations, methods, and types of drugs. ILAR J. 50: 343-360. 99 Iwama, G.K., Ackerman, P.A. (1994) Anaesthetics. In: Biochemistry and molecular biology of fishes, vol. 3 (Hochachka, P. Mommsen, T.; eds.). Elsevier Publ., pp. 1-15. 100 Neiffer, D.L., Stamper, M.A. (2009) Fish sedation, anesthesia, analgesia, and euthanasia: considerations, methods, and types of drugs. ILAR J. 50: 343-360. 65 International Zebrafish Medaka Course IZMC Wirkstoff Konzentration Art Kommentar 75 mg/L Kabeljau bikarbonat puffern (pH 7 – 7.5) Hälterung 10 mg/L Salmoniden Stammlösung 15 - 50 mg/L 1 g/L Spray 1 g/L Phenoxyethanol 2-Phenoxyethanol Hälterung Quinaldin Quinaldinsulfat - 0.5 ml/L mg/L 0.1 - 0.5 ml/L 100 - 200 mg/L 15 - 60 mg/L 15 - 40 mg/L 30 - 70 mg/L 10 - 30 mg/L 25 - 55 mg/L 15 - 70 mg/L Allgemein Salmoniden Karpfen Sedierung Sprühen auf Kiemen Euthanasie bakterizide und fungizide Lösung allgemein Salmoniden Wels Sonnenbarsch Felsenbarsch Forellenbarsch Tabelle 6: Dosierung der wichtigsten Anästhetika für eine Auswahl häufig gezüchteter Fischarten (mg/L) Atlantischer Lachs Regenboge nforelle Flusskarpfen Gabelwels Nil-Tilapia Felsenbarsch Salmo salar Oncorhynchus mykiss Cyprinus carpio Ictalurus puntatus Oreochromis niloticus Morone saxatilis MS-222 40 - 50 40 - 60 100 - 250 50 - 250 100 - 200 100 - 150 Benzocain 40 25 - 50 n.d. n.d. 25 - 100 50 - 100 Quinaldin 25 - 40 n.d. 10 - 40 25 - 60 25 - 50 25 - 40 2Phenoxyethanol 100 - 200 100 - 200 400 - 600 n.d. 400 - 600 n.d. Metomidat 2 - 10 5-6 n.d. 4-8 n.d. 7 - 10 Nelkenöl 10 - 50 40 - 120 40 - 100 100 n.d. 60 TM 10 - 50 20 n.d. 20 - 60 n.d. n.d. Anästhetikum Aqui-S n.d. – nicht ermittelbar Tabelle 7: Herstellung von Stammlösungen für Tauchbäder von Betäubungsmitteln Produkt Dosisleistung Nelkenöl (Eugenol) Jeder ml Nelkenöl enthält etwa 1 g Eugenol. Eugenol ist nicht vollständig wasserlöslich und sollte daher 1:10 mit 95 % Ethanol (1 Teil Nelkenöl, 9 Teile Ethanol) gemischt werden. Die Stammlösung enthält dann 100 mg/ml Eugenol. Lösen von 1 g MS-222 (ein 0,5 ml Löffel enthält etwa 400 mg MS-222) und 1 g Natriumbicarbonat (NaHCO3) in 100 ml destilliertem Wasser. Die Stammlösung enthält 10 mg/ml MS-222. Die Lösung sollte beschriftet und datiert werden. Sie kann so in einem lichtgeschützten Behältnis bis zu 3 Monate aufbewahrt werden. Gewöhnlich wird die Stammlösung mit Ethanol oder Aceton (normalerweise100 g/L) hergestellt. Sie kann in einem lichtgeschütztem Behältnis für ein Jahr aufbewahrt werden. MS-222 (Tricain methansulfonat) Benzocain 66 International Zebrafish Medaka Course IZMC 6.7 Nicht chemische Betäubungsmittel 6.7.1 Hypothermie (rasches Kühlen) Hypothermie ist eine häufig angewendete Methode, um Fische in Fischzuchten ruhigzustellen oder zu immobilisieren 101 . Niedrige Wassertemperaturen erhöhen den Sauerstoffgehalt im Wasser, reduzieren aber gleichzeitig die Schwimmaktivität und den Sauerstoffverbrauch der Fische. Das Wasser kann durch Abkühlung (Kältetechnik) oder durch die Zugabe von Eis gekühlt werden. Schrittweises Kühlen wird empfohlen, da schnelles Abkühlen zu einem Temperaturschock führen kann. Bei typischen Kaltwasser-Fischarten ist Hypothermie jedoch erst bei Temperaturen unterhalb von 0 °C (-2,0 bis -4,5 °C) wirksam. Dies kann nur durch die Zugabe von 25 bis 90 µg/L Salz (NaCl) mit anschließender Behandlung mit einem Wärmetauscher erreicht werden. Die Zugabe von Trockeneis kann zu Hyperkapnie (erhöhter Atmungsaktivität mit hoheCO2-Werten) und sauren Bedingungen führen, wenn es direkt ins Wasser gegeben wird. Folglich kann Hypothermie nur für typische Warmwasser-Fische empfohlen werden, da Betäubungseffekte sonst nicht induziert werden können, wenn die Akklimationstemperaturen unterhalb von 10 °C liegen 102. Wenn Fische durch das Herabsetzen der Wassertemperaturen immobilisiert werden, ist der Sicherheitsfaktor ziemlich gering, und Fische können sterben, wenn die Temperatur zu weit oder zu schnell verringert wird. Deswegen muss die Kühlungsrate sorgfältig kontrolliert und die benötigte Temperatur konstant gehalten werden. Als Daumenregel gilt, die Wassertemperatur nicht um mehr als 1 °C pro 15 Minuten zu reduzieren. Hypothermie führt nur zu einer langsamen, milden Betäubung, die durch Bewegungslosigkeit, reduzierte Kraftentwicklung und verminderte Nervensensibilität gekennzeichnet ist 103 . Aus diesem Grund wird diese Methode oft in Kombination mit chemischen Betäubungsmitteln angewendet, um die benötigte Betäubungsmittelmenge herabzusetzen 104, den Sauerstoffverbrauch zu reduzieren und somit die Zeit, in der der Fisch betäubt sein kann, zu erhöhen. Als Betäubungsmethode ist Hypothermie nicht tief genug, um längere Operationen durchzuführen 105 . Es wurde auch beobachtet, dass Hypothermie per se nicht zur Schmerzfreiheit beiträgt 106. Rasches Abkühlen führt dagegen zu tödlichen Schockzuständen, die durch die Störung der Osmoregulation hervorgerufen werden 107 . Hypothermie als Betäubungsmethode kann in Situationen angewendet werden, in der Betäubungsmittel kontraindiziert sind, 101 Hovda, J., Linley, T.J. (2000) The potential application of hypothermia for anesthesia in adult Pacific salmon. N. Am. J. Aquacult. 62: 67-72. 102 Summerfelt R.C. & Smith L.S. (1990) Anesthesia, surgery and related techniques. In: Methods for Fish Biology (eds. C.B. Schreck & P.B. Moyle), pp. 213-272. Bethesda MD: American Fisheries Society. 103 Summerfelt R.C. & Smith L.S. (1990) Anesthesia, surgery and related techniques. In: Methods for Fish Biology (eds. C.B. Schreck & P.B. Moyle), pp. 213-272. Bethesda MD: American Fisheries Society. 104 Erikson, U., Hultmann, L., Steen, J.E. (2006) Live chilling of Atlantic salmon (Salmo salar) combined with mild carbon dioxide anesthesia. I. Establishing a method for large-scale processing of farmed fish. Aquaculture 252: 183198. 105 Iwama, G.K., Ackerman, P.A. (1994) Anaesthetics. In: Biochemistry and molecular biology of fishes, vol. 3 (Hochachka, P. Mommsen, T.; eds.). Elsevier Publ., pp. 1-15. 106 Matthews, M., Varga, Z.M. (2012) Anesthesia and euthanasia in zebrafish. ILAR J. 53: 192-204 107 Ross, L., Ross, B. (2008) Anaesthetic and sedative techniques for aquatic animals, 3rd ed. John Wiley & Sons; 240 pp. 67 International Zebrafish Medaka Course IZMC oder bei Larven einiger Arten, die sehr hohe Dosen chemischer Betäubungsmittele gut tolerieren können 108. Wenn die Kiemen bei jungen Larven noch nicht aktiviert sind, ist die Aufnahme von chemischen Betäubungsmitteln auf die Haut beschränkt und deshalb sehr niedrig. Zu Tötungszwecken ist der Gebrauch von Kälteschocks mit einer sofort darauf folgenden Mazeration des Schädels durch einen in der Spüle eingebauten Küchenabfallzerkleinerer als Methode einsetzbar 109. 6.7.2 Elektro-Betäubung Eine weitere Alternative zu chemischen Betäubungsmitteln ist der Gebrauch von Elektrizität. Elektrofischen ist eine gebräuchliche Methode, um juvenile und adulte Fische in der Fischwirtschaft und für Biomonitoringzwecke zu fangen 110. Wechselstrom, Rechteckwellen von Gleichstrom und gepulster Gleich- und Wechselstrom (Richtstrom) werden seit vielen Jahren zum Elektrofischen genutzt. Gleichstrom kann zu Anodotaxis (Bewegung zur Anode hin), Elektronarkose (Betäuben) und Elektrotetanie (tetanische Muskelkontraktionen) führen, während Wechselstrom nur Elektronarkose und -tetanie auslöst. Das Ziel der Elektrobetäubung ist es, Elektronarkose herbeizuführen und gleichzeitig schwere Muskelkrämpfe zu vermeiden, die zu einer Wirbelsäulenverletzung führen können. Die Reaktion von Fischen auf Elektrizität hängt von der Stärke des elektrischen Feldes und der Dauer des Schocks ab. Andere Faktoren wie Leitfähigkeit des Wasers, Temperatur, Größe und Art des Fisches können sich auf die Effektivität der Elektrobetäubung auswirken. In Meerwasser ist die Elektrobetäubung ineffektiv, da es im Vergleich zu Fischen deutlich leitfähiger ist. Im Süßwasser sind Fische leitfähiger als das Wasser; aus diesem Grund ist es sehr einfach, einen elektrischen Strom durch den Fisch fließen zu lassen. Fische, die einem schwachen Gleichstrom (z.B. 12 V, 30 - 150 mA) ausgesetzt werden, werden immobilisiert, allerdings nur so lange, wie sie sich im elektrischen Feld befinden. Wenn der Strom versiegt, kann der Fisch fast sofort wieder entkommen. Diese Methode immobilisiert nur und führt zu keiner richtigen Betäubung. Wechselstrom löst eine kurzfristige Betäubung aus, und das Abschalten des Stroms kann die Betäubung nicht aufheben. Größere Fische sind schneller betroffen als kleinere; die Betäubungsdauer nimmt mit der Köperlänge zu. Bei 100 bis 115 Volt hält die Betäubung nur für weniger als 1 Minute an; höhere Spannungen (220 – 240 V) sind wohl besser geeignet und können für bis zu 5 Minuten zu einem Reaktionsverlust bei Berührung führen. Für artspezifische Anforderungen an den benötigten Strom, siehe 111 . In der Praxis induzieren Elektroschocks in der Regenbogenforelle eine sofortige Erhöhung von Corticoid- und Laktatkonzentrationen im Plasma, mit anhaltendem Anstieg von Glucose und Corticoiden im Plasma mindestens bis 6 Stunden nach dem Fang, sowie kardiovaskulären Veränderungen einschließlich Rhythmusstörungen. Diese Reaktionen werden Trauma, Sauerstoffmangel und allgemeinen Adaptionssyndromen zugeschrieben. Elektrobetäubung ist daher eine invasive und belastende Methode. In der Natur hat Elektrobetäubung eine beträchtliche Auswirkung 108 Massee, K.C., Rust, M.B., Hardy, R.W., Stickney, R.R. (1995) The effectiveness of tricaine, quinaldine sulfate and metomidate as anesthetics for larval fish. Aquaculture 134: 351-359. 109 Nickum et al. (2004) In: American Fisheries Society, American Institute of Fishery Research Biologists, American Society of Ichthyologists and Herpetologists. 2004. Guidelines for the Use of Fishes in Research. 110 Reynolds, J. (1996) Electrofishing. In: Fisheries Techniques, 2nd ed. (eds. B. Murphy & D. Willis), pp. 221-253. Bethesda: American Fisheries Society. 111 Iwama, G.K., Ackerman, P.A. (1994) Anaesthetics. In: Biochemistry and molecular biology of fishes, vol. 3 (Hochachka, P. Mommsen, T.; eds.). Elsevier Publ., pp. 1-15. 68 International Zebrafish Medaka Course IZMC auf andere Taxa; es erhöht z.B. den Anteil an abdriftenden Makroinvertebraten um das 10-fache nach dem Schock. Bei unsachgemäßer Benutzung im Labor kann elektrische Stimulation eine heftige Muskelantwort auslösen, die verstümmeln oder töten kann. Bei sachgemäßer Anwendung können dagegen nur wenige schädliche Langzeiteffekte am Fisch beobachtet werden. Allerdings treten grundsätzlich akute physiologische Störungen auf und es gibt Hinweise für eine erhöhte Anfälligkeit zur Prädation während der Erholungsphase nach dem Elektrofischen. Außerdem, sollte auf die Sicherheit des Anwenders geachtet werden, wenn mit Elektrizität gearbeitet wird. 6.8 Injektion von Betäubungsmitteln Besonders bei größeren Fischarten kann die Injektion der Inkubation in Betäubungsmittel vorgezogen werden. Es gibt zwei geeignete Stellen zur Injektion in aktiven/ freischwimmenden Fischen: (1) I.M. = intramuskuläre Injektion (wenn möglich, in die gut durchblutete rote Muskulatur; gewöhnlich auf ziemlich kleine Volumina begrenzt); (2) I.P. = intraperitoneale Injektion in die sekundäre Leibeshöhle (gewöhnlich größere Volumina als bei der I.M.-Injektion). Da das Ausmaß an roter Muskulatur sehr stark von der Lebensweise und Spezies des Fisches abhängt, tritt eine beträchtliche Artabhängigkeit auf. Normalerweise sollten I.M.Injektionen auf große Dauerschwimmer wie Thun oder Lachs beschränkt werden. In der Praxis können große freischwimmende Fische (z.B. Thun) nur mit Hilfe von PressluftPfeilen mit Betäubungsmittel injiziert werden, die von Harpunen abgefeuert werden, sobald der Fisch im Netz gefangen ist. In Gefangenschaft können große Individuen auch mittels eines automatisch auslösenden Narkosestabs, der mit einer Spritze beladen ist, betäubt werden. Häufig verwendete Betäubungsmittel für die intraperitoneale (I.P.) Injektion sind (1) Ketamin HCl (Detomidin; N-Methyl-D-Aspartat (NMDA) Rezeptorantagonist) (2) Xylazin HCl (α-2 Adrenozeptor-Agonist) (3) Detomidin HCl (α-2 Adrenozeptor-Agonist) (4) Medetomidin HCl (α-2 Adrenozeptor-Agonist) (5) Propofol (wirkt auf die γ-Aminobuttersäure (GABA)-Rezeptoren) Die normale Vorgehensweise ist, (1) den Fisch zu wiegen, (2) die Betäubungsmittelkonzentration in Abhängigkeit des Gewichts zu berechnen, (3) das angefärbte Betäubungsmittel intraperitoneal zu injizieren, (4) zu warten, bis der Fisch sein Gleichgewicht verliert, (5) die geplanten Eingriffe vorzunehmen (z.B. Blutproben, EKG, Impedanz, etc.), und (6) die Erholung abzuwarten. Tab. 8 gibt Empfehlungen für die Dosierung von Betäubungsmitteln, die via Injektion verabreicht werden 69 International Zebrafish Medaka Course IZMC Tabelle 8: Empfehlungen für die Dosierung einiger Injektionsbetäubungsmittel für Fische Wirkstoff Dosisleistung Art Ketaminehydrochlorid 66 – 88 mg/kg I.M. 130 mg/kg I.M. 30 mg/kg I.M. 30 mg/kg I.M. 1 – 2 mg/kg I.M. Allgemein Rgenbogenforelle andere Salmoniden Cichliden Ketamin kombiniert mit Medetomidin aufgehoben mit Atipamezol Saffan 0.05 – 0.1 mg/kg I.M. 0.2 mg/kg I.M. 12 mg/kg I.M. Alphaxolon Alphadolon Tabelle 9: Empfehlungen für die Dosierung von Analgetika für Fische Wirkstoff Dosisleistung Art Kommentar Buprenorphin Butorphanol Regenbogenforelle Allgemein Koi Regenbogenforelle reduzierte Aktivität Carprofen Ketoprofen 0.01 - 0.1 mg/kg I.M. 0.05 - 0.1 mg/kg I.M. 0.4 mg/kg I.M. 1 - 5 mg/kg I.M. 2 mg/kg I.M. Lidocain 0.1 - 2 mg/kg I.M. Regenbogenforelle Zebrabärbling niedrige Aktivität entzündungshemmender Effekt Tabelle 10: Empfehlungen für die Dosierung von Notfallmedikamenten im Fisch Wirkstoff Dosisleistung Doxapram Epinephrin 5 mg/kg I.V., I.P. 0.2 – 0.5 ml I.M., I.C., I.V., I.P. Art Kommentar Atemdepression Herzstillstand I.M. – intramuskulär; I.C. – intrakardial; I.V. – intravenös; I.P. – intraperitoneal 6.9 Andauernde Betäubung und deren Überwachung Im Falle von komplizierteren Eingriffen oder bei mehrmaligem Beproben müssen Maßnahmen ergriffen werden, um Sauerstoffmangel, aber auch einem zu frühen Erwachen aus der Narkose vorzubeugen. In solchen Fällen muss eine künstliche Ventilation während des Eingriffs eingesetzt werden. Bei größeren Fischen kann die Betäubung mit Hilfe eines Elektrokardiogramms überwacht oder die Impendanz gemessen werden. Nach dem Erwachen können etliche Stressindikatoren den Stress, der durch die Betäubung entstanden ist, widerspiegeln, z.B. können Catecholamine (Adrenalin, Noradrenalin) via HPLC oder Steroidhormone via ELISA bestimmt werden. Wie bereits erwähnt, zeigen nahezu alle Methoden, die im Augenblick angewendet werden, einen gewissen Grad an Nebeneffekten (Tabelle 11; für artspezifische Information siehe 112). Tabelle 11: Auswahl an gut dokumentierten Nebeneffekten einiger gebräuchlicher Fisch Anästhetika 113 112 Neiffer, D.L., Stamper, M.A. (2009) Fish sedation, anesthesia, analgesia, and euthanasia: considerations, methods, and types of drugs. ILAR J. 50: 343-360. 70 International Zebrafish Medaka Course IZMC Dosis (mg/L) Nebeneffekte Betäubungsmittel Initialeffekte Sekundäre Effekte MS-222 50 – 400 Herzrasen; erhöhte Atmung; Hyperglykämie Benzocain 25 – 150 Herzrasen; erhöhte Atmung; Hyperglykämie Nelkenöl 4 – 150 Eugenol Metomidat 20 – 200 0.06 – 10 2-Phenoxyethanol 0.25 – 600 Quinaldin Quinaldinsulfat 10 – 50 5 – 100 Erniedrigte kardiovaskuläre Antwort; Hyperglykämie; erhöhte Laktat-, Hämatokrit- und Anschwellen von Catecholamin-Werte, Erythrozyten Erniedrigte kardiovaskuläre Antwort; Hyperglykämie; erhöhte Laktat-, Hämatokrit- und Anschwellen von Catecholamin-Werte, Erythrozyten; unterdrückte Immunfunktion Erniedrigte Ventilationsrate und kardiovaskuläre Antwort Erhöhte Catecholamin- und Hämatocrit-Werte Reduzierte Nebennieren-Steroid-Produktion, die zu einem reduzierten Cortisolwert führt; verringerte Atem- und Herzfrequenz; verminderter pH des Blutes; Sauerstoffunterversorgung Erniedrigte Ventilierungsrate, Herzfrequenz, Blutdruck und Blut pH; erhöhte Nebennierenhormone; Hyperglykämie; reduzierte Immunfunktion Erniedrigte Herzfrequenz und Atemfunktion Erhöhte Cortisol und Immunglobin M Werte im Serum; Hyperglykämie Herzrasen Die genannten Dosen sind nicht für alle Arten oder unter allen Bedingungen (z. B. Temperatur, Körpergröße, physiologischer Zustand muss vorher überprüft werden) anwendbar. Wenn mit unbekannten Arten oder Wirkstoffen gearbeitet wird, sollte zuerst die geringste Dosis und eine kleine Zahlen an Fischen genutzt werden, um die Effektivität des Betäubungsmittels zu überprüfen. 6.10 Euthanasie Das Ziel der Euthanasie ist es, ein Tier auf humane Weise zu töten. Für Versuche mit Tieren gilt, dass die Euthanasie professionell und so früh und so schnell wie möglich unter Anwendung für die verwendeten Laborfischarten geeigneterer Methoden durchgeführt werden sollte, sobald erkannt wird, dass eine Euthanasie notwendig wird. Da sich das Wohlergehen von Fischen unter experimentellen Bedingungen jederzeit verschlechtern kann, sollte jederzeit in Euthanasie geschultes Personal verfügbar sein. Es sollte in jedem Fall darauf geachtet werden, dass bei der Euthanasie jeder Schaden, Schmerz oder Leid des Fisches auf ein absolutes Minimum beschränkt wird. Allgemeine Regeln für die Euthanasie 114 sind identisch mit denen, die bereits für die Betäubung aufgelistet worden sind. Gleichermaßen entsprechen die Methoden für die Euthanasie denen für die Anästhesie: Inhalation (Inkubation) oder Injektion (gewöhnlich durch eine Überdosis an Betäubungsmittel), anhaltende Hypothermie oder elektrischer Strom. Die Überdosierung von immobilisierenden Medikamenten ist eine akzeptable Art der Euthanasie 115 . Die häufigste Wahl fällt auf den Gebrauch von Immersionsmedikamenten (und besonders MS-222), die 5 bis 10-fach höher 113 Sneddon, L.U. (2012) Clinical anesthesia and analgesia in fish. J. Exot. Pet Med. 21: 32-43. AVMA − American Veterinary Medical Association (2013) Guidelines on Euthanasia of animals: 2013 edition. Available online under http://www.avma.org/issues/animal_welfare/euthanasia.pdf, as accessed January 1, 2014. 115 AVMA − American Veterinary Medical Association (2013) Guidelines on Euthanasia of animals: 2013 edition. Available online under http://www.avma.org/issues/animal_welfare/euthanasia.pdf, as accessed January 1, 2014. 114 71 International Zebrafish Medaka Course IZMC konzentriert werden als der artspezifischen Betäubungskonzentration entspricht, obwohl injizierbare Wirkstoffe genauso effektiv sind. Die Fische sollten noch 5 bis 10 Minuten in der Betäubungslösung verbleiben, nachdem die letzten Bewegungen des Operculums beobachtet worden sind (außer bei Arten mit RAM-Ventilation). Dies stellt in gewöhnlich, aber nicht immer, sicher, dass der Fisch gestorben ist. Alternative effektive Methoden sind Genickbruch, Durchtrennung der Wirbelsäule, und Ausbluten, die alle bei tief betäubten Fischen angewendet werden können. Erst seit kurzem existieren Zweifel über die Eignung von MS-222 als Wirkstoff für Ruhigstellung, Betäubung und Euthanasie in Fischen, da in Zebrabärblingen, die MS-222 ausgesetzt waren, Vermeidungsverhalten beobachtet wurde 116 117 118. Besondere Sorgfalt sollte aufgewendet werden, um geeignete Sedierung und Schmerzfreiheit vor der Euthanasie zu gewährleisten. Die Wahl eines geeigneten Protokolls hängt primär vom Zustand und der Art des Fisches ab. Die Kriterien hierfür sind praktisch identisch mit jenen für die Wahl geeigneter Betäubungsmethoden. Nach dem Abtöten sollten die Überreste nach den gebräuchlichen Vorgaben entsorgt werden. Normalerweise sollte ein Fisch in einer dafür geeigneten Einrichtung eingeäschert werden. Bei genetisch veränderten Fischen müssen zusätzliche Vorschriften beachtet werden. 6.11 Anästhesie und Euthanasie beim Zebrabärbling Nach der neuesten Übersicht über Betäubung und Euthanasie bei Zebrafischen durch Matthews & Varga 119 , ist MS-222 das am häufigsten gebrauchte Beruhigungs- und Betäubungsmittel beim Zebrabärbling. Die Dosis-Wirkungs-Beziehung von MS-222 hängt von Alter, Größe und metabolischem Zustand ab. Eine Zunahme der Sensitivität gegenüber MS-222 konnte in 3 bis 9 Tage alten Larven beobachtet werden, wahrscheinlich durch die Veränderungen der Detoxifizierungsaktivität in der Leber. Mittlere tödliche Konzentrationen bei 4 bis 7 Tage alten Zebrabärblingslarven deuten auf fundamentale Veränderungen in der Entwicklung hin, die mit der Reifung der Kiemen 120 und der Leber 121 , 122 einhergehen. MS-222 wird häufig für die Sedierung (0,01 mg/ml 123), die Betäubung (0,168 mg/ml 124) und das Abtöten (0,2 – 0,3 mg/ml 125) von Zebrabärblingen verwendet. 116 Nordgreen, J., Tahamtani, F.M., Janczak, A.M., Horsberg, T.E. (2014) Behavioral effects of the commonly used fish anesthetic tricaine methanesulfonate (MS-222) on zebrafish (Danio rerio) and its relevance for the acetic acid pain test. PLoS ONE 9(3): e92116. doi:10.1371/journal.pone.0092116 117 Readman, G.D., Owen, S.F., Murrell, J.C., Knowles, T.G. (2013) do fish perceive anesthetics as aversive? PLoS ONE 8(9): e73773. doi:10.1371/journal.pone.0073773 118 Wong, D., von Keyserlingk, M.A:G., Richards, J.G., Weary, D.M. (2014) Conditioned place avoidance in zebrafish (Danio rerio) to three chemcials used for euthanasia and anesthesia. PLoS ONE 9(2): e88030. doi:10.1371/journal.pone.0088030 119 Matthews, M., Varga, Z.M. (2012) Anesthesia and euthanasia in zebrafish. ILAR J. 53: 192-204 120 Shadrin, A.M., Ozernyuk, N.D. (2002) Development of the gill system in early ontogenesis of the zebrafish and nine-spine stickleback. Ontogenez. 33: 118-123. 121 Field, H.A., Ober, E.A., Roeser, T., Stainier, D.Y. (2003) Formation of the digestive system in zebrafish. I. Liver morphogenesis. Dev. Biol. 253: 279-290. 122 Sakaguchi, T.F., Sadler, K.C., Crosnier, C., Stainier, D.Y. (2008) Endothelial signals modulate hepatocyte apicobasal polarization in zebrafish. Curr Biol. 18: 1565-1571. 123 Trevarrow, B. (2007) Section 7.59. In: The zebrafish book: A guide for the laboratory use of zebrafish (Danio rerio; Westerfield, M., ed.). Eugene, University of Oregon Press. 124 Westerfield, M. (2007) The zebrafish book: A guide for the laboratory use of zebrafish (Danio rerio). Eugene, University of Oregon Press. 72 International Zebrafish Medaka Course IZMC Im Vergleich mit MS-222 scheint Eugenol mehrere Vorteile für den Zebrabärbling zu haben, z.B. Verfügbarkeit, geringe Kosten und geringere Betäubungsmittel-Dosen. Einige Stadien und vollständige Betäubung werden mit vergleichsweise geringeren Konzentrationen weniger schnell mit Eugenol induziert, jedoch dauert die Erholungsphase länger als mit MS-222 126. Eine Dosis von 2 - 5 mg/L wird empfohlen, um adulte Zebrabärblinge ruhigzustellen, 60 - 100 mg/L, um sie zu betäuben 127 . Des Weiteren hat Eugenol einen besseren Sicherheitsfaktor und scheint die Effekte von dichtem Besatz und Behandlungsstress bei der Dickkopfelritze (Pimephales promelas) zu mindern. Diese Annahme beruht auf der Analyse von Cortison-Werten im Plasma und neutrophilen Funktion, wohingegen bei MS-222 keine Verringerung der Stressantwort gemessen werden konnte 128,129. Obwohl es wohl Beweise dafür gibt, dass die Kühlung (Hypothermie) als Betäubungsmittel bei einigen Arten angewendet werden kann, empfehlen Matthews & Varga 130 Hypothermie nicht als Betäubungsmethode beim Zebrabärbling. Nach ihrer Argumentation wird die Kühlung besser zur Immobilisierung verwendet, wo sie deutlich wirksamer ist als z.B. eine Überdosis MS-222. Im Gegensatz dazu propagieren sie den Gebrauch von Thermoschock in Kombination mit einer unmittelbaren Mazeration des Schädels mittels eines in die Spüle eingebauten Häckslers. Dies führt zu einer sofortigen Zerstörung jeglicher Gehirnfunktion und -aktivität im adulten Zebrabärbling. Hypothermaler Schock ist anscheinend weniger stressig, führt schneller zum Tod als das Ausbleiben von Lebenszeichen (Bewegung des Operculums, Gleichgewicht, und Herzschlag), ist beständiger, leichter durchzuführen und sicherer für das Personal als der Gebrauch von MS-222 131 . Histopathologische Untersuchungen von adulten Zebrabärblingen brachten keinen Nachweis von Eiskristallbildung 132. Für 5 bis 6 Tage alte (‚early stage‘) Embryonen und Larven ist der Gebrauch von MS222 auch in sehr hohen Konzentrationen bis 1000 mg/L keine effektive Methode, um sie abzutöten, da sie ihren Sauerstoffbedarf über die Haut decken. Daher ist für diese frühen Entwicklungsstadien hypothermischer Schock eine effektivere Methode, solange sie für mindestens 20 Minuten inkubiert werden. Für 1 bis 2 Tage alte Embryonen ist jedoch auch das schnelle Abkühlen keine effektive Methode zum Abtöten. Es braucht mindestens 5 bis 14 Stunden Exposition, um den Eintritt des Todes gewährleisten zu können 133 . Daher müssen dem Eiswasser Chemikalien wie Isopropanol hinzugefügt werden, um den Tod der Zebrabärblingsembryonen sicher und schnell herbeizuführen. 125 Wilson, J.M., Bunte, R.M., Carty, A.J. (2009) Evaluation of rapid cooling and tricaine methanesulfonate (MS222) as methods of euthanasia in zebrafish (Danio rerio). JAALAS 48: 785-789. 126 Grush, J., Noakes, D. (2004) The efficacy of clove oil as an anesthetic for the zebrafish, Danio rerio (Hamilton). Zebrafish 1: 46-53. 127 Grush, J., Noakes, D. (2004) The efficacy of clove oil as an anesthetic for the zebrafish, Danio rerio (Hamilton). Zebrafish 1: 46-53. 128 Palic, D., Herolt, D., Andreasen, C., Menzel, B. (2006) Anesthetic efficacy of tricaine methanesulfonate, metomidate and Eugenol: Effects on plasma cortisol concentration and neutrophil function in fathead minnows (Pimephales promelas Rafinesque, 1820). Aquaculture 254: 675-685. 129 Welker, T., Lim, C., Yildirim-Aksoy, M. (2007) Effect of buffered and un-buffered tricaine methanesulfonate (MS222) at different concentrations on the stress responses of channel catfish, Ictalurus punctatus. J Appl. Aquacult. 130 Matthews, M., Varga, Z.M. (2012) Anesthesia and euthanasia in zebrafish. ILAR J. 53: 192-204. 131 Wilson, J.M., Bunte, R.M., Carty, A.J. (2009) Evaluation of rapid cooling and tricaine methanesulfonate (MS222) as methods of euthanasia in zebrafish (Danio rerio). JAALAS 48: 785-789. 132 Blessing, J.J., J.C. Marshall, and S.R. Balcombe, Humane killing of fishes for scientific research: a comparison of two methods. Journal of fish biology, 2010. 76(10): p. 2571-7. 133 Matthews, M., Varga, Z.M. (2012) Anesthesia and euthanasia in zebrafish. ILAR J. 53: 192-204. 73 International Zebrafish Medaka Course IZMC 7. Verfahren zur Gewährleistung der Gesundheit, dem Wohlergehen und der Pflege von Zebrafischen (Danio rerio) und Medakas (Oryzias latipes) (Uwe Strähle, Steffen Scholpp, Sandra Lechleiter) 7.1 Fischkrankheiten 134 7.1.1 Erkennen von typischen Krankheitssymptomen und Krankheitserregern Hautveränderungen: Manche Erkrankung gehen mit Hauttrübung einher. Die sonst klare Schleimhaut wird glasig-trüb oder rötet sich und feine Blutgefäße sind plötzlich zu sehen. Hautentzündungen können auch in Geschwürform auftreten und so tief werden, dass man die rote Muskulatur darunter sieht. Oder die Schuppen stellen sich teilweise auf und röten sich. Auch größere Parasiten wie Karpfenläuse und Ankerwürmer können schon mit bloßem Auge erkannt werden, Auflagerungen wie Hauttumoren sind gleichfalls sehr auffällig. Veränderung der Atemfrequenz: Normalerweise atmet ein Fisch ruhig und regelmäßig, etwa 80 Schläge des Kiemendeckels pro Minute. Beschleunigte Atmung ist häufig bei Fischen zu sehen, die sich in Richtung des Wassereinlaufes stellen, da dort meist das sauerstoffreichste Wasser anzutreffen ist. Bei bestimmten Kiemenerkrankungen kann einseitiges Kiemendeckelklemmen erkennbar sein. Das sieht so aus, als ob der Fisch mit nur einer Kieme atmen würde. Veränderung des Auges: Eingesunkene Augen sind ein Zeichen für todkranke Fische, die alle Reserven aufgebraucht haben. Glotzaugen, die weiter über den Kopf hinaus stehen als üblich, können ein Zeichen für Bluthochdruck, aber auch für schwere Nierenerkrankungen sein. Veränderung der Körperform: Das kann eine Verkrümmung der Körperachse sein oder plötzliche Beulen, die den sonst symmetrischen Fisch einseitig verändern. Abmagerung ist erkennbar, wenn der Fisch hinter dem Kopf sehr schmal wird und die Rückenmuskeln verschwinden. Veränderung der Flossen: Flossenstrahlen können rot und entzündet sein, Flossen reißen plötzlich ein oder sehen ausgefranst aus. Besonders die Schwanzflosse zeigt mit abgestorbenen Rändern an, wenn der Fisch zu wenig Sauerstoff in den Körper befördert. Auf den Flossen gibt es auch weiße oder andersfarbige Auflagerungen oder Verletzungen mit Bruch der Flossenstrahlen. Die Flossenbasis, wo die Flossen angewachsen sind, kann durch Entzündungen verändert sein, der Fisch klemmt und schont dann die betroffene Flosse. Bei Parasitenbefall und Unwohlsein durch Kälte oder Infektionskrankheiten sitzen die Fische häufig am Boden und klemmen alle Flossen ein. 134 http://zebrafish.org/zirc/health/diseaseManual.php BSAVA Manual of Ornamental Fish, Editor William H. Wildgoose -second edition- British Small Animal Veterinary Association, 2001, ISBN 0-905214-57-9 Fish Disease - Diagnosis and Treatment, Editor E. Noga -Second edition- Blackwell Publishing, 2010, ISBN 978-08138-0697-6 74 International Zebrafish Medaka Course IZMC 7.1.2 Beschreibung der wichtigsten, relevanten Erkrankungen Protozoen auf Haut und Kiemen, sog. Hauttrüber Costia, Chilodonella, Trichodina: Die Symptome sind meist Hauttrübung, Juckreiz mit Scheuern an Gegenständen, beschleunigte Atmung, Hautrötung, machmal auch schwarze Flecken in der Haut. Durch mikroskopische Untersuchungen von Haut und Kiemen kann man den Erreger identifizieren und danach gezielt behandeln. Hauttrüber sind typisch für suboptimale Temperaturen oder schlechte Haltungsbedingungen/Hygiene. Ichthyopthirius multifiliis, Erreger der Pünktchenkrankheit (ich): Weiße Punkte sind mit bloßem Auge in den Flossen am besten zu erkennen. Meist wird man an die Weißpünktchenkrankheit denken, verursacht durch den Ciliaten Ichthyophthirius multifiliis. Sie verursacht starken Juckreiz, Atembeschwerden und Flossenklemmen, alles Allgemeinsymptome, die für Haut- und Kiemenentzündungen sprechen. Ein Hautabstrich, der mikroskopisch untersucht wird, hilft, die Diagnose abzusichern. Der sehr unterschiedlich große (bis 1 mm!) Ciliat bewegt sich mit langsamen Drehbewegungen im Epithel von Haut und Kiemen. Die größten Stadien besitzen den pathognomischen hufeisenförmigen Kern. Die Entwicklung erfolgt über ein Zystenstadium mit intrazellulärer Zellteilung und über hieraus entlassene Schwärmer, die aktiv im Wasser schwimmen und den Fisch befallen. Dort bohren sie sich in die Schleimhaut ein und wachsen heran. Ichthyophthirius gilt als echtes Pathogen und muss wegen seines Entwicklungszyklus mindestens 5 Tage lang behandelt werden. Die Badebehandlungen können nur die Schwärmerstadien erfassen. UV-Licht tötet die Stadien im freien Wasser ebenfalls sehr effektiv ab und verhindert daher prophylaktisch eine Infektion in einem zirkulierenden System. Samtkrankheit: Der Erreger Piscinoodinium pillulare ist ein Dinoflagellat, der sich sehr schnell vermehrt und für viele Fischarten ein Pathogen darstellt. Die Haut und Kiemen werden von Dinosporen befallen, die sich anhaften und vom Epithel ernähren. Im Gegensatz zu “ich”, lebt der Erreger jedoch auf und nicht in der Schleimhaut. Wie bei „ich“ gibt es ein Vermehrungsstadium außerhalb des Fische und aktiv bewegliche, infektiöse Stadien im Wasser. Der gesamte Lebenszyklus dauert bei aquaristischen Wassertemperaturen zwei Wochen. Die Symptome sind samtartige Veränderung der Haut und Lethargie, schnelle Atmung und Tod in kurzer Zeit. Die Diagnose wird mikroskopisch gestellt: Oodinium ist ein ovaler und nicht aktiv beweglicher Einzeller, der im Lichtmikroskop weitgehend undurchsichtig erscheint. An einem Pol ist eine aufgehellte Stelle typisch. Die Infektion der Kiemen geht einher mit einer auffälligen Epithelhyperplasie, die Hautschleimhäute können blutig erodiert sein. Da es sich um einen Dinoflagellaten handelt, sind hier nur kupferhaltige Präparate für die Bekämpfung aussichtsreich. Protozoen in den inneren Organen Microsporidien: Mikrosporidien sind Sporentierchen, die intrazellulär in den inneren Organen leben und einen sehr komplizierten Lebenszyklus durchlaufen. Befallene Fische können Abmagerung oder Wirbelsäulenverkrümmung zeigen, was jedoch auch bei anderen Erkrankungen auftreten kann. Untersuchungen haben gezeigt, dass 75 International Zebrafish Medaka Course IZMC Zebrafische besonders häufig Pseudoloma neurophila beherbergen, viele auch ohne jegliche Krankheitssymptome zu zeigen. Bei Microsporidien gibt ein Sporenstadium, das außerhalb des Körpers überleben kann und möglicherweise über die Aufnahme mit dem Futter im Darm für andere Fische infektiös ist. Eine horizontale Übertragung über das Ei wird untersucht. Die Diagnose kann nativ in Quetschpräparaten von Hirn, Muskulatur, Eierstock und Niere gestellt, über histologische Untersuchungen mittels HE Färbung, Gramfärbung (z.B. Accustain® von Sigma-Aldarich) nachgewiesen werden. Die eleganteste Methode ist die PCR, wie sie am Zebrafish International Resource Center (ZIRC) durchgeführt und auch im KIT verwendet wird. Die verschiedenen Stadien umfassen ein Sporenstadium mit ovalen Sporen, die an einem schmalen Pol eine deutliche Vakuole besitzen und ca. 5,4 x 2,7 μm groß sind. Darüber hinaus sind Xenome mit bis zu 16 Sporen im ZNS anzutreffen. Die Übertragung kann durch UV-Licht verhindert werden, daher ist dies die beste Prophylaxe. Zudem gelten alle Maßnahmen, die üblich sind, um die Übertragung von Erregern von einem Stock auf den anderen zu verhindern: Kranke Tiere, die abgemagert sind oder krumm, sollten tierschutzgerecht getötet werden. Die weiblichen Laichfische sollten mittels der PCR 4x im Jahr mit statistisch relevanten Probezahlen untersucht werden (siehe 7.5.). Die Übertragung von Wildfängen auf Labortiere kann durch ein Hygienemanagement und gut fachliche Praxis vermieden werden. Wildfänge dürfen nach der Eigewinnung nicht in Systeme mit Laborfischen gesetzt werden. Die stressfreie Umwelt hilft dabei, Infektionen zum Ausbruch zu bringen. Metazoen Myxosporidien: Lange Zeit hat man Myxosporidien als einzellige Lebewesen gesehen. Sie sind heute jedoch ins Reich der Metazoen eingeordnet. Viele leben in Organhohlräumen, wie der Gallenblase und den Gallengängen oder der Niere, andere leben direkt im Gewebe. Sie verursachen in beiden Fällen wenig Gewebezerstörung, außer wenn große Zahlen von Zysten in lebenswichtigen Organen wie dem ZNS, den Kiemen oder dem Herzen auftreten. Der Lebenszyklus ist sehr kompliziert und verläuft über mehrere vegetative Stadien, die in der Produktion von mehrzelligen Myxosporen enden. Ihre Morphologie wird zur Diagnose herangezogen. Weitere Stadien befinden sich außerhalb des Wirtes und meist ist ein Zwischenwirt eingeschaltet, wenn auch einzelne Myxosporidien eine direkte Entwicklung durchlaufen können. In most cases the infection is asymptomatic. Die Erkrankung verläuft meist ohne Symptome. Bei histologischen Untersuchungen am ZIRC sind in Zebrafischen Xenome von Myxidium oder Zschokkella nachgewiesen worden. Mittels Giemsa-Färbung kann man die Polkapseln und Sporen besser erkennbar machen. Auch mit den eigentlich für die Blutuntersuchung verwendeten Testsimplets® kann man die Sporen in 1000-facher Vergrößerung sehr gut sichtbar machen. Die Infektion kann mit Naturnahrung (Oligochäten) eingeschleppt werden, ist aber auf Grund der geringen Pathogenität nicht behandlungswürdig. Nematoden: Bei Laborfischen sind es besonders die Fadenwürmer aus der Gattung Capillaria, die relativ häufig sind. Bei Zebrafischen sind Pseudocapillaria tomentosa nachgewiesen worden. Diese können über einen Zwischenwirt wie Tubifex tubifex, verbreitet und eingeschleppt werden, es ist aber auch eine direkte Infektion über die Aufnahme von Eiern möglich. Die adulten Würmer können sich auch in der Körperhöhle von Zebrafischen aufhalten. Ein Massenbefall im Darm kann chronische Abmagerung 76 International Zebrafish Medaka Course IZMC hervorrufen, bei Zebrafischen ist zudem eine erhöhte Anzahl von Neoplasien bei Anwesenheit von Capillaria nachgewiesen worden. Die Diagnose kann durch Nachweis der typischen Eier (zitronenförmig mit zwei Polkapseln) in Kotproben oder bei der Sektion in Darmquetschpräparaten oder Darminhalt gestellt werden. Die Würmer sind nicht mit dem bloßen Auge erkennbar. Eine Behandlung mit verschiedenen Antihelmintika ist möglich. Da sich die Infektion in zirkulierenden Anlagen stapelt und eine große Zahl von Eiern im System vorhanden sein kann, sollte mehrmals behandelt und weitere hygienische Maßnahmen wie Filterreinigung und häufige Entfernung von Kot durch Absaugen getroffen werden. Bakterielle Probleme: Flavobacterium columnare: Columnarisbakterien gehören zu den gefährlichsten bakteriellen Krankheitserregern, besonders in zirkulierenden Anlagen. Sie können fast als hospitalistische Keime bezeichnet werden, denn sie neigen zu schneller Resistenzbildung und können besonders bei der Aufzucht von Fischen sehr pathogen sein. Futterreste und jede andere Art von Eiweißverbindungen sind die Nahrungsgrundlage, weshalb gute Hygiene und angemessene Fütterung wichtige prophylaktische Maßnahmen sind. Die Wasserqualität spielt eine wichtige Rolle, besonders sollten hohe Ammoniaklevels vermieden werden. Wichtig ist dies gerade beim Transport, daher sollten die Tiere nicht zu dicht gepackt werden. Columnarisbakterien können Kiemenentzündungen und -hyperplasien hervorrufen, was zu schneller Atmung führt. Meist stehen die Tiere dann unter der Wasseroberfläche. Flossenschäden und -einschmelzungen oder watteartige weiße Beläge können ebenfalls auftreten. Man erkennt die Bakterien nativ als gleitende Stäbchen, die sich nach einigen Minuten zu Konglomeraten zusammenballen. Sie sind in den inneren Organen, besonders in Quetschpräparaten der Milz, bei 400er Vergrößerung gut zu erkennen. Die Behandlung erfolgt in der Regel mit Chloramin T über mehrere Tage. Fischtuberkulose: Die Fischtuberkulose wird durch atypische Mykobakterien ausgelöst. Es handelt sich um Wasser- und Bodenkeime, die auf der ganzen Welt vorkommen und in praktisch allen Wildfängen häufig ohne Krankheitssymptome schlummern. Jede Form von Stress kann die in Granulomen abgekapselten Bakterien zur Vermehrung anregen und eine akute Erkrankung meist nur einzelner Tiere auslösen. Zu den wichtigsten Vertretern gehören Mycobacterium marinum und M. fortuitum. Die Fischtuberkulose ist die einzige Zoonose bei der Haltung von Zebrafischen oder Medaka. Sie verursacht chronische Hautentzündungen im Bereich der Hände oder der Arme, wo der Fischpfleger häufig kleine Wunden hat, die eine Eintrittspforte für die säurefesten Bakterien darstellen. In der Regel beschränkt sich die Infektion des Menschen auf Hautveränderungen. Symptome bei den erkrankten Fischen gehen einher mit Schuppensträube, Rückgratverkrümmung, Hautgeschwüren oder chronischer Abmagerung, je nachdem, welches Organsystem befallen ist. Bei der Untersuchung sollte man die Milz, die Kopfniere und die Gonaden sorgfältig untersuchen oder für die Histologie konservieren. Die Verdachtsdiagnose kann beim Nachweis der typischen Granulome mit zwiebelschalenartig geschichtetem Bindegewebe um eine gelblich verfärbte zentrale Nekrose gestellt werden. Der Erregernachweis wird kulturell in spezialisierten Labors, durch eine Ziehl-Neelson-Färbung mit Nachweis säurefester Stäbchen oder mittels PCR Technik geführt. 77 International Zebrafish Medaka Course IZMC 7.1.3 Behandlungen Die Behandlung sollte nur nach exakter Krankheitsdiagnose erfolgen. Eventuell muss alternativ eine Bestandstötung abgewogen werden, z.B., um eine Kontamination ganzer Anlagen zu verhindern, oder wenn eine Therapie nicht aussichtsreich erscheint. Da die meisten der Präparate verschreibungspflichtig sind, sollte ein Tierarzt eingeschaltet werden. Dieser muss die Dosierung, Behandlungsart und -dauer festlegen. Verfügbare Methoden zur Aufrechterhaltung eines angemessenen Gesundheitsstatus a. Allgemeine Behandlungsmethoden Krankheitserreger Behandlung Ichthyophthirius multifiliis (Pünktchenkrankheit) Trichodina Parasitenbäder mit Malachtigrünoxalat Formaldehyd Parasitenbäder mit Malachtigrünoxalat Formaldehyd Parasitenbäder mit Formaldehyd Malachitgrünoxalat Kupferhaltige Präparate aus dem Zoohandel Metronidazolhaltiges Bad oder Futter Toltrazuril (Baycox® von Bayer), Fumagillin Costia Oodinium Flagellaten im Darm Kokzidien Microsporidien Myxosporidien Gyrodactylus Cestoden Nematoden Karfenlaus (Argulus) Ankerwurm (Lernea) Bakterien Parasitenbäder mit Wurmmitteln Antiparasitaria angereichert oder und/oder und/oder und/oder Futter mit Mechanisch entfernen (Pinzette) Lokale Wunddesinfektion Parasitenbad mit Diflubenzuron Tupferprobe nehmen! Bakteriologische Untersuchung und Antibiogram! Anwendung nach genauer Analyse Bestandsproblem/Einzeltierproblem Futter Bad Antibakterielle Bäder zur Keimdrucksenkung: Salzbäder Peroxide Chloramin-T Acriflavin b. Kochsalz als Therapeutikum (jod- und fluoridfrei!) Effekt Bakterizid Fungzid Amöbizid Protozid Desinfizierend Appetitanregend Stressminderung Förderung der Schleimhautproduktion Verbesserung der Kiemenfunktion Zeitschema Kurzzeitbäder: 10-20 g/Liter Wasser für 10 bis 20 Minuten an drei aufeinander folgenden Tagen Langzeitbäder/Beckenbehandlung: 1 bis 3 kg/1000 Liter als Dauerbad, nach Wasserwechseln nachdosieren Senkung der Nitritgifigkeit Algizid 78 Gefahren Nicht zusammen mit Zeolith oder vergleichbaren Materialien anwenden! Schädlich für Pflanzen! Ausreichend große Behälter verwenden, gut belüften, ggfs. Abdeckung verwenden International Zebrafish Medaka Course IZMC Verbesserung der Osmoregulation Ausgleich des Energiehaushaltes Haltungsbedingungen für Labortiere a. Mögliche Strategien zur Aufrechterhaltung angemessener Wasserbedingungen Ursache Maßnahme Erste Hilfe Aufhören zu füttern Wasseruntersuchung Wasserprobe zur Keimzahlbestimmung im Labor Filter/Rohrreinigung Teilwasserwechsel UV Funktion prüfen Teilwasserwechsel intensivieren UV Lampen ggfs. tauschen Pumpenleistung prüfen und ggfs. erhöhen Dimensionierung des Filters überdenken, zusätzliche Filter anschließen Sauerstoffversorgung verbessern Sofort Teilwasserwechsel, Ursache herausfinden, Filter reinigen, Futterstop für 3-7 Tage, eventuell lebende Bakterien oder Enzyme zum Ammoniakabbau oder frisches Zeolith einbringen Sofort Teilwasserwechsel, eventuell aufsalzen (Hinweise beachten!) Wasserqualität Ammoniak (über 0.1 mg/l) Nitrit (über 0.6 mg/l) pH Sturz (unter 5) pH zu hoch (über 9) Bakterieller Keimdruck Bakterien Parasiten Amöben Kupfer Metalle Ozon und Reaktionsprodukte Wasser seine im Ggfs. Wasser aufhärten zur besseren Pufferung Ggfs. pH-Steuerung warten lassen, pH-Sonden neu kalibrieren Algen rechtzeitig bekämpfen Beschattung Belüftung optimieren (weniger CO2 ausblasen) Pufferung mit Kreidekalk Teilwasserwechsel Anlagenhygiene Aufsalzen Keimdrucksenkende Mittel Bakteriologische Untersuchung und Antibiogramm Keimdrucksenkende Wasserbehandlung: Salz Chloramin-T Peroxid Acriflavin Virkon S Actomar B100 Ggfs. Antibiotische Injektionen oder Futter Je nach Diagnose: Parasitenbad Aufsalzen auf 0.5% (Hinweise beachten!) Zulauf aus Leitungsrohren und Zisternen überprüfen Teilwasserwechsel mit geeignetem Wasser Wasseruntersuchung auf Schwermetalle einleiten Verwendete Metalle in der Anlage überprüfen, geeignet ist nur V2A Stahl und höher Verarbeitung verschiedener Metalle an einem Werkstück ändern (wegen der Gefahr der Elektrolyse) Anlagen ausschalten und ggfs. Warten lassen War Ozon die Ursache, warden die Fische innerhalb weniger Stunden wieder besser aussehen 79 International Zebrafish Medaka Course IZMC b. Krankheitsprophylaxe Zur Krankheitsprophylaxe zählen alle Maßnahmen, die verhindern, dass sich Keime im System übermäßig anreichern oder neue Keime von außen eingeschleppt und in den Anlagen verbreitet werden. Somit ist es nötig, sich mit guter Praxis um die Filter-, Wasser- und Beckenpflege zu beschäftigen. Im Einzelnen sollten folgende Grundregeln beachtet werden: • UV-Strahler müssen regelmäßig kontrolliert und ggfs. entkalkt werden. Die festgelegte Brenndauer (meist 6 Monate bis 1 Jahr) sollte nicht überschritten werden. • Je nach Fischbesatz ist ein 5-10%iger Wasseraustausch mit Leitungswasser pro Tag in den Anlagen anzustreben. • Für die Filterpflege und Beckenreinigung sollten Routinezeiten festgelegt und dokumentiert werden. • Tote Fische müssen schnellstmöglich aus den Becken entfernt werden. • Gesunde Becken zuerst, kranke Fische zuletzt versorgen. • Kein Naturfutter/Lebendfutter verwenden. • Futterreste immer schnellstmöglich entfernen. • Fütterung immer vor den Pflegemaßnahmen oder nachdem die Hände gründlich gereinigt und desinfiziert wurden. • Kescher, Becher und andere Fangeinrichtungen immer nach Gebrauch gründlich reinigen und abtrocknen lassen (z.B. auf der Heizung). • Das Bleachen der Eier ist eine zentrale und extrem wichtige Anforderung bei der Erhaltung der Blutlinien. Besonders, wenn Blutauffrischung erforderlich wird und neuen Elterntiere verwendet werden, sollten die gebleachten Eier in frische Becken überführt werden und nicht mehr mit den Eltern in Kontakt kommen. • Neue Fische immer in Quarantäne nehmen und von den anderen Tieren trennen. Quarantäne für mindestens 3 Wochen einplanen. • Strikte Trennung aller Fischräume und Kreisläufe hinsichtlich der Gerätschaften und Versorgung. Beim Wechsel von Kreislauf zu Kreislauf ist Händewaschen eine wichtige Prophylaxemaßnahme. 80 geeignetem International Zebrafish Medaka Course IZMC 7.1.5 Probezahlen für Gesundheitsüberwachung 135 Wenn man einen Fischbestand von 10 bis zu 100 Tieren mit einer 95% Sicherheit beproben will, sollten mindestens 10 Tiere pro Beckeneinheit untersucht werden. Eine Beckeneinheit sind alle Becken, die in einem Kreislauf zusammen gefiltert werden. Höhere Probenzahlen erhöhen die Aussagekraft stark. Man kann je nach Validierung des anzuwendenden Testverfahrens manchmal auch Probenpools untersuchen. 7.2 Liste von potentielle Gesundheitsrisiken beim Kontakt mit Zebrafischen oder Medaka Zoonose beschreibt Krankheiten, die von Tieren auf den Menschen übertragen werden können. Das Risiko der Übertragung von Fischen auf Menschen ist generell sehr niedrig. Jedoch gibt es Krankheiten, die durch Kontakt mit dem Aquarienwasser auf den Menschen übertragen werden können. Im allgemeinen erkranken Menschen wenn sie infiziertes Fischfleisch aufnehmen (orale Aufnahme)oder über Kontamination von verletzter Haut. Eine wichtige Eigenschaft von Bakterien ist die Möglichkeit einer opportunistische Infektion, d.h. das der menschliche Wirt bereits ein geschwächtes Immunsystem aufweist. Folgende Erreger können Zoonosen bedingen: Mycobakterium Bakterien die zur Gattung der Mykobakterien gehören zu den stäbchenförmige, grampositiven Bakterien. Zwei Vertreter der Mykobakterien, Mycobacterium marinum und M. fortuitum sind Pathogene für tropische Fische. Menschen können typischerweise den Erreger beim Kontakt mit Aquarienwasser über verletzte Hautstellen aufnehmen. Ein Granulom-ähnliches Knötchen kann sich an der Infektionsstelle bilden. Diese erscheinen dann als rote, sich vergrößernde Knötchen typischerweise wenige Wochen nach der Infektion. Die Infektion kann sich bis in die Lymphknoten ausweiten. Diese Krankheit tritt normalerweise nur bei Menschen mit geschwächtem Immunsystem auf. Aeromonas spp sind fakultativ anaerobe, gram-negative stäbchen-förmige Bakterien, die zur intestinalen Microflora in tropischen Fischen gerechnet werden. Menschen mit einer Aeromonas Infektionen können vielfältige Syndrome, wie z.B. Gastroenteritis oder lokale Wundinfektion, zeigen. Auch hier sind Infektionen besonders in immunsupprimierten Patienten zu beobachten. Bakterien und Einzeller die in dokumentierten Fällen zu Infektionen im Menschen geführt haben sind Gram-negative Organismen: Plesiomonas shigelloides, Pseudomonas fluorescens, Escherichia coli, Salmonella spp., Klebsiella spp., Edwardsiella tarda 135 Amtliche Methodensammlung: Stand Mai 2013 / Hrsg.: Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit; Redakt.: T. Homeier-Bachmann, H. Kubitza. - Wusterhausen : Friedrich-Loeffler-Institut, Bundesforschungsinstitut für Tiergesundheit, 2013. - 514 S. 81 International Zebrafish Medaka Course IZMC Gram-positive Organismen: Streptococcus, Staphylcocccus, Clostridium, Erysipelothrix, Nocardia Einzeller: Cryptosporidum Allergische Reaktionen Fisch-Proteine können gegebenenfalls allergische Reaktionen bei Menschen hervorrufen. Allerdings sind dokumentierte Fälle sehr selten und eventuell durch Hypersensibilisieren über direkten Kontakt oder Inhalation zu begründen. Verfahren um Infektionen zu vermeiden Hände waschen. Die einfachste und effektivste Art sich vor einer Kontamination zu schützen ist ausführliches und regelmäßiges Händewaschen. Dies schließt das Reinigen der Unterarme ein. Des Weiteren soll auf Rauchen, Trinken und Essen in Tierräumen verzichtet werden. Schutzhandschuhe tragen. In Situationen in denen die Hände längere Zeit Aquarienwasser ausgesetzt sind, es offenen Wunden oder Schnitte gibt, sollten Schutzhandschuhe getragen werden. Im Falle eines Verletzung: In diesem Fall ist es wichtig unverzüglich den Leiter/Aufsichtsführenden zu informieren. Handelt es sich um kleiner Verletzungen können diese sofort mit antibakterieller Seife gesäubert und vor weiterer Kontamination geschützt werden. Bei größeren Verletzungen sollte der Leiter/Aufsichtsführenden kontaktieren und ebenfalls Kontakt mit dem Arbeitsschutz-/Sicherheitsbeauftragten aufgenommen werden. Den behandelnden Arzt informieren. Bei Krankheiten sollte der Arzt darüber informieret werden, daß mit Fischen gearbeitet wird. Viele Zoonosen haben Fieberähnliche Symptome. Der behandelnde Arzt benötigt diese spezielle Information um gegebenenfalls eine akkurate Diagnose erstellen zu können. 82 International Zebrafish Medaka Course IZMC 8 Statistische Analyse 136 (Markus Reischl) Das deutsche Tierschutzgesetz aus dem Jahre 2013 bestimmt in § 7 (1)1.b), dass die Anzahl an Tieren, die in Experimenten verwendet werden, auf eine für den Versuch unbedingt erforderliche Anzahl an Individuen beschränkt werden muss. Die Tierschutzversuchstierverordnung (TierSchVersV), die dieser Gesetzgebung folgt, legt fest, dass die Anzahl der benötigten Tiere als auch die Art, wie diese Anzahl berechnet wurde, in einem „Tierversuchsantrag“ dargelegt und begründet werden müssen. Entsprechend müssen die Fragen in Abschnitt 1.4.2 des Antragsformulars beantwortet werden, und das Formular „Angaben zur biometrischen Planung“ muss ausgefüllt und beigelegt werden. Behörden und Ethikkommissionen legen besonderen Wert auf eine umfassende Beschreibung dieser Berechnungen und eine kompetente biometrische Rechtfertigung der Tieranzahlen für Experimente. Für umfangreiche Studien wird daher dringend empfohlen, einen erfahrenen Biometriker oder Statistiker bereits in den frühen Phasen der Antragstellung zu kontaktieren und um Hilfestellung zu bitten. Idealerweise wird einem Antrag zudem ein schriftliches Gutachten des Biometrikers beigelegt. In einfachen Studien, die nur Mittelwerte von Experimentparametern vergleichen, kann folgendermaßen vorgegangen werden: Ein Experiment ist vorab einzuteilen in Experimentgruppen (negative Kontrollgruppe auch Negativkontrolle genannt, Effektgruppe 1, Effektgruppe 2 usw.), die zu untersuchen sind. Jede Gruppe besteht wiederum aus einzelnen Experimentwiederholungen oder -ausprägungen , die typischerweise durch eine Variable 𝑥𝑥, beschrieben werden. Beispiele sind die Intensität einer Fluoreszenz, die Anzahl an Zellen oder die Fläche eines fluoreszierenden Organs. Die Anzahl der notwendigen Tiere in jeder Experimentgruppe kann dann auf der Basis von Vorversuchen oder Informationen aus der Literatur ermittelt werden, in denen diese Variable ebenfalls erhoben wurde. Hierfür ist es zwingend erforderlich aus den Vorversuchen Informationen ablesen zu können, wie sich die Variable im Falle einer negativen Aussage (z.B. negative Kontrollgruppe, die keinen Effekt aufweist, z. B. keine erhöhte Fluoreszenz, die in einer Larve zu sehen ist.) auswirkt und wie sie sich verhält, wenn ein Effekt zu beobachten ist (z.B. Erhöhung einer Fluoreszenz). 136 ERDFELDER, E.; BUCHNER, A.; FAUL, F.; BRANDT, M.: Allgemeine Psychologie und Deduktivistische Methodologie, Kap. GPOWER: Teststärkeanalysen leicht gemacht., S. 148–166. Vandenhoeck & Ruprecht, 2004. MAYR, S.; ERDFELDER, E.; BUCHNER, A.; FAUL, F.: A short tutorial of GPower. Tutorials in Quantitative Methods for Psychology 3 (2007), S. 51–59. 83 International Zebrafish Medaka Course IZMC Mittelwert (m) und Standardabweichung (s) aller 𝑥𝑥𝑖𝑖 der negativen Kontrolgruppe und der Effektgruppe müssen dann berechnet werden. Sind n Werte gemessen worden, lassen sie sich gemäß 𝑛𝑛 1 𝑚𝑚 = � 𝑥𝑥𝑖𝑖 𝑛𝑛 𝑖𝑖=1 𝑛𝑛 1 𝑠𝑠 = � �(𝑥𝑥𝑖𝑖 − 𝑚𝑚)2 𝑛𝑛 − 1 𝑖𝑖=1 bestimmen. Die Berechnung ist in EXCEL mittels der Befehle MITTELWERT und STABW möglich. Auf diese Weise wird für die Negativkontrolle eine Mittelwert 𝑚𝑚𝑐𝑐 und eine Standardabweichung 𝑠𝑠𝑐𝑐 , erhalten, für die Effektgruppe analog Mittelwert 𝑚𝑚𝑒𝑒 und Standardabweichung 𝑠𝑠𝑒𝑒 . Beispiel: Ein Experiment misst den Effekt einer Substanz auf die Expression eines Reporter-Transgens. Eine negatives Kontrollexperiment mit DMSO wurde 11 Mal wiederholt und lieferte die folgenden relativen Expressionsniveaus des ReporterTransgens: 0; 2; 2; 1; 0; 1; 1; 3; 0; 0; 1. Ein Experiment mit einer aktiven Substanz lieferte einen Effekt und zeigte die folgenden relativen Expressionsniveaus: 2; 4; 2; 3; 4; 3; 2; 3; 3; 5; 2. Der Mittelwert des Kontrollexperiments ist 𝑚𝑚𝑐𝑐 = 1 und kann in EXCEL berechnet werden durch MITTELWERT(0; 2; 2; 1; 0; 1; 1; 3; 0; 0; 1) Die Standardabweichung ist 𝑠𝑠𝑐𝑐 = 1 und wird berechnet durch STABW(0; 2; 2; 1; 0; 1; 1; 3; 0; 0; 1). Entsprechend liefert das Experiment mit der aktiven Substanz die Werte 𝑚𝑚𝑒𝑒 = 3 und 𝑠𝑠𝑒𝑒 = 1. Sind die berechneten Standardabweichungen gleich (𝑠𝑠𝑒𝑒 = 𝑠𝑠𝑐𝑐 = 𝑠𝑠), kann die Anzahl der für signifikante Ergebnisse benötigten Tiere berechnet werden durch 2 2�𝑧𝑧1−𝛽𝛽 +𝑧𝑧1−𝛼𝛼 �𝑠𝑠 𝑛𝑛 ≈ � � . 𝑚𝑚𝑐𝑐 − 𝑚𝑚𝑒𝑒 Wobei 𝑧𝑧1−𝛼𝛼 and 𝑧𝑧1−𝛽𝛽 statistische Parameter sind, die Tabellenwerken entnommen werden können (Werte der Verteilungsfunktion der Standardnormalverteilung). 𝑧𝑧1−𝛼𝛼 hängt vom gewünschten Signifikanzniveau 𝛼𝛼 ab und beschreibt die Qualität des statistischen Ergebnisses (Prozentsatz von falsch positiv gewerteten Versuchen). 𝑧𝑧1−𝛽𝛽 hängt von der sogenannten Macht des statistischen Tests 𝛽𝛽 ab, die die Anzahl der Falsch−Negativen bewertet. 𝛼𝛼 und 𝛽𝛽 können zwischen 0 und 1 frei gewählt werden. Je kleiner sie sind, desto zuverlässiger ist das Ergebnis der statistischen Auswertung, oft wird, 𝛼𝛼 viermal kleiner gewählt als β. 84 International Zebrafish Medaka Course IZMC Wenn keine spezielle statistische Analyse erforderlich ist, dürfen Standardparameter für die biometrische Fallzahlplanung verwendet werden: Hiefür wird 𝛼𝛼 auf 0.05 gesetzt, es ergibt sich dann 𝑧𝑧1−𝛼𝛼 =1.65, 𝛽𝛽 wird auf 0.2 gesetzt, womit 𝑧𝑧1−𝛽𝛽 = 0.84. Jegliche andere Wertkombination von 𝛼𝛼 und 𝛽𝛽 kann durch den EXCEL- Befehl NORM.INV(1 − 𝑤𝑤𝑤𝑤𝑤𝑤𝑤𝑤; 0; 1) berechnet werden. Beispiel: Aus dem vorhergenden Experiment wurde 𝑚𝑚𝑐𝑐 = 1, 𝑚𝑚𝑒𝑒 = 3 und (𝑠𝑠𝑒𝑒 = 𝑠𝑠𝑐𝑐 = 𝑠𝑠 = 1) berechnet. Für das zu planende Experiment sind Falsch-Positive Fehlerraten von maximal 1% (=Signifikanzniveau α = 0.01), und Falsch-Negative Fehlerraten von 10% (=Macht β= 0.1) sicherzustellen. Es ergibt sich 𝑧𝑧1−𝛼𝛼 = 𝑧𝑧0.99 = NORM.INV(1 − 0,01; 0; 1) = NORM.INV(0,99; 0; 1) = 2.32 𝑧𝑧1−𝛽𝛽 = 𝑧𝑧0.9 = NORM.INV(1 − 0,1; 0; 1) = NORM.INV(0,9; 0; 1) = 1.28. Werden diese Werte in o.g. Formel eingesetzt, ergibt sich 𝑛𝑛 ≈ � 2 2 ∙ (1.28 + 2.32) ∙ 1 � ≈ 12.96. 3−1 Somit muss das zu planende Experiment 12.96 Tiere enthalten, in jeder Gruppe mindestens 12.96/2 = 6.48. Aufgerundet ergibt sich die Anzahl der pro Gruppe benötigten Tiere zu 7. Diese Vorgehensweise findet sich auch in Software-Pakten wie z.B. GPower (Abb.19 und Literatur 137). Die Software liefert zudem auch Fallzahlplanungen für kompliziertere Fälle. Oftmals wird dabei der Parameter „Effekt-Größe“ 𝑑𝑑 erfragt. Er ist gegeben durch 𝑑𝑑 = 𝑚𝑚𝑐𝑐 −𝑚𝑚𝑒𝑒 𝑠𝑠 , Beispiel: Im vorliegenden Fall gilt 𝑑𝑑 = 3−1 1 = 2. 137 ERDFELDER, E.; BUCHNER, A.; FAUL, F.; BRANDT, M.: Allgemeine Psychologie und Deduktivistische Methodologie, Kap. GPOWER: Teststärkeanalysen leicht gemacht., S. 148–166. Vandenhoeck & Ruprecht, 2004. MAYR, S.; ERDFELDER, E.; BUCHNER, A.; FAUL, F.: A short tutorial of GPower. Tutorials in Quantitative Methods for Psychology 3 (2007), S. 51–59. 85 International Zebrafish Medaka Course IZMC Abb. 19: Beispiel einer Berechnung mit GPower 86 International Zebrafish Medaka Course IZMC 9. Abkürzungen AD ADR BC BGBl BioP BmTierSSchV BVL CLP-Regulation CNS dpf ECVAM EDSP ELISA EU EZRC FA FDA FDA/CVM FELASA FET FFDCA FIFRA GenTG GMO HE stain Anno Domini, (German: n. Chr.) The European Agreement concerning the International Carriage of Dangerous Goods by Road Before Christ (German: v. Chr.) Bundesgesetzblattes, das öffentliche Verkündungsblatt der Bundesrepublik Deutschland (The Federal Law Gazette) Regulation (EU) No 528/2012 of the European parliament and of the council of 22 May 2012 concerning the making available on the market and use of biocidal products (EU 2012). Binnenmarkt-Tierseuchenschutzverordnung – Verordnung über das innergemeinschaftliche Verbringen sowie die Einfuhr und Durchfuhr von Tieren und Waren (Internal Market Epizootic Protection Ordinance, Germany) Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (The Federal Office of Consumer Protection and Food Safety, Germany) fulfils many tasks in the area of food safety and protects the economic interests of consumers across national boundaries The euopean regulation on classification, labeling and packaging of substances and mixtures (CLP-Regulation (EC) No 1272/2008) central nervous system days post fertilization (dpf) European Centre for the Validation of Alternative Methods (ECVAM), hosted by the Joint Research Centre of the European Commission, which coordinated the validation of alternative approaches to animal testing in the European Union since 1991. US-EPA Endocrine disrupter screening program (US EPA 2011) Enzyme Linked Immunosorbent Assay European Union (Europäische Union) European Zebrafish Resource Centre (Europäisches ZebrafischRessourcenzentrum) Commission Regulation (EC) No 429/2008 of 25 April 2008 on detailed rules for the implementation of Regulation (EC) No 1831/2003 of the European Parliament and of the Council as regards the preparation and the presentation of applications and the assessment and the authorization of feed additives (EU 2008) U.S. Food and drug administration the US FDA Center for Veterinary Medicine Federation of European Laboratory Animal Science Associations Fish Embryo Test Federal Food, Drug, and Cosmetic Act (US congress 2002) US Federal Insecticide, Fungicide and Rodenticide Act (McElroy et al. 2011) Gesetz zur Regelung der Gentechnik (Gentechnikgesetz) (The German law on biotechnology) genetically modified organism (genetisch veränderter Organismus (GVO)) Hematoxylin and eosin stain 87 International Zebrafish Medaka Course IZMC HMP HOCNF hpf HPLC i.c. i.m. i.p. i.v. IATA IATA-DGR IATA-LAR IZMC LD50 lof mutant MS-222 MSDS mya n.a. n.r. NTP OCA OIE PCR PPP 3Rs REACH RID TierSchB TierSchG Directive 2001/83/EC on the Community code relating to medicinal products for human use (EU, 2001) and corresponding guidelines for environmental risk assessment of the European Medicines Agency (EMA/CHMP 2006) OSPAR Guidelines for completing the harmonised offshore chemical notification format (OSPAR 2012) hours post fertilization High Performance Liquid Chromatography intracardiac intramuscular intraperitoneal intravenous International Air Transport Association (IATA) - an international trade association for the world’s airlines representing 84% of total air traffic (240 airlines) IATA Dangerous Goods Regulations (DGR) IATA Live Animals Regulations (LAR) International Zebrafish/Medaka Course lethal dose, 50% - the dose of a substance required to kill half the members of a tested population after a specified test duration long fin mutant tricaine, metacaine, tricaine mesylate, tricaine methanesulfonate, TMS, Finquel Material Safety Data Sheets millions of years ago no information available not required by any regulation nichttechnische Projektzusammenfassung (non-technical project summary) oculocutaneous albinism International Office of Epizootic Diseases (OIE), the international organisation designated under the Agreement on the Application of Sanitary and Phytosanitary Measures in application of GATT 1994 which is responsible for the establishment of international animal health rules for trade in animals and animal products. Polymerase Chain Reaction Commission Regulation (EU) No 283/2013 of 1 March 2013 setting out the data requirements for active substances, in accordance with Regulation (EC) No 1107/2009 of the European Parliament and of the Council concerning the placing of plant protection products on the market (EU 2012, 2013) Classification of the humane experimental techniques as replacement, reduction, and refinement by Russell and Burch in 1959 - now commonly known as the 3Rs Regulation EC (No) 1907/2006 on the Registration, Evaluation, Authorization and Restriction of Chemicals. (EU 2006) Regulations concerning the International Carriage of Dangerous Goods by Rail Tierschutzbeauftragter (Animal Welfare Officer) Tierschutzgesetz (The German Animal Protection Act) 88 International Zebrafish Medaka Course IZMC TierSchVersV TL TSCA TSchTrV TÜ US EPA OCSPP VersTierMeldV VMP WHO ZEBET ZIRC Tierschutzversuchstierverordnung (German, implementing the German Animal Protection Act (Tierschutzgesetz)) Tübingen (or Tüpfel) long fin Toxic Substances Control Act (GAO 2007) Tierschutztransportverordnung (German, implementing the Council Regulation (EC) No 2010/63/EU on the protection of animals during transport and related operations) Tübingen (or Tuebingen, TU) genetic background United States Environmental Protection Agency, Office of Chemical Safety and Pollution Prevention Versuchstiermeldeverordnung (German, implementing the COMMISSION IMPLEMENTING DECISION of 14 November 2012 establishing a common format for the submission of the information pursuant to Directive 2010/63/EU of the European Parliament and of the Council on the protection of animals used for scientific purposes (2012/707/EU)) Directive 2004/28/EC amending Directive 2001/82/EC on the Community code relating to veterinary medicinal products (Regulation EC 726/2004) (EU, 2004) and corresponding guidelines for environmental risk assessment of committee for medicinal products for veterinary use (EMA/CVMP 2008) World Health Organization Zentralstelle zur Erfassung und Bewertung von Ersatz- und Ergänzungsmethoden zum Tierversuch am Bundesinstitut für Risikobewertung (BfR) (Centre for the Documentation and Evaluation of Alternatives to Animal Experiments at the The Federal Institute for Risk Assessment (BfR), Germany) Zebrafish International Resource Center 89 International Zebrafish Medaka Course IZMC 10. Fische in der Toxikologie und Ökotoxikologie (Thomas Braunbeck) Laut § 1 des aktuellen deutschen Tierschutzgesetzes (BGBl. I S. 1206, 1313) dürfen Wirbeltiere, insbesondere warmblütige Wirbeltiere nicht ohne vernünftigen Grund getötet werden. Die Untersuchung „adverser“ Effekte von Chemikalien auf Fische und/oder die Umwelt werden jedoch als ausreichende Begründung für Tierversuche mit Fischen angesehen, und so sind Versuche mit Fischen heute ein wesentlicher Bestandteil von Prüfszenarien in der Toxikologie und Ökotoxikologie. Somit ist der (Öko)Toxikologe im Hinblick auf Tierschutzrechte in der paradoxen Lage, Fischen Schmerz, Leid und Schaden zuzufügen, um solche negative Effekte in der Umwelt zu verhindern. 10.1 Fischtests in der Abwasserüberprüfung Weltweit werden die allermeisten Fische für Routineuntersuchungen von Abwässern „benutzt“. In einigen Ländern wird die Zahl der hierfür eingesetzten Fische nicht einmal dokumentiert. In Deutschland ist für die Ermittlung der potentiellen Toxizität von Abwässern für Fische der routinemäßig angewandte akute Fischtest nach dem Deutschen Abwasserabgabengesetz eingeführt worden. Neben anderen Parametern wurde die Toxizität von Abwässern für Fische herangezogen, um eine entsprechende Abgabe für die Umweltverschmutzung zu berechnen. Somit war das Abwasserabgabengesetz die erste nationale Regelung, die eine potentielle Bedrohung für die Umwelt mit einer Abgabe verband. Ursprünglich war der Test nach DIN 38412, Teil 20 (DIN 1981) für 10 Fische (i.d.R. Goldorfe, Leuciscus idus melanotus; s.u.) pro Abwasserverdünnung über einen Zeitraum von 48 oder (später) 96 Stunden konzipiert worden. Aus tierschutzrechtlichen Gründen wurde die Zahl schließlich auf drei reduziert, und in den letzten Jahren wurde der Test nur noch für die Bestätigung bereits existierenden Wissens über die Toxizität eines bestimmten Abwassers eingesetzt. 2003 wurde der akute Fischtest für die Bestimmung der Abwassertoxizität durch den sogenannten „Fischeitest“ (DIN 2001) ersetzt, bei welchem frisch befruchtete Eier des Zebrabärblings (Danio rerio) über 48 Stunden einer Reihe von Abwasserverdünnungen ausgesetzt werden. Als Endpunkte für die akute Letalität werden hier Koagulation des Embryos, Fehlen der Semiten, fehlender Herzschlag und Nichtablösen der Schwanzknospe herangezogen (Tab. 12; Abb. 20-22). Auch wenn mit dieser Methode der Einsatz lebender Tiere nicht gänzlich vermieden werden kann, ist die Exposition gegenüber den potentiell schädlichen Testlösungen auf ein Entwicklungsstadium reduziert, welches wahrscheinlich weniger empfindlich für Schmerz und Leiden ist. Dem Tierschutzgedanken folgend, ist der Fischembryotest daher wenigstens als Verfeinerung, wenn nicht als Ersatz für Tierversuche im Sinne der Terminologie z.B. des Britischen Innenministeriums oder der neuen EU-Tierschutzrichtlinie einzustufen. 90 International Zebrafish Medaka Course IZMC Tabelle 12: Endpunkte für die Routineuntersuchung von Abwässern nach Deutschem Standard DIN 38415, Teil 6 (DIN 2001; 138. 139. In den USA wurde die Untersuchung von Abwässern erst kürzlich etabliert. Hier werden typische Kaltwasserfische wie Regenbogenforelle (Oncorhynchus mykiss; s.u.) oder Dickkopfelritze (Pimephales promelas; s.u.) eingesetzt. Abb. 20: (links): Unter Hellfeldbelichtung sind koagulierte Zebrabärblingsembryonen nicht mehr transparent1.(rechts): Nichtablösen der Schwanzknospe in lateraler (→; 96 Stunden alter Zebrabärblingsembryo). Man beachte auch die fehlende Augenanlage (*;1). Abb. 21: Fehlender Herzschlag ist indiziert bei Nichtpulsieren des Herzens (Doppelpfeil). Die Immobilität der Blutzellen z.B. in der Aorta abdominalis (→ kleines Bild) ist kein Indikator für fehlenden Herzschlag. Man beachte auch das Fehlen der Somiten bei diesem Embryo(*, Muskelgewebe erscheint eher homogen und nicht segmentiert). Um fehlenden Herzschlag zu diagnostizieren, muss der Embryo mindestens 1 Min. mit einer Vergrößerung von mindestens 80x beobachtet werden (1). 10.2 Fischtests für die Chemikalienuntersuchung: akute Fischtests mit adulten Fischen und der Fischembryotest als Alternativmethode Im Gegensatz zur Abwasseruntersuchung, welche ausschließlich nationalen Regelungen unterliegt, wird die Registrierung von Chemikalien seit 2006, dem Jahr des Inkrafttretens von REACH, von der EU reguliert (EC 2006). REACH gilt nicht nur für Chemikalien, die neu am Markt erscheinen, sondern für alle Industriechemikalien, die in der Europäischen Union gehandelt werden. Dies ist ein großer Schritt vorwärts, wenn man die bisherigen nationalen Regelungen für Chemikalien betrachtet. Im Gegensatz zu den bisherigen Testverfahren bedeutet dies, dass alle Chemikalien getestet werden müssen. 138 Braunbeck, T., Böttcher, M., Hollert, H., Kosmehl, T., Lammer, E., Leist, E., Rudolf, M. and Seitz, N. (2005) Towards an alternative for the acute fish LC50 test in chemical assessment: The fish embryo toxicity test goes multispecies − an update. ALTEX 22: 87-102. 139 Braunbeck, T., Böttcher, M., Hollert, H., Kosmehl, T., Lammer, E., Leist, E., Rudolf, M. and Seitz, N. (2005) Towards an alternative for the acute fish LC50 test in chemical assessment: The fish embryo toxicity test goes multispecies − an update. ALTEX 22: 87-102. 91 International Zebrafish Medaka Course IZMC Da der Einsatz fischbasierter Tests bei vielen Regelungen eine zentrale Rolle spielt, ist ein signifikanter Anstieg an Toxizitätstests mit Fischen zu erwarten. Tatsächlich würde REACH nach einer Schätzung von Hartung & Rovida 140 bedeuten, dass bis zu 20mal mehr Tiere in Fischversuchen eingesetzt und 6mal höhere Kosten entstehen würden als nach früheren Schätzungen, denn in der regulatorischen Toxikologie gibt es keine alternativen Methoden mit einem hohen Durchsatz, die nicht auf Tierversuchen basieren (Abb. 22). Allerdings, wie bereits im Weißbuch der EU für die zukünftige Chemikalienpolitik (2001) beschrieben und in REACH (EU 2006) bestätigt, sind alternative Testmethoden anzuwenden, wo immer möglich. Im Jahr 2013 wurde der Fischembryotests als erste alternative Testmethode in der Ökotoxikologie durch die Arbeitsgruppe der Nationalen Koordinatoren für das OECD Richtlinien Programm etabliert ( 141, Abb. 23). Obwohl der Fischembryotest (FET) in der OECD Fish Testing Framework 142 nicht explizit als Alternativmethode zum konventionellen akuten Fischtest nach der OECD Richtlinie 203 143 erwähnt wird, wird er als alternative Testmethode für die Bestimmung der akuten Toxizität von Chemikalien für Fische anerkannt. Hervorzuheben ist, dass die Ergebnisse des FET hervorragend mit denen des Abb. 22: Schätzungen der Zahlen von Chemikalien (a) und Tieren (b) die erwartungsgemäß für die Einhaltung konventionellen akuten Fischtoxizitätsvon REACH benötigt werden. Die Schätzungen für den tests korrelieren ( 144, 145 ; Abb.24). besten Fall von 68.000 Substanzen und 54 Millionen Tieren sind weit über den offiziellen Schätzungen der EU (von:1, basierend auf1). Die weitaus meisten Tests werden für die Reproduktionstoxikologie benötigt. 140 Hartung, T. and Rovida, C. (2009) Chemical regulators have overreached. Nature 460: 1080-1081. Knacker, T., Boettcher, M., Rufli, H., Frische, T., Stolzenberg, H.C., Teigeler, M., Zok, S., Braunbeck, T. and Schäfers, C. (2010) Environmental effect assessment for sexual-endocrine disrupting chemicals − fish testing strategy. Integr. Environ. Assess. Manag. 6: 653-662. 141 OECD (2013) OECD Guidelines for the Testing of Chemicals. Section 2: Effects on Biotic Systems Test No. 236: Fish embryo acute toxicity (FET) test.. Paris, France: Organization for Economic Co-operation and Development. 142 OECD (2012) OECD Guidelines for the Testing of Chemicals. Section 2: Effects on Biotic Systems Test No. 305. Bioaccumulation in Fish: Aqueous and Dietary Exposure. Paris, France: Organization for Economic Cooperation and Development. 143 OECD (1992a) OECD Guidelines for the Testing of Chemicals. Section 2: Effects on Biotic Systems Test No. 203: Acute Toxicity for Fish. Paris, France: Organization for Economic Cooperation and Development. OECD (1992b) OECD Guidelines for the Testing of Chemicals. Section 2: Effects on Biotic Systems Test No. 210: Fish, Early-Life Stage Toxicity Test. Paris, France: Organization for Economic Cooperation and Development. 144 Lammer, E., Carr, G.J., Wendler, K., Rawlings, J.M., Belanger, S.E. and Braunbeck, T. (2009) Is the fish embryo test (FET) with the zebrafish (Danio rerio) a potential alternative for the acute toxicity test? Comparative Biochemistry and Physiology, Part C 149: 196-209. 145 Belanger, S.E., Rawlings, J.M. and Carr, G.J. (2013) Use of fish embryo toxicity tests for the prediction of acute fish toxicity to chemcials. Environ. Toxicol. Chem. 32: 1768-1783. 92 International Zebrafish Medaka Course IZMC Abb. 23: Schema des Fischembryotests (von links nach rechts): Sammeln der Eier, Vorexposition der Eier in Kristallisationsschalen unmittelbar nach der Befruchtung, Auswahl der befruchteten Eier mit dem Inversionsmikroskop oder Binokular und Verteilung der befruchteten Eier auf vorbelastete 24-well Mikrotiterplatten (Original von1, bearbeitet nach1). Abb. 24: Vergleich des Fischembryotests (FET) mit dem akuten Fischtest für 151 (links) und 72 (rechts) Substanzen (rechts; inkl. Daten für alle Arten). Offene Kreise stehen für die einzelnen Testdaten; gefüllte Kreise zeigen das geometrische Mittel der Daten für FET bzw. akuten Fischtest-Ergebnisse für jede Chemikalie. Wie aus dem Vergleich der beiden Graphen ersichtlich ist, wird das Hinzufügen neuer Chemikalien die Korrelation nicht signifikant beeinflussen. LC50 = durchschnittliche letale Konzentration1. Wenn er in seiner verlängerten Version angewandt wird, kann der FET sogar als Alternative für verlängerte Fischtests dienen (z.B. 146, 147). 146 OECD (1992b) OECD Guidelines for the Testing of Chemicals. Section 2: Effects on Biotic Systems Test No. 210: Fish, Early-Life Stage Toxicity Test. Paris, France: Organization for Economic Cooperation and Development. 147 OECD (1998) OECD Guidelines for the Testing of Chemicals. Section 2: Effects on Biotic Systems Test No. 212: Fish, Short-term Toxicity Test on Embryo and Sac-Fry Stages. Paris, France: Organization for Economic Cooperation and Development. 93 International Zebrafish Medaka Course IZMC Allerdings wird im Falle der Abwasseruntersuchung unter nationalen und internationalen Regulatoren diskutiert, ob der FET als Ersatzmethode im Sinne des 3R-Prinzips von Russell & Burch 148 angesehen werden kann oder ob es lediglich als volle oder gar nur relative Verfeinerung gelten sollte. Gleichwohl stimmt der FET vollkommen mit dem neuen Tierschutz-/Versuchstierverordnung der EU 149 . überein. Er endet nach 96 Stunden und nutzt somit ausschließlich Entwicklungsstadien ohne unabhängige Nahrungsaufnahme, also solche, die nach der EU-Richtlinie 150 noch nicht als geschützte Stadien angesehen werden 151 . Wichtig ist auch, dass die EU-Richtlinie ältere Diskussionen über die Frage beendet, ob der kritische Schritt in der Fischentwicklung, ab welchem der Organismus regulatorischen Schutz bedarf, (a) der Zeitpunkt des Schlüpfens oder (b) der Beginn der unabhängigen Ernährung ist (Abb. 25). Abb. 25: Überblick über die verschiedenen Terminologien für einen Fisch“embryo“ und eine Fisch“larve“ (nach Kendall et al., 1984). Nach einigen älteren Ansichten wurde der Übergang vom Embryo zur Larve als der Zeitpunkt des Schlupfes definiert (durchgehende rote Linien), wohingegen die alternative Ansicht, dass das Aufbrauchen des Dottervorrats als entscheidender Schritt für den Übergang in das Larvenstadium angesehen wird (blaue unterbrochene Linie), von der neuen Tierschutz-/Versuchtstierverordnung der EU1 übernommen wurde. Wie bereits von Braunbeck et al. 152 , beschrieben, kann das Prinzip des FET als Alternative zum akuten Fischtoxizitätstest auch für andere Fischarten als den Zebrabärbling übernommen werden, etwa für die Dickkopfelritze und den Medaka 148 Russell, W.M.S. and Burch, R.L. (1959) The principles of humane experimental techniques. Methuen, London, UK, 238 pp. 149 EU (2010) Directive 2010/63/EU of the European parliament and of the council of 22 September 2010 on the protection of animals used for scientific purposes. Off. Journal of the EU L 276: 33-79. 150 EU (2010) Directive 2010/63/EU of the European parliament and of the council of 22 September 2010 on the protection of animals used for scientific purposes. Off. Journal of the EU L 276: 33-79. 151 Strähle, U., Scholz, S., Geisler, R., Greiner, P., Hollert, H., Rastegar, S., Schumacher, A., Selderslaghs, I., Weiss, C., Witters, H. and Braunbeck, T. (2011) Zebrafish embryos as an alternative to animal experiments − a commentary on the definition of the onset of protected life stages in animal welfare regulations. Reprod Toxicol. 33: 245-153. 152 Braunbeck, T., Böttcher, M., Hollert, H., Kosmehl, T., Lammer, E., Leist, E., Rudolf, M. and Seitz, N. (2005) Towards an alternative for the acute fish LC50 test in chemical assessment: The fish embryo toxicity test goes multispecies − an update. ALTEX 22: 87-102. 94 International Zebrafish Medaka Course IZMC (Oryzias latipes), deren Sensitivität Zebrabärblings ist (Tab. 13). erwiesenermaßen ähnlich zu der des Tabelle 13: LC50 Daten für ausgewählte Referenzsubstanzen zu Embryotests mit dem Zebrabärbling (Danio rerio), Medaka (Oryzias latipes) und Dickkopfelritze (Pimephales promelas1). 10.3 Rechtliche Bestimmungen für Fischtests außer akuten Toxizitätstests In der Europäischen Union (EU) werden Chemikalien bzw. die jeweiligen Stoffgruppen mit Hilfe verschiedener Instrumente des Gesetzgebers in Hinblick auf ihre Risiken für Mensch und Umwelt bewertet (Tab.15). Die meisten Industriechemikalien werden von der Europäischen Chemikalienverordnung 153 gemeinhin bekannt als REACH, reguliert. Sie beinhaltet spezifische Regulierungen für Pflanzenschutzmittel 154,155, Biozide 156,157 158 ; 159 Produkte für die Humanund Veterinärmedizin und 160 , 161 . 162 Lebensmittelzusatzstoffe Außerdem befasst sich REACH mit Umweltbedenken, die durch Substanzen in Kosmetika geweckt werden. 153 EU (2006) Regulation (EC) No 1907/2006 of the European Parliament and of the Council of 18 December 2006 concerning the Registration, Evaluation, Authorization and Restriction of Chemicals (REACH), establishing a European Chemicals Agency, amending Directive 1999/45/EC and repealing Council Regulation (EEC) No 793/93 and Commission Regulation (EC) No 1488/94 as well as Council Directive 76/769/EEC and Commission Directives 91/155/EEC, 93/67/EEC, 93/105/EC and 2000/21/EC. Official Journal of the European Union L 136, p. 3-280. 154 EU (2009) Regulation (EC) No 1107/2009 of the European Parliament and of the Council of 21 October 2009 concerning the placing of plant protection products on the market and repealing council directives 79/117/EEC and 91/414/EEC. OJ European Union. L309, 1-50. 155 EU (2013) Commission Regulation (EU) No 283/2013 of 1 March 2013 setting out the data requirements for active substances, in accordance with Regulation (EC) No 1107/2009 of the European Parliament and of the Council concerning the placing of plant protection products on the market. OJ European Union. L93, 1-84. 156 EU (1998) Directive 98/8/EC of the European Parliament and of the Council of 16 February 1998 concerning the placing of biocidal products on the market. OJ European Union. L123, 1-63. 157 EU (2012) Regulation (EU) No 528/2012 of the European Parliament and of the Council of 22 May 2012 concerning the making available on the market and use of biocidal products. OJ European Union. L761, 1-123. 158 EMA/CHMP (2006) Guideline on the environmental risk assessment of medicinal products for human use. EMEA/CHMP/SWP/4447/00. European Medicines Agency. Available at www.ema.europe.eu. 159 EMA/CVMP (2008) Revised guideline on environmental impact assessment for veterinary medicinal products in support of the VICH guidelines GL6 AND GL 38. EMEA/CVMP/ERA/418282/2005-Rev.1. European Medicines Agency. Available at www.ema.europe.eu. 160 EU (2003) Regulation (EC) No 1831/2003 of the European Parliament and of the Council of 22 September 2003 on additives for use in animal nutrition. OJ European Union. L268, 29-43. 95 International Zebrafish Medaka Course IZMC Diese verschiedenen europäischen Teststrategien und Richtlinien werden stark von internationalen Aktivitäten, hauptsächlich denen der OECD, beeinflusst, welche eine Harmonisierung der Testverfahren und Reglementierungen anstreben 163 . Die OECD stellt harmonisierte Test Guidelines als Basis für die gegenseitige Anerkennung von Daten zur Verfügung. Durch das Aufteilen der Risikobewertung auf internationaler Ebene werden so redundante Tests und Kosten vermieden. Mit der GHSVerordnung 164, (GHS = Global harmonisiertes System zur Einstufung, Kennzeichnung und Verpackung von Chemikalien, UN 2001), die eng mit REACH und den Bestimmungen für den Pflanzenschutz und für Biozide verbunden ist, hat zudem die WHO auf die Europäische Reglementierung von Tierversuchen eingewirkt. In allen Bestimmungen wird bei den empfohlenen Testverfahren auf die OECD Test Guidelines Bezug genommen (Tab. 14). Fische in Tests einzusetzen, ist notwendig, um Daten zu aquatischer Kurzzeit- und Langzeittoxizität zu generieren. So werden möglicherweise weitere Studien zur Bioakkumulation im Fisch (abhängig von der Hydrophobie, Persistenz und Toxizität) und zur Identifikation endokriner Disruptoren erforderlich (formale regulatorische Definitionen für diese Substanzen und Auslöser für solche Tests müssen noch formuliert werden). Ein allgemeines Verfahren, um Endpunkte für akute Toxizität, chronische Toxizität und endokrine Disruptoren bei Fischen miteinander zu verbinden ist von der OECD mit dem Fish Toxicity Testing Framework entwickelt worden. Diese OECD-Initiative lässt einen Spielraum dafür offen, wo alternative Testverfahren angewandt werden oder angewandt werden können. Weitere Informationen siehe 165. 161 EU (2008) Commission Regulation (EC) No 429/2008 of 25 April 2008 on detailed rules for the implementation of Regulation (EC) No 1831/2003 of the European Parliament and of the Council as regards the preparation and the presentation of applications and the assessment and the authorization of feed additives. OJ European Union. L133, 1-65. 162 EU (2009) Regulation (EC) No 1272/2008 of the European Parliament and of the Council of 16 December 2008 on classification, labelling and packaging of substances and mixtures, amending and repealing Directives 67/548/EEC and 1999/45/EC, and amending Regulation (EC) No 1907/2006. OJ European Union. L353, 1-1355. 163 Koëter, H.B.W.M., 2003. Mutual acceptance of data: harmonized test methods and quality assurance of data—the process explained. Toxicol. Lett. 140, 11-20. 164 OECD (2012) Fish Toxicity Testing Framework. OECD Series on Testing and Assessment No. 171; ENV/JM/MONO(2012)16, 174 pp. 165 Scholz, S., Sela, E., Blaha, L., Braunbeck, T., Galay-Burgos, M., García-Franco, M., Guinea, J., Klüver, N., Schirmer, K., Tanneberger, K., Tobor-Kapłon, M., Witters, H., Belanger, S., Benfenati, E., Creton, S., Cronin, M.T.D., Eggen, R.I.L., Embry, M., Ekman, D., Gourmelon, A., Halder, M., Hardy, B., Hartung, T., Hubesch, B., Jungmann, D., Lampi, M.A., Lee, L., Marc Léonard, M., Küster, E., Lillicrap, A., Luckenbach, T., Murk, A.J., Navas, J.M., Peijnenburg, W., Repetto, G., Salinas, E., Schüürmann, G., Spielmann, H., Tollefsen, K.E., Walter-Rohde, S., Whale, G., Wheeler, J.R., Winter, M.J. (2013) A European perspective on alternatives to animal testing for environmental hazard identification and risk assessment. Regul. Toxicol. Parmacol. 67: 506-530. 96 International Zebrafish Medaka Course IZMC Tabelle 14: Zusammenfassung der gesetzlichen Rahmenbestimmungen der Europäischen Union (EU), für die Tierversuche nötig sind, um eine Risikobewertung für mögliche Umweltschäden durchführen zu können. Zum Vergleich und um zu zeigen, dass ähnliche Regelwerke außerhalb der EU existieren, ist auch der entsprechende gesetzliche Rahmen in den USA mit aufgeführt. Anforderungen für die Durchführung der einzelnen Tests wurden den jeweiligen Gesetzesvorschriften und/oder dem OECD Fish Toxicity Testing Framework 166. entnommen. Test Typ/ OECD Richtlinie (oder ggf. entsprechend US EPA) Gesetzlicher Rahmen Europa USA Anzahl an Tieren, die für das Testen einer Substanz benötigt werden AKUTE TOXIZITÄT OECD 203 und OCSPP 850.1075:Fish Acute toxicity test (US EPA 1996; OECD 1992; US EPA 2002) REACH. Erforderlich für Substanzen, von denen >10 Tonnen/Jahr produziert oder importiert werden (Erlass unter bestimmten Bedingungen möglich). PPP. Obligatorisch: Regenbogenforelle (Schwellenwertverfahren) TSCA: bedingt erforderlich FIFRA: Süßwasserspezies aus Kalt- und Warmwasser und 1 Salzwasserart FFDCA: Tier 2 Test von Medikamenten und Biologika für die Verfeinerung von Bewertungskriterien (FDA 1998) BioP. Obligatorisch für eine Süßwasserart (und eine marine Art wenn relevant; Schwellenwertverfahren). VMP. Obligatorisch für Tier A. FA. Benötigt wenn PEC ≥ 0,1 µg/L in Oberflächenwasser oder ≥ 10 µg/kg im Sediment. HOCNF. Obligatorisch wenn nicht bereits unter REACH getestet. Anstelle eines vollen Akuten Fisch Toxizitätstests kann ein Limit-Test durchgeführt werden. Abwasseruntersuchungen: Abwasseruntersuchungen: Schweden (Naturvårdsverket, 2010) (OSPAR 2000) Clean Water Act (US Congress 33 U.S.C. 1251) Dänemark, Frankreich, Irland, Norwegen (OSPAR 2000) Die konkreten Anforderungen für Abwasseruntersuchungen unterscheiden sich auf staatlicher und regionaler Ebene und bewegen sich für gewöhnlich in einem gewissen Freisetzungsrahmen. Generell fehlt eine detaillierte Anleitung wenn der Akute Fisch Toxizitätstest für Abwasser durchgeführt werden soll. Akute Fisch Tests sind oft notwendig wenn verfügbare Daten und Erfahrung nur 166 OECD (2012) Fish Toxicity Testing Framework. OECD Series on Testing and Assessment No. 171; ENV/JM/MONO(2012)16, 174 pp. 97 42 International Zebrafish Medaka Course IZMC Test Typ/ OECD Richtlinie (oder ggf. entsprechend US EPA) Gesetzlicher Rahmen Europa USA Anzahl an Tieren, die für das Testen einer Substanz benötigt werden unzureichend vorhanden sind. (OSPAR 2000) CHRONISCHE TOXIZITÄT OECD 210 OCSPP 850.1400: Fish Early Life-Stage test REACH. Erforderlich für Chemikalien von denen >100 Tonnen/Jahr produziert oder importiert werden, wenn die chemische Sicherheitsbewertung indiziert, dass Effekte auf aquatische Organismen weiteruntersucht werden müssen. Die Notwendigkeit kann durch einen PEC/PNEC-Schlüssel über 1 angezeigt sein, aber auch durch Informationen zu hohen akuten bis chronischen Werten der Analoga oder zu physikalischchemischen Parameter, die auf eine schlechte Wasserlöslichkeit oder ein hohes Biokonzentrationspotential hinweisen. FIFRA. Erforderlich für Süßwasserarten; bedingt erforderlich für Salzwasserarten 420 PPP. Erforderlich wenn Exposition in Oberflächenwasser wahrscheinlich ist und die Substanz stabil ist in Wasser (Hydrolyse <90% in 24 Stunden) Abwasseruntersuchungen BioP. Obligatorisch für PNEC (predicted no effect concentration)-Verfeinerung. Clean Water Act (US Congress 33 U.S.C. 1251) HMP. Obligatorisch für Phase II Tier A. VMP. Obligatorisch für Phase II Tier B. Abwasseruntersuchungen: Schweden (Naturvårdsverket, 2010): Erforderlich je nach Ergebnis der akuten Tests und wenn PEC/PNEC >1 (basierend auf verfügbaren Daten zu den einzelnen Substanzen). OECD 215 Fish, Juvenile Growth test TTSCA. Bedingt erforderlich REACH. Kann anstelle des Fish Early Life-Stage Test oder Fish, Short-term Toxicity Test on Embryo and Sac-Fry Stages durchgeführt werden. Die konkreten Anforderungen für Abwasseruntersuchungen unterscheiden sich auf staatlicher und regionaler Ebene und bewegen sich für gewöhnlich in einem gewissen Freisetzungsrahmen. n.r. n.a. PPP. Nur erforderlich wenn Fish Early Life Stage Test 98 International Zebrafish Medaka Course IZMC Test Typ/ OECD Richtlinie (oder ggf. entsprechend US EPA) Gesetzlicher Rahmen Europa USA Anzahl an Tieren, die für das Testen einer Substanz benötigt werden oder Fish Full Life Cycle Test nicht angemessen sind. BioP. Erforderlich für PNEC Verfeinerung (wenn log Kow < 5). OECD 212: Fish, Short-term Toxicity Test REACH. Kann anstelle des Fish Early Life-Stage Test oder Fish Juvenile Growth Test durchgeführt werden Fish full life cycle test (not yet internationally standardised, Crane et al. 2010; US EPA 1998) PPP: Nur erforderlich wenn der Biokonzentrationsfaktor größer als 1000 ist und die Eliminierung der aktiven Substanz während einer Ausscheidungsphase von 14 Tagen niedriger als 95% ist, oder die Substanz sich stabil in Wasser oder Sediment verhält (DT90 > 100 Tage) (CTGB, 2013) . n.r. n.a. FIFRA: bedingt erforderlich wenn die geschätzte Umweltkonzentration ≥ 0.1 x FELS NOEC oder Studien an anderen Organismen darauf hinweisen, dass die reproduktive Physiologie von Fischen beeinträchtigt werden könnte (US EPA 1996). n.a. Biozide: siehe REACH BIOKONZENTRATIONSSTUDIEN OECD 305 and OCSPP 850.1730. Bioconcentration: Flow-through fish test REACH. Erforderlich bei über 100 Tonnen/Jahr und log Kow ≥3 TSCA. Bedingt erforderlich PPP. Erforderlich für Produkte mit log Kow >3 wesentlicher Stabilität. FIFRA. Bedingt erforderlich BioP. Erforderlich für Antifouling-Produkte, Detergenzien und wenn log Kow ≥3. 108 HMP. Erforderlich wenn log Kow ≥ 4.5 und in Tier B wenn log KOW ≥3. VMP. Erforderlich in Phase II Tier B wenn log Kow ≥4. FA. Optional für Phase IIB HOCNF. Obligatorisch wenn log Kow >3, aber Bivalvia Test kann alternativ durchgeführt werden. ENDOKRINE DISRUPTION OECD 229 and OCSPP 890.1350: REACH. Erforderlich bei Bedenken wegen potentieller endokriner Disruption (OECD 2012b TSCA, FIFRA, FFDCA: durch endokrinen Disruptor Screeningverfahren (US EPA 2011). EDSP Tier 1 99 80 – 96 (nach Europäischen International Zebrafish Medaka Course IZMC Test Typ/ OECD Richtlinie (oder ggf. entsprechend US EPA) Fish short term reproduction assay Gesetzlicher Rahmen Europa USA PPP. bei Bedenken bezüglich Säuger- und anderer Daten (US EPA 2011) Anzahl an Tieren, die für das Testen einer Substanz benötigt werden Bestimmungen) (US n.a.) BioP. Erforderlich bei Bedenken wegen potentieller endokriner Disruption (OECD 2012) HMP. Bedingt erforderlich. VMP. Bedingt erforderlich. OECD 230 Fish screening assay REACH. Erforderlich bei Bedenken wegen potentieller endokriner Disruption. n.r. 80-96 n.r. 840 (definitiv) PPP. Erforderlich bei Bedenken wegen potentieller endokriner Disruption. BioP. Erforderlich bei Bedenken wegen potentieller endokriner Disruption. HMP. Bedingt erforderlich. VMP. Bedingt erforderlich. OECD 234 Fish sexual development test REACH. Bedingt erforderlich bei Bedenken wegen potentieller endokriner Disruption. 480 (Screeningverfahren) PPP. optional, conditions not clearly defined (EU 2012) BioP. Vermutlich erforderlich bei Bedenken wegen potentieller endokriner Disruption. HMP. Vermutlich erforderlich bei Bedenken wegen potentieller endokriner Disruption. VMP. Vermutlich erforderlich bei Bedenken wegen potentieller endokriner Disruption. Fish full life-cycle test (noch nicht international standardisiert, Crane et al. 2010; US EPA 1998) PPP FIFRA: Erforderlich, aber als Teil eines chronischen Toxizitätstests ohne Fokus auf endokrine Disruption (siehe oben) EDSP tier 2 (US EPA 2011) 100 1776 International Zebrafish Medaka Course IZMC Abkürzungen: BioP EDSP FA FIFRA FFDCA HMP HOCNF n.a. n.r. PPP REACH TSCA US EPA OCSPP VMP Regulation (EU) No 528/2012 of the European parliament and of the council of 22 May 2012 concerning the making available on the market and use of biocidal products (EU 2012). US-EPA Endocrine disrupter screening program (US EPA 2011) Commission Regulation (EC) No 429/2008 of 25 April 2008 on detailed rules for the implementation of Regulation (EC) No 1831/2003 of the European Parliament and of the Council as regards the preparation and the presentation of applications and the assessment and the authorization of feed additives (EU 2008) US Federal Insecticide, Fungicide and Rodenticide Act (McElroy et al. 2011) Federal Food, Drug, and Cosmetic Act (US congress 2002) Directive 2001/83/EC on the Community code relating to medicinal products for human use (EU, 2001) and corresponding guidelines for environmental risk assessment of the European Medicines Agency (EMA/CHMP 2006) OSPAR Guidelines for completing the harmonised offshore chemical notification format (OSPAR 2012) no information available, keine Information verfügbar not required by any regulation, nach keiner Bestimmung erforderlich Commission Regulation (EU) No 283/2013 of 1 March 2013 setting out the data requirements for active substances, in accordance with Regulation (EC) No 1107/2009 of the European Parliament and of the Council concerning the placing of plant protection products on the market (EU 2012, 2013) Regulation EC (No) 1907/2006 on the Registration, Evaluation, Authorization and Restriction of Chemicals. (EU 2006) Toxic Substances Control Act (GAO 2007) United States Environmental Protection Agency, Office of Chemical Safety and Pollution Prevention Directive 2004/28/EC amending Directive 2001/82/EC on the Community code relating to veterinary medicinal products (Regulation EC 726/2004) (EU, 2004) and corresponding guidelines for environmental risk assessment of committee for medicinal products for veterinary use (EMA/CVMP 2008) 101 International Zebrafish Medaka Course IZMC 10.4 Fische, die üblicherweise in der (Öko)Toxikologie verwendet werden Die Fischarten, die in der (Öko)Toxikologie benutzt werden, unterscheiden sich nicht grundsätzlich von denen, die in anderen Disziplinen wie der allgemeinen Pathologie, Entwicklungsbiologie oder Physiologie verwendet werden. Es folgen einige Informationen über jene Arten, die am häufigsten in den gängigen Toxizitätstests verwendet werden (vgl. Tab.3), mit besonderem Augenmerk auf die sogenannten kleinen „OECD-Arten“ Zebrabärbling, Dickkopfelritze und Medaka, da diese nicht nur für Kurzzeit- (akute) Toxizitätstests eingesetzt werden können, sondern auch in verlängerten Tests wie einem Full Life-Cycle-Test oder einem Zwei-Generationen Test (vgl. z.B. 167). 10.4.1 Zebrabärbling (Danio rerio) Für Informationen zur Biologie des Zebrabärblings siehe Teil 4.1 dieses Handbuchs. Üblicherweise werden in der (Öko)Toxikologie Wildtypformen benutzt. Einige häufig benutzte sind nachfolgend aufgeführt: • • • • • • • • 10.4.2 AB (AB) AB/C32 (AB/C32) AB/TL (AB/TL) AB/Tuebingen (AB/TU) C32 (C32) Cologne (KOLN) Darjeeling (DAR) Ekkwill (EKW) • • • • • • • • HK/AB (HK/AB) HK/Sing (HK/SING) Hong Kong (HK) India (IND) Indonesia (INDO) Nadia (NA) RIKEN WT (RW) Singapore (SING) • • • • • • • • SJA (SJA) SJD (SJD) SJD/C32 (SJD/C32) Tuebingen (TU) Tupfel long fin (TL) Tupfel long fin nacre (TLN) WIK (WIK) WIK/AB (WIK/AB) Medaka (Oryzias latipes) Für Informationen zur Biologie des Medaka siehe Teil 4.2 dieses Handbuchs. 10.4.3 Dickkopfelritze (Pimephales promelas) Die Dickkopfelritze (engl. fathead minnow; Pimephales promelas Rafinesque) gehört zur großen Familie der Karpfenartigen (Cyprinidae). Den wissenschaftlichen Namen hat dieser Fisch sowohl der Kopfform des Männchens (Pimephales – „dicker Kopf“) als auch der Farbe der Männchen während der Paarungszeit (promelas – „vorne schwarz“) zu verdanken. Der „dicke Kopf“ rührt während der Paarungszeit von der Proliferation von Epithelzellen auf dem dorsalen Teil des Kopfes her. Der Körper adulter Dickkopfelritzen ist leicht abgeflacht. Sie besitzen eine kurze, stumpfe Schnauze und ein leicht unterständiges Maul. 167 Knacker, T., Boettcher, M., Rufli, H., Frische, T., Stolzenberg, H.C., Teigeler, M., Zok, S., Braunbeck, T. and Schäfers, C. (2010) Environmental effect assessment for sexual-endocrine disrupting chemicals − fish testing strategy. Integr. Environ. Assess. Manag. 6: 653-662. 102 International Zebrafish Medaka Course IZMC Die Farbe der Dickkopfelritze ist oliv bis braun an der Körperoberseite und silbrig weiß an der Körperunterseite mit einem dunklen mediolateralen Streifen. Sie trägt einen dunklen Fleck mittig an der Oberkante der Dorsalflosse. Die Körperlänge adulter Tiere variiert zwischen 40 und 100 mm mit einem starken Sexualdimorphismus. Beim i.d.R. größeren Männchen entwickeln sich während der Paarungszeit ein massiger grauer Aufwuchs im Nacken und etwa 16 weiße Brutwarzen auf der Schnauze (Abb. 26). Die Dickkopfelritze ist in gemäßigten Süßwasserhabitaten in vielen Teilen Nordamerikas anzutreffen, von Zentralkanada in Richtung Süden entlang der Rocky Mountains bis nach Texas und in Richtung Osten bis nach Virginia und die nordöstlichen Vereinigten Staaten. Sie bewohnt für gewöhnlich die Tümpel und Nebengewässer von kleinen Bächen, ist aber gelegentlich auch in größeren Flüssen, Teichen und Seen zu finden. Sie bleibt in der Regel nahe der Uferlinie oder in der Nähe von Pflanzenmaterial. Adulte Fische sind omnivor; fressen Insekten, Algen, Detritus und kleinste Crustaceen. Das Verbreitungsgebiet der Dickkopfelritze beschränkte sich ursprünglich auf den mittleren Westen der USA und das obere Einzugsgebiet des Mississippi, im Westen bis nach Utah, im Norden bis nach Kanada und im Osten bis nach Maine. Aufgrund ihrer Beliebtheit als Köderfisch ist die Dickkopfelritze heute in der gesamten USA verbreitet, denn vielerorts entfloh sie aus Zuchten oder Ködereimern. Abb. 26: Dickkopfelritze (Pimephales promelas): weibliches (links) und männliches Tier (rechts). Das Männchen ist in Balzfärbung dargestellt, mit rostralen Warzen. Quelle: http://aquaticpath.phhp.ufl.edu/fhm/intro.html. Die Dickkopfelritze ist bekannt für den von ihr produzierten Schreckstoff (Signalstoff, der als Stresssignal abgegeben werden). Außerdem ist sie ausgesprochen tolerant gegenüber harten Lebensbedingungen, weshalb sie unter Umständen in Gewässern anzutreffen ist, die für andere Fische weitestgehend unbewohnbar sind, wie beispielsweise in Abwasserkanälen. Aus diesem Grund ist die Dickkopfelritze auch Gegenstand zahlreicher Studien, welche die Effekte solcher Abwässer auf aquatische Ökosysteme untersuchen. Ebenso ist sie die in den USA bevorzugte Fischart in Toxizitätstests, weshalb die US EPA Chemikalientoxizitätsdatenbank (ECOTOX) hauptsächlich auf Daten aus Experimenten mit der Dickkopfelritze basiert. Dickkopfelritzen, die in einer Studie beispielsweise mit dem Abwasser aus Mastparzellen für Vieh belastet wurden, zeigten Veränderungen ihrer Geschlechtsorgane. Männliche Fische wiesen eine reduzierte testikuläre Testosteronproduktion, veränderte Kopfform und reduzierte Hodengröße auf, während sich bei weiblichen Fischen das Östrogen-Androgen-Verhältnis zugunsten der Androgene verschob. Somit fand also sowohl eine Feminisierung der Männchen als auch eine Defeminisierung der Weibchen statt. 103 International Zebrafish Medaka Course IZMC Auch die Auswirkungen eines niedrigem pH-Werts (Gewässerversauerung) auf die Dickkopfelritze sind ausgiebig untersucht worden. Obwohl die Überlebensrate der Tiere durch eine langfristige Belastung mit niedrigem pH nur minimal beeinträchtigt war, traten nachweislich Verhaltensstörungen auf. Sie zeigten verschiedene Arten von Stressverhalten, wie Schwimmen an der Oberfläche und Hyperaktivität. Außerdem traten Missbildungen auf. So entwickelten beide Geschlechter verhältnismäßig kleine Köpfe. Die Männchen verloren an Glanz und Farbe. Die Weibchen dagegen entwickelten zwar Eier, laichten aber nicht ab. Die Eizahl pro Weibchen war dadurch drastisch reduziert, die Eier waren fragil und hatten einen verringerten Innendruck. Je niedriger der pH-Wert war, desto unwahrscheinlicher wurde letztlich auch das Schlüpfen. 10.4.4 Regenbogenforelle (Oncorhynchus mykiss) Die Regenbogenforelle (engl. rainbow trout) ist eine Salmonidenart, welche im Kaltwasser der in den Pazifik mündenden Flüsse in Asien und Nordamerika beheimatet ist. Der Steelhead, auch Steelheadforelle, ist die anadrome Form der Regenbogenforelle, die für gewöhnlich ins Süßwasser zurückkehrt, um zu laichen, nachdem sie zwei bis drei Jahre im Meer gelebt hat. Süßwasserformen, die in den Großen Seen in Michigan eingeführt wurden und in die Flüsse abwandern, um zu laichen, werden ebenfalls Steelhead genannt. Adulte Regenbogenforellen wiegen im Süßwasser durchschnittlich zwischen 0,5 und 2,3 kg, während die Tiere in den Seen und anadrome Formen über 9 kg Gewicht erreichen können. Die Färbung variiert beträchtlich je nach Unterart, Form und Habitat. Adulte Fische sind an dem breiten rötlichen Streifen entlang der Seitenlinie erkennbar, der von den Kiemen bis zum Schwanz reicht. Dieses Merkmal ist bei Männchen während der Paarungszeit besonders stark ausgeprägt (Abb. 27). Abb. 27: Regenbogenforelle (Oncorhynchus mykiss). Quelle: species- rainbowtrout-fish.jpg. Wildfänge dieser Art und Tiere aus Zuchtstationen wurden als Nahrungsquelle und für den Angelsport in mindestens 45 Ländern auf allen Kontinenten außer der Antarktis ausgesetzt. Die Einführung außerhalb ihres ursprünglichen Verbreitungsgebiets in den USA, Südeuropa, Australien und Südamerika hat dort negative Auswirkungen auf einheimische Fischarten. Die eingebürgerten Populationen der Regenbogenforelle treten als neue Räuber für einheimische Fischarten auf, treten zu diesen in Konkurrenz, übertragen Krankheiten wie z.B. die Drehkrankheit oder hybridisieren mit eng verwandten Arten und Unterarten, und reduzieren somit die genetische Reinheit. Andere Einbürgerungen in Gewässer, die vorher fischfrei waren bzw. stark dezimierte Bestände einheimischer Fische aufwiesen, haben Sportfischereigewässer von Weltklasse wie die Großen Seen in den USA geschaffen. 104 International Zebrafish Medaka Course IZMC Aufgrund der weiten Verbreitung der Regenbogenforelle in den nördlichen Staaten der USA und in Kanada wird sie dort häufig für Toxizitätsmonitoring unter Freilandbedingungen genutzt. Allerdings wird dieser Fisch wegen seiner schwierigen Hälterung, seiner Größe und der langen Zeit bis zur Geschlechtsreife nur selten für Toxizitätsversuche unter kontrollierten Laborbedingungen eingesetzt. 10.4.5 Edelsteinkärpfling (Cyprinodon variegatus) Der Edelsteinkärpfling (Cyprinodon variegatus variegatus), im Englischen sheepshead minnow, ist ein euryhaliner Vertreter der Gattung der Wüstenkärpflinge, der in Salzwiesen- und Ästuargebieten entlang der Atlantikküsten Nord- und Zentralamerikas lebt. Er bevorzugt ruhige, flache Gewässer und ist sowohl in Salzwasserbuchten und Ästuaren als auch im Inland von Küstengebieten in Bächen, Kanälen und Gräben anzutreffen. Aufgrund seiner Vorliebe für Salzwasserhabitate kommt der Edelsteinkärpfling in den USA vielfach für das Toxizitätsmonitoring in Ästuar- und Küstengebieten zum Einsatz. Der adulte Edelsteinkärpfling ist zwischen 4 und 6 cm lang. Er ist silbern gefärbt und von rundlicher Gestalt. Er besitzt eine Rückenflosse, eine Afterflosse und keine erkennbare Seitenlinie Fig. 28). Männliche Fische sind i.d.R. größer als weibliche. Beim Männchen befindet sich ein schwarzer Balken am distalen Ende der Schwanzflosse, während das Weibchen einen deutlichen dunklen Fleck am Ende der Rückenflosse aufweist. Der Edelsteinkärpfling ist in der Lage kann in extrem flachen Gewässern leben, in denen er durchaus die einzige Fischspezies darstellen kann. Er kann an der Wasseroberfläche Luft schlucken und somit in Gewässern mit extrem niedrigen Sauerstoffgehalt überleben. Edelsteinkärpflinge graben sich in das Sediment ein um sich vor Fressfeinden zu verbergen oder um sich vor extrem warmem bzw. kaltem Wasser zu schützen. Gelegentlich verstecken sie sich zwischen Seegras oder Algen. Sie bewegen sich in Schwärmen, vor allem wenn sie verunsichert sind. Zu ihren Fressfeinden gehören der Rote Trommler, Cynoscion nebulosus (spotted sea trout), der Atlantische Umber, Schildkröten und einige Watvögel. Sie sind ein wichtiges Bindeglied zur Küsten-Nahrungskette und ernähren sich von Pflanzenmaterial, Algen, Detritus, Stechmücken, sowie kleineren Fischen. Der Edelsteinkärpfling wird im Alter von etwa drei Monaten geschlechtsreif. In kälteren Gewässern ist die Paarungszeit der Fische zwischen Februar und Oktober; in wärmeren Gewässern praktisch das ganze Jahr hindurch. Das Männchen baut Nestgruben am Grunde von Buchten um Weibchen anzulocken. Während der Balzzeit färben sich die Männchen hell blau Fig. 28) und verteidigen energisch ihre Nester. Die Weibchen laichen während der Laichzeit mehrere Male im Abstand von 1 - 7 Tagen und produzieren pro Laichperiode zwischen 100 und 300 Eiern. Die Eier sind klebrig und haften an Pflanzen, am Grund und aneinander. Je nach Wassertemperatur reifen sie 4 - 12 Tage. Larven haben beim Schlupf (typischerweise während der Frühlings- und Sommerzeit) eine Gesamtlänge von 4 7 mm und sind gelblich gefärbt. Die Lebensdauer des Edelsteinkärpflings ist unbekannt. 105 International Zebrafish Medaka Course IZMC Abb. 28: Edelsteinkärpfling (Cyprinodon variegatus). Quelle: http://www.fishesoftexas.org/media/ attachments/taxa/images/web/2701.jpg 10.4.6 Guppy (Poecilia reticulata) Der Guppy (Poecilia reticulata) gehört zu den weltweit verbreitetsten Tropenfischen und den beliebtesten Süßwasseraquarienfischen. Er gehört zur Familie der Poeciliidae und ist wie alle Fische, die zu dieser Familie gehören, lebendgebärend. Guppys sind in hohem Maße anpassungsfähig und fühlen sich unter ganz unterschiedlichen Umweltbedingungen wohl. Die Männchen, welche kleiner sind als die Weibchen, besitzen kräftig gemusterte Rücken- und Schwanzflossen, während die Weibchen unauffälliger gefärbt sind. Wild lebende Guppys ernähren sich in der Regel von benthischen Algen und wasserlebenden Insektenlarven. Guppys haben einen auffälligen Sexualdimorphismus. Während Wildtyp-Weibchen grau gefärbt sind, haben Männchen Flecken, Punkte oder Streifen, die in vielen verschiedenen Farben möglich sind. Guppy-Männchen sind in der Regel zwischen 1,5 und 3,5 cm lang, Weibchen zwischen 3 und 6 cm Fig. 29). Es gibt viele verschiedene Zuchtformen, die durch verschiedene Farben, Muster, Formen und Flossengrößen charakterisiert sind, wie beispielsweise Schlangenhaut- und Grasvarianten. Viele der gezüchteten Rassen haben morphologische Eigenschaften, die sich sehr von denen ihrer Wildtyp-Vorfahren unterscheiden. Männchen und Weibchen vieler Zuchtformen sind in der Regel größer und sind viel lebhafter gefärbt. Guppys haben, wie der Mensch 23 Chromosomenpaare inklusive eines Geschlechtschromosomenpaars. Die Gene, die für die Färbung der Männchen verantwortlich sind, befinden sich auf dem Y-Chromosom. Das ursprüngliche Verbreitungsgebiet des Guppys erstreckt sich über Antigua und Barbuda, Barbados, Brasilien, Guyana, Jamaika, die Niederländischen Antillen, Trinidad und Tobago, die Amerikanischen Jungferninseln und Venezuela. Allerdings sind Guppys in viele Ländern auf allen Kontinenten außer der Antarktis eingeführt worden. Manchmal ist dies zwar ungewollt geschehen, meist aber zur Kontrolle von Stechmücken-Plagen. Es ist davon ausgegangen worden, dass die Guppys die Stechmückenlarven fressen und somit der Ausbreitung der Malaria entgegenwirken; allerdings hat sich das Einbürgern des Guppy vielerorts negativ auf heimische Fischpopulationen ausgewirkt. Feldstudien haben gezeigt, dass Guppys fast jedes Süßwasserhabitat besiedelt haben, dass in ihrem Verbreitungsgebiet liegt, besonders küstennahe Fließgewässer des südamerikanischen Festlands. Guppys haben zudem hohe Toleranz gegenüber Brackwasser und sind somit auch in einigen Brackwasserhabitaten anzutreffen. Tendenziell kommen sie häufiger in kleineren Fließgewässern und Teichen vor als in großen, tiefen oder schnell fließenden Flüssen. 106 International Zebrafish Medaka Course IZMC Fig. 29: Wilde männliche (oben) und weibliche (unten) Guppys (Poecilia reticulata). Quelle: http://en.wikipedia.org/wiki/Guppy. Guppys werden als Modellorganismen in der (Öko)Toxikologie, Evolutions- und Entwicklungsbiologie eingesetzt. Dank seiner speziellen Brutstrategie des Lebendgebärens ist der Guppy in der Ökotoxikologie zu einem interessanten Modell für nicht eierlegende Fische geworden, z.B. für Bioakkumulationsstudien und den Transfer von Schadstoffen von einer Generation auf die nächste. 10.4.7 Goldorfe (Leuciscus idus melanotus) Die Goldorfe (Leuciscus idus melanotus) ist eine als Zierfisch genutzte Unterart des Aland (Leuciscus idus), der auch Orfe oder Nerfling genannt wird. Der Aland selbst ist ein Süßwasserfisch aus der Familie der Cyprinidae und ist in Nordeuropa und Asien anzutreffen. Er lebt typischerweise in Schwärmen in größeren Flüssen, Teichen und Seen. Der englische Name „ide“ kommt aus dem Schwedischen („id“) und bezieht sich ursprünglich auf seine helle Farbe (Abb. 30). Abb. 30: Goldorfe (Leuciscus idus melanotus). Quelle: http://www.naturchiemsee. de/assets/images/autogen/a_Goldorfe.jpg Die Körperform der Goldorfe ist die typische Cyprinidenform. Im Allgemeinen ist sie silbrig gefärbt und ihre Flossen leicht pinkfarben oder rötlich. Schwanz- und Rückenflosse können gräulich sein. Ältere und größere Fische können gelb bis bronzefarben gefärbt sein. 107 International Zebrafish Medaka Course IZMC Der Aland kann zwischen 60 und 80 cm lang werden, wobei die Durchschnittsgröße bei etwa 40 cm liegt. Er erreicht ein Gewicht von über 4 kg und ist ein Raubfisch, welcher Insekten, Crustaceen, Mollusken und kleine Fische verspeist. Im Frühling wandert er in Flüsse ab, um über Kies oder Pflanzenmaterial abzulaichen; die Eier können an Steinen klebend oder an Pflanzen im flachen Wasser gefunden werden. Da der Aland in den meisten deutschen Flusssystemen verbreitet ist, wurde die Goldorfe, ein typischer Aquarienfisch, in Deutschland einst als eine „einheimische Art“ für Toxizitätstests eingeführt. Da sich jedoch die natürliche Verbreitung der Goldorfe auf Gewässer in gemäßigten Breiten beschränkt, ist ihr Paarungsverhalten saisonal, d.h. dass Jungfische für gewöhnlich nicht das ganze Jahr über verfügbar sind. Daher ist die Goldorfe nicht nur in Deutschland eher ungeeignet für Toxizitätstests. Aus diesem Grund ist die Goldorfe für Routinetoxizitätstests in den vergangenen Jahren mehr und mehr durch den Zebrabärbling, die Dickkopfelritze und den Medaka abgelöst worden, welche sich ganzjährig fortpflanzen und zudem regelmäßiger laichen und in ihrer Hälterung weniger anspruchsvoll sind als die Goldorfe. 10.5 Diversität von Fischarten in alternativen Testmethoden Wie von Braunbeck et al. dargelegt worden ist, ist der Fischeitest (FET) nicht nur auf den Embryo des Zebrabärblings beschränkt, sondern leicht – mit minimalen artspezifischen Anpassungen – auch auf die anderen sogenannten „OECD-Arten“ anwendbar, also die Dickkopfelritze (Pimephales promelas) und den Medaka (Oryzias latipes; Tab. 15). Wie beispielshaft von Braunbeck et al. (2005) dargelegt werden konnte, ist die Variabilität zwischen dem FET mit dem Zebrabärbling, der Dickkopfelritze und dem Medaka nicht größer als die Variation zwischen der akuten Fischtoxizität bei verschiedenen Arten. (Abb. 31). 108 International Zebrafish Medaka Course IZMC Tabelle 15: Fischarten mit Haltung, Zucht und Testbedingungen, die für den Fischembryotest (FET;aus 168) vorgeschrieben sind. 169 Zebrafisch (Danio rerio) Amerikanische Elritze (Pimephales promelas) Medaka (Oryzias latipes) Herkunftsland Indien, Burma, Malakka, Sumatra Zentrales Nordamerika Japan, China, Südkorea Geschlechtsunterschiede Weibchen: vorstehender Bauch bei Trächtigkeit Männchen: dünner, orangene Färbung zwischen Längsstreifen (hauptsächlich an Schwanzflosse) Weibchen: dicker beim Eiertragen, Legeröhre Nicht-laichende Männchen: Schwarzer Punkt an Rückenflosse Laichende Männchen: schwarze Kopffärbung, Hochzeitspolster auf dem Rücken und Hochzeitsanalhöcker, Schwarze Streifen an den Längsachsen Weibchen: generell etwas dicker, tragen klebende Eier an Afterflosse Männchen: Größere Afterflosse, papilläre Fortsätze auf hinteren Rückenflossen-stacheln Fütterung 171 Trockenfutter (TetraMin; Tetra, Melle, FRG) einmal täglich; drei Tage vor dem Laichen zusätzlich adulte gefrorene Salzkrebschen (Artemia spec.) zweimal täglich (ad libitum). Um die Wasserqualität zu garantieren, werden Abfälle und Fäkalien eine Stunde nach Fütterung entfernt. Nassgewicht der Weibchen: 0.65 ± 0.13 g Männchen: 0.5 ± 0.1 g ausgewachsenen Fische Weibchen: 1.5 ± 0.3 g Männchen: 2.5 ± 0.5 g Weibchen: 0.35 ± 0.07 g Männchen: 0.35 ± 0.07 g Tank171 beleuchtung Leuchtstoffröhren (großes Spektrum); 10-20 µE/M²/s, 540-1080 lux, oder 50-100 ft-c (umgebende Laborbeleuchtung); 14 h Licht, 10 h Dunkelheit Wasser171 qualität 26.0 ± 0.5 °C, O2 ≥ 8.5 mg/l, Wasserhärte: 20°dH (~ 213 mg/l CaCO3), NO3-: ≤ 48 mg/l, NH3 und NO2-: < 0.01 mg/l, pH = 7.8 ± 0.2 Weiter Kriterien für Wasser171 qualität Partikeldichte< 20 mg/l, Organische Kohlenstoff < 2 mg/l, unionisiertes Ammoniak < 1 µg/l, Chlorreste < 10 µg/l, Phosphororganische Verbindungen < 50 ng/l, chloroorganische Verbindungen und polychloroorganische Biphenyle < 50 ng/l, Chloride < 25 ng/l Zebrafisch 16.5 ± 1.5 °C, O2 ≥ 8.5 mg/l, Wasserhärte: 20°dH (~ 213 mg/l CaCO3), NO3-: ≤ 48 mg/l, NH3 und NO2-: < 0.01 mg/l, pH = 7.8 ± 0.2 Amerikanische Elritze 24.0 ± 0.5 °C, O2 ≥ 8.5 mg/l, Wasserhärte: 20°dH (~ 213 mg/l CaCO3), NO3-: ≤ 48 mg/l, NH3 und NO2-: < 0.01 mg/l, pH = 7.8 ± 0.2 Medaka 168 Braunbeck, T., Böttcher, M., Hollert, H., Kosmehl, T., Lammer, E., Leist, E., Rudolf, M. and Seitz, N. (2005) Towards an alternative for the acute fish LC50 test in chemical assessment: The fish embryo toxicity test goes multi-species − an update. ALTEX 22: 87-102. 169 Bitte zu beachten, dass die in der Tabelle angegebenen Wasser, Beleuchtungs-, Fütterungs- und andere Haltungsbedingungen durch die Standardisierung des Analyseprotokols vorgegeben sind. Zebrabärblinge und Medakas vertragen eine viel größere Bandbreite an Haltungsbedingungen. 109 International Zebrafish Medaka Course IZMC (Danio rerio) 171 (Pimephales promelas) (Oryzias latipes) 180 l (max. 80 Tiere) 50 l (max. 60 Tiere) 171 Tankgröße für 171 die Haltung 180 l (max. 200 Tiere) Struktur und Aussehen der Eier Stabile Chorionhöhle, sehr Chorion härtet erst im transparent, nicht klebrig, Mehrzellstadium aus, Durchmesser ~ 0.8 mm transparent, klebt auf Oberflächen, Durchmesser < 1 mm stabiles Chorion mit feinen Härchen (haftet an der Analflosse des Weibchens), leicht transparent, Durchmesser < 1 mm Embryoentwicklung bei 25 °C 18 St.: Somitenentwicklung 21 St.: Abteilung der Schwanzes 26 St.: sichtbarer Herzschlag 28 St.: Blutzirkulation 72 St.: Schlüpfen 22 St.: Somitenentwicklung 25 St.: Abteilung des Schwanzes 27 St.: sichtbarer Herzschlag 30 St.: Blutzirkulation 160 St.: Schlüpfen 28 St.: Somitenentwicklung 28 St.: Abteilung des Schwanzes 30 St.: sichtbarer Herzschlag 32 St.: Blutzirkulation 7-8 T.: Schlüpfen Durchfluss, 26°C, 24-well Platten (2 ml pro Well) Durchfluss, 25°C, 24-well Platten (2 ml pro Well) 24 St.: Entwicklung der Schwarzflosse, Somitenbildung 48 St.: sichtbarer Herzschlag 28 St.: Schwanzentwicklung, Somitenentwicklung 3 T.: Blutzirkulation 4 T.: Blutzirkulation 30 St.: Somitenentwicklung 78 St.: Blutzirkulation 7 St.: Blutzirkulation 10 St.: Blutzirkulation 14 St.: Blutzirkulation permanent (interner Filter) permanent (interner Filter) extern (durch Luft) 4:2 2:4 15:15 4 l Tanks mit Stahlgitterboden und künstlichen Pflanzen als Laichstimulantien; externe Heizmatten 30 l Tanks mit schwarzen, auf 24°C gehaltenen Glasplatten mit zwei geteilten Tonrohren zur Eiablage 30 l Tanks mit schwarzen Glaswänden, mehreren künstlichen Pflanzen oder Ceratophyllum spec. zur Eiablage 171 Testart Toxikologische Beurteilung bei 25 °C Wasser171 umwälzung Verhältnis m/w 171 für Laichen Laichtanks 171 Durchfluss, 26°C, 24well Platten (2 ml pro Well) 110 International Zebrafish Medaka Course IZMC Abb. 31: Akute Toxizität (LC50) von Natriumlaurylsulfat (SDS) bei ausgewählten Fischarten in vivo (blau) und bei Embryonen des Zebrabärblings, Medaka und der Dickkopfelritze in ovo nach 48 h Exposition (rot; von 170) 10.6 Alternativmethoden für Fischtoxizitätstests, die nicht auf Embryonen basieren Im Gegensatz zu Fischembryonen, die hinsichtlich ihrer Sensitivität gegenüber Chemikalien und Abwässern eine hervorragende Korrelation mit adulten Fischen zeigen, sind Fischzellkulturen vielfach als potentieller In vitro-Alternative zum akuten Fischtoxizitätstest untersucht worden 171. Allerdings scheinen Fischzelllinien weniger empfindlich zu reagieren als der intakte Fisch, weswegen sie besonders für routinemäßige Abwasseruntersuchungen weniger geeignet erscheinen. Mit der Etablierung neuer Fischzelllinien und der Optimierung der Zellkulturbedingungen könnte dieses Problem zukünftig jedoch gelöst werden, was Fischzelllinien zu einer wirklichen Alternative zum konventionellen akuten Fischtoxizitätstest machen würde 172,173. 170 Braunbeck, T., Böttcher, M., Hollert, H., Kosmehl, T., Lammer, E., Leist, E., Rudolf, M. and Seitz, N. (2005) Towards an alternative for the acute fish LC50 test in chemical assessment: The fish embryo toxicity test goes multi-species − an update. ALTEX 22: 87-102. 171 Castano, A., Bols, B., Braunbeck, T., Dierickx, P., Halder, M., Isomaa, B., Kawahara, K., Lee, L.E.J., Mothersill, C., Pärt, P., Repetto, G., Riego Sintes, J., Rufli, H., Smith, R., Wood, C., Segner, H. (2003) The use of fish cells in ecotoxicology B The report and recommendations of ECVAM workshop 47. ATLA 31: 317-351. 172 Schirmer, K., Tanneberger, K., Kramer, N.I., Völker, D., Scholz, S., Hafner, C., Lee, L.E.J., Bols, N.C. and Hermens, J.L.M. (2008) Developing a list of reference chemicals for testing alternatives to whole fish toxicity tests. Aquat. Toxicol. 90: 128-137. 173 Scholz, S., Sela, E., Blaha, L., Braunbeck, T., Galay-Burgos, M., García-Franco, M., Guinea, J., Klüver, N., Schirmer, K., Tanneberger, K., Tobor-Kapłon, M., Witters, H., Belanger, S., Benfenati, E., Creton, S., Cronin, M.T.D., Eggen, R.I.L., Embry, M., Ekman, D., Gourmelon, A., Halder, M., Hardy, B., Hartung, T., Hubesch, B., Jungmann, D., Lampi, M.A., Lee, L., Marc Léonard, M., Küster, E., Lillicrap, A., Luckenbach, T., Murk, A.J., Navas, J.M., Peijnenburg, W., Repetto, G., Salinas, E., Schüürmann, G., Spielmann, H., Tollefsen, K.E., WalterRohde, S., Whale, G., Wheeler, J.R., Winter, M.J. (2013) A European perspective on alternatives to animal testing for environmental hazard identification and risk assessment. Regul. Toxicol. Parmacol. 67: 506-530. 111 International Zebrafish Medaka Course IZMC 11. Zebrafischembryos als Modellorganismen in der Chemischen Biologie und Genetik (Uwe Strähle, Sepand Rastegar) Obwohl wir große Fortschritte gemacht haben, die molekularen Ursachen von Krankheiten zu verstehen, hat die „Food and Drug Administration“ (FDA) der USA im letzten Jahrzehnt einen 50%-igen Rückgang in der Registrierung neuer Medikamente beobachtet. Zur gleichen Zeit steigerten sich die Subventionen für Forschung und Entwicklung im privaten und öffentlichen Bereich um 250%. Im März 2004 lautete der Titel eines FDA – Bericht: „Innovation oder Stagnation, Aufgaben und Chancen auf dem schwierigen Weg zu neuen Medikamenten! („Innovation or Stagnation, Challenge and Opportunity on the Critical Path to New Medical Products”) Dieser Bericht kam zu dem Ergebnis, dass nicht genügend an Möglichkeiten geforscht wurde, effiziente und sichere Produkte zu entdecken mit Methoden, die schnell und billig sind. In vielen Fällen müssen die Wissenschaftler auf Konzepte des letzten Jahrhunderts zurückgreifen. Ähnliche Feststellungen wurden auch in Europa gemacht. Die Entwicklung von Medikamenten war eines der Hauptthemen des Forschungsprogrammes FP7, indem Kooperationsinitiativen für Technologien zur innovativen Medizin gefördert wurden 174 . Für die EU waren diese vorhergehenden Bemühungen noch nicht ausreichend und so wurde Medikamentenentwicklung zu einem der Schlüsselthemen im neuen Forschungsförderungsprogramm Horizon 2020 175 . Dazu sollen neue Techniken und Modelle entwickelt werden, um die Wirksamkeit und Sicherheit von potentiellen Medikamenten gleich am Beginn ihrer Entwicklung zu erkennen. Ein großes Problem bei klassischen Pharmascreens ist auch die Tatsache, dass der Screening-Assay häufig auf eine einzelne Komponente in höchst verzweigten biologischer Netzwerke gerichtet ist. Kompensatorische Mechanismen oder unerwartete Toxizität im Organismus lassen sich mit solchen Ansätzen nicht erfassen und werden in der Regel erst in Nachfolgestudien in Tierexperimenten oder bei Anwendung am Menschen gefunden. Auf jeden Fall wird dies in einem Stadium festgestellt, wo bereits riesige Summen und viele Jahre Arbeit in ein Kanditatenmedikament investiert worden sind. Viele unserer bedeutendsten Medikamente wurden durch zufällige Exposition von Tieren oder Menschen gefunden, wie das Medikament gegen Thrombose, Warfarin, oder das Herzmedikament Digoxin 176 . Ein groß angelegter Pharma-Screen mit Säugetieren wäre jedoch ethisch und finanziell nicht zu rechtfertigen. Alternativ kann man die Embryonen von Fischen nutzen. Pioniere in US Laboren haben gezeigt, dass die Embryonen des Zebrabärblings für Medikamentensuche eingesetzt werden können. Die ersten potentiellen Pharmazeutika aus diesen Tests befinden sich in Phase 1 und 2 der klinischen Untersuchungen. Beispielsweise erhöht Prostaglandin E2 die Anzahl von Blutstammzellen im Zebrabärbling und wird nun in der klinischen Phase 2 als „Ansiedlungshelfer“ nach Knochenmarktransplantationen getestet 177 . Dorsomorphin ist ein Inhibitor der BMP-Rezeptoren und wurde als erster Inhibitor des BMP Signalweges überhaupt über morphologische Screens in Zebrafischembryonen 174 d2013_0246en01.pdf d2013_0246en01.pdf 176 Zon and Peterson, Nature Reviews Drug Discovery, pp 36, vol. 4, 2005 177 North et al. Nature 2007 175 112 International Zebrafish Medaka Course IZMC entdeckt 178. Dorsomorphin und seine Derivate sind Kandidaten für Medikamente, um den Eisenhaushalt im Körper zu regulieren und heterotope Ossifikation zu behandeln. 179. Zebrafischembryonen sind sehr gut für chemische Screens einsetzbar. Kleine, lösliche Moleküle werden normalerweise im Wasser gelöst und von den Embryonen über die Haut absorbiert. Es ist dazu keine zeitraubende Injektion nötig. Die Platten können durch individuelle Beobachtung oder über automatisierte Hochdurchsatzbildgebungsverfahren ausgewertet werden. Der Einsatz von hochentwickelter Transgenese zusammen mit der Transparenz der Embryonen erlaubt eine hochauflösende Analyse, die von anderen Wirbeltiermodellen nicht erreicht wird. Im Hinblick auf Medikamentenscreening lässt der Zebrafisch vor allem die Beobachtung von komplexem Zellverhalten und physiologischen Parametern an einem lebenden, intakten Organismus in Echtzeit zu. Zum Beispiel kann das Verhalten von Stammzellen oder Immunzellen in ihrer natürlichen Umgebung analysiert werden, ohne die Nachteile einer in vitro Zellkultur zu haben. Diese Experimente in einem Organismus haben den Vorteil, dass sie nicht nur die Auswirkung auf einzelne Zellen, sondern auch die Wirkung der zu testenden Komponenten auf den gesamten Signalweg und dessen Netzwerk beobachten lassen. Zusätzlich können komplexe toxische Parameter getestet werden. Zum Beispiel kann man mit dem Zebrabärblingsembryo mit hoher Wahrscheinlichkeit Herzrhythmusstörungen vorhersagen, wie Verlängerung des QT Intervalls. Dies ist eine häufige und sehr gefährliche Nebenwirkung von Medikamenten, die mehrfach erst in späten Phasen der Medikamentenentwicklung oder sogar erst nach Markteinführung des Medikamentes erkannt worden ist. Während der letzten Jahre wurden viele Mutationen im Zebrabärbling isoliert, die als Modelle für Krankheiten wie Krebs, Herzkrankheiten, neurodegenerative Defekte und viele andere menschliche Krankheiten dienen. Zebrabärblinge wurden zu einem akzeptierten Modell für Humangenetiker, um Mutationen im menschlichen Genom ursächlich mit bestimmten erblich bedingten Krankheiten zu verknüpfen. Durch die letzten genetischen Untersuchungen und die letzten Abb. 32: Automatisiertes Mikroskop am EZRC für das Screening vieler ZebrafischSequenzierungen 180 haben die Wissenschaftler nun embryos. Zugang zu Mutationen, die in mehr als 50% der Protein-kodierenden Gene im Zebrabärbling vorkommen. Mit der Einführung von neuen, hoch effizienten knock-out Techniken, die auf Sequenz-spezifischen synthetischen Nukleasen beruhen, können Mutationen in jedem beliebigen Gen hervorgerufen werden. Betrachtet man weiterhin die Tatsache, 178 Yu, P.B., et al., Dorsomorphin inhibits BMP signals required for embryogenesis and iron metabolism. Nature chemical biology, 2008. 4(1): p. 33-41. 179 Hong, C.C. and P.B. Yu, Applications of small molecule BMP inhibitors in physiology and disease. Cytokine & growth factor reviews, 2009. 20(5-6): p. 409-18. 180 Kettleborough, R.N., et al., A systematic genome-wide analysis of zebrafish protein-coding gene function. Nature, 2013. 496(7446): p. 494-7. Driever, W., et al., A genetic screen for mutations affecting embryogenesis in zebrafish. Development, 1996. 123: p. 37-46. Haffter, P. and C. Nusslein-Volhard, Large scale genetics in a small vertebrate, the zebrafish. The International journal of developmental biology, 1996. 40(1): p. 221-7. 113 International Zebrafish Medaka Course IZMC dass das Genom von Fisch und Mensch zu 70% identisch ist 181 , können somit gezielt menschliche Krankheiten modelliert werden. Diese Fülle von Krankheitsmodellen eröffnet neue Wege für die Medikamentensuche. So können an diesen Modellen, die Wirkung von chemischen Verbindungen auf pathologische Netzwerke im Kontext eines lebenden Organismus systematisch getestet werden. Hier zeigte eine Gruppe aus den USA die Unterdrückung von Gefäßmissbildungen durch Chemikalien an einem Zebrabärblingsmodell 182 . Die potentiellen Medikamente, die mit diesem Screen entdeckt wurden, werden momentan darauf untersucht, ob sie die Bildung neuer Blutgefäße bei Herzinfarkt beeinflussen können 183. Solche Screens umfassen typischerweise die Behandlung von Embryonen mit tausenden chemischen Substanzen, die sich in ihrer Struktur unterscheiden und entweder von Forschern selbst hergestellt, oder über den Markt bezogen werden. Wenn diese Screens mit automatisierten Techniken kombiniert werden, angefangen vom Sortieren der Embryonen, über Mikroskopie und Datenanalyse (Abb.32), kann der Durchsatz bis auf mehr als zehntausend Substanzen Abb. 33: Automatisiertes, steigen. Zusätzlich wird eine große Auflösung erreicht, robotisches Videosystem am EZRC, um das Fressverhalten von eine detaillierte Analyse der Morphologie. Die Zebrafischen zu überwachen. Sensitivität dieser Fischembryonen-Assays kann durch Transgene, die bestimmte Zelltypen oder biochemische Prozesse markieren, erhöht werden. Des Weiteren können die Screens dazu verwendet werden, die Auswirkungen der Chemikalie auf das Verhalten des Zebrabärbliings zu beobachten b.z.w. zu messen (Abb.33). Ergebnisse solcher Screens leisten ausserem einen großen Beitrag zur Charakterisierung der biologischen Effekte, die von künstlich hergestellten Substanzen ausgelöst werden, denen wir im täglichen Leben ausgesetzt sind. 181 Howe, K., et al., The zebrafish reference genome sequence and its relationship to the human genome. Nature, 2013. 496(7446): p. 498-503. 182 Peterson, R.T., et al., Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nature biotechnology, 2004. 22(5): p. 595-9. 183 Kettleborough, R.N., et al., A systematic genome-wide analysis of zebrafish protein-coding gene function. Nature, 2013. 496(7446): p. 494-7. 114 Unterstützt durch: European Zebrafish Resource Center Karlsruhe Institute of Technology (KIT) Institute of Toxicology and Genetics (ITG) Hermann‐von‐Helmholtz‐Platz 1 76344 Eggenstein‐Leopoldshafen Germany Tel.: +49 721 608‐22716 EZRC‐Requests∂itg kit edu www.ezrc.kit.edu EuFishBioMed European Society for Fish Models in Biology and Medicine e.V. Karlsruhe Institute of Technology (KIT) Institute of Toxicology and Genetics (ITG) Hermann‐von‐Helmholtz‐Platz 1 D‐76344 Eggenstein‐Leopoldshafen Germany Tel: +49‐721‐608‐23291 eufishbiomed∂itg kit edu www.eufishbiomed.kit.edu fischcare Dr. med. vet. Sandra Lechleiter Fachtierarzt für Fische Fuhrmannstraße 4 D‐75305 Neuenbürg T +49 (0) 7082 949698 F +49 (0) 7082 940880 M +49 (0) 171 1722659 sandra‐[email protected] www.fischcare.de