09-02-2007 - Spektralfarben SABRINA
Werbung

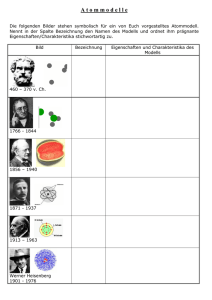
Sabrina Bosch Klasse 12c1 Chemie - Protokoll Freitag, der 09.02.2007 - 3. und 4. Stunde Wiederholung verschiedener Atommodelle Daltons Atommodell (um 1800) Die vier Kernaussagen: 1. Jedes Element besteht aus kleinsten, nicht weiter teilbaren Teilchen, den Atomen. 2. Alle Atome eines Elements haben die gleiche Größe und die gleiche Masse. Die Atome unterschiedlicher Elemente unterscheiden sich in ihrer Masse. Damit gibt es genau so viele Atomarten, wie es Elemente gibt. 3. Atome sind unzerstörbar. Sie können durch chemische Vorgänge weder vernichtet noch erzeugt werden. 4. Bei chemischen Reaktionen werden die Atome der Ausgangsstoffe neu angeordnet und in bestimmten Anzahlverhältnissen miteinander verknüpft. Die Atome stellt man sich als winzig kleine Kugeln vor. Thomsonsches Atommodell (1903) Beim Thomsonschen Atommodell besteht das Atom aus einer gleichmäßig verteilten Masse und aus positiver Ladung. In dieser Masse bewegen sich Elektronen. Es wurde von Joseph John Thomson entwickelt und wird auch als „Rosinenkuchenmodell“ bezeichnet. Im Grundzustand sind die Elektronen so verteilt, dass ihre potentielle Energie minimal ist. Werden sie angeregt, beginnen sie zu schwingen. Thomson schloss aus Experimenten mit Röntgenstrahlen, dass die Anzahl der Elektronen in einem Atom etwa gleich der Massenzahl des Atoms sei. Rutherfordschers Atommodell (1909) Versuch: In einen Blei-Block mit Öffnung zu einer Seite hin wird ein radioaktiver Stoff gelegt, der Strahlung abgibt: Alpha-, Beta- oder Gamma-Strahlung. Diese Strahlen werden durch die Öffnung im Bleiblock durch ein elektrisches Feld geleitet. Die Beta-Strahlen lenkt man zum positiven Pol hin ab, die AlphaStrahlen zum negativen Pol und die Gamma-Strahlen bleiben unverändert. Die Alpha-Strahlung wird durch eine (ca. 1000 Atome) dünne Goldplatte geleitet. Die Strahlung lässt sich danach mit einem Leuchtschirm sichtbar machen. Beobachtungen: Der Großteil der Alpha-Teilchen kann die Goldfolie (mehr oder weniger) ungehindert passieren. Größere Streuwinkel kommen immer seltener vor. Auch Streuwinkel von über 90° gibt es, aber extrem selten. Einige Alpha-Teilchen werden zurückgestreut. Seite 1 von 2 Sabrina Bosch Klasse 12c1 Wenn die Alpha-Teilchen auf den Kern der Goldfolie stoßen, werden sie zurückgeworfen, dies erklärt die an manchen Stellen strahlenden Punkte. Die Ablenkung der Alpha-Teilchen und ihre Winkelverteilung lassen sich dadurch verstehen, dass sich in den Atomen ein sehr kleines Massezentrum befindet, das elektrisch geladen ist. Man nennt dieses Massezentrum den Atomkern. Die meisten Strahlen sind durch die Goldfolie gekommen, d.h. dass zwischen den Kernen ein großer Freiraum besteht. Das Ergebnis führte auf das Rutherfordsches Atommodell. Die Elektronen, die um den Kern kreisen, schirmen die positive Kern-Ladung ab, sodass das Atom nach außen hin neutral erscheint. Bohrsches Atommodell (1913) Die Elektronen in der Atomhülle bewegen sich auf genau festgelegten Bahnen um den Kern. Durch Energiezufuhr können Elektronen auf ein höheres Energieniveau angehoben werden. Beim Zurückfallen der Elektronen auf das niedrigere Energieniveau wird Licht mit bestimmter Wellenlänge abgestrahlt. Besprechung der Hausaufgaben vom Mittwoch, den 07.02.2007 Buch S.339 Aufgabe A1 Lösung: Wenn ein Stoff das gesamte sichtbare Licht absorbiert, ergibt sich ein schwarzer Farbeindruck. Absorbiert ein Stoff Licht im Wellenbereich 440-480nm ergibt sich ein orangeroter Farbeindruck. Das Spektrum des Lichts Seite 2 von 2