Kalorimetrie 2016 - Graf (AB)
Werbung

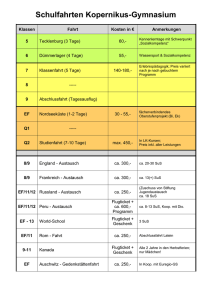
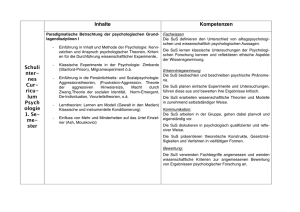
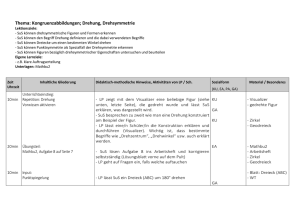
Fachdidaktik Chemie UZH FDIII - Experimentierkurs Arbeitsblatt: Energiegehalt von Holzkohle Einleitung: Jede chemische Reaktion ist mit einem Energieumsatz verbunden. Dabei wird zwischen exothermen Reaktionen, bei denen Energie frei wird, und endothermen Reaktionen, welche für den Ablauf Energiezufuhr benötigen, unterschieden. In der Chemie wird die frei werdende oder benötigte Wärmeenergie als Reaktionswärme (oder als Reaktionsenthalpie, ∆HR) bezeichnet. Die meisten exothermen Reaktionen sind Verbrennungsreaktionen, die dabei frei werdende Wärme, die Reaktionswärme der Verbrennungsreaktion also, wird als Verbrennungsenthalpie bezeichnet. Diese Energie- oder Wärmemenge (Masseinheit Joule) kann nur experimentell mit einem Bombenkalorimeter gemessen werden. Ziele: Die SuS können Beobachtungen adäquat zu Papier bringen. Die SuS lernen den Begriff der Wärmekapazität kennen und können diesen in einfachen Berechnungen einsetzen. Die SuS können mittels der ermittelten Temperaturen aus dem Kalorimeterversuch die Verbrennungswärme von Holzkohle berechnen. Die SuS lernen, mit Einheiten richtig umzugehen und mögliche Fehlerquellen zu eruieren. Beobachtung: Wir skizzieren schematisch den Aufbau des Kalorimeters und notieren, was wir während des Versuchs beobachten. Skizze: Beobachtung: 1 Fachdidaktik Chemie UZH FDIII - Experimentierkurs Auswertung: Wie können wir nun die Verbrennungswärme bestimmen, also, wie viel Energie in unserem Stückchen Kohle steckt? Dazu notieren wir erst einmal alle Eckdaten des Versuchs: Masse unseres Holzkohlestücks (g): _________________ Umrechnungsfaktor auf 1g Holzkohle: _________________ Masse des Wassers (g): _________________ Wassertemperatur vor Verbrennung (°C): _________________ Wassertemperatur nach Verbrennung (°C): _________________ Temperaturunterschied ∆T (°C): _________________ Spezifische Wärmekapazität1 cp des Wassers: 4.19 J/g°C (streng genommen J/gK) Berechnung der Verbrennungswärme der Holzkohle: Die Formel zur Berechnung lautet wie folgt (pro g Holzkohle): ∆HR = ∆T(°C) x m(H2O)(g) x cp(H2O)(J/g°C) x Umrechnungsfaktor Einsetzen unserer Werte ergibt (achten sie auf die richtigen Einheiten): Tragen sie hier den für die Holzkohle in der Literatur angegebenen Wert (pro g!) ein (Elemente, S. 170): __________________ Vergleichen Sie die beiden Werte. Was fällt auf? Falls der berechnete Wert vom Literaturwert abweicht, was könnten mögliche Fehlerquellen sein? 1 Die spezifische Wärmekapazität cp eines Stoffes gibt Auskunft über die Fähigkeit eines Stoffes, Wärme zu speichern. Sie kann nur experimentell bestimmt werden. 2 Fachdidaktik Chemie UZH FDIII - Experimentierkurs Lösungen zum Arbeitsblatt Einleitung Jede chemische Reaktion ist mit einem Energieumsatz verbunden. Dabei wird zwischen exothermen Reaktionen, bei denen Energie frei wird, und endothermen Reaktionen, welche für den Ablauf Energiezufuhr benötigen, unterschieden. In der Chemie wird die frei werdende oder benötigte Wärmeenergie als Reaktionswärme (oder als Reaktionsenthalpie, ∆HR) bezeichnet. Die meisten exothermen Reaktionen sind Verbrennungsreaktionen, die dabei frei werdende Wärme, die Reaktionswärme der Verbrennungsreaktion also, wird als Verbrennungsenthalpie bezeichnet. Diese Energie- oder Wärmemenge (Maßeinheit Joule) kann nur experimentell mit einem Bombenkalorimeter gemessen werden. Ziele: Die SuS können Beobachtungen adäquat zu Papier bringen. Die SuS lernen den Begriff der Wärmekapazität kennen und können diesen in einfachen Berechnungen einsetzen. Die SuS können mittels der ermittelten Temperaturen aus dem Kalorimeterversuch die Verbrennungswärme von Holzkohle berechnen. Die SuS lernen, mit Einheiten richtig umzugehen. Beobachtung: Wir skizzieren schematisch den Aufbau des Kalorimeters und notieren, was wir während des Versuchs beobachten (Skizze unter Umständen vollständig oder teilweise vorgeben. Man könnte auch eine schematische Skizze machen.). Das glimmende Holzkohlestückchen glüht nach der Sauerstoffzufuhr hell auf. Die Verbrennung liefert Wärme, die das Wasser im Kalorimeter aufheizt. Die Temperaturzunahme kann an dem Thermometer abgelesen werden. Die Temperatur erreicht nach dem Ende der Verbrennung ihr Maximum. 3 Fachdidaktik Chemie UZH FDIII - Experimentierkurs Auswertung: Wie können wir nun die Verbrennungswärme bestimmen, also, wie viel Energie in unserem Stückchen Kohle steckt? Dazu notieren wir erst einmal alle Eckdaten des Versuchs: Daten vom Experimentiertag Masse unseres Holzkohlestücks (g): 0.15 Umrechnungsfaktor auf 1g Holzkohle: 6.66 Masse des Wassers (g): 500 Wassertemperatur vor Verbrennung (°C): 21.2 Wassertemperatur nach Verbrennung (°C): 23.2 Temperaturunterschied ∆T (°C): 2 Spezifische Wärmekapazität2 cp des Wassers: 4.19 J/g°C (streng genommen J/gK) Berechnung der Verbrennungswärme der Holzkohle: Die Formel zur Berechnung lautet wie folgt (pro g Holzkohle): ∆HR = ∆T(°C) x m(H2O)(g) x cp(H2O)(J/g°C) x Umrechnungsfaktor Einsetzen unserer Werte ergibt (achten sie auf die richtigen Einheiten): (-) 27'905J = (-) 27.9KJ/g Tragen sie hier den für die Holzkohle in der Literatur angegebenen Wert (pro g) ein (Elemente, S. 170): - 26KJ/g Vergleichen Sie die beiden Werte. Was fällt auf? Der experimentell berechnete Wert ist meist etwas geringer. Am Experimentiertag höher, aber ziemlich genau. Falls der berechnete Wert vom Literaturwert abweicht, was könnten mögliche Fehlerquellen sein? Temperatur mit herkömmlichem Thermometer nicht ganz genau zu bestimmen. Zusammensetzung der Holzkohle kann variieren. Wassermenge nicht genau bestimmt. Falls Wert zu tief: Nicht alle Wärme wird komplett vom Wasser aufgenommen. Ein wenig Wärme wird auch von der Apparatur absorbiert. Es bräuchte die Wärmekapazität des Kalorimeters selbst als Korrekturwert. 2 Die spezifische Wärmekapazität cp eines Stoffes gibt Auskunft über die Fähigkeit eines Stoffes, Wärme zu speichern. Sie kann nur experimentell bestimmt werden. 4 Fachdidaktik Chemie UZH FDIII - Experimentierkurs Bemerkungen: Eigentlich müssten alle Temperaturwerte in Kelvin angegeben werden. Zwecks didaktischer Vereinfachung wird hier mit °C gearbeitet. Literatur: Steiger Markus et al. (2007). Elemente. Grundlagen der Chemie für Schweizer Mittelschulen (7., unveränderter Nachdruck 2015). Zug: Klett und Balmer. http://www.seilnacht.com/versuche/kalori.html https://de.wikipedia.org/wiki/Spezifische_W%C3%A4rmekapazit%C3%A4t Autor: Urs Graf 5