Zusammenfassung, Einleitung und Aufgabenstellung
Werbung

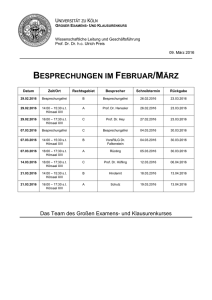
1. Zusammenfassung Transglutaminasen sind die einzigen Enzyme, die irreversible kovalente Isopeptidbindungen zwischen einem Glutamindonor und einem Aminodonor knüpfen. Dabei sind die Substrate mit Glutamindonoreigenschaften die wissenschaftlich interessanteren, da die Transglutaminase nur mit wenigen Glutaminresten reagiert. Die Eigenschaften der Umgebungen dieser reaktiven Glutaminreste wurden sowohl auf der Primär- und auf der Sekundär-, als auch auf der Tertiärstrukturebene untersucht. Informationen über die Substrate wurden aus der klassischen Literatur und aus der frei verfügbaren Datenbank „Medline“ (http://www.ncbi.nlm.nih.gov/PubMed/) recherchiert. Die Primär- und Tertiärstrukturen der Proteine konnten ebenfalls aus kostenlos zur Verfügung gestellten Datenbanken bezogen werden. Die Auswertung der Daten erfolgte unter Zuhilfenahme von Programmen, die umsonst aus dem Internet beziehbar sind bzw. mit einem selbstgeschriebenen Programm. Ausgehend von den Publikationen von Schechter und Berger [1967] sowie Coussons et al. [1992], die die Umgebungen der reaktiven Stellen untersucht haben, wurden die Primärstrukturen interpretiert. Dabei konnten die Ergebnisse der Literatur bestätigt und erweitert werden. Der Ansatz aus den Primärstrukturen die entsprechenden Sekundärstrukturen zu berechnen, fiel unbefriedigend aus. Im Vergleich mit experimentell gewonnenen Sekundärstrukturen hatte keine der verwendeten Methoden zur Sekundärstrukturberechnung annähernd gleiche Ergebnisse. Die Auswertung der Tertiärstrukturen brachte als Ergebnis, daß sich die reaktiven Glutaminreste in der Regel an der Oberfläche des Proteins befinden. Offensichtlich hat die Zugänglichkeit der Glutamine bei der Wechselwirkung mit Transglutaminasen eine zentrale Bedeutung. 2. Einleitung In dieser Diplomarbeit werden Ansätze gesucht, wie mit Hilfe des Computers und des Internet im Bereich der Biochemie neue Wege aufgezeigt werden können. Konkret werden die Enzymfamilie der Transglutaminasen und ihre Substrate behandelt. In diesem Kapitel soll ein Überblick über die Transglutaminasen und ihre Substrate gegeben werden. Weiterhin wird ein Abriß über die Einsatzmöglichkeiten der Computerauswertung in der Biochemie gegeben. 2.1. Transglutaminasen Die Protein-Glutamin-γ-Glutamyltransferasen, kurz Transglutaminasen genannt, gehören zur Enzymklasse der Transferasen. Neben den Transferasen existieren noch weitere fünf Enzymklassen: die Oxidoreductasen, die Hydrolasen, die Lyasen, die Isomerasen und die Ligasen. Jede dieser Klassen wird durch die erste Zahl der Enzyme Classification -Number eindeutig gekennzeichnet. Jede Nummer besteht aus vier Zahlen. Die erste Zahl der Nummer kennzeichnet die Klasse. Die zweite kennzeichnet die Unterklasse, die dritte die der „Unterunterklassen“. Mit der vierten Zahl der Nummer wird dann das konkrete Enzym spezifiziert. Die Einordnung der Transglutaminase mit der EC-Nummer 2.3.2.13 wird exemplarisch für alle anderen Enzyme vorgestellt. Sie sieht folgendermaßen aus: EC 2. Transferasen EC 2. 3. Acyltransferasen EC 2. 3. 2. Aminoacyltransferasen EC 2. 3. 2. 13 Protein-Glutamin-γ-Glutamyltransferase Eine Übersicht der Enzymklassifikation findet sich bei der Datenbank Enzyme (http://www.expasy.ch/sprot/enzyme.html) auf dem Expert Protein Analysis System (ExPASy) Molecular Biology Server (http://www.expasy.ch/) in der Schweiz. Die wichtigste Reaktion, die die Transglutaminase katalysiert, ist die Knüpfung von kovalenten Bindungen zwischen Glutamin- und Lysinresten eines oder verschiedener Proteine, was zu hochmolekularen Proteinpolymeren führen kann. Diese Reaktion ist in Abbildung 2-1 vereinfacht dargestellt. Die Carboxamidgruppe von Glutamin wird unter Freisetzung von Ammoniak auf ein primäres Amin übertragen. Die Aminfunktion wird in den meisten Fällen von einem Lysin übernommen. Wenn es sich um die Reste ein und desselben Proteins handelt, entsteht eine intramolekulare Bindung, bei Resten von zwei verschiedenen Molekülen handelt es sich um eine intermolekulare Bindung. O H H N N N O H H NH4 O H N + H N O N O N Abb. 2-1: H H O + TGase H O H 2N NH2 O N N O H O Kovalente Verknüpfung der Seitenketten von Glutamin (links) und Lysin (rechts) durch eine Transglutaminase Die geknüpften Bindungen in Proteinaggregaten können nicht mehr enzymatisch gespalten werden. Damit ist die durch Transglutaminasen katalysierte Vernetzung nach heutigem Kenntnisstand irreversibel. Die katalytische Reaktion ist mehrstufig. In der ersten Stufe reagiert die Transglutaminase mit einem Glutaminylrest, was zur Bildung eines binären Komplexes führt. TGase Cys His H - O S TGase + Cys O H H Abb. 2-2: H H N H O His S N N H Cys O + NH4 O H N O + NH2 O N N His H -O S NH2 TGase + O Acyl-Enzymkomplex Mechanismus der Bildung des Acyl-Enzymintermediats von TGasen [modifiziert nach Pedersen et al., 1994] Dieser Acyl-Enzymkomplex reagiert dann mit einem Amindonor weiter unter Ausbildung einer kovalenten Bildung zwischen Glutamin- und Amindonor. Dabei wird Transglutaminase freigesetzt. TGase O Cys Cys His S -O S H2N CH2R O H N N H O O His H H His H - S + N O + O NH CH2R H N Acyl-Enzymkomplex Abb. 2-3: Cys TGase TGase NH CH2R O H N N H O Reaktion des Acyl-Enzymintermediats mit einem primären Amin [modifiziert nach Pedersen et al., 1994] Wie schon in den oben gezeigten Mechanismen ersichtlich ist, sind die Aminosäuren Cystein und Histidin im Aktivzentrum der Transglutaminase essentiell für die katalytische Aktivität des Enzyms. Dieses Paar wird noch stabilisiert durch einen Aspartatrest. Diese Anordnung funktioneller Seitenketten wird als katalytische Triade bezeichnet (Abb. 2-4; Abb. 2-5). Asp 396 _ Cys 314 H H S _ H + N O O N O His 373 Tyr 560 Abb. 2-4: Die katalytische Triade im humanen Blutgerinnungsfaktor XIII (die am besten untersuchten Transglutaminase), in der zusätzlich die phenolische Hydroxylgruppe des Tyrosins 560 die deprotonierte Form des Cysteins stabilisiert (nach den Daten der Röntgenstrukturanalyse) [modifiziert nach Yee et al., 1994] Abb. 2-5: Die oben gezeigte schematische Abbildung als Molekülausschnitt bearbeitet mit RasMol [modifiziert nach Yee et al., 1994] Transglutaminasen wurden mittlerweile in allen Bereichen der belebten Natur nachgewiesen, die Säugerenzyme sind jedoch mit Abstand am eingehendsten charakterisiert. Die Aufklärung einiger ihrer physiologischen Funktionen, Reaktionsmechanismen und die entschlüsselten Sequenzinformationen bilden die Grundlagen zum Verständnis der gesamten Enzymfamilie. Eine Grundannahme dieser Arbeit ist, daß aus den bekannten Informationen über die Säugertranstransglutaminasen Rückschlüsse auf die katalytyschen Eigenschaften von bakteriellen Transglutaminasen gezogen werden können. Die Säugertransglutaminasen und einige ihrer charakteristischen Eigenschaften werden auf der nächsten Seite tabellarisch aufgeführt. Die Tabelle 2-1 gibt eine Übersicht über Säugertransglutaminasen. Genprodukt Synonyme Transglutaminase Keratinocyten1 Transglutaminase TGK Molmasse / Aufbau Anzahl der Aminosäuren; Organismus; Literaturverweis 92 kDa 816 AS; Mensch; [Kim et al., 1994] Transglutaminase Gewebetransglutamin 77 kDa 2 ase TGC Meerschweinchenleb erTransglutaminase 689 AS; Meerschweinchen; [Ikura et al., 1988; korrigiert Polakowska et al., 1992 und Ikura et al., 1995] Transglutaminase Epidermale- bzw. 3 HaarfollikelTransglutaminase TGE 692 AS; Mensch; 77 kDa (Aktivierung durch [Kim et al., 1993] proteolytische Spaltung in ein aktives 50 kDa Fragment) Plasma XIII(a) 320 kDa Heterotetramer a2b2 2 a-Untereinheiten je 83 kDa (Aktivierung durch proteolytische Abspaltung eines 5 kDa Peptids) 2 b-Untereinheiten je 76,5 kDa Faktor Fibrinstabilisierender Faktor, FSF, Fibrinoligase Transglutaminase ProstataTransglutaminase, 4 TGp Tab. 2-1: 730 / 731 AS; Mensch; [Takahashi et al., 1986; Grundmann et al., 1986; Ichinose et al., 1986a] 641 AS [Ichinose et al., 1986b] 65 kDa (SDS-PAGE) 668 AS; Ratte; [Ho et al.,1992] [Seitz et al., 1991] 75,5 kDa berechnet [Ho et al., 1992] Terminologie und proteinchemische Daten zum Aufbau von Säugertransglutaminasen [nach Pasternack, 1998] Die wichtigsten Vertreter dieser Unterfamilie der Transglutaminasen sind Plasma Faktor XIII(a) und Transglutaminase 2. Beide spielen eine wichtige physiologische Rolle. Der Plasma Faktor XIII(a) wirkt mit bei der Blutgerinnung, auf die später noch einmal genauer eingegangen wird. Die Transglutaminase 2 ist am programmierten Zelltod und an dem Aufbau der extrazellulären Matrix beteiligt. Die hohe Substratspezifität der Transglutaminasen bei den Glutamindonoren ist ein Charakteristikum dieser Enzyme; beispielsweise wird von dem Protein Involucrin von 150 Glutaminresten nur ein einziges als Glutamindonor akzeptiert. Obwohl alle Transglutaminasen die gleiche Reaktion katalysieren, bestehen Unterschiede in ihrer Substratspezifität. Der Plasma Faktor XIII(a) ist das Enzym mit der höchsten Substratspezifität. Faktor XIII ist auch die einzige Transglutaminase, deren 3-dimensionale Struktur aufgeklärt ist, und soll deshalb als Modell für alle anderen Transglutaminasen herangezogen werden. Abb. 2-6: Die 3-dimensionale Darstellung von Faktor XIII(a) Hier ist die aktivierte Form des Faktor XIII dargestellt (Faktor XIIIa), der aus zwei a-Untereinheiten, die beide ein aktives Zentrum besitzen, besteht. Die katalytischen Triaden sind hervorgehoben [modifiziert nach Yee et al., 1994]. Faktor XIII ist ein essentielles Enzym in der Blutgerinnung, die zu den wichtigsten Schutzmechanismen des Körpers gehört und den schnellen Verschluß beschädigter Gefäße gewährleistet. Der als Hämostase bezeichnete Vorgang besteht aus einer Abfolge von Reaktionen, an deren Ende ein aus quervernetzten Fibrinfasern bestehendes Blutgerinnsels gebildet wird. Der im Blutkreislauf zirkulierende inaktive Faktor XIII wird durch die Serinprotease Thrombin aktiviert. Das Aktivzentrum der nun als Faktor XIIIa bezeichneten aktiven Transglutaminase wird dadurch für seine Substratproteine zugänglich. Ebenfalls entstehen im Gerinnungsverlauf durch Thrombin aus Fibrinogen aggregierende Fibrinfasern. Diese werden, wie in Abbildung 2-6 dargestellt, durch die Transglutaminase vernetzt. Dadurch verhärtet sich das Blutgerinnsel und wird resistent gegen mechanische Einflüsse und proteolytischen Abbau. Fibrinopeptide 2A 2B Fibrinogen n (A α ) 2 (B β ) 2 γ 2 aggregiertes Fibrin (α 2β 2γ2) n Fibrinmonomer n α 2β 2γ2 Thrombin Faktor XIII (a 2 b 2 ) Faktor XIII' (a' 2 b 2 ) N-terminale Fragmente Abb. 2-7: C a ++ Faktor XIIIa a* 2 b2 kovalent vernetztes Fibrinaggregat Reaktionsfolge der Vernetzung eines Fibrinaggregates durch den Blutgerinnungsfaktor XIII [nach Lorand und Conrad, 1984] Die Bedeutung von FXIII wird ersichtlich, wenn man sich vergegenwärtigt, daß Menschen mit keinem oder einem nicht funktionsfähigen Faktor XIII lebenslange Schwierigkeiten mit der Blutgerinnung haben, was zu verlängerten Blutungen und/oder Wiederaufbrechen von Wunden führt. 2.2. Substrate Bei den Substraten soll in dieser Arbeit nur auf Glutamindonoren eingegangen werden. Nochmal erwähnt sei die hohe Substratspezifität der Transglutaminasen gegenüber Glutamindonoren. Offensichtlich besteht ein direkter Zusammenhang zwischen Substratspezifität und biologischer Funktion der Substrate. Die Gemeinsamkeiten dieser Glutamindonoren herauszuarbeiten ist Ziel dieser Arbeit. Im Gegensatz dazu reagieren die Transglutaminasen auf der Seite der Amindonoren sehr unspezifisch, so daß fast jedes primäre Amin als Amindonor akzeptiert wird. Es erscheint sinnvoll die Substrate in folgende Gruppen zu unterscheiden: 1. physiologisch relevante Proteine / Peptide 2. industriell nutzbare Proteine / Peptide Beispielhaft stehen für die erste Gruppe, neben dem schon erwähnten Fibrin in der Blutgerinnung, das α2-Antiplasmin und der von-Willebrandt-Faktor, welche ebenfalls eine Rolle in der Blutgerinnung spielen, und das Nidogen, welches eine Rolle im Membranaufbau spielt. Abb. 2-8: Die A3 Domäne des von-Willebrandt-Faktors Die Glutaminreste sind hervorgehoben. [nach Huinzinga et al., 1997] In Abbildung 2-8 kann man erkennen, daß sich Glutaminreste von der A3 Domäne des vonWillebrandt-Faktors an der Oberfläche des Moleküls befinden, was eine zwingende Notwendigkeit für die Reaktionsfähigkeit mit Transglutaminase ist. Zur zweiten Gruppe zählen beispielsweise die Familie der Caseine, welche aus der Milch gewonnen werden, die Makroglobuline und das α-Lactalbumin. Abb. 2-9: α-Lactalbumin, bei dem die Glutaminreste und die bekannte Reaktionsstelle nochmals verstärkt hervorgehoben sind. [nach Acharya et al., 1989] Auch bei diesem Molekül befinden sich die Glutaminreste in einer exponierten Lage. Es scheinen aber noch andere Faktoren für die Reaktionsfähigkeit der Glutaminreste eine Rolle zu spielen, da nur einer der sieben exponierten Glutaminresten mit Transglutaminase reagiert. Diese Faktoren zu bestimmen, ist zentrale Aufgabe dieser Arbeit. 2.3. Möglichkeiten der Computerauswertung Computergestützte Datenverarbeitung kann auf breiter Basis in der Biochemie eingesetzt werden. Neben Speicherung und Verwaltung der anfallenden Daten sowie der multimedialen Kommunikation über Computernetzwerke ist die wichtigste Aufgabe die Auswertung von Daten. Dieser Abriß bezieht sich auf Daten, die im Protein- / Peptidbereich anfallen. Einige der Auswertemöglichkeiten sind ebenfalls in anderen Bereichen der Biochemie, z.B. bei den Nukleinsäuren, anwendbar. Die einfachste Art der Auswertung ist die Bestimmung der charakteristischen Daten eines Proteins. Hierzu gehören: 1. die absolute Anzahl jeder Aminosäure 2. die relative Anzahl jeder Aminosäure in Bezug auf die Aminosäuresequenz 3. der geladene bzw. polare und hydrophobe Anteil der Aminosäuren im Protein Hinzu kommen die komplexeren Berechnungen: 4. der Hydrophilie 5. der Hydrophobie Die vergleichenden Methoden ermöglichen: 6. das Auffinden von kürzeren Sequenzen als Segmente in umfangreicheren Primärstrukturen 7. den Sequenzvergleich Zuletzt gibt es noch die Visualisierungen sowohl der Sekundärstruktur als auch der Tertiärstruktur und der Quartärstruktur. Alle oben aufgeführten Punkte werden bei der Beschreibung der Programme im übernächsten Kapitel behandelt. Auf einen großen Bereich der Computerauswertung, das Molecular Modelling, kann in der Diplomarbeit nicht eingegangen werden. Dies würde den Umfang und den Zeitrahmen sprengen. 3. Aufgabenstellung Die Aufgabenstellung dieser Diplomarbeit ergibt sich aus der Frage, welche Bedingungen erfüllt sein müssen, damit ein Substrat mit Transglutaminasen reagieren kann. Um diese Frage ausreichend beantworten zu können, sollen alle in der Literatur bekannten Proteinsubstrate der Gewebetransglutaminasen und des Faktors XIII mit Hilfe des Computers untersucht werden. Diese Untersuchungen und Betrachtungen sollen sich sowohl auf die Primär-, die Sekundär-, als auch auf die Tertiärstruktur der Substrate beziehen. Eine besondere Betrachtung soll den Umgebungen der Glutaminreste gelten. Hierbei sollen die Glutaminreste, bei denen bekannt ist, daß sie mit Transglutaminase reagieren, eine besondere Beachtung erfahren. Die Aufgabe wird folgendermaßen unterteilt: 1. Sichtung der Literatur nach bekannten Substraten der Transglutaminasen 2. Recherchen in der Datenbank „Medline“ (http://www.ncbi.nlm.nih.gov/PubMed/) nach Substraten von Transglutaminasen 3. Recherchen in den einschlägigen Datenbanken („SWISS-PROT“ (http://expasy.hcuge.ch/sprot/sprot-top.html), PIR (http://nbrfa.Georgetown.Edu/pir), PRF (http://www.genome.ad.jp/dbget-bin/www_bfind?prf) und PDB (http://pdb.pdb.bnl.gov/)) nach Primär- und Tertiärstrukturen der Substrate 4. Beschreibung der eingesetzten Programme 5. Beschreibung der Datenbanken, die zur Recherche herangezogen werden 6. Beschreibung der verwendeten Datenformate 7. Auswertung der Aminosäureverteilung in der Glutaminumgebung 8. Sequenzvergleich der reaktiven Zentren des Enzyms und der Umgebungen der reaktiven Stellen der Substrate 9. Berechnung und Betrachtung von Sekundärstrukturen 10. Visualisierung von Molekülen, sofern deren 3-dimensionale Struktur bekannt ist. Aus der Lage der Glutaminreste im Molekül können Rückschlüsse auf ihre Reaktionsfähigkeit gezogen werden.