Ancotil - Pneumonie Aktuell 2017
Werbung

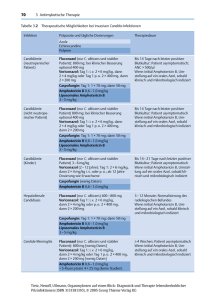
Fachinformation Ancotily 1. Bezeichnung des Arzneimittels Ancotil y Wirkstoff: Flucytosin 2. Verschreibungsstatus/ Apothekenpflicht Verschreibungspflichtig 3. Zusammensetzung des Arzneimittels 3.1 Stoff- oder Indikationsgruppe Antimykotikum mit systemischer Wirksamkeit. 3.2 Arzneilich wirksamer Bestandteil nach Art und Menge 1 Flasche Ancotil, Infusionslösung (250 ml), enthält 2,5 g Flucytosin in isotonischer Infusionslösung. Flucytosin 3.3 Sonstige Bestandteile Natriumchlorid; Salzsäure; Tris(hydroxymethyl)-aminomethan und Wasser für Injektionszwecke. Gelegentlich werden folgende Nebenwirkungen beobachtet: – Magen-Darm-Beschwerden (Durchfall, Übelkeit, Erbrechen), – reversibler Anstieg der Serum-Transaminasen, – Blutbildveränderungen mit Anämie, Leukopenie, Granulozytopenie und Thrombozytopenie in Abhängigkeit von einem evtl. erhöhten Serumspiegel, – Hautausschlag, in Einzelfällen wurde das Auftreten des Lyell-Syndroms beobachtet. – Selten kommt es zu Halluzinationen, Schwindel, Kopfschmerzen und Müdigkeit. In Einzelfällen sind allergische Reaktionen sowie Krämpfe beobachtet worden. Meistens treten die Störungen in den ersten 2 bis 3 Therapiewochen auf. Allergie gegen Flucytosin. Die Nebenwirkungen können bei einer Kombinationstherapie mit Amphotericin B und anderen potentiell nephrotoxischen Substanzen häufiger auftreten. Es kann dementsprechend zu erhöhten Wirkstoffspiegeln von Flucytosin im Serum kommen, wenn die Dosis nicht der reduzierten Nierenfunktion angepaßt wird. Verwendung bei Schwangerschaft und Laktation: Ein genotoxisches Potential von Flucytosin ist nicht auszuschließen. Flucytosin ist im Tierversuch teratogen. Über die Teratogenität von Flucytosin beim Menschen liegen bisher keine ausreichenden Daten vor. Auswirkungen auf Kraftfahrer und die Bedienung von Maschinen: Bei systemischer Anwendung von Flucytosin sind Beeinträchtigungen der Fahrtüchtigkeit und der Fähigkeit zur Bedienung von Maschinen möglich, wegen der in der Regel stationären Therapie jedoch meist irrelevant. 4. Anwendungsgebiete Generalisierte Candidose, Chromoblastomykose, Kryptokokkose. 5. Gegenanzeigen Angaben über die Plazentagängigkeit und Konzentrationen in der Muttermilch liegen ebenfalls nicht vor. Flucytosin ist daher in der Frühschwangerschaft (1. Trimenon) kontraindiziert und sollte auch während des weiteren Verlaufs der Schwangerschaft nur bei vitalen Indikationen unter strengster Nutzen-RisikoAbwägung verordnet werden. Dies gilt auch für die Stillperiode. 6. Nebenwirkungen Mai 1998 Desweiteren wurde in Einzelfällen über myokardiale Toxizität und ventrikuläre Dysfunktion berichtet. Eine Agranulozytose wurde als schwere hämatologische Nebenwirkung in seltenen Fällen beschrieben. Bei Patienten, die mit Immunsuppressiva behandelt worden sind, kann eine irreversible Schädigung des Knochenmarks auftreten. Diese Patienten sollten daher besonders sorgfältig überwacht werden (s. auch ,,Besondere Hinweise‘‘ unter: 11. ,,Art und Dauer der Anwendung‘‘). Die Nebenwirkungen von Flucytosin betreffen hauptsächlich den Gastrointestinaltrakt, die Leber und das Knochenmark. Schwere Nebenwirkungen können bei erhöhten Serumkonzentrationen von Flucytosin auftreten (z. B. bei Niereninsuffizienz, wenn die Dosierung nicht der reduzierten Ausscheidungsfunktion der Niere angepaßt wird). Einzelfälle mit ulcerierender Colitis und Darmperforation sind bekannt. Ebenso wurde in Einzelfällen über Hepatomegalie und Leberzellnekrosen mit letalem Ausgang berichtet. 0126-t688 -- Ancotil -- a 7. Wechselwirkungen mit anderen Mitteln Die gleichzeitige Anwendung von Flucytosin mit nephrotoxischen Substanzen erfordert besonders sorgfältige Überwachung der Nierenfunktion. Medikamente, die die glomeruläre Filtration beeinträchtigen, verlängern die Halbwertszeit von Flucytosin. Eine Verkürzung der Halbwertszeit trat bei gleichzeitiger Gabe von Natriumhydrogencarbonat auf. Die antimykotische Wirkung von Flucytosin kann möglicherweise durch Cytarabin beeinträchtigt werden. Eine gleichzeitige Behandlung mit Flucytosin und Cytarabin kann jedoch unter mikrobiologischer Kontrolle für besondere Situationen in Betracht gezogen werden. Bei Patienten unter zytostatischer Therapie kann es zu einer Verstärkung von Leukopenie und Thrombopenie kommen. Einfluß auf Laboruntersuchungen: Flucytosin kann bei der Zwei-Schritt-Enzymbestimmung für Kreatinin zu falsch positiven Reaktionen führen und eine Azotämie anzeigen. Die Jaffe Reaktion wird durch Flucytosin nicht beeinflußt. 8. Warnhinweise Keine. 9. Wichtigste Inkompatibilitäten Die Ancotil, Infusionslösung darf mit anderen Medikamenten nicht gemischt werden. Infusionslösungen von Ancotil und Amphotericin B sind bei der Kombinationstherapie getrennt zu verabreichen. 10. Dosierung mit Einzel- und Tagesgaben Die intravenöse Dosierung beträgt bei Kindern und Erwachsenen 150 bis 200 mg pro kg Körpergewicht (KG) pro Tag in vier Einzelgaben. 1 ml Infusionslösung enthält 10 mg Flucytosin. Bei Früh- und Neugeborenen wird eine Tagesdosis von 60 bis 80 mg pro kg Körpergewicht in zwei Einzelgaben empfohlen. Eine niedrigere Dosierung (100 mg pro kg KG pro Tag) ist gewöhnlich ausreichend für die Behandlung der Harnwegs-Candidose und der Chromoblastomykose. Eine höhere Dosierung (200 mg pro kg KG pro Tag) wird für die Behandlung der Kryptokokkose und der septischen Candida-Infektion benötigt. Höhere Dosen als 200 mg pro kg KG und pro Tag (ausnahmsweise bis zu 300 mg pro kg KG pro Tag) können sich bei der Behandlung der Candida-Endocarditis als nötig erweisen. Bei Hämodialysepatienten mit Anurie oder Nephrektomie darf die initiale Einzeldosis von 50 mg pro kg KG unter keinen Umständen wiederholt werden, bevor die nächste Dialyse stattgefunden hat. Als Faustregel gilt: Im Anschluß an jede Dialyse werden erneut 50 mg pro kg KG verabreicht, da die Summe der Wirkstoffmengen, die durch die Dialyse und extrarenale Mechanismen eliminiert werden, etwa der vorher gegebenen Einzeldosis entspricht. Dosierung in Kombination mit Amphotericin B: Untersuchungen in vitro und an experimentell infizierten Tieren beweisen bei gleichzeitiger Gabe von Ancotil und Amphotericin B eine gegenseitige Wirkungsverstärkung. Klinische Resultate bestätigen diese Befunde. Durch die automatische Kochsalzzufuhr bei i.v. Anwendung von Ancotil in Kombination mit Amphotericin B gelingt es, die Nierenverträglichkeit von Amphotericin B entscheidend zu verbessern. Für die Kombinationstherapie werden folgende Tagesdosen empfohlen: 150 mg Ancotil plus 0,3 mg Amphotericin B pro kg KG. 1 Fachinformation Ancotily Zu beachten: – Ancotil wird vom ersten Tag an in voller Dosierung (150 mg/kg KG/Tag) gegeben. – Amphotericin B muß initial einschleichend dosiert werden, 1. Tag 0,1 mg pro kg KG, 2. Tag 0,2 mg pro kg KG, 3. Tag 0,3 mg pro kg KG. – Die Erhaltungsdosis von 0,3 mg Amphotericin B pro kg KG pro Tag ist kleiner als bei der Monotherapie mit diesem Medikament. – In der Kombination mit Amphotericin B ist eine besonders sorgfältige Überwachung der Nierenfunktion nötig. 11. Art und Dauer der Anwendung Die Anwendung erfolgt als Kurzzeitinfusion (20 bis 40 Minuten Einlaufzeit für 250 ml), bei normaler Nierenfunktion im Abstand von 6 Stunden. Die intravenös anwendbare Lösung von Flucytosin kann auch intrathekal und intraartikulär appliziert werden. Eine intrakavitäre Anwendung oder Verwendung der Infusionslösung zu Inhalationszwecken ist ebenfalls möglich, jedoch nur bei gleichzeitiger intravenöser Behandlung, da sonst ausreichende Wirkstoffspiegel nicht gewährleistet sind. Eine Verlängerung des Dosierungsintervalls muß bei einer Kreatinin-Clearance von 40 ml/min und weniger erfolgen. Bei einer Kreatinin-Clearance von 40 bis 20 ml/min sollte das Dosierungsintervall 12 Stunden betragen, bei 20 bis 10 ml/min 24 Stunden. Beträgt die Kreatinin-Clearance weniger als 10 ml/min, muß 12 Stunden nach der ersten Dosis eine Bestimmung des Serumspiegels vorgenommen werden. Die weitere Gabe sollte so erfolgen, daß die Serumkonzentrationen von Flucytosin zwischen 25 bis 40 µg/ml liegen. Dosisreduktion entsprechend der Einschränkung der Nierenfunktion durchgeführt werden (siehe Punkte 10 und 11: ,,Dosierung‘‘ und ,,Art der Anwendung‘‘). Bei Neu- und Frühgeborenen kann der Natriumgehalt der Flucytosin-Infusionslösung (2 g Natrium/250 ml = 0,14 mval Na/ml) zu Hypernatriämie führen. 12. Notfallmaßnahmen, Symptome und Gegenmittel Symptome: Vergiftungsfälle mit Flucytosin sind bisher nicht bekannt. Ein spezifisches Antidot existiert nicht. Leichtere toxische Effekte wie Übelkeit, Erbrechen, Diarrhoe, Knochenmarkschädigung und Anstieg der Lebertransaminasen sind nach Absetzen der Therapie gewöhnlich voll reversibel. Therapie: Bei Überdosierung ist eine möglichst frühzeitige, forcierte Diurese angezeigt. Bei Peritonealdialyse wie bei Hämodialyse entspricht die Clearance etwa derjenigen von Kreatinin. Peritonealdialyse führt gegenüber Hämodialyse zu einer verzögerten Elimination von Flucytosin. 13. Pharmakologische und toxikologische Eigenschaften, Pharmakokinetik und Bioverfügbarkeit, soweit diese Angaben für die therapeutische Verwendung erforderlich sind 13.1 Pharmakologische Eigenschaften Flucytosin, ein Pyrimidinderivat, ist ein Antimykotikum, dessen fungistatische und fungi- zide (Hefen) Wirkungen auf Störungen der Protein- und DNS-Synthese zurückzuführen sind. Im Gegensatz zu Säugerzellen wird Flucytosin selektiv von Pilzen über die Cytosinpermease aufgenommen, desaminiert und als 5-Fluoruracil in die Zell-RNS eingebaut, wo es als ,,falsche Base‘‘ wirkt und eine fehlprogrammierte Proteinbiosynthese induziert. Außerdem kommt es zu einer Hemmung der DNS-Synthese, da 5-Fluoruracil die Thymidilat-Synthese blockiert. Flucytosin ist wirksam bei systemischen und lokalen Infektionen mit Hefen wie Candida, Torulopsis und Kryptokokkose sowie bei Chromomykose. Bei Aspergillen wirkt es ausschließlich fungistatisch. 13.2 Toxikologische Eigenschaften Akute Toxizität: LD50 in mg/kg Körpergewicht in Abhängigkeit von der Applikationsart: Maus: Y2000 per os Y2000 subkutan 1190 intraperitoneal Y 500 intravenös Ratten: Y8000 per os (erwachsen) Y 125 intraperitoneal Ratten: Y2000 per os (neugeboren) Y 250 intraperitoneal Chronische Toxizität: Orale Dosen von 100, 200 und 400 mg pro kg KG wurden während 13 Wochen täglich an Cebus-Affen verabreicht. Toxische Wirkungen traten dabei nicht in Erscheinung. Behandlungsdauer: Die Behandlungsdauer richtet sich nach der Mykoseform und deren therapeutischem Ansprechen. In der Regel genügen (2 bis) 3 bis 4 Wochen. Bei Monotherapie mit Flucytosin sollten 4 bis 6 Wochen möglichst nicht überschritten werden. Eine Ausnahme bildet die Chromomykose, bei der die FlucytosinMonotherapie meist 2 bis 4 Monate, manchmal noch länger, dauern muß. Besondere Vorsichtshinweise für den Gebrauch: Bei systemischen Pilzinfektionen soll eine Kombinationstherapie mit Amphotericin B durchgeführt werden. Sensibilitätsbestimmung vor Therapiebeginn und in regelmäßigen Abständen während der Behandlung werden empfohlen. Blutbild, Transaminasen, Cholestaseparameter und Nierenwerte (Harnstoff, KreatininClearance) müssen vor Beginn der Therapie bestimmt sowie in der 1. Woche täglich, später 2mal wöchentlich, kontrolliert werden. Patienten mit gestörter Leberfunktion können mit Flucytosin behandelt werden, bedürfen aber einer besonders sorgfältigen Überwachung. Bei Patienten unter zytostatischer oder immunsuppressiver Therapie müssen engere Kontrollen der Blutbildwerte erfolgen. Bei Patienten mit Niereninsuffizienz muß eine 2 Abbildung 1: Wirkungsmechanismus von Ancotil. 0126-t688 -- Ancotil -- a Fachinformation Ancotily Teratogene Wirkung: Flucytosin ist im Tierversuch teratogen. Für den Menschen liegen bisher keine ausreichenden diesbezüglichen Daten vor. Ein Umbau von Flucytosin zu 5-Fluoruracil durch die Darmflora ist möglich. Nebenwirkungen, entsprechend dem bekannten genotoxischen Potential von 5-Fluoruracil, sind daher nicht auszuschließen. Eliminationskonstante (K, h—1) Mai 1998 19. Name oder Firma und Anschrift des pharmazeutischen Unternehmers ICN Pharmaceuticals Germany GmbH Bolongarostraße 82 – 84 65929 Frankfurt Telefon: (0 69) 33 99 04-0 Telefax: (0 69) 33 99 04-99 13.3 Pharmakokinetik Verteilung: Die Verteilung von Ancotil im menschlichen Organismus erfolgt rasch und gleichmäßig. Die Proteinbindung beträgt 5 %. Der Steady-state-Serumspiegel sollte durchschnittlich bei 35 bis 70 µg/ml liegen. Maxima über 100 bis 120 µg/ml dürfen nicht überschritten und höchstens als kurze Konzentrationsspitzen erreicht werden, da sonst ein erhöhtes Risiko toxischer Wirkungen besteht. Werte unter 25 µg/ml sollen möglichst vermieden werden, damit eine optimale fungistatische und vor allem fungizide Wirkung erwartet werden darf. Unabhängig von meningealen Entzündungen beträgt die Flucytosinkonzentration im Liquor ca. 75 % des Serumwertes. Unter der Standarddosierung und bei normaler Nierenfunktion wird die optimale Wirkstoffkonzentration nach der zweiten bis dritten Applikation erreicht. Annähernd gleiche Konzentrationen wie im Serum sind auch in der Peritonealflüssigkeit bestimmt worden. 18. Stand der Information Abbildung 2: Beziehung zwischen der Eliminationskonstanten (K) von Ancotil und der endogenen Kreatinin-Clearance. Hinweis: Dieses Arzneimittel ist nach den gesetzlichen Übergangsvorschriften im Verkehr. Die behördliche Prüfung auf pharmazeutische Qualität, Wirksamkeit und Unbedenklichkeit ist noch nicht abgeschlossen. Ancotil ist nur gering an Serumproteine gebunden und deshalb sehr gut hämodialysierbar. Die Hämodialyse-Clearance entspricht derjenigen von Kreatinin und nimmt proportional zum Blutfluß durch den Dialysator zu. Normalerweise wird pro Hämodialyse praktisch die Gesamtmenge einer Einzeldosis eliminiert, so daß nach jeder Hämodialyse wieder eine volle Dosis von 50 mg/ kg KG appliziert werden muß. Die Peritonealdialyse ist weniger wirksam, obwohl auch hier die Elimination von Flucytosin der von Kreatinin entspricht. 13.4 Bioverfügbarkeit Die Bioverfügbarkeit der Infusionslösung beträgt 100 %. 14. Sonstige Hinweise Keine. Im Bronchialsekret von Hunden wurden ebenso hohe Konzentrationen wie im Serum gemessen. In der Synovialflüssigkeit des Knies und im Kammerwasser des Auges betragen die Konzentrationen nur ein Drittel bzw. ein Fünftel der gleichzeitigen Serumspiegel. Die Konzentrationen von Ancotil im Urin sind bis zu 100mal höher als im Serum. Metabolisierung: Ancotil wird vom Menschen praktisch nicht metabolisiert. Im Serum von Patienten wird nur unverändertes Flucytosin gefunden. Auch im Urin, mit dem über 90 % des unveränderten Wirkstoffes ausgeschieden werden, befinden sich höchstens 1,1 % Metaboliten. Mai 1998 Elimination: Die Ausscheidung erfolgt nahezu vollständig über die Nieren. Die Plasmahalbwertszeit bei Gesunden liegt zwischen 3 bis 6 Stunden. Bei Niereninsuffizienz ist die Halbwertszeit auf 30 bis 250 Stunden verlängert. Zwischen der Eliminationskonstanten von Ancotil und der endogenen Kreatinin-Clearance besteht eine lineare Beziehung. 0126-t688 -- Ancotil -- a 15. Dauer der Haltbarkeit 2 Jahre Eine Teilentnahme aus den Infusionsflaschen ist möglich, der Rest muß nach spätestens 24 Stunden aufgebraucht werden. Nach Ablauf des auf der Packung angegebenen Verfallsdatums soll das Präparat nicht mehr angewendet werden. 16. Besondere Lagerund Aufbewahrungshinweise Flucytosin ist bei Temperaturen von +18 tC bis +25 tC stabil. Wird es bei höheren Temperaturen gelagert, findet zum Teil ein Umbau zu 5-Fluoruracil statt (nicht sichtbar). Aufbewahrung unter +18 tC kann Ausfällungen zur Folge haben. Diese können durch Erwärmung bis zu 3 Stunden auf maximal +60 tC unter mehrmaligem kräftigem Schütteln wieder in Lösung gebracht werden. Die Qualität von Ancotil wird dadurch nicht beeinflußt. 17. Darreichungsform und Packungsgröße Infusionslösung 1 % (nur für Krankenhausbedarf): 5 Flaschen zu 250 ml Zentrale Anforderung an: Bundesverband der Pharmazeutischen Industrie e. V. FachInfo-Service Postfach 12 55 88322 Aulendorf 3