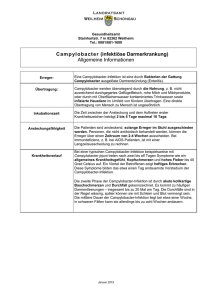
192 Infektionen durch Campylobacter und verwandte
Werbung
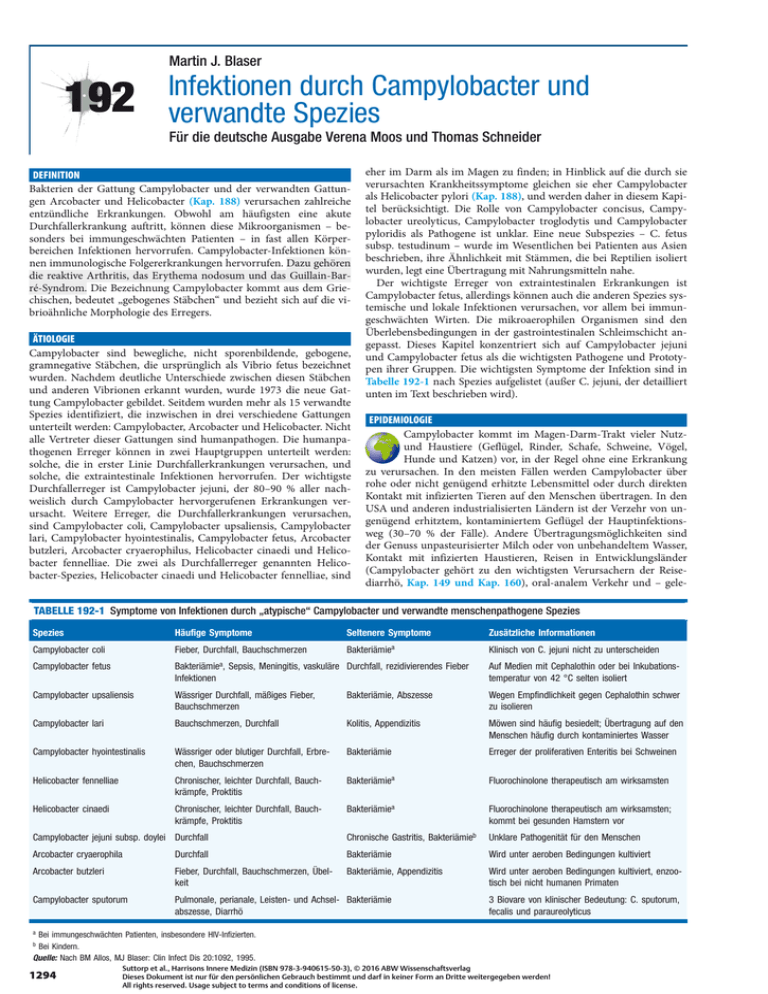
Martin J. Blaser 192 Infektionen durch Campylobacter und verwandte Spezies Für die deutsche Ausgabe Verena Moos und Thomas Schneider DEFINITION Bakterien der Gattung Campylobacter und der verwandten Gattungen Arcobacter und Helicobacter (Kap. 188) verursachen zahlreiche entzündliche Erkrankungen. Obwohl am häufigsten eine akute Durchfallerkrankung auftritt, können diese Mikroorganismen – besonders bei immungeschwächten Patienten – in fast allen Körperbereichen Infektionen hervorrufen. Campylobacter-Infektionen können immunologische Folgererkrankungen hervorrufen. Dazu gehören die reaktive Arthritis, das Erythema nodosum und das Guillain-Barré-Syndrom. Die Bezeichnung Campylobacter kommt aus dem Griechischen, bedeutet „gebogenes Stäbchen“ und bezieht sich auf die vibrioähnliche Morphologie des Erregers. ÄTIOLOGIE Campylobacter sind bewegliche, nicht sporenbildende, gebogene, gramnegative Stäbchen, die ursprünglich als Vibrio fetus bezeichnet wurden. Nachdem deutliche Unterschiede zwischen diesen Stäbchen und anderen Vibrionen erkannt wurden, wurde 1973 die neue Gattung Campylobacter gebildet. Seitdem wurden mehr als 15 verwandte Spezies identifiziert, die inzwischen in drei verschiedene Gattungen unterteilt werden: Campylobacter, Arcobacter und Helicobacter. Nicht alle Vertreter dieser Gattungen sind humanpathogen. Die humanpathogenen Erreger können in zwei Hauptgruppen unterteilt werden: solche, die in erster Linie Durchfallerkrankungen verursachen, und solche, die extraintestinale Infektionen hervorrufen. Der wichtigste Durchfallerreger ist Campylobacter jejuni, der 80–90 % aller nachweislich durch Campylobacter hervorgerufenen Erkrankungen verursacht. Weitere Erreger, die Durchfallerkrankungen verursachen, sind Campylobacter coli, Campylobacter upsaliensis, Campylobacter lari, Campylobacter hyointestinalis, Campylobacter fetus, Arcobacter butzleri, Arcobacter cryaerophilus, Helicobacter cinaedi und Helicobacter fennelliae. Die zwei als Durchfallerreger genannten Helicobacter-Spezies, Helicobacter cinaedi und Helicobacter fennelliae, sind eher im Darm als im Magen zu finden; in Hinblick auf die durch sie verursachten Krankheitssymptome gleichen sie eher Campylobacter als Helicobacter pylori (Kap. 188), und werden daher in diesem Kapitel berücksichtigt. Die Rolle von Campylobacter concisus, Campylobacter ureolyticus, Campylobacter troglodytis und Campylobacter pyloridis als Pathogene ist unklar. Eine neue Subspezies – C. fetus subsp. testudinum – wurde im Wesentlichen bei Patienten aus Asien beschrieben, ihre Ähnlichkeit mit Stämmen, die bei Reptilien isoliert wurden, legt eine Übertragung mit Nahrungsmitteln nahe. Der wichtigste Erreger von extraintestinalen Erkrankungen ist Campylobacter fetus, allerdings können auch die anderen Spezies systemische und lokale Infektionen verursachen, vor allem bei immungeschwächten Wirten. Die mikroaerophilen Organismen sind den Überlebensbedingungen in der gastrointestinalen Schleimschicht angepasst. Dieses Kapitel konzentriert sich auf Campylobacter jejuni und Campylobacter fetus als die wichtigsten Pathogene und Prototypen ihrer Gruppen. Die wichtigsten Symptome der Infektion sind in Tabelle 192-1 nach Spezies aufgelistet (außer C. jejuni, der detailliert unten im Text beschrieben wird). EPIDEMIOLOGIE Campylobacter kommt im Magen-Darm-Trakt vieler Nutzund Haustiere (Geflügel, Rinder, Schafe, Schweine, Vögel, Hunde und Katzen) vor, in der Regel ohne eine Erkrankung zu verursachen. In den meisten Fällen werden Campylobacter über rohe oder nicht genügend erhitzte Lebensmittel oder durch direkten Kontakt mit infizierten Tieren auf den Menschen übertragen. In den USA und anderen industrialisierten Ländern ist der Verzehr von ungenügend erhitztem, kontaminiertem Geflügel der Hauptinfektionsweg (30–70 % der Fälle). Andere Übertragungsmöglichkeiten sind der Genuss unpasteurisierter Milch oder von unbehandeltem Wasser, Kontakt mit infizierten Haustieren, Reisen in Entwicklungsländer (Campylobacter gehört zu den wichtigsten Verursachern der Reisediarrhö, Kap. 149 und Kap. 160), oral-analem Verkehr und – gele- TABELLE 192-1 Symptome von Infektionen durch „atypische“ Campylobacter und verwandte menschenpathogene Spezies Spezies Häufige Symptome Seltenere Symptome Bakteriämiea Zusätzliche Informationen Campylobacter coli Fieber, Durchfall, Bauchschmerzen Campylobacter fetus Bakteriämiea, Sepsis, Meningitis, vaskuläre Durchfall, rezidivierendes Fieber Infektionen Auf Medien mit Cephalothin oder bei Inkubationstemperatur von 42 °C selten isoliert Campylobacter upsaliensis Wässriger Durchfall, mäßiges Fieber, Bauchschmerzen Bakteriämie, Abszesse Wegen Empfindlichkeit gegen Cephalothin schwer zu isolieren Campylobacter lari Bauchschmerzen, Durchfall Kolitis, Appendizitis Möwen sind häufig besiedelt; Übertragung auf den Menschen häufig durch kontaminiertes Wasser Campylobacter hyointestinalis Wässriger oder blutiger Durchfall, Erbrechen, Bauchschmerzen Bakteriämie Erreger der proliferativen Enteritis bei Schweinen Helicobacter fennelliae Chronischer, leichter Durchfall, Bauchkrämpfe, Proktitis Bakteriämiea Fluorochinolone therapeutisch am wirksamsten Helicobacter cinaedi Chronischer, leichter Durchfall, Bauchkrämpfe, Proktitis Bakteriämiea Fluorochinolone therapeutisch am wirksamsten; kommt bei gesunden Hamstern vor Klinisch von C. jejuni nicht zu unterscheiden Campylobacter jejuni subsp. doylei Durchfall Chronische Gastritis, Bakteriämieb Unklare Pathogenität für den Menschen Arcobacter cryaerophila Durchfall Bakteriämie Wird unter aeroben Bedingungen kultiviert Arcobacter butzleri Fieber, Durchfall, Bauchschmerzen, Übelkeit Bakteriämie, Appendizitis Wird unter aeroben Bedingungen kultiviert, enzootisch bei nicht humanen Primaten Campylobacter sputorum Pulmonale, perianale, Leisten- und Achsel- Bakteriämie abszesse, Diarrhö 3 Biovare von klinischer Bedeutung: C. sputorum, fecalis und paraureolyticus a Bei immungeschwächten Patienten, insbesondere HIV-Infizierten. Bei Kindern. Quelle: Nach BM Allos, MJ Blaser: Clin Infect Dis 20:1092, 1995. b 1294 Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license. Infektionen durch Campylobacter und verwandte Spezies gentlich – der Kontakt mit einem stuhlinkontinenten, infizierten Patienten (z. B. Säuglinge). Infektionen durch Campylobacter sind häufig. Mehrere Studien haben gezeigt, dass in den USA durch Campylobacter verursachte Durchfälle häufiger sind als Salmonellen- und Shigellenenteritiden zusammen. Infektionen treten das ganze Jahr über auf, mit Inzidenzgipfeln im Sommer und Frühherbst. Die Erkrankung betrifft alle Altersgruppen; allerdings ist die Erkrankungsrate durch C. jejuni bei Kleinkindern und jungen Erwachsenen am höchsten, während Infektionen durch C. fetus hauptsächlich Säuglinge und Greise betreffen. Durch C. fetus, andere Campylobacter oder verwandte Spezies verursachte systemische Infektionen kommen überwiegend bei immungeschwächten Patienten vor. Ein erhöhtes Risiko haben Patienten mit AIDS, Hypogammaglobulinämie, Neoplasien, Lebererkrankungen, Diabetes mellitus und generalisierter Arteriosklerose sowie Neugeborene und Schwangere. Allerdings können bisweilen auch gesund erscheinende, nicht schwangere Personen mit Gastroenteritis eine transiente Campylobacter-Bakteriämie entwickeln. In Entwicklungsländern sind Infektionen durch C. jejuni hyperendemisch, wobei die Rate bei Kindern unter 2 Jahren am höchsten ist. Die Infektionshäufigkeit (und die Wahrscheinlichkeit einer Erkrankung bei Infektion) nimmt mit dem Alter ab. Diese Beobachtungen lassen vermuten, dass häufige Exposition gegenüber C. jejuni zur Entwicklung einer Immunität führt. Campylobacter-Infektionen nehmen in Deutschland weiterhin zu und stehen laut Erhebungen des Robert Koch-Instituts (www.rki.de) inzwischen vor der Salmonellenenteritis auf Platz 1 aller gemeldeten bakteriellen Darminfektionen. 2014 wurden 70.972 an das RKI gemeldete Fälle registriert. PATHOLOGIE UND PATHOGENESE Viele C.-jejuni-Infektionen verlaufen – besonders bei Wirten, die mehrere vorangegangene Infektionen mit Campylobacter hatten und dadurch eine partielle Immunität haben – subklinisch. Symptomatische Infektionen treten 2–4 Tage (Variationsbreite 1–7 Tage) nach oraler Aufnahme der Erreger auf. Gewebeschäden treten in Jejunum, Ileum und/oder Kolon auf. In Biopsien zeigen sich eine akute, unspezifische, entzündliche Reaktion mit Neutrophilen, Monozyten und Eosinophilen in der Lamina propria sowie eine Epithelschädigung mit Erschöpfung der Schleimreserven, Degeneration von Drüsen und Kryptenabszessen. Die Biopsiebefunde können mit einer Crohn-Krankheit oder Colitis ulcerosa vereinbar sein. Allerdings sollten diese „idiopathischen“ chronisch entzündlichen Darmerkrankungen erst diagnostiziert werden, wenn eine infektiöse Kolitis – insbesondere durch Campylobacter – ausgeschlossen wurde. Die Häufigkeit, der Schweregrad und die zahlreichen Rezidive von C.-jejuni-Infektionen bei Patienten mit Hypogammaglobulinämie deuten darauf hin, dass Antikörper für eine protektive Immunität wichtig sind. Die Pathogenese der Infektion ist unklar. Während Beweglichkeit und die Fähigkeit zur Adhärenz an Wirtsgewebe für die Krankheitsentstehung wichtig zu sein scheinen, spielen klassische Enterotoxine und Zytotoxine offenbar keine wesentliche Rolle bei der Gewebeschädigung oder der Entwicklung von Symptomen, obwohl sie beschrieben wurden, darunter auch CDT (cytolethal distending toxin). Zahlreiche Beobachtungen sprechen dafür, dass die Gewebeinvasion durch den Erreger von klinischer Bedeutung ist. Dazu gehören der intraepitheliale Nachweis von C. jejuni (wenn auch in geringer Zahl), eine deutliche Gewebereaktion und gelegentlich auftretende Bakteriämien. Die Pathogenese von C. fetus ist besser verstanden. Nahezu alle klinischen Isolate besitzen eine kapselartige Struktur aus Proteinen (SLayer), die dem Erreger Widerstandsfähigkeit gegen komplementvermitteltes Opsonieren und Abtöten verleiht und die Entstehung einer Bakteriämie mit Streuung der Erreger außerhalb des Darms begünstigt. Die Fähigkeit der Bakterien, das Expressionsmuster der S-LayerProteine (und damit die Antigenität) zu variieren, könnte zum chronischen Verlauf und zu den häufigen Rezidiven von C.-fetus-Infektionen bei abwehrgeschwächten Patienten beitragen. KLINISCHES BILD Die Symptome von Infektionen durch die verschiedenen Campylobacter spp. und die verwandten Arcobacter spp. sowie die Helicobacter spp., die Durchfallerkrankungen verursachen, scheinen sehr ähnlich zu sein. C. jejuni kann dabei als Prototyp angesehen werden, nicht zuletzt, weil er der häufigste darmpathogene Keim dieser Gruppe ist. Häufig treten Prodromi (Fieber, Kopf- und Gliederschmerzen und/oder 192 Unwohlsein) auf, die 12–48 Stunden später von intestinalen Symptomen abgelöst werden. In dieser Phase treten gewöhnlich Durchfall, Bauchschmerzen und Fieber auf. Der Schweregrad des Durchfalls reicht von wenigen flüssigen Stühlen bis zur ausgeprägten blutigen Diarrhö. Die meisten Patienten, die sich bei einem Arzt vorstellen, haben auf dem Höhepunkt der Erkrankung mindestens zehnmal am Tag Stuhlgang. Die Bauchschmerzen sind in der Regel krampfartig und können das Hauptsymptom sein. Üblicherweise sind diese Schmerzen diffus, können aber auch örtlich begrenzt sein. So können sich Infektionen durch C. jejuni als Pseudoappendizitis manifestieren. Wenn Fieber das einzige Symptom ist, kann die Frühphase einer C.-jejuni-Infektion auch einem beginnenden Typhus ähneln. Bei Kleinkindern mit Fieber können Krampfanfälle auftreten. Eine Campylobacter-Enteritis verläuft normalerweise selbstlimitierend. Bei 10–20 % der Patienten, die einen Arzt konsultieren, halten die Beschwerden länger als eine Woche an und bei 5–10 % der unbehandelten Patienten treten Rückfälle auf. Studien an Epidemien mit ambulanten Quellen zeigen, dass oft leichtere Krankheiten oder asymptomatische Infektionen auftreten. C. fetus kann (besonders bei anderweitig Gesunden) Durchfallerkrankungen hervorrufen, die ähnlich verlaufen, wie oben für C. jejuni beschrieben. Auch eine intermittierende Diarrhö oder unspezifische, diffuse Bauchschmerzen können auftreten. Folgekrankheiten sind selten und die Prognose ist gut. C. fetus kann eine langwierige, rezidivierende systemische Erkrankung mit Fieber, Schüttelfrost und Gliederschmerzen ohne offensichtlichen Infektionsherd hervorrufen. Dieses Krankheitsbild tritt besonders häufig bei abwehrgeschwächten Patienten auf. Als potenziell schwerwiegende Komplikationen können sekundäre endogene Infektionen (z. B. von Meningen, Gehirn, Knochen, Harnwegen oder Weichteilen) auftreten. C. fetus hat eine Affinität zu Gefäßen, daher können sich Infektionen auch als Endokarditiden, mykotische Aneurysmen und septische Thrombophlebitiden manifestieren. Eine Infektion während der Schwangerschaft führt häufig zum Tod des Fötus. Mehrere Campylobacter-Spezies und Helicobacter cinaedi verursachen bei immungeschwächten Patienten rezidivierende Infektionen des Unterhautfettgewebes mit Fieber und Bakteriämie. KOMPLIKATIONEN Außer bei Infektionen durch C. fetus kommt eine Bakteriämie selten vor. Betroffen sind meist immungeschwächte, sehr alte oder sehr junge Patienten. Drei Formen extraintestinaler Infektion sind bekannt: (1) vorübergehende Bakteriämien bei Patienten mit Enteritis, die anderweitig gesund sind (gutartiger Verlauf, keine spezifische Behandlung erforderlich); (2) anhaltende Bakteriämien oder fokale Infektionen ohne andere Erkrankungen (Enteritis als Ursache der Bakteriämie, gutes Ansprechen auf Antibiotika) und (3) anhaltende Bakteriämien oder fokale Infektionen bei abwehrgeschwächten Patienten. Symptome einer Enteritis müssen dabei nicht vorliegen. Eine antibiotische Behandlung – wahrscheinlich über längere Zeit – ist für die Unterdrückung oder Heilung der Infektion notwendig. Infektionen durch Campylobacter, Arcobacter oder intestinale Helicobacter können bei Patienten mit AIDS oder Hypogammaglobulinämie einen schweren, protrahierten Verlauf haben und sich außerhalb des Darms abspielen. Rückfälle nach Beendigung der Behandlung sind häufig. Patienten mit Hypogammaglobulinämie können auch Osteomyelitiden und erysipelartige Hautveränderungen oder Entzündungen des subkutanen Bindegewebes entwickeln. Zu den lokalen, eitrigen Komplikationen der Infektion gehören Cholezystitiden, Pankreatitiden und Zystitiden. Durch Streuung des Erregers kann es zu einer Meningitis, Endokarditis, Arthritis, Peritonitis, Entzündung des subkutanen Bindegewebes und zum septischen Abort kommen. Allerdings sind diese Komplikationen bei immunkompetenten Patienten selten. Gelegentlich werden akute Infektionen auch durch eine Hepatitis, interstitielle Nephritis oder das hämolytisch-urämische Syndrom kompliziert. Besonders bei HLA-B27-positiven Personen können mehrere Wochen nach der Infektion reaktive Arthritiden und andere rheumatologische Beschwerden auftreten. Ein Erythema nodosum wird ebenfalls häufig gesehen. Nur selten entstehen nach einer Campylobacter-Infektion ein Guillain-Barré-Syndrom oder seine Varianten, das Miller-Fisher-Syndrom bzw. die kraniale (Poly-)Neuropathie, und zwar in 1 von 1000–2000 Erkrankungsfällen bzw. bei bestimmten Serotypen von C. jejuni (z. B. O19) in 1 von 100–200 Fällen. Trotz der Seltenheit dieser Komplikation geht man aufgrund der hohen Inzidenz von Campylobacter-Infektionen davon aus, dass möglicherweise 20–40 % aller Guillain-Barré-Fälle durch Campylobacter aus- Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license. 1295 Teil 8 Infektionskrankheiten gelöst werden. Das Vorhandensein von an Sialinsäure gekoppelten Lipopolysacchariden bei C.-jejuni-Stämmen stellt eine Art molekularer Mimikry dar, die zur Erkennung sialinisierter Zelloberflächenmoleküle auf Axonen im Sinne einer autoimmunologischen Reaktion führt. Auch asymptomatische Campylobacter-Infektionen können dieses Syndrom auslösen. Die immunoproliferativen Dünndarmerkrankungen (Alpha-Ketten-Krankheit), eine lymphoproliferative Erkrankung die vom Mukosa-assoziierten lymphatischen Gewebe abstammt, wurde mit Campylobacter-Infektionen in Zusammenhang gebracht. Unter antibiotischer Therapie kam es dabei zu einer klinischen Besserung. DIAGNOSTIK Bei Patienten mit Campylobacter-Enteritis spiegelt die Leukozytenzahl im peripheren Blut die Schwere des Entzündungsprozesses wider. Leukozyten und Erythrozyten finden sich in nahezu allen Stuhlproben von Patienten mit einer Campylobacter-Infektion, die sich in den USA bei einem Arzt vorstellen. Nach Gram oder Giemsa gefärbte Stuhlausstriche sollten bei jedem Verdachtsfall untersucht werden. Im gramgefärbten Stuhlpräparat kann man die charakteristische vibrioartige Morphologie erkennen, während sich im Phasenkontrast- oder Dunkelfeldmikroskop die typische spiralenartige Beweglichkeit der Erreger beobachten lässt. Die Diagnose einer Campylobacter-Infektion wird durch die Isolierung des Erregers aus Stuhl-, Blut- oder anderen Kulturen bestätigt. Für Stuhlkulturen von Patienten mit entzündlichem oder blutigem Durchfall sollten immer auch für Campylobacter spezifische Medien verwendet werden, da die schwierig zu kultivierenden Erreger sonst nicht identifiziert werden. Nicht alle selektiven Medien sind in gleicher Weise für alle Campylobacter-Stämme verwendbar. Der fehlende Nachweis von Campylobacter im Stuhl schließt nicht aus, dass Erreger vorhanden sind. Zur Erleichterung der exakten Diagnose wurden speziesspezifische PCR-Tests entwickelt. Der Nachweis von Erregern im Stuhl ist fast immer gleichbedeutend mit einer Infektion. Nur in einem kurzen Zeitraum nach Genesung gibt es eine Phase asymptomatischer Keimausscheidung. Eine Dauerbesiedlung des Darms kommt beim Menschen nicht vor. C. sputorum und verwandte Organismen, die in der Mundhöhle vorkommen, sind Kommensalen ohne wesentliche pathogene Bedeutung. Aufgrund der geringen Stoffwechselaktivität in üblichen Blutkulturen können Campylobacter-Bakteriämien einem Nachweis entgehen. Daher sollten auch schwach positive Ergebnisse durch quantitative Analysemethoden vom Labor erfasst werden. DIFFERENZIALDIAGNOSTIK Klinisch lässt sich eine Campylobacter-Enteritis nicht sicher von Infektionen durch Salmonella, Shigella, Yersinia und anderen Enteropathogenen abgrenzen. Fieber und der Nachweis von Leukozyten und Erythrozyten im Stuhl weisen auf eine entzündliche Diarrhö hin; die endgültige Diagnose wird anhand des Kulturergebnisses (oder des mikroskopischen Nachweises) gestellt. In ähnlicher Weise werden auch extraintestinale Infektionen durch Kultur entsprechender Proben diagnostiziert. Im Zusammenhang mit septischen Aborten sollte an eine Campylobacter-Infektion gedacht werden, bei einer septischen Thrombophlebitis kommt speziell C. fetus infrage. Es muss nochmals betont werden, dass (1) das klinische Bild einer Campylobacter-Enteritis dem einer Colitis ulcerosa oder einer Crohn-Krankheit zum Verwechseln ähnlich sein kann, (2) die Campylobacter-Enteritis weitaus häufiger ist als die beiden genannten Krankheiten (besonders bei jungen Erwachsenen) und (3) histologisch nicht immer zwischen einer infektiösen und einer nicht infektiösen entzündlichen Darmerkrankung unterschieden werden kann. Daher sollte eine chronisch entzündliche Darmerkrankung erst diagnostiziert werden, nachdem eine Infektion durch Campylobacter ausgeschlossen wurde, und insbesondere, wenn sich anamnestisch Hinweise für Auslandsaufenthalte, Kontakt mit Tieren, Immunschwäche oder mit hohem Übertragungsrisiko einhergehendes Verhalten ergeben. BEHANDLUNG: INFEKTIONEN DURCH CAMPYLOBACTER UND VERWANDTE SPEZIES Das Wichtigste bei der Therapie von Durchfallerkrankungen ist die Substitution von Flüssigkeit und Elektrolyten (Kap. 160). Eine Campylobacter-Enteritis sollte nur in ganz seltenen Ausnahmefällen (z. B. schwere Begleiterkrankung, chronisch entzündliche Darmerkrankung) antibiotisch behandelt werden. Eine derartige Therapie kann 1296 bei Immungeschwächten, bei hohem Fieber, blutigen Durchfällen, schwerer Diarrhö, einer Erkrankungsdauer von mehr als einer Woche und einer zunehmenden Verschlimmerung der Symptome angezeigt sein. Mittel der Wahl ist Erythromycin für 5–7 (4 × 250 mg/d p.o.; Kinder 30–50 mg/kg/d, verteilt auf mehrere Gaben). Klinische Studien und In-vitro-Antibiogramme deuten darauf hin, dass auch andere Makrolide, wie Azithromycin (über 1–3 Tage), therapeutisch wirksam sind. Eine Alternative bei Erwachsenen bildet Ciprofloxacin (2 × 500 mg/d) oder ein anderes Fluorchinolon über 5–7 Tage, aber Resistenzen gegen diese Antibiotikaklasse sind häufig, ebenso wie gegen Tetrazykline: In den USA waren im Jahr 2010 etwa 22 % der Isolate resistent gegen Ciprofloxacin. Da eine Makrolidresistenz normalerweise deutlich seltener vorkommt, (< 10 %), stellen diese Substanzen bei empirischer Therapie die Medikamente der Wahl dar. In Europa liegt die Resistenzrate gegen Ciprofloxacin derzeit bei etwa 60 %. Deshalb sollten Ciprofloxacin oder andere Fluorchinolone in Deutschland nicht zur Behandlung verwendet werden. Dies gilt zunehmend auch für Tetrazykline. Patienten, die mit einem antibiotikaresistenten Stamm infiziert sind, haben ein höheres Risiko für einen ungünstigen Krankheitsverlauf. Die Anwendung von Medikamenten zur Hemmung der Darmmotilität wird nicht empfohlen, da die Erkrankungsdauer verlängert werden kann und ein möglicher Zusammenhang mit dem toxischen Megakolon und mit Todesfällen besteht. Ein Übertritt von enteritischen Campylobacter ins Blut wird nicht beobachtet. Systemische Infektionen mit Campylobacter spp. kommen in Deutschland bei Erwachsenen sehr selten vor. In diesen Fällen handelt es sich nicht um Camplyobacter jejuni oder coli. Bei systemischen Infektionen sollte bis zum Eintreffen des Antibiogramms eine empirische Behandlung mit Gentamicin (3 × 1,7 mg/kg/d i.v. nach einer initialen Gabe von 2 mg/kg), Imipenem (4 × 500 mg/d) oder Chloramphenicol (3–4 × 50 mg/kg/d i.v.) begonnen werden. Die Therapiedauer sollte für Patienten ohne Immundefekt oder endovaskuläre Infektion 14 Tage betragen. Immunsupprimierte Patienten mit systemischen C.-fetus-Infektionen oder Patienten mit endovaskulären Infektionen müssen in der Regel bis zu 4 Wochen lang antibiotisch behandelt werden. Rezidivierende Erkrankungen bei immunsupprimierten Patienten können manchmal eine lebenslange Therapie/Prophylaxe notwendig machen. PROGNOSE Nahezu alle Patienten mit Campylobacter-Infektionen mit Enteritis erholen sich vollständig von ihrer Krankheit – mit oder ohne antibiotische Behandlung. Die seltenen Todesfälle werden vermutlich durch eine ausgeprägte Hypovolämie mitbedingt. Gelegentlich treten als Folgekrankheiten eine reaktive Arthritis, ein Erythema nodosum oder ein GuillainBarré-Syndrom bzw. seine Varianten auf. Systemische Infektionen durch C. fetus enden häufiger tödlich als Erkrankungen durch die verwandten Erreger. Diese erhöhte Letalität ist zum Teil durch die betroffene Population bedingt. Die Prognose hängt davon ab, wie schnell die richtige Therapie eingeleitet wird. Patienten ohne andere Grundkrankheit überleben C.-fetus-Infektionen gewöhnlich ohne Folgen. Abwehrgeschwächte Patienten erleiden häufig rezidivierende und/oder lebensbedrohliche Infektionen mit unterschiedlichen Campylobacter spp. WEITERFÜHRENDE LITERATUR EPPS SV, HARVEY RB, HUME ME et al: Foodborne Campylobacter: infections, metabolism, pathogenesis and reservoirs. Int J Environ Res Public Health 10:6292–6304, 2013 GOLZ G, ROSNER B, HOFREUTER D et al: Relevance of Campylobacter to public health – the need for a One Health approach. Int J Med Microbiol 304:817–823, 2014 KAAKOUSH NO, CASTANO-RODRIGUEZ N, MITCHELL HM, MAN SM: Global epidemiology of Campylobacter infection. Clin Microbiol Rev 28:687–720, 2015 STINGL K, KNUVER MT, VOGT P et al: Quo vadis? – Monitoring Campylobacter in Germany. Eur J Microbiol Immunol (Bp) 2:88–96, 2012 WAGENAAR JA, VAN BERGEN MA, BLASER MJ, TAUXE RV, NEWELL DG, VAN PUTTEN JP: Campylobacter fetus infections in humans: exposure and disease. Clin Infect Dis 58:1579–1586, 2014 Suttorp et al., Harrisons Innere Medizin (ISBN 978-3-940615-50-3), © 2016 ABW Wissenschaftsverlag Dieses Dokument ist nur für den persönlichen Gebrauch bestimmt und darf in keiner Form an Dritte weitergegeben werden! All rights reserved. Usage subject to terms and conditions of license.