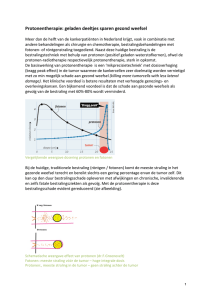
Samenvatting biologie van kanker – maart/april 2014
Werbung

Samenvatting biologie van kanker – maart/april 2014 – Manon Meerman Hoorcollege biologie van kanker – 17 maart 2014 – de Jonge Kanker: genetische ziekte; multi-step process genetische veranderingen laten transformatie van normale naar kankercellen steeds sneller verlopen. Hallmarks of Cancer (Weinberg): Cel gaat minder snel dood Kan zijn eigen groeisignaal genereren Kan ontsnappen aan groeionderdrukkende signalen Kan invaseren en metastaseren Kan oneindig doordelen Kan eigen vaatgroei (angiogenese) induceren: nodig bij groei boven 3-4 mm (zuurstof en voedingsstoffen). Daarnaast ook andere cellulaire energiehuishouding (minder glycolyse: minder ATP via mitochondriën), genomische instabiliteit/mutaties, tegengaan activatie IS, inductie eigen ontstekingsreactie (meer groeifactoren meer groei: tumor). Benigne tumor goedaardig; blijft bij elkaar in besloten omgeving. Maligne tumor kwaadaardig; groeit invasief in omringend weefsel (bijv. stroma). Verschillende kankers ontstaan uit verschillende weefsel-/celtypen: Carcinoom: epitheel Sarcoom: spier-/bindweefsel Leukemie: hematopoïetische systeem Glioma: hersencellen Melanoom: pigmentcellen huid Grootste groep is die van carcinomen 2 subtypes: adenocarcinomen (klieromringend epitheel) en squamous cel carcinomen (buitenkant ergens van, bijv. de huid). Afhankelijk v/h celtype zijn er andere subtypes. Melanomen uit pigmentcellen (huid): patiënt ontwikkelt donkere plekken/wildgroei op de huid met verdikkingen. Vaak 1 mutatie in RAF-eiwit gevoelig voor druk. Tumor krijgt wel nieuwe mutaties (slechte prognose). Meest voorkomende kankers zijn epitheliale tumoren v/d long, darm, borst, maag en baarmoderhals. Kanker ontstaat uit 1 abnormale cel. Eicel 2 X-chromosomen: op X zit een dehydrogenase-eiwit met 2 varianten, één minder hittestabiel dan de andere. De ene X wordt uitgeschakeld (random). In offspring zal een X van moeder en een X van vader actief zijn. Heterozygoot voor dehydrogenase-eiwit als mensen een tumor krijgen, welke variant tot expressie? Als één v/d allelen altijd verloren gaat, moet het een monoklonale tumor zijn. Testen op agarosegel altijd één v/d 2 varianten verloren: niet specifiek een bepaalde. Als een gedifferentieerde cel deelt en één X is uitgeschakeld, dan blijft dat zo. In die cel is somatische mutatie opgetreden in normale cellen, niet erfelijk. Betekent niet dat kanker niet erfelijk kan worden doorgegeven! Kan door chromosomale translocatie, carcinogene stoffen, straling, virussen. Twee gameten geven een zygote. Cellen differentiëren tot normale lichaamscellen. Mutatie in lichaamscel ander soort cellen groeit uit: wordt niet doorgegeven aan offspring! Mutaties in kiembaancellen (germ-line) geef je wel door: erfelijke mutatie. Kanker in kiembaancellen komt niet voor: lethaal. Mutatie die bijdraagt aan kanker wel. Translocatie chromosoom 9 en 22 9q+ en 22q-: Philadelphia-chromosoom (leukemie). Kanker ontstaat uit accumulaties van mutaties in de tijd. Spontane mutatiefrequentie (Goldie & Coldman) 1 mutatie in 1 gen in 105/106 celdelingen; hoeft nergens tot de leiden, maar er zijn veel delingen. Nu ook steeds meer jongere mensen met kanker. Baarmoederhalskanker ontwikkelt uit minder afwijkende cellen: ontwikkeling kent verschillende stadia. Laag gradige neoplasie: nog steeds normale cellen; verdikte wand (5-10% krijgt kanker). Hoog gradige neoplasie: alleen nog maar delende cellen (40-70% krijgt kanker). Ontwikkeling naar kanker kan wel 10 jaar duren. Darmkanker ontwikkelt uit poliepen (adenomen): Kankerstamcellen: lijken op stamcellen, maar niet helemaal hetzelfde. Normale stamcellen kunnen zichzelf vernieuwen mutaties: kankerstamcel. Transit amplifying cells kunnen door mutaties ook stamceleigenschappen krijgen. Kankerstamcellen zijn in kleine populatie v/d tumor te vinden. Versnelling kankerproces: Opeenvolgende cycli v mutaties/selecties Toegenomen genetische instabiliteit helpt afwijkende cel meer afwijking te verkrijgen; o Chromosomaal: te laten zien met kleuring; ieder chromosoom een andere kleur zijn chromosomen nog origineel of heeft er herschikking/crossing over/translocatie plaatsgevonden? o Epigenetisch: verandering van histonen (acetylatie/methylatie): genen kunnen niet meer afgelezen worden (geen genexpressie) of DNA-methylatie: geen aflezing v/d promotor meer. Minder celdood (apoptose/autofagie) en differentiatie gedifferentieerde cellen delen minder. Apoptose rol bij embryogenese en verwijderen oud epitheel/geactiveerde immuuncellen. Proces is verloren bij aantal kankers, sowieso minder bij afwijkende cellen. Verminderde autofagie speelt grote rol in celoverleving/celdood: insluiten v beschadigde cytoplasmatische organellen (bijv. mitochondriën) en eiwitaggregaten in autofagosoom fuseren met autolysosomen afbraak producten + transport naar cytosol voor hergebruik. Teveel autofagie leidt tot type II PCD. Apoptose is type I PCD. In kankercellen gaat van alles mis; krijgt nieuwe eigenschappen agressiever. Toegenomen proliferatie bijv. poliep: apoptose niet afgenomen, maar meer deling (inbalans). Normaliter: cellen delen, oude cellen in apoptose (homeostase). 2 mogelijkehden: o Toegenomen celdeling cellen delen in hoog tempo: relatief meer cellen. o Afgenomen apoptose niet alle oude cellen dood: meer cellen over. Vaak een combi van beide. Onafhankelijkheid v/d omgeving (metastase) vaatgroei nodig om tumor te verbinden met vaten, ook voor voedingsstoffen en afvoer afvalstoffen. Alleen zo kunnen ze metastaseren. Metastase zorgt voor slechte prognose van kankers (slechte behandeling). Geen random proces kankercellen hechten daar waar juiste voedingsstoffen zijn: bij borstkanker hebben kankercellen receptoren (CXCR4) die liganden (CXCL12) binden gemaakt op botcellen tumor metastaseert naar botcellen. Minder/niet naar andere weefsels. Nieuwe therapie: blokkeren ligand? Antagonist? Epidemiologie grote verschillen tussen landen: afhankelijk van omgevingsfactoren: Mutagene stoffen: rook, asbest. DNA-schade door straling: UV, radioactiviteit. Virussen: HPV en HIV. Ames test hoe mutageen is een stof? Mutageen ≠ carcinogeen! Mengen leverextract, (potentiaal) mutagene stof en histidine-afhankelijke Salmonella mengen: op bodem zonder histidine brengen als de stof mutageen is worden er kolonies gevormd: stof veroorzaakt mutaties in de bacterie waardoor ze niet meer histidine-afhankelijk zijn. Toename in aantal vrouwen dat sterft aan longkanker: afhankelijk van frequentie roken is incidentie hoger. Niet-rokers kunnen ook longkanker krijgen. Omgevingsfactoren belangrijk longkanker nam toe na WO II: meer rokende vrouwen. Lifestyle belangrijk: hoog in vet, laag in groenten, roken kunnen leiden tot kanker. Betrokken genen: Oncogenen 1 mutatie in één allel is genoeg: proto-oncogen oncogen. Aanwezigheid van Wt-gen maakt dan niet meer uit. “Gain of function”-mutatie: geeft een dominant groeistimulerend effect. Tumor suppressor genen beide allelen moeten gemuteerd worden: anders neemt Wt-allel de functie over. “Loss of function”-mutatie. Induceert erfelijke kanker. Identificatie kankergenen kippenonderzoek: Bij opnieuw inspuiten steeds snellere ontwikkeling van sarcomen. Virus was de oorzaak: transformeerde cellen door eigen virale genen (oncogenen) te integreren in het genoom: induceert kanker. Er zijn veel virussen bekend die kanker kunnen induceren! Meeste humane/dierlijke oncogenen zijn gemuteerde vormen van normale, cellulaire genen: v-onc virale oncogenen. c-onc cellulaire oncogenen: reguleren celgroei en celcyclus. Mutatie of overexpressie oncogen (bijv. Ras) verhoogde genactiviteit: proliferatie gaat door ondanks cel-cel contact. Virussen kunnen ook tumor suppressor genen onderdrukken, bijv. HPV-virus: Normale cel: controle op celdeling: 1) normale cellen hebben Rb op de transcriptiefactor geen eiwitafschrijving, 2) actief p53 als extra controle geen celproliferatie door aanmaak van p21 (blokker celdeling). HPV virusinfectie: bevat E6 en E7 eiwit: E7 bindt Rb de transcriptiefactor kan actief worden en eiwitten aanmaken belangrijk voor celdeling. E6 blokkeert p53: opnieuw geen goede blok op celproliferatie. Chemopreventie aspirine, celecoxib (adenomen). In een poliep worden COX-1 en -2 geïnduceerd, bij normale cellen alleen COX-1, bij een poliep ook COX-2. Aspirine is een COX-2 remmer en wordt dus ingezet als chemopreventief middel. Cel wordt langzamerhand iets afwijkend: produceert factoren die stromacellen aanzetten tot TNF-productie activatie signaaltransductieroutes in epitheelcellen: maken COX-2 verschillende effecten: Verlies contactinhibitie Ondergrond-onafhankelijke groei Verlies E-cadherine Snellere deling Tumorcellen gebruiken omgeving om factoren te krijgen die de cel nodig heeft. HPV-vaccin bevat antilichamen tegen de virussen. Langdurig gebruik van chemopreventie middelen effectiviteit vs. toxiciteit? Hoorcollege biologie van kanker – 18-03-2014 – Schuringa Hoofdstuk 4 Oncogen: gemuteerd gen dat bijdraagt aan kankerontwikkeling. Heten proto-oncogenen in normale, niet-gemuteerde staat. Spelen rol bij celdeling. TSG: genen die kankerontwikkeling kunnen blokkeren/onderdrukken. TSGs sturen productie v eiwitten die onderdeel uitmaken van een systeem dat celdeling reguleert; tumor suppressor eiwit houdt celdeling onder controle. Identificatie oncogenen experiment: Fibroblasten blootstellen aan carcinogenen: DNA extraheren transfectie m.b.v. calciumfosfaat precipitatie alle 20.000 genen onafhankelijk terugstoppen in normale fibroblasten: wat is de rol v/h gen? Niet alle gemuteerde genen veroorzaken kanker; degene die dat wel doen vertonen afwijkende groei in het schaaltje: daarna bestuderen gen in vivo en analyse v/d genen. Ook te doen met DNA v humane tumorcellen klomp fibroblasten (kanker groeigedrag). Daarna analyse v/h DNA in de afwijkende cellen. VB: erbB gen dat verschillende kankers (vooral borst) kan induceren: probleem bij borstkanker is amplificatie van erbB in de tumorcel; leidt tot slechte prognose. Analyse erbB-expressie: Blot expressie erbB van 4 borstkankerpatiënten: heel veel DNA, RNA en eiwit aanwezig v/h gen bij patiënt 1 Immunohistochemie donkere kleuring bij patiënt 1, dus veel eiwitexpressie in die cellen. FISH m.b.v. probes (groen voor erbB2) kun je zien hoeveel kopieën erbB2 er in de cel zitten: normaliter 2, nu meer (genduplicatie/-amplificatie). Kaplan-Meier plot: uitzetten grote groepen patiënten tegen diagnose. Patiënten zonder genamplificatie vs. patiënten met >5 kopieën laatste groep veel slechtere prognose: meer mensen ziek. Plot met alle chromosomen (x) vs. frequentie veranderde transcripten (y): duplicaties van veel verschillende chromosomen veroorzaken bijv. Wilms tumor ziekte door amplificatie van meerdere genen op verschillende chromosomen. Ewings sarcoma amplificatie op chromosoom 8: handig voor identificatie betrokken genen. N-myc: oncogen: patiënten met weinig kopieën myc vs. patiënten met >10 kopieën myc: laatste groep heeft slechtere diagnose en ernstiger ziekteverloop. myc veroorzaakt neuroblastoom. Tumor niet altijd door genduplicatie, ook bijv. door genmutaties, bijv. Ras-mutaties (blaaskanker). Ras belangrijk signaaltransductie-eiwit, vaak gemuteerd op positie 12 (glycine naar valine). Sowieso vaak gemuteerd, rol bij meerdere kankers. Klein GTPase eiwit in 2 mogelijke toestanden: GDP-gebonden (inactief) of GTP-gebonden (actief); wisselt hier steeds tussen. Mutatie op 12 zorgt ervoor dat Ras altijd actief is (GTPgebonden) continue signaaltransductie. Vroeger werden transfectie-experimenten gebruikt om te tracen welk deel van een eiwit gemuteerd is en als oncogen functioneert, nu wordt er gewoon gebruik gemaakt van sequencing welke mutaties en waar? Chromosomale translocaties: stukjes homoloog chromosoom wisselen uit. Bijv. Burkitts’ Lymphoma: 8q- en 14q+: myc komt in buurt van promoter die hard aan staat. myc-locus normaliter sterk gereguleerd: door translocatie komt voor myc een sterk actieve promoter veel myc-expressie. Komt veel voor in lymfoïde leukemieën. miRNAs komen eerst als pre miRNA tot expressie, maar worden geprocessed tot kleine stukjes miRNA; kunnen messenger v/e eiwitcoderend gen binden. Expressie van veel miRNAs binden uiteinde transcript: 1) instabiliteit RNA en 2) translatie verloopt inefficiënt. Bij sommige translocaties is de negatieve regulatoire bindingsite voor miRNAs afwezig en wordt er veel meer RNA gevormd. Translocatie kan ook leiden tot verandering in functie van genen: breekpunten v chromosomen midden in een gen: bijv. 9-22 op 9 zit abl en op 22 bcr. Breekpunt resulteert in fusie-eiwit Bcr-Abl fusie-eiwit. Abl (kinase): strak gereguleerd, door fusie is controle weg: eiwit altijd aan downstream targets gefosforyleerd. Fusie-eiwit is anders gevouwen, andere functie. Fosforylering heeft een ATP-binding site nodig eiwit is nu altijd in ATP-gebonden vorm (geen ADP), dus altijd actief. Bcr-Abl expressie aanschakeling erg veel signaaltransductieroutes in de cel. Belangrijke info: waarom ontstaan dit soort kankers? Kennis van fusie-eiwit analogen te maken die passen in binding pocket met hogere affiniteit dan ATP: geen actief eiwit meer (Gleevec bijv.): ATP-analogen. Samengevat: kanker wordt veroorzaakt door veranderingen in DNA: * Mutaties in genen * Genoomamplificaties verhoogde expressie van bijv. groeistimulerende genen (myc) * Chromsomale translocaties verhoogde expressie oncogenen: fusie aan actieve promoters, verlies v negatieve regulatie en fusie-eiwitten met veranderde functie. Hoofdstuk 5: hoe kunnen oncogenen cellen transformeren? Normale versies van oncogen-gecodeerde eiwitten zijn belangrijk bij celdeling en regulatie daarvan. Metazoa (meercelligen) hebben cel-celinteracties: cellen in de buurt bepalen wanneer andere cellen delen, differentiëren, doodgaan. Vaak via groeifactoren/cytokines. Weefselhomeostase hangt af van: Generatie van nieuwe cellen wanneer nodig. Verwijderen van overschot/onnodige cellen. Wondherstel. Goede immuunrespons. Cellen kunnen zelf niet beslissen of ze gaan delen of niet, gaat via groeifactoren. Bijv. dunne darm veel soorten cellen (stamcellen, mucusvormende, vili enz.): communicatie heel belangrijk. Bloedplaatjes produceren PDGF (groeifactor) voor andere cellen, ook essentieel voor bloedstolling; chemoattractant voor fibroblasten, gemaakt op plek v/d wond; zorgt ook dat fibroblasten gaan delen. Mitogeen: groeifactor die celdeling stimuleert. Wound healing assay laag fibroblasten, deel weg m.b.v. pipet: toevoegen van PDGF zorgt voor migratie van fibroblasten. Defect voor PDGF-receptor geen migratie. v-Src: eerste oncogen gevonden in virussen; overexpressie v-Src in normale cellen transformeert ze: Verandering celvorm. Verhoogde glucose-opname. Anchorage-independent growth. Zijn er verschillende targets voor het kinase? Src is een tyrosine kinase, dus fosforyleert substraten. Normale fibroblasten expressie van Src en analyse van eiwitexpressie met Ab’s die gefosforyleerde substraten herkennen. In cellen met Src-expressie enorm scala aan banden; Src heeft dus veel targets! EGF-receptor ectodomain (bindt ligand), transmembraan-/plasmamembraandomein. De laatste heeft veel homologie met Src. Tyrosine kinase familie: 59 stuks op 20.000 genen. Allemaal iets anders eigenschappen, maar intracellulair erg homoloog (extracellulair, ligand bindend niet); allemaal eigen ligand. Mutaties hierin zorgen voor allerlei kankers. Veel receptor-ligandparen niet in eencellige eukaryoten, maar pas in meercelligen! AEV (virus) kan erythroleukemie induceren: muteert erbB oncogen codeert voor de EGFreceptor; bij infectie met AEV raakt het ectodomain verloren (wat het ligand bindt). Hoe kan dit functioneren als oncogen? Kankercel aantal variaties: Mutaties die structuur beïnvloeden kan leiden tot ligand-onafhankelijke signaaltransductie of verdwijnen ectodomain. Overexpressie membraaneiwitten ligand-onafhankelijke signaling. Een veranderde groeifactor receptor kan gaan functioneren als onco-eiwit. Normaliter: cel stimuleert zichzelf niet bij signaling. Cel maakt PDGF, maar dat bindt andere cellen. Kankercellen maken GF’s voor eigen receptoren of vice versa: signaling systeem is veranderd! Sprake van verkeerde paracriene signaling. Paracriene signaling andere cellen. Endocriene signaling andere weefsels. Dimerisatiemodel: waarom is een dimeerreceptor actief? transfosforylatie. Kinasedomeinen zitten zo dat alleen anderen binnen een dimeer kunnen fosforyleren; bijeenbrengen monomere receptoren door een ligand is genoeg voor aanschakelen signalering. Samengevat tot nu toe: Meercelligen maken gebruik van ligand-receptor interacties om extracellulaire signaleringen mogelijk te maken (autocrien, endocrien, paracrien). Receptoractivatie: ligandbinding, transfosforylatie en fosforylatie van intracellulaire eiwitten. Kanker kan ontwikkelen door: hoge expressie autocriene groeifactoren/liganden, hoge receptorexpressie en receptormutaties. Cytokinereceptoren: zelf geen tyrosine kinasedomein, maar recruteren deze, bijv. Tyk2 of Jak1. Ligandbinding dimerisatie transfosforylatie door tyrosine kinasedomeinen. Als ze actief zijn kunnen residuen in de receptor zelf wel worden gefosforyleerd. Fosforylatie-residuen: tyrosine, threonine en serine. Serine/threonine kinase receptoren: bijv. TGF-β receptoren. Ligandbinding dimerisatie: transfosforylatie en signaaltransductie. Notch signaling: begint wanneer twee cellen met elkaar communiceren; ene cel heeft Notch tot expressie, andere het ligand Delta (op membraan). Als Delta bindt aan Notch-receptor vinden aantal cleavage-stpapen plaats (proteolytische activiteit): eerst wordt een extracellulair deel van Notch geknipt, dan intracellulaire cleavage intracellulair geknipt Notch vormt de TF gaat naar de kern regulatie genexpressie. Patched-Smoothened signaling: 2 membraaneiwitten die elkaar negatief beïnvloeden. Membraan/vesikeleiwitten. Patched heeft negative invloed op Smoothened: actief Smoothened activeert Gli Gli (TF) raakt v/d membraan verwijderd, gaat naar kern en reguleert genexpressie. Ligand Hedgehog bindt Patched en activeert het: repressie op Smoothened valt weg. Wnt-signaling: eindpunt is β-catenine (TF): zonder ligand wordt dit afgebroken. Geen celactivatie zorgt ervoor dat eiwitcomplex β-catenine fosforyleert afbraak. Zonder β-catenine (TF) geen signaling. Binding Wnt-ligand aan Frizzled axine weggetrokken naar het membraan; complex valt uiteen: zonder axine geen degradatie van β-catenine gaat naar kern en reguleert daar genexpressie (stimulatie proliferatie en stamcelstatus). Integrines (membraaneiwitten): zitten op cellen; extracellulaire matrix (ECM) bestaat uit glycoproteïnen, hyaluronzuur en proteoglycanen; hebben invloed op gedrag v/d cel. Cellen kunnen ECM binden via integrine-receptoren dimeren bestaan uit α- en y-keten. Activatie integrines signaaltransductie: bijv. continue reorganisatie van cytoskelet (actine). Integrines clusteren tot focal adhesions: punt waarop cel sterk kan interacteren met ECM. Activatie Ras zorgt voor integrine-onafhankelijke groei zonder focal adhesions: onafhankelijke groei = kenmerk van kanker! Ras in kankers vaak geactiveerd; proliferatie kan zo plaatsvinden zonder ECM context. Normaliter: activatie integrines echt nodig voor proliferatie. Anchorage-independent growth Hoofdstuk 6 Cel + mix van groeifactoren in serum eerst worden immediate early genes aangezet. RNAs worden uit de kern getransporteerd en zetten een tweede zet transcriptiefactoren aan (delayed early gene response). Er zijn 229 immediate early genes die supersnel kunnen reageren op groeifactoren. Niet alle responsen gaan via genexpressie! Fosforylatie fosfaatgroep is negatief geladen: als deze op tyr/ser/thr komt induceert het conformationele verandering. Negatieve lading kan ook interacteren met positieve lading verschillende domeinen in eiwitten hebben bepaalde lading stabiele interactie-units ontstaan, bijv. SH2. SH2: bouwsteen voor tyrosinekinases in veel eiwitten; heeft een tyrosine- en een arginineresidu (positief) stabiel. Tyrosine fosforylatie stuurt locatie/activiteit van cytoplasmatische eiwitten: gefosforyleerde eiwitten vormen platform voor andere eiwitten. Omgeving bepaalt welke andere eiwitten kunnen binden. Specifieke interactiepartners sturen specificiteit. Groot scala aan post-translationele modificaties scala aan specificiteit. Groeifactorreceptoren kunnen Ras activeren via SH2 en SH3-domeinen. Ras gebonden door membraaneiwitten: Ras in één oncogen hoe kunnen diverse fenotypes bereikt worden in cellen door een enkel oncogen? Ras kan verschillende signaaltransductieroutes activeren: MAPK pathway: actief Ras activeert Raf Mek Erk (MAPK) activatie TFs die zorgen voor genexpressie. Msk1 (TF) is betrokken bij chromatine remodeling (epigenetica) en elF4E (TF) is betrokken bij eiwitsynthese meer eiwitsynthese. Veel mutaties in deze pathway! Mutaties in B-Raf kunnen deze pathway activeren zonder Ras-activatie. PI3K pathway: gebruik van lipiden in de lipide membraanlaag. PIP2 gefosforyleerd tot PIP3 (trifosforylering) : vormt docking site voor eiwitten met PHdomeinen en recruteren ze naar het membraan. Akt-PKB één v/d belangrijkste. PTEN draait de pathway om kanker: PI3K hyperactief, PTEN inactief = continue signaling. Cdc42 pathway: induceert verandering in actineskelet: celbeweging en –adhesie. Dus: Ras induceert 3 pathways: * MAPK transcriptie, eiwitsynthese. * PI3K remming apoptose, eiwitsynthese, celcyclus progressie. * Cdc42 celbeweging en –adhesie. Mutaties in alle voorgaande pathways kunnen kanker induceren. Hematopoïese: vorming van bloed uit hematopoietische stamcellen in het beenmerg. Kunnen zelfvernieuwing ondergaan (nieuwe stamcellen generatie) of dochtercellen genereren differentiatie tot bloedceltypen. Cytokines en receptoren sturen differentiatie/deling enz. Leukemie chronische klachten (vermoeidheid, stollingsproblemen): tekort aan bepaald type cellen; door mutatie geen maturatie bloedcellen ophoping immature cellen. Jak-Stat pathway: Jak-kinases recruteren extra eiwitten (Stat) aan de receptoren actieve signaling. Stat eiwitten werken als transcriptiefactor. Actief fosforylatie SH2-domeinen stabiele interactie tussen SH2-domeinen: dimeer. Stat transloceert naar de kern en zet genexpressie aan. Leukemie cellen gedragen zich onafhankelijk v groeifactoren. Bcr-Abl is een tyr kinase die Stat transcriptiefactoren aan kan zetten. FLT3-ITDs ook tyr kinase in cytoplasma die constante activatie van Stat5 induceren. Door ook verlies van negatieve feedback continu genexpressie. Bij knockouts van Stat5 raakt groei van cellen ernstig verstoord, gepaard met sterke toename in apoptose. Is Stat5 een oncogen? breng een gezonde cel gemuteerd Stat5 in (actief): induceert continue groei, in vitro transformatiegedrag, veranderde interacties met omgevingscellen (sterker). Negatieve feedback uitschakelen signaaltransductie. Actief Ras zet cascade in: activeert o.a. Sprouty wat via negatieve signaling Ras-signaling weer uitzet. Sprake van “tijdelijke activatie”. Speelt veel in TSGs. Ras-GAP wordt geactiveerd bij activatie van Ras zorgt voor inactivatie van Ras. Activatie leidt tot inactivatie. Positieve feedback NF1 zorgt ervoor dat een cel in rust bij een beetje Ras-activiteit weer stilgelegd wordt (meteen inactief). Geen Ras-signaling zonder ligand dus. Activatie van Ras met een ligand fosforylatie NF1: valt uit elkaar, dus Ras kan goed werken. Stopt negatieve feedback. Hoorcollege biologie van kanker – 19-03-2014 – Kruyt (medische oncologie) Hoofdstuk 7 Proto-oncogenen en oncogenen sturen proliferatie van cellen. Producten van proto-oncogenen belangrijk in groeistimulerende signalen mutaties leiden dus tot continue groeisignalen en proliferatie van kankercellen (Ras, myc). Tumor suppressor genen (TSGs) hangen activiteit van proto-oncogenen tegen: spelen ook een rol in kanker ontwikkeling. Kankerfenotype geïdentificeerd met celfusie experimenten. Fusie normale en tumorcel tot hybride cel: wordt dit normale of tumorcel? Zonder tumorvirus zou een fenotype van hybride cel recessief zijn: beide allelen van een TSG moeten dus gemuteerd zijn. TSG geraakt in beide kopieën functie totaal defect: kankerontwikkeling. Kans op mutatie 106, kans op dubbele mutatie is dus 1012: laag risico ander mechanisme? Loss of heterozygosity (LOH): functioneel gen verloren, dus homozygoot. Bijv. mutant RbTSG gelokaliseerd op 13q14. Door mitotische recombinatie wisselen delen zusterchromatiden uit waardoor dochtercellen ontstaan met dubbele kopie v/d mutatie. Komt 105/104 keer voor per celgeneratie. Genen vlakbij Rb verliezen ook heterozygotie worden homozygoot. Ook wel allelische deletie genoemd. Oorzaken LOH: ► Gene conversion tijdens DNA synthese wordt ene strand verteld in de ene kopie. Polymerase springt naar ander (homoloog) chromosoom en weer terug naar oude strand; stukje v/d homologe strand wordt gekopieerd: stuk v/h originele chromosoom wordt vervangen door stuk v/h homologe chromosoom. Frequenter dan mitotische recombinatie. ► Breuk in chromosomen stuk gaat verloren zonder nieuwe kopie: hemizygotie: alle genen van dit stuk hebben één kopie: maar één allelische versie v/e gen. Netto resultaat is een niet-functionerend TSG. ► ► Non-disjunctie uiteentrekken chromosomen naar dochtercellen gaat mis: één dochtercel met 1 en één met 3 chromosomen. Nakomeling kan er bijv. 1 krijgen ipv 2: als hierop het TSG lag, is er inactief TSG verhoogde kans op kanker. CpG methylatie methylatie in promotor v/e gen zorgt voor silencing van genexpressie: TFs binden slechter. Even effectief als mutatie v/d nucleotidesequentie. Retinoblastoma gen (Rb) veroorzaakt tumor in de retina. Kinderen met defecte kopie van Rb hebben grotere kans op bottumoren als volwassene. Twee varianten sporadic (spontaan: 2 defecte kopieën) en familiar (erfelijk: familieleden al 1 defectekopie: nog één hit nodig!). Mapping op regio 13q14 ligt esterase D locus; bij optreden van retinoblastoma vonden ze dat patiëntjes heterozygoot waren voor dit gen: één allel was al verloren gegaan, dus hebben LOH ondergaan. Aangedaan bij deze kanker moet dichtbij Rb-gen liggen! Tumoren welke sequenties ontbreken er in de tumor? Zijn potentiële TSGs. Te identificeren m.b.v. markers die dichtbij liggen op het chromosoom dat steeds LOH ondergaat tijdens ontwikkeling v/e bepaalde tumor. Linkage analysis identificeren van genen aan de hand van genen in de buurt. APC gen: ontwikkelt darmpoliepen (voorstadium darmkanker) bij afwezigheid. Bepaalde families waarin ziektes veel voorkomen zijn ideaal voor identificatie van betrokken genen! Bekende TSGs, bijv. p53 en Rb zijn vaak aangetast in vormen van kanker. Deze worden ook door virussen aangepakt genen zijn belangrijk voor overleving v/d cel en activatie van bepaalde reactiemechanismen op virussen (neutralisatie infectie bijv.). TSGs sommige onderdrukken direct celproliferatie op groeiremmende signalen en differentiatiesignalen. Andere TSGs zijn onderdeel van controlesysteem dat proliferatie remt door inbalans in metabolisme en DNA schade. Twee soorten TSGs: ► Gatekeepers sturen direct biologie v/d cellen door invloed op differentiatie, proliferatie en celdood. ► Caretakes verzorgende functie over status v/h genoom: bij beschadigingen moeten deze gerepareerd worden; ook geen celdeling dan. Oncogenen zijn niet overerfelijk: worden niet overgegeven in kiembaancellen (lethaal). TSGs: grote groep genen die normaliter tumorontwikkeling voorkomen in normale lichaamsweefsels. Er is onderscheid tussen TSGs die vroeg of laat in kankerontwikkeling tot expressie komen sommige onderdrukken primaire tumorvorming, andere beperken metastase. TSGs kunnen ook miRNAs coderen (naast eiwitten). Afwezigheid v genexpressie in tumorcellen geeft niet aan dat dit een TSG is kan ook geval zijn van normaal genexpressiepatroon in celdifferentiatie. Genetische criteria TSGs ► Veel LOH van een specifiek gen in tumorcellen kunnen natuurlijk ook genen zijn die dichtbij het potentiële TSG liggen. ► Gen is alleen een TSG als het veel LOH in veel tumorcelgenomen ondergaat en de resulterende homozygote allelen inactiverende mutaties hebben. ► Functioneel heeft het potentiële TSG eiwitproduct een tumor onderdrukkende functie? Eiwitten integreren in allerlei signaling pathways in verschillende delen v/d cel als “negatieve signaling” die de positieve (groeisignalen bijv.) tegenwerken (balans!). Functionele analyse Wt-versie van potentiële TSGs inbrengen in tumorcellen zonder detecteerbare expressie van deze genen. Keert de tumorcel deels/volledig terug naar een normaal fenotype of gaat het in apoptose? Ectopische expressie van veel genen (in een gastheercel waar ze normaal niet tot expressie komen) zorgt er vaak voor dat cellen stoppen met groeien of in apoptose gaan. Conditionele knock outs potentiële TSGs vormen ook goed model voor identificatie; als dit in kiembaan wordt gedaan leidt het vaak tot stoppen van embryonale ontwikkeling dood. Met induceerbaar systeem gen uitknocken in volwassen muis muis heeft vectoren al in genoom, hierin liggen genen die je uit kunt knocken door triggering van bepaalde systemen. Therapeutische mogelijkheden: terugzetten gezonde kopie v/e gen in een patiënt? Lastig bij kanker. In lab goed te doen, in vivo moeilijk. Bijwerkingen zijn toxische schade aan andere, gezonde weefsels. ► Tumoren leiden aan meer problemen dan de gemuteerde TSG. ► Moeilijk met gentherapie alle tumorcellen te raken. Afwezigheid van TSG functie cellen gevoeliger voor types low-moleculair-weight-drugs: tijdens tumorontwikkeling worden bepaalde tumorcellen afhankelijk van signalen van de (afwezige) TSGs. Dus: verlies van PTEN (een TSG) hyperactief Akt/Pkb (continu actief) tumoren: Akt/Pkb is wel een kinase dus wel te targeten. TSGs zelf zijn moeilijk te targeten (want, afwezig). Key concepts: Op cellulair niveau is het fenotype van tumorcellen recessief, omdat expressie afhangt van inactivatie van TSGs. Verlies van genetische informatie is dus essentieel voor ontwikkeling v/d meeste tumoren. TSGs zijn hierdoor vaak als inactieve allelen aanwezig in genomen van tumorcellen. Verlies van TSGs heeft invloed op fenotype v/d cel als beide kopieën verloren gaan als nul-allelen (inactief) in heterozygote staat in cellen in het lichaam zitten hebben ze geen invloed op fenotype. Verlies van TSG functie kan door (1) genetische mutatie of (2) epigenetische silencing van genen door promotor methylatie. Inactivatie van één TSG kopie kan leiden tot verlies van andere kopie door LOH: - Mitotische recombinatie - Verlies van chromosomaal stuk - Non-disjunctie - Genconversie LOH komt vaker voor dan mutaties of promotor methylatie, verschilt wel per gen. Veel LOH in een bepaald deel v/e chromosoom geeft vaak een TSG aan. TSGs reguleren celproliferatie: verlies van een gen kan leiden tot tumorcelformatie. Mutante, defecte kopieën van TSGs kunnen worden overgeërfd hogere gevoeligheid voor ontwikkeling van kanker. Er zijn binnen TSGs “gatekeepers” en “caretakers”. Verlies van TSGs komt vaker voor dan mutatie van proto-oncogen oncogen. Vaak meerdere geïnactiveerde TSGs binnen één tumorcel. Hoofdstuk 9 In 50% van alle kankers zitten mutaties; resulteert vaak in functioneel inactief p53 eiwit. p53 TF: aantal functies, o.a. stoppen van celcyclusprogressie en inductie van apoptose. Gemuteerd p53 blokkeert mogelijkheid om celcyclus te stoppen of apoptose te induceren. p53 belangrijk bij activatie celcyclus blokkades/checkpoints. Induceert ook apoptose als celschade niet gereguleerd kan worden, bijv. DNA schade. Gevonden met virusonderzoek interesse in SV40-virus dat bepaald eiwit maakt (Large T). Expressie van p53 werd gevonden bij SV40+ fibroblasten: bij gelelektroforese kwam een p53-bandje op bij SV40+ cellen, niet bij controlegroepen. Later bleek Large T bindingspartner te zijn van p53 bindt met elke unit p53: onttrekt het van normale functie. Experiment p53: inbrengen Ras-oncogenen in fibroblasten + bepaalde variant p53: Wt p53: geen kolonievorming van groeiende cellen. Deletiemutant p53: wel kolonievorming van groeiende cellen p53 kan niet (volledig) Ras onderdrukken: continue groeistimulatie door Ras. Puntmutant val-135 p53: veel meer kolonievorming eis voor TSG. p53 -/- slechte prognose voor muizen, niet hebben van p53 zorgt ervoor dat homozygote muizen vroeg doodgaan aan allerlei tumoren (sarcomen, leukemieën). Heterozygoot p53 (niet helemaal Wt) betere overleving. p53 is een TF reguleert genexpressie en heeft dus een sequence-specific DNA-bindingsdomein: bindt specifieke sequenties v/h DNA, vaak promotors. Tetramerisatiedomein: functioneert alleen als tetrameer! p53-mutaties vaak in DNA-bindend domein. Tetrameer: verklaart waarom p53 heterozygoot nog steeds een fenotype heeft; combinatie Wt-gen en gemuteerd gen. Bij tetrameer verschillende configuraties van interacties als mutant subunit p53 in het tetrameercomplex zit is het niet geheel meer functioneel. Statistisch gezien is er een kleine kans op volledig functioneel complex. Complete deletie p53-gen met één gezonde kopie allemaal gezonde complexen: alleen gezonde kopieën blijven over. Mutatie niet geheel functionerende complexen (dominantnegatief). Tetramerisatiedomein mutant in heterozygote situatie geen consequenties: gezonde kopie zorgt toch voor tetramerisatie. Eiwit kan niet meer meedoen, geen dominant-negatief effect. p53 ontvangt continu signalen van verschillende surveillantiesystemen: als p53 specifieke signalen krijgt (1) stopt het celproliferatie of (2) induceert het apoptose. Tumorcellen raken dit p53-systeem dus graag kwijt. Signalen te weinig nucleotiden, UV-straling, ioniserende straling, hypoxie. Effecten celcyclus arrest of senescence, DNA repair, geen angiogenese of apoptose. Expressie van p53 normaliter niet te zien op eiwitniveau: alleen wanneer er iets moet gebeuren. Bestraling verhoogde p53-expressie, later ook p21Cip1. p53 detecteert celschade en zorgt voor halt in celcyclus. Actineniveaus worden gemeten in de blot als controlemechanisme: zijn onderdeel v/h cytoskelet en is gebruikt om hoeveelheid ingebracht eiwit te testen (is wel overal evenveel?). Overleving p53 +/+: levensvatbaarheid daalt, bijna alle cellen gaan dood. Straling was zo hoog dat het niet te repareren was en cellen in apoptose gaan. Bij p53 +/- een flinke afname in celoverleving, minder apoptose dan bij Wt. Bij p53 -/- blijven cellen leven/delen ondanks flinke schade! Regulatie p53: eiwitlevelregulatie d.m.v. afbraak door het proteasoom soort barrelvormige structuur; eiwtten gaan erin en komen er in kleine eiwitdeeltjes uit. Proteasoom heeft proteases die eiwitten kapot knippen; leidt tot snelle afbraak. Eiwitten gelabeld met ubiquitine (ketens) vormt een “vlaggetje” wat herkend wordt door het proteasoom degradatie. Mdm2 labelt p53 met ubiquitine: ligase dat dit kan doen. Activatie van Mdm2 zorgt voor accumulatie van p53. Één v/d targetgenen van p53 is weer Mdm2 negatieve feedbackloop. Benodigde targetgenen worden geactiveerd door p53, wat weer leidt tot afbraak van p53. Apoptose: gereguleerde vernietiging van een cel door genetisch gecodeerd proces, ook wel programmed cell death (PCD). Belangrijk proces, vooral bij het immuunsysteem, bijv. eliminatie van zelfreactieve T-cellen of het doden van viraal geïnfecteerde cellen door NK-cellen. Ook belangrijk bij weefselhomeostase grootte van weefsels, verwijdering onnodige cellen. Disregulatie van apoptose belangrijk bij kankerontwikkeling! Na apoptose blijft er nog een apoptotisch lichaam over deze wordt gefagocyteerd door macrofagen of buurtcellen. Anoikis cellen sterven als ze loskomen van hun omgeving. Veel epitheelcellen zitten in bepaalde structuur (voorwaarde voor overleving): apoptose in werking zodra de cel daarvan loskomt. Autofagie/autofagocytose katabolisch systeem dat vernietiging van onnodige/niet werkende celcomponenten induceert. Gaat m.b.v. lysosomen. Bij apoptose komt er cytochroom c vrij vanuit de mitochondriën. Twee eiwitfamilies spelen een rol: pro-survival eiwitten (Bcl-2) en pro-apoptosis eiwiten (Bax/Bak BH3-only). Het humane genoom codeert voor 24 Bcl-2 achtige eiwitten: 6 hiervan zijn anti-apoptotisch, 18 zijn pro-apoptotisch. Pro-apoptotische eiwitten reguleren lek raken van mitochondriën in het apoptotisch proces. Bak’s eiwitten die waarschijnlijk een porie maken in het buitenmembraan van mitochondriën als ze binden. Hebben pro-apoptotische werking: cytochroom c lekt door de poriën. Complex aantal interacties, logica Bax en Bak zijn eiwitten die poriën maken ( apoptose). Alle andere eiwitten (pro-survivals) binden Bax en Bak en remmen porievorming. Pro-apoptotische eiwitten (BH3-only’s) kunnen door signalen in de cel geactiveerd worden en ervoor zorgen dat pro-survivals hun werking op Bax/Bak niet meer kunnen doen en Bax/Bak actief worden. Noxa, Puma zijn ook pro-apoptotische eiwitten die de Bax-/Bak-remmende eiwitten kunnen remmen. Hoorcollege biologie van kanker – 20-03-2014 – Kruyt Intrinsieke apoptosepathway: Cel wordt van binnenuit gedemonteerd, tot er kleine stukken over zijn die gefagocyteerd/verwijderd kunnen worden. Caspases proteases die op eiwitniveau alles kapotknippen; kunnen ook andere mechanismen activeren. Worden geproduceerd als zymogeen (pro-enzym). Onderverdeeld in 2 soorten: Initiators bovenin de pathway: cleaven elkaar bij activatie en activeren effectoren: inductie “sneeuwbaleffect”. Zijn caspases 2, 8, 9 en 10. Effectors knippen substraten kapot. Zijn caspases 3, 6 en 7. Deze caspases zijn betrokken bij apoptose (vooral 8 en 9). Pro-caspases in de cel zijn inactief: activatiestappen nodig verwijdering pro-domein of cleavage van subunits. Porievorming leidt tot lekken van cytochroom c uit mitochondriën: functioneert als cofactor voor activatie van procaspase 9 actief caspase 9, samen met eiwit Apaf-1. Cytochroom c bindt complex van Apaf-1 eiwitten. Procaspase 9 wordt geactiveerd en vormt met cytochroom c-Apaf-1 complex het apoptosoom: samen met ATP leidt het tot activatie van effector caspases. DNA-fragmentatie DNAse wordt geactiveerd op moment dat een inhibitor (ICAD) geknipt wordt door effector caspases. ICAD is remmer van DNA en knipt het DNA in stukjes. Cytoskeleteiwitten zijn ook substraten van effector caspases. Caspases kunnen geremd worden regulatiemogelijkheden: gebeurt door inhibitors of apoptosis (IAPs): als cytochroom c vrijkomt samen met Smac/DIABLO (ander mitochondriaal eiwit dat IAPs remt) is dit een goede activatie v/d apoptotische route: IAPs worden zo geremd en door cytochroom c wordt de caspasepathway in gang gezet. Extrinsieke apoptosepathway Death receptors externe signalen die apoptotische route activeren. Voorbeelden zijn Fas, TNF-receptoren en DR3/4/5. DR4/5 lijken specifiek apoptose te induceren in kankercellen interessant voor onderzoek! Receptoren vormen intracellulair een cluster (trimerisatie) ligand bindt trimerisatie vorming intracellulair docking platform voor andere eiwitten. Andere eiwitten binden, bijv. FADD. Caspases kunnen FADD binden apoptosepathway in gang. Externe signalen induceren dus apoptose in de cel! Procaspase 8 eiwtten worden bijeen gebracht: liggen dicht bij elkaar en kunnen cleaven met hun caspasedomein. Heet ook wel DISC (Death Initiating Signaling Complex). Crosstalk: bij activatie procaspase 8/10 of activatie effector caspases cleavage van Bideiwit tot actief tBid. tBid heft invloed op porievorming door Bax/Bak. Hier komen dus de extrinsieke (death receptors) en intrinsieke (apoptosoom) bij elkaar. Cleavage van Bid heet ook wel de amplification pathway. Granzyme B is een sterke activator van caspases uitscheiden door CTLs (dus rol van IS). Rol van p53: kan op verschillende manieren apoptose beïnvloeden. Targetgenen van p53 horen bij Bcl-2 familie. Bax wordt bijv. beïnvloed door p53 verhoogde expressie porievorming mitochondrium. Puma, Nox en andere eiwitten kunnen ook worden beïnvloed door actief p53. Kan ook de levels van death receptors beïnvloeden upregulatie door actief p53. In veel tumoren wordt apoptose gedereguleerd door verschillen in genexpressie: verschillende eiwitten hebben direct/indirect effect op apoptose. Therapeutische mogelijkheden aangrijpen op verschillende componenten van apoptotische pathways, bijv: Activatie death receptors door toevoegen van liganden Remmen Bcl-2 genen mitochondriale apoptose kan beter plaatsvinden. Remmen IAPs weghalen suppressie op apoptose. Imaging ratexperiment expressie p53 in tumorcellen die dat voorheen niet hadden (zie plaatje 2). Tumorcellen gelabeld met bepaald enzym dat imaging mogelijk maakt. Alle cellen met het substraat geven fluorescentie af. Plaatje 2 geen p53, enorme tumor. Plaatje 3 + 4 p53 weer aangeschakeld, tumor vermindert aanzienlijk verdwijnt. Hoofdstuk 14 Metastase (uitzaaiing) gevormd door tumorcellen die primaire tumor hebben verlaten en door bloed-/lymfevaten op zoek zijn naar nieuwe plekken in het lichaam om kolonies te vormen. Metastase geeft slechte prognose; chirurgie niet meer mogelijk, alleen bij primaire tumoren. Afbeelding: CT-scan gekoppeld aan FDG-PET (FDG: vorm van glucose geel). Gele kleur geeft tumorcellen weer (hier: Non-Hodgekins Lymphoma). Goed te zien zijn uitzaaiingen over het lichaam, ook wel secundaire tumoren genoemd. Micrometastases te klein om te detecteren op bijv. FDG-PET scans. Gaat om kleine aantallen cellen. Kunnen al gevormd zijn voor de primaire tumor wordt ontdekt! Metastasering: primaire tumor induceert angiogenese (voedsel) tumorcellen komen in deze vaten (intravasatie): cellen zijn invasief, kunnen door bloedvatwand cellen interacteren met bloedcellen, bereiken het hart en gaan circulatie in zaaien uit in bijv. longen/brein/beenmerg extravasatie: van bloed naar weefsel (vaak ander type) vorming micrometastase vorming macrometastase (secundaire tumor): kolonisatie. Metastatische inefficiëntie kleine kans dat alle stappen tot kolonisatie goed verlopen; daarom kleine kans dat tumorcel uitzaait in het lichaam. Kolonisatie afh. v/d aanpassing v/d tumorcel aan micro-omgeving van het nieuwe weefsel. Intravasatie vanuit primaire tumor naar het bloed. Hulp v stromale cellen is nodig (bijv. macrofagen). Anoikis vorm van apoptose dat wordt getriggerd wanneer een cel van zijn substraat (bijv. ECM) loskomt. Erythrocyten zijn elastisch; gaan makkelijk door capillairen. Tumorcellen niet lopen gemakkelijk vast; kan gepaard gaan met clustering samen met bloedcellen want ze trekken bloedplaatjes aan. Tumorcellen worden dus in circulatie gevonden als multicellulaire aggregaten in een cluster van circulerende tumorcellen (CTCs). Dit helpt bij in leven houden tumorcellen! CTCs zijn detecteerbaar in het bloed. Extravasatie uittreden tumorcellen van bloedvat naar weefsel. (1) Tumorcel raakt fysiek vast in capillair. (2) Grote hoeveelheid bloedplaatjes (blauw) hechten aan de tumorcel microtrombus. (3) Tumorcel duwt een epitheelcel opzij en krijgt direct contact met basilair membraan v/h capillair. (4) Binnen een dag wordt microtrombus opgelost door proteases gericht tegen stolsels. (5) Tumorcel gaat prolifereren in het lumen v/h capillair. (6) Binnen dagen/soms weken dringt tumorcel door het basilair membraan in het omringende weefsel parenchym. Kolonisatie gebeurt niet altijd; snelheidsbepalende stap van het gehele proces. Veel micrometastases kunnen voorkomen (maandenlang) zonder uit te groeien tot secundaire tumor. CTCs diagnostische marker; effecten van therapie ook te monitoren. Geven ook informatie over wat er mis is in tumorcellen identificatie therapeutische targets: want, komen uit primaire tumor (zelfde genoom). Aantal tumorcellen in beenmerg (DTCs) nog betere diagnostische marker dan CTCs (als ze aanwezig zijn) aantal DTCs geeft ophoping van uitzaaiende tumorcellen over bepaalde tijd weer, aantal CTCs kan worden gestuurd door kinetische processen die hun overleving in de circulatie aansturen. Heterogene primaire tumor zaait uit in heterogene micrometastases door het lichaam v/e kankerpatiënt. Primaire tumor wordt verwijderd, micrometastases blijven achter; weinig overblijvende ziekte. Één micrometastasis groeit uit (later) macroscopische metastase nieuwe micrometastases meerdere macroscopische metastases ziekterelaps. Primaire tumor behoudt structuur van epitheelcellagen voor motiliteit en invasieve eigenschappen moeten carcinoomcellen epitheeleigenschappen kwijtraken en eigenschappen van mesenchymale cellen aannemen EMT (epithelial-mesenchymal transition). Mesenchymcellen raken los zonder dood te gaan en zijn migratief. EMT vindt plaats bij (1) embryonale ontwikkeling en (2) wondgenezing. Embryonale ontwikkeling enorme bewegingen van cellen die andere organen gaan vormen door embryo heen, bijv. vorming neurale buis. Karakteristieken EMT: Verlies van: Cytokeratine expressie (intermediair filament). Tight junctions en epitheel adherens junctions met E-cadherine (cel-cel contact). Epitheelcel polariteit (lumenkant etc.). Epitheel genexpressieprogramma. Verkrijgen van: Fibroblastachtige vorm. Motiliteit en invasieve eigenschappen. Verhoogde weerstand tegen apoptose. Mesenchymaal genexpressieprogramma incl. EMT-inducerende TFs. Mesenchymale adherens junction protein (N-cadherine). Proteasesecretie (helpt bij afbraak ECM). Vimentine-expressie (intermediair filament). Fibronectinesecretie, PDGF receptor expressie en integrine expressie. Stamcelachtige eigenschappen. Tumorcellen houden zich aan elkaar vast m.b.v. E-cadherines; zitten tussen cellen en verbinden cytoskeletten m.b.v. actinebundels. Deze structuren worden verbroken bij metastasering. E-cadherine expressie (epitheelmarker) verwacht je bruin bij kleuring met IHC op het celmembraan. Resultaat in centrum tumor lokaliseert E-cadherine naar de celmembranen, geen expressie aan het invasief front wel tumorcellen, maar zonder E-cadherine expressie (of lager). E-cadherine aan de buitenkant; aan de binnenkant kan β-catenine binden; eiwit zit gebonden aan binnenkant v/d cel. Zorgt voor verbinding E-cadherine aan cytoskelet. β-catenine belangrijk bij Wnt-signaling TF die genen aan kan zetten. Kan in het cytoplasma loskomen (door verlies E-cadherine) en signalering activeren. Staining β-catenine normaliter meer in de membraan, niet in de kern. Bij invasief front verandert expressie en zie je het ook terug in de kern (door verlies E-cadherine). Met moleculaire karakteristieken nagaan of tumorcellen EMT ondergaan expressie epitheelmarkers neemt af, expressie mesenchymale markers neemt toe. EMT wordt gestuurd door externe signalen; reversibel proces. Belangrijk bij kolonisatie van (secundaire) tumoren. Metastase mogelijk doordat tumorcellen mesenchymaal worden en kunnen migreren. Na extravasatie kan het omgekeerde proces (MET) plaatsvinden cellen worden weer epitheliaal. TGF-β is een stimulus morfologie verandert niet, maar E-cadherine verdwijnt en vimentin (mesenchymmarker) stijgt. Bij verwijderen van TGF-β stimulus groeien cellen weer als epitheel. Wnt-signaling induceert ook ECM. Sommige tumorcellen brengen liganden als TGF-β tot expressie induceert ECM. Functie van deze signalen wordt geremd door blokkers als BMPs, DKK1 en SFRP1. Cellen ondergaan EMT en remmen productie van deze blokkers (versterking signaal); ook verhoogde expressie andere Wnt-signalen. Deze 3 autocriene loops zorgen voor behoud mesenchymale staat. Er zijn ook TFs die EMT reguleren: extracellulaire signalen worden doorgegeven naar de kern genexpressie: induceren EMT. Zijn o.a. Snail, Slug, Twist en Goosecoid. Als cellen EMT ondergaan verkrijgen ze stamceleigenschappen kunnen zelfvernieuwen: belangrijk voor vormen nieuwe tumorkolonie in ander weefsel. Transcriptiefactoren spelen een rol: regulatie v genexpressie van epitheliale/mesenchymale genen. Bijv. Twist bindt promotors Twist, Snail, Slug en Zeb1 en is afhankelijk van Slug inductie om EMT te induceren. Slug en Twist vaak samen tot expressie in borstkanker wanneer Twist expressie uit wordt gezet raakt Slug ook verloren. Verschillende TFs binden promotor van E-cadherine gen (CDH1) repressie E-cadherine. ZEB1/-2 spelen belangrijke rol in keuze of carcinoma cellen zijn epitheelcelkenmerken moet behouden of een EMT programma moet activeren. Spelen ook een rol in een bistabiele switch tussen epitheliaal ↔ mesenchymaal. Lage expressieniveaus van deze TFs (Snail, Twist) betere overleving/prognose kankers. Seed and soil hypothese tumorcellen metastaseren alleen naar de juiste ondergrond. Vb. prostaatkanker metastaseert bijv. veel naar het beenmerg en minder naar het brein, lever en longen. Hypothese kan niet alle vormen van metastase verklaren! Ook afh. van de vaten tussen plek van primaire tumor en plek van metastase. Plekken die normaliter niet worden gekoloniseerd kunnen wel worden gekoloniseerd gelocaliseerde wonden. Gebieden van chronische ontsteking kunnen plekken voor metastase worden allerlei mitogene/trofische signalen. CTCs kunnen het stroma v/d primaire tumor zelf de beste plek vinden om uit te zaaien tumor self-seeding. Targetorganen geven chemoattractants (chemokinen) af die CTCs aantrekken. Bloedvaten kunnen ook weefselspecifieke moleculen tot expressie brengen; kunnen docking sites vormen voor cellen met bepaalde adhesiemoleculen (bijv. integrines). Dit model heet de “vascular ZIP code theory” luminale oppervlakken van vaten dragen een soort “homing adressen”. 66% van metastases zijn te verklaren door bloedflowpatronen tussen de 2 plekken. 20% van de gevallen te verklaren door micro-omgeving v/d targetweefsels. 14% van de gevallen te verklaren door negatieve interacties cellen trekken actief CTCs aan. Hoorcollege biologie van kanker – 21-03-2014 – Fehrmann Genomic profiling hoe ziet het genoom van een tumor eruit? Welke mutaties, deleties, amplificaties? Vroeger m.b.v. technieken waarmee je één gen bekeek, nu sequencing. Genomics DNA-niveau in kaart brengen: waar zitten mutaties o.i.d.? Transcriptomics mRNA-niveau: genexpressie; welke genen hoog/laag tot expressie? Epigenomics methylatie, histonmodificatie? Sequencing gebeurt dus op meerdere niveaus in de cel. Verkregen data wordt geïntegreerd en geïnterpreteerd voor beter begrip van kanker en klinische toepassingen. Doel analyse van: Pathofysiologisch gedrag van tumoren: wat kan leiden tot nieuwe therapieën? Therapierespons: betere selectie mogelijk op optimale behandelingsstrategie voor een individu. Stel: altijd chromosoom 11 amplificatie bij bepaalde tumor; reageert niet op chemo geen chemotherapie toepassen. Hoe leidt een afwijking tot kanker die agressief en invasief is? Genomische instabiliteit ophoping van somatische genetische veranderingen (mutaties, CNAs). Er is een “driver” vs. “passenger” probleem in oncologie bij een bepaald kanker is een deel v/e chromosoom gemuteerd/geamplificeerd: niet elk gen op dat deel veroorzaakt kankerontwikkeling (passengers), dit gebeurt maar door één/enkele genen (drivers). Bijv.: locus van 10 genen deletie 1 gen veroorzaakt metastase (driver), andere niet (passengers). Borstkanker betrokken gen is HER2/Neu gen. Zit normaliter op chromosoom 17, maar in 20-30% v/d borstkankerpatiënten is er HER2 amplificatie. Meer HER2 verhoogde genexpressie meer HER2 eiwit op buitenkant tumorcel. Geamplificeerd HER2 agressievere tumoren. Activatie HER2 downstream effecten: tumoreigenschappen; cel gaat groeien en minder snel dood. Middel grijpt aan op HER2 (Traztuzumab). Er is een duidelijke relatie tussen veranderingen in DNA – genexpressie. Genexpressie belangrijke factor in tumorontwikkeling? eQTL genomische gebieden (loci) die expressie van mRNA reguleren. Er wordt gekeken naar twee veranderingen in DNA: SNPs variatie in DNA v/e enkele nucleotide. Kan germ-line of somatisch. Copy number variation deleties, amplificaties: extra/ontbrekende stukjes DNA. Er wordt gekeken naar hoeveel genomische gebieden nu duidelijk gerelateerd zijn met genexpressie van bepaalde genen. Vb. bloed van 1500 individuen germ-line DNA in kaart brengen. Er werden 300 SNPs gevonden in die patiënten. Daarnaast ook mRNA microarrays waarmee je genexpressie van 20.000 genen kunt meten in die cellen. Resultaat SNPs bekend samen met het genexpressieprofiel van patiëntne. Je gaat op zoek naar SNPs die zorgen voor hogere expressie v/e bepaald gen. Cis-eQTL: SNP met invloed op expressie van een gen in de buurt (< 250 kb). Trans-eQTL: SNP geassocieerd met niveau genexpressie van genen die verder weg liggen (> 5 mb), of genen op een ander chromosoom. Afbeelding op x-as alle gevonden SNPs gesorteerd op chromosoom, op y-as genexpressie op genomische positie. Zwarte band geven cis-eQTLs weer: SNPs die significant effect hebben expressieniveau van genen vlakbij. Rode stipjes (grootte = significantieniveau) geven trans-eQTLs weer; SNPs effect op genexpressie, maar op genen over hele genoom. In totaal voor 7,500 genen 50,000 SNPs gevonden die expressieniveau kunnen beïnvloeden. Trans-eQTLs maar voor 202 genen. SNPs dus sterk geassocieerd met genexpressie van veel genen is genexpressieverandering belangrijke tussenstap waardoor DNAveranderingen leiden tot kanker? Genome.gov database met genome-wide association studies; wordt gekeken naar associatie van SNPs met bepaalde ziektes. Statistiek: kijken naar alle SNPs. 17% v/d SNPs hebben effect op genen op hetzelfde chromosoom (cis). Bij ziekte-geassocieerde SNPs is dit percentage 40,4%: ook sterke toename in percentage trans-eQTLs. Verandering in genexpressie is belangrijke tussenstap bij ziektes met oorsprong in het DNA. VB – Beta thalassemia/Hb levels (bloedziekte). 3 SNPs die sterk geassocieerd zijn met ziekteontwikkeling. De twee onderste SNPs hebben ook veel invloed op andere genen (staan eronder): zijn trans-eQTLs. De bovenste is een cis-eQTL. Allemaal geassocieerd met ziekte, maar ook met expressieniveau v/h HBG2-gen. Key concepts: Kanker is een “DNA-ziekte”: genomische instabiliteit leidt tot somatische mutaties en CNAs. DNA afwijkingen hebben downstream effecten: verandering van genexpressie is belangrijk! Leidt tot tumorgedrag en therapierespons. Integrative genomics biedt beter inzicht in relevante genen en biologische routes. Genexpressieniveau is belangrijk waarom kijk je dan niet alleen naar mRNA? Data dump biedt veel mRNA expressieprofielen van grote en heterogene sets tumoren. Naïef experiment creëren LCL (lymphoblastoid cell line) cellijn met karyotypering. Voor 5 chromosomen is amplificatie te zien dus ook meer genafschrijving naar mRNA en dus verhoogde genexpressie. Creëren genexpressieprofiel: elk puntje een gen niet duidelijk hogere genexpressie bij die gemuteerde chromosomen?! Fout genexpressie gereguleerd door allerlei factoren: Genetisch (SNPs, lesies). Fysiologisch hogere genexpressie na maaltijd, nuchter gaan sommige genen omhoog en andere omlaag. Geldt ook voor dag-nachtritme (effect op 40% v genexpressie). Metabolisch (net gegeten bijv.) Experimentele variatie (groot, maar niet interessant) ene dag is de andere niet. Celtype-specifiek Deze effecten moet je er dus uit zien te filteren als je wil kijken naar verschillen in genexpressie tussen chromosomen. Model: zie de cel als een groot regelpaneel met knopjes die genexpressie aansturen: zijn hoger of lager te zitten. Als knopje 1 omhoog gezet wordt gaat genexpressie van bepaalde genen omhoog of juist omlaag. Hoeveel “knopjes” zijn er? Hoe zijn ze verbonden met genen en wat voor invloed hebben ze? Voor elk “knopje” de stand berekenen en dan terugdraaien naar 0 betrokken genen worden ook naar 0 gedraaid. Zo ook variatie in genexpressie door dag-nachtritme of experimentele/fysiologische effecten weggenomen. Experiment opnieuw nu wel variatie in genexpressie te zien! Toe te schrijven aan amplificatie van genen. Duidelijk downstream consequenties te zien op genexpressie. Grote overlap tussen daadwerkelijke DNA-amplificaties en genexpressie. Eerst niet te zien vanwege ruis. Publieke dataset samples van 16,000 tumoren te identificeren aan de hand v genexpressieprofielen. Onderliggende lesies/amplificaties e.d. dus al bekend. Bepaalde tumoren zijn enorm genomisch instabiel erg agressieve kankers. Tumorcellen gaan niet dood door defecte DNA-reparatieroutes of fouten in DNA wat herstelt de balans met genomische instabiliteit? Hoge genomische instabiliteit welke genen betrokken? Waarschijnlijk te maken met herstel v/d balans. Bepaald gen altijd geamplificeerd in zo’n tumor; kan nodig zijn om überhaupt te overleven met genomische instabiliteit. Tumorsamples: voor elk gen berekend wat correlatie met genomische instabiliteit is. Therapie kan dan aangrijpen op die genen p53 meest gemuteerd in elke tumor. Hoorcollege biologie van kanker – 24-03-2013 – van Vugt Hoofdstuk 8 Celcyclus klok: houdt de cel in rust (G0), of kan het laten beginnen met celcyclus. Heeft externe signalen nodig die de klok aan/uit kunnen zetten: Groeifactoren wanneer groei nodig is. Genoom integriteit monitoren bij veel schade, geen celdeling. TGF-β receptoren geven signaal om niet te delen. Integrines kunnen voelen of er contact is met buurtcellen: te druk is geen deling. Metabolisme sensoren negatief signaal bij slechte omstandigheden voor deling. Verder zijn er veel regulatoire stappen tussen G1 en M. Celcyclus: vanuit G0 G1 S G2 M(itose). G1 fase: cellen groeien, worden gezond genoeg om te delen. Restrictiepunt (R-point): beslissend moment of cellen wel/niet de cyclus ingaan. S-fase: genoom replicatie. G2-fase: cellen bereiden voor op deling. M-fase: deling van de cel en genoom in 2 dochtercellen. Het doel v/d celcyclus is gelijke verdeling van genomisch materiaal over 2 dochtercellen. Ideale situatie: 2n (replicatie): 4n 2 dochtercellen met 2n. In afwijkende situatie leidt bijv. dubbele replicatie tot 2 dochtercellen met 4n of is er dubbele mitose met daardoor 4 dochtercellen met 1n. Toch gaat het vaak goed door veiligheidsmechanismen, en zijn er bijv. ook geen shortcuts van M G2 of naar G1 zonder mitose. Cycline betrokken bij celcyclusregulatie. Bij mitose wordt cycline snel afgebroken en komt weer langzaam op bij volgende S-fase. Er is een kinase dat cyclines bindt: Cyclin-dependent kinase (Cdk). Cyclines zijn niet altijd aanwezig, Cdk’s daarentegen wel. Cdk is dus een kinase (enzym): deze is alleen actief in complex met cyclines. Cycline-Cdk voorkomt replicatie: doordat complexen in G2 opkomen (aan einde S-fase), kan het genoom niet repliceren na de S-fase. Zonder cycline-Cdk ook geen mitose in G1 geen cycline, dus nooit een shortcut naar M, zonder langs S en G2 te gaan. Celcyclus altijd in de juiste volgorde! Cycline-Cdk regulatie: 1. Cdk begint met 2 remmende fosforgroepen; daarna cyclineproductie. 2. Cycline bindt aan Cdk, Cdk wordt gefosforyleerd (activerend). 3. Cycline fosforylatie (activerend). 4. Complex gaat naar de kern v/d cel. 5. Remmende fosforgroepen worden van Cdk gehaald actief complex. Hierna zijn 2 mogelijkheden: (6) een remmer bindt: CKI (Cdk-inhibitor) complex raakt inactief en werkt niet meer of (7) cycline degradatie geen werkend complex meer. Cycline-Cdk wordt in het cytoplasma geproduceerd en moet actief naar de kern worden getransporteerd. Eenvoudige organismen hebben maar één type cycline en Cdk (goed modelorganisme), mensen hebben er meer: Cycline B Nuclear D1 Cycline E Cycline A Elke celcyclusfase heeft een eigen profiel van cycline-activiteit: Het begint met Cdk4/6 gebonden aan Cycline D cycline E-Cdk2 cycline A-Cdk2 cyclineA-Cdk1 (Cdc2). De laatste bepaalt mitose. Restrictiepunt (R-point) “point of no return”: na dit punt is terugkeer onmogelijk, cel moet de hele celcyclus doorgaan. Vóór het R-point zijn cellen gevoelig voor groeifactoren en TGF-β. Op R-point wordt eerst Cdk4/6 geactiveerd daarna progressie door cyclus. Groeifactoren hebben dus invloed op Cdk4/6; worden gebonden door cycline D. Cycline D productie is de key tot activatie v/d celcyclus. Productie is te beïnvloeden door verschillende externe signalen: Groeifactoren binden tyrosine kinasereceptoren, via Ras-pathway MAPK; kan ook via binden aan HER2/Neu. ECM integrines zorgen voor activatie Ras-pathway MAPK. Cytokines binden cytokinereceptor en activeren zo Jak-STAT pathway. Ontwikkeling Wnt-factoren activeren Frizzled en zorgen voor cycline D-productie via β-catenine. Immuuncellen reageren op cytokines via andere receptoren: effect is wel hetzelfde; cycline D productie. Hedgehog (embryogenese) werkt via Pathed en Smoothened ook op cycline D productie. VB – stimuleren macrofagen met CSF1 hormoon (GF) na 2 uur hoge cycline D1 productie. Te zien door hoge aanwezigheid cycline D1 mRNA. Na de R-point is de celcyclus autonoom er is cascade van reacties die elkaar activeren, voornamelijk via cycline-productie. Geen externe signalen meer nodig. Er is nog wel regulatie, bijv. door CDK remmers. Bij kanker vaak problemen met veiligheidsmechanismen. Regulatie celcyclus CDK remmers (CKIs): INK4 eiwitten; genen p16 t/m p19: remmen Cdk4/6. p21, p27, p57: remmen alle andere Cdks. Remming gebeurt door sterische hinder. E2F transcriptiefactoren 8-tal transcriptiefactoren die promotorregio binden van genen die nodig zijn voor celdeling. 1, 2 3 werken stimulerend, 4-8 remmend. Bij grote aanwezigheid van deze TFs willen cellen graag delen: gevaarlijk om altijd aan te houden. pRb binden deze TFs en remmen het hiermee. pRb remt dus celdeling. Rb wordt gefosforyleerd door actieve cycline-Cdk4/6 complexen: eerst is er hypofosforylatie (1 fosforgroep bindt nog steeds E2F). Vervolgens een beetje E-Cdk2 activiteit; zorgen voor hyperfosforylatie van Rb: geen E2F binding meer, E2F wordt actief en zet genen aan die zorgen voor benodigde eiwitten voor de celcyclus. Dus: G1 Rb hypofosforylatie. Laat G1 (rond R-point) Rb hyperfosforylatie; geen E2F binding meer. S-fase E2F afgebroken. Cycline-Cdk’s zijn nodig voor hyperfosforylatie: E2F valt eraf en wordt actief: ze zorgen zelf voor nieuwe cyclineproductie die Cdk’s kunnen binden meer cycline-Cdk complexen: amplificatieloop: je kunt dus niet net over de R-point en dan weer terug: point of no return. Andere amplificatieloop beetje Cdk-activiteit zorgt voor fosforylatie van p27: herkenningsteken voor ubiquitine ligase, dus die zet ubiquitine op p27: “moleculaire barcode” dat aangeeft dat cel afgebroken moet worden proteasoom actief: p27 afgebroken. Hierdoor worden Cdk’s actief omdat remming op Cdk’s wegvalt; dit herhaalt zich (amplificatie). Beetje actief Cdk zorgt er dus voor dat remmer wordt afgebroken, en signaal versterkt wordt. Kankers R-point kritiek moment; op genetisch niveau veel veranderingen rond R-point. Veel gemuteerde genen waardoor ze inactief of hyperactief (door amplificatie) worden, wat leidt tot vernaderingen in de routes. Bijv. meer Cdk4/6 meer uitschakeling Rb meer cellen in celcyclus. Key concepts: Celcyclus is geordende volgorde van celcyclus fases. Gereguleerd door Cycline-Cdk complexen. Cycline-Cdk’s zijn sterk gereguleerd. Cycline D is de 1e cycline die de celcyclus start. Na R-point celcyclus kan niet meer terug. Rb (retinoblastoma) 1 zorgt dat de celcyclus niet zomaar vanzelf start. Veel oncogenen/TSGs in deze pathway. Hoofdstuk 10 Cellen kunnen niet eeuwig delen. Senescence na een aantal delingen gaan cellen in permanent arrest. Cellen zijn te zien met een beta galactosidase assay kijken of beta galactosidase wordt geknipt; blauw weergegeven in assay. Blauwkeuring geeft senescence weer. In dit soort assays zijn zulke cellen te zien aan groter cytoplasma. Er zijn weinig cycline-Cdk’s bij cellen in senescence remmers van Cdk (p21, p16) allebei heel hoog na 43 celdelingen (PD): 100% v/d lifespan. p16 is lid van INK4-familie, p21 hoort bij een ander soort remmers. Senescence ook te vinden in vivo proces blijkt te versnellen door stress: DNA schade Oxidatieve schade (20% vs. 3% O2) Defecten in DNA repair Telomeren bepalen de beperkte hoeveelheid celdelingen. Bij elke deling wordt het telomeer DNA korter: na een tijd zo kort dat het een signaal afgeeft dat deling niet meer veilig is (crisis). Bestaat uit duizenden TTAGGG-repeats in eukaryoten. Telomeren worden korter bij deling tijdens replicatie maakt DNA helicase het DNA open: resulteert in een leading en lagging strand. Aan lagging wordt een stukje DNA gemaakt waarvoor een primer nodig is: aan het eind is de strand te kort primer valt eraf (polymerase is groot). Kan geen DNA meer geproduceerd worden zonder primer, dus wordt het laatste stuk overgeslagen. Na x aantal delingen te kort voor normale functie: geen beschermend DNA-einde meer. Wordt herkend als “breuk” en dus gerepareerd: fusie van chromatide-einden waardoor chromatiden niet te scheiden zijn in celdeling worden uit elkaar getrokken: random breuk wat nieuwe situatie genereert opnieuw reparatie fusion-breakage-fusion-cycles. Resultaat: chromosomale deleties en amplificaties. Telomeren worden normaliter niet herkend als breuk: komt doordat er een lus aan het einde zit. Korte telomeren hebben te weinig lengte voor een lus. Repeat is G-rich (TTAGGG), complementair stuk is Crich (AATCCC): single strand blijft over overhang van G-rich strand zorgt voor een loop die terugkeert naar eigen chromosoom (t-loop). Er is ook een displacement (D-) loop. Voor vorming v/d loop zijn verschillende eiwitten nodig: deze eiwitten herkennen en binden telomeer repeats. Begint met TRF1 en -2 die nucleotiden kunnen herkennen en direct kunnen binden; zitten alleen op telomeren. Halen andere eiwitten erbij die het DNA in een loop trekken. Kankercellen kunnen vaker delen dan normale cellen: telomeren worden langer gemaakt m.b.v. het eiwit hTERT telomerase enzym bestaande uit DNA polymerase en een RNA template. Is eigenlijk een “stukje telomeer”; kan repeats toevoegen aan DNA uiteinde. Bindt het laatste stukje telomeer met binder en verlengt het hiermee. Niet aanwezig in humane weefsels, behalve stamcellen en embryonale cellen. Toevoegen hTERT aan normale cellen meten polymerase-activiteit (TRAP assay): hoge activiteit. Truc waarbij overexpressie van een eiwit leidt tot omzeilen senescence. Gebeurt veel in kankers. Key concepts: Telomeren worden elke deling korter. Te korte telomeren stoppen celgroei. Telomeren worden opgevouwen in T-loops. Tumoren kunnen oneindig delen door hogere expressie telomerase. Hoofdstuk 12 DNA schade is de directe oorzaak van kankerontwikkeling, maar wordt ook gebruikt voor behandeling van kanker (chemo-/radiotherapie). Doel is zoveel mogelijk schade in tumorcellen. DNA-schade in gezond weefsel zorgt voor bijwerkingen van therapie. Oorzaken DNA-schade: Intrinsiek replicatie: inserties, deleties, mismatches. Extrinsiek zonlicht, straling, chemicaliën en chemotherapie. Chemische stoffen kunnen ook kanker induceren: carcinogenen: zijn onder te verdelen; Genotoxisch: induceren DNA-schade. - Direct acting carcinogens zijn in een “potje” al DNA beschadigend; intrinsieke activiteit. - Indirect acting carcinogens pas DNA beschadigend als ze ingenomen worden en in maag-/darmkanaal komen: moeten geactiveerd worden. Niet-genotoxisch: induceren geen DNA-schade. Sigarettenrook bevat >60 carcinogenen, veel genotoxische stoffen. Draagt bij aan 8090% van alle gevallen longkanker. Gezond houden DNA: Organisatie v/h lichaam DNA reparatie Organisatie v/h lichaam opbouw van organen begint met stamcellen: delen weinig, kunnen veranderen in alle celtypen. DNA schade komt door veel celdelingen (veel fouten); weinig celdelingen zorgt dus voor bescherming. Stamcellen zitten zo ver mogelijk van toxische stoffen. Stamcellen (1) transit amplifying cells: delen vaak; mogen in apoptose, want worden weer aangevuld en (2) gedifferentieerde cellen; delen niet, komen in contact met toxische stoffen. Darm: vili steken uit naar lumen v/d darm. Epitheel en vili komen in contact met langskomende stoffen (ook toxisch!). Gedifferentieerde cellen zitten dus bovenaan mogen verloren gaan. Diep in de darm zitten transit amplifying cells delen vaker, verder van toxische stoffen. Helemaal onderaan stamcellen vullen andere cellen aan; hier schade = gevaarlijk! DNA reparatie veel soorten schade, elk eigen soort repairmechanism: Mismatch repair herstellen replicatiefouten (mismatch). Replicatievork: DNA-strengen uit elkaar getrokken, polymerase zorgt voor nieuwe basen eraan. Wanneer een verkeerde match wordt gemaakt, bijv. T-C (mismatch) is reparatie nodig anders in volgende ronde een normaal lijkende sequentie maar met één puntmutatie: moet je voorkomen!!! Reparatie G-C was origineel, is T-C van gemaakt. Als je nu de C vervangt door een A in repairmechanisme krijg je 2 gemuteerde strands situatie is erger geworden: 2 dochtercellen met mutatie. Moet dus bekend zijn welke v/d 2 basen fout was DNA polymerase legt nieuw basen op oud DNA; door eraf vallen van polymerases ontstaan kleine openingen (nicks), zijn later ligases voor. Nicks onderscheid tussen oude en nieuwe strand: baseparen van nieuwe strand worden eruit geknipt en later opnieuw opgevuld. Repair: (1) m.b.v nicks herkenning van nieuwe strand; (2) basen rondom mismatch worden verwijderd; (3) opvulling “gat” in nieuwe strand. MutSα herkent DNA dat beetje openstaat: MutLα gaat in buurt op zoek en vindt opengemaakt DNA. Zorgt dat DNA rondom de ‘nick’ in loop komt en eruit wordt geknipt. Als nicks binnen seconden opgevuld worden, weet je niet wat nieuwe / oude strand was: systeem moet snel genoeg zijn om mismatch op tijd te vinden. Dubbelstrengs repair twee mechanismen bij toxische soort schade: - Non-homologe end joining (G1, NHEJ) - Homologe recombinatie (S t/m M, HR) Non-homologe end joining (G1) einden van de chromatiden worden bij elkaar gebracht. Tussen nucleotiden zitten fosforgroepen. Als overhang niet gelijk is kun je ze niet zomaar aan elkaar plakken: Overhang is niet gelijk, stukje is afgebroken mechanisme: (1) extra fosforgroep eraan plakken (bovenste strand), (2) base-verwijdering en (3) plakken. Wel mist een nucleotide: sequentie klopt niet meer in intron geen probleem, in exon wel. Mechanisme is non-homoloog (geen referentiesequentie), niet conservatief (niet behoudend sequentie verandert) met base loss mutatie. Simpelste soort DNA repair bij ds breuken. Homologe recombinatie (S t/m M) je zit al voorbij replicatie, dus ander zusterchromatide ligt naast de gebroken streng. Sequentie is identiek intacte streng opengemaakt (m.b.v. helicase): kapotte streng invaseert m.b.v. polymerase worden hele stukken DNA gekopieerd nieuwe stukken DNA in de kapotte streng gezet en aan elkaar geplakt. Het is semi-conservatief (uitwisseling geen mutaties). HR (voorbij G1-fase) error-free. NHEJ (in G1-fase) error-prone. In kankers wordt DNA niet gerepareerd eiwitcomplex betrokken (Mre11, Rad50, Nbs1). Eiwitcomplex herkent ds breuken: kinase wordt geactiveerd (ATM) kan veel eiwitten activeren en zorgen voor verschillende effecten: Celcyclus arrest (p21, p53, Chk2) DNA reparative (BRCA2, BRCA1, FANCD2) Apoptose (PUMA, Noxa, p53) Activatie van deze eiwitten is gemuteerd in veel ziektes: bijv. ATM (Ataxia Telanciestasia of Louis-Bar syndroom). Beide kopieën van ATM-gen zijn gemuteerd. Zorgt voor toenemende moeite met coördinatie van beweging (ataxie) en clusters van vergrote bloedvaten (telanciestasia). Zorgt voor een verhoogde kans op kanker: 40% kans op kanker voor hun 20e vooral lymfomen/leukemieën. Mutaties eerste eiwitcomplex: Mre11 ziekte lijkt op ATM, maar is milder (ATLD). Beide kopieën Mre11 gemuteerd. Nbs1 ook beide kopieën gemuteerd. Sterke kans op ontwikkeling lymfomen; niet teveel bestraling nodig, want dan valt het lichaam uit elkaar. Mutatie reparatiemechanismen: mutatie in Brca1/-2 hoeft maar één kopie te zijn! Een dubbele mutatie hierin is lethaal. Hoge kans op kankerontwikkeling: Karakteristieken DNA repair: Extreem gevoelig voor bestraling Aanleg voor verschillende kankertypes Laat het belang van onderhouden van DNA zien om ons gezond te houden Er is dus een sterke link tussen DNA schade voor kanker: bij schade worden eiwitten geactiveerd (ATM, Brca) cellen stoppen met delen, DNA repairmechanismen worden actief en bij teveel schade wordt apoptose geïnduceerd. PARP1 gen dat nodig is voor reparatiemechanisme wanneer een base niet helemaal klopt en de goede wordt teruggezet. PARP1 knipt slechte base eruit: maakt lange ribosestrengen die ervoor zorgen dat juiste enzymen actief worden. PARP-inhibitor zorgt voor niet-gerepareerde ss breuk (één base kapot). Remmen PARP in delende cellen template streng veroorzaakt een ds breuk: een relatief onbelangrijk gen (PARP) zorgt in inactieve staat dus voor ds breuk in delende cellen. Kankerpatiënten naast normale cellen delen tumorcellen vaak: veel mutaties in tumorcellen, dus in tumorcellen goede repair ds breuk is toxisch maar wordt in tumorcellen niet gerepareerd! Wt-cel (Brca +/+) cellen krijgen pas last van toxische stof op hoge concentratie. Brca +/- iets sneller last, maar scheelt niet veel. Brca -/- snel last: PARP inhibitor geeft bij lage concentraties toxische stof al ss breuken, bij delende cellen omgezet in ds breuken. PARP1-remming is zeer toxisch in Brca1/2 mutant tumoren. Dit heet synthetic lethality cellen pas dood bij uitschakelen beide allelen. Key concepts: DNA wordt gezond gehouden door organisatie v/h lichaam en door DNA repair. Verschillende soorten DNA schade hebben eigen soort repair. Soms foutloos (HR), soms met fouten (NHEJ). Defecten in DNA repair geeft verhoogde kans op kanker. Biedt ook mogelijkheden voor gerichte kankerbehandeling. Hoorcollege biologie van kanker – 26-03-2014 – Terwisscha van Scheltinga Moleculaire imaging = visualisatie, karakterisatie en meting van biologische processen op moleculaire en cellulaire niveaus in mensen en andere organismen. Verschillende vormen: Anatomische imaging grootte, vorm, dichtheid, bijv. met CT, MRI en mammografie; bijv. tumorrespons op verandering van grootte. Moleculaire imaging tumorbiologie in vivo, bijv. met PET, SPECT en MRI; bijv. tumorrespons op veranderingen in moleculaire processen: therapie effectief? Moleculaire imaging targets bij bekijken van tumoren zijn bijv. celmembraanreceptoren (HER2, VEGF receptoren) te targeten met Ab’s. Ab’s remmen één v/d receptoren; werken nl. als antagonist. Kunnen niet zomaar door membranen, dus targeten alleen receptoren op het membraan. Ook groeifactoren zijn te visualiseren: VEGF (uitgescheiden door tumor). Liganden: Radioactiviteit (PET, SPECT) Fluorescentie (optische imaging) Contrastvloeistof (MRI) SPECT gebruik van gammastraling die gemetne wordt. Tracer injectie: verdeelt zich over het lichaam en gaat bijv. naar de tumor. Camera draait om de patiënt. Vanuit verschillende vlakken kleine beeldjes, samen een 3D-beeld. PET ook gebruik v/e tracer. Positron-uitstralende isotopen worden gebruikt die elektronen vinden: 2 fotonen worden in tegengestelde richting uitgezonden gemeten door de camera. Worden tegelijk uitgezonden, dus is te herleiden waar ze vandaan kwamen. Radioactieve deeltjes hebben korte halfwaardetijd radioactiviteit moet gemaakt worden ter plekke! SPECT Gamma-uitstralende epitopen (111In, 99mTc, 123/125I) Medium ruimtelijke resolutie Semikwantitatief Achtergrondproblemen Relatief goedkoop PET Positron-uitstralende isotopen (18F, 11C, 15O, 64Cu, 89Zr) Hoge ruimtelijke resolutie Kwantitatief Hoog signaal t.o.v. ruis Duur (door cyclotron) 18 F gebruikt voor tumormetabolisme door te labelen aan fluorodeoxyglucose (FDG). Is een glucose analoog en visualiseert dus glucose metabolisme: vaak toegenomen in tumorcellen. FLT (fluorothymidine) ook vaak gebruikt met 18F pyrimidine analoog: opname geeft proliferatie van tumorcellen weer. Monoklonale Ab’s Ab’s met hoogspecifieke targetherkenning en –binding. Lange halfwaardetijd: halfwaardetijd geeft hier tijd waarin helft v/d targets is gebonden aan. Hierdoor radioactieve isotoop nodig met ook lange halfwaardetijd paar geschikte isotopen, bijv. 111ln (68 uur) en 89Zr (78 uur). Imaging met Ab’s zorgt voor (1) informatie over de Ab’s (farmacokinetiek in bloed, orgaandistributie, targetorgaan/tumor accumulatie) en (2) informatie over het target v/d Ab (targetexpressie in alle lesies, verzadiging v/d target door de Ab, targetexpressie modulatie door Ab/andere drugs). Personalized medicine: verschillen in dosering, andere toedieningsmethode? 89 Zr labeling methode: (1) Chelatie: binden van een chelaat aan de Ab. Chelaat is kleiner dan het Ab, dus eigenschappen worden zo min mogelijk of niet veranderd. (2) Radiolabeling: 89Zr wordt gekoppeld aan het chelaat: bindt aan lysine. Chelaat mag niet het Ag-bindend deel binden! Dan verandert functie v/d Ab. HER2-receptor: Human Epidermal Growth Factor receptor 2. Betrokken bij celoverleving en anti-apoptotische pathways, proliferatie, maturatie, metastase en angiogenese. Overexpressie in 25% v/d borstkankerpatiënten. Bindt aan Trastuzimab kan worden gevisualiseerd; metastases ook zo zichtbaar te maken. Therapieën gericht tegen HER2receptor zijn zo ook te imagen. Ab bindt aan receptor: receptor zorgt voor internalisatie (opname): Ab komt in de tumorcel. Belangrijk eigenschap van Zr is dat het niet uitgescheiden kan worden, dus blijft in de tumorcel. Al het Zr dat naar de tumor is gebracht wordt gemeten hoeveel v/d drug komt in de tumor? Patiëntentesting doel is: kijken of het werkt: gaat het naar de tumor, is het visualiseerbaar? Lage dosis alleen zichtbaar in maag-/darmkanaal. Hoge dosis antilichaam verdeelt zich over het lichaam: grote vaten goed zichtbaar en het hart (het zit goed in het bloed). Hoe later je scant, hoe minder in het bloed en hoe meer in bepaalde lesies. HSP90 moleculaire chaperone, belangrijk voor instandhouding eiwitten en vorming van die eiwitten: Behoudt angiogenese Zorgt voor zelf-voorziening in groeisignalen O.a. VEGF en HER2 zijn afhankelijk van HSP90. Dus: remming HSP90 = remming van die receptoren. MicroPET imaging (muis) in verloop van tijd neemt relatieve opname van 89Zr bevacizumab op in de tumor v/d muis. Het grootste deel van de tracer blijft ook in de buurt v/d tumor; vooral rondom tumorcellen, niet in de tumor zelf. Na verloop van tijd pas optimale opname v/d Ab. VGEF-gestuurde therapie HSP90 remming minder VEGF productie mTOR remming downregulatie VEGF Sunitinib upregulatie VEGF Optische imaging gebruik van licht; gelimiteerde penetratie van weefsels en dergelijke. Hiervoor zijn dus nieuwe tracers en verbeterde detectieapparatuur nodig. Optische fluorescente imaging elektronen worden in hogere toestand aangeslagen en vallen terug naar grondtoestand: hierbij stralen ze fotonen uit met hogere golflengte (emissie). Dit wordt geanalyseerd en gedetecteerd met een machine met 3 camera’s tegelijk. Probleem is dat licht geabsorbeerd wordt niet alle organen te visualiseren; daarom rood licht: hogere golflengte = grotere penetratie door weefsels. Fluorescentie geeft alleen lokaal beeldvorming: geen 3D; niet verder kijken dan paar cm. Je gebruikt dus intra-operatieve beeldvorming chirurg visualiseert tumor tijdens operatie en kijkt of het positieve snijranden heeft (dat tumor weer kan teruggroeien of er positieve lymfeklieren zijn; eerst punt v uitzaaiing). Tijdens endoscopie ook tumoren visualiseren. Dual imaging: optisch (licht) + fluorescentie (89Zr): Op de scans zie je ook zichtbaar kleine lesies: techniek is dus gevoelig genoeg om met klein beetje tracer het zichtbaar te maken. Kleine lesies zijn fluorescent ook te imagen. Key concepts: Introductie in moleculaire imaging 2 voorbeelden van Ab-imaging: o HER2 imaging met Trastuzumab o VEGF imaging met Bevacizumab 89 Zr imaging Optische imaging Hoorcollege biologie van kanker – 26-03-2014 – Wisman Hoofdstuk 1 Epigenetica = studie van erfelijke verandering in genfunctie zonder verandering in DNAsequentie; regulatie van genexpressie. Histonmodificatie DNA methylatie Nucleosoom remodeling miRNA Er moet een grote hoeveelheid DNA verpakt worden in een cel: daarom is er gecondenseerde structuur van chromosomen in de cel. DNA is omwikkeld om histonen (eiwitten) zorgen voor makkelijke verpakking van DNA. Histonmodificatie Deacetylatie Methylatie Fosforylatie Ubiquitinilatie Elke omwikkeling van DNA zit om 8 histonen heen met staarten kunnen worden gemodificeerd. Modificaties zorgen ervoor dat op die plekken een open of juist dichte chromatinestructuur is: open/dicht voor gentranscriptie. Zo is in bepaalde weefseltype genexpressie wel/niet actief. Writers voeren modificatie uit op verschillende aminozuren v/h eiwit: kunnen ervoor zorgen dat een gen uit/aan komt te staan. Markers worden herkend door readers (nucleosoom remodeling complexen); dragen bij aan genexpressie. Erasers verwijderen de markers van writers. Aanzetten histone methyl transferase writers. Uitzetten histone demethylase erasers. DNA methylatie aanzetten methylgroep op 5e positie van cytosine (C). Vindt alleen plaats bij C die voorafgegaan wordt door G CpG dinucleotiden. Een C tussen twee T’s kan niet gemethyleerd worden. Methylatie gebeurd door DNA methyl transferases (DNMTs); 3 sooten: De novo methylatie door DNMT-3a en DNMT-3b. Maintenance door DNMT-1. CpG dinucleotiden zitten vaak in clusters CpG eilanden: Regio van tenminste 200 bp. Een G-C percentage van >50%. CpG-ratio observed-expected > 0.6 Als alle C’s in een CpG eiland gemethyleerd worden resulteert dit in gene silencing. DNMT-1 zorgt voor maintenance methylatie. Tijdens replicatie scheiden twee gemethyleerde strengen: vorming van complementaire strengen, maar nog niet gemethyleerd: dit gebeurt door DNMT-1; methyleert de nieuwe strengen. Carcinogenese upregulatie DNMT-3b. Naarmate de ontwikkeling van kanker vordert wordt DNMT-3b meer up gereguleerd. Zorgt ervoor dat er meer de novo DNA methylatie plaatsvindt. Normale cel: methylatie begint in promotorregio waar transcriptie bindt. Zgn. monitoren (wit) zijn niet gemethyleerd. Histonmodificaties zijn zodanig dat gemodificeerde staarten euchromatinestructuur vormen zodat transcriptie kan plaatsvinden. Kankercel: TSGs raken gemethyleerd: histonmodificaties veranderd zodat de structuur dicht is; geen transcriptie TSGs meer (werking valt weg). CpG eilanden worden gemethyleerd en gehypermethyleerd, losse CpGs worden gedemethyleerd. Meer open chromatinestructuur meer oncogenen tot expressie. Cervix carcinogenese basale laag met cellen die kunnen delen rijpen uit naar boven toe. Als HPV geïntegreerd is in DNA kan het ervoor zorgen dat celcyclus niet meer goed gereguleerd is verandering in normale cellen: meer dysplastisch, meer carcinogeen. CIN-klassificatie hoger is meer maligne: CIN1 is nog premaligne: als 1/3 v/d laag dysplastisch is (CN1). Daarna CIN2, CIN3 en echt maligne bij CA dysplastische cellen dringen door lagen heen. Naarmate carcinogeniteit toeneemt, neemt gemethyleerd cytosine af (5mC). CpG-eilanden methylatie neemt wel toe. Actieve demethylatie door TET-enzymen (1, 2 en 3), maar ook door TDG. DNMT zet een methylgroep aan C: TET-enzymen zetten 5mC om in een 5hydroxymethylatie C, daarna in 5fC en daarna in 5caC. Daarna omzetting door TDG. Hierdoor gaat BER (repairmechanisme) aan en zorgt ervoor dat C wordt omgezet in een normale, niet-gemethyleerde C. Gemethyleerde C kan er ook worden afgeknipt gevaarlijk, leidt tot mutaties. In kankers ook mutaties in enzymen die methyleren. Methylatie-specifieke PCR er wordt gebruik gemaakt van een bisulfiet behandeling: gemethyleerde C’s zijn hier beschermd tegen, dus blijven een C. Niet-gemethyleerde C’s worden hiermee omgezet in U(racil), met PCR afgelezen als T: dus PCR conversie van C T. Primers die passen op CpGs tonen dus specifiek gemethyleerd of nietgemethyleerd DNA aan. Kan later misschien gebruikt worden als diagnostische tool. Streepjes geven CpGs weer op het gen. Gekeken naar methylatie dit gen is in tumoren in hele promotorregio gemethyleerd. Normaal weefsel aanliggend aan tumor heeft ook veel methylatie. Dit is histologisch niet te zien. Sequencing geeft dus extra informatie. DNA v/d controlegroep is dus geheel ongemethyleerd. PAP-klassificatie geeft ook carcinogeniteit aan. Pap V komt overeen met carcinoom. PAP I is normaal. Epigenetische therapie invloed op allerlei effecten van epigenetica: Stamcelachtig gedrag ↓ Weerstand tegen chemotherapie ↓ Immuunresponsen ↑ Metastase of EMT ↓ Celproliferatie en –overleving ↓ Apoptose of gevoeligheid voor chemotherapie ↑ MGMT: gen als dit gen gemethyleerd is speelt het een rol in glioblastomas. Normaliter worden deze patiënten behandeld met radiotherapie; actief gen zorgt ervoor dat Temozolomide wordt omgezet en niet meer kan functioneren als anti-tumor agent. Key concepts: DNA promotor hypermethylatie resulteert in transcriptionele silencing. TSGs zijn vaak aangetast in epigenetische regulatie. Tijdens carcinogenese ontstaat er meer DNA promotor hypermethylatie van TSGs. Histonmodificatie/DNA methylatie is reversibel. DNA methylatie kan gebruikt worden als diagnostische marker. Hoorcollege biologie van kanker – 27-03-2014 – de Jong Resistentie tegen chemo is belangrijk. Komt vaak voor dat tumor weer uitgroeit na kuur, waarna nieuwe therapie nodig is omdat de cellen resistent zijn geworden. Tumoren kunnen ook onder detectieniveau komen en daardoor ineens uitgroeien. Als tumor terugkeert binnen aantal maanden vaak sprake van resistentie. Chemotherapie wel levensverlengend bij uitzaaiingen, bijv. leukemie, multiple myeloma, niet-kleincellige longkanker, eierstok- of darmkanker. Chemotherapie grijpt vooral aan op toegenomen proliferatie van tumorcellen: door optreden van spontane mutaties kunnen paar cellen niet meer gevoelig zijn voor de therapie. p53 belangrijk voor respons; integreert verschillende signalen als DNA-schade, waarna groeiarrest kan optreden (inductie p21) of apoptose door aanzetten apoptosegenen. p53 vaak gemuteerd in kankers; route door DNA schade (chemo) werkt in kankercellen al überhaupt al niet meer goed: reageert niet zo snel op trigger als DNA schade. HPV E6 remt p53: niet meer functioneel; ook in baarmoederhalskanker werkt p53 dus niet. Ideale targets voor targeted therapie: Aanwezig in meeste patiënten met bepaalde ziekte. Speelt cruciale rol in ontwikkeling v/d afwijking. Unieke activiteit (1) waar ziekte van afhankelijk is en (2) die vervangbaar is in normale cellen. Oncogenen (bijv. Ras, Src). Tumoren staan niet op zichzelf: heterotypische structuur. Tumor bestaat uit allerlei celtypen, is dus moeilijk aan te passen. Begrijpen van interacties is dus handig voor ontwikkeling van nieuwe middelen. Stromale cellen gaan ook een interactie aan met tumorcellen scheiden factoren uit dat tumorcellen stimuleert te delen. Interacties tussen epitheelcellen en andere celtypen komt ook veel voor: receptor- en ligand-interactie is gemedieerd voorbeeld: PDGF-A positieve epitheliale cellen en PDGFR-A positieve mesenchymale cellen: Basalcelcarcinoma tumor transplanteren van arm naar rug zonder stromacellen. Blijkt dat tumor ook effectiever groeit met stromale cellen: omgeving is nodig Normale epitheliale borstcellen transformeren met virus (SV40 groei): tumor groeit langzaam als ie gewoon ingespoten wordt: + fibroblasten (factoren die uitgescheiden worden) snellere groei. + Matrigel (ECM gemaakt door muizen sarcomacellen) snellere groei. Deze factoren zorgen voor groter tumorvolume na bepaalde tijd. Borstkankermetastases passen zich geheel aan aan het orgaan waar het zich dan bevindt. Darmkankers doen dit niet en behouden structuur. Small molecules eindigen op –nib en antilichamen op –mab. Ideale targets voor moleculaire therapie zijn uiteraard de hallmarks of cancer: Target Specificiteit Binding Dosis Weefseldistributie Toxiciteit ADCC Locatie Halfwaardetijd Small molecule Tyrosine kinase domein +++ Meeste snel reversibel Oraal, dagelijks Compleet Uitslag, diarree, pulmonair Nee Intracellulair t1/2 serum kort Antilichaam Receptor ectodomein ++++ Receptorinternalisering Intraveneus, wekelijks Minder compleet Uitslag, allergie Mogelijk Extracellulair t1/2 serum lang Testen nieuwe drugs (fase 1-3): na muistesten blijven aantal varianten over: (1) Maximaal Tolereerbare Dosis (MTD) inspuiten dosis bij 3 patiënten, bij geen toxiciteit verhoging van dosis, enzovoorts. (2) Welk tumortype/welk stadium waarvoor drug gebruiken? (3) Vergelijken met andere (standaard)therapieën beter dan standaardtherapie? Bij kanker slechte groep waar je op test: het gaat om voorbehandelde patiënten altijd beetje effectiviteit. Daarom worden kankerdrugs snel geregistreerd. Gleevec Imatinib mesylate. Het is een kinaseremmer van verschillende kinases als Abl, Bcr-Abl, PDGFR en c-Kit en heeft daarom een rol bij verschillende tumoren. Bcr-Abl heel actief fusie-eiwit door translocatie op chromosomen 9 en 22. Gleevec grijpt aan op actieve loop. M.b.v. eiwitkristallen is een drug ontworpen die zo in het molecuul zit dat ATP niet meer kan binden en er geen downstream fosforylatie is. Gleevec is een remmer en ook al gaan er wel (veel) cellen dood, de tumor blijft aanwezig. Dankzij mutaties in Bcr-Abl werkt Gleevec (imatinib) niet meer: een ander middel, Ponatinib werkt echter nog wel. Belangrijk moet je zodra je eerste mutaties detecteert in het bloed overschakelen naar andere middelen? HER-familie : niet actief als receptor, moeten nl. dimeriseren met eigen broertje of ander familielid van HER-receptoren. Als een ligand bindt worden tyrosine kinasedomeinen actief. Kinases vaak gemuteerd in kankers ligand niet meer nodig, pathway altijd hard aan. Tyrosine kinaseremmers grijpen hierop aan. TKIs zijn gericht tegen gemuteerde leden v/d HER-familie, bijv. EGFR. Iressa en Tarceva zijn voorbeelden van small molecules die fungeren als remmer van tyrosine kinasedomeinen (TKIs): blokkeren actieve eiwitten waardoor de cel stopt met delen en groeien. Toxiciteit/effect op de huid is voorspeller van effectiviteit EGFR remmer. HER2 overexpressie en activatie Overexpressie in veel tumortypen borst-, eierstok- en niet-kleincellige longkanker. Dit wordt veroorzaakt door: Verhoogd genkopienummer. Verhoogde mRNA transcriptie. Verhoogde celmembraan expressie. Verlies van extracellulair domein. Antilichamen kunnen ook remmend fungeren. Alle kinasepathways zijn onderin te remmen, maar remmen doe je liever vroeg in de cascade dan laat. Er zijn altijd wel andere routes die effect hebben op elkaar. Downstream remmen ook mogelijk: mTOR “mammalian target of rapamycin”: stuurt allerlei processen aan, maar vooral groei van (tumor)cellen; nodig voor verkrijgen van massa. Belangrijk drug target met rapamycien stofje bindt (1) mTOR en (2) FKBP12 binding protein 12 systeem staat niet meer aan, dus geen signaling op celgroei. BRAF V600E mutatie valine vervangen door glutamine op aminozuur 600. Hoge gevoeligheid voor vemurafenib: effect is dat downstream signaling niet meer aanwezig is. Gecombineerd in mutante B-Ras-tumor route gaat niet meer via BRaf, maar via C-Raf gaat veel sneller aan. Als je in normale cellen B-raf remt, gaat Craf sneller aan risicovol voor normale cellen. Vemurafenib verbetert ziektevrije overleving bij melanomen en terugkeer van tumoren wordt voorkomen. Wel snel resistentie. Probleem targeted therapy is dat het zo specifiek is, dat ontsnapping via mutaties heel gemakkelijk is. Aangrijpen op apoptotische routes kan ook: m.b.v. TRAIL bindt 3 receptoren, die trimeriseren en zetten de death receptor goed aan. Alleen tumorcellen zijn hier gevoelig voor. Chemotherapie zet mitochondriële route aan: samen (crosstalk) met aanzetten extrinsieke pathway zorgt voor veel en effectieve apoptose. Combinatie death receptors + chemotherapie zeer effectief in vitro/vivo. 26S proteasoom 3 enzymatische activiteiten; eiwitknipper. Alleen geubiquitinileerde eiwitten worden hierin afgebroken. Multiple myeloma veel eiwitproductie: is te behandelen met een proteasoomremmer: omdat er zoveel eiwitproducten zijn, altijd wel een paar verkeerd gevouwen veel ERstress: als je bortezomic gebruikt wat het proteasoom blokkeert, kunnen deze producten niet worden afgebroken. Heel erg toxische resultaten, alleen effectief bij multiple myeloma. Ideale targets moleculaire therapie: HDAC inhibitors Chemotherapie DNA schade Bcl-2 inhibitors P53 activators/Mdm2 blokkers Proteasoom inhibitors IAP inhibitors apoptose actief mABs zijn specifiek. Small molecules minder, maar wel selectieve enzymatische remmers: zijn soms minder effectieve remmers van interacties tussen eiwitten (p53-Mdm2 lukt wel). Small peptides hebben mogelijk sterkere/selectievere binding. Drug die beetje lijkt op Mdm2 p53 niet afgebroken: level hoog = meer apoptose. Met small molecules wordt geprobeerd eiwit-eiwit interacties na te bootsen. Stapled peptides hebben soort “nietje” waardoor ze weinig bewegen. Key concepts: Tumoren bestaan uit tumorcellen en micro-omgeving van verschillende normale en immuuncellen. Tumorcellen en interactie met omgeving zijn doelwitten van therapie. Chemotherapie grijpt daar niet (of niet specifiek) op aan. Veel targeted drugs zijn in de kliniek doorgedrongen. Opvallende responsen gezien imatinib (Gleevec), trastuzumab, vemurafenib. Resistentie tegen targeted drugs treedt snel(ler) op. Grote uitdaging: welke combinaties voor een tumor(type)? Hoorcollege biologie van kanker – 27-03-2014 – Poelstra Hoofdstuk 16 Na de start v/h moleculaire biologietijdperk neemt tumorsterfte nauwelijks af: komt doordat diagnostiek toegenomen is tumoren eerder te zien door imaging. Preventie en vroege diagnostiek vormen de beste therapie, ook al neemt incidentie toe. Verbetering diagnostiek: stratificatie van patiënten bekijken genenpatronen en dan expressie van bepaalde genen. Hierdoor bekend dat borstkankerpatiënten in 2 groepen uiteenvallen (1) goed te behandelen en (2) slecht te behandelen. Genenpakket is prognostische waarde. Klassieke antitumor therapieën: mosterdgas (alkylerend cytostaticum) induceert beenmergsuppressie. Bloedcellen ontstaan uit stamcellen in het beenmerg. WO I mensen die mosterdgas overleefden kregen anemie: gas tastte sneldelende cellen aan; dus ook tumorcellen geneesmiddel? Alkylerende cytostatica verstoring DNA-replicatie door binding aan baseparen. Bijv. cyclophosphamide: stofje wordt inactief ingespoten, geactiveerd door cytochroom p450 (enzym). Actieve metaboliet ontstaat: vervalt snel in andere structuur, wat vervalt in fosforamide (mosterdgasachtig, actief) en acrolein (toxisch): toxische stoffen accumuleren in de nier ( nefrotoxiciteit). Fosforamide vervalt in een sterk reactief, + geladen product: zoekt het meest negatief geladen stukje molecuul in de cel dit is guanylaat (G) in het DNA: de stikstofgroep op G is het meest elektronenrijk. Reactieve stof bindt aan G irreversibele crosslinking. Dit gebeurt in sneldelende, dus tumorcellen! DNA ontspoort: door binding aan G wordt DNA niet afgelezen en daardoor replicatie verstoord. Antimetabolieten structuur van basen zijn iets te veranderen door bijv. F-groep aan T te zetten. Wordt wel herkend als base, maar DNA polymerase kan er niets mee en wordt (irreversibel) geremd. De F-gebonden T bindt aan polymerase, maar polymerase kan het niet inbouwen en wordt daarmee onschadelijk gemaakt. Antimetabolieten lijken op kleine stukjes v/h endogeen molecuul, maar blokkeren RNA-/DNA-polymerase. Topo-isomeraseremmers krachtig: topo-isomerase essentieel bij transcriptie. Bij aflezing dubbele helix (celdeling, RNA synthese) raakt alles in de knoop: DNA kan hier breken topo-isomerase enzymen (1/2) maken reversibele breuk, werken als swivel en herstellen de breuk. I werkt op ss DNA, II op ds DNA. Topo-isomeraseremmers remmen deze enzymen (irreversibel) door het te binden gevolg is breuk in DNA celdood. Doxorubicine is én een topo-isomeraseremmer en bindt aan het DNA (alkylerende eigenschap), en genereert zuurstofradicalen (na activatie door Cyt p-450). Remt ook een hoop enzymen. Zéér krachtig, veel gebruikt cytostaticum. Plant alkaloïden binden microtubili die de cel vormen en een belangrijke rol spelen bij celdeling. Brengen eiwitten/moleculen vanuit kern naar uitlopers v/d cel. Binden microtubili vinblastine/-cristine binden waardoor polymeer niet afgebroken kan worden stabiele microtubuul: mitose gaat mis, cel sterft. Hormonale geneesmiddelen: sommige tumoren hebben verhoogde expressie van oestrogeen-/testosteronreceptoren borstkankers, prostaatkankers. Zijn steroïdgevoelige tumoren: Mammacarcinoom binding aan E receptoren: gebruik Tamoxifen (E-analoog). Prostaat binding aan T receptoren: gebruik flutamide. Of: platleggen T-productie m.b.v. Leuprolide & Goserelin. Tumorresistentie grootste probleem bij antitumor therapieën: bepaald aantal tumorcellen blijft over, wordt resistent en groeit weer uit. P-glycoproteïne (P-gp): pompeiwit met ATP klapt het aan elkaar en wordt het geneesmiddel er weer uit gepompt. Coderend gen is MDR1 (Multi Drug Resistant 1). Meer manieren voor tumorresistentie: Downregulatie transporters drug komt niet meer binnen. Upregulatie van MDR-genen drug snel weer weg. Downregulatie van Cyt P-450 geen activatie van drug. Verhoogde expressie van enzymen die afbraak regelen versnelde afbraak. Herstel van schade of inductie beschermende enzymen DNA repair enzymen, verhoogde expressie van target enzym (methotrexaat), zuurstofradicaal scavengers (maken radicalen onschadelijk). Antistoffen spelen een rol in afweer zijn in te zetten als nieuwe geneesmiddelen: ontwikkeling van tumor-specifieke antistoffen, vooral tegen groeifactorreceptoren. Hoofdstuk 13: Nieuwe therapieën Tumorcellen zitten in sterk gestructureerd weefsel met tal van celtypen: tumorcel zelf is in de minderheid. Er is veel communicatie, bijv. m.b.v. PDGF-A producerende cellen voor andere cellen met receptor hiervoor. De ene cel genereert signaal, ander reageert. Extracellulaire matrix (ECM) bevat o.a. collageen type IV, glycoproteïnen (laminine, peptidoglycaan). Glycoproteinen zijn – geladen, dus binden H2O. Cellen gaan interactie aan met ECM en zitten er zo in vast geankerd. ECM is nodig hart contraheert en vaten bewegen door ECM, zouden anders losscheuren bij elke contractie. Tumorgroei ontstekingscellen migreren uit bloed naar ontstekingshaard/tumor. Tumor trekt deze cellen aan als puinruimers. Migreren door ECM naar tumorhaard met uitscheiden van collegenases (bijv. MMP9) knippen collageen. Proteoglycanen ketens van GAGs, chondroïtine sulfaat of keratan sulfaat. Hiermee vormt de ECM een “voorraadkast” van groeifactoren (FGF, VEGF) en cytokines. Als er tumorgroei optreedt worden MMPs actief, breken ze de matrix af en verbreken ze cel-cel contacten. GFs komen langzaam vrij. Na secretie is er ook direct weer inactivatie van MMPs door TIMPs (Tissue Inhibitors of MetalloProteinases), maar dit is in tumoren nogal ontregeld. Dit lijkt op proces van weefselherstel, maar tumor is dan een “never ending wound”. Tijdens wondheling komen er ook veel groeifactoren vrij, zodat de wond snel dichtgroeit. Tumorcellen hebben veel groeifactorreceptoren grote respons. VEGF induceert neo-angiogenese in tumoren vorming van nieuwe bloedvaten. Nodig wanneer tumor groter wordt dan 0.2 mm: nodig voor aanvoer van extra voedingsstoffen voor groei en metastasering. Bloedvaten snel aangelegd door VEGF en PDFG, daardoor slordig. Pericyten bij tumor-geassocieerde bloedvaten niet overal aanwezig; vat wordt niet overal afgeschermd dus is er grote kans op lekken. Zijn ook niet gestructureerd. Tumor geeft signaal aan beenmerg mestcellen/macrofagen delen snel productie MMP9 afgifte actief VEGF veel angiogenese in tumoren. Angiogenic switch tumor gaat angiogenese induceren: hierdoor wordt de tumor agressiever, invasier en gaat dus metastaseren. Slechtere prognose. Targeting naar bloedvatendotheel mogelijkheid voor nieuwe therapie. Aanpakken van neoangiogenese bloedvaten met Ab’s die heel specifiek de VEGF-receptor blokkeert. Toch zegt onderzoek in muismodellen weinig: humane tumoren zijn ingewikkelder, lijken niet op muistumoren. Één cellijn is geen tumor en één Ag is geen target. Hoorcollege Biologie van kanker – 27-03-2014 – van den Berg Genexpressie strak gereguleerd proces op verschillende niveaus: Transcriptie: DNA mRNA: - Transcriptiefactoren, activatoren, repressors - Enhancers - Epigenetische markers mRNA niveau - Splicing - Transport - Stabiliteit, degradatie Eiwitniveau - Modificatie - Stabiliteit Kankerontwikkeling is een multi-step process. In tumor is er sterke selectie op welke cel het beste apoptose/het IS kan ontsnappen. Bijdragen aspecten zijn (1) veranderde eiwitfunctie (activerende/inactiverende mutaties) en (2) veranderde genexpressie (bijv. door chromosomale afwijkingen, epigenetica of non-coding RNAs). Non-coding RNAs hoeveelheid coderend DNA is vrij klein, en RNA is misschien veel belangrijk dan alleen “tussenmolecuul” tussen DNA en eiwit. Ong. 60% v/h DNA wordt afgeschreven naar RNA, en een klein deel RNA codeert voor eiwitten. Non-coding RNAs hebben invloed op genexpressie regulatie op verschillende niveaus: Chromatine verandering van chromatinestructuur, modificaties. Gentranscriptie transcriptionele co-activatie/-repressie, regulatie splicing machinerie. Transcript regulatie stabiliteit van mRNA en andere non-coding RNAs, regulatie van translatie. Non-coding RNAs zijn in te delen in klasses: eerst op lengte ncRNAs <200nt vallen onder de kleine ncRNAs, daarboven zijn het grote. Korte ncRNAs ribosomaal, small nuclear, miRNAs.. Lange ncRNAs pseudogenen, antisense, lange intronic.. microRNAs 18-22 nucleotiden enkelstreng RNA. Worden gecodeerd in het humane genoom. Ze hebben een kenmerkende stem-loop structuur. Kunnen binden aan mRNAs. Hun belangrijkste functie is remming van eiwittranslatie op twee manieren. Kunnen op verschillende plekken voorkomen, naamgeving is daarvan afhankelijk: gaat aan de hand van belangrijke, bekende eiwitcoderende genen in de buurt. 4 mogelijkheden: Poly-cystronic, in een intron v/e niet eiwitcoderend gen. Mono-cystronic, in een exon v/e niet eiwitcoderend gen. Poly-cystronic, in een intron v/e eiwitcoderend gen. Mono-cystronic, in een exon v/e eiwitcoderend gen. Mono-cystronic één stem-like loop. Als miRNAs in een exon liggen heeft dat gen dus twee functionele eiwitproducten. Processing: primair miRNA transcript wordt geleid tot transcriptie (RNA polymerase). Eiwitten Drosha en DGCR8 herkennen stem-loop en binden het knippen flanking sequenties eraf precursor miRNA (pre) gevormd. Exportin-5 en Ran-GTP transporteren precursor miRNA naar het cytoplasma voor verdere processing. Dicer-TRBP verwijdert de stem-like loop strengen worden gescheiden één van de strengen wordt in een eiwitcomplex ingebouwd met Ago2 (belangrijk) RISC complex: het functionele eindproduct. Andere streng wordt meestal afgebroken. Beiden kunnen ook behouden blijven. RISC bindt mRNA van eiwitcoderende genen. Homologie is beperkt, niet 100%. Het bindt in het laatste stukje mRNA (seed sequence); nucleotide 2-8: belangrijkst voor herkenning target. miRNAs kunnen zo meerdere targets hebben. miRNAs binden meestal de 3’-UTR region. miRNAs met zelfde seed sequence binden dus dezelfde genen. 30% van alle genen gereguleerd door miRNAs; elk miRNA heeft meerdere celtype specifieke targetgenen, en elk gen is getarget door meerdere miRNAs. Voorspellen targetgenen wordt gebaseerd op: Algehele homologie / homologie in seed sequence. Bindingsenergie Structurele eigenschappen Veel false positive interacties, en je mist ook makkelijk veel interacties met computerprogramma’s. Verder wordt er geen rekening gehouden met co-expressie. In vitro targetgen identificatie: gaat om een gen-voor-gen benadering m.b.v. bijvoorbeeld een Western Blot of reporter assay. Precursor transfectie (pre 17) kan p21 eiwit reguleren. Als we miRNA tot overexpressie brengen is er relatief minder p21 eiwit, als we het remmen is er meer. Zo kun je de effecten analyseren, maar is wel een arbeidsintensief en langdurend proces. Reportersystemen met een truc bekijken of iets een interactie aangaat, ook gen voor gen. Alternatieven high throughput methoden als RISC-IP; inbrengen van een Ab gericht tegen Abo2 met daaraan een label. Welke genen aanwezig in de fractie? Proteomics welke eiwitten komen er verschillend tot expressie? Lange ncRNAs >200 nucleotiden; verschillende subklassen op basis van genomische locatie. Kunnen ook in intronen of exonen liggen. Paar lncRNAs hebben ook wel eiwitfuncties: SRA1 codeert voor een eiwit en een lncRNA: komt door alternative splicing; je kunt een coderend of niet-coderende vorm krijgen. Balans tussen twee splicing varianten bepaalt functionaliteit. TBRG1 alternative splicing. p53 kan ook functioneren als ncRNA: kan gereguleerd worden door Mdm2-eiwit: bindt aan p53 en wordt dan geubiquitinileerd en afgebroken. Mdm2 kan ook mRNA transcript van p53 binden waarmee translatie geremd wordt en dus eiwitproductie. Mdm2 kan ervoor zorgen dat mRNA transcript van p53 niet wordt omgezet in eiwit. lncRNAs functioneel? onderscheid tussen transcriptionele ruis/achtergrond transcriptie en functioneel lncRNA. Bewijzen voor functionaliteit lncRNAs: (Beperkte) conservatie. Specifieke interacties met moleculen die bepaalde, duidelijke functies hebben, bijv. eiwitten. Gereguleerde expressie: expressieniveaus verschillen tussen cel-/weefseltypen, verschillende stadia in genexpressie in o.a. ontwikkeling, differentiatie en ziektestadia. 4 mogelijke manieren van lncRNA functie: (1) Recruteren EMC: epigenetische modifier complexen binden genoom en zorgen voor activerende/inhiberende markers op het chromatine genexpressie aan/uit. (2) Wegvangen transcriptiefactoren: als lncRNA bepaalde structuur heeft die TF kan binden kan de TF niet meer promotorregio binden en is er geen genexpressie. (3) Remmen miRNA functie: lncRNA dienen als “spots” voor miRNAs: lncRNAs binden het RISC-complex waardoor die zijn werk niet meer goed kan doen. Kan ook mRNA binden voordat zodat het RISC er niet meer aan kan binden. (4) Inductie post-transcriptionele modificatie: nadat transcript gevormd is genexpressie reguleren remming translatie, inductie degradatie of splicing modulatie. Er zijn al wel enkele lncRNAs met bekende functie, zoals endo-siRNA, miRNA sponge en Scaffold. Aantal Grootte Conservatie Genomische locatie Expressie Functie miRNA ~2,600 ~22nt Hoog Kanker-geassocieerde loci Weefselspecifiek Remming eiwittranslatie lncRNA >10,000 >200 nt Laag Door het hele genoom Weefselspecifiek Verschillende Key concepts: ncRNAs dragen significant bij aan regulatie van genexpressie. miRNAs worden gevormd uit grotere primaire transcripten en remmen eiwittranslatie door te binden aan 3’-UTR. lncRNAs hebben beperkte conservatie: stimuleren/remmen genexpressie op verschillende niveaus met verschillende mechanismen. miRNAs in kankerontwikkeling: Teveel miRNAs eiwitexpressie van TSGs wordt sterk onderdrukt: gaat hier om oncogene miRNAs die tumor suppressor genen targeten. Te weinig miRNAs gaat om tumor suppressor miRNAs die verlaagd tot expressie komen en dus te weinig oncogenen targeten: teveel aan oncogeen eiwit. Het is dus een kruislinkse interactie tussen oncogenen en TSGs. Betrokkenheid van miRNAs in kankerontwikkeling komt op verschillende niveaus terug. Veranderde expressieniveaus in tumorcellen bijv. Hodgkin lymfoom (B-cel) zit in lymfeklieren. 1% v/d tumorcellen zit in de aangedane lymfeklieren. Cellijnen worden geanalyseerd op een heat map: simpel overzicht van expressie van heel veel genen in heel veel samples. Kleur geeft het expressieniveau v/h gen aan in cellijn. Welke miRNAs meest vergelijkbare expressieniveaus? Verder met in situ hybridisatie verder kijken op weefselcoupes gelabelde probes hybridiseren en aankleuren. Paarse aankleuringen geven tumorcellen weer. Veranderde expressie niet alleen in cellijnen, maar dus ook in weefsels. miRNAs op genomische loci betrokken bij kanker bijv. Burkitt’s lymfoom: snelgroeinde tumor, verdubbelt in 400 uur. Veel deleties, translocaties en amplificaties vallen samen met plekken van miRNAs. Deregulatie van oncogenencluster (miRNA cluster 17~92): amplificatie van chromosomaal gebied 13q31-32 geeft verhoogde expressie miRNA-17~92. Translocatie 8-14 verhoogde myc-expressie: myc komt te liggen voor promotor voor BCR als gevolg van translocatie hoge expressie van myc-gen: belangrijke TF die genen reguleert, o.a. miR-17~92 verhoogde expressie. Deregulatie miR-15 en miR-16 13q14 deletie leidt tot downregulatie miR-15/16 omdat dit in het verloren gebied ligt. Dit zorgt voor ontwikkeling van CLL er is nog maar één kopie van dit chromosomaal stuk. Veranderde miRNA niveaus kunnen ook invloed hebben op proliferatie van kankercellen: m.b.v. proliferatie-assay testen. Je reguleert miRNA expressie in cellen (vaak tumor) met retrovirale infectiesystemen: op dit virus ligt miRNA remmer of overexpressor. Na 21 dagen oncogen-/tumor suppressor activiteit meten. miR-155 groot effect op proliferatie, zorgen ervoor dat cellen nog harder gaan groeien. Er is ook een 3-tal andere miRNAs die proliferatie juist erg kunnen remmen (26b, 26a, 150). Muismodellen voor CLL manipuleren van miRNA 15/16 waar een deletie in zit. Hiermee ontwikkel je CLL in de muis. Kan ook door upreguleren miRNA-29 (oncogeen). Myc muismodel myc is een belangrijk oncogen: overexpressie leidt in muizen tot allerlei lymfomen. Dicer is belangrijk voor biogenese van miRNAs – knockout van Dicer leidt tot minder lymfomen en ontwikkeling wordt sowieso uitgesteld. miRNAs zijn over het algemeen belangrijk bij oncogenese. Er zijn meer oncogene dan tumor supressor miRNAs. Upregulatie miR-17~92 én myc versnelde lymfomagenese. Gedereguleerde lncRNA expressie door genomische afwijkingen: GAS5 translocaties met Notch1 en BCL6: 1q gain in borstkanker, en 1q afwijkingen in melanomen en lymfomen. Hostgenen van miRNAs, bijv. DLEU2 DLEU2 wordt ook gezien als lncRNA, maar wordt ook van gedacht dat het andere functies heeft. Verlies van 13q14 incl. DLEU2, het miRNA-15/16 gen in CLL. Muismodellen zijn er weinig. Een model is Xist: belangrijk gen voor inactivatie Xchromosoom. RNA van Xist zorgt voor silencing v/h gen. In bloedcelen ontstaat reactivatie van X waardoor genome-wide veranderingen plaatsvinden ontwikkeling agressieve myeloproliferatief neoplasme en myelodysplatisch syndroom. Grote tumoren op lever en nieren; bij homozygoot defect nog erger, maar bij heterozygoot al sterk aanwezig. Dus niet alleen betrokken bij X-inactivatie. lncRNAs spelen een rol bij ontwikkeling van de “hallmarks van cancer”: bijvoorbeeld in regulatie van transcriptie, fungeren als RNA primer of RNA splicer. Toepassingen ncRNA (klinisch): Diagnostisch: klassificatie en ziektemarker. Prognostisch: prognostische waarde en respons op therapie. Therapeutisch: inductie of remming van miRNAs. Het is bijv. mogelijk om middelen te ontwikkelen die bepaalde miRNAs remmen: doxycycline remt bijv. miR-21 waardoor geen lymfomen ontwikkelen. Key concepts: Meerdere bewijzen voor een belangrijke rol van ncRNAs in kankerontwikkeling. Links met de hallmarks of cancer. De rol van miRNAs in carcinogenese is goed beschreven en breidt nog uit. De rol van lncRNAs is duidelijk, maar er is nog niet veel over onderzocht. ncRNAs vormen nieuwe targets voor het ontwerpen van anti-kankertherapieën. Biologie van kanker – 28-03-2014 – de Jong Er wordt veel farmaceutisch onderzoek gedaan naar therapie voor verschillende kankers, maar weinig drugs behalen de kliniek. Trajecten zijn lang, wel tientallen jaren; voor verkorten traject zijn goede modellen nodig. Veel gebruik gemaakt van 60 humane tumorcellijnen: testen van toxiciteit en relateren aan eiwitexpressie; m.b.v. PC-programma COMPARE uniekheid, werkingsmechanisme. Tegenwoordig ook veel gebruik van tumor xenograft modellen. Muisonderzoek testen van 60 humane cellijnen: implanteren van cellen, tumor laten groeien analyseren. Cellijnpanel blijkt echter niet voldoende; niet alle tumor(sub)typen zijn erin vertegenwoordigd, dus geeft niet genoeg informatie. Cellijnen: voor- en nadelen: Pro: - Makkelijk in gebruik. - Mechanistische studies: aan-/uitschakelen genen mogelijk. - Xenograften: humane cellen in muizen te brengen. Con: - Geen stromale cellen enz. aanwezig (nodig voor GFs). - Geen voorspellend vermogen: door kweken geselecteerd op goed groeiende cellijnen. - Beperkt aantal modellen aanwezig per tumortype. - Homogeen - Zelfde cellijn als tumor? - Mycoplasmavrij: cellijn kan besmet zijn met bijv. muiscellen: bacterie die in cellen metabolisme overnemen. 75% is besmet. CAM-model (chicken embryo chorioallantoic membrane) gebruik van bevrucht ei, zonder kapje. Op membraan laat je tumorcellen groeien (+- 10-15 dagen). Handig voor vaatonderzoek. Transplantatie van tumor mogelijk samen met stromacellen. Pro: - 10 dagen levensvatbaar, dan komt embryo tegen de laag aan. - Studeren van pathway (in)activatie mogelijk. Con: - Tumor micro-omgeving niet intact. - Alleen korte termijneffecten kunnen gemeten worden. Ex-vivo onderzoek met Krumdieck slicer mogelijk om hele dunne plakjes tumor te snijden en te testen met verschillende drugs. Bijv. kijken naar marker voor apoptose (geknipt caspase 3). Blijkt dat TRAIL + cisplastin (chemo) het beste werkt (zie afbeelding). DR5 samen met TRAIL werkt ook goed. Krumdieck slices: Pro: - Levensvatbaar >72 uur - Tumor micro-omgeving intact - Bestuderen pathway (in)activatie mogelijk. Con: - Heterogeniteit tussen plakjes: niet gelijke weefselstructuur. - Alleen korte termijneffecten Verschillende muismodellen: Syngeneic getransplanteerde tumor dat ook metastaseert. Voordeel is dat IS nog inatact is. GEMM mutatie leidt tot tumorvorming, geen metastase, maar IS nog wel intact. Subcutane xenograft getransplanteerde tumor dat niet metastaseert. Hier is het IS niet meer intact. Orthotopische xenograft getransplanteerde tumor naar orgaan van herkomt: IS ook niet meer intact. GEMM tumorvorming wordt bewerkstelligd door Cre-Lox systeem: Cre knipt de Lox-site. Inbrengen van Cre in de muis targetgen zet je tussen twee Lox-sites: deze wordt er dus vervolgens uitgeknipt. Je creëert een knockout. Dus: kruisen muizen: (1) heeft Cre-site in genoom en (2) heeft gen van interesse tussen 2 Lox-sites. Cre is specifiek te maken promotor ervoor, zodat het alleen actief wordt in bepaalde weefsels. Erachter is GTP te plaatsen dat actief wordt als het gen eruit wordt geknipt. Syngeneic/GEMM: Pro: - Immuunsysteem is nog aanwezig - Orthotopische tumorgroei Con: - Beperkte modellen - Beperkte genenset - Antilichamen tegen humane eiwitten doen het niet altijd. Tumorimplantaat heeft in begin moeite met groeien. Met IHC wel te zien dat het nog steeds erg lijkt op een humane tumor: in verloop van tijd wel verlies van humane cellen doordat muizencellen ze overgroeien. Stromacellen zijn immers normaal; delen niet zoveel als tumorcellen. Kijken naar twee targets IGF-receptor en VEGF m.b.v. twee fluorescente stains (tegen antilichamen). 2 markers gebruikt met verschillende golflengte; afhankelijk v/d golflengte zie je verschillende gebieden oplichten: Er zijn overlappende, maar ook verschillende gebieden. Één met name in de circulatie, andere op de tumor: je ziet dat VEGF eerst veel in de tumor zit, maar uiteindelijk wordt uitgescheiden via de nieren. Key concepts: Meer drugs moeten succesvol in de kliniek komen: meer behandelingsopties en lagere kosten. Cellijnen blijven nodig als eerste stap voor analyse van functies en xenografts. CAM model en Krumdieck slices geven inzicht in korte termijneffecten. Xenografts (GEMM/syngeneic): immuunsysteem aanwezig, maar niet geschikt voor soortspecifieke drugs. Xenografts (PDX modellen): goed te gebruiken voor trials in muizen, reflecteren beter de patiënt dan cellijnen.