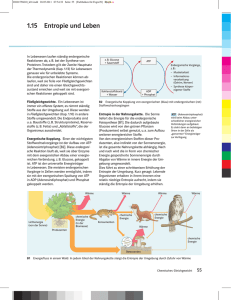
NTS Kapitel 7: Thermische Systeme
Werbung

Kapitel 7 Thermische Systeme Wärme und Kälte begegnen uns vom Anfang unseres Lebens an, sie spielen von Technik über Biologie bis zum Universum eine fundamental wichtige Rolle. Unsere Erfahrung mit Wärme und Kälte ist direkt und trotzdem nicht einfach wissenschaftlich zu fassen. Wie Elektrizität ist Wärme unsichtbar. So ist es nicht erstaunlich, dass die ersten Wissenschaftler, die sich mit thermischen Phänomenen ausführlicher auseinandergesetzt haben (Accademia del Cimento: zweite Hälfte 17. Jahrhundert; Joseph Black: 2. Hälfte 18. Jahrhundert; Sadi Carnot: 1824), bildhafte Erklärungen benutzten, die ähnlich sind wie die für Elektrizität, die ihrerseits aus der Welt der Fluide geborgt sind. Man nennt die damals entstandene Theorie Wärmestoff-Theorie (Wärmestoff auf Lateinisch: Caloricum). Wärmestoff ist in Materialien drin, kann zu- oder abgeführt werden, macht die Stoffe warm oder schmilzt oder verdampft sie, lässt Luft expandieren und macht auch sonst noch ein paar interessante Dinge. Um 1850 wurde diese Vorstellungswelt plötzlich auf den Kopf gestellt. Rudolf Clausius hat eine Entwicklung auf den Punkt gebracht, an deren Ende gesagt wurde, Wärme sei Energie. Zwischen 1800 und 1850 wurde der Energiebegriff langsam in der Physik Mode und seine Anwendung kam gerade recht. (Seither steht in fast jedem Kapitel, das je über Wärme geschrieben wurde, dass die Wärmestoff-Vorstellung falsch sei – was aber Unsinn ist). Energie wird dazu missbraucht, alles, was wir nicht sehen, als Energie zu bezeichnen. In Populärdarstellungen der Wissenschaften und in Science Fiction Filmen hört man genau das. Man teilt die Welt in Materie und Energie ein, so wie wir in Philosophie und Religion einen Menschen in Körper und Geist unterteilen – was aber letzten Endes nicht funktioniert. Menschen geben den Kräften der Natur drei Grundeigenschaften: Menge, Intensität und Macht (Kraft oder Energie). Wenn man die Menge mit ihrer Macht verwechselt – und das hat Clausius in seiner Thermodynamik getan – dann fehlt der “Akteur” oder “Agent” in unseren Erklärungen, und die formale Theorie wird plötzlich surreal. Auf die thermischen Phänomene gemünzt heisst das, wenn man den Wärmestoff nicht hat, kann man die Welt nicht mehr verständlich und bildhaft erklären. [Dieses Problem haben wir mit der Elektrizität im Alltag, obwohl die gängige Elektrizitätslehre zwischen Menge, Intensität und Macht (Energie) sauber unterscheidet.] Wenn wir wie bisher systemisch und phänomenologisch denken und einfach mal schauen, wie uns die Wärme begegnet, so sehen wir viel Ähnlichkeit im Verhalten fluider, elektrischer und thermischer Phänomene. Die Modelle thermischer dynamischer Vorgänge können darum mit Strukturen analog zu Hydraulik und Elektrizität aufgebaut werden. Zu den hydraulischen oder elektrischen Grundgrössen gibt es entsprechende thermische Konzepte, mit denen wir Thermodynamik relativ einfach verstehen können. Das werden wir in diesem Kapitel ausnutzen und dynamische 214 Thermische Systeme Modelle einfacher thermischer Vorgänge bauen. Im zweiten Teil des Kurses werden dann die Anwendungen thermischer und chemischer Prozesse vertieft – sowohl für Umweltwissenschaften als auch Energietechnik. Es gibt allerdings einen wichtigen Unterschied zwischen Wärmestoff und Fluiden oder elektrischer Ladung: Wärmestoff kann erschaffen werden. Das muss man erst mal verdauen, dafür wird man aber mit einer bildhaften Erklärung einer Grundeigenschaft der Welt belohnt: Vorgänge laufen teilweise nur in eine Richtung, was man das Phänomen der Irreversibilität nennt. Die Erzeugbarkeit von Wärmestoff hat genau damit zu tun. 7.1 Phänomene und Wortmodelle Wir wollen hier einige Phänomene besprechen, die zwar nur einen kleinen Ausschnitt aus der Welt der Wärme (und Kälte) zeigen, aber sehr wichtig und prototypisch sind. Sie werden uns zeigen, wie wir mit wenigen Grundbegriffen thermische Phänomene beschreiben können. 7.1.1 Körper im Wärmekontakt Nach drei Beispielen von Systemen, in denen sich Spannungen ausgleichen und Niveaus anpassen (Löhne in einer Firma, Druckdifferenzen in kommunizierenden Gefässen und Spannungen über kommunizierenden Kondensatoren) sehen wir hier das vierte Beispiel mit analogem Verhalten (Abb.7.1). Bringt man zwei Körper, die verschieden warm sind, in Kontakt, so gleichen sich nach mehr oder weniger langer Zeit ihre Temperaturen aneinander an. Temperature / °C 100 80 60 40 20 [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ 0 500 1000 1500 Time / s 2000 Temperature / °C 100 [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ 80 60 40 20 0 50 100 150 Time / s 200 Abbildung 7.1: Ein Gefäss mit zwei durch eine dünne Blechwand getrennten Kammern (oben links). Füllt man verschieden warmes Wasser in die Kammern und verschliesst dann das Gefäss auf allen Seiten gut wärmeisolierend, so ändern sich die Temperaturen wie im Diagramm oben rechts gezeigt. Wenn ein kaltes Stück Kupfer in heisses Wasser in einem isolierten Gefäss getaucht wird (unten links), so gleicht sich die Temperatur des Kupfers an die des Wassers an (Diagramm unten rechts). Ein Wortmodell für diesen Typ Vorgang ist sehr simpel. Die Sache passiert, weil vom wärmerem Körper Wärmestoff zum kälteren fliesst und zwar als Folge des 7.1 Phänomene und Wortmodelle 215 Temperaturunterschieds. Der Vorgang läuft so lange, bis der Temperaturunterschied Null geworden ist, bis wir also thermisches Gleichgewicht haben. Ganz klar laufen die Vorgänge des Angleichs schneller, wenn der Temperaturunterschied höher ist und langsamer, wenn er tiefer ist. Sie sehen, dass zwei Begriffe und zwei weitere damit zusammenhängende verwendet werden, um über den Vorgang zu sprechen: Wärme in einem Körper (WärmestoffMenge), fliessende Wärme (also Wärmestrom), Temperatur und Temperaturunterschied. Diese Grössen haben in Hydraulik und Elektrizität ihre Entsprechungen (Tabelle 7.1). Tabelle 7.1: Analogie zwischen Hydraulik, Elektrizität und Thermodynamik Hydraulik Elektrizität Thermodynamik Menge (Fluid-)Volumen Ladung Wärme(stoff) Transport Volumen-Strom Ladungs-Strom Wärme(stoff)strom Produktion — — Produktionsrate des Wärmestoffs Druck el. Potential Temperatur Druckunterschied Spannung Temperaturunterschied Speicher Gefäss Kondensator Material Leitung Schlauch, Rohr Leiter Wärmeleiter Pumpe Pumpe Generator Wärmepumpe Niveau -unterschied Ein ganz wichtiger Schritt für das Verständnis thermischer Vorgänge ist die Unterscheidung zwischen Wärme(stoff)menge und Temperatur. Offensichtlich sagt uns die Temperatur eines Körpers, wie warm er ist, während die Wärmestoffmenge sagt, wie viel Wärme drin ist. Die folgenden zwei Beispiele machen diesen Unterschied überdeutlich. 7.1.2 Gefrieren von Wasser Mischt man in einem Behälter zerstossenes Eis mit viel Salz, so wird die Mischung sehr kalt (etwas, was wir aus dem Alltag kennen und was man versteht, wenn man ein paar chemische Konzepte kennt; siehe Teil II des Kurses). Stellt man ein Reagenzglas mit etwas warmem Wasser in diese Mischung, so zeigt ein Thermometer im Wasser, dass dieses zuerst kalt wird, dann längere Zeit nicht kälter wird und schliesslich dann aber doch noch kälter wird (und zwar so kalt wie die Eis-Salz Mischung; siehe Abb.7.2). Wenn man in das Reagenzglas schaut, sieht man, dass das Wasser während der Phase, in der die Temperatur nicht ändert und gerade 0°C beträgt, zu Eis wird. Was mit dem Wasser im Reagenzglas passiert, versteht man so. Da sich das warme Wasser in einer sehr kalten Umgebung befindet, gibt es Wärmestoff ab (man sagt, das Wasser werde gekühlt). Dadurch verliert das Wasser einen Teil seines Wärmestoffs, und weil Wasser mit weniger Wärmestoff drin kälter ist, ist die Temperatur tiefer. Der Wärmestoff fliesst, weil es einen Temperaturunterschied gibt. Wenn das Wasser 0°C kühl geworden ist, passiert etwas Interessantes. Der Temperaturunterschied zur Eis-Salz Mischung im Gefäss ist immer noch da, also fliesst 216 Thermische Systeme weiter Wärmestoff aus dem Wasser im Reagenzglas in das kalte Eis-Salz Gemisch. Das Wasser wird dabei aber nicht mehr kälter: Obwohl die Wärmestoffmenge im Wasser abnimmt, fällt die Temperatur nicht weiter (also können Wärmestoffmenge und Temperatur nicht das selbe Konzept sein!). Dafür passiert etwas Anderes: das Wasser im Reagenzglas wird zu Eis. Am Schluss dieser Phase (Plateau im Diagramm in Abb.7.2) haben wir Eis bei 0°C. Dieses Eis ist gleich warm (oder kalt) wie das Wasser am Anfang der Phasenumwandlung, aber es hat viel weniger Wärmestoff. Man kann den Vorgang umdrehen: wenn man Eis von 0°C heizt, d.h. ihm Wärmestoff zuführt, so schmilzt es, ohne dabei wärmer zu werden. Am Schluss des Vorgangs haben wir Wasser von 0°C. Temperature / K 300 280 260 E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E 240 0 1000 2000 3000 Time / s Abbildung 7.2: Temperatur von Wasser in einem Reagenzglas, das in eine – 20°C kalte Eis-Salz Mischung gestellt wird. Horizontale Datenlinie: Temperatur der Eis-Salz Mischung. Sinkende Temperaturlinie: Temperatur des Wassers im Reagenzglas. Horizontales Plateau bei 0°C = 273 K: Wasser wird zu Eis. Das Experiment in Abb.7.2 geht noch etwas weiter. Wir haben inzwischen einen festen Stoff (Eis im Reagenzglas) in Kontakt mit einem immer noch kälteren Stoff (Eis-Salz Gemisch im Behälter), also zwei verschieden warme Stoffe in Wärmekontakt. Wärmestoff fliesst weiter aus dem Eis im Reagenzglas in das Gemisch, wodurch die Temperatur des Eises weiter sinkt. Die Form der Kurve ist wie die am Anfang und hat grosse Ähnlichkeit mit den Messkurven des Entleerens von Gefässen oder dem Entladen von Kondensatoren. Fragen & Übungen 1. Warum zeigt mindestens das zweite Beispiel in Abb.7.1, dass die Temperatur nicht das Mass für Wärmemenge sein kann? Welche Rolle spielt die Temperatur? 2. Was passiert mit der Wärmestoffmenge des Gemisches aus Wasser und Eis im Vor- gang in Abb.7.2 zwischen ungefähr 250 s und 1400 s? Sollte da die Temperatur nicht zu- oder abnehmen? 7.1.3 Komprimieren von Luft Sperrt man Luft in einen Zylinder mit Kolben, so kann man die Luft im Gefäss komprimieren. Wir wissen aus Erfahrung mit Fahrradpumpen, dass die Luft dabei sehr heiss wird. Das passiert schon nach einem einzigen schnellen Kompressionsvorgang, wie man zeigen kann, wenn man etwas Zunder in den Zylinder gibt: der Zunder entzündet sich spontan. Das passiert auch in Dieselmotoren, wo Dieselbrennstoff in die komprimierte heisse Luft gespritzt wird und sich entzündet. Warum wird die Luft durch Kompression heiss? Eine erste recht einleuchtende Idee ist die, dass wir durch Reibung Wärmestoff erzeugen, dass also mehr Wärmestoff in der komprimierten Luft ist, und diese darum wärmer ist. [Die Idee ist klar: Wärme macht warm, also hat ein wärmerer Stoff mehr Wärme drin. Das stimmt natürlich bei 7.1 Phänomene und Wortmodelle 217 Wasser oder einem Stück Eisen.] Wärmestoff musste erzeugt werden, da er sicher nicht von Aussen zufliessen konnte: die Luft ist ja während des ganzen Vorgangs wärmer als die Umgebung. Die Sache hat nur einen Haken: die Reibung beim Vorgang ist sehr gering. Luft reibt in sich fast nicht, sie ist – wie wir vom Spielen mit Fahrradpumpen wissen – sehr elastisch, und in einem elastischen Material gibt es keine Reibung. Die Reibung zwischen Kolben und Zylinderwand reicht auch nirgendwo hin; man kann sie durch Schmieren auch beliebig klein machen, wenn man will. Also ist die Wärmestoffmenge in der Luft am Ende der Kompressionsphase gleich wie am Anfang. Warum ist die Luft dann wärmer? Ganz einfach, weil die gleiche Wärmestoffmenge in einem kleineren Volumen drin ist. Diese Art der bildhaften Erklärung stammt von den Forschern aus der Zeit Ende 18. Jahrhundert. Wir wissen ja auch, dass Wärmezufuhr zur Ausdehnung von Luft führt. Wärme macht also nicht nur warm, sie macht im Allgemeinen auch gross. Wenn man Luft komprimiert, ohne Wärmestoff abzulassen, so wird der Wärmestoff, der die Luft ursprünglich “gross” gemacht hat, diese nun warm machen. Das bedeutet natürlich auch, dass man Luft komprimieren kann, ohne dass sie (wesentlich) wärmer wird: man muss sie nur mit der richtigen Rate kühlen (Wärmestoff abfliessen lassen). Wieder ist klar, dass Wärmestoffmenge und Temperatur nicht das selbe Konzept sein können (anders gesagt, die selbe Grösse messen). Der Wärmestoff in der Luft bleibt bei der Kompression ohne Kühlung konstant, die Temperatur steigt. Die beiden Grössen und ihre Werte haben nichts miteinander zu tun. Gegen Ende des 19. Jahrhunderts hat man sogenannte Temperatur-Wärmestoff Diagramme eingeführt, mit denen man einige wichtige thermische Vorgänge leicht versteht (siehe Abb.7.3). Abbildung 7.3: Temperatur-Wärmestoff Diagramme für verschiedene Vorgänge. Links: Heizen oder Kühlen eines festen oder Flüssigen Materials, das sein Volumen nicht ändert und auch sonst nichts durchmacht; das Diagramm gilt auch für Luft, die sie sich erwärmt und ausdehnt. Mitte: Isotherme Expansion oder Kompression von Luft (konstante Temperatur; die Luft muss gleichzeitig geheizt oder gekühlt werden). Rechts: Kompression oder Expansion von Luft ohne Kühlen oder Heizen (Vorgänge ohne Kühlen oder Heizen – ohne Abfuhr oder Zufuhr von Wärmestoff – nennt man adiabatische Vorgänge). T ist das Symbol für die (absolute) Temperatur, S nehmen wir für Wärmestoffmenge. 3. Warum zeigen einzelne der Vorgänge bei denen Luft geheizt oder gekühlt und kom- primiert oder expandiert wird, dass Wärmestoffmenge und Temperatur nicht die selbe Grösse sein können? 4. Wie kann man das Volumen von Luft ändern, ohne dass sich dabei die Temperatur ändert (isotherme Vorgänge)? 5. Könnte man bei isothermem Expandieren/Komprimieren von Luft von aufsaugen oder ausquetschen von Wärmestoff sprechen? Fragen & Übungen 218 Thermische Systeme 6. Was passiert, wenn man Luft in einem Gefäss mit festem Volumen heizt (oder kühlt)? Ändert sich die Temperatur von Luft anders, wenn das Heizen/Kühlen nicht in einem festen Gefäss sondern bei konstantem Druck stattfindet (zum Beispiel, wenn man eine Menge Luft in der Atmosphäre betrachtet)? 7.1.4 Peltier-Element als Wärmepumpe Wenn man wie in Abb.7.4 ein Peltier-Element (eine Art thermoelektrisches Element) zwischen zwei gleich warme Körper bringt und das Element dann an einen elektrischen Generator anschliesst (es also elektrisch antreibt), so wird der eine Körper wärmer und der andere kälter. Temperature / C 35 30 25 [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ [ 20 0 2500 5000 7500 10000 Time / s Abbildung 7.4: In einem (isolierten) Gefäss hat es zwei Kammern mit gleich warmem Wasser. Ein thermoelektrisches Peltier-Element spielt die Trennwand zwischen den beiden Wassermengen. Deckt man das Gefäss isolierend ab und stellt den elektrischen Generator für das Peltier-Element an, dann wird die eine Wassermenge kälter und die andere wärmer. Allerdings is das nur am Anfang so – ab einem bestimmten Punkt wird die kältere Wassermenge auch wärmer. Man sieht auch, dass die mittlere Temperatur der beiden Wassermengen steigt (es wird also wärmer im Gefäss). Diesen Vorgang erklärt man so. Wird Wasser wärmer, so nimmt seine Wärmestoffmenge zu, es muss also Wärmestoff von aussen kriegen. Da das ganze Gefäss wärmeisoliert ist, die zweite Wassermenge aber kälter wird, ist es einleuchtend anzunehmen, dass der Wärmestoff aus der zweiten Wassermenge kommt. Da Wärme sicher nicht von selbst vom kälteren in das wärmere Wasser fliesst, muss das Peltier-Element den Wärmestoff “bergauf zwingen”, also pumpen. Dazu muss man das Peltier-Element antreiben. Man sieht wieder, dass Wärmestoff wie ein “Stoff” angeschaut wird, den man auch pumpen kann, und dass die Temperatur die Rolle eines Niveaus spielt – wie das elektrische Potential bei elektrischen oder der Druck bei hydraulischen Phänomenen. Warum steigt die mittlere Temperatur im Gefäss? Da sich dort alles feste oder flüssige Stoffe befinden, heisst das, dass die gesamte Wärmestoffmenge im Gefäss zunimmt. Da das Gefäss gut nach aussen isoliert ist, Wärmestoff also nicht von aussen kommen kann, und da das wärmer werdende Wasser Wärmestoff dem kälter werdenden Wasser entzieht (dort die Bilanz also ausgeglichen ist), muss im Gefäss Wärmestoff entstehen. Im Peltier-Element laufen wärmeproduzierende (irreversible) Vorgänge ab, insbesondere durch das Fliessen von elektrischer Ladung durch das Leitermaterial des Peltier-Elementes (elektrische Heizung!). Fragen & Übungen 7. Wieso müssen wir aus den Temperaturänderungen der beiden Wassermengen in Abb.7.4 schliessen, dass Wärmestoff vom kälter werdenden Wasserkörper auf den anderen übertragen wird? Könnte sich die Temperatur des Wassers nicht auch durch andere Vorgänge geändert haben? 7.1 Phänomene und Wortmodelle 219 8. Wärme fliesst doch von selber vom wärmeren zum kälteren Körper (Abb.7.1)? Wie ist denn der Vorgang in Abb.7.4 möglich? 9. Warum deutet das Ansteigen der mittleren Temperatur des Systems in Abb.7.4 an, dass Wärmestoff erzeugt worden sein muss? 7.1.5 Wärmestoff, Temperatur und thermische Leistung Wir haben schon ganz am Anfang des Kapitels darauf hingewiesen, dass wir zwar mit einer weitgehenden Analogie zwischen thermischen und hydraulischen oder elektrischen Phänomenen arbeiten können, dass diese Analogie aber in einem ganz wichtigen Punkt nicht funktioniert. In der Hydraulik hat man es mit Vorgängen zu tun, bei denen die Flüssigkeitsmengen (ihre Volumina) gesamthaft konstant bleiben: wenn Wasser aus einem Gefäss fliesst, so ist es woanders angelangt. Die selbe Vorstellung macht man sich von elektrischer Ladung: es ist unmöglich, Ladung zu erschaffen oder zu vernichten. Wenn wir sagen, wir “erzeugen Elektrizität”, so trennen wir (positive und negative) Ladung oder wir zwingen Ladung mit Hilfe von Generatoren zum Fliessen. In jedem Fall “erzeugen” wir nur einen elektrischen Potentialunterschied. Wärmestoffproduktion. Beim Wärmestoff versagt diese Annahme: Wärmestoff kann erzeugt aber nicht vernichtet werden. Wie schon gesagt, diese Vorstellung muss man sich erarbeiten. Die Forscher, die vor zwei- bis dreihundert Jahren mit der Wärmestofftheorie gearbeitet haben, wollten so eine Vorstellung nicht annehmen. Das war ein Grund dafür, dass die Forscher nach etwa 1840 die Wärmestofftheorie nicht weiter benutzen wollten: mit der alten Form kann man Irreversibilität nicht erklären. Wenn man wie wir weiter mit den Grundbildern, die Menschen auch zur Beschreibung des Alltags verwenden, weiter machen will, muss man die alte Wärmestofftheorie in diesem Punkt erweitern. Hier ist ein Phänomen, das erklärt, warum man sich vorstellen muss, Wärmestoff könne erzeugt aber nicht vernichtet werden. Begriffe und Elemente Begriffe: Wärmestoffmenge (technischer Begriff: Entropie), Strom des Wärmestoffs, Temperatur = thermisches Potential, Temperaturunterschied = thermische Spannung, und direkt davon abhängende Begriffe wie geflossene Menge des Wärmestoffs. Kälte kommt als formaler Begriff nicht mehr vor. Wir können Kälte als Abwesenheit von Wärme oder wie “negative Wärme” auffassen. Bei der Beschreibung thermischer Phänomene reicht der Begriff der Wärme. Elemente: Materialien als Wärmestoffspeicher, Materialien als Wärmestoff-Leiter oder Widerstände, Wärmepumpen und Wärmekraftmaschinen. Eigenschaften der Elemente: In einer Theorie thermischer Systeme kommen natürlich noch Grössen vor, mit denen man die Eigenschaften der Elemente quantifiziert (Beispiel: bei einem Wärmespeicher die Kapazität, bei einem Leiter der Leitwert oder Widerstandswert). Ein Buch liegt auf einem Tisch, und man versetzt ihm einen Stoss. Es gleitet eine Strecke über den Tisch, wobei es langsamer wird und schliesslich zum Stehen kommt. Wir machen Reibung für das Phänomen verantwortlich, und wir wissen, dass dabei Wärme produziert wurde. Konzepte 220 Thermische Systeme Jetzt kann man den mechanischen Aspekt des Vorgangs umkehren, was aber nicht von selber geschieht. Man kann das Buch im Prinzip mit der Hand so führen, dass es sich genau rückwärts über den Tisch bewegt. Bahn und Geschwindigkeit können umgedreht werden. Ein Aspekt des Vorgangs lässt sich aber nicht umkehren: Wärme verschwindet nicht, sie wird nicht zerstört. Vielmehr wird wieder Wärme erzeugt. Wie man es auch dreht und wendet, es gibt einen Aspekt der Natur, den man nicht umkehren kann. Man kann Bewegung umkehren. Man kann Elektrizität, die von selber von höheren zu tieferen Potentialen fliesst, in die umgekehrte Richtung pumpen. Man kann chemische Reaktionen, die in eine Richtung laufen, in die andere Richtung zwingen. Man kann Wärmestoff pumpen statt sie wie von selbst “bergab” fliessen lassen. Aber man kann die normalerweise immer auftretende Wärmeproduktion nicht umdrehen. Kehrt man Vorgänge um, so wird (noch mehr) Wärmestoff erzeugt. Man sagt in technischer Sprache, dass Wärmestoff – anders als elektrische Ladung – keine erhalte Grösse ist, keinem Erhaltungsgesetz folgt (oder nur einem halben: er kann nicht zerstört werden). Konzepte Irreversibilität Wenn bei einem Vorgang Wärmestoff erzeugt wurde, so sagt man, der Vorgang sei irreversibel gewesen. Bilanz des Wärmestoffs: In der Bilanzgleichung für Wärmestoff muss man neben Strömen auch noch Produktionsraten für Wärmestoff berücksichtigen. Die Änderungsrate des Wärmestoffs eines Elementes ergibt sich also durch die Summe aller Ströme und Produktionsraten. Irreversible Vorgänge: Mechanische Reibung, Reibung beim Fliessen von Fluiden, Feuer (und viele andere chemische Prozesse), Leitung von elektrischer Ladung, Diffusion von Stoffen, Absorption von (Sonnen)Strahlung, radioaktiver Zerfall, Wärmetransport. Temperatur. Nicht nur der Wärmestoff ist in diesem wichtigen Punkt der Erzeugbarkeit nur beschränkt zur Elektrizitätsmenge analog, auch die Temperatur hat als Gegenstück zum elektrischen Potential eine interessante abweichende Eigenschaft: sie hat einen absoluten Nullpunkt. Tieftemperaturphysik ist eine auch technisch sehr wichtige Domäne, die seit mehr als hundert Jahren auf hohem Niveau betrieben wird. Man findet bei aller Anstrengung nur Temperaturwerte, die bis – 273°C gehen. Aus diesem Grund – verbunden mit einigen Überlegungen – sagt man, die Temperatur sei nach unten beschränkt, und man macht den tiefsten möglichen Temperaturpunkt zum Nullpunkt der Kelvinskala. Die Kelvin-Temperaturen sind also um 273 K höher als die entsprechenden Celsius-Temperaturwerte. Das elektrische Potential ist demhingegen nicht absolut. Man muss einen frei wählbaren Bezugspunkt nehmen, wenn man Werte des Potentials angeben will. Mit anderen Worten, nur die Potentialdifferenz (die Spannung) ist von Bezugspunkten unabhängig. Das selbe Phänomen haben wir beim Gravitationspotential, dem Äquivalent zum elektrischen Potential in Schwerefeldern. Der Potentialnullpunkt zum Beispiel im Schwerefeld der Erde kann frei gewählt werden – wir nehmen dazu of die Meereshöhe. In der Elektrizität nimmt man dazu oft die “Erde”, d.h., Schaltungen können “geerdet” werden, und so ist dann der Potentialwert Null für den geerdeten Punkt. Es gibt eine Überlegung, die uns davon überzeugen kann, dass es für die Temperatur einen festen Nullpunkt geben sollte. Es scheint einleuchtend, dass die Erzeugung 7.1 Phänomene und Wortmodelle 221 von Wärmestoff eine bestimmte Energiemenge braucht (der erzeugende Vorgang muss so und so viel Energie freisetzen), die von der Temperatur abhängt. Im Wasserfallbild der Vorgänge (siehe Kapitel 6) sieht das so aus: Wärmestoff erzeugen heisst, ihn bildhaft von Null Kelvin auf die im Material, wo der Wärmestoff erzeugt wird, herrschende Temperatur zu pumpen. Das braucht natürlich eine wohldefinierte Energiemenge. Dynamisch gesprochen heisst das, dass die Leistung des Wärmestoff erzeugenden Vorgangs so berechnet werden muss: (7.1) Pdiss = T ΠS Diese Beziehung ist in Abb.7.5 bildlich dargestellt. Das Symbol Pdiss steht für die Rate, mit der Energie für die Erzeugung von Wärmestoff benutzt wird. Man nennt sie auch Dissipationsleistung oder einfach Dissipationsrate. ΠS steht für die Rate, mit der Wärmestoff erzeugt wird. Immersion heater IQ Pel ΠS Heat Pdiss ϕ1 ϕ2 T Abbildung 7.5: Wärmestofferzeugung mit einem Tauchsieder. Im elektrischen Vorgang wird Energie mit wohldefinierter Rate (elektrische Leistung) freigesetzt. Die so zur Verfügung gestellte Energie wird benutzt, um den erzeugten Wärmestoff von 0 K auf die gewünschte Temperatur zu pumpen. Nun können wir argumentieren, dass die Temperatur absolut festgelegt sein muss. Wäre das nicht der Fall, dann wäre nicht definiert, wie viel ein Prozess tun muss (wie viel Energie er zur Verfügung stellen muss), damit eine bestimmte Menge Entropie erzeugt werden kann. Dieses Problem haben wir in der Elektrizität und der Gravitation nicht: elektrische Ladung und Masse (die “Schwereladung”) können weder erzeugt noch vernichtet werden. Darum können diese beiden Potentiale willkürlich gewählt werden. Warum ist denn der Druck absolut? Die Antwort ist einfach: Volumen ist keine erhaltene Grösse, obwohl wir das in der Hydraulik inkompressibler Flüssigkeiten annehmen. Volumen kann man erschaffen oder vernichten (ein Fluid kann man expandieren oder komprimieren). Das Selbe gilt übrigens für das Potential chemischer Prozesse (das chemische Potential, d.h. die Intensität von Stoffen). Das chemische Potential ist absolut, da Stoffe erzeugt und vernichtet werden können. Die Kraft der Wärme. Im Jahr 1824 erschien Sadi Carnot’s Buch mit dem Titel Reflexion sur la puissance motrice du feu. Wir borgen von ihm das Bild, was Energie mit Prozessen zu tun hat (siehe schon Kapitel 4). Seine puissance (englisch: power) bedeutet Kraft oder Macht, es geht also um die Kraft der Wärme, die er sich als Wärmestoff vorstellte. Bei Carnot taucht zum ersten mal vollkommen klar differenziert der Zusammenhang zwischen Menge, Intensität und Macht eines Phänomens auf (und ist in dieser expliziten Form so gut wie das einzige Beispiel für diese Denkweise in der Physik geblieben, bis es Ende des 20. Jahrhunderts als allgemeine Form wieder aufgegriffen wurde): 222 Thermische Systeme D’après les notions établies jusqu’à présent, on peut comparer avec assez de justesse la puissance motrice de la chaleur à celle d’une chute d’eau [. . . ]. La puissance motrice d’une chute d’eau dépend de sa hauteur et de la quantité du liquide; la puissance motrice de la chaleur dépend aussi de la quantité de calorique employé, et de ce qu’on pourrait nommer, de ce que nous appellerons en effet la hauteur de sa chute, c’est-à-dire de la différence de température des corps entre lesquels se fait l’échange du calorique. Mit Hilfe unserer Prozessdiagramme (Kapitel 6) können wir seine Worte in eine visuelle Metapher und diese dann in eine Gleichung überführen (Abb.7.6): (7.2) Pth = (T1 − T2 ) IS Wir sagen in moderner Sprache, dass ein Wärmestoffstrom IS , der durch eine Wärmekraftmaschinen von einer Temperatur T1 (Ofen) auf eine Temperatur T2 (Kühler) fällt, Energie mit der Rate Pth freisetzt. Diese Rate nennen wir thermische Leistung: sie ist Carnot’s Kraft der Wärme. Das ist analog zur Rate, mit der Energie durch fallendes Wasser freigesetzt wird (siehe Tabelle 6.2). Die Beziehung für Wärmestoffproduktion Gl.(7.1) folgt also aus diesem Bild. Das Selbe gilt auch für die Energie, die zum Pumpen von Wärmestoff (z.B. im Peltier-Element, Abb.7.4) gebraucht wird. Diese Zusammenhänge zwischen Entropie, Temperatur und Energie werden ausführlicher in Kapitel 8 behandelt. Heat engine Pmech Heat flow Angular momentum Pth IS T2 IS T1 Abbildung 7.6: Eine Wärmekraftmaschine (im Bild eine Stirling Maschine) setzt Energie mit einer Rate frei, die proportional zum Wärmestoffstrom und zum Gefälle der Temperatur zwischen Eingang und Ausgang der Maschine ist. Das Prozessdiagramm erinnert an ein Wasserfallbild, so wie es Carnot’s Worte suggerieren. Entropie. In der nach 1850 entwickelten Form der Thermodynamik ist die Wärmestoffvorstellung beiseite geschoben worden. Obwohl Wärmephänomene einen Mengenaspekt haben (so will es die menschliche Vorstellung), hat Clausius diesen Aspekt nicht weiter in die immer formaler werdende Theorie übernommen. William Thomson (Lord Kelvin) und Clausius entwickelten eine Form der Theorie, in der ein Aspekt der Wärme (Wärmetransport) mit Energie(transport) gleich gesetzt wurde. In salopper aber falscher Form sagen wir heute, Wärme sei Energie. (Nur fliessende Wärme ist in der Standard-Theorie Energie; Wärmeinhalt gibt es darum in der traditionellen Thermodynamik nicht.) Wenn man das macht, dann vermischt man den Mengencharakter der Wärme mit ihrem Kraftcharakter. Die so geformte Theorie ist nur noch formal, sie hat keinen bildhaft verständlichen oder grundlegend menschlichen Charakter mehr. Natürlich rächt sich die Wärme an uns für diese Verzerrung menschlicher Vorstellungen und zwingt uns, eine neue formale Grösse einzuführen, damit die Theorie 7.1 Phänomene und Wortmodelle 223 doch vollständig wird. Clausius hat das getan und das Konzept der Entropie eingeführt, das als rein mathematisches Konstrukt aufgefasst wird und als nicht wirklich verständlich gilt. Kurz nach 1900 hat der Thermodynamiker H. L. Callendar darauf hingewiesen, dass Clausius’ Entropie im Wesentlichen dem Caloricum von Sadi Carnot entspricht, und dass man darum die Entropie sehr leicht durch die bildhafte Vorstellung der Funktionsweise von Wärmekraftmaschinen von Carnot verstehen kann. Gegen Ende des 20. Jahrhunderts wurden dann Darstellungen der Thermodynamik erarbeitet, wo die Entropie in Analogie zum Wärmestoff von Sadi Carnot und seinen Vorgängern erscheint (natürlich mit der Erweiterung, dass der Wärmestoff erzeugbar sein muss). Auf diesen Darstellungen bauen wir die Theorie der Dynamik der Wärme in unserem Kurs auf. Wir verwenden von nun an öfter das formale Wort Entropie für Wärmestoff. Box 7.1: Wärmestoff und Entropie Bilder sind mächtig, besonders weil wir sie oft für die Realität oder die Wahrheit halten, statt für das, was sie sind: mächtige Vorstellungen, mit denen wir gut arbeiten können, wenn die Bilder stimmig sind. Wenn man Clausius’ “Wärme ist Energie” für wahr nimmt, dann muss Carnot natürlich Unrecht haben. Dass Wärmestoff und Entropie im Wesentlichen die selbe Bedeutung haben, ist dann kaum mehr zu erkennen. Der Weg zu einer einfachen bildhaften Darstellung thermischer Vorgänge ist ein für alle mal verbaut. Dass Clausius die Wärme direkt als Energiegrösse eingeführt hat, hat allerdings nicht nur mit der damals aufkommenden Vorstellung von Energie zu tun. Es ist noch etwas anderes um diese Zeit in die Physik übernommen worden: die Vorstellung, dass die Welt aus kleinen Teilchen bestehe, die im leeren Raum rumsausen und so durch die Theorie der Mechanik die Erklärung für alles in der Welt liefern. Clausius (1850): Dazu kommt noch, dass in neuerer Zeit immer noch mehr Thatsachen bekannt werden, die dafür sprechen, dass die Wärme nicht ein Stoff sei, sondern in einer Bewegung der kleinsten Theile der Körper bestehe. Für Clausius war das Mass der “Bewegung”, von der er spricht, die Energie der Bewegung, und daraus folgt schliesslich die heute übliche Interpretation der Wärme. Das macht dann eine umständliche und indirekte Einführung der Entropie notwendig. Man versteht so ihre grundlegende und einfache Bedeutung nicht. Nach Clausius wurde auf der Vorstellung der Bewegung kleiner Teilchen die statistische Interpretation der Entropie entwickelt. Dort entspricht die Entropie der Zahl möglicher “Anordnungen” oder Zustände einer Ansammlung von Teilchen. Diese Interpretation wird populär (wenn auch unbrauchbar) als “Entropie ist (ein Mass für) Unordnung” dargestellt. Interessant ist, dass man ja in Clausius’ Satz das Wort “Bewegung” als “Mass für die Regellosigkeit der Bewegung” nehmen könnte. Dann wäre Wärme eben dieses Mass und würde mit der Entropie und nicht mit der Energie in Verbindung gebracht. Das ist in der Geschichte aber nicht passiert. Die Vorstellung von der Energie war zu mächtig und, wie der Mathematiker C.A. Truesdell bemerkte, Clausius’ mathematische Künste zu gering, etwas anderes zu denken. 224 Thermische Systeme 7.1.6 Heizen von Wasser und Glykol Wenn man Flüssigkeiten in einem so gut wie möglich thermisch isolierten Gefäss elektrisch heizt, so kann man indirekt die Beziehung zwischen (Änderung der) Wärmestoffmenge in der Flüssigkeit und (Änderung der) Temperatur beobachten und so experimentell das Temperatur-Wärmestoff-Diagramm für einen Stoff wie in Abb.7.3 bestimmen. Die Temperatur kann man messen, und da die elektrische Leistung eines Tauchsieders auch sehr leicht messbar ist, lässt sich nach Gl.(7.1) die Produktionsrate der Entropie bestimmen. Wenn wir annehmen, es gehe keine Entropie wegen Wärmeverlust an die Umwelt verloren, so bedeutet das, dass wir die Zunahme der Entropie mit der Erhöhung der Temperatur in Verbindung bringen können. Wenn wir reale Daten für Wasser und Glykol betrachten (Abb.7.7), sehen wir folgende Erscheinungen. Wie erwartet steigt die Temperatur mit der gespeicherten Wärmestoffmenge – wenn das Material keine anderen Prozesse wie Volumenänderung, Phasenänderung (oder generell chemische Änderungen) durchmachen kann, dann macht Wärmestoff warm. Zweitens stellen wir fest, dass Einheitsmengen verschiedener Stoffe verschieden stark auf Entropie reagieren: Glykol lässt sich leichter erwärmen – hat eine höhere Erwärmbarkeit – als Wasser (der Unterschied ist grob ein Faktor 2). Anders gesagt, Wasser braucht mehr Entropie, um sich gleich stark zu erwärmen. Das ist wie ein dickerer Tank, der mehr Flüssigkeit als ein dünnerer braucht, um sich zu füllen. Also hat Wasser die grössere Wärmestoffkapazität (Entropiekapazität) als Glykol. X XX XX X X X X X X X X X 350 X X X X X X X X X X X XX WaterX X 330 X XX X X XX XX X X XGlycol X X X 310 0 1000 1 Pressure / mbar Temperature / K 370 995 BB B B H 2 H H H 990 B H J J B H J J H 3 B J H J B H J J 985 980 975 0 1 1 2 2 3 4 Volume / L 5 3 200 400 600 800 Specific Entropy / J/(K·kg) Abbildung 7.7: Experimentelle Daten zum Zusammenhang zwischen Temperatur und spezifischer Entropie (Entropie pro Masse) von zwei Flüssigkeiten: Wasser und Glykol. Die Interpolationskurve für Glykol ist eine Gerade, die für Wasser eine wachsende Exponentialfunktion. Im Vergleich zur Hydraulik handelt es sich beim beim TS-Diagramm um das Druck-Volumen Diagramm, d.h., die kapazitive Charakteristik (Abb.3.5). Eine dritte Beobachtung betrifft die Form der charakteristischen Kurve. Die Daten für Glykol passen fast perfekt auf eine Gerade. Das bedeutet, dass Glykol eine konstante Entropiekapazität haben sollte. Schaut man bei Wasser genau hin, so sieht man, dass die Kurve mit steigender Entropie oder Temperatur stärker ansteigt – die Erwärmbarkeit von Wasser nimmt mit der Temperatur zu, die Entropiekapazität nimmt ab – sie ist also nicht konstant. Präzise Messungen zeigen, dass eine steigende Exponentialfunktion die Daten sehr gut annähert. 7.1 Phänomene und Wortmodelle 225 10. Welche Einheit muss laut Gl.(7.1) die Produktionsrate des Wärmestoffs haben? Welche Einheit hat demnach der Wärmestoff (Entropie)? Denken Sie daran, dass die Einheit der Temperatur das Kelvin (K) ist. Fragen & Übungen 11. Sie betreiben einen elektrischen Tauchsieder mit einer elektrischen Leistung von 300 W. Nehmen Sie an, er heize Wasser bei gerade 27°C. Wie gross ist in dem Moment die Entropieproduktionsrate (Produktionsrate des Wärmestoffs)? Nimmt die Entropie des Wassers darum gerade mit dieser Rate zu? 12. Bei einem grossen thermischen Kraftwerk sei die elektrische Leistung 1.0 GW. Die Energie wird durch das Herunterfallen des Wärmestoffs vom Reaktor (Temperatur 600 K) zum Kühler (Temperatur 300 K) freigesetzt (zur Verfügung gestellt). Wie gross ist demnach der Wärmestoffstrom (Entropiestrom) durch die Wärmekraftmaschine? 13. Welcher Stoff ist – auf die Masse bezogen – leichter erwärmbar: Wasser oder Glykol? Was heisst das für die Entropiekapazität? Wie sieht man in einem TS -Diagramm, dass die Entropiekapazität eines Stoffs konstant ist? 14. Wie gross ist die Erwärmbarkeit eines Gemisches von Eis und Wasser (Eis beim Schmelzen oder Wasser beim Gefrieren, Abb.7.2)? Warum kann man den Phasenübergang nicht mit einer Entropiekapazität (Wärmestoffkapazität) beschreiben? Phänomene in thermischen Systemen Quellen Lectures and books · Fuchs H. U. (2010): The Dynamics of Heat. A Unified Approach to Thermodynamics and Heat Transfer. Springer, New York. Chapter 4, pp. 99-107. · Fuchs H. U. (2006-2010): Lecture Notes for NTS. Course Website. Chapter 3, pp. 1-9. Chapter 1 (Long version), pp. 1-7. · Borer T., Frommenwiler P., Fuchs H. U., et al. (2010): Physik, ein systemdynamischer Zugang. h.e.p. verlag, Bern. pp. 116-117, 120-121. Wärme, Temperatur, Energie Lectures and books · Fuchs H. U. (2010): The Dynamics of Heat. A Unified Approach to Thermodynamics and Heat Transfer. Springer, New York. Chapter 4, pp. 131-141. · Fuchs H. U. (2006-2010): Lecture Notes for NTS. Course Website. Chapter 3, pp. 1-9. Chapter 1 (Long version), p. 9. · Borer T., Frommenwiler P., Fuchs H. U., et al. (2010): Physik, ein systemdynamischer Zugang. h.e.p. verlag, Bern. pp. 122-123. Quellen 226 Thermische Systeme 7.2 Modelle dynamischer Systeme Wir werden uns in diesem Kapitel auf konkrete Modelle des Heizens und Kühlens von Materialien beschränken, deren einzige Reaktion auf Wärmestoff eine Temperaturänderung ist (wir vernachlässigen mögliche Volumenänderungen, Phasenänderungen oder sonstige Änderungen von Eigenschaften). 7.2.1 Angleich von Temperaturen Mit einem Modell, das analog zu den für Lohnangleich (Abb.2.3), Niveauausgleich (Abb.2.10) und Spannungsausgleich bei Kondensatoren (Abb.4.3) ist, kann für die beiden in Abb.7.1 dargestellten Phänomene mit ihren Messungen angewendet werden (Abb.7.8 rechts). Wir ersetzen entsprechend den Vorstellungen in Tabelle 7.1 Ladung durch Wärmestoff (Entropie), Ladungsstrom durch Wärmestoffstrom (Entropiestrom), Spannungen der Kondensatoren durch Temperatur der beiden Körper, Spannung über dem Widerstandselement durch Temperaturdifferenz, Leitwert durch Entropieleitwert GS und elektrische Kapazitäten durch Entropiekapazitäten (für die wir das Symbol K oder KS verwenden). G Q1 GS S1 Q2 IQ IS C1 C2 UR U C1 S2 U C2 K1 K2 delta T T1 T2 Abbildung 7.8: Diagramm eines systemdynamischen Modells für den Angleich der Temperaturen von zwei in Wärmekontakt stehenden Körpern (rechts). Das Diagramm ist vollkommen analog zu dem für den Angleich von Spannungen von Kondensatoren (links) aus Abb.4.3 (und natürlich auch dem von Füllniveaus in Abb.2.10). Um zu sehen, wie weit die Modellvorstellungen schon reichen, wenden wir das Modell in Abb.7.8 (rechts) auf das konkrete Experiment, das in Abschnitt 7.1.1 besprochen und in Abb.7.1 (oben) dargestellt ist. Dabei handelt es sich um den Angleich von Temperaturen von zwei Wassermengen in zwei gleich grossen Kammern. Das ganze Gefäss ist nach aussen recht gut thermisch isoliert. Man sieht, dass sich die gemessenen Temperaturen so verhalten, wie wir das von analogen hydraulischen und elektrischen Systemen erwarten würden (siehe Abb.7.9, rechts). Macht man eine Simulation mit gleichen konstanten Kapazitäts-Werten für die beiden Wassermengen, so erhält man die Kurven, die sich erwartungsgemäss genau in der Mitte zwischen den beiden Anfangstemperaturen treffen. Die gemessenen Temperaturen treffen sich allerdings leicht unter dem Mittelwert de beiden Anfangstemperaturen. Da das Gefäss nicht perfekt thermisch isoliert werden kann, ist es möglich, dass der Unterschied zwischen unserem ersten Modell und den Daten durch Entropieverlust an die Umgebung erklärbar ist. Tatsächlich kann man das Modell durch eine einfache Darstellung dieses Effekts (Kühlen eines Körpers in kühlerer Umgebung, siehe Abschnitt 7.2.2) ergänzen und erhält dann eine Simulation, die kaum mehr von den Messungen unterschieden werden kann. Obwohl das Modell gut funktioniert, sollten wir vorsichtig sein. Wir wissen aus Beobachtungen, dass der Zusammenhang zwischen Temperatur und gespeicherter Wärmestoffmenge (Entropie) bei Wasser nicht linear ist – und damit ändern sich 7.2 Modelle dynamischer Systeme 227 360 Temperature / K 350 340 Simulation 330 320 Experiment 310 300 290 0 500 1000 1500 Time / s 2000 2500 Abbildung 7.9: Diagramm eines systemdynamischen Modells für den Angleich der Temperaturen von zwei in Wärmekontakt stehenden Körpern (links). Im Diagramm rechts sind eine Simulation und Daten zu sehen – die Daten stammen aus dem in Abb.7.1 oben gezeigten Experiment. die Voraussetzungen für die konstitutiven Beziehungen und, wie wir sehen werden, auch für die Prozesse. Man hat auf jeden Fall man drei Probleme zu lösen. · (1) Das erste kennen wir von den RC-Systemen, wie sie in den Kapiteln 3 und 4 schon besprochen wurden: Mann kann mit Hilfe des Modells und einer Messung die beiden Parameter – Kapazität und Leitwert – nicht unabhängig voneinander bestimmen (siehe die Diskussion in Abschnitt 4.5). Nur ihr Produkt ist durch die Dynamik festgelegt. Man braucht also unabhängige Messungen (am einfachsten einen der beiden Parameter separat), um beide Grössen zahlenmässig festzulegen. · (2) Das zweite Problem, das sich hier auftut, hat damit zu tun, dass die Entro- piekapazität von Wasser nicht konstant ist, sondern von der Temperatur des Körpers abhängt. Aus der Theorie und Praxis der Thermodynamik, von der wir hier ein klein wenig etwas sehen werden, weiss man, dass die Entropiekapazität von 1 kg Wasser bei 20°C ungefähr 14.3 J/K2 beträgt und invers mit der (Kelvin-)Temperatur variiert. Obwohl die Variabilität im Bereich der Temperaturen im Experiment nicht sehr hoch ist, sollte man das Modell verbessern lernen. · (3) Das dritte Problem betrifft einen grundsätzlichen Fehler, den wir gemacht haben. Etwas weniger drastisch ausgedrückt, wir haben einen Prozess vernachlässigt, der hier noch dazu kommt, allerdings auch wieder keinen allzu grossen Einfluss hat: Wenn Wärmestoff (Entropie) von Orten mit höherer zu solchen mit tieferer Temperatur fliesst, entsteht Wärmestoff (Entropie). Das macht sich bei hohen Temperaturunterschieden deutlich bemerkbar, in unserem Experiment allerdings noch nicht so stark. Wir werden an dieser Stelle das Modell noch nicht verbessern, sondern mit konstanter Kapazität von 13 J/K2 für ein Kilogramm Wasser arbeiten (im ersten Experiment in Abb.7.1 waren je 0.95 kg Wasser in jeder Kammer) und so durch Anpassen des verbleibenden Parameters GS dessen unbekannten Wert bestimmen. Wir wollen aber kurz diskutieren, warum wir annehmen sollten, dass bei der Wärmeübertragung mehr Wärmestoff entsteht. Wenn man im Experiment die beiden Wassermengen nach aussen perfekt isoliert, treffen sich die beiden Temperaturen fast genau in der Mitte zwischen den beiden 228 Thermische Systeme Anfangstemperaturen (Abb.7.1, oben rechts). Wenn die beiden Entropiekapazitäten konstant wären, dann wäre auch das Modell perfekt und es gäbe keine Entropieproduktion zu berücksichtigen. Die Kapazitäten variieren aber umgekehrt mit der Temperatur, was heisst, dass die mittlere Kapazität des wärmeren Wassers kleiner als die des kühleren Wassers ist. Wenn man das im Modell berücksichtigt, dann wird die Gleichgewichtstemperatur am Schluss im Modell etwas unter dem Mittelwert der Anfangstemperaturen zu liegen kommen – im Gegensatz zum Experiment. Da das Wasser real am Ende wärmer als im Modell ist, muss etwas mehr Wärmestoff am Ende als am Anfang da sein: Entropie muss entstanden sein. Das muss man sich noch anders überlegen. Laut Gl.(7.1) muss Energie freigesetzt werden, damit Wärmestoff entstehen kann. Das ist laut GL.(7.2) der Fall: Wärmestoff fliesst bergab vom wärmeren zum kühleren Körper, setzt also Energie frei – das müsste aus Analogie mit bisherigen Prozessen der Fall sein, auch wenn wir davon scheinbar nichts merken. Mit dieser Energie kann man was anfangen, nur ist hier die einzige Möglichkeit, dass Entropie entsteht. Würde etwas anderes passieren, wenn man die Trennwand im Gefäss im Experiment durch ein Peltier-Element ersetzen würde (wie im Bild in Abb.7.4)? Das ist genau der Fall! Das Peltier-Element arbeitet dann als Wärmekraftmaschine, das heisst, es benutzt freigesetzte Energie, um elektrische Ladung zu pumpen (das Element arbeitet dann als elektrischer Generator). Fragen & Übungen 15. Warum sollte man im Modell in Abb.7.9 erwarten, dass die Gleichgewichtstemperatur in der Simulation genau in der Mitte zwischen den beiden Anfangstemperaturen liegt? 16. Warum liegt die Gleichgewichtstemperatur in einem Modell wie in Abb.7.8 (rechts) bei gleichen Wassermengen unterhalb der mittleren Temperatur, wenn man Entropieproduktion vernachlässigt? 17. Welche Einheit muss die Entropiekapazität haben? Die Entropiekapazität pro Kilo- gramm (man spricht von der spezifischen Entropiekapazität, Entropiekapazität pro Masse)? 18. Welche Einheit muss der Entropieleitwert haben? 19. Wie hoch sind die Anfangstemperaturen der beiden Wassermengen im Experiment in Abb.7.1 in der absoluten (Kelvin) Skala? 20. Thermische Landschaft. Im Experiment in Abb.7.4 werden die beiden Wassermengen gerührt, was bedeutet, dass die Temperaturen im Wasser räumlich homogen sind. Allerdings geht die Temperatur in einer dünnen Übergangsschicht im Wasser zum Peltier-Element hinunter (damit der Wärmestoff fliesst), geht im Peltier-Element hinauf (der Wärmestoff wird gepumpt) und fällt wieder in einer dünnen Schicht im Wasser auf der anderen Seite. Denken Sie sich eine gerade Linie vom einen Wasserkörper zum anderen. Definieren Sie entlang der Linie ein paar wichtige Punkte. Zeichnen Sie dann ein Diagramm, in dem die Temperatur als Funktion der Position entlang dieser Linie skizziert wird. Denken Sie sich einen geschlossenen Pfad vom Anfang der Linie, entlang der Linie und zurück durch die “Unterwelt” bei 0 K zum Anfang. Ist die Summe aller Temperaturunterschiede gleich Null? 7.2.2 Heizen und Kühlen von Wasser In diesem Beispiel werden wir ein Modell eines thermischen RC-Systems machen, das uns erlaubt, Kapazität und Entropieleitwert unabhängig voneinander zu bestimmen. 7.2 Modelle dynamischer Systeme 229 Wir betrachten das gleichzeitige Heizen und Kühlen von Wasser in einem Gefäss mit einem Tauchsieder. Damit werden wir einen Wert für die Entropiekapazität von Wasser erhalten. Eine bestimmte Menge Wasser wird in einem geschlossenen dünnwandigen Metallgefäss mit Hilfe einer regelbaren elektrischen Heizung erwärmt (Abb.7.10). Wir verstehen das System und seine Prozesse durch folgendes Modell. Wir haben einen einzigen Körper (die vorgegebene Menge Wasser) in einer Umwelt konstanter Temperatur; im Modell gehört dazu ein Reservoir, das den momentanen Entropieinhalt des Wassers repräsentiert. Wenn das Wasser die selbe Temperatur hat und nicht geheizt oder gekühlt wird, passiert nichts. Wir haben aber einen elektrischen Heizdraht im Wasser und lassen diese Heizung laufen. Es wird Entropie erzeugt (der elektrische Vorgang stellt Energie zur Verfügung), die im Wasser gesammelt wird. In typischer Software für systemdynamische Modelle werden alle Prozesse – auch solche von Erzeugung oder Vernichtung – durch Flows dargestellt, also gibt es im Modell einen Zufluss zum Reservoir, der durch die Beziehung entsprechend Gl.(7.1) festgelegt wird: ΠS = 1 Pdiss T (7.3) Natürlich ist die Dissipationsrate gleich der elektrischen Leistung: alle Energie, die die elektrische Heizung zur Verfügung stellt, wird im Prozess der Entropieerzeugung genutzt (in der Technik sagt man, eine elektrische Heizung sei vollkommen dissipativ). Temperature / K 320 310 300 EE EEEEEEEEEEEEEEEEEEEEEEEEEEEEEEE EEEEEEEEEEE EE EEEEEEEE E EEEEEEE EEEEE EEEE EEEE E E E E EEE EE EE E E EE E E E E E E E E E E E 290 0 2000 4000 6000 8000 10000 Time / s Abbildung 7.10: Daten des elektrischen Heizens von Wasser (210 g) bei einer elektrischen Leistung von 10 W in einem geschlossenen dünnwandigen Metallgefäss (links). Das Gefäss befindet sich in einer Umgebung bei konstant 293 K. Rechts: Diagramm eines dynamischen Modells für das thermische System. Aufgrund der Vermehrung der Entropie im Wasser wird dieses wärmer. Nun setzt ein zweiter Vorgang ein: das wärmer werdende Wasser kühlt sich in der Umgebung ab, das es jetzt einen Temperaturunterschied als Antrieb für einen Wärmestoffstrom gibt. Diesen machen wir proportional zum Temperaturunterschied zwischen Wasser und Umwelt, wobei wir einen noch unbekannten Leitwert für die Entropie benützen: IS = GS (T − Ta ) (7.4) Das Symbol Ta steht für die Umgebungstemperatur, die hier 20°C beträgt. Die in der Gleichung ausgedrückte Idee entspringt der selben Annahme, die wir schon öfter getroffen haben: ein Transport ist proportional zu seinem Antrieb (Temperaturunterschied als thermische Spannung). Ob diese Idee gut ist, kann nur der Vergleich mit Messungen zeigen. 230 Thermische Systeme Der letzte fehlende Aspekt im Modell betrifft die Bestimmung der Temperatur des Wassers. Obwohl wir schon gehört haben, dass die Entropie-Kapazität von Wasser nicht konstant ist, werden wir uns mit diesem Ansatz begnügen und daher Folgendes annehmen: 1 T = S (7.5) K Der Vollständigkeit halber schreiben wir noch die Entropiebilanzgleichung (Wärmestoffbilanz) für das Wasser auf. Der Wärmestoff im Wasser ändert seine Menge aufgrund der Erzeugung und des Abflusses: (7.6) Ṡ = −IS + ΠS Diese Beziehung sehen wir in der grafischen Darstellung des Modelldiagramms (siehe die Konstruktion aus Reservoir und zwei Flows, Abb.7.10, rechts). Konzepte Wärmestoffbilanz (Entropiebilanz) Bilanzen stellen den Zusammenhang zwischen Speicherung von anhäufbaren Grössen und ihren Transporten und oder ihrer Erzeugung dar. Für Volumen und elektrische Ladung haben wir Bilanzgleichungen mit Änderungsraten der gespeicherten Menge und den zugehörigen Strömen gesehen. Entropie (Wärmestoff) ist wie Ladung oder das Volumen einer Flüssigkeitsmenge eine bilanzierbare Grösse, wobei hier nun zum ersten Mal ein Produktionsprozess gleichzeitig mit Transportprozessen auftreten kann. Aus diesem Grund muss in der Bilanzgleichung ein Term für die Erzeugung der Entropie mit eingeführt werden: X dS = IS,i + ΠS , dt X 4S = Se,i + Sprod , ΠS ≥ 0 (7.7) Sprod ≥ 0 (7.8) Die zweite Gleichung ist die integrierte Version für eine Zeitspanne. Der Index e bedeutet ausgetauscht oder transportiert (e: exchanged). prod steht für produziert. Das Zeichen ≥ sagt uns, dass eine Entropieproduktionsrate nicht negativ sein kann (sie darf Null sein; wenn das eintritt, heisst der Prozess reversibel ). Simulation und Bestimmung der Parameter. Wenn man versucht, Simulationsergebnisse dieses Modells an die gemessenen Daten anzupassen, so geht das sehr gut. Insbesondere hat man keine Freiheit mehr. Die beiden noch unbekannten Parameter – Entropiekapazität und Entropieleitwert – können beide separat bestimmt werden, nicht nur in Kombination wie zum Beispiel beim Entladen oder Laden eines Kondensators. Den Grund kann man sich so überlegen. Da wir die Entropieproduktionsrate kennen – sie ist durch die Leistung des elektrischen Prozesses und die Temperatur des Wassers festgelegt – und die erzeugte Entropie im stationären Zustand aus dem Wasser hinaus fliessen muss, kann man den Entropieleitwert zuerst unabhängig bestimmen. Im stationären Zustand (Abschnitt 3.2.3) gilt dS/dt = 0, und daher muss der Entropiestrom gleich der Erzeugungsrate der Entropie sein: IS = ΠS 7.2 Modelle dynamischer Systeme 231 Wenn man die beiden Beziehungen Gl.(7.3) und Gl.(7.4) einsetzt, so ergibt sich GS (T − TA ) = 1 Pel , T woraus man GS mit Hilfe der Daten aus dem Experiment bestimmen kann. In unserem Fall (Abb.7.10) ergibt sich ein Wert von ungefähr 1.5 · 10−3 W/K2 . Die Entropiekapazität des Wassers lässt sich jetzt mit der Entropiebilanz Gl.(7.6) und der dynamischen Form von Gl.(7.5), nämlich (7.9) Ṡ = K Ṫ bestimmen. Das geht besonders einfach für den Anfangszeitpunkt des Experimentes, in dem in unserem Fall IS = 0 W/K gilt. Die Änderungsrate der Temperatur zu diesem Anfangszeitpunkt liest man aus den Daten des Experiments. So erhält man in unserem Fall K = 3.1 J/K2 . Da die Masse des Wassers im kleinen Behälter 0.210 kg beträgt, ist die spezifische Entropiekapazität von Wasser ungefähr k= 3.1 J J K ≈ = 14.8 2 m 0.210 K2 kg K kg k ist das Symbol für die spezifische Entropiekapazität. Der Wert ist höher als genauere Messungen ergeben. Eine Simulation des Modells mit Parameteranpassung liefert leicht bessere Werte als die hier von Hand aus dem Diagramm gelesenen. 1900 s Temperature / K 320 310 300 EE EEEEEEEEEEEEEEEEEEEEEEEEEEEEEEE EE EEEEEEEEE EE EEEEEEEE E EEEEEEE EEEEE EEEE EEEE E EEE EEE EE EE E E EE EE E E E E E E E E E dT 21 K K ≈ = 0.011 dt 1900 s s 314 K 306 K = 293 K + 0.63·21 K 293 K 290 0 2000 4000 6000 Time / s 8000 10000 Abbildung 7.11: Bestimmung der Temperatur des stationären Zustands und der Änderungsrate der Temperatur gerade am Anfang. 21. Wie gross ist die Entropiekapazität von 10 kg Wasser? 22. Wie gross wäre der Entropieleitwert des im Experiment verwendeten Systems, wenn die Oberfläche zwei mal so gross (und alles Andere exakt gleich) wäre? 23. Warum ist der Wärmestoffstrom (Entropiestrom) aus dem Gefäss bei t = 0 s gleich Null? 24. Bestimmen Sie die Änderungsrate der Entropie des Wassers bei t = 0 s aus den experimentellen Daten. 25. Warum folgt die dynamische Form des Zusammenhangs zwischen gespeichertem Wärmestoff (Entropie) und der Temperatur des Materials in Gl.(7.9) nicht direkt aus unserer bisherigen Definition in Gl.(7.5)? Welche zusätzliche Annahme muss man treffen? Folgt umgekehrt Gl.(7.5) aus Gl.(7.9)? Ist eine der beiden Formen allgemeiner als die andere? Fragen & Übungen 232 Thermische Systeme 26. Welche Beziehung zwischen den im System in Abb.7.10 auftretenden Prozessen gilt im stationären Zustand? 27. Kann man die beiden Materialparameter (Entropiekapazität des Wassers und Entro- pieleitwert der Oberfläche des Systems) auch dann unabhängig voneinander bestimmen, wenn die Temperatur des Wassers am Anfang nicht gleich der der Umgebung ist? 28. Eiskaltes Wasser wird in eine Flasche gegossen, eine Magnetstab zum Rühren wird dazugegeben, die Flasche wird verschlossen und in einem warmen Raum auf einen Magnetrührer gestellt. Das Wasser in der Flasche wird also laufend gerührt. Wir sich die Wassertemperatur nach längerer Zeit auf die Umgebungstemperatur einstellen? Wird sie tiefer oder höher sein? 7.2.3 Dynamisches Verhalten von Thermometern In Abb.7.12 sieht man die Temperaturangabe eines Thermometers, das zuerst in heisses Wasser gesteckt und dann herausgenommen, schnell abgetrocknet und an die Luft gelegt wurde. Man sieht, dass der Sensor nicht sofort sondern verzögert auf die sprunghafte Änderung der Temperatur seiner Umgebung reagiert – im Wasser noch halbwegs schnell, an der Luft aber äusserst langsam. Es scheint unmöglich, so ein Thermometer für die Messung von relativ schnell variierender Lufttemperatur zu gebrauchen. Ein dynamisches Modell für das Thermometer ist strukturell äusserst einfach. Der Sensor speichert Entropie, und es gibt Entropietransfer zwischen ihm und seiner Umwelt. Speicherung und Transfer können wie in den bisherigen Modellen konzeptualisiert werden. Die einzige Schwierigkeit beim Modell ist eine praktische. Umwelttemperatur und Entropieleitwert hängen von den jeweiligen Umständen ab, die man mit IF. . . THEN. . . ELSE. . . Konstrukten in den Griff kriegt. In Tabelle 7.2 sind Werte für die verschiedenen Phasen angegeben, die ein fast perfektes Simulationsergebnis liefern. Temperature / K 330 320 310 300 E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E 290 0 100 200 300 Time / s 400 500 Abbildung 7.12: Temperatur eines Thermometer, das zuerst in heisses Wasser gesteckt und danach (getrocknet) an die Luft gelegt wird. Das Modell (rechts) bildet das Verhalten des Thermometers als thermisches System ab. Das Modell funktioniert äusserst gut, es hat aber einen Haken: wir kennen die Entropiekapazität des Thermometers nicht, und deshalb können wir die Leitwerte auch nicht absolut sondern nur relativ zueinander bestimmen (die Wärmeübertragung im Wasser geht zwanzig mal besser als in der Luft). Wir haben das klassische Problem eines einfachen RC-Systems, bei dem durch die Dynamik alleine nur die Zeitkonstante, nicht aber die Kapazitäts- und Leitwerte (oder Widerstandswerte) bestimmt sind. 7.2 Modelle dynamischer Systeme 233 Tabelle 7.2: Parameter für das Modell in Abb.7.12. Ta / K K S / J/(K2 kg) G S / W/K 298.4 1.0 · 10−3 1.0 · 10−5 39 s – 108 s 322 1.0 · 10−3 2.0 · 10−4 108 s – 500 s 298.4 1.0 · 10−3 1.0 · 10−5 Phase 0 s – 39 s Die Kapazität (oder den Leitwert) durch andere Versuche separat auszumessen, ist praktisch fast nicht möglich. Stellen Sie sich vor, wir wollten unser Thermometer trotzdem für die Messung relativ schnell sich ändernder Lufttemperatur einsetzen, was bedeutet, dass wir seine Dynamik in einem Modell mit einbeziehen müssen. Die Idee ist folgende. Mit dem Thermometer erhalten wir Daten. Das Modell eines Systems sagt Temperaturen im System voraus, die aber nicht mit den gemessenen übereinstimmen können, weil das Thermometer auf jede Änderung der Temperatur verzögert reagiert. Wenn wir die Daten mit dem Modell vergleichen wollen, müssen wir das Thermometer als Element im System behandeln. Das macht man folgendermassen. Die Form des zeitlichen Verhaltens der Temperatur nennt man eine Verzögerung erster Ordnung mit einer bestimmten Zeitkonstante (Abb.7.13; die beiden Zeitkonstanten kann man grafisch ungefähr ausmessen, und man erhält etwa 5 s für die erste und etwas weniger als 100 s für die zweite). Sie entspricht den Formen, die wir vom Füllen und Entleeren von einfachen Behältern kennen. Temperature / K 330 320 310 300 E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E E 313 K 307 K 290 0 100 200 300 Time / s 400 500 Abbildung 7.13: Bestimmung der Zeitkonstanten des Thermometers in Wasser (Anstieg der Temperatur) und in der Luft (Sinken der Temperatur). Die erste Zeitkonstante entsprich der Dauer, bis die Temperatur vom Anfangswert um 63% der Differenz zum Endwert erhöht wurde. Die zweite Zeitkonstante entspricht der Dauer, in der die Temperatur vom Anfangswert um 63% der Differenz zum Endwert gefallen ist (also noch 37% der Differenz höher als der Endwert liegt). Man kann diese Form von Kurven in einem einfachen mathematischen Modell ähnlich wie in Abb.7.12 nachbilden. Man deutet die bisherigen Ideen von Inhalt und Strom, der den Inhalt ändert, rein mathematisch. Dann steht ein Reservoirsymbol für eine veränderliche Grösse, und ein einziges Flowsymbol (als Zufluss gezeichnet), wird als Änderungsrate dieser Grösse interpretiert (Abb.7.14). Damit sich die Temperatur des modellierten Thermometers (TT h ) so verhält, wie wir es vom materiellen Thermometer aus dem Experiment kennen, muss man die Änderungsrate seiner Temperatur proportional zur Differenz zwischen ThermometerTemperatur und Temperatur des Mediums (T ), in das man das Thermometer steckt, 234 Thermische Systeme 360 Temperature / K EEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEEE dTTh/dt 340 320 EEEEEEEEEEEEEEEEEEEEEEEEEEEEEEE 300 EEEEEE 280 0 500 1000 Time / s 1500 Abbildung 7.14: Links: Diagramm eines dynamischen Modells der Verzögerung erster Ordnung der Temperatur eines Thermometers. Ein Reservoir wird als Grösse uminterpretiert (TT h ), die sich ändern soll. Der einzige Flow repräsentiert ihre Änderungsrate (dTT h /dt). Diese Änderungsrate wird von der Differenz zwischen Aussentemperatur T und Temperatur des Thermometers (TT h ) gemacht. Die Inverse der Zeitkonstante ist die Proportionalitätskonstante der Änderungsrate. Rechts: Simulation eines Vorgangs, bei dem das Thermometer, das in Luft eine Zeitkonstante von 100 s hat, zuerst in heisse Luft von 350 K und dann in kühlere Luft von 310 K gesteckt wird (die Temperatur der Umgebung des Thermometers ändert also sprunghaft). machen. Die Proportionalitätskonstante muss die Inverse der Zeitkonstante τ sein: 1 dTT h = (T − TT h ) dt τ (7.10) Wie die Simulation (Abb.7.14, rechts) zeigt, verhält sich das Modell-Thermometer tatsächlich wie erwartet. Der einzige Parameter, den man für diese Problemstellung braucht, ist also die Zeitkonstante des Thermometers und nicht seine Kapazität und sein Leitwert (oder Widerstandswert) separat. Fragen & Übungen 29. Warum wurde das Thermometer, nachdem es aus dem Wasser genommen wurde, abgetrocknet, bevor man es in der Luft ruhen liess? 30. Was könnte man tun, damit ein Thermometer in gegebenem Medium schneller auf Temperaturänderungen reagiert? 31. Bestimmen Sie die Zeitkonstanten des Thermometers in Wasser und in Luft. Die Daten findet man in PSS_VLE, Chapter 3, Qucik Access, Page 5. 7.2.4 Temperatur eines Gebäudes regeln Ein ganz einfaches Modell des Heizens und Kühlens eines Gebäudes kann der Untersuchung einer Temperaturregelung dienen. Wir stellen uns ein Gebäude als ein einziges homogenes Element mit einer bestimmten Entropiekapazität vor. Die Gebäudehülle hat einen Entropieleitwert, der zusammen mit dem Unterschied der Temperaturen (innen und aussen) den Wärmestoffverlust festlegt (Abb.7.15, Gl.(7.4)). Wärmestoff wird vom Ofen mit einer Rate nachgeliefert, die von der (chemischen) Leistung des Verbrennungsprozesses und der Raumtemperatur (Gl.(7.1)) festgelegt wird. Der Ofen wird dadurch geregelt, dass man die Innentemperatur (T ) mit einer gewünschten Thermostattemperatur (Tset ) vergleicht. Man kann sich beliebig viele mehr oder weniger verschiedene Regelstrategien vorstellen (einfaches An- und Abstellen, Verbrennungsleistung proportional zum Unterschied der Raumtemperatur von der Thermostattemperatur, etc.). In diesem Modell wählen wir eine Methode, 7.2 Modelle dynamischer Systeme Building Pheater ΠS 235 Insulation T IS,loss S T Ta Abbildung 7.15: Modell des Heizens und Kühlens eines Gebäudes. Das Gebäude wird als ein einziges (homogenes) Element aufgefasst, in dem Wärmestoff im Ofen erzeugt wird, und bei dem Wärmestoff an die (kältere) Umgebung abfliesst. Temperaturen (Temperaturunterschiede) bestimmen die Prozesse. bei der der Ofen mit zum Temperaturunterschied proportionaler Leistung bis zu einem Maximalwert arbeitet (PH,max ): PiS = IF (T < Tset ) THEN MIN(PH,max /T , PH,max /T ∗ (Tset − T)) ELSE 0 Damit das Modell noch gewisse Flexibilität hat, legen wir die Aussentemperatur durch eine Sinusfunktion mit einer Amplitude von ein paar Grad um einen konstanten tiefen Mittelwert und einer Periode von einem Tag fest: 2π t Ta = Ta,0 + 4TAmp sin tp Hier ist tp = 86400 s die Periode der Schwankung, und 4TAmp stellt die Amplitude dar. Ta,0 steht für die mittlere (feste) Aussentemperatur. Damit das Modell einigermassen praktisch ist, muss man die Parameter sinnvoll schätzen: Entropiekapazität, Entropieleitwert für die Verluste und (maximale) Heizleistung. Man kann mit der Entropiekapazität anfangen. Man schätzt die Masse des Gebäudes und nimmt an, dass die Materialien eine spezifische Entropiekapazität von etwas weniger als der Hälfte von Wasser haben (also etwa 5 J/(K2 kg)). Dann kann man das Modell in einer Simulation mit abgestellter Heizung verwenden und GS,loss so einstellen, dass ein warmes Gebäude etwa in 10 Tagen sehr kalt wird. Alternativ schätzt man so die Zeitkonstante und bestimmt GS,loss durch seinen Zusammenhang mit der Zeitkonstante und der Kapazität. Bleibt noch die maximal mögliche Heizleistung. Hier können wir das Gebäude in einer Simulation mit einer tiefen Temperatur starten und schauen, wie gross PH,max gemacht werden muss, dass das Gebäude innerhalb nützlicher Frist einigermassen warm ist. 32. Die hier gewählte Regelstrategie führt dazu, dass die Innentemperatur immer unter der gewünschten Temperatur Tset bleibt. Warum ist das so? 33. Wie sieht eine elektrische Schaltung aus, die zu wesentlichen Aspekten des Systems analog ist? 34. Wenn die Masse des Gebäudes 200 Tonnen beträgt, wie gross ist dann die Entropiekapazität in etwa? Wie gross muss man den Entropieleitwert machen, damit die Zeitkonstante des Gebäudes etwa 5 Tage beträgt? Fragen & Übungen 236 Thermische Systeme 35. Wenn der Entropieleitwert des Gebäudes 2 W/K2 beträgt, wie gross ist dann der Entropiestrom an die Umwelt, wenn der Temperaturunterschied 20 K beträgt? Wie gross muss man die Entropieproduktionsrate machen, damit man bei konstanter Aussentemperatur diesen Temperaturunterschied halten kann? Wie gross ist die dazugehörige Heizleistung? 36. Vernachlässigen Sie den Entropieverlust an die Umwelt und schätzen Sie ab, wie gross die Heizleistung gemacht werden muss, damit das Gebäude in einem Tag 5 Grad wärmer wird. Box 7.2: Beweis von Gleichung (7.10) Der Beweis, dass das rein mathematische Modell für die Temperatur in Abb.7.14 mit der Änderungsrate der Temperatur nach Gl.(7.10) zum selben Resultat wie das physische Modell des Thermometers in Abb.7.12 führt, geht folgendermassen. Das Modell des physischen Thermometers besteht aus folgenden Ideen. Am Anfang steht die Entropiebilanz des Elementes: dST h = IS dt , ST h (0) = ST h,0 Der zweite Ausdruck ist die Anfangsbedingung für die Entropie. Die Entropie des Elementes hängt mit seiner Temperatur zusammen: ST h = K TT h und der Entropiestrom von Umgebung zum Element (oder umgekehrt) wird als proportional zur Temperaturdifferenz angenommen: IS = GS (T − TT h ) Man kann die beiden konstitutiven Beziehungen in die Bilanzgleichung einsetzen: d (K TT h ) = GS (T − TT h ) dt Kist konstant. Darum erhalten wir: GS d TT h = (T − TT h ) dt K Da die Zeitkonstante durch τ = K/GS gegeben ist, erhalten wir Gl.(7.10). 7.2.5 Erstarren von Wasser ... 7.2.6 ... Wärmespeicher mit PCM 7.3 Konzepte und Beziehungen 7.3 237 Konzepte und Beziehungen Theorie: Konzepte und Beziehungen Lectures and books · Fuchs H. U. (2010): The Dynamics of Heat. A Unified Approach to Thermo- dynamics and Heat Transfer. Springer, New York. Chapter 4, pp. 120-141, 146-152, 156-163. · Fuchs H. U. (2006-2010): Lecture Notes for NTS. Course Website. Chapter 3, pp. 7-13. · Borer T., Frommenwiler P., Fuchs H. U., et al. (2010): Physik, ein systemdynamischer Zugang. h.e.p. verlag, Bern. pp. 118-127. 7.3.1 Bilanzieren des Wärmestoffs ... 7.3.2 Temperatur und thermische Spannung ... 7.3.3 Wärmequellen ... 7.3.4 Transportbeziehungen ... 7.3.5 Speicherbeziehungen ... 7.3.6 Schmelzen und Erstarren ... ... 7.4 Verhalten thermischer Systeme ... 7.5 ... Kräfte der Natur und Analogiedenken Quellen 238 Thermische Systeme Aufgaben Antworten zu Fragen und Übungen 1. Warum zeigt mindestens das zweite Beispiel in Abb.7.1, dass die Temperatur nicht das Mass für Wärmemenge sein kann? Welche Rolle spielt die Temperatur? Antwort: Temperatur ist das thermische Niveau, das sich angleicht. Im zweiten Beispiel liegt das Schlussniveau nicht in der Mitte der beiden Anfangsniveaus, was sagt, dass sich die beiden Körper trotz gleicher Temperatur irgendwie thermisch unterscheiden müssen (der Unterschied wird als Unterschied der gespeicherten Wärmestoffmenge, die sich nicht anglleicht, interpretiert). 2. Was passiert mit der Wärmestoffmenge des Gemisches aus Wasser und Eis im Vor- gang in Abb.7.2 zwischen ungefähr 250 s und 1400 s? Sollte da die Temperatur nicht zu- oder abnehmen? Antwort: Wärmestoffmenge nimmt zu, Temperatur bleibt trotzdem konstant bei Phasenübergängen. 3. Warum zeigen einzelne der Vorgänge bei denen Luft geheizt oder gekühlt und kom- primiert oder expandiert wird, dass Wärmestoffmenge und Temperatur nicht die selbe Grösse sein können? Antwort: Zum Beispiel bei adiabatischer Kompression (Kompression ohne heizen/kühlen): Wärmestoffmenge bleibt konstant, Temperatur steigt. 4. Wie kann man das Volumen von Luft ändern, ohne dass sich dabei die Temperatur ändert (isotherme Vorgänge)? Antwort: Volumen während heizen/kühlen ändern. 5. Könnte man bei isothermem Expandieren/Komprimieren von Luft von aufsaugen oder ausquetschen von Wärmestoff sprechen? Antwort: Ja. 6. Was passiert, wenn man Luft in einem Gefäss mit festem Volumen heizt (oder kühlt)? Ändert sich die Temperatur von Luft anders, wenn das Heizen/Kühlen nicht in einem festen Gefäss sondern bei konstantem Druck stattfindet (zum Beispiel, wenn man eine Menge Luft in der Atmosphäre betrachtet)? Antwort: Temperatur steigt (sinkt). Ja, weniger schnelle Änderung. 7. Wieso müssen wir aus den Temperaturänderungen der beiden Wassermengen in Abb.7.4 schliessen, dass Wärmestoff vom kälter werdenden Wasserkörper auf den anderen übertragen wird? Könnte sich die Temperatur des Wassers nicht auch durch andere Vorgänge geändert haben? Antwort: Wasser ändert seine Temperatur nur, wenn es gekühlt oder geheizt wird. 8. Wärme fliesst doch von selber vom wärmeren zum kälteren Körper (Abb.7.1)? Wie ist denn der Vorgang in Abb.7.4 möglich? Antwort: Man pumpt: Energie, die elektrisch zur Verfügung gestellt wird, wird genutzt. 9. Warum deutet das Ansteigen der mittleren Temperatur des Systems in Abb.7.4 an, dass Wärmestoff erzeugt worden sein muss? Antwort: Wasser wird nur durch Heizen wärmer. Von aussen wird kein Wärmestoff zugeführt. 7.5 Kräfte der Natur und Analogiedenken 239 10. Welche Einheit muss laut Gl.(7.1) die Produktionsrate des Wärmestoffs haben? Welche Einheit hat demnach der Wärmestoff (Entropie)? Denken Sie daran, dass die Einheit der Temperatur das Kelvin (K) ist. Antwort: W/K. J/K. 11. Sie betreiben einen elektrischen Tauchsieder mit einer elektrischen Leistung von 300 W. Nehmen Sie an, er heize Wasser bei gerade 27°C. Wie gross ist in dem Moment die Entropieproduktionsrate (Produktionsrate des Wärmestoffs)? Nimmt die Entropie des Wassers darum gerade mit dieser Rate zu? Antwort: 1.0 W/K (ja, wenn keine nach aussen abgegeben wird). 12. Bei einem grossen thermischen Kraftwerk sei die elektrische Leistung 1.0 GW. Die Energie wird durch das Herunterfallen des Wärmestoffs vom Reaktor (Temperatur 600 K) zum Kühler (Temperatur 300 K) freigesetzt (zur Verfügung gestellt). Wie gross ist demnach der Wärmestoffstrom (Entropiestrom) durch die Wärmekraftmaschine? Antwort: (Muss grösser sein als) 3.33 MW/K (Ergebnis gilt nur für ideale Wärmekraftmaschine). 13. Welcher Stoff ist – auf die Masse bezogen – leichter erwärmbar: Wasser oder Glykol? Was heisst das für die Entropiekapazität? Wie sieht man in einem TS -Diagramm, dass die Entropiekapazität eines Stoffs konstant ist? Antwort: Glykol ist leichter erwärmbar – seine Entropiekapazität ist kleiner. Gerade TS -Beziehung heisst konstante Entropiekapazität. 14. Wie gross ist die Erwärmbarkeit eines Gemisches von Eis und Wasser (Eis beim Schmelzen oder Wasser beim Gefrieren, Abb.7.2)? Warum kann man den Phasenübergang nicht mit einer Entropiekapazität (Wärmestoffkapazität) beschreiben? Antwort: Da die Temperatur trotz Wärmezufuhr oder -abfuhr nicht ändert, ist die Erwärmbarkeit Null. Das gäbe eine unendlich hohe Kapazität. 15. Warum sollte man im Modell in Abb.7.9 erwarten, dass die Gleichgewichtstempera- tur in der Simulation genau in der Mitte zwischen den beiden Anfangstemperaturen liegt? Antwort: Bei gleichen und konstanten Kapazitäten der beiden beteiligten Speicher (und ohne Abfluss nach aussen), muss das Gleichgewichtsniveau so liegen – das ist bei kommunizierenden Wassergefässen in der Hydraulik und bei elektrischen Kondensatoren auch so. 16. Warum liegt die Gleichgewichtstemperatur in einem Modell wie in Abb.7.8 (rechts) bei gleichen Wassermengen unterhalb der mittleren Temperatur, wenn man Entropieproduktion vernachlässigt? Antwort: K2 > K1 (um also auf die bei Experimenten gemessene mittlere Temperatur zu kommen, muss zusätzlich Wärmestoff im System “erscheinen”). 17. Welche Einheit muss die Entropiekapazität haben? Die Entropiekapazität pro Kilo- gramm (man spricht von der spezifischen Entropiekapazität, Entropiekapazität pro Masse)? Antwort: J/K2 . J/(K2 ·kg). 18. Welche Einheit muss der Entropieleitwert haben? Antwort: W/K2 . 19. Wie hoch sind die Anfangstemperaturen der beiden Wassermengen im Experiment in Abb.7.1 in der absoluten (Kelvin) Skala? Antwort: 292 K, 360 K. 20. Thermische Landschaft. Im Experiment in Abb.7.4 werden die beiden Wassermengen gerührt, was bedeutet, dass die Temperaturen im Wasser räumlich homogen sind. Allerdings geht die Temperatur in einer dünnen Übergangsschicht im Wasser zum 240 Thermische Systeme Peltier-Element hinunter (damit der Wärmestoff fliesst), geht im Peltier-Element hinauf (der Wärmestoff wird gepumpt) und fällt wieder in einer dünnen Schicht im Wasser auf der anderen Seite. Denken Sie sich eine gerade Linie vom einen Wasserkörper zum anderen. Definieren Sie entlang der Linie ein paar wichtige Punkte. Zeichnen Sie dann ein Diagramm, in dem die Temperatur als Funktion der Position entlang dieser Linie skizziert wird. Denken Sie sich einen geschlossenen Pfad vom Anfang der Linie, entlang der Linie und zurück durch die “Unterwelt” bei 0 K zum Anfang. Ist die Summe aller Temperaturunterschiede gleich Null? Antwort: Ja. 21. Wie gross ist die Entropiekapazität von 10 kg Wasser? Antwort: 140 J/K2 bei 300 K. 22. Wie gross wäre der Entropieleitwert des im Experiment verwendeten Systems, wenn die Oberfläche zwei mal so gross (und alles Andere exakt gleich) wäre? Antwort: Zwei mal so gross. 23. Warum ist der Wärmestoffstrom (Entropiestrom) aus dem Gefäss bei t = 0 s gleich Null? Antwort: T_Wasser = T_Umwelt. 24. Bestimmen Sie die Änderungsrate der Entropie des Wassers bei t = 0 s aus den experimentellen Daten. Antwort: dS/dt = K_S·dT/dt = 3.1·0.011 W/K = 0.034 W/K. 25. Warum folgt die dynamische Form des Zusammenhangs zwischen gespeichertem Wärmestoff (Entropie) und der Temperatur des Materials in Gl.(7.9) nicht direkt aus unserer bisherigen Definition in Gl.(7.5)? Welche zusätzliche Annahme muss man treffen? Folgt umgekehrt Gl.(7.5) aus Gl.(7.9)? Ist eine der beiden Formen allgemeiner als die andere? Antwort: Gl.(7.5) folgt aus Gl.(7.9), wenn K = const. Gl.(7.9) ist allgemeiner. 26. Welche Beziehung zwischen den im System in Abb.7.10 auftretenden Prozessen gilt im stationären Zustand? Antwort: IS = Pi_S. 27. Kann man die beiden Materialparameter (Entropiekapazität des Wassers und Entro- pieleitwert der Oberfläche des Systems) auch dann unabhängig voneinander bestimmen, wenn die Temperatur des Wassers am Anfang nicht gleich der der Umgebung ist? Antwort: Ja. 28. Eiskaltes Wasser wird in eine Flasche gegossen, eine Magnetstab zum Rühren wird dazugegeben, die Flasche wird verschlossen und in einem warmen Raum auf einen Magnetrührer gestellt. Das Wasser in der Flasche wird also laufend gerührt. Wir sich die Wassertemperatur nach längerer Zeit auf die Umgebungstemperatur einstellen? Wird sie tiefer oder höher sein? Antwort: Temperatur wird höher als Umgebungstemperatur werden. 29. Warum wurde das Thermometer, nachdem es aus dem Wasser genommen wurde, abgetrocknet, bevor man es in der Luft ruhen liess? Antwort: Weil Verdunstung von Wasser das Thermometer schneller kühlt. 30. Was könnte man tun, damit ein Thermometer in gegebenem Medium schneller auf Temperaturänderungen reagiert? Antwort: Es muss eine kleinere Entropiekapaziät haben, oder der Wärmeübergang zum Medium muss besser sein (Thermometer in Luft heftig bewegen!). 31. Bestimmen Sie die Zeitkonstanten des Thermometers in Wasser und in Luft. Die Daten findet man in PSS_VLE, Chapter 3, Qucik Access, Page 5. Antwort: Ungefähr 5 s und 90 s. 7.5 Kräfte der Natur und Analogiedenken 241 32. Die hier gewählte Regelstrategie führt dazu, dass die Innentemperatur immer unter der gewünschten Temperatur Tset bleibt. Warum ist das so? Antwort: Wegen des ständigen Wärmeverlustes muss ständig geheizt werden. 33. Wie sieht eine elektrische Schaltung aus, die zu wesentlichen Aspekten des Systems analog ist? Antwort: 34. Wenn die Masse des Gebäudes 200 Tonnen beträgt, wie gross ist dann die Entropiekapazität in etwa? Wie gross muss man den Entropieleitwert machen, damit die Zeitkonstante des Gebäudes etwa 5 Tage beträgt? Antwort: 7·105 J/K2 . 1.6 W/K2 . 35. Wenn der Entropieleitwert des Gebäudes 2 W/K2 beträgt, wie gross ist dann der Entropiestrom an die Umwelt, wenn der Temperaturunterschied 20 K beträgt? Wie gross muss man die Entropieproduktionsrate machen, damit man bei konstanter Aussentemperatur diesen Temperaturunterschied halten kann? Wie gross ist die dazugehörige Heizleistung? Antwort: 40 W/K. 40 W/K. 12 kW. 36. Vernachlässigen Sie den Entropieverlust an die Umwelt und schätzen Sie ab, wie gross die Heizleistung gemacht werden muss, damit das Gebäude in einem Tag 5 Grad wärmer wird. Antwort: 12 kW. 242 Thermische Systeme