Lösungsblatt 11: Carbonsäuren und Aromaten
Werbung

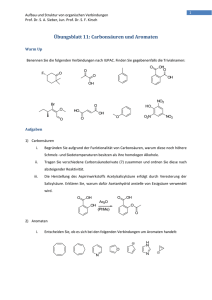
1 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Lösungsblatt11:CarbonsäurenundAromaten WarmUp Benennen Sie die folgenden Verbindungen nach IUPAC. Finden Sie gegebenenfalls die Trivialnamen: Aufgaben 1) Carbonsäuren i. Begründen Sie aufgrund der Funktionalität von Carbonsäuren, warum diese noch höhere Schmelz‐ und Siedetemperaturen besitzen als ihre homologen Alkohole. Carbonsäuren bilden aufgrund ihrer Carboxylgruppe 2 Wasserstoffbrücken aus. Sie besitzen damit noch höhere intermolekulare Anziehungskräfte als Alkohole. ii. Tragen Sie verschiedene Carbonsäurederivate (7) zusammen und ordnen Sie diese nach absteigender Reaktivität. 2 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch iii. Die Herstellung des Aspirinwirkstoffs Acetylsalicylsäure erfolgt durch Veresterung der Salicylsäure. Erklären Sie, warum dafür Acetanhydrid anstelle von Essigsäure verwendet wird. O O OH OH Ac2O OH O (PhMe) O Bei der Veresterung kommt es zum nucleophilen Angriff des Alkohols auf den Carbonylkohlenstoff und zur Bildung eines tetraedrischen Intermediats. Im Falle von Essigsäure ist ein Hydroxidion (R=OH) abzuspalten, während im Falle von Acetanhydrid (R=OAc) eine wesentlich bessere Abgangsgruppe vorhanden ist. Daher können durch die Anwendung des Anhydrids bessere Ausbeuten erzielt werden. Ein weiterer Faktor ist die erhöhte Reaktivität des Anhydrids gegenüber der Carbonsäure, was zu einem schnelleren Umsatz führt. 2) Aromaten i. Entscheiden Sie, ob es sich bei den folgenden Verbindungen um Aromaten handelt: ii. Besprechen Sie den Mechanismus der elektrophilen, aromatischen Substitution am Beispiel der Bromierung des Benzens: 3 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch iii. Diskutieren Sie das ortho/para‐Verhältnis der Produkte nach der Behandlung folgender Edukte mit Nitriersäure: Methylbenzen: ortho/para Position für Substitution bevorzugt. Produktverteilung statistisch verteilt ortho/para = 2:1 tert‐Butylbenzen: ortho/para Position für Substitution bevorzugt. Sterische Hinderung der ortho Substitution ortho/para < 1 3) Reaktivität i. Ergänzen Sie die Produkte folgenden Reaktionen: 4 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch NH [H+] O O N O O O O NaOEt O O Dieckmann-Kondensation (EtOH) O O O H N NH2 (HOAc) O Cl Cl2 FeCl3 NO2 HO O OH (PhMe) H2SO4 SO3 NO2 HO O HO OH (PhMe) SO3H O OH HO3S OH OH [H+] Fiedl-Crafts-Alkylierung Burnout Bei der Synthese des klinisch wichtigen Hormons Adrenalin ist eine Vorstufe das Katechol Dopamin. Die funktionelle Gruppe der arylischen 1,2‐Diole soll durch Rühren in leicht angesäuerter Acetonlösung geschützt werden. Wie sieht das Produkt dieser Reaktion aus? Wie heißt die entstandene funktionelle Gruppe? Welche leicht zugängliche Aminosäure könnte der Ausgangspunkt der Adrenalinsynthese sein? Entscheiden Sie ob die bereits vorhandenen Substituenten am Aromaten die Einführung der verbleibenden Funktionalität begünstigen oder nicht. 5 Aufbau und Struktur von organischen Verbindungen Prof. Dr. S. A. Sieber, Jun. Prof. Dr. S. F. Kirsch Das Katechol wird durch die Bildung eines Vollacetals geschützt. Ausgangspunkt der Synthese ist die natürliche Aminosäure L‐Tyrosin. Sowohl die Hydroxygruppe, als auch der aliphatische Rest besitzen eine Donorfunktion am Aromaten. Daher ist jeweils eine ortho‐Substitution zu erwarten. Jedoch hat der Alkohol einen stärkeren Effekt, da er aktiv Elektronen in den Ring donieren kann (Mesomerer‐Effekt), während der Alkyrest nur über Hyperkonjugation doniert (Induktiver‐Effekt). Generell ist ein Produktgemisch zu erwarten.