Präsentation - Chemieunterricht.ch
Werbung

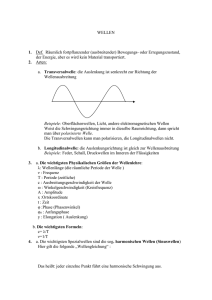
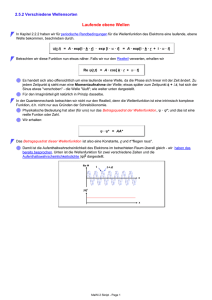
Entwicklung der Atommodelle Entwicklung der Atommodelle Demokrit 460 v Chr. „Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter; in Wirklichkeit gibt es nur Atome im leeren Raum.“ Entwicklung der Atommodelle Es gibt so viele verschiedene Atome wie es Elemente gibt. Dalton, 1766 Entwicklung der Atommodelle Rutherford, 1871 Entwicklung der Atommodelle Coulomb-Kraft? Entwicklung der Atommodelle Beobachtungen: Entwicklung der Atommodelle Entwicklung der Atommodelle Schalenmodell von Bohr: Elektronen können den Atomkern nur auf ganz bestimmten Kreisen umlaufen. Eine Änderung des Energiezustandes des Atoms kann nur durch den Übergang von einem stationären Zustand in einen anderen erfolgen. Die Frequenz der bei einem solchen Übergang ausgestrahlten bzw. absorbierten Strahlung ergibt sich aus der Differenz der beiden Energiezustände des Atoms. Entwicklung der Atommodelle Und das Kugelteilchenmodell? Entwicklung der Atommodelle Kügelchen können Atome, Moleküle oder Ionen sein! Beobachten: Spektroskopie ∆E = hν Mit h = Planck-Konstante, ν = Frequenz Spektroskopie: ∆E = hν Mit h = Planck-Konstante, ν = Frequenz Elektromagnetische Wellen: z.B. Licht Spektroskopie: ∆E = hν Mit h = Planck-Konstante, ν = Frequenz Elektromagnetische Wellen: z.B. Licht ∆E = hν http://ircamera.as.arizona.edu/NatSci102/Nat Sci102/lectures/spectroscopy.htm Photoelektrischer Effekt: Teilchencharakter für Licht Photoelektrischer Effekt: Teilchencharakter für Licht Entwicklung der Atommodelle Und was ist mit den Nebengruppenelementen? Entwicklung der Atommodelle Und mit der Unschärferelation? Radarfalle Gleichzeitige Bestimmung des Ortes und der Geschwindigkeit eines Autos Begründung der Unschärfebeziehung Langwelliges Licht ergibt ein unscharfes Bild Unschärfe in der Ortsbestimmung Kurzwelliges Licht ist hochenergetisch Störung der Bewegung des Elektrons Unschärfe in der Geschwindigkeitsbestimmung Werner Heisenberg Die Unschärfe-Beziehung widerspricht dem Bohr‘schen Atommodell Wellencharakter des Elektrons theoretische Vorhersage Prince Louis-Victor Pierre Raymond de Broglie Louis de Broglie Wellencharakter des Elektrons Nachdem Albert Einstein die einseitige (!) Doktorarbeit von L. de Broglie gelesen hatte, schrieb er an Max Born: „Das müssen Sie lesen! Wenn es auch verrückt aussieht, so ist es doch durchaus gediegen“ Wellen-Teilchen-Dualismus René Magritte, Decalcomania, 1966 Wellen-Teilchen-Dualismus René Magritte, Decalcomania, 1966 Text aus GEO kompakt Weiterforschen: www.teilchenphysik.ch Licht mit Wellencharakter: Interferenz Elektronen als Wellen: Interferenz Elektron als Welle mathematische Beschreibung Erwin Schrödinger Nobelpreis für Physik 1933 Elektron als Welle eingesperrt durch Anziehung durch Atomkern Es bilden sich stehende Wellen! http://www.youtube.com/watch?v=n1d1rycvj4&feature=player_detailpage http://www.youtube.com/watch?feature=play er_detailpage&v=no7ZPPqtZEg Rückblick: Warum nicht Bohr Rückblick: Welle Teilchen Dualismus Für Licht Welle Teilchen und für Elektronen Rückblick: Elektron als Welle Vergleich: Experiment mit Kügelchen Rückblick: Elektron als Welle Konstruktive Interferenz Destruktive Interferenz Elektron als Welle eingesperrt durch Anziehung durch Atomkern Es bilden sich stehende Wellen! http://www.youtube.com/watch?v=n1d1rycvj4&feature=player_detailpage http://www.youtube.com/watch?feature=play er_detailpage&v=no7ZPPqtZEg Analogie: Eingesperrte Wellen in der Musik Eindimensionale stehende Wellen Lipscher ZK 2012 Zweidimensionale stehende Wellen Trommelfell Lipscher ZK 2012 Zweidimensionale stehende Wellen Lipscher ZK 2012 Elektron als Welle eingesperrt in einem Atom Dreidimensionale stehende Wellen Elektron als Welle Deutung der Wellenfunktion Max Born Nobelpreis für Physik 1954 Elektron als Welle Orbitalbegriff Dreidimensionale stehende Wellen Wahrscheinlichkeit ein Elektron zu finden s-Orbital Raum in dem Wahrscheinlichkeit 90% Elektron zu finden s-Orbital Orbitale p-Orbital Orbitale p-Orbital Orbitale d-Orbitale Orbitale Elektron als Welle eingesperrt in einem Atom • Nur bestimmte Zustände sind möglich • Steht im Einklang mit der Unschärfebeziehung • Die Elektronen fallen nicht in den Kern Wellenbeschreibung des Elektrons Wellenmechanik Energie kann sich nur stufenweise ändern Quanten = Energieportionen Quantenmechanik Lipscher ZK 2012 Mögliche Schwingungszustände eines Elektrons n=5 n =4 n=3 n= 2 n = 1 Entspricht den Schalennummern = Hauptquantenzahl Quadrierte Funktion = Aufenthaltswahrscheinlichkeit Orbitale für Wasserstoffatom Orbitale für Mehrelektronensystem Orbitale für Mehrelektronensystem Pauli-Prinzip: Elektronen müssen sich immer durch eine Quantenzahl unterscheiden Orbitale für Mehrelektronensystem Hund‘sche Regel: Orbitale werden zuerst einfach besetzt Orbitale für Mehrelektronensystem