Festkörperphysik - Blatt 1 - Kristallstruktur und Chemische Bindung
Werbung

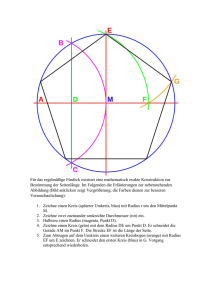
Festkörperphysik - Blatt 1 - Kristallstruktur und Chemische Bindung Abgabe, Dienstag 27.04.2009, 10:15 Stichworte: Packungsdichte, kubisches Bravais-Gitter, Ionenkristalle, Madelungkonstante 1. Packungsdichte (3 Punkte) In Abbildung 1 sind die drei kubischen Bravais-Gitter abgebildet. (a) primitiv kubisch (sc): Gitterpunkte sind die Ecken des Würfels (Kantenlänge a). (b) raumzentriert kubisch (bcc): Gitterpunkte sind die Ecken des Würfels und der Mittelpunkt des Würfels. (c) flächenzentriert kubisch (fcc): Gitterpunkte sind die Ecken des Würfels und die Flächenmittelpunkte. Berechnen Sie die maximale Raumerfüllung, welche sich nach dem Modell harter Kugeln für diese drei Gitter ergibt. D.h. setzten Sie an jeden Gitterpunkt eine Kugel mit maximalem Radius R, so dass die Kugeln nicht überlappen und vergleichen Sie deren Gesamtvolumen (Anteil im Würfel) mit dem Volumen des Würfels. Abbildung 1: Einfach kubisches (sc), kubisch raumzentriertes (bcc) und kubisch flächenzentriertes (fcc) Gitter. 2. Radienqotientenregel(3 Punkte) Bei welchem Radienverhältnis r/R passt eine Kugel mit dem Radius r genau in die Mitte einer tetraedrischen, bzw. würfelförmigen bzw. oktaedrischen Anordnung von Kugeln mit dem Radius R? Die Kugeln mit Radius R sitzen auf den jeweiligen Eckpunkten und wir nehmen an, dass sich diese Kugeln in der jeweiligen Anordnung gerade berühren. Abbildung 2: Tetraeder, Würfel und Oktaeder. Die Kugeln mit Radius R sitzen an den jeweiligen Eckpunkten und sollen sich gerade nicht berühren. Skizzieren Sie die Tetraeder- und Oktaederumgebung im fcc Gitter (siehe Abbildung 1). 3. Ionenkristall (6 Punkte) Die Energie eines Ions im Feld aller anderen Bausteine eines Ionenkristalls besteht aus einem anziehenden Coulombanteil ∝ −1/r und einem abstoßenden Anteil ∝ 1/rn 2 Ae Ui = − 4π² + 0r B rn . (1) wobei: r = Abstand nächster Nachbarn, A = Madelungkonstante. A und B ergeben sich durch Summation über alle Ionen j mit j 6= i. a) Skizzieren Sie den Verlauf der potentiellen Energie Ui für n = 12. b) Berechnen Sie die Madelungkonstante A für eine lineare Kette von Ionen gleichen Abstands a und abwechselnder Ladung durch Aufsummieren des Coulombanteils. 2 3 4 (Hinweis: ln(1 + x) = 1 − x2 + x3 − x4 ± . . . ; −1 ≤ x ≤ 1) c) Berechnen Sie die Madelungkonstante eines zweidimensionalen quadratischen Ionenkristalls (Ionenladung ±e) unter Berücksichtigung der Beiträge in der Gittersumme bis zum fünften Nachbarn. d) Bestimmen Sie die Gitterenergie UG (in Abhängigkeit von A) eines aus 2N Ionen bestehenden Kristalls, wenn der Gleichgewichtsabstand nächster Nachbarn r = a ist. e) Die Madelungkonstante für NaCl beträgt A ' 1.7476. Betimmen Sie für NaCl (Gitterkonstante a = 5.64 Å, Bindungsenergie pro Ionenpaar −8.23 eV) den Exponent n des abstoßenden Anteils des Potentials. f) Gegeben sind die isotherme Kompressibilität κ, die Madelungkonstante A und der Gleichgewichstabstand a. Wie gross ist der Exponent n im abstoßenden Anteil der Gleichung (1) für einen kubischen Kristall? Hinweise: κ= 1 ∂V | V ∂p T =const. und U = p · dV Für einen kubischen Kristall müssen wir nur eine Raumrichtung betrachten. Zeigen Sie d2 U d2 U dr 2 zunächst, dass im Gleichgewicht gilt: dV 2 = dr 2 ( dV ) .