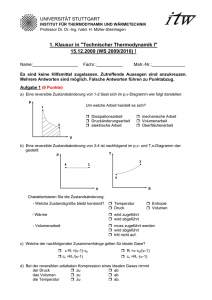
Zustandsgleichungen des idealen Gases
Werbung
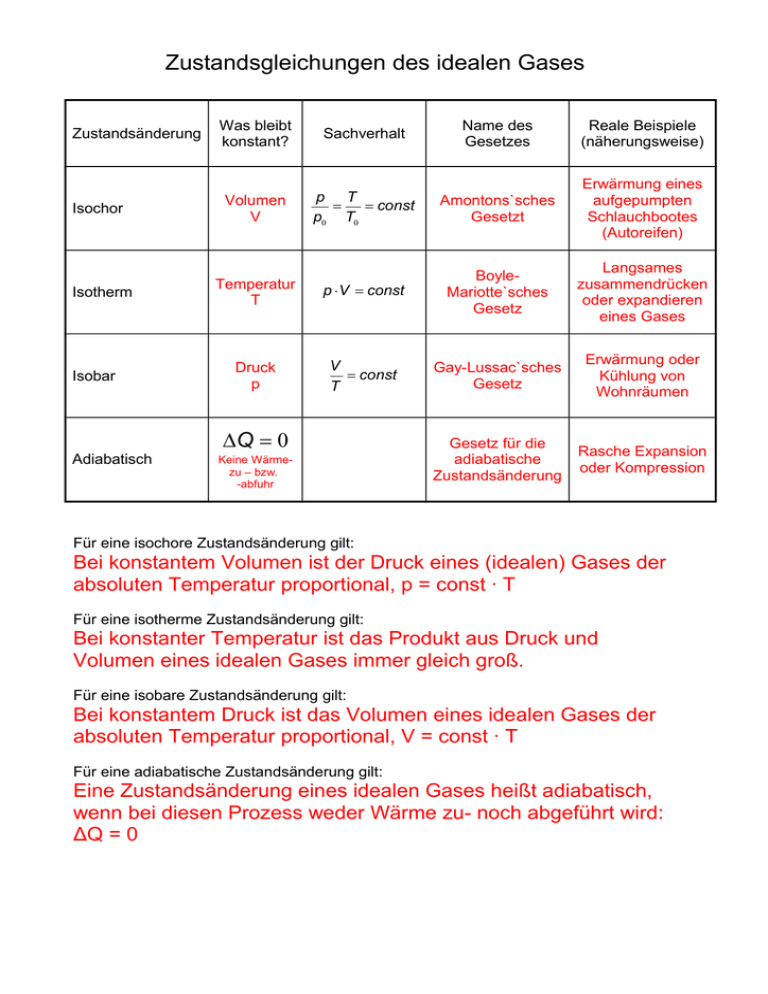
Zustandsgleichungen des idealen Gases Zustandsänderung Isochor Isotherm Isobar Was bleibt konstant? Sachverhalt Name des Gesetzes Reale Beispiele (näherungsweise) Volumen V p T = = const p0 T0 Amontons`sches Gesetzt Erwärmung eines aufgepumpten Schlauchbootes (Autoreifen) Temperatur T p × V = const BoyleMariotte`sches Gesetz Langsames zusammendrücken oder expandieren eines Gases Druck p V = const T Gay-Lussac`sches Gesetz Erwärmung oder Kühlung von Wohnräumen Gesetz für die adiabatische Zustandsänderung Rasche Expansion oder Kompression DQ = 0 Adiabatisch Keine Wärmezu – bzw. -abfuhr Für eine isochore Zustandsänderung gilt: Bei konstantem Volumen ist der Druck eines (idealen) Gases der absoluten Temperatur proportional, p = const ∙ T Für eine isotherme Zustandsänderung gilt: Bei konstanter Temperatur ist das Produkt aus Druck und Volumen eines idealen Gases immer gleich groß. Für eine isobare Zustandsänderung gilt: Bei konstantem Druck ist das Volumen eines idealen Gases der absoluten Temperatur proportional, V = const ∙ T Für eine adiabatische Zustandsänderung gilt: Eine Zustandsänderung eines idealen Gases heißt adiabatisch, wenn bei diesen Prozess weder Wärme zu- noch abgeführt wird: ΔQ = 0