Erklärungen zum Orbitalmodell ANDRÉ
Werbung

PROTOKOLL VOM 21. FEBRUAR 2007
Chemie
Zu Beginn der Unterrichtsstunde wurde der zuletzt behandelte Stoff kurz vorgestellt.
Auch die kommende Stunde sollte, wie auch die vorherige, zum Thema das
Orbitalmodell haben.
Dazu erklärte uns Herr Beckmann noch einige grundlegende Dinge. Zwischendurch
wurden drei Schüler an die Tafel gerufen, welche die gestellte Hausaufgabe von der
Stunde am Dienstag 20.02.07 anschreiben sollten (diese wurde jedoch nicht mehr
verglichen).
Schnell wurde deutlich, dass viele der Schüler das Orbitalmodell noch nicht
verstanden hatten. Vor allem das zuletzt ausgeteilte Arbeitsblatt, auf dem sich die
Hausaufgabe befand, bereitete vielen Schwierigkeiten. Das Orbitalmodell musste
also von neuem erklärt werden.
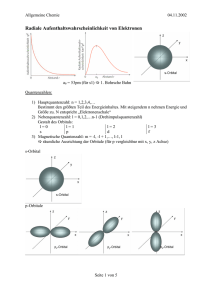
Die Quantenzahlen
Die Quantenzahlen geben an, in welchem Orbital eines Atoms sich ein Elektron
aufhält.
Die Hauptquantenzahl (n) bezeichnet hierbei die Nummer der Hauptschale
(K-Schale = 𝑛 = 1 ; L-Schale = 𝑛 = 2 ; M-Schale = 𝑛 = 3 ; …).
Die Nebenquantenzahl (l) gibt den Drehimpuls des Elektrons an. Sie ist die (erste)
Feinstruktur der Schale in der Anzahl der Orbitale mit verschiedenen Energien. Des
weiteren ist sie immer mindestens um eins kleiner als die Hauptquantenzahl (n)
𝑙 ≤ 𝑛 − 1. Eine Nebenquantenzahl von Null entspricht einem s-Orbital. 𝑙 = 0 = 𝑠
Des weiteren gilt: 𝑙 = 1 = 𝑝 ; 𝑙 = 2 = 𝑑 ; 𝑙 = 3 = 𝑓
Die Magnetquantenzahl (m) unterteilt die Bereiche der Nebenquantenzustände in
noch geringere Energiebereiche. Sie ist die (zweite) Feinstruktur der Schale in der
Anzahl der Orbitale mit gleicher Energie. 𝑚 ist der Bereich von – 𝑙 bis +𝑙. Als
Beispiel: 𝑙 = 2 => 𝑚 = {−2; −1; 0; +1; +2}
Die Spinquantenzahl (s) beschreibt den Eigendrehimpuls des Elektrons. Sie kann
für jeden der durch die drei Quantenzahlen (n,l,m) beschriebenen Energiezustände
1
1
zwei Werte, + 2 und − 2, annehmen und entspricht aufgrund des Pauli-Prinzips der
Zahl zur Unterscheidung der beiden Elektronen, die ein Orbital enthalten kann (dritte
Feinstruktur).
Die Elektronenkonfiguration
Die Elektronenkonfigurationen werden dann für jede Haupt- und Nebenquantenzahl
separat aufgeschrieben. Hier betrachten wir beispielsweise das Element Neon:
Von: André Garbotz
1
PROTOKOLL VOM 21. FEBRUAR 2007
Chemie
10Ne:
Neon hat eine 1s2 2s2 2p6 Elektronenkonfiguration. Die Zahlen geben an:
Hauptquantenzahl (n), Nebenquantenzahl als Orbital (l) und das Produkt
aus der Anzahl der Energiezustände (m) und der Anzahl der Elektronen pro
Zustand (s).
Zum Schluss hier noch ein ausführliches Beispiel zu den Quantenzahlen und der
jeweiligen Elektronenkonfiguration.
19K:
n
l
m
s
1
0
0
±
1
2
2
0
0
±
2
1
-1 ; 0 ; +1
1
1
1
±2 ±2 ±2
1
2
1s2 2s2
2p6
3
0
0
±
1
2
3s2
3
1
-1 ; 0 ; +1
1
1
1
±2 ±2 ±2
3p6
3
2
-2 ; -1 ; 0 ; +1 ; +2
+
1
2
3d1
Die Pfeile in den Kästen geben an, wie viele Elektronen in dem Orbital vorhanden
1
sind. + 2 =
Von: André Garbotz
1
−2 =
2