6 Physik der Farbe (2)
Werbung

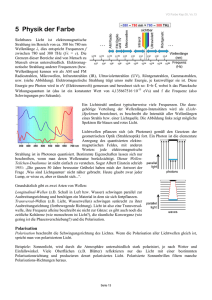
VO Farbe Kap.06, Vs.16 6 Physik der Farbe (2) Sichtbares Licht ist elektromagnetische Strahlung im Bereich von ca. 380 bis 780 nm Wellenlänge λ, dies entspricht Frequenzen f zwischen 780 und 380 THz (f·λ = c). Die Grenzen dieser Bereiche sind von Mensch zu Mensch etwas unterschiedlich. Elektromagnetische Strahlung anderer Frequenzen (bzw. Wellenlängen) kennen wir als AM und FM Radiostrahlen, Mikrowellen, Infrarotstrahlen (IR), Ultraviolettstrahlen (UV), Röntgenstrahlen, Gammastrahlen, usw. (siehe Abbildung). Elektromagnetische Strahlung trägt umso mehr Energie, je kurzwelliger sie ist. Diese Energie pro Photon wird in eV (Elektronenvolt) gemessen und berechnet sich so: E=h·f, wobei h das Plancksche Wirkungsquantum ist (das ist ein konstanter Wert von 4,135667516·10-15 eVs) und f die Frequenz (also Schwingungen pro Sekunde). Ein sichtbares Photon hat also eine Energie von mindestens ca. 1,65 eV (Rot-Ende) und maximal ca. 3,26 eV (Blau-Ende). Der Energielevel E eines Photons ist also verkehrt proportional zur Wellenlänge λ: E = const/λ bzw. E*λ = const. Ein Lichtstrahl umfasst typischerweise viele Frequenzen. Die dazugehörige Verteilung der Wellenlängen-Intensitäten wird als (Licht-)Spektrum bezeichnet, es beschreibt die Intensität aller Wellenlängen eines Strahls bzw. einer Lichtquelle. Die Abbildung links zeigt mögliche Spektren für blaues und rotes Licht. Lichtwellen pflanzen sich (als Photonen) gemäß den Gesetzen der geometrischen Optik (Strahlenoptik) fort. Ein Photon ist die elementare Anregung des quantisierten elektromagnetischen Feldes, mit anderen Worten: jede elektromagnetische Strahlung ist in Photonen quantisiert. Bestimmte Eigenschaften lassen sich nur beschreiben, wenn man deren Wellennatur berücksichtigt. Dieser WellenTeilchen-Dualismus ist nicht einfach zu verstehen. Sogar Albert Einstein schrieb 1951: „Die ganzen 50 Jahre bewusster Grübelei haben mich der Antwort der Frage ‚Was sind Lichtquanten‘ nicht näher gebracht. Heute glaubt zwar jeder Lump, er wisse es, aber er täuscht sich...“. Grundsätzlich gibt es zwei Arten von Wellen: Longitudinal-Wellen (z.B. Schall in Luft bzw. Wasser) schwingen parallel zur Ausbreitungsrichtung und benötigen ein Material in dem sie sich fortpflanzen. Transversal-Wellen (z.B. Licht, Wasserwellen) schwingen senkrecht zu ihrer Ausbreitungsrichtung (fortbewegende Richtung). Licht ist also eine Transversalwelle, ihre Frequenz alleine beschreibt sie nicht zur Gänze: es gibt auch noch die zeitliche Kohärenz (wie monochrom ist Licht?), die räumliche Konvergenz (wie gering ist die Phasenverschiebung?) und die Polarisation. Polarisation Polarisation beschreibt die Schwingungsrichtung des Lichtes. Wenn die Polarisation aller Lichtwellen gleich ist, spricht man von polarisiertem Licht. Beispiele: Sonnenlicht, wird durch die Atmosphäre unterschiedlich stark polarisiert, je nach Wetter und Einfallswinkel. Viele Oberflächen (z.B. Blätter) reflektieren nur das Licht mit einer bestimmten Polarisationsrichtung und produzieren derart polarisiertes Licht. Polarisierte Sonnenbrillen filtern manche Polarisations-Richtungen heraus. Seite 15 VO Farbe Kap.06, Vs.16 Wellen schwingen in zwei Dimensionen, daher hat auch Polarisation zwei unabhängige Richtungen. Je nach Stärke und Phasenverschiebung dieser beiden Richtungen erhält man unterschiedliche Polarisations-Effekte: lineare – zirkulare – elliptische Polarisation Mit polarisierten Bildern lassen sich 3D-Projektionen herstellen. Jedes zweite Bild der Bildfolge wird vertikal polarisiert, während die anderen Bilder horizontal polarisiert abgebildet werden. Der Betrachter trägt eine Brille, dessen eines Glas nur horizontal polarisiertes Licht durchlässt, das andere nur vertikal polarisiertes Licht. So kann man jedem Auge ein anderes Bild präsentieren, womit ein 3DEffekt erzeugt werden kann. Bessere Systeme verwenden zirkulierend-polarisiertes Licht, wobei ein Auge mit rechts-zirkulierender Polarisation bedient wird, das andere mit links-zirkulierender Polarisation. Ursachen für farbiges Licht Bei Lichtquellen bewirkt die Art der Erzeugung des Lichtes ein bestimmtes Spektrum, das für die Farbe dieses Lichtes verantwortlich ist. In allen anderen Fällen wird die Farbe zumindest teilweise durch Interaktion mit den Objekten verändert und erzeugt somit die wahrgenommene Farbe der Objekte. Das sind hauptsächlich diffuse und spiegelnde Reflexion, Absorption und Streuung. Ausflug in die Quantenmechanik Jedes Atom und Molekül hat einen stabilen Grundzustand. Durch Zufuhr von Energie (z.B. Hitze, Strom, Licht) können Elektronen höhere Energieniveaus annehmen, was dazu führt, dass sie in eine höhere Elektronenbahn überwechseln. Diesen Zustand nennt man angeregter Zustand. Die meisten angeregten Zustände sind sehr instabil und streben sehr rasch in einen stabileren Zustand zurück (Abb. rechts), wobei die für den angeregten Zustand notwendige Energie wieder abgegeben wird. Da jedes Atom oder Molekül aber nur ganz bestimmte diskrete Energiezustände annehmen kann, ist für jeden Wechsel des Energieniveaus eine genau definierte Energiemenge notwendig. Vor allem hat die abgegebene Energie beim Zurückwechseln von einem höheren in ein stabileres Energieniveau (elektromagnetische Strahlung) immer einen materialspezifischen Wert. Wenn diese Strahlung im sichtbaren Bereich liegt, entsteht so Licht. Umgekehrt wird Licht, das genau so viel Energie hat, wie für eine Anregung notwendig ist, absorbiert. Weiters passiert es oft, dass der Rücksprung nicht auf einmal erfolgt, sondern über ein oder mehrere (ebenfalls labile) Zwischenzustände passiert (Abb. links). Dadurch wird die abzugebende Energie in mehrere Photonen geringerer Energie zerteilt. Insbesondere kann dadurch auch Wärme entstehen, wenn die Energie eines Zwischensprunges weniger als 1,6 eV hat, also längerwellig als 780 nm ist. Aus dem Spektrum des von einem Objekt abgegebenen Lichtes (bzw. der elektromagnetischen Strahlung) lässt sich dann leicht die chemische Zusammensetzung des Materials ablesen, weil jedes Element bzw. Molekül eine charakteristische Kombination von Abstrahlungsfrequenzen hat. Die Abbildung rechts zeigt mögliche Quantensprünge bei einem Molekül mit drei möglichen angeregten Zuständen. Durch Energiezufuhr (A) wird es in den angeregten Zustand III übergeführt, von wo es entweder durch Abgabe der gleichen Energiemenge (E) sofort wieder in Seite 16 VO Farbe Kap.06, Vs.16 den Grundzustand zurückfällt, oder schrittweise drei Photonen abgibt, zuerst (B) in den Zustand II, dann (C) in den Zustand I, und schließlich (D) in den Grundzustand. Die drei Energiemengen (B), (C) und (D) erzeugen dann drei verschieden energiereiche Photonen, also drei verschiedene Wellenlängen von Licht. Zusammen mit dem Sprung E hat das dieses Molekül also ein Spektrum mit 4 charakteristischen Linien. Laser (Light Amplification by Stimulation of Emitted Radiation) Ein Laser ist eine gerichtete Lichtquelle mit extrem kohärenter, monochromatischer Strahlungsenergie, die beinahe völlige Parallelität besitzt. Beim Entstehungsprozess von Laser, der stimulierten Emission, regt ein bereits erzeugtes Photon ein Atom dazu an, ein weiteres Photon abzugeben, das dieselben Eigenschaften besitzt. Dieser Prozess wiederholt sich sehr oft, womit sich ein monochromatischer Lichtstrahl erzeugen lässt, dessen Wellen nicht nur vollkommen parallel, also in die gleiche Richtung gehend, sind, sondern die auch phasengleich (aber nicht polarisiert) ausgestrahlt werden, wodurch das Licht sehr große Strecken zurücklegen kann, ohne zerstreut zu werden. Die Eigenschaften von Laser werden in vielen Bereichen genutzt, wie z.B. der Wissenschaft, Technik, Militär, Medizin und dem alltäglichen Leben. Laser finden ihre Hauptverwendung in der Farbwissenschaft im Bereich der Spektroradiometrie, wo sie als monochromatische Quellen dienen, oder als Werkzeug zum Ausrichten von optischen Komponenten. Laser decken das gesamte sichtbare Spektrum und darüber hinaus (IR - UV) ab. Licht und Biologie Die chemische Bindungsenergie der meisten stabilen Moleküle beträgt mindestens 3 eV. Strahlung mit weniger Energie, also Photonen mit weniger als 3 eV, können folglich die meisten Moleküle nicht zerstören. Photonen mit mehr Energie (also kurzwelligere = höherfrequente Strahlung; UV, Röntgenstrahlen etc.) können dagegen in vielen Molekülen einzelne Elektronen herausschlagen, und das Molekül damit verändern und damit auch chemische Reaktionen triggern, im Falle organischer Moleküle diese auch schädigen oder zerstören. 750 nm entspricht 1,65 eV, 380 nm entspricht 3,26 eV. Das Auge kann also die energiereichste elektromagnetische Strahlung wahrnehmen, die unser Gewebe gerade noch nicht schädigt. Energiereichere Strahlung wird (zum Glück!) von der Atmosphäre so weitgehend absorbiert, dass auch nur ganz wenig vorhanden ist, und dadurch Lebewesen überhaupt existieren können. Unser Auge ist also auf die kurzwelligsten Strahlen sensitiv, die unser Gewebe nicht zerstören. Umgekehrt müssen die Pigmente im Auge auf die Lichtstrahlung chemisch reagieren, und das geht nur, wenn dazu genug Energie eintrifft. Rhodopsin und die Lodopsine sind also Moleküle mit geringstmöglicher Bindungsenergie. Daher können Augen (aller Tiere!) auch unmöglich „Licht“ sehen, das langwelliger als 780 nm ist (im Gegensatz zu kurzwelligerer Strahlung als 380 nm). Seite 17