Phasediagramm von Diphenyl und Naphtalin
Werbung

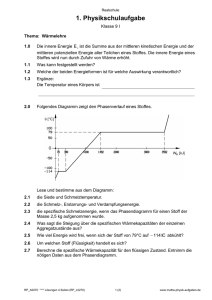
Phasediagramm von Diphenyl und Naphtalin Versuch 6 Versuchsteilnehmer: Damian Hodel,Jan Rys eMail: [email protected], [email protected] Versuchsdatum: 3.1.07 Assistent: Toni Ivas eMail: [email protected] Praktikum 1, Phasendiagramm 1. Zusammenfassung 2. Einführung Jan Rys, Damian Hodel 2.1. Ziel Das Ziel war es, ein Phasendiagramm für Diphenyl und Naphtalin aus experimentellen Werten zu erstellen. 2.2. Leitsubstanzen Für den Versuch wurden verwendet: Diphenyl: C12H10 M = 154.21 g/mol Smp = 69°C Naphtalin: C10H8 M = 128.17 g/mol Smp = 78.2°C Beide Stoffe sind in Ethanol, Diethylether, Benzol löslich. Die eutekische Mischung hat eine Zusammensetzung von 45.5 mol-% Naphtalin und 54.5 mol-% Diphenyl. 2.3. Theorie 2.3.1. Phasendiagramm Aus einem Phasendiagramm kann man die Phasen (im Gleichgewichtszustand) einer bestimmten prozentualen Zusammensetzung und Temperatur zweier oder mehrerer Stoffe ablesen. Bei den Parametern handelt es sich um intensive und extrensive Zustandsvariablen. Die intensiven Parameter, wie z.B. Druck, Dichte, Temperatur sind unabhängig von der Grösse des betrachteten Systems. Im Gegensatz dazu sehen die extensiven Zustandsgrösse, wie z.B. innere Energie, Volumen, Entropie und die freie Energie, die systemunabhängig sind. Abbildung 1 zeigt ein binäres isobares Phasendiagramm. Das Diagramm wird durch zwei Grenzlinien in drei Bereiche aufgeteilt. Oben befindet sich der Stabilitätsbereich der Schmelze. Der Bereich ganz unten ist der Stabilitätsbereich der Mischkristalle. Dazwischen liegen die 2-Phasen-Felder (Kristalle und Schmelze). Die Grenzlinie zwischen Schmelze und Schmelze/Kristall wird Liquidus und die zwischen Kristall und Schmelze/Kristall wird Solidus genannt. Der Punkt an dem alle Linien zusammen treffen wird Eutektikum genannt. Die eutektische Zusammensetzung stellt diejenige Zusammsetzung dar, welche die niederigste Schmelztemperatur aufweist. Beim Aufschmelzen oder Erstarren durchläuft das eutektische Gemisch kein 2-PhasenGebiet. Seite 2 von 15 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel 2.3.2. Thermisches Verhalten von Gemischen Für die Bestimmung eines Phasendiagramms verwendet man in der thermischen Analyse die Abkühlungskurven. Dabei wird die gemessene Temperatur über der Zeit aufgetragen. Festkörper bzw. Schmelzen kühlen sich bei konstantem Temperatur (Energie) – entzug gemäss ihrer spezifischen Wärmekapazität ab (vgl. Abb. 1). Bei reinen Komponenten (Kurve A und B) und beim Eutektikum (Kurve xE) zeigt sich ein Haltepunkt der Temperatur. Dabei beginnt die Kristallisation und die freigesetzte Kristallisationswärme verhindert eine weitere Abkühlung bis das gesamte System kristallisiert ist. Mischungen dagegen weisen beim Erreichen der Liquiduslinie einen Knickpunkt auf (Kurve X1). Da dabei eine Substanz beginnt auszukristllisieren kommt es zu einer verlangsamten Abkühlung wegen der freigesetzten Erstarrungswärme. Im 2-Phasen-Gebiet existiert kein definierter Schmelzpunkt. Die Schmelze verarmt beim Abkühlen an der Substanz mit dem höheren Schmelzpunkt. Beim erreichen der eutektischen Linie bleibt die Temperatur konstant und der Rest kristallisiert aus. Abbildung 1: Abkühlungskurven 2.4. Hypothese Ist es möglich die Abkühlungskurven eines Gemisches mit verschiedenen Zusammensetzungen zu messen, so kann man daraus ein binäres Phasendiagramm für das Gemisch erzeugen. Seite 3 von 15 Praktikum 1, Phasendiagramm 3. Jan Rys, Damian Hodel Material und Methoden 3.1. Chemikalien Für das binäre Gemisch wurden Naphtalin und Diphenyl in verschieden molaren Zusammensetzungen verwendet. 3.2. Messung der Abkühlungskurven Wir führten den Versuch anhand von 5 verschiedenen molaren Zusammensetzungen durch. Die Proben wurden in ein Reagenzglas gegeben. Danach erwärmten wir das Gemisch unter Rühren im Wasserbad auf ca. 80°C. Das Reagenzglas wurde in einen kleinen Zylinder gemäss Versuchsanordnung (Abb. 2) in ein Eisbad gestellt. Von diesem Zeitpunkt an wurde die Temperatur der Probe alle 10 s mit einem Thermometer gemessen. Es wurde solange gemessen bis das ganze Gemisch kristallisiert war. Danach wurden die gemessenen Temperaturen gegen die Zeit aufgetragen. Abbildung 2: Versuchsanordnung Es wurden folgende Gemische verwendet: Tabelle 1: Verwendete Gemische zur Bestimmung der Abkühlungskurven Probe 1. Substanz Masse in [g] ± 0.001 [g] 1 2 3 4 5 Diphenyl Diphenyl Diphenyl Diphenyl Diphenyl 3 3 3 3 3 Anzahl [mol] ± 0.001 [mol] 0.019 0.019 0.019 0.019 0.019 Seite 4 von 15 2. Substanz Masse in [g] ± 0.001 [g] Naphtalin Naphtalin Naphtalin Naphtalin Naphtalin 0.609 1.282 2.179 4.522 9.741 Anzahl [mol] ± 0.001 [mol] 0.005 0.010 0.017 0.035 0.076 Praktikum 1, Phasendiagramm 4. Jan Rys, Damian Hodel Resultate Die Tabellen mit den Messdaten sind dem Anhang zu entnehmen. Die Kurven wurde in kleine charakteristische Abschnitte unterteilt (vgl. Kap. 2.3.2) und eine Regressionsgerade darüber gelegt. 60 58 T [ЎC ] 56 54 52 50 48 70 120 170 220 270 320 t [s] Abbildung 3: Ausschnitt der Abkühlungskurve für die 1. Probe Abbildung 3 zeigt einen typischen Verlauf einer Abkühlungskurve für den Phasenübergang zwischen flüssig und fest. Seite 5 von 15 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel Danach wurden die Phasenübergänge (Knick in der Geraden, Anstieg der Temperatur) in ein neues Diagramm umgewandelt. Dabei entstand folgendes binäres Phasendiagramm: 90 80 70 T [ЎC] 60 L 50 α +L 40 β +L 30 20 α+β 10 0 0 10 20 30 40 50 60 Naphtalin [mol-% ] Abbildung 4: Phasendiagramm Diphenyl / Naphtalin Seite 6 von 15 70 80 90 100 Praktikum 1, Phasendiagramm 5. Jan Rys, Damian Hodel Diskussion 5.1. Ziel/Hypothese Das Ziel wurde erreicht. Es ist uns gelungen für verschiedene Zusammensetzungen von Diphenyl und Naphtalin Abkühlungskurven zu messen und daraus ein Phasendiagramm für das Gemisch zu ermitteln. 5.2. Phasendiagramm Das erhaltene Phasendiagramm macht Sinn. Das Eutektikum liegt auf der Seite der höheren Diphenyl-Konzentration, was auch zu erwarten war, da die Schmelztemperatur von reinem Dyphenyl tiefer ist als der von reinem Naphtalin. Die Bestimmung der Temperaturen für die Umwandlungen aus den Abkühlungskurven war nicht immer einfach. Vor allem bei der Umwandlung von der Schmelze zu einem 2-Phasen-Gemisch konnte die Temperatur nicht immer klar abgelesen werden. Die Soliduslinie konnte nur über das eutektische Gemisch eindeutig bestimmt werden. Ein Grund für die Schwierigkeit zur Bestimmung der Liquiduslinie liegt möglicherweise darin, dass der Thermometer zwischenzeitlich die Glaswand des Reagenzglases berührt hat. Zudem können ebenfalls Ungenauigkeiten beim Einwägen der Stoffe zu einem Fehler führen. Um die Genauigkeit zu erhöhen sollte es möglich sein mehr Messpunkte in kürzeren Zeitabständen zu bestimmen. Je kleiner das Intervall umso genauer wird die Abkühlungskurve dargestellt. 6. [1] Referenzen Departement Materialwissenschaft ETH Zürich (Herbst 2005). Phasendiagramm. Versuch Nummer 6. Seite 7 von 15 Praktikum 1, Phasendiagramm 7. Jan Rys, Damian Hodel Anhang 75 70 65 T [ЎC ] 60 55 50 45 40 35 0 100 200 300 400 500 600 t [s] Abbildung 5: Abkühlungskurve der 1. Probe 70 65 T [ЎC] 60 55 50 45 40 35 0 100 200 300 400 t [s] Abbildung 6: Abkühlungskurve der 2. Probe Seite 8 von 15 500 600 700 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel 80 75 70 65 T [ЎC] 60 55 50 45 40 35 30 0 100 200 300 400 500 600 700 800 900 1000 1100 t [s] Abbildung 7: Abkühlungskurve der 3. Probe 80 75 70 T [ЎC] 65 60 55 50 45 40 35 0 100 200 300 t [s] Abbildung 8: Abkühlungskurve der 4. Probe Seite 9 von 15 400 500 600 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel 75 70 65 T [ЎC] 60 55 50 45 40 35 0 100 200 300 400 500 600 t [s] Abbildung 9: Abkühlungskurve der 5. Probe Seite 10 von 15 700 800 900 1000 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel Tabelle 2: Messwerte für die 1. Probe Probe 1 Verhältnis Diphenyl/Naphtalin in [mol-%] 80/20 T [°C] t [s] 73 72.8 72.4 70.6 68.8 67 65.6 63.9 61.8 59.8 58.4 56.8 55.8 54.6 54.6 53.8 53.2 52.6 52.9 53.3 53.5 53.4 53.3 53.1 52.7 52.4 52.1 51.3 50.9 50.4 50.2 49.7 49.2 48.9 48.6 48.4 48 T [°C] 0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 Seite 11 von 15 t [s] 47.6 47.3 46.6 46.2 45.8 45 44.5 44.2 43.8 43.6 43.3 42.9 42.5 42.1 41.9 41.5 41.1 40.9 40.6 40.1 39.8 39.4 39.2 38.9 370 380 390 400 410 420 430 440 450 460 470 480 490 500 510 520 530 540 550 560 570 580 590 600 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel Tabelle 3: Messwerte für die 2. Probe Probe 2 Verhältnis Diphenyl/Naphtalin in [mol-%] 65/35 T [°C] t [s] 70.4 69 67.5 66.4 65.2 64.1 62 61.3 60 59 58 57 56.2 55 54.1 53.2 52.2 51.5 50.6 49.7 49 48 47.5 46.7 45.9 45.2 44.5 43.9 43.3 42.7 42 41.4 41 40.3 39.7 39.3 38.9 T [°C] 0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 Seite 12 von 15 t [s] 38.4 37.9 37.7 37.3 37.1 36.9 36.8 36.8 37.3 37.8 38.2 38.5 38.9 39 39.2 39.2 39.3 39.3 39.2 39.2 39.2 39 38.9 38.8 38.8 38.5 38.5 38.4 38.3 38.3 38.1 38.1 38 38 38 37.9 370 380 390 400 410 420 430 440 450 460 470 480 490 500 510 520 530 540 550 560 570 580 590 600 610 620 630 640 650 660 670 680 690 700 710 720 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel Tabelle 4: Messwerte für die 3. Probe Probe 3 Verhältnis Diphenyl/Naphtalin in [mol-%] 54.5/45.5 T [°C] t [s] 82.2 80.8 79.3 77 75.2 73.8 72.5 71.2 70.1 69 67.7 66.5 65.3 64.2 63.3 62.2 61.2 60.3 59.2 58.3 57.5 56.6 55.8 54.6 53.9 53.3 52.4 51.6 50.8 50.3 49.3 48.9 48 47.4 46.8 46.1 45.5 44.8 44.2 43.6 43 42.6 T [°C] 0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 370 380 390 400 410 Seite 13 von 15 t [s] 42 41.5 40.9 40.5 40 39.6 39 38.5 38.1 37.5 37.2 36.8 36.5 36 35.7 35.3 35 34.7 34.4 34.2 33.9 33.8 33.6 33.3 33 32.9 32.7 32.6 32.7 32.9 33 33.6 34 34.5 34.9 35.3 35.7 35.8 36 36.3 36.4 36.5 T [°C] 420 430 440 450 460 470 480 490 500 510 520 530 540 550 560 570 580 590 600 610 620 630 640 650 660 670 680 690 700 710 720 730 740 750 760 770 780 790 800 810 820 830 Zeit [s] 36.6 36.6 36.6 36.7 36.7 36.7 36.8 36.8 36.8 36.8 36.8 36.8 36.8 36.8 36.7 36.7 36.7 36.6 36.5 36.5 36.4 36.4 36.4 36.4 36.3 36.3 36.2 36.2 36.2 36.2 36.2 36 36 35.9 35.9 35.9 35.9 840 850 860 870 880 890 900 910 920 930 940 950 960 970 980 990 1000 1010 1020 1030 1040 1050 1060 1070 1080 1090 1100 1110 1120 1130 1140 1150 1160 1170 1180 1190 1200 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel Tabelle 5: Messwerte für die 4. Probe Probe 4 Verhältnis Diphenyl/Naphtalin in [mol-%] 35/65 T [°C] t [s] 76.9 72.2 67 64.6 63.5 61.6 60.8 59.4 58 57 55.7 54.7 53.5 52.8 52 51.4 51 50.7 50.4 50 49.6 49.2 48.8 48.4 48.2 47.8 47.5 47.1 46.8 46.6 46.3 46 45.7 45.5 45.1 44.9 44.6 T [°C] 0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 370 Seite 14 von 15 t [s] 44.3 44 43.7 43.4 43.1 43 42.6 42.3 41.9 41.7 41.3 41.1 40.8 40.6 40.3 39.9 39.8 39.5 39 39 38.8 38.8 38.5 380 390 400 410 420 430 440 450 460 470 480 490 500 510 520 530 540 550 560 570 580 590 600 Praktikum 1, Phasendiagramm Jan Rys, Damian Hodel Tabelle 6: Messwerte für die 5. Probe Probe 5 Verhältnis Diphenyl/Naphtalin in [mol-%] 20/80 T [°C] t [s] 72.1 71 69.8 68.4 67.3 66.3 65.8 65.7 65.6 65.5 65.3 65 64.7 64.4 64.1 63.7 63.4 63.1 62.7 62.4 62 61.6 61.3 60.9 60.5 60.2 59.9 59.5 59.2 58.9 58.4 58.2 57.8 57.5 57.1 56.8 56.5 T [°C] 0 10 20 30 40 50 60 70 80 90 100 110 120 130 140 150 160 170 180 190 200 210 220 230 240 250 260 270 280 290 300 310 320 330 340 350 360 370 Seite 15 von 15 t [s] 56.1 55.8 55.5 55.2 54.9 54.4 54.2 53.9 53.6 53.3 53.1 52.7 52.4 52.2 51.8 51.6 51.3 51 50.7 50.4 50.1 49.9 49.6 49.3 49 48.8 48.5 48.1 47.9 47.7 47.4 47.1 46.9 46.6 46.3 46.1 45.8 45.6 T [°C] 380 390 400 410 420 430 440 450 460 470 480 490 500 510 520 530 540 550 560 570 580 590 600 610 620 630 640 650 660 670 680 690 700 710 720 730 740 750 t [s] 45.3 45 44.8 44.6 44.3 44.1 43.8 43.6 43.3 43.1 42.9 42.6 42.4 42.2 41.9 41.8 41.6 41.4 41.2 41 40.8 40.6 40.5 40.3 40.1 40 39.8 760 770 780 790 800 810 820 830 840 850 860 870 880 890 900 910 920 930 940 950 960 970 980 990 1000 1010 1020