Nur Text - Ruhr-Universität Bochum
Werbung

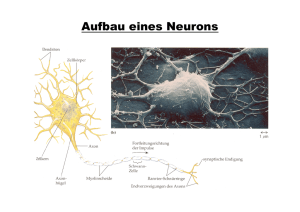
Prof. Dr. Rolf Dermietzel, Dr. Carola Meier, Dr. Georg Zoidl, Institut für Anatomie, Neuroanatomie und Molekulare Hirnforschung, Medizinische Fakultät „Aschenputtel“ unter den Zellkontakten: Elektrische Synapse Viel zu lange unterschätzt rücken sie jetzt in den Blickpunkt der Forscher: Elektrische Synapsen leiten Signale blitzschnell durch die Nervenbahn und spielen damit eine wichtige Rolle bei einigen natürlichen und krankhaften Prozessen im Gehirn. Das weitverbreitete Verständnis des Übertragungsmechanismus von elektrischen Impulsen in Nervenzellen schließt chemische Botenstoffe ein, die an bestimmten Kontakten (Synapsen) abgegeben werden. Diese sog. Neurotransmitter vermitteln das Signal an nachgeschaltete Nervenzellen weiter. Heute weiß man, dass zahlreiche solcher Botenstoffe existieren und für fundamentale Prozesse der Signalverarbeitung im Nervensystem verantwortlich sind. Eine ganze Reihe von Erkrankungen des zentralen Nervensystems beruhen auf dem Verlust eines bestimmten Botenstoffes, z. B. des Dopamins bei der Parkinson-Erkrankung. Die meisten Neuropharmaka wie Beruhigungsmittel und Antidepressiva greifen in den Stoffwechsel der Neurotransmitter ein, indem sie Veränderungen des Erregungszustandes in ganz bestimmten Hirnregionen dämpfen oder stimulieren. Die Möglichkeit in den Haushalt der Botenstoffe einzugreifen und über Störungen ihres Stoffwechsels neurologische und psychiatrische Erkrankungen erklären zu können, hat chemische Synapsen zu einem Schwerpunkt neurowissenschaftlicher Forschung werden lassen. Erst in jüngster Zeit wird deutlich, dass alternativ zu den chemischen Synapsen Membrankontakte im Nervensystem existieren, die keine Botenstoffe benutzen, und an denen elektrische Impulse direkt übertragen werden: Der grundlegende physikalische Vorgang der Signalvermittlung zwischen Neuronen – die Änderung der Spannung an der Nervenzellmembran und der daraus resultierende Stromfluss an den Synapsen – kommt hier ohne die Helfershelfer Neurotransmitter aus (s. Abb. 1 u. 2). Erst in den letzten Jahren hat sich die elektrische Synapse als ebenbürtiger Partner der chemischen Synapse erwiesen. Sie ist für bestimmte elementare Verarbeitungsmechanismen im zentralen Nervensystem sogar von erheblicher Bedeutung. Ein wesentlicher Vorteil elektrischer Synapsen, auch Gap Junctions genannt, ist die hohe Geschwindigkeit ihrer direkten Erregungsübertragungen. Dagegen führen bei der chemischen Synapse (s. Abb. 3) Signalabgabe, Diffusion durch den Spalt, der die beiden Nervenzellen trennt, sowie die Reaktionen an der Membran der nachfolgenden Nervenzelle, die den Impuls weiterleitet, zu einer Verzögerung von bis zu 0,5 Millisekunden. Das entspricht der Dauer eines Wimpernschlages und ist für die Dimensionen der Physik und Physiologie eine erhebliche Zeitspanne. Elektrische Synapsen, die den Strom direkt von Zelle zu Zelle weiterleiten, wurden zuerst bei Nervenzellen von Fischen gefunden, wo sie z.B. Fluchtreflexe vermitteln. Sie setzen außerordentlich schnelle Verhaltensmuster in Gang, die für das Überleben wichtig sind. Der Aufbau der elektrischen Synapsen unterscheidet sich erheblich von dem der chemischen Synapsen. Die elektrische Synapse besteht aus kleinen durch Eiweißmoleküle gebildeten Kanälen (s. Abb. 1 u. 2). Diese Kanäle verbinden die beiden aneinander grenzenden Zellen, indem sie die Zellmembranen durchdringen und den Zwischenzellraum überbrücken. Damit wird ein direkter Stromfluss zwischen Nervenzellen möglich. Auch zwischen den Stützzellen (Gliazellen) befinden sich in großer Zahl Strukturen, die den elektrischen Synapsen entsprechen. Sie verbinden das Gliagewebe wie ein Netzwerk zu einem funktionellen Synzytium (Abb. 4). Herzmuskelzellen sind ebenfalls durch solche Kontakte miteinander gekoppelt. Sie leiten elektrische Impulse weiter, die zur Kontraktion der Muskulatur führen. Eine Blockade dieser Strukturen würde sofort zum Herzstillstand führen. Elektrische Synapsen bzw. Gap Junctions lassen sich nachweisen und exakt lokalisieren, seitdem man die Eiweiße, aus denen die Kanäle aufgebaut sind, identifizieren und dagegen Antikörper produzieren konnte (s. Abb. 5). Wir sind mehr als zwanzig Jahre auch der Frage nachgegangen, wie groß die Zahl elektrischer Synapsen im Gehirn von Wirbeltieren ist, und an welchen Stellen sie anzutreffen sind. Erstaunlicherweise sind sie im Gehirn von Nagern, die man als Labortiere nutzt, viel häufiger vorhanden, als ursprünglich vermutet. Sie treten an Neuronen zwar nicht so zahlreich auf wie die chemischen Synapsen, sind dafür aber in bestimmten Nervenzellansammlungen mit spezifischen Funktionen konzentriert. Man trifft sie hauptsächlich dort an, wo eine schnelle Erregungsleitung benötigt wird, weil die Aktivität von Nervenzellgruppen synchronisiert werden soll. So gibt es in der Hirnrinde ein System von Nervenzellen, das seine Aktivität offenbar über elektrische Synapsen synchronisieren kann, und das diesen Rhythmus an übergeordnete neuronale Netzwerke weiterleitet. Seit langem ist bekannt, dass sich von der Hirnrinde rhythmische Aktivitäten ableiten lassen, die man als Oszillationen bezeichnet. Für die Entstehung dieser in ihrer Frequenz zum Teil variierenden Oszillationen werden unterschiedliche Mechanismen verantwortlich gemacht. Neueste Untersuchungen zeigen jedoch, dass offenbar für das Entstehen von Oszillationen in der Hirnrinde elektrische Synapsen mitverantwortlich sind. Sie synchronisieren jene Nervenzellen miteinander, die einen hemmenden Einfluss auf übergeordnete Neuronen ausüben. In diesen übergeordneten aus sog. Pyramidenzellen bestehenden Netzwerken vermutet man die Speicherorte für Erinnerungen sowie Regionen, in denen Wahrnehmungen verarbeitet und motorische Funktionen initiiert werden. Die hemmenden Nervenzellen können offenbar eintreffende Erregungen filtern, sie aufgrund ihrer Kopplung durch elektrische Synapsen in schnelle rhythmische Entladungen umwandeln und diese Rhythmen über größere Distanzen an die übergeordneten Neurone weiterleiten. Dies ist vergleichbar einem Harmonium, das über die rhythmische Bedienung von Blasebälgen unterschiedliche Pfeifen ansteuert, die in ihrem Zusammenspiel einen Akkord und aus der Reihung von Akkorden Musik entstehen lassen. Die rhythmische Zufuhr von Luft ermöglicht es, über die gesamte Tastatur die spezifischen Pfeifentöne zu bedienen. Komplexer Sinneseindruck formt sich wie eine Melodie Wenn man das Bild des Harmoniums auf das Gehirn überträgt, so können über die schnelle Ausbreitung von rhythmischen Erregungen durch elektrische Synapsen fast gleichzeitig über die gesamte Tastatur des Gehirns Regionen mit unterschiedlichen Funktionen (Akkorden) angesteuert werden. Daraus formt sich dann wie eine Melodie oder ein ganzes symphonisches Werk ein komplexer Sinneseindruck. Über solche Mechanismen erklären sich komplizierte Wahrnehmungsbilder, die unser Gehirn aus vielen gleichzeitig eintreffenden Detailinformationen zu einem Bild von der Welt verschmilzt. Elektrische Synapsen scheinen bei diesem Vorgang der sog. Koinzidenz-Detektion (Gleichzeitigkeit der Registrierung) eine wichtige Rolle zu spielen. Das Auftreten von synchronen über elektrische Synapsen vermittelten Aktivitäten im Gehirn kann aber auch Krankheitsursachen haben. So wird zum Beispiel heftig diskutiert, ob elektrische Synapsen am Entstehen epileptischer Anfälle oder bei der Größenausdehnung eines Schlaganfalles beteiligt sind. Da epileptische Anfälle immer durch ein hohes Maß an synchroner Aktivität von Nervenzellen gekennzeichnet sind, deren Entladungen sich über weite Hirnareale ausbreiten, ist es naheliegend, dass die schnell leitenden elektrischen Synapsen hierbei eine Rolle spielen. Wir entwickeln und prüfen zur Zeit Substanzen, die eine Weiterleitung von elektrischen Impulsen an diesen Synapsen hemmen. Derartige Substanzen könnten einen neuen Ansatz bei der Behandlung von Epilepsien bieten. Neuer Therapieansatz für Epilepsie Auch bei der Entstehung von größeren Hirndefekten nach einem Schlaganfall scheinen elektrische Synapsen eine wichtige Rolle zu spielen (s. Info, S. 38). Vermutlich sorgen die Gap Junctions zwischen den Gliazellen dafür, dass das innere Milieu des Gehirns konstant gehalten wird. Offenbar werden gelöste Substanzen über die Kontakte zwischen den Gliazellen innerhalb des glialen Netzwerkes verteilt. Bei massivem Stress, wie durch einen Schlaganfall ausgelöst, können sich schädliche Stoffwechselprodukte in den Zellen anhäufen. Werden diese Substanzen dann aber über die Gap Junctions weitergeleitet, können sie auch primär nicht vom Infarkt betroffene Zellgruppen schädigen. Der Vorgang wird als “Bystander-Effekt” (engl.: Beistand) bezeichnet. Im Falle des Hirninfarktes vermittelt dieser „Beistand“ jedoch Zelltod induzierende Faktoren, die letztlich das Infarktareal vergrößern. Auch hier wäre es von Vorteil, die funktionelle Kopplung der glialen Zellen über Gap Junctions zu verringern (s. Info). Welche Substanzen freigesetzt werden und wie diese bei einem solchen „negativen Beistand“ weiter geleitet werden, ist bislang noch nicht aufgeklärt. Ihre Auswirkungen können aber beim Hirninfarkt wie auch bei mechanischen Hirnverletzungen dramatisch sein. Blickt man auf die Entwicklung dieses Forschungszweiges der modernen Neurowissenschaften zurück, so stellt man fest, die elektrische Synapse ist im Bewusstsein der Hirnforscher endlich aus dem Schatten der chemischen Synapse hervorgetreten. Sie wird nicht nur unser Verständnis von der Funktionsweise des Gehirns bereichern, sondern hält auch neue Therapieansätze für eine Reihe von Erkrankungen des Nervensystems bereit.