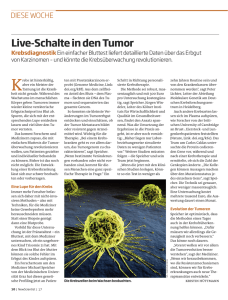
+ H - Uni Saarland Logo
Werbung

Vorlesung Teil 2: Organische Chemie Prof. Dr. Andreas Speicher Universität des Saarlandes Organische Chemie Campus C4 2, 4.05 Postfach 15 11 50 66123 Saarbrücken 66041 Saarbrücken Tel.: 0681 302 2749 Fax.: 0681 302 2029 e-mail: [email protected] Sprechstunde: nach Vorlesung, im Praktikum Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 1 Vorlesungsplan Zeek, 7. Aufl.: OC1 14.12. 1. Organische Chemie – Chemie des Kohlenstoffs 11.1 OC2 17.12. 2. Gesättigte Kohlenwasserstoffe: Alkane 11.2-4, 13.5 OC3 19.12 3. Ungesättigte Kohlenwasserstoffe: Alkene 11.5 19.12 13.15 Uhr: Sicherheitsbelehrung zum Praktikum, Infos OC4 21.12. (3.) Polyene und Polymerisation OC5 07.01. 4. Aromaten und Alkine 11.6/7 OC6 09.01. 5. Alkohole, Phenole, Ether, Schwefelverbindungen 13.1-13.3 OC7 11.01. 6. Amine; 7. Nucleophile Substitution, 8. Heterocyclen 13.4/6, 21.1-3 OC8 14.01. 9. Carbonylverbindungen: Aldehyde, Ketone, Chinone 14., 15. OC9 16.01. 10. Carbonsäuren und Carbonsäure-Derivate 16. OC10 18.01 11. Stereochemie und Stereoselektivität 18. OC11 21.01. 12. Kohlenhydrate I 20. 23.01 Klausur 1 OC12 25.01. 12. Kohlenhydrate II 20. OC13 28.01. 13. Aminosäuren, Peptide, Proteine 19. OC14 30.01. 14. Stofftrennung und Spektroskopie 5.6, 22. OC15 01.02. 15. Reaktionskinetik 12. OC16 04.02. 16. Derivate anorganischer Säuren; 17. Nucleinsäuren 17. ; 21.4 06.02. Klausur 2 08.02. 18. Weitere medizinisch relevante Verbindungen, WH/Übung OC17 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie diverse 2 Bücher zu Vorlesung und Praktikum: Urban & Fischer 5. Auflage 2003, ISBN: 3-437-42441-6 6. Auflage 2005/2006, ISBN: 978-3437424410 7. Auflage 2010, ISBN: 978-3437424434 EUR 35,95 Urban & Fischer 1. Auflage 2008 ISBN-13: 978-3437424465 EUR 15,95 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 3 Bücher zu Vorlesung und Praktikum: Pearson 2008 de Gruyter, 9. Auflage 2008 ISBN 978-3827372864 ISBN 978-3-11-019063-2 EUR 49,95 EUR 29,95 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 4 Bücher zu Vorlesung und Praktikum: Schatz, Tammer Erste Hilfe … 1. Auflage 2007 2. Auflage 2012 Springer ISBN 978-3642204135 EUR 34,95 Institut für medizinische und pharmazeutische Prüfungsfragen (IMPP) Gegenstandskatalog Chemie/Biochemie Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 5 Bücher zu Vorlesung und Praktikum: McMurry, Begley: Organische Chemie der biologischen Stoffwechselvorgänge Elsevier 2006 ISBN-13: 978-3827416575 EUR 59,50 (Amazon: 24,95) Gossauer: Struktur und Reaktivität der Biomoleküle Wiley-VCH 2006 ISBN-13: 978-3-906390-29-1 EUR 75,00 (Amazon: 59,90) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 6 1. Organische Chemie – Die Chemie des Kohlenstoffs Anorganische Chemie Organische Chemie Cl Na Na Cl Na Na Cl Cl Na Na Cl Cl Na Na Cl Cl Na Na Cl Na Cl Cl Na Cl Na Cl Cl Na Cl Na Cl Cl Na Cl Na Cl Na Cl Na Cl Na Na Cl Na Cl Na Cl Cl ? Na Na Cl Na Cl Cl NaCl Cl Na Na Cl Na Cl Na NaCl (Kochsalz) DNS (Desoxyribonukleinsäure) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 7 1. Organische Chemie – Die Chemie des Kohlenstoffs Anorganisch Organisch Friedrich Wöhler 1828 • • • • • Mineralische Materie alle Elemente Ionen (-bindungen) Kristalle schnelle Reaktionen • • • • • Lebende Materie C, H, O, N, S, P, Hal kovalente Bindungen auch unpolare Verbindungen langsame Reaktionen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 8 1. Organische Chemie – Die Chemie des Kohlenstoffs Der Kohlenstoff … • Nichtmetall • vierwertig, kovalente Bindungen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 9 1. Organische Chemie – Die Chemie des Kohlenstoffs Chemische Bindung mit Kohlenstoff Elektronenkonfiguration des Kohlenstoffs: Hybridisierungen: Grundzustand: 1s2, 2s2, 2p2 nur zweiwertig, kein Oktett angeregter Zustand: 1s2, 2s1, 2p3 vierwertig Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 10 1. Organische Chemie – Die Chemie des Kohlenstoffs sp3-Hybridisierung: 2s + 2px + 2py + 2pz verbleibt: vier sp3-Orbitale –– „tetraedrisch“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 11 1. Organische Chemie – Die Chemie des Kohlenstoffs sp2-Hybridisierung: 2s + 2px + 2py verbleibt: drei sp2-Orbitale 2pz „trigonal planar“ von oben von der Seite © P. Bruice, Organische Chemie, Pearson Studium 2007 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 12 1. Organische Chemie – Die Chemie des Kohlenstoffs sp-Hybridisierung: 2s + 2px verbleiben: zwei sp-Orbitale 2py + 2pz „linear“ © P. Bruice, Organische Chemie, Pearson Studium 2007 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 13 1. Organische Chemie – Die Chemie des Kohlenstoffs Die Vielfalt …. der Kohlenstoff-Verbindungen: • Kohlenstoff ist vierwertig • 3 verschiedene Hybridisierungen und Geometrien am C • kovalente Bindungen zu vielen Elementen des PSE*) • Einfach- und Mehrfachbindungen • Kohlenstoff-Kohlenstoff-Bindungen *) biologisch relevante Verbindungen: H, O, N, P, S, Hal.. …. der Reaktionen von Kohlenstoff-Verbindungen: • unterschiedliche Polarität der Bindungen zum Kohlenstoff • Reaktionen über C-Kationen, C-Anionen und C-Radikale Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 14 1. Organische Chemie – Die Chemie des Kohlenstoffs Die Vielfalt der Kohlenstoff-Verbindungen: Funktionelle Gruppen Verbindungsklassen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 15 1. Organische Chemie – Die Chemie des Kohlenstoffs Glykogen Proteine Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie DNS 16 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Das Methan: CH4 Kugel-Stab-Modell Kalottenmodell Moleküloberfläche Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 17 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Lineare Alkane CnH2n+2 Homologe Reihe: CnH2n+2 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 18 2. 2.1 Anzahl C Name Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Summenformel Schmp. [°C] Sdp. [°C] bei 20°C 1 Methan CH4 -182.5 -162 Gas 2 Ethan C2H6 -183.3 -89 Gas 3 Propan C3H8 -188 -42 Gas 4 Butan C4H10 -138 0 Gas 5 Pentan C5H12 -130 36 flüssig 6 Hexan C6H14 -95 69 flüssig 7 Heptan C7H16 -91 98 flüssig 8 Octan C8H18 -57 126 flüssig 9 Nonan C9H20 -54 151 flüssig 10 Decan C10H22 -30 174 flüssig 11 Undecan C11H24 -26 196 flüssig 12 Dodecan C12H26 -10 216 flüssig Eicosan C20H42 37 343 fest Erdgas „Gase“ „Petrolether“ „Benzin“ „Diesel“ … 20 „Wachs“ Brennstoffe, Lösemittel, Salbengrundlage (Vaseline) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 19 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Konstitution: Gerüstisomerie ab “Butan” Summenformel Zahl der Isomeren C3H8 C4H10 C5H12 C6H14 C7H16 C8H18 1 2 3 5 9 18 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie C40H82 62.481.801.147.341 20 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Nomenklatur: Alkylreste / Alkylsubstituenten CH 3 Methyl CH2 Ethyl H3C H3C CH2 CH 2 H3C CH CH 3 H3C CH 2 CH2 CH2 H3C CH 2 CH CH3 H3C CH CH2 n-Propyl Isopropyl primäres C: mit 0 oder 1 C verbunden n-Butyl sekundäres C: mit 2 C verbunden sek-Butyl tertiäres C: mit 3 C verbuden Isobutyl CH3 H3C C CH3 tert-Butyl CH3 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 21 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Nomenklatur: Grundregeln für Alkane Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 22 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Übungsaufgaben: Benennen Sie folgende Verbindungen: H 3C CH 2 CH2 CH CH2 CH 2 CH 3 CH2 CH2 CH 2 CH 3 H 3C CH 2 CH2 CH CH2 CH 2 CH 2 CH3 CH CH3 CH3 CH2 CH3 CH 3 H 3C CH 2 C CH2 CH2 CH CH CH 2 CH3 CH2 CH 2 CH 3 CH3 Zeichnen Sie folgende Verbindung: 6-Ethyl-2,2,4-trimethyl-4-propyloctan Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 23 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Übungsaufgaben: Benennen Sie folgende Verbindungen: 4-(1-Propyl)octan n-propyl 4-(2-Propyl)octan isopropyl 3,3,6-Triethyl-7-methylnonan Zeichnen Sie folgende Verbindung: 6-Ethyl-2,2,4-trimethyl-4-propyloctan Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 24 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Konformation: Drehung um s-Bindungen s-Bindung: Orbitalüberlappung auf der Verbindungsachse der Atome s-Anteil der beteiligten Orbitale (sp3, sp2, sp) Ethan: Drehung um Einfachbindung: Konformationen Energieunterschiede Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 25 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Konformationen: Kalottenmodelle: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 26 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Konformationen: Ethan Torsionsenergie in Abhängigkeit vom Torsionswinkel Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 27 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Die gestaffelte „Konformation“ ist um 12.5 kJ/mol energieärmer ! 60° H H H H H H 255 pm H gestaffelt H H Warum? H H H HH H 0° 229 pm ekliptisch H H H van-der-Waals-Abstoßung HH H H H H Ist das viel ? k B T -RGT k e h 12.5 kJ/mol Eyring-Gleichung: Rechnung: bei 25°C sind ~ 3,6•1010 Drehungen pro s möglich !! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 28 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Konformationen des n-Butan: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 29 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften n-Butan: CH3 CH3 H H H energetisch „günstig“: CH3 H CH3 H H H CH3 H H gauche H H H H CH3H CH3 H CH3 H H CH3 anti H3C H 3C H CH3 CH3 CH3 H H H H H H H H H H gauche • Beliebig viele Konformationen (Rotamere), Minima und Maxima • Konformere: Rotamere in einem „Energietal“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 30 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften n-Decan – Konformation(en) und Schreibweisen Räumliche Gestalt großer Moleküle Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 31 2. 2.1 Gesättigte Kohlenwasserstoffe: Alkane Struktur und Eigenschaften Übungsaufgaben: Benennen Sie folgende Verbindungen: 4-(1-Propyl)octan n-propyl 4-(2-Propyl)octan isopropyl 3,3,6-Triethyl-7-methylnonan Zeichnen Sie folgende Verbindung: 6-Ethyl-2,2,4-trimethyl-4-propyloctan Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 32 Wiederholung: Chemie des Kohlenstoffs, Alkane Kohlenstoff: C ist vierwertig Hybridisierungen und Geometrien Methan C-C -Bindungen Ethan Propan Butan Pentan Alkane: homologe Reihe Konstitutionsisomere (Nomenklatur) Konformationen und Konformere „Polyalkan“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 33 2.2 Cyclische Alkane Cycloalkane durch Ringschluss homologe Reihe CnH2n keine anti-Konformationen „Torsionsspannung“ Ringspannung ungünstige Bindungswinkel „Winkelspannung“ Geometrischer Bindungswinkel bei ebener (planarer) Struktur: Moleküle „optimieren“ ihre Geometrie Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 34 2.2 Cyclische Alkane Cyclohexan: Cyclohexan • nicht planar • „Sesselkonformation“: alle Bindungswinkel ~110° • an allen Bindungen gestaffelt und gauche-Konformation ! • Ringspannung ~0 kJ/mol ! • axiale und äquatoriale Substituenten • „Ober- und Unterseite“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 35 2.2 Cyclische Alkane Cyclohexan: Drehung um Einfachbindungen Konformationen ? • keine „Winkelspannung“, aber: • zwei C-C -Bindungen ekliptisch „Torsionsspannung“ • + 1,4-Repulsion (180 pm) energiereicher als Sessel (25 kJ/mol) kein Konformer Sesselformen (1+2) energetisch günstig Konformere Jeder Substituent ändert von Sesselform 1 nach Sesselform 2 seine räumliche Lage von äquatorial zu axial und umgekehrt („Durchklappen“) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 36 2.2 Cyclische Alkane Cyclohexan mit einem Substituenten: 3D: Equatoriale Position 3D-Bild: Axiale Position Ein Substituent R passt besser in equatoriale Position Je größer der Substituent R, umso eher günstiger um: DG0 = – R • T• ln K R = CH3: 7.1 kJ/mol (95 : 5) R = tert-Butyl: 18.9 kJ/mol (99.9 : 0.1) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 37 2.2 Cyclische Alkane Cyclohexan mit zwei benachbarten Substituenten: H "oben" "unten" H H HH trans: auf der entgegen gesetzten „Ringseite“ H H H H H H cis: auf der gleichen „Ringseite“ H Modell X = Y = CH3 : DG0 = 8.4 kJ/mol Modell X = Y = CH3 : DG0 = 0 kJ/mol Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 38 2.2 Cyclische Alkane Steroide (Grundgerüst): Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 39 2.2 Cyclische Alkane Wir zeichnen einen Sessel: • äquatoriale Bindungen • axiale Bindungen • benachbarte axiale Bindungen sind anti • benachbarte äquatoriale Bindungen sind gauche © P. Bruice, Organische Chemie, Pearson Studium 2007 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 40 Molekülbaukästen „Organische Chemie“ Basis-Set: 19,90 Erweiterungsset: 42,90 Pearson Studium: 35,00 Chem Draw Ultra 2013 (13.0) + ältere Versionen ChemDraw: Zeichnen chemischer Strukturen Chem3D: 3D-Darstellung und Optimierung http://www.cambridgesoft.com/ Campus-Lizenz erlaubt jedem Besitzer einer E-Mail-Adresse mit Endung @mx.uni-saarland.de bzw. @stud.uni-saarland.de den Download der Software und den Bezug einer Serien-Nummer, die jeweils die Installation auf 3 Rechnern (auch Laptops, Privatrechner usw.) ermöglicht. Serien-Nummer und die Installationsdatei über folgenden Link: http://scistore.cambridgesoft.com/sitelicense.cfm?sid=1170 mit seiner E-mail-Adresse einloggen die benötigten Daten werden zugeschickt Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 41 2.3 Eigenschaften und Reaktionen der Alkane • unpolar (Elektronegativität: H: 2.2 • C1 - C4 gasförmig, C5 - C20 flüssig, > C20 fest • • • • • • C: 2.6) > C1000 : Kunststoff („Polyethylen“) leichter als Wasser nicht mit Wasser mischbar: hydrophob mit unpolaren Substanzen mischbar: lipophil (relativ) reaktionsträge, „Paraffine“ brennbar: Oxidation mit Luftsauerstoff: CH4 + 2 O2 2 C8H18 + 25 O2 Benzinbrand CO2 + 2 H2O + 820 kJ/mol 16 CO2 + 18 H2O + Wärmeenergie Wachsbrand Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 42 2.3 Eigenschaften und Reaktionen der Alkane Reaktionen organischer Verbindungen: Typisierung nach Spaltung von Bindungen Elektronegativität: H 2.2 Bindungsenergien: • C-H : 413 kJ/mol • C-C : 369 kJ/mol C 2.6 homolytische Bindungsspaltung hoher Energieaufwand Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 43 2.3 Eigenschaften und Reaktionen der Alkane Radikale: • Atome oder Moleküle mit einem (oder mehreren) ungepaarten Elektronen • Bildung durch Homolyse • Energiezufuhr durch Wärme, Licht, energiereiche Strahlung, … • instabil (da kein Elektronenoktett), (meist) sehr reaktiv und kurzlebig Cl Cl 2 H H C H Cl H H H C H H Radikale reagieren: • mit einer weiteren kovalenten Bindung unter Homolyse • mit einem weiteren Radikal unter „Kombination“ • mit einem „Radikalfänger“ zu einem stabileren Radikal Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 44 2.3 Eigenschaften und Reaktionen der Alkane Die radikalische Substitution an Alkanen: SR Mechanismus der Chlorierung von Methan: Radikalkettenreaktion langsamer Schritt: „geschwindigkeitsbestimmend“ Bruttoreaktion: CH4 + Cl2 Energiebilanz: CH3Cl + HCl -87 kJ/mol Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 45 2.3 Eigenschaften und Reaktionen der Alkane Merke 1: Stabilität und Reaktivität • Radikale sind (i.d.R.) sehr reaktiv, abhängig von Energie zur Bindungsspaltung • Auch Kohlenstoff-Radikale sind unterschiedlich stabil/reaktiv: Stabilität von Alkylradikalen: •„Elektronenmangel“ kann abgeschwächt oder verstärkt werden • durch „elektronenschiebende (+)“ oder „elektronenziehende (-)“ Gruppen • induktive Effekte über s-Bindungen (vgl. EN): +I oder -I • mesomere Effekte über nichtbindende Elektronenpaare oder p-Bindungen: +M oder -M Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 46 2.3 Eigenschaften und Reaktionen der Alkane Merke 2: Reaktivität und Selektivität • stabilere Radikale bilden sich leichter (geringerer Energieaufwand) • Reaktionen über stabilisierte Radikale verlaufen schneller (Aktivierungsenergie) • Energiereiche Radikale sind weniger selektiv Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 47 2.3 Eigenschaften und Reaktionen der Alkane Radikale sind toxisch - Quellen: • äußere Einwirkung (Bestrahlung u. a.), • Enzyme v. a. in der Atmungskette: Elektronenübertragung in Teilschritten: O O2 H + e- O + O O e- + O 2 H+ O Superoxid, toxisch H2O2 H + e + H+ H2O + H O Peroxid, toxisch ROS Hydroxyl-Radikal, toxisch, reaktiver als Fluor Wirkung: Radikale, Reaktive Sauerstoff-Species (ROS) + : Entzündungsabwehr - : „Oxidativer Stress“: Mutationen (DNA), Gewebsschädigung („Alterung“),… „Bekämpfung“: • Enzymatische Zersetzung • Radikalfänger (Vitamin C, Vitamin E,…) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 48 2.3 Eigenschaften und Reaktionen der Alkane Sauerstoff und „Autoxidation“ Spezialfall: Sauerstoff als „Diradikal“ O O O O gezielt: „Abbau“ von Fetten z. B. durch Lipoxygenasen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 49 Zusammenfassung: Alkane Alkane: homologe Reihe Konstitutionsisomere (Nomenklatur) Konformationen und Konformere Cycloalkane am Beispiel Cyclohexan: Sessel-Konformer, axial und equatorial, cis und trans Steroide unpolar, brennbar und reaktionsträge Radikalische Substitution, Kettenreaktion Radikale Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 50 2.4 Halogenalkane Gesundheitsschädlich: • Luftgrenzwert = höchstzulässige Konzentration als Gas/Dampf/Schwebestoff, die bei langfristiger Exposition 8 h/d 40h/Woche die Gesundheit nicht beeinträchtigt [ml/m3=ppm] • LD50 = letale Dosis (Dosis bei der 50% der Versuchstiere verenden) [g/kg] Name Luft LD50 oral Dichlormethan 100 ppm 1.6 g/kg Chloroform 0.5 ppm 0.9 g/kg Tetrachlormethan 10 ppm 1.7 g/kg Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 51 2.4 Halogenalkane • Lösemittel: • Kühl- und Kältemittel • Vereisungsmittel • Inhalationsnarkotika • Insektizide Gefährdung der Ozonschicht: Fluorchlorkohlenwasserstoffe (FCKW) Cl + O3 ClO + O3 ClO Cl + + O2 2 O2 „Umweltgifte“: ? Zeek, S. 191: „Halogenierte Kohlenwasserstoffe kommen in der Natur nicht vor.“ ? ! 4500 halogehaltige Naturstoffe ! Chlormethan: ~ 5 Mio t/a: holzzerstörende Pilze, Algen, Plankton, Vulkane, Buschfeuer... ~ 26000 t/a: andropogen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 52 2.4 Halogenalkane Chemische Reaktivität der Halogenalkane: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 53 Übungen: Versuche im Praktikum: 3.1, 3.6 Die nebenstehende Anordnung (Newman-Projektion) des n-Butans heißt: A gauche Konformation B syn Konformation Photohalogenierung und Autoxidation von Alkanen verlaufen A unter Heterolyse von kovalenten Bindungen B nach einem radikalischen Prozess. Die folgende Verbindung hat den IUPAC-Namen A 4-Brom-3-chlor-5-ethyloctan B 3-Propyl-4-brom-5-chlorheptan Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 54 Übungen: Welche der folgenden Verbindungen sind identisch ? Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 55 3. 3.1 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Struktur und Eigenschaften sp2-Hybridisierung: „trigonal planar“ © P. Bruice, Organische Chemie, Pearson Studium 2007 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 56 3. 3.1 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Struktur und Eigenschaften Alkene: C=C - Doppelbindung: 1 s-Bindung, 1 p-Bindung alle Bindungswinkel ~120° Doppelbindung: 133 pm keine Unterscheidung zwischen s- und p-Bindung Drehung „nicht möglich“ bei 293 K: k = 5,7x10-37 s-1 keine Konformere bei 1273 K: k = 138 s-1 E © P. Bruice, Organische Chemie, Pearson Studium 2007 275 kJ/mol Rotationswinkel Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 57 3. 3.1 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Struktur und Eigenschaften Nomenklatur der Alkene acyclische Alkene mit 1 Doppelbindung: homologe Reihe: CnH2n H2C CH 2 H2C Ethen (Ethylen) CH CH 3 H2C CH CH 2 CH 3 2-Hexen CH3 CH CH3 2-Buten CH3 CH CH2 CH2 HC 1-Buten Propen (Propylen) "Phytohormon" H3C HC H3C H3C HC 1 2 C 3 CH3 CH2 CH CH3 4 5 6 3,5-Dimethyl-2-hexen cyclische Alkene mit 1 Doppelbindung: homologe Reihe: CnH2n-2 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 58 3. 3.1 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Struktur und Eigenschaften Stereoisomerie: geometrische Isomere (cis-/trans-Isomere) • räumliche Anordnung von Substituenten an einer Doppelbindung • 1,2-disubstituiere Verbindungen: cis/trans-Isomerie • cis: • trans: trans-Form in der Regel etwas energieärmer (s.u.) unterschiedliche chemische und physikalische Eigenschaften: (Modelle) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 59 3. 3.1 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Struktur und Eigenschaften Nomenklatur bei höher substituierte Alkenen: An beiden sp2-C-Atomen den Substituenten mit höchster Priorität bestimmen (Ordnungszahl !!) Liegen diese Substituenten an der Doppelbindung: entgegen gesetzt E zusammen Z • cis = • zusammen = Z OZ: Br: 35; Cl: 17 2 1 • trans = • entgegengesetzt = E Cl Cl H Br 1 2 E Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 1 1 Cl Br H Cl 2 2 Z 60 3.2 Reaktionen Reaktionen von Alkenen Bindungsenergien: C-C 369 kJ/mol C=C 683 kJ/mol = 369 + 314 kJ/mol Alkene sind ungesättigt Additionsreaktionen + X C X C sp2 sp2 C C X X sp3 sp3 + X Y C C X Y Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 61 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Typen von Additionsreaktionen an Alkene: Alken Reagenz „Katalysator“ Produkt (Metall) C C + H H C C H H Substanzklasse Reaktionstyp Alkan Hydrierung 1,2-Dihalogenalkan Halogenierung Halogenalkan Hydrohalogenierung Br C C + Br C Br C Br C C + H C X C X C OH Alkohol H [H +] C C + H OH C Hydratisierung H Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 62 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Wie laufen diese Reaktionen ab ? Doppelbindung = s-Bindung + p-Bindung hohe Elektronendichte ein elektrophiles Teilchen „greift an“ Elektrophile Addition Hydrierung beide H simultan von derselben Seite cis-Addition (formal ist ein „H-Atom“ das Elektrophil) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 63 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Die „Stereoselektivität“ kann nachgewiesen werden: Hydrierungen verlaufen exotherm, aber mit Aktivierungsenergie: Katalysator ! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 64 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Halogenierung Nucleophil C C C Br Elektrophil Br p-Komplex Br C Br Br C C Br (s-Komplex) Bromonium-Ion Elektrophil: „Br+“ zweistufig, Rückseitenangriff an fixierte „Zwischenstufe“ trans-Addition Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 65 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Beweis für „Stereoselektivität“: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 66 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Hydrohalogenierung und Hydratisierung H+ als Elektrophil zweistufig, nicht fixierte Zwischenstufe Addition nicht „stereoselektiv“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 67 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen aber: Alkylgruppen zeigen +I-Effekt: Carbenium-Ion hat „Elektronendefizit“ • Stabilisierung durch „elektronenschiebende ()“ Gruppen • induktive Effekte (+I) [oder mesomere Effekte (+M)] • Stabilität: tertiär > sekundär > primär Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 68 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Die Reaktion verläuft (bei unsymmetrischen Alkenen) regioselektiv !! Markovnikov-Regel: „Die Addition erfolgt über das stabilere Carbenium-Ion im ersten Schritt.“ M-ORA 329: Elektrophile Addition (Hydratisierung) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 69 3. 3.2 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Reaktionen Wie gewinnt man Alkene ? Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 70 Zusammenfassung: Alkene mindestens eine C=C –Doppelbindung, planare Geometrie s-Bindung + p-Bindung keine Rotation cis- und trans-Isomere „ungesättigt“ Additionsreaktionen elektrophile Addition: selektive Reaktionen Umkehrreaktion: Eliminierung Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 71 3.3 Polyene und Polymerisation Diene und Polyene Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 72 3. 3.3 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Polyene und Polymerisation Warum ist b-Carotin farbig? MO-Theorie: Bei der kovalenten chemischen Bindung werden… …Atomorbitale kombiniert zu Molekülorbitalen! nur für p-Orbitale © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 73 3. 3.3 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Polyene und Polymerisation DE h h Molekül H2C CH2 b-Carotin c [nm] „Absorbierte Farbe“ Beobachtete Farbe 165 UV „farblos“ 217 UV „farblos“ 334 UV „farblos“ 455 „blau“ rot-orange Chromophore („farbgebende“) Gruppen in farbigen Verbindungen enthalten p-Bindungen: C=C, C=O, N=O, N=N,… Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 74 3. 3.3 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Polyene und Polymerisation Die Chemie des Sehvorgangs Protein Rhodopsin (rötlicher Farbstoff, „Sehpurpur“) – Seitenkette 11-cis-Retinal Lichtquant auf 11-cis-Retinal Isomerisierung innerhalb 1/1000 s zu 11-trans-Retinal Protein zerfällt in 11-trans-Retinal und Apoprotein „Opsin“ elektrischer Impuls an die Nervenzellen Rückreaktion in Rhodopsin durch Retinal-Isomerase (langsam, bis ½ h) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 75 3. 3.3 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Polyene und Polymerisation Polymerisation von Alkenen Elektrophile (kationische) Polymerisation: H E H H H H H E H H E „substituierte“ Polyethylene: F F F F F F Polytetrafluorethen = TEFLON F n F F F F F F F Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 76 3. 3.3 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Polyene und Polymerisation Anwendungen: Verpackungen Haushaltsartikel Textilindustrie Automobilbau Baustoffe Unterhaltungstechnik Medizintechnik …. http://www.teli.de/jdc/mdm-ca.html Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 77 Adhäsive Füllungstherapie Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 78 3. 3.3 Ungesättigte Kohlenwasserstoffe: Alkene („Olefine“) Polyene und Polymerisation Naturstoffe durch Polymerisation: Terpene Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 79 Zusammenfassung: Alkene mindestens eine C=C –Doppelbindung, planare Geometrie s-Bindung + p-Bindung keine Rotation cis- und trans-Isomere „ungesättigt“ Additionsreaktionen elektrophile Addition: selektive Reaktionen Umkehrreaktion: Eliminierung Diene und Polyene: kumulierte, konjugierte, isolierte Doppelbindungen Farbigkeit (Chromophore) Physiologie des Sehens Polymerisation von Alkenen Kunststoffe (Werkstoffe) Natürliche Polyene: Terpene Bromierung von Ketchup Lycopen(in) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 80 Übungen: Versuche im Praktikum: 3.2, 3.7, 4.6 Durch katalytische Hydrierung von 1,2-Dimethylcyclohexen entsteht A Verbindung X B Verbindung Y Bei der säurekatalysierten Addition von Wasser an Isobuten (1) entsteht A Verbindung 3 B Verbindung 2 Bei welcher Substanz handelt es sich um ein Polyen? A b-Carotin B Polyethylen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 81 4. 4.1 Aromaten und Alkine Benzol, Aromatizität und „Aromaten“ „Aromatische Verbindungen“ „Benzol“: Entdeckung: Faraday, 1825 Summenformel C6H6: Mitscherlich, 1834 Struktur: Kekulé, 1865 Bindungstheorie: Hückel, 1931 (Hückel-Regel) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 82 4. 4.1 Aromaten und Alkine Benzol, Aromatizität und „Aromaten“ Bindungstheorie: © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 Dieses „Bindungssystem“ ist im Falle von Benzol besonders stabil !? Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 83 4. 4.1 Aromaten und Alkine Benzol, Aromatizität und „Aromaten“ Hückel-Regel: Cyclisch konjugierte planare Systeme mit (4n + 2) p-Elektronen sind stabilisiert Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 84 4. 4.1 Aromaten und Alkine Benzol, Aromatizität und „Aromaten“ Hückel-Regel: Cyclisch konjugierte planare Systeme mit (4n+2)p-Elektronen sind stabilisiert Beweis: Hydrierungsenergien (theoretisch-experimentell): © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 Stabilisierungsenergie = Resonanzenergie = Mesomerie-Energie: ~ 150 kJ/mol Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 85 4. 4.1 Aromaten und Alkine Benzol, Aromatizität und „Aromaten“ Mesomerie, Delokalisierung: Die Elektronenverteilung in einem Molekül kann nicht mit einer, sondern nur durch mehrere (konventionelle) Strukturformeln beschrieben werden. Der „wahre“ Bindungszustand liegt zwischen diesen mesomeren Grenzformeln. oder Einfachbindung: 154 pm Doppelbindung: 133 pm 139 pm Benzen • cyclisch, konjugiert, planar, 4n+2 • alle C-C und alle C-H-Bindungen gleich(wertig) • stabilisiert • keine Additionsreaktionen, sondern Substitutionsreaktionen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 86 4. 4.1 Aromaten und Alkine Benzol, Aromatizität und „Aromaten“ Homologe des Benzols: PAK: Polycyclische Aromatische Kohlenwasserstoffe Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 87 4. 4.1 Aromaten und Alkine Benzol, Aromatizität und „Aromaten“ Nomenklatur: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 88 außerplanmäßig: Zusammenfassung: Diene, Polyene, Polymerisation Diene und Polyene: kumulierte, konjugierte, isolierte Doppelbindungen Farbigkeit (Chromophore) Physiologie des Sehens Polymerisation von Alkenen Kunststoffe (Werkstoffe) Natürliche Polyene: Terpene Zusammenfassung: Aromaten Aromaten: konjugierte Alkene mit spezieller Elektronenverteilung (Delokalisieung)und Bindungsverhältnissen Hückel-Regel und Mesomeriestabilisierung: Cyclisch konjugierte planare Systeme mit (4n + 2) p-Elektronen sind stabilisiert (~150 kJ/mol) „Benzol“ (Benzen) als wichtigster Vertreter Homologe des Benzols ortho-, meta-, para-Substitution Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie Benzen 89 4.2 Elektrophile Substitution an Aromaten Elektrophile Substitution elektronenreiches p-System Erhalt der Mesomerie-Energie Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 90 4. 4.2 Aromaten und Alkine Elektrophile Substitution am Aromaten Der s-Komplex: • mesomeriestabilisiert (Grenzformeln) • nicht aromatisch • positive (Partial-)Ladung ortho und para zum neuen Substituenten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 91 4. 4.2 Aromaten und Alkine Elektrophile Substitution am Aromaten Beispiele für elektrophile Substitutionen an Aromaten (SEAr) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 92 4. 4.2 Aromaten und Alkine Elektrophile Substitution am Aromaten Reaktionen von Cyclohexen und Benzol Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 93 4. 4.2 Aromaten und Alkine Elektrophile Substitution am Aromaten Die Zweitsubstitution an Aromaten: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 94 4. 4.2 Aromaten und Alkine Elektrophile Substitution am Aromaten Erstsubstituent „schiebt“ Elektronen (+ I, +M-Effekt) Zweitsubstituent in ortho und para günstig Erstsubstituent „zieht“ Elektronen (-I, -M) Zweitsubstituent in ortho und para ungünstig in meta noch günstig induktive Effekte über s-Bindungen (vgl. EN): +I oder -I mesomere Effekte über nichtbindende Elektronenpaare oder p-Bindungen: +M oder -M Außerdem: Substituenten 1. Ordnung beschleunigen die Reaktion, Substituenten 2. Ordnung verlangsamen die Reaktion M-ORA 588: Elektrophile Substitution am Aromaten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 95 4. Aromaten und Alkine Naturstoffe mit Benzen als Baustein: Pharmazeutische Wirkstoffe: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 96 Zusammenfassung: Aromaten Aromaten: konjugierte Alkene mit spezieller Elektronenverteilung (Delokalisieung)und Bindungsverhältnissen Hückel-Regel und Mesomeriestabilisierung „Benzol“ (Benzen) als wichtigster Vertreter Elektrophile Substitution (statt Addition) s-Komplex bestimmt Reaktivität und Zweitsubstitution wichtiges Bauelement in Naturstoffen und Wirkstoffen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 97 Übungen: Versuche im Praktikum: 3.3 Die beiden folgenden Strukturen… A B sind identisch. sind Konstitutionsisomere. In welcher Verbindung sind C-Atome unterschiedlicher Hybridisierung enthalten? A B Verbindung A Verbindung B Die Nitrierung von Benzol mit Nitriersäure (HNO3/H2SO4) ergibt: A B Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 98 4.3 Alkine Alkine (Acetylene): homologe Reihe: CnH2n-2 sp-Hybridisierung: 2s + 2px verbleiben: zwei sp-Orbitale 2py + 2pz Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 99 4. 4.3 Aromaten und Alkine Alkine sp © P. Bruice, Organische Chemie, Pearson Studium 2007 Alkine: Eine s-Bindung zwischen zwei C durch Überlappung von 2 sp, 2 p-Bindungen durch Überlappung der verbleibenden 2+2 p-Orbitale 180° H C C H Alkin-Einheit: linear, rotationssymmetrisch, Bindungslänge: 120 pm Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 100 4. 4.3 Aromaten und Alkine Alkine • Ethin, Acetylen: Pharmazeutische Wirkstoffe: H3C OH C C H H3C C C H H H H OH H H H H 3CO O "Norethynodrel" "Mestranol" (Contraceptiva) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 101 5. Alkohole, Phenole, Ether, Schwefelverbindungen C6H12O6 2 C2H5OH + 2 CO2 / -100 kJ/mol Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 102 5. Alkohole, Phenole, Ether, Schwefelverbindungen 5.1 Alkohole („Alkanole“) und Phenole Funktionelle Gruppe: -OH „Hydroxy- oder Hydroxyl-Gruppe“ Typen: Einwertige / mehrwertige Alkohole Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 103 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Typen: Stellungsisomere: R CH2 OH primäre Alkohole OH am primären C-Atom sekundäre Alkohole OH am sekundären C-Atom tertiäre Alkohole OH am tertiären C-Atom R CH OH R R R C OH R sek. H3C CH CH3 prim. H3C CH2 CH2 OH 1-Propanol, 2-Propanol, Isopropanol, Isopropylalkohol Sdp. 97° Sdp. 82° prim. H3C H2C CH2 OH CH2 OH H3C sek. H2C CH CH3 OH CH3 H3C prim. CH CH2 OH CH3 tert. H3C C CH3 OH n-Butanol, 1-Butanol sek-Butanol, 2-Butanol iso-Butanol 2-Methyl-1-propanol tert-Butanol 2-Methyl-2-propanol Sdp. 118° Sdp. 99° Sdp. 108° Sdp. 83° Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 104 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Systematische Nomenklatur (IUPAC-Nomenklatur): a) längste Kette, die die OH-Gruppe trägt, gibt Bezeichnung b) OH-tragendes C-Atom erhält die kleinstmögliche Ziffer c) weitere Ziffern erhalten die Substituenten, die an der Grundstruktur sitzen. Beispiel: 3-Benzyl-3-methylpentan-2-ol Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 105 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Phenole: Hydroxygruppe direkt am aromatischen System Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 106 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Physikalische Eigenschaften Siedepunkt: Methan: -161°C, Methanol: +64°C Ethan: -89°C, Ethanol: +78°C n-Pentan Diethylether O Cl 1-Chlorpropan MG Dipolmoment [D] Sdp. (°C) 72 0 +36 74 1.18 +35 79 2.10 +47 72 2.72 +76 74 1.63 +118 (!) 74 1.68 +141 (!) H Butanal C O n-Butanol OH OH Propansäure C O Toluol CH3 92 +111 Phenol OH 94 +182 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 107 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Alkohole… • haben hohe Siedepunkte • sind bis C4 beliebig mit Wasser mischbar (hydrophil) • sind schwache Basen • sind sehr schwache Säuren • sind Nucleophile (am Sauerstoff) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 108 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Säure-Base Eigenschaften von Alkoholen / Phenolen Phenole sind stärkere Säuren, Alkohole sind stärkere Basen ! Phenolat-Ionen sind (mesomerie-)stabilisiert: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 109 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Phenole sind im basischen löslich: Phenole sind aktivierte Aromaten: • schnelle SEAr-Reaktion • dirigierend in ortho- und para-Position • OH-Gruppe ist Substituent 1. Ordnung Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 110 5. 5.1 Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole („Alkanole“) und Phenole Methanol: • Vergiftung bei geringen Dosen • Ursache: Giftwirkung der Oxidationsprodukte Formaldehyd und Ameisensäure • akute Therapie: Gabe von Ethanol Ethanol: • letale Dosis im Blut: 4 ‰ (4 mg/ml) • Oxidation zu Acetaldehyd und Essigsäure • Abusus: > 60 g/Tag • als Desinfektionsmittel (alternativ: Isopropanol) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 111 Zusammenfassung: Alkohole und Phenole Funktionelle Gruppe: -OH wichtige Vertreter: Methanol, Ethanol, Phenol einwertige und mehrwertige polar, Wasserstoff-Brückenbindungen schwache Basen, schwache Säuren Phenole sind stärkere Säuren und aktivierte Aromaten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 112 5. Alkohole, Phenole, Ether, Schwefelverbindungen 5.2 Ether Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 113 5. 5.2 Alkohole, Phenole, Ether, Schwefelverbindungen Ether • charakteristisch riechende Flüssigkeiten • niedrige Siedepunkte • • • • ausgezeichnete Lösungsmittel und Extraktionsmittel leichter als Wasser und mit Wasser nicht mischbar keine H-Brücken (nur H-Brücken-Akzeptoren) schwache Basen Löslichkeit in starken wässrigen Säuren (z.B. konz. HCl) Formel n-Pentan M Sdp. 72 36°C R R n-Butanol 74 118°C Diethylether 74 35°C H O H H O O O H H H H R O + HCl R' R O R' + Cl- (Dialkyl)oxonium-Ion Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 114 5. 5.2 Alkohole, Phenole, Ether, Schwefelverbindungen Ether Diethylether („Äther“) als Inhalationsnarkotikum: • ab 4 Vol% in der Atemluft + Überdosierung unproblematisch - Explosionsgefahr, postnarkotisches Erbrechen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 115 5. 5.2 Alkohole, Phenole, Ether, Schwefelverbindungen Ether Oxirane (Epoxide): durch Ringspannung sehr reaktiv Ringöffnung H Nucleophil H H O O O H+ - OH katalytisch OH H OH OH H+ OH trans-1,2-Diol "DNA" "DNA" H2N H+ NH O HO Oxygenase HO Benzpyren HO OH Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie OH 116 5. Alkohole, Phenole, Ether, Schwefelverbindungen 5.3 Darstellung von Alkoholen und Ethern Chemische Reaktivität der Halogenalkane: Nucleophile Substitution: SN Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 117 5. 5.3 Alkohole, Phenole, Ether, Schwefelverbindungen Darstellung von Alkoholen und Ethern Ethanol: C6H12O6 2 C2H5OH + 2 CO2 / -100 kJ/mol http://www.augsburg.brauhaus1516.de/grafiken/brauereirundgang.swf Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 118 Übungen: Alkohole, Ether: Praktikum Versuch 3.5 Welche Aussage zu den nebenstehenden Substanzen trifft zu? A 1 ist in jedem Verhältnis mit Wasser mischbar B 2 hat einen höheren Siedepunkt als 1 Welche Aussage trifft zu? Glycerin ist ein A tertiärer Alkohol B dreiwertiger Alkohol Nebenstehende Verbindung A ist ein Phenol B heißt Benzylalkohol Nebenstehende Verbindung ist ein A sekundärer Alkohol B cyclischer Ether Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 119 5.4 Organische Schwefelverbindungen • intensiv im Geruch! • gänzlich anderes Oxidationsverhalten als Sauerstoffverbindungen! Thiole: • schwächere Wasserstoffbrückenbindungen als Alkohole • acider als Alkohole • Oxidation zu „Disulfiden“ Thioether: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 120 5.4 Organische Schwefelverbindungen Thiole und Disulfide: © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 121 5.4 Organische Schwefelverbindungen Thioether: • als Nucleophil: Bildung von „Sulfoniumsalzen“: übertragen selbst wiederum Methylgruppen: „aktives Methyl“ Beispiel: Aminosäure Methionin Welche Aussage zu Thiolen trifft zu? A Thiole können zu Disulfiden oxidiert werden. B Thiole sind schwefelanaloge Ether. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 122 Zusammenfassung: Alkohole, Phenole, Ether, Schwefelverbindungen Alkohole, Phenole: FG: -OH; wichtige Vertreter: Methanol, Ethanol, Phenol einwertige und mehrwertige polar, Wasserstoff-Brückenbindungen schwache Basen, schwache Säuren, Phenole stärker sauer Darstellung von Alkoholen: Hydratisierung von Alkenen, Nucleophile Substitution, Gärung Ether: unpolar, stärker basisch als Alkohole Inhalationsnarkotika cyclische Epoxide Darstellung: Nucleophile Substitution Schwefelverbindungen: Thiole, Thioether Oxidation zu Disulfiden, Sulfoxiden,… „Aktives Methyl“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 123 6. Amine – Einfache Organische Stickstoffverbindungen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 124 6. Amine – Einfache Organische Stickstoffverbindungen Alkaloide: • vorwiegend in Pflanzen vorkommende „basische“ Naturstoffe mit einem oder mehreren, meist „cyclisch“ eingebauten Stickstoff-Atomen im Molekül • häufig ausgeprägte pharmakologishe Wirkung • N-Atome entstammen biosynthetisch überwiegend Aminosäuren. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 125 6. Amine – Einfache Organische Stickstoffverbindungen Amine sind (schwache) Basen: R R NH2 H N R NH3 X Ammoniumsalze + HX R R3N Amin R2NH 2 X + OH - HX (analog NH4 R3NH X ) (Versuch 3.4) pKB NH3 4.79 3.36 3.29 Aliphatische Amine sind stärker basisch als NH3 ( +I - Effekt) 4.26 Anilin 9.42 Dipenylamin 13.1 Aromatische Amine sind schwächer basisch als NH3 (–I/–M - Effekt) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 126 6. Amine – Einfache Organische Stickstoffverbindungen Amine sind Nucleophile: Nucleophile Substitution: SN Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 127 6. Amine – Einfache Organische Stickstoffverbindungen Amine: Reaktion mit Nitrosyl-Kationen: NaNO2 + HCl - HCl + H+ [HNO2] NO+ + H2O Nitrosyl-Kation N H N O N N O - H N H+ Cl + NO+ CH2 NH 2 primäres Amin Nucleophil O Nitrosamin sekundäres Amin Nucleophil H 3C N -H + H 3C CH2 H N + N O H+ - H 2O H3C Diazotierung CH2 N N Diazoniumsalz Substitution Cl(oder H 2O) RT "Desaminierung" (Versuch 3.4) H3C CH 2 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie Cl + N2 128 Zusammenfassung: Amine abgeleitet von Ammoniak primäre, sekundäre, tertiäre basisch nucleophil medizinisch sehr bedeutsam Übungen: Piperidin (siehe rechts) ist ein A primäres Amin B sekundäres Amin Welche Aussage zu nebenstehender Verbindung trifft zu ? A Behandlung mit Nitrit/Schwefelsäure führt zu Stickstoffentwicklung (Desaminierung). B Es handelt sich um ein tertiäres Amin. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 129 7. Nucleophile Substitution (SN), Reaktionskinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 130 7. Nucleophile Substitution (SN), Reaktionskinetik gute Nucleophile „Nu“ mindestens: nicht bindendes Elektronenpaar gut: negative Ladung SHIOHNH3 H2O Reaktivität = Nucleophilie Polarisierbarkeit Basizität Nu Nu gute Abgangsgruppen X: schwach basisch I-, Br- , Cl- , OH2 Merke: Anionen starker Säuren ! schlechte Abgangsgruppen X: NH3 , OH- , NH2- , HProf. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 131 7. Nucleophile Substitution (SN), Reaktionskinetik Substratstruktur ? zwei Mechanismen der nucleophilen Substitution ! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 132 7. Nucleophile Substitution (SN), Reaktionskinetik “Bimolekulare” nucleophile Substitution: SN2 SN2 – Reaktion: Nu R3C-X ORA 216: Nucleophile Substitution (SN2 ) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 133 7. Nucleophile Substitution (SN), Reaktionskinetik “Monomolekulare” nucleophile Substitution: SN1 SN1 – Reaktion: R3C-X ORA 237: Nucleophile Substitution (SN1 ) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 134 Übungen: Durch welche Reaktion kann ein Alkohol hergestellt werden? A Umsetzung (nucleophile Substitution) eines Alkoholats mit einem Halogenalkan. B Umsetzung (nucleophile Substitution) von Hydroxid mit einem Halogenalkan. Iodmethan wird in Wasser zu Methanol hydrolysiert. Setzt man Natronlauge zu, wird die Reaktion A schneller. B langsamer. tert-Butylbromid reagiert in SN-Reaktionen bevorzugt nach A SN2 -Mechanismus B SN1 -Mechanismus Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 135 8. Heterocyclen • Heteroatom(e) im Ring (N, O, S, …) • gesättigt oder aromatisch (Hetarene) • Fünf- und Sechsringe, einzeln oder „kondensiert“ • wichtig: N-Heterocyclen: Ersatz von =CH- gegen =NSechsring, aromatisch (6p): Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 136 8. Heterocyclen Fünfring, aromatisch (6p): Fünfring, nicht aromatisch: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 137 8. Heterocyclen „Sechsring“ kondensiert, aromatisch (10p): Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 138 8. Heterocyclen Fünfring, kondensiert, aromatisch (10p): Übung: Nicotin (nebenstehend) setzt sich zusammen aus einem A aromatischen 5-Ring- und 6-Ring-Heterocyclus B 6-Ring-Heterocyclus und einem tertiären Amin Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 139 9. Carbonylverbindungen: Aldehyde, Ketone, Chinone Übersicht: Carbonylverbindungen: (1) (2) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 140 9. Carbonylverbindungen: Aldehyde, Ketone, Chinone 9.1 Aldehyde und Ketone: Herstellung und Nomenklatur (Versuch 3.6) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 141 9. 9.1 Carbonylverbindungen: Aldehyde, Ketone, Chinone Aldehyde und Ketone: Herstellung und Nomenklatur Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 142 9. 9.1 Carbonylverbindungen: Aldehyde, Ketone, Chinone Aldehyde und Ketone: Herstellung und Nomenklatur Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 143 9.2 Struktur, Eigenschaften, Reaktivität Formel Sdp. Propan -44°C Propanal 49°C Propanon (Aceton) 56°C 2-Propanol 82°C Propansäure 141°C Formaldehyd: gasförmig, wasserlöslich Acetaldehyd: leicht flüchtig, wasserlöslich Aceton: wassermischbar, gutes Lösemittel Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 144 9. 9.2 Carbonylverbindungen: Aldehyde, Ketone, Chinone Struktur, Eigenschaften, Reaktivität Keto-Enol-Tautomerie und a-C-H-Acidität Aceton, einfache Ketone: • >98 % Ketoform, <2% Enolform • pKS ~ 18-20 Tautomerie: Strukturisomere stehen im chemischen Gleichgewicht Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 145 9.3 Reaktionen von Aldehyden und Ketonen Addition von Wasser … Nucleophile Addition: AN Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 146 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen … und Alkoholen Nucleophile Addition: AN (Halb)Acetale sind keine Ether !! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 147 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen Reaktion mit Aminen Nucleophile Addition: AN Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 148 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen Wh. (Kap. 3.3): Chemie des Sehvorgangs : Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 149 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen „Transaminierung“ über Azomethine: • Enzyme: Aminotransferasen (älter: Transaminasen) • Flexible Umwandlung von Aminosäuren in Ketocarbonsäuren Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 150 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen Reduktion und Oxidation von Aldehyden und Ketonen (Versuch 3.6) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 151 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen „Reduktionsmittel“: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 152 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen Die Aldolreaktion (Praktikum: Versuch 4.1) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 153 9. 9.3 Carbonylverbindungen: Aldehyde, Ketone, Chinone Reaktionen von Aldehyden und Ketonen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 154 9.4 Chinone Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 155 9. 9.4 Carbonylverbindungen: Aldehyde, Ketone, Chinone Chinone Redoxpaar Chinon/Hydrochinon Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 156 Zusammenfassung: Aldehyde, Ketone, Chinone Aldehyde, Ketone: Funktionelle Gruppe: C=O Wichtige Vertreter: Formaldehyd, Acetaldehyd, Benzaldehyd Keto-Enol-Tautomerie a-C-H-Acidität Nucleophile Addition (AN) Hydrate, Halbacetale, Acetale Imine (Azomethine, Schiffsche Basen) Aldolkondensation Reduktion und Oxidation Chinone Konjugierte C=C und C=O-Doppelbindungen Redoxsystem Chinon/Hydrochinon Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 157 Übungen: Welche Aussage zu Formaldehyd trifft zu ? A Formaldehyd ist der einfachste Aldehyd mit der Formel CH3–CHO B Formaldehyd ist bei Raumtemperatur gasförmig, seine wässrige Lösung (ca. 37%) heißt Formalin. Nebenstehenden Verbindungstyp ist ein A Acetal B Halbacetal Welche Struktureinheit spielt eine Rolle bei der Transaminierung mit Pyridoxalphosphat (Vitamin B6)? A ein Imin A B ein Hydrazon B Welche der nebenstehenden Verbindungen ist ein Chinon? A Verbindung A ("Hydrochinon") B Verbindung B (in Vitamin K) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 158 10. Carbonsäuren und Carbonsäurederivate O C O H Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 159 10. Carbonsäuren und Carbonsäurederivate 10.1 Carbonsäuren: Struktur und Eigenschaften • Schmelz- und Siedepunkte noch höher als bei Alkoholen • stark assoziiert über H-Brücken O H O C • in Lösung und in Gasphase dimere Assoziate • C1 – C4 wasserlöslich, ab C4 schlechter bis schwerlöslich C O H O • Acidität: saure Reaktion in Wasser mit Basen Bildung wasserlöslicher Salze + R COOH + H2O R COO R COOH + NaOH R COO Na H3O + H2O Acidität von Carbonsäuren !! Acidität allgemein: Carbonsäuren > Phenole > Wasser > Alkohole pKS (5) (9) (14) (16) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 160 10. 10.1 Carbonsäuren und Carbonsäurederivate Carbonsäuren: Struktur und Eigenschaften pKS = (Praktikum: Versuch 4.2) H–COOH 3.8 CH3–COOH 4.76 CH3-CH2-COOH 4.9 F–CH2–COOH 2.58 Cl Cl– 2.81 CH 3 CH CH2 COOH Br– 2.90 I– 3.17 CH2 CH2 CH2 COOH CH3–COOH 4.76 Cl ClCH2–COOH 2.81 Cl2CH–COOH 1.29 Cl3C–COOH 0.89 CH3 CH2 CH2 COOH CH3 H2C CH COOH Cl pKS = 4.9 2.81 4.06 4.52 COOH 4.22 Reaktion von Carbonsäuren mit Magenesium Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 161 10.2 Carbonsäurederivate: Reaktivität Polarisierung der C=O-Bindung steigt Reaktivität steigt Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 162 10. 10.2 Carbonsäuren und Carbonsäurederivate Carbonsäurederivate: Reaktivität An der C=O-Gruppe: Nucleophile Substitution (SN) am sp2 C-Atom (über tetraedrische Zwischenstufe) Am Nucleophil: Acylierung, Übertragung einer Acyl-Gruppe O R C Acyl-Rest O H3C C Acetyl-Rest Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 163 10. 10.2 Carbonsäuren und Carbonsäurederivate Carbonsäurederivate: Reaktivität Carbonylreste und Carboxylatanionen O O Formyl- H C Formiat H C O O Acetyl- H 3C O Acetat C H3C C O O Propionyl- O Propionat H3C CH2 C H3C CH 2 C O O Benzoyl- C O Benzoat C O Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 164 10.3 Carbonsäurechloride ORA 949: Reaktion Säurechlorid mit Amin Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 165 10.4 Carbonsäureanydride Merke: Carbonsäurechloride (und -anhydride) sind die Acylierungsreagenzien des Chemikers Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 166 10. 10.4 Carbonsäuren und Carbonsäurederivate Carbonsäureanydride Acetylsalicylsäure (ASS) Extraktion Gerbstoffe, Farbstoffe, Wirkstoffe: Salicylsäure Weidenrinde 1897 Hoffmann Acetylsalicylsäure Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 167 10. 10.4 Carbonsäuren und Carbonsäurederivate Carbonsäureanydride Synthese von ASS (Versuch 4.4) Acetylierung unter physiologischen Bedingungen ? O H 3C C O HO C H2 H2 C CH3 N CH 3 CH3 X Cholin H3C C O [H+], - HOAc H 3C C O O C H2 H2 C CH3 N CH3 CH3 X Acetylcholin Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 168 10.5 Carbonsäureester H+ O R C H + + H+ R HO R' OH O C OH Die „saure“ Veresterung ist reversibel ! O O R' - H R H+ HOH C O R' (Versuch 4.3) Cyclische Ester: Lactone Säurekatalysierte Veresterung Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 169 10. 10.5 Carbonsäuren und Carbonsäurederivate Carbonsäureester Polyester durch „Polykondensation“: „spezielle“ Polyester: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 170 10. 10.5 Carbonsäuren und Carbonsäurederivate Carbonsäureester Die „saure“ Veresterung ist reversibel ! Die “Verseifung” von Carbonsäure-Estern Die „Verseifung“ ist irreversibel ! ORA 955: Verseifung eines Esters Wieso Verseifung ? Hier Ende des Stoffes für Teilklausur 2! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 171 Übungen: 2-Chlorpropansäure ist eine stärkere Säure als 3-Chlorpropansäure A stimmt B stimmt nicht Bei welchem Verbindungstyp handelt es sich um ein reaktiveres Carbonsäure-Derivat ? A Carbonsäurechlorid B Carbonsäureester Nebenstehende Verbindung ist ein A -Lacton B cyclischer Carbonsäureester Bei der Herstellung von Acetylsalicylsäure aus Salicylsäure A wird die Salicylsäure an der Carbonsäuregruppe verestert. B wird die phenolische Hydroxylgruppe mit Essigsäureanhydrid acetyliert. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 172 10.6 Fettsäuren, Fette (Triglyceride), Lipide „Fettsäuren“: • gerade Anzahl C (Biosynthese aus Acetat) • eine Carboxylgruppe • Doppelbindungen: 0-3 • immer isoliert • immer cis (Fixierung der räumlichen Anordnung, meist an C-2 von Glycerin) • im tierischen Organismus Biosynthese bis max. D9 essentielle Fettsäuren 1 3 Palmitinsäure COOH 4 -6 -3 9 2 b C15 H31COOH COOH Stearinsäure C17 H35COOH COOH Ölsäure (D9-cis-Octadecansäure) COOH Linolsäure (v. a. in Pflanzenölen) COOH Linolensäure (v. a. in Fischölen) a Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 173 10. 10.6 Carbonsäuren und Carbonsäurederivate Fettsäuren, Fette (Triglyceride), Lipide Triglyceride (Fette und Öle, Neutralfette) • wenig(!) Mono- und Diglyceride (Zwischenprodukte) • einfache (nur eine Fettsäuresorte) • gemischte Verseifung, Seifen, Tenside (Versuch 4.5) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 174 10. 10.6 Carbonsäuren und Carbonsäurederivate Fettsäuren, Fette (Triglyceride), Lipide Seifenwirkung: als Tenside Mizelle Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 175 10. 10.6 Carbonsäuren und Carbonsäurederivate Fettsäuren, Fette (Triglyceride), Lipide Zusammensetzung von Zahnpasta (Prof. Dr. G. Lang, Kosmetikchemie I – Teil 6) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 176 10. 10.6 Carbonsäuren und Carbonsäurederivate Fettsäuren, Fette (Triglyceride), Lipide „Fettsäuren“ als Bausteine im Stoffwechsel: • • • • • in geringen Mengen in sehr vielen Organen, Geweben und Körperflüssigkeiten Kontraktion glatter Muskulatur blutdrucksenkend Prostaglandine Hormonproduktion ….. „Lipide“ „In der Biosphäre vorkommende Verbindungen, die in Wasser nur wenig, aber in organischen Lösemitteln gut löslich sind. Sie gehören verschiedenen Verbindungsklassen an. Einziges gemeinsames Strukturmerkmal ist eine relativ große hydrophobe (lipophile) Teilstruktur.“ • • • • • • Isopren-Derivate (Terpene, Carotinoide, Steroide) langkettige Alkohole langkettige Carbonsäuren (“Fettsäuren“) Ester (Triglyceride, u. a.) Phospholipide Glycolipide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 177 10.7 Carbonsäurethioester Reaktivität steigt CH3 O H3C C + S CoA HO CH 2 CH2 N CH3 CH3 CH3 H 3C C O CH 2 CH2 N - CoA-SH O CH3 CH3 Acetylcholin Übertragung einer Acyl-(Acetyl-)gruppe auf Sauerstoff Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 178 10. 10.7 Carbonsäuren und Carbonsäurederivate Carbonsäurethioester CoenzymA Acetyl-CoA „Drehpunkt“ des Stoffwechsels CoA-SH Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 179 10. 10.7 Carbonsäuren und Carbonsäurederivate Carbonsäurethioester Übertragung einer Acyl-(Acetyl-)gruppe auf Kohlenstoff: „Chemie“: C -C-Verknüpfung O O EtO C a CH 3 Base - EtO H+ Essigsäureethylester ("Ethylacetat") C O C CH2 CH3 EtO - EtO- EtO Nucleophile Substitution (SN) am Ester O O C CH2 C CH 3 Acetessigsäureethylester „Biosynthese“: u.a. Fettsäurebiosynthese mit Acetyl-CoA Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 180 10.8 Carbonsäureamide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 181 10. 10.8 Carbonsäuren und Carbonsäurederivate Carbonsäureamide Cyclische Amide: Lactame Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 182 10.9 Carbonsäuren mit weiteren funktionellen Gruppen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 183 Übungsaufgaben O Nebenstehende Verbindung ist ein Triglycerid. H 2C O A stimmt nicht HC O B stimmt H 2C O O Alkylreste Die Tensidwirkung von Fettsäure-Anionen beruht A auf der hydrophilen Carboxylat-Funktion und der lipophilen Alkylkette B auf der lipophilen Carboxylat-Funktion und der hydrophoben Alkylkette Nebenstehende Verbindung ist ein A b-Lactam B cyclisches Carbonsäureamid O N H Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 184 Zusammenfassung: Carbonsäuren und Carbonsäurederivate Funktionelle Gruppe: -COOH Ameisensäure, Essigsäure, Benzoesäure Carbonsäuren sind sauer, Anionen: Carboxylate Carbonsäurederivate: -chloride, -anydride, -thioester, -ester, -amide Nucleophile Substitution am sp2 - C-Atom, Acyclierung saure Veresterung (reversibel); Verseifung von Estern (irreversibel) Polyester als Kunststoffe Ester des Glycerins mit Fettsäuren: Triglyceride (Lipide) Thioester zur „biochemischen“ Acylierung O-Acylierung und C-Acylierung Carbonsäureamide: z. B. Peptide cyclische Derivate: Lactone, Lactame Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 185 11. Stereochemie und Stereoselektivität Räumlicher Aufbau ↔ Funktion biochemisch relevanter Verbindungen (R)-(-)-Adrenalin Erhöht Blutdruck und Herzfrequenz H + NHMe HO HO OH (S)-(+)-Adrenalin OH HO HO Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie + NHMe H 186 11. Stereochemie und Stereoselektivität 11.1 Konstitution, Konformation, Konfiguration Isomere: gleiche Summenformel aber „andere Struktur“ Isomere Konstitutionsisomere Stereoisomere Sequenz der Atome räumlichen Anordnung „Strukturisomere“: Gerüstisomere Konformationsisomere (Konformere, Rotationsisomere) Stellungsisomere Geometrische Isomere Funktionsisomere (cis/trans-Isomere) Konfigurationsisomere Enantiomere, Diastereomere Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 187 11. 11.1 Stereochemie und Stereoselektivität Konstitution, Konformation, Konfiguration Konstitutionsisomere: Gerüstisomere unterscheiden sich im Kohlenstoffgerüst Stellungsisomere unterscheiden sich in Position einer funktionellen Gruppe Funktionsisomere enthalten unterschiedliche funktionelle Gruppen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 188 11. 11.1 Stereochemie und Stereoselektivität Konstitution, Konformation, Konfiguration Konformationen und Konformere: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 189 11. 11.1 Stereochemie und Stereoselektivität Konstitution, Konformation, Konfiguration Geometrische Isomere (cis-/trans-Isomere) fixierte räumlichen Anordnung von Substituenten • an einer Doppelbindung: Cl Cl H H Cl cis H Cl Cl Cl Br H Cl trans H Br H Cl Z E • an Ringsystemen: Y Y X X Y X e/e 1,2-trans X e/a Y 1,2-cis Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 190 11.2 Chiralität Ein Körper ist chiral, wenn er mit seinem Spiegelbild nicht identisch ist / nicht zur Deckung zu bringen ist ! Konfiguration: „Absolute“ Anordnung im Raum Stereoisomere: Konfigurationsisomere Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 191 11. 11.2 Stereochemie und Stereoselektivität Chiralität Wann ist ein Molekül chiral ? Faustregel: keine Spiegelebene, kein Inversionszentrum (1) Chiralitätszentrum: Symmetrieebenen: 2 nicht chiral 1 nicht chiral Br • Zentrales Atom mit 4 verschiedenen Substituenten • Meist C (sp3); auch bei P, S, N…möglich Asymmetriezentrum, stereogenes Zentrum 0 chiral F Br H Cl Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie H Cl F 192 11. 11.2 Stereochemie und Stereoselektivität Chiralität (2) Chiralitätsachse: Achse Spiegel a b „Schraube“ Helikale Strukturen, vgl. a- und b-Helix (Proteine, DNA) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 193 11. 11.2 Stereochemie und Stereoselektivität Chiralität Chirale Moleküle: Enantiomere COOH H3C H OH HOOC H HO CH 3 2-Hydroxypropansäure (Milchsäure) Zwei Moleküle, die sich wie Objekt und Spiegelbild verhalten, aber nicht identisch sind, nennt man Enantiomere ! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 194 11. 11.2 Stereochemie und Stereoselektivität Chiralität Schreibweisen und Nomenklatur der Stereochemie (1) R,S-Nomenklatur (Cahn-Ingold-Prelog Regeln, 1964) Zeichnen eines Tetraeders entsprechend der realen räumlichen Gestalt: Wie unterscheidet man im Namen Bild und Spiegelbild ? R,S-Nomenklatur Grundlage: Priorität der 4 Substituenten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 195 11. 11.2 Stereochemie und Stereoselektivität Chiralität 1. Festlegung der Prioritätenreihenfolge: Die direkt an das asymmetrische *C-Atom gebundenen Atome (a) werden nach fallender Ordnungszahl betrachtet: höhere Ordnungszahl höhere Priorität. gleichwertig Betrachtung der weiteren „Bindungssphären“ b, c, d…. , c b 1 OH a c b a *C a b a c H H H H 2 HO C C C C C H 3 H H H H H 4 b c Mehrfachbindungen zählen als mehrere Einfachbindungen: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 196 11. 11.2 Stereochemie und Stereoselektivität Chiralität 2. Betrachtung des Moleküls: • Substituent niedrigster Priorität (meist H) zeigt nach hinten (Blick „von vorne“ über das asymmetrische C-Atom in die C-H-Bindung) • Reihenfolge der restlichen drei Substituenten nach abnehmender Priorität geordnet entspricht: Drehung im Uhrzeigersinn R-Konfiguration (rectus) Drehung im Gegenuhrzeigersinn S-Konfiguration (sinister) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 197 11. 11.2 (2) Stereochemie und Stereoselektivität Chiralität D,L-Nomenklatur (nach Emil Fischer, 1900) Nur für spezielle Verbindungen möglich und gebräuchlich !! a-substituierte Aldehyde Zucker !! a-substituierte Carbonsäuren Aminosäuren, Hydroxysäuren Konvention: Projektionsformeln nach Fischer: Höchst oxidierter Substituent an der senkrechten Kante nach oben + hinten Relevanter a-Substituent an der horizontalen Kante nach vorne, rechts oder links ! CHO CHO H Modell H OH OH CH2OH CH2OH D-Glycerinaldehyd dexter CHO CHO HO HO H H CH2OH CH2OH L-Glycerinaldehyd laevus Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 198 11. 11.2 Stereochemie und Stereoselektivität Chiralität Bedeutet D = R und L = S ??? Wie kann ich R/S aus D/L ableiten ?? R/S ist neu (1964) und universell D/L ist „alt“ und speziell 2 2 1 H NH2 H 4 H 2N CH2OH HOH2C 3 L-Serin 3 1 H2N COOH 2 L-Cystein 4 3 H NH 2 HOH2C S mit Blickrichtung vorne um 90°nach rechts in Tafelebene drehen 1 3 HOOC COOH H NH2 H 4 CH 2SH COOH HOOC COOH HSH2C 4 2 H NH2 HSH2C 1 R Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie !! 199 11. 11.2 Stereochemie und Stereoselektivität Chiralität In welcher physikalischen Eigenschaft unterscheiden sich 1) chirale von achiralen Verbindungen und 2) Enantiomere untereinander ? Optische Aktivität Die Ebene des polarisierten Lichts wird in einem chiralen Medium gedreht: Enantiomere drehen die Polarisationsebene von linear polarisiertem Licht - unter sonst gleichen Bedingungen - um den gleichen Betrag a nach links: (-) bzw. rechts (+) Messung: Polarimeter Polarimetrie Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 200 11. 11.2 Stereochemie und Stereoselektivität Chiralität Das Ausmaß der Drehung ist proportional …der Konzentration c der Lösung (angegeben in g/100 cm3) …und der Schichtdicke l (angegeben in dm): spezifischer Drehwert [a ] T a 20 gemessener Drehwert c l Konzentration in g/cm3 Länge der Küvette (Schichtdicke) in dm [a]D Messtemperatur Na-D-Linie (589 nm) (Na-Dampf-Lampe) Merke: Es besteht kein Zusammenhang zwischen optischem Drehsinn: Bezeichnung nach Fischer: Bezeichnung nach CIP: (+) oder (-) D oder L R oder S Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 201 11. 11.2 Stereochemie und Stereoselektivität Chiralität Die reinen Substanzen: Enantiomere S- oder L(+)-Milchsäure R- oder D(-)-Milchsäure [a]D = + 3.8 [a]D = - 3.8 Das 1:1 Gemisch: Racemat [a]D = 0 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 202 11. 11.2 Stereochemie und Stereoselektivität Chiralität Racemisierung: Prozess der Überführung eines Enantiomers in das Racemat Racematspaltung: Trennung eines Racemats in die beiden Enantiomeren Inversion: 11.3 Überführung eines Enantiomers in das spiegelbildliche Verbindungen mit mehreren Chiralitätszentren: Enantiomere, Diastereomere, meso-Verbindungen Jedes einzelne Stereozentrum mit R oder S bezeichnen und diese Deskriptoren in den Namen aufnehmen Wie viele Stereoisomere gibt es von diesen Verbindungen ? Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 203 11. 11.3 Stereochemie und Stereoselektivität Enantiomere, Diastereomere, meso-Verbindungen 1 Asymmetrie-Element 2 Enantiomere 2 Stereoisomere 2 Asymmetrie-Elemente 2 Enantiomerenpaare, zueinender diastereomer 4 Stereoisomere n Chiralitätselemente (unterschiedlich substituiert!) 2n Stereoisomere Enantiomere und Diastereomere Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 204 11. 11.3 Stereochemie und Stereoselektivität Enantiomere, Diastereomere, meso-Verbindungen Enantiomere und Diastereomere in Fischer-Projektion: auch hier nur bei speziellen Verbindungen: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 205 11. 11.3 Stereochemie und Stereoselektivität Enantiomere, Diastereomere, meso-Verbindungen (1) Zwei Enantiomere haben an allen Asymmetriezentren entgegen gesetzte Konfiguration. • Enantiomere verhalten sich wie Bild und Spiegelbild. Sie lassen sich nicht durch Drehung zur Deckung bringen. • Enantiomere haben die gleichen physikalischen und chemischen Eigenschaften (Schmelzpunkte, Siedepunkte, etc.). • Sie unterscheiden sich nur in ihrer Wechselwirkung mit polarisiertem Licht: optische Aktivität entgegen gesetzter optischer Drehsinn (2) Diastereomere unterscheiden sich nicht an allen, d.h. x < n Stereozentren • Diastereomere verhalten sich nicht wie Bild und Spiegelbild. Sie haben prinzipiell unterschiedliche chemische und physikalische Eigenschaften. (3) Zwei Stereoisomere sind entweder enantiomer oder diastereomer zueinander. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 206 11. 11.3 Stereochemie und Stereoselektivität Enantiomere, Diastereomere, meso-Verbindungen meso-Verbindungen Sonderfall: z. B. Molekül mit 2 Stereozentren die aber die gleichen vier (verschiedenen) Substituenten tragen Spiegelebene in einem Stereoisomer = meso-Form Es existieren 2 Enantiomere und 1 meso-Verbindung • Die meso-Verbindung ist nicht chiral (und auch nicht optisch aktiv). Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 207 11. 11.3 Stereochemie und Stereoselektivität Enantiomere, Diastereomere, meso-Verbindungen Klassisches Beispiel in Fischer-Projektion: • • Salze: „Tartrate“ Chelat-Ligand Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 208 11.4 Biologische Eigenschaften von Enantiomeren „Die Natur ist chiral“: mikroskopisch, makroskopisch Viele Biomoleküle sind chiral: Kohlenhydrate, Hydroxysäuren, Amine, Aminosäuren … Polysaccharide, DNA, Alkaloide, Peptide, Proteine ... Enzyme und Rezeptoren sind chiral, insbesondere das aktive Zentrum. Die Wechselwirkungen mit chiralen Substraten entsprechen diastereomeren Relationen und sind unterschiedlich. Enantiomere und Rezeptoren molekulare Erkennung Enantiomere binden an unterschiedliche Rezeptoren oder unterschiedlich gut. Die biologische Wirkung ist unterschiedlich. Moderne Pharmazeutika sollen chiral sein. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 209 11. 11.4 Stereochemie und Stereoselektivität Biologische Eigenschaften von Enantiomeren Enantiomere und Rezeptoren/Enzyme molekulare Erkennung Drei-Punkt-Wechselwirkung (1933) • Passt • • Passt nicht Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 210 11. 11.4 Stereochemie und Stereoselektivität Biologische Eigenschaften von Enantiomeren (R)-(-)-Adrenalin erhöht Blutdruck und Herzfrequenz H + NHMe HO HO OH gute Bindung von (R)-(-)-Adrenalin an den Adrenalin-Rezeptor (S)-(+)-Adrenalin schwache Wirkung OH HO HO + NHMe H schwächere Bindung von (S)-(+)an den Adrenalin-Rezeptor Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 211 11. 11.4 Stereochemie und Stereoselektivität Biologische Eigenschaften von Enantiomeren (R)-(+)-Thalidomid • Antidepressivum • Beruhigungsmittel (S)-(-)-Thalidomid • toxisch, teratogen • „Contergan“-Affäre (S)-(-)-Limonen „Fichtennadeln“ (R)-(+)-Limonen „Citrusduft“ Trennung von Enantiomeren (Racematspaltung) oder Synthese reiner Enantiomere Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 212 11. 11.4 Stereochemie und Stereoselektivität Biologische Eigenschaften von Enantiomeren Ziel: stereoselektive (enantioselektive) Synthese Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 213 Zusammenfassung: Stereochemie • Isomerie • Konstitution, Konformation, Konfiguration • Konstitutionsisomere und Stereoisomere • Geometrische Isomere (cis/trans) • Konfigurationsisomere: Enantiomere und Diastereomere • Chiralität, Symmetrieelemente, Chiralitätselemente (Zentrum, Achse) • Chirale Moleküle: R/S-Nomenklatur, Fischer-Nomenklatur (D/L) • optische Aktivität, spezifischer Drehwert • Enantiomere, Racemat, Diastereomere, meso-Verbindungen • pharmakologische Eigenschaften von Enantiomeren • stereoselektive (enantioselektive) Synthese Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 214 Übungsaufgaben Welche der nebenstehenden Verbindungen sind geometrische Isomere ? A B (1) und (2) (1) und (3) Die nebenstehende Verbindung ist A B (S)-Milchsäure (R)-Milchsäure Welches Strukturmerkmal bzw. welche funktionelle Gruppe tritt in der abgebildeten Verbindung nicht auf? A B C D E tertiärer Alkohol Acetal Halbacetal zwei stereogene Zentren (Chiralitätszentren) Trichlormethylgruppe Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 215 12. Kohlenhydrate Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 216 12. Kohlenhydrate 12.1 Aufbau von Kohlenhydraten - Monosaccharide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 217 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Zuckerstammbaum: D-Reihe Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 218 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide • Monosaccharide: 1 Zuckerbaustein • Stammverbindung: D- bzw. L-Glycerinaldehyd • Anzahl der Kohlenstoffatome: 4-6 Tetrose, Pentose, Hexose • 1 Carbonylgruppe: Aldosen und Ketosen • OH-Gruppen an allen anderen C • asymmetrische C-Atome (Stereozentren) CHO * OH HO * CH 2OH O HO * * OH * OH CH 2OH * OH * OH CH 2OH D-Glucose D-Fructose • acyclisch ?? Stellungsisomere Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 219 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Enantiomere Zucker unterscheiden sich an allen asymmetrischen C: CHO * OH HO CHO HO D-Glucose OH * * * OH * OH CH 2OH * HO HO * * CH 2OH L-Glucose Epimere Zucker unterscheiden sich an einem asymmetrischen C: CHO * OH 1 2 3 4 5 6 HO OH OH CH 2OH D-Glucose CHO OH CHO HO HO * HO OH OH CH2OH D-Mannose Epimere bzgl. C2 * OH OH CH 2OH D-Glucose CHO OH HO HO * OH CH2OH D-Galactose Epimere bzgl. C4 Diastereomere Zucker unterscheiden sich an 0 < 1 < n asymmetrischen C Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 220 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Ringstruktur von Monosacchariden: cyclische Halbacetalform Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 221 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Anomere Zucker unterscheiden sich in der Konfiguration am Acetal-C der cyclischen Form (bei Aldosen C-1): a und b Anomere Zucker können in Lösung über die ringoffene Form im Gleichgewicht stehen (Mutarotation) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 222 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Pyranosen und Furanosen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 223 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Ribose und Desoxyribose Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 224 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide • „Desoxyzucker“ • Aminozucker: NH2- statt OH-Gruppen: • in Hyaluronsäure („Gelenkschmiere“) und Knorpel • in Antibiotika (Glykosid-Antibiotika) u.a. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 225 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Eigenschaften von Monosacchariden • Oxidation und Reduktion Fehling Aldosen sind „reduzierende“ Zucker! Tollens (Versuch 5.1) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 226 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 227 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide • Isomerisierung über die „Endiolform“ O H C H H C OH C CH2OH H C HO H OH CH2OH (D-)Glycerinaldehyd H C C H OH H OH C C Base HO CH2OH OH C O C O CH2OH CH2OH "Endiol" O H C Dihydroxyaceton H OH H OH H Base C OH C O HO H H OH H OH H OH H OH H OH H OH CH2OH D-Glucose CH2OH CH2OH "Endiol" D-Fructose • auch mit Isomerasen Ketosen wirken im basischen ebenfalls reduzierend ! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 228 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide • Vitamin C als Endiol: (Biosynthese aus D-Glucose oder D-Gulose) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 229 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide • als Phosphate im Stoffwechsel: CH2OH CHO C O HO C H OH H C OH OH O H C OH H C OH HO C H H C H C CH2O Isomerase P O O Glucose-6-phosphat CH2O P Fructose-6-phosphat Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 230 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide • (Voll)Acetale: Glycoside Wiederholung: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 231 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide Beispiele mit einfacher Alkoholkomponente: H H OH 5 HO HO H O 5 1 H H HO HO H HO O Methyl-a -D-glucopyranosid H O 1 H H CH3 OH OH OH HO O CH 3 H Methyl-b-D-glucopyranosid 5 H HO H O 1 H H HO O CH 3 H Methyl-b-D-galactopyranosid Glycoside sind (wie Acetale): • labil gegen wässrige Säure • stabil gegen Basen • stabil gegen Reduktionsmittel • stabil gegen Oxidationsmittel, d.h. nicht reduzierend „O-Glycoside“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 232 12. 12.1 Kohlenhydrate Aufbau von Kohlenhydraten - Monosaccharide • N-Glycoside: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 233 12. Kohlenhydrate 12.2 Disaccharide (Voll-)Acetale mit einem 2. Monosaccharid als Alkoholkomponente: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 234 12. 12.2 Kohlenhydrate Disaccharide = Disaccharide Typ I: Verknüpfung anomeres OH + alkoholisches OH reduzierende Disaccharide OH OH O 4 1 HO OH OH HO O Lactose 1 O 4 OH b-D-Galactopyranosyl-(1-4)-D-glucopyranose OH • • • • • Muttermilch: 5,5 – 7,5 % Lactose (primäre Kohlenhydratquelle für Säuglinge) Lactase zur Spaltung „Lactose-Intoleranz“: Lactase fehlt beim Heranwachsen „Abschaltung“ des Lactase-Gens bei 10-15 % der Erwachsenen Lactase als Verdauungshelfer Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 235 12. 12.2 Kohlenhydrate Disaccharide = Disaccharide Typ II: Verknüpfung anomeres OH + anomeres OH Nur Vollacetal-Struktur nicht reduzierende Disaccharide bei Aldosen: 1 1 verknüpft, bei einer Ketose: 1 2 verknüpft Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 236 12. Kohlenhydrate 12.3 Polysaccharide Stärke und Glycogen Grundstruktur: 1,4-a-glycosidische Verknüpfung von a-D-Glucoseeinheiten O 6 4 O HO O O HO 1 6 4 O HO O O 6 1 Amylose: 4 HO O O (im wesentlichen) unverzweigte Kettenmoleküle O HO 1 4 6 wasserlöslich: 20 %, MG 10000 – 50000 HO O O Amylopektin: HO 1 HO stark verzweigte Kettenmoleküle: Hauptketten 1,4-glycosidisch, O Verzweigungen 1,6-glycosidisch wasserunlöslich, MG 50000 – 180000 Glycogen: ähnlich Amylopektion 1,4-verknüpft und 1,6-verzweigt, deutlich höherer Verzweigungsgrad, wasserunlöslich Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 237 12. 12.3 Kohlenhydrate Polysaccharide Amylose O O O O HO HO O HO O HO O HO O • gewinkelt, vgl. Maltose O HO O OH O HO O O • Helixstruktur mit Hohlraum • Einlagerung von Iod: Iod-Stärke-Reaktion (Versuch 5.2) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 238 12. 12.3 Kohlenhydrate Polysaccharide O Amylose 6 4 O O HO O HO 6 1 4 O O HO O HO 1 4 6 O O HO Amylase O HO 1 4 6 O O HO H OH H O 4 HO HO H 1 H H OH O HO H Maltose 1 O + OH 4 H Säure O H H HO HO 1 H HO Maltase a -D-Glucose Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 239 12. 12.3 Kohlenhydrate Polysaccharide Amylopektin Glykogen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 240 12. 12.3 Kohlenhydrate Polysaccharide Cellulose Grundstruktur: 1,4-b-glycosidische Verknüpfung von b-D-Glucoseeinheiten OH OH 4 O HO O OH H OH 1 O O 4 1 O 4 O H O OH OH 1 H O 1 O O OH O O 4 OH Cellobiose faserartige Moleküle, wasserunlöslich Cellulose unter dem Mikroskop: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 241 Zusammenfassung: Kohlenhydrate • • • • • • • • • • • Cn(H2O)n: Photosynthese und Verbrennung Zuckerstammbäume ausgehend von D,L-Glycerinaldehyd Tetrosen/Pentosen/Hexosen – Aldosen/Ketosen Chiralitätszentren: Enantiomere, Diastereomere, Epimere cyclische Halbacetale, Anomere (a/b) , Pyranosen und Furanosen Oxidation und Reduktion Endiolform (z. B. Vitamin C) Phosphatierung Vollacetale: glykosidische Bindung, O- /N-Glycoside Disaccharide Typ I und II Polysaccharide: Stärke/Glykogen – Cellulose Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 242 Übungsfragen: Welche Monosaccharide sind Epimere ? A D-Glucose und D-Fructose B D-Glucose und D-Mannose Bei der positiven Tollens-Probe wird D-Galactose oxidiert zu A D-Galactonsäure B D-Galacturonsäure Glycogen ist ein Polysaccharid aus A 1,4- verknüpften a-D-Glucose-Einheiten mit starker Verzweigung durch zusätzliche 1,6-Verknüpfung. B ähnlich wie Amylose linear 1,4- verknüpften a-D-Glucose- Einheiten. Welche Aussage trifft nicht zu? Lactose und Maltose A können beide durch Maltase abgebaut werden B haben dieselbe Molmasse C sind unterschiedlich C1–C4 verknüpft D können als α- und β-Anomere vorliegen E besitzen beide reduzierende Eigenschaften Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 243 13. Aminosäuren und Peptide 13.1 Aminosäuren proteinogen: 20 (+1) essentiell: 10 (+1) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 244 13. 13.1 Aminosäuren und Peptide Aminosäuren Aminosäuren mit unpolaren aliphatischen Seitenketten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 245 13. 13.1 Aminosäuren und Peptide Aminosäuren mit aromatische Seitenketten COOH H2N COOH H2N C H CH2 H N H H H2C Phenylalanin Phe, F H 2C COOH H2N C C OH Tyrosin Tyr, Y Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie Tryptophan Try, W 246 13. 13.1 Aminosäuren und Peptide Aminosäuren mit polaren, ungeladenen (neutralen) Seitenketten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 247 13. 13.1 Aminosäuren und Peptide Aminosäuren mit polaren, basischen Seitenketten mit polaren, sauren Seitenketten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 248 13. 13.1 Aminosäuren und Peptide Aminosäuren Aminosäuren als Betaine, Zwitterionen, Ampholyte H 3N CH2 H 2N CH2 pK S Carbonsäure: ~4.8 pK B Amin: ~3.4 COOH positiv geladen pK S Ammonium: ~10.6 pK B Carboxylat: ~9.2 COO - H+ - H+ H 3N CH H 3N CH R Glycin: pK S ~ 10.0 pK B ~ 12.0 COO COOH H 2N CH R pKS1 pKS2 neutral bei einem definierten pH-Wert: „Isoelektrischer Punkt“ pHIP = COO R negativ geladen pKS1 + pKS2 2 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 249 13. 13.1 Aminosäuren und Peptide Aminosäuren Titrationskurve einer neutralen Aminosäure COOH - H+ H 3N CH2 pKS1 COO H 3N CH2 COO - H+ H 2N CH2 pKS2 = 10.0 pHIP = pKS1 + pKS2 2 = 2.0 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 250 13. 13.1 Aminosäuren und Peptide Aminosäuren Titrationskurve einer sauren Aminosäure Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 251 13. 13.1 Aminosäuren und Peptide Aminosäuren Titrationskurve einer basischen Aminosäure Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 252 13. 13.1 Aminosäuren und Peptide Aminosäuren Nachweis von Aminosäuren: über den isoelektrischen Punkt (IP) Kathode Anode + - pH pH 2 12 7 isoelektrische Fokussierung Asp Gly Lys Anode Kathode + IP = 3.0 IP = 6.0 pH 2 - IP = 10.0 7 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 12 pH 253 13. 13.1 Aminosäuren und Peptide Aminosäuren Nachweis von Aminosäuren: Ninhydrin-Test Aminosäuren als Chelatliganden H O R O C N HC Cu2+ CH C N H H O R O H Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 254 13. 13.1 Aminosäuren und Peptide Aminosäuren Decarboxylierung von Aminosäuren Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 255 13. 13.1 Aminosäuren und Peptide Aminosäuren Acylierung und Veresterung von Aminosäuren N-Acetylcystein Mucolytikum, Antioxidans Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 256 13.2 Peptide Peptidbindung und Dipeptide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 257 13. 13.2 Aminosäuren und Peptide Peptide „Phenylalaninquelle“: nicht bei Patienten mit Phenylketonurie • angeborene Stoffwechselstörung (1 : 80.000) • Anreicherung von Phe Hirnschädigung (Störung der geistigen Entwicklung) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 258 13. 13.2 Aminosäuren und Peptide Peptide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 259 13. 13.2 Aminosäuren und Peptide Peptide Tripeptide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 260 13. 13.2 Aminosäuren und Peptide Peptide Geometrie der Peptidbindung • • • • Peptid-Mesomerie 6 Atome der Peptidbindung in einer Ebene Partieller Doppelbindungscharakter der C–N –Bindung Sterische Fixierung, meist trans an „ -C=N- “ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 261 13. 13.2 Aminosäuren und Peptide Peptide Geometrie in der Primärstruktur „Peptid-Rückgrat“ Durch die Unbeweglichkeit der planaren Peptidbindungen können nur wenige stabile Konformationen ausgebildet werden: Sekundärstrukturen. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 262 13.3 Polypeptide und Primärstruktur Oligopeptide: 2-10 AS (Poly)Peptide: 11-100 AS Proteine: >100 AS Aminosäuren MG MG bis 10.000 (1-10 kDa) 10-1000 kDa Polypeptide Primärstruktur: Aminosäuresequenz Abfolge der Aminosäuren in der Kette Peptidsynthese Sequenzanalyse sequenziell im Labor: automatisiert Biosynthese Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 263 13. 13.3 Aminosäuren und Peptide Polypeptide und Primärstruktur Peptidsynthese im Labor R1 R2 R2 O H N + H2N H 2N COOH COOH H2N R1 O Schützen R2 oder R1 + SG N H OH COOH SG H2N Entschützen am N- oder C-Terminus O Aktivieren R2 SG R1 X N H Kuppeln + SG H2N O R2 O SG - HX O H N N H Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie O SG R1 264 13. 13.3 Aminosäuren und Peptide Polypeptide und Primärstruktur Protein-Biosynthese RNA R1 O H N R2 O O H2N N H O R2 tRNA R1 O N H O Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 265 13.4 Sekundärstrukturen Optimierung von Geometrie (Konformation) sowie polaren Wechselwirkungen / H-Brücken F a l t b l a t t - Struktur: b-Struktur (von b-Keratin) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 266 13. 13.4 Aminosäuren und Peptide Sekundärstrukturen • Zusammenlagerung zweier gefalteter Kettenabschnitte • H-Brücken zwischen den beiden Kettenabschnitten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 267 13. 13.4 Aminosäuren und Peptide Sekundärstrukturen • Seitenketten R alternierend nach „oben“ oder „unten“; • H-Brücken zwischen gegen- oder gleichläufigen Kettenabschnitten Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 268 13. 13.4 Aminosäuren und Peptide Sekundärstrukturen a - H e l i x - Struktur: • • • • • schraubenförmige Anordnung i.d.R. 3,6 Aminosäuren pro Windung H-Brücken innerhalb der gleichen Helix: C=O und NH-Gruppen von Windung zu Windung im passendem Abstand H-Brücken in Richtung der Schraubenachse erhöhte Stabilität Seitenketten stehen nach außen und können weiter „wechselwirken“ 0.54nm a-Helix: rechts-Schraube Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 269 13.5 Tertiärstrukturen Supersekundärstrukturen („Überstrukturen, Motive“): • „Arrangement“ von Sekundärstrukturabschnitten (Helices / Faltblätter) sowie Schlaufen („Loops“, Aminosäure-Abschnitte, die keiner Sekundärstruktur angehören) Stabilisierung über Seitenketten: • Disulfid-Bindungen zwischen Cystein-Resten • H-Brücken • ionische Wechselwirkungen zwischen Seitenketten • hydrophobe Wechselwirkungen Nur eine Polypeptideinheit Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 270 13. 13.5 Aminosäuren und Peptide Tertiärstrukturen © 2007 Pearson Studium / Abbildung aus: Bruice: Organische Chemie, 5. Aufl. / ISBN: 978-3-8273-7190-4 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 271 13. 13.5 Aminosäuren und Peptide Tertiärstrukturen Disulfid-Brücken zwischen Cystein-Resten Das Haar Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 272 13. 13.5 Aminosäuren und Peptide Tertiärstrukturen Tertiärstruktur Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 273 13.6 Quartärstrukturen Aggregate aus Peptidketten-Untereinheiten (typisch 2-6, bis zu 20) Cofaktoren und Coenzyme Kooperativität: Bindung kleiner Moleküle Cofaktor „Häm“ Quartärstruktur des Hämoglobins: Tetramer aus 4 UE von 2 verschiedenen Typen a und b Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 274 13. 13.6 Aminosäuren und Peptide Quartärstrukturen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 275 13. 13.6 Aminosäuren und Peptide Quartärstrukturen Cofaktoren und Coenzyme begrenzte „chemische Potenz“ nackter Enzyme, z. B. zur Elektronenübertragung. Metallionen: Zn2+, Fe2+, Co2+, Cu2+ ..... am Enzym spezifisch koordiniert Cofaktoren oder prosthetische („zusätzliche“) Gruppe; z. B. Häm - niedermolekulare Verbindungen, enthalten häufig Metall-Ionen - permanent an das Enzym gebunden (meist kovalent) - Regeneration der aktiven Form im katalytischen Cyclus Coenzyme oder Cosubstrate, z. B. NADH - relativ niedermolekular - in einem Assoziations- / Dissoziationsgleichgewicht an Enzym gebunden - ausreichend hohe Konzentration erforderlich Apoenzym + Coenzym (Holo-)Enzym Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 276 13. 13.6 Aminosäuren und Peptide Quartärstrukturen Proteine: Einteilung nach Funktion und Zusammensetzung: Skleroproteine: Gerüst- und Faserproteine (z. B. Bindegewebe): wasserunlöslich Sphäroproteine (globuläre Proteine): wasserlöslich; u. a. Transportproteine, Enzyme Proteinkomplexe („Proteide“): Protein- + Nichtproteinanteil Glykoproteine (Valenzbindung) Phosphoproteine (Valenzbindung) Lipoproteine (lose Aggregate) Metalloproteine (Komplexbindung) Enzyme: Biokatalysatoren „Zink-Finger-Proteine“ Spezifische Bindung an DNA (Transskriptionsfaktoren) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 277 13.7 Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 278 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 279 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 280 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 281 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 282 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 283 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 284 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 285 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 286 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 287 13. 13.7 Aminosäuren und Peptide Enzymkinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 288 13. 13.7 Aminosäuren und Peptide Enzymkinetik Enzymkinetik - Sättigungskinetik (Michaelis u. Menten) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 289 13.8 Synthetische Polyamide 1,6-Diaminohexan (C6) ("Hexamethylendiamin") n H 2N O Adipinsäure (C6) OH + n HO NH 2 O 1. Salzbildung, 2. 300 °C - n H2O O H N OH N H O n Amidbindung Polyamid 66, "Nylon 6,6" (Dupont, 1935) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 290 13. 13.8 Aminosäuren und Peptide Synthetische Polyamide O n H 2N + n NH 2 Cl Cl O - n HCl O H N N H O n Amidbindung Versuch: Nylon-Seiltrick Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 291 Zusammenfassung: Aminosäuren und Peptide • • • • • • • • • • • insbesondere a-Aminocarbonsäuren proteinogen, z. T. essentiell Einteilung nach Seitenkette, Buchstaben-Codes Betaine, Ampholyte, Titration, isoelektrischer Punkt Decarboxylierung zu biogenen Aminen Peptidbindung als Spezialfall der Amidbindung Peptidsynthese, Sequenzanalyse Polypeptide: Primär-, Sekundär-, Tertiär-, Quartärstruktur Proteine Enzyme als Biokatalysatoren synthetische Polyamide Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 292 Übungsfragen: Nebenstehende Aminosäure A B □ □ H enthält einen Imidazol-Ring und heißt Histidin. N CH2 CH COOH N enthält einen Indol-Ring und heißt Tryptophan. NH2 Die Säurestärke von ungeladenem Alanin (Betain-Struktur) wird bestimmt A B □ □ von der Acidität der Ammoniumgruppe. von der Acidität der Carboxylgruppe. Welche Aussage zur Verbindung dieser Verbindung trifft nicht zu ? A B □ □ Sie enthält eine Disulfidbrücke Sie ist ein Dipeptid HOOC CH CH2 S NH2 S CH2 CH COOH NH2 Welche Aussage zur a-Helix von Proteinen trifft zu ? A □ Sie wird durch intermolekulare Wasserstoffbrücken stabilisiert. B □ Die Seitenketten der Aminosäure-Bausteine zeigen aus der Helix nach außen. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 293 14. Stofftrennung und Spektroskopie Medizinische Diagnostik, Klinische Chemie Trenn- und Reinigungsverfahren: • Destillation • Sublimation, Gefriertrocknung • Kristallisation (V. 4.4) • Flüssig-flüssig Verteilung (V. 4.2) • Chromatographie (V. 1.4, 4.4) • Dialyse/Ultrafiltration Vorlesungsteil Allgemeine/Anorganische Chemie ! Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 294 14. 14.1 Stofftrennung und Spektroskopie Chromatographische Verfahren Dünnschichtchromatographie (DC) Kapillarkräfte Fließmittel, mobile Phase Folie mit Kieselgel u.a., stationäre Phase Retentionsfaktor: a b R f ( A) ; R f ( B) c c Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 295 14. 14.1 Stofftrennung und Spektroskopie Chromatographische Verfahren Dünnschichtchromatographie (DC) Filterpapier aufgetrennte Farbstoffe Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 296 14. 14.1 Stofftrennung und Spektroskopie Chromatographische Verfahren Säulenchromatographie (SC, CC) Schwerkraft Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 297 14. 14.1 Stofftrennung und Spektroskopie Chromatographische Verfahren Variante: HPLC: Hochdruck- oder Hochleistungs-Flüssigkeitschromatographie • sehr feines Kieselgel • kompakte Säulen (z. B. 4 mm x 20 cm) • Pumpenförderung des Eluenten • Instrumentelle Detektion (Brechungsindex, UV/VIS,…) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 298 Stofftrennung und Spektroskopie Chromatographische Verfahren HPLC: Konzentration 14. 14.1 Zeit Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 299 14. 14.1 Stofftrennung und Spektroskopie Chromatographische Verfahren Gaschromatographie Kapillar-GC: Kirschwasser Stationäre Phase: Hochviskoser Film (z. B. 0,25 mm) in Kunststoff-Kapillare (z. B. 25 m x 0,25 mm ID) Mobile Phase: z. B. Helium Detektion: Wärmeleitfähigkeit (WLD) Flammenionisation (FID) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 300 14.2 Spektroskopische Verfahren: Grundlagen Molekülanregung: E(nergie) angeregter Zustand DE Grundzustand Messung: Absorption, Emission DE als Wärme und/oder Elektromagnetische Strahlung: DE = h • h = 6.62 • 10–34 Js (Planck-Konstante) : Frequenz der Strahlung [1/s] vgl. c/ : Wellenlänge (meist in nm=10–9m) c: Lichtgeschwindigkeit Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 301 14. 14.2 Stofftrennung und Spektroskopie Spektroskopische Verfahren: Grundlagen Elektromagnetische Strahlung: DE = h • mit c/ Wellenlänge 106 105 104 103 102 101 1 FunkFrequenzen Radiofrequenzen RadarWellen FernsehFrequenzen 106 10-1 10-2 105 104 103 102 101 1 10-1 10-2 10-3 10-4 106 IR-Strahlung, „Strahlungswärme“ UV-Strahlung Kosmische Strahlung 10-5 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14 -Strahlung X-Strahlung [m] Mikrowelle: 2.45 GHz / 12.2 cm [nm] Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 302 14.3 UV / VIS – Spektroskopie angeregt werden: energiereichere elektronische Zustände: Elektronenanregung Elektronenübergänge: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 303 14. 14.3 Stofftrennung und Spektroskopie UV / VIS – Spektroskopie Aufnahme eines UV/VIS-Spektrums: Absorption als Funktion der Wellenlänge (200-1000 nm) Bandenspektrum (Lage und Intensität der Bande) Farbigkeit von Substanzen Substanzcharakterisierung Substanzquantifizierung Hämoglobin in Wasser Chlorophyll in Methanol (Versuch 5.4) NAD+ und NADH Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 304 14. 14.3 Stofftrennung und Spektroskopie UV / VIS – Spektroskopie Messung bei einer Wellenlänge: Photometrie Photometer d I0 I Messküvette Fotozelle Anzeige Lambert-Beersches Gesetz: 10log I0/I = Ext(inktion) = ec d e: molarer Extinktionskoeffizient (Substanz- und Wellenlängen-abhängig) Dimension: z. B. dm2/mol Konzentrationsbestimmung: Ext c Diagnostik (z. B. Blutuntersuchungen) Reaktionskinetik Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie (Versuch 5.4) (Versuch 5.5) 305 14.4 Infrarotspektroskopie (IR) angeregt werden: Molekülschwingungen ( = 2-15 mm) Valenzschwingung C-H Deformationsschwingung C=O „Fingerabdruck“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 306 14.5 Kernresonanzspektroskopie (NMR=“Nuclear Magnetic Resonance”) angeregt werden: Ausrichtung des magnetischen Momentes eines Atomkernes entgegen die Feldrichtung eines äußeren Magnetfeldes S ( = 20-600 MHz, = 0,5-15 m) B0 N „geeignete“ Kerne: 1H, 13C, 31P, … äußeres Magnetfeld Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 307 14. 14.5 Stofftrennung und Spektroskopie Kernresonanzspektroskopie NMR-Spektrometer NMR-Spektrum einer Einzelsubstanz Magnetfeldstärke: 1,5-15 Tesla „Chemische Verschiebung“ von Protonen im Magnetfeld Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 308 14. 14.5 Stofftrennung und Spektroskopie Kernresonanzspektroskopie am Menschen: Kernspin-Tomographie (MagnetResonanzTomographie) „Vermessung“ der Protonen von Wasser- und Fettbestandteilen im Organismus Hell-Dunkel-Kontraste (wasserreich: dunkel; wasserarm: hell, z.B. Knochen) Abbildung von Organen und unterschiedlichen Gewebearten z. B. Gefäßerweiterungen, Ausdehnung von Tumoren Magnetfeldstärke: 1,5-3 Tesla • Schichtweise Aufnahme • Keine energiereiche Strahlung Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 309 15. Reaktionskinetik (Zeeck, Kap. 12.) Reaktion: A + ... B + ... Definition: Reaktionsgeschwindigkeit: Reaktionskinetik: • Geschwindigkeit einer chemischen Reaktion (RG): Abnahme der Edukt-Konzentration (oder) Zunahme Produkt-Konzentration mit der Zeit Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 310 15. Reaktionskinetik Abhängigkeit der RG von Konzentrationen der Ausgangstoffe (Edukte): Geschwindigkeitsgesetz 1. Ordnung: • Die RG ist proportional zu 1 Eduktkonzentration: A + ... B + ... v- d[A] k1 [A] dt • z. B. monomolekulare Reaktion: 1 Teilchen ist am langsamen und daher die Geschwindigkeit bestimmenden Schritt beteiligt SN1 – Reaktion: R3C-X v= d [R3C-X] dt = k1• [R3C-X] Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 311 15. Reaktionskinetik Geschwindigkeitsgesetz 2. Ordnung: • Die RG ist proportional zu 2 Eduktkonzentrationen: d[A] v k 2 [A] [B] dt • (i.d.R.) bimolekulare Reaktion; 2 Teilchen (Atome, Moleküle) sind am langsamen und daher die Geschwindigkeit bestimmenden Schritt beteiligt SN2 – Reaktion: Nu R3C-X v= d [R3C-X] = k2•[Nu]•[R3C-X] dt Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 312 15. Reaktionskinetik Reaktion 0. Ordnung: A + ... B + ... • Die RG ist konstant, d.h. von keiner Eduktkonzentration abhängig: d[A] v k0 dt d[A] -k 0 dt [ A] [ A ]0 [A] [A]0 t d [ A] -k0 dt t0 [A] -k 0 t [A]0 Beispiel: Ethanolabbau im Körper: 100mg/kg Körpergewicht/h = 0,1‰ / h [A]0/2 t t1/2 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 313 15. Reaktionskinetik v- Reaktion 1. Ordnung: d[A] k1 [A] dt [ A] A + ... B + ... [ A ]0 t d [ A] - k1 dt [ A] t 0 ln[A] ln[A]0 - k1 t [A] [A]0 e-k1t Halbwertszeit: t1/2 wenn: [A] [A]0 2 t½ ln 2 k1 [A]0 [B] [A]0/2 [A] [A]0 e-k1t t1/2 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 314 15. Reaktionskinetik Auswertung einer Reaktionskinetik 1. Ordnung: [A] ln[A] ln[A]0 ln[A] ln[A]0 - k1 t [A] [A]0 e-k1t t1/2 t 20 40 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 60 80 100 t 315 15. Reaktionskinetik Reaktion 2. Ordnung: A + B + .... vReaktion pseudoerster Ordnung: eine Konzentration konstant X + Y + .... d[A] k 2 [A] [B] dt k 2 [B] k '2 v k '2 [A] [A]0 t t1/2 Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 316 15. Reaktionskinetik Versuch 5.5: Photometrische Bestimmung einer Reaktionskinetik: Verseifung eines Esters Messung: Konzentrationsabnahme an Edukt Konzentrationszunahme an Produkt [PNPA]t [PNPA]0 - [NP]t Ext t e [NP]t d [NP]t Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie Ext t ed 317 Übungsfragen 1 nm = 10–9 m Lichtgeschwindigkeit: c = 300000 km/s Planck-Konstante: h = 6,62 x 10–34 J s Elektromagnetische Strahlung der Wellenlänge = 10 nm besitzt eine Energie (pro Lichtquant) von Elektromagnetische Strahlung: A 1,986 x 10–17 Joule Energie: E = h • mit = c/ B 1,986 x 10–20 Joule Eine Lösung von p-Nitrophenolat in Wasser (e = 193000 dm2/mol) hat in einer 1 cm dicken Küvette im Photometer eine Extinktion von 0,772. A Die Konzentration der Lösung beträgt 4 x 10–4 mol/L B Die Konzentration der Lösung beträgt 4 x 10–5 mol/L Bei einer Reaktion erster Ordnung ist nach 150 s die Konzentration des Ausgangsstoffes A von ursprünglich 0,6 mol/L auf 0,3 mol/L gesunken. Nach welcher Zeit, gerechnet vom Start der Reaktion beträgt die Konzentration von A noch 0,15 mol/L ? A 225 s B 300 s Bei einer Gleichgewichtsreaktion verringert ein Katalysator die freie Aktivierungsenthalpie DG# A für Hin- und Rückreaktion. B zur bevorzugten Bildung der Produkte. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 318 16. 16.1 Derivate anorganischer Säuren Derivate der „Kohlensäure“ Oxidationsstufen des Kohlenstoffs: “Kohlensäure-Derivate”: +IV +III +I -I Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 319 16. 16.1 Derivate anorganischer Säuren Derivate der „Kohlensäure“ Harnstoff O • farblos, wasserlöslich • wenig basisch C H N NH2 (aber stärker als „normale“ Amide) 2 • Ausscheidung: 20-50 g in 24 h • Abbau stickstoffhaltiger Verbindungen („Harnstoff-Cyclus“) • Nachweis durch die „Biuret-Reaktion“ • enzymatische Hydrolyse in Bakterien durch Urease • als Funktionalität in: O Harnsäure O N H NH R O N H + H+ H2N C H NH2 O H N HN O O R NH "Barbiturate" R = H: Barbitursäure R = Ethyl: Veronal O Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 320 16. 16.1 Derivate anorganischer Säuren Derivate der „Kohlensäure“ Guanidin NH H2N C NH 2 + H+ NH2 H2N C NH2 stark basisch ! „funktionelle“ Aminosäure u.a. Muskeldurchblutung Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 321 16.2 Derivate der Schwefelsäure („Sulfate“) Heparine • Bausteine: D-Glucuronsäure, D-Glucosamin; 1,4-a-glykosidisch • Kettenlänge variabel (MR ~ 17000) • Sulfatgruppen an unterschiedlichen Positionen, Ø 1.25 pro Monosaccharid, • erhöhte Wasserlöslichkeit (anionischer Polyelektrolyt) • Gewinnung aus tierischen Organen (v. a. Leber, gr. hepar) • als Natrium-Salz (Heparin-Natrium): Injektionslösungen, Salben, Zäpfchen • oral unwirksam Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 322 16.3 Derivate der Phosphorsäure pKS1: 2.0 pKS2: 7.2 „physiologische“ Bedingungen: Mono- und Diester als Anionen „Phosphate“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 323 16. 16.3 Derivate anorganischer Säuren Derivate der Phosphorsäure • Phosphate sind sehr gut wasserlöslich; hydrophil • Phosphate sind unter nicht enzymatischen Bedingungen hydrolysestabil • Phosphorsäure und Phosphate bilden energiereiche „Anhydride“ O R O P O OH HO O P OH HO O O R O P O R O OH R O P O P P P O O O R O O P P O O O O O O P O P P O OH HO P OH O "Diphosphat" OH O P "Triphosphat" Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 324 16. 16.3 Derivate anorganischer Säuren Derivate der Phosphorsäure Phospholipide: Lecithin H H P H C OH H C OH O O CH2 HO P H C OH H C OH O Glycerin-3-phosphat CH 2 O O C H2C hydrophil HC O O O lipophil C O (H 3C)3N H 2C H2C O P O CH 2 O Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 325 16. 16.3 Derivate anorganischer Säuren Derivate der Phosphorsäure z. B. Transport nicht membrangängiger Stoffe Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 326 16. 16.3 Derivate anorganischer Säuren Derivate der Phosphorsäure Vesikel, Liposomen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie Zellmembranen 327 17. Nucleoside, Nucleotide und Nukleinsäuren Heterocyclische Basen: Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 328 17. Nucleoside, Nucleotide und Nukleinsäuren Nucleoside: heterocyclische Base + (Desoxy)Ribose NH2 NH2 HOH2C O N OH N + OH OH b-D-Ribofuranose N H N [H+ ], - H2O 5' HOH2C O b N 1' N Adenin N N 3' OH OH Adenin-b-N-D-ribofuranosid, "Adenosin", in RNA, ATP usw. Nucleotide: Nucleosid-Phosphat • in DNA / RNA • Energieüberträger • Cosubstrate für Redoxreaktionen • … für Phosphorylierungsreaktionen • Botenstoffe („second messenger“) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 329 17. Nucleoside, Nucleotide und Nukleinsäuren Adenosin-Phosphate als Energiespeicher • kontrollierte Energieabgabe (enzymatisch) • Kopplung mit Energie verbrauchenden Prozessen (oder umgekehrt) • Phosphatgruppen übertragende Reagenzien und Reaktionen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 330 17. Nucleoside, Nucleotide und Nukleinsäuren NAD(P)+ / NAD(P)H: Nicotinamid-adenin-dinucleotid-(phosphat) Coenzym der Dehydrogenasen: O NH2 N H2N O N O OH HO O O P O O - N P O O Ribose Diphosphat N O - OH Nicotinamid N O(OPO32-) Ribose(-2'-phosphat) Adenin Adenosin(2'-phosphat) O H O +2e H2N H H + H H 2N N Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie N 331 17. Nucleoside, Nucleotide und Nukleinsäuren Heterocyclische Basen: in RNA in DNA NH2 N N H N N Adenin (A) O N N H NH Guanin (G) NH2 N NH 2 N N H Cytosin (C) O O O H 3C NH N H Uracil (U) NH Thymin (T) O Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie N H O 332 17. Nucleoside, Nucleotide und Nukleinsäuren Nucleoside in RNA in DNA NH2 N NH2 N N N Adenosin (A) N HO N O H H H OH H OH H H N NH N O H H OH H OH NH 2 N N N H NH2 O H OH O N OH H OH HO O H H OH H OH O H H NH N O O O H NH 2 N Cytidin (C) HO H NH H N H OH HO NH2 O H O H Guanosin (G) N HO N O H O N HO N HO Uridin (U) O H OH 2'-DesoxyThymidin (T) H3C N HO Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie NH O O H H OH H 333 17. Nucleoside, Nucleotide und Nukleinsäuren Nucleotide in RNA in DNA Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 334 17. Nucleoside, Nucleotide und Nukleinsäuren Nucleinsäuren Ribonucleinsäure (RNA) Desoxyribonucleinsäure (DNA) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 335 17. Nucleoside, Nucleotide und Nukleinsäuren Basenpaarung: nur in DNA Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 336 17. Nucleoside, Nucleotide und Nukleinsäuren DNA-Doppelhelix • • • • T A C G G C G C T A A T Doppelhelixmodell der DNA postuliert von Watson und Crick, 1953 Nobelpreis für Physiologie und Medizin, 1962 Weiß unterlegt: Gerüst aus Zucker und Phosphorsäurediester Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 337 17. Nucleoside, Nucleotide und Nukleinsäuren Nucleinsäuren Ribonucleinsäure (RNA) • fast nur als Einzelstrangmolekül • sehr verschiedenartige Raumstrukturen • RNA-Polynucleotide sind recht unterschiedlich lang, im Vergleich zur DNA kurz (einige Tausend Nucleotide) Desoxyribonucleinsäure (DNA) • Jeweils zwei Polynucleotidstränge winden sich um eine gemeinsame Achse • Stränge werden durch H-Brücken zwischen den Basen zusammengehalten • DNA-Polynucleotide sind sehr lang: • Bakterien: ~2 x 106; • Mensch: 3.2 x 109 Basenpaare Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 338 17. Nucleoside, Nucleotide und Nukleinsäuren Die DNA und der genetische Code • Basentripletts codieren für eine bestimmte Aminosäure • Tripletts als Start- oder Stopp-Codons • Genomforschung: • 2001 Sequenzierung des Humangenoms mit 3.2 x 109 Basenpaaren „Genomics“ • 30.000 – 40.000 Gene ? Zuordnung zu ihrer Funktion ? Regulierung ? Differenzierung „Proteomics“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 339 17. Nucleoside, Nucleotide und Nukleinsäuren Replikation der DNA • DNA kann Information speichern • Die beiden Einzelstränge sind komplementär gebaut (wie Positiv / Negativ) • Die Information lässt sich kopieren (Replikation) • Der Doppelstrang wird aufgetrennt und durch Anlagerung komplementärer Nucleotide identisch verdoppelt. • Die Information kann abgelesen werden und über Botenstoffe aus dem Zellkern ins Cytoplasma gebracht werden, z. B. Transkription auf RNA zur Proteinbiosynthese (Translation) Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 340 17. Nucleoside, Nucleotide und Nukleinsäuren Die DNA als Target für Medikation: NH2 O F N NH N HO N H O NH O N O O 5-Fluoruracil Einbau statt Thymidin Krebs-Chemotherapie Nebenwirkungen N N H H N3 H Azidothymidin verhindert bei Retroviren (HIV) das Umschreiben von RNA in DNA; verzögert Ausbreitung von HIV; Nebenwirkungen O NH2 OH Aciclovir Guanosin-Derivat verhindert DNA-Replikation in von Herpes simplex (HSV) infizierten Zellen Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 341 Übungsfragen Welche Aussage zum abgebildeten Ausschnitt aus einer Nucleinsäurekette trifft nicht zu? A□ Es handelt sich um einen Ausschnitt der DNA. B□ Die Base ist ein Pyrimidinderivat. C□ Die Base heißt Thymin. D□ Nucleinsäuren enthalten energiereiche Phosphorsäureanhydridbindungen. E□ Die abgebildete Nucleinsäure enthält 2-Desoxy-D-Ribose. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 342 Übungsfragen Welche Aussage zur Basenpaarung von Nucleinsäuren trifft zu ? A□ Bei der Basenpaarung werden Wasserstoffbrücken zwischen zwei gegenüberliegenden Purinbasen ausgebildet. B□ Für eine korrekte Basenpaarung müssen Thymin, Cytosin und Guanin in der Lactam-(Keto-)Form vorliegen. Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 343 Übungsfragen Welche Aussage zu Harnstoff und Guanidin trifft nicht zu? A□ Wässrige Harnstoff-Lösungen reagieren neutral. B□ Wässrige Guanidin-Lösungen reagieren basisch. C□ Harnstoff und Guanidin sind Moleküle mit einem C-Atom. D□ Ein Harnstoffrest ist im Ornithin enthalten. E□ Biotin ist formal ein zyklisches Harnstoffderivat. COOH H2N C H NH Arginin NH2 Arginase HN C H O O H + C COOH H2N NH2 Ornithin NH 2 NH2 O HN NH H H (+)-Biotin (Vitamin H) Eigelb, Hefe fördert Wachstum von Microorganismen S HOOC Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 344 Weitere biologisch/medizinisch relevante Verbindungen 18. Steroide Terpene, „Isoprenoide“ Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 345 18. Steroide Steroid-Biosynthese Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 346 18. Steroide Cholesterin Cholesterinabkömmlinge Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 347 18. Steroide Sexualhormone Contraceptiva H3C OH C C H H3C C C H H H H OH H H H H 3CO O "Norethynodrel" "Mestranol" Prof. Dr. A. Speicher - Chemie für Mediziner - Organische Chemie 348