8 Glycosidaseinhibierung durch Calystegine
Werbung
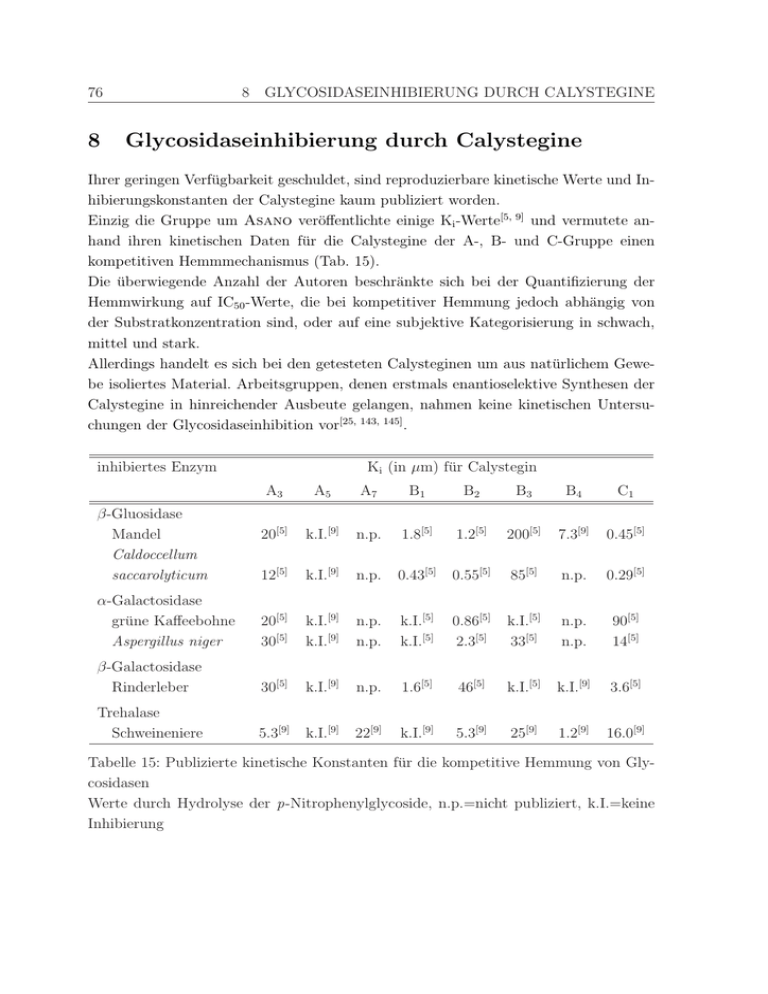
76 8 8 GLYCOSIDASEINHIBIERUNG DURCH CALYSTEGINE Glycosidaseinhibierung durch Calystegine Ihrer geringen Verfügbarkeit geschuldet, sind reproduzierbare kinetische Werte und Inhibierungskonstanten der Calystegine kaum publiziert worden. Einzig die Gruppe um Asano veröffentlichte einige Ki -Werte[5, 9] und vermutete anhand ihren kinetischen Daten für die Calystegine der A-, B- und C-Gruppe einen kompetitiven Hemmmechanismus (Tab. 15). Die überwiegende Anzahl der Autoren beschränkte sich bei der Quantifizierung der Hemmwirkung auf IC50 -Werte, die bei kompetitiver Hemmung jedoch abhängig von der Substratkonzentration sind, oder auf eine subjektive Kategorisierung in schwach, mittel und stark. Allerdings handelt es sich bei den getesteten Calysteginen um aus natürlichem Gewebe isoliertes Material. Arbeitsgruppen, denen erstmals enantioselektive Synthesen der Calystegine in hinreichender Ausbeute gelangen, nahmen keine kinetischen Untersuchungen der Glycosidaseinhibition vor[25, 143, 145] . inhibiertes Enzym Ki (in µm) für Calystegin A3 A5 A7 B1 B2 B3 B4 C1 20[5] k.I.[9] n.p. 1.8[5] 1.2[5] 200[5] 7.3[9] 0.45[5] 12[5] k.I.[9] n.p. 0.43[5] 0.55[5] 85[5] n.p. 0.29[5] α-Galactosidase grüne Kaffeebohne Aspergillus niger 20[5] 30[5] k.I.[9] k.I.[9] n.p. n.p. k.I.[5] k.I.[5] 0.86[5] 2.3[5] k.I.[5] 33[5] n.p. n.p. 90[5] 14[5] β-Galactosidase Rinderleber 30[5] k.I.[9] n.p. 1.6[5] 46[5] k.I.[5] k.I.[9] 3.6[5] Trehalase Schweineniere 5.3[9] k.I.[9] 22[9] k.I.[9] 5.3[9] 25[9] 1.2[9] 16.0[9] β-Gluosidase Mandel Caldoccellum saccarolyticum Tabelle 15: Publizierte kinetische Konstanten für die kompetitive Hemmung von Glycosidasen Werte durch Hydrolyse der p-Nitrophenylglycoside, n.p.=nicht publiziert, k.I.=keine Inhibierung 8.1 Mikrotiterplattenassay 8.1 77 Mikrotiterplattenassay Glycosidasen beschränken ihre katalytische Wirkung nicht ausschließlich auf natürliche Glycoside[141, 32, 92] . Synthetische, kommerziell erhältliche Glycoside, deren Aglycon im UV/VIS-Bereich absorbiert, eignen sich für eine photometrische Bestimmung der enzymatischen Aktivität von Glycosidasen. Durch enzymatische Hydrolyse von 4-Nitrophenyl-glycosiden entstehendes 4-Nitrophenol absorbiert im Bereich von 400-415 nm und kann photometrisch gut quantitativ bestimmt werden (Abb. 59). Bei Annahme einer einfachen Michaelis-Menten-Kinetik können die KM -Konstanten der Glycosidasen auf diese Weise einfach bestimmt werden (Abb. 58). Mit dieser Methode lassen sich natürlich auch Hemmwirkungen kompetitiver Inhibitoren auf die enzymatische Aktivität der Glycosidasen quantifizieren. Abbildung 58: Reaktionsschema des Michaelis-Menten-Modells einer kompetitiven Hemmung; Ki = [E][I] und KM = kk−1 + kk21 = KS + kk21 [EI] 1 NO2 NO2 CH2OH O HOHO CH2OH β-Glucosidase O O + H2O + HO HO OH OH OH OH Abbildung 59: Enzymatische Hydrolyse von p-Nitrophenyl-β-D-glucosid durch βGlucosidase 78 8 GLYCOSIDASEINHIBIERUNG DURCH CALYSTEGINE Das in unserer Arbeitsgruppe entwickelte High Throughput Screening - System (HTSSystem) ist ein vielseitig einsetzbarer Absorptionsassay für Mikrotiterplatten mit 96 Kavitäten, der eine schnelle Optimierung der Hydrolysebedingungen (pH-Wert, Konzentration, Temperatur usw.) ermöglicht. Mit Hilfe dieses Assays wird die enzymatische Hydrolyse von 4-Nitrophenyl-glucosiden mit β-Glucosidase bzw. α-Glucosidase im Natriumacetatpuffer (50 mM) bei λ=415 nm in Anwesenheit der Calystegine photometrisch verfolgt. Die Bestimmung des Extinktionsmaximums des 4-Nitrophenols erfolgt bei einem pHWert von 6, um optimale Bedingungen für die enzymatische Umsetzung zu gewährleisten. Da sowohl Substrat als auch Aglycon im UV-Bereich absorbieren, kann eine Quantifizierung über das 4-Nitrophenol nur im UV/VIS-Spektrum erfolgen (Abb. 60). 3,5 3,0 Natriumacetatpuffer; pH 6 Natriumacetatpuffer; pH 5 Extinktion 2,5 2,0 1,5 1,0 0,5 0,0 300 325 350 375 400 425 450 475 500 Wellenlänge in nm Abbildung 60: UV/VIS-Spektrum von 4-Nitrophenol im Natriumacetatpuffer Um die Inhibitoraktivitäten der Calystegine quantifizieren zu können, werden vier oder mehr Substratkonzentrationen (0,5 mM, 0,67 mM, 1,0 mM und 2,0 mM; 4-Nitrophenylglucosid) mit jeweils vier verschiedenen Inhibitorkonzentrationen vermessen. Die Konzentrationen der Calystegine wurde abhängig von ihrer Aktivität variiert. Aus den gemessenen Zeit-Umsatz-Kurven können die Inhibitorkonstanten (Ki ) der Calystegine durch Lineweaver-Burk-bzw. Dixon-Auftragungen ermittelt werden. Diese Ki Werte weisen gegenüber häufig publizierten IC50 -Werten den Vorteil der Substratkonzentrationsunabhängigkeit auf. 8.2 Kompetitive Hemmung der Mandel-β-Glucosidase 8.2 79 Kompetitive Hemmung der Mandel-β-Glucosidase Bei dem verwendeten Enzym handelt es sich um die β-Glucosidase der Mandel (14.3 U/mg; EC 3.2.1.21). Die Michaelis-Konstante der β-Glucosidase unter den genannten Bedingungen beträgt KM =2.5 mM. In der Literatur wurden bislang Werte von 2.5 mM[35] und 3.6 mM[5, 9] veröffentlicht. 1,2 Konzentration Calystegin B2 0 µM 2 µM 4 µM 6 µM 8 µM 1,0 OD 0,8 0,6 0,4 0,2 0,0 0 200 400 600 800 1000 1200 1400 t in s Abbildung 61: Enzymatische Hydrolyse einer 2 mM 4-Nitrophenyl-β-D-glucopyranosidlösung bei verschiedenen Calystegin B2 Konzentrationen durch β-Glucosidase der Mandel Alle sechs synthetisierten Calystegine wurden auf ihre Hemmaktivitäten bezüglich der Mandel-β-Glucosidase untersucht, um die jeweilige Inhibitorkonstante Ki zu bestimmen. Die Ergebnisse werden in Tabelle 16 aufgeführt. In Abb. 61 wird die exzellente Hemmwirkung des Calystegins B2 auf die β-Glucosidase schon bei sehr geringen Konzentrationen im mikromolekularen Bereich veranschaulicht. Calystegin B2 ist der potenteste Hemmer der Mandel-β-Glucosidase unter den hier vermessenen Calysteginen mit einem Ki -Wert von 5.9 µM. Es gehört folglich zu den stärksten bekannten β-Glucosidase-Hemmern, da bisher noch keine Ki -Werte < 1 µM veröffentlicht wurden. Calystegin B4 und das fluorierte Calystegin B2 sind ebenfalls gute β-GlucosidaseInhibitoren mit Ki -Werten im unteren mikromolekularen Bereich. 80 8 GLYCOSIDASEINHIBIERUNG DURCH CALYSTEGINE Calystegin Ki Enzymkonz. pro well B2 19 B4 38 3-Desoxy-3-F-B2 70 B3 29 A7 54 3-epi-B2 80 5.9 µM 15.2 µM 82 µM 320 µM 2.1 mM k.I. 0.22165 0.24525 0.24310 0.24453 0.22166 0.21879 u/ml u/ml u/ml u/ml u/ml u/ml Inhibitorkonzentration 0; 2; 4; 6; 8 µM 0; 6; 12; 18; 24 µM 0; 42; 84; 168; 252; 336 µM 0; 0.1; 0.2; 0.4; 0.6 mM 0; 1.5; 3.0; 4.5; 6.0 mM 0; 1; 5; 10 mM Tabelle 16: ermittelte Ki -Werte der Calystegine für Mandel-β-Glucosidase Werte durch Hydrolyse der p-Nitrophenylglycoside, k.I.=keine Inhibierung Eine mittlere Stellung mit einem Ki -Wert von 320 µM nimmt das Calystegin B3 ein. Der schlechteste Inhibitor mit einer Inhibierungskonstanten von 2.1 mM ist das Calystegin A7 1/v0 (mM/min) -1 30 Konzentration Calystegin B2 0 µΜ 2 µΜ 4 µΜ 6 µΜ 8 µΜ 20 10 0 0,0 0,5 1,0 1/[S] (mM) 1,5 2,0 -1 Abbildung 62: Lineweaver-Burk-Auftragung der Calystegin B2 -Inhibierung von Mandel-β-Glucosidase Calystegin 3-epi-B2 verfügt über keinerlei Inhibitor-Aktivitäten (Abb. 64; S.82). Wobei die experimentellen Werte nicht ganz eindeutig sind. So erhöht sich bei einer Inhibitorkonzentration von 1 mM die Umsatzgeschwindigkeit, während bei höheren Konzentrationen die Produktentwicklung leicht gehemmt wird. Eine Erklärung könnte die 8.2 Kompetitive Hemmung der Mandel-β-Glucosidase 81 Substratkonz. 0.5 mM 1.0 mM 2.0 mM 70 60 1/v0 (mM/min)-1 50 40 30 20 10 0 -0,1 0,0 -Ki 0,1 0,2 0,3 [I] mM Abbildung 63: Dixon-Auftragung der Calystegin 3-Desoxy-3-fluor-B2 -Inhibierung von Mandel-β-Glucosidase ungewöhnliche axiale Stellung der OH-Gruppe an C3 sein, welche eine Bindung an dem aktiven Zentrum des Enzyms erschwert. Die Möglichkeit einer nicht-kompetetiven Hemmung kann ebenfalls nicht ausgeschlossen werden. Zudem erreicht die Inhibitorkonzentration bei diesem Versuch eine Größenordnung, die trotz eines 50 mM Puffers geringfügig den pH-Wert der Lösung und damit das Absorptionsverhalten des 4-Nitrophenols zu verändern vermag. Die in dieser Arbeit ermittelten Ki -Werte der bekannten natürlichen Calystegine sind allesamt niedriger als die von Asano veröffentlichten[5, 9] , bewegen sich aber in einer Größenordnung. Die Gründe hierfür sind vielfältiger Natur. Zum einen ist der von Asano publizierte KM -Wert der Glycosidase von 3.6 mM größer als der hier ermittelte von 2.5 mM. Somit ist die von Asano verwendete Mandel-β-Glucosidase weniger aktiv bzw. spezifisch. Desweiteren wurden die veröffentlichten Ki -Werte durch Endpunktbestimmungen ermittelt, wodurch Anfangsgeschwindigkeiten nicht direkt aus den Messdaten zugänglich sind und somit die Ergebnisse fehleranfälliger sind. Zudem handelt es sich bei den Calysteginen um isoliertes Material, welches mit anderen, ebenfalls im Pflanzenextrakt enthaltenen, Substanzen, die über ähnliche physikalische und chemische Eigenschaften verfügen, verunreinigt sein kann. Diese Verunreinigungen können schon in extrem niedrigen Konzentrationsbereichen über signifikante inhibito- 82 8 GLYCOSIDASEINHIBIERUNG DURCH CALYSTEGINE Konzentration Calystegin 3-epi-B2 1,6 0 mM 1 mM 5 mM 10 mM 1,4 1,2 OD 1,0 0,8 0,6 0,4 0,2 0,0 0 200 400 600 800 1000 1200 1400 t in s Abbildung 64: Enzymatische Hydrolyse einer 2 mM 4-Nitrophenyl-β-D-glucopyranosidlösung bei verschiedenen Calystegin 3-epi-B2 Konzentrationen durch βGlucosidase der Mandel rische Aktivitäten verfügen und folglich die Messwerte verfälschen. 8.3 Struktur-Wirkung-Beziehung Der Wirkmechanismus der β-Glucosidase ist noch unbekannt. Man vermutet allerdings eine saure Katalyse, die von einer aciden Gruppe innerhalb des aktiven Zentrums unterstützt wird. Es wird gemeinhin angenommen, dass die biologisch aktiven Calystegine deswegen über eine große Affinität zur β-Glucosidase verfügen, weil sie nicht nur an der Stelle, welche die Spezifität für das Glycon festlegt, binden, sondern auch wegen der Säure-BaseWechselwirkungen der Iminogruppe des Calystegins mit der Säurefunktion innerhalb des aktiven Zentrums. Asano et al. nahmen an, dass die äquatoriale Hydroxylgruppe an C4 die Affinität zur Glycosyl-Kationen-Bindungsstelle erhöht und eine äquatoriale OH-Funktion an C2 ein essentielles Merkmal für die Erkennung bzw. starke Bindung an das aktive Zentrum von Glycosidasen sei[5] . Die hier präsentierten Ergebnisse können nicht auf derartig einfache kausale Zusammenhänge reduziert werden. Offensichtlich tragen eine Vielzahl von strukturellen Merkmalen zur Stärke und Spezifität der Glycosidase-Hemmung durch Calystegine bei. 8.4 Kompetitive Hemmung der Hefe-α-Glucosidase 83 Um die strukturellen Anforderungen der Glycosidase-Inhibierung verstehen zu können, müssen weitere Isomere der Calystegine zugänglich gemacht und getestet werden. 8.4 Kompetitive Hemmung der Hefe-α-Glucosidase Die α-Glucosidase der Hefe (EC 3.2.1.20) ist mit einem gemessenen KM -Wert von 0.27 mM ein aktiveres und spezifischeres Enzym als die β-Glucosidase der Mandel mit KM =2.5 mM. Die Affinität der getesteten Calystegine zur α-Glucosidase ist ungleich geringer als zur β-Glucosidase. Weder Calystegin B2 (Abb. 65), noch sein fluoriertes Analogon Calystegin 3-Desoxy-3-fluor-B2 (Abb. 66) sind in der Lage die Hydrolyse der pNitrophenylglycoside durch die α-Glucosidase der Hefe signifikant zu hemmen. Die Konzentrationen der Calystegine wurde bei diesen Tests, im Vergleich zur Inhibierung der β-Glucosidase, um den Faktor 10-40 erhöht. Eine Effekt auf die Enzymaktivität blieb allerdings auch bei diesen hohen Konzentrationen aus (Tab. 17). 1,4 Konzentration Calystegin B2 1,2 0 µM 100 µM 150 µM 250 µM 1,0 OD 0,8 0,6 0,4 0,2 0,0 0 200 400 600 800 1000 1200 1400 t in s Abbildung 65: Enzymatische Hydrolyse einer 2 mM 4-Nitrophenyl-α-D-glucopyranosidlösung bei verschiedenen Calystegin B2 Konzentrationen durch α-Glucosidase der Hefe Warum die Calystegine im Gegensatz zu guten α-Glucosidase-Inhibitoren wie 1-Desoxynojirimycin oder Castanospermin nicht in der Lage sind die enzymatische Hydrolyse von α-Glucosiden zu hemmen, bleibt ungeklärt. Sterische Ursachen können ebenso aus- 84 8 GLYCOSIDASEINHIBIERUNG DURCH CALYSTEGINE Calystegin Ki Enzymkonz. pro well B2 19 3-Desoxy-3-fluor-B2 70 k.I. k.I. 0.22165 u/ml 0.24310 u/ml Inhibitorkonzentration 0; 100; 150; 200; 250 µM 0; 0.84; 1.26; 1.68; 2.1 mM Tabelle 17: Ermittelte Ki -Werte der Calystegine für Hefe-α-Glucosidase Werte durch Hydrolyse der p-Nitrophenylglycoside, k.I.=keine Inhibierung geschlossen werden, wie die räumliche Anordnung der drei benachbarten Hydroxylgruppen, welche bei allen zuvor erwähnten Verbindungen identisch ist. Die Unterschiede in der Affinität zur α-Glucosidase müssen andere, z.Z. noch unbekannte Ursachen haben. 1,4 Konzentration Calystegin 3-Desoxy-3-fluor-B2 0 mM 0.84 mM 2.10 mM 1,2 1,0 OD 0,8 0,6 0,4 0,2 0,0 0 200 400 600 800 1000 1200 1400 t in s Abbildung 66: Enzymatische Hydrolyse einer 2 mM 4-Nitrophenyl-α-D-glucopyranosidlösung bei verschiedenen Calystegin 3-Desoxy-3-fluor-B2 Konzentrationen durch α-Glucosidase der Hefe

