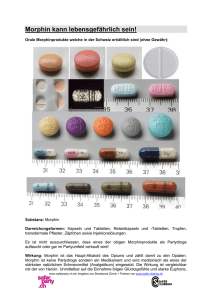
Der Einfluss verschiedener Morphinderivate auf den thermischen
Werbung

Paula Dönselmann im Sande Der Einfluss verschiedener Morphinderivate auf den thermischen nozizeptiven Schwellenwert beim Pferd Cuvillier Verlag Göttingen Internationaler wissenschaftlicher Fachverlag Bibliografische Information der Deutschen Nationalbibliothek Die Deutsche Nationalbibliothek verzeichnet diese Publikation in der Deutschen Nationalbibliografie; detaillierte bibliografische Daten sind im Internet über http://dnb.d-nb.de abrufbar. 1. Aufl. - Göttingen : Cuvillier, 2013 Zugl.: Hannover (TiHo), Univ., Diss., 2013 978-3-95404-402-3 © CUVILLIER VERLAG, Göttingen 2013 Nonnenstieg 8, 37075 Göttingen Telefon: 0551-54724-0 Telefax: 0551-54724-21 www.cuvillier.de Alle Rechte vorbehalten. Ohne ausdrückliche Genehmigung des Verlages ist es nicht gestattet, das Buch oder Teile daraus auf fotomechanischem Weg (Fotokopie, Mikrokopie) zu vervielfältigen. 1. Auflage, 2013 Gedruckt auf säurefreiem Papier 978-3-95404-402-3 Tierärztliche Hochschule Hannover Der Einfluss verschiedener Morphinderivate auf den thermischen nozizeptiven Schwellenwert beim Pferd INAUGURAL – DISSERTATION Zur Erlangung des Grades einer Doktorin oder eines Doktors der Veterinärmedizin - Doctor medicinae veterinariae ( Dr. med. vet. ) vorgelegt von Paula Dönselmann im Sande Hildesheim Hannover 2013 Wissenschaftliche Betreuung: Prof. Dr. S. Kästner, Klinik für Pferde 1. Gutachter: Prof. Dr. S. Kästner 2. Gutachter: Prof. Dr. K. Huber Tag der mündlichen Prüfung: 13.05.2013 Meiner Familie Inhaltsverzeichnis Inhaltsverzeichnis 1 Einleitung........................................................................................................... 11 2 Literaturübersicht............................................................................................... 13 2.1 Schmerz ..................................................................................................... 13 2.1.1 Schmerzwahrnehmung und Funktion des Schmerzes.......................... 13 2.1.2 Physiologie der Schmerzweiterleitung .................................................. 13 2.1.2.1 Transduktion................................................................................... 14 2.1.2.2 Transmission und Modulation......................................................... 15 2.1.2.3 Projektion und Perzeption .............................................................. 15 2.1.2.4 Die Gate Control Theory................................................................. 16 2.1.3 Pathologie des Schmerzes ................................................................... 17 2.1.3.1 Entzündlicher und neuropathischer Schmerz ................................. 17 2.1.3.1.1 Periphere Sensibilisierung ........................................................ 17 2.1.3.1.2 Zentrale Sensibilisierung........................................................... 18 2.1.4 2.2 Schmerzbeurteilung beim Pferd............................................................ 19 Nozizeptive Schwellenwerte....................................................................... 20 2.2.1 Ansprüche an die Messmethoden......................................................... 21 2.2.2 Modalitäten der nozizeptiven Stimulation.............................................. 21 2.2.2.1 Elektische Stimualtion .................................................................... 21 2.2.2.2 Mechanische Stimulation................................................................ 22 2.2.2.3 Thermostimulation.......................................................................... 23 2.2.3 2.3 Einflussfaktoren auf die Thermostimulation .......................................... 25 Opioide....................................................................................................... 26 2.3.1 Wirkmechanismus................................................................................. 26 2.3.2 Klassifizierung der Opioide ................................................................... 29 2.3.3 Unerwünschte Wirkungen ..................................................................... 30 2.3.3.1 Drangwandern und Verhaltensänderungen.................................... 30 2.3.3.2 Herz-Kreislauf System.................................................................... 30 2.3.3.3 Atmung ........................................................................................... 31 2.3.3.4 Gastrointestinaltrakt........................................................................ 31 2.3.3.5 Urogenitaltrakt ................................................................................ 32 2.3.4 Dosierung und Applikationsweg............................................................ 32 2.3.5 Morphin ................................................................................................. 33 Inhaltsverzeichnis 3 4 2.3.6 Levomethadon ...................................................................................... 34 2.3.7 Butorphanol........................................................................................... 34 Material und Methode........................................................................................ 36 3.1 Probanden.................................................................................................. 36 3.2 Versuchsaufbau ......................................................................................... 36 3.2.1 Instrumentierung ................................................................................... 36 3.2.2 Messvorgang ........................................................................................ 39 3.2.3 Vorbereitung der Pferde........................................................................ 40 3.2.4 Studiendesign ....................................................................................... 41 3.2.5 Beurteilung der Nebenwirkungen.......................................................... 41 3.2.6 Behandlungen....................................................................................... 43 3.2.7 Messzeitpunkte ..................................................................................... 44 3.2.8 Versorgung der Pferde nach Versuchsende ......................................... 45 3.2.9 Statistik ................................................................................................. 45 Ergebnisse ........................................................................................................ 47 4.1 Verhalten der Pferde während der Messungen .......................................... 47 4.2 Placebo-Behandlung .................................................................................. 47 4.2.1 Reaktion auf den thermischen Stimulus................................................ 47 4.2.2 Schwellenwerte..................................................................................... 47 4.2.3 Kotabsatz und Darmgeräusche............................................................. 48 4.2.4 Herzfrequenz und Atemfrequenz .......................................................... 48 4.3 Opioide in der niedrigen Dosierung ............................................................ 49 4.3.1 Reaktion auf den thermischen Stimulus................................................ 49 4.3.2 Kontroll-Messung .................................................................................. 49 4.3.3 Schwellenwerte nach Morphin–Applikation (0,1 mg/kg)........................ 49 4.3.4 Schwellenwerte nach Butorphanol-Applikation (0,1 mg/kg) .................. 50 4.3.5 Schwellenwerte nach Levomethadon-Applikation (0,1 mg/kg).............. 51 4.3.6 Die Schwellenwerte der drei Opioide im Vergleich (0,1 mg/kg) ............ 52 4.3.7 Verhalten der Pferde nach Injektion von Morphin, Butorphanol und Levomethadon (0,1 mg/kg)................................................................................ 53 4.3.8 Kotabsatz und Darmgeräusche............................................................. 54 4.3.9 Herzfrequenz und Atemfrequenz .......................................................... 56 4.4 Opioide in der hohen Dosierung................................................................. 56 4.4.1 Reaktion auf den thermischen Stimulus................................................ 56 Inhaltsverzeichnis 4.4.2 Kontroll-Messung .................................................................................. 57 4.4.3 Schwellenwerte nach Morphin–Applikation (0,2 mg/kg)........................ 57 4.4.4 Schwellenwerte nach Butorphanol-Applikation (0,2 mg/kg) .................. 58 4.4.5 Schwellenwerte nach Levomethadon-Applikation (0,2 mg/kg).............. 59 4.4.6 Die Schwellenwerte der drei Opioide im Vergleich (0,2 mg/kg) ............ 60 4.4.7 Verhalten der Pferde nach Injektion von Morphin, Butorphanol und Levomethadon (0,2 mg/kg)................................................................................ 61 5 4.4.8 Kotabsatz und Darmgeräusche............................................................. 62 4.4.9 Herzfrequenz und Atemfrequenz .......................................................... 64 4.5 Vergleichende Darstellung der Schwellenwerte in beiden Dosierungen .... 64 4.6 Hautirritationen nach der thermischen Stimulation ..................................... 67 Diskussion ......................................................................................................... 68 5.1 Methodik..................................................................................................... 68 5.1.1 Methode zur Bestimmung des nozizeptiven Schwellenwertes.............. 68 5.1.2 Medikamente und Dosierungen ............................................................ 72 5.2 Ergebnisse ................................................................................................. 73 5.2.1 Morphin ................................................................................................. 73 5.2.1.1 Einfluss von Morphin auf das Verhalten ......................................... 74 5.2.1.2 Einfluss von Morphin auf den Darmtrakt......................................... 75 5.2.1.3 Einfluss von Morphin auf die Atem– und Herzfrequenz.................. 75 5.2.2 Butorphanol........................................................................................... 76 5.2.2.1 Einfluss von Butorphanol auf das Verhalten................................... 77 5.2.2.2 Einfluss von Butorphanol auf den Darmtrakt .................................. 78 5.2.2.3 Einfluss von Butorphanol auf die Atem –und Herzfrequenz ........... 78 5.2.3 Levomethadon ...................................................................................... 79 5.2.3.1 Einfluss von Levomethadon auf das Verhalten .............................. 80 5.2.3.2 Einfluss von Levomethadon auf den Darmtrakt.............................. 81 5.2.3.3 Einfluss von Levomethadon auf die Atem –und Herzfrequenz ....... 81 5.2.4 Vergleich der Opioide ........................................................................... 82 5.2.5 Ausblick................................................................................................. 86 6 Zusammenfassung ............................................................................................ 88 7 Summary ........................................................................................................... 90 8 Literaturverzeichnis ........................................................................................... 92 Abkürzungsverzeichnis Abkürzungsverzeichnis Abb. Abbildung AM Arzneimittel B0,1 Butorphanol0,1 B0,2 Butorphanol0,2 DTI Dauertropfinfusion GABA Gamma-Amino-Buttersäure ggr. geringgradig hgr. hochgradig i.m. intramuskulär i.v. intravenös kg Kilogramm L0,1 Levomethadon0,1 L0,2 Levomethadon0,2 m Meter M0,1 Morphin0,1 M0,2 Morphin0,2 M3G Morphin-3-Glucuronid M6G Morphin-6-Glucuronid mg Milligramm mgr. mittelgradig Min. Minuten ml Milliliter mmHg Millimeter Quecksilbersäule MZP Messzeitpunkt NaCl Natriumchlorid NGF Nerve Groth Factor NMDA N-Methyl-D-Aspartat NSAID Nichtsteroidale Antiphlogistika P Placebo PaCO2 arterieller Kohlendioxidpartialdruck PaO2 arterieller Sauerstoffpartialdruck s Sekunde Abkürzungsverzeichnis SD Standardabweichung t Zeitpunkt Tab. Tabelle Temp. Temperatur TNF Tumornekrosefaktor VR1 Vanilloid-1-Rezeptor WTT2 Wireless Thermal Testing System Sonderzeichen: Į alpha ȕ beta į delta ț kappa ȝ mü % Prozent °C Grad Celsius > größer als < kleiner als Einleitung 1 Einleitung In den letzten Jahren kam es in der Veterinärmedizin zu einer vermehrten Forschung im Bereich der Schmerztherapie und gleichzeitig zu einem verstärkten Einsatz von Analgetika bei Tieren (DOHOO u. DOHOO 1996; CAPNER et al. 1999; LASCELLES et al. 1999; RAEKALLIO et al. 2003), wobei nur wenige Studien an Pferden durchgeführt wurden (RAEKALLIO et al. 1997b; TAYLOR et al. 2002; FLECKNELL 2008). Im Vergleich zu der Humanmedizin ist der Einsatz von Schmerzmitteln beim Pferd immer noch restriktiv. Dies ist zum Teil auf eine ungenügende Schmerzerkennung beim Pferd zurückzuführen (RAEKALLIO et al. 1997b; LE BARS et al. 2001). Aber auch wirtschaftliche Aspekte sowie potentielle unerwünschte Arzneimittelwirkungen werden als Gründe in der Literatur beschrieben (CAPNER et al. 1999; LASCELLES et al. 1999; DUCHARME 2000; PRICE et al. 2002; TAYLOR 2005; FLECKNELL 2008). Die potentielle Gefahr einer Überbelastung bei orthopädischen Erkrankungen oder die Maskierung des Krankheitsbildes aufgrund der Gabe von Analgetika kann als eine weitere Ursache für ein reduziertes Schmerzmanagement genannt werden (TAYLOR 2005). Wie wichtig der optimale Einsatz von Schmerzmitteln nicht nur in Hinblick auf die ethische Komponente, sondern auch in Bezug auf den Heilungsverlauf ist, konnte in mehreren humanmedizinischen Studien gezeigt werden (LIU et al. 1995; SINGELYN et al. 1998; CAPDEVILA et al. 1999). Bei Pferden führte die intraoperative Gabe von Morphin in einer Studie von CLARK et al. (2008) zu einer besseren Erholung sowie zu einer verkürzten Aufstehphase nach der Allgemeinanästhesie. Zudem konnte durch die prä- und intraoperative Gabe von Analgetika der postoperative Bedarf an Schmerzmitteln reduziert werden (MCQUAY et al. 1988; JOHNSON et al. 1993; CLARK et al. 2005). Auch bei der Entstehung von pathologischen Schmerzzuständen spielt das Schmerzmanagement eine wichtige Rolle (TAYLOR 2005). So kann die Entstehung von zentraler Sensibilisierung und einer damit verbundenen gesenkten Schmerzschwelle durch eine frühzeitige Versorgung mit Analgetika verhindert werden (RICHMOND et al. 1993; TAYLOR et al. 2002). Eine schmerz-assoziierte Appetitlosigkeit kann zu einer negativen Energiebilanz führen und somit nicht zuletzt das Immunsystem negativ beeinflussen (TAYLOR et al. 2002; TAYLOR 2005). 11 Einleitung Unter diesen Gesichtspunkten ist die weitere Erarbeitung effektiver Analgesieprotokolle, verbunden mit wissenschaftlich fundierten Dosisangaben und Dosierungsintervallen, essentiell, um das Schmerzmanagement beim Pferd weiter zu optimieren. Ziel dieser Studie ist es, mithilfe der Thermostimulation die analgetische Effektivität gebräuchlicher Dosierungen von Morphin, Butorphanol und Levomethadon beim Pferd zu vergleichen. Des Weiteren ist es das Ziel, eine mögliche Steigerung der analgetischen Effektivität nach Applikation einer höheren Dosierung von Morphin, Butorphanol und Levomethadon zu testen sowie mögliche Opioid-assoziierte Nebenwirkungen zu untersuchen. 12 Literaturübersicht 2 Literaturübersicht 2.1 Schmerz 2.1.1 Schmerzwahrnehmung und Funktion des Schmerzes Schmerz dient zum einen als eine Schutzfunktion und stellt zum anderen eine individuelle Wahrnehmung dar, so dass eine objektive Einschätzung sowie Beschreibung dieses Zustandes vor allem in der Veterinärmedizin nur schwer möglich ist (TAYLOR et al. 2002). Der Begriff Schmerz wird von der „International Association for the study of pain“ (IASP) als “unangenehmes Gefühl und emotionale Erfahrung verbunden mit tatsächlichen und potentiellen Gewebsschäden“ definiert. Eine Ergänzung für die Veterinärmedizin brachte der Zusatz von ZIMMERMANN (1986), der Schmerz bei Tieren als eine „aversive Empfindungserfahrung, verursacht durch aktuelle oder potentielle Verletzung (Schädigung), die ihrerseits schützende motorische und vegetative Reaktionen auslöst sowie erlerntes Meideverhalten bewirkt und das spezifische Artverhalten – einschließlich des Sozialverhaltens – modifizieren kann“ beschreibt. Nach dieser Definition vermittelt Schmerz neben der subjektiven, negativen Wahrnehmung gleichzeitig schützende Funktionen, indem der Schmerz das Individuum vor realen sowie vor potentiellen Gewebsschäden warnt. Trotz der genannten positiven, schützenden Aspekte verliert der Schmerz bei lang anhaltenden Schmerzzuständen sowohl beim Menschen als auch beim Tier seine physiologische Funktion und entwickelt sich zu einem pathologischen Zustand (HERRERO et al. 2000). 2.1.2 Physiologie der Schmerzweiterleitung Nozizeptoren liegen als freie Nervenendigungen in der Dermis. Sie werden durch schmerzhafte Stimuli aktiviert und bewirken eine Weiterleitung der noxischen Information über das Rückenmark in das Gehirn (BURGESS u. PERL 1967; MUIR u. WOOLF 2001). Dieser Prozess kann wie folgt in verschiedene Phasen unterteilt werden: 13 Literaturübersicht 2.1.2.1 Transduktion Die Transduktion von chemischen, thermischen oder mechanischen Stimuli erfolgt über Nozizeptoren in der Haut, wo sie in Aktionspotentiale umgewandelt werden (MUIR u. WOOLF 2001). Im Fall von noxischer Hitze kommt es zu einer Registrierung des Reizes über den Vanilloid-1-Rezeptor (VR1) (CATERINA et al. 1997; TOMINAGA et al. 1998). Dies führt zu einer Öffnung von Kationenkanälen, dem Einstrom von Kalzium und Kalium und einer nachfolgenden Depolarisation (HEYMAN u. RANG 1985; MARSH et al. 1987). Der Vanilloid-1-Rezeptor kann zudem über Capsaicin, ein Bestandteil der Chili-Schote, aktiviert werden (CATERINA et al. 1997). Durch Capsaicin kommt es nach Aufnahme von Chili-Schoten zu der Geschmackswahrnehmung der „Schärfe“. TOMINAGA et al. (1998) konnten eine Aktivierung des VR1 bei Temperaturen > 43 °C und na ch Einfluss von Capsaicin beobachten. CATERINA et al. (2000) untersuchten die Reaktion auf thermische Stimuli an knock-out Mäusen, denen der VR1 fehlt. Während die Antwort der knockout Mäuse auf mechanische Stimuli unverändert war, kam es zu einer verlängerten Reaktionszeit auf die thermischen Stimuli im Bereich von höheren Temperaturen. Die Reaktion auf niedrige Temperaturen war hingegen vergleichbar mit der Reaktion der Wildtyp Mäuse. Eine Senkung des pH-Wertes kann eine Sensibilisierung des VR1 zur Folge haben, so dass es schon bei niedrigeren Temperaturen zu einer Öffnung der Kationenkanäle kommt (TOMINAGA et al. 1998; JORDT et al. 2000). Der Einfluss weiterer, VR1-unabhängiger Mechanismen auf die Hitze-induzierte Schmerzleitung sollte jedoch in Betracht gezogen werden. Wie bereits erwähnt, dient die Aktivierung dieser Rezeptoren in der Haut dazu, den Organismus vor potentiell schädlichen Einflüssen zu schützen. Das bedeutet gleichzeitig, dass diese äußeren Einflüsse von einer bestimmten Intensität sein müssen, um die Nozizeptoren in der Haut zu aktivieren (BECK et al. 1974). Für den thermischen Stimulus ist hier von einer Temperatur >45 °C auszugehen (BECK et al. 1974). Die Nozizeptoren der Haut können in zwei Gruppen unterteilt werden: 14 Literaturübersicht C-Nozizeptoren: Die unmyelinisierten C-polymodalen Fasern reagieren auf Hitze (<40-45 °C), Druck und chemische Reize und gehören zu den langsam leitenden Fasern (<1,4 m/s) (BECK et al. 1974; LYNN u. CARPENTER 1982; HARPER u. LAWSON 1985). Ihnen wird der längere „brennende“ Schmerz zugeordnet (JULIUS u. BASBAUM 2001). Aį- Nozizeptoren: Die dünn-myelinisierten Aį-mechanoheat Nozizeptoren werden vor allem durch Hitze (>45 °C) und Druck aktiviert (BECK et al. 1974). Ih re Leitungsgeschwindigkeit liegt deutlich über der der C-Rezeptoren (2,2-8 m/s) (HARPER u. LAWSON 1985) und sie vermitteln den sogenannten kurzen „scharfen“ Schmerz (JULIUS u. BASBAUM 2001; BECK et al. 1974; TOREBJORK u. OCHOA 1990). Für die Vermittlung von nicht-noxischen Stimuli sind die myelinisierten, schnell leitenden Aȕ-Fasern zuständig (XU u. LU 2011). 2.1.2.2 Transmission und Modulation Die Nozizeptoren leiten als primäre afferente Fasern das Signal über die dorsale Wurzel weiter in das Rückenmark (MUIR u. WOOLF 2001). Hier enden sie in sekundären Neuronen, die wiederum in drei Gruppen unterteilt werden können (CRAIG 2003). Die nozizeptiv-spezifischen Zellen reagieren ausschließlich auf noxische Stimuli, während die low-threshold Neuronen auf nicht-noxische Stimuli antworten. Zudem findet man wide-dynamic-range (WDR) Neuronen, die auf beide Arten von Stimuli ansprechen (CLARK u. CLARK 1999; RICE u. JUSTINS 1999). Als Folge der nozizeptiven Aktivität setzen die afferenten Fasern verschiedene Neurotransmitter frei (DICKENSON 1995) und tragen somit zur Transmission des nozizeptiven Signals bei (RICE u. JUSTINS 1999). Dazu gehören Glutamat und Neuropeptide wie Substanz P und Neurokinin A (BATTAGLIA u. RUSTIONI 1988; DUGGAN et al. 1988). Im Rückenmark findet eine Modulation und Weiterleitung der Signale an das Gehirn statt (RICE u. JUSTINS 1999). (siehe Kap. 2.1.2.4 „Die Gate Control Theory“) 2.1.2.3 Projektion und Perzeption Das Gehirn besteht aus einer Vielzahl von Hirnarealen, die im Zusammenspiel zur Schmerzwahrnehmung führen und diese auch beeinflussen (CLARK u. CLARK 15 Literaturübersicht 1999). Über den Tractus spinothalamicus werden die nozizeptiven Informationen zuerst in den Thalamus geleitet, um von hier in weitere Areale wie das limbische System und den somatosensorischen Kortex zu gelangen (CLARK u. CLARK 1999; PRICE 2000; WOOLF u. MAX 2001; APKARIAN et al. 2005). 2.1.2.4 Die Gate Control Theory Die im Rückenmark stattfindende Interaktion, auch als „Gate Control Theory“ bezeichnet, wurde 1965 von MELZACK und WALL erstmals beschrieben. Obwohl sie in ihren Grundzügen auch heute noch Gültigkeit besitzt, muss angemerkt werden, dass die „Gate Control Theory“ die Mechanismen der Schmerzmodulation sehr vereinfacht darstellt und viele komplexe Vorgänge unberücksichtigt lässt (SUFKA u. PRICE 2002). Während die Aį- und C-Fasern noxische Informationen zum Rückenmark leiten, sind die dickeren Aȕ Fasern für die Vermittlung der nicht-noxischen Stimuli zuständig (XU u. LU 2011). Erreichen die Informationen der Aį- und C-Fasern die Substantia gelantinosa im Rückenmark, kommt es zu einer Hemmung inhibierender Neurone. Die Aȕ-Fasern vermitteln hingegen eine Aktivierung der inhibierenden Neuronen in der Substantia gelatinosa (WALL 1978; MELZACK 1996; SANDKÜHLER 1996). Da diese inhibierenden Neuronen einen hemmenden Einfluss auf die Transmissionszellen haben, können sie die Weiterleitung von Informationen an das Gehirn unterbrechen. Wird der Einfluss der inhibierenden Neuronen auf die Transmissionszellen unterbrochen, öffnet sich das „Tor“ und nozizeptive Informationen gelangen auf die supraspinale Ebene (MELZACK 1996). Das bedeutet, dass die Aktivität der Aȕ-Fasern das „Tor“ geschlossen hält, während die Aį- und C-Fasern eine Öffnung des „Tores“ hervorrufen können (XU u. LU 2011). Erst wenn die Transmissionszellen ein gewisses Level an Aktivität erreicht haben, wird ein zentrales Aktionssystem, bestehend aus verschiedenen neuralen Strukturen, aktiviert (MELZACK 1996; SUFKA u. PRICE 2002). Ein weiterer inhibierender Einfluss geht von deszendierenden Bahnen aus, die ihren Ursprung im Gehirn haben und hemmend auf die Transmissionszellen einwirken. (MELZACK et al. 1958; WALL 1978; GJERSTAD et al. 2001). Das periaquäduktale Grau spielt hierbei eine zentrale Rolle; absteigend steht es in Verbindung mit der Formatio reticularis und dem Nucleus raphe magnus im Bereich der rostroventralen Medulla, von wo aus die inhibitorische Wirkung auf das Dorsalhorn des Rückenmarks 16 Literaturübersicht und eine aktivierende Wirkung auf inhibitorische Interneurone ausgeübt wird (GEBHART u. OSSIPOV 1986; HEINRICHER et al. 2009). Die elektrische Stimulation dieser Hirnareale führt dementsprechend zu einem Ausbleiben der Schmerzantwort auf noxische Stimuli (MAYER et al. 1971; JURNA 1980). Die deszendierenden Bahnen wirken jedoch nicht nur inhibitorisch, sondern auch erregend, wobei diese beiden Pole physiologischer Weise in einem ausgewogenen Verhältnis zueinander stehen (ZHUO u. GEBHART 1990). Ein Ungleichgewicht des Systems kann an pathologischen Schmerzzuständen wie der zentralen Sensibilisierung beteiligt sein (HEINRICHER et al. 2009). Zusätzlich können auch kurze Signale von Aį- und C-Fasern zu einer Hemmung der Interneuronen führen. So könnte das Phänomen der Schmerzerleichterung nach kurzen, schmerzhaften Stimuli erklärt werden (PRICE u. MCHAFFIE 1988). 2.1.3 Pathologie des Schmerzes Während der physiologische Schmerz ausschließlich durch noxische Stimuli hervorgerufen werden kann, kommt es bei pathologischen Schmerzzuständen zu einer Verschiebung der Schmerzschwelle. 2.1.3.1 Entzündlicher und neuropathischer Schmerz In entzündlichem Gewebe kommt es zu einer veränderten Schmerzwahrnehmung, so dass schon nicht-noxische Stimuli ein Schmerzempfinden verursachen (Allodynie) und noxische Stimuli eine unverhältnismäßig hohe Schmerzantwort auslösen (Hyperalgesie) (MUIR u. WOOLF 2001; COSTIGAN et al. 2009). Der neuropathische Schmerz entsteht in Folge primärer Defekte des Nervensystems und geht einher mit Allodynie (RICE u. JUSTINS 1999). Die grundlegenden Mechanismen dieser pathologischen Schmerzzustände finden in der Peripherie aber auch zentral statt und werden als periphere und zentrale Sensibilisierung bezeichnet. 2.1.3.1.1 Periphere Sensibilisierung Die periphere Sensibilisierung resultiert aus entzündlichen Zuständen, die mit der Ausschüttung von chemischen Mediatoren einhergehen. Dazu gehören unter anderem Prostaglandine, Zytokine (z.B. Interleukine, TNF) und Wachstumsfaktoren 17 Literaturübersicht (z.B. NGF) (MUIR u. WOOLF 2001; SAMAD et al. 2001). Diese sensibilisieren die primären afferenten Neuronen, so dass es schon bei nicht-noxischen Stimuli zu einer Schmerzantwort kommt (JULIUS u. BASBAUM 2001). Das heißt, dass die „highthreshold“ Neuronen nun als „low-threshold“ Neuronen fungieren (DRAY 1995). Zusätzlich kommt es bei Entzündungen und Gewebsschäden zur Aktivierung von sogenannten schlafenden Nozizeptoren, die in gesundem Gewebe nicht auf noxische Stimuli reagieren. Unter dem Einfluss der inflammatorischen Mediatoren sprechen diese auf sensorische Stimuli an oder weisen sogar spontane Aktivität auf (SCHAIBLE u. SCHMIDT 1988; SCHMELZ et al. 1994; XU et al. 2000). Es handelt sich hierbei im Allgemeinen um einen temporären Zustand, welcher sich mit Abklingen der Entzündungssymptome normalisiert (DRAY 1995; KOLTZENBURG 1999). 2.1.3.1.2 Zentrale Sensibilisierung Bei lang anhaltender Entzündung oder peripheren Nervenschädigungen kann sich aus der temporären peripheren Sensibilisierung eine zentrale Sensibilisierung entwickeln (CHAPMAN et al. 1998; KIDD u. URBAN 2001). Aufgrund der aktivitätsabhängigen erhöhten Erregbarkeit der spinalen Neuronen führt die Aktivierung der Aȕ-Neuronen, welche unter physiologischen Bedingungen für die Informationsverarbeitung nicht-noxischer Stimuli zuständig sind, zu einer Schmerzantwort (LAIRD u. BENNETT 1993; TAKAISHI et al. 1996; BABA et al. 1999; MUIR 2010). Bei der Entstehung der zentralen Sensibilisierung spielt der NMDA-Rezeptor (NMethyl-D-Aspartat) eine wichtige Rolle (WOOLF u. THOMPSON 1991; SOUTH et al. 2003; ULTENIUS et al. 2006; YOSHIMURA u. YONEHARA 2006). So kann die Gabe von NMDA-Rezeptor-Antagonisten eine artifiziell hervorgerufene Übererregbarkeit von nozizeptiven Neuronen verhindern (WOOLF u. THOMPSON 1991; MA u. WOOLF 1995). Der NMDA-Rezeptor gehört zu der Gruppe der ionotropen Glutamatrezeptoren, kann also in Folge der Erregung von primären afferenten Neuronen durch freigesetztes Glutamat aktiviert werden. Zudem löst der nicht körpereigene Stoff N-Methyl-D-Aspartat eine Aktivierung des Rezeptors aus (YOSHIMURA u. YONEHARA 2006). Normalerweise kommt es durch sich im Kanal befindliche Magnesium Ionen (Mg2+) zu einer spannungsabhängigen Blockade des Ionenkanals (MAYER et al. 1984). Unter dem Einfluss von Protein-Kinase C kann 18 Literaturübersicht eine Reduzierung der Mg2+ assoziierten Blockade des Ionenkanals herbeigeführt werden (CHEN u. MAE HUANG 1992). NMDA-Rezeptor-Antagonisten, wie z.B. Ketamin, werden therapeutisch genutzt, um pathologische Schmerzzustände zu behandeln (BACKONJA et al. 1994; SANG 2000). 2.1.4 Schmerzbeurteilung beim Pferd Während in der Humanmedizin die verbale Kommunikation einen essentiellen Bestandteil der Schmerzevaluation darstellt, ist die Einschätzung von Schmerzzuständen beim Tier weitaus komplexer (LE BARS et al. 2001). Die Schmerzäußerungen sind stark spezies-spezifisch, so dass hierbei schon die korrekte Interpretation des artspezifischen Verhaltens sowie Kenntnisse der physiologischen Parameter der jeweiligen Tierart unabdingbar sind (BATESON 1991; MOLONY u. KENT 1997; PRICE et al. 2003). Besonders für das Pferd als Fluchttier ist das unauffällige Verhalten bei Schmerzzuständen mitunter überlebenswichtig, was die Einschätzung und das Erkennen von Schmerz weiter erschwert. Um postoperative Schmerzzustände zu evaluieren haben PRICE et al. (2003) einen modifizierten Verhaltensscore genutzt, um Parameter wie Ohrposition, Kopfposition, Liegen, Stehen, Position in der Box oder Futteraufnahme zu untersuchen. Ein physiologischer Parameter, dessen Veränderung und Anstieg in Verbindung mit Schmerzzuständen gebracht wird, ist die Herzfrequenz. Eine objektive Beurteilung ausschließlich anhand der Herzfrequenz ist jedoch nicht möglich, da eine erhöhte Herzfrequenz nicht schmerzspezifisch ist. Gleichzeitig ist eine normale Herzfrequenz kein sicheres Ausschlusskriterium für Schmerzzustände (RAEKALLIO et al. 1997b; TAYLOR et al. 2002; PRICE et al. 2003). Auch die Beurteilung von Schmerz mithilfe eines Elektroenzephalogramms (ICHINOSE et al. 1999) oder der Bestimmung von Kortisol und ȕ-Endorphin im Plasma (RAEKALLIO et al. 1997a; RAEKALLIO et al. 1997b) wird zwar in der Literatur beschrieben, brachte jedoch ebenfalls unspezifische Ergebnisse. Letztendlich wird davon ausgegangen, dass Eingriffe und Zustände, die beim Menschen Schmerzen verursachen, dies beim Tier in ähnlicher Weise tun (BATESON 1991; FLECKNELL 2008). 19 Literaturübersicht 2.2 Nozizeptive Schwellenwerte Mithilfe der Evaluation des nozizeptiven Schwellenwertes kann experimentell die Effektivität von Analgetika untersucht werden, wobei verschiedene Methoden beim Tier und beim Menschen eingesetzt werden (STOLL u. GREENE 1959; YARNITSKY et al. 1995). Eine wichtige Rolle spielt die Bestimmung von nozizeptiven Schwellenwerten beim Labortier in der präklinischen Phase der Entwicklung von Medikamenten (SHIMOYAMA et al. 1997; YAMAMOTO et al. 2002). Genutzt werden elektrische, thermische und mechanische Stimuli, um eine Antwort des Individuums auf den gesetzten Reiz auszulösen (CHAMBERS et al. 1990; SCHATZMAN et al. 2001; ROBERTSON et al. 2005; SPADAVECCHIA et al. 2007; LOVE et al. 2011b). So kann experimentell eine noxische Situation nachempfunden werden (LAMOTTE et al. 1983), um mithilfe der erreichten Schmerzschwelle Rückschlüsse auf die Effektivität von Analgetika ziehen zu können. Abhängig von dem Testmodell, können verschiedene Arten von Schmerz nachempfunden werden. Während mithilfe der thermischen, elektrischen und mechanischen Stimulation der Haut der akute Oberflächenschmerz ausgelöst wird, existieren weitere Verfahren zum Testen des entzündlichen oder visceralen Schmerzes (PIPPI u. LUMB 1979; KALPRAVIDH et al. 1984b, a; STEIN et al. 1988; PATEL et al. 2001; ROBERTSON et al. 2005; SPADAVECCHIA et al. 2007). In der Humanmedizin kann über die verbale Kommunikation der empfundene Schmerz nicht nur quantitativ, sondern auch qualitativ beschrieben werden. Dies ist beim Tier nicht möglich, so dass man auf autonome Reaktionen, somatomotorische Reflexe sowie bewusste Reaktionen angewiesen ist (RAMABADRAN u. BANSINATH 1986). Diese Reaktion wird dann als Endpunkt gewertet, woraufhin der nozizeptive Reiz beendet wird. Die Zeit bis zum Einsetzen der Reaktion (Latenz) oder die Stärke des applizierten Reizes bei Reaktion (Schwellenwert) wird gemessen (LE BARS et al. 2001). Eine Erhöhung des nozizeptiven Schwellenwertes oder der Latenz nach Applikation eines Schmerzmittels wird als antinozizeptiver Effekt gewertet (HARGREAVES et al. 1988). Aufgrund der dosisabhängigen Reaktion auf den Stimulus kann das Testsystem ebenfalls zur Dosisfindung für die spätere klinische Anwendung von Analgetika eingesetzt werden (LOVE et al. 2011a). 20 Literaturübersicht 2.2.1 Ansprüche an die Messmethoden Gewünscht ist ein einfach wiederholbarer, verlässlicher, nicht-invasiver Stimulus mit einem klar definierten Endpunkt (BEECHER 1957; LOVE et al. 2011a). Starke Gewebeschäden sowie lang anhaltende Schmerzen sollen bei diesem Testverfahren ausgeschlossen werden (LOVE et al. 2011a), so dass die Stimulation von vorneherein zeitlich oder quantitativ begrenzt wird. Um einen optimalen Endpunkt, d.h. die Reaktion des Tieres auf den Stimulus, festlegen zu können, ist die Auswahl des Stimulationspunktes am Pferd ausschlaggebend (LOVE et al. 2011a; POLLER et al. 2013). Nachteilig ist beispielsweise die Interferenz der durch Opioide ausgelösten Lokomotion mit dem als Endpunkt festgelegten Hochziehen der Gliedmaße als Reaktion auf einen nozizeptiven Stimulus (KAMERLING et al. 1985; LOVE et al. 2011b). Im Gegensatz dazu ist die Evaluierung des Pannikulusreflexes infolge der thermischen Stimulation am Widerrist unabhängig vom Opioid-induzierten Drangwandern. Hier stellt jedoch die Anwesenheit von Insekten eine mögliche Schwachstelle dar, da die Abwehrreaktion auf ein Insekt mit der Reaktion auf den nozizeptiven Stimulus interferieren kann. (LOVE et al. 2011a). Es ist zu beachten, dass der experimentell ausgelöste Schmerz mithilfe eines nozizeptiven Stimulus nicht mit klinischen Schmerzen gleichgesetzt werden kann (LOVE et al. 2011a). So ist es zum Beispiel nicht möglich, die Wirksamkeit von nichtsteroidalen Antiphlogistika (NSAIDs) mithilfe der akuten nozizeptiven Stimulation zu evaluieren, da das Setzen einer entzündlichen Läsion notwendig ist, um die analgetische Wirkung von NSAIDs zu testen (GIRAUDEL et al. 2005; STEAGALL et al. 2007; TAYLOR et al. 2007b). Zudem ist beim klinischen Schmerz aufgrund der Beteiligung verschiedener Schmerzarten von einem weitaus komplexeren Vorgang auszugehen, als dies beim experimentell ausgelösten Schmerz der Fall ist (NIELSEN et al. 2009). 2.2.2 Modalitäten der nozizeptiven Stimulation beim Pferd 2.2.2.1 Elektrische Stimulation Bei der elektrischen Stimulation wird eine Elektrode auf die rasierte Gliedmaße aufgebracht und die Stromstärke konstant erhöht (SPADAVECCHIA et al. 2002; SPADAVECCHIA et al. 2007). Eine Reaktion des Pferdes auf den elektrischen 21 Literaturübersicht Stimulus erfolgt in Form von Hochziehen dieser Gliedmaße (SCHATZMAN et al. 2001), was mithilfe der Elektromyographie objektiv registriert werden kann (SPADAVECCHIA et al. 2002; SPADAVECCHIA et al. 2007). Vorteile der elektrischen Stimulation sind gut quantifizierbare, nicht-invasive und reproduzierbare Stimuli (LE BARS et al. 2001). Ein Nachteil der elektrischen Stimulation ist jedoch, dass es sich hierbei nicht um einen natürlichen Stimulus handelt. Die Stimulation der Fasern erfolgt nicht differenziert, d.h. sowohl kleine Aį- und C-Fasern als auch große Fasern, die nicht für die Nozizeption zuständig sind, werden aktiviert. Zudem umgeht diese Art von Stimulation den peripheren Rezeptor, so dass die Untersuchung peripherer Transduktionsmechanismen mit diesem System nicht möglich ist (LE BARS et al. 2001). 2.2.2.2 Mechanische Stimulation Die mechanische Stimulation kann über sog. von Frey Filamente (RÉDUA et al. 2002), über die Stimulation mithilfe feiner Nadelstiche (CLARKE u. PATON 1988; NILSFORS et al. 1988) oder über einen pneumatisch gesteuerten stumpfen Stahlstift (CHAMBERS et al. 1990; SCHATZMAN et al. 2001) erfolgen. Die von Frey Filamente werden auf die Haut gedrückt, bis sie eine U-artige Form annehmen. Aufgrund unterschiedlicher Dicke der Filamente kann die auf die Haut ausgeübte Kraft variiert werden (RÉDUA et al. 2002; BOVE 2006). Die Stärke der Filamente wird erhöht bis eine Abwehrreaktion des Pferdes zu beobachten ist. Die mechanische Stimulation mithilfe eines pneumatisch gesteuerten stumpfen Stahlstifts erfolgt am Röhrbein des Pferdes. Der Druck auf das Bein wird konstant erhöht, bis es zu einer Reaktion in Form von Hochziehen der Gliedmaße kommt, was als Endpunkt gewertet wird (CHAMBERS et al. 1990; SCHATZMAN et al. 2001). Eine mechanische Stimulation mithilfe eines tragbaren, handgesteuerten Druckalgometers wurde ebenfalls für das Pferd beschrieben. Mit diesem System konnten nozizeptive Schwellenwerte mit guter Wiederholbarkeit ermittelt werden (HAUSSLER u. ERB 2006). Nachteil der mechanischen Stimulation ist, dass bei niedrigem Druck vor allem low-threshold Mechanorezeptoren aktiviert werden und es erst bei starken mechanischen Stimuli, die zum Teil gewebeschädigend sein können, zu einer Aktivierung von Nozizeptoren kommt (LE BARS et al. 2001). Um dem klinischen Bild der Kolik näher zu kommen, existiert eine Messmethode zur Evaluierung des viszeralen Schmerzes. Dies geschieht über das Setzen eines 22 Literaturübersicht Dehnungsreizes im Darmtrakt, wobei als Endpunkt entweder die Verhaltensänderung des Pferdes festgelegt oder aber die Bewegung des Pferdes objektiv mit einem Akzelerometer gemessen wird (KALPRAVIDH et al. 1984b, a). Der Dehnungsreiz wird aufgebaut, indem ein Ballon in das Zäkum (PIPPI u. LUMB 1979; KALPRAVIDH et al. 1984b, a), in das Duodenum (MERRITT et al. 2002; SANCHEZ et al. 2008) oder in das Rektum (SKARDA u. MUIR 2003; SANCHEZ et al. 2008) implantiert und das Volumen des Ballons konstant erhöht wird. 2.2.2.3 Thermostimulation Mithilfe der thermischen Stimulation der Haut kann ein oberflächlicher Schmerz ausgelöst werden. Bei der Thermostimulation kommt es zu einer selektiven Stimulation der kutanen Rezeptoren, so dass lokale thermosensitive und nozizeptive Fasern aktiviert werden (LE BARS et al. 2001). Wie im Kapitel 2.1.2.1 beschrieben, existieren verschiedene nozizeptive Rezeptoren, die auf einen schmerzhaften Reiz reagieren. Abhängig von der Heizrate sprechen sowohl Aį-Fasern als auch C-Fasern auf den thermischen Stimulus an (MCMULLAN et al. 2004; LOVE et al. 2011a). Bei einer schnellen Heizrate von 6,5 °C/s wurden nach thermischer Stimulation an der Pfote bei Ratten Aį-Fasern aktiviert, wohingegen bei einer langsamen Heizrate (0,9 °C/s) die Schmerzreaktion C-Faser vermittelt war (YEOMANS u. PROUDFIT 1996). Bei der thermischen Stimulation kann entweder die Zeit (Latenz) gemessen werden, die es braucht bis ein Pferd auf eine konstante Temperatur reagiert (PIPPI 1979; PIPPI u. LUMB 1979; KAMERLING et al. 1985) oder die Temperatur wird stufenweise erhöht, bis das Pferd eine Reaktion zeigt (ROBERTSON et al. 2005; LOVE et al. 2011b). Beim Pferd werden hierbei zwei verschiedene Methoden der Thermostimulation eingesetzt: Strahlungswärme: Mittels einer strahlenden Lichtquelle, die mit einem definierten Abstand auf die rasierte, geschwärzte Haut gehalten wird, kann abhängig von der Lokalisation eine bestimmte Antwort des Pferdes ausgelöst werden (PIPPI 1979; DHANJAL et al. 2009). Beim Anbringen des Systems an die Gliedmaße wird das Hochziehen der Gliedmaße als Endpunkt definiert (PIPPI 1979; KALPRAVIDH et al. 1984b; 23 Literaturübersicht KAMERLING et al. 1985; CARREGARO et al. 2007). Wird die Lichtquelle auf den Widerrist fokussiert, reagiert das Pferd mit einem Pannikulusreflex (KAMERLING et al. 1985; KAMERLING et al. 1988; DHANJAL et al. 2009). Die benötigte Zeit (Latenz) bis zum Erreichen des Endpunktes wird bewertet (LE BARS et al. 2001). Kommt es nach Applikation von Analgetika zu einem verlängerten Zeitintervall zwischen Stimulus und Endpunkt, wird dies als antinozizeptiver Effekt interpretiert (LOVE et al. 2011a). Der Vorteil dieses Systems ist, dass aufgrund der strahlenden Lichtquelle die Haut nicht berührt wird und somit ausschließlich Hitze-sensitive Fasern angesprochen werden (LOVE et al. 2011a). Schwachstellen dieses Testsystems sind die variablen Leitungseigenschaften der Wärme (LOVE et al. 2011a) sowie ein möglicher Lerneffekt oder Konditionierung des Pferdes durch das sichtbare Licht (KAMERLING et al. 1985). Kontaktwärme: Die thermische Stimulation mithilfe eines Heizelementes mit direktem Kontakt auf der Haut wird schon seit langem in der Humanmedizin, beim Labortier und der Katze eingesetzt (FRUHSTORFER et al. 1976; KENSHALO u. BERGEN 1975; CASEY u. MORROW 1983; HÄMÄLÄINEN et al. 1996; DIXON et al. 2002; ROBERTSON et al. 2003; LASCELLES u. ROBERTSON 2004; TAYLOR et al. 2007a). Seit einigen Jahren kommt dieses System auch beim Pferd erfolgreich zum Einsatz (ROBERTSON et al. 2005; LOVE et al. 2008; SANCHEZ et al. 2008; LOVE et al. 2011b). Hierbei wird das Heizelement mit einem konstanten Druck auf die Haut aufgebracht und in definierten Zeiteinheiten aufgeheizt (ROBERTSON et al. 2005; LOVE et al. 2011b). Das Heizelement beinhaltet gleichzeitig einen Temperatursensor, der die Hauttemperatur erfasst (ROBERTSON et al. 2005; SANCHEZ et al. 2008; ELFENBEIN et al. 2009; LOVE et al. 2011b). Um Gewebeschäden zu vermeiden, wird eine cut-out Temperatur als Endpunkt eingestellt, bei der das Gerät den Heizvorgang selbständig beendet (LOVE et al. 2011b). Die in der Literatur für verschiedene Spezies angegebenen cut-out Temperaturwerte variieren zwischen 45 °C und 60 °C (DIXON et al. 2002; TAYLOR et al. 2007 a). Des Weiteren hat die gewählte Heizrate einen Einfluss auf die Qualität der Messung: Eine Reduzierung der Heizrate von 0,85 °C/s auf 0,5 °C/s führte zu einer exakteren 24 Literaturübersicht Reaktion auf den Stimulus in Form eines Pannikulusreflexes sowie zu einer geringeren Streuung der Schwellenwerte (LOVE et al. 2008). Das Aufbringen des Heizelementes auf die Haut hat den Vorteil, dass aufgrund des Kontaktes mit der Haut und dem konstanten Druck eine standardisierte Transferrate der Wärme gewährleistet werden kann (LE BARS et al. 2001; YARNITSKY u. OCHOA 1990). 2.2.3 Einflussfaktoren auf die Thermostimulation Umgebungsbedingungen: Ablenkende Stimuli aus der Umgebung können den nozizeptiven Schwellenwert beeinflussen (MIRON et al. 1989). So wird in der Humanmedizin Ablenkung genutzt, um eine Erleichterung von schmerzhaften Zuständen zu erreichen (WISMEIJER u. VINGERHOETS 2005). Zudem konnte bei Mäusen und Ratten eine stress-induzierte Analgesie beobachtet werden (KELLY u. FRANKLIN 1984; KAVALIERS u. COLWELL 1991; FORD et al. 2008). Waren Ratten einer neuen Umgebungen oder fremden Objekten ausgesetzt, kam es zu einer Reduzierung der Schmerzantwort auf den durch Formalin ausgelösten nozizeptiven Reiz (FORD et al. 2008). Auch beim Pferd konnte der Einfluss der Umgebung auf den nozizeptiven Schwellenwert beobachtet werden (CHAMBERS 1994; POLLER et al. 2013). In einer Studie von POLLER et al. (2013) wurde der Versuchsaufbau bei der Thermostimulation an in der Box frei laufender mit dem in einem Stand fixierten Pferde verglichen. Die Thermostimulation am freilaufenden Pferd brachte im Vergleich zu den fixierten Pferden konstantere und verlässlichere Schwellenwerte. Umgebungstemperaturen: Extreme Außentemperaturen beeinflussen (POLLER et können al. 2013). die Es thermische kommt zu Stimulation ebenfalls Veränderungen der Hautdurchblutung und der Hauttemperatur (BERRY et al. 1984; POLLER et al. 2013) und somit zu einer veränderten Weiterleitung der Wärme durch die Haut zu den Nozizeptoren. Veränderungen der Hauttemperatur haben in einer Studie an Ratten einen Einfluss auf den nozizeptiven Schwellenwert aufzeigen können (LASCELLES et al. 1995), wohingegen LICHTMAN et al. (1993) dies in einem ähnlichen Versuchsaufbau nicht nachvollziehen konnte. POLLER et al. (2013) konnten im Vergleich zu warmen Umgebungstemperaturen 25 (>20 °C) bei Literaturübersicht Umgebungstemperaturen < 10 °C signifikant niedriger e Hauttemperaturen der Pferde sowie signifikant erhöhte Schwellenwerte feststellen. Veränderungen der Hautdurchblutung können die Schwellenwertbestimmung beeinflussen (LOVE et al. 2011a). Während Acepromazin und Butorphanol nachweislich keinen Effekt auf die Hauttemperatur hatten (LOVE et al. 2011b), konnte ein signifikantes Absinken der Hauttemperatur nach Gabe von Detomidin beobachten werden (ELFENBEIN et al. 2009). 2.3 Opioide Als Opioide werden natürliche sowie synthetische Stoffe mit Morphin-artigen Eigenschaften bezeichnet, die ihre Aktivität überwiegend durch die Interaktion an Opioidrezeptoren ausüben (GAYNOR u. MUIR 2008). Seit Jahrzehnten werden Opioide in der Human- und Veterinärmedizin als effektive Schmerzmittel eingesetzt (DOBKIN et al. 1974; TAVAKOLI et al. 1976; DUCHARME 2000) und auch beim Pferd konnte die analgetische Wirkung in verschiedenen Studien nachgewiesen werden (KALPRAVIDH et al. 1984b; KAMERLING et al. 1986; KAMERLING et al. 1988; SCHATZMAN et al. 2001). 2.3.1 Wirkmechanismus Opioide wirken direkt am peripheren sowie zentralen Nervensystem, sowohl im Rückenmark als auch im Gehirn (INTURRISI 2002). Im Gehirn spielt das periaquäduktale Grau (PAG) eine wichtige Rolle in der Opioid-vermittelten Analgesie (DEAKIN u. DOSTROVSKY 1978). Bei Ratten mit induzierten Läsionen des PAGs konnte eine im Vergleich zu gesunden Ratten reduzierte Analgesie nach MorphinGabe beobachtet werden (DOSTROVSKY u. DEAKIN 1977; DEAKIN u. DOSTROVSKY 1978). Im Rückenmark entfalten Opioide ihre Wirkung sowohl prä-, als auch postsynaptisch, indem sie an G-Protein-gekoppelte Opioidrezeptoren binden (INTURRISI 2002; IRNATEN et al. 2003). Im Folgenden kommt es in der Synapse zur Hemmung der Adenylatzyklase und Aktivierung von Kaliumkanälen mit einer damit verbundenen postsynaptischen Hyperpolarisation (NORTH et al. 1987; TORRECILLA et al. 2002) sowie zu einer Hemmung spannungsabhängiger Kalziumkanäle (AKINS u. MCCLESKEY 1993; SCHROEDER u. MCCLESKEY 1993; IRNATEN et al. 2003). 26 Literaturübersicht Die Freisetzung von Neurotransmittern wie Substanz P wird herabgesetzt (KURAISHI et al. 1985; INTURRISI 2002). Gleichzeitig kommt es durch die Inhibition des hemmenden Einflusses des Neurotransmitters GABA auf deszendierende Bahnen zu einer Aktivierung dieses schmerzhemmenden Systems (VAUGHAN et al. 1997). Zum jetzigen Zeitpunkt konnten bei der Ratte und beim Pferd verschiedene Rezeptorgruppen und –untergruppen nachgewiesen werden, die zentral aber auch peripher im Körper lokalisiert sind (ZUKIN et al. 1988; PASTERNAK 1993; SHEEHY et al. 2001; HELLYER et al. 2003; WENK et al. 2006). Diese vermitteln neben der gewünschten Analgesie zusätzlich unerwünschte Wirkungen wie kardiopulmonäre Veränderungen, verminderte Darmmotilität sowie gesteigerte Lokomotion (COMBIE et al. 1981b; KIEFFER 1999; CARREGARO et al. 2006). Als Hauptgruppen sind hier die μ-, δ- und ț-Rezeptoren zu nennen (PASTERNAK 1993). Die Wirkung der einzelnen Opioide ist abhängig von deren Aktivität und Affinität an den verschiedenen Rezeptoren (GAYNOR u. MUIR 2008). Die μ-Rezeptoren vermitteln neben der spinalen und supraspinalen Analgesie zusätzlich gesteigerte Lokomotion, respiratorische Depression, reduzierte MagenDarm-Motilität und physische Opiatabhängigkeit (MATTHES et al. 1996; KIEFFER 1999). Beim Menschen kann es nach der Langzeitgabe von μ-Rezeptor-Agonisten aufgrund einer Opioid-induzierten Euphorie zu einer psychischen Abhängigkeit sowie zu einer Toleranzentwicklung und physischen Abhängigkeit kommen (PRESTON et al. 1990; COLLETT 1998). Auch bei der Maus und der Ratte konnte eine Toleranzentwicklung nach Gabe von μ-Rezeptor-Agonisten beobachtet werden (MARTIN et al 1963; BOHN et al. 2000). Bei Wildtyp-Mäusen konnte nach Morphin-Applikation eine reduzierte Atemfrequenz festgestellt werden, während bei knock-out Mäusen, denen das Gen für den μRezeptor fehlt, keine respiratorischen Veränderungen auftraten (MATTHES et al. 1998). Wildtyp-Mäuse zeigten nach Morphin-Injektion eine reduzierte Darmmotilität, wohingegen in knock-out Mäusen keine Veränderungen des Ingestatransports beobachtet werden konnten (ROY et al. 1998). Auch die gesteigerte Lokomotion blieb in knock-out Mäusen nach Morphin-Applikation aus (TIAN et al. 1997). Die μRezeptoren machen im Verhältnis zu den restlichen Opioidrezeptoren sowohl im Gehirn als auch im Rückenmark den größten Anteil aus (TEMPEL u. ZUKIN 1987). 27 Literaturübersicht Die ț-Rezeptoren sind vor allem im Rückenmark vorhanden und vermitteln somit überwiegend eine spinale Analgesie. In einem Versuch mit knock-out Mäusen, denen der ț-Rezeptor fehlt, blieb die bei Wildtyp-Mäusen erzeugte analgetische Wirkung des ț-Rezeptor-Agonisten U50488H aus (SIMONIN et al. 1998). Im Vergleich zu den μ-Rezeptoren ist jedoch eine geringere unerwünschte Wirkung auf die Lokomotion sowie auf das Atem- und Herz-Kreislauf-System beschrieben (KAMERLING et al. 1986; KAMERLING et al. 1988). In einer Studie an Ratten und Meerschweinchen konnten Unterschiede in der Verteilung von ț-Rezeptoren Untergruppen (ț1- und ț2Rezeptor) zwischen den Spezies, aber auch innerhalb der Spezies festgestellt werden (UNTERWALD et al. 1991). Die spezifische Rolle der δ-Rezeptoren ist noch nicht genau geklärt, sie vermitteln jedoch sowohl im Gehirn wie auch im Rückenmark Analgesie (FREYE u. LEVY 2008). Für alle drei Rezeptortypen gibt es Hinweise auf das Vorkommen weiterer Subtypen (NOCK et al. 1988; ZUKIN et al. 1988; SOFUOGLU et al. 1991; PASTERNAK 2001), wobei die genaue Zuordnung der unterschiedlichen pharmakologischen Wirkungen noch aussteht (KIEFFER 1999). Auch in der Peripherie üben Opioide ihre Wirkung über Opioidrezeptoren aus. Sie sind in verschiedenen Organsystemen, wie zum Beispiel dem Magen-Darm-Trakt, der Niere, der Lunge, der Leber und dem Herzen angesiedelt (WITTERT et al. 1996). Außerdem scheint es unter bestimmten Entzündungserscheinungen zu einer Erhöhung der Dichte an peripheren Opioidrezeptoren zu kommen. Opioidrezeptoren werden über das Dorsalhorn des Rückenmarks in die peripheren Nervenendigungen transportiert (JANSON u. STEIN 2003). Zudem kommt es zur Freisetzung von endogenen Opioid-Peptiden aus Entzündungszellen und zu einer Interaktion der Peptide mit den Opioidrezeptoren und einer daraus resultierenden lokalen Analgesie (JANSON u. STEIN 2003; GAYNOR u. MUIR 2008). So konnte bei der Maus eine TZell vermittelte Freisetzung von ȕ-Endorphin im Magen-Darm-Trakt untersucht werden (VERMA-GANDHU et al. 2006). Opioide haben einen selektiven Einfluss auf den länger anhaltenden, dumpfen Schmerz („second pain“), der durch langsam leitende, unmyelinisierte C-Fasern vermittelt wird, wohingegen ihr Effekt auf den von kleinen, myelinisierten Aį-Fasern vermittelten kurzen, scharfen Schmerz („first pain“) gering ist (COOPER et al. 1986; STRIMBU-GOZARIU et al. 1993; FEE u. BOVILL 2005). 28 Literaturübersicht 2.3.2 Klassifizierung der Opioide Opioide können abhängig von ihrer Wirkung an den Opioidrezeptoren in verschiedene Gruppen eingeteilt werden: Agonisten Reine Agonisten haben durch ihre hohe Affinität sowie intrinsische Aktivität zu einem Rezeptor ausschließlich aktivierende Eigenschaften (FEE u. BOVILL 2005). Hierzu gehört unter anderem Morphin, welches seine rein agonistische Wirkung vor allem am ȝ-Rezeptor ausübt (GAYNOR u. MUIR 2008). Antagonisten Antagonisten besitzen eine hohe Affinität zu Opioidrezeptoren, mit einer gleichzeitig fehlenden intrinsischen Aktivität, so dass die Opioidwirkung aufgehoben wird (FEE u. BOVILL 2005). Zu erwähnen sei, dass neben den gewünschten antagonistischen Wirkungen vor allem bei erkrankten Tieren starke Schmerzzustände ausgelöst werden können (GAYNOR u. MUIR 2008). Beispielhaft ist hier Naloxon zu nennen, welches seine antagonistische Wirkung an allen Opioidrezeptoren ausübt (SHAW et al. 1982; LAHTI et al 1985; NARITA et al. 2003). Agonisten-Antagonisten Butorphanol gehört mit seiner hohen Affinität und intrinsischen Aktivität an țRezeptoren und gleichzeitigen hohen Affinität mit geringer intrinsischen Aktivität am ȝ-Rezeptor, zu den gemischten Agonisten–Antagonisten (GREENWALD u. STITZER 1998; GAYNOR u. MUIR 2008). So kommt es, abhängig von der Spezies, vor allem am ț-Rezeptor zu einer vorwiegend agonistischen Wirkung (GREENWALD u. STITZER 1998). Bei Primaten hingegen ist die agonistische Wirkung von Butorphanol vielmehr am ȝ-Rezeptor nachvollziehbar (VIVIAN et al. 1999; WALSH et al. 2001). Partielle Agonisten Partielle Agonisten, wie zum Beispiel Buprenorphin, besitzen eine hohe Affinität mit einer im Vergleich zum vollen Agonisten niedrigeren intrinsischen Aktivität am 29 Literaturübersicht jeweiligen Rezeptor. Partielle Agonisten vermitteln somit eine weniger effektive Analgesie als volle Agonisten (FEE u. BOVILL 2005; GAYNOR u. MUIR 2008). Ab einer bestimmten Dosis stellt sich ein Plateaueffekt („ceiling effect“) ein, d.h. dass mit der Dosiserhöhung keine weitere Erhöhung der analgetischen Effektivität erreicht werden kann. 2.3.3 Unerwünschte Wirkungen 2.3.3.1 Drangwandern und Verhaltensänderungen Während Opioide beim Menschen und bei vielen anderen Tierarten eine depressive Wirkung auf das ZNS haben können, kommt es beim Pferd zu zentraler Erregung und gesteigerter Lokomotion, bzw. sogenanntem Drangwandern (MAMA et al. 1993; NOLAN et al. 1994). Da die durch Opioide verstärkte lokomotorische Aktivität durch den Antagonisten Naloxon reduziert bzw. aufgehoben werden kann (COMBIE et al. 1981b), liegt eine Opioidrezeptor-assoziierte Vermittlung nahe. Zudem wird die Rolle von Dopamin beim Opioid-assoziierten Drangwandern kontrovers diskutiert (CLUTTON 2010). Zum einen konnte Acepromazin mit seiner anti-dopaminergen Wirkung eine Reduzierung des Opioid-assoziierten Drangwanderns bewirken (DHASMANA et al. 1972; COMBIE et al. 1981a; COMBIE et al. 1981b), zum anderen führte die Gabe des DopaminAntagonisten NNC 01-0756 zu keinerlei Verminderung des Alfentanil-vermittelten Drangwanderns (PASCOE u. TAYLOR 2003). Das Auslösen von Drangwandern scheint stärker über die μ-Agonisten als über die țAgonisten vermittelt zu werden (KAMERLING et al. 1986; KAMERLING et al. 1988; BENNETT u. STEFFEY 2002), wohingegen die ț-Agonisten vermehrt Ataxie verursachen (CLUTTON 2010). Zusätzlich konnte nach Opioid-Gabe das Auftreten von Ataxie, Schwanken, Zittern, Scharren sowie ein erhöhter Muskeltonus beobachtet werden (KALPRAVIDH et al. 1984a; SELLON et al. 2001). 2.3.3.2 Herz-Kreislauf System Die Auswirkung von Opioiden auf die Kreislaufsituation bei Pferden wird in der Literatur kontrovers diskutiert. Während einige Autoren eine Sympathikus-Stimulation 30 Literaturübersicht und eine damit verbundene Erhöhung der Herzfrequenz, des arteriellen Blutdrucks und des Herzauswurfes beschreiben (HILLIDGE u. LEES 1976; MUIR et al. 1978; KALPRAVIDH et al. 1984b; CARREGARO et al. 2006), konnte in weiteren Studien nach Opioid-Applikation keine Veränderungen der Herz-Kreislauf-Parameter bzw. ein initiales Absinken des Blutdrucks festgestellt werden (ROBERTSON et al. 1981; VAN DIJK u. NYKS 1998). 2.3.3.3 Atmung Opioide üben eine dosisabhängige depressive Wirkung auf die Atmung aus, indem sie die Sensitivität von peripheren und zentralen Chemorezeptoren in der Medulla oblangata für Kohlendioxid herabsetzen (FLÓREZ et al. 1968; ZOBRIST et al. 1981; GAYNOR u. MUIR 2008). Trotzdem scheint der Einfluss von Opioiden auf den Respirationstrakt beim wachen Pferd eine untergeordnete Rolle zu spielen, da es in mehreren Studien nach OpioidGabe zu keinen bzw. geringgradigen Veränderungen der respiratorischen Parameter kam (MUIR et al. 1978; ROBERTSON et al. 1981; KALPRAVIDH et al. 1984b; SELLON et al. 2004; LOVE et al. 2011b; FIGUEIREDO et al. 2012). 2.3.3.4 Gastrointestinaltrakt Auf die Motilität der glatten Muskulatur des Magen-Darm-Trakts haben Opioide, vor allem μ-Rezeptor-Agonisten, eine hemmende Wirkung (DAVIES u. GERRING 1983; SOJKA et al. 1988; BOSCAN et al. 2006). So konnte nach Gabe von Morphin (0,5 und 1 mg/kg) eine initiale Stimulation mit darauf folgender Hemmung der elektrischen und mechanischen Aktivität des Dickdarms für bis zu drei Stunden nachgewiesen werden (ROGER et al. 1985). Gleichzeitig wird der intestinale Transport von Ingesta reduziert (ROBERTS u. ARGENZIO 1986). Vor allem bei Opioid-Gabe über mehrere Tage kann es als Folge zu verzögerter Magenentleerung sowie Obstipationen kommen (BOSCAN et al. 2006). Dagegen zeigen klinische Studien keine eindeutigen Ergebnisse (SENIOR et al. 2004; LOVE et al. 2006; SENIOR et al. 2007). MIRCICA et al. (2003) konnten in einer retrospektiven Fallanalyse keine Unterschiede bezüglich postoperativer gastrointestinaler Komplikationen in einer mit Morphin behandelten Gruppe (prä –und 31 Literaturübersicht intraoperativ, jeweils 100-170 ȝg/kg Morphin i.v.) und der Gruppe ohne MorphinApplikation erkennen. Eine andere Studie konnte ein 4-fach erhöhtes Risiko für postoperative Kolik nach orthopädischen Operationen in der mit Morphin (0,08-0,3 mg/kg) behandelten Gruppe feststellen (SENIOR et al. 2004). 2.3.3.5 Urogenitaltrakt Nach Opioid-Gabe kann es aufgrund eines erhöhten Tonus Musculus sphincter urethrae externus zu einer Urinretention kommen (GAYNOR u. MUIR 2008). 2.3.4 Dosierung und Applikationsweg Butorphanol und Levomethadon sind für die intravenöse Applikation für das Pferd zugelassen. Morphin ist in Deutschland nicht für das Pferd zugelassen, befindet sich aber im Anhang der Verordnung (EG) Nr. 1950/2006 zur Erstellung eines Verzeichnisses von für die Behandlung von Equiden wesentlichen Stoffen gemäß der Richtlinie 2001/82/EG des Europäischen Parlaments und des Rates zur Schaffung eines Gemeinschaftskodexes für Tierarzneimittel und darf somit beim Pferd angewendet werden. Zu beachten ist eine damit verbundene Wartezeit von 6 Monaten und der Eintrag in den Equidenpass. Eine intramuskuläre Applikation ist unter anderem für Morphin und Butorphanol beschrieben (KALPRAVIDH et al. 1984b; FIGUEIREDO et al. 2012). Als weitere Applikationswege für Opioide sind die extradurale sowie die intraartikuläre Injektion zu erwähnen (RAEKALLIO et al. 1996; SANTOS et al. 2009; LINDEGAARD et al. 2010). Analgetisch wirksame Dosen werden für Morphin zwischen 0,05–0,3 mg/kg Körpergewicht beschrieben (CLARK et al. 2005; CORLETTO et al. 2005; CLUTTON 2010). Während für Butorphanol im Beipackzettel (Alvegesic® vet. 10 mg/ ml, CP-Pharma Handelsgesellschaft mbH, Ostlandring 13, D-31303 Burgdorf) eine Dosisempfehlung von 0,05-0,1 mg/kg Körpergewicht i.v. gegeben ist, sind in der wissenschaftlichen Literatur Dosisangaben für eine analgetische Wirkung im Bereich von 0,025-0,4 mg/kg beschrieben (KALPRAVIDH et al. 1984a; SCHATZMAN et al. 2001; SELLON et al. 2001; CLUTTON 2010). 32 Literaturübersicht Im Beipackzettel für Levomethadon (L-Polamivet, Levomethadonhydrochlorid 2,5 mg, Fenpipramidhydrochlorid 0,125 mg in 1 ml, Intervet Deutschland GmbH, Unterschleißheim) ist die Dosisempfehlung von 0,05-0,075 mg/kg Körpergewicht i.v. für eine Kombination mit Xylazin (0,4-0,6 mg/kg) empfohlen. 2.3.5 Morphin Morphin ist das Hauptalkaloid des Opiums und stellt als Prototyp der Opioide eine Vergleichsgröße für andere Verbindungen dieser Gruppe dar (INTURRISI 2002). Somit wird die Potenz von Morphin mit 1 angegeben (MUIR u. HUBBELL 2008). Die Serumhalbwertszeit für Morphin beträgt beim Pferd 87,9 Minuten (COMBIE et al. 1983). Beim Pferd wurde nach intramuskulärer Injektion von 0,66 mg/kg Morphin eine Wirkdauer von 30-60 Minuten nachgewiesen (KALPRAVIDH et al. 1984b). Morphin ist aufgrund seiner zwei Hydroxygruppen schlecht fettlöslich, was zu einer reduzierten Penetrierung der Blut-Hirn-Schranke führt (FEE u. BOVILL 2005). Es wird hauptsächlich in der Leber zu Morphin-3-Glucuronid (M3G) und Morphin-6Glucuronid (M6G) metabolisiert, wobei Morphin-6-Glucuronid pharmakologisch aktiv ist. Beim Menschen ist die Plasmakonzentration von M6G 30 Minuten nach i.v. Injektion höher als die des ursprünglich applizierten Morphins (OSBORNE et al. 1990). Es kann die Blut-Hirn-Schranke überwinden und trägt beim Menschen erheblich zur analgetischen Wirkung bei (OSBORNE et al. 1992). Die Halbwertszeit der Gleichgewichtseinstellung zwischen Blut und Hirn beträgt für M6G 3-16 Stunden, für Morphin hingegen nur 2-4,5 Stunden. Im Gegensatz zu M6G besitzt M3G keine analgetische Aktivität (FEE u. BOVILL 2005). Seine Wirkung übt Morphin als voller Agonist vor allem über die μ-Rezeptoren aus, so dass bekannte Nebenwirkungen vor allem in Form von Atemdepression, herabgesetzter Motilität des Magen-Darm-Trakts und Drangwandern auftreten (COMBIE et al. 1981; MATTHES et al. 1996). Eine weitere unerwünschte Wirkung von Morphin ist die potentielle Histaminausschüttung (WITHINGTON et al. 1993) im Rahmen einer anaphylaktoiden Reaktion nach intravenöser Applikation oder einer epiduralen Applikation mit nachfolgendem Juckreiz (BROMAGE et al. 1982; HAITJEMA u. GIBSON 2001; KALCHOFNER et al. 2007). 33 Literaturübersicht 2.3.6 Levomethadon Levomethadon ist ein vollsynthetisches Opioid mit rein agonistischer Wirkung am μRezeptor (RIEDERER u. LAUX 2009; LÖSCHER et al. 2010; AKTORIES et al. 2011). Zudem hat Levomethadon, im Gegensatz zu Morphin, antagonistische Aktivität am NMDA-Rezeptor (GORMAN et al. 1997), welcher eine wichtige Rolle in der zentralen Schmerzweiterleitung spielt (WOOLF u. THOMPSON 1991; KRISTENSEN et al. 1992; FELSBY et al. 1996). Methadon liegt als Racemat vor, wobei das rechtsdrehende Dextromethadon nahezu keine analgetische Potenz besitzt (LEMBERG et al. 2006). So erklärt sich eine ungefähr doppelt so starke analgetische Wirksamkeit des linksdrehenden Levomethadons im Vergleich zu Methadon (VERTHEIN et al. 2005; BRUERA u. YENNURAJALINGAM 2011). Die Potenz von Methadon liegt bei 1 und ist somit vergleichbar mit der von Morphin (FEE u. BOVILL 2005; MUIR u. HUBBELL 2008). Levomethadon wird in der Leber metabolisiert und der unveränderte Wirkstoff über die Niere ausgeschieden. Vor allem beim Menschen aber auch beim Hund kommt es nach Applikation von Levomethadon zu starker vagaler Stimulation, so dass Levomethadon grundsätzlich in der Kombination mit einem Parasympatholytikum verabreicht wird (LÖSCHER et al. 2010). Das Präparat L-Polamivet® enthält als Parasympatholytikum Fenpipramid. Obwohl Levomethadon und auch Methadon in der Praxis als Analgetikum genutzt werden (PRICE et al. 2002; RÖCKEN et al. 2007; JUNG et al. 2008), sind Studien zu der analgetischen Wirkung, Wirkdauer sowie unerwünschten Wirkungen beim Pferd kaum vorhanden. Während Levomethadon und Methadon beim Menschen (ÄNGGÅRD et al. 1979; BULUNGHAM et al. 1982) und beim Hund (RIVIERE u. PAPICH 2009) eine vergleichsweise lange Halbwertszeit aufweist, konnte in einer Studie beim Pferd für Methadon (i.v.) eine Eliminationshalbwertszeit von 58 Minuten ermittelt werden (LINARDI et al. 2012). SCHATZMAN et al. (2001) konnten nach Gabe von Levomethadon in einer Dosierung von 0,1 mg/kg in Kombination mit Detomidin (0,01 mg/kg) eine analgetische Wirkung für 90 Minuten beim Pferd nachvollziehen. 2.3.7 Butorphanol Butorphanol ist ein vollsynthetisches Opioid (DOBKIN et al. 1974) mit agonistischer Wirkung am ț-Rezeptor und antagonistischer Wirkung am μ-Rezeptor (COMMISKEY 34 Literaturübersicht et al. 2005). Es wurde mit dem Ziel entwickelt, das in der Humanmedizin bestehende Suchtpotential im Einsatz mit Opioiden zu minimieren und gleichzeitig ein starkes Analgetikum mit möglichst geringen Nebenwirkungen zu erhalten (DOBKIN et al. 1974; TAVAKOLI et al. 1976). Die den reinen μ-Agonisten zugesprochenen kardiopulmonären Nebenwirkungen sowie die Reduktion der Darmmotilität sollen bei Butorphanol aufgrund dieser antagonistischen Wirkung am μ-Rezeptor geringer ausfallen. Die analgetische Potenz von Butorphanol ist höher als die von Morphin und wird mit 3 bis 5 angegeben (FEE u. BOVILL 2005; GAYNOR u. MUIR 2008). Eine Besonderheit des Butorphanols ist der sogenannte Plateaueffekt Ab einer bestimmten Dosis kommt es zu keiner weiteren Verstärkung der Analgesie, so dass bei niedrigen Dosierungen die analgetische Potenz zwar höher ist als die von Morphin, bei einer Dosiserhöhung jedoch dieses Plateau gehalten wird (TRANQUILLI et al. 2007; GAYNOR u. MUIR 2008). Die Dauer der Wirkung von Butorphanol scheint variabel zu sein und zudem abhängig von Tierart und Applikationsweg. Beim Pferd betrug die Wirkdauer nach intravenöser Injektion in Dosierungen von 0,05-0,4 mg/kg 15-90 Minuten (KALPRAVIDH et al. 1984a), wohingegen LOVE et. al. (2011b) eine analgetische Wirkung für 2,9 Stunden nach intravenöser Injektion von Butorphanol (0,1 mg/kg) feststellen konnten. Während KNYCH et al. (2012) nach einer Bolus-Injektion von 0,1 mg/kg Butorphanol i.v. eine Eliminationshalbwertszeit von 5,9 Stunden beim Pferd nachweisen konnten, stellten SELLON et al. (2001) mit einem weniger sensitiven Messverfahren nur eine Eliminationshalbwertszeit von 44,4 Minuten fest. Butorphanol wird in der Leber zu einem inaktiven Metaboliten verstoffwechselt, die Ausscheidung des unveränderten Wirkstoffs geschieht vor allem über die Niere (MUIR u. HUBBELL 2008). 35 Material und Methode 3 Material und Methode 3.1 Probanden Bei den Probanden handelte es sich um acht klinisch allgemeingesunde Pferde der Klinik für Pferde, Stiftung Tierärztliche Hochschule Hannover im Alter von 6-24 Jahre und einem Gewicht von 430-633 kg. Darunter befanden sich sechs Stuten und zwei Wallache. Zwei der Pferde waren Traber, zwei Pferde waren Vollblut Araber und vier der Tiere gehörten der Hannoveraner Zuchtrichtung an. Die Pferde wurden in Boxen (4x4 m) gehalten und wurden regelmäßig bewegt oder hatten freien Auslauf auf einer Weide. Die Fütterung erfolgte bis zwölf Stunden vor Versuchsbeginn ausschließlich mit Heu und Möhren und wurde dann auf Mash und Heucobs umgestellt. Die Pferde hatten ständigen Zugang zu Wasser. Ein Tierversuchsantrag wurde nach § 8 Abs. 1 des Tierschutzgesetzes an das Niedersächsische Landesamt für Verbraucherschutz und Lebensmittelsicherheit (LAVES) gestellt und von diesem genehmigt. (33.9-42502-04-11/0511) 3.2 Versuchsaufbau 3.2.1 Instrumentierung Für die Bestimmung des thermischen nozizeptiven Schwellenwertes wurde das Wireless Thermal Testing System (WTT2) von der Firma “Topcat Metrology Ltd” genutzt (Abb. 1). Dieses System wurde primär für die Schmerzevaluation bei der Katze entwickelt (DIXON et al. 2002; ROBERTSON et al. 2003; LASCELLES u. ROBERTSON 2004; TAYLOR et al. 2007a) und wird modifiziert (LOVE et al. 2008) beim Pferd eingesetzt (ROBERTSON et al. 2005; SANCHEZ et al. 2008; LOVE et al. 2011b). 36 Material und Methode Abb. 1 Wireless Thermal Testing System (WTT2), bestehend aus der “display unit” (links) und dem “thermal block” (rechts) Das Gerät besteht aus einer „display unit“, die mithilfe von Klettband an einem Longiergurt auf dem Pferderücken befestigt wird. Sie weist zwei Displays auf, an denen zum einen die Hauttemperatur ablesbar ist und zum anderen bei einem Heizvorgang die erreichte Temperatur angezeigt wird. An der „display unit“ können verschiedene Einstellungen vorgenommen werden, wie zum Beispiel die Heizrate und die Starttemperatur. In dieser Studie wurde eine Heizrate von 0,6 °C/s (ROBERTSON et al. 2005; POLLER et al. 2013) mit einer Starttemperatur von 30 °C ausgewählt. Verbunden mit der „display unit“ ist das „heating element“, welches ebenfalls mit Klettband an dem Longiergurt kurz unterhalb der „display unit“ befestigt wird. Es befindet sich in einer isolierten Kunststoffschale, um mögliche Schaltgeräusche zu minimieren und so eine „Pavlowsche Konditionierung“ zu vermeiden. Eine gewünschte cut-out Temperatur kann über eine Schraube am „heating element“ eingestellt werden. Hier wurde eine Temperatur von 55 °C (ROBERTSON et al. 2005; POLLER et al. 2013) gewählt, um potentielle Gewebeschäden zu vermeiden. Über ein Flachbandkabel steht das „heating element“ in Verbindung mit dem Heizelement, welches auf der Haut des Pferdes liegt. Ein integrierter Temperatursensor dient zur Registrierung der Hauttemperatur vor Messbeginn (Abb. 2). 37 Material und Methode Abb. 2: Heizelement mit integriertem Temperatur- Abb. 3: Fernbedienung sensor; mit Klettband auf der Druckmanschette befestigt Für einen optimalen Kontakt zwischen Heizelement und Haut des Pferdes mit einem gewünschten, konstanten Druck wird das Heizelement auf eine Druckmanschette aufgebracht und mit Klebeband am Pferd befestigt. Die Druckmanschette wird über ein luftleitendes System, welches über die „display unit“ gesteuert wird, aufgepumpt. Über eine Spritze wird dem System Luft zugeführt und bei Erreichen eines Druckes von 30 mmHg leuchtet an der „display unit“ eine grüne Lampe (low press) auf. Sobald ein Druck von 80 mmHg erreicht ist, erleuchtet eine rote Lampe (high press) und das luftleitende System kann geschlossen werden, so dass ein Druck zwischen 30 und 80 mmHg gehalten wird. Gesteuert wird das WTT2 mithilfe eine Fernbedienung über Infrarotdetektoren, die beidseits an der „display unit“ angebracht sind (Abb. 3). So ist es dem Untersucher möglich, Distanz zum Pferd zu halten, um das Pferd in seiner gewohnten Umgebung nicht zu stören. Gleichzeitig kann so eine freie Bewegung des Pferdes während eines Messvorganges toleriert werden. 38 Material und Methode Abb. 4 Aufbau des WTT2 auf dem Pferderücken mithilfe eines Longiergurtes. Zu sehen ist die „display unit“ und die an das luftleitende System angeschlossene Spritze zum Druckaufbau. Unter dem Klebeband am linken Widerrist befindet sich das Heizelement mit der Druckmanschette. 3.2.2 Messvorgang Um die Haut an den Druck des Heizelementes zu gewöhnen und eine Angleichung der Temperatur des Heizelementes an die Hauttemperatur zu erreichen, erfolgte die Anbringung ca. fünf Minuten vor Messbeginn. Wie oben erklärt, wurde ein konstanter Druck über die Druckmanschette aufgebaut, woraufhin der Untersucher die Box verlassen oder einen Abstand zum Pferd in der Box einhalten konnte. Nach dem Einschalten des „Status“-Schalters an der Fernbedienung konnte die Hauttemperatur auf dem Display abgelesen werden. 39 Material und Methode Zum Starten des Heizvorganges musste der „Stimulus“-Knopf konstant gedrückt werden – kam es zu einer Reaktion des Pferdes wurde der Knopf sofort gelöst, der Heizvorgang somit abgeschlossen, das Heizelement von der Haut entfernt und der erreichte Schwellenwert dokumentiert. Blieb eine Reaktion des Pferdes aus, stoppte das Gerät selbstständig den Heizvorgang bei 55 °C. Für die statistische Auswertung wurde das Erreichen der cut-out Temperatur mit 56 °C notiert. Als Reaktion auf den Stimulus wurde ein Pannikulusreflex im Bereich des Widerrists sowie deutliche Abwehrreaktionen in Form von Schütteln oder Umdrehen des Kopfes in Richtung Widerrist gewertet. 3.2.3 Vorbereitung der Pferde Die Versuchspferde wurden zwölf Stunden vor Versuchsbeginn mit Mash und Heucobs gefüttert und hatten freien Zugang zu Wasser. Auch zwischen den Messungen wurden die Pferde mit kleinen Portionen Mash und Heucobs gefüttert. Das Scheren und Rasieren des Widerrist (ca. 10 x 10 cm) wurde etwa zwölf Stunden vor Versuchsbeginn durchgeführt. Eine klinische Allgemeinuntersuchung erfolgte vor jeder Versuchsreihe. Bei Störung der Beobachtung der Abwehrreaktion durch Fliegen wurde das Pferd mit Fliegenspray und einer modifizierten Fliegendecke, die den Messbereich aussparte, geschützt. Für die AM-Applikation wurde etwa eine Stunde vor Versuchsbeginn ein Venenverweilkatheter (Vygonyle S, Vygon, Ecouen, Frankreich) in die rechte oder linke Vena jugularis eingebracht. Vorbereitend wurde im Übergang vom oberen zum mittleren Halsdrittel eine Fläche von ca. 8 x 10 cm rasiert, für drei Minuten mit Chlorhexidinglukonat gewaschen und anschließend mit einer Alkohollösung desinfiziert. Eine lokale Anästhesie im Bereich der Einstichstelle erfolgte mit 2 ml Mepivacainhydrochlorid (Scandicain 2%, AstraZeneca GmbH, Wedel). Als Notfallmedikamente standen ständig Adrenalin (Adrenalin 1:1000, Jenapharm®, mibe GmbH Arzneimittel, Brehna), Acepromazin (Vetranquil® 1%, Albrecht GmbH, Düsseldorf) und Naloxon (Naloxon-ratiopharm® 0,4 mg/ml, ratiopharm GmbH, Ulm) zur Verfügung. 40 Material und Methode 3.2.4 Studiendesign Die Studie wurde als kontrollierter, teil randomisierter, experimenteller Versuch mit verblindetem Untersucher im kompletten cross-over Design durchgeführt. Jedes der acht Pferde wurde unter Placebo und Morphin, Butorphanol und Levomethadon in einer niedrigen und einer hohen Dosierung getestet mit mindestens 14 Tagen zwischen den Versuchsdurchläufen. Alle Pferde durchliefen immer zuerst die Arzneimittelapplikation in der niedrigen Dosierung. Die thermische Stimulation der Haut erfolgte beidseits, abwechselnd am Widerrist. Für diese Lokalisation wurde eine Heizrate mit 0,6 °C pro Sekunde und einer Starttemperatur von 30 °C vorgegeben. Die Messungen erfolgten in der Box in gewohnter Umgebung, wobei darauf geachtet wurde Ablenkung und Unruhe zu vermeiden. Die Messungen wurden zwischen dem 12.09.2011 und dem 13.06.2012 durchgeführt. Um extreme Außentemperaturen auszuschließen, die die Bestimmung des thermischen Schwellenwertes beeinflussen können (POLLER et al. 2013), fanden in den Wintermonaten (21.10.2012 bis 15.04.2012) keine Versuche statt, so dass Raumtemperaturen zwischen 10 bis 25 °C gewährl eistet werden konnten. 3.2.5 Beurteilung der Nebenwirkungen Verhalten: Sowohl vor als auch nach AM-Applikation wurde das Verhalten der Pferde beobachtet. Dabei wurde insbesondere auf Unruhe, Nervosität, Ataxie, Zittern und Sedierung geachtet. Zusätzlich wurde dokumentiert, ob sich das Pferd aufmerksam zeigte oder durch äußere Einflussfaktoren abgelenkt wurde. Besondere Aufmerksamkeit wurden Stereotypien wie Oberlippenspiel, Zungenspiel, Leerkauen oder Drangwandern geschenkt. Ein konstantes Scharren mit den Vordergliedmaßen vor der Krippe in Verbindung mit Futtersuche wurde als simuliertes Fressverhalten gewertet. Der Grad des Drangwanderns wurde wie folgt eingeteilt: geringgradig: 1-2 Runden Kreislaufen, danach erscheint das Pferd wieder ruhig, Pferd ist problemlos am Halfter und Strick in der Box zu halten. 41 Material und Methode mittelgradig: 4-5 Runden Kreislaufen, danach erscheint das Pferd wieder ruhig, Pferd ist problemlos am Halfter und Strick in der Box zu halten. hochgradig: Pferd läuft ohne Pausen, nur mit großem Aufwand von einer Person am Halfter und Strick zu halten. Hauttemperatur: Vor jeder Messung wurde die Hauttemperatur des Messbereiches dokumentiert. Außentemperatur: Die Außentemperatur wurde zu jedem Messzeitpunkt ermittelt. Die relative Luftfeuchtigkeit wurde zu jedem Messdurchlauf einmalig aufgezeichnet. (Vaisala, HUMIDITY AND TEMPERATURE PROBE, HM 141, Made in Finland) Hautkontrolle: Nach jeder Messung sowie 24 Stunden nach den Messungen wurden die Messbereiche am Widerrist auf potentielle Hautirritationen überprüft. Die Haut wurde adspektorisch auf Veränderungen wie Rötung oder Schwellung überprüft. Kotabsatz: Nach AM-Applikation wurde der Kotabsatz des Pferdes beobachtet. Dabei wurde der erste Kotabsatz nach AM-Applikation protokolliert. Darmgeräusche: Zu jedem Messzeitpunkt wurden die Darmgeräusche in allen vier Quadranten (rechte und linke Fossa lumbalis, rechts und links abdominal) auskultatorisch überprüft und dokumentiert. Die Einteilung erfolgte nach folgenden Kriterien: - keine Darmgeräusche in allen vier Quadranten + sehr leise, nicht frequente Darmgeräusche in 1-2 Quadranten ++ leise, aber frequente Darmgeräusche in allen 4 Quadranten +++ laute, frequente Darmgeräusche in allen 4 Quadranten 42 Material und Methode Beurteilt wurde die Zeit nach AM-Applikation bis die Darmgeräusche wieder dem Zustand vor der Medikamenten Gabe entsprachen. Herzfrequenz und Atemfrequenz: Die Herzfrequenz wurde im Anschluss jeder Messung auskultatorisch mittels Phonendoskop ermittelt. Die Atemfrequenz wurde adspektorisch über Beobachtung der Thoraxexkursionen nach jeder Stimulation ausgezählt. 3.2.6 Behandlungen Für die Untersuchungen wurden folgende Medikamente verwendet: • Morphin (Morphin HEXAL 20mg/ml, HEXAL AG, Holzkirchen), • Butorphanol (Alvegesic® vet. 10 mg/ ml, CP-Pharma Handelsgesellschaft mbH, Ostlandring 13, D-31303 Burgdorf), • Levomethadon (L-Polamivet®, Levomethadonhydrochlorid 2,5 mg, Fenpipramidhydrochlorid 0,125 mg in 1 ml, Intervet Deutschland GmbH, Unterschleißheim), • Isotone Kochsalzlösung (0,9 %, B. Braun Melsungen AG, Melsungen) Alle acht Pferde durchliefen sieben Behandlungen: • Morphin 0,1 mg/kg i.v. (M0,1) • Morphin 0,2 mg/kg i.v. (M0,2) • Butorphanol 0,1 mg/kg i.v. (B0,1) • Butorphanol 0,2 mg/kg i.v. (B0,2) • Levomethadon 0,1 mg/kg i.v. (L0,1) • Levomethadon 0,2 mg/kg i.v. (L0,2) • Isotone Kochsalzlösung i.v. (P) Alle Medikamente wurden von einer an den Untersuchungen nicht beteiligten Person mit isotoner Kochsalzlösung auf ein Volumen von 100 ml aufgefüllt, um eine Applikation über zehn Minuten (Kurzinfusion) und eine verblindete Untersuchung zu ermöglichen. Im ersten Teil des Versuches wurde Morphin (M0,1), Butorphanol (B0,1) und Levomethadon (L0,1) in einer Dosierung von 0,1 mg/kg i.v. appliziert. Für den 43 Material und Methode zweiten Teil des Versuches wurde eine Dosierung für Morphin (M0,2), Butorphanol (B0,2) und Levomethadon (L0,2) von 0,2 mg/kg i.v. gewählt. Als Placebo-Behandlung (P) wurde eine Versuchsreihe mit isotoner Kochsalz-Lösung durchgeführt. 3.2.7 Messzeitpunkte Für die Bestimmung des Ausgangsschwellenwertes (Kontrollwert), wurden vor AMApplikation drei Messungen im Abstand von 20 Minuten vorgenommen und gemittelt. Das Ende der AM-Applikation wurde als Zeitpunkt 0 (t0) definiert. Daraufhin wurden Messungen nach 10, 30, 60, 90, 120, 240, 300, 360, 420, 540 und 1350 Minuten durchgeführt (Abb. 5). ,ĂƵƉƚǀĞƌƐƵĐŚĞdŚĞƌŵŽƐƚŝŵƵůĂƚŝŽŶ WĨĞƌĚ͗ Kƌƚ͗ ,ĞŝnjƌĂƚĞ͗ ƵƘĞŶƚĞŵƉ͘ >ƵĨƚĨĞƵĐŚƚ͗͘ hŚƌnjĞŝƚ͗ ĂƚƵŵ͗ DͲƉƉůŝŬĂƚŝŽŶ͗ Ždžϰdžϰŵ Ϭ͕ϲΣͬƐĞĐ K K DĞƐƐƵŶŐ͗ ^ƚŝŵƵůĂƚŝŽŶ;ŵŝŶ͘Ϳ ^ĞŝƚĞ hŚƌnjĞŝƚ ,ĂƵƚƚĞŵƉĞƌĂƚƵƌ;ΣͿ ^ĐŚǁĞůůĞŶǁĞƌƚ;ΣͿ ƵƘĞŶƚĞŵƉĞƌĂƚƵƌ;ΣͿ ZĞĨůĞdž WĂŶŶŝŬƵůƵƐƌĞĨůĞdž ŬĞŝŶZĞĨůĞdž ďĞǁƵƐƐƚĞ ZĞĂŬƚŝŽŶ <ŽƉĨnjƵƌ^ĞŝƚĞ ƐŽŶƐƚŝŐĞ ŬĞŝŶĞ sĞƌŚĂůƚĞŶ ͲϱϬ ͲϯϬ ͲϭϬ ϭϬ ϯϬ hŶƌƵŚĞͬƌĂŶŐǁĂŶĚĞƌŶ ĂƵĨŵĞƌŬƐĂŵ ĂďŐĞůĞŶŬƚ ^ĞĚŝĞƌƚ <ŽƉĨŚƂŚĞ ƵŐĞŶŽĨĨĞŶͬŐĞƐĐŚůŽƐƐĞŶ 44 ϲϬ tŝĚĞƌƌŝƐƚ ϵϬ ϭϮϬ ϭϴϬ ϮϰϬ ϯϬϬ ϯϲϬ ϰϮϬ ϱϰϬ 22,5 h Material und Methode ^ƚŝŵƵůĂƚŝŽŶ;ŵŝŶ͘Ϳ KŚƌĞŶƉŽƐŝƚŝŽŶ ŶĂĐŚǀŽƌŶŐĞƌŝĐŚƚĞƚ njƵƌ^ĞŝƚĞŐĞƌŝĐŚƚĞƚ ŶĂĐŚŚŝŶƚĞŶͬĂŶŐĞůĞŐƚ EƺƐƚĞƌŶ ĞŶƚƐƉĂŶŶƚ ĞŶŐ ŐĞďůćŚƚ sŝƚĂů njĞŝĐŚĞŶ ,ĞƌnjĨƌĞƋƵĞŶnj ƚĞŵĨƌĞƋƵĞŶnj ĂƌŵŐĞƌćƵƐĐŚĞ <ŽƚĂďƐĂƚnj ,ĂƵƚŬŽŶƚƌŽůůĞ Ž͘ď͘ ŐŐƌ͘sĞƌďƌĞŶŶƵŶŐ ŵŐƌ͘sĞƌďƌĞŶŶƵŶŐ ŶĂĐŚϮϰŚ ͲϱϬ ͲϯϬ ͲϭϬ ϭϬ ϯϬ ϲϬ tŝĚĞƌƌŝƐƚ ϵϬ ϭϮϬ ϭϴϬ ϮϰϬ ϯϬϬ ϯϲϬ ϰϮϬ ϱϰϬ 22,5 h Abb. 5 Protokoll des Hauptversuchs: Für jeden Messzeitpunkt stand eine Spalte zur Dokumentation zur Verfügung. Protokolliert wurde die Uhrzeit, die Hauttemperatur, der Schwellenwert, die Außentemperatur, der erfolgte Reflex, bewusste Reaktionen, das Verhalten, die Ohrenposition, die Nüstern, die Vitalzeichen sowie potentielle Hautirritationen. 3.2.8 Versorgung der Pferde nach Versuchsende Mit besonderer Aufmerksamkeit auf Anzeichen einer Kolik wurde das klinische Allgemeinbefinden der Pferde über 24 Stunden nach Versuchsende überprüft. War ein normaler Kotabsatz zu beobachten, wurde wieder auf die gewohnte Fütterung mit Heu umgestellt. Bei Auftreten von Rötung und Schwellung der Haut wurden die betroffenen Areale alle drei Stunden mit einer Sulfadiazin-Silber-haltigen Salbe (Flammazine®, Sinclair Pharmaceuticcal Espana, San Fernando de Henares, Spanien) versorgt. 3.2.9 Statistik Die Auswertung der Daten erfolgte mit dem Statistikprogramm SAS, Version 9.3 (SAS Institute, Cary, NC); für die Auswertung des linearen Modells wurde darin die Prozedur „MIXED“ benutzt. Es wurde ein Signifikanzniveau von p 0,05 berücksichtigt. Die Modellresiduen der Temperaturmessungen wurden mittels Shapiro-Wilk-Test und visueller Beurteilung der QQ-Plots auf Normalverteilung geprüft. Für die deskriptive 45 Material und Methode Statistik wurden arithmetische Mittelwerte und Standardabweichungen berechnet. Messwiederholungen vor Behandlung wurden zu einem Kontrollwert gemittelt. Der Vergleich der Messungen zwischen den verschiedenen Behandlungen an 13 Messzeitpunkten (MZP) erfolgte mittels einer zweifaktoriellen Varianzanalyse für repeated measurements mit Berücksichtigung der Interaktion. Die Vergleiche zwischen den Medikationen zu jedem MZP wurden mittels einfaktorieller Varianzanalyse und post hoc Tukey´s-t-Test berechnet. Die Vergleiche der Messzeitpunkte gegen die Kontrolle für jede Medikation erfolgte mit einfaktorieller Varianzanalyse für Messwiederholungen mit post hoc Dunnett´s tTest. Für die Berechnung der prozentualen Temperaturabweichung (TE%) wurde folgende Formel eingesetzt (Brosnan et al. 2009): TE % = 100 x ([TT – T0] / [Tc-T0]) TT: thermischer Schwellenwert, T0: Hauttemperatur, Tc: cut-out Temperatur 46 Ergebnisse 4 Ergebnisse 4.1 Verhalten der Pferde während der Messungen Alle Pferde tolerierten das aufgebaute System an dem Longiergurt nach einer Eingewöhnungsphase von einigen Minuten gut. Während sich der Untersucher außerhalb der Box befand, zeigten sie ein normales Verhalten in der Box. Eine erhöhte Aufmerksamkeit konnte bei Manipulation am Gerät beobachtet werden. Ein Pferd reagierte nur auf den thermischen Stimulus, wenn es den Untersucher in der Nähe nicht wahrnahm. Keines der Pferde zeigte im Verlauf der Studie ein gestörtes Allgemeinbefinden oder Anzeichen einer Kolik. 4.2 Placebo-Behandlung 4.2.1 Reaktion auf den thermischen Stimulus In 55% der Fälle zeigten die Pferde als Reaktion auf den thermischen Stimulus einen Pannikulusreflex, wobei bei 24,1% der Messungen nachfolgend eine bewusste Reaktion zu beobachten war. Hierbei zeigten die Pferde Schütteln des ganzen Körpers, Schütteln des Kopfes, Umdrehen des Kopfes in Richtung Widerrist oder Schweifschlagen, aber auch sehr dezente Reaktion wie nach hinten Drehen der Ohren oder ein plötzlich auftretender, aufmerksamer und konzentrierter Gesichtsausdruck. In 41,7% der Messungen traten bewusste Reaktionen ohne vorherigen Pannikulusreflex auf. Als Reaktion auf den Stimulus wurde hier nur eindeutiges Schütteln des Kopfes oder des Körpers und Umdrehen des Kopfes in Richtung Widerrist gewertet. Die cut-out Temperatur wurde in 3,3% (4 von 120) der Messungen erreicht, wobei dies nur in einer Versuchsreihe, d.h. bei einem Pferd, aufgetreten ist. 4.2.2 Schwellenwerte Der thermische nozizeptive Schwellenwert war über den gesamten Beobachtungszeitraum stabil (Abb. 6). Der Verlauf der TE % Werte war vergleichbar mit dem Verlauf der Schwellenwerte (Anhang 4). 47 Ergebnisse Abb. 6: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Placebo-Behandlung (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AMApplikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. 4.2.3 Kotabsatz und Darmgeräusche Die Darmgeräusche waren im Vergleich zu dem Kontrollwert in der Behandlung P zu keinem Zeitpunkt reduziert. Sowohl vor, als auch nach der AM-Applikation konnten die Darmgeräusche mit +++ bewertet werden. Der erste Kotabsatz nach Injektion von Natrium-Chlorid erfolgte im Mittel nach 46 ± 40 Minuten. 4.2.4 Herzfrequenz und Atemfrequenz In Behandlung P kam es im Beobachtungszeitraum zu keiner signifikanten Veränderung der Herzfrequenz sowie der Atemfrequenz (Anhang 7 und 8). 48 Ergebnisse 4.3 Opioide in der niedrigen Dosierung 4.3.1 Reaktion auf den thermischen Stimulus In 84,44 % der Fälle zeigten die Pferde als Reaktion auf den thermischen Stimulus einen Pannikulusreflex, wobei bei 10,6% der Messungen zusätzlich eine bewusste Reaktion zu beobachten war. Hierbei zeigten die Pferde Schütteln des ganzen Körpers, Schütteln des Kopfes, Umdrehen des Kopfes in Richtung Widerrist oder Schweifschlagen, aber auch sehr dezente Reaktion wie nach hinten Drehen der Ohren oder ein plötzlich auftretender, aufmerksamer und konzentrierter Gesichtsausdruck. In 7,8 % der Messungen traten bewusste Reaktionen ohne gleichzeitig auftretenden Pannikulusreflex auf. Als Reaktion auf den Stimulus wurde hier nur eindeutiges Schütteln des Kopfes oder des Körpers und Umdrehen des Kopfes in Richtung Widerrist gewertet. Die cut-out Temperatur wurde in 7,5 % (27 von 360) der Messungen erreicht, wovon alle in den Zeitraum nach Opioid-Applikation fallen. 4.3.2 Kontroll-Messung Der Mittelwert der Kontrollwerte lag in der M0,1-Behandlung bei 46,61 ± 3,9 °C, in der B0,1-Behandlung bei 46,05 ± 1,2°C und in der L 0,1-Behandlung bei 46,25 ± 2,7 °C. Diese Werte wiesen keine statistisch signifikanten Unterschiede auf, die maximale Temperaturdifferenz der Mittelwerte lag bei 0,56 °C . 4.3.3 Schwellenwerte nach Morphin–Applikation (0,1 mg/kg) Der mittlere thermische nozizeptive Schwellenwert war in der M0,1-Behandlung im Vergleich zu dem Kontrollwert zu keinem Zeitpunkt signifikant erhöht. Nach 90 Minuten konnte der Maximalwert festgestellt werden, die Werte der Kontrolle wurden nach 180 Minuten erreicht (Abb. 7). Der Verlauf der TE % Werte war vergleichbar mit dem Verlauf der absoluten Schwellenwerte (Anhang 5). 49 Ergebnisse Abb. 7: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl) (n=8) und M0,1 (Morphin 0,1 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. 4.3.4 Schwellenwerte nach Butorphanol-Applikation (0,1 mg/kg) Der mittlere thermische nozizeptive Schwellenwert war in der Behandlung B0,1 für 90 Minuten signifikant erhöht (p<0,05). Der Maximalwert wurde zum Zeitpunkt t30 erreicht und die Werte der Kontrolle wurden nach 180 Minuten wieder erreicht (Abb. 8). Die P-Behandlung und die B0,1-Behandlung wiesen nach 10, 30, 60 und 90 Minuten signifikante Unterschiede der Schwellenwerte untereinander auf. Der Verlauf der TE % Werte war vergleichbar mit dem Verlauf der absoluten Schwellenwerte (Anhang 5). 50 Ergebnisse Abb. 8: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl) (n=8) und B0,1 (Butorphanol 0,1 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. *Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschied (p<0,05) zu der Behandlu ng P. 4.3.5 Schwellenwerte nach Levomethadon-Applikation (0,1 mg/kg) Der mittlere thermische nozizeptive Schwellenwert war in der L0,1-Behandlung für 60 Minuten signifikant (p<0,05) erhöht. Der Maximalwert lag mit 51,04 °C bei 10 Minuten und die Werte der Kontrolle konnten nach 360 Minuten erreicht werden (Abb. 9). Zwischen der P-Behandlung und der L0,1-Behandlung kam es nach 10, 30 und 60 Minuten zu einem signifikanten Unterschied der Schwellenwerte. Der Verlauf der TE % Werte war vergleichbar mit dem Verlauf der absoluten Schwellenwerte (Anhang 5). 51 Ergebnisse Abb. 9: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl) (n=8) und L0,1 (Levomethadon 0,1 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AMApplikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. *Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschied (p<0, 05) zu der Behandlung P. 4.3.6 Die Schwellenwerte der drei Opioide im Vergleich (0,1 mg/kg) Zum Zeitpunkt t10, t30 und t540 konnte ein signifikanter Unterschied zwischen den mittleren Schwellenwerten der B0,1-Behandlung und der M0,1-Behandlung festgestellt werden (p<0,05). Zwischen den mittleren Schwellenwerten der Behandlung L0,1 und M0,1 kam es nach 300 Minuten zu einem signifikanten Unterschied (Abb. 10). 52 Ergebnisse Abb. 10: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl), M0,1 (Morphin 0,1 mg/kg) B0,1 (Butorphanol 0,1 mg/kg) und L0,1 (Levomethadon 0,1 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. *Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschied (p <0,05) zu der Behandlung M0,1. 4.3.7 Verhalten der Pferde nach Injektion von Morphin, Butorphanol und Levomethadon (0,1 mg/kg) In der Behandlung M0,1 zeigte ein Pferd geringgradiges Drangwandern sowie Zungenspiel. In den Behandlungen B0,1 und L0,1 konnte bei verschiedenen Probanden Drangwandern, erhöhter Muskeltonus, Zittern, Ataxie, Kopfzucken sowie Lippenspiel beobachtet werden (Tab. 1). Bei keinem der Pferde konnte nach AMGabe eine Sedierung beobachtet werden. 53 Ergebnisse Tab. 1: Verhalten der Pferde nach Applikation von Morphin, Butorphanol und Levomethadon in einer Dosierung von 0,1 mg/kg. Angegeben ist die Anzahl der Pferde (n=8), die mit Verhaltensänderungen in Form von Drangwandern, Lippenspiel, Zungenspiel, Leerkauen, Kopfzucken, einem erhöhten Muskeltonus, Zittern, Ataxie oder einem simulierten Fressverhalten nach der AM-Applikation über einen Untersuchungszeitraum von 1350 Minuten aufgefallen sind. 0,1 mg/kg Morphin Butorphanol Levomethadon Drangwandern kein 7 3 2 ggr. 1 3 4 mgr. 0 2 2 hgr. 0 0 0 Lippenspiel 0 3 1 Zungenspiel 1 0 0 Leerkauen 0 0 0 Kopfzucken 0 4 3 Muskeltonus Ĺ 0 4 2 Zittern 0 1 1 Ataxie 0 4 2 Fressverhalten 0 0 0 Die Pferde zeigten nach durchschnittlich einer Stunde ein normales Verhalten, vergleichbar mit dem Zustand vor AM-Applikation. Dies konnte in der Behandlung M0,1 nach 45 ± 104 Minuten, in der Behandlung B0,1 nach 68 ± 55 Minuten und in der Behandlung L0,1 nach 59 ± 59 Minuten erreicht werden, wobei kein statistisch signifikanter Unterschied erreicht wurde. 4.3.8 Kotabsatz und Darmgeräusche Die Darmgeräusche waren in der Behandlung M0,1 im Mittel für 113 ± 35 Minuten, in der Behandlung B0,1 für 109 ± 51 Minuten und in der Behandlung L0,1 für 90 ± 28 Minuten reduziert, d.h. sie erreichten nach diesem Zeitraum den Zustand vor der AM- 54 Ergebnisse Applikation. Ein signifikanter Unterschied zwischen den Mittelwerten der Behandlungen konnte nicht festgestellt werden (Tab. 2). Der erste Kotabsatz nach AM-Applikation war im Mittel in der Behandlung M0,1 nach 195 ± 149 Minuten, in der Behandlung B0,1 nach 183 ± 92 Minuten und in der Behandlung L0,1 nach 144 ± 103 Minuten zu beobachten (Tab. 3). Auch hier konnte kein signifikanter Unterschied zwischen den Mittelwerten der Behandlungen festgestellt werden. Tab. 2: Zeitraum (Minuten; Mittelwert, SD), in dem eine Reduzierung der Darmgeräusche nach Applikation von Morphin (0,1 mg/kg), Butorphanol (0,1 mg/kg) oder Levomethadon (0,1mg/kg) bis zum Erreichen des Zustandes vor AM-Applikation festgestellt werden konnte. Darmgeräusche reduziert (min) Morphin 0,1 mg/kg Butorphanol 0,1 mg/kg Levomethadon 0,1 mg/kg Pferd 1 180 60 120 Pferd 2 120 180 90 Pferd 3 90 60 90 Pferd 4 90 180 60 Pferd 5 120 120 120 Pferd 6 120 120 60 Pferd 7 120 90 60 Pferd 8 60 60 120 113 ± 35 109 ±51 90 ± 28 Zu jedem Messzeitpunkt (t0–t1350) wurden die Darmgeräusche der Pferde (n=8) in allen vier Quadranten (rechte und linke Fossa lumbalis, rechts und links abdominal) auskultatorisch überprüft und mit einem Score von „-“ bis „+++“ beurteilt, wobei „-“ keine Darmgeräusche in allen vier Quadranten und „+++“ laute, frequente Darmgeräusche in allen vier Quadranten kennzeichnet. 55 Ergebnisse Tab. 3: Zeitraum (Minuten; Mittelwert, SD) zwischen Applikation von Morphin (0,1 mg/kg), Butorphanol (0,1 mg/kg) oder Levomethadon (0,1 mg/kg) (t0) und dem ersten Kotabsatz über einen Messzeitraum von 1350 Minuten (n=8). Morphin 0,1 mg/kg Butorphanol 0,1 mg/kg Levomethadon 0,1 mg/kg Pferd 1 480 150 330 Pferd 2 360 240 150 Pferd 3 60 210 45 Pferd 4 90 360 60 Pferd 5 180 120 270 Pferd 6 180 180 120 Pferd 7 120 150 90 Pferd 8 90 195 ± 149 50 183 ± 92 90 144 ± 103 Kotabsatz (min) 4.3.9 Herzfrequenz und Atemfrequenz Nach Applikation von Morphin (0,1 mg/kg), Butorphanol (0,1 mg/kg) und Levomethadon (0,1 mg/kg) kam es zu keiner signifikanten Veränderung der Herzoder Atemfrequenz (Anhang 7 und 8). 4.4 Opioide in der hohen Dosierung 4.4.1 Reaktion auf den thermischen Stimulus In 51,9% der Fälle zeigten die Pferde als Reaktion auf den thermischen Stimulus einen Pannikulusreflex, wobei bei 12,5% der Messungen zusätzlich eine bewusste Reaktion zu beobachten war. Hierbei zeigten die Pferde Schütteln des ganzen Körpers, Schütteln des Kopfes, Umdrehen des Kopfes in Richtung Widerrist oder Schweifschlagen, aber auch sehr dezente Reaktion wie nach hinten Drehen der Ohren oder ein plötzlich auftretender, aufmerksamer und konzentrierter Gesichtsausdruck. In 27,5% der Messungen traten bewusste Reaktionen ohne gleichzeitig auftretenden Pannikulusreflex auf. Als Reaktion auf den Stimulus wurde hier nur eindeutiges 56 Ergebnisse Schütteln des Kopfes oder des Körpers und Umdrehen des Kopfes in Richtung Widerrist gewertet. Die cut-out Temperatur wurde in 20,6% (74 von 360) der Messungen erreicht, wovon alle in den Zeitraum nach Opioid-Applikation fielen. 4.4.2 Kontroll-Messung Der Mittelwert der Kontrolle lag in der B0,2-Behandlung bei 46,85 ± 2,4 °C, in der L 0,2Behandlung bei 46,98 ± 1,6 °C und in der M 0,2-Behandlung bei 46,76 ± 2,6 °C. Diese Werte wiesen keine signifikanten Unterschiede auf, die maximale Temperaturdifferenz dieser Mittelwerte lag bei 0,22 °C. 4.4.3 Schwellenwerte nach Morphin–Applikation (0,2 mg/kg) Der mittlere thermische nozizeptive Schwellenwert war in Behandlung M0,2 für 240 Minuten signifikant (p<0,05) erhöht. Der Maximalwert lag mit 51,8 °C bei 30 Minuten und die Werte der Kontrolle konnten nach 540 Minuten erreicht werden. Zwischen der P-Behandlung und der M0,2-Behandlung kam es nach 10, 30, 90, 180 sowie 240 Minuten zu einem signifikanten Unterschied der Schwellenwerte (Abb.11). Der Verlauf der TE % Werte war vergleichbar mit dem Verlauf der absoluten Schwellenwerte (Anhang 6). 57 Ergebnisse Abb. 11: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl) (n=8) und M0,2 (Morphin 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. * Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschied (p<0,05) zu der Behandlu ng P. 4.4.4 Schwellenwerte nach Butorphanol-Applikation (0,2 mg/kg) Der mittlere thermische nozizeptive Schwellenwert war in der Behandlung B0,2 für 90 Minuten signifikant (p<0,05) erhöht. Der Maximalwert lag mit 54,65 °C bei 10 Minuten und die Werte der Kontrolle konnten nach 540 Minuten erreicht werden. Zwischen den Behandlungen P und B0,2 konnten nach 10, 30, 60 und 90 Minuten signifikante Unterschiede der Schwellenwerte festgestellt werden (Abb. 12). Der Verlauf der TE % Werte war vergleichbar mit dem Verlauf der absoluten Schwellenwerte (Anhang 6). 58 Ergebnisse Abb. 12: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl) (n=8) und B0,2 (Butorphanol 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. * Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschied (p<0,05) zu der Behandlu ng P. 4.4.5 Schwellenwerte nach Levomethadon-Applikation (0,2 mg/kg) Der mittlere thermische nozizeptive Schwellenwert war in der L0,2-Behandlung für 300 Minuten signifikant (p<0,05) erhöht. Der Maximalwert (55,74 °C) wurde nach 30 Minuten erreicht und die Werte der Kontrolle konnten nach 540 Minuten erreicht werden (Abb. 13). Zwischen der P-Behandlung und L0,2-Behandlung kam es nach 10, 30, 60, 90, 120, 180, 240 und 300 Minuten zu einem signifikanten Unterschied der Schwellenwerte. Der Verlauf der TE % Werte war vergleichbar mit dem Verlauf der absoluten Schwellenwerte (Anhang 6). 59 Ergebnisse Abb. 13: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl) (n=8) und L0,2 (Levomethadon 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AMApplikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. * Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschied (p<0, 05) zu der Behandlung P. 4.4.6 Die Schwellenwerte der drei Opioide im Vergleich (0,2 mg/kg) Zum Zeitpunkt t10, t30 und t60 konnte ein signifikanter Unterschied der Schwellenwerte der Behandlungen L0,2 und M0,2 festgestellt werden. Die Behandlungen L0,2 und B0,2 wiesen nach 120 Minuten signifikante Unterschiede der Schwellenwerte auf. Zwischen den Schwellenwerten der Behandlungen B0,2 und M0,2 kam es nach 60 Minuten zu signifikanten Unterschieden der Schwellenwerte (Abb.14). 60 Ergebnisse Abb. 14: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen P (NaCl), M0,2 (Morphin 0,2 mg/kg) B0,2 (Butorphanol 0,2 mg/kg) und L0,2 (Levomethadon 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. *Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschied (p<0,05) zu der Behandlung M0,2. ^Signifikanter Unterschied (p<0,05) zu der Behandlung B0,2. 4.4.7 Verhalten der Pferde nach Injektion von Morphin, Butorphanol und Levomethadon (0,2 mg/kg) In den Behandlungen M0,2, B0,2 und L0,2 zeigten die Pferde Drangwandern, Lippenspiel, Kopfzucken, einen erhöhten Muskeltonus, Zittern, Ataxie und Leerkauen. Ein simuliertes Fressverhalten konnte in Form von starkem Betteln (Scharren mit den Vordergliedmaßen vor der Krippe) sowie Futtersuche in den Behandlungen M0,2, B0,2 und L0,2 beobachtet werden (Tab. 4). Bei keinem der Pferde konnte nach AM-Gabe eine Sedierung beobachtet werden. 61 Ergebnisse Tab. 4: Verhalten der Pferde nach Applikation von Morphin, Butorphanol und Levomethadon in einer Dosierung von 0,2 mg/kg. Angegeben ist die Anzahl der Pferde (n=8), die mit Verhaltensänderungen in Form von Drangwandern, Lippenspiel, Zungenspiel, Leerkauen, Kopfzucken, einem erhöhten Muskeltonus, Zittern, Ataxie oder einem simulierten Fressverhalten nach der AM-Applikation über einen Untersuchungszeitraum von 1350 Minuten aufgefallen sind. 0,2 mg/kg Morphin Butorphanol Levomethadon Drangwandern kein 3 0 0 ggr. 4 5 3 mgr. 1 1 3 hgr. 0 2 2 Lippenspiel 1 3 2 Zungenspiel 0 0 0 Leerkauen 1 1 1 Kopfzucken 2 3 3 Muskeltonus Ĺ 1 3 5 Zittern 1 0 3 Ataxie 1 6 4 Fressverhalten 4 2 3 In der M0,2-Behandlung konnte nach 135 ± 179 Minuten, in der B0,2-Behandlung nach 169 ± 70 Minuten und in der L0,2-Behandlung nach 154 ± 81 Minuten erneut ein normales Verhalten beobachtet werden. Signifikante Unterschiede der Mittelwerte der Behandlungen M0,2, B0,2 und L0,2 sind nicht aufgetreten. Es konnte jedoch ein signifikanter Unterschied der Mittelwerte zwischen den Behandlungen B0,1 und B0,2 (p<0,05) sowie zwischen den Behandlungen L0,1 und L0,2 (p<0,05) festgestellt werden. Zwischen den Behandlungen M0,1 und M0,2 wiesen die Mittelwerte keine signifikanten Unterschiede auf. 4.4.8 Kotabsatz und Darmgeräusche Die Darmgeräusche waren in der M0,2-Behandlung im Mittel für 158 ± 77 Minuten, in der B0,2-Behandlung für 90 ± 23 Minuten und in der L0,2-Behandlung für 105 ± 51 Minuten reduziert, d.h. sie erreichten nach diesem Zeitraum den Zustand vor der AM62 Ergebnisse Applikation (Tab. 5). Ein signifikanter Unterschied zwischen den Behandlungen konnte nicht festgestellt werden. Der erste Kotabsatz nach AM-Applikation war in der M0,2-Behandlung im Mittel nach 188 ± 148 Minuten, in der B0,2-Behandlung nach 129 ± 82 Minuten und in der L0,2Behandlung nach 130 ± 100 Minuten zu beobachten (Tab. 6), wobei auch hier keine signifikanten Unterschiede zwischen den Behandlungen aufgetreten sind. Tab. 5: Zeitraum (Minuten; Mittelwert, SD), in dem eine Reduzierung der Darmgeräusche nach Applikation von Morphin (0,2 mg/kg), Butorphanol (0,2 mg/kg) oder Levomethadon (0,2 mg/kg) bis zum Erreichen des Zustandes vor AM-Applikation festgestellt werden konnte. Darmgeräusche reduziert (min) Morphin 0,2 mg/kg Butorphanol 0,2 mg/kg Levomethadon 0,2 mg/kg Pferd 2 90 60 90 Pferd 3 60 120 90 Pferd 4 240 90 120 Pferd 5 180 120 60 Pferd 6 240 60 60 Pferd 7 120 90 180 Pferd 8 90 90 60 158 ± 76 90 ± 23 105 ± 51 Zu jedem Messzeitpunkt (t0–t1350) wurden die Darmgeräusche der Pferde (n=8) in allen vier Quadranten (rechte und linke Fossa lumbalis, rechts und links abdominal) auskultatorisch überprüft und mit einem Score von „-“ bis „+++“ beurteilt, wobei „-“ keine Darmgeräusche in allen vier Quadranten und „+++“ laute, frequente Darmgeräusche in allen vier Quadranten kennzeichnet. 63 Ergebnisse Tab. 6: Zeitraum (Minuten; Mittelwert, SD) zwischen Applikation von Morphin (0,2 mg/kg), Butorphanol (0,2 mg/kg) oder Levomethadon (0,2 mg/kg) (t0) und dem ersten Kotabsatz über einen Messzeitraum von 1350 Minuten (n=8). Morphin 0,2 mg/kg Butorphanol 0,2 mg/kg Levomethadon 0,2 mg/kg Pferd 1 420 300 300 Pferd 2 90 120 240 Pferd 3 120 102 10 Pferd 4 60 60 120 Pferd 5 90 180 120 Pferd 6 300 120 120 Pferd 7 360 120 120 Pferd 8 60 188 ± 148 30 129 ± 82 10 130 ± 100 Kotabsatz (min.) 4.4.9 Herzfrequenz und Atemfrequenz Nach Applikation von Morphin (0,2 mg/kg), Butorphanol (0,2 mg/kg) und Levomethadon (0,2 mg/kg) kam es zu keiner signifikanten Veränderung der Atemfrequenz (Anhang 7). In der Behandlung M0,2 konnte eine im Vergleich zu der Kontrolle (39 ± 3 Schläge/Minute) kurzzeitige signifikante Erhöhung der Herzfrequenz zum Zeitpunkt t30 (42 ± 3 Schläge/Minute) beobachtet werden (Anhang 8). In der Behandlung B0,2 konnte keine signifikante Erhöhung der Herzfrequenz registriert werden, wobei es zum Zeitpunkt t10-60 bei einem Pferd zu einer Erhöhung der Herzfrequenz bis zu 56 Schlägen/Minute kam. In der L0,2-Behandlung kam es im Vergleich zu der Kontrolle (37 ± 4 Schläge/Minute) zu einer signifikanten Erhöhung der Herzfrequenz zum Zeitpunkt t10 (45 ± 6 Schläge/Minute) und t30 (47 ± 4 Schläge/Minute). 4.5 Vergleichende Darstellung der Schwellenwerte in beiden Dosierungen Zwischen den Behandlungen M0,1 und M0,2 kam es nach 180 Minuten zu einem signifikanten Unterschied der Schwellenwerte (Abb. 15). Es konnten keine signifikanten Unterschiede der Schwellenwerte zwischen den Behandlungen B0,1 und B0,2 festgestellt werden (Abb. 16). 64 Ergebnisse Zwischen den Behandlungen L0,1 und L0,2 kam es nach 10, 30 und 90 Minuten zu signifikanten Unterschieden der Schwellenwerte (Abb. 17). Abb. 15: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen M0,1 (Morphin 0,1 mg/kg) (n=8) und M0,2 (Morphin 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. *Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschie d (p<0,05) zwischen den Behandlungen M0,1 und M0,2. 65 Ergebnisse Abb. 16: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen B0,1 (Butorphanol 0,1 mg/kg) (n=8) und B0,2 (Butorphanol 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. *Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). 66 Ergebnisse Abb. 17: Verlauf der nozizeptiven Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlungen L0,1 (Levomethadon 0,1 mg/kg) (n=8) und L0,2 (Levomethadon 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. *Signifikanter Unterschied (p<0,05) zu dem Kontrollwert (t0). °Signifikanter Unterschie d (p<0,05) zwischen den Behandlungen L0,1 und L0,2. 4.6 Hautirritationen nach der thermischen Stimulation Das zur Thermostimulation genutzte Hautareal am Widerrist wurde nach jeder Messung und nach 24 Stunden auf Hautirritation überprüft. Bei Temperaturen des Heizelementes bis 53 °C konnten hier keine Hautreak tionen festgestellt werden, wohingegen es bei Erreichen der cut-out Temperatur von 55 °C zu ca. 1 x 0,3 cm großen, erhabenen, geröteten Hautveränderungen kam. Diese waren direkt nach der Messung häufig nicht sichtbar, entwickelten sich jedoch innerhalb von 24 Stunden zu Papeln, die in vereinzelten Fällen mit pergamentartiger Ablösung der obersten Keratinschicht einhergingen. Die Abheilung erfolgte in allen Fällen unter lokaler Therapie mit einer SulfadiazinSilber-haltigen Salbe (Flammazine®, Sinclair Pharmaceuticcal Espana, San Fernando de Henares, Spanien) komplikationslos innerhalb einiger Tage. 67 Diskussion 5 Diskussion Ziel dieser Studie war die Evaluierung der analgetischen Effektivität und Wirkdauer gebräuchlicher Dosierungen von Morphin, Butorphanol und Levomethadon sowie einer erhöhten Dosierung dieser Opioide beim Pferd. Dabei wurde die Hypothese aufgestellt, dass die Dosiserhöhung der Opioide eine Steigerung und Verlängerung der Analgesie bewirkt. Ein weiteres Ziel der Studie war der Vergleich der Opioidinduzierten Nebenwirkungen der Morphinderivate bezüglich Vorkommen und Ausprägung. 5.1 Methodik 5.1.1 Methode zur Bestimmung des nozizeptiven Schwellenwertes Die kutane Thermostimulation konnte erfolgreich eingesetzt werden, um verschiedene Morphinderivate beim Pferd zu evaluieren. Alle hier untersuchten Pferde tolerierten das aufgebaute System gut und reagierten mit Pannikulusreflex oder bewusster Abwehrreaktion auf den thermischen Stimulus. Nur ein Pferd wurde in den Vorversuchen aus der Studie ausgeschlossen, da es keine eindeutige Reaktion auf den applizierten thermischen Stimulus zeigte. Diese Beobachtung steht mit vorherigen Studien zur Thermostimulation mithilfe Kontaktwärmestimulation beim Pferd überein (ROBERTSON et al. 2005; SANCHEZ et al. 2008; LOVE et al. 2011b; POLLER et al. 2013). Die objektive Evaluierung verschiedener Analgetika zur Erarbeitung effektiver Schmerztherapien mit experimentellen Schmerzmodellen beim Tier stellt einen wichtigen Forschungsbereich der Veterinärmedizin dar. Hierbei ist die Übereinstimmung des Versuchsaufbaus mit dem Tierschutzgesetz sowie mit allgemeingültigen ethisch-moralischen Gesichtspunkten essentiell. Daraus ergibt sich das Ziel Schmerz zu testen, ohne starke oder lang anhaltende Schmerzen beim Tier zu verursachen. Mit der hier beschriebenen Thermostimulation ist es möglich, das Pferd in seiner gewohnten Umgebung zu halten und einen kurzen schmerzhaften Stimulus zu applizieren, der nach einer Reaktion des Tieres umgehend abgestellt wird und das Tier möglichst gering belastet. Über den gesamten Studienverlauf konnte weder gegenüber dem Untersucher, noch gegenüber dem Testsystem eine Aversion der Pferde beobachtet werden. Die Pferde zeigten auch nach wiederholter 68 Diskussion Stimulation kein Abwehrverhalten beim Aufbringen des Systems und tolerierten das aufgebrachte Instrumentarium gut. Die Abweichung der gemittelten Schwellenwerte der verschiedenen Behandlungen vor AM-Gabe (Kontrollwert) ist gering ausgefallen. Auch in der Placebo-Behandlung lagen die mittleren Schwellenwerte dicht beieinander und blieben insgesamt über die Zeit und auch nach wiederholter Stimulation stabil. Ein abweichender, erhöhter Schwellenwert in der Behandlung P zum Zeitpunkt t120 ist mit einer ausbleibenden Reaktion eines Pferdes und somit einem Erreichen der cut-out Temperatur zu erklären. Die thermische nozizeptive Stimulation stellt eine natürliche Schmerzmodalität dar. Der thermische nozizeptive Reiz wird über in der Haut liegende C-polymodale Nozizeptoren oder Aį-mechanoheat Nozizeptoren registriert (BECK et al. 1974; LYNN u. CARPENTER 1982; HARPER u. LAWSON 1985). Abhängig von der Heizrate werden die C- oder Aį-Fasern aktiviert (MCMULLAN et al. 2004; LOVE et al. 2011a). Bei der hier gewählten Heizrate von 0,6 °C/s ist von einer Aktivierung der C-Fasern auszugehen (YEOMANS u. PROUDFIT 1996). Während in der vorliegenden Studie nach Gabe von Butorphanol (0,1 mg/kg) eine signifikante Erhöhung der Schwellenwerte für 90 Minuten auftrat, konnten SPADAVECCHIA et al. (2007) in der gleichen Dosierung mithilfe elektrischer Stimulation keine sichere Analgesie nachweisen. Durch die dort gewählte Stromstärke von 1-5,5 mA ist von einer Aktivierung der Aį-Fasern auszugehen, so dass die Autoren ihre Ergebnisse als ein ungenügendes Ansprechen der Aį-Fasern auf Butorphanol interpretieren. Es ist bekannt, dass ȝ-Agonisten vor allem die C-Faser-Aktivität hemmen, während ihr Einfluss auf die myelinisierten Aį-Fasern gering ist (COOPER et al. 1986; STRIMBU-GOZARIU et al. 1993). Die verwendete Methode der kutanen Thermostimulation stellt somit eine geeignete Methode dar, um Opioidwirkungen beim Pferd nachzuweisen. Ein Nachteil der Kontaktwärmestimulation mit dem direkt auf die Haut aufgebrachten Heizelement ist die mögliche Aktivierung von Mechanorezeptoren (SVENSSON et al. 1997). Aus diesem Grund wurde das Heizelement frühzeitig auf die Haut aufgebracht, gefolgt von einer kurzen Adaptionszeit bis zum Start des Heizvorgangs, 69 Diskussion mit dem Ziel, den Einfluss der Mechanorezeptoren auf die Messergebnisse zu minimieren. Die Wahl der Lokalisation der Stimulation am Körper des Pferdes kann die eindeutige Zuordnung einer Abwehrreaktion (Endpunkt) eventuell beeinflussen. Eine bekannte Nebenwirkung von Opioiden beim Pferd ist das Opioid-induzierte Drangwandern (COMBIE et al. 1979; COMBIE et al. 1981b; ROBERTSON et al. 1981; KALPRAVIDH et al. 1984a; KNYCH et al. 2012), welches auch in dieser Studie bei den meisten Probanden auftrat. Eine Stimulation an der Gliedmaße und einem damit erwarteten Endpunkt in Form von Hochziehen der Gliedmaße kann mit der motorischen Aktivität interferieren (KAMERLING et al. 1985; SPADAVECCHIA et al. 2007; LOVE et al. 2011b). Eine korrekte Identifizierung des Endpunktes ist somit nicht zu gewährleisten, so dass in der vorliegenden Studie für die Stimulation der Widerrist gewählt wurde. Eine Auswertung und Endpunkterkennung, in Form eines Pannikulusreflexes oder einer bewussten Reaktion, war unabhängig von den Verhaltensänderungen des Pferdes über den gesamten Messzeitraum möglich. Auch in anderen Studien konnte mithilfe der Stimulation am Widerrist der Pannikulusreflex oder eine bewusste Reaktion als ein klarer, leicht erkennbarer Endpunkt festgelegt werden (KAMERLING et al. 1985; LOVE et al. 2011b; POLLER et al. 2013). Die Thermostimulation am Widerrist scheint somit eine verlässliche und wiederholbare Methode darzustellen, um den nozizeptiven Schwellenwert beim Pferd zu ermitteln. Im Verlauf der Studie stellte sich der Pannikulusreflex jedoch nur zum Teil als stabil heraus, da im ersten Teil des Versuches mehr Pferde mit einem Pannikulusreflex reagierten. Im zweiten Teil des Versuches stieg der Anteil der Pferde die mit einer bewussten Reaktion auf den thermischen Stimulus reagiert haben. Es kam dabei jedoch nicht zu falsch positiven Ergebnissen in den Kontrollmessungen oder in der Placebobehandlung. Die Pferde haben die Antwort auf den Stimulus nicht komplett ausgelassen, sondern stattdessen mit einer bewussten Reaktion, in Form von Schütteln oder Umdrehen des Kopfes in Richtung Widerrist reagiert, ohne zuvor einen Pannikulusreflex zu zeigen. Eine zeitliche Versetztheit des Pannikulusreflexes und der bewussten Reaktion ist nicht auszuschließen, so dass hier eine Schwachstelle dieser Methodik anzusprechen ist. Im Verlauf der Messungen konnte jedoch gehäuft eine bewusste Reaktion in Kombination mit einem Pannikulusreflex 70 Diskussion beobachtet werden, wobei diese immer innerhalb von 1-2 Sekunden hintereinander aufgetreten sind. Bei einer Heizrate von 0,6 °C/s w ürde die Fehlerrate somit bei 0,61,2 °C liegen. Zudem sind die Schwellenwerte der Ko ntrolle der verschiedenen AMBehandlungen und der Placebo-Behandlung über den gesamten Untersuchungszeitraum stabil geblieben, so dass der Einfluss des reduziert auftretenden Pannikulusreflexes auf die Ergebnisse als gering einzuschätzen ist. Eine mögliche Erklärung für diese Beobachtung konnte nicht gefunden werden. CHAMBERS et al. (1990) haben bei Evaluieren eines mechanischen Schmerztests einen Lerneffekt beobachten können, der sich aber von der oben beschriebenen Reduzierung des Pannikulusreflexes unterscheidet. Die Pferde haben vor Setzen des mechanischen Stimulus mit dem Hochziehen der Gliedmaße auf das aufgebrachte System reagiert. In dieser Studie ist nur bei einem Pferd vereinzelt ein Lerneffekt in Form von einer frühzeitigen bewussten Reaktion aufgetreten, der letztendlich mithilfe des kabellosen Systems vermieden werden konnte. Durch die Steuerung des Messvorgangs über die Fernbedienung konnte der Untersucher sich unauffällig am Rande oder außerhalb der Box aufhalten. So konnte ein normales Verhalten des Pferdes abgewartet werden, um dann zeitversetzt zum Aufbringen des Systems den Messvorgang zu starten. Die Wahl der Heizrate bei der Bestimmung des nozizeptiven Schwellenwertes mithilfe der Thermostimulation kann die Genauigkeit der Ergebnisse beeinflussen und die Streuung der ermittelten Schwellenwerte reduzieren (LOVE et al. 2008). In dieser Studie wurde eine Heizrate von 0,6 °C/s gewä hlt, da für die Lokalisation am Widerrist mit dieser Heizrate wiederholbare Ergebnisse beim Pferd erreicht werden konnten (ROBERTSON et al. 2005; POLLER et al. 2013). Da die Außentemperatur einen Einfluss auf die Hauttemperatur sowie den Heizvorgang und die Temperaturübertragung haben kann (BERRY et al. 1984; LASCELLES et al. 1995; POLLER et al. 2013), wurden alle Messungen bei Temperaturen zwischen 10 °C und 25 °C Außentemperat ur durchgeführt. Bei diesen Temperaturbedingungen wurden in einer vorherigen Untersuchung die wenigsten Fehlmessungen beobachtet (POLLER et al. 2013). Der Anspruch an die gewählte cut-out Temperatur liegt darin, zum einen potentielle Gewebeschäden zu vermeiden und zum anderen möglichst eindeutige und differenzierbare Ergebnisse zu erreichen. 71 Während bei einer niedrigen Diskussion Maximaltemperatur von 45 °C gehäuft die cut-out Tem peratur erreicht wurde (SANCHEZ et al. 2008) und damit eine analgetische Wirkung einer Substanz mit möglicher Erhöhung des thermischen Schwellenwertes statistisch nicht erkennbar war (ELFENBEIN et al. 2009), konnte mit einer cut-out Temperatur von 55 °C nach Gabe von Lidocain eine statistisch relevante Erhöhung der Schwellenwerte beobachtet werden (ROBERTSON et al. 2005). Auch in der vorliegenden Studie konnten mit einer cut-out Temperatur von 55 °C die antinozizeptiven Effekte der Opioide deutlich identifiziert werden. Bei Erreichen von 55 °C kam es jedoch bei einigen Pferden zu Hautreaktionen, die innerhalb weniger Tage komplikationslos zur Abheilung kamen. Die Schwellenwerte der Kontrolle der einzelnen Behandlungen haben mit Temperaturen zwischen 46,05 und 46,98 °C einen deutlichen Abstand zu der hier gewählten cut-out Temperatur. In zukünftigen Studien kann somit eine Reduzierung um 1-2 °C in Betracht gezogen werden, u m mögliche Hautirritation zu vermeiden. LOVE et al. (2011b) konnten mit einer cut-out Temperatur von 53 °C gute Ergebnisse erzielen, ohne dass Hautirritationen aufgetreten sind. Ein möglicher Einfluss der gewählten Heizrate (0,5 °C/s, bzw. 0,6 °C/s in der vorliegenden Studie) und der damit verbundenen Kontaktzeit des Heizelementes mit erhöhter Temperatur ist hierbei jedoch nicht zu vernachlässigen. 5.1.2 Medikamente und Dosierungen Aufgrund der exzitatorischen und lokomotorischen Nebenwirkungen von Opioiden, werden Morphin und Morphinderivate in der Praxis häufig mit Į2-Agonisten oder Acepromazin kombiniert (CLARKE u. PATON 1988; NILSFORS et al. 1988; TAYLOR et al. 1988; LEBLANC 1991). Ziel dieser Studie war es jedoch, den reinen Effekt von Morphin, Butorphanol und Levomethadon auf den nozizeptiven Schwellenwert zu testen. Da Į2-Agonisten selbst einen analgetischen Effekt aufweisen, kann es zu einem direkten Einfluss der Į2-Agonisten auf den nozizeptiven Schwellenwert kommen (SCHATZMAN et al. 2001; MOENS et al. 2003; SPADAVECCHIA et al. 2005; ROHRBACH et al. 2009). Für das Testen der analgetischen Wirkung von Opioiden stellt die zusätzliche Gabe von Acepromazin eine mögliche Kombination dar, da einerseits das Opioid-induzierte Drangwandern reduziert wird (DHASMANA et al. 1972; COMBIE et al. 1981a; COMBIE et al. 1981b) und andererseits kein Einfluss von Acepromazin auf den nozizeptiven Schwellenwert zu erwarten ist (POLLER 2012). Dies wurde in 72 Diskussion Vorversuchen überprüft, durch die Wahl des Stimulationspunktes am Widerrist konnte jedoch keine Interferenz des Drangwanderns mit der Auswertung des Endpunktes festgestellt werden, so dass von einer Kombination mit Acepromazin abgesehen werden konnte. Bei der Dosisfindung von Morphin, Butorphanol und Levomethadon im ersten Teil des Versuches orientierte man sich an Angaben aus der Literatur, aktuellen Lehrbüchern (CLARKE u. PATON 1988; SCHATZMAN et al. 2001; SELLON et al. 2001; MIRCICA et al. 2003; CLARK et al. 2005; CORLETTO et al. 2005; MUIR u. HUBBEL 2008; FIGUEIREDO et al. 2012; KNYCH et al. 2012) und dem Beipackzettel der einzelnen Medikamente sowie an gebräuchlichen Dosierungen im alltäglichen klinischen Einsatz. Im zweiten Teil des Versuches war es das Ziel, den Einfluss einer Dosiserhöhung auf die analgetische Effektivität und das Auftreten von Nebenwirkungen zu evaluieren. Die Gabe der Opioide in 100 ml isotoner Kochsalzlösung über zehn Minuten (Kurzinfusion) wurde gewählt, da in den Vorversuchen ein Pferd nach Bolus Injektion von Morphin (0,1 mg/kg) mit starkem Schwitzen, Husten, Hyperventilation und einer kurzfristigen Erhöhung der Herzfrequenz von 44 auf 60 Schlägen/Minute aufgefallen ist. Die potentielle Histaminausschüttung ist eine bekannte Nebenwirkung nach Morphin Injektion in der Humanmedizin (WITHINGTON et al. 1993) und wurde auch bei Pferden beobachtet (K. CLARKE, persönliche Mitteilung). Die beschriebene Reaktion konnte im Verlauf dieser Studie im Anschluss der Gabe der Opioide nicht weiter beobachtet werden. 5.2 Ergebnisse 5.2.1 Morphin Morphin stellt den Prototyp der Opioide dar und wird häufig in einer Dosierung von 0,1 mg/kg beim Pferd empfohlen (CLARKE u. PATON 1988; MIRCICA et al. 2003; CORLETTO et al. 2005; FIGUEIREDO et al. 2012). In unserer Studie konnte nach Applikation von Morphin (0,1 mg/kg) keine signifikante Erhöhung der nozizeptiven Schwellenwerte erreicht werden, obwohl ein geringgradiger und verzögerter Anstieg des Schwellenwertes zu beobachten war. Dieses Ergebnis stimmt überein mit den Ergebnissen einer Studie von FIGUEIREDO et al. (2012), in der nach intravenöser 73 Diskussion Gabe von 0,05 mg/kg und 0,1 mg/kg Morphin keine signifikante Erhöhung der nozizeptiven Schwellenwerte nach Thermostimulation festgestellt werden konnte. In der höheren Dosierung von Morphin (0,2 mg/kg) konnte jedoch eine signifikante, moderate Erhöhung der Schwellenwerte für 240 Minuten beobachtet werden. Vergleichbare kontrollierte Studien zur intravenösen Applikation von Morphin in dieser Dosierung sind der Autorin nicht bekannt. Während die auch in Lehrbüchern empfohlene Dosierung von 0,1 mg/kg in der vorliegenden Studie keine sichere Analgesie gewährleisten konnte, stimmen die Ergebnisse nach Gabe von Morphin in der höheren Dosierung eher mit einer erhöhten Dosisempfehlung von CLUTTON (2010) (Morphin 0,1-0,3 mg/kg i.v.) überein. 5.2.1.1 Einfluss von Morphin auf das Verhalten Die in der Behandlung M0,1 nur geringgradig aufgetretenen Verhaltensänderungen, passen zu den Beobachtungen von FIGUEIREDO et al. (2012), in der nach Gabe von Morphin in einer Dosierung von 0,05 und 0,1 mg/kg kein abnormes Verhalten oder signifikant erhöhtes Drangwandern festgestellt werden konnte. Dosisabhängig ist es nach Morphingabe zu einem verstärkten Auftreten von Drangwandern und weiteren unerwünschten Wirkungen gekommen. So konnte in der Behandlung M0,2 bei vier Pferden geringgradiges und bei einem Pferd mittelgradiges Drangwandern beobachtet werden. Auch in weiteren Studien konnte eine dosisabhängige Verstärkung des Drangwanderns nach Morphin-Gabe beobachtet werden. Morphin löste in einer Dosierung von 0,1 und 0,3 mg/kg (i.v.) kaum Drangwandern aus, während in derselben Studie nach Applikation von Morphin (0,6 mg/kg i.v.) über einen Zeitraum von vier Stunden deutliches Drangwandern zu beobachten war (COMBIE et al. 1979). In einer weiteren Studie löste Morphin in einer Dosierungen von 2,4 mg/kg i.v. über Stunden starkes Drangwandern sowie zusätzliche Unkoordination aus (COMBIE et al. 1981b). Zudem kam es in der vorliegenden Studien nach Morphin-Injektion in einer Dosierung von 0,2 mg/kg vereinzelt zu Verhaltensänderungen, Ataxie und Zittern. Dies konnte ähnlich nach Injektion von 0,66 mg/kg Morphin i.m. beobachtet werden mit exzitatorischem Verhalten im Sinne von Drangwandern, Zittern, Scharren und Kopfzucken kam (KALPRAVIDH et al. 1984b). 74 Diskussion Es ist zu beachten, dass die oben beschriebenen Dosierungen von Morphin, die zu lang anhaltenden, starken Drangwandern führten, deutlich oberhalb der klinisch eingesetzten Dosis liegen. Beim Einsatz von Morphin in Dosierungen von 0,1-0,2 mg/kg ist somit von milden, klinisch akzeptablen unerwünschten Verhaltensänderungen auszugehen. 5.2.1.2 Einfluss von Morphin auf den Darmtrakt Der negative Einfluss von Opioiden auf die Peristaltik des Darmtrakts und ein damit verbundenes Risiko einer Obstipation ist eine bekannte Nebenwirkung von Morphin (ROBERTS u. ARGENZIO 1986; KOHN u. MUIR 1988; BOSCAN et al. 2006). In der vorliegenden Studie kam es nach Gabe von Morphin zu einer Reduzierung der Darmgeräusche für 113 Minuten (0,1 mg/kg) bzw. 158 Minuten (0,2 mg/kg), wobei die Werte keine signifikanten Unterschiede aufweisen. Diese Ergebnisse stehen im Einklang mit einer aktuellen Studie zum Einfluss von Morphin auf den Darmtrakt. Hier konnte nach Gabe von 0,1 mg/kg Morphin i.v. eine Reduzierung der Darmgeräusche für 120 Minuten festgestellt werden, die abgesetzte Menge an Kot über einen Zeitraum von 48 Stunden veränderte sich jedoch nicht (FIGUEIREDO et al. 2012). Dies weist auf einen deutlichen Einfluss von Morphin auf den Magendarmtrakt des Pferdes hin. Obwohl es in dieser Studie zu keinen Kolikanzeichen kam, ist zu beachten, dass das Risiko einer Kolikerkrankung bei erkrankten Tieren deutlich höher anzusehen ist, als bei den hier genutzten klinisch gesunden Pferden. So konnte in einer retrospektiven Studie ein mit Morphin assoziiertes erhöhtes Risiko für Kolik nach orthopädischen Operationen festgestellt werden, während die Gabe von Butorphanol nicht mit einer erhöhten Inzidenz an Koliken einherging (SENIOR et al. 2004). Anzeichen eines simulierten Fressverhaltens konnte in dieser Studie nach MorphinGabe in einer Dosierung von 0,2 mg/kg beobachtet werden, während dies in einer Studie von COMBIE et al. (1979) schon nach Morphin-Injektion in einer Dosierung von 0,1 mg/kg auffiel. 5.2.1.3 Einfluss von Morphin auf die Atem– und Herzfrequenz Opioide besitzen dosisabhängige Wirkungen auf die Atemtätigkeit (GAYNOR u. MUIR 2008), jedoch konnte in beiden hier gewählten Dosierungen von Morphin kein 75 Diskussion Einfluss auf die Atemfrequenz ermittelt werden. Dies stimmt überein mit den Ergebnissen einer Studie von FIGUEIREDO et al. (2012), in welcher nach Gabe von Morphin (0,1 mg/kg i.v. und i.m.) keine Veränderung der Atemfrequenz festgestellt werden konnte. Es kam jedoch zu einem Absinken des Sauerstoffpartialdruckes, wobei die Werte über den kompletten Untersuchungszeitraum im Referenzbereich für den Sauerstoffpartialdruck für erwachsene Pferde lagen (FIGUEIREDO et al. 2012). Dagegen konnten in einer früheren Studie nach Applikation von Morphin (0,12 mg/kg) keine Veränderungen der arteriellen Blutgaswerte festgestellt werden (MUIR et al. 1978). Während es in einer Studie am stehenden, unsedierten Pferd nach Gabe von 0,1 mg/kg Morphin i.v. zu einer kurzzeitigen Erhöhung der Herzfrequenz kam (FIGUEIREDO et al. 2012), konnte dies in der vorliegenden Studie erst in der höheren Dosierung von 0,2 mg/kg beobachtet werden. Insgesamt ist der Einfluss von Morphin in den genutzten Dosierungen auf das kardiorespiratorische System als klinisch nicht relevant zu erachten. 5.2.2 Butorphanol Der synthetische Agonist-Antagonist Butorphanol wird häufig in der Pferdemedizin eingesetzt (PRICE et al. 2002) und wurde zudem in verschiedenen Studien zum Pferd untersucht (KALPRAVIDH et al. 1984b, a; SELLON et al. 2004; CORLETTO et al. 2005; KNYCH et al. 2012). Der Einsatz von Butorphanol wird vor allem in Hinblick auf die Behandlung von visceralen Schmerzzuständen empfohlen (KALPRAVIDH et al. 1984b). Unter praxisnahen Gesichtspunkten hat Butorphanol den Vorteil, dass es nicht unter das Betäubungsmittelgesetz fällt, was seinen im Verhältnis zu Morphin und Levomethadon häufigen Einsatz erklärt (PRICE et al. 2002). In beiden Dosierungen konnte in dieser Studie nach Butorphanol-Gabe eine signifikante Erhöhung der nozizeptiven Schwellenwerte für 90 Minuten festgestellt werden. KALPRAVIDH et al. (1984a) untersuchten die analgetische Effektivität verschiedener Dosierungen von Butorphanol auf Basis eines oberflächlichen (Thermostimulation) sowie visceralen Schmerzmodells und sehen basierend auf ihren Ergebnissen eine Dosierung von 0,2 mg/kg als optimal an. Dagegen konnte in dieser Studie kaum eine mit der Dosiserhöhung einhergehende Erhöhung der Schwellenwerte festgestellt werden. Vielmehr ähnelt der Kurvenverlauf in der Behandlung B0,1 stark dem Kurvenverlauf der mittleren Schwellenwerte der 76 Diskussion Behandlung B0,2. Ein Plateaueffekt bei Dosierungen oberhalb von 0,1 mg/kg liegt hier nahe, müsste aber über weitere Dosiserhöhung überprüft werden. Auch LOVE et al. (2011b) konnten nach Injektion von 0,1 mg/kg Butorphanol mithilfe der Thermostimulation eine signifikante Erhöhung der nozizeptiven Schwellenwerte feststellen, die sogar für 2,9 Stunden bestand. Hingegen konnten für Butorphanol in einer Dosierung von 0,1 mg/kg mithilfe der elektrischen Stimulation keine signifikant erhöhten Schwellenwerte nachgewiesen werden (SPADAVECCHIA et al. 2007). Die oben bereits beschriebene alleinige Aktivierung der Aį-Fasern nach Elektrostimulation mit der in dieser Studie verwendeten Stimulationsintensität kann zu diesem abweichenden Ergebnis beigetragen haben. 5.2.2.1 Einfluss von Butorphanol auf das Verhalten Wie schon in anderen Studien beobachtet werden konnte (ROBERTSON et al. 1981; KALPRAVIDH et al. 1984a), kam es auch hier zu einer dosisabhängigen Verstärkung des Drangwanderns nach Injektion von Butorphanol. Während in einer vorherigen Studie nach Injektion von Butorphanol (0,1 mg/kg; 0,2 mg/kg i.v.) Drangwandern nur für bis zu 40 bzw. 70 Minuten beobachtet werden konnte (KALPRAVIDH et al. 1984a), dauerte in dieser Studie das Drangwandern nach Butorphanol-Gabe (0,1 mg/kg; 0,2 mg/kg) länger an, so dass im Mittel nach 68 Minuten bzw. nach 169 Minuten ein normales Verhalten der Pferde erreicht werden konnte. Dagegen konnten KNYCH et al. (2012) nach intravenöser Butorphanol-Gabe (0,1 mg/kg) das Drangwandern für einen noch längeren Zeitraum, d.h. für bis zu 150 Minuten beobachten. Eine mögliche Erklärung für die unterschiedliche Dauer des Drangwanderns in den verschiedenen Studien sind individuelle Reaktionen auf die Opioid-Gabe (MAMA et al. 1993). Zudem ist der direkte Vergleich der Studien aufgrund nicht einheitlicher und Untersucher-abhängiger Beurteilungssysteme des Drangwanderns kritisch zu betrachten. Weitere Verhaltensauffälligkeiten wie ein erhöhter Muskeltonus, Zittern, Ataxie, Kopfzucken und Lippenspiel sind in beiden Dosierungen nach Butorphanol-Gabe aufgetreten. Ähnliche Verhaltensänderungen konnten auch in anderen Studien nach Butorphanol beobachtet werden (KALPRAVIDH et al. 1984b; NOLAN et al. 1994; SELLON et al. 2001; KNYCH et al. 2012). Während für das Drangwandern ein Dopamin-vermittelter Mechanismus diskutiert wird (DHASMANA et al. 1972; 77 Diskussion COMBIE et al. 1981b; PASCOE u. TAYLOR 2003), sind keine Informationen zu den weiteren Verhaltensänderungen beim Pferd aufzufinden. Bei der Katze konnte jedoch das Morphin-induzierte manische Verhalten nach Gabe eines Dopaminrezeptor-Blockers reduziert werden (DHASMANA et al. 1972), so dass ein Einfluss von Dopamin auf das gesamte Verhaltensrepertoire nach Opioid Verabreichung in Betracht gezogen werden kann. Der Einfluss weiterer Neurotransmitter, wie Gamma-Amino-Buttersäure, auf die zentral erregenden Eigenschaften von Opioiden wird diskutiert (KAMATA 1987). So konnte bei der Ratte die Injektion von GABA-Agonisten das durch einen ȝ-Agonisten ausgelöste Drangwandern reduzieren (AUSTIN U. KALIVAS 1998). 5.2.2.2 Einfluss von Butorphanol auf den Darmtrakt Obwohl Butorphanol als ț-Agonist einen geringeren negativen Einfluss auf den Magen-Darm-Trakt, im Sinne einer Reduzierung der Peristaltik, zugesprochen wird (ROBERTS u. ARGENZIO 1986; ROGER et al. 1994), konnten in mehreren Studien reduzierte Darmgeräusche nach Butorphanol nachgewiesen werden (SELLON et al. 2001; KNYCH et al. 2012). Auch in dieser Studie kam es nach Butorphanol-Gabe zu einer deutlichen Verringerung der Darmgeräusche und einem verzögerten Kotabsatz. Mit Dosiserhöhung kam es zu einer weiteren, jedoch statistisch nicht relevanten Reduzierung der Darmmotilität. Ein verzögerter Kotabsatz nach Butorphanol-Gabe (0,1-0,13 mg/kg) konnte ebenfalls von SELLON et al. (2001) beobachtet werden, wobei die totale gastrointestinale Transportzeit im Vergleich zu der PlaceboBehandlung keinen Unterschied aufwies. Simuliertes Fressverhalten wurde bei zwei Pferden in der Behandlung B0,2 beobachtet. Ähnliche Beobachtungen nach Injektion von Butorphanol konnten in der Literatur nicht gefunden werden. 5.2.2.3 Einfluss von Butorphanol auf die Atem –und Herzfrequenz Während in zwei Studien eine signifikante Erhöhungen der Herzfrequenz nach Gabe von Butorphanol in einer Dosierung von 0,1 mg/kg beobachtet werden konnte (SKARDA u. MUIR 2003; KNYCH et al. 2012), kam es in der vorliegenden Studie zwar vereinzelt zu einer kurzzeitigen Erhöhung (0,2 mg/kg) der Herzfrequenz, eine statistisch relevante Veränderung der Herzfrequenz konnte jedoch in beiden 78 Diskussion Dosierungen nicht festgestellt werden. Dies passt zu den Ergebnissen in weiteren Studien (ROBERTSON et al. 1981; SELLON et al. 2001; LOVE et al. 2011b), in denen keine signifikante Erhöhung der Herzfrequenz nach Butorphanol-Gabe beschrieben wurde. Wie in vorherigen Studien beeinflusste Butorphanol die Atemfrequenz am wachen Pferd nicht (ROBERTSON et al. 1981; KALPRAVIDH et al. 1984b; SELLON et al. 2001; LOVE et al. 2011b). Dagegen konnten SKARDA und MUIR (2003) nach Gabe von 0,1 mg/kg Butorphanol eine Erhöhung der Atemfrequenz mit gleichzeitiger Reduzierung des Sauerstoffpartialdruckes feststellen, die im Ausmaß jedoch als moderat und klinisch nicht relevant eingeschätzt werden müssen. Von einer klinischen Relevanz der kardiorespiratorischen Nebenwirkungen ist bei den hier genutzten Dosierungen von Butorphanol somit nicht auszugehen. 5.2.3 Levomethadon Während in dieser Studie nach Levomethadon-Gabe (0,1 mg/kg) eine signifikante Erhöhung der Schwellenwerte für 60 Minuten zu beobachten war, konnten SCHATZMAN et al. (2001) in der gleichen Dosierung mithilfe von elektrischer und mechanischer Stimulation eine signifikante Erhöhung der Schwellenwerte für 90 Minuten beobachten. Hierbei ist jedoch zu beachten, dass Levomethadon in Kombination mit Detomidin injiziert worden ist und die alleinige Gabe von Detomidin zu einer Erhöhung der Schwellenwerte für 45 bzw. 60 Minuten geführt hat. Ein synergistischer oder additiver Effekt von Detomidin und Levomethadon ist nicht auszuschließen. Dosisabhängig kam es zu einer weiteren Erhöhung des thermischen Schwellenwertes und Wirkungsverlängerung auf 300 Minuten bei Dosiserhöhung auf 0,2 mg/kg Levomethadon. Während in der Packungsbeilage von L-Polamivet® eine Dosisempfehlung von 0,05-0,075 mg/kg i.v. (in Kombination mit Xylazin (0,4-0,6 mg/kg)) angegeben ist und Levomethadon in anderen Studien (BRUGMANS u. DEEGEN 2001; SCHATZMAN et al. 2001) in einer Dosierung von 0,1 mg/kg eingesetzt worden ist, konnte hier eine dosisabhängige Steigerung und Verlängerung der Analgesie durch Levomethadon erreicht werden. Der Einsatz von Levomethadon in Dosierungen unter 0,1 mg/kg sollte somit neu überdacht werden, so dass weitere Studien notwendig sind um für den Einsatz von Levomethadon beim Pferd eine fundierte Dosisempfehlung zu erarbeiten. 79 Diskussion Weitere publizierte Studien zum Einsatz von Levomethadon beim Pferd sind der Autorin nicht bekannt. Beim Hund konnte nach intramuskulärer Injektion von Levomethadon (0,2 mg/kg) eine Erhöhung der nozizeptiven thermischen Schwellenwerte für 15 bis 120 Minuten erreicht werden (HOFFMANN et al. 2012). Methadon liegt als Racemat, also als Kombination aus Dextro –und Levomethadon, vor. Daher besitzt es, aufgrund der kaum vorhandenen analgetischen Wirksamkeit des rechtsdrehenden Dextromethadon, im Vergleich zu Levomethadon eine nur halb so starke analgetische Wirksamkeit (VERTHEIN et al. 2005; LEMBERG et al. 2006; BRUERA u. YENNURAJALINGAM 2011). Methadon wurde in einer Dosierung von 0,1 mg/kg in einer Kombination mit Detomidin (CLARKE u. PATON 1988), bzw. mit Acepromazin und Xylazin (NILSFORS et al. 1988) getestet. Ein noxischer Stimulus wurde durch Nadelstiche am Kronsaum gesetzt. Beide Arbeitsgruppen konnten nach Gabe von Methadon eine Reduzierung der Reaktion auf diesen Stimulus feststellen, wobei genaue zeitliche Angaben nicht gemacht wurden. Eine equipotente Dosierung von Levomethadon kann mit 0,05 mg/kg angegeben werden. Aufgrund der gleichzeitigen Applikation von Į2-Agonisten, die alleine schon einen analgetischen Effekt aufweisen, und aufgrund der nicht identischen analgetischen Testverfahren ist ein direkter Vergleich mit der vorliegenden Studie jedoch nicht möglich. 5.2.3.1 Einfluss von Levomethadon auf das Verhalten Nach Injektion von Levomethadon kam es dosisabhängig zu Drangwandern und Verhaltensauffälligkeiten in Form von Lippenspiel, Leerkauen, Kopfzucken, erhöhtem Muskeltonus, Zittern, Ataxie und simuliertem Fressverhalten. Ähnliche Verhaltensänderungen konnten zuvor in anderen Studien mit Methadon beobachtet werden. So konnten COMBIE et al. (1979) nach Gabe von Methadon (0,1; 0,5 und 1 mg/kg) dosisabhängiges Drangwandern für zwei bis fünf Stunden feststellen, begleitet von Unkoordination und versuchten Niedergehen in den höheren Dosierungen. Keinerlei Veränderung des Verhaltens oder Drangwandern sind in einer Studie von LINARDI et al. (2012) nach Injektion von Methadon (0,15 mg/kg i.v.) aufgefallen. Eine mögliche Erklärung könnte die verhältnismäßig geringe Dosierung sein, die umgerechnet in etwa 0,075 mg/kg Levomethadon entsprechen würde. 80 Diskussion In den vorliegenden Untersuchungen zeigten die Pferde vor allem in der höheren Dosierung (0,2 mg/kg) nach Levomethadon-Gabe deutliche unerwünschte Verhaltensauffälligkeiten. 5.2.3.2 Einfluss von Levomethadon auf den Darmtrakt Die negative Wirkung auf die Darmmotilität und ein damit verbundenes Risiko einer Obstipation ist eine bekannte Nebenwirkung beim Einsatz von Methadon in der Humanmedizin (YUAN et al. 1998). Auch in dieser Studie konnte nach Levomethadon-Gabe eine deutliche Reduzierung der Darmgeräusche und ein verzögerter Kotabsatz festgestellt werden. Dagegen konnten LINARDI et al. (2012) nach Gabe von Methadon (0,15 mg/kg) keine Verminderung der Darmmotilität beim Pferd feststellen, was wiederum an der umgerechnet niedrigen Dosierung liegen könnte. Ähnlich wie nach Injektion von Morphin und Butorphanol, verursachte Levomethadon in der höheren Dosierung ein simuliertes Fressverhalten. 5.2.3.3 Einfluss von Levomethadon auf die Atem –und Herzfrequenz Nur in der erhöhten Dosierung von 0,2 mg/kg induzierte Levomethadon eine Erhöhung der Herzfrequenz über 30 Minuten nach Injektion. Aufgrund der Kombination des Levomethadons mit dem Anticholinergikum Fenpipramid kann nicht differenziert werden, ob diese Herzfrequenzerhöhung über eine Opioid induzierte zentrale Erregung oder über den parasympatholytischen Effekt des Fenpipramids ausgelöst wurde. Studien zu den kardiorespiratorischen Auswirkungen von Levomethadon in der Kombination mit Fenpipramid (L-Polamivet®) oder zu Fenpipramid alleine sind der Autorin nicht bekannt. Nach alleiniger Gabe von Methadon (0,15 mg/kg) ist die Herzfrequenz und die Atemfrequenz der Pferde über den gesamten Untersuchungszeitraum im Referenzbereich geblieben (LINARDI et al. 2012). Dagegen konnten MUIR et al. (1978) nach Injektion von Methadon (0,12 mg/kg) geringfügige Schwankungen der Atemfrequenz und eine kurzfristige Erhöhung der Herzfrequenz und des Herzauswurfes beobachten. Insgesamt ist der Einfluss von Levomethadon in den hier genutzten Dosierungen auf das kardiorespiratorische System als klinisch nicht relevant zu erachten. 81 Diskussion 5.2.4 Vergleich der Opioide Die in der Literatur angegebene Potenz der drei Opioide liegt für Morphin bei 1, für Butorphanol bei 3-5 und für Methadon bei 1 (FEE u. BOVILL 2005; GAYNOR u. MUIR 2008; MUIR u. HUBBELL 2008), so dass sich für das Isomer Levomethadon eine Potenz von ca. 2 ergibt. Während es bei einer Dosierung von 0,1 mg/kg nach Gabe von Butorphanol und Levomethadon zu signifikant erhöhten Schwellenwerten kam, konnte nach Applikation von Morphin zwar ein leichter Anstieg der nozizeptiven Schwellenwerte festgestellt werden, diese erreichten jedoch zu keinem Zeitpunkt statistisch signifikante Werte. In der höheren Dosierung (0,2 mg/kg) kam es nach Gabe von Morphin zu signifikant erhöhten Schwellenwerten, diese liegen jedoch deutlich unterhalb der erreichten Schwellenwerte nach Injektion von Levomethadon (0,2 mg/kg) und Butorphanol (0,2 mg/kg). Wenn man von den in der Literatur beschriebenen Potenzen für Morphin und Methadon ausgeht, müsste man eine equipotente Wirkung von 0,2 mg/kg Morphin und 0,1 mg/kg Levomethadon erwarten. Mit Werten von 51,8 °C und 51,04 °C. zeigen die Beh andlungn M0,2 und L0,1 tatsächlich vergleichbar hohe maximale nozizeptive Schwellenwerte. Unterschiede in Wirkdauer und Verlauf der Schwellenwerte sind mit den bereits beschriebenen unterschiedlichen lipophilen Eigenschaften (FEE u. BOVILL 2005) und der damit verbundenen Penetrierung der Blut-Hirn-Schranke sowie mit unterschiedlichen Eliminationszeiten (COMBIE et al. 1983; LINARDI et al. 2012) zu erklären. Dementsprechend konnte in dieser Studie mit Levomethadon (0,2 mg/kg) die stärkste analgetische Effektivität erreicht werden, während die analgetische Effektivität von Morphin (0,2 mg/kg) deutlich unterhalb der erreichten Ergebnisse von Levomethadon (0,2 mg/kg) und Butorphanol (0,2 mg/kg) lag. Zudem konnte mit Levomethadon (0,2 mg/kg) im Vergleich zu Morphin (0,2 mg/kg) und Butorphanol (0,2 mg/kg) die längste Wirkdauer erreicht werden. Aus den hier dargestellten Ergebnissen ergibt sich, dass die gewählten Dosierungen für die drei Opioide nicht equipotent sind. Zudem lässt sich anhand der Ergebnisse demonstrieren, dass die analgetische Potenz nicht mit der analgetischen Effektivität gleichzusetzen ist (GAYNOR u. MUIR 2008). Obwohl Butorphanol eine im Vergleich zu Morphin und Levomethadon höhere Potenz besitzt und in der niedrigen Dosierung auch eine höhere analgetische Effektivität als Morphin und Levomethadon erreichte, 82 Diskussion konnte in der höheren Dosierung für Levomethadon die stärkste analgetische Effektivität beobachtet werden. Dies kann mit der geringen intrinsischen Aktivität und dem damit verbundenen Plateaueffekt der analgetischen Wirkung für Butorphanol erklärt werden. Die zusätzliche antagonistische Wirkung von Levomethadon am NMDA-Rezeptor (GORMAN et al. 1997) trägt unter Umständen zu der hier beobachteten starken Analgesie von Levomethadon bei. Der NMDA-Rezeptor spielt eine wichtige Rolle bei der Entstehung von pathologischen Schmerzzuständen (WOOLF u. THOMPSON 1991; KRISTENSEN et al. 1992; FELSBY et al. 1996), so dass der Einsatz von Levomethadon bei chronisch kranken Tieren von Vorteil sein kann, wobei in der vorliegenden Studie ausschließlich der akute Schmerz getestet wurde. Im Vergleich zu Morphin und Methadon konnte mit Levomethadon in einem neuropathischen Schmerzmodell an der Ratte eine bessere Analgesie erreicht werden (LEMBERG et al. 2006). Im Gegensatz zu Levomethadon und Butorphanol, die einen steilen Wirkungsanstieg aufweisen, kam es nach Injektion von Morphin zu einem relativ flachen Kurvenanstieg mit verhältnismäßig spätem Maximalwert. Auch der Beginn des Drangwanderns setzte nach Morphin-Injektion zum Teil später ein, als nach Applikation von Butorphanol oder Levomethadon. Dies konnte ähnlich in einer Studie von COMBIE et al. (1979) beobachtet werden, in welcher der Peak des Drangwanderns erst bis zu drei Stunden nach Morphin-Applikation erreicht wurde. Die geringe Lipidlöslichkeit von Morphin und die damit verbundene verzögerte Penetration der Blut-Hirn-Schranke (FEE u. BOVILL 2005) kann hier als eine mögliche Ursache für den verzögerten Wirkungseintritt genannt werden. Daraus folgend ist der schnellere Wirkungseintritt von Butorphanol und Levomethadon mit einer deutlich höheren Lipidlöslichkeit zu erklären (FEE u. BOVILL 2005). In einer Dosierung von 0,2 mg/kg kam es nach Morphin-Injektion zu einem biphasischen Kurvenverlauf, der nach Butorphanol und Levomethadon so nicht beobachtet werden konnte. Eine mögliche Erklärung ist die Tatsache, dass Morphin in der Leber neben dem inaktiven Morphin-3-Glucuronid (M3G) zu dem pharmakologisch aktiven Morphin-6-Glucuronid (M6G) metabolisiert wird (OSBORNE et al. 1990; OSBORNE et al. 1992). Auch beim Pferd konnte nach intravenöser und oraler Gabe von Morphin sowohl M6G, als auch M3G im Plasma nachgewiesen werden (FIGUEIREDO et al. 2012). 83 Diskussion Nach einer primären Wirkungsphase des Morphins könnte es somit zu einer zweiten Wirkungsphase durch das metabolisierte Morphin-6-Glucuronid kommen. Während beim Menschen 30 Minuten post Injektion bereits hohe Plasmakonzentrationen des M6G (OSBORNE et al. 1990) festgestellt werden konnten, sind beim Pferd keine weiteren Studien zur Metabolisierung von Morphin und der Wirkung dieser einzelnen Metabolite bekannt. Die Nebenwirkungen in Form von Drangwandern, erhöhtem Muskeltonus und Ataxie sind in dieser Studie nach Morphin-Applikation im Vergleich zu Levomethadon und Butorphanol verhältnismäßig gering ausgefallen. Jedoch lagen die nach MorphinGabe erreichten Schwellenwerte auch deutlich unterhalb der ermittelten Schwellenwerte nach Butorphanol und Levomethadon. Die im Vergleich zu Butorphanol niedrige Potenz von Morphin, lässt eine weitere Verstärkung der Nebenwirkungen und der analgetischen Effektivität in Dosierungen oberhalb von 0,2 mg/kg vermuten. Eine den ț-Agonisten zugesprochene geringere Neigung, Drangwandern auszulösen (KAMERLING et al. 1986; KAMERLING et al. 1988), konnte hier nicht nachvollzogen werden. Im Vergleich zu Levomethadon löste Butorphanol vergleichbar starkes, dosisabhängiges Drangwandern aus. Dagegen stimmen Beschreibungen über das vergleichsweise häufige Auftreten einer Ataxie nach Butorphanol-Gabe (MAMA et al. 1993; SELLON et al. 2001; KNYCH et al. 2012) mit den Beobachtungen in dieser Studie überein. Untersuchungen zu den Ursachen der Ataxie nach Butorphanol Injektion beim Pferd sind nicht vorhanden. Ein möglicher Erklärungsversuch ist aufgrund der lipophilen Eigenschaften von Butorphanol (FEE u. BOVILL 2005), die einen hohen spinalen Wirkstoffspiegel ermöglichen könnten, verbunden mit dem Vorkommen von k-Rezeptoren im Rückenmark zu machen (MANSOUR et al. 1988). Eine daraus resultierende spinale Ataxie ist in Betracht zu ziehen. Die Reduzierung der Darmmotilität und der damit verbundene verringerte Ingestatransport sind bekannte Nebenwirkungen von Opioiden (DAVIES u. GERRING 1983; ROGER et al. 1985; ROBERTS u. ARGENZIO 1986; BOSCAN et al. 2006). Hierbei geht man von einer direkten Wirkung der Opioide an Opioidrezeptoren im Darmtrakt aus (CHAMOUARD et al. 1993; BAGNOL et al. 1997; FICKEL et al. 1997). Obwohl es in dieser Studie über Stunden zu einer Reduzierung der Darmgeräusche kam, wurde kein 84 Pferd auffällig mit reduziertem Diskussion Allgemeinbefinden oder Anzeichen einer Kolik. Im Vergleich zu Butorphanol und Levomethadon führte die Gabe von Morphin länger zu reduzierten Darmgeräuschen und zu einem längeren Zeitraum bis zum ersten Kotabsatz nach AM-Gabe. Obwohl diese Werte keine signifikanten Unterschiede aufweisen, scheint Morphin in dieser Studie somit einen stärkeren Einfluss auf den Darmtrakt zu haben als Butorphanol und Levomethadon. Dazu passen Ergebnisse einer retrospektiven Studie, in der ein mit Morphin assoziiertes erhöhtes Risiko von Kolikerkrankungen nach orthopädischen Operationen festgestellt werden konnte (SENIOR et al. 2004). Die Gabe von Butorphanol konnte hingegen nicht mit einer erhöhten Inzidenz an Koliken in Verbindung gebracht werden (SENIOR et al. 2004). Im Allgemeinen wird den reinen ȝ-Agonisten eine stärkere unerwünschte Wirkung auf den Magen-Darm-Trakt zugesprochen als den ț-Agonisten. In einer Studie an Ponys wurde der Einfluss von Fentanyl, einem reinen ȝ-Agonisten, und U50488H, einem reinen ț-Agonisten, auf die Darmaktivität und dem damit verbundenen Ingestatransport untersucht (ROGER et al. 1994). Die elektrische Aktivität wurde mittels Elektromyographie anhand in den Dickdarm implantierter Elektroden gemessen. Während Fentanyl einen erheblichen Einfluss auf die elektrische Aktivität des Dickdarms aufwies, zeigte U50488HH nur einen geringen Einfluss auf die Darmmotilität. Dies erklärt den vergleichbar geringeren Einfluss von Butorphanol auf die Darmgeräusche und den Kotabsatz, während Levomethadon als reiner ȝ-Agonist nicht in diese Gruppe einzuordnen ist. Die Kombination von Levomethadon mit dem Parasympatholytikum Fenpipramid lässt vielmehr eine weitere Reduzierung der Darmgeräusche vermuten. Die reduzierte Futteraufnahme nach einer Operation ist ein unerwünschter und mit einem potentiell verzögerten Heilungsverlauf einhergehender Zustand. Sowohl in dieser Studie, als auch in einer Studie von COMBIE et al. (1979) konnte ein Opioidassoziiertes simuliertes Fressverhalten beobachtet werden. Der Einfluss von Opioiden auf den Appetit und die Nahrungsaufnahme ist schon seit einiger Zeit bekannt und seitdem Inhalt mehrerer wissenschaftlicher Arbeiten. So konnte beim Menschen in mehreren Studien ein reduzierter Appetit auf salzige und süße Lebensmittel nach Gabe von Opioid-Antagonisten nachgewiesen werden (YEOMANS et al. 1990; BERTINO et al. 1991; YEOMANS u. WRIGHT 1991). Bei der Ratte wurde die Aufnahme einer Saccharin-haltigen Lösung nach Opioid-Antagonist 85 Diskussion und Opioid-Agonist Gabe beurteilt. Während nach Injektion von Morphin die Aufnahme der süßen Lösung anstieg, löste die Gabe von Naloxon eine Reduktion der Aufnahme aus (COOPER 1983). Der Einfluss von Opioiden auf die Futteraufnahme, die Gewichtszunahme und den Heilungsverlauf beim kranken Pferd stellt somit eine wichtige Fragestellung in der Veterinärmedizin und in zukünftigen Untersuchungen dar. Das hier beschriebene simulierte Fressverhalten konnte einfach und eindeutig durch permanentes, nicht zu unterbrechendes Scharren vor der Krippe interpretiert werden. Das Verhalten konnte von einer möglichen Koliksymptomatik abgegrenzt werden, da die Pferde beim Anbieten von Futter sofort mit dem Scharren stoppten und bei Futterentzug das Scharren sofort fortführten. Näherte sich der Untersucher der Krippe, wurde das Scharren verstärkt, so dass dieses Verhalten als Betteln und simuliertes Fressverhalten interpretiert werden könnte. 5.2.5 Ausblick Die negativen Wirkungen von Opioiden auf den Magen-Darm-Trakt sowie unerwünschte Erregungserscheinungen, tragen zu einem restriktiven Einsatz in der Pferdemedizin bei (BENNETT u. STEFFEY 2002; PRICE et al. 2002; SENIOR et al. 2004). Der Einfluss von Opioiden auf den Magen-Darm-Trakt ist einerseits nicht zu unterschätzen, darf andererseits aber auch nicht vor einer adäquaten analgetischen Versorgung schmerzhafter Tiere abschrecken. Eine fundierte Einschätzung der Krankheitsursache sowie die Einbeziehung der Schmerzsymptomatik sollten die Wahl des Analgetikums stets beeinflussen. Besonders bei Risikopatienten, wie zum Beispiel orthopädischen Patienten mit Boxenruhe, sollte bei Einsatz von Opioiden eine prophylaktische Fütterung mit Mash in Betracht gezogen werden. Eine weitere Möglichkeit, die unerwünschten Wirkungen auf den Magen-Darm-Trakt sowie auf das Verhalten zu reduzieren, ist die Dauertropfinfusion (DTI) von Opioiden. SELLON et al. (2001) haben den Einfluss von Butorphanol als Bolus-Injektion (0,10,13 mg/kg und als DTI (Bolus: 17,8 ȝg/kg; DTI: 23,7 ȝg/kg/h) auf die Darmgeräusche und das Verhalten verglichen. Im Vergleich zu der Bolus-Injektion konnte nach der DTI von Butorphanol ein geringerer Einfluss auf die Darmmotilität und das Verhalten beobachtet werden. Ein gleichmäßiger Plasmaspiegel der Medikamente, ohne den nach Bolus-Injektion zu erwartenden Peak, kann als Erklärung für die geringeren Nebenwirkungen bei der DTI genannt werden. In einer 86 Diskussion klinischen Studie ging die postoperative Versorgung mit einem Butorphanol-DTI im Vergleich zur Placebo-Behandlung mit geringeren Plasma-Kortisol-Werten, geringerem Gewichtsverlust und schnelleren Erreichen eines normalen Verhaltens einher (SELLON et al. 2004). Um die unerwünschten Nebenwirkungen bei der Nutzung von Opioiden beim Pferd zu reduzieren, können weitere Untersuchungen zum Einsatz von Levomethadon und Morphin als DTI von Interesse sein. Insgesamt ist der Einfluss von Opioiden auf das kardiorespiratorische System beim Pferd als klinisch nicht relevant zu bewerten. Die exzitatorische Wirkung der Opioide auf das ZNS und eine damit verbundene erhöhte sympathische Aktivität wird als Ursache für die stimulierende Wirkung der Opioide auf das Herz diskutiert (MUIR et al. 1978; KALPRAVIDH et al. 1984b; CARREGARO et al. 2007). Ein Stute hat auf alle drei Opioide mit ausbleibenden bzw. nur geringgradigen Verhaltensänderungen und Drangwandern in den höheren Dosierungen reagiert, wobei auch der Anstieg der Schwellenwerte bei diesem Pferd vergleichsweise niedrig ausgefallen ist. Individuelle Reaktion auf Opioide konnten auch in anderen Studien beim Pferd beobachtet werden (MAMA et al. 1993). Es ist bekannt, dass geschlechterabhängige Unterschiede in der nozizeptiven Wahrnehmung existieren. So konnte bei Frauen eine im Vergleich zum Mann stärkere Sensitivität gegenüber Kälte- und Hitzeschmerz beobachtet werden (KLATZKIN et al. 2010). Weiter ist eine zyklusabhängige Schmerzwahrnehmung in Betracht zu ziehen, da bei der weiblichen Ratte nach Ovariektomie eine Reduzierung der nozizeptiven Sensitivität dargestellt werde konnte (TERNER et al. 2005). Geschlecht und Zyklusstand wurde bei den in der vorliegenden Studie genutzten Pferden nicht berücksichtig. Abschließend ist zu sagen, dass die Thermostimulation eine geeignete Methode zur Bestimmung des nozizeptiven Schwellenwertes beim Pferd darstellt. Levomethadon führte dosisabhängig zu einer guten, lang anhaltenden Analgesie, während nach Butorphanol-Gabe keine Verstärkung der Analgesie in der höheren Dosierung zu erreichen war. Morphin führte in der häufig empfohlenen Dosierung von 0,1 mg/kg zu keiner nachweisbaren Analgesie im akuten nozizeptiven Schmerzmodell. 87 Zusammenfassung 6 Zusammenfassung Paula Dönselmann im Sande Der Einfluss verschiedener Morphinderivate auf den thermischen nozizeptiven Schwellenwert beim Pferd. Ziel dieser Studie war es, mithilfe der Thermostimulation die analgetische Effektivität gebräuchlicher Dosierungen von Morphin, Butorphanol und Levomethadon beim Pferd zu vergleichen. Weiterhin sollte untersucht werden, ob eine mögliche Steigerung der analgetischen Effektivität nach Applikation einer höheren Dosierung von Morphin, Butorphanol und Levomethadon erzielt werden kann. Das Auftreten möglicher Opioid-assoziierter Nebenwirkungen stellte einen weiteren Untersuchungspunkt dar. Für die Untersuchungen wurden acht klinisch allgemeingesunde Pferde der Klinik für Pferde, Stiftung Tierärztliche Hochschule Hannover, im von Alter 6-24 Jahren und einem Gewicht von 430-633 kg verwendet. Der kutane thermische nozizeptive Schwellenwert wurde mittels Kontaktwärmestimulation am Widerrist am frei laufenden Pferd bestimmt. Die Studie wurde als kontrollierter, teil randomisierter, experimenteller Versuch mit verblindetem Untersucher im kompletten cross-over Design durchgeführt. Jedes der acht Pferde wurde unter Placebo (P = isotone Kochsalzlösung) und Morphin (M0,1 = 0,1 mg/kg; M0,2 = 0,2 mg/kg), Butorphanol (B0,1 = 0,1 mg/kg; B0,2 = 0,2 mg/kg), Levomethadon (L0,1 = 0,1 mg/kg; L0,2 = 0,2 mg/kg) in einer niedrigen und einer hohen Dosierung getestet mit mindestens 14 Tagen zwischen den Versuchsdurchläufen. Für die Ermittlung eines Kontroll Schwellenwertes, wurden vor AM-Applikation drei Messungen im Abstand von 20 Minuten vorgenommen. Daraufhin wurde Morphin, Butorphanol, Levomethadon oder ein Placebo intravenös injiziert. Im Verlauf wurden Messungen nach 10, 30, 60, 90, 120, 240, 300, 360, 420, 540 und 1350 Minuten durchgeführt. Weiterhin wurden zu jedem Messzeitpunkt Verhalten, Drangwandern, Kotabsatz, Darmgeräusche, Herzund Atemfrequenz und die Hauttemperatur aufgezeichnet. Die Auswertung der Daten erfolgte mit dem Statistikprogramm SAS, Version 9.3 (SAS Institute, Cary, NC). Es wurde ein Signifikanzniveau von p 0,05 berücksichtigt. 88 Zusammenfassung Die Vergleiche zwischen den Medikationen zu jedem MZP wurden mittels einfaktorieller Varianzanalyse und post hoc Tukey´s t-Test berechnet. Die Vergleiche der Messzeitpunkte gegen die Kontrolle (Kontrollwert) für jede Medikation erfolgte mit einfaktorieller Varianzanalyse für Messwiederholungen mit post hoc Dunnett´s t-Test. In der Behandlung M0,1 kam es zu einer leichten Erhöhung der Schwellenwerte, die jedoch zu keinem Zeitpunkt statistische Signifikanz erreichten. Zu signifikant erhöhten Schwellenwerten kam es in den Behandlungen M0,2 für 240 Min., B0,1 für 90 Min., B0,2 für 90 Min., L0,1 für 60 Min. und L0,2 für 300 Min.. Verhaltensänderungen sind in Form von Drangwandern, Lippenspiel, Kopfzucken, erhöhten Muskeltonus, Zittern, Ataxie, Leerkauen und einem simuliertem Fressverhalten aufgefallen. In allen Opioid Behandlungen trat eine Reduzierung der Darmgeräusche und ein verzögerter Kotabsatz auf. Eine signifikante Veränderung der Atemfrequenz ist in keiner Behandlung beobachtet worden. Während in den Behandlungen M0,1, B0,1, B0,2 und L0,1 keine Veränderungen der Herzfrequenz auftraten, konnte in den Behandlungen M0,2 (t30) und L0,2 (t10, t30) eine vorübergehende leichte Erhöhung der Herzfrequenz beobachtet werden. Levomethadon führte dosisabhängig zu einer guten, lang anhaltenden Analgesie, während nach Butorphanol-Gabe keine Verstärkung oder Verlängerung der Analgesie in der höheren Dosierung zu erreichen war. Morphin führte ausschließlich in der höheren Dosierung zu einer nachweisbaren, moderaten Analgesie. 89 Summary 7 Summary Paula Dönselmann im Sande Effect of morphine, butorphanol and levomethadone on the thermal nociceptive threshold in horses. The purpose of the study was to evaluate the thermal antinociceptive effect of commonly used doses of morphine, butorphanol and levomethadone in horses. In addition, it was the purpose to examine the antinociceptive effect of increased doses of these opioids and associated side effects. Eight healthy experimental horses with an age of 6-24 years and a bodyweight of 430-633 kg were used in the study. The cutaneous thermal nociceptive threshold was measured by means of ramped contact heat stimulation at the withers in unrestrained horses. The study was performed in a partly randomized, placebo-controlled, experimental and blinded cross-over design. Each horse received placebo (P = 0.9 % saline) and morphine (M0.1 = 0.1 mg/kg; M0.2 = 0.2 mg/kg), butorphanol (B0.1 = 0.1 mg/kg; B0.2 = 0.2 mg/kg) and levomethadone (L0.1 = 0.1 mg/kg; L0.2 = 0.2 mg/kg) in a lower and a higher doses with a wash out period of 14 days. For controlmeasurements, thermal thresholds were determined three times before medication. Horses received morphine, butorphanol, levomethadone or placebo i.v.. Thermal nociceptive thresholds were determined for 22.5 hours at preset time points (10, 30, 60, 90, 120, 240, 300, 360, 420, 540 and 1350 minutes). At each time point heart rate, respiratory rate, defecation, intestinal sounds, behaviour and skin temperature were documented. Statistical analyses were performed using SAS version 9.3 (SAS Institute, Cary, NC). Statistical significance was attributed when p 0,05. The comparison between the medications at each measurement point was calculated via analysis of variance and post hoc tukey-test. The comparison of the time points to the control for each medication was calculated via analysis of variance for repeated measurements with post hoc dunnetts-t-test. 90 Summary In group M0.1 changes in thermal thresholds did not reach significance. Thermal threshold increased significantly in the groups M0.2, B0.1, B0.2, L0.1 and L0.2 for 240 min., 90 min., 90 min., 60 min. and 300 min., respectively. After administration of morphine, butorphanol and levomethadone, the horses showed dose-dependant increased locomotion, tremor, increased muscle tonus, head shaking, ataxia and sham feeding. As a result of the opioid injection the intestinal sounds decreased and there was delayed defecation. In group M0.1, B0.1, B0.2 and L0.1 no change in heart rate occurred, whereas a temporary increase in heart rate was seen in group M0.2 (t30) and L0.2 (t10, t30).There was no change in respiratory rate in any group. Levomethadone induced a dose-dependant increase and prolongation of analgesia, whereas with butorphanol the increased dose did not improve cutaneous antinociception. Morphine only provided detectable moderate analgesia in a dose of 0.2 mg/kg. 91 Literaturverzeichnis 8 Literaturverzeichnis AKINS, P. T. u. E. W. MCCLESKEY (1993): Characterization of potassium currents in adult rat sensory neurons and modulation by opioids and cyclic AMP. Neuroscience 56, 759-769. AKTORIES, K., U. FÖRSTERMANN, F. B. HOFMANN u. K. STARKE (2005): Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage, Urban und Fischer, München ÄNGGÅRD, E., M. I. NILSSON, J. HOLMSTRAND u. L. M. GUNNE (1979): Pharmacokinetics of methadone during maintenance therapy: Pulse labeling with deuterated methadone in the steady state. European Journal of Clinical Pharmacology 16, 53-57. APKARIAN, A. V., M. C. BUSHNELL, R.-D. TREEDE u. J.-K. ZUBIETA (2005): Human brain mechanisms of pain perception and regulation in health and disease. European Journal of Pain 9, 463-484. AUSTIN, M. C. u. P. W. KALIVAS (1989): Blockade of enkephalinergic and GABAergic mediated locomotion in the nucleus accumbens by muscimol in the ventral pallidum. Japanese Journal of Pharmacology 50, 487-490. BABA, H., T. P. DOUBELL u. C. J. WOOLF (1999): Peripheral Inflammation Facilitates Aȕ-Fiber-Mediated Synaptic Input to the Substantia Gelatinosa of the Adult Rat Spinal Cord. The Journal of Neuroscience 19, 859-867. BACKONJA, M., G. ARNDT, K. A. GOMBAR, B. CHECK u. M. ZIMMERMANN (1994): Response of chronic neuropathic pain syndromes to ketamine: a preliminary study. Pain 56, 51-57. 92 Literaturverzeichnis BAGNOL, D., A. MANSOUR, H. AKIL u. S. J. WATSON (1997): Cellular localization and distribution of the cloned mu and kappa opioid receptors in rat gastrointestinal tract. Neuroscience 81, 579-591. BATESON, P. (1991): Assessment of pain in animals. Animal Behaviour 42, 827-839. BATTAGLIA, G. u. A. RUSTIONI (1988): Coexistence of glutamate and substance P in dorsal root ganglion neurons of the rat and monkey. The Journal of Comparative Neurology 277, 302-312. BECK, P. W., H. O. HANDWERKER u. M. ZIMMERMANN (1974): Nervous outflow from the cat's foot during noxious radiant heat stimulation. Brain Research 67, 373-386. BEECHER, H. K. (1957): The Measurement of Pain. Pharmacological Reviews 9, 59-209. BENNETT, R. C. u. E. P. STEFFEY (2002): Use of opioids for pain and anesthetic management in horses. Veterinary Clinics of North America-Equine Practice 18, 47-60 BERRY, J. J., L. D. MONTGOMERY u. B. A. WILLIAMS (1984): Thermoregulatory responses of rats to varying environmental temperatures. Aviat Space Environ Medicin 55, 546-549. BERTINO, M., G. K. BEAUCHAMP u. K. ENGELMAN (1991): Naltrexone, an opioid blocker, alters taste perception and nutrient intake in humans. American Journal of Physiology - Regulatory, Integrative and Comparative Physiology 261, R59-R63. 93 Literaturverzeichnis BOHN, L. M., R. R. GAINETDINOV, F. T. LIN, R. J. LEFKOWITZ u. M. G. CARON (2000): Mu-opioid receptor desensitization by beta-arrestin-2 determines morphine tolerance but not dependence. Nature 408, 720-723. BOSCAN, P., L. M. VAN HOOGMOED, T. B. FARVER u. J. R. SNYDER (2006): Evaluation of the effects of the opioid agonist morphine on gastrointestinal tract function in horses. American Journal of Veterinary Research. 67, 992-997. BOVE, G. (2006): Mechanical sensory threshold testing using nylon monofilaments: the pain field's "tin standard". Pain 124, 13-17. BROMAGE, P. R., E. M. CAMPORESI, P. A. C. DURANT u. C. H. NIELSEN (1982): Nonrespiratory Side Effects of Epidural Morphine. Anesthesia & Analgesia 61, 490-495. BROSNAN R. J., B. H. PYPENDOP, K. T. SIAO, S. D. STANLEY (2009): Effects of remifentanil on measures of anesthetic immobility and analgesia in cats. American Journal of Veterinary Research 70, 1065-1071. BRUERA, E. u. S. YENNURAJALINGAM (2011): Oxford American Handbook of Hospice and Palliative Medicine. 1. Auflage, Oxford University Press, USA 94 Literaturverzeichnis BRUGMANS, F. u. E. DEEGEN (2001): Laparoscopic surgical technique for repair of rectal and colonic tears in horses: An experimental study. Veterinary Surgery 30, 409-416. BULUNGHAM, R. E. S., H. J. MCQUAY, E. J. B. PORTER, D. THOMAS, M. C. ALLEN u. R. A. MOORE (1982): Acute i.v. methadone kinetics in man: relationship to chronic studies. British Journal of Anaesthesia 54, 1271-1276. BURGESS, P. R. u. E. R. PERL (1967): Myelinated afferent fibres responding specifically to noxious stimulation of the skin. The Journal of Physiology 190, 541-562. CAPDEVILA, X., Y. BARTHELET, P. BIBOULET, Y. RYCKWAERT, J. RUBENOVITCH u. F. D'ATHIS (1999): Effects of Perioperative Analgesic Technique on the Surgical Outcome and Duration of Rehabilitation after Major Knee Surgery. Anesthesiology 91, 8-15. CAPNER, A., B. D. X. LASCELLES u. A. E. WATERMAN-PEARSON (1999): Current British veterinary attitudes to perioperative analgesia for dogs. Veterinary Record 145, 95-99. CARREGARO, A. B., S. P. L. LUNA, M. I. MATAQUEIRO u. A. DE QUEIROZ-NETO (2007): Effects of buprenorphine on nociception and spontaneous locomotor activity in horses. American Journal of Veterinary Research 68, 246-250. CARREGARO, A. B., F. J. T. NETO, S. L. BEIER u. S. R. L. LUNA (2006): Cardiopulmonary effects of buprenorphine in horses. American Journal of Veterinary Research 67, 1675-1680. 95 Literaturverzeichnis CASEY, K. L. u. T. J. MORROW (1983): Nocifensive responses to cutaneous thermal stimuli in the cat: stimulus-response profiles, latencies, and afferent activity. Journal of Neurophysiology 50, 1497-1515. CATERINA, M. J., M. A. SCHUMACHER, M. TOMINAGA, T. A. ROSEN, J. D. LEVINE u. D. JULIUS (1997): The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature 389, 816-824. CATERINA, M. J., A. LEFFLER, A. B. MALMBERG, W. J. MARTIN, J. TRAFTON, K. R. PETERSEN-ZEITZ, M. KOLTZENBURG, A. I. BASBAUM u. D. JULIUS (2000): Impaired Nociception and Pain Sensation in Mice Lacking the Capsaicin Receptor. Science 288, 306-313. CHAMBERS (1994): Further development of equipment to measure nociceptive thresholds in large animals. Veterinary Anaesthesia and Analgesia 21, 66-72 CHAMBERS , J. P., A. LIVINGSTON u. A. E. WATERMAN (1990): A device for testing nociceptive thresholds in horses. Veterinary Anaesthesia and Analgesia 17, 42-44. CHAMOUARD, P., A. KLEIN, E. MARTIN, M. ADLOFF u. F. ANGEL (1993): Regulatory role of enteric kappa opioid receptors in human colonic motility. Life Sciences 53, 1149-1156. CHAPMAN, V., R. SUZUKI u. A. H. DICKENSON (1998): Electrophysiological characterization of spinal neuronal response properties in anaesthetized rats after ligation of spinal nerves L5-L6. The Journal of Physiology 507, 881-894. 96 Literaturverzeichnis CHEN, L. u. L.-Y. MAE HUANG (1992): Protein kinase C reduces Mg2+ block of NMDA-receptor channels as a mechanism of modulation. Nature 356, 521-523. CLARK, J. O. u. T. P. CLARK (1999): Analgesia. Veterinary Clinics of North America-Equine Practice 15, 705-723. CLARK, L., R. E. CLUTTON, K. J. BLISSITT u. M. E. CHASE-TOPPING (2005): Effects of peri-operative morphine administration during halothane anaesthesia in horses. Veterinary Anaesthesia and Analgesia 32, 10-15. CLARK, L., R. E. CLUTTON, K. J. BLISSITT u. M. E. CHASE-TOPPING (2008): The effects of morphine on the recovery of horses from halothane anaesthesia. Veterinary Anaesthesia and Analgesia 35, 22-29. CLARKE, K. W. u. B. S. PATON (1988): Combined use of detomidine with opiates in the horse. Equine Veterinary Journal 20, 331-334. CLUTTON, R. E. (2010): Opioid analgesia in horses. Veterinary Clinics of North America-Equine Practice 26, 493-514. COLLETT, B. J. (1998): Opioid tolerance: the clinical perspective. British Journal of Anaesthesia 81, 58-68. COMBIE, J., J. W. BLAKE, B. E. RAMEY u. T. TOBIN (1981a): Pharmacology of narcotic analgesics in the horse: quantitative detection of morphine in equine blood and urine and logit-Log transformations of this data. American Journal of Veterinary Research 42, 1523-1530. 97 Literaturverzeichnis COMBIE, J., J. DOUGHERTY, E. NUGENT u. T. TOBIN (1979): The Pharmacology of Narcotic Analgesics in the Horse. IV. Dose and Time Response Relationships for Behavioral Responses to Moprhine, Meperidine, Pentazocine, Anileridine, Methadone, and Hydromorphone. Journal of equine medicine and surgery. 3, 377-385 COMBIE, J., T. SHULTS, E. C. NUGENT, J. DOUGHERTY u. T. TOBIN (1981b): Pharmacology of narcotic analgesics in the horse: selective blockade of narcoticinduced locomotor activity. American Journal of Veterinary Research 42, 716-721. COMBIE, J. D., T. E. NUGENT u. T. TOBIN (1983): Pharmacokinetics and protein binding of morphine in horses. American Journal of Veterinary Research 44, 870-874. COMMISKEY, S., L. W. FAN, I. K. HO u. R. W. ROCKHOLD (2005): Butorphanol: effects of a prototypical agonist-antagonist analgesic on ț-opioid receptors. Journal of Pharmacological Science 98, 109-116. COOPER, B. Y., C. J. VIERCK JR u. D. C. YEOMANS (1986): Selective reduction of second pain sensations by systemic morphine in humans. Pain 24, 93-116. COOPER, S. J. (1983): Effects of opiate agonists and antagonists on fluid intake and saccharin choice in the rat. Neuropharmacology 22, 323-328. CORLETTO, F., A. A. RAISIS u. J. C. BREARLEY (2005): Comparison of morphine and butorphanol as pre-anaesthetic agents in combination with romifidine for field castration in ponies. Veterinary Anaesthesia and Analgesia 32, 16-22. 98 Literaturverzeichnis COSTIGAN, M., J. SCHOLZ u. C. J. WOOLF (2009): Neuropathic pain: a maladaptive response of the nervous system to damage. Annual Review of Neuroscience 32, 1-32. CRAIG, A. D. (2003): Pain mechanisms: labeled lines versus convergence in central processing. Annual Review of Neuroscience 26, 1-30. DAVIES, J. V. u. E. L. GERRING (1983): Effect of spasmolytic analgesic drugs on the motility patterns of the equine small intestine. Research in Veterinary Science 34, 334-339. DEAKIN, J. F. W. u. J. O. DOSTROVSKY (1978): Involvement of the periaqueductal grey matter and spinal 5-hydroxytryptaminergic pathways in morphine analgesia: effcts of lesions and 5-hydroxytryptamine depletion. British Journal of Pharmacology 63, 159-165. DHANJAL, J. K., D. V. WILSON, E. ROBINSON, T. T. TOBIN u. L. DIROKULU (2009): Intravenous tramadol: effects, nociceptive properties, and pharmacokinetics in horses. Veterinary Anaesthesia and Analgesia 36, 581-590. DHASMANA, K. M., K. S. DIXIT, B. P. JAJU u. M. L. GUPTA (1972): Role of central dopaminergic receptors in manic response of cats to morphine. Psychopharmacologia 24, 380-383. DICKENSON, A. H. (1995): Spinal cord pharmacology of pain. British Journal of Anaesthesia 75, 193-200. DIXON, M. J., S. A. ROBERTSON u. P. M. TAYLOR (2002): A thermal threshold testing device for evaluation of analgesics in cats. Research in Veterinary Science 72, 205-210. 99 Literaturverzeichnis DOBKIN, A., S. EAMKAOW, S. ZAK u. F. CARUSO (1974): Butorphanol: a double-blind evaluation in postoperative patients with moderate or severe pain. Canadian Journal of Anesthesia / Journal canadien d'anesthésie 21, 600-610. DOHOO, S. E. u. I. R. DOHOO (1996): Factors influencing the postoperative use of analgesics in dogs and cats by Canadian veterinarians. Canadian Veterinary Journal 37, 552-556. DRAY, A. (1995): Inflammatory mediators of pain. British Journal of Anaesthesia 75, 125-131. DUCHARME, J. (2000): Acute pain and pain control: State of the art. Annals of Emergency Medicine 35, 592-603. DUGGAN, A. W., I. A. HENDRY, C. R. MORTON, W. D. HUTCHINSON u. Z. Q. ZHAO (1988): Cutaneous stimuli releasing immunoreactive substance P in the dorsal horn of the cat. Brain Research 451, 261-273. ELFENBEIN, J. R., L. C. SANCHEZ, S. A. ROBERTSON, C. A. COLE u. R. SAMS (2009): Effect of detomidine on visceral and somatic nociception and duodenal motility in conscious adult horses. Veterinary Anaesthesia and Analgesia 36, 162-172. FEE, J. P. H. u. J. G. BOVILL (2005): Pharmacology For Anaesthesiologists. Taylor & Francis, Abingdon 100 Literaturverzeichnis FELSBY, S., J. NIELSEN, L. ARENDT-NIELSEN u. T. S. JENSEN (1996): NMDA receptor blockade in chronic neuropathic pain: a comparison of ketamine and magnesium chloride. Pain 64, 283-291. FICKEL, J., D. BAGNOL, S. J. WATSON u. H. AKIL (1997): Opioid receptor expression in the rat gastrointestinal tract: a quantitative study with comparison to the brain. Molecular Brain Research 46, 1-8. FIGUEIREDO, J. P., W. W. MUIR u. R. SAMS (2012): Cardiorespiratory, gastrointestinal, and analgesic effects of morphine sulfate in conscious healthy horses. American Journal of Veterinary Research 73, 799-808. FLECKNELL, P. (2008): Analgesia from a veterinary perspective. British Journal of Anaesthesia 101, 121-124. FLÓREZ, J., L. E. MCCARTHY u. H. L. BORISON (1968): A COMPARATIVE STUDY IN THE CAT OF THE RESPIRATORY EFFECTS OF MORPHINE INJECTED INTRAVENOUSLY AND INTO THE CEREBROSPINAL FLUID. Journal of Pharmacology and Experimental Therapeutics 163, 448-455. FORD, G. K., O. MORIARTY, B. E. MCGUIRE u. D. P. FINN (2008): Investigating the effects of distracting stimuli on nociceptive behaviour and associated alterations in brain monoamines in rats. European Journal of Pain 12, 970-979. 101 Literaturverzeichnis FREYE, E. u. J. V. LEVY (2008): Opioids in Medicine: A Comprehensive Review on the Mode of Action and the Use of Analgesics in Different Clinical Pain States. Springer, Dordrecht FRUHSTORFER, H., U. LINDBLOM u. W. C. SCHMIDT (1976): Method for quantitative estimation of thermal thresholds in patients. Journal of Neurology, Neurosurgery & Psychiatry 39, 1071-1075. GAYNOR, J. S. u. W. W. MUIR (2008): Handbook of Veterinary Pain Management 2. Auflage, Mosby/Elsevier, Missouri GEBHART, G. F. u. M. H. OSSIPOV (1986): Characterization of inhibition of the spinal nociceptive tail-flick reflex in the rat from the medullary lateral reticular nucleus. The Journal of Neuroscience 6, 701-713. GIRAUDEL, J. M., A. DIQUELOU, P. LEES u. P. L. TOUTAIN (2005): Development and validation of a new model of inflammation in the cat and selection of surrogate endpoints for testing anti-inflammatory drugs. Journal of Veterinary Pharmacology and Therapeutics 28, 275-285. GJERSTAD, J., A. TJOLSEN u. K. HOLE (2001): Induction of long-term potentiation of single wide dynamic range neurones in the dorsal horn is inhibited by descending pathways. Pain 91, 263-268. GORMAN, A. L., K. J. ELLIOTT u. C. E. INTURRISI (1997): The d- and l-isomers of methadone bind to the non-competitive site on the N-methylD-aspartate (NMDA) receptor in rat forebrain and spinal cord. Neuroscience Letters 223, 5-8. 102 Literaturverzeichnis GREENWALD, M. K. u. M. L. STITZER (1998): Butorphanol agonist effects and acute physical dependence in opioid abusers: comparison with morphine. Drug and Alcohol Dependence 53, 17-30. HÄMÄLÄINEN, M. M., T. KAUPPILA, T. TAIRA u. A. PERTOVAARA (1996): A noninvasive method for studying quantitatively heat-evoked nocifensive hindlimb withdrawal reflexes in lightly anesthetized rats. Physiology & Behavior 59, 389-392. HARGREAVES, K., R. DUBNER, F. BROWN, C. FLORES u. J. JORIS (1988): A new and sensitive method for measuring thermal nociception in cutaneous hyperalgesia. Pain 32, 77-88. HARPER, A. A. u. S. N. LAWSON (1985): Conduction velocity is related to morphological cell type in rat dorsal root ganglion neurones. The Journal of Physiology 359, 31-46. HAUSSLER, K. K. u. H. N. ERB (2006): Mechanical nociceptive thresholds in the axial skeleton of horses. Equine Veterinary Journal 38, 70-75. HEINRICHER, M. M., I. TAVARES, J. L. LEITH u. B. M. LUMB (2009): Descending control of nociception: Specificity, recruitment and plasticity. Brain Research Reviews 60, 214-225. HELLYER, P. W., L. BAI, J. SUPON, C. QUAIL, A. E. WAGNER, K. R. MAMA u. K. R. MAGNUSSON (2003): Comparison of opioid and alpha-2 adrenergic receptor binding in horse and dog brain using radioligand autoradiography. Veterinary Anaesthesia and Analgesia 30, 172-182. 103 Literaturverzeichnis HERRERO, J. F., J. M. A. LAIRD u. J. A. LOPEZ-GARCIA (2000): Wind-up of spinal cord neurones and pain sensation: much ado about something? Progress in Neurobiology 61, 169-203. HEYMAN, I. u. H. P. RANG (1985): Depolarizing responses to capsaicin in a subpopulation of rat dorsal root ganglion cells. Neuroscience Letters 56, 69-75. HILLIDGE, C. J. u. P. LEES (1976): Proceedings: Influence of etorphine, acepromazine and diprenorphine on cardiovascular function in ponies. British Journal of Pharmacology 56, 375P-376P. HOFFMANN, M. V., S. B. R. KASTNER, M. KIETZMANN u. S. KRAMER (2012): Contact heat thermal threshold testing in beagle dogs: baseline reproducibility and the effect of acepromazine, levomethadone and fenpipramide. BMC Veterinary Research 8, 206. ICHINOSE, F., M. MIYAZAKI, T. GOTO, H. TAKAHASHI, K. TERUI, Y. NIIMI, S. UEZONO, S. MORITA u. H. YANAGIDA (1999): Electroencephalographic responses to the formalin test in rats. Pain 80, 251-256. INTURRISI, C. E. (2002): Clinical Pharmacology of Opioids for Pain. The Clinical Journal of Pain 18, S3-S13. IRNATEN, M., S. A. AICHER, J. WANG, P. VENKATESAN, C. EVANS, S. BAXI u. D. MENDELOWITZ (2003): ȝ-opioid receptors are located postsynaptically and endomorphin-1 inhibits voltagegated calcium currents in premotor cardiac parasympathetic neurons in the rat nucleus ambiguus. Neuroscience 116, 573-582. 104 Literaturverzeichnis JANSON, W. u. C. STEIN (2003): Peripheral Opioid Analgesia. Current Pharmaceutical Biotechnology 4, 270-274. JOHNSON, C., P. TAYLOR, S. YOUNG u. J. BREARLEY (1993): Postoperative analgesia using phenylbutazone, flunixin or carprofen in horses. Veterinary Record 133, 336-338. JORDT, S.-E., M. TOMINAGA u. D. JULIUS (2000): Acid potentiation of the capsaicin receptor determined by a key extracellular site. Proceedings of the National Academy of Sciences 97, 8134-8139. JULIUS, D. u. A. I. BASBAUM (2001): Molecular mechanisms of nociception. Nature 413, 203-210. JUNG, C., R. HOSPES, H. BOSTEDT u. L. F. LITZKE (2008): Surgical treatment of uterine torsion using a ventral midline laparotomy in 19 mares. Australian Veterinary Journal 86, 272-276. JURNA, I. (1980): Effect of stimulation in the periaqueductal grey matter on activity in ascending axons of the rat spinal cord: selective inhibition of activity evoked by afferent A[delta] and C fibre stimulation and failure of naloxone to reduce inhibition. Brain Research 196, 33-42. KALPRAVIDH, M., W. V. LUMB, M. WRIGHT u. R. B. HEATH (1984a): Analgesic effects of butorphanol in horses: dose-response studies. American Journal of Veterinary Research 45, 211-216. KALPRAVIDH, M., W. V. LUMB, M. WRIGHT u. R. B. HEATH (1984b): Effects of butorphanol, flunixin, levorphanol, morphine, and xylazine in ponies. American Journal of Veterinary Research 45, 217-223. 105 Literaturverzeichnis KAMATA, K. (1987): Pharmacological studies on the interrelation between the dopaminergic, GABAergic and opioid peptidergic systems in the central nervous system of the rat. Japanese Journal of Pharmacology 45, 439-447. KAMERLING, S., T. WECKMAN, J. DONAHOE u. T. TOBIN (1988): Dose related effects of the kappa agonist U-50, 488H on behaviour, nociception and autonomic response in the horse. Equine Veterinary Journal 20, 114-118. KAMERLING, S. G., D. J. DEQUICK, T. J. WECKMAN u. T. TOBIN (1986): Dose-related effects of ethylketazocine on nociception, behaviour and autonomic responses in the horse. Journal of Pharmacy and Pharmacology 38, 40-45. KAMERLING, S. G., T. J. WECKMAN, D. J. DEQUICK u. T. TOBIN (1985): A method for studying cutaneous pain perception and analgesia in horses. Journal of Pharmacological Methods 13, 267-274. KAVALIERS, M. u. D. D. COLWELL (1991): Sex differences in opioid and non-opioid mediated predator-induced analgesia in mice. Brain Research 568, 173-177. KELLY, S. J. u. K. B. J. FRANKLIN (1984): Evidence that stress augments morphine analgesia by increasing brain tryptophan. Neuroscience Letters 44, 305-310. KIDD, B. L. u. L. A. URBAN (2001): Mechanisms of inflammatory pain. British Journal of Anaesthesia 87, 3-11. KIEFFER, B. L. (1999): Opioids: first lessons from knockout mice. Trends in Pharmacological Sciences 20, 19-26. 106 Literaturverzeichnis KLATZKIN, R. R., B. MECHLIN u. S. S. GIRDLER (2010): Menstrual cycle phase does not influence gender differences in experimental pain sensitivity. European Journal of Pain 14, 77-82. KNYCH, H. K., H. C. CASBEER, D. S. MCKEMIE u. R. M. ARTHUR (2012): Pharmacokinetics and pharmacodynamics of butorphanol following intravenous administration to the horse. Journal of Veterinary Pharmacology and Therapeutics 36, 21-30 KOHN, C. W. u. W. W. MUIR, 3RD (1988): Selected aspects of the clinical pharmacology of visceral analgesics and gut motility modifying drugs in the horse. Journal of Veterinary Internal Medicine 2, 85-91. KOLTZENBURG, M. (1999): The changing sensitivity in the life of the nociceptor. Pain 82, Supplement 1, 93-S102. KRISTENSEN, J. D., B. SVENSSON u. T. GORDH JR (1992): The NMDA-receptor antagonist CPP abolishes neurogenic ‘wind-up pain’ after intrathecal administration in humans. Pain 51, 249-253. KURAISHI, Y., N. HIROTA, Y. SATO, S. KANEKO, M. SATOH u. H. TAKAGI (1985): Noradrenergic inhibition of the release of substance P from the primary afferents in the rabbit spinal dorsal horn. Brain Research 359, 177-182. LAHTI, R. A., M. M. MICKELSON, J. M. MCCALL u. P. F. VON VOIGTLANDER (1985): [3H]U-69593 a highly selective ligand for the opioid ț receptor. European Journal of Pharmacology 109, 281-284. 107 Literaturverzeichnis LAIRD, J. M. u. G. J. BENNETT (1993): An electrophysiological study of dorsal horn neurons in the spinal cord of rats with an experimental peripheral neuropathy. Journal of Neurophysiology 69, 2072-2085. LAMOTTE, R. H., J. G. THALHAMMER u. C. J. ROBINSON (1983): Peripheral neural correlates of magnitude of cutaneous pain and hyperalgesia: a comparison of neural events in monkey with sensory judgments in human. Journal of Neurophysiology 50, 1-26. LASCELLES, B. D. X., C. A. CAPNER u. A. E. WATERMAN-PEARSON (1999): Current British veterinary attitudes to perioperative analgesia for cats and small mammals. Veterinary Record 145, 601-604. LASCELLES, B. D. X., A. E. WATERMAN, P. J. CRIPPS, A. LIVINGSTON u. G. HENDERSON (1995): Central sensitization as a result of surgical pain: investigation of the pre-emptive value of pethidine for ovariohysterectomy in the rat. Pain 62, 201-212. LASCELLES, B. D. X. B., PHD u. S. A. B. ROBERTSON, PHD (2004): Use of thermal threshold response to evaluate the antinociceptive effects of butorphanol in cats. American Journal of Veterinary Research 65, 1085-1089 LE BARS, D., M. GOZARIU u. S. W. CADDEN (2001): Animal models of nociception. Pharmacological Reviews 53, 597-652. LEBLANC, P. H. (1991): Chemical restraint for surgery in the standing horse. The Veterinary clinics of North America. Equine practice 7, 521-533. 108 Literaturverzeichnis LEMBERG, K., V. K. KONTINEN, K. VILJAKKA, I. KYLÄNLAHTI, J. YLIKAUHALUOMA u. E. KALSO (2006): Morphine, Oxycodone, Methadone and Its Enantiomers in Different Models of Nociception in the Rat. Anesthesia & Analgesia 102, 1768-1774. LICHTMAN, A. H., F. L. SMITH u. B. R. MARTIN (1993): Evidence that the antinociceptive tail-flick response is produced independently from changes in either tail-skin temperature or core temperature. Pain 55, 283-295. LINARDI, R. L., A. M. STOKES, M. L. KEOWEN, S. A. BARKER, G. L. HOSGOOD u. SHORT C. R. (2012): Bioavailability and pharmacokinetics of oral and injectable formulations of methadone after intravenous, oral, and intragastric administration in horses. American Journal of Veterinary Research 73, 290-295. LINDEGAARD, C., M. H. THOMSEN, S. LARSEN u. P. H. ANDERSEN (2010): Analgesic efficacy of intra-articular morphine in experimentally induced radiocarpal synovitis in horses. Veterinary Anaesthesia and Analgesia 37, 171-185. LIU, S. S., R. L. CARPENTER, D. C. MACKEY, R. C. THIRLBY, S. M. RUPP, T. S. J. SHINE, N. G. FEINGLASS, P. P. METZGER, J. T. FULMER u. S. L. SMITH (1995): Effects of Perioperative Analgesic Technique on Rate of Recovery after Colon Surgery. Anesthesiology 83, 757-765. LÖSCHER W., F. UNGEMACH, R. KROKER (2010): Pharmakotherapie bei Haus- und Nutztieren. 8. Auflage, Enke, Stuttgart LOVE, E. J., J. G. LANE u. P. J. MURISON (2006): Morphine administration in horses anaesthetized for upper respiratory tract surgery. Veterinary Anaesthesia and Analgesia 33, 179-188. 109 Literaturverzeichnis LOVE, E. J., J. MURRELL u. H. R. WHAY (2011a): Thermal and mechanical nociceptive threshold testing in horses: a review. Veterinary Anaesthesia and Analgesia 38, 3-14. LOVE, E. J., P. M. TAYLOR, J. MURRELL u. H. R. WHAY (2011b): Effects of acepromazine, butorphanol and buprenorphine on thermal and mechanical nociceptive thresholds in horses. Equine Veterinary Journal 44, 221-225 LOVE, E. J., P. M. TAYLOR, J. MURRELL et al. (2008): Modification of a Feline Thermal Threshold System for Use In Horse Association of Veterinary Anaesthesists 35, 1-18. LYNN, B. u. S. E. CARPENTER (1982): Primary afferent units from the hairy skin of the rat hind limb. Brain Research 238, 29-43. MA, Q.-P. u. C. J. WOOLF (1995): Noxious stimuli induce an N-methyl-d-aspartate receptor-dependent hypersensitivity of the flexion withdrawal reflex to touch: implications for the treatment of mechanical allodynia. Pain 61, 383-390. MAMA, K. R., P. J. PASCOE u. E. P. STEFFEY (1993): Evaluation of the interaction of mu and kappa opioid agonists on locomotor behavior in the horse. Canadian Journal of Veterinary Research 57, 106-109. MARSH, S. J., C. E. STANSFELD, D. A. BROWN, R. DAVEY u. D. MCCARTHY (1987): The mechanism of action of capsaicin on sensory C-type neurons and their axons in vitro. Neuroscience 23, 275-289. 110 Literaturverzeichnis MARTIN, W. R., A. WIKLER, C. G. EADES u. F. T. PESCOR (1963): Tolerance to and Physical Dependence on Morphine in Rats. Psychopharmacologia 4, 247-260. MATTHES, H. W. D., R. MALDONADO, F. SIMONIN, O. VALVERDE, S. SLOWE, I. KITCHEN, K. BEFORT, A. DIERICH, M. LE MEUR, P. DOLLE, E. TZAVARA, J. HANOUNE, B. P. ROQUES u. B. L. KIEFFER (1996): Loss of morphine-induced analgesia, reward effect and withdrawal symptoms in mice lacking the ȝ-opioid-receptor gene. Nature 383, 819-823. MATTHES, H. W. D., C. SMADJA, O. VALVERDE, J.-L. VONESCH, A. S. FOUTZ, E. BOUDINOT, M. DENAVIT-SAUBIé, C. SEVERINI, L. NEGRI, B. P. ROQUES, R. MALDONADO u. B. L. KIEFFER (1998): Activity of the į-Opioid Receptor Is Partially Reduced, Whereas Activity of the țReceptor Is Maintained in Mice Lacking the ȝ-Receptor. The Journal of Neuroscience 18, 7285-7295. MAYER, D. J., T. L. WOLFLE, H. AKIL, B. CARDER u. J. C. LIEBESKIND (1971): Analgesia from electrical stimulation in the brainstem of the rat. Science 174, 1351-1354. MAYER, M. L., G. L. WESTBROOK u. P. B. GUTHRIE (1984): Voltage-dependent block by Mg2+ of NMDA responses in spinal cord neurones. Nature 309, 261-263. MCMULLAN, S., D. A. A. SIMPSON u. B. M. LUMB (2004): A reliable method for the preferential activation of C- or A-fibre heat nociceptors. Journal of Neuroscience Methods 138, 133-139. MCQUAY, H. J., D. CARROLL u. R. A. MOORE (1988): Postoperative orthopaedic pain - the effect of opiate premedication and local anaesthetic blocks. Pain 33, 291-295. 111 Literaturverzeichnis MELZACK u. WALL (1965): Pain mechanisms: A New Theory Science 971-979. MELZACK, R. (1996): Gate control theory: on the evolution of pain concepts. Official Journal of the American Pain Society 5,128-138 MELZACK, R., W. A. STOTLER u. W. K. LIVINGSTON (1958): Effects of discrete brainstem lesions in cats on perception of noxious stimulation. Journal of Neurophysiology 21, 353-367. MERRITT, A. M., H. XIE, G. D. LESTER, J. A. BURROW, M. LORENZO-FIGUERAS u. Z. MAHFOUD (2002): Evaluation of a method to experimentally induce colic in horses and the effects of acupuncture applied at the Guan-yuan-shu (similar to BL-21) acupoint. American Journal of Veterinary Research 63, 1006-1011. MIRCICA, E., R. E. CLUTTON, K. W. KYLES u. K. J. BLISSITT (2003): Problems associated with perioperative morphine in horses: a retrospective case analysis. Veterinary Anaesthesia and Analgesia 30, 147-155. MIRON, D., G. H. DUNCAN u. M. CATHERINE BUSHNELL (1989): Effects of attention on the intensity and unpleasantness of thermal pain. Pain 39, 345-352. MOENS, Y., F. LANZ, M. G. DOHERR u. U. SCHATZMANN (2003): A comparison of the antinociceptive effects of xylazine, detomidine and romifidine on experimental pain in horses. Veterinary Anaesthesia and Analgesia 30, 183-190. 112 Literaturverzeichnis MOLONY, V. u. J. E. KENT (1997): Assessment of acute pain in farm animals using behavioral and physiological measurements. Journal of Animal Science 75, 266-272. MUIR, W. W. u. J. A. E. HUBBELL (2008): Equine Anesthesia: Monitoring and Emergency Therapy. 2. Auflage, Mosby Elsevier, Missouri MUIR, W. W., R. T. SKARDA u. W. C. SHEEHAN (1978): Cardiopulmonary effects of narcotic agonists and a partial agonist in horses. American Journal of Veterinary Research 39, 1632-1635. MUIR, W. W. u. C. J. WOOLF (2001): Mechanisms of pain and their therapeutic implications. Journal of the American Veterinary Medical Association 219, 1346-1356. MUIR, W. W. (2010): Pain: Mechanisms and Management in Horses. Veterinary Clinics of North America: Equine Practice 26, 467-480. NARITA, M., M. SUZUKI, H. MIZOGUCHI, M. NARITA, Y. YAJIMA, S. SAKURADA, L. F. TSENG u. T. SUZUKI (2003): Up-regulation of ȝ-opioid receptor-mediated G-protein activation in protein kinase CȖ knockout mice following repeated naloxone treatment. Neuroscience Letters 338, 103-106. NIELSEN, C. S., R. STAUD u. D. D. PRICE (2009): Individual Differences in Pain Sensitivity: Consequences. The Journal of Pain 10, 231-237. 113 Measurement, Causation, and Literaturverzeichnis NILSFORS, L., C. KVART, P. KALLINGS, J. CARLSTEN u. U. BONDESSON (1988): Cardiorespiratory and sedative effects of a combination of acepromazine, xylazine and methadone in the horse. Equine Veterinary Journal 20, 364-367. NOCK, B., A. RAJPARA, L. H. O'CONNOR u. T. J. CICERO (1988): Autoradiography of [3H]U-69593 binding sites in rat brain: evidence for ț opioid receptor subtypes. European Journal of Pharmacology 154, 27-34. NOLAN, A. M., W. BESLEY, J. REID u. G. GRAY (1994): The effects of butorphanol on locomotor activity in ponies: a preliminary study. Journal of Veterinary Pharmacology and Therapeutics 17, 323-326. NORTH, R. A., J. T. WILLIAMS, A. SURPRENANT u. M. J. CHRISTIE (1987): Mu and delta receptors belong to a family of receptors that are coupled to potassium channels. Proceedings of the National Academy of Sciences 84, 5487-5491. OSBORNE, R., S. JOEL, D. TREW u. M. SLEVIN (1990): Morphine and metabolite behavior after different routes of morphine administration: Demonstration of the importance of the active metabolite morphine-6-glucuronide. Clinical Pharmacology and Therapeutics 47, 12-19. OSBORNE, R., P. THOMPSON, S. JOEL, D. TREW, N. PATEL u. M. SLEVIN (1992): The analgesic activity of morphine-6-glucuronide. British Journal of Clinical Pharmacology 34, 130-138. PASCOE, P. J. u. P. M. TAYLOR (2003): Effects of dopamine antagonists on alfentanil-induced locomotor activity in horses. Veterinary Anaesthesia and Analgesia 30, 165-171. 114 Literaturverzeichnis PASTERNAK, G. W. (1993): Pharmacological mechanisms of opioid analgesics. Clinical neuropharmacology 16, 1-18. PASTERNAK, G. W. (2001): Insights into mu opioid pharmacology: The role of mu opioid receptor subtypes. Life Sciences 68, 2213-2219. PATEL, S., S. NAEEM, A. KESINGLAND, W. FROESTL, M. CAPOGNA, L. URBAN u. A. FOX (2001): The effects of GABAB agonists and gabapentin on mechanical hyperalgesia in models of neuropathic and inflammatory pain in the rat. Pain 90, 217-226. PIPPI, N. L. u. W. V. LUMB (1979): Objective tests of analgesic drugs in ponies. American Journal of Veterinary Research 40, 1082-1086. PIPPI, N. L., LUMB, W.V., FIALHO, S.A.G., SCOTT, R.J. (1979): A model for evaluating pain in ponies. Journal of equine medicine and surgery. 3, 430-435 POLLER, C. (2012): Evaluierung eines Thermostimulationsgerätes zur standardisierten Beurteilung der Nozizeption beim Pferd- Vergleich verschiedener Körperregionen, Umgebungsbedingungen und Medikationen Hannover, tierärztliche Hochschule, Dissertation POLLER, C., K. HOPSTER, K. ROHN u. S. B. KASTNER (2013): Evaluation of contact heat thermal threshold testing for standardized assessment of cutaneous nociception in horses - comparison of different locations and environmental conditions. BMC Veterinary Research 9, 4. 115 Literaturverzeichnis PRESTON, K. L., D. R. JASINSKI u. M. TESTA (1991): Abuse potential and pharmacological comparison of tramadol and morphine. Drug and Alcohol Dependence 27, 7-17. PRICE, D. D. (2000): Psychological and Neural Mechanisms of the Affective Dimension of Pain. Science 288, 1769-1772. PRICE, D. D. u. J. G. MCHAFFIE (1988): Effects of heterotopic conditioning stimuli on first and second pain: A psychophysical evaluation in humans. Pain 34, 245-252. PRICE, J., S. CATRIONA, E. M. WELSH u. N. K. WARAN (2003): Preliminary evaluation of a behaviour-based system for assessment of post-operative pain in horses following arthroscopic surgery. Veterinary Anaesthesia and Analgesia 30, 124-137. PRICE, J., J. M. MARQUES, E. M. WELSH u. N. K. WARAN (2002): Pilot epidemiological study of attitudes towards pain in horses. Veterinary Record 151, 570-575. RAEKALLIO, M., K. M. HEINONEN, J. KUUSSAARI u. O. VAINIO (2003): Pain Alleviation in Animals: Attitudes and Practices of Finnish Veterinarians. The Veterinary Journal 165, 131-135. RAEKALLIO, M., P. M. TAYLOR u. R. C. BENNETT (1997a): Preliminary investigations of pain and analgesia assessment in horses administered phenylbutazone or placebo after arthroscopic surgery. Veterinary Surgery 26, 150-155. RAEKALLIO, M., P. M. TAYLOR u. M. BLOOMFIELD (1997b): A comparison of methods for evaluation of pain and distress after orthopaedic surgery in horses. Veterinary Anaesthesia and Analgesia 24, 17-20. 116 Literaturverzeichnis RAEKALLIO, M., P. M. TAYLOR, C. B. JOHNSON, R. M. TULAMO u. M. RUPRAH (1996): The disposition and local effects of intra-articular morphine in normal ponies. Veterinary Anaesthesia and Analgesia 23, 23-26. RAMABADRAN, K. u. M. BANSINATH (1986): A Critical Analysis of the Experimental Evaluation of Nociceptive Reactions in Animals. Pharmaceutical Research 3, 263-270. RÉDUA, M. A., C. A. A. VALADÃO, J. C. DUQUE u. L. T. BALESTRERO (2002): The pre-emptive effect of epidural ketamine on wound sensitivity in horses tested by using von Frey filaments. Veterinary Anaesthesia and Analgesia 29, 200-206. RICE, A. S. C. u. D. M. JUSTINS (1999): Pain mechanisms and pathways. Current Anaesthesia & Critical Care 10, 98-104. RICHMOND, C. E., L. M. BROMLEY u. C. J. WOOLF (1993): Preoperative morphine pre-empts postoperative pain. The Lancet 342, 73-75. RIEDERER, P. u. G. LAUX (2009): Grundlagen der Neuro-Psychopharmakologie: Ein Therapiehandbuch. Springer, Wien RIVIERE, J. E. u. M. G. PAPICH (2009): Veterinary Pharmacology and Therapeutics. 9. Auflage, Wiley-Blackwell, Iowa ROBERTS, M. C. u. A. ARGENZIO (1986): Effects of amitraz, several opiate derivatives and anticholinergic agents on intestinal transit in ponies. Equine Veterinary Journal 18, 256-260. 117 Literaturverzeichnis ROBERTSON, J. T., W. W. MUIR u. R. SAMS (1981): Cardiopulmonary effects of butorphanol tartrate in horses. American Journal of Veterinary Research 42, 41-44. ROBERTSON, S. A., L. C. SANCHEZ, A. M. MERRITT u. T. J. DOHERTY (2005): Effect of systemic lidocaine on visceral and somatic nociception in conscious horses. Equine Veterinary Journal 37, 122-127. ROBERTSON, S. A., P. M. TAYLOR, B. D. X. LASCELLES u. M. J. DIXON (2003): Changes in thermal threshold response in eight cats after administration of buprenorphine, butorphanol and morphine. Veterinary Record 153, 462-465. RÖCKEN, M., G. MOSEL, C. STEHLE, J. RASS u. L. F. LITZKE (2007): Left- and Right-Sided Laparoscopic-Assisted Nephrectomy in Standing Horses with Unilateral Renal Disease. Veterinary Surgery 36, 568-572. ROGER, T., T. BARDON u. Y. RUCKEBUSCH (1985): Colonic motor responses in the pony: relevance of colonic stimulation by opiate antagonists. American Journal of Veterinary Research 46, 31-35. ROGER, T., T. BARDON u. Y. RUCKEBUSCH (1994): Comparative effects of mu and kappa opiate agonists on the cecocolic motility in the pony. Canadian Journal of Veterinary Research 58, 163-166. ROHRBACH, H., T. KORPIVAARA, U. SCHATZMANN u. C. SPADAVECCHIA (2009): Comparison of the effects of the alpha-2 agonists detomidine, romifidine and xylazine on nociceptive withdrawal reflex and temporal summation in horses. Veterinary Anaesthesia and Analgesia 36, 384-395. 118 Literaturverzeichnis ROY, S., H.-C. LIU u. H. H. LOH (1998): ȝ-Opioid receptor-knockout mice: the role of ȝ-opioid receptor in gastrointestinal transit. Molecular Brain Research 56, 281-283. SAMAD, T. A., K. A. MOORE, A. SAPIRSTEIN, S. BILLET, A. ALLCHORNE, S. POOLE, J. V. BONVENTRE u. C. J. WOOLF (2001): Interleukin-1beta-mediated induction of Cox-2 in the CNS contributes to inflammatory pain hypersensitivity. Nature 410, 471-475. SANCHEZ, L. C., J. R. ELFENBEIN u. S. A. ROBERTSON (2008): Effect of acepromazine, butorphanol, or N-butylscopolammonium bromide on visceral and somatic nociception and duodenal motility in conscious horses. American Journal of Veterinary Research 69, 579-585. SANDKÜHLER (1996): The organization and function of endogenous antinociceptive systems. Progress in Neurobiology 50, 49-81. SANTOS, L. C. P., A. N. DE MORAES u. M. E. SAITO (2009): Effects of intraarticular ropivacaine and morphine on lipopolysaccharide-induced synovitis in horses. Veterinary Anaesthesia and Analgesia 36, 280-286. SCHAIBLE, H. G. u. R. F. SCHMIDT (1988): Excitation and sensitization of fine articular afferents from cat's knee joint by prostaglandin E2. The Journal of Physiology 403, 91-104. 119 Literaturverzeichnis SCHATZMAN, U., S. ARMBRUSTER, F. STUCKI, A. BUSATO u. I. KOHLER (2001): Analgesic effect of butorphanol and levomethadone in detomidine sedated horses. Journal of Veterinary Medicine 48, 337-342. SCHMELZ, M., R. SCHMIDT, M. RINGKAMP, H. O. HANDWERKER u. H. E. TOREBJORK (1994): Sensitization of insensitive branches of C nociceptors in human skin. Journal of Physiology 480, 389-394. SCHROEDER, J. u. E. MCCLESKEY (1993): Inhibition of Ca2+ currents by a mu-opioid in a defined subset of rat sensory neurons. The Journal of Neuroscience 13, 867-873. SELLON, D. C., V. L. MONROE, M. C. ROBERTS u. M. G. PAPICH (2001): Pharmacokinetics and adverse effects of butorphanol administered by single intravenous injection or continuous intravenous infusion in horses. American Journal of Veterinary Research 62, 183-189. SELLON, D. C., M. C. ROBERTS, A. T. BLIKSLAGER, C. ULIBARRI u. M. G. PAPICH (2004): Effects of Continuous Rate Intravenous Infusion of Butorphanol on Physiologic and Outcome Variables in Horses after Celiotomy. Journal of Veterinary Internal Medicine 18, 555-563. SENIOR, J. M., G. L. PINCHBECK, R. ALLISTER, A. H. DUGDALE, L. CLARK, R. E. CLUTTON, K. COUMBE, S. DYSON u. P. D. CLEGG (2007): Reported morbidities following 861 anaesthetics given at four equine hospitals. Veterinary Record 160, 407-408. SENIOR, J. M., G. L. PINCHBECK, A. H. A. DUGDALE u. P. D. CLEGG (2004): Retrospectoive Study the risk factors and prevalence of colic in horses after orthopaedic surgery. Veterinary Record 155, 321-325. 120 Literaturverzeichnis SHAW, J. S., L. MILLER, M. J. TURNBULL, J. J. GORMLEY u. J. S. MORLEY (1982): Selective antagonists at the opiate delta-receptor. Life Sciences 31, 1259-1262. SHEEHY, J. G., P. W. HELLYER, G. E. SAMMONDS, K. R. MAMA, B. E. POWERS, D. A. HENDRICKSON u. K. R. MAGNUSSON (2001): Evaluation of opioid receptors in synovial membranes of horses. American Journal of Veterinary Research 62, 1408-1412. SHIMOYAMA, M., N. SHIMOYAMA, C. E. INTURRISI u. K. J. ELLIOTT (1997): Gabapentin enhances the antinociceptive effects of spinal morphine in the rat tail-flick test. Pain 72, 375-382. SIMONIN, F., O. VALVERDE, C. SMADJA, S. SLOWE, I. KITCHEN, A. DIERICH, M. LE MEUR, B. P. ROQUES, R. MALDONADO u. B. L. KIEFFER (1998): Disruption of the ț-opioid receptor gene in mice enhances sensitivity to chemical visceral pain, impairs pharmacological actions of the selective ț-agonist U-50,488H and attenuates morphine withdrawal. EMBO Journal 17, 886-897. SINGELYN, F. J., M. DEYAERT, D. JORIS, E. PENDEVILLE u. J. M. GOUVERNEUR (1998): Effects of intravenous patient-controlled analgesia with morphine, continuous epidural analgesia, and continuous three-in-one block on postoperative pain and knee rehabilitation after unilateral total knee arthroplasty. Anesthesia & Analgesia 87, 88-92. SKARDA, R. T. u. W. W. MUIR (2003): Comparison of electroacupuncture and butorphanol on respiratory and cardiovascular effects and rectal pain threshold after controlled rectal distention in mares. American Journal of Veterinary Research 64, 137-144. 121 Literaturverzeichnis SOFUOGLU, M., P. S. PORTOGHESE u. A. E. TAKEMORI (1991): Differential antagonism of delta opioid agonists by naltrindole and its benzofuran analog (NTB) in mice: evidence for delta opioid receptor subtypes. Journal of Pharmacology and Experimental Therapeutics 257, 676-680. SOJKA, J. E., S. B. ADAMS, C. H. LAMAR u. L. L. ELLER (1988): Effect of butorphanol, pentazocine, meperidine, or metoclopramide on intestinal motility in female ponies. American Journal of Veterinary Research 49, 527-529. SOUTH, S. M., T. KOHNO, B. K. KASPAR, D. HEGARTY, B. VISSEL, C. T. DRAKE, M. OHATA, S. JENAB, A. W. SAILER, S. MALKMUS, T. MASUYAMA, P. HORNER, J. BOGULAVSKY, F. H. GAGE, T. L. YAKSH, C. J. WOOLF, S. F. HEINEMANN u. C. E. INTURRISI (2003): A Conditional Deletion of the NR1 Subunit of the NMDA Receptor in Adult Spinal Cord Dorsal Horn Reduces NMDA Currents and Injury-Induced Pain. The Journal of Neuroscience 23, 5031-5040. SPADAVECCHIA, C., L. ARENDT-NIELSEN, O. K. ANDERSEN, L. SPADAVECCHIA u. U. SCHATZMANN (2005): Effect of romifidine on the nociceptive withdrawal reflex and temporal summation in conscious horses. American Journal of Veterinary Research 66, 1992-1998. SPADAVECCHIA, C., L. ARENDT-NIELSEN, L. SPADAVECCHIA, M. MOSING, U. AUER u. R. VAN DEN HOVEN (2007): Effects of butorphanol on the withdrawal reflex using threshold, suprathreshold and repeated subthreshold electrical stimuli in conscious horses. Veterinary Anaesthesia and Analgesia 34, 48-58. SPADAVECCHIA, C., L. SPADAVECCHIA, O. K. ANDERSEN, L. ARENDTNIELSEN, M. LEANDRI u. U. SCHATZMANN (2002): Quantitative assessment of nociception in horses by use of the nociceptive withdrawal reflex evoked by transcutaneous electrical stimulation. American Journal of Veterinary Research 63, 1551-1556. 122 Literaturverzeichnis STEAGALL, P. V., P. M. TAYLOR, J. T. BRONDANI, S. P. LUNA, M. J. DIXON u. T. H. FERREIRA (2007): Effects of buprenorphine, carprofen and saline on thermal and mechanical nociceptive thresholds in cats. Veterinary Anaesthesia and Analgesia 34, 344-350. STEIN, C., M. J. MILLAN u. A. HERZ (1988): Unilateral inflammation of the hindpaw in rats as a model of prolonged noxious stimulation: Alterations in behavior and nociceptive thresholds. Pharmacology Biochemistry and Behavior 31, 445-451. STOLL, A. M. u. L. C. GREENE (1959): Relationship between pain and tissue damage due to thermal radiation. Journal of Applied Physiology 14, 373-382. STRIMBU-GOZARIU, M., F. GUIRIMAND, J.-C. WILLER u. D. LE BARS (1993): A sensitive test for studying the effects of opioids on a C-fibre reflex elicited by a wide range of stimulus intensities in the rat. European Journal of Pharmacology 237, 197-205. SUFKA, K. J. u. D. D. PRICE (2002): Gate Control Theory Reconsidered. Brain and Mind 3, 277-290. SVENSSON, B. R., AHMAD BEYDOUN, THOMAS J. MORROW u. P. KENNETH L. CASEY (1997): Comparative psychophysical characteristics of cutaneous CO2 laser and contact heat stimulation. Somatosensory & Motor Research 14, 113-118. 123 Literaturverzeichnis TAKAISHI, K., J. H. EISELE JR u. E. CARSTENS (1996): Behavioral and electrophysiological assessment of hyperalgesia and changes in dorsal horn responses following partial sciatic nerve ligation in rats. Pain 66, 297-306. TAVAKOLI, M., G. CORSSEN u. F. S. CARUSO (1976): Butorphanol and morphine: a double-blind comparison of their parenteral analgesic activity. Anesthesia and Analgesia 55, 394-401. TAYLOR, P., A. BROWNING u. C. HARRIS (1988): Detomidine-butorphanol sedation in equine clinical practice. Veterinary Record 123, 388-390. TAYLOR, P. M. (1985): Chemical restraint of the standing horse. Equine Veterinary Journal 17, 269-273. TAYLOR, P. M. (2005): Pharmacological approaches to pain management in the horse. In: American Association of Equine Practitioners (AAEP), Lexington, 398-402. TAYLOR, P. M., P. J. PASCOE u. K. R. MAMA (2002): Diagnosing and treating pain in the horse. Where are we today? Veterinary Clinics of North America-Equine Practice 18, 1-19 TAYLOR, P. M., S. A. ROBERTSON u. M. J. DIXON (2007a): Evaluation of the use of thermal thresholds to investigate NSAID analgesia in a model of inflammatory pain in cats. Journal of Feline Medicine and Surgery 9, 313-318. 124 Literaturverzeichnis TAYLOR, P. M., H. RYMASZEWSKA u. S. S. YOUNG (1990): Evaluation of combinations of nalbuphine with acepromazine or detomidine for sedation in ponies. Veterinary Anaesthesia and Analgesia 17, 38-41. TAYLOR, P. M., P. V. M. STEAGALL, M. J. DIXON, T. H. FERREIRA u. S. P. L. LUNA (2007b): Carprofen and buprenorphine prevent hyperalgesia in a model of inflammatory pain in cats. Research in Veterinary Science 83, 369-375. TEMPEL, A. u. R. S. ZUKIN (1987): Neuroanatomical patterns of the mu, delta, and kappa opioid receptors of rat brain as determined by quantitative in vitro autoradiography. Proceedings of the National Academy of Sciences 84, 4308-4312. TERNER, J. M., L. M. LOMAS u. M. J. PICKER (2005): Influence of Estrous Cycle and Gonadal Hormone Depletion on Nociception and Opioid Antinociception in Female Rats of Four Strains. The Journal of Pain 6, 372-383. TIAN, M., H. E. BROXMEYER, Y. FAN, Z. LAI, S. ZHANG, S. ARONICA, S. COOPER, R. M. BIGSBY, R. STEINMETZ, S. J. ENGLE, A. MESTEK, J. D. POLLOCK, M. N. LEHMAN, H. T. JANSEN, M. YING, P. J. STAMBROOK, J. A. TISCHFIELD u. L. YU (1997): Altered Hematopoiesis, Behavior, and Sexual Function in ȝ Opioid Receptor-deficient Mice. The Journal of Experimental Medicine 185, 1517-1522. TOMINAGA, M., M. J. CATERINA, A. B. MALMBERG, T. A. ROSEN, H. GILBERT, K. SKINNER, B. E. RAUMANN, A. I. BASBAUM u. D. JULIUS (1998): The Cloned Capsaicin Receptor Integrates Multiple Pain-Producing Stimuli. Neuron 21, 531-543 125 Literaturverzeichnis TOREBJORK, H. E. u. J. L. OCHOA (1990): New method to identify nociceptor units innervating glabrous skin of the human hand. Experimental Brain Research 81, 509-514. TORRECILLA, M., C. L. MARKER, S. C. CINTORA, M. STOFFEL, J. T. WILLIAMS u. K. WICKMAN (2002): G-Protein-Gated Potassium Channels Containing Kir3.2 and Kir3.3 Subunits Mediate the Acute Inhibitory Effects of Opioids on Locus Ceruleus Neurons. The Journal of Neuroscience 22, 4328-4334. TRANQUILLI; W.J., J. C. THURMON, K.A. GRIMM Lumb & Jones' Veterinary Anesthesia and Analgesia 4. Auflage, Blackwell Publishing, Iowa ULTENIUS, C., B. LINDEROTH, B. A. MEYERSON u. J. WALLIN (2006): Spinal NMDA receptor phosphorylation correlates with the presence of neuropathic signs following peripheral nerve injury in the rat. Neuroscience Letters 399, 85-90. UNTERWALD, E. M., C. KNAPP u. R. S. ZUKIN (1991): Neuroanatomical localization ofț1and ț2 opioid receptors in rat and guinea pig brain. Brain Research 562, 57-65. VAN DIJK, P. u. S. K. NYKS (1998): Changes in heart rate, mean arterial pressure, blood biochemistry, plasma glucose, plasma lactate and some plasma enzymes during sufentanil/halothane anaesthesia in horses. Veterinary Anaesthesia and Analgesia 25, 13-18. VAUGHAN CW, I. S., CONNOR MA, CHRISTIE MJ. (1997): How opioids inhibit GABA-mediated neurotransmission. Nature 390, 611-614 126 Literaturverzeichnis VERMA-GANDHU, M., P. BERCIK, Y. MOTOMURA, E. F. VERDU, W. I. KHAN, P. A. BLENNERHASSETT, L. WANG, R. T. EL-SHARKAWY u. S. M. COLLINS (2006): CD4+ T-cell modulation of visceral nociception in mice. Gastroenterology 130, 1721-1728. VERTHEIN, U., R. ULLMANN, A. LACHMANN, A. DÜRING, B. KOCH, H.-G. MEYER-THOMPSON, R. SCHMIDT, J. REIMER u. C. HAASEN (2005): The effects of racemic d,l-methadone and l-methadone in substituted patients—a randomized controlled study. Drug and Alcohol Dependence 80, 267-271. VIVIAN, J. A., M. B. DEYOUNG, T. L. SUMPTER, J. R. TRAYNOR, J. W. LEWIS u. J. H. WOODS (1999): ț-Opioid Receptor Effects of Butorphanol in Rhesus Monkeys. Journal of Pharmacology and Experimental Therapeutics 290, 259-265. WALL, P. D. (1978): The gate control theory of pain mechanism. A re-examination and re-statement Brain 101, 1-18 WALSH, S. L., E. C. STRAIN, M. E. ABREU u. G. E. BIGELOW (2001): Enadoline, a selective kappa opioid agonist: comparison with butorphanol and hydromorphone in humans. Psychopharmacology 157, 151-162. WENK, H. N., J.-D. BREDERSON u. C. N. HONDA (2006): Morphine Directly Inhibits Nociceptors in Inflamed Skin. Journal of Neurophysiology 95, 2083-2097. WISMEIJER, A. u. A. VINGERHOETS (2005): The use of virtual reality and audiovisual eyeglass systems as adjunct analgesic techniques: A review of the literature. Annals of Behavioral Medicine 30, 268-278. 127 Literaturverzeichnis WITHINGTON, D. E., J. A. PATRICK u. F. REYNOLDS (1993): Histamine release by morphine and diamorphine in man. Anaesthesia 48, 26-29. WITTERT, G., P. HOPE u. D. PYLE (1996): Tissue Distribution of Opioid Receptor Gene Expression in the Rat. Biochemical and Biophysical Research Communications 218, 877-881. WOOLF, C. J. u. M. B. MAX (2001): Mechanism-based Pain Diagnosis: Issues for Analgesic Drug Development. Anesthesiology 95, 241-249. WOOLF, C. J. u. S. W. N. THOMPSON (1991): The induction and maintenance of central sensitization is dependent on N-methyl-daspartic acid receptor activation; implications for the treatment of post-injury pain hypersensitivity states. Pain 44, 293-299. XU, F. u. T. LU (2011): Introduction to Skin Biothermomechanics and Thermal Pain. Springer, Berlin Heidelberg XU, G.-Y., L.-Y. M. HUANG u. Z.-Q. ZHAO (2000): Activation of silent mechanoreceptive cat C and Aį sensory neurons and their substance P expression following peripheral inflammation. The Journal of Physiology 528, 339-348. YAMAMOTO, T., N. NOZAKI-TAGUCHI u. T. CHIBA (2002): Analgesic effect of intrathecally administered orexin-A in the rat formalin test and in the rat hot plate test. British Journal of Pharmacology 137, 170-176. 128 Literaturverzeichnis YARNITSKY, D. u. J. L. OCHOA (1990): Studies of heat pain sensation in man: perception thresholds, rate of stimulus rise and reaction time. Pain 40, 85-91. YARNITSKY, D., E. SPRECHER, R. ZASLANSKY u. J. A. HEMLI (1995): Heat pain thresholds: normative data and repeatability. Pain 60, 329-332. YEOMANS, D. C. u. H. K. PROUDFIT (1996): Nociceptive responses to high and low rates of noxious cutaneous heating are mediated by different nociceptors in the rat: electrophysiological evidence. Pain 68, 141-150. YEOMANS, M. R. u. P. WRIGHT (1991): Lower pleasantness of palatable foods in nalmefene-treated human volunteers. Appetite 16, 249-259. YEOMANS, M. R., P. WRIGHT, H. A. MACLEOD u. J. A. CRITCHLEY (1990): Effects of nalmefene on feeding in humans. Dissociation of hunger and palatability. Psychopharmacology 100, 426-432. YOSHIMURA, M. u. N. YONEHARA (2006): Alteration in sensitivity of ionotropic glutamate receptors and tachykinin receptors in spinal cord contribute to development and maintenance of nerve injury-evoked neuropathic pain. Neuroscience Research 56, 21-28. YUAN, C., J. FOSS, M. O'CONNOR, J. MOSS u. M. ROIZEN (1998): Gut motility and transit changes in patients receiving long-term methadone maintenance. The Journal of Clinical Pharmacology 38, 931-935. 129 Literaturverzeichnis ZHUO, M. u. G. F. GEBHART (1990): Characterization of descending inhibition and facilitation from the nuclei reticularis gigantocellularis and gigantocellularis pars alpha in the rat. Pain 42, 337-350. ZIMMERMANN, M. (1986): Behavioural investigations of pain in animals. Assessing Pain in Farm Animals (Duncan IJH and Molony Y eds), 16-29. ZOBRIST, R. H., H. W. ALLERTON u. G. E. ISOM (1981): Characterization of the respiratory activity of (D-Ala2)methionine-enkephalinamide. European Journal of Pharmacology 70, 121-128. ZUKIN, R. S., M. EGHBALI, D. OLIVE, E. M. UNTERWALD u. A. TEMPEL (1988): Characterization and visualization of rat and guinea pig brain kappa opioid receptors: evidence for kappa 1 and kappa 2 opioid receptors. Proceedings of the National Academy of Sciences 85, 4061-4065. 130 Anhang Anhang 1: Nozizeptive Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der Behandlung P (NaCl) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert, t0) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. Placebo (NaCl) Zeit (min) Temperatur (°C) 0 45,91 ± 2,7 10 45,06 ± 3,7 30 45,96 ± 2,1 60 46,28 ± 3,4 90 46,64 ± 3,4 120 47,96 ± 3,8 180 45,85 ± 3,9 240 46,21 ± 4,8 300 46,33 ± 4,3 360 46,10 ± 2,7 420 46,78 ± 4,4 540 45,58 ± 3,2 1350 46,86 ± 1,3 131 Anhang Anhang 2: Nozizeptive Schwellenwerte (Temperatur, °C) nach thermischer Stimulation am Widerrist der M0,1-Behandlung (Morphin 0,1 mg/kg), der B0,1-Behandlung (Butorphanol 0,1 mg/kg) und der L0,1-Behandlung (Levomethadon 0,1 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert, t0) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. Morphin Butorphanol Levomethadon (0,1 mg/kg) (0,1 mg/kg) (0,1 mg/kg) Zeit (min) Temperatur (°C) Temperatur (°C) 0 46,60 ± 3,9 46,05 ± 1,2 46,23 ± 2,7 10 48,11 ± 2,3 51,98 ± 3,9 a,b 51,04 ± 3,4 a 30 48,00 ± 6,2 53,23 ± 4,4 a,b 50,20 ± 3,2 a 60 49,31 ± 4,6 51,10 ± 5,3 a 50,58 ± 3,8 a 90 49,95 ± 4,0 51,21 ± 4,4 a 48,28 ± 3,3 120 47,61 ± 2,3 48,11 ± 4,2 49,15 ± 5,3 180 44,71 ± 4,1 46,21 ± 3,0 47,70 ± 6,5 240 45,08 ± 4,7 45,76 ± 4,0 47,89 ± 6,3 300 43,53 ± 3,5 46,78 ± 2,3 47,61 ± 4,1b 360 45,35 ± 5,3 45,18 ± 2,9 44,99 ± 3,5 420 44,55 ± 3,6 45,86 ± 2,5 47,75 ± 4,2 b 540 43,36 ± 4,5 46,39 ± 1,2 1350 45,41 ± 4,8 46,89 ± 2,3 Temperatur (°C) 46,04 ± 2,6 47,14 ± 2,6 a signifikanter Unterschied zu dem Kontrollwert (t0) b signfikanter Unterschied zu der Behandlung M0,1 (Morphin 0,1 mg/kg) 132 Anhang Anhang 3 Nozizeptive Schwellenwerte (Temperatur, °C) nach t hermischer Stimulation am Widerrist der M0,2-Behandlung (Morphin 0,2 mg/kg), der B0,2-Behandlung (Butorphanol 0,2 mg/kg) und der L0,2-Behandlung (Levomethadon 0,2 mg/kg) (n=8). Abgebildet sind die erreichten Schwellenwerte (Mittelwert, SD) vor der AM-Applikation (Kontrollwert, t0) und nach der AM-Applikation zu den jeweiligen Messzeitpunkten über einen Zeitraum von 1350 Minuten. Morphin Butorphanol Levomethadon (0,2 mg/kg) (0,2 mg/kg) (0,2 mg/kg) Zeit (min) Temperatur (°C) Temperatur (°C) Temperat ur (°C) 0 46,76 ± 2,6 46,85 ± 2,4 46,98 ± 1,6 10 51,71 ± 4,7 a 54,65 ± 3,8 a 55,39 ± 1,7 a,b 30 51,88 ± 3,6 a 54,43 ± 3,5 a 55,74 ± 0,7 a, b 60 49,44 ± 3,5 a 53,75 ± 3,5 a,b 53,35 ± 3,5 a, b 90 50,11 ± 4,4 a 52,13 ± 4,7 a 53,46 ± 3,5 a 120 50,40 ± 4,7 a 48,51 ± 2,1 53,00 ± 3,7 a,c 180 51,16 ± 4,1 a 48,81 ± 3,4 51,91 ± 4,4 a 240 50,04 ± 3,9 a 48,71 ± 2,2 49,83 ± 4,6 a 300 47,97 ± 2,3 47,35 ± 3,3 49,83 ± 3,1 a 360 47,04 ± 2,4 47,04 ± 2,2 48,25 ± 3,6 420 47,19 ± 3,6 47,14 ± 3,2 48,79 ± 3,1 540 45,64 ± 2,3 46,93 ± 1,2 45,95 ± 2,7 1350 46,61 ± 3,2 47,39 ± 1,7 47,23 ± 0,7 a signifikanter Unterschied zu dem Kontrollwert (t0) b signifikanter Unterschied zu der Behandlung M0,2 (Morphin 0,2 mg/kg) c signifikanter Unterschied zu der Behandlung B0,2 (Butorphanol 0,2 mg/kg) 133 Anhang Anhang 4: Prozentuale Temperaturabweichung (TE %) der P-Behandlung (NaCl) (n=8) zu den jeweiligen Messzeitpunkten (t0 bis t1350). Der nozizeptive Schwellenwert (TT) wurde mithilfe der Thermostimulation am Widerrist ermittelt. Über einen Temperatursensor konnte die Hauttemperatur (T0) ermittelt werden, die cut-out Temperatur (Tc) wurde im vorneherein mit 55 °C festgelegt. Placebo (NaCl) Zeit (min) TE % 0 63,97 ± 10,8 10 60,79 ± 15,2 30 62,99 ± 7,6 60 64,61 ± 13,5 90 61,02 ± 16,0 120 70,81 ± 15,7 180 61,35 ± 16,9 240 62,64 ± 20,4 300 62,77 ± 19,1 360 61,91 ± 12,8 420 63,52 ± 19,6 540 59,72 ± 13,2 1350 67,19 ± 6,4 TE % = 100 x ([TT – T0] / [Tc-T0] 134 Anhang Anhang 5: Prozentuale Temperaturabweichung (TE %) der M0,1-Behandlung (Morphin 0,1 mg/kg), der B0,1-Behandlung (Butorphanol 0,1 mg/kg) und der L0,1-Behandlung (Levomethadon 0,1 mg/kg) (n=8) vor der AM-Applikation (t0) und zu den jeweiligen Zeitpunkten (t10 bis t1350) nach Opioid-Applikation im Vergleich. Der nozizeptive Schwellenwert (TT) wurde mithilfe der Thermostimulation am Widerrist ermittelt. Über einen Temperatursensor konnte die Hauttemperatur (T0) ermittelt werden, die cut-out Temperatur (Tc) wurde im vorneherein mit 55 °C festgelegt. Morphin 0,1 mg/kg Butorphanol 0,1 mg/kg Levomethadon 0,1 mg/kg Zeit (min) TE % TE % TE % 0 65,37 ± 16,3 62,34 ± 5,6 65,04 ± 11,3 10 71,81 ± 9,6 a 87,33 ± 16,6 83,87 a ± 14,0 30 70,49 ± 25,7 92,68 a ± 18,2 79,98 a ± 13,8 60 75,63 ± 19,2 83,46 a ± 23,0 81,39 a ± 16,3 90 78,54 ± 16,9 83,79 a ± 18,9 72,14 ± 13,4 120 68,71 ± 9,3 69,34 ± 19,2 75,60 ± 21,9 180 55,89 ± 16,7 61,74 ± 13,9 69,33 ± 27,8 240 55,88 ± 22,2 59,35 ± 19,2 69,69 ± 26,8 300 49,34 ± 16,5 63,75 ± 10,9 68,67 ± 17,6 360 57,60 ± 23,3 56,75 ± 14,1 57,44 ± 14,8 420 54,27 ± 15,4 60,09 ± 10,7 70,18 ± 17,2 540 49,37 ± 19,2 62,40 ± 5,9 63,14 ± 9,8 1350 60,79 ± 19,7 67,18 ± 7,9 signifikanter Unterschied zu dem Kontrollwert (t0) 68,30 ± 10,5 a TE % = 100 x ([TT – T0] / [Tc-T0] 135 Anhang Anhang 6: Prozentuale Temperaturabweichung (TE %) der M0,2-Behandlung (Morphin 0,2 mg/kg), der B0,2-Behandlung (Butorphanol 0,2 mg/kg) und der L0,2-Behandlung (Levomethadon 0,2 mg/kg) (n=8) vor der AM-Applikation (t0) und zu den jeweiligen Zeitpunkten (t10 bis t1350) nach Opioid-Applikation im Vergleich. Der nozizeptive Schwellenwert (TT) wurde mithilfe der Thermostimulation am Widerrist ermittelt. Über einen Temperatursensor konnte die Hauttemperatur (T0) ermittelt werden, die cut-out Temperatur (Tc) wurde im vorneherein mit 55 °C festgelegt. Morphin 0,2 mg/kg Butorphanol 0,2 mg/kg Levomethadon 0,2 mg/kg Zeit (min) TE % TE % TE % 0 68,54 ± 11,2 67,06 ± 10,7 68,30 ± 7,1 a a a 98,92 ± 14,5 101,45 ± 7,0 a 98,02 ± 12,8 a 95,67 ± 13,1 a a a 102,92 ± 3,0 a 93,29 ± 14,1 88,55 ± 18,6 a 93,65 ± 14,4 a 72,92 ± 8,3 91,49 ± 15,6 a 10 87,05 ± 18,4 30 87,96 ± 13,8 60 78,15 ± 13,8 90 80,59 ± 16,9 120 81,56 ± 18,7 180 84,54 ± 16,6 73,87 ± 14,4 86,82 ± 18,8 240 79,02 ± 16,6 73,33 ± 8,7 78,45 ± 19,0 300 69,96 ± 11,4 67,52 ± 14,1 78,29 ± 13,2 360 65,75 ± 11,5 65,46 ± 10,1 70,94 ± 15,7 420 67,19 ± 14,1 66,32 ± 13,4 73,60 ± 13,4 540 59,97 ± 9,4 64,24 ± 6,6 60,73 ± 12,7 1350 67,21 ± 12,8 69,12 ± 7,3 signifikanter Unterschied zu dem Kontrollwert (t0) 68,96 ± 3,7 TE % = 100 x ([TT – T0] / [Tc-T0] 136 a a a a a a Anhang Anhang 7: Atemfrequenz (Atemzüge/Minute; Mittelwert, SD) der Behandlungen P (NaCl), M0,1 (Morphin 0,1 mg/kg), M0,2 (Morphin 0,2 mg/kg), B0,1 (Butorphanol 0,1 mg/kg), B0,2 (Butorphanol 0,2 mg/kg), L0,1 (Levomethadon 0,1 mg/kg) und L0,2 (Levomethadon 0,2 mg/kg) (n=8) vor der AM- Applikation (t0) und zu den jeweiligen Zeitpunkten (t10 bis t1350) nach AM-Applikation im Vergleich. Zeit (min) Ϭ ϭϬ ϯϬ ϲϬ ϵϬ ϭϮϬ ϭϴϬ ϮϰϬ ϯϬϬ ϯϲϬ ϰϮϬ ϱϰϬ 1350 NaCl M0,1 M0,2 B0,1 B0,2 L0,1 L0,2 13 ± 3 13 ± 2 13 ± 3 13 ± 3 14 ± 2 12 ± 2 14 ± 3 14 ± 2 14 ± 3 14 ± 2 15 ± 4 15 ± 3 13 ± 5 15 ± 3 13 ± 2 12 ± 2 14 ± 2 14 ± 5 14 ± 3 10 ± 2 15 ± 1 14 ± 1 12 ± 2 13 ± 2 15 ± 7 15 ± 3 11 ± 2 14 ± 2 13 ± 1 12 ± 1 13 ± 2 16 ± 7 15 ± 3 11 ± 2 14 ± 2 12 ± 1 12 ± 2 13 ± 2 14 ± 4 14 ± 2 11 ± 2 14 ± 2 13 ± 1 12 ± 1 13 ± 2 15 ± 4 15 ± 2 12 ± 1 14 ± 2 12 ± 1 12 ± 1 13 ± 2 14 ± 4 14 ± 2 11 ± 1 14 ± 2 12 ± 1 12 ± 1 13 ± 2 14 ± 4 14 ± 2 12 ± 1 14 ± 2 13 ± 1 12 ± 1 13 ± 1 12 ± 2 14 ± 2 11 ± 1 14 ± 2 13 ± 1 12 ± 1 13 ± 1 12 ± 2 14 ± 2 11 ± 1 14 ± 2 13 ± 2 14 ± 2 12 ± 1 12 ± 1 13 ± 1 13 ± 1 11 ± 1 12 ± 2 14 ± 2 14 ± 2 11 ± 1 11 ± 1 14 ± 2 14 ± 2 Anhang 8: Herzfrequenz (Schläge/Minute; Mittelwert, SD) der Behandlungen P (NaCl), M0,1 (Morphin 0,1 mg/kg), M0,2 (Morphin 0,2 mg/kg), B0,1 (Butorphanol 0,1 mg/kg), B0,2 (Butorphanol 0,2 mg/kg), L0,1 (Levomethadon 0,1 mg/kg) und L0,2 (Levomethadon 0,2 mg/kg) (n=8) vor der AM- Applikation (t0) und zu den jeweiligen Zeitpunkten (t10 bis t1350) nach AM-Applikation im Vergleich. Zeit (min) NaCl M0,1 M0,2 B0,1 B0,2 L0,1 L0,2 Ϭ 38 ± 3 35 ± 4 39 ± 2 37 ± 3 36 ± 6 34 ± 3 37 ± 4 ϭϬ 38 ± 2 37 ± 4 42 ± 5 41 ± 5 41 ± 5 37 ± 3 45 ± 6 a a a 39 ± 4 36 ± 3 42 ± 3 40 ± 5 41 ± 7 36 ± 3 47 ± 4 ϲϬ 38 ± 3 36 ± 3 41 ± 2 39 ± 3 41 ± 7 37 ± 1 43 ± 6 ϵϬ 39 ± 4 34 ± 3 40 ± 3 39 ± 3 38 ± 5 37 ± 3 40 ± 4 ϭϮϬ 39 ± 5 35 ± 2 41 ± 3 38 ± 3 38 ± 4 36 ± 3 39 ± 1 ϭϴϬ 38 ± 3 34 ± 2 40 ± 1 36 ± 3 38 ± 3 34 ± 3 39 ± 2 ϮϰϬ 37 ± 3 34 ± 2 39 ± 3 36 ± 3 37 ± 3 36 ± 1 37 ± 2 ϯϬϬ 37 ± 2 34 ± 2 39 ± 2 36 ± 2 36 ± 3 35 ± 2 37 ± 2 ϯϲϬ 37 ± 3 34 ± 2 38 ± 2 35 ± 3 37 ± 3 36 ± 1 38 ± 2 ϰϮϬ 37 ± 2 34 ± 2 38 ± 2 36 ± 3 37 ± 3 36 ± 1 38 ± 1 36 ± 3 36 ± 2 38 ± 2 37 ± 1 35 ± 2 36 ± 1 37 ± 2 38 ± 2 ϯϬ ϱϰϬ 37 ± 2 35 ± 2 38 ± 2 1350 39 ± 4 35 ± 3 39 ± 3 a signifikanter Unterschied zu dem Kontrollwert (t0) 137 Anhang Anhang 9: Hauttemperatur (°C, Mittelwert, SD) der Behandlun gen P (NaCl), M0,1 (Morphin 0,1 mg/kg), M0,2 (Morphin 0,2 mg/kg), B0,1 (Butorphanol 0,1 mg/kg), B0,2 (Butorphanol 0,2 mg/kg), L0,1 (Levomethadon 0,1 mg/kg) und L0,2 (Levomethadon 0,2 mg/kg) (n=8) vor der AMApplikation (t0) und zu den jeweiligen Zeitpunkten (t10 bis t1350) nach AM-Applikation P M0,1 M0,2 B0,1 Zeit (min) 0 10 30 60 90 120 180 240 300 360 420 540 1350 0 10 30 60 90 120 180 240 300 360 420 540 1350 0 10 30 60 90 120 180 240 300 360 420 540 1350 0 10 30 60 90 120 180 Pferd 1 29,6 30,5 30,9 30,8 28,7 30,1 30,4 31 30 30,8 32,2 31,4 29,3 30,4 30,8 30,1 29,1 30,2 30,1 32,3 30,1 33,1 32,8 32,7 30,1 29,8 28,5 29,5 30 30,2 30,1 29,9 30,4 30,1 32 30,8 31,2 31,9 28,7 34,3 31,9 33,2 33,9 33,8 33,6 33,2 Pferd 2 27,8 26,9 27,5 27,1 29,1 29,4 32,5 29,8 31,2 30,5 32,1 31,2 28,9 30,9 30,1 31,2 32,1 32 31,9 31 32,9 33 32,1 32 32,8 30,9 28,3 28,9 30,2 29,8 30,1 30,4 32,1 31,4 32,1 32,9 32 32,1 29,8 30,9 31,6 30,2 30,4 30,8 31,2 30,1 Pferd 3 29,7 28,9 30,1 30 31 30,1 30,5 30,1 30,3 30 31,2 30,4 30,2 32,9 29,5 30,2 33,1 31,9 32,9 32,7 33,2 32 32,5 32,1 33,2 29,9 26,5 27,1 26,9 27,1 26,9 30,1 30,2 30,1 30,3 31 32,3 31,9 27,6 30 29,9 30,1 29 31 32 31,2 Pferd 4 30,5 30,8 32,6 31,1 32,9 31,7 30,8 31,3 33,4 30,7 33,1 30,8 32,1 31,4 33,1 33,4 32,2 31,9 31,2 33,2 34,1 32,4 32,9 32,8 32,1 29,8 30,4 30,8 31,2 32 31,9 31,7 31,2 33,2 34 34,3 35 34,2 31,9 32,8 31,6 31,2 32,8 32,1 33,1 32,8 Pferd 5 30,8 30,2 31 30,8 31,2 30,9 31 32,1 31,8 33 33,1 32,8 30,8 30,9 32,1 31,2 32,2 32,4 32,3 32,5 32,1 32 32,4 32,5 32,1 29,8 27,8 30 27 28,1 30 30,4 32,1 31,8 32,4 32,1 31,7 30,8 27,8 30 29,8 31,4 30,2 31,4 32,1 33,1 138 Pferd 6 30,1 29,8 30,3 30,4 30,2 31,2 31,6 33,2 31,5 33,2 33,1 33,5 30,8 30 30,9 31,3 31,2 32,1 32,2 31,9 32,4 32,8 32,1 32,4 32,2 32,6 28 28,9 29,5 28,1 28,5 28,1 28,9 29,2 28,7 29,1 28,7 29,8 29,7 31,6 32,3 31,9 32,8 32,1 33,2 33 Pferd 7 30,1 30,1 32,4 33 32,8 33,1 32,4 33 32,2 32,8 31,7 32,5 30,2 29,2 28,4 29,6 29,8 31,2 31,3 30,2 31,8 32,1 32,8 32,7 32,1 32,3 29 27,8 28,1 28,2 29 29,5 30 30 29,7 30,2 30 31 30 28,9 28,8 28,9 30,1 31,2 31,5 30,8 Pferd 8 29,2 29,1 30 29,7 28,9 29 30,1 30 30,2 30 31 30,2 27,9 29,7 30 30,1 31,5 30 30,2 30,3 30,2 30,4 31,2 30,4 31 28,9 29,9 29,9 29,9 29,8 29,7 29,9 30 31,9 31,5 31,8 30,7 31,4 28,7 30,5 30,1 30,2 32,1 31,5 32,3 31,2 Mittelwert, SD 29,7 ± 0,9 29,5 ± 1,2 30,6 ± 1,6 30,4 ± 1,7 30,6 ± 1,7 30,7 ± 1,3 31,2 ± 0,9 31,3 ± 1,3 31,3 ± 1,2 31,4 ± 1,4 32,2 ± 0,9 31,6 ± 1,2 30 ± 1,3 30,7 ± 1,2 30,6 ± 1,5 30,9 ± 1,2 31,4 ± 1,3 31,5 ± 0,9 31,5 ± 1 31,8 ± 1,1 32,1 ± 1,4 32,2 ± 0,9 32,4 ± 0,6 32,2 ± 0,8 32 ± 1 30,5 ± 1,3 28,6 ± 1,2 29,1 ± 1,2 29,1 ± 1,6 29,2 ± 1,6 29,5 ± 1,5 30 ± 1 30,6 ± 1,1 31 ± 1,3 31,3 ± 1,7 31,5 ± 1,6 31,5 ± 1,9 31,6 ± 1,3 29,3 ± 1,4 31,1 ± 1,7 30,8 ± 1,3 30,9 ± 1,3 31,4 ± 1,7 31,7 ± 1 32,4 ± 0,9 31,9 ± 1,2 Anhang B0,2 L0,1 L0,2 240 300 360 420 540 1350 0 10 30 60 90 120 180 240 300 360 420 540 1350 0 10 30 60 90 120 180 240 300 360 420 540 1350 0 10 30 60 90 120 180 240 300 360 420 540 1350 33,1 33,8 32,9 34,1 33,1 32,9 28,9 28,5 27,7 28,3 28,8 30,1 30,4 30,1 31,2 31,9 30,9 30,7 29,8 29,4 30,4 30,1 31,1 30,2 30,8 31,2 31,8 31 33 31,7 31 32 31,9 33 30,7 32,3 33 32,9 33,2 32,9 32,8 33,4 32,9 33,1 31,9 32,1 32,7 32,5 31,9 32,3 30,1 28 27,9 27,6 30,1 32,1 32,2 31,5 30 31,1 32,3 30,8 31,7 29,8 29,5 28,7 29,1 29,7 30,4 30,6 30,7 31,8 29,8 31 30,1 30,5 30 31,6 29,8 32,1 33,1 32,8 31,5 31,7 33 32,9 32,7 32 33,2 30,6 31,5 31,8 31,2 30,9 31,1 31,2 29,4 30,1 28,9 28,7 29,9 30,2 31,9 30,2 30,4 30,2 31,2 30,8 31,3 29,3 31,5 31,2 30,7 31,2 30,1 30,2 31 30,7 30,1 30,2 31,2 30,1 30 30,3 30 31,2 30,8 31,3 32,1 31,9 32 33 32,9 32,8 30 32,1 32,3 32,1 32,1 32,2 30,1 27,1 26,9 27,9 26,8 30 31 30,2 31,1 30 31,3 30,2 31,2 27,2 29,9 31,3 33,1 33,2 30,8 32,3 33 33,2 33 32,7 32,8 33,1 30,9 29,7 29,9 30 30,5 30,8 33,3 33,1 33,4 34 33,4 33,5 32,8 29,8 32,3 32,4 33,1 32,9 32,5 31 32,5 30,8 31,9 31,7 32,1 32,8 33,2 34,2 34,1 34 33,8 34,3 32,8 30,5 31,2 31,3 31,4 31,2 31,9 31,2 31 30,1 30,2 30,1 30 28,9 28,6 27,8 28,1 29,3 29,8 29,9 30,1 30,4 30,8 31,1 29,9 30,1 30,3 139 33,2 33,1 33,3 33,2 33 30,9 32,9 33,9 31,7 31,9 32 31,9 32 33,3 31,9 32,7 33,5 34,6 30,8 30,5 30,1 31 31,3 31,9 30,9 31,9 31,1 31,2 31,2 30 30,3 30,8 29,9 29,5 29,9 30,2 29,8 30,3 31,2 30,9 30,4 32,5 33,1 32,7 30,2 30,7 30,9 31,1 31 31,8 30 31,4 32,8 29,8 28,7 30,2 30,6 31,4 31 30,8 31,1 30,7 33,1 30 29,9 31,2 29,6 30,2 30,5 30,3 31,2 32,3 32,1 31,5 31,2 29,8 29,8 28,6 29 30,1 30,2 29,8 30,9 31,9 31,5 30 30,5 29,7 30,2 27,4 30,8 30 30,2 30,4 30,2 27,8 29,7 27,8 28,5 30 30,1 30,2 30,1 31,9 31,5 31,6 32,1 31,7 30,2 29,9 28,5 28,7 28,9 30 31,2 31 30,8 31,8 32 30,2 30,3 28,8 26,4 26,1 26,7 26,9 27,3 27,5 27,8 27,5 28,2 28,8 28,9 29,5 28,5 32 ± 0,9 32,1 ± 1,2 32,1 ± 1,1 32,1 ± 1,3 32 ± 1 30,5 ± 1,4 30 ± 2,1 29,8 ± 2,5 29,3 ± 1,7 29,5 ± 1,7 30,7 ± 1,3 31,1 ± 1 31,3 ± 1,1 31,5 ± 1,6 31,4 ± 1,3 31,9 ± 1,1 31,7 ± 1,3 32,3 ± 1,5 30,2 ± 1,6 29,9 ± 0,4 30,4 ± 1,2 30,5 ± 1,4 30,8 ± 1,3 30,8 ± 0,6 31 ± 0,8 31,3 ± 0,8 31,6 ± 0,8 31,2 ± 1,1 31,5 ± 1,1 30,8 ± 1 30,8 ± 1 30,2 ± 1,1 29,6 ± 1,8 29,4 ± 2 29,7 ± 1,6 30,5 ± 1,9 30,5 ± 1,8 31 ± 1,8 31,4 ± 1,8 31,4 ± 1,9 31,4 ± 1,9 31,9 ± 1,6 31,6 ± 1,8 31,8 ± 1,6 29,8 ± 1,4 Danksagung An dieser Stelle möchte ich mich bei den Menschen bedanken, ohne die diese Doktorarbeit nie zustande gekommen wäre. Als erstes möchte ich Prof. Dr. S. Kästner für das Überlassen des interessanten Dissertationsthemas und die gute wissenschaftliche Betreuung bedanken. Ich danke Prof. Dr. K. Feige für die Möglichkeit, diese Studie in der Klinik für Pferde durchzuführen. Mein ganz besonderer Dank geht an Dr. K. Hopster, der mit Abstand der beste (und lustigste) Betreuer ist, den man sich wünschen kann. Kristin Iburg danke ich für die Bildung des unschlagbaren Teams „Thermostimulation“! Dr. K. Rohn danke ich für die Unterstützung bei dem statistischen Teil meiner Arbeit. Für die tatkräftige Hilfe und Unterstützung während meiner Versuche, aber vor allem für die Tatsache, dass sie die zwei Jahre an der Pferdeklinik zu einer äußerst lustigen und schönen Zeit gemacht haben, möchte ich mich bei meinen Mitdoktoranden bedanken. Malte Schmidt danke ich für das geduldige und zuversichtliche Lesen der allerersten Versionen dieser Arbeit, für die geduldige und zuversichtliche Hilfestellung bei jeglichen computertechnischen oder sonstigen Problemen und für das Herstellen hochprofessioneller Fotos. Annika Fiedler danke ich für den spontanen und schnellen Einsatz beim Ausgleichen meiner grammatikalischen Schwächen. Auch den Studenten, die mir beim praktischen Ablauf meiner Dissertation geholfen haben, möchte ich danken. 140 Bei Vincent Suttor möchte ich mich für die Korrektur des englischensprachigen Teils meiner Doktorarbeit bedanken. Ida Dönselmann danke ich für die konstruktiven Anmerkungen zu meiner Arbeit. Für einen optimalen Ausgleich zum Dissertationsstress und für unvergessliche Abende geht selbstredend auch ein großes Dankeschön an meine „DienstagsFreunde“. Mein größter Dank geht an meine Familie. Zum einen natürlich weil sie mich in den letzten Jahren immer bedingungslos unterstützt hat, zum anderen weil sie ein großer, lustiger Haufen toller Menschen mit großem Ablenkungs- und Zerstreuungspotential ist! 141