Adenoviridae
Werbung

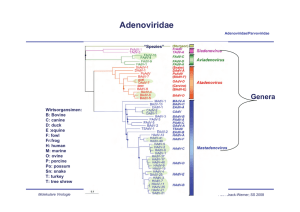
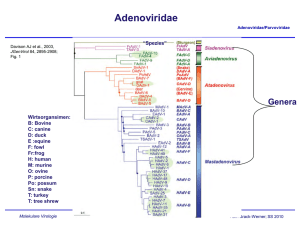
Adenoviridae Adenoviridae/Parvoviridae Davison AJ et al., 2003, JGenVirol 84, 2895-2908; Fig. 1 “Spezies” Genera Wirtsorgansimen: B: Bovine C: canine D: duck E :equine F: fowl Fr:frog H: human M: murine O: ovine P: porcine Po: possum Sn: snake T: turkey T: tree shrew Molekulare Virologie Ruth Brack-Werner; SS 2011 Adenovirus Merkmale Adenoviridae/Parvoviridae Partikel: Keine Behüllung; Ikosaeder. Genom: ds DNA: linear (36-48 kbp); umgekehrt sich wiederholende Sequenzen an beiden Enden; 5’Enden verknüpft mit viralen Proteinen; Genom-Replikation: Semikonservative DNA Replikation; virale DNA Polymerase; Keine Okazaki Fragmente; Protein wirkt als Primer; Molekulare Virologie Ruth Brack-Werner; SS 2011 Adenovirus Adenoviridae/Parvoviridae RNA Splicing wurde erstmalig von P.A. Sharp und R.J. Roberts 1977 beschrieben; Nobel-Preis: 1993. Aus Fields Virology 4th edition, 2002, Chapter 67, Lippincott, Williams and Wilkins, 2002 Fig. 67-4 Molekulare Virologie Ruth Brack-Werner; SS 2011 Struktur von Adenoviren Adenoviridae/Parvoviridae Hexonprotein Coreprotein Pentonbasisprotein VII Coreprotein Fiberprotein √ http://pathmicro.med.sc.edu/mhunt/adeno-diag.jpg Durchmesser ca. 80-110 nm; unbehüllt http://www.accessexcellence.org/RC/VL/GG/images/adenovirus. gi Molekulare Virologie Ikosaedrische Struktur 20 Flächen, 12 Ecken; 252 Capsomere: 240 Hexone; 12 Pentone 12 Fiber Ruth Brack-Werner; SS 2011 Adenovirus Genom-Struktur Adenoviridae/Parvoviridae “Quasi-zirkuläre” Struktur der ds DNA durch Interaktion der 5’ verknüpften terminalen Proteine “Pfannen-Stiel” Struktur vermittelt durch Basenpaarung an beiden Enden (umgekehrte sich wiederholende Sequenzen) Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Abb. 19.19. Molekulare Virologie Ruth Brack-Werner; SS 2011 Adenovirusgenom: Leserahmen Adenoviridae/Parvoviridae Davison AJ et al., 2003, JGenVirol 84, 2895-2908; Fig. 1 Molekulare Virologie Ruth Brack-Werner; SS 2011 Adenovirus: Genom und Transkripte Adenoviridae/Parvoviridae Aus Fields Virology 4th edition, 2002, Chapter 67, Lippincott, Williams and Wilkins, 2002 Fig. 67-3 Molekulare Virologie Ruth Brack-Werner; SS 2011 Sehr frühe (immediate early) virale Proteine Adenoviridae/Parvoviridae Transkriptionseinheit/ Protein Modifikation/ Grösse (kD) Funktionen Zelluläre Interaktionspartn er (Bsp) E1A Phosphoryliert 40 Trans-Aktivator der Transkription früher viraler Gene (E2.E3.E4) und zelluläre Gene; Immortalisierung; Transformation (gemeinsam mit E1B) TFIID (=TBP); andere TFs Phosphoryliert 26 Trans-Repressor; Immortalisation, Transformation Rb105; Phosphoryliert 55 Transformation zusammen mit E1A; Fördert Export von viralen mRNAs für Translation von späten Proteinen vom Zellkern zum Zytoplasma (zusammen mit E4/34 kD) p53 Phosphoryliert 20 Aktiv bei DNA Synthese; vermindert zytopathogene Effekte E1B Molekulare Virologie Rb105; Ruth Brack-Werner; SS 2011 Frühe (Early) virale Proteine (I) Adenoviridae/Parvoviridae Transkriptionseinheit Modifikation/Grösse (kD) Funktionen E2 E2A: Phosphoryliert 72 Aktiv bei DNA Replikation; bindet Einzelstrang DNA E2 E2B: 80 Vorläufer des Terminalen Proteins; Kovalent am 5’-Ende der viralen DNA gebunden; “Priming” bei der Initiation der DNA Synthese; E2 140 DNA Polymerase. Molekulare Virologie Ruth Brack-Werner; SS 2011 Adenovirus-Genomreplikation (I) Adenoviridae/Parvoviridae Veresterung von Serin im TP (80kD Vorläuferform) mit dCMP Rest WW von TP-80kDa mit kovalent an 5’Ende des Genoms gebundenem TP55kDa. Bildung des Initiationskomplexes; Cytosin an TP-80 kDa hybridisiert mit Guanin ; Verdrängung des an TP-55 kDa gebundenen Strangs; der verdrängte Strang komplexiert mit E2A; Synthese des neuen Strangs. Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Abb. 19.21a. Molekulare Virologie Ruth Brack-Werner; SS 2011 Adenovirus-Genomreplikation (II) Adenoviridae/Parvoviridae Elongation; DS mit einem neuen Strang Mit E2A komplexierter Einzelstrang (Elternstrang) Synthese des zweiten Strangs Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 19l, Abb. 19.21b. Molekulare Virologie Ruth Brack-Werner; SS 2011 Frühe (Early) virale Proteine (II) Adenoviridae/Parvoviridae Transkriptionseinhei t/Protein Modifikation/Grösse (kD) Funktionen E3 34 “Akzessorische Proteine”; Fördern persistente Infektion; E3 Glykosyliert 19 Verringerung der Anzahl MCH-I Moleküle auf der Zelloberfläche; E3 14,7 Reduziert die Empfindlichkeit für Zellyse durch TNFα. E3 10,4 Wirkt als Mitogen: Interagiert mit EGF Rezeptor und fördert Proliferation der Zelle; Molekulare Virologie Ruth Brack-Werner; SS 2011 Frühe (Early) virale Proteine (II) Adenoviridae/Parvoviridae Transkriptionseinheit Modifikation/Grösse (kD) Funktionen E4 34 Fördert Export von viralen mRNAs für Translation von späten Proteinen vom Zellkern zum Zytoplasma (zusammen mit E1B/55 kD); Hemmt Export der zellulären mRNAs (host cell shutoff) E4 17 Interaktion und Aktivierung von E2F; E4 14 Proteinkinase; Phosphorylierung von zellulären (z.B. AP-1) und viralen (E1A) Proteinen; E4 10 Bindung an Kernmatrix. Molekulare Virologie Ruth Brack-Werner; SS 2011 1-4: Kontakt mit Rezeptor auf der Zelloberfläche (z.B. CAR = Coxsackie Adenovirus Receptor) sowie mit KoRezeptor (Integrine); Endozytose des Virus; Transport von Proteinassoziierter DNA in den Zellkern über Mikrotubuli; 5-8: Expression, Synthese und KerinImport von E1A; 9-14: Induktion der Synthese von Proteinen für Genomreplikation; Replikation des Genoms 15-18: Expression, Synthese und Kernimport von Strukturproteinen 19-21: Zusammenbau von Kapsiden; Proteaseabhängige Reifung der Virione; Freisetzung der Viruspartikel nach Zerstörung der Zelle. Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR, Skalka AM, 2nd edition. ASM Press. Appendix, Fig. 2. Adenovirus-assoziierte Krankheiten: Übertragung und Symptome Adenoviridae/Parvoviridae Übertragung: über Aerosole, kontaminierte Gegenstände, Flüssigkeiten (Schwimmbad!) Symptome • Ca. 50% der Infektionen asymptomatisch; • Hauptsächlich Erkrankungen der Atemwege: Erkältung, Bronchitis, Pneumonie • Fieber; • Gastroenteritis; • Bindehautentzündung; Molekulare Virologie Ruth Brack-Werner; SS 2011 Adenovirus-assoziierte Krankheiten Adenoviridae/Parvoviridae Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Lectures/engler102405.pdf Ruth Brack-Werner; SS 2011 Humane Adenoviren: Serotypen Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Adenoviridae/Parvoviridae Lectures/engler102405.pdf Ruth Brack-Werner; SS 2011 Übertragungswege von Adenoviren Adenoviridae/Parvoviridae Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Lectures/engler102405.pdf Ruth Brack-Werner; SS 2011 Verlauf der Adenovirus Infektion Adenoviridae/Parvoviridae Molekulare Virologie Engler, 2005 www.microbio.uab.edu/Dental-Opt/ Lectures/engler102405.pdf Ruth Brack-Werner; SS 2011 Adenoviren: Zusammenfassung Adenoviridae/Parvoviridae 1. 2. Viruspartikel: 1. unbehüllt; 2. enthalten lineare doppelsträngige DNA Moleküle (30-36 kbp) Virale Proteine: 1. ≥ 9 Strukturproteine; 2. Mehrere Proteine für die Regulation der viralen Expression (transkriptionell und post-transkriptionell); transformierende Proteine; DNA Polymerase; Terminales Protein mit dem 5’ Ende der viralen DNA verknüpft, dient als Primer für die Replikation der DNA. 3. Virale Expression 1. Mehrere Promoteren 2. Mehrere mRNAs; Bildung durch alternatives Splicing (Entdeckung an Adenovirus) 4. Human-pathogene Vertreter verursachen, Bindehautentzündung, Erkältungen, Magen/Darm Störungen Molekulare Virologie Ruth Brack-Werner; SS 2011 Parvoviridae Adenoviridae/Parvoviridae Mensch Mensch http://www.tulane.edu/~dmsander/WWW/335/Parvoviruses.html Molekulare Virologie Ruth Brack-Werner; SS 2011 Parvoviridae Adenoviridae/Parvoviridae Dependoviruspartikel: Ca. 20 nm Durchmesser Adenoviruspartikel: Ca. 90 nm Durchmesser http://www.tulane.edu/~dmsander/WWW/335/Parvoviruses.html Molekulare Virologie Ruth Brack-Werner; SS 2011 Parvoviridae: Genom Adenoviridae/Parvoviridae Lineare einzelsträngige DNA; 4860 Basen (AAV-2) bis 5600 Basen (Parvovirus B19); Palindromische Sequenzabschnitte an beiden Enden: Ermöglichen die Bildung von Haarnadelförmige Strukturen an beiden Enden bzw. die Faltung des Genoms in eine Pfannenstielstruktur; http://www.tulane.edu/~dmsander/WWW/335/Parvoviruses.html Molekulare Virologie Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 20.1, Abb. 20.2. Ruth Brack-Werner; SS 2011 AAV Gene Adenoviridae/Parvoviridae 2 ORFs: 6 mRNA Spezies (3 verschiedene Promotoren; Alternative splice sites) http://hvd.ens-lyon.fr/human_virology_dpt/teams/gs_aav/pr_aav/fp_aav Molekulare Virologie Ruth Brack-Werner; SS 2011 Parvovirusproteine Adenoviridae/Parvoviridae Proteine Grösse (kD) B19 AAV-2 VP1 VP2 VP3 83 58 NS1 Rep78 71 NS2 Rep68 11 Rep52,Rep40 - Funktionen 87 62 73 Kapsidproteine 78 Helikase, ATP-ase, Endonuklease, Transaktivator; Helikase, Endonuklease, Transaktivator, Tumorsuppressor, Genomintegration 68 ? Helikase, Endonuklease, Transaktivator, Tumorsuppressor*, Genomintegration 52, 40 Im Zytoplasma; Helikase; Verpackung der DNA *Fördert Apoptose; Stabilisiert RB105/E2F Komplexe Molekulare Virologie Ruth Brack-Werner; SS 2011 Parvovirus: Genomreplikation (Modell) Adenoviridae/Parvoviridae Auffaltung durch Helikaseaktivität von NS1/Rep78 Trs: terminal resolution site; Erkennungssequenz für Spaltung durch NS1/Rep 78 Endonuklease Aus”Molekulare Virologie”, Modrow, Falk, Truyen, 2.Auflage, 2003, Spektrum Akademischer Verlag, Kap. 20.1, Abb. 20.2. Molekulare Virologie Ruth Brack-Werner; SS 2011 AAV: Latente Phase Adenoviridae/Parvoviridae 1.-3. Eintritt des Virus; Einzelstrang Genom in d. Zellkern; 4. Synthese von Doppelstrang DNA; 5. Transkription am P5 Promoter; 6. Synthese von Rep 78; 7. Rep78 UNTERDRÜCKT die weiteren Promotoren; 8. Rep 78 fördert die Integration von mehreren Virus-Genomkopien in 19q13.3qter; Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR, Skalka AM, 2nd edition. ASM Press. Appendix, Fig. 11. Molekulare Virologie Ruth Brack-Werner; SS 2011 AAV: Produktive Replikation Adenoviridae/Parvoviridae 9. Infektion m. Adenovirus (= Helfervirus); 10. Synthese der Adenovirus “early” Genprodukte, die für die AAV Replikation nötig sind; (E1a, E1b, E2a, E4) 11. “Rescue” des AAV-Genoms; 12. E1A aktiviert den P5 Promoter und die Synthese von Rep78; 13. Rep 78 aktiviert die anderen Promotoren und die Synthese der weiteren Proteine; 14. Replikation der AAV-DNA; 17. Kapsidproteine werden in den Zellkern transportiert und assoziieren dort miteinander; 18. Verpackung der einzelsträngigen DNA in das Kapsid; 19. Zusammenbau des Partikels. Molekulare Virologie Ruth Brack-Werner; SS 2011 Principles of Virology, 2004. Flint SJ, Enquist LW, Racaniello VR, Pathogenität von Parvovirus B19 für Menschen Adenoviridae/Parvoviridae Übertragung: Virus wird über Speichel ausgeschieden; Übertragung durch Tröpfcheninfektion oder kontaminierte Blutkonserven; Verursacht Ringelröteln; Bei infektion von Schwangeren kann es zur schweren Schädigung des Fötus kommen; Symptome: Fieber, Gliederschmerzen, Ausschlag; bei Erwachsenen Entzündung der Gelenke; Vermehrt sich in erythroide Vorläuferzellen; Molekulare Virologie Ruth Brack-Werner; SS 2011 Pathogenität von Parvovirus B19 für Menschen Adenoviridae/Parvoviridae http://www.stanford.edu/group/virus/parvo/2005/B19.html Molekulare Virologie Ruth Brack-Werner; SS 2011 Parvoviren: Zusammenfassung Adenoviridae/Parvoviridae 1. 2. Viruspartikel: 1. unbehüllt; 2. enthalten lineare einzelsträngige DNA Molek. (4,8 – 5,6 kb) Virale Proteine: 1. 2 Strukturproteine 2. Mehrere Nichtstrukturproteine: Funktionen bei der Regulation der viralen Expression (Transkription) und DNA Replikation 3. 4. Expression 1. 1 bis 3 Promotoren 2. Mehrere mRNAs; Bildung durch alternatives Splicing 3. 2 Leseraster Besonderheiten: Dependoviren können nur in Adenovirus-infizierten Zellen replizieren; AAV: Integration am spez. Lokus für Latenz 5. Human-Pathogene Vertreter: Parvovirus B19 (Erythrovirus) verursacht Molekulare Virologie Ringelröteln Ruth Brack-Werner; SS 2011