Charakterisierung von Säuren
Werbung

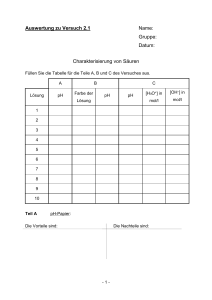
Auswertung zu Versuch 2.1 Name: Gruppe: Datum: Charakterisierung von Säuren Füllen Sie die Tabelle für die Teile A, B und C des Versuches aus. A Lösung pH B Farbe der C pH Lösung pH [H3O+] in [OH–] in mol/l mol/l 1 2 3 4 5 6 7 8 9 10 Teil A pH-Papier: Die Vorteile sind: Die Nachteile sind: -1- Teil B Universalindikator: Die Vorteile sind: Teil C Die Nachteile sind: pH-Meter Die Vorteile sind: Die Nachteile sind: Vergleichen Sie die Vorteile und Nachteile bei der Verwendung von pH-Papier, Universalindikator oder pH-Meter. Berücksichtigen sie dabei die unterschiedlichen Prinzipien der Messmethoden. Visum Assistent/in: -2- Auswertung zu Versuch 2.2 Name: Gruppe: Datum: Massanalyse Bestimmung der Konzentration einer Salzsäure Vergleich von pH-Meter und Indikator 1. Anfertigung einer 0.1 molaren KOH Einwaage KOH: Zeichnen Sie auf Millimeterpapier die Titrationskurve, die mit Hilfe des pH-Meters ermittelt wurde und ermitteln Sie die genaue Konzentration Ihrer KOH-Lösung. Die mit dem pH-Meter ermittelten Äquivalenzpunkte liegen bei: 1. ml 0.1 M HCl 2. ml 0.1 M HCl 3. ml 0.1 M HCl Daraus ergibt sich eine Konzentration von: 1. M 2. M 3. M Mit dem Mittelwert von ± M Allg. Formel zur Berechnung des Titerfaktors: Der Faktor des Titers beträgt: Notieren Sie den ermittelten Korrekturfaktor auf dem Etikett Ihrer etwa 0.1 M KOH. -1- 2. Titrieren Sie nun Ihre HCl-Lösung. Zeichnen Sie auf Millimeterpapier die Titrationskurven, die mit Hilfe des pH-Meters ermittelt wurden. Die drei graphisch ermittelten Äquivalenzpunkte liegen bei: 1. pH = und ml 0.1 M KOH 2. pH = und ml 0.1 M KOH 3. pH = und ml 0.1 M KOH Formel zur Berechnung der Konzentration: Daraus ergibt sich eine Konzentration der HCl-Lösung: 1. M 2. M 3. M Mit dem Mittelwert von ± M Formel zur Berechnung der Masse der ausgegebenen HCl: Die Menge HCl in dem 100 ml Masskolben ist ± g Die mit Indikator Phenolphthalein ermittelten Äquivalenzpunkte liegen bei: 1. ml 0.1 M KOH 2. ml 0.1 M KOH 3. ml 0.1 M KOH Daraus ergibt sich eine Konzentration von: 1. M 2. M 3. M Mit dem Mittelwert von ± -2- M Schätzen Sie den pKS-Wert von Phenolphthalein: Die drei Äquivalenzpunkte, die mit dem Indikator Methylrot ermittelt wurden, liegen bei: 1. ml 0.1 M KOH 2. ml 0.1 M KOH 3. ml 0.1 M KOH Daraus ergibt sich eine Konzentration der HCl-Lösung: 1. M 2. M 3. M Mit dem Mittelwert von ± Die Menge HCl in dem 100 ml Masskolben ist M ± g Vergleichen Sie die Ergebnisse und kommentieren Sie diese. Visum Assistent/in: -3- Auswertung zu Versuch 2.3 Name: Gruppe: Datum: Titration einer schwachen Säure mit einer starken Base: Bestimmung der Säurekonzentration von Essigsäure Berechnen Sie den pH-Wert einer 0.04 M Kaliumacetat-Lösung: Formel: pH = Zeichnen Sie die Titrationskurve, die im Versuch gemessen wurde, auf Millimeterpapier und bestimmen Sie graphisch den Äquivalenzpunkt. Er liegt bei: pH = und ml 0.1 M KOH Der Faktor des Titers beträgt: Die drei Äquivalenzpunkte, die mit dem Indikator ermittelt wurden, liegen bei 1. ml 0.1 M KOH 2. ml 0.1 M KOH 3. ml 0.1 M KOH Die Konzentration der Essigsäure beträgt: Formel: 1. M 2. M 3. M Mit dem Mittelwert von ± M Begründen Sie die Wahl des Indikators: Visum Assistent/in: -1- Auswertung zu Versuch 2.4 Name: Gruppe: Datum: Identifizierung einer unbekannten organischen Säure Teil B Titration Zeichnen Sie die Titrationskurve auf Millimeterpapier und bestimmen Sie graphisch den Äquivalenzpunkt und den pKS-Wert (Pufferpunkt): pKS Ep Der Faktor des Titers beträgt: Füllen Sie nachfolgende Tabelle aus: Einwaage der Säure [g] ml 0.1 M KOH bis zum Äquivalenzmasse EM Sprung [g/mol] Die Äquivalenzmasse der umkristallisierten Säure beträgt: ± g/Mol -1- Teil C Schmelzpunktbestimmung Geben Sie folgende Werte für den Schmelzpunkt an: Erstes Auftreten von Flüssigkeitströpfchen bei Die gesamte Probe ist flüssig bei °C °C Äquivalenzmasse Smp. pK-Wert unbekannte Säure theoretische Werte Bitte notieren Sie die Standardabweichung! Es handelt sich folglich um: Zeichnen Sie die Strukturformeln aller möglichen Säuren: Visum Assistent/in: -2- Auswertung zu Versuch 2.5 Name: Gruppe: Datum: Puffervermögen Teil A Berechnung der relevanten Konzentrationen Zeigen Sie den allgemeinen Rechenweg für diese Pufferlösungen auf: Füllen Sie die nachstehende Tabelle aus. Puffer pH pKS HOAc/OAc– H2PO4–/HPO42– Htris+/tris -1- [HA] [A–] Teil B Herstellung der Lösungen Aus den unter A berechneten Konzentrationen ergeben sich folgende Einwaagen: Acetatpuffer aus NaOAc.3 H2O und HCl: Molmasse [g/mol] Stoffmenge in mol bzw. Einwaage [g] bzw. Volumen für 100 ml (auf 100 ml) Konzentration [M] Lösung NaOAc.3 H2O HCl Phosphatpuffer aus Na2HPO4.12 H2O und NaH2PO4.2 H2O: Stoffmenge in mol Einwaage [g] für (auf 100 ml) 100 ml Lösung Stoffmenge in mol (auf 100 ml) Einwaage [g] bzw. benötigtes Volumen für 100 ml Lösung Molmasse [g/mol] Na2HPO4.12 H2O NaH2PO4.2 H2O Trispuffer aus tris und HCl: Molmasse [g/mol] bzw. Konzentration [M] tris HCl Teil D und E Titration Zeichnen Sie die Titrationskurven auf Millimeterpapier. Es sollen jeweils die Kurven der sauren und der basischen Titration eines Puffersystems in den gleichen Graphen gezeichnet werden. Die Faktoren der beiden Titer betragen: 0.01 M HCl: 0.01 M KOH: -2- Berechnen Sie die Zugabe an 0.01 M Säure bzw. Base, so dass sich der pH-Wert um eine Einheit ändert. Geben Sie den Rechenweg auf einem Beiblatt (Rückseite) ab. Vergleichen Sie die Resultate mit den experimentell erhaltenen Werten: Berechnete Menge Experimentell ermittelte (ml) an Menge (ml) an 0.01 M 0.01 M 0.01 M 0.01 M HCl KOH HCl KOH Theoretischen Werte mit realer Titerkonzentration HOAc/ OAc– H2PO4/ HPO42– Htris+/ tris Visum Assistent/in: -3- Auswertung zu Versuch 3.1 Name: Gruppe: Datum: Argentometrische Chloridanalyse (Klarpunktstitration, Titration nach Mohr, potenziometrische Titration) Teil A Klarpunktstitration Für ml der 0.1 M AgNO3-Lösung wurden wogen. Die Lösung ist exakt Einwaage von Anzahl Mol KI KI [g] Teil B g AgNO3 einge- M. theoretischer tatsächlicher Verbrauch an Verbrauch an AgNO3 [ml] AgNO3 [ml] Abweichung in % Titration nach Mohr Die 0.1 M AgNO3-Lösung ist exakt M. Der ermittelte Blindwert beträgt ml AgNO3-Lösung. In der Tabelle sollen die korrigierten Werte für den Verbrauch an AgNO3-Lösung eingesetzt werden. Nr. Einwaage des Verbrauch an unbek. Salzes [g] AgNO3 [ml] 1. 2. 3. Daraus ergibt sich ein Mittelwert mit Streuung von: EM = ± -4- g/mol Äquivalenzmasse Die Molmassen der möglichen Salze betragen: Mr(NaCl) = Mr(NaBr) = Mr(KCl) = Mr(KBr) = Mr(NH4Cl) = Beim unbekannten Salz handelt es sich um Teil C Potenziometrische Titration Kalibrierung: Wie lautet die Nernst-Gleichung für die Titration? Verwende s und pAg, wobei s= RT ln10 F pAg = -log[Ag+] und Füllen Sie untenstehende Tabelle aus, wobei die Konzentrationsänderung bei der Bestimmung von [Ag+] berücksichtigt werden soll. V [ml] Mole Ag+ [Ag+] pAg ΔE [mV] 100 101 102 104 109 110 112 117 Erstellen Sie ein Diagramm E vs. pAg. Aus dem Achsenabschnitt kann nun E0’ bestimmt werden. E0‘ = -5- E0(Ag/Ag+) = Aus der Steigung soll der experimentelle Wert für s ermittelt werden: s= Potentiometrische Titration: Zeichnen Sie die Titrationskurve. Füllen Sie nachstehende Tabelle aus: ml KCl V [ml] 0.0 100.0 0.2 100.2 0.4 100.4 0.6 100.6 0.8 100.8 ΔE [mV] pAg [Ag+] Es können nun [Cl–] und KL berechnet werden. Welchen Teil der Kurve verwenden Sie dazu? Begründen Sie die Wahl! -6- Ergänzen Sie die untenstehenden Bilanzgleichungen [Ag]0 = [Cl–]zg = Daraus folgt [Cl–] = KL = [Ag+][Cl–] = ml KCl [Cl–]zg [Ag+]0 [Ag+] (Volumenänderung!) Der Mittelwert beträgt: 2 KL = M Vergleichen Sie mit Literaturwerten: Was sind mögliche Fehlerquellen? -7- [Cl–] KL Vergleichen Sie die drei Methoden der quantitativen Chloridanalyse miteinander (Einfachheit, Genauigkeit): Visum Assistent/in: -8- Auswertung zu Versuch 3.2 Name: Gruppe: Datum: Gravimetrische Bestimmung des Nickelgehaltes Warum ist es vorteilhaft, wenn bei der Gravimetrie der gebildete Festkörper eine möglichst grosse Molmasse hat? Die 1%-ige Dimethylglyoxim-Lösung wurde folgendermassen hergestellt: Gravimetrisch wurde folgendes Ergebnis erhalten: Tiegel leer [g] Tiegel mit Masse an Ni(Hdmg)2 Ni(Hdmg)2 in g Stoffmenge Ni(Hdmg)2 in mol g Ni2+ in 50 ml Dies ergibt einen Mittelwert mit Streuung von ± g/50ml Wie kann man allgemein prüfen, ob die beabsichtigte Fällung eines Bestandteiles einer Lösung vollständig ist? -1- Wie kann man prüfen, ob die Trocknung eines Niederschlages beendet ist? Begründen Sie die Fehler, die entstehen, wenn ungenügend abgekühlte Tiegel für Wägungen benutzt werden. Visum Assistent/in: -2- Auswertung zu Versuch 4.1 Name: Gruppe: Datum: Batterie Erklären Sie den Aufbau einer galvanischen Zelle. Stellen Sie die Redoxgleichungen auf. Berechnen Sie die Spannung der Zelle und vergleichen Sie das Ergebnis mit der Messung. Visum Assistent/in: -1- Auswertung zu Versuch 4.2 Name: Gruppe: Datum: Synthese und Charakterisierung zweier Kobaltkomplexe Teil 1 Synthese der Komplexe Tragen Sie unten ein, wie viel von den einzelnen Edukten eingewogen wurde. Wie viel Mol entspricht das? Synthese von A: CoCl2.6 H2O: g mol g mol Synthese von B: CoCl2.6 H2O: Beschreiben Sie die Produkte nach Aussehen (Pulver, Kristalle, ...) und Farbe. Wie viel Gramm Produkt wurde jeweils erhalten? Produkt A: Produkt B: Welches sind die wesentlichen Unterschiede der beiden Synthesen? -1- Versuchen Sie Reaktionsgleichungen für alle Teilreaktionen aufzustellen. Hinweis: bei beiden Synthesen wird aus CoCl2 ein Kobalt(III)-aminkomplex gebildet. Teil 2 Iodometrische Kobaltanalyse Formulieren Sie die Reaktionsgleichungen sämtlicher Arbeitsschritte: Aufschluss: Oxidation von I– durch den Luftsauerstoff: Was passiert bei der Zugabe von 2 M HCl? Reduktion von Co3+ mit I–: Titration von I2 bzw. I3– mit Thiosulfat: -2- Wie lautet die Bruttogleichung für die Titration: Wie wurde die 0.01 M Thiosulfatlösung hergestellt: Berechnen Sie, wie viel Massenprozent Co in den Verbindungen A und B enthalten sind. Komplex Einwaage ml 0.01 M g Co in der Massenprozent [g] Thiosulfatlösung Titrationslösung Co in A bzw. B A B Geben Sie die Ergebnisse an und diskutieren Sie das Resultat. Die Mittelwerte mit Streuung betragen: Komplex A: Massenprozent Co: ± % mol Co Komplex B: Massenprozent Co: ± % mol Co Muss Kaliumiodid für die Titration genau eingewogen werden? (kurze Begründung) -3- Warum ist es vorteilhaft, Iodid als Reduktionsmittel einzusetzen und nicht Co3+ direkt mit Thiosulfat zu titrieren? Teil 3 Bestimmung des Ammoniakgehaltes Stellen Sie die Reaktionsgleichungen für die Zersetzung des Komplexes, die Reaktion von Ammoniak mit Borsäure und die Titration auf: Berechnen Sie die Massenprozente Stickstoff in den Verbindung A und B: Komplex Einwaage ml 0.1 M [g] HCl g NH3 in der N in der Massenpro- Titrations- Titrations- zent Stickstoff lösung lösung in A bzw. B A B Komplex A: Massenprozent N: % mol N Komplex B: Massenprozent N: % mol N Schätzen Sie die Genauigkeit Ihrer Analyse ein. Wie erhöhen Sie bei quantitativen analytischen Bestimmungen die Genauigkeit der Messung, und wie geben Sie einen Hinweis auf die Qualität ihrer Ergebnisse an? -4- Das Molverhältnis (nicht das Verhältnis der Prozentzahlen) für beide Komplexe beträgt: Komplex A: N : Co = Komplex B: N : Co = Versuchen Sie eine vernünftige Formel der Art Cox(NH3)y(Rest)z für beide Komplexe aufzustellen: Komplex A: Komplex B: Teil 4 Bestimmung des Halogenidgehaltes Leitfähigkeitsmessungen S. Die Leitfähigkeit des dest. Wassers betrug Für die 0.001 M Lösungen der Verbindungen A und B wurden mg der Verbindung A auf ml mg der Verbindung B auf ml verdünnt. Berechnen Sie die molare Leitfähigkeit der Verbindungen: (Achten Sie auf die Einheiten!) Verbindung Konzentration c [M] Zellkonstante f (cm -1) gemessene Werte S) A B -5- molare spez. Leitfähigkeit Leitfähigkeit (S.cm-1) c (S.cm2.mol-1) Für die Vergleichsverbindungen wurden die nachstehenden Leitfähigkeiten erhalten: spez. Leitfähigkeit Verbindung NaCl CuCl2 CuSO4 Erklären Sie Unterschiede in den Resultaten. Was kann man für die Verbindungen A und B aus diesen Messungen schliessen? Konduktometrische Chloridanalyse Zeichnen Sie die Titrationskurve der konduktometrischen Chloridanalyse für beide Komplexe (Extrablatt). Für die 0.001 M Lösungen der Verbindungen A und B wurden mg der Verbindung A auf ml mg der Verbindung B auf ml verdünnt. Berechnen Sie die Anzahl Gewichtsprozente in den Verbindungen A und B Verbindung ml AgNO3 bis mol AgNO3 Schnittpunkt A B Was bewirkt der Einfluss des Löslichkeitsproduktes auf die Kurve? -6- Gew.% Cl Tragen Sie für die Verbindungen A und B die erhaltenen Gewichtsprozente unten ein. Berechnen Sie die gebrochenen stöchiometrischen Koeffizienten xi und stellen Sie diese ins Verhältnis. Verbindung Gew.% Co Gew.% N Gew. % Cl A xCo = xN = xCl = B xCo = xN = xCl = Aus den ganzzahligen stöchiometrischen Koeffizienten erhält man dann die folgenden Summenformeln: Verbindung A: Molmasse: g/mol Verbindung B: Molmasse_ g/mol Sind die erhaltenen Summenformeln sinnvoll? Begründen Sie die Antwort. Geben Sie Strukturvorschläge für beide Verbindungen an: -7- Mit den nun bekannten Summenformeln soll nun die molare Leitfähigkeit neu berechnet werden: Verbindung Konzentration c Zellkonstante f [M] spez. molare Leitfähigkeit Leitfähigkeit c A B Ebenfalls kann nun die Ausbeute der Synthesen berechnet werden: g CoCl2 eingesetzt moleingesetzt g Komplex erhalten molerhalten Verbindung A Verbindung B Visum Assistent/in: -8- Ausbeute (%) Auswertung zu Versuch 4.3 Name: Gruppe: Datum: Verschiedene Oxidationsstufen von Mangan Ergänzen Sie die fehlenden Reduktionspotentiale (E0/V): +7 +6 +5 +4 +3 +2 0 1.70 sauer 1.23 MnO4- 0.90 2.90 HMnO4- H3MnO4 0.95 MnO2 Mn3+ -1.18 Mn Mn2+ basisch 0.62 MnO4- 0.56 0.27 MnO42- MnO43- -0.25 MnO2 Mn2O3 Mn(OH)2 -1.56 Mn 0.34 Formulieren Sie sämtliche Halbzellenreaktionsgleichungen und die Bruttoreaktionsgleichungen, und bestimmen Sie die E0 bzw. EMK für alle ablaufenden Reaktionen. Ergänzen Sie dafür die untenstehenden Gleichungen. Beachten Sie das Milieu, in der die Reaktion abläuft! Denken Sie daran, dass E0 als Standard-Reduktionspotential definiert ist. a) OH– Ox Red MnO4– + 7 Mn O4– + OH– → E0 = → MnO42– → Mn O42– E0 = 6 Farbe: -1- EMK = b) Ox → E0 = Red → E0 = → EMK = MnO42– + H+ Farbe: Ox → Red → Mn2+ E0 = → Mn2+ + Cl2 EMK = E0 = Cl2 Farbe: Ox → E0 = Red → E0 = Mn2+ + OH– → Mn(OH)2 + O2 → EMK = Ox → E0 = Red → E0 = Mn(OH)2 Farbe: c) Mn2+ + PbO2 → EMK = Farbe: Welchen Einfluss hat der pH-Wert auf die Reaktionen? +IV +VI +VII Versuchen Sie zu erklären, warum nur Mn(2 vorliegt, von Mn , Mn und Mn jedoch aq) kein Aquaion vorliegt. Visum Assistent/in: -2- Auswertung zu Versuch 5.1 Name: Gruppe: Datum: Kupferkomplexe und Ligandenaustauschreaktionen Füllen Sie das beigelegte Flussdiagramm aus [Produkt und Farbe (in Klammern) eintragen]. Ergänzen Sie die nachstehenden Reaktionsgleichungen und tragen Sie die Standardreduktionspotentiale wo erforderlich ein. Die Oxidationszahl des Kupfers soll jeweils angegeben werden. H2O A 1. CuO + HClO4 B 2. Cu2+ + Cl– → 3. CuCl42– + H2O → 4. Cu2+ + NH3 → CuCl42– Vergleichen Sie hierzu die Synthesen der Kobaltamin-Komplexe (4.2) Frage: Warum wird anfangs NH4Cl zugegeben? 5. Cu2+ + OH– → Vergleichen Sie diese Reaktion mit dem Aufschluss der KobaltaminKomplexe! ΔT 6. Vergleichen Sie auch hier wieder mit Versuch 4.2 (Heizen beim Aufschluss)! C 7. [Cu(H2O)6](ClO4)2 [Cu(CH3CN)4]2+ → Ox. Cu(0) E0 = → Red. Cu2+ Cu(0) + CH3CN Cu2+ E0 = → Cu+ -1- EMK = 8. [Cu(CH3CN)4]+ + ClO4– 9. [Cu(CH3CN)4]+ + → I– → 10. [Cu(CH3CN)4]+ + OH– → 11. [Cu(CH3CN)4]+ + NH3 → [Cu(NH3)2]+ Ox. [Cu(NH3)2]+ E0 = Vergleichen Sie Reaktion B4. → Red. E0 = Bruttorkt. EMK = → 12. [Cu(CH3CN)4]ClO4 13. [Cu(CH3CN)4]ClO4 + [CuCl2]– Cl– → [CuCl2]– H2O Zeichnen Sie die Strukturformel der folgenden Verbindungen auf: Cu(aq)2+: [Cu(NH3)4]2+: [Cu(NH3)2]+: [Cu(CH3CN)4]+: Visum Assistent/in: -2- CuO (schwarz) Kupfer(I) Kupfer(II) A ( ) 1 Kristalle Lösung C B ( Kristalle 7 ) Lösung ( ) 4 ( ( ) ) 2 ( ) 5 8 ( 9 ( 12 ) ( 13 ) ) ( 10 ) ( 11 ) ( 3 ) ( 6 ) Auswertung zu Versuch 5.2 Name: Gruppe: Datum: Komplexchemie des Nickels Schreiben Sie ein ausführliches Protokoll zu diesem Versuch. Siehe Kapitel 1.3.3 - Formulieren Sie alle Reaktionsgleichungen. - Geben Sie die möglichen Strukturen für die synthetisierten Nickelkomplexe an. - Beschreiben Sie in chemischen Reaktionsgleichungen den Kreislauf des Ni2+. -1- Auswertung zu Versuch 5.3 Name: Gruppe: Datum: Komplexometrische Titration Bestimmung von Zink Formulieren Sie die Reaktionsgleichung unter der Annahme, dass das Metall am Anfang als Aquaion [Zn(H2O)6]2+ vorliegt und erklären Sie die verschiedenen Farbänderungen. Für die EDTA-Lösung wurden g Komplexon III eingewogen. Die Masslösung hat folglich eine Konzentration von M. Bestimmen Sie die Konzentration der ausgegebenen Lösung: Nr. ml EDTA-Lösung Konzentration der Konzentration in 100 ml Zn-Lsg. [M] mg/l Dies ergibt einen Mittelwert mit Streuung von: ± -1- mg/l Bestimmung des Kalziumgehaltes Formulieren Sie die Reaktionsgleichungen unter der Annahme, dass die freien Metallionen als Aquaion vorliegen und erklären Sie die verschiedenen Farbänderungen. Für die EDTA-Lösung wurden g Komplexon III eingewogen und auf 1000 ml verdünnt. Die Masslösung hat folglich eine Konzentration von M. Bestimmen Sie die Konzentration der ausgegebenen Lösung: Nr. ml EDTA-Lösung Konzentration der Konzentration in 100 ml Ca-Lsg. [M] mg/l Dies ergibt einen Mittelwert mit Streuung von: ± mg/l ± mmol/l Visum Assistent/in: -2- Auswertung zu Versuch 6.1 Name: Gruppe: Datum: Vorversuche zur Ermittlung der Kationen in einem Substanzgemisch Teil A Flammenfarben und Atomemission Es wurden folgende Flammenfarben beobachtet: Kation Farbe mit blossem Auge Spektrometer Li Na K Cs Ca Sr Ba Cu Gemisch Im Gemisch sind folglich nachstehende Kationen enthalten: -3- Kobaltglas Teil B Boraxperle Vervollständigen Sie die Tabelle mit ihren Beobachtungen. Oxidationsflamme Reduktionsflamme Cr Co Cu Mn Visum Assistent/in: -4- Auswertung zu Versuch 6.2 Name: Gruppe: Datum: Aufschluss unlöslicher Metallsalze Formulieren sie alle Reaktionsgleichungen und Beobachtungen und Ihre Ergebnisse. a) Soda–Pottasche Aufschluss, Nachweis von Ba b) Saurer Aufschluss, Nachweis Fe c) Oxidationsschmelze, Nachweis von Cr Visum / Assistent/in -1- Auswertung zu Versuch 6.3 Name: Gruppe: Datum: Anionenanalyse Vervollständigen Sie jeweils die Reaktionsgleichungen und notieren Sie Ihre Beobachtungen. Carbonat: CO32– + H+ CO2 + Ba(OH)2 + CO2 Beobachtungen: Acetat: CH3COO– + HSO4– Beobachtungen: Nachweis von Bor: Na2B4O7 + H2SO4 + H2O B(OH)3 + CH3OH Beobachtungen: Ammoniumionen: HCl NH4+ + OH– Beobachtungen: -1- NH4Cl Sulfat: SO42– + Ba2+ Beobachtungen: Oxalat: Ca2+ + (COO–)2 Aus welchem Grund wird diese Fällung vorgenommen? MnO4– + (COO–)2 + CO2 + Beobachtungen: Nitrat: Fe2+ + H+ + NO3– NO + [Fe(H2O)6]2+ + NO + Ursache der braunen Farbe: Beobachtungen: Nitrit: (Mit Strukturformeln der Reagenzien) -2- Beobachtungen: Was sind für Probleme aufgetreten? Wie hätten allfällige Störungen vermieden werden können? Visum Assistent/in: -3- Auswertung zu Versuch 6.4 Name: Gruppe: Datum: Vollständige qualitative Analyse eines einfachen Substanzgemisches Beschreiben Sie stichpunktartig die Durchführung Ihrer Analyse (schematisch, mit Ihren Beobachtungen, Extrablatt). Tragen Sie in die Tabelle die gefundenen Kationen und Anionen ein. Kationen Anionen Beantworten Sie im Protokoll die folgenden Fragen: - Formulieren Sie die Reaktionsgleichungen für alle Trennungsgänge und Nachweisreaktionen. - Begründen Sie anhand Ihrer Probe die Notwendigkeit des Sodaauszuges. - Sind bei der Analyse Störungen aufgetreten, wenn ja, wie hätte man sie vermeiden können. Visum Assistent/in: -4-