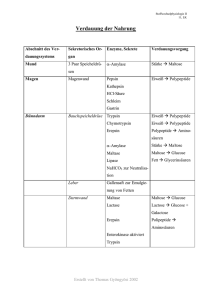
Charakterisierung der Verteilung lysosomaler Zystein
Werbung

Aus dem Institut für Pathologie an den Berufsgenossenschaftlichen Kliniken Bergmannsheil -Universitätsklinik der Ruhr-Universität Bochum Direktor: Prof. Dr. med. K. M. Müller ___________________________________ Charakterisierung der Verteilung lysosomaler Zystein- und Asparaginproteasen in der menschlichen Lunge und ihre Bedeutung bei der Prozessierung des Surfactant Proteins B Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Falkultät der Ruhr-Universität Bochum vorgelegt von Nadja Riemann aus Herford 2001 Dekan: Prof. Dr. med. G. Muhr Referent: Prof. Dr. med. K. M. Müller Koreferent: Prof. Dr. Albrecht Bofe Tag der mündlichen Prüfung: 17.12.2002 -3- Inhaltsverzeichnis INHALTSVERZEICHNIS Abkürzungen................................................................................ 6 1 Einleitung ................................................................................7 1.1 Kathepsine ......................................................................................... 7 1.2 Surfactant......................................................................................... 10 1.3 Fragestellung und Zielsetzung ......................................................... 11 2 Material und Methoden ........................................................12 2.1 Untersuchungsgut ............................................................................ 12 2.2 Untersuchungsmethoden ................................................................. 12 2.2.1 Konventionelle Histologie.............................................................. 12 2.2.2 Immunhistochemie ........................................................................ 12 2.2.3 Immunelektronenmikroskopische Untersuchung .......................... 16 2.2.4 Biochemische Untersuchung ........................................................ 17 3 Ergebnisse ............................................................................19 3.1 Ergebnisse der immunhistochemischen Untersuchung ................... 19 3.1.1 Verteilung der Zysteinproteasen B, K, L und S in der humanen Lunge..................................................................................................... 19 3.1.2 Nachweis von Kathepsin H in der humanen Lunge und seine Kolokalisation mit Surfactant Protein B ................................................. 21 3.1.3 Verteilung der Asparaginproteasen Kathepsin D und E in der humanen Lunge ..................................................................................... 23 3.1.4 Verteilung von Kathepsin E in den Clara-Zellen............................ 25 3.1.5 Verteilung der Asparaginprotease Napsin A in der humanen Lunge ............................................................................................................... 27 3.1.6 Verteilung von SP-B und seinen Vorstufen (NPROSP-B und CPROSP-B) in den Clara-Zellen............................................................ 29 4 Diskussion ............................................................................31 4.1 Kathepsin B...................................................................................... 32 4.1.1 Untersuchungsergebnis ................................................................ 32 4.1.2 Allgemeine Charakteristika ........................................................... 32 4.1.3 Aufbau........................................................................................... 32 -4- Inhaltsverzeichnis 4.1.4 Funktion ........................................................................................ 34 4.1.5 Die Bedeutung von Kathepsin B in der menschlichen Lunge........ 36 4.2 Kathepsin D ..................................................................................... 36 4.2.1 Untersuchungsergebnis ................................................................ 36 4.2.2 Allgemeine Charakteristika ........................................................... 37 4.2.3 Aufbau........................................................................................... 37 4.2.4 Funktion ........................................................................................ 38 4.2.5 Die Bedeutung von Kathepsin D in der menschlichen Lunge ....... 39 4.3 Kathepsin E...................................................................................... 39 4.3.1 Untersuchungsergebnis ................................................................ 39 4.3.2 Allgemeine Charakteristika ........................................................... 40 4.3.3 Aufbau........................................................................................... 40 4.3.4 Funktion ........................................................................................ 42 4.3.5 Die Bedeutung von Kathepsin E in der menschlichen Lunge........ 43 4.4 Kathepsin H ..................................................................................... 43 4.4.1 Untersuchungsergebnis ................................................................ 43 4.4.2 Allgemeine Charakteristika ........................................................... 44 4.4.3 Aufbau........................................................................................... 44 4.4.4 Funktion ........................................................................................ 45 4.4.5 Kathepsin H und die Prozessierung von SP-B.............................. 46 4.5 Kathepsin K (Synonym: Kathepsin O2) ............................................ 47 4.5.1 Untersuchungsergebnis ................................................................ 47 4.5.2 Allgemeine Charakteristika ........................................................... 47 4.5.3 Aufbau........................................................................................... 47 4.5.4 Funktion ........................................................................................ 48 4.5.5 Die Bedeutung von Kathepsin K in der menschlichen Lunge........ 50 4.6 Kathepsin L ...................................................................................... 50 4.6.1 Untersuchungsergebnis ................................................................ 50 4.6.2 Allgemeine Charakteristika ........................................................... 50 4.6.3 Aufbau........................................................................................... 51 4.6.4 Funktion ........................................................................................ 52 4.6.5 Die Bedeutung von Kathepsin L in der menschlichen Lunge ........ 53 4.7 Kathepsin S...................................................................................... 54 4.7.1 Untersuchungsergebnis ................................................................ 54 -5- Inhaltsverzeichnis 4.7.2 Allgemeine Charakteristika ........................................................... 54 4.7.3 Aufbau........................................................................................... 55 4.7.4 Funktion ........................................................................................ 56 4.7.5 Die Bedeutung von Kathepsin S in der menschlichen Lunge........ 56 4.8 Napsin A .......................................................................................... 57 4.8.1 Untersuchungsergebnis ................................................................ 57 4.8.2 Allgemeine Charakteristika ........................................................... 57 4.8.3 Aufbau........................................................................................... 57 4.8.4 Funktion ........................................................................................ 58 4.8.5 Napsin A und die Prozessierung von Surfactant Protein B ........... 59 4.9 Surfactant......................................................................................... 60 4.10 Surfactant Protein B ......................................................................... 61 4.10.1 Untersuchungsergebnis ............................................................. 61 4.10.2 Allgemeine Charakteristika ........................................................ 61 4.10.3 Aufbau........................................................................................ 61 4.10.4 Funktion ..................................................................................... 63 4.11 Die Bedeutung von Kathepsin H und Napsin A in der Prozessierung des Surfactant Proteins B ......................................................................... 65 4.12 Clara-Zellen ..................................................................................... 67 4.12.1 Allgemeine Charakteristika ........................................................ 67 4.12.2 Aufbau des „Clara-Cell specific“ Proteins CC10 ........................ 68 4.12.3 Funktion der Clara-Zellen........................................................... 69 4.13 Die Prozessierung des Surfactant Proteins B in den Clara-ZellGranula .................................................................................................. 70 5 Zusammenfassung...............................................................71 6 Literatur ................................................................................. 73 -6- AMP Adenosinmonophosphat ATP Adenosintriphosphat APAAP alkalische Phosphatase anti-alkalische Phosphatase AS Aminosäure BAL Broncho-Alveoläre-Lavage CRD carbohydrate recognition domain DNA Desoxyribonukleinsäure (-acid) DPPC Dipalmitoylphosphatidylcholin EDTA ethylene diamine tetraacetic acid = Äthylendiamintetraessigsäure EvG Elastica-van-Gieson HLA Human Leucocyte Antigen HE Hämatoxylin-Eosin HNF-3α Hepatozellulärer nukleärer Faktor-3α HIV human immunodeficiency virus INF Interferon LPS Lipopolysaccharid MHC major histocompatibility complex PAS Perjodsäure (-acid) Schiff PDGF Plättchen (-derived) wachstums (-growth) faktor RDS respiratory distress syndrom (Atemnotsyndrom) RNA Ribonukleinsäure (-acid) SP-A/B/C/D Surfactant Protein A/B/C/D TCA Trichloressigsäure (-acid) TNF Tumornekrosefaktor TGF transforming growth factor TTF Thyroidaler Transkriptionsfaktor Abkürzungen 1. Einleitung -7- 1 Einleitung 1.1 Kathepsine Die Kathepsine stellen eine Gruppe von lysosomalen Enzymen dar, die die proteolytische Prozessierung von Proteinen katalysieren. Eine Unterteilung der lysosomalen Enzyme in die Familie der Pepsin- und Papainproteasen ist aufgrund ihrer unterschiedlichen Aminosäuren im katalytischen Zentrum möglich. Barrett (1992) verdeutlichte diese Unterschiede in der folgenden Tabelle: Die Tabelle verdeutlicht die unterschiedliche Zugehörigkeit der Kathepsine zur Familie der Pepsin- und Papainproteasen in Abhängigkeit von den Aminiosäuren im katalytischen Zentrum. Tabelle 1: Darstellung der Enzyme sowie ihrer katalytischen Aktivität und Familienzugehörigkeit Enzyme Katalytische Aktivität Familie Kathepsin D Asparagin Pepsin Kathepsin B Zystein Papain Kathepsin H Zystein Papain Kathepsin L Zystein Papain Kathepsin S Zystein Papain Zu den Asparaginproteasen werden heute noch die Napsine und Kathepsin E, zu den Zysteinproteasen Kathepsin K gezählt (Fowler et al. 1995, Gelb et al. 1996, Schauer-Vukasinovic et al. 2000). Die Kathepsine zeigen einen ähnlichen Aufbau. Von der Zelle wird ein Präprokathepsin gebildet, das posttranslational in ein Prokathepsin und das mature Kathepsin prozessiert wird. Folgende Sequenzen konnten lokalisiert werden: 1. eine ca. 12-16 Aminosäuren lange Signalsequenz am NH2-terminalen Ende 2. eine sich daran anschließende ca. 100 Aminosäuren lange Proregion und 3. das mature Enzym mit dem COOH-terminalen Ende. Nach der Synthese an den membranassoziierten Ribosomen erfolgt der Transport des Präproproteins mit Hilfe der Signalsequenz in das endoplasmatische Retikulum, wo die Signalsequenz meist im Bereich der 1. Einleitung -8- Position Ala-X-Ala abgespalten wird. Das Proenzym gelangt dann in den Golgi-Apparat, wo den Kathepsinen auf der cis-Seite des Golgi-Komplexes Oligosaccharide in Form von Mannose-6-Phosphat angehängt werden, welche auf der trans-Seite des Golgi-Komplexes von dem M-6-P-Rezeptor erkannt und gebunden werden. Diese Rezeptoranbindung ermöglicht den Weitertransport zu den Lysosomen, in denen die maturen Kathepsine die Degradation ihrer Substrate vornehmen (Bohley et al. 1992, Bossard et al. 1996, von Heijne 1983). Die genauen Prozessierungsschritte und die möglicherweise beteiligten Enzyme, die zur Bildung des maturen Kathepsins führen, sind noch nicht bekannt. Einzig vom Kathepsin E weiß man, daß es teilweise über autokatalytische Prozesse aktiviert wird (Kageyama et al.1992). Als charakteristisches Merkmal findet man im katalytischen Zentrum der Familie der Pepsinproteasen Asparaginsäurereste und im katalytischen Zentrum der Familie der Papainproteasen Zysteinsäurereste (Barrett 1992). Der Abbau der Substrate durch die einzelnen Kathepsine dagegen erfolgt auf unterschiedliche Weise, so daß hierin kein familienspezifisches Merkmal besteht (Barrrett 1992). Das pH-Optimum für die meisten Enzyme der Familie der Pepsin- und Papainproteasen liegt im sauren Bereich. Basierend auf theoretischen Überlegungen in Bezug auf die Aminosäuresequenz der Zysteinproteasen liegt das pH-Optimum für diese Enzyme normalerweise im neutralen pHBereich. Hier hat also im Laufe der Jahre ein Adaptationsprozeß an das saure Milieu der Lysosomen stattgefunden (Barrett 1992). Eine weitere Unterscheidung der beiden Kathepsinfamilien ist auch in Bezug auf ihre Inhibition im katalytischen Zentrum möglich. Die Zysteinproteasen werden durch E-64 (irreversibel) und Kininogen, die Asparaginproteasen durch Pepstatin (reversibel) gehemmt. Bei neutralen und basischen pHWerten sind für beide Familien keine proteolytischen Aktivitäten mehr nachweisbar (Barrett 1992). Biochemisch sind die Kathepsine in nahezu allen Organen des humanen Organismus lokalisiert. Kathepsin E zum Beispiel findet sich in besonders hohen Konzentrationen in den Organen, die in die Degradation von Antigenen involviert sind (Langehanszellen der Haut, Milz, Tonsillen etc.) 1. Einleitung -9- (Solcia et al. 1993, Finzi et al. 1993). Kathepsin K zeigt dagegen besonders hohe Konzentrationen im Knochengewebe (Inaoka et al.1995). Die Kathepsine B, D und L lassen sich in fast allen Organen des menschlichen Organismus nachweisen, wohingegen Kathepsin S nur in wenigen Organen (Lunge, Leber, Milz) lokalisiert werden konnte (Joseph et al. 1988, Furuhashi et al. 1991, Bohley et al. 1992, Shi et al. 1994, Brömme et al. 1996). Napsin A, die bislang jüngste Asparaginprotease, konnte nur in der Lunge und in der Niere nachgewiesen werden (Schauer-Vukasinovic et al. 1999 und 2000). Es wird auch ein extrazelluläres von den Lysosomen unabhängiges Vorkommen diskutiert (Gabrijelcic et al. 1990). Matsuba et al. (1989) wiesen die Kathepsine B, H und L in den sekretorischen Granula der juxtaglomerulären Zellen der Rattenniere nach, was auf eine mögliche Mitbeteiligung an der Prozessierung von Renin aus seinen inaktiven Vorstufen hindeutet (Matsuba et al. 1989). Weiterhin zeigte sich, daß die Kathepsine unter anderem bei der Tumorinfiltration und Metastasierung, bei Entzündungsprozeßen, Demyelinisierungserkrankungen, Muskeldystrophien und bei der Destruktion von Knorpel- und Knochengewebe im Rahmen der Arthrose eine Rolle spielen (Turk et al. 1986). 1. Einleitung 1.2 - 10 - Surfactant Der Surfactant wird von den cuboiden Alveolarepithelzellen, den Typ-IIPneumozyten, synthetisiert und sezerniert. Die Abgabe aus diesen Zellen erfolgt über eine regulierte Sekretion. Im Alveolarraum verteilt sich der Surfactant wie ein Film gleichmäßig auf der Innenfläche der Alveolen. Seine Hauptaufgabe liegt in der Reduktion der Oberflächenspannung, um ein Kollabieren der Alveole am Ende der Expiration zu verhindern (Blümcke et al. 1995). Der von ihm gebildete Film dient ferner als „Schutzschicht“. Der Surfactant ist in der Lage, mit der Inspiration aufgenommenes Material wie Mikroorganismen und Proteine einzuhüllen und so den Alveolarmakrophagen besser zugänglich zu machen. Weiterhin fördert er den intrazellulären Abbau von Mikroorganismen (Blümcke et al. 1995). Der Surfactant besteht aus einem Lipid-Protein-Gemisch, dessen wichtigster Bestandteil das Dipalmitoylphosphatidylcholin (DPPC) darstellt. Im Surfactant sind weiterhin neutrale Lipide (Cholesterol) nachweisbar, deren genaue Bedeutung noch nicht bekannt ist (King et al. 1972, Haagsmann et al. 1991). Die Lipide des Surfactant werden von den Typ-II-Pneumozyten synthetisiert, in den Lamellenkörperchen gespeichert und aus diesen in den Alveolarraum freigesetzt. Weiterhin findet eine Wiederaufnahme der Lipide aus dem Alveolarraum in den Typ-II-Pneumozyten statt. Ein Teil der Lipide wird erneut in den Lammellenkörperchen gespeichert und auf entsprechende Reize wieder in die Alveole freigesetzt. Ein anderer Teil wird in den Typ-IIPneumozyten degradiert und seine Abbauprodukte teilweise zur de novo Synthese von Surfactant herangezogen (Wright et al. 1990). Als weitere Bestandteile des Surfactant konnten bisher die vier Surfactant assoziierten Proteine A, B, C und D nachgewiesen werden. Ihre Benennung in Form von SP-A, SP-B, SP-C und SP-D erfolgte in alphabetischer Reihenfolge abhängig vom Zeitpunkt ihrer Entdeckung (Possmayer et al. 1988). 1. Einleitung 1.3 - 11 - Fragestellung und Zielsetzung Ziel dieser Studie ist es, an Hand von immunhistochemischen, biochemischen und elektronenmikroskopischen Methoden die Verteilung der Zysteinproteasen B, H, K, L und S sowie der Asparaginproteasen D, E und Napsin A in der humanen Lunge und im Material der Broncho-AlveolärenLavage (BAL) zu charakterisieren. Weiterhin soll ermittelt werden, welche der Kathepsine aufgrund einer Kolokalisation mit dem Surfactant Protein B möglicherweise in die bislang ungeklärte proteolytische Prozessierung dieses Proteins involviert sind. Von Interesse sind hierbei folgende Fragestellungen: Zur Verteilung der Zystein- und Asparaginproteasen in der menschlichen Lunge (immunhistochemisch und immunelektronenmikroskopisch): - In welchen Zellen und Zellorganellen sind die Zysteinproteasen B, H, K, L und S sowie die Asparaginproteasen D, E und Napsin A in der menschlichen Lunge lokalisiert? Zur Kolokalisation der Zystein- und Asparaginproteasen mit dem Surfactant Protein B in der menschlichen Lunge (immunhistochemisch): - In welchen Zellen und Zellorganellen liegt eine Kolokalisation des Surfactant Proteins B mit einem oder mehreren Angehörigen der Zysteinund/oder Asparaginproteasen in der menschlichen Lunge vor? 2. Material und Methoden - 12 - 2 Material und Methoden 2.1 Untersuchungsgut Zur Untersuchung kamen acht humane Lungengewebsproben aus einem Kollektiv von Spenderlungen Verstorbener ohne Hinweis für wesentliche pulmonale Vorerkrankungen. Es handelt sich hierbei um Lungen, für die entweder über das Eurotransplant Foundation Center, Leiden, kein geeigneter Empfänger gefunden werden konnte oder die aus klinischen Gründen nicht der Transplantation zugeführt werden durften. Die Fixierung und Einbettung der eingesetzten Präparate erfolgte für die Immunhistochemie mit 4%igem gepufferten Formalin und Paraffin. Für die Immunelektronenmikroskopie wurde ein Gemisch aus 4%igem Paraformaldehyd und 0.5%igem Glutaraldehyd in 0.2M Hepes-Puffer eingesetzt. 2.2 Untersuchungsmethoden 2.2.1 Konventionelle Histologie Die Färbung der in Paraffin eingebetteten Gewebeschnitte erfolgte nach histologischen Standard-Protokollen. Zum Einsatz kamen die HE-Färbung (Hämatoxylin-Eosin, Übersichtsfärbung), die EvG-Färbung (Elastica-vanGieson) und die PAS-Färbung (Perjod-Säure-Schiff). 2.2.2 Immunhistochemie Bei den immunhistologischen Untersuchungen kamen polyklonale Antikörper gegen die Kathepsine B, D, E, H, K, L und S, Napsin A sowie das Surfactant Protein B und das Clara-Zell-spezifische Protein CC10 zum Einsatz. Bei den für die Kathepsine verwendeten Antikörpern handelt es sich um polyklonale Antikörper aus dem Kaninchen (Kathepsin D, H, K und S) und der Ziege (Kathepsin B, L und E). In Bezug auf das Surfactant Protein B wurden nicht nur Antikörper gegen die mature Form von SP-B verwendet, sondern auch gegen das N- und C- 2. Material und Methoden terminale Ende von - 13 - Surfactant-Protein-B-Vorstufen (NPROSP-B und CPROSP-B). Der nachstehenden Tabelle 2 können die entsprechenden Vorbehandlungen, Verdünnungen und die Bezugsquelle für die Kathepsine entnommen werden. Tabelle 2: Charakterisierung der verwendeten Antikörper (Kathepsine) Antikörper Art Verdünnung Bezugsquelle Vorbehandlung Kathepsin B Ziege 1:400 Dr. F. Bühling Keine Kathepsin D Polyklonal 1:500 Dr. F. Bühling MW und E Ziege N19 und 1:70 C20 1:60 Dr. F. Bühling Keine Kathepsin H Polyklonal 1:600 Dr. F. Bühling Keine Kathepsin K Polyklonal 1:300 Dr. F. Bühling MW Kathepsin L Ziege 1:1000 Dr. F. Bühling MW Kathepsin S Polyklonal 1:400 Dr. F. Bühling MW und E Kathepsin E MW: Mikrowelle E: Enzymatische Vorbehandlung Bei den Antikörpern für das Surfactant Protein B handelt es sich um polyklonale Antikörper aus dem Kaninchen. Der folgenden Tabelle 3 können die entsprechenden Vorbehandlungen, Verdünnungen sowie die Bezugsquelle entnommen werden. Tabelle 3: Charakterisierung der verwendeten Antikörper (Surfactant Proteine) Antikörper Art Verdünnung Bezugsquelle Vorbehandlung SP-B Polyklonal 1:3000 Fa. Chemicon Keine NPROSP-B Polyklonal 1:200 CPROSP-B Polyklonal 1:200 Prof. S. Hagwood Prof. S. Hagwood Keine Keine Die immunhistochemischen Schnitte wurden mit Hilfe der APAAP-Methode (alkalische Phosphatase anti-alkalische Phosphatase) und den 2. Material und Methoden - 14 - entsprechenden Antikörpern gefärbt, wobei die Schritte 1 bis 3 manuell und die Schritte 4 bis 9 automatisch mit Hilfe des Chem Mate 500 der Firma DAKO erfolgten. 1) 3-4 µm dicke Schnittpräparate des in Formalin fixierten und in Paraffin eigebetteten Gewebes wurden auf einen speziellen Kapillarspaltobjektträger der Firma DAKO aufgezogen. Anschließend wurden die Präparate über Nacht bei 37°C im Wärmeschrank getrocknet. 2) Die Schnittpräparate wurden in Xylol entparaffiniert und in einer absteigenden Alkoholreihe (100%, 96% und 70%) rehydriert. Anschließend wurden die Präparate für 10 Min. in Tris-Puffer (pH 7.2) gespült. 3) Die Vorbehandlung der Schnittpräparate erfolgt in Abhängigkeit des verwendeten Primärantikörpers: - Mikrowelle: Die Schnitte wurden in Puffer (Antigen Retrieval Buffer) entweder mit 10 mM Citratpuffer, pH 6.0 (Firma Quartett) oder in 1 mM EDTA, pH 8.0 für 15 Minuten bei 600 Watt in der Mikrowelle gekocht und anschließend für weitere 10 Minuten in warmem Puffer stehengelassen. - Enzymatische Vorbehandlung: Die Schnitte wurden mit Protease (Firma Sigma) 3.3 mg in 50 ml Tris-Puffer bei 37°C für 10 Minuten inkubiert. 4) Die Schnitte wurden mit den jeweiligen Primärantikörpern in der entsprechenden Verdünnung (siehe Tabelle 2 und 3) für 25 Minuten bei Raumtemperatur inkubiert. Die Antikörperverdünnung erfolgte mit Hilfe eines Diluents der Firma Zymed. Zwischen den einzelnen Inkubationen erfolgten Waschvorgänge mit Puffern aus einem Puffer-Kit der Firma DAKO (K5006). 2. Material und Methoden - 15 - 5) Zwischenbehandlung für die Kathepsine B, L und E Diese Kathepsine werden mit RAG- (rabbit-anti-goat) Antikörpern behandelt, um sie den weiteren Schritten der APAAP-Methode zugänglich zu machen. Der Antikörper wurde für die einzelnen Kathepsine in folgender Verdünnung eingesetzt. - Kathepsin B: 1:1000 - Kathepsin L: 1:1000 - Kathepsin E N19 und N20: 1:2000 6) Hieran schloß sich eine weitere 25minütige Inkubation mit MAR (mouseanti-rabbit)-Serum an, das mit dem Diluent 1:300 verdünnt wurde. 7) Es erfolgte eine erneute Spülung der Präparate und eine weitere Inkubation bei Raumtemperatur Sekundärantikörper = Link von (APAAP-Kit 25 Minuten K5000, mit Firma einem DAKO, gebrauchsfertig). Bei diesem Brückenantikörper handelt es sich um Kaninchen-Anti-Maus-Immunglobuline aller Isotope. 8) Nach erneuter Spülung erfolgte eine weitere Inkubation von 25 Minuten bei Raumtemperatur mit einem APAAP-Komplex (APAAP-Kit K5000, Firma DAKO, gebrauchsfertig). Der APAAP-Komplex besteht aus monoklonalen Maus-IgG1-Antikörpern, die spezifisch an die alkalische Phosphatase aus der Kälberdarmmukosa gebunden waren. 9) Zur Verstärkung der Reaktion erfolgte eine Wiederholung der Schritte 5 und 6 für jeweils 10 Minuten. 10) Zur Farbentwicklung wurde ebenfalls das APAAP-Kit benutzt. Als Chromogen-Substrat kam Neufuchsin zur Anwendung. Die endogene AP wurde durch Zugabe von Levamisol (0.2 mmol), ebenfalls im APAAP-Kit enthalten, geblockt. Die Inkubationszeit betrug 4x5 Minuten, wobei zwischendurch Spülvorgänge mit Tris-Puffer stattfanden. 2. Material und Methoden - 16 - 11) Die Gegenfärbung erfolgte mit Mayers-Hämatoxylin für 2 Minuten. Anschließend wurden die Schnittpräparate erst für 2 Minuten in Wasser gebläut und dann für weitere 2 Minuten in Tris-Puffer gegeben. Durch die aufsteigende Alkoholreihe wurden die Schnitte zunächst dehydriert, um dann über Xylol mit Eukitt oder Eindeckfolie (Eindeckautomat der Firma Vogel) abgedeckt zu werden. Die Auswertung der histologischen Präparate erfolgte über Mikroskope und den Computer. Mit Hilfe eines Lichtmikroskopes (Axioskop, Carl Zeiss, Jena) wurden die Präparate der konventionellen Histologie und der Immunhistochemie ausgewertet. Die Dokumentation erfolgte mittels einer CCD-Kamera (HV-C20M, Hitachi Denshi Ltd., Japan) am Lichtmikroskop und über ein Dokumentationssystem (Diskus V4.20, Technisches Büro Hilgers, Königswinter). 2.2.3 Immunelektronenmikroskopische Untersuchung 1) Fixierung des Lungengewebes mit einem Gemisch aus 4%igem Paraformaldehyd und 0,5%igem Glutaraldehyd in 0.2M Hepes-Puffer mit einem pH-Wert von 7.4. 2) Infiltration der angefertigten Blöckchen mit 2.3M Sucrose über Nacht und Einfrierung in flüssigem Stickstoff 3) Transfer der eingefrorenen Blöckchen in 0.5% Uranylazetat in Methanol bei –80°C für weitere 36 Stunden 4) Temperaturerhöhung auf –45°C, wobei die Erhöhung in Schritten von jeweils 5°C pro Stunde erfolgt 5) Mehrmaliges Waschen der Präparate mit purem Methanol und anschließende Gabe der Blöckchen in Lomikryl HM 20 über HM20Methanol 1:1 und 2:1 für jeweils 2 Stunden 6) Polymerisation der Blöckchen mit UV-Licht für 2 Tage bei –45°C 2. Material und Methoden - 17 - 7) Beschriftung der Ultradünnschnitte über folgende Prozedur: Aufziehen der Schnitte auf mit Kupfer oder Nickel überzogene Formvar Netzgitter („mesh grids“). Zur Blockierung freier Aldehydgruppen und unspezifischer Bindungsstellen werden die „grids“ zunächst auf einen Tropfen 0.02% Glyzin/TBS für 15 Min und dann auf einen Tropfen Blockierungspuffer (FCS/Tween20/TBS) gelegt. Im nächsten Schritt werden die „grids“ auf einen Tropfen primären Antikörper gegen Napsin A oder Kathepsin H verdünnt in Blockierungspuffer für 60 Minuten gelegt. Daran schließt sich ein 6 maliges Spülen der „grids“ für jeweils 5 Minuten in Blockierungspuffer an. Die Immunreaktion wird durch Inkubation mit einem sekundären, mit 10 nm Gold beschichteten Antikörper sichtbar gemacht. Hieran schließt sich ein erneutes Spülen an, diesmal mit Blockierungspuffer (4 mal für jeweils 5 Minuten), TBS (5 mal für jeweils 5 Minuten) und destilliertem Wasser (3 mal). Abschließend werden die „grids“ mit einem Tropfen 4% wässrigen Uranylazetat kontrastiert, 3 mal kurz mit destilliertem Wasser gespült und über Nacht bei 40°C getrocknet. Die Auswertung erfolgte mit dem Zeiss Elektronenmikoskop 900 (Zeiss, Oberkochen, Deutschland) bei 50 kV. 2.2.4 Biochemische Untersuchung Bei der weiterführenden Western blot Untersuchung an Material aus einer Broncho-Alveolären-Lavage kamen polyklonale und auch ein monoklonaler Antikörper gegen Surfactant Protein B und seine Vorstufen (NPROSP-B, CPROSP-B) zum Einsatz. Die polyklonalen Antikörper gegen das N- und Cterminale Ende des SP-B wurden teilweise bereits in der Immunhistochemie verwendet. Die Charakterisierung der eingesetzten AK ist aus der folgenden Tabelle 4 zu entnehmen, wobei sich Art und Angriffsdomäne auf den jeweils vorangestellten Antikörper beziehen: Tabelle 4: Charakterisierung der verwendeten Antikörper (Surfactant Proteine) Antikörper Art Angriffsdomäne Verdünnung Bezugsquelle NPROSP-B Polyklonal N-Terminus 1:1000 Prof. S. Hagwood CPROSP-B Polyklonal C-Terminus 1:1000 Prof. S. Hagwood SP-B Monoklonal SP-B 1:20000 Dr. Suzuki 2. Material und Methoden - 18 - Die biochemischen Analysen wurden mit dem NuPAGE Elektrophorese System der Firma Novex/Invitrigon (Carlsbad, CA, USA) entsprechend dem Standardprotokoll durchgeführt: 1) Beladung der Gele (4-12% NuPAGE Bis-Tris Gel) mit einem Aliquot der BAL und einem Laufpuffer (NuPAGE MES/SDS Running Buffer); Ladepuffer: 2X NuPAGE LDS Sample Buffer; Elektrophorese: 200 Volt, nicht-reduzierende Bedingungen, 50-60 Minuten; Größenstandard: Mark 12 (Fa. Novex/Invitrigon) und Prestained Precision (Fa. Bio-RAD, Hercules, CA, USA) 2) Transfer der Proteine auf Nitrozellulose-Membranfilterpapier der Stärke 0,2 µm mittels Transfer-Puffers (NuPAGE Transfer Buffer) mit 20% Methanol bei einer Spannung von 35 Volt über 120 Minuten 3) Inkubation für zwei Stunden in TBS-Puffer-Lösung mit 5% Magermilchpulver 4) Inkubation mit verdünnten Primärantikörpern über Nacht (Verdünnung siehe Tabelle 4) in 10 ml der jeweiligen Antikörper / 5% Milch-TBS-PufferLösung 5) Dreimal Waschen in jeweils 20-30 ml 5% Milch-TBS-Pufferlösung 6) Inkubation mit den Sekundärantikörpern (bei polyklonalem Primärantikörper: anti-rabbit IgG, AP-(alkalische Phosphatase) gekoppelt (Fa. Promega, Madison, WI, USA); bei monoklonalem Primärantikörper: anti-mouse IgG, AP-gekoppelt (Fa. Promega)) verdünnt 1:5000 in 10 ml 5% Milch-TBS-Pufferlösung über eine Stunde 7) Dreimal Waschen in jeweils 20-30 ml TBS-Pufferlösung und einmal in 10 ml AP-Puffer (100 mmol Tris (pH 9,5), 100 mmol NaCl, 5 mmol MgCl2) 8) Färbung unter Sichtkontrolle mit einem Gemisch aus 66 µl NBT und 33 µl BCIP (Fa. Promega) 3. Ergebnisse - 19 - 3 Ergebnisse 3.1 Ergebnisse der immunhistochemischen Untersuchung 3.1.1 Verteilung der Zysteinproteasen B, K, L und S in der humanen Lunge Die Kathepsine B, K und L zeigten eine stark positive Reaktion im zilientragenden Bronchialepithel und in den Alveolarmakrophagen, wohingegen die Reaktion in den Pneumozyten negativ ausfiel (siehe hierzu Abbildung 1a-f). Für Kathepsin S fand sich eine positive Reaktion ausschließlich in den Alveolarmakrophagen. Kathepsin S ließ sich im zilientragenden Bronchialepithel und den Pneumozyten immunhistochemisch nicht nachweisen (siehe hierzu Abbildung 1g und h). Abbildung 1: Verteilung der Zysteinproteasen a) Nachweis von Kathepsin B im zilientragenden Bronchialepithel b) Nachweis von Kathepsin B in den Alveolarmakrophagen sowie negativer Nachweis in den Pneumozyten c) Nachweis von Kathepsin K im zilientragenden Bronchialepithel d) Nachweis von Kathepsin K in den Alveolarmakrophagen sowie negativer Nachweis in den Pneumozyten e) Nachweis von Kathepsin L im zilientragenden Bronchialepithel f) Nachweis von Kathepsin L in den Alveolarmakrophagen sowie negativer Nachweis in den Pneumozyten g) Nachweis von Kathepsin S in den Alveolarmakrophagen h) Kein Nachweis von Kathepsin S im zilientragenden Bronchialepithel und den Pneumozyten 3. Ergebnisse - 20 - a) b) Kathepsin B Kathepsin B c) d) Kathepsin K Kathepsin K e) f) Kathepsin L Kathepsin L g) h) Kathepsin S Kathepsin S Abbildung 1: Verteilung der Zysteinproteasen 3. Ergebnisse - 21 - 3.1.2 Nachweis von Kathepsin H in der humanen Lunge und seine Kolokalisation mit Surfactant Protein B Kathepsin H zeigte immunhistochemisch eine stark positive Reaktion im zilientragenden Bronchialepithel und in den Alveolarmakrophagen. Als einziges Kathepsin konnte es zusätzlich in den Typ-II-Pneumozyten lokalisiert werden (siehe hierzu Abbildung 2a und b). Ein Double-Labeling zeigte eine Kolokalisation von Kathepsin H mit dem Surfactant Protein B in den Typ-II-Pneumozyten (siehe hierzu Abbildung 2c und d). Immunelektronenmikroskopisch ließ sich Kathepsin H in den Lysosomen des Bronchialepithels sowie in den primären und sekundären Lysosomen der Alveolarmakrophagen darstellen (siehe hierzu Abbidung 2e und f). Weiterhin zeigte sich eine positive Reaktion im Bereich der Typ-II-Pneumozyten in den multivesikulären Körperchen und entlang der „limiting membrane“ sowie des „projection core“ der Lamellenkörperchen (siehe hierzu Abbildung 2g und h). Für die immunelektronenmikroskopische Darstellung wurde für die Abbildungen e) bis g) eine Primärvergrößerung von 30000 sowie für die Abbildung h) von 50000 gewählt. Abbildung 2: Lokalisation von Kathepsin H und Surfactant Protein B a) b) c) d) e) f) Nachweis von Kathepsin H im zilientragenden Bronchialepithel Nachweis von Kathepsin H in den Makrophagen und in den Pneumozyten Nachweis von Kathepsin H in den Pneumozyten bei starker Vergrößerung Nachweis von SP-B in den Pneumozyten bei starker Vergrößerung Lokalisation von Kathepsin H in Lysosomen des Bronchialepithels Lokalisation von Kathepsin H in primären und sekundären Lysosomen (Phagolysosomen) von Alveolarmakrophagen g) Ausschnitt eines Typ-II-Pneumozyten mit Lokalisation von Kathepsin H im äußeren Abschnitt und entlang der „limiting membrane“ eines Lamellenkörperchens h) Lokalisation von Kathepsin H über der Matrix eines multivesikulären Körperchens 3. Ergebnisse - 22 - a) b) Kathepsin H Kathepsin H c) d) Kathepsin H SP-B e) f) Kathepsin H Kathepsin H g) h) Kathepsin H Kathepsin H Abbildung 2: Lokalisation von Kathepsin H und Surfactant Protein B 3. Ergebnisse - 23 - 3.1.3 Verteilung der Asparaginproteasen Kathepsin D und E in der humanen Lunge Kathepsin D zeigte eine positive Reaktion im zilientragenden Bronchialepithel und in den Alveolarmakrophagen. In den Typ-II-Pneumozyten konnte es immunhistochemisch nicht lokalisiert werden (siehe hierzu Abbildung 3b und c). Kathepsin E zeigte eine positive Reaktion in nicht zilientragenden Bronchialepithelzellen, den Clara-Zellen. In Aveolarmakrophagen und Typ-IIPneumozyten ließ es sich immunhistochemisch nicht nachweisen (siehe hierzu Abbildung 3e und f). Immunelektronenmikroskopisch konnte Kathepsin D in den Lysosomen des kinozilientragenden Bronchialepithels nachgewiesen werden (siehe hierzu Abbildung 3d). Die Darstellung erfolgte mit einer 20000fachen Primärvergrößerung. Abbildung 3: Verteilung der Asparaginproteasen a) Übersicht Kathepsin D b) Nachweis von Kathepsin D in den Alveolarmakrophagen, aber kein Nachweis in den Pneumozyten c) Nachweis von Kathepsin D im zilientragenden Bronchialepithel d) Lokalisation von Kathepsin D in den Lysosomen des kinozilientragenden Bronchialepithels e) Nachweis von Kathepsin E in den Clara-Zellen f) Kein Nachweis von Kathepsin E in den Pneumozyten und den Alveolarmakrophagen 3. Ergebnisse - 24 - a) b) Kathepsin D Kathepsin D c) d) Kathepsin D Kathepsin D e) f) Kathepsin E Kathepsin E Abbildung 3: Verteilung der Asparaginproteasen 3. Ergebnisse - 25 - 3.1.4 Verteilung von Kathepsin E in den Clara-Zellen Für den Nachweis von Kathepsin E und CC10 in Clara-Zellen wurde ein Double-Labeling an Serienschnitten durchgeführt. Kathepsin E konnte immunhistochemisch ausschließlich in CC10-negativen Clara-Zellen im Übergangsbereich der Bronchioli terminalis in die Bronchioli respiratorii lokalisiert werden. Eine Kolokalisation von Kathepsin E mit dem „Clara-cell specific“ Protein CC10 gelang nicht (siehe hierzu Abbildung 4a-h). Abbildung 4: Verteilung von Kathepsin E auf CC10-positive und -negative Zellen a) b) c) d) e) f) g) h) Nachweis von Kathepsin E in CC10-negativen Clara-Zellen Nachweis von CC10-positiven Clara-Zellen Nachweis von Kathepsin E in CC10-negativen Clara-Zellen Nachweis von CC10-positiven Clara-Zellen Nachweis von Kathepsin E in CC10-negativen Clara-Zellen Nachweis von CC10-positiven Clara-Zellen Nachweis von Kathepsin E in CC10-negativen Clara-Zellen Nachweis von CC10-positiven Clara-Zellen 3. Ergebnisse - 26 - a) b) Kathepsin E Clara-Zelle CC10 c) d) Kathepsin E Clara-Zelle CC10 e) f) Kathepsin E Clara-Zelle CC10 g) h) Kathepsin E Clara-Zelle CC10 Abbildung 4: Verteilung von Kathepsin E auf CC10-positive und -negative Zellen 3. Ergebnisse - 27 - 3.1.5 Verteilung der Asparaginprotease Napsin A in der humanen Lunge Napsin A konnte immunhistochemisch in den Pneumozyten und den Alveolarmakrophagen lokalisiert werden (siehe hierzu Abbildung 5a und b). Immunelektronenmikroskopisch ließ sich Napsin A in Typ-II-Pneumozyten, Alveolarmakrophagen und Clara-Zellen nachweisen. Die Abbildungen sind in einer 30000fachen Primärvergrößerung dargestellt. In den Typ-II-Pneumozyten konnte es in den Lamellenkörperchen im Bereich des „projection core“ sowie den multivesikulären Körperchen lokalisiert werden (siehe hierzu Abbildung 5c und d). In den Alveolarmakrophagen war Napsin A in den Lysosomen nachweisbar (siehe hierzu Abbildung 5e). In den Clara-Zellen fand sich Napsin A in den typischen Clara-Zell-Granula (siehe hierzu Abbildung 5f). Abbildung 5: Verteilung von Napsin A a) Nachweis von Napsin A in Pneumozyten b) Nachweis von Napsin A in Alveolarmakrophagen c) Typisches Lamellenkörperchen mit Lokalisation des Napsins A über dem „projektion core“ d) Lokalisation von Napsin A in multivesikulären Körperchen der Typ-IIPneumozyten bei starker Vergrößerung e) Lokalisation von Napsin A in primären und sekundären Lysosomen (Phagolysosomen) in Alveolarmarkophagen f) Lokalisation von Napsin A in Clara-Zell-Granula 3. Ergebnisse - 28 - a) b) Napsin A Napsin A c) Napsin A d) Napsin A Lamellenkörperchen multivesikuläres Körperchen e) Napsin A f) Napsin A Alveolarmakrophage Clara-Zelle Abbildung 5: Verteilung von Napsin A 3. Ergebnisse - 29 - 3.1.6 Verteilung von SP-B und seinen Vorstufen (NPROSP-B und CPROSP-B) in den Clara-Zellen Für den Nachweis von maturem SP-B, seinen Vorstufen und CC10 in den Clara-Zellen wurde ein immunhistochemisches „Labeling“ an Serienschnitten durchgeführt. Abbildung 6a zeigt die Lokalisation von CC10-positiven Clara-Zellen in einem Brochiolus. Stark positive Reaktionen zeigten sich in der Kolokalisation für NPROSP-B und CPROSP-B mit dem „Clara-cell-specific“ Protein CC10 in den ClaraZellen im Bereich des Bronchiolus (siehe hierzu Abbildung 6b und c). Matures SP-B zeigte im Gegensatz dazu nur eine ganz schwach positive Reaktion (siehe hierzu Abbildung 6d). Biochemisch ließ sich im Immunoblot der BAL partiell prozessiertes proSP-B mit einem Molekulargewicht von 24 kDa, der N-Terminus des proSP-B mit einem Molekulargewicht von 19 kDa nach TCA-Präzipitation und matures SP-B mit einem Molekulargewicht von 18 kDa nachweisen (siehe hierzu Abbildung 6e). Abbildung 6: Verteilung von NPROSP-B, CPROSP-B und SP-B auf die CC10-positive Clara-Zelle, Western blot einer BaL a) CC10-positive Zelle im terminalen Bronchiolus b) Nachweis von NPROSP-B in der CC10-positiven Zelle im terminalen Bronchiolus c) Nachweis von CPROSP-B in der CC10-positiven Zelle im terminalen Bronchiolus d) Nachweis von SP-B in der CC10-positiven Zelle im terminalen Bronchiolus e) Western blot Auswertung von BAL Material: Bahnen 1,3,5: Molekulargewichtstandard Bahnen 2,4,6: BAL eines Patienten ohne Lungenerkrankung Bahn 2: Nachweis eines ca. 24 kDa partiell prozesssierten SP-B Bahn 4: Nachweis eines ca. 19 kDa N-Terminus Bahn 6: Nachweis des 18 kDa maturen SP-B 3. Ergebnisse - 30 - a) Clara-Zelle CC10 b) NPROSP-B terminaler Bronchiolus terminaler Bronchiolus c) CPROSP-B d) SP-B terminaler Bronchiolus terminaler Bronchiolus CPROSP-B NPROSP-B SP-B TCA Precipitation e) BAL BAL BAL BAL Abbildung 6: Verteilung von NPROSP-B, CPROSP-B und SP-B auf die CC10-positive Clara-Zelle, Western blot einer BAL 4. Diskussion - 31 - 4 Diskussion In der vorliegenden Dissertationsschrift wird die Charakterisierung der Kathepsine B, D, E, H, K, L und S und Napsin A in der humanen Lunge in Bezug auf das Expressionsmuster in den Zellen und Zellorganellen sowie ihre möglichen physiologischen Funktionen behandelt. Von besonderer Bedeutung ist in diesem Zusammenhang die Fragestellung, ob und welche der Proteasen aufgrund ihrer Lokalisationen möglicherweise in die Prozessierung des Surfactant Proteins B involviert sind. Bei den Zysteinproteasen (B, H, K, L und S) und den Asparaginproteasen (D, E und Napsin A) erfolgt die Unterscheidung in die Familien der Pepsin- und Papainproteasen aufgrund unterschiedlicher Aminosäuren im katalytischen Zentrum. In den katalytischen Zentren der Pepsinproteasen sind Asparaginreste und in denen der Papainproteasen Zysteinreste lokalisiert. Bezogen auf die Prozessierungsschritte Synthese zum des maturen Präproproteins Kathepsin finden und sich die keine spezifischen Unterschiede innerhalb der beiden Familien. Im Rahmen der Diskussion werden die einzelnen Kathepsine und ihre physiologischen Aufgaben im humanen Organismus beschrieben, wobei die Ausarbeitung der Zystein- und Asparaginproteasen alphabetisch erfolgt. Wesentliche Aspekte dieser Arbeit liegen im Nachweis der Kolokalisation von Kathepsin H und Napsin A mit dem Surfactant Protein B und einer möglichen Involvierung der beiden Proteine in die Prozessierung von SP-B, so daß im Anschluß an die Kathepsine die Prozessierung des Surfactant assoziierten Proteins B diskutiert wird. Abschließend erfolgt die Diskussion zur Funktion der ClaraZellen, da auch in diesen Zellen Surfactant Protein B exprimiert wird. Bislang ist unklar, ob auch in den Clara-Zellen eine Prozessierung des proSP-B erfolgt und welche Proteasen involviert sind. 4. Diskussion 4.1 - 32 - Kathepsin B 4.1.1 Untersuchungsergebnis In der Lunge konnte Kathepsin B immunhistochemisch im zilientragenden Bronchialepithel und in den Alveolarmakrophagen lokalisiert werden. 4.1.2 Allgemeine Charakteristika Das mature Kathepsin B, dessen kodierende Gene auf Chromosom acht lokalisiert sind, setzt sich aus einer monomeren und einer dimeren Form zusammen, die sich hinsichtlich einer unterschiedlichen Aminosäure in Position 228 und dem Verlust eines Dipeptids unterscheiden (Chan et al. 1986, Shi et al. 1994). Kathepsin B, welches ein Angehöriger der Papainproteasen ist, spaltet seine Substrate durch Exopeptidase- und nur zu einem geringen Prozentsatz durch Endopeptidaseaktivität. Entscheidendes Charakteristikum für Kathepsin B ist seine Aktivität als Peptidyldipeptidase, die eine Spaltung der Substrate vom C-terminalen Ende beinhaltet (Barrett et al. 1981, Bohley et al. 1992, Barrett 1992). Das pH-Optimum für die Kathepsinaktivität liegt bei 6.0 (Barrett 1972). 4.1.3 Aufbau Vorstufe des maturen Kathepsins B ist das aus folgenden Sequenzen bestehende 339 Aminosäuren lange und ca. 40 kDa schwere Präprokathepsin: 1. eine aus 17 Aminosäuren bestehende Signalsequenz am NH2-terminalen Ende (Position 1-17) 2. das sich daran anschließende aus 62 Aminosäuren bestehende Propeptid (Position 18-79) und 3. das aus 254 Aminosäuren bestehende und ca. 27-29 kDa schwere, monomere Kathepsin B (Position 80-333) mit einer aus sechs Aminosäuren bestehenden Extension am COOH-terminalen Ende (Position 334-339) (Chan et al. 1986, Heidtmann et al. 1997). Die dimere Form von Kathepsin B entsteht durch Spaltung zwischen den Resten 126 und 129, die über den Verlust eines Dipeptids miteinander verbunden werden. Sie besitzt somit nur eine Länge von 252 Aminosäuren 4. Diskussion - 33 - und setzt sich aus einer 22.4 kDa schweren und einer 5.2 kDa leichten Kette zusammen (Chan et al. 1986, Sloane 1990). Weiterhin unterscheiden sich die monomere und die dimere Form noch durch den Tausch von αAminobernsteinsäuremonoamid gegen α-Aminobernsteinsäure in Position 228. Sowohl bei der monomeren als auch der dimeren Form kommt es, wahrscheinlich in den Lysosomen, zum Verlust des Hexapeptids am COOHterminalen Ende. Die Transformation der monomeren in die dimere Form erfolgt vermutlich in den Lysosomen, da beide Formen in dieser Zellorganelle lokalisiert werden konnten. Weiterhin zeigte sich, daß beide Formen enzymatisch aktiv sind (Takio et al. 1983, Chan et al. 1986). Matures Kathepsin B verfügt über eine Glykolysierungseinheit im Bereich des Asparagins in Position 228. Im trans-Golgi Bereich binden die Zucker der Glykolysierungseinheit an den Mannose-6-Phosphat-Rezeptor und es erfolgt der Transport zu den Lysosomen (Sly et al. 1982, Chan et al. 1986). Im katalytischen Zentrum des maturen Kathepsins B ist ein Zysteinrest lokalisiert, weshalb Kathepsin B zu den Zysteinproteasen gezählt wird. Das katalytische Zentrum setzt sich aus Seitenketten unterschiedlicher Herkunft zusammen. Eine der Seitenketten entstammt einem Zysteinrest im Nterminalen Ende des Enzyms. Die andere Seitenkette leitet sich von einem Histidinrest im C-terminalen Ende des Enzyms ab (Takio et al. 1983). Im dimeren Kathepsin B ist die katalytisch wirksame Einheit in der leichten Kette lokalisiert (Sloane 1990). Inhibitoren für die enzymatische Aktivität des humanen Kathepsins B sind Stefin A und B (sie sind im Intrazellularraum lokalisiert), Cystatin C (Lokalisation in interstitialen Körperflüssigkeiten), E-64, Leupeptin, CA-074 (in vitro ein selektiver Inhibitor für Kathepsin B) und Antipain (Erdel et al. 1990, Warfel et al. 1991, Mizuochi et al. 1994, Heidtmann et al. 1997). Die Verteilung der Extrazellularraum Stefine ist und auf des das Cystatins auf unterschiedliche den Intra- bzw. Molekulargewicht zurückzuführen (Heidtmann et al. 1997). Eine Inhibition über den α1Proteinase Inhibitor findet nicht statt (Starkey et al. 1973). Die Transformation von Präprokathepsin B, welches von maligne entarteten Geweben exprimiert wird, zum maturen Monomer kann in vitro durch Pepstatin gehemmt werden. Eine in vitro ablaufende Aktivierung erfolgt über 4. Diskussion - 34 - Kathepsin D. In vivo sind an der Aktivierung möglicherweise extrazelluläre Metalloproteinasen oder ebenfalls Kathepsin D beteiligt (Nishimura et al. 1988, Sloane et al. 1990). 4.1.4 Funktion Matures Kathepsin B ist in fast allen Organen des menschlichen Körpers lokalisiert. Über seine Peptidyldipeptidaseaktivität ist es an der Prozessierung biologisch aktiver Peptide aus ihren inaktiven Vorstufen beteiligt. Beispiele für die Abspaltung basischer Aminosäurereste in Form von Dipeptiden vom C-terminalen Ende sind die Prozessierung von Proinsulin zu Insulin, von Proalbumin zu Albumin, von Proparathyrin zu Parathyrin sowie die Bildung von Glukagon und Muskelaldolase. Diese Prozesse finden in den GolgiVesikeln der Zellen statt (Chance 1972, Hamilton et al. 1974, Russell und Geller 1975, Barrett et al. 1981). Furuhashi et al. (1991) wiesen Kathepsin B in den Lysosomen aller gastroduodenalen Mukosazellen mit Ausnahme der Becherzellen nach. Sie gehen ebenfalls von der Annahme aus, daß dieses Enzym nicht nur an der enzymatischen Degradation von Proteinen und Peptiden, sondern auch an der Prozessierung aktiver Peptide aus ihren Vorstufen beteiligt ist (Furuhashi et al. 1991). Zu diesem Ergebnis kamen auch Watanabe et al. (1988) und Matsuba et al. (1989) an Hand von Tierstudien. Sie konnten, bei Ratten, eine Lokalisation von Kathepsin B in den α-Zellen des Pankreas und den juxtaglomerulären Zellen der Niere nachweisen (Watanabe et al. 1988, Matsuba et al. 1989). Kathepsin B ist möglicherweise auch an pathologischen Prozessen beteiligt, wie zum Beispiel Entzündungsprozesse, Tumorinfiltration und Metastasierung, Erkrankungen die mit Demyelinisierungserscheinungen einhergehen, Knorpeldestruktionen bei der rheumatoiden Arthritis und Muskeldystrophien (Turk et al. 1986). Diese Erkrankungen gehen mit erhöhten Kathepsin B Konzentrationen und einer entsprechend erhöhten mRNA Konzentration einher (Gabrijelcic et al. 1990, Moin et al. 1989). In Bezug auf die rheumatoide Arthritis konnten als Substrate für matures Kathepsin B Kollagen, Proteoglykane und Fibronektin nachgewiesen werden (Barret 1977, Isemura et al. 1981). 4. Diskussion - 35 - Weiterhin zeigte sich, daß für einen begrenzten Zeitraum der Abbau von Substraten bei pH-Werten von 7.0-7.5 noch möglich ist, bevor die irreversible Denaturierung des Enzyms erfolgt (Mort et al. 1984). Werle et al. (1997) versuchten eine Erklärung für dieses Phänomen zu finden und kamen zu mehreren Ansätzen: 1. dem Vorliegen unterschiedlicher Isoformen (Deval et al. 1990) 2. der Veränderung des katalytischen Zentrums in Bezug auf die Endo- und Exopeptidaseaktivität 3. dem Nachweis von Mutanten des maturen Kathepsins B (Hasnain et al. 1992) 4. eine erhöhte Variationsbreite durch unterschiedliche Glykolysierung, Phosphorylierung und Prozessierung des COOH-terminalen Endes von Kathepsin B und 5. die Bindung an endogene Inhibitoren (zum Beispiel α2-Makroglobulin) zur Stabilisierung des Enzyms (Starkey et al. 1973) (Werle et al. 1997). Desweiteren ist Kathepsin B in die Tumorinfiltration und Metastasierung involviert. Matures Kathepsin B zeigt eine Assoziation zu den Membranen des Tumorgewebes und entgeht so einer Inhibition durch neutrale pH-Werte und entsprechende Inhibitoren. Es ist möglicherweise über drei Schritte an der Tumorinfiltration beteiligt: 1. Lösung der Tumorzellen von der Basalmembran des umgebenden Gewebes durch die Fähigkeit von Kathepsin B Substanzen, wie Fibronektin, Glykoproteine und Laminin abzubauen 2. Destruktion der Basalmembran durch den durch Kathepsin B gesteuerten Abbau von Kollagen Typ 4 und von Glykoproteinen und 3. durch Kathepsin B bedingte Freisetzung chemotaktischer Substanzen aus der Basalmembran, die eine Invasion der malignen Zellen in das umgebende Gewebe herbeiführen (Sloane 1990). Diese These wird untermauert von Mori et al. (1997), die ein ähnliches Modell für die Tumorinfiltration und Metastasierung von nicht kleinzelligen malignen pulmonalen Tumoren beschrieben (Mori et al. 1997). Ein weiterer Wirkungskreis von humanem Kathepsin B liegt in seiner Involvierung in immunologische Prozesse. Mizuochi et al. (1994) wiesen eine Mitbeteiligung an der Degradation der invarianten Kette des MHC Klasse 2 4. Diskussion - 36 - αβ-Heterodimers in den Endosomen unter Bildung eines funktionalen MHCMoleküls der Klasse 2 nach. Dieses besitzt die Möglichkeit, Antigene zu binden und sie den T4-Helferzellen zu präsentieren. Mit Hilfe spezifischer Inhibitoren ließ sich als weitere Aufgabe eine in vitro Involvierung in die Prozessierung und Präsentation von Antigenen nachweisen (Mizuochi et al. 1994). 4.1.5 Die Bedeutung von Kathepsin B in der menschlichen Lunge Padilla et al. (1988) und Lesser et al. (1992) konnten in Tierversuchen mit Hamsterlungen zeigen, daß hohe Konzentrationen an Kathepsin B in den Alveolarmakrophagen zur Entstehung von Lungenemphysemen beitrugen (Padilla et al. 1988, Lesser et al. 1992). Diese „Fähigkeit“ ist auf das hohe Elastin-abbauende Potential von Kathepsin B zurückzuführen. Inwieweit es an der Entstehung von Emphysemen in der humanen Lunge involviert ist, ist noch nicht näher beschrieben worden. Weiterhin ist Kathepsin B möglicherweise an der Tumorinfiltration und Metastasierung von nicht kleinzelligen malignen Lungentumoren beteiligt (Mori et al. 1997). In ihnen lassen sich höhere Konzentrationen von Kathepsin B nachweisen, wohingegen die Menge an Zysteinproteaseinhibitoren erniedrigt ist. Das Ungleichgewicht zwischen der Protease und ihrem spezifischen Inhibitor könnte einen möglichen Faktor für die Tumorinfiltration und -metastasierung darstellen (Heidtmann et al. 1997). Bezogen auf die Fragestellung der vorliegenden Dissertation hat sich gezeigt, daß Kathepsin B nicht in die Prozessierung von Surfactant Protein B involviert ist, da es immunhistochemisch weder in Typ-II-Pneumozyten noch in Clara-Zellen lokalisiert werden konnte. 4.2 Kathepsin D 4.2.1 Untersuchungsergebnis Kathepsin D konnte immunhistochemisch in den Alveolarmakrophagen und im zilientragenden Bronchialepithel nachgewiesen werden. Sich daran anschließende immunelektronenmikroskopische Untersuchungen zeigten eine Lokalisation von Kathepsin D in den Lysosomen der kinozilientragenden Bronchialepithelien und den Alveolarmakrophagen. 4. Diskussion - 37 - 4.2.2 Allgemeine Charakteristika Matures Kathepsin D, dessen kodierendes Gen auf Chromosom 11p15 liegt und über Östrogen reguliert wird, ist eine Endoprotease mit einem pHOptimum zwischen 3.0 und 5.0, die der Pepsinfamilie angehört (Cavailles et al. 1991, Bohley et al. 1992, May et al. 1993, Kasper et al. 1996). Im Gegensatz zu den anderen Angehörigen der Pepsinfamilie liegt Kathepsin D als Dimer und nicht als Monomer vor (Tang et al. 1987, Yonezawa et al. 1988). 4.2.3 Aufbau Vorläufer des 45 kDa schweren maturen Kathepsins D ist ein 53 kDa schweres Präpropolypeptid und ein 47 kDa schweres Propeptid. Das Präpropolypeptid besitzt 412 Aminosäuren und setzt sich aus folgenden Komponenten zusammen: 1. der Signalsequenz im Bereich des NH2-terminalen Endes (Position 1-20) 2. einem sich daran anschließenden Propeptid (Position 21-44) und 3. dem maturen Kathepsin D (Position 45-412). Im Bereich der Endosomen kommt es zur Prozessierung der 46 Aminosäuren langen Prosequenz am NH2-terminalen Ende (Faust et al. 1985, Diment et al. 1988, Metcalf et al. 1993). Die mature Form, die als Glykoprotein vorliegt, besteht aus einer 14 kDa und einer 31 kDa schweren Untereinheit, die über eine Disulfidbrücke in Position 97 und 98 miteinander verbunden ist (Reid et al. 1986, Tang et al. 1987, Diment et al. 1988). Bei Schweinen kommt es zum Verlust von einem kDa im Bereich der schweren Kette, was auf eine Abspaltung von sieben Aminosäuren im NH2terminalen und von zwei Aminosäuren im COOH-terminalen Ende zurückzuführen ist (Erickson et al. 1983). Über die Bedeutung dieser Aminosäureabspaltungen liegen noch keine Erkenntnisse vor. Das humane Kathepsin D verfügt im Gegensatz zum Schweinekathepsin über neun zusätzliche Aminosäuren, von denen sieben in den Positionen 98104 und zwei im COOH-terminalen Bereich lokalisiert sind (Faust et al. 1985). Die Glykolysierungseinheiten des Kathepsins D liegen in Position 67 mit fünf Oligosacchariden und in Position 183 mit drei Oligosacchariden über welche 4. Diskussion - 38 - die Bindung an den Mannose-6-Phosphat-Rezeptor und der Transport zu den Lysosomen erfolgt (Sly et al. 1982, Takahashi et al. 1983, Tang et al. 1987). Weiterhin konnte eine membran-assoziierte und eine aktive lösliche Form nachgewiesen werden. Die membran-assoziierte Form ist in den Endosomen lokalisiert und stellt das Präpropolypeptid dar, wohingegen es sich bei der aktiven löslichen Form, die zum Teil noch in den Endosomen und ansonsten überwiegend in den Lysosomen lokalisiert ist, um das mature Kathepsin D handelt (Diment et al. 1988). Der Prozessierungsvorgang wird über einen sauren pH-Bereich unter Abspaltung eines Teiles der Prosequenz katalysiert. Es ist noch nicht geklärt, warum die Prozessierung der Prosequenz in zwei Teilschritten erfolgt (Hasilik et al. 1982). Ein reversibler Inhibitor für das mature Kathepsin D ist Pepstatin (Kirschke et al. 1987, Beynon et al. 1989). 4.2.4 Funktion Matures Kathepsin D ist an der Degradation von Proteinen beteiligt, die in Position P1 und P1` des Substrates hydrophobe Reste aufweisen und länger als fünf Aminosäuren sind (Imoto et al. 1987, van Noort et al. 1989). Zu diesen Substraten gehören unter anderem Hämoglobin, Myosin, Angiotensinogen, Proteoglykane, Myelin, Endorphine und zytosolische Proteine. Serumalbumin, Kollagen und Gelatine werden nur zu einem geringen Prozentsatz abgebaut (Kirschke et al. 1987). Die Prozessierung von Angiotensinogen belegt eine Beteiligung von Kathepsin D an der Bildung von aktiven Enzymen aus ihren inaktiven Metaboliten (Kirschke et al. 1987). Diese Beobachtung wird durch eine Studie von Takaoka et al. (1990) untermauert. Sie wiesen die Prozessierung des maturen Endothelins 1 aus seinem inaktiven Propeptid durch Spaltung zwischen den Aminosäuren Trp21 und Val22 mit Hilfe von Kathepsin D nach. Hieraus ergibt sich möglicherweise eine Involvierung des Enzyms in pathologische Prozesse wie zum Beispiel die portale und renale Hypertension sowie die durch eine Hypertension ausgelösten vaskulären Veränderungen über die erhöhte Bildung vasokonstriktorisch wirksamer Substanzen (Takaoka et al. 1990). 4. Diskussion - 39 - Weitere Aufgaben von Kathepsin D sind die Stimulation der DNA-Synthese und der Mitose während der Gewebsregeneration, die physiologische Regulation von Kathepsin B- und L-ähnlichen Zysteinproteasen sowie die Degradation extra- und intrazellulärer Proteine. Hieraus ergibt sich ebenfalls eine mögliche Involvierung dieses Kathepsins in pathologische Prozesse, wie zum Beispiel die Wundheilungsstörungen Leberzirrhose, im Bereich der myokardiale Haut, Erkrankungen, Tumorinfiltration und Metastasierung und interstitiale pulmonale Erkrankungen, die gemeinsam mit erhöhten Kathepsin D-Werten einhergehen (Ryvniak et al. 1990, Leto et al. 1992, Hernandez-Cueto et al. 1993, Solovyeva et al.1995). Mizuochi et al. (1994) berichteten über eine Involvierung von Kathepsin D in immunologische Prozesse. Sie zeigten zum einen, daß Kathepsin D den ersten Schritt der Degradation der invarianten Kette des αβ-Heterodimers der MHC-Moleküle der Klasse 2 unter Bildung eines funktionalen MHCMoleküles katalysiert und zum anderen, daß es eine wichtige Rolle bei der Prozessierung von Antigenen spielt (Mizuochi et al. 1994). 4.2.5 Die Bedeutung von Kathepsin D in der menschlichen Lunge Studien von Chang et al. (1986 und 1989) zeigten, daß man bei Rauchern erhöhte Werte von Kathepsin D in den Alveolarmakrophagen und der BAL nachweisen konnte. Sie folgerten hieraus, daß Kathepsin D möglicherweise an der Entstehung von Erkrankungen beteiligt ist, die durch das Rauchen von Zigaretten ausgelöst werden (Chang et al. 1986 und 1989). Im Rahmen dieser Studie konnte Kathepsin D als möglicher Kandidat für die Prozessierung von Surfactant Protein B ausgeschlossen werden, da es immunhistochemisch weder in Typ-II-Pneumozyten noch in Clara-Zellen lokalisiert werden konnte. 4.3 Kathepsin E 4.3.1 Untersuchungsergebnis Kathepsin E konnte immunhistochemisch im Rahmen dieser Studie ausschließlich in den Clara-Zellen lokalisiert werden. Double-LabelingUntersuchungen zeigten, daß sich Kathepsin E nur in den CC10-negativen 4. Diskussion - 40 - Clara-Zellen im Übergangsbereich der Bronchioli terminalis in die Bronchioli respiratorii lokalisieren ließ. Die CC10-positive Clara-Zelle, die sich überwiegend im Bereich der Bronchiolen nachweisen ließ, war Kathepsin E-negativ. 4.3.2 Allgemeine Charakteristika Kathepsin E, dessen kodierende Gene auf Chromosom eins lokalisiert sind, liegt im humanen Organismus als Homodimer vor (Azuma et al. 1989, Fowler et al. 1995). Es setzt sich aus zwei Monomeren mit einem Molekulargewicht von jeweils ca. 42 kDa zusammen, die über eine Disulfidbrücke verbunden sind. Es ist ein Angehöriger der Pepsinfamilie, das als einziges Kathepsin nicht in den Lysosomen lokalisiert ist. Matures Kathepsin E ist unter physiologischen Bedingungen nur im Intrazellularraum nachweisbar und zählt somit auch nicht zu den sekretorischen Enzymen (Fowler et al. 1995) 4.3.3 Aufbau Matures Kathepsin Präpropolypeptid E geht hervor, aus das einem sich 379 aus Aminosäuren folgenden langen Abschnitten zusammensetzt: 1. einer 19 Aminosäuren langen Signalsequenz (Position1-19) 2. dem sich daran anschließenden Propeptid (Position 20-39) und 3. dem maturen Kathepsin (Position 40-379) (Azuma et al. 1989, Rao-Naik et al. 1995, Azim et al. 1999). Es verfügt, wie die anderen Kathepsine auch, über Glykolysierungseinheiten. Beide Einheiten sind beim Kathepsin E im maturen Enzym in den Positionen Asn67 und Asn311 lokalisiert (Kageyama et al. 1992). Das Propeptid wickelt sich im dreidimensionalen Molekül um den zentralen Anteil des Enzyms, die basischen Aminosäuren der Seitenketten bilden Ionenbindungen mit den negativ geladenen Aminosäuren des maturen Kathepsins. Weiterhin findet die Stabilisierung des Propeptids mit dem maturen Kathepsin über Wasserstoffbrückenbindungen, hydrophobe Interaktionen und Ionenpaare statt. Die zwölf nachweisbaren Ionenpaare entstehen über Anziehungskräfte zwischen den benachbarten positiv und negativ geladenen Seitenketten, von denen acht der Stabilität zwischen dem Propeptid und dem maturen Enzym und vier der intramolekularen Stabilität des maturen Kathepsins E dienen. 4. Diskussion - 41 - Das Propeptid (Position 1-39) liegt als Strang in β-Konformation im Nterminalen Bereich vor, dem sich drei α-helikale Bereiche anschließen. Die Aminosäuren in den Positionen P2-P9 bilden Wasserstoffbrückenbindungen mit den Aminosäuren in den Positionen P162-P168 des maturen Kathepsins. Die Reste in den Positionen P11-P39 bilden α-helikale Strukturen (α1:P11P19, α2:P22-P29 und α3:P33-P37), die der Stabilität der Sekundärstruktur dienen. Den Trigger für die Konformationsänderung der dreidimensionalen Struktur und die Prozessierung des Propeptids stellt ein Absinken des pH-Wertes in den sauren Bereich dar. Hierdurch kommt es zur Protonierung der in den Seitenketten lokalisierten karboxylierten Aspartat- und Glutamatreste (Position 6, 8, 12, 36-38) und dadurch bedingt zur Destabilisierung der Ionenbindungen und zur Abspaltung des Propeptids (Azim et al. 1999). Im N-terminalen Bereich des maturen Kathepsins E ist die Sequenz Thr-GluSer-Cys4-Ser lokalisiert, die für die Dimerisation zweier 42 kDa schwerer Dimere über eine intermolekulare Disulfidbrücke mit Hilfe von Cys4 (entspricht bezogen auf das gesamte Molekül der Position Cys37) zum 84 kDa schweren Homodimer verantwortlich ist. Die in dieser Sequenz enthaltene Aminosäure Cys in Position vier ist weiterhin an der autokatalytischen Aktivierung des Kathepsins bei pH-Werten zwischen 4.0 und 6.0 beteiligt (Kageyama et al. 1992, Rao-Naik et al. 1995, Fowler et al. 1995). Kathepsin E liegt sowohl als Monomer als auch als Dimer vor. Übergänge zwischen beiden Formen sind möglich. Durch die Anwesenheit eines reduzierenden Agens, wie zum Beispiel Glutathion, kann die dimere Form in die monomere Form umgewandelt werden. Die Abwesenheit eines reduzierenden Agens führt dagegen zur Transformation der monomeren in die dimere Form. Die dimere Form scheint für die Stabilität des Moleküls unter alkalischen Bedingungen wichtig zu sein. Die monomere Form ist dagegen eher für die enzymatische Aktivität von Kathepsin E in vivo nötig (Kageyama et al. 1992). Für die katalytische Aktivität des Enzyms sind die Asparaginsäuren Asp32 und Asp215 (sie sind in ihrer Numerierung vom Zymogen abgeleitet und liegen beim Kathepsin E beide im maturen Anteil) relevant. Sie sind im dreidimensionalen Molekül auf einem Schleifenpaar lokalisiert, zwischen dem 4. Diskussion - 42 - sich der am katalytischen Zentrum beteiligte aktive Spalt befindet. Im Präpropolypeptid sind Wasserstoffbrückenbindungen zwischen Lys36, Asp32 und Asp215 lokalisiert, desgleichen zwischen Tyr9, Tyr37, Asp32 und Asp215. Die Aktivierung der katalytischen Einheit erfolgt über die Spaltung der Wasserstoffbrückenbindungen sowie eine Konformationsänderung der Sekundärstruktur im Bereich der α1-helikalen Struktur (Azim et al. 1999). Kathepsin E wird über Pepstatin inhibiert (Kageyama et al. 1992). 4.3.4 Funktion Kathepsin E baut Substrate ab, die über eine charakteristische Anordnung ihrer Aminosäuren in entsprechenden Positionen verfügen müssen: 1. in Position P1 und P1` ist das Vorliegen von hydrophoben Aminosäuren mit einer aromatischen oder aliphatischen Seitenkette notwendig, Valund Ile-Reste können nur abgebaut werden, wenn sie in Position P1`, nicht aber in Position P1 vorliegen 2. in Position P2` ist die Spezifität geringer; hier können zum Beispiel auch kleine und polare Aminosäuren degradiert werden 3. in Position P4 und P3`-P5` wird bevorzugt Pro gebunden und 4. die Positionen P4-P7 sind wichtig für die Interaktion mit dem Enzym. Das katalytische Zentrum von Kathepsin E verfügt über eine Länge von vier nm und degradiert Substrate mit ca. sieben bis neun Aminosäuren (Arnold et al. 1997). Eine Involvierung von Kathepsin E findet sich bei der Prozessierung von Antigenen und Prohormonen sowie der Infektion humaner Zellen mit dem HIVirus (Lees et al. 1990, Clements et al. 1991, Bennett et al. 1992). Eine Studie von Clements et al. (1991) zeigte, daß Kathepsin E an der Spaltung von gp 120 im HI-Virus 1 und von gp 105 im HI-Virus 2 beteiligt ist. Über diesen Vorgang ist das Virus in der Lage, in die CD4+-Lymphozyten einzudringen (Clements et al. 1991). Die Beteiligung von Kathepsin E an der Umwandlung von Prohormonen aus ihren inaktiven Vorstufen verdeutlicht eine Studie von Lees et al. (1990), die nachwiesen, daß Kathepsin E die Prozessierung von Endothelin aus seiner inaktiven Vorstufe katalysiert (Lees et al. 1990). Matures Kathepsin E konnte in den Endosomen der Langehanszellen der Haut, den interdigitierenden Retikulumzellen von Lymphknoten, Milz, 4. Diskussion - 43 - Tonsillen und Niere sowie den Clara-Zellen der Lunge nachgewiesen werden. In diesen Zellen ist es an der intrazellulären Prozessierung von Antigenen beteiligt, die dann an der Oberfläche dieser Zellen präsentiert werden. In Alveolarmakrophagen, die ebenfalls in die Prozessierung von Antigenen involviert sind, konnte Kathepsin E nicht lokalisiert werden (Reid et al. 1986, Solcia et al. 1993, Finzi et al. 1993, Bosi et al.1993, Arbustini et al. 1994). Pathologische Prozesse, wie zum Beispiel chronisch interstitiale pulmonale Erkrankungen, chronische Gastritis und chronische Darmerkrankungen gehen mit einer erhöhten de novo Bildung von Kathepsin E einher (Arbustini et al. 1994). Der Nachweis von Kathepsin E in den Foveolarzellen des Magens stellt eine mögliche weitere Aufgabe dieses Enzyms dar, die sich auf Regenerationsprozesse der Magenschleimhaut bezieht (Sakai et al. 1989). 4.3.5 Die Bedeutung von Kathepsin E in der menschlichen Lunge Arbustini et al. (1994) konnten Kathepsin E in den Clara-Zellen der humanen Lunge nachweisen, wo es an der intrazellulären Prozessierung von Antigenen beteiligt ist, die anschließend an der Oberfläche von Antigenpräsentierenden Zellen präsentiert werden. Ihre Studie zeigte weiterhin, daß eine de novo Synthese von Kathepsin E und HLA-DR durch hyperplastische Typ-II-Pneumozyten im transplantierten Lungengewebe möglicherweise den Auslöser zur Tansplantatabstoßung darstellt. Diese Reaktion ist wahrscheinlich über Antigenprozessierung und -präsentation gesteuert (Arbustini et al. 1994). Kathepsin E konnte in dieser Studie immunhistochemisch nur in den CC10negativen Clara-Zellen lokalisiert werden. Es kommt somit als Kandidat für die Prozessierung des Surfactant Proteins B nicht in Betracht, da diese in den Typ-II-Pneumozyten und den CC10-positiven Clara-Zellen abläuft. 4.4 Kathepsin H 4.4.1 Untersuchungsergebnis Kathepsin H ist immunhistochemisch neben seiner Lokalisation in Alveolarmakrophagen und im zilientragenden Bronchialepithel im Rahmen 4. Diskussion dieser Studie - 44 - als einziges Kathepsin in den Typ-II-Pneumozyten nachgewiesen worden. Immunelektronenmikroskopisch fand sich Kathepsin H in den Lamellenkörperchen im Bereich des „projection core“ und der „limiting membrane“ und in den multivesikulären Körperchen der Typ-IIPneumozyten. In den Alveolarmakrophagen und den Bronchialepithelien konnte Kathepsin H in den Lysosomen lokalisiert werden. 4.4.2 Allgemeine Charakteristika Das mature Kathepsin H, dessen kodierendes Gen auf dem humanen Chromosom 15 lokalisiert ist, liegt als glykolysierte Polypeptidkette mit einem Molekulargewicht von 28 kDa vor (Barret et al. 1981, Quian et al. 1990, Shi et al. 1994). Kathepsin H verfügt neben seiner Endopeptidase- als einziges Kathepsin auch noch über eine Aminopeptidaseaktivität (Wiederanders et al. 1992). 4.4.3 Aufbau Die Prozessierung zum maturen Kathepsin H erfolgt, wie bei den anderen Kathepsinen auch, über ein Präpropeptid und ein Propeptid. Für die humane Form sind die genauen Aminosäuresequenzen, an denen die Prozessierungsprozesse ablaufen, noch nicht bekannt (Bohley et al. 1992). Quian et al. (1990) untersuchten die Synthese und Prozessierung von Kathepsin H aus der Rattenleber. Vorläufer der maturen Form ist ein 313 Aminosäuren langes Präprokathepsin, das über Aminosäureabspaltungen vom N-terminalen Ende zum 220 Aminosäuren langem aktiven Enzym umgesetzt wird. Modifikationen am C-terminalen Ende finden nicht statt (Quian et al. 1990). Im Propeptid sind zwei Glykolysierungseinheiten lokalisiert, die in die intrazellulären Transportprozesse involviert sind. Eine weitere Glykolysierungseinheit findet sich im maturen Kathepsin H. Die Funktion dieser dritten Glykolysierungseinheit ist noch nicht geklärt. Das mature Kathepsin H der Rattenleber liegt als Monomer und als Dimer vor. Die dimere Form entsteht aus der monomeren Form durch endoproteolytische Spaltung in der Nähe des carboxyterminalen Endes zwischen den Aminosäuren Asn177 und Gly178, wobei es im Gegensatz zum 4. Diskussion - 45 - Kathepsin B nicht zum Verlust von Aminosäuren kommt (Fuchs et al. 1988, Qian et al. 1990). Humanes Kathepsin H setzt sich aus einer 22 kDa schweren (Position 1-169) und einer sechs kDa leichten (Position 170-220) Kette zusammen. Für die Aktivität der katalytischen Einheit ist das Vorhandensein beider Ketten notwendig. Es werden sowohl die in der schweren Kette lokalisierten Aminosäuren Cys26 und His als auch die in der leichten Kette lokalisierten Aminosäuren Asn175, Ser176 und Trp177 benötigt. Sie bilden gemeinsam die dreidimensionale Struktur des katalytischen Zentrums (Kirschke et al. 1987, Fuchs et al. 1988). Eine Inhibition der Enzymaktivität des maturen Kathepsins H erfolgt über basische pH-Werte (über eine irreversible Destruktion der Sekundärstruktur), Diazomethane (sie führen zu einer langsamen Hemmung), Peptidaldehyde (sie stellen einen relativ schwachen reversiblen Inhibitor mit einer Wirkung von Ki ~ 3.7 x 10-8 M dar), α2-Makroglobulin und E-64. (Barrett et al. 1981, Barrett 1992) 4.4.4 Funktion Matures Kathepsin H verfügt sowohl über Endo- als auch Aminopeptidaseaktivität. Die Aminopeptidaseaktivität beruht auf der Abspaltung von Aminosäuren vom N-terminalen Ende der Substrate, wobei diese über eine freie αAminogruppe verfügen müssen. Nα-acetylierte Aminogruppen können nicht gespalten werden. Im Gegensatz zu der eher unspezifischen Aminopeptidaseaktivität, die nur an das Vorhandensein einer freien αAminogruppe gebunden ist, ist die Aktivität der Endopeptidase sehr viel spezifischer. Sie favorisiert Substrate, die in Position P2 und P3 eine hydrophobe Aminosäure aufweisen. Dieses konnte zum Beispiel für die βKette des Insulins nachgewiesen werden (Koga et al. 1992). Die Hauptfunktion von Kathepsin H liegt vermutlich im intralysosomalen Abbau von Peptiden, die von Kathepsin L und D durch den Abbau aus größeren Proteinen gebildet werden (Bohley et al. 1992). Eine weitere Aufgabe des Enzyms ist die Prozessierung biologisch aktiver Peptide aus den entsprechenden Propeptiden. Diese Erkenntnisse 4. Diskussion - 46 - resultieren aus dem Nachweis von Kathepsin H in den sekretorischen Granula endokriner Zellen, wie zum Beispiel den gastrointestinalen und den thyroidal follikulären Zellen der Ratte sowie den humanen α- und β-Zellen des Pankreas (Uchiyama et al. 1989, Im et al. 1989, Furuhashi et al. 1991). Gabrijelcic et al. (1990) wiesen erhöhte Kathepsin H-Konzentrationen in der Synovialflüssigkeit von Arthritispatienten nach (Gabrijelcic et al. 1990). Es ist bislang spekulativ, ob auch Kathepsin H extrazellulär wirksam ist und bei der Arthritis mit einer Entzündung und Destruktion des Gelenkes einhergeht. Eine Involvierung des maturen Kathepsins H in die Tumorprogression und Metastasierung konnte im Gegensatz zu den anderen Kathepsinen nicht belegt werden (Quian et al. 1990). 4.4.5 Kathepsin H und die Prozessierung von SP-B Kathepsin H konnte immunhistochemisch als einzige Zysteinpotease in den Typ-II-Pneumozyten lokalisiert werden. Ein ebenfalls immunhistochemisch durchgeführtes „Double-Labeling“ von Kathepsin H mit SP-B an Serienschnitten zeigte eine Kolokalisation in den Typ-II-Pneumozyten. Zur exakten Lokalisation von Kathepsin H in Bezug auf die einzelnen Zellorganellen im Typ-II-Pneumozyten wurden immunelektronenmikroskopische Untersuchungen angeschlossen. Diese erbrachten den Nachweis von Kathepsin H in den multivesikulären Körperchen und den Lamellenkörperchen der Typ-II-Pneumozyten. Voorhout et al. (1992) und Brasch et al. konnten zeigen, daß die multivesikulären Körperchen in den Typ-II-Pneumozyten nicht nur Transportvesikel sind, sondern daß in diesen Körperchen die Prozessierung des proSP-B stattfindet. Aufgrund seiner Lokalisation ist die Zysteinprotease Kathepsin H ein möglicher Kandidat, der in den multivesikulären Körperchen in die Prozessierung des Surfactant Proteins B involviert ist. Weitere Erläuterungen folgen nach der Abhandlung über SP-B. 4. Diskussion 4.5 - 47 - Kathepsin K (Synonym: Kathepsin O2) 4.5.1 Untersuchungsergebnis Kathepsin K ließ sich immunhistochemisch in Alveolarmakrophagen und im zilientragenden Bronchialepithel nachweisen. 4.5.2 Allgemeine Charakteristika Kathepsin K ist eine in den Lysosomen vorkommende Zysteinprotease, die der Papainfamilie angehört. Das Gen, das dieses Enzym kodiert, liegt auf Chromosom 1q21 (Gelb et al. 1996). Das mature Kathepsin K liegt intralysosomal als Monomer mit einem Molekulargewicht von 29 kDa und einer Länge von 215 Aminosäuren vor. Die Stabilisierung erfolgt mit Hilfe von sechs Zysteinresten, die intramolekulare Disulfidbrücken bilden (Gelb et al. 1996). Weiterhin findet man im maturen Kathepsin K drei Aminosäuren, die in die Bildung des katalytischen Zentrums involviert sind. Es handelt sich hierbei um die Aminosäuren in den Positionen Cys139, His276 und Asn296 (Bossard et al. 1996). 4.5.3 Aufbau Vorläufer des maturen Kathepsins K ist ein 329 Aminosäuren langes Präpropolypeptid, das folgende Abschnitte enthält: 1. ein 15 Aminosäuren langes Signalpeptid am N-terminalen Ende (Position 1-15) 2. eine 99 Aminosäure lange, sich daran anschließende Proregion (Position 16-114) und 3. das 215 Aminosäuren lange mature Kathepsin K mit dem C-terminalen Ende (Position 115-329) (Gelb et al. 1996). Die Signalsequenz besitzt eine positiv geladene Aminosäure (Lys5) in der Nähe des initialen Methionin, woran sich hydrophobe Aminosäuren anschließen. Terminiert wird die Signalsequenz von Ala15. Die Abspaltung der Proregion erfolgt zwischen Arg114 und Ala115 (Bossard et al. 1996). Das mature Kathepsin K ist ein monomeres 215 Aminosäuren langes Protein mit einem Molekulargewicht von ca. 29 kDa (Gelb et al. 1996). Brömme et al. (1996) konnten im Kathepsin K noch keine Glykolysierungseinheiten 4. Diskussion - 48 - nachweisen (Brömme et al. 1996), wohingegen Gelb et al. (1996) von drei Glykolysierungseinheiten ausgehen. Jeweils eine dieser Einheiten ist im Propeptid und im maturen Enzym lokalisiert. Im trans-Golgi-Bereich bindet der Zucker Mannose-6-Phosphat der Glykolysierungseinheit Mannose-6-Phosphat-Rezeptor, mit dessen Hilfe der an den Transport des Propeptids zu den Lysosomen erfolgt (Gelb et al. 1996). Die Bildung des maturen Kathepsins K aus dem Präpropolypeptid kann in vitro in Anwesenheit von Pepsin bei einem pH-Wert von 4.0 katalysiert werden (Brömme et al. 1996). Mc Queney et al. (1997) konnten in vivo eine autokatalytische Umwandlung nachweisen, die an das Vorhandensein der AS Cys139 gebunden ist. In ihrem Versuch ersetzten sie Cys139 durch einen Serinrest in der gleichen Position. Unter Zugabe von 1% exogenem maturen Wildtyp Kathepsin K ließen sich nur Intermediärprodukte, aber kein matures Kathepsin nachweisen (Mc Queney et al. 1997). In Mäusen wird Kathepsin K überwiegend von Osteoklasten und Chondroklasten und nur in einem geringen Maße von Monozyten und Makrophagen exprimiert (Rantakokko et al. 1996). Im menschlichen Lungengewebe konnte, im Gegensatz zu den Ergebnissen an Mäusen, Kathepsin K im Rahmen dieser Studie immmunhistochemisch in den Alveolarmakrophagen und den zilientragenden Bronchialepithelien nachgewiesen werden. Die Enzymaktivität kann über E-64, Leupeptin (langsam bindend), Aldehyde, Diazomethane Enzymaktivität und über Cystatin gehemmt spezifische werden, Inhibitoren wohingegen der Serin- die und Asparaginproteasen unbeeinflußt bleibt (Brömme et al. 1996, Bossard et al. 1996). Eine Erhöhung der Genexpression in Osteoklasten konnte durch einen Vitamin A Metaboliten („retinoic acid“) nachgewiesen werden (Saneshige et al. 1995). 4.5.4 Funktion Die bisherigen Untersuchungen zeigen, daß Kathepsin K eine wichtige Rolle im Knochenstoffwechsel spielt. Es ist in hohen Konzentrationen in Osteoklasten, in anderen Organen wie Herz, Skelettmuskel, Kolon, Ovar und Plazenta aber nur in geringen Mengen nachweisbar (Inaoka et al. 1995, Brömme et al. 1996, Gelb et al. 1996). 4. Diskussion - 49 - Unter physiologischen Bedingungen finden am Knochen laufend Auf- und Abbauprozesse statt, die eine normale Belastung des Knochens ermöglichen. Die Degradation des Knochens beinhaltet zwei Mechanismen: - Demineralisation der Knochenmatrix, die zu über 90% Kollagen Typ 1 enthält (Delaisse et al. 1992, Krane et al. 1994) - Abbau extrazellulärer Matrixproteine (Delaisse et al. 1992) Eine Lokalisation von Kathepsin K hat man in den Lysosomen der Osteoklasten gefunden, die den knochenabbauenden Anteil darstellen. Kathepsin K ist in vitro in der Lage, bei sauren pH-Werten Kollagen Typ 1 intralysosomal abzubauen (Brömme et al. 1996). Weiterhin ist es an der Degradation der extrazellulären Matrix beteiligt. Die Osteoklasten schaffen bei der Knochendegradation ein saures Umgebungsmilieu mit pH-Werten zwischen 5.0 und 6.0, so daß Kathepsin K auch extrazellulär, in den Knochennischen die Knochenmatrix abbauen kann (Reilly et al. 1989, Bossard et al. 1996, Brömme et al. 1996). Der genaue Mechanismus wie, das Enzym aus den intrazellulären Lysosomen in den Extrazellularraum gelangt, ist bislang noch nicht geklärt. Am Beispiel der Pyknodysostose soll exemplarisch die Rolle des Kathepsins K erläutert werden. Bei der Pyknodysostose handelt es sich um eine hereditäre autosomalrezessive Erkrankung, die durch kleine Statur, kraniale Suturen und erhöhte Knochendichte und -fragilität gekennzeichnet ist. Das fehlerhafte Gen liegt auf dem humanen Chromosom 1q21 und führt zu einem nicht funktionsfähigen mutierten Kathepsin K. Die Translation der mRNA stoppt im Bereich der Aminosäure 241 unter dem Verlust der letzten 89 Aminosäuren des carboxyterminalen Endes. Dies führt zu einem Verlust der katalytischen Aktivität, da zwei der drei benötigten Aminosäuren der katalytischen Einheit verlorengehen. Weiterhin ist die Stabilität des maturen Kathepsins nicht mehr erhalten, da zwei der hierfür benötigten Aminosäuren ebenfalls verlorengehen (Johnson et al.1996). Kathepsin K favorisiert Substrate, die in Position P1 eine hydrophile Seitenkette mit enthaltenem Arg oder Lys und einer sich in Position P2 anschließenden hydrophoben Seitenkette besitzen (Bossard et al. 1996). Zu 4. Diskussion - 50 - diesen Substraten gehören Kollagen Typ 1, Elastin, Gelatine und Osteonektin (Brömme et al.1996, Gelb et al. 1996, Johnson et al. 1996). Substrate mit einer hydrophoben Seitenkette in Position P1 werden nicht katalysiert (Bossard et al. 1996). 4.5.5 Die Bedeutung von Kathepsin K in der menschlichen Lunge Es hat sich gezeigt, daß Papain, eine Zysteinprotease, die der Papayapflanze entstammt, bei intratrachealer Gabe in der Lage ist, ein Lungenemphysem bei Hamstern auszulösen. Der Auslöser für diese Erkrankung ist das Elastin-abbauende Potential dieser Zysteinprotease (Goldring et al. 1968). Kathepsin K ist eine Zysteinprotease mit elastinolytischer Aktivität. Zu ihren Substraten gehört unter anderem Elastin. Möglicherweise ist Kathepsin K ebenfalls an der Entstehung eines Lungenemphysems beteiligt (Brömme et al. 1996). Im Rahmen dieser Arbeit konnte gezeigt werden, daß Kathepsin K nicht an der Prozessierung von Surfactant Protein B beteiligt ist, da es immunhistochemisch nur in Alveolarmakrophagen und im zilientragenden Bronchialepithel, nicht aber in den Typ-II-Pneumozyten und den Clara-Zellen lokalisiert werden konnte. 4.6 Kathepsin L 4.6.1 Untersuchungsergebnis Kathepsin L konnte immunhistochemisch in der Lunge in den Alveolarmakrophagen sowie dem zilientragenden Bronchialepithel nachgewiesen werden. 4.6.2 Allgemeine Charakteristika Das mature Kathepsin L, dessen kodierende Gene auf Chromosom 9q21-22 lokalisiert sind, liegt intralysosomal mit einem Molekulargewicht von 25 kDa vor (Reilly et al. 1989, Chauhan et al. 1993). Es verfügt über eine Variation seiner Karbohydratanteile, aus denen Formen mit unterschiedlichen isoelektrischen Punkten resultieren (Bohley et al. 1992). In den Lysosomen weist Kathepsin L von allen Kathepsinen die stärkste proteolytische Wirkung auf verschiedene Substrate auf. Die Substrate werden über Endopeptidaseaktivität gespalten (Bohley et al. 1992). 4. Diskussion - 51 - 4.6.3 Aufbau Der Synthesevorgang von Kathepsin L umfaßt eine 43 kDa schwere Präproform, ein 34 kDa schweres Intermediärprodukt und das 25 kDa schwere mature Enzym (Reilly et al.1989). Die Präproform besitzt 334 Aminosäuren und enthält folgende Abschnitte: 1. eine 17 Aminosäuren lange Präproregion am N-terminalen Ende (Position 1-17) 2. eine sich daran anschließende 96 Aminosäuren lange Proregion (Position 18-113) und 3. das mature Kathepsin (Position 114-334) mit dem C-terminalen Ende (Portnoy et al. 1986). Die Prozessierung des Präpropolypeptids zum Propolypeptid erfolgt gemäß einer Studie von Wiederanders et al. (1989) mit Hilfe von Kathepsin D, was durch den Nachweis von aktivem Kathepsin D im Bereich der GolgiMembranen und der Verlangsamung des Prozessierungsschrittes in Abwesenheit des Enzyms noch unterstützt wird (Wiederanders et al. 1989). Mason et al. (1985 und 1986) beschrieben ein 30 kDa schweres matures Kathepsin L, welches sich aus einer schweren Kette und einer leichten Kette zusammensetzt. Die schwere Kette, mit einem Molekulargewicht von 25 kDa, entstammt dem N-terminalen Ende des einkettigen Vorläuferproteins. Die leichte Kette, mit einem Molekulargewicht von fünf kDa, entstammt dagegen dem C-terminalen Ende des einkettigen Vorläuferproteins. In der schweren Kette liegt die für die Enzymwirkung wichtige katalytische Einheit im Bereich der AS Cys25. Über eine intramolekulare Disulfidbrücke erfolgt die Verbindung zur leichten Kette (Mason et al. 1985 und 1986). Konträr zu Mason et al. konnten Reilly et al. (1989) die Exprimierung der leichten Kette nicht nachweisen und gehen somit von einem maturen Kathepsin von 25 kDa aus (Reilly et al. 1989). Zur Synthese von maturem Kathepsin L sind Alveolarmakrophagen, Osteoklasten und die Sertolizellen des Hodens befähigt. In ihnen sind entsprechende mRNA Korrelate lokalisiert (Reilly et al. 1989, EricksonLawrence et al. 1991, Page et al. 1993). Die Expression von Kathepsin L durch menschliche Alveolarmakrophagen läuft voraussichtlich über Regulationsprozesse, die aber noch nicht weiter charakterisiert sind. Im 4. Diskussion - 52 - Gegensatz zu den Alveolarmakrophagen sind Monozyten nicht in der Lage, Kathepsin L zu exprimieren. Die Fähigkeit zur Bildung von Kathepsin L kann nicht durch die Transformation eines Monozyten zur Makrophage induziert werden (Reilly et al. 1989). In Bezug auf die Exprimierung von Kathepsin L scheint es Unterschiede innerhalb der einzelnen Makrophagenpopulationen zu geben. In Bezug auf die Synthese der mRNA kann man zwei unterschiedliche Formen nachweisen, die aber beide aus dem Gen auf Chromosom 9q21-22 hervorgehen. Die Unterschiede entstehen durch alternatives Splicen der cDNA und sind im Bereich des 5` translationalen Endes des Moleküls lokalisiert. Die verschiedenen Spliceprodukte beziehen sich auf die Transkription und die Stabilität des Kathepsins L. Ein weiteres Ergebnis dieser Studie ist der Nachweis von humaner Kathepsin L cDNA auf Chromosom 10q23-24, die aber bisher als „stumm“ gilt, da von dieser Region kein matures Enzym exprimiert wird (Chauhan et al. 1993). Kathepsin L wird weiterhin von malignen Zellen synthetisiert (Heidtmann et al. 1993). Denhardt et al. (1987) zeigten eine negative Korrelation zwischen der Menge der synthetisierten mRNA und der Ausprägung von Tumorprogression und -metastasierung auf (Denhardt et al. 1987). Die enzymatische Aktivität von maturem Kathepsin L wird durch einen neutralen und basischen pH-Wert gehemmt, da die α-helikalen Anteile der Sekundärstruktur irreversibel zerstört werden. Weitere Inhibitoren sind Cystatin C und Kininogen, die ihre Wirkung im Extrazellularraum entfalten sowie Stefin B. Dieses bildet mit Kathepsin L im neutralen pH-Bereich reversible Komplexe, die sich im sauren Bereich wieder voneinander lösen und eine erneute katalytische Aktivität des Enzyms ermöglichen (Barrett et al. 1984, Dufour et al. 1987, Turk et al. 1993). Ein relativ spezifischer Inhibitor ist Z-Phe-Phe-CHN2 sowie die Peptidaldehyde (zum Beispiel Leupeptin) (Leary et al. 1977, Watanabe et al. 1979, Green et al. 1980). Leupeptin ist ein reversibler Inhibitor für Kathepsin L. (Umezawa 1976). 4.6.4 Funktion Kathepsin L ist an der intralysosomalen Spaltung unterschiedlichster Proteine beteiligt, was aus der Vielzahl der Substrate ersichtlich wird. Es ermöglicht den Abbau von Myosin, Aktin, Troponin, Calmodulin, Tubulin, 4. Diskussion - 53 - Vimetin, Kollagen, Elastin, Hämoglobin, Albumin, Histonen, Insulin, Glukagon und einigen zytosolischen Enzymen mit Ausnahme der Laktatdehydrogenase (LDH) (Bohley et al. 1987). Diesen Substraten ist gemeinsam, daß sie in den Positionen P2 und P3 die für den Abbauprozeß nötigen hydrophoben Aminosäuren aufweisen. Hilfreich, aber nicht notwendig ist eine zusätzliche apolare Aminosäure in Position P1. Kathepsin L ist in Niere, Lunge, Leber, Milz, Gehirn, Magen und Herz sowie in Muskel- und Knochengewebe nachweisbar (Joseph et al. 1988, Furuhashi et al.1991, Bohley et al.1992, Brömme et al. 1996). Kathepsin L ist auch in pathologische Prozesse wie die Nekrose der Myofibrillen bei Myopathien, die myokardiale Ischämie und die renal-tubuläre Proteinurie involviert (Olbricht et al. 1986, Tsuchida et al. 1986, Kominami et al. 1987). Brömme et al. (1996) erbrachten den Nachweis der Lokalisation von Kathepsin L in Osteoklasten und extrazellulären Knochennischen. Der Abbau des Knochens durch dieses Enzym geht allerdings in sehr viel geringerem Maße vonstatten als der durch Kathepsin K (Brömme et al. 1996). Einschränkend ist hierbei jedoch auszuführen, daß Kathepsin L nur dann in der Lage ist extrazellulär tätig zu werden, wenn das Vorliegen eines sauren pH-Wertes gewährleistet ist. In malignen Tumoren lassen sich erhöhte Konzentrationen an Kathepsin L mRNA nachweisen (Denhardt et al. 1987). Diese Ergebnisse legen die Vermutung nahe, daß Kathepsin L aufgrund seiner Eigenschaft, die Matrixproteine abzubauen, in die Invasion von Tumorzellen involviert sein könnte. (Guinec et al. 1993). Furuhashi et al. (1991) zeigten, daß Kathepsin L nicht nur in den Abbau von intralysosomalen Substraten involviert ist, sondern weiterhin auch noch über die Fähigkeit verfügt, die Prozessierung biologisch aktiver Peptide aus ihren Vorstufen zu katalysieren (Furuhashi et al. 1991). 4.6.5 Die Bedeutung von Kathepsin L in der menschlichen Lunge Eine Studie von Heidtmann et al. (1993) zeigte, daß die Bildung einer „späten“ Form von Prokathepsin L möglicherweise eine wichtige Rolle bei der Tumorinvasion und Metastasierung von nicht kleinzelligen, malignen Lungentumoren zu spielen scheint. Das Prokathepsin L verfügt im 4. Diskussion - 54 - Gegensatz zum maturen Kathepsin L über Eigenschaften, die für die Tumorzellen „nützlich“ sind: 1. eine Akkumulation von Prokathepsin L im Extrazellularraum ist auch bei neutralem pH-Wert möglich, ohne daß die Aktivität des Enzyms verloren geht 2. Extrazelluläres Prokathepsin L wäre möglicherweise in der Lage, Zielstrukturen der extrazellulären Matrix zu durchdringen, um dann aktiviert zu werden 3. Prokathepsin L kann von immunkompetenten Zellen aufgenommen werden, in Interaktion mit der Antigenprozessierung treten, und so die Immunkompetenz des Wirtes unterdrücken Ein ähnliches Modell konnte für kleinzellige Lungentumoren, die über ein noch höheres Metastasierungspotential verfügen, nicht beschrieben werden. In ihnen ließen sich auch keine erhöhten Werte von Kathepsin L nachweisen. Weitere Studien über die Involvierung eines „späten“ Prokathepsins L in die Tumorinfiltration und Metastasierung sollten angeschlossen werden, da es sich bislang nur um Vermutungen handelt (Heidtmann et al. 1993). Bezogen auf die vorliegende Arbeit hat sich gezeigt, daß Kathepsin L als möglicher Kandidat für die Prozessierung von Surfactant Protein B nicht in Betracht kommt, da es immunhistochemisch weder in Typ-II-Pneumozyten noch in den Clara-Zell-spezifischen Granula lokalisiert werden konnte. 4.7 Kathepsin S 4.7.1 Untersuchungsergebnis Diese Untersuchung erbrachte immunhistochemisch den Nachweis, daß Kathepsin S ausschließlich in den Alveolarmakrophagen der menschlichen Lunge lokalisiert ist. 4.7.2 Allgemeine Charakteristika Humanes Kathepsin S, dessen kodierende Gene auf dem Chromosom 1q21 lokalisiert sind, ist eine Zysteinprotease mit einem Molekulargewicht von ca. 24 kDa und einer Länge von 217 Aminosäuren (Wideranders et al. 1991). Im Gegensatz zu den Kathepsinen B, H und L, die auch als Dimere vorliegen 4. Diskussion - 55 - können, konnte vom Kathepsin S nur ein Monomer nachgewiesen werden (Wiederanders et al. 1992, Shi et al. 1992). Das pH-Optimum für matures Kathepsin S liegt zwischen 5.0 und 8.0, womit es das einzige Kathepsin ist, das auch im basischen pH-Bereich noch aktiv ist (Kirschke et al. 1994). 4.7.3 Aufbau Die Gensequenzen für die Kodierung von Kathepsin S enthalten Informationen über 1. Exon eins bis fünf 2. Intron eins bis vier 3. Teile von Intron fünf und 4. einen ca. sieben Kilobasen schweren Anteil der 5` begrenzenden Region, der nicht über eine an der Genregulation beteiligte TATA- oder CAAT-Box verfügt. In die Genregulation involviert sind wahrscheinlich zwei SP1 und achtzehn AP1 Abschnitte im Kathepsin S, an welche die Transkriptionsfaktoren gebunden werden. Über die Transkriptionsfaktoren, die an der Regulation der Expression des humanen Kathepsins S beteiligt sind, ist noch nichts bekannt (Shi et al. 1994). Vorläufer des maturen humanen Kathepsins S ist ein aus 331 Aminosäuren und einem Molekulargewicht von 37 kDa bestehendes Präpropolypeptid mit folgenden Sequenzen: 1. einem 15 Aminosäuren langem Signalpeptid am NH2-terminalen Ende (Position 1-15) 2. einem 99 Aminosäuren langem Propeptid (Position 16-114) und 3. dem maturen ca. 24 kDa schweren und 217 Aminosäuren langem Kathepsin S (Position 115-331) (Wiederanders et al.1992). Im Gegensatz zu den anderen Kathepsinen ist im humanen Kathepsin S nur eine Glykolysierungseinheit nachweisbar, die im Bereich der Signalsequenz lokalisiert ist. Sie umfaßt die Aminosäuren Asn11, Ile10 und Thr9. Hieraus ergibt sich, daß die Modifikation zum maturen Kathepsin S erst nach Bindung an Mannose-6-Phosphat-Rezeptor und Transport zu den Lysosomen erfolgen kann (Wiederanders et al. 1992). 4. Diskussion - 56 - Die Aktivierung und Prozessierung zum maturen Kathepsin S erfolgt autokatalytisch bei einem pH-Wert von 4.0 (Brömme et al. 1993). Zur Synthese befähigt sind in hohem Maße die Alveolarmakrophagen der Lunge, die Milz und in einem geringeren Umfang das Gehirn, das Ileum, die Thyroidea sowie das Ovar. In ihnen lassen sich entsprechende mRNA Konzentrationen nachweisen (Quian et al. 1989, Petanceska et al. 1992). Inhibitoren für das katalytische Zentrum des maturen Kathepsins S sind E64, Cystatin C, Cbz-Phe-Phe-CHN2, Cbz-Tyr-Ala-CHN2 und Cbz-Tyr-Tyr(οbutyl)-CHN2 (Shi et al. 1992). 4.7.4 Funktion Kathepsin S konnte bisher nur in sehr wenigen Organen des humanen Organismus nachgewiesen werden. Erhöhte Konzentrationen finden sich in der Lunge, der Milz und dem Herzen. Die alleinige Expression von Kathepsin S in den Alveolarmakrophagen sowie die hohen Konzentrationen in der Milz, könnten auf eine mögliche Involvierung dieses Kathepsins in immunologische Prozesse hindeuten (Shi et al. 1994). Zu diesem Ergebnis kamen auch Riese et al. (1998), die eine Prozessierung der invarianten Kette vom αβ-Heterodimer des Endoproteinaseaktivität MHC-Moleküls unter Bildung der eines Klasse zwei funktionalen über Moleküls nachweisen konnten. Aus einer Inhibition von maturem Kathepsin S resultiert somit die Akkumulation von Klasse zwei assoziierten Intermediärprodukten der invarianten Kette, eine attenuierte Komplexbildung von MHC-Proteinen der Klasse zwei und ihren Antigenpeptiden sowie eine aufgehobene Antigenpräsentation. Eine Inhibition von Kathepsin S hat allerdings nur eine Modifikation und nicht eine vollständige Unterdrückung der Immunantwort zur Folge (Riese et al. 1998). 4.7.5 Die Bedeutung von Kathepsin S in der menschlichen Lunge In den Alveolarmakrophagen der Lunge besitzt Kathepsin S ein hohes, Elastin-abbauendes Potential. Über die Fähigkeit, Elastin abzubauen ist es, wie auch Kathepsin K, möglicherweise in die Entstehung von Lungenemphysemen involviert (Shi et al. 1992, Brömme et al. 1996). Im Rahmen dieser Studie konnte gezeigt werden, daß Kathepsin S immunhistochemisch ausschließlich in den Alveolarmakrophagen 4. Diskussion - 57 - nachweisbar war. Es ist somit als möglicher Kandidat, der in die Prozessierung des Surfactant Proteins B involviert ist, auszuschließen. 4.8 Napsin A 4.8.1 Untersuchungsergebnis Napsin A konnte immunhistochemisch sowohl in den Typ-II-Pneumozyten, Alveolarmakrophagen, als auch in den Clara-Zellen der Lunge lokalisiert werden. Sich daran anschließende immunelektronenmikroskopische Untersuchungen zeigten die ultrastrukturelle Verteilung von Napsin A in den einzelnen Zellorganellen. In den Typ-II-Pneumozyten ließ sich Napsin A in den multivesikulären Körperchen und in den Lamellenkörperchen über dem „projection core“ lokalisieren. In den Makrophagen fand es sich in Lysosomen. In den Clara-Zellen wurde eine Reaktion in den Clara-ZellGranula gefunden. 4.8.2 Allgemeine Charakteristika Die Napsine gehören wie die Kathepsine D und E zur Gruppe der Asparaginproteasen. Zwei Isoformen werden voneinander unterschieden: 1. Napsin A, das von der Lunge und der Niere und 2. Napsin B, das nur von immunkompetenten Zellen exprimiert wird (Schauer-Vukasinovic et al. 2000). Matures Napsin A liegt als Monomer mit einem Molekulargewicht von ca. 38 kDa vor (Schauer-Vukasinovic 1999). Sein pH-Optimum liegt zwischen 5.0 und 6.0, wobei eine gewisse Stabilität auch noch bei einem pH-Wert von 7.0 zu beobachten ist (Schauer-Vukasinovic et al. 2000) 4.8.3 Aufbau Vorläufer des maturen Napsins A ist das aus 420 Aminosäuren bestehende Präpropolypeptid, das sich aus folgenden Abschnitten zusammensetzt: 1. einem 24 Aminosäuren langem Signalpeptid im Bereich des NH2terminalen Endes (Position 1-24) 2. einem sich daran anschließenden Propeptid (Position 25-64) 3. dem maturen Enzym (Position 65-402) und 4. Diskussion - 58 - 4. einer C-terminalen Extension (Position 403-420) (Tatnell et al.1998). Unter Abspaltung des N- und C-terminalen Endes entsteht das einkettige, ca. 38 kDa schwere mature Napsin A (Schauer-Vukasinovic et al. 1999). Weiterhin besitzt humanes Napsin A drei Glykolysierungseinheiten und drei Disulfidbrücken. Die Glykolysierungseinheit in Position Asn26-Phe27-Thr28 entspricht der Einheit im Kathepsin E und die in Position Asn67-Gly68-Thr69 der im Kathepsin D und Renin. Die dritte Einheit ist von den anderen Asparaginproteasen unabhängig (Tatnell et al. 1998). Die unterschiedliche Glykolysierung dieser Einheiten führt wahrscheinlich zum Auftreten der Isoformen des Napsins A. Die Isoformen besitzen zum Teil ein höheres, teilweise auch ein niedrigeres Molekulargewicht, bezogen auf das Molekulargewicht des maturen Napsins A (Chuman et al. 1999). Napsin A zeigt die größte Strukturhomologie mit Kathepsin D. In Bezug auf die cDNA und die Aminosäuresequenz findet man eine 47.1%ige und 48.3%ige Übereinstimmung (Tatnell et al. 1998, Schauer-Vukasinovic et al. 1999). Napsin B unterscheidet sich von Napsin A zum einen durch das Fehlen eines translationalen Stop-Codons und zum anderen durch eine andersartige Aminosäuresequenz (Tatnell et al. 1998, Schauer-Vukasinovic et al. 1999). Das aktive Zentrum der Asparaginproteasen enthält zwei Asp-Reste, die in unterschiedlichen Domänen des Enzyms lokalisiert und an der katalytischen Funktion beteiligt sind (Wingo et al. 1999). Diese lassen sich möglicherweise auch im Napsin nachweisen, da es sich hierbei ebenfalls um eine Asparaginprotease handelt. 4.8.4 Funktion Napsin A läßt sich nur in der Niere und in der Lunge lokalisieren. In der Niere ist es überwiegend im Epithel des proximalen Tubulus nachweisbar, was zu der Vermutung führte, daß es an den aktiven Transportprozessen, die in diesem Nierenabschnitt stattfinden, beteiligt ist (Schauer-Vukasinovic et al. 1999 und 2000). In der Lunge konnten Schauer-Vukasinovic et al. (1999) Napsin A immunhistochemisch in Pneumozyten, Alveolarmakrophagen sowie in nicht näher charakterisierten Epithelien der terminalen und respiratorischen Brochioli nachweisen (Schauer-Vukasinovic et al. 1999). 4. Diskussion - 59 - Bereits 1992 vermuteten Weaver et al., daß entweder Kathepsin D oder eine Aspartyl-Protease in die Prozessierung von Surfactant Protein B involviert ist. Sie stützten ihre Vermutung auf die Ergebnisse ihrer Studie, die zeigte, daß die Prozessierung des PräproSp-B zum 25 kDa schweren Intermediärprodukt nur bei sauren pH-Werten ablief und über Inhibitoren des katalytischen Zentrums der Asparaginproteasen gehemmt werden konnte (Weaver et al. 1992). Chuman et al. (1999) zeigten über in situ Hybridisierung, daß Napsin A in den Typ-II-Pneumozyten lokalisiert ist. Sie spekulierten aufgrund der Ergebnisse von Weaver et al. (1992), daß es sich bei der an der Prozessierung von SP-B beteiligten Aspartyl-Protease möglicherweise um Napsin A handeln könnte (Chuman et al. 1999). Weiterhin zeigt sich, daß Napsin A in über 90% der primären Adenokarzinomen der Lunge nachweisbar ist. Bislang ist es noch spekulativ, ob Napsin A möglicherweise in der Zukunft als Marker zur Unterscheidung zwischen primären und sekundären Adenokarzinomen der Lunge eingesetzt werden kann (Chuman et al. 1999). 4.8.5 Napsin A und die Prozessierung von Surfactant Protein B Napsin A konnte immunhistochemisch in den Typ-II-Pneumozyten und den Alveolarmakrophagen lokalisiert werden. Zur exakten Lokalisation von Napsin A in Bezug auf die einzelnen Zellorganellen in den Typ-IIPneumozyten wurden immunelektronenmikroskopische Untersuchungen angeschlossen. Hierüber konnte Napsin A im Typ-II-Pneumozyten in den multivesikulären Körperchen und den Lamellenkörperchen nachgewiesen werden. Weiterhin konnte Napsin A immunelektronenmikroskopisch in den Clara-Zell-spezifischen Granula lokalisiert werden. Aufgrund seiner Lokalisation ist Napsin A ein möglicher Kandidat, der in den Typ-IIPneumozyten im Bereich der multivesikulären Körperchen und möglicherweise auch in den Clara-Zellen in die Prozessierung des Surfactant Proteins B involviert ist. Weitere Erläuterungen folgen nach der Abhandlung über SP-B. 4. Diskussion 4.9 - 60 - Surfactant Die Hauptfunktion des Surfactants ist es, die Oberflächenspannung der Alveolen-Luft-Grenze herabzusetzen. Er setzt sich zu 90% aus Lipiden und zu 10% aus Proteinen zusammen. Der Lipidanteil besteht zu 80-90% aus Phospholipiden, deren Hauptanteil mit ca. 60% das Dipalmitoylphosphatidylcholin (DPPC) ausmacht (Haagsmann et al. 1991). Seine Aufgabe ist es, bei niedrigem pulmonalem Volumen, die Oberflächenspannung der Alveolen-Luft-Grenze auf Werte unter 10mN/m herabzusetzen (Clements 1977). Ebenfalls im Surfactant nachweisbar sind Phosphatidylglycerol (PG) und neutrale Lipide, von denen das Cholesterol den größten Anteil stellt (Haagsmann et al. 1991). Bislang sind vier Surfactant assoziierte Proteine charakterisiert: SP-A, SP-B, SP-C und SP-D (Haagsman et al. 1991). Der Surfactant wird in den Typ-II-Pneumozyten synthetisiert und in den Lamellenkörperchen der Typ-II-Pneumozyten gespeichert (Ballard et al. 1989). Auf einen entsprechenden Reiz hin (zum Beispiel ein tiefer Atemzug) erfolgt die Freisetzung der Lamellenkörperchen in die Alveole und es kommt zur Bildung des tubulären Myelins, aus dem sich ein „Monolayer“ bildet, der die Alveole auskleidet (Haagsman et al. 1991). Eine Studie von Williams et al. (1991) zeigte, daß die Bildung des tubulären Myelins mit Hilfe von SP-A, SP-B, Lipiden sowie Kalziumionen erfolgt und daß SP-C nicht in der Lage ist, SP-B oder SP-A bei der Bildung dieses Myelins zu ersetzen. In Abwesenheit von SP-B und in Anwesenheit von SPC konnten nur multilamelläre Aggregate und einzelne diskoide Partikel nachgewiesen werden. Auch in einer Mischung von Lipiden mit SP-B und SP-C fanden sich nur diskoide Partikel. Hieraus ergibt sich, daß SP-A und SP-B die entscheidenden Komponenten für die Bildung des tubulären Myelins darstellen (Williams et al. 1991). 4. Diskussion - 61 - 4.10 Surfactant Protein B 4.10.1 Untersuchungsergebnis Surfactant Protein B konnte immunhistochemisch in den Typ-II-Pneumozyten und den Clara-Zellen der Lunge nachgewiesen werden. In den Typ-IIPneumozyten fand sich eine Kolokalisation mit Kathepsin H und Napsin A. In den Clara-Zellen dagegen konnte nur eine Kolokalisation mit Napsin A gezeigt werden. 4.10.2 Allgemeine Charakteristika Humanes matures Surfactant Protein B ist ein acht kDa schweres und 79 Aminosäuren langes hydrophobes Protein, dessen kodierende Gene auf Chromosom zwei lokalisiert sind (Emrie et al. 1988, Johansson et al. 1992). Im intraalveolären Surfactant liegt es als 18 kDa schwerer Dimer vor, der durch die Verbindung zweier Monomere über eine Disulfidbrücke entsteht. An der Stabilität des Moleküls sind weitere drei intramolekulare Disulfidbrücken beteiligt (Johansson et al. 1991 und 1992). 4.10.3 Aufbau Surfactant Protein B wird von Typ-II-Pneumozyten und von den Clara-Zellen der Lunge exprimiert, in denen sich entsprechende mRNA Korrelate lokalisieren lassen (Phelps und Floros 1991). Vorläufer des maturen Surfactant Proteins B ist ein 381 Aminosäuren langes und 40 kDa schweres Präproprotein, das sich aus folgenden Abschnitten zusammensetzt: 1. einer 20-23 Aminosäuren langen Signalsequenz am N-terminalen Ende (Position 1-23) 2. einem sich daran anschließenden ca. 176 Aminosäuren langem Propeptid (Position 24-199) 3. dem maturen SP-B (Position 200-279) und 4. dem 102 Aminosäuren langem Peptid am C-terminalen Ende (Position 280-381) (O`Reilly et al. 1989). Mit Hilfe der Signalsequenz erfolgt der Transport des Präproproteins in das Lumen des endoplasmatischen Retikulums, wo es zur Abspaltung dieses Peptids und zur Glykolysierung von Asparagin311 im COOH-terminalen 4. Diskussion - 62 - Propeptid unter Bildung eines 42 kDa schweren Intermediärproduktes kommt (O`Reilly et al. 1989, Weaver et al. 1992, Whitsett et al. 1995). Über die funktionelle Bedeutung des glykolysierten Asparagins liegen noch keine Erkenntnisse vor (Whitsett et al.1995). In zwei weiteren Teilschritten erfolgt die Abspaltung des Propeptids am Nterminalen Ende. Es kommt zunächst zur Prozessierung der Kette im Bereich der Aminosäure Gly190, wobei ein Intermediärprodukt mit einem Molekulargewicht von 25 kDa entsteht. Dieser Schritt ist im Golgi-Komplex lokalisiert (Guttentag et al. 1998). Der noch verbleibende Anteil im Bereich des N-terminalen Endes dient als „Wegweiser“ für SP-B zu den Lamellenkörperchen und wird erst im Bereich der multivesikulären Körperchen nach Prozessierung des COOH-terminalen Endes (im Bereich der AS Met279) abgespalten. Die Prozessierung des COOH-terminalen Endes erfolgt zwischen den AS Gln200 und Phe201 (Pryhuber et al. 1998, Guttentag 1998, Korimilli et al. 2000). Eine in vitro Untersuchung von Weaver et al. (1992) zeigte, daß die Prozessierung zur 25 kDa schweren Intermediärform durch Kathepsin D oder eine Kathepsin D ähnliche Aspartyl-Protease katalysiert wird (Weaver et al. 1992). Die Prozessierung des COOH- und des verbleibenden NH2-terminalen Endes unterliegen wahrscheinlich einer hormonellen Regulation (Guttentag et al.1998). Angaben über mögliche beteiligte Enzyme liegen noch nicht vor. Das mature SP-B liegt intraalveolär als 18 kDa schwerer Dimer vor, der durch die Verbindung zweier Monomere über eine intermolekulare Disulfidbrücke in der Position Cys48 gebildet wird (Guttentag et al. 1998, Lin et al.1999). Gespeichert wird SP-B in den Lamellenkörperchen der Typ-IIPneumozyten, aus denen es in die Alveole freigesetzt wird. Im Rahmen des „Recycling“ kommt es zu einer Wiederaufnahme des SP-B durch die Typ-IIPneumozyten. Die Endozytose verläuft über einen rezeptorunabhängigen Vorgang. Ein Teil des wiederaufgenommenen SP-B wird degradiert und der andere Teil wird bei Bedarf erneut in die Alveole abgegeben (Pryhuber et al. 1998). Die Vorstufen des maturen Surfactant Proteins B lassen sich im endoplasmatischen Retikulum, dem Golgi-Komplex und den multivesikulären 4. Diskussion - 63 - Körperchen der Typ-II-Pneumozyten nachweisen. Matures SP-B ist dagegen nur in den multivesikulären Körperchen und den Lamellenkörperchen lokalisiert. Synthese und Prozessierung des PräproSP-B zum maturen SP-B sind also auf Stufe der multivesikulären Körperchen abgeschlossen (Voorhout et al. 1992). Die Expression wird über Glukokortikoide (zum Beispiel Dexamethason) forciert. Sie bewirken eine Induktion der Transkription und über posttranslatorische Modifikationen die erhöhte Synthese der SP-B mRNA (O`Reilly et al. 1991). Über einen ähnlichen, wenn auch eher abgeschwächten Wirkungsmechanismus verfügt auch cAMP (Ballard et al. 1989). Der hepatozytäre nukleäre Faktor 3α (HNF3α) und der thyroidale Transkriptionsfaktor 1 (TTF1) binden dagegen im Bereich des Promotors und bewirken auf diesem Wege eine Erhöhung der Transkriptionsrate (Bohinski et al. 1994). Inhibitoren für den Syntheseweg sind unter anderem Phorbolester und der Tumornekrosefaktor-α. Sie entfalten vermutlich ihre Wirkung über eine Modifikation der mRNA Rate (Whitsett et al. 1992). 4.10.4 Funktion SP-B ist zusammen mit SP-A, Lipiden und Ca2+-Ionen in der Lage, tubuläres Myelin auszubilden, welches intraalveolär zur Bildung eines „Monolayers“ führt, der die Alveole auskleidet (Suzuki et al. 1989, Williams et al. 1991). Weiterhin ist SP-B in der Lage, seine positiv geladenen Aminosäuren an die negativ geladenen Aminosäuren der Surfactantlipide (zum Beispiel Phosphatidylcholin, DPPG) zu binden. Über diesen Mechanismus wird die Surfactantfunktion, die in der Herabsetzung der Oberflächenspannung zwischen Alveole und Luft liegt, verbessert. Erreicht wird dieser Effekt durch die verbesserte Adsorption, Spreizung und Insertion der Surfactantlipide in den Surfactant (Baatz et al. 1990, Whitsett et al. 1995, Nag et al. 1999). Dieser Effekt wird noch unterstützt durch die Fähigkeit von SP-B, der Zerstörung der Surfactantlipide durch Plasmaproteine (zum Beispiel Fibrinogen) entgegenzuwirken (Venkitaraman et al. 1991, Seeger et al. 1992). 4. Diskussion - 64 - In vitro Studien haben gezeigt, daß SP-B die Wiederaufnahme der Surfactantlipide in den Typ-II-Pneumozyten stimuliert (Rice et al. 1989). Anhand einer Studie mit Mäusen von Clark et. al. (1995) konnte der Nachweis erbracht werden, daß ein absoluter Mangel von SP-B mit dem Leben nicht vereinbar ist. SP-B -/- negative Mäuse starben kurz nach der Geburt, ohne daß es zur Entfaltung der Lunge kam, wohingegen SP-B +/positive Mäuse nach der Geburt eine normale Belüftung des pulmonalen Gewebes mit einer allerdings verminderten Lungencompliance und „air trapping“ aufwiesen (Clark et al. 1995, Yusen et al.1999). Weiterführende Studien von Lin et al. (1999) ergaben, daß die selektive Bildung von SP-B in den Clara-Zellen bei SP-B -/- Mäusen nicht zum postnatalen Überleben dieser Tiere führte, da es nur zur Bildung des 25 kDa schweren Intermediärproduktes, nicht aber zur Bildung eines funktionalen maturen SPB durch die Clara-Zellen kam. Die Aufnahme des von den Clara-Zellen in die Alveole sezernierten Intermediärproduktes durch die Typ-II-Pneumozyten zur weiteren Prozessierung zum maturen SP-B war nicht möglich (Lin et al. 1999). Bei Neugeborenen führt ein Mangel an SP-B, der zum Beispiel durch die Insertion von zwei Basenpaaren in das Codon 121 der SP-B mRNA (Mutation 121 ins2) ausgelöst wird, postnatal zu einer respiratorischen Insuffizienz („infant respiratory distress syndrom“), die ohne eine Lungentransplantation innerhalb der ersten Lebenswochen zum Tode führt (Nogee et al. 2000). Eine weitere Aufgabe von SP-B ist seine Involvierung in die Prozessierung von SP-C. Das COOH-terminale Ende scheint an der Prozessierung von proSP-C beteiligt zu sein, da ein Fehlen dieser Domäne in der Mäuselunge zur Akkumulation eines elf kDa schweren Intermediärproduktes, nicht aber zur Bildung von maturem SP-C führte (Akinbi et al.1997). Lin et al. (1999) zeigten, daß es sowohl unter physiologischen als auch unter pathologischen Bedingungen zum alternativen Splicen der SP-B mRNA kommen kann. Sie konnten feststellen, daß bei pulmonalen Erkrankungen die Menge an aufgetretenen Spliceprodukten höher ist als unter physiologischen Bedingungen. Möglicherweise stehen diese modifizierten 4. Diskussion - 65 - SP-B mRNAs in einem Zusammenhang mit dem Auftreten von pulmonalen Erkrankungen (Lin et al. 1999). 4.11 Die Bedeutung von Kathepsin H und Napsin A in der Prozessierung des Surfactant Proteins B Im Rahmen dieser Studie wurde immunhistochemisch zunächst die Verteilung der Kathepsine der Familie Papainproteasen B, H, K, L und S sowie der Familie der Pepsinproteasen D, E und Napsin A in der menschlichen Lunge charakterisiert. Als einzige Proteasen ließen sich Kathepsin H und Napsin A in den Typ-II-Pneumozyten nachweisen. Napsin A fand sich im Gegensatz zu Kathepsin H auch in den Clara-Zellen. In den Clara-Zellen ist es mit pro SP-B kolokalisiert. Doppellabeling- Untersuchungen zeigten eine Kolokalisation von SP-B mit Kathepsin H und Napsin A in den cuboidalen Alveolardeckepithelien. Zur weiteren Charakterisierung der Zellorganellen, in denen sich Kathepsin H und Napsin A darstellen ließen, wurden immunelektronenmikroskopische Untersuchungen Kathepsin angeschlossen. H multivesikulären und Im Napsin Körperchen Rahmen A in den dieser Untersuchung Typ-II-Pneumozyten nachgewiesen werden. konnten in Aufgrund den ihrer Lokalisation kommen nur Kathepsin H und Napsin A als mögliche Kandidaten für die Prozessierung des Surfactant Proteins B in Frage. Eine in vitro Studie von Weaver et al. (1992) an der Rattenlunge zeigte, daß möglicherweise Kathepsin D oder eine Kathepsin D ähnliche AspartylProtease in die Prozessierung des PräproSP-B zum 25 kDa schweren Intermediärprodukt involviert ist. Seine Ergebnisse stützen sich unter anderem darauf, daß die Prozessierungsschritte nur bei sauren pH-Werten ablaufen und über Inhibitoren (zum Beispiel Pepstatin A), die auf die katalytische Einheit der Asparaginproteasen einwirken, gehemmt werden können. Substanzen, die die katalytische Aktivität der Zysteinproteasen hemmen, zeigten keine Wirkung (Weaver et al. 1992). Yarus et al. (1997) führten Untersuchungen an transgenen Mäusen durch, welche SP-B über die Brustdrüse abgaben. In der sekretierten Milch konnte nur das ca. 40 kDa schwere Präproprotein nachgewiesen werden. Ein 25 kDa schweres Intermediärprodukt fand sich nicht, obwohl in den Zellen der Brustdrüse Kathepsin D in hohen Konzentrationen vorlag. Sie kamen zu dem 4. Diskussion - 66 - Ergebnis, daß Kathepsin D in vivo nicht in die Prozessierung des Surfactant Proteins B involviert sein kann (Yarus et al. 1997). Im Rahmen dieser Studie an gesunden nicht transplantierten menschlichen Lungen zeigte sich ebenfalls, daß Kathepsin D in der menschlichen Lunge nicht in die Prozessierung des Surfactant Proteins B involviert sein kann, da sich Kathepsin D immunhistochemisch und immunelektronenmikroskopisch weder in Typ-II-Pneumozyten noch in Clara-Zellen nachweisen ließ. Schauer-Vukasinovic et al. charakterisierten 1999 einen weiteren „Angehörigen“ der Familie der Pepsinproteasen. Es handelte sich hierbei um das Napsin A, das sich im Lungengewebe in Typ-II-Pneumozyten, den Alveolarmakrophagen, dem respiratorischen Epithel, den Plasmazellen und den Lymphozyten lokalisieren ließ (Schauer-Vukasinovic et al. 1999). Ergänzend zu diesen Ergebnissen konnte in dieser Studie Napsin A in multivesikulären Körperchen und Lamellenkörperchen in Typ-II-Pneumozyten sowie in Clara-Zell-Granula lokalisiert werden. Matures Napsin A zeigt eine ausgeprägte Homologie zu Kathepsin D , die sich auf die cDNA (47,1%) und die Aminosäuresequenz (48,3%) bezieht. Weiterhin finden sich Ähnlichkeiten im Bereich der Glykolysierungseinheiten. Die Glykolysierungseinheit in Position Asn67-Gly68-Thr69 ist in ihrem Lokalisationsort identisch zu den Lokalisationsorten im Kathepsin D und im Renin (Tatnell et al. 1998). Setzt man die heutigen Erkenntnisse von Tatnell et al. (1998) und SchauerVukasinovic et al. (1999) in Beziehung zu den Egebnissen von Weaver et al. (1992), liegt die Vermutung nahe, daß es sich bei der von Weaver et al. (1992) postulierten Asparaginprotease möglicherweise um Napsin A handelt (Tatnell et al. 1998, Schauer-Vukasinovic et al. 1999, Weaver et al. 1992). Die vorliegenden Ergebnisse dieser Arbeit deuten darauf hin, daß Napsin A auch an der Prozessierung des proSP-B in Typ-II-Pneumozyten und ClaraZellen beteiligt ist. Die Prozessierung des Präproproteins findet in ClaraZellen wahrscheinlich nur bis zur Stufe des 25 kDa schweren Intermediärproduktes statt, das sich sowohl immunhistochemisch im Lumen der Bronchioli, als auch der Broncho-Alveolären-Lavage-Flüssigkeit nachweisen läßt. Matures Surfactant Protein B konnte immunhistochemisch in den Clara-Zellen nicht eindeutig lokalisiert werden. Der Mangel an maturem SP-B in Clara-Zellen kann möglicherweise auf das Fehlen von 4. Diskussion - 67 - Kathepsin H in diesen Zellen zurückzuführen sein, so daß die weitere Prozessierung zum maturen SP-B nicht erfolgen kann. Im Gegensatz Präproproteins zu den Clara-Zellen findet die Prozessierung des in den Typ-II-Pneumozyten bis zum maturen Surfactant Protein B statt, wobei dieser Vorgang bereits im Bereich der multivesikulären Körperchen abgeschlossen ist. Zusammenfassend legen die Ergebnisse dieser Studie die Vermutung nahe, daß die Prozessierung bis zum 25 kDa Intermediärprodukt mit Hilfe von Napsin A erfolgt, während die weiteren Prozessierungsschritte, die Typ-II-Zell-spezifisch sind, durch Kathepsin H katalysiert werden. Noch nicht veröffentlichte weiterführende biochemische Untersuchungen von Herrn Dr. F. Brasch (Institut für Pathologie, Berufsgenossenschaftliche Universitätskliniken Bergmannsheil) und Herrn Dr. F. Bühling (Institut für Immunologie, Universität Magdeburg) zeigen bereits, daß Kathepsin H und Napsin A in die Prozessierung des Surfactant Proteins B involviert sind. 4.12 Clara-Zellen 4.12.1 Allgemeine Charakteristika Die Clara-Zellen sind eine Gruppe von nicht-zilientragenden sekretorischen Zellen im pulmonalen Gewebe, die 1937 erstmals von Max Clara beschrieben wurden. 1967 postulierte Niden, daß die Clara-Zellen in der Lage seien, den pulmonalen Surfactant zu bilden, der dann von den Typ-II-Pneumozyten über Endozytose aufgenommen und in den Lysosomen gespeichert wird (Niden 1967). Weiterführende Studien von Clements (1970) und Askin et al. (1971) und sollten dieses Ergebnis widerlegen und zeigen, daß der Surfactant intraalveolar von den Typ-II-Pneumozyten gebildet wird (Clements 1970, Askin et al. 1971). Heute weiß man, daß die Synthese des Surfactant in den Typ-II-Pneumozyten stattfindet (Ballard et al. 1989). In den Clara-Zellen konnten weiterhin die Surfactant Proteine A, B und D nachgewiesen werden sowie ein Teil der Surfactantlipide gebunden an das „Clara-Cell specific“ Protein CC10 (Singh et al. 1997). Ob diese Bestandteile nur in den Clara-Zellen gespeichert oder auch von ihnen synthetisiert werden, ist noch nicht geklärt. 4. Diskussion - 68 - Phelps und Floros charkterisierten 1991 die Unterschiede in der Lokalisation der mRNA der Surfactant assoziierten Proteine A und B in Bezug auf die humane und die Rattenlunge. In der Rattenlunge konnten sie die mRNA von SP-A und SP-B in Typ-II-Pneumozyten und in nicht zilientragenden Bronchiolarzellen nachweisen. Im humanen Lungengewebe lokalisierten sie die mRNA von SP-A und SP-B in Typ-II-Zellen sowie die SP-B mRNA in nicht zilientragenden Bronchiolarzellen (Phelps und Floros 1991). Die Clara-Zelle läßt sich in CC10-positive und CC10-negative Zellen einteilen (Singh et al. 1997). Die Ergebnisse der vorliegenden Untersuchung zeigen, daß proSP-B in CC10-positiven Clara-Zellen synthetisiert, vermutlich in diesen Zellen aber nur inkomplett bis zum 25 kDa schweren Intermediärprodukt prozessiert wird. 4.12.2 Aufbau des „Clara-Cell specific“ Proteins CC10 Das 10 kDa schwere „Clara-Cell specific“ (CC10) Protein, dessen kodierende Gene auf dem Chromosom 11p12-q13 lokalisiert sind, setzt sich aus einem 91 Aminosäuren langem Proprotein zusammen, das folgende Sequenzen enthält: 1. eine Signalsequenz am N-terminalen Ende (Position 1-21) und 2. das mature CC10 (Position 22-91). Matures CC10 liegt als Dimer vor, der sich aus zwei Monomeren von jeweils 70 Aminosäuren Länge und einem Molekulargewicht von jeweils fünf kDa über Verbindung mit zwei antiparallelen Disulfidbrücken in den Positionen Cys3-Cys69` und Cys3`-Cys69 zusammensetzt (Singh et al. 1988, Umland et al. 1994). Die Monomere enthalten vier α-Helices in den Positionen Pro4Leu, Pro18-Leu27, Gln32-Asp46 und Gln50-Ser66, die über kurze Schleifen in β-Formation verbunden sind (Umland et al. 1994). Weiterhin verfügt das CC10-Protein in seiner Struktur über eine „hydrophobe Tasche“, die durch die Polymerisation der beiden Monomere zum Dimer entsteht. Nach Sekretion des CC10-Proteins aus der Clara-Zelle in den Bronchiolarraum können an die „hydrophobe Tasche“ Lipide, wie zum Beispiel Phospholipase A2, Phosphatidylcholin und Phosphatidylinositol, binden (Singh et al. 1990, Umland et al. 1994). 4. Diskussion - 69 - In Tierversuchen an Kaninchenlungen konnte gezeigt werden, daß die Expression von CC10-Protein über Kortison erhöht werden konnte. Ob die Expressionsrate auch in der humanen Lunge über Kortison erhöht werden kann, kann durch diese Tierversuche nicht eindeutig geklärt werden, da sich humanes- und Kaninchen-CC10-Protein in ihrem Aufbau unterscheiden (Wolf et al. 1992). Singh et al. (1988) konnten die CC10-positiven Clara-Zellen in Bronchiolen mit einem Durchmesser von fünf mm oder weniger lokalisieren. In cuboidalen, nicht zilientragenden Zellen der respiratorischen Bronchiolen und den proximalen Bronchiolen waren sie nicht nachweisbar (Singh et al. 1988). 4.12.3 Funktion der Clara-Zellen Über ihre Fähigkeit, Phospholipase A2 in der „hydrophoben Tasche“ zu binden, sind die CC10-Proteine der Clara-Zellen möglicherweise in die Regulation von Entzündungsprozessen in den Bronchiolen involviert, wobei man sich diesen Mechanismus folgendermaßen vorstellen könnte: Phospholipase A2 ist in die Produktion der Arachidonsäure involviert, die wiederum an der Bildung der Entzündungsmediatoren Prostaglandine und Leukotriene beteiligt ist (Hay et al. 1995, Singh et al. 1990). Eine Inhibition der Phosphololipase A2 würde somit möglicherweise zu einer Verminderung von Entzündungsmediatoren führen. Diese These wird zusätzlich durch die Tatsache gestützt, daß die Gene für das CC10-Protein der Clara-Zellen in einer Region auf Chromosom elf lokalisiert sind, in der sich noch weitere für die Regulation an Entzündungsprozessen beteiligte Gene befinden (Singh et al. 1997). Ferner zeigten Lesur et al. (1995) in einer in vitro Studie, daß das CC10-Protein eine Phospholipase-A2-vermittelte Hemmung der Fibroblastenmigration bewirkt. Ein Mangel an CC10-Protein führte zum Auftreten einer Lungenfibrose (Lesur et al. 1995). Als eine weitere Aufgabe der Clara-Zellen zeigten Brody et al. (1987) in Tierversuchen eine Involvierung in die Regeneration des Bronchialepithels. Sie installierten Clara-Zellen des Kaninchens in die „nackte“ (nach Entfernung des eigentlichen Trachealepithels) Trachea von Ratten und konnten eine de novo Bildung von Zellen beobachten. Es hat sich allerdings gezeigt, daß es nur zur Neubildung von Clara-Zellen und zilientragenden 4. Diskussion - 70 - Zellen kam. Eine Neubildung von Basalzellen und mukösen Drüsen konnte nicht beobachtet werden (Brody et al. 1987). 4.13 Die Prozessierung des Surfactant Proteins B in den Clara-ZellGranula Im Rahmen dieser Studie konnte immunhistochemisch in den CC10positiven Clara-Zellen in den Bronchiolen eindeutig proSP-B nachgewiesen werden, wobei jedoch nur wenige Clara-Zellen mit dem Antikörper gegen matures SP-B schwach angefärbt wurden. Diese schwach positive Reaktion in den Clara-Zellen stellt möglicherweise eine Kreuzreaktion mit proSP-B dar. Die Prozessierung des proSP-B findet in den Clara-Zellen wahrscheinlich nur bis zur Stufe des 25 kDa schweren Intermediärproduktes statt, welches sich biochemisch in der BAL-Flüssigkeit und immunhistochemisch im Lumen der Bronchioli nachweisen ließ. Hieraus ergibt sich, daß die Clara-Zellen in der Lage sind, dieses Intermediärprodukt zu sezernieren. Weiterhin zeigte diese Studie, daß in den Clara-Zell-Granula nur Napsin A, nicht aber Kathepsin H nachweisbar ist. 5. Zusammenfassung - 71 - 5 Zusammenfassung Bei den Zysteinproteasen und Asparaginproteasen handelt es sich um zwei Familien von lysosomalen Proteasen, über deren Verteilung und Funktion in der menschlichen Lunge bisher nur wenig bekannt ist. Ziel der vorliegenden Arbeit war es, die Verteilung der Zysteinproteasen Kathepsin B, H, K, L und S sowie der Asparaginproteasen Kathepsin D, E und Napsin A in der humanen Lunge zu charakterisieren, insbesondere unter der Fragestellung, welche der Proteasen aufgrund ihrer Lokalisation in die Prozessierung des Surfactant Proteins B involviert sein könnten. Untersucht wurden humane Lungengewebsproben von Explantaten acht gesunder erwachsener Individuen. Für die immunhistochemischen Untersuchungen wurden Antikörper gegen die Zysteinproteasen Kathepsin B, H, K, L und S, die Asparaginproteasen Kathepsin D, E und Napsin A, gegen das Surfactant Protein B sowie die Proform des SP-B (proSP-B) und das ClaraZell-spezifische Protein CC10 eingesetzt. Zusätzlich wurde immun- elektronenmikroskopisch die Verteilung der Kathepsine D, H und Napsin A untersucht. Immunhistochemisch fanden sich in den zilientragenden Bronchialepithelien und den Alveolarmakrophagen die Kathepsine B, D, H, K und L. Kathepsin D ließ sich ultrastrukturell nur in den Lysosomen der Kinozilien tragenden Bronchialepithelien lokalisieren. Kathepsin S fand sich immunhistochemisch ausschließlich in Alveolarmakrophagen, in denen sich auch Napsin A nachweisen ließ. Kathepsin E ließ sich in CC10-negativen Clara-Zellen im Übergangsbereich der Bronchioli terminales in Bronchioli respiratorii lokalisieren. Kathepsin H und Napsin A ließen sich als einzige Proteasen in den cuboidalen Alveolardeckepithelien nachweisen. chungen zeigten eine Kolokalisation Doppellabeling-Untersu- mit SP-B in diesen Zellen. Immunelektronenmikroskopisch ließen sich Kathepsin H und Napsin A in den Lamellenkörperchen und den multivesikulären Körperchen der Typ-IIPneumozyten nachweisen. Napsin A fand sich ferner in den Granula der Clara-Zellen kolokalisiert mit proSP-B. In der BAL ließ sich ein 5. Zusammenfassung - 72 - Intermediärprodukt des proSP-B nachweisen, welches von den Clara-Zellen in den Bronchioli sezerniert wird. Zusammenfassend zeigen die erzielten Ergebnisse, daß sich die untersuchten lysosomalen Proteasen in ihrer zellulären Verteilung in der humanen Lunge unterscheiden und aufgrund ihrer Lokalisation nur Kathepsin H und Napsin A als Kandidaten für die Prozessierung des Surfactant Proteins B in Typ-II-Pneumozyten in Frage kommen. In den Clara-Zellen ist nur Napsin A ein Kandidat, der in die Prozessierung des Surfactant Proteins B involviert ist, wobei sich aus den Untersuchungen indirekt Hinweise ergaben, daß das proSP-B nur bis zu einem 25 kDa schweren Intermediärprodukt prozessiert wird, das von den Clara-Zellen sezerniert wird und in der BAL nachweisbar ist. Diese unvollständige Prozessierung des proSP-B in Clara-Zellen ist möglicherweise durch das Fehlen von Kathepsin H in diesen Zellen bedingt. Die Untersuchungsergebnisse zeigen, daß auch lysosomale Zystein- und Asparaginproteasen partiell in den sehr komplexen Vorgang der Prozessierung eingebunden sind. von pulmonalen Surfactant Proteinen 6. Literaturverzeichnis - 73 - LITERATURVERZEICHNIS 1. Akinbi, H. T., Breslin, J. S., Ikegami, M., Iwamoto, H. S., Clark, J. C., Whitsett, J. A., Jobe, A. H. und Weaver, T. E. (1997) Rescue of SP-B knockout mice with a truncated SP-B proprotein. Function of the Cterminal propeptide J.Biol.Chem.; 272: 9640-9647 2. Arbustini, E., Morbini, P., Diegoli, M., Grasso, M., Fasani, R., Vitulo, P., Fiocca, R., Cremaschi, P., Volpato, G. und Martinelli, L. (1994) Coexpression of aspartic proteinases and human leukocyte antigen-DR in human transplanted lung Am.J.Pathol.; 145: 310-321 3. Arnold, D., Keilholz, W., Schild, H., Dumrese, T., Stevanovic, S. und Rammensee, H. G. (1997) Substrate specificity of cathepsins D and E determined by N-terminal and C-terminal sequencing of peptide pools Eur.J.Biochem.; 249: 171-179 4. Askin, F. B. und Kuhn, C. (1971) The cellular origin of pulmonary surfactant Lab Invest; 25: 260-268 5. Azim, M. K. und Zaidi, Z. H. (1999) Molecular modeling of human procathepsin E: analysis of salt-bridge interactions between propeptide and enzyme segment Biochem.Biophys.Res.Commun.; 264: 825-832 6. Azuma, T., Pals, G., Mohandas, T. K., Couvreur, J. M. und Taggart, R. T. (1989) Human gastric cathepsin E. Predicted sequence, localization to chromosome 1, and sequence homology with other aspartic proteinases J.Biol.Chem.; 264: 16748-16753 7. Baatz, J. E., Elledge, B. und Whitsett, J. A. (1990) Surfactant protein SP-B induces ordering at the surface of model membrane bilayers Biochemistry; 29: 6714-6720 8. Ballard, P. L. (1989) Hormonal regulation of pulmonary surfactant Endocr.Rev.; 10: 165-181 9. Barrett, A. J. (1972) A new assay for cathepsin B1 and other thiol proteinases Anal.Biochem.; 47: 280-293 10. Barrett, A. J. (1992) Cellular proteolysis. An overview Ann.N.Y.Acad.Sci.; 674: 1-15 6. Literaturverzeichnis 11. - 74 - Barrett, A. J. und Kirschke, H. (1981) Cathepsin B, Cathepsin H, and cathepsin L Methods Enzymol.; 80 Pt C: 535-561 12. Barrett, A. J., Davies, M. E. und Grubb, A. (1984) The place of human gamma-trace (cystatin C) amongst the cysteine proteinase inhibitors Biochem.Biophys.Res.Commun.; 120: 631-636 13. Beynon, R. J. und Bond, J. S., Proteolytic Enzymes. A Practical Approach, pp. 1-259, IRL Press, Oxford 1989 14. Bohinski, R. J., Di Lauro, R. und Whitsett, J. A. (1994) The lung-specific surfactant protein B gene promoter is a target for thyroid transcription factor 1 and hepatocyte nuclear factor 3, indicating common factors for organ-specific gene expression along the foregut axis Mol.Cell Biol.; 14: 5671-5681 15. Bohley, P. (1987) Intracellular Proteolysis. In: Hydrolytic Enzymes; New Comprehensive Biochemistry, vol. 16 (Neuberger, A und Brocklehurst, K. Hrsg.), pp. 307-332, Elsevier, Amsterdam 16. Bohley, P. und Seglen, P. O. (1992) Proteases and proteolysis in the lysosome Experientia ; 48: 151-157 17. Bosi, F., Silini, E., Luisetti, M., Romano, A. M., Prati, U., Silvestri, M., Tinelli, C., Samloff, I. M. und Fiocca, R. (1993) Aspartic proteinases in normal lung and interstitial pulmonary diseases Am.J.Respir.Cell Mol.Biol.; 8: 626-632 18. Bossard, M. J., Tomaszek, T. A., Thompson, S. K., Amegadzie, B. Y., Hanning, C. R., Jones, C., Kurdyla, J. T., McNulty, D. E., Drake, F. H., Gowen, M. und Levy, M. A. (1996) Proteolytic activity of human osteoclast cathepsin K. Expression, purification, activation, and substrate identification J.Biol.Chem.; 271: 12517-12524 19. Brody, A. R., Hook, G. E., Cameron, G. S., Jetten, A. M., Butterick, C. J. und Nettesheim, P. (1987) The differentiation capacity of Clara cells isolated from the lungs of rabbits Lab Invest ; 57: 219-229 20. Bromme, D., Bonneau, P. R., Lachance, P., Wiederanders, B., Kirschke, H., Peters, C., Thomas, D. Y., Storer, A. C. und Vernet, T. (1993) Functional expression of human cathepsin S in Saccharomyces cerevisiae. Purification and characterization of the recombinant enzyme J.Biol.Chem.; 268: 4832-4838 6. Literaturverzeichnis 21. - 75 - Bromme, D., Okamoto, K., Wang, B. B. und Biroc, S. (1996) Human cathepsin O2, a matrix protein-degrading cysteine protease expressed in osteoclasts. Functional expression of human cathepsin O2 in Spodoptera frugiperda and characterization of the enzyme J.Biol.Chem.; 271: 2126-2132 22. Cavailles, V., Augereau, P. und Rochefort, H. (1991) Cathepsin D gene of human MCF7 cells contains estrogen-responsive sequences in its 5' proximal flanking region Biochem.Biophys.Res.Commun.; 174: 816-824 23. Chan, S. J., San Segundo, B., McCormick, M. B. und Steiner, D. F. (1986) Nucleotide and predicted amino acid sequences of cloned human and mouse preprocathepsin B cDNAs Proc.Natl.Acad.Sci.U.S.A ; 83: 7721-7725 24. Chance, R. E. (1972) Amino acid sequences of proinsulins and intermediates Diabetes; 21: 461-467 25. Chang, J. C., Lesser, M., Yoo, O. H. und Orlowski, M. (1986) Increased cathepsin B-like activity in alveolar macrophages and bronchoalveolar lavage fluid from smokers Am.Rev.Respir.Dis.; 134: 538-541 26. Chang, J.C., Yoo, O.H. und Lesser, M. (1989) Cathepsin D Activity is increased in Alveolar Macrophages and Bronchoalveolar Lavage Fluid of Smokers Am.Rev.Respir.Dis.; 140: 958-960 27. Chauhan, S. S., Popescu, N. C., Ray, D., Fleischmann, R., Gottesman, M. M. und Troen, B. R. (1993) Cloning, genomic organization, and chromosomal localization of human cathepsin L J.Biol.Chem.; 268: 1039-1045 28. Chuman, Y., Bergman, A., Ueno, T., Saito, S., Sakaguchi, K., Alaiya, A. A., Franzen, B., Bergman, T., Arnott, D., Auer, G., Appella, E., Jornvall, H. und Linder, S. (1999) Napsin A, a member of the aspartic protease family, is abundantly expressed in normal lung and kidney tissue and is expressed in lung adenocarcinomas FEBS Lett.; 462: 129-134 29. Clark, J. C., Wert, S. E., Bachurski, C. J., Stahlman, M. T., Stripp, B. R., Weaver, T. E. und Whitsett, J. A. (1995) Targeted disruption of the surfactant protein B gene disrupts surfactant homeostasis, causing respiratory failure in newborn mice Proc.Natl.Acad.Sci.U.S.A ; 92: 7794-7798 6. Literaturverzeichnis 30. - 76 - Clements, G. J., Price-Jones, M. J., Stephens, P. E., Sutton, C., Schulz, T. F., Clapham, P. R., McKeating, J. A., McClure, M. O., Thomson, S. und Marsh, M. (1991) The V3 loops of the HIV-1 and HIV-2 surface glycoproteins contain proteolytic cleavage sites: a possible function in viral fusion? AIDS Res.Hum.Retroviruses ; 7: 3-16 31. Clements, J. A. (1970) Pulmonary surfactant Am.Rev.Respir.Dis.; 101: 984-990 32. Clements, J. A. (1977) Functions of the alveolar lining Am.Rev.Respir.Dis.; 115: 67-71 33. Delaissé, J.-M. und Vaes, G. (1992) Biology and Physiology of the Osteoclast (Rifkin, B.R.and Gay, C.V. Hrsg.); pp. 289314 34. Denhardt, D. T., Greenberg, A. H., Egan, S. E., Hamilton, R. T. und Wright, J. A. (1987) Cysteine proteinase cathepsin L expression correlates closely with the metastatic potential of H-ras-transformed murine fibroblasts Oncogene; 2: 55-59 35. Deval, C., Bechet, D., Obled, A. und Ferrara, M. (1990) Purification and properties of different isoforms of bovine cathepsin B Biochem.Cell Biol.; 68: 822-826 36. Diment, S., Leech, M. S. und Stahl, P. D. (1988) Cathepsin D is membrane-associated in macrophage endosomes J.Biol.Chem.; 263: 6901-6907 37. Dufour, E., Obled, A., Valin, C., Bechet, D., Ribadeau-Dumas, B. und Huet, J. C. (1987) Purification and amino acid sequence of chicken liver cathepsin L Biochemistry; 26: 5689-5695 38. Emrie, P. A., Jones, C., Hofmann, T. und Fisher, J. H. (1988) The coding sequence for the human 18,000-dalton hydrophobic pulmonary surfactant protein is located on chromosome 2 and identifies a restriction fragment length polymorphism Somat.Cell Mol.Genet.; 14: 105-110 39. Erdel, M., Trefz, G., Spiess, E., Habermaas, S., Spring, H., Lah, T. und Ebert, W. (1990) Localization of cathepsin B in two human lung cancer cell lines J.Histochem.Cytochem.; 38: 1313-1321 40. Erickson, A. H. und Blobel, G. (1983) Carboxyl-terminal proteolytic processing during biosynthesis of the lysosomal enzymes beta-glucuronidase and cathepsin D Biochemistry; 22: 5201-5205 6. Literaturverzeichnis 41. - 77 - Erickson-Lawrence, M., Zabludoff, S. D. und Wright, W. W. (1991) Cyclic protein-2, a secretory product of rat Sertoli cells, is the proenzyme form of cathepsin L Mol.Endocrinol.; 5: 1789-1798 42. Faust, P. L., Kornfeld, S. und Chirgwin, J. M. (1985) Cloning and sequence analysis of cDNA for human cathepsin D Proc.Natl.Acad.Sci.U.S.A ; 82: 4910-4914 43. Finzi, G., Cornaggia, M., Capella, C., Fiocca, R., Bosi, F., Solcia, E. und Samloff, I. M. (1993) Cathepsin E in follicle associated epithelium of intestine and tonsils: localization to M cells and possible role in antigen processing Histochemistry; 99: 201-211 44. Fowler, S. D., Kay, J., Dunn, B. M. und Tatnell, P. J. (1995) Monomeric human cathepsin E FEBS Lett.; 366: 72-74 45. Fuchs, R., Machleidt, W. und Gassen, H. G. (1988) Molecular cloning and sequencing of a cDNA coding for mature human kidney cathepsin H Biol.Chem.Hoppe Seyler ; 369: 469-475 46. Furuhashi, M., Nakahara, A., Fukutomi, H., Kominami, E., Grube, D. und Uchiyama, Y. (1991) Immunocytochemical localization of cathepsins B, H, and L in the rat gastro-duodenal mucosa Histochemistry ; 95: 231-239 47. Gabrijelcic, D., Annan-Prah, A., Rodic, B., Rozman, B., Cotic, V. und Turk, V. (1990) Determination of cathepsins B and H in sera and synovial fluids of patients with different joint diseases J.Clin.Chem.Clin.Biochem.; 28: 149-153 48. Gelb, B. D., Moissoglu, K., Zhang, J., Martignetti, J. A., Bromme, D. und Desnick, R. J. (1996) Cathepsin K: isolation and characterization of the murine cDNA and genomic sequence, the homologue of the human pycnodysostosis gene Biochem.Mol.Med.; 59: 200-206 49. Gelb, B. D., Shi, G. P., Chapman, H. A. und Desnick, R. J. (1996) Pycnodysostosis, a lysosomal disease caused by cathepsin K deficiency Science; 273: 1236-1238 50. Goldring, I. P., Greenburg, L. und Ratner, I. M. (1968) On the production of emphysema in Syrian hamsters by aerosol inhalation of papain Arch.Environ.Health; 16: 59-60 51. Green, G. D. und Shaw, E. (1980) J.Biol.Chem.; 251: 4528 6. Literaturverzeichnis 52. - 78 - Guinec, N., Dalet-Fumeron, V. und Pagano, M. (1993) "In vitro" study of basement membrane degradation by the cysteine proteinases, cathepsins B, B-like and L. Digestion of collagen IV, laminin, fibronectin, and release of gelatinase activities from basement membrane fibronectin Biol.Chem.Hoppe Seyler; 374: 1135-1146 53. Guttentag, S. H., Beers, M. F., Bieler, B. M. und Ballard, P. L. (1998) Surfactant protein B processing in human fetal lung Am.J.Physiol ; 275: L559-L566 54. Haagsman, H. P. und van Golde, L. M. (1991) Synthesis and assembly of lung surfactant Annu.Rev.Physiol ; 53: 441-464 55. Hamilton, J. W., Niall, H. D., Jacobs, J. W., Keutmann, H. T., Potts, J. T., Jr. und Cohn, D. V. (1974) The N-terminal amino-acid sequence of bovine proparathyroid hormone Proc.Natl.Acad.Sci.U.S.A; 71: 653-656 56. Hasilik, A., von Figura, K., Conzelmann, E., Nehrkorn, H. und Sandhoff, K. (1982) Lysosomal enzyme precursors in human fibroblasts. Activation of cathepsin D precursor in vitro and activity of beta-hexosaminidase A precursor towards ganglioside GM2 Eur.J.Biochem.; 125: 317-321 57. Hasnain, S., Hirama, T., Tam, A. und Mort, J. S. (1992) Characterization of recombinant rat cathepsin B and nonglycosylated mutants expressed in yeast. New insights into the pH dependence of cathepsin B-catalyzed hydrolyses J.Biol.Chem.; 267: 4713-4721 58. Hay, J. G., Danel, C., Chu, C. S. und Crystal, R. G. (1995) Human CC10 gene expression in airway epithelium and subchromosomal locus suggest linkage to airway disease Am.J.Physiol ; 268: L565-L575 59. Heidtmann, H. H., Salge, U., Abrahamson, M., Bencina, M., Kastelic, L., KopitarJerala, N., Turk, V. und Lah, T. T. (1997) Cathepsin B and cysteine proteinase inhibitors in human lung cancer cell lines Clin.Exp.Metastasis ; 15: 368-381 60. Heidtmann, H. H., Salge, U., Havemann, K., Kirschke, H. und Wiederanders, B. (1993) Secretion of a latent, acid activatable cathepsin L precursor by human non-small cell lung cancer cell lines Oncol.Res.; 5: 441-451 61. Hernandez-Cueto, C., Lorente, J. A., Pedal, I., Villanueva, E., Zimmer, G., Girela, E. und Miltner, E. (1993) Cathepsin D as a vitality marker in human skin wounds Int.J.Legal Med.; 106: 145-147 6. Literaturverzeichnis 62. - 79 - Im, B., Kominami, E., Grube, D. und Uchiyama, Y. (1989) Immunocytochemical localization of cathepsins B and H in human pancreatic endocrine cells and insulinoma cells Histochemistry; 93: 111-118 63. Imoto, T., Okazaki, K., Koga, H. und Yamada, H. (1987) Specificity of rat liver cathepsin D J.Biochem.(Tokyo); 101: 575-580 64. Inaoka, T., Bilbe, G., Ishibashi, O., Tezuka, K., Kumegawa, M. und Kokubo, T. (1995) Molecular cloning of human cDNA for cathepsin K: novel cysteine proteinase predominantly expressed in bone Biochem.Biophys.Res.Commun.; 206: 89-96 65. Isemura, M., Yosizawa, Z., Takahashi, K., Kosaka, H., Kojima, N. und Ono, T. (1981) Characterization of porcine plasma fibronectin and its fragmentation by porcine liver cathepsin B J.Biochem.(Tokyo); 90: 1-9 66. Johansson, J., Curstedt, T. und Jornvall, H. (1991) Surfactant protein B: disulfide bridges, structural properties, and kringle similarities Biochemistry; 30: 6917-6921 67. Johansson, J., Jornvall, H. und Curstedt, T. (1992) Human surfactant polypeptide SP-B. Disulfide bridges, C-terminal end, and peptide analysis of the airway form FEBS Lett.; 301: 165-167 68. Johnson, M. R., Polymeropoulos, M. H., Vos, H. L., Ortiz de Luna, R. I. und Francomano, C. A. (1996) A nonsense mutation in the cathepsin K gene observed in a family with pycnodysostosis Genome Res.; 6: 1050-1055 69. Joseph, L. J., Chang, L. C., Stamenkovich, D. und Sukhatme, V. P. (1988) Complete nucleotide and deduced amino acid sequences of human and murine preprocathepsin L. An abundant transcript induced by transformation of fibroblasts J.Clin.Invest ; 81: 1621-1629 70. Kageyama, T., Ichinose, M., Tsukada, S., Miki, K., Kurokawa, K., Koiwai, O., Tanji, M., Yakabe, E., Athauda, S. B. und Takahashi, K. (1992) Gastric procathepsin E and progastricsin from guinea pig. Purification, molecular cloning of cDNAs, and characterization of enzymatic properties, with special reference to procathepsin E J.Biol.Chem.; 267: 16450-16459 71. Kasper, M., Lackie, P., Haase, M., Schuh, D. und Muller, M. (1996) Immunolocalization of cathepsin D in pneumocytes of normal human lung and in pulmonary fibrosis Virchows Arch.; 428: 207-215 6. Literaturverzeichnis 72. - 80 - King, R. J. und Clements, J. A. (1972) Surface active materials from dog lung. II. Composition and physiological correlations Am.J.Physiol ; 223: 715-726 73. Kirschke, H. und Barrett, A. J. (1987) Chemistry of lysosomal proteases. In: Lysosomes: Their Role in Protein Breakdown pp. 193-238, Academic Press, London 74. Kirschke, H. und Wiederanders, B. (1994) Cathepsin S and related lysosomal endopeptidases Methods Enzymol.; 244: 500-511 75. Koga, H., Mori, N., Yamada, H., Nishimura, Y., Tokuda, K., Kato, K. und Imoto, T. (1992) Endo- and Aminopepdidase Activities of Rat Cathepsin H Chem.Pharm.Bull.(Tokyo) ; 40: 965-970 76. Kominami, E., Kunio, I. und Katunuma, N. (1987) Activation of the intramyofibral autophagic-lysosomal system in muscular dystrophy Am.J.Pathol.; 127: 461-466 77. Korimilli, A., Gonzales, L. W. und Guttentag, S. H. (2000) Intracellular localization of processing events in human surfactant protein B biosynthesis J.Biol.Chem.; 275: 8672-8679 78. Krane, S. M. und Simon, L. (1994) Scientific American Medicine; 3: 1-26 79. Leary, R. und Shaw, E. (1977) Inactivation of cathepsin B1 by diazomethyl ketones Biochem.Biophys.Res.Commun.; 79: 926-931 80. Lees, W. E., Kalinka, S., Meech, J., Capper, S. J., Cook, N. D. und Kay, J. (1990) Generation of human endothelin by cathepsin E FEBS Lett.; 273: 99-102 81. Lesser, M., Padilla, M. L. und Cardozo, C. (1992) Induction of emphysema in hamsters by intratracheal instillation of cathepsin B Am.Rev.Respir.Dis. ; 145: 661-668 82. Lesur, O., Bernard, A., Arsalane, K., Lauwerys, R., Begin, R., Cantin, A. und Lane, D. (1995) Clara cell protein (CC-16) induces a phospholipase A2-mediated inhibition of fibroblast migration in vitro Am.J.Respir.Crit Care Med.; 152: 290-297 83. Leto, G., Gebbia, N., Rausa, L. und Tumminello, F. M. (1992) Cathepsin D in the malignant progression of neoplastic diseases (review) Anticancer Res.; 12: 235-240 6. Literaturverzeichnis 84. - 81 - Lin, S., Na, C. L., Akinbi, H. T., Apsley, K. S., Whitsett, J. A. und Weaver, T. E. (1999) Surfactant protein B (SP-B) -/- mice are rescued by restoration of SP-B expression in alveolar type II cells but not Clara cells J.Biol.Chem.; 274: 19168-19174 85. Lin, Z., Wang, G., deMello, D. E. und Floros, J. (1999) An alternatively spliced surfactant protein B mRNA in normal human lung: disease implication Biochem.J.; 343 Pt 1: 145-149 86. Mason, R. W., Green, G. D. und Barrett, A. J. (1985) Human liver cathepsin L Biochem.J.; 226: 233-241 87. Mason, R. W., Walker, J. E. und Northrop, F. D. (1986) The N-terminal amino acid sequences of the heavy and light chains of human cathepsin L. Relationship to a cDNA clone for a major cysteine proteinase from a mouse macrophage cell line Biochem.J.; 240: 373-377 88. Matsuba, H., Watanabe, T., Watanabe, M., Ishii, Y., Waguri, S., Kominami, E. und Uchiyama, Y. (1989) Immunocytochemical localization of prorenin, renin, and cathepsins B, H, and L in juxtaglomerular cells of rat kidney J.Histochem.Cytochem.; 37: 1689-1697 89. May, F. E., Smith, D. J. und Westley, B. R. (1993) The human cathepsin D-encoding gene is transcribed from an estrogen- regulated and a constitutive start point Gene; 134: 277-282 90. McQueney, M. S., Amegadzie, B. Y., D'Alessio, K., Hanning, C. R., McLaughlin, M. M., McNulty, D., Carr, S. A., Ijames, C., Kurdyla, J. und Jones, C. S. (1997) Autocatalytic activation of human cathepsin K J.Biol.Chem.; 272: 13955-13960 91. Metcalf, P. und Fusek, M. (1993) Two crystal structures for cathepsin D: the lysosomal targeting signal and active site EMBO J.; 12: 1293-1302 92. Mizuochi, T., Yee, S. T., Kasai, M., Kakiuchi, T., Muno, D. und Kominami, E. (1994) Both cathepsin B and cathepsin D are necessary for processing of ovalbumin as well as for degradation of class II MHC invariant chain Immunol.Lett.; 43: 189-193 93. Moin, K., Rozhin, J., McKernan, T. B., Sanders, V. J., Fong, D., Honn, K. V. und Sloane, B. F. (1989) Enhanced levels of cathepsin B mRNA in murine tumors FEBS Lett.; 244: 61-64 6. Literaturverzeichnis 94. - 82 - Morgenroth, K. (1995) Atemtrakt: Schutzmechanismen des Alveolarepithels In: Pathologie p. 458, (Blümcke, S. Hrsg.), Walter de Gruyter Verlag, Berlin 95. Mori, M., Kohli, A., Baker, S. P., Savas, L. und Fraire, A. E. (1997) Laminin and cathepsin B as prognostic factors in stage I non-small cell lung cancer: are they useful? Mod.Pathol.; 10: 572-577 96. Mort, J. S., Recklies, A. D. und Poole, A. R. (1984) Extracellular presence of the lysosomal proteinase cathepsin B in rheumatoid synovium and its activity at neutral pH Arthritis Rheum.; 27: 509-515 97. Nag, K., Munro, J. G., Inchley, K., Schurch, S., Petersen, N. O. und Possmayer, F. (1999) SP-B refining of pulmonary surfactant phospholipid films Am.J.Physiol ; 277: L1179-L1189 98. Niden, A. H. (1967) Bronchiolar and large alveolar cell in pulmonary phospholipid metabolism Science ; 158: 1323-1324 99. Nishimura, Y., Kawabata, T. und Kato, K. (1988) Identification of latent procathepsins B and L in microsomal lumen: characterization of enzymatic activation and proteolytic processing in vitro Arch.Biochem.Biophys.; 261: 64-71 100. Nogee, L. M., Wert, S. E., Proffit, S. A., Hull, W. M. und Whitsett, J. A. (2000) Allelic heterogeneity in hereditary surfactant protein B (SP-B) deficiency Am.J.Respir.Crit Care Med.; 161: 973-981 101. O'Reilly, M. A., Clark, J. C. und Whitsett, J. A. (1991) Glucocorticoid enhances pulmonary surfactant protein B gene transcription Am.J.Physiol ; 260: L37-L43 102. O'Reilly, M. A., Weaver, T. E., Pilot-Matias, T. J., Sarin, V. K., Gazdar, A. F. und Whitsett, J. A. (1989) In vitro translation, post-translational processing and secretion of pulmonary surfactant protein B precursors Biochim.Biophys.Acta; 1011: 140-148 103. Olbricht, C. J., Cannon, J. K., Garg, L. C. und Tisher, C. C. (1986) Activities of cathepsins B and L in isolated nephron segments from proteinuric and nonproteinuric rats Am.J.Physiol; 250: F1055-F1062 104. Padilla, M. L., Galicki, N. I., Kleinerman, J., Orlowski, M. und Lesser, M. (1988) High cathepsin B activity in alveolar macrophages occurs with elastase- induced emphysema but not with bleomycin-induced pulmonary fibrosis in hamsters Am.J.Pathol.; 131: 92-101 6. Literaturverzeichnis - 83 - 105. Page, A. E., Hayman, A. R., Andersson, L. M., Chambers, T. J. und Warburton, M. J. (1993) Degradation of bone matrix proteins by osteoclast cathepsins Int.J.Biochem.; 25: 545-550 106. Petanceska, S. und Devi, L. (1992) Sequence analysis, tissue distribution, and expression of rat cathepsin S J.Biol.Chem.; 267: 26038-26043 107. Phelps, D. S. und Floros, J. (1991) Localization of pulmonary surfactant proteins using immunohistochemistry and tissue in situ hybridization Exp.Lung Res.; 17: 985-995 108. Portnoy, D. A., Erickson, A. H., Kochan, J., Ravetch, J. V. und Unkeless, J. C. (1986) Cloning and characterization of a mouse cysteine proteinase J.Biol.Chem.; 261: 14697-14703 109. Possmayer, F. (1988) A proposed nomenclature for pulmonary surfactant-associated proteins Am.Rev.Respir.Dis. ; 138: 990-998 110. Pryhuber, G. S. (1998) Regulation and function of pulmonary surfactant protein B Mol.Genet.Metab ; 64: 217-228 111. Qian, F., Bajkowski, A. S., Steiner, D. F., Chan, S. J. und Frankfater, A. (1989) Expression of five cathepsins in murine melanomas of varying metastatic potential and normal tissues Cancer Res.; 49: 4870-4875 112. Qian, F., Frankfater, A., Miller, R. V., Chan, S. J. und Steiner, D. F. (1990) Molecular cloning of rat precursor cathepsin H and the expression of five lysosomal cathepsins in normal tissues and in a rat carcinosarcoma Int.J.Biochem.; 22: 1457-1464 113. Rantakokko, J., Aro, H. T., Savontaus, M. und Vuorio, E. (1996) Mouse cathepsin K: cDNA cloning and predominant expression of the gene in osteoclasts, and in some hypertrophying chondrocytes during mouse development FEBS Lett.; 393: 307-313 114. Rao-Naik, C., Guruprasad, K., Batley, B., Rapundalo, S., Hill, J., Blundell, T., Kay, J. und Dunn, B. M. (1995) Exploring the binding preferences/specificity in the active site of human cathepsin E Proteins ; 22: 168-181 115. Reid, W. A., Valler, M. J. und Kay, J. (1986) Immunolocalization of cathepsin D in normal and neoplastic human tissues J.Clin.Pathol.; 39: 1323-1330 6. Literaturverzeichnis - 84 - 116. Reilly, J. J., Jr., Mason, R. W., Chen, P., Joseph, L. J., Sukhatme, V. P., Yee, R. und Chapman, H. A., Jr. (1989) Synthesis and processing of cathepsin L, an elastase, by human alveolar macrophages Biochem.J.; 257: 493-498 117. Rice, W. R., Sarin, V. K., Fox, J. L., Baatz, J., Wert, S. und Whitsett, J. A. (1989) Surfactant peptides stimulate uptake of phosphatidylcholine by isolated cells Biochim.Biophys.Acta; 1006: 237-245 118. Riese, R. J., Mitchell, R. N., Villadangos, J. A., Shi, G. P., Palmer, J. T., Karp, E. R., De Sanctis, G. T., Ploegh, H. L. und Chapman, H. A. (1998) Cathepsin S activity regulates antigen presentation and immunity J.Clin.Invest ; 101: 2351-2363 119. Russell, J. H. und Geller, D. M. (1975) The structure of rat proalbumin J.Biol.Chem.; 250: 3409-3413 120. Ryvniak, V. V., Gudumak, V. S. und Onia, E. S. (1990) Intracellular and extracellular activity of cathepsin D in the liver in cirrhosis and its involution Biull.Eksp.Biol.Med.; 109: 199-200 121. Sakai, H., Saku, T., Kato, Y. und Yamamoto, K. (1989) Quantitation and immunohistochemical localization of cathepsins E and D in rat tissues and blood cells Biochim.Biophys.Acta ; 991: 367-375 122. Saneshige, S., Mano, H., Tezuka, K., Kakudo, S., Mori, Y., Honda, Y., Itabashi, A., Yamada, T., Miyata, K. und Hakeda, Y. (1995) Retinoic acid directly stimulates osteoclastic bone resorption and gene expression of cathepsin K/OC-2 Biochem.J.; 309 (Pt 3): 721-724 123. Schauer-Vukasinovic, V., Bur, D., Kitas, E., Schlatter, D., Rosse, G., Lahm, H. W. und Giller, T. (2000) Purification and characterization of active recombinant human napsin A Eur.J.Biochem.; 267: 2573-2580 124. Schauer-Vukasinovic, V., Bur, D., Kling, D., Gruninger, F. und Giller, T. (1999) Human napsin A: expression, immunochemical detection, and tissue localization FEBS Lett.; 462: 135-139 125. Schauer-Vukasinovic, V., Wright, M. B., Breu, V. und Giller, T. (2000) Cloning, expression and functional characterization of rat napsin Biochim.Biophys.Acta ; 1492: 207-210 126. Seeger, W., Gunther, A. und Thede, C. (1992) Differential sensitivity to fibrinogen inhibition of SP-C- vs. SP-B- based surfactants Am.J.Physiol; 262: L286-L291 6. Literaturverzeichnis - 85 - 127. Shi, G. P., Munger, J. S., Meara, J. P., Rich, D. H. und Chapman, H. A. (1992) Molecular cloning and expression of human alveolar macrophage cathepsin S, an elastinolytic cysteine protease J.Biol.Chem.; 267: 7258-7262 128. Shi, G. P., Webb, A. C., Foster, K. E., Knoll, J. H., Lemere, C. A., Munger, J. S. und Chapman, H. A. (1994) Human cathepsin S: chromosomal localization, gene structure, and tissue distribution J.Biol.Chem.; 269: 11530-11536 129. Singh, G. und Katyal, S. L. (1997) Clara cells and Clara cell 10 kD protein (CC10) Am.J.Respir.Cell Mol.Biol.; 17: 141-143 130. Singh, G., Katyal, S. L., Brown, W. E., Kennedy, A. L., Singh, U. und Wong-Chong, M. L. (1990) Clara cell 10 kDa protein (CC10): comparison of structure and function to uteroglobin Biochim.Biophys.Acta ; 1039: 348-355 131. Singh, G., Katyal, S. L., Brown, W. E., Phillips, S., Kennedy, A. L., Anthony, J. und Squeglia, N. (1988) Amino-acid and cDNA nucleotide sequences of human Clara cell 10 kDa protein Biochim.Biophys.Acta ; 950: 329-337 132. Singh, G., Singh, J., Katyal, S. L., Brown, W. E., Kramps, J. A., Paradis, I. L., Dauber, J. H., Macpherson, T. A. und Squeglia, N. (1988) Identification, cellular localization, isolation, and characterization of human Clara cellspecific 10 KD protein J.Histochem.Cytochem.; 36: 73-80 133. Sloane, B. F. (1990) Cathepsin B and cystatins: evidence for a role in cancer progression Semin.Cancer Biol.; 1: 137-152 134. Sly, W. S. und Fischer, H. D. (1982) The phosphomannosyl recognition system for intracellular and intercellular transport of lysosomal enzymes J.Cell Biochem.; 18: 67-85 135. Solcia, E., Paulli, M., Silini, E., Fiocca, R., Finzi, G., Kindl, S., Boveri, E., Bosi, F., Cornaggia, M. und Capella, C. (1993) Cathepsin E in antigen-presenting Langerhans and interdigitating reticulum cells. Its possible role in antigen processing Eur.J.Histochem.; 37: 19-26 136. Solovyeva, N. I., Balayevskaya, T. O., Dilakyan, E. A., Zakamaldina-Zama, T. A., Pozdnev, V. F., Topol, L. Z. und Kisseljov, F. L. (1995) Proteolytic enzymes at various stages of oncogenic transformation of rat fibroblasts. I. Aspartyl and cysteine proteinases Int.J.Cancer; 60: 495-500 6. Literaturverzeichnis - 86 - 137. Starkey, P. M. und Barrett, A. J. (1973) Inhibition by alpha-macroglobulin and other serum proteins Biochem.J.; 131: 823-831 138. Suzuki, Y., Fujita, Y. und Kogishi, K. (1989) Reconstitution of tubular myelin from synthetic lipids and proteins associated with pig pulmonary surfactant Am.Rev.Respir.Dis.; 140: 75-81 139. Takahashi, T. und Tang, J. (1983) Amino acid sequence of porcine spleen cathepsin D light chain J.Biol.Chem.; 258: 6435-6443 140. Takahashi, T., Schmidt, P. G. und Tang, J. (1983) Oligosaccharide units of lysosomal cathepsin D from porcine spleen. Amino acid sequence and carbohydrate structure of the glycopeptides J.Biol.Chem.; 258: 2819-2830 141. Takaoka, M., Hukumori, Y., Shiragami, K., Ikegawa, R., Matsumura, Y. und Morimoto, S. (1990) Proteolytic processing of porcine big endothelin-1 catalyzed by cathepsin D Biochem.Biophys.Res.Commun.; 173: 1218-1223 142. Takio, K., Towatari, T., Katunuma, N., Teller, D. C. und Titani, K. (1983) Homology of amino acid sequences of rat liver cathepsins B and H with that of papain Proc.Natl.Acad.Sci.U.S.A; 80: 3666-3670 143. Tang, J. und Wong, R. N. (1987) Evolution in the structure and function of aspartic proteases J.Cell Biochem.; 33: 53-63 144. Tatnell, P. J., Powell, D. J., Hill, J., Smith, T. S., Tew, D. G. und Kay, J. (1998) Napsins: new human aspartic proteinases. Distinction between two closely related genes FEBS Lett.; 441: 43-48 145. Tsuchida, K., Aihara, H., Isogai, K., Hanada, K. und Shibata, N. (1986) Degradation of myocardial structural proteins in myocardial infarcted dogs is reduced by Ep459, a cysteine proteinase inhibitor Biol.Chem.Hoppe Seyler; 367: 39-45 146. Turk, B., Dolenc, I., Turk, V. und Bieth, J. G. (1993) Kinetics of the pH-induced inactivation of human cathepsin L Biochemistry ; 32: 375-380 147. Turk, V., Brzin, J., Kopitar, M., Kotnik, M., Lenarcic, B., Popovic, T., Ritonja, A., Trstenjak, M., Rozman, B. und Machleidt, W. (1986) Human Cathepsin B,H and L and their enodgenous protein inhibitors: structure, function and biological role. In: Proteinases in Inflammation and Tumor Invasion (Tschesche, H. Hrsg.) pp. 77-92, Walter de Gruyter Verlag, Berlin 6. Literaturverzeichnis - 87 - 148. Uchiyama, Y., Watanabe, M., Watanabe, T., Ishii, Y., Matsuba, H., Waguri, S. und Kominami, E. (1989) Variations in immunocytochemical localization of cathepsin B and thyroxine in follicular cells of the rat thyroid gland and plasma TSH concentrations over 24 hours Cell Tissue Res.; 256: 355-360 149. Uchiyama, Y., Watanabe, T., Watanabe, M., Ishii, Y., Matsuba, H., Waguri, S. und Kominami, E. (1989) Immunocytochemical localization of cathepsins B, H, L, and T4 in follicular cells of rat thyroid gland J.Histochem.Cytochem.; 37: 691-696 150. Umezawa, H. (1976) Structures and activities of protease inhibitors of microbial origin Methods Enzymol.; 45: 678-695 151. Umland, T. C., Swaminathan, S., Singh, G., Warty, V., Furey, W., Pletcher, J. und Sax, M. (1994) Structure of a human Clara cell phospholipid-binding protein-ligand complex at 1.9 A resolution Nat.Struct.Biol.; 1: 538-545 152. van Noort, J. M. und van der Drift, A. C. (1989) The selectivity of cathepsin D suggests an involvement of the enzyme in the generation of T-cell epitopes J.Biol.Chem.; 264: 14159-14164 153. Venkitaraman, A. R., Baatz, J. E., Whitsett, J. A., Hall, S. B. und Notter, R. H. (1991) Biophysical inhibition of synthetic phospholipid-lung surfactant apoprotein admixtures by plasma proteins Chem.Phys.Lipids; 57: 49-57 154. von Heijne, G. (1983) Patterns of amino acids near signal-sequence cleavage sites Eur.J.Biochem.; 133: 17-21 155. Voorhout, W. F., Veenendaal, T., Haagsman, H. P., Weaver, T. E., Whitsett, J. A., van Golde, L. M. und Geuze, H. J. (1992) Intracellular processing of pulmonary surfactant protein B in an endosomal/lysosomal compartment Am.J.Physiol ; 263: L479-L486 156. Warfel, A. H., Cardozo, C., Yoo, O. H. und Zucker-Franklin, D. (1991) Cystatin C and cathepsin B production by alveolar macrophages from smokers and nonsmokers J.Leukoc.Biol.; 49: 41-47 6. Literaturverzeichnis - 88 - 157. Watanabe, H., Green, G. D. und Shaw, E. (1979) A comparison of the behavior of chymotrypsin and cathepsin B towards peptidyl diazomethyl ketones Biochem.Biophys.Res.Commun.; 89: 1354-1360 158. Watanabe, M., Watanabe, T., Ishii, Y., Matsuba, H., Kimura, S., Fujita, T., Kominami, E., Katunuma, N. und Uchiyama, Y. (1988) Immunocytochemical localization of cathepsins B, H, and their endogenous inhibitor, cystatin beta, in islet endocrine cells of rat pancreas J.Histochem.Cytochem.; 36: 783-791 159. Weaver, T. E., Lin, S., Bogucki, B. und Dey, C. (1992) Processing of surfactant protein B proprotein by a cathepsin D-like protease Am.J.Physiol ; 263: L95-103 160. Werle, B., Julke, B., Lah, T., Spiess, E. und Ebert, W. (1997) Cathepsin B fraction active at physiological pH of 7.5 is of prognostic significance in squamous cell carcinoma of human lung Br.J.Cancer ; 75: 1137-1143 161. Whitsett, J. A., Clark, J. C., Wispe, J. R. und Pryhuber, G. S. (1992) Effects of TNF-alpha and phorbol ester on human surfactant protein and MnSOD gene transcription in vitro Am.J.Physiol; 262: L688-L693 162. Whitsett, J. A., Nogee, L. M., Weaver, T. E. und Horowitz, A. D. (1995) Human surfactant protein B: structure, function, regulation, and genetic disease Physiol Rev.; 75: 749-757 163. Wiederanders, B. und Kirschke, H. (1989) The processing of a cathepsin L precursor in vitro Arch.Biochem.Biophys.; 272: 516-521 164. Wiederanders, B., Bromme, D., Kirschke, H., von Figura, K., Schmidt, B. und Peters, C. (1992) Phylogenetic conservation of cysteine proteinases. Cloning and expression of a cDNA coding for human cathepsin S J.Biol.Chem.; 267: 13708-13713 165. Williams, M. C., Hawgood, S. und Hamilton, R. L. (1991) Changes in lipid structure produced by surfactant proteins SP-A, SP-B, and SP-C Am.J.Respir.Cell Mol.Biol.; 5: 41-50 166. Wingo, P. A., Ries, L. A., Giovino, G. A., Miller, D. S., Rosenberg, H. M., Shopland, D. R., Thun, M. J. und Edwards, B. K. (1999) Annual report to the nation on the status of cancer, 1973-1996, with a special section on lung cancer and tobacco smoking J.Natl.Cancer Inst.; 91: 675-690 6. Literaturverzeichnis - 89 - 167. Wolf, M., Klug, J., Hackenberg, R., Gessler, M., Grzeschik, K. H., Beato, M. und Suske, G. (1992) Human CC10, the homologue of rabbit uteroglobin: genomic cloning, chromosomal localization and expression in endometrial cell lines Hum.Mol.Genet.; 1: 371-378 168. Wright, J. R. (1990) Clearance and recycling of pulmonary surfactant Am.J.Physiol ; 259: L1-12 169. Yarus, S., Greenberg, N. M., Wei, Y., Whitsett, J. A., Weaver, T. E. und Rosen, J. M. (1997) Secretion of unprocessed human surfactant protein B in milk of transgenic mice Transgenic Res.; 6: 51-57 170. Yonezawa, S., Takahashi, T., Wang, X. J., Wong, R. N., Hartsuck, J. A. und Tang, J. (1988) Structures at the proteolytic processing region of cathepsin D J.Biol.Chem.; 263: 16504-16511 171. Yusen, R. D., Cohen, A. H. und Hamvas, A. (1999) Normal lung function in subjects heterozygous for surfactant protein-B deficiency Am.J.Respir.Crit Care Med.; 159: 411-414 - 90 - Danksagung DANKSAGUNG Mein besonderer Dank gilt meinem Doktorvater Herrn Prof. Dr. med. K. M. MÜLLER für die Überlassung des Themas dieser Dissertation sowie für die zahlreichen Anregungen und Hilfestellungen. Meinem Betreuer Herrn Dr. F. BRASCH danke ich besonders herzlich für die hervorragende Betreuung, die ausgezeichnete Einführung in die Materie, die vielen Diskussionen und Hinweise und die Zeit, die er für mich erübrigt hat. Den medizinisch-technischen Assistentinnen A. KRUSAT und S. SCHAUB gilt mein besonderer Dank für die Erstellung hervorragender Schnittpräparate und immunhistochemischer Färbungen. Mein besonderer Dank gilt Herrn Dr. rer. nat. G. JOHNEN und Frau S. GEIGER für die biochemische Aufarbeitung der BAL-Proben. Mein herzlicher Dank gilt T. Blumenschein, C. Riemann-Spernau sowie K. und E. Waldschmidt, die diese Dissertation Korrektur gelesen haben. Für die Überlassung der benötigten Antikörper danke ich Dr. S. Hagwood, Prof. of Pediatrics, UCLA, Dr. F. Bühling, Magdeburg sowie Dr. Suzuki, Tokio, Japan. - 91 - Lebenslauf Lebenslauf Ich wurde am 4. August 1971 als Tochter von Christa Riemann-Spernau und Dr. Friedrich Riemann in Herford geboren. Von 1977 bis 1982 besuchte ich die Loh-Grundschule in Dortmund und anschließend bis 1985 das Mallinckrodt-Gymnasium in Dortmund. Das Schuljahr 1985/1986 verbrachte ich am Colegio Visconde de Porto Seguro in Sao Paulo, Brasilien. Ab 1986 besuchte ich erneut das Mallinckrodt-Gymnasium in Dortmund, das ich 1991 mit dem Abitur abschloß. Von 1991 bis 1992 leistete ich ein Freiwilliges Soziales Jahr im St. JohannesHospital in Dortmund ab. Von November 1992 bis Ende September 1994 erfolgte die Ausbildung zur Medizinisch-Technischen-Assistentin am Knappschafts-Krankenhaus in Bochum-Langendreer, die ich vor Beginn meines Studiums abschloß. Seit dem Wintersemester 1994/1995 bin ich an der Ruhr-Universität-Bochum im Fach Humanmedizin eingeschrieben. Während des Sommersemesters 2000 und des Wintersemesters 2000/2001 arbeitete ich am Institut für Pathologie an den Berufsgenossenschaftlichen Kliniken Bergmannsheil an der Charakterisierung der Zysteinproteasen B, H, K, L und S sowie der Asparaginproteasen D, E und Napsin A und ihrer Bedeutung bei der Prozessierung des Surfactant Proteins B. Zum Ende des Sommersemesters 2001 werde ich mein zweites Staatsexamen ablegen und dann mit dem Praktischen Jahr beginnen. Abstract Riemann Nadja Charakterisierung der Verteilung lysosomaler Zystein- und Asparaginproteasen in der menschlichen Lunge und ihre Bedeutung bei der Prozessierung des Surfactant Proteins B Einleitung: Bei den Zysteinproteasen und Asparaginproteasen handelt es sich um zwei Familien von lysosomalen Proteasen, über deren Verteilung und Funktion in der menschlichen Lunge bisher nur wenig bekannt ist. Fragestellung: Ziel der vorliegenden Arbeit war es, die Verteilung der Zysteinproteasen Kathepsin B, H, K, L und S sowie der Asparaginproteasen Kathepsin D, E und Napsin A in der humanen Lunge zu charakterisieren, insbesondere unter der Fragestellung, welche der Proteasen aufgrund ihrer Lokalisation in die Prozessierung des Surfactant Proteins B involviert sein könnten. Material und Methoden: Untersucht wurden humane Lungengewebsproben von Explantaten acht gesunder erwachsener Individuen. Für die immunhistochemischen Untersuchungen wurden Antikörper gegen die Zysteinproteasen Kathepsin B, H, K, L und S, die Asparaginproteasen Kathepsin D, E und Napsin A, gegen das Surfactant Protein B sowie die Proform des SP-B (proSP-B) und das Clara-Zell-spezifische Protein CC10 eingesetzt. Zusätzlich wurde immunelektronenmikroskopisch die Verteilung der Kathepsine D, H und Napsin A untersucht. Ergebnisse: Immunhistochemisch fanden sich in den zilientragenden Bronchialepithelien und den Alveolarmakrophagen die Kathepsine B, D, H, K und L. Kathepsin D ließ sich ultrastrukturell nur in den Lysosomen der Kinozilien tragenden Bronchialepithelien lokalisieren. Kathepsin S fand sich immunhistochemisch ausschließlich in Alveolarmakrophagen, in denen sich auch Napsin A nachweisen ließ. Kathepsin E ließ sich in CC10-negativen Clara-Zellen im Übergangsbereich der Bronchioli terminales in Bronchioli respiratorii lokalisieren. Kathepsin H und Napsin A ließen sich als einzige Proteasen in den cuboidalen Alveolardeckepithelien nachweisen. Doppellabeling-Untersuchungen zeigten eine Kolokalisation mit SP-B in diesen Zellen. Immunelektronenmikroskopisch ließen sich Kathepsin H und Napsin A in den Lamellenkörperchen und den multivesikulären Körperchen der Typ-II-Pneumozyten nachweisen. Napsin A fand sich ferner in den Granula der Clara-Zellen kolokalisiert mit proSP-B. In der BAL ließ sich ein Intermediärprodukt des proSP-B nachweisen, welches von den Clara-Zellen in den Bronchioli sezerniert wird. Schlußfolgerungen: Zusammenfassend zeigen die erzielten Ergebnisse, daß sich die untersuchten lysosomalen Proteasen in ihrer zellulären Verteilung in der humanen Lunge unterscheiden und aufgrund ihrer Lokalisation nur Kathepsin H und Napsin A als Kandidaten für die Prozessierung des Surfactant Proteins B in Typ-II-Pneumozyten in Frage kommen. In den Clara-Zellen ist nur Napsin A ein Kandidat, der in die Prozessierung des Surfactant Proteins B involviert ist, wobei sich aus den Untersuchungen indirekt Hinweise ergaben, daß das proSP-B nur bis zu einem 25 kDa schweren Intermediärprodukt prozessiert wird, das von den Clara-Zellen sezerniert wird und in der BAL nachweisbar ist. Diese unvollständige Prozessierung des proSP-B in Clara-Zellen ist möglicherweise durch das Fehlen von Kathepsin H in diesen Zellen bedingt. Die Untersuchungsergebnisse zeigen, daß auch lysosomale Zystein- und Asparaginproteasen partiell in den komplexen Vorgang der Prozessierung von Surfactant Proteinen eingebunden sind.