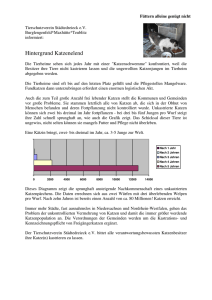
Endoparasitenbefall bei Fund- und Abgabehunden und
Werbung

Tierärztliche Hochschule Hannover Endoparasitenbefall bei Fund- und Abgabehunden und -katzen in Niedersachsen und Untersuchungen zur Anthelminthikaresistenz INAUGURAL-DISSERTATION zur Erlangung des Grades einer Doktorin der Veterinärmedizin - Doctor medicinae veterinariae (Dr. med. vet.) vorgelegt von Monika Rohen aus Sögel Hannover 2009 Wissenschaftliche Betreuung: Univ.-Prof. Dr. T. Schnieder Institut für Parasitologie 1. Gutachter: Univ.-Prof. Dr. T. Schnieder 2. Gutachter: Univ.-Prof. Dr. H. Hackbarth Tag der mündlichen Prüfung: 15.05.2009 Meiner Familie und meinen Freunden Teile der vorliegenden Dissertation wurden bereits auf folgenden Tagungen vorgestellt: C. Epe, M. Rohen, L. Kreienbrock (2007): „Untersuchungen zum Vorkommen von Endoparasiten von Hunden und Katzen in Tierheimen Niedersachsens und Versuche zur Einschätzung der AnthelminthikaWirsamkeit“ Tagung der Deutschen Veterinärmedizinischen Gesellschaft e.V. (DVG) Celle, 04.-06.06.2007 C. Epe, M. Rohen, L. Kreienbrock (2007): “Examinations in endoparasite prevalences in dogs and cats in animal shelters in Lower-Saxony and investigations of anthelmintic resistance” 21st International Conference of the World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) Gent, 19.-23.08.2007 M. Rohen, C. Epe, T. Schnieder, L. Kreienbrock (2008): „Untersuchungen zum Vorkommen von Endoparasiten bei Hunden und Katzen aus Tierheimen in Niedersachsen und Untersuchungen zur Anthelminthikaresistenz“ Tagung der Deutschen Veterinärmedizinischen Gesellschaft e.V. (DVG) Celle, 09.-11.07.2008 Inhaltsverzeichnis Inhaltsverzeichnis 1 Einleitung 1 2 Literaturübersicht 2 2.1 Nematoden 2 2.1.1 Toxocara spp. 2 2.1.2 Toxascaris leonina 7 2.1.3 Hakenwürmer 9 2.1.4 Trichuris spp. 14 2.1.5 Capillaria spp. 16 2.1.6 Aelurostrongylus abstrusus 18 2.2 Zestoden 2.2.1 Taeniiden 20 20 2.2.1.1 Echinococcus spp. 21 2.2.1.2 Taenia spp. 23 2.3 Protozoen 26 2.3.1 Hammondia spp. 26 2.3.2 Neospora caninum 27 2.3.3 Toxoplasma gondii 30 2.3.4 Isospora spp. 34 2.3.5 Giardia duodenalis 37 2.4 Antiparasitika 41 2.4.1 Benzimidazole 41 2.4.2 Tetrahydropyrimidine 43 2.4.3 Makrozyklische Laktone 43 2.4.4 Praziquantel 45 2.5 Anthelminthikaresistenz 46 2.5.1 Definition 46 2.5.2 Vorkommen 46 2.5.3 Diagnostik der Anthelminthikaresistenz 48 2.5.3.1 Kontrollierter Test 48 I Inhaltsverzeichnis 2.5.3.2 Kritischer Test 48 2.5.3.3 Eizahlreduktionstest 49 3 Eigene Untersuchungen 3.1 Material 51 51 3.1.1 Antiparasitika 51 3.1.2 Giardia-Koproantigentest 52 3.1.3 Lösungen 52 3.1.4 Einwegartikel 52 3.1.5 Mehrwegartikel 52 3.1.6 Geräte 53 3.1.7 Computerprogramme 53 3.2 Methoden 54 3.2.1 Auswahl der Tierheime 54 3.2.2 Tiere 55 3.2.3 Probenentnahme und Versand 56 3.2.4 Antiparasitika 57 3.2.5 Kotuntersuchungen 58 3.2.5.1 Kombiniertes Sedimentations-Flotationsverfahren 58 3.2.5.2 Auswanderverfahren nach Baermann 59 3.2.5.3 Ei- bzw. Oozystenzählung nach McMaster 59 3.2.5.4 Prüfung auf Anthelminthikaresistenz mit dem Eizahlreduktionstest 3.2.5.5 Giardia-Koproantigen-Nachweis 3.2.6 Statistische Auswertung 4 Ergebnisse 4.1 Koproskopische Untersuchung 61 63 64 64 4.1.1 Parasitenspektrum und -häufigkeit 64 4.1.2 Kombinationen von Parasiten bei Polyinfektionen 66 4.1.3 Parasitenbefall in unterschiedlichen Altersgruppen 69 4.1.4 Parasitenbefall in Abhängigkeit vom Geschlecht 71 4.1.5 Parasitenbefall in Abhängigkeit vom Aufnahmegrund 72 4.2 Quantitative Kotuntersuchung mit McMaster II 61 74 Inhaltsverzeichnis 4.3 Wirksamkeit der Antiparasitika bei Hunden 76 4.3.1 Eizahlreduktionstest mit Fenbendazol 77 4.3.2 Eizahlreduktionstest mit Pyrantel 77 4.4 Wirksamkeit der Antiparasitika bei Katzen 77 4.4.1 Eizahlreduktionstest mit Fenbendazol 78 4.4.2 Eizahlreduktionstest mit Milbemycinoxim 78 4.4.3 Eizahlreduktionstest mit Pyrantel 78 4.4.4 Wirksamkeit von Praziquantel gegen Taeniiden 79 4.4.5 Wirksamkeit von Fenbendazol gegen A. abstrusus 79 4.5 Giardia-Koproantigennachweis 80 4.5.1 Vergleich des Giardia sp.-Nachweises in dem kombinierten Sedimentations-Flotationsverfahren und dem GiardiaKoproantigennachweis 80 4.5.2 Giardia-Koproantigennachweis in Kombination mit in der Koproskopie nachgewiesenen Parasitenstadien 81 4.5.3 Giardia-Koproantigennachweis in Abhängigkeit zum Alter 82 4.5.4 Giardia-Koproantigennachweis in Abhängigkeit zum Geschlecht 83 4.5.5 Giardia-Koproantigennachweis in Abhängigkeit zum Aufnahmegrund 5 Diskussion 83 85 5.1 Verwendete Methoden 85 5.2 Vorkommen von Endoparasiten 88 5.3 Nachweis von Endoparasiten bei unterschiedlichem Alter 100 5.4 Nachweis von Endoparasiten bei unterschiedlichem Geschlecht 104 5.5 Nachweis von Endoparasiten bei unterschiedlichem Aufnahmegrund 105 5.6 Quantitative Kotuntersuchung mit McMaster 106 5.7 Wirksamkeit der verwendeten Anthelminthika 111 6 Bedeutung für die Tierheime 116 7 Abschließende Beurteilung 122 8 Zusammenfassung 124 9 Summary 126 III Inhaltsverzeichnis 10 Literaturverzeichnis 128 11 Anhang 160 IV 11.1 Fragebogen 160 11.2 Tabellen 161 11.3 Abbildungsverzeichnis 171 11.4 Tabellenverzeichnis 172 11.5 Abkürzungsverzeichnis 175 1 Einleitung 1 Einleitung Tierheime sind vom hygienischen Standpunkt aus gesehen als offene Tierhaltungssysteme anzusehen. Dies gilt ganz besonders für Tierheime, in denen Fundtiere (vor allem Hunde und Katzen) ohne anamnestische Angaben über Herkunft, Impfprophylaxe oder anthelminthische Behandlung aufgenommen werden. Aus Sicherheitsgründen für die bestehende Tierpopulation im Heim wie auch als Schutz von Menschen vor Zoonosen muss ein konsequentes Vorgehen bei Aufnahme von Tieren in das Tierheim eingehalten werden. Neben der umfassenden Impfprophylaxe ist die Erfassung von Parasitosen und deren Behandlung eine wichtige Voraussetzung für das Wohlergehen der Tiere und die Verhütung seuchenhafter Erkrankungen sowie zoonotischer Risiken. Ziel der vorliegenden Arbeit war es, das Endoparasitenspektrum bei Fund- und Abgabehunden und -katzen in Niedersachsen zu untersuchen, um epidemiologische Daten zu sammeln und die Eintrittsuntersuchung sowie die Parasitenbekämpfung zu optimieren. Folgende Fragestellungen wurden bearbeitet: Wie sieht das Endoparasitenspektrum aus? Wie hoch ist die Befallsextensität und -intensität mit Endoparasiten? Gibt es Zusammenhänge zwischen Endoparasitenbefall und Alter, Geschlecht oder Aufnahmegrund der Tiere? Unterscheiden sich die in vorliegender Studie ermittelten Prävalenzen für Giardia sp. hinsichtlich unterschiedlicher Nachweisverfahren (konventionelle koproskopische Verfahren versus kommerziell erhältlicher Giardia-Koproantigennachweis)? Weiterhin sollten vor dem Hintergrund der sich verschärfenden Anthelminthikaresistenzproblematik bei Wiederkäuern und Pferden und neueren Veröffentlichungen aus Australien, die über Resistenzen von Ancylostoma caninumIsolaten gegenüber Pyrantel bei Hunden berichten, mit dieser Studie aktuelle Aussagen über das Vorhandensein einer etwaigen verminderten Anthelminthikawirksamkeit bei Hund und Katze gemacht werden. Dazu wurden mit Hilfe der bislang einzigen in diesem Bereich einsetzbaren Feldmethode, des Eizahlreduktionstests, Untersuchungen zur aktuellen Wirksamkeit handelsüblicher Anthelminthika der Wirkstoffklassen Benzimidazole, Tetrahydropyrimidine und Makrozyklische Laktone gegenüber zuvor nachgewiesener Parasiten durchgeführt. 1 2 Literaturübersicht 2 Literaturübersicht 2.1 Nematoden 2.1.1 Toxocara spp. Aus der Gruppe der Spulwürmer (Familie Ascarididae) verursachen Toxocara canis und Toxocara cati nicht nur die Toxocarose des Hundes bzw. der Katze, sondern sind als Zoonoseerreger auch für die Toxocarose des Menschen verantwortlich. Endwirte von T. canis sind der Hund und andere Kanidenarten, von T. cati die Katze und wildlebende Feliden (ECKERT et al. 2008). Als paratenische Wirte können unter anderem Nagetiere, Schweine, Schafe und auch der Mensch befallen werden (ECKERT et al. 2008). Die Eier von T. canis sind etwas größer als die von T. cati (75 x 90 µm bzw. 65 x 75 µm), kugelförmig und haben eine dicke, raue, alveolierte Schale (THIENPONT et a. 1990). Toxocara-Eier sind sehr widerstandsfähig gegenüber Umweltfaktoren. Die Lebensdauer dieser Eier beträgt in feuchtem Milieu einige Monate bis zu vier Jahre und Kälteperioden werden gut überstanden (LLOYD 1998). Eine Abtötung der Spulwurmeier ist durch Hitze über 70 °C möglich (DEPLAZES 2006). Toxocara-Eier werden ungefurcht ausgeschieden, und in ihnen entwickelt sich bei 15 °C bis 20 °C innerhalb von zwei bis sieben Wochen eine infektionsfähige Larve (BRUNASKA et al. 1995, LLOYD 1998). Nach Aufnahme larvenhaltiger Eier durch paratenische Wirte kommt es in diesen zu einer somatischen Wanderung der Larven in Muskulatur, innere Organe und in das Zentralnervensystem (OLSEN 1962; BURREN 1968; BISSERU 1969; WARREN 1969; LOHMANN 1985; SCHÖN u. STOYE 1986). Eine Entwicklung über das infektionsfähige Stadium hinaus findet in paratenischen Wirten jedoch nicht statt (STOYE 1979). Infektion und Entwicklung von T. canis beim Hund Hunde können sich durch die orale Aufnahme von infektionsfähigen larvenhaltigen Eiern oder durch Übertragung infektiöser Larven (diaplazentar, transmammär oder in paratenischen Wirten) infizieren (STOYE 1979; BOSSE u. STOYE 1981). Die Larven 2 2 Literaturübersicht von T. canis führen eine Körperwanderung durch, deren Verlauf vom Alter, Immunstatus der Tiere und vom Infektionsdruck abhängt (OVERGAAUW 1997b). Eine Möglichkeit ist der tracheale Wanderweg beim jungen Tier. Die infektionsfähigen Larven schlüpfen aus den Eihüllen, penetrieren die Darmwand und gelangen auf dem Blutweg über die Leber in die Lunge, wo sie sich zur IV. Larve entwickeln und dann über Trachea und Pharynx wieder in den Darm gelangen, wo sie nach einer letzten Häutung zu Adulten heranwachsen. Bei älteren Tieren kommt es nur nach einer sehr schwachen Erstinfektion zur trachealen Wanderung und intestinalen Besiedlung. Bei immunen Tieren unterbleibt die tracheale Wanderung und es kommt zur somatischen Wanderung (ZIMMERMANN et al. 1985). Bei dieser Art der Wanderung ist der Weg der Larven bis zur Lunge der gleiche, doch dann verlassen die Larven die Lunge über die Pleurahöhle oder arterielle Kapillaren. Über den großen Kreislauf erfolgt dann die Streuung der Larven in verschiedene Organe, wo sie das Endstromgebiet verlassen und in Granulome oder Kapseln eingeschlossen werden. Bevorzugte Lokalisation dieser somatischen Larven ist die quergestreifte Muskulatur, in der sie jahrelang lebensfähig bleiben (STOYE 1983). Der wichtigste und effizienteste Infektionsmodus für T. canis ist die pränatale Infektion. Hier werden um den 42. Trächtigkeitstag infolge hormoneller Umstellung ruhende Larven aktiviert, die über Blutbahn und Plazenta in die Föten gelangen. Ebenso gelangen dorthin aber auch Larven, die aus Neuinfektionen während der Trächtigkeit stammen. Die pränatal infizierten Welpen scheiden ab Tag 21 post partum Eier mit dem Kot aus, was wiederum zu einem patenten Befall bei der Hündin führen kann (STOYE 1989). Aufgrund der langen Lebensdauer der somatischen Larven in der Muskulatur der Hündin können ohne Neuinfektion mehrere Würfe pränatal infiziert werden (STOYE 1989). Nach der somatischen Wanderung von T. canis kommt es je nach Zeitpunkt der Infektion des Muttertieres auch zur galaktogenen Infektion der Welpen. Bei Erstinfektionen der Hündin bis zum letzten Drittel der Trächtigkeit überwiegt die pränatale Übertragung, danach wird ein größerer Teil der Larven galaktogen übertragen (BOSSE 1980). 3 2 Literaturübersicht Infektion und Entwicklung von T. cati bei der Katze Katzen infizieren sich mit T. cati durch die orale Aufnahme von infektionsfähigen, larvenhaltigen Eiern oder durch Übertragung infektiöser Larven (galaktogen oder in paratenischen Wirten) (SPRENT 1956; SWERCZEK et al. 1971). Auch bei der Katze kommt es zu unterschiedlichen Wanderungen des Parasiten. Bei Infektion mit larvenhaltigen Eiern kommt es zur trachealen Wanderung der Larven mit Ansiedlung im Dünndarm. Ebenso ist der somatische Wanderweg beschrieben und die galaktogene Übertragung von Larven auf Jungtiere. Letztere findet hauptsächlich nach akuter Infektion des Muttertieres statt (COATI et al. 2004). Weiterhin kommt es nach oraler Infektion mit larvenhaltigen Eiern von T. cati auch zur Einwanderung von Larven in die Magenwand. Die Larven vollziehen dort ihre Weiterentwicklung und siedeln sich dann im Dünndarm an. Bei Infektion der Katze durch Larven in paratenischen Wirten oder in der Muttermilch wird ebenfalls diese zuletzt genannte Wanderung beobachtet. Die Larven dringen in die Magen- und Dünndarmwand ein, entwickeln sich dort und kehren dann als Adulte ins Darmlumen zurück. Pränatale Infektionen konnten bei Katzen nicht nachgewiesen werden (COATI et al. 2004). Da während der gesamten Laktationsperiode Larven mit der Milch ausgeschieden werden, erscheint die galaktogene Infektion als bedeutendster Infektionsweg von T. cati (ECKERT et al. 2008). Humane Toxocarose T. canis und T. cati sind als Zoonoseerreger verantwortlich für die Toxocarose des Menschen mit dem Krankheitsbild der Larva migrans visceralis und der Larva migrans ocularis (OVERGAAUW 1997a; DESPOMMIER 2003; FISHER 2003). Infizieren sich Menschen mit larvenhaltigen Eiern von T. canis oder T. cati, wandern die freigesetzten Larven aus dem Darm in die Leber und weitere Organe und Gewebe. Die Larven können sehr lange überleben und verursachen vor allem bei Kindern Erkrankungen. Auch Erwachsene können erkranken, aber in den meisten Fällen ist die Infektion mild und asymptomatisch, mit einer Eosinophilie als einzigem Symptom (CROSS 1994). Das Krankheitsbild der Larva migrans visceralis tritt vorwiegend bei Kindern unter fünf Jahren auf (DESPOMMIER 2003). Klinisch 4 2 Literaturübersicht können unter anderem Fieber, Hepato- und Splenomegalie, Bronchospasmus und Eosinophilie auftreten. Aber auch Myokarditis, Nephritis, zentralnervöse Störungen und das Auftreten von Hautaffektionen wurden beschrieben (DESPOMMIER 2003). Beim Krankheitsbild der Larva migrans ocularis kann es zu Sehstörungen bis hin zur vollständigen Erblindung kommen (DESPOMMIER 2003). Vorkommen und Verbreitung beim Hund Bei koproskopischen Untersuchungen von Hunden in Deutschland wurde ein patenter Befall mit T. canis in 1,95 % bis 11,0 % der untersuchten Kotproben festgestellt (HÖRCHNER et al. 1981; HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004; STAUB 2004). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für T. canis von 2,9 % bis 33,6 % festgestellt werden (SUPPERER u. HINAIDY 1986; HARALABIDIS et al. 1988; FOK et al. 2001; VANPARIJS et al. 1991; DEPLAZES et al. 1995; O´SULLIVAN 1997; OVERGAAUW 1997c; LUTY 2001; HABLUETZEL et al. 2003; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; DUBNÁ et al. 2007; MARTÍNEZ-MORENO et al. 2007; MIRÓ et al. 2007). Offenbar besteht eine Altersdisposition für die Infektion mit T. canis. So waren in der Studie von BARUTZKI u. SCHAPER (2003) im Zeitraum von 1999 bis 2002 Hunde mit einem Alter von bis zu einem Jahr signifikant häufiger befallen als ältere Tiere. Hunde mit einem Alter von bis zu einem Jahr wiesen in der genannten Studie eine Prävalenz für T. canis von 13,3 % auf, bei den Hunden von ein bis fünf Jahren lag die Prävalenz bei 3,5 %, bei den fünf bis zehn Jahre alten Tieren bei 2,5 % und bei den über zehn Jahre alten Tieren bei 1,9 %. Auch in den Studien von MARTÍNEZMORENO et al. (2007) und BATCHELOR et al. (2008) waren junge Hunde bis zu einem Alter von einem Jahr deutlich häufiger mit T. canis befallen als ältere Hunde. In der Studie von LUTY (2001) wurde T. canis am häufigsten bei Hunden bis zu einem Alter von drei Monaten gefunden, auch HARALABIDIS et al. (1988), COGGINS (1998) und FOK et al. (2001) stellten in ihren Studien in dieser Alterskategorie die höchste Befallsrate mit T. canis fest. MARTÍNEZ-MORENO et al. (2007) konnten bei der Untersuchung von 1800 Hunden keinen signifikanten Unterschied in Bezug auf eine Geschlechtsabhängigkeit bei der 5 2 Literaturübersicht Infektion mit T. canis feststellen. In den Studien von VISCO et al. (1977), COGGINS (1998) und HABLUETZEL et al. (2003) wurden jeweils ähnliche Befallsraten für Hündinnen und Rüden festgestellt. Bei kastrierten männlichen und weiblichen Hunden konnten jedoch in mehreren Studien geringere Prävalenzen für T. canis festgestellt werden als bei ihren unkastrierten Artgenossen (VISCO et al. 1977; KIRKPATRICK 1988; PULLOLA et al. 2006). DEPLAZES et al. (1995), die Kotproben von 217 Fundhunden und 154 Abgabehunden bei ihrem Eintritt in ein Tierheim im Kanton Tessin koproskopisch untersuchten, wiesen T. canis bei 17 % der Fundhunde und 14 % der Abgabehunde nach. Vorkommen und Verbreitung bei der Katze Bei Katzen wurden Eier von T. cati bei koproskopischen Untersuchungen in Deutschland mit Prävalenzen von 3,9 % bis 55,0 % nachgewiesen (EMDE 1991, UNBEHAUEN 1991, EPE et al. 1993; RASCHKA et al. 1994; MUNDHENKE 1998; HECKING-VELTMAN 1999, BARUTZKI u. SCHAPER 2003, EPE et al. 2004, DIEFFENBACHER 2006). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für T. cati von 4,7 % bis 60 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; OVERGAAUW 1997c; LUTY 2001; MIRÓ et al. 2004; ROBBEN et al. 2004). Viele Autoren konnten eine Altersabhängigkeit des Spulwurmbefalls bei Katzen feststellen. Eine besonders hohe Befallsrate wurde bei Katzen unter sechs Monaten festgestellt (VISCO et al. 1978; EMDE 1991, UNBEHAUEN 1991, MUNDHENKE 1998) oder bis zu einem Jahr (MERZ-SCHENKER et al. 1976; WILSON-HANSON u. PRESCOTT 1982; SEILER et al. 1983; RASCHKA et al. 1994; BARUTZKI u. SCHAPER 2003; DIEFFENBACHER 2006). Einige Untersucher beobachteten höhere Befallsraten bei weiblichen (RASCHKA et al. 1994; DELAHAY et al. 1998), andere bei männlichen Tieren (KREBITZ 1982; EMDE 1991). In anderen Studien wurden keine Hinweise auf eine Geschlechtsdisposition gefunden (MERZ-SCHENKER et al. 1976; VISCO et al. 1978; HIEPE et al. 1988; UNBEHAUEN 1991; MUNDHENKE 1998; HECKINGVELTMAN 1999). VISCO et al. (1978) stellten einen signifikant verminderten Befall 6 2 Literaturübersicht mit Spulwürmern bei kastrierten Tieren im Vergleich zu ihren unkastrierten Artgenossen fest. In der Studie von OVERGAAUW (1997c) konnte T. cati mit 21 % signifikant häufiger in Kotproben streunender Katzen (n=56) nachgewiesen werden als mit 4,7 % in Proben von Katzen, die in menschlicher Obhut lebten (n=236). Auch MIRÓ et al. (2004) wiesen diesen Parasiten mit 20,3 % häufiger bei streunenden Katzen (n=231) als mit 10,7 % bei Katzen aus menschlicher Obhut (n=103) nach. 2.1.2 Toxascaris leonina Der Spulwurm Toxascaris leonina ist ein weltweit verbreiteter Dünndarmparasit von Hund und Katze und zwischen diesen Wirten wechselseitig übertragbar (ANDERSON 2000). Außerdem ist diese Art bei zahlreichen anderen Feliden und Kaniden nachgewiesen worden (SPRENT 1959). Als paratenische Wirte sind Nagetiere beschrieben (STEFFE 1983). T. leonina kommt seltener vor als ToxocaraArten (DEPLAZES 2006). Die Eier von T. leonina sind 75 x 85 µm groß, kugelförmig bis leicht oval und besitzen eine dicke, glatte und farblose Schale (THIENPONT et al. 1990). Sie werden vom Endwirt ungefurcht mit dem Kot ausgeschieden, und in ihnen entwickelt sich bei 27 °C innerhalb von acht bis neun Tagen eine infektiöse Larve (ANDERSON 2000). Nehmen paratenische Wirte wie z.B. Mäuse solche infektiösen Spulwurmeier auf, schlüpfen die Larven im Darm, vollziehen eine somatische Wanderung und kapseln sich anschließend im Gewebe ein, wo sie lange lebensfähig bleiben können (SPRENT 1952; ANDERSON 2000). Die somatische Wanderung kann auch bei Mäusen zu transmammärer Larvenübertragung führen (STEFFE 1983). Hunde und Katzen infizieren sich mit T. leonina durch orale Aufnahme von Eiern oder paratenischen Wirten, die infektiöse Larven enthalten (DEPLAZES 2006). Die Larven dringen in die Darmwand ein, häuten sich dort und kehren daraufhin wieder in das Darmlumen zurück, wo die Entwicklung zur Geschlechtsreife erfolgt. In geringem Maße kann es zur somatischen Wanderung der Larven in mesenteriale Lymphknoten, Pankreas, Leber, Lunge und Muskulatur kommen (STOYE 1983). 7 2 Literaturübersicht Nach experimenteller Infektion mit embryonierten Eiern werden als Präpatenz 48 bis 77 Tage angegeben (ANDERSON 2000). Vorkommen und Verbreitung beim Hund Bei koproskopischen Untersuchungen von Hunden in Deutschland wurde ein patenter Befall mit T. leonina in 0 % bis 3,9 % der untersuchten Kotproben festgestellt (HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für T. leonina von 0 % bis 13 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; DEPLAZES et al. 1995; O´SULLIVAN 1997; OVERGAAUW 1997c; FOK et al. 2001; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; MIRÓ et al. 2007; DUBNÁ et al. 2007). Vorkommen und Verbreitung bei der Katze Bei Katzen wurde T. leonina in verschiedenen Untersuchungen in Deutschland nicht nachgewiesen (HANSEL u. RUSCHER 1980; HIEPE et al. 1988; BEELITZ et al. 1992; SCHUSTER et al. 1997; MUNDHENKE 1998; HECKING-VELTMAN 1999; BARUTZKI u. SCHAPER 2003). In anderen Studien wurde eine Prävalenz von 0,1 % bis 1,0 % nachgewiesen (EMDE 1991, UNBEHAUEN 1991, EPE et al. 1993; EPE et al. 2004). DIEFFENBACHER (2006), der Kotproben von 101 verwilderten Hauskatzen aus dem Landkreis Neustrelitz koproskopisch untersuchte, konnte T. leonina bei 9,9 % der untersuchten Katzen nachweisen. In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für T. leonina von 0 % bis 5,4 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; OVERGAAUW 1997c; MIRÓ et al. 2004; ROBBEN et al. 2004). 8 2 Literaturübersicht 2.1.3 Hakenwürmer Beim Hund und bei anderen Kaniden kommen in Mitteleuropa die Hakenwurmarten Ancylostoma caninum und Uncinaria stenocephala vor, bei der Katze parasitieren die Arten Ancylostoma tubaeforme und seltener U. stenocephala (ECKERT et al. 2008). Die Verbreitung der Hakenwurmarten ist klimaabhängig, weil für die Entwicklung im Freien unterschiedliche Temperaturansprüche bestehen. Beim Hund kommt U. stenocephala aufgrund seiner Anpassung an gemäßigtes und subarktisches Klima in den entsprechenden Regionen Europas am häufigsten vor, wohingegen A. caninum zwar auch in Zonen mit gemäßigtem Klima, hauptsächlich aber in den Tropen und Subtropen zu finden ist (DEPLAZES 2006). Die Eier dieser Hakenwurmarten sind von ovaler Form mit dünner Schale und enthalten in frischem Kot vier bis 16 Blastomeren. Hinsichtlich der Größe bestehen geringe Unterschiede (A. caninum 52 - 79 x 25 - 58 µm, A. tubaeforme 45 - 78 x 34 57 µm, U. stenocephala 71 - 92 x 35 - 58 µm), jedoch ist eine sichere Unterscheidung im Einzelfall schwierig, da nicht alle Eier in den angegebenen Größenbereichen liegen (DEPLAZES 2006). In den mit den Fäzes ausgeschiedenen Hakenwurmeiern bilden sich die I. Larven, die aus den Eihüllen schlüpfen und sich in Abhängigkeit von den Außentemperaturen über ein zweites Larvenstadium zu infektiösen, bescheideten III. Larven entwickeln (DEPLAZES 2006). Für A. caninum ist diese Entwicklung bei einem Temperaturoptimum von 25 °C bis 30 °C, ausreichender Sauerstoffzufuhr und genügender Feuchtigkeit innerhalb von vier bis fünf Tagen abgeschlossen. Die III. Larven sind in feuchtem Boden mehrere Monate lang lebensfähig. Nagetiere können als paratenische Wirte dienen (ECKERT et al. 2008). Infektiöse Larven von Hakenwürmern können in die Haut des Menschen eindringen und durch ihre Migration ein als Larva migrans cutanea bezeichnetes Krankheitsbild mit Papeln, entzündlich veränderten, gewundenen Wandergängen und Juckreiz verursachen (DEPLAZES 2006). Die Larven wandern für gewöhnlich in der Epidermis für Wochen bis Monate (HEUKELBACH u. FELDMEIER 2008). Selten dringen die Larven weiter in den Körper vor (DEPLAZES 2006). A. caninum kann 9 2 Literaturübersicht Erreger einer eosinophilen Enteritis des Menschen sein, bei der es zur Ansiedlung adulter Parasiten im Darm kommt (CROESE et al. 1996; PROCIV u. CROESE 1996). Infektion und Entwicklung von A. caninum beim Hund Die Entwicklung von A. caninum im Hund ist sehr komplex. Eine Infektion mit infektionsfähigen III. Larven von A. caninum kann perkutan und per os durch die Aufnahme von mit III. Larven infizierten paratenischen Wirten, durch die Aufnahme von III. Larven aus der Umgebung oder durch eine galaktogene Übertragung von III. Larven auf die Welpen erfolgen (ANDERSON 2000). Gelangen infektionsfähige III. Larven auf die Haut, dringen sie innerhalb kurzer Zeit in die Haarwurzelscheiden und Anhangsdrüsen ein, wobei sie in der Regel ihre Scheide abstreifen. Von den Haarfollikeln aus erfolgt die weitere Migration in die Subkutis, hier gelingt es einem Teil der Larven in venöse Kapillaren oder Lymphgefäße einzudringen und somit über das rechte Herz in die Lunge und von dort über Pharynx, Oesophagus und Magen in den Darm zu gelangen (trachealer Wanderweg), wo sie sich zum adulten Hakenwurm entwickeln (STOYE 1983). Ein Teil der perkutan eingedrungenen Larven vollzieht eine somatische Wanderung vom Infektionsort oder von der Lunge aus in verschiedene Gewebe, wo sie dann ihre Aktivität einbüßen und als hypobiotische III. Larven jahrelang überleben können. Hauptlokalisation solcher Stadien sind die quergestreifte Muskulatur und das Fettgewebe (STOYE 1983). Aufgrund hormoneller Einflüsse wird im Muttertier ein Teil der hypobiotischen Larven gegen Ende der Trächtigkeit und während des Östrus reaktiviert (STOYE u. KRAUSE 1976). Die so reaktivierten Larven gelangen durch transsomatische Wanderung in die Milchdrüse, diese kann jedoch auch durch III. Larven, welche erst kurz zuvor in die Hündin eingedrungen sind, befallen werden (GEISER et al. 1992). Die Larvenausscheidung mit der Milch findet vorwiegend in der ersten Laktationswoche statt, jedoch können geringere Mengen auch bis zum Ende der Säugeperiode ausgeschieden werden (GEISER et al. 1992). Ohne dass eine erneute Infektion der Hündin stattgefunden haben muss, können auch in späteren Trächtigkeiten die in der Muskulatur und im Fettgewebe verharrenden hypobiotischen Larven reaktiviert und über die Milch ausgeschieden werden. Dabei 10 2 Literaturübersicht nimmt die Intensität der Larvenausscheidung mit steigender Laktationszahl ab (STOYE 1992). Nach einer oralen Infektion mit frei lebenden III. Larven wandert der größte Teil der Larven in die Dünndarmwand ein, entwickelt sich zum IV. Larvenstadium und kehrt in das Darmlumen zurück, wo sie sich zu Adulten entwickeln (STOYE 1983). Dies führt zu einem stärkeren Befall des Darms als nach perkutaner Infektion (STOYE 1983, 1992). Nur ein kleiner Teil der oral aufgenommenen Larven dringt in das Blutgefäßsystem ein, um eine tracheale Wanderung zu vollziehen (STOYE 1983). Nach einer oralen Infektion mit galaktogen oder mit paratenischen Wirten übertragener III. Larven kommt es im Hund wahrscheinlich vorwiegend zu einer Direktansiedlung im Darm und nur selten zur Körperwanderung (STOYE 1983). Die präadulten und adulten Stadien von Ancylostoma-Arten saugen sich an der Dünndarmmukosa fest. Dadurch entstehen kleine Läsionen, durch die Blut austritt, das von den Hakenwürmern aufgenommen wird oder in den Darmkanal des Wirtes verloren geht (ECKERT et al. 2008). Als klinische Erscheinungen können bei Befall mit Ancylostoma-Arten Abmagerung, rasche Ermüdbarkeit, Durchfall (oft auch blutig), Exsikkose und Anämie auftreten (DEPLAZES 2006). Infektion und Entwicklung von A. tubaeforme bei der Katze Die Katze infiziert sich mit A. tubaeforme perkutan oder per os, die Biologie ist ähnlich wie bei A. caninum. Auch hier sind die III. Larven die infektiösen Stadien und nach oraler Infektion kommt es zur Direktansiedlung im Darm, nach perkutaner Infektion ist eine Körperwanderung vor der Darmbesiedlung eingeschaltet. Die Präpatenzzeiten betragen je nach Infektionsmodus 19 bis 22 Tage (DEPLAZES 2006). Über transmammäre Infektionen ist nichts bekannt. Infektion und Entwicklung von U. stenocephala bei Hund bzw. Katze Bei U. stenocephala erfolgt die Infektion des definitiven Wirtes Hund bzw. Katze vorwiegend durch die orale Aufnahme infektiöser Larven. Eine perkutane Infektion von Endwirten mit anschließender trachealer Wanderung der Larven ist nur von untergeordneter Bedeutung, da nur wenige den Dünndarm erreichen und die Entwicklung zu adulten Stadien durchlaufen (ANDERSON 2000). Es wird bei dieser 11 2 Literaturübersicht Art keine Körperwanderung nach oraler Infektion beschrieben. Die III. Larven werfen im Magen ihre Scheide ab und dringen in die Drüsenlumina der Pylorusregion und des Duodenums ein. Schon zwei Tage p.i. sind die Larven im Lumen des Dünndarms anzutreffen, wo sie die Häutungen zu IV. und V. Larven und schließlich die Weiterentwicklung zu Adulten vollziehen (ANDERSON 2000). Weder experimentelle Untersuchungen noch epidemiologische Beobachtungen gaben Hinweise auf das Vorkommen pränataler oder transmammärer Infektionen (FEILKE 1985). U. stenocephala heftet sich zwar ebenfalls an der Darmwand fest, ernährt sich jedoch im Gegensatz zu A. caninum nicht hämatophag, sondern vorwiegend von Gewebebestandteilen (DEPLAZES 2006). Starker intestinaler Befall mit U. stenocephala führt zu verzögertem Wachstum, Abmagerung, schleimigem Durchfall und teils auch zur Hypoproteinämie (ECKERT et al. 2008). Vorkommen und Verbreitung von Hakenwürmern beim Hund Bei koproskopischen Untersuchungen von Hunden in Deutschland wurde ein patenter Befall mit Hakenwürmern in 1,1 % bis 3,2 % der untersuchten Kotproben festgestellt (HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). In anderen europäischen Ländern konnten für Hakenwürmer bei koproskopischen Untersuchungen Prävalenzen von 0 % bis 18 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; DEPLAZES et al. 1995; O´SULLIVAN 1997; OVERGAAUW 1997c; FOK et al. 2001; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; MIRÓ et al. 2007; DUBNÁ et al. 2007). Ob eine Altersdisposition besteht, ist unklar. BARUTZKI u. SCHAPER (2003) stellten Hakenwurmbefall signifikant häufiger bei bis zu einem Jahr alten Hunden fest als bei Tieren über einem Jahr. SOWEMIMO u. ASAOLU (2008) stellten Hakenwurmbefall am häufigsten bei jungen Hunden bis zu einem Alter von sechs Monaten fest. MARTÍNEZ-MORENO et al. (2007) konnten Hakenwürmer in einer Studie in Spanien jedoch häufiger bei Tieren über einem Jahr nachweisen als bei jüngeren Tieren (Prävalenzen bei Hunden unter vier Monaten: 16,8 %; vier bis 12 Monate: 28,9 %; 12 bis 36 Monate: 42,8 %; über 36 Monate: 41,9 %). Auch KIRKPATRICK (1988) stellte Hakenwurmbefall häufiger bei älteren Tieren über zwei Jahren fest. 12 2 Literaturübersicht Vorkommen und Verbreitung von Hakenwürmern bei der Katze Bei Katzen lagen die Befallshäufigkeiten in Deutschland koproskopischen Untersuchungen zufolge bei 0 % bis 2 % (EMDE 1991, UNBEHAUEN 1991, EPE et al. 1993; RASCHKA et al. 1994, MUNDHENKE 1998; HECKING-VELTMAN 1999, BARUTZKI u. SCHAPER 2003, EPE et al. 2004, DIEFFENBACHER 2006). In der Studie von RASCHKA et al. (1994) wurden bei der Sektion von überwiegend streunenden Katzen (n=111) aus Sachsen und Thüringen keine Hakenwürmer nachgewiesen. Auch HIEPE et al. (1988) wiesen keine Stadien von Hakenwürmern bei der Sektion von Katzen (n=170) aus Deutschland nach. SCHUSTER et al. (1997) konnten jedoch bei der Sektion von Katzen aus Ostbrandenburg (n=155) A. tubaeforme mit einer Prävalenz von 17 % nachweisen. In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für Hakenwürmer von 0 % bis 3,0 % festgestellt werden (SUPPERER u. HINAIDY 1986; OVERGAAUW 1997c; MIRÓ et al. 2004; ROBBEN et al. 2004). VANPARIJS et al. (1991) fanden Hakenwurmeier in Kotproben von streunenden Katzen (n=30) sogar in 36,6 %. SUPPERER u. HINAIDY (1986) stellten bei der Untersuchung der MagenDarm-Trakte von 421 Katzen aus Österreich A. tubaeforme mit einer Gesamtprävalenz von 14,0 % fest. In der genannten Studie wurde dabei ein deutlich höherer Befall von Landkatzen (17,1 %) im Vergleich zu Stadtkatzen (1,2 %) festgestellt. Ob eine Altersdisposition besteht, ist unklar. VISCO et al. (1978) wiesen einen patenten Hakenwurmbefall am häufigsten bei Katzen im Alter von ein bis fünf Jahren nach. WILSON-HANSON u. PRESCOTT (1982) wiesen Hakenwürmer nur in Katzen mit einem Alter von über zwei Jahren und UNBEHAUEN (1991) nur in über einem Jahr alten Katzen nach. HECKING-VELTMAN (1999) hingegen wies diese Parasiten bereits in Kotproben von Katzen unter sechs Monaten nach. Aufgrund niedriger Befallsraten konnten in genannter Studie jedoch keine signifikanten Unterschiede in Bezug auf die Befallsraten in den einzelnen Altersklassen gefunden werden. Weiterhin wies HECKING-VELTMAN (1999) Hakenwurmeier nur in Kotproben von männlichen Tieren nach, aufgrund der niedrigen Fallzahlen war jedoch keine statistische Berechnung möglich. Gemäß einer Studie von VISCO et al. (1978) gibt es keine Hinweise auf eine Geschlechtsdisposition. UNBEHAUEN (1991), die 1989 13 2 Literaturübersicht und 1990 Kotproben von Katzen aus dem Raum Lübeck mit einer Flotationsmethode untersuchte, wies Eier von Hakenwürmern bei 4,1 % der untersuchten Kotproben von verwilderten Katzen (n=98) nach, bei Katzen ohne Auslauf (n=276) hingegen wurden Stadien von Hakenwürmern nicht nachgewiesen. 2.1.4 Trichuris spp. Hund, Fuchs und andere Kaniden sind mit Nematoden der Gattung Trichuris recht häufig, Katzen dagegen sehr selten befallen. Die Art Trichuris vulpis kommt bei Hund, Fuchs und Katze in vielen Teilen der Welt vor (TAYLOR et al. 2007). Bei Katzen wurden auf dem amerikanischen Kontinent und in Australien weitere Arten, Trichuris campanula, Trichuris serrata und Trichuris felis gefunden (ECKERT et al. 2008). Infektionen des Menschen mit T. vulpis werden nur selten beobachtet (DEPLAZES 2006). Die Eier sind zitronenförmig, bräunlich und haben zwei Polpfröpfe. Die Größe beträgt bei Eiern von T. vulpis 70 - 85 x 36 - 40 µm. Sie werden in ungefurchtem Zustand ausgeschieden und sind sehr widerstandsfähig. Bei genügender Feuchtigkeit und günstigen Temperaturen bildet sich binnen neun bis zehn Tagen die infektionsfähige I. Larve, die im Ei verbleibt. Unter optimalen Bedingungen bleiben die Eier jahrelang infektiös (TAYLOR et al. 2007). Hunde und Katzen infizieren sich mit T. vulpis durch die perorale Aufnahme infektiöser Eier. Die Larven schlüpfen im Duodenum und Jejunum aus den Eihüllen und schließen in der Schleimhaut des Dünn- und Dickdarmes eine etwa zehn Tage dauernde histotrope Phase an. Daraufhin erfolgt die Besiedlung des Zäkums, seltener auch des Kolons. Die Präpatenz beträgt neun bis 13 Wochen (ECKERT et al. 2008). Vorkommen und Verbreitung beim Hund Die Prävalenzen dieses Parasiten sind bei Hunden je nach Haltungsart und Region variabel. Bei Kotuntersuchungen von Hunden in Deutschland wurde ein Befall mit T. vulpis in 0,2 % bis 3,2 % der untersuchten Kotproben festgestellt (HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 14 2 Literaturübersicht 2004). In anderen europäischen Ländern konnten für T. vulpis bei koproskopischen Untersuchungen Prävalenzen von 0 % bis 34,1 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; DEPLAZES et al. 1995; O´SULLIVAN 1997; OVERGAAUW 1997c; FOK et al. 2001; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; MIRÓ et al. 2007; DUBNÁ et al. 2007). Bei OVERGAAUW u. BOERSEMA (1998) waren von 286 erwachsenen Hunden aus 32 Hundezuchten aus den Niederlanden 29 % mit T. vulpis befallen, von den in dieser Studie untersuchten Tieren unter sechs Monaten Lebensalter (n=159) jedoch keines. Auch in der Studie von VISCO et al. (1977) waren Hunde unter sechs Monaten im Vergleich zu den älteren Tieren signifikant vermindert mit T. vulpis befallen. VANPARIJS et al. (1991) konnten mit 24,7 % einen vermehrten Befall von Rassehunden aus Zwingern (n=246) im Vergleich zu 7,0 % von streunenden Hunden (n=2324) feststellen. Vorkommen und Verbreitung bei der Katze Bei der Katze wurden Trichuris spp. bei verschiedenen koproskopischen Untersuchungen in Deutschland nicht nachgewiesen (RASCHKA et al. 1994, MUNDHENKE 1998; HECKING-VELTMAN 1999, BARUTZKI u. SCHAPER 2003, EPE et al. 2004, DIEFFENBACHER 2006) bzw. in Prävalenzen von 0,1 % bis 1,4 % (HANSEL u. RUSCHER 1980; EMDE 1991, UNBEHAUEN 1991, EPE et al. 1993). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für Trichuris spp. von 0 % bis 0,4 % festgestellt werden (MERZSCHENKER et al. 1976; SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; OVERGAAUW 1997c; MIRÓ et al. 2004; ROBBEN et al. 2004). 15 2 Literaturübersicht 2.1.5 Capillaria spp. Bei Hund und Katze parasitieren verschiedene Capillaria-Arten in unterschiedlicher Häufigkeit und Lokalisation, u.a. Capillaria putorii (syn. Aonchotheca putorii) im Magen und Dünndarm, Capillaria aerophila (syn. Eucoleus aerophilus) in der Trachea und den Bronchien, seltener in Nasen- und Stirnhöhlen, Capillaria plica (syn. Pearsonema plica) in der Harnblase und Capillaria hepatica (syn. Calodium hepaticum) in der Leber. Die Eier von Capillaria-Arten sind den Trichuris-Eiern morphologisch ähnlich, jedoch sind die Seitenwände oft nicht so stark und regelmäßig gewölbt (DEPLAZES 2006). C. putorii parasitiert bei Musteliden, Hund, Katze und Igel (TAYLOR et al. 2007). Die Eier sind 54 - 66 x 21 - 26 µm groß, mit zwei flachen Polpfröpfen versehen (DEPLAZES 2006) und finden sich im Kot. Neue Wirte infizieren sich durch Aufnahme larvenhaltiger Eier oder über Regenwürmer als Zwischenwirte (ANDERSON 2000). Die Präpatenz beträgt etwa vier Wochen, bei Katzen kann die Eiausscheidung jedoch fehlen (DEPLAZES 2006). C. aerophila parasitiert bei Fuchs, Hund, Katze und selten auch beim Menschen (TAYLOR et al. 2007). Die Eier sind 60 - 70 x 35 - 40 µm groß, bräunlich und mit zwei Polpfröpfen versehen (DEPLAZES 2006). Sie werden im Respirationstrakt hochgeflimmert oder -gehustet und gelangen über den Rachen und den MagenDarm-Trakt mit dem Kot in die Außenwelt. Sie können daher nicht nur im Kot, sondern auch in Schleimproben aus dem Respirationstrakt nachgewiesen werden (DEPLAZES 2006). In diesen Eiern entwickeln sich unter optimalen Bedingungen in 35 bis 45 Tagen infektiöse Stadien (ANDERSON 2000). In experimentellen Untersuchungen gelang eine Infektion von Katzen, Hunden und Füchsen mit infizierten Regenwürmern (ANDERSON 2000). Die nach Aufnahme infizierter Regenwürmer im Darm freiwerdenden Larven erreichen in einem neuen Wirt auf dem Lymph-Blut-Weg innerhalb von sieben bis zehn Tagen die Lunge, wo sie sich in den Respirationswegen ansiedeln (DEPLAZES 2006). Die Präpatenz beträgt etwa vier Wochen, die Lebensdauer der Parasiten im Wirt ca. zehn bis elf Monate (DEPLAZES 2006). 16 2 Literaturübersicht C. plica parasitiert bei Fuchs, Hund und Katze (TAYLOR et al. 2007). Die Eier sind 55 - 67 x 26 - 29 µm groß, mit zwei flachen Polpfröpfen versehen (DEPLAZES 2006) und finden sich im Urin. Regenwürmer sind als Zwischenwirte für die Übertragung notwendig. Im Endwirt gelangt die Larve nach oraler Aufnahme und Penetration der Darmwand auf hämatogenem Weg in das Nierenbecken und die Harnblase. Die Präpatenz beträgt 58 bis 63 Tage (DEPLAZES 2006). C. hepatica parasitiert bei Nagern und Lagomorpha, kommt aber auch bei anderen Säugetierarten wie z.B. dem Hund und der Katze sowie beim Menschen vor (ANDERSON 2000, TAYLOR et al. 2007). Die Eier sind 56 - 62 x 28 - 32 µm groß und finden sich im Lebergewebe (ECKERT et al. 2008). Sie werden beim Tod des Wirtes oder nach Verzehr desselben durch einen Karnivoren frei, von dem die Eier durch Verdauung freigesetzt und im Kot ausgeschieden werden. Im Freien entwickelt sich im Ei in feuchtem Milieu bei 25 °C in 35 bis 45 Tagen eine infektiöse Larve (ANDERSON 2000). Nach Aufnahme infektiöser Eier durch einen neuen Wirt schlüpfen die Larven im Darm aus ihren Eihüllen, wandern im Blutstrom zur Leber und siedeln sich dort an. Nach einer Präpatenz von 21 Tagen erfolgt die Eiablage. Vorkommen und Verbreitung beim Hund Bei koproskopischen Untersuchungen von Hunden in Deutschland wurde ein patenter Befall mit Eiern von Capillaria spp. in 0 % bis 0,7 % der untersuchten Kotproben festgestellt (HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für Capillaria spp. von 0 % bis 1 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; DEPLAZES et al. 1995; O´SULLIVAN 1997; OVERGAAUW 1997c; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; MIRÓ et al. 2007; DUBNÁ et al. 2007). Vorkommen und Verbreitung bei der Katze Bei Katzen wurden Eier von Capillaria spp. bei 0 % bis 4,6 % der koproskopischen Untersuchungen in Deutschland gefunden (HANSEL u. RUSCHER 1980; EMDE 1991; UNBEHAUEN 1991; BEELITZ et al. 1992; EPE et al. 1993; RASCHKA et al. 17 2 Literaturübersicht 1994; MUNDHENKE 1998; HECKING-VELTMAN 1999, BARUTZKI u. SCHAPER 2003, EPE et al. 2004, DIEFFENBACHER 2006). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Eier von Capillaria spp. in 0 % bis 11,2 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; OVERGAAUW 1997c; MIRÓ et al. 2004; ROBBEN et al. 2004). MUNDHENKE (1998) und HECKING-VELTMAN (1999) stellten bei jungen Katzen in der Altersgruppe von bis zu sechs Monaten eine Prävalenz für Capillaria spp. von 2,5 % bzw. 2,6 % fest, in der Altersgruppe von über zwei Jahren waren es bei HECKING-VELTMAN (1999) noch 1,5 %. In verschiedenen Studien wurde Capillaria spp. häufiger bei Landkatzen nachgewiesen als bei Stadtkatzen (SUPPERER u. HINAIDY 1986, HIEPE et al. 1988). UNBEHAUEN (1991), die Kotproben von Katzen aus dem Raum Lübeck untersuchte, wies Eier von Capillaria spp. bei 4,1 % der untersuchten Kotproben von verwilderten Katzen (n=98) nach, bei Katzen ohne Auslauf (n=276) hingegen wurden Eier von Capillaria spp. nicht nachgewiesen. 2.1.6 Aelurostrongylus abstrusus Aelurostrongylus abstrusus parasitiert in den Bronchioli und Alveolen der Lunge bei Katzen weltweit (ANDERSON 2000; TAYLOR et al. 2007; TRAVERSA u. GUGLIELMINI 2008). Katzen dienen als Endwirte dieses Parasiten, Landschnecken als Zwischenwirte. Schnecken verzehrende Tiere wie Amphibien, Reptilien, Vögel und Nagetiere können als paratenische Wirte dienen (ANDERSON 2000; TAYLOR et al. 2007; TRAVERSA u. GUGLIELMINI 2008). Der Nachweis der I. Larve von A. abstrusus erfolgt koproskopisch mittels Auswanderverfahren nach BaermannWetzel oder durch mikroskopische Untersuchung von Trachealsekret. Ein von ECKERT u. LÄMMLER (1972) beschriebenes Sedimentations-Flotationsverfahren mit Zinksulfatlösung gilt ebenfalls als geeignet. Die Larven sind 300 - 390 µm groß und an dem typischen GUGLIELMINI 2008). 18 S-förmigen Hinterende erkennbar (TRAVERSA u. 2 Literaturübersicht Die bis zu 10 mm großen adulten Lungenwürmer legen in den Bronchiolen und Alveolen ihre Eier ab. Die I. Larve schlüpft bereits in den Atemwegen der Katze, wird in den Pharynx hochgehustet, dort abgeschluckt und nach der Magen-DarmPassage mit dem Kot ausgeschieden (TRAVERSA u. GUGLIELMINI 2008). In der Außenwelt dringen die Larven aktiv in Landschnecken ein und entwickeln sich dort zu infektionsfähigen III. Larven. Katzen können sich durch die Aufnahme der befallenen Zwischenwirte, häufiger aber durch Schnecken verzehrende Transportwirte infizieren (ANDERSON 2000; TAYLOR et al. 2007). Die im Verdauungskanal der Katzen freiwerdende III. Larve penetriert die Ösophagus-, Magen- oder Darmwand, erreicht über den Lymph-Blutweg die Lunge und setzt sich in den Alveolen fest (ANDERSON 2000; TAYLOR et al. 2007; TRAVERSA et al. 2008). Die Präpatenz beträgt zwischen 35 und 63 Tagen, die Patenz bis zu zwei Jahre (DEPLAZES 2006). Vorkommen und Verbreitung bei der Katze Aufgrund von Kotuntersuchungen mittels Auswanderverfahrens nach Baermann wurde für die Katze in Deutschland eine Prävalenz von 0 % bis 1,0 % angegeben (EPE et al. 1993; RASCHKA et al. 1994; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). TAUBERT et al. (2008), die in den Jahren 2003 bis 2007 231 Kotproben von Katzen mit klinischen Symptomen aus Deutschland mit dem Auswanderverfahren nach Baermann untersuchten, stellten eine Prävalenz von 5,6 % fest. Bei Sektionen von 170 Katzen aus der ehemaligen DDR lag die Befallshäufigkeit bei 15,3 % (HIEPE et al. 1988). SCHUSTER et al. (1997), die 155 Katzen aus dem Osten Brandenburgs einer parasitologischen Sektion unterzogen, stellten diesen Parasiten bei 10 % der Tiere fest. RASCHKA et al. (1994), die 111 überwiegend streunende Katzen aus Thüringen und Sachsen koproskopisch und durch parasitologische Teilsektion untersuchte, stellte diesen Parasiten jedoch bei keiner der untersuchten Katzen fest. In anderen europäischen Ländern konnte aufgrund von Kotuntersuchungen mittels Auswanderverfahrens eine Befallshäufigkeit von 2,6 % bis 18,5 % festgestellt werden (ROBBEN et al. 2004; TRAVERSA et al. 2008; PAYOPUENTE et al. 2008). 19 2 Literaturübersicht In der Studie von TRAVERSA et al. (2008) waren Katzen mit Freigang und junge Tiere unter einem Jahr signifikant häufiger befallen als Wohnungskatzen bzw. Tiere über einem Jahr. HIEPE et al. (1988) fanden A. abstrusus in der Sektion häufiger bei Landkatzen (20,8 %) als bei Stadtkatzen (2,0 %). SUPPERER u. HINAIDY (1986), die Magen-Darm-Trakte von Katzen aus Österreich (n=421) untersuchten, konnten diesen Parasiten mit einer Prävalenz von 1,8 % nur bei Landkatzen, bei Stadtkatzen jedoch nicht nachweisen. 2.2 Zestoden Hund und Katze sind Endwirte verschiedener Bandwurmarten, die im Dünndarm parasitieren (intestinaler Bandwurmbefall). Gelegentlich können sie aber auch Fehlwirte für larvale Stadien von Zestoden (Metazestoden) sein, die sich in Organen außerhalb des Darmes ansiedeln (extraintestinaler Befall mit Metazestoden). Der intestinale Bandwurmbefall ist für Hund und Katze kaum pathogen (DEPLAZES 2006). Dennoch ist seine Bekämpfung äußerst wichtig, da Bandwurmträger eine Infektionsquelle für Zwischen- und Fehlwirte darstellen, unter anderem für Haus- und Wildsäugetiere sowie z.T. für Menschen, in denen sich Metazestoden entwickeln, welche eine erhebliche Pathogenität entfalten können (DEPLAZES 2006). 2.2.1 Taeniiden Die weltweit verbreitete Familie der Taeniiden besteht aus den Gattungen Taenia und Echinococcus. Als Adultstadium parasitieren Vertreter dieser Familie im Dünndarm von Menschen (Taenia spp.) oder Karnivoren (Taenia spp. und Echinococcus spp.) und sind nur wenig pathogen. Dagegen können sich die zweiten Larvenstadien einiger Arten (Finnen, Metazestoden) in Säugetieren und akzidentiell auch im Menschen entwickeln und im Falle der Echinokokkose schwere Erkrankungen und Todesfälle hervorrufen (DEPLAZES 2006). Eier von Arten der Familie Taeniidae können morphologisch nicht differenziert werden, daher kann aufgrund des koprologischen Nachweises der Eier immer nur 20 2 Literaturübersicht eine Familiendiagnose gestellt werden. Die Eier sind kugelförmig, 26 - 41 x 24 40 µm groß und enthalten eine dicke, radiär gestreifte Embryophore mit Onkosphäre (DEPLAZES 2006). Vor diesem Hintergrund sind Taeniideneier im Kot eines Tieres immer als potenzielle Erreger einer schweren Zoonose zu betrachten. Zur weiteren Differenzierung von Parasiten aus der Familie der Taeniidae können immunologische und molekularbiologische Methoden eingesetzt werden. So sind Koproantigen-ELISAs für verschiedene Taenia-Arten entwickelt worden. Zudem steht mit einem Kopro-DNA-Nachweis für Echinococcus multilocularis ein hochspezifischer und hochsensitiver Test zur Verfügung. 2.2.1.1 Echinococcus spp. Echinococcus granulosus und Echinococcus multilocularis sind zwei Bandwurmarten von Karnivoren mit zoonotischem Potential. Sie verursachen als Larvenstadien die Zystische Echinokokkose bzw. die Alveoläre Echinokokkose. Diese Erkrankungsformen gehören zu den wichtigsten parasitären Zoonosen Europas (DEPLAZES 2006). In Deutschland fällt die Echinokokkose des Menschen unter das Infektionsschutzgesetz und ist meldepflichtig. 2.2.1.1.1 E. granulosus Als Endwirt für E. granulosus gelten der Hund und andere Kaniden, als Zwischenwirte eine Vielzahl von herbivoren oder omnivoren Ungulaten (RAUSCH 1995). Es existieren morphologisch, verschiedene biologisch und Stämme auch von genetisch E. granulosus, die voneinander sich unterscheiden (PEARSON et al. 2002; THOMPSON u. McMANUS 2002; VAN HERWERDEN et al. 2000; LAVIKAINEN et al. 2003; ECKERT u. DEPLAZES 2004). Die Eier von E. granulosus gelangen mit den Proglottiden in die Außenwelt oder werden bereits im Darm frei und mit dem Kot ausgeschieden (ECKERT u. DEPLAZES 2004). Sie können von Zwischen- bzw. Fehlwirten wie Schafen, Ziegen, Rindern, Schweinen und Pferden oder auch vom Menschen oral aufgenommen werden (ECKERT u. DEPLAZES 2004). Im Darm der Zwischen- oder Fehlwirte schlüpfen aus den Eiern die Onkosphären, die in die Darmwand eindringen und auf dem Blutweg in die Leber, aber zum Teil auch in die Lunge sowie in andere Organe 21 2 Literaturübersicht gelangen. Aus den Onkosphären entstehen zunächst kleine Bläschen, die allmählich zu Finnen (Metazestoden) heranwachsen. Die Finne von E. granulosus stellt im typischen Fall eine mit Flüssigkeit gefüllte, ein- oder mehrkammerige Blase dar (auch Zyste genannt). In dieser kommt es frühestens fünf bis sechs Monate nach der Infektion zur Bildung zahlreicher Kopfanlagen (Protoskolizes). Das Wachstum der Finnen und die Produktion der Kopfanlagen erfolgt langsam. Hauptlokalisation der Finnen von E. granulosus sind Leber und Lunge, seltener andere Organe. Die Krankheitserscheinungen werden durch das starke expansive Wachstum der Finnen verursacht. Der Endwirt infiziert sich durch den Verzehr von Schlachtabfällen (Innereien) oder Beutetieren, die fertile Finnen von E. granulosus enthalten. Aus den Protoskolizes entwickeln sich im Dünndarm innerhalb einiger Wochen geschlechtsreife Stadien. Die Präpatenz variiert bei einzelnen Stämmen von E. granulosus zwischen etwa fünf und acht Wochen (THOMPSON 1995). Die Infektion verläuft beim Endwirt in der Regel symptomlos, auch bei starkem Befall (ECKERT et al. 2001). In Nord- und Mitteleuropa ist E. granulosus-Befall selten geworden (ECKERT et al. 2008). Bei Hunden in Deutschland, Österreich und der Schweiz kommt er nur sporadisch vor (ECKERT et al. 2008). 2.2.1.1.2 E. multilocularis E. multilocularis zeigt einen Lebenszyklus mit Karnivoren als Endwirt und typischerweise Nagern als Zwischenwirt (SCHANTZ et al. 1995). Der wichtigste Endwirt von E. multilocularis für den Erhalt des Zyklus ist in Mitteleuropa der Rotfuchs (Vulpes vulpes). Doch können unter anderem auch Hund und Katze Träger dieses Bandwurmes sein, wobei die Katze weniger empfänglich für E. multilocularis ist (VOGEL 1957; CRELLIN et al. 1981; THOMPSON u. ECKERT 1983; JENKINS u. ROMIG 2000; THOMPSON et al. 2003; KAPEL et al. 2006; THOMPSON et al. 2006). Der Zyklus von E. multilocularis entspricht im Prinzip dem von E. granulosus, weist aber wichtige Besonderheiten auf. Auch die Eier von E. multilocularis können von Zwischenwirten oder gelegentlich auch vom Menschen und anderen Fehlwirten aufgenommen werden. Im Darm der Zwischen- oder Fehlwirte schlüpft aus dem Ei die Onkosphäre, die nach Penetration der Darmwand hämatogen in die Leber gelangt und sich dort zur Finne 22 2 Literaturübersicht (Metazestode) entwickelt. Diese Finne zeichnet sich durch ihr tumorartiges, infiltratives Wachstum aus und kann metastasieren. Im natürlichen Zwischenwirt entwickeln sich im Verlauf von 40 bis 60 Tagen in den Finnen zahlreiche Kopfanlagen (Protoskolizes), wodurch sie für den Endwirt infektiös werden. Durch den Verzehr eines infizierten Zwischenwirtes gelangt das Metazestodengewebe in den Magen-Darm-Trakt des Endwirtes. Hier entwickelt sich der adulte Fuchsbandwurm, der bei starkem Befall den gesamten Dünndarm besiedeln kann. Die Präpatenz beträgt ca. vier bis fünf Wochen, die Patenz ca. sechs Monate (DEPLAZES 2006). E. multilocularis ist in der nördlichen Hemisphäre weit verbreitet (DEPLAZES 2006). Die Prävalenzen von E. multilocularis bei Füchsen in Europa schwanken in verschiedenen Gebieten zwischen unter einem bis über 70 %. Trotz hoher Prävalenz bei Füchsen sind Hunde und Katzen im Durchschnitt relativ selten Träger des Parasiten, z.B. waren in der Ostschweiz 0,3 % von 660 Hunden und 0,4 % von 263 Katzen mit diesem Parasiten befallen (DEPLAZES et al. 1999). 2.2.1.2 Taenia spp. Bei Hund und Katze parasitieren mehrere Taenia-Arten. In Mitteleuropa ist beim Hund vor allem Taenia hydatigena, bei der Katze Taenia taeniaeformis von Bedeutung. Als Zwischenwirte fungieren bei T. hydatigena unter anderem Haus- und Wildwiederkäuer sowie Schweine, bei T. taeniaeformis Nagetiere. In seltenen Fällen kann auch der Mensch als Fehlwirt verschiedener Taenia-Arten dienen. Die Eier gelangen mit den Proglottiden in die Außenwelt, oder sie werden bereits im Darm frei und mit dem Kot ausgeschieden. Zwischenwirte infizieren sich durch die orale Aufnahme von Eiern oder Proglottiden. Im Darm der Zwischenwirte schlüpfen aus den Eiern die Onkosphären, diese dringen in die Darmwand ein und gelangen über die Pfortader in die Leber. Die Finnen von T. taeniaeformis entwickeln sich in der Leber, die von T. hydatigena auch im Netz und Gekröse des Zwischenwirtes. Hund und Katze infizieren sich durch die Aufnahme reifer Finnen. Im Dünndarm des Endwirts stülpt sich die Finne aus, und der Skolex heftet sich an die Darmwand an. Die Präpatenzzeit beträgt bei T. hydatigena nach Erstinfektion 52 bis 66 Tage, die Patenz 41 bis 860 Tage (DEPLAZES u. ECKERT 1988). Bei T. taeniaeformis beträgt die Präpatenzzeit 23 bis 80 Tage, die Patenz 196 bis 952 Tage. Täglich werden bei 23 2 Literaturübersicht T. hydatigena etwa zwei bis sechs Proglottiden pro Bandwurm ausgeschieden, die jeweils bis zu 55000 Eier enthalten können, bei T. taeniaeformis werden täglich vier Proglottiden pro Bandwurm ausgeschieden, die jeweils bis zu 12000 Eier enthalten können. Die reifen Proglottiden von Taenia-Arten bei Hund und Katze sind sieben bis 12 mm lang und drei bis 4,5 mm breit. Sie können mit dem Kot abgehen oder auch aktiv den Enddarm verlassen. Dabei können sie für einige Zeit in Afternähe im Fell des Endwirtes haften. Während der Patenz scheiden Hund und Katze ständig, jedoch mit zeitweiligen Schwankungen und Unterbrechungen, Proglottiden und Eier aus. In vielen Studien konnte nachgewiesen werden, dass Taeniiden-Eier mit der so genannten Klebeband-Methode häufiger nachgewiesen werden konnten als bei koproskopischer Untersuchung (DEPLAZES et al. 1995, DEPLAZES u. ECKERT 1988). Vorkommen und Verbreitung von Taeniiden beim Hund Eier von Taeniiden wurden bei Hunden aus Deutschland in 0,2 % bis 5,2 % der koproskopischen Untersuchungen gefunden (HÖRCHNER et al. 1981; HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Eier von Taeniiden bei 0 % bis 11 % der untersuchten Hundekotproben festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; DEPLAZES et al. 1995; O´SULLIVAN 1997; FOK et al. 2001; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; MIRÓ et al. 2007; DUBNÁ et al. 2007). In einer Studie in der Südschweiz konnten mit der Klebeband-Methode und dem kombinierten Sedimentations-Flotationsverfahren bei neun von 217 Fundhunden (4,2 %) Eier von Taeniiden gefunden werden, wohingegen bei untersuchten Abgabehunden keine Taeniiden-Eier nachgewiesen werden konnten (DEPLAZES et al. 1995). In genannter Studie wurde bei den positiven Fundhunden zusätzlich auf Echinococcus–Koproantigen in einem Sandwich-ELISA untersucht, wobei sich bei einem Tier eine starke Reaktion zeigte. Bei der Sektion dieses Tieres konnten über 10000 gravide E. granulosus-Exemplare nachgewiesen werden. In einer Studie von DYACHENKO et al. (2008) wurden in den Jahren 2004 und 2005 21588 Kotproben von Hunden aus Deutschland und anderen europäischen Ländern 24 2 Literaturübersicht mit verschiedenen parasitologischen Untersuchungsmethoden untersucht. Im Flotationsverfahren (ZnSO4-NaCl) erwiesen sich in der genannten Studie dabei 0,25 % (n=54) der Hundekotproben als positiv für Taeniiden-Eier. In dieser Studie wurden die Untersuchungen Taeniiden-Eier (PCR) in die durch weiterführende einzelnen molekularbiologische Echinococcus- und Taenia-Arten differenziert. E. granulosus-DNA konnte dabei aus keiner Probe isoliert werden, jedoch erwiesen sich 0,24 % der Proben als positiv für E. multilocularis-DNA. TaeniaArten, die bei Hunden in dieser Studie nachgewiesen werden konnten, waren Taenia crassiceps (n=8), Taenia martis, Taenia serialis, Taenia polyacantha, Taenia taeniaeformis und Taenia pisiformis (jeweils n=1). Vorkommen und Verbreitung von Taeniiden bei Katzen Bei Katzen wurden Eier von Taeniiden in verschiedenen Studien bei 0,3 % bis 19,8 % der koproskopischen Untersuchungen in Deutschland gefunden (HANSEL u. RUSCHER 1980; EMDE 1991, UNBEHAUEN 1991, EPE et al. 1993; RASCHKA et al. 1994, MUNDHENKE 1998; HECKING-VELTMAN 1999, BARUTZKI u. SCHAPER 2003, EPE et al. 2004, DIEFFENBACHER 2006). Bei Sektionen von streunenden Katzen wurde ein Befall mit T. taeniaeformis von 22,0 % bis 33,3 % festgestellt (RASCHKA et al. 1994, SCHUSTER et al. 1997). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen von Katzenkotproben Eier von Taeniiden bei 3 % bis 20 % festgestellt werden (MERZ-SCHENKER et al. 1976; SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; MIRÓ et al. 2004; ROBBEN et al. 2004). In der Studie von DYACHENKO et al. (2008) wurden auch 10650 Kotproben von Katzen untersucht, davon erwiesen sich 0,34 % (n=37) als positiv für Taeniideneier. E. multilocularis-DNA konnte in 0,25 % dieser Proben amplifiziert werden. In Echinococcus-negativen, aber zestodenpositiven Proben von Katzen wurde weiterhin ausschließlich T. taeniaeformis identifiziert. In vielen Studien waren erwachsene Katzen häufiger mit Bandwürmern befallen als Jungtiere (EMDE 1991, UNBEHAUEN 1991, RASCHKA et al. 1994, MUNDHENKE 1998; HECKING-VELTMAN 1999, DIEFFENBACHER 2006). Eine Geschlechtsdisposition wurde sowohl für weibliche (ENGBÆK et al. 1984; DIEFFENBACHER 2006) als auch für männliche Tiere (HIEPE et al. 1988) 25 2 Literaturübersicht festgestellt, so dass diese Frage nicht eindeutig beantwortet werden kann. UNBEHAUEN (1991) stellte Eier von Taeniiden in 18,4 % der Kotproben von streunenden Katzen (n=98) fest, in Proben von Katzen mit Auslauf (n=177) waren 6,2 % der Tiere befallen. Bei reinen Wohnungskatzen (n=276) konnte UNBEHAUEN (1991) Stadien von Taeniiden koproskopisch nicht nachweisen. Auch andere Untersucher beobachteten bei streunenden Katzen eine hohe Prävalenz (HIEPE et al. 1988; RASCHKA et al. 1994, SCHUSTER et al. 1997). Vergleicht man die Verbreitung von Taenia spp. bei Stadt- und Landkatzen, so sind Landkatzen häufiger infiziert als Stadtkatzen (SUPPERER u. HINAIDY 1986; HIEPE et al. 1988). 2.3 Protozoen 2.3.1 Hammondia spp. Arten der Gattung Hammondia gehören zu den zystenbildenden Kokzidien und besitzen einen wahrscheinlich obligat heteroxenen Lebenszyklus (TENTER u. DEPLAZES 2006). Endwirte für Hammondia hammondi sind Haus- und Wildkatzen, für Hammondia heydorni Hunde, Kojoten und Füchse (DUBEY 1993). Als Zwischenwirte konnten für H. hammondi experimentell unter anderem Kleinnager, Kaninchen, Schweine, Schafe, Ziegen und Hunde identifiziert werden. Zwischenwirte für H. heydorni sind unter anderem Hauswiederkäuer, Pferde, Kaninchen, Meerschweinchen und Hunde (DUBEY 1993). Molekularphylogenetische Analysen zeigten, dass H. hammondi eng mit T. gondii (siehe Kap. 2.3.3), und dass H. heydorni eng mit N. caninum (siehe Kap. 2.3.2) verwandt ist (MUGRIDGE et al. 1999). Die Gattung Hammondia ist in ihrer derzeitigen Zusammensetzung nicht valide. Sie soll in vorliegender Arbeit dennoch als eigenständige Gattung behandelt werden. Die Oozysten von Hammondia spp. werden unsporuliert mit den Fäzes ausgeschieden und sind 11 - 13 x 10 - 13 µm (H. hammondi) bzw. 13 x 11 µm (H. heydorni) groß (TAYLOR et al. 2007). Oozysten von H. hammondi sind morphologisch nicht von den Oozysten von T. gondii, Oozysten von H. heydorni nicht 26 2 Literaturübersicht von den Oozysten von N. caninum zu unterscheiden. Die Sporogonie findet innerhalb von zwei bis drei Tagen in der Umwelt statt und führt zur Bildung infektiöser Oozysten, die jeweils zwei Sporozysten mit je vier Sporozoiten enthalten (TENTER u. DEPLAZES 2006). In den Zwischenwirten findet eine Vermehrung durch Endodyogenie mit Zystenbildung statt. Die Zysten von H. hammondi bilden sich dabei vor allem in der Skelettmuskulatur, aber vereinzelt auch in Herzmuskulatur und im Gehirn. Die Endwirte infizieren sich durch den Verzehr zystenhaltiger Organe von Zwischenwirten (TAYLOR et al. 2007). Im Endwirt finden in Epithelzellen des Dünndarms eine Merogonie und die Gamogonie statt. Die Präpatenz beträgt bei der Katze fünf bis 13 Tage, beim Hund sieben bis 17 Tage. Während der Patenz, die bei der Katze ein bis 28 Tage, beim Hund ein bis 20 Tage dauert, werden unsporulierte Oozysten mit dem Kot des Endwirtes ausgeschieden. Infektionen mit H. hammondi verlaufen bei der Katze symptomlos. Beim Hund verliefen experimentelle Infektionen mit H. heydorni sowohl im End- als auch im Zwischenwirt meist symptomlos, es wird jedoch auch über Durchfall und Anorexie bei Welpen berichtet. H. hammondi und H. heydorni sind keine Zoonoseerreger. Zur Verbreitung der Parasiten siehe jeweils unter N. caninum (siehe Kap. 2.3.2) bzw. unter T. gondii (siehe Kap. 2.3.3). 2.3.2 Neospora caninum Neospora caninum gehört zu den zystenbildenden Kokzidien und besitzt einen heteroxenen Lebenszyklus. Der Erreger wurde erstmals von BJERKÅS et al. (1984) im Zusammenhang mit Erkrankungen bei Hunden in Norwegen beschrieben und kommt mittlerweile weltweit vor. Die bisher bekannten Endwirte von N. caninum sind der Hund und der Kojote (McALLISTER et al. 1998; GONDIM et al. 2004). Als Zwischenwirte dienen nach derzeitigem Kenntnisstand unter natürlichen Bedingungen vor allem Rinder, aber auch Schafe, Ziegen, Wasserbüffel, Hirsche, Kamele, Nashörner, Hasen, Füchse und Hunde (DUBEY et al. 2007). Die Oozysten von N. caninum sind morphologisch von den Oozysten von Hammondia heydorni (siehe Kap. 2.3.1) nicht zu unterscheiden (DUBEY et al. 2002). Sie werden in 27 2 Literaturübersicht unsporuliertem Zustand ausgeschieden, sind sphärisch bis subsphärisch und besitzen einen Durchmesser von 10 - 11 µm (McALLISTER et al. 1998). Die Sporogonie findet innerhalb von drei Tagen in der Außenwelt statt und führt zur Bildung infektiöser Oozysten, die jeweils zwei Sporozysten mit je vier Sporozoiten enthalten. Infiziert sich ein Zwischenwirt z.B. durch die orale Aufnahme von sporulierten Oozysten, kommt es zu zwei ungeschlechtlichen Vermehrungsphasen, die beide in Form einer Endodyogenie verlaufen. Während der ersten Phase entwickeln sich Tachyzoiten, die viele Zelltypen und Organe befallen können. Sie können vertikal auf den Fetus übertragen werden. Während der zweiten Vermehrungsphase entwickeln sich innerhalb von Zysten die Bradyzoiten, die sich nur noch selten teilen. Die Zysten, die vorwiegend in neuronalem Gewebe (Gehirn, Rückenmark, Spinalnerven, Retina), manchmal aber auch in anderen Organen wie der Augenmuskulatur oder Plazenta vorkommen, können über lange Zeit persistieren und entwickeln sich erst dann weiter, wenn sie von einem Endwirt gefressen werden (LINDSAY u. DUBEY 2000). Hunde infizieren sich wahrscheinlich horizontal durch den Verzehr eines Zwischenwirtes, dessen Gewebe Neospora-Zysten enthält oder vertikal durch die diaplazentare Übertragung von Tachyzoiten von der trächtigen Hündin auf ihre Nachkommen. Die Einzelheiten der intestinalen Vermehrung im Endwirt sind noch nicht bekannt. Ob Hunde auch durch die Aufnahme sporulierter Oozysten von N. caninum infiziert werden können, ist noch nicht geklärt (DUBEY et al. 2007). Bei Hunden, die als Endwirt für N. caninum fungieren, werden ab dem fünften Tag p.i. meist für elf bis 20 Tage unsporulierte Oozysten ausgeschieden. Unter natürlichen Bedingungen werden Neosporosen besonders bei Hunden und Wiederkäuern beobachtet, bei denen es nach diaplazentarer Übertragung des Parasiten zu Aborten, embryonalen Schäden oder schweren konnatalen Erkrankungen der Nachkommen mit Todesfolge kommen kann. Bei Hunden stehen schwere konnatale Neosporosen mit neuromuskulären Symptomen im Vordergrund. Bei erwachsenen Tieren wird über klinisch manifeste Neosporosen seltener berichtet. 28 2 Literaturübersicht In menschlichen Sera konnten bei einigen Untersuchungen Antikörper gegen N. caninum festgestellt werden (NAM et al. 1998; TRANAS et al. 1999; LOBATO et al. 2006), jedoch ist die Bedeutung einer N. caninum-Exposition für Menschen bislang unbekannt. Zurzeit gibt es keine Hinweise darauf, dass die Neosporose eine Bedeutung für den Menschen hat (DUBEY et al. 2007). Vorkommen und Verbreitung beim Hund Oozysten von N. caninum können bei patenter Infektion mittels Flotationsmethoden nachgewiesen werden. Da die Oozysten von N. caninum und Hammondia heydorni (siehe Kap. 2.3.1) morphologisch als nicht voneinander unterscheidbar gelten (DUBEY et al. 2002), müssen zu ihrer Differenzierung andere Methoden wie zum Beispiel der Mäuseinokulationstest oder molekularbiologische Methoden angewendet werden. In Deutschland wurden patente Infektionen mit Oozysten vom Neospora- / Hammondia-Typ bei 0 % bis 0,5 % der untersuchten Hundekotproben festgestellt (EPE et al. 1993; BARUTZKI u. SCHAPER 2003; STAUB 2004; EPE et al. 2004; SCHARES et al. 2005). In der Studie von SCHARES et al. (2005) wurden bei 24089 untersuchten Kotproben von Hunden bei 47 Tieren (0,19 %) Oozysten vom Neospora- / Hammondia-Typ gefunden. 28 von diesen positiven Proben wurden im Gerbil-Bioassay weitergehend untersucht. Aufgrund von Antikörperbildung der Gerbile gegen Antigene von N. caninum NC-1 Tachyzoiten wurde angenommen, dass es sich bei sieben von diesen Isolaten um N. caninum-Isolate handelte. In der Studie von STAUB (2004) wiesen von 292 untersuchten Hundesera aus Rheinland-Pfalz 4,45 % Antikörper gegen N. caninum auf. In Studien aus anderen europäischen Ländern konnten in verschiedenen Hundepopulationen Seroprävalenzen von 0 % bis 29 % festgestellt werden (BARBER et al. 1997; BJÖRKMAN et al. 1994; CRINGOLI et al. 1996; CRINGOLI et al. 2002; ORTUŇO et al. 2002; WANHA et al. 2005; VÁCLAVEC et al. 2007). 29 2 Literaturübersicht 2.3.3 Toxoplasma gondii Toxoplasma gondii gehört zu den so genannten zystenbildenden Kokzidien und besitzt einen fakultativ heteroxenen Lebenszyklus. Endwirte sind Feliden, als Zwischenwirte dienen alle warmblütigen Lebewesen einschließlich des Menschen (DUBEY u. BEATTIE 1988). Es existieren verschiedene Stämme von T. gondii, die untereinander sehr starke genetische und phänotypische Ähnlichkeiten aufweisen. Die Oozysten von T. gondii werden in unsporuliertem Zustand ausgeschieden. Sie sind 13 x 12 µm groß und sphärisch (TAYLOR et al. 2007). Sie sind morphologisch von den Oozysten von Hammondia hammondi (siehe Kapitel 2.3.1) nicht zu unterscheiden. Die Sporogonie findet innerhalb von ein bis vier Tagen in der Umwelt statt und führt zur Bildung infektiöser Oozysten, die jeweils zwei Sporozysten mit je vier Sporozoiten enthalten (DUBEY u. BEATTIE 1988; JACKSON u. HUTCHISON 1989; DUBEY 1993; 1998). Infiziert sich ein Zwischenwirt durch die orale Aufnahme von sporulierten Oozysten, werden im Darm die Sporozoiten frei und dringen in subepitheliale Zellen ein. Es kommt nun zu zwei ungeschlechtlichen Vermehrungsphasen, die beide in Form einer Endodyogenie verlaufen. Während der ersten Phase entwickeln sich durch wiederholte, schnelle Zweiteilung Tachyzoiten, die hämatogen verbreitet werden und viele Zelltypen und Organe befallen können. Mit dem Einsetzen der Antikörperbildung sowie der Ausbildung einer zellvermittelten Immunität durch den Zwischenwirt (FRENKEL vollzieht 2000). T. gondii Anstelle von einen Wechsel Tachyzoiten des Entwicklungsstadiums entstehen in der zweiten Entwicklungsphase durch fortgesetzte Endodyogenien, die jetzt jedoch langsamer ablaufen, innerhalb von Gewebezysten die Bradyzoiten. Die Gewebezysten weisen eine hohe Affinität zu neuralen und muskulären Geweben wie Gehirn, Auge, Herzund Skelettmuskulatur auf, können jedoch auch in Organen wie Lunge, Leber und Niere beobachtet werden (DUBEY 1993; 1998). Sie liegen dabei meist reaktionslos im Wirtsgewebe und der Parasit kann auf diese Weise in einigen Wirtsspezies ein Leben lang persistieren (TENTER et al. 2000). Unter bestimmten Bedingungen 30 2 Literaturübersicht können diese latenten T. gondii-Infektionen jedoch reaktiviert werden, z.B. durch eine Immunsuppression. Kommt es zur oralen Aufnahme von zystenhaltigem Fleisch durch einen Endwirt, so findet in dessen Darmepithel die sexuelle Entwicklung von T. gondii statt, die mit der Bildung von Oozysten endet (FRENKEL et al. 1970). Im Dünndarm werden die Bradyzoiten frei und dringen in Darmepithelzellen ein. Sie vermehren sich zunächst ungeschlechtlich durch eine initiale Endodyogenie und anschließend durch wiederholte Endopolygenien. Die terminalen Merozoiten initiieren dann die geschlechtliche Entwicklungsphase. Gamogonie und Oozystenbildung erfolgen ebenfalls in Epithelzellen des Dünndarms. Die Oozysten werden unsporuliert ins Darmlumen und mit dem Kot in die Umwelt ausgeschieden. Neben der geschlechtlichen Entwicklung im Darmepithel der Katze penetrieren in der Regel auch einige Parasiten die Lamina propria des Dünndarmes und vermehren sich in extraintestinalen Organen. Dabei kommt es wie bei den Zwischenwirten zu einer zweiphasigen ungeschlechtlichen Vermehrung mit der Bildung von Tachyzoiten und Gewebezysten (KRAHENBUHL u. REMINGTON 1982). Unter natürlichen Bedingungen können sich sowohl die Zwischenwirte als auch die Endwirte über drei infektiöse Stadien infizieren: die Tachyzoiten, die in den Gewebezysten enthaltenen Bradyzoiten und die in den sporulierten Oozysten enthaltenden Sporozoiten. Eine horizontale Infektion mit T. gondii kann entweder durch die Ingestion von Gewebezysten beim Verzehr von rohem Fleisch oder Innereien oder durch die orale Aufnahme von sporulierten Oozysten erfolgen. Bei der vertikalen Infektion mit T. gondii werden Tachyzoiten diaplazentar und bei einigen Wirtsspezies auch galaktogen von der Mutter auf die Nachkommen übertragen (TENTER et al. 2000). Die Dauer von Präpatenz und Patenz ist abhängig von der Art des aufgenommenen infektiösen Stadiums. Bei fast allen Katzen, die primär durch Gewebezysten infiziert werden, kommt es nach einer Präpatenz von drei bis zehn Tagen zur Ausscheidung von Oozysten, die bis zu 20 Tage andauern kann (TENTER et al. 2000). Hingegen scheiden etwa ein Drittel der Katzen, die primär durch Oozysten infiziert werden, erst nach 18 bis 49 Tagen und nur bis zu zehn Tage lang Oozysten aus (FREYRE et al. 1989; DUBEY 1996). Die gegenüber einer Infektion mit Gewebezysten verlängerte 31 2 Literaturübersicht Präpatenz ist dadurch zu erklären, dass die Sporozoiten zunächst in extraintestinale Organe eindringen. Die Katze dient T. gondii hierbei zunächst auch als Zwischenwirt und es erfolgt dementsprechend eine ungeschlechtliche Entwicklung. Die Gamogonie findet erst im Anschluss daran statt. Die Anzahl der dabei ausgeschiedenen Oozysten ist deutlich niedriger als nach einer Infektion durch Gewebezysten (DUBEY u. FRENKEL 1976). Vorkommen und Verbreitung beim Menschen Die Toxoplasmose gehört zu den häufigsten parasitären Zoonosen. Man schätzt, dass bei etwa einem Drittel der Weltbevölkerung Antikörper gegen T. gondii vorhanden sind (DUBEY u. BEATTIE 1988; JACKSON u. HUTCHISON 1989; TENTER et al. 2000). In Deutschland schwankt die mittlere Befallsrate, festgestellt durch Antikörpernachweis regional zwischen ca. 30 % und 60 % der Bevölkerung (LUCIUS u. LOOS-FRANK 2008). Eine Erstinfektion mit T. gondii verläuft bei immunkompetenten Menschen meist klinisch inapparent, in einigen Fällen aber treten Lymphadenopathie oder okuläre Toxoplasmose auf (MONTOYA u. LIESENFELD 2004). Tritt die Erstinfektion bei Frauen in der Schwangerschaft auf, kann es zu schweren fötalen Schädigungen oder Spätschäden kommen, die sich zum Teil erst mehrere Jahre nach der Geburt des Kindes manifestieren (TENTER u. FEHLHABER 2002). Bei immundefizienten Personen kann es bei einer Erstinfektion mit T. gondii zu einer akuten disseminierten Toxoplasmose und im Falle einer bereits vorhandenen latenten Infektion zu einer reaktivierten Toxoplasmose mit Enzephalitis kommen (MONTOYA u. LIESENFELD 2004). Vorkommen und Verbreitung bei der Katze Bei Feliden verlaufen Infektionen mit T. gondii in der Regel klinisch inapparent, diaplazentare Infektionen sind selten (DUBEY 1986; DUBEY u. BEATTIE 1988). Latente Infektionen mit T. gondii kommen bei Haus- und Wildkatzen weltweit mit hoher Prävalenz vor (TENTER et al. 2000). Bei Hauskatzen in Deutschland lassen sich Antikörper gegen T. gondii zwischen 36 % und 46 %, bei streunenden Katzen und Wildkatzen zwischen 56 % und 66 % nachweisen (HECKING-VELTMAN et al. 2001). Zu einer Ausscheidung von Oozysten kommt es bei Katzen meist nur nach 32 2 Literaturübersicht einer Primärinfektion mit T. gondii. Danach entwickelt sich in der Regel ein guter Immunschutz bei den Tieren, der jedoch nicht lebenslang anhält. Eine zweite Patenz konnte experimentell bei Katzen erzeugt werden, die nach der Erstinfektion sechs Jahre lang isoliert gehalten und anschließend erneut infiziert wurden (DUBEY 1995; DUBEY et al. 1995). Eine erneute Ausscheidung von T. gondii (reshedding) konnte auch durch die Reaktivierung einer chronischen Infektion erzeugt werden. Dies gelang sowohl durch eine Superinfektion mit Isospora spp. als auch durch die Applikation von immunsupprimierenden Medikamenten (JACKSON u. HUTCHISON 1989). Ob und unter welchen Umständen es unter natürlichen Bedingungen zum so genannten reshedding von Oozysten kommt, ist bislang unbekannt (TENTER et al. 2000). Oozysten von T. gondii können bei patenter Infektion in einigen Fällen mittels Flotationsmethoden nachgewiesen werden. Dieser Nachweis gelingt in der Regel jedoch nur während der Hauptausscheidungsphase, welche meist nur ein bis zwei Tage anhält (TENTER u. DEPLAZES 2006). Zur Differenzierung von Oozysten von T. gondii und denen von H. hammondi stehen der Mäuseinokulationstest bzw. seit einigen Jahren auch molekularbiologische Methoden zur Verfügung, welche aber in der Routinediagnostik bisher nur selten zur Anwendung kamen. In Deutschland wurden bei Katzen patente Infektionen mit Oozysten vom Toxoplasma- / Hammondia-Typ nicht (HIEPE et al. 1988; KNAUS u. FEHLER 1989; HECKINGVELTMAN 1999, DIEFFENBACHER 2006) bzw. in Prävalenzen von 0,1 % bis 3,6 % nachgewiesen (EMDE 1991; EPE et al. 1993; RASCHKA et al. 1994; MUNDHENKE 1998; BARUTZKI u. SCHAPER 2003; EPE et al. 2004; SCHARES et al. 2008). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen von Katzenkotproben Oozysten vom Toxoplasma- / Hammondia-Typ nicht (MERZSCHENKER et al. 1976; VANPARIJS et al. 1991; MIRÓ et al. 2004) bzw. in Prävalenzen von 0,3 % bis 4,7 % (SUPPERER u. HINAIDY 1986; ROBBEN et al. 2004) festgestellt werden. Ein Mäuseinokulationstest oder molekularbiologische Methoden wurden aber nicht in jedem Fall durchgeführt. SCHARES et al. (2008) untersuchten in Zusammenarbeit mit einem Privatlabor in Deutschland 20317 Kotproben von Katzen koproskopisch. 68 dieser Katzen (0,33 %) wiesen in der Kotuntersuchung Oozysten vom Toxoplasma- / Hammondia-Typ auf. 48 dieser 33 2 Literaturübersicht positiven Proben konnten mit molekularbiologischen Methoden weiterführend untersucht werden, wobei bei 22 Katzen (0,11 %) T. gondii und bei 20 Katzen (0,1 %) H. hammondi identifiziert werden konnte. Bei sechs dieser Katzen (0,03 %) konnte keine Artdiagnose gestellt werden. Vorkommen und Verbreitung beim Hund Hunde sind Zwischenwirte für T. gondii, sie erkranken jedoch in der Regel nicht. Bei Hunden sind latente, subklinische T.-gondii-Infektionen die Regel und kommen sehr häufig vor (BAUER 2006a). In einer Studie aus Deutschland wiesen von 248 untersuchten Hunden aus Rheinland-Pfalz 30,99 % Antikörper gegen T. gondii auf (STAUB 2004). In einer Studie aus Österreich konnten Antikörper im Immunfluoreszenztest (IFAT) bei 26 % (n=242) der untersuchten Sera von Hunden ermittelt werden (WANHA et al. 2005). BAUER (2007) berichtet von einer Durchseuchungsrate in Frankreich und Schweden zwischen 30 % und 40 %. SCHARES et al. (2005) konnten in einer Studie aus Deutschland bei zwei von 24089 untersuchten Kotproben von Hunden Oozysten von T. gondii nachweisen. Die Autoren der genannten Studie nehmen an, dass diese Hunde die Oozysten durch Koprophagie aufnahmen. 2.3.4 Isospora spp. Beim Hund parasitieren Isospora canis, Isospora ohioensis und Isospora burrowsi, bei der Katze Isospora felis und Isospora rivolta (BOCH et al. 1981). Die Oozysten der bei Hund oder Katze parasitierenden Isospora-Arten haben eine glatte, farblose Oozystenwand. Bis auf die Oozysten von I. felis, welche eiförmig und an einem Pol leicht zugespitzt sind, sind die Oozysten kugelförmig bis ovoid. Bei den drei IsosporaArten des Hundes kann man mit Sicherheit nur die Oozysten von I. canis von den übrigen unterscheiden (39 x 32 µm). I. ohioensis und I. burrowsi ähneln sich in ihrer Größe zu sehr (I. ohioensis: 24 x 20 bzw. I. burrowsi: 21 x 18 µm). Die exogenen Stadien der beiden letztgenannten fallen allgemein unter den so genannten „Ohioensis-Komplex“ zusammen (TRAYSER u. TODD 1978). Bei der Katze lassen 34 2 Literaturübersicht sich die beiden Arten I. felis und I. rivolta durch die unterschiedliche Größe von 45 x 33 µm bzw. 26 x 24 µm sowie die typische Form der Oozysten differenzieren (BOCH et al. 1981). Die Oozysten von Isospora spp. werden unsporuliert mit dem Kot ausgeschieden (FAYER 1980). Die Sporogonie erfolgt in der Umwelt innerhalb von wenigen Tagen, beinflusst unter anderem durch Wärme und Feuchtigkeit der Umgebung (LEPP u. TODD 1974; TODD u. ERNST 1979). Es bilden sich zwei ovale Sporozysten, die je vier Sporozoiten und einen granulierten Sporozystenrestkörper enthalten. Als paratenische Wirte dienen bei den Isospora-Arten des Hundes Nagetiere und Büffel. Während bei I. ohioensis außerdem noch Schweine, Esel und Katzen paratenische Wirte sein können, sind es bei I. canis noch Schweine, Kamele und Katzen. Bei den Isospora-Arten der Katze dienen als paratenische Wirte Nagetiere, Rinder, Schafe, Kamele und Kaninchen (TENTER u. DEPLAZES 2006). Nehmen paratenische Wirte sporulierte Isospora-Oozysten auf, kommt es zu einer hämatogenen Streuung der Sporozoiten und zu einem Befall extraintestinaler Gewebe, insbesondere der Mesenteriallymphknoten, aber auch der Leber, Milz, Skelettmuskulatur (LINDSAY u. BLAGBURN 1994; LINDSAY et al. 1997) und des Gehirns (BOCH et al. 1981). Die Sporozoiten dringen in Wirtszellen ein und verbleiben dort als inaktive Dormozoiten (FAYER 1980; LINDSAY u. BLAGBURN 1994). Hunde und Katzen infizieren sich durch orale Aufnahme sporulierter Oozysten oder durch den Verzehr von Geweben paratenischer Wirte mit Dormozoiten (BOCH et al. 1981). Es kommt zur Exzystierung im Dünndarm, daraufhin dringen die Sporozoiten in die Epithelzellen des Wirtes ein (BOCH et al. 1981; LINDSAY u. BLAGBURN 1994; LINDSAY et al. 1997). Es kommt nun in den Darmzellen des Wirtstieres je nach Isospora-Art zu ein bis drei ungeschlechtlichen Vermehrungen (Merogonien) (LINDSAY u. BLAGBURN 1994). Anschließend erfolgt die Gamogonie, bei der letztendlich die Zygote entsteht. Diese wird mit fester Hülle umgeben und mit dem Kot als Oozyste ausgeschieden (TODD u. ERNST 1979; LINDSAY u. BLAGBURN 1991). Neben dieser intestinalen Entwicklung ist auch ein Befall extraintestinaler Organe möglich. Einige der aus den Oozysten freigewordenen Sporozoiten können im Endwirt die Darmwand penetrieren und in Mesenteriallymphknoten oder andere 35 2 Literaturübersicht extraintestinale Gewebe wie Milz und Leber eintreten (LINDSAY u. BLAGBURN 1994), wo sie monozoitische Zysten (FAYER 1980) bilden und wachsen, sich jedoch nicht vermehren (GREENE u. PRESTWOOD 1984). Die Präpatenz beträgt je nach Art vier bis elf Tage, die Patenz vier bis 28 Tage (TENTER u. DEPLAZES 2006). Vorkommen und Verbreitung beim Hund Isospora-Arten sind weltweit bei Hunden verbreitet. BARUTZKI u. SCHAPER (2003), die Ergebnisse parasitologischer Kotuntersuchungen eines Tierärztlichen Labors in Süddeutschland aus den Jahren 1999 bis 2002 veröffentlichten, wiesen bei 8438 untersuchten Proben von Hunden aus Deutschland eine Prävalenz von 2,6 % für I. canis und von 5,5 % für I. ohioensis fest. In anderen Studien wurde zwischen den beiden Arten nicht unterschieden und der Gesamtbefall von Isospora spp. mit 2,3 % bis 5,2 % angegeben (EMDE 1988; EPE et al. 1993; EPE et al. 2004; STAUB 2004). In verschiedenen Hundezuchten lag der Anteil an Isospora-positiven Würfen bei 80 % oder höher (BODE 1999; DAUGSCHIES et al. 2000; BUEHL et al. 2006). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen für Isospora spp. von 1,3 % bis 8,0 % festgestellt werden (VANPARIJS et al. 1991; DEPLAZES et al. 1995; FOK et al. 2001; LeNOBEL et al. 2004; SAGER et al. 2006; MIRÓ et al. 2007; DUBNÁ et al. 2007). Die Infektion wird bei Hunden aller Altersklassen gefunden, tritt aber in der Regel häufiger bei Jungtieren auf (VISCO et al. 1977; EMDE 1988; GOTHE u. REICHLER 1990; BARUTZKI u. SCHAPER 2003; BUEHL et al. 2006; MARTÍNEZ-MORENO et al. 2007; BATCHELOR et al. 2008). Natürliche Infektionen von Welpen finden vorwiegend in den ersten Lebenswochen statt (BODE 1999; SEELIGER 1999; BUEHL et al. 2006). Werden mehrere Tiere auf engem Raum gehalten, kann sich der Parasit besonders schnell ausbreiten. Vorkommen und Verbreitung bei der Katze Bei Katzen wurde in Deutschland aufgrund von Kotuntersuchungen eine Prävalenz von 1,9 % bis 17,1 % für I. felis und 1,4 % bis 12,6 % für I. rivolta festgestellt (UNBEHAUEN 1991, RASCHKA et al. 1994, MUNDHENKE 1998; HECKINGVELTMAN 1999, BARUTZKI u. SCHAPER 2003). In anderen Studien wurde 36 2 Literaturübersicht zwischen den beiden Arten nicht unterschieden und der Gesamtbefall mit Isospora spp. mit 2,8 % bis 10,7 % angegeben (EMDE 1991; EPE et al. 1993; EPE et al. 2004). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Prävalenzen von 1,9 % bis 20 % für I. felis und 0,8 % bis 20,1 % für I. rivolta festgestellt werden (MERZ-SCHENKER et al. 1976; NICHOL et al. 1981; SEILER et al. 1983; SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; ROBBEN et al. 2004). Auch bei Katzen waren in vielen Untersuchungen junge Tiere häufiger befallen als ältere Tiere (EMDE 1991; RASCHKA et al. 1994; HECKING-VELTMAN 1999, BARUTZKI u. SCHAPER 2003). RASCHKA et al. (1994) sahen bei streunenden Katzen eine hohe Prävalenz (I. felis 17,1 %, I.rivolta 12,6 %), wohingegen HECKINGVELTMAN (1999) in dieser Gruppe deutlich niedrigere Befallsraten nachwies (I. felis 5,1 %, I.rivolta 1,4 %). Laut HECKING-VELTMAN et al. (2001) sind Streuner nicht häufiger als Hauskatzen mit Isospora spp. infiziert, obwohl sie eher Gelegenheit zum Erjagen von möglichen Zwischenwirten oder paratenischen Wirten wie Maus und Ratte haben. Für die genannten Autoren ist die sich nach einer Primärinfektion ausbildende Immunität Grund dafür, dass bei Streunern trotz erhöhter Exposition eine Reinfektion meist nicht mehr patent wird (HECKING-VELTMAN et al. 2001). 2.3.5 Giardia duodenalis Giardia duodenalis (syn. Giardia intestinalis, Giardia lamblia) ist weltweit verbreitet und parasitiert bei Hund, Katze, vielen anderen Haustieren und dem Menschen (TAYLOR et al. 2007). Es existieren unterschiedliche Genotypen, von denen die Typen A und B parallel im Menschen und in Tieren auftreten, so dass eine zoonotische Übertragung angenommen wird (LUCIUS u. LOOS-FRANK 2008). Die Genotypen C bis G sind wahrscheinlich wirtsspezifisch und scheinen nicht von Tieren auf den Menschen übertragbar zu sein (CACCIÒ u. RYAN 2008). Die Genotypen C und D wurden bisher in Hunden, Katzen, Koyoten und Wölfen, der Genotyp F in Katzen und der Genotyp G in Ratten nachgewiesen (CACCIÒ u. RYAN 2008). Beim Hund wurden bisher die Genotypen A1 bis A4, B3, B4, C und D, bei der Katze die Genotypen A1, B4, C, D und F gefunden (CACCIÒ u. RYAN 2008). 37 2 Literaturübersicht Die Zysten, die mit dem Kot des Wirtes in die Umwelt ausgeschieden werden, sind 8 - 12 x 7 - 10 µm groß, ovoid, und besitzen vier Kerne (TAYLOR et al. 2007). Sie können durch Flotationsverfahren, SAF-Konzentrationsverfahren oder Antikörpermarkierung nachgewiesen werden. Bei Nachweis der Zysten mit Flotationsmethoden, z.B. mit Zinksulfatlösung, werden die Zysten deformiert, bleiben aber erkennbar. Eine einmalige Kotuntersuchung auf Giardia sp. ist oftmals negativ aufgrund der intermittierenden Zystenausscheidung (ZIMMER u. BURRINGTON 1986; DECOCK et al. 2003; DRYDEN et al. 2006). Viele Autoren empfehlen daher wiederholte Kotuntersuchungen zum Nachweis von Giardia sp. (ZIMMER u. BURRINGTON 1986; DECOCK et al. 2003; DRYDEN et al. 2006). DRYDEN et al. (2006) empfehlen eine dreimalige Kotuntersuchung innerhalb einer Woche. Weiterhin besteht die Möglichkeit, Giardia-Koproantigen mit kommerziell erhältlichen Testkits nachzuweisen. Diese Methode hat sich als sensitiver bzw. ebenso sensitiv wie die Koproskopie erwiesen (DECOCK et al. 2003). Ein Vorteil dieser Nachweismethode ist, dass Koproantigene von G. duodenalis auch dann nachgewiesen werden, wenn die Zystenausscheidung sistiert. In einer Studie von CIRAK u. BAUER (2004) wurden Kotproben von 270 Hunden und 100 Katzen aus drei deutschen Tierheimen vergleichend mit konventionellen koproskopischen Untersuchungsmethoden und kommerziellen Koproantigen-Elisa-Kits zum Nachweis von Giardien verglichen. Giardia-Zysten wurden in 9 % bzw. 0 % der Hunde- bzw. Katzenkotproben in der Koproskopie nachgewiesen. Dagegen war der GiardiaKoproantigen-ELISA (Prospect Giardia Microplate Assay) in 29,5 % der Hunde- und 22,4 % der Katzenkotproben positiv (CIRAK u. BAUER 2004). Nur bei starkem Befall können im Kot auch die Trophozoiten nachgewiesen werden. Diese sind bilateral-symmetrisch gebaut und ähneln in ihrer Form einer halben Birne mit konvexer Dorsalseite und flacher Ventralseite, die vorne zu einer großen Adhäsionsscheibe vertieft ist. Sie besitzen zwei Kerne und vier Geißelpaare (ECKERT et al. 2008). Die Wirte infizieren sich durch die orale Aufnahme der Giardia-Zysten. Diese exzystieren im Duodenum, wobei aus jeder Zyste zwei Trophozoiten entstehen. Diese parasitieren beim Hund überwiegend im Duodenum und proximalen Jejunum, bei der Katze auch im distalen Jejunum und Zäkum, wo sie frei im Lumen oder mit 38 2 Literaturübersicht der ventralen Haftscheibe am Mikrovillisaum der Epithelzellen haftend gefunden werden. Die Vermehrung der Trophozoiten erfolgt durch Längsteilung. Im distalen Jejunum und im Blinddarm kommt es zur Enzystierung, wobei eine widerstandsfähige Zystenwand gebildet wird. Die Zysten werden mit dem Kot des Wirtes in die Umwelt ausgeschieden und sind unmittelbar für andere Wirte infektiös. Die Präpatenz beträgt bei Hund und Katze vier bis 16 Tage, die Patenz Wochen bis Monate (ECKERT et al. 2008). Vorkommen und Verbreitung beim Hund In Deutschland wurden Giardia-Infektionen bei Hunden mit verschiedenen Anreicherungsverfahren in 0 % bis 6 % der untersuchten Kotproben festgestellt (HÖRCHNER 1981; EMDE 1988, EPE et al. 1993; EPE et al. 2004). In einem Giardia-Koproantigennachweis erwiesen sich Hundekotproben als positiv (BARUTZKI u. 16,6 % der SCHAPER 2003). untersuchten In anderen europäischen Ländern konnte Giardia sp. bei koproskopischen Untersuchungen in Prävalenzen von 0 % bis 10,3 % festgestellt werden (SUPPERER u. HINAIDY 1986; HARALABIDIS et al. 1988; VANPARIJS et al. 1991; DEPLAZES et al. 1995; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; DUBNÁ et al. 2007; MIRÓ et al. 2007; PAPAZAHARIADOU et al. 2007). Hunde aller Altersstufen können Giardien ausscheiden, jedoch waren in vielen Studien Hunde unter einem Jahr häufiger befallen als ältere Tiere (SWAN u. THOMPSON 1986; SYKES u. FOX 1989; ZISLIN et al. 2002; BARUTZKI 2002; CAPELLI et al. 2003; BATCHELOR et al. 2008). Epidemiologische Untersuchungen bei Hunden in Süddeutschland ergaben höhere Prävalenzen bei Zwingerhunden, in größeren Beständen und bei intensiver Zucht im Vergleich mit Wohnungs- und Einzeltierhaltung oder Kleinzuchten (BARUTZKI 1989). 39 2 Literaturübersicht Vorkommen und Verbreitung bei der Katze Bei Katzen wurden Giardia-Infektionen in Deutschland mit verschiedenen Anreicherungsverfahren bei 0 % bis 2,4 % der untersuchten Kotproben festgestellt (HIEPE et al. 1988; EMDE 1991; UNBEHAUEN 1991; EPE et al. 1993; MUNDHENKE 1998; RASCHKA et al. 1994; HECKING-VELTMAN 1999; EPE et al. 2004; DIEFFENBACHER 2006). In anderen europäischen Ländern konnten bei koproskopischen Untersuchungen Zysten von Giardia sp. bei 0 % bis 6,1 % festgestellt werden (MERZ-SCHENKER et al. 1976; SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; MIRÓ et al. 2004; ROBBEN et al. 2004). In einem GiardiaKoproantigennachweis erwiesen sich 12,6 % der untersuchten Katzenkotproben als positiv (BARUTZKI u. SCHAPER 2003). Katzen aller Altersstufen können Giardien ausscheiden, jedoch waren in vielen Studien Katzen unter einem Jahr häufiger betroffen als ältere Tiere (WOLFF u. ECKERT 1979; SEILER et al. 1983; UNBEHAUEN 1991). 40 2 Literaturübersicht 2.4 Antiparasitika Antiparasitika sind Chemotherapeutika zur Behandlung und Prophylaxe von Infektionen oder Infestationen mit Endo- bzw. Ektoparasiten (UNGEMACH 2006). Für die Endoparasitenbekämpfung stehen bei Hund und Katze eine Vielzahl von Antiparasitika zur Verfügung, welche aufgrund ihrer Aktivitätsspektren, physikochemischen Eigenschaften und ihrer Wirkungsweise in die folgenden Gruppen eingeteilt werden können: Piperazin und seine Derivate, Diethylcarbamazin, Tetrahydropyrimidine, Makrozyklische Imidazothiazole, Laktone, sowie Benzimidazole Cyclooctadepsipeptide und Probenzimidazole, und die Zestodizide Praziquantel und Epsiprantel (SANCHEZ BRUNI et al. 2006). Im Folgenden soll auf Antiparasitika aus den Wirkstoffklassen der Benzimidazole, Tetrahydropyrimidine und Makrozyklischen Laktone sowie auf das Zestodizid Praziquantel näher eingegangen werden. 2.4.1 Benzimidazole Benzimidazole zeichnen sich allgemein durch eine große Wirkungsbreite und gute Verträglichkeit aus. Seit der Zulassung von Thiabendazol im Jahr 1961 (BROWN et al. 1961) werden sie weltweit und in großem Umfang eingesetzt. Ihre Wirkung beruht auf einer Hemmung der Polymerisation von Tubulin zu Mikrotubuli, wodurch unter anderem die Ausbildung des Zytoskeletts, die Aufnahme und der intrazelluläre Transport von Nährstoffen und Stoffwechselsubstraten verhindert werden (UNGEMACH 2006). Insbesondere durch verringerte Glukoseaufnahme und Herabsetzung mitochondrialer Reaktionen kommt es zu einer ATP-Verarmung. Nach Ausschöpfung seiner Energiereserven stirbt der Parasit ab und wird nach etwa zwei bis drei Tagen ausgeschieden (UNGEMACH 2006). Die Wirkung der Benzimidazole gegen intestinale Nematoden ist umso besser, je geringer ihre Resorption und je länger dadurch ihre Verweildauer im Gastrointestinaltrakt ist. Bei Wiederkäuern und Pferden dienen der Pansen bzw. das Caecum als Reservoir aus dem längerfristig 41 2 Literaturübersicht wirksame Konzentrationen abgegeben werden. Bei Fleischfressern jedoch ist die Darmpassagezeit kurz, so dass die schwer löslichen Benzimidazole hier in relativ hoher Dosierung an mehreren aufeinanderfolgenden Tagen gegeben werden müsen, um eine ähnlich hohe anthelminthische Wirkung wie bei Pflanzenfressern zu erzielen (McKELLAR et al. 1990). Alle Benzimidazole sind hoch wirksam gegen Adulte und im Darmlumen befindliche Larvenstadien. Mit den neueren Benzimidazolen wie Mebendazol, Oxfendazol, Fenbendazol oder Albendazol kann auch eine zuverlässige Wirkung gegen verschiedene inhibierte und histotrope Larvenstadien sowie gegen extraintestinale Nematoden, z.B. adulte und immature Lungenwürmer, erzielt werden (UNGEMACH 2006). Fenbendazol wirkt bei Hunden in einer Dosierung von 50 mg/kg KGW an drei aufeinander folgenden Tagen oral verabreicht gegen reife und unreife Stadien von T. canis, T. leonina und T. vulpis, sowie gegen A. caninum, U. stenocephala und Bandwürmer der Gattung Taenia spp. (BURKE u. ROBERSON 1978, 1979; ROBERSON u. BURKE 1982; FISHER et al. 1993; MIRÓ et al. 2007). Bei Katzen wirkt es in gleicher Dosierung wie beim Hund gegen reife Stadien von T. cati, gegen reife und unreife Stadien von A. tubaeforme und gegen reife Stadien von Taenia spp. (ROBERSON u. BURKE 1980; SCHMID u. DÜWEL 1990). Auch gegen A. abstrusus bei Katzen ist Fenbendazol wirksam. Hierfür werden Dosierungen von 20 bis 50 mg/kg p.o., an fünf bis 15 aufeinander folgenden Tagen verabreicht, als wirksam angesehen (SMITH 1980; HAMILTON et al. 1984; NAYLOR et al. 1984; GRANDI et al. 2005). Weiterhin besitzt Fenbendazol eine Wirksamkeit gegen Capillaria aerophila in einer Dosierung von 50 mg/kg p.o. an zehn aufeinander folgenden Tagen verabreicht (FOREYT 2001). Außerdem zeigte sich Fenbendazol in einer Dosierung von 50 mg/kg KGW an drei aufeinander folgenden Tagen oral verabreicht als wirksam gegenüber Giardia sp. (BARR et al. 1994; ZAJAC et al. 1998; FOREYT 2001). Da die Rezidivrate mit diesem Parasiten jedoch hoch ist, wird eine wiederholte Behandlung nach zwei bis drei Wochen empfohlen (DEPLAZES 2006). 42 2 Literaturübersicht 2.4.2 Tetrahydropyrimidine Zu den bei Hund und Katze in Deutschland als Anthelminthika eingesetzten Pyrimidinen gehören das Pyrantel und das Oxantel. Sie wirken als Acetylcholinagonisten an nikotinartigen und muskarinartigen Cholinorezeptoren, was zu einer spastischen Paralyse der Parasiten führt (MARTIN et al. 1997). Um die Persistenz einer wirksamen Konzentration im Verdauungstrakt zu erhöhen, werden sie als schwer lösliche Embonate eingesetzt. Das Wirkungsspektrum umfasst nur reife und unreife Darmlumenstadien, während histotrope, inhibierte und extraintestinale Larvenstadien und Parasiten nicht ausreichend erfasst werden (UNGEMACH 2006). Pyrantel gilt bei Hunden in einer Dosierung von 5 mg Pyrantelembonat/kg KGW als wirksam gegen intestinale Stadien von T. canis, T. leonina, A. caninum und U. stenocephala (LINDQUIST 1975; TODD et al. 1975; KLEIN et al. 1978; JACOBS 1987). Gegen T. vulpis, Zestoden und extraintestinale Nematoden ist es unwirksam (LINDQUIST 1975; TODD et al. 1975; KLEIN et al. 1978). Bei der Katze wirkt es in einer Dosierung von 20 mg Pyrantelembonat/kg KGW gegen intestinale Stadien von T. cati und A. tubaeforme (REINEMEYER u. DeNOVO 1990; RIDLEY et al. 1991). 2.4.3 Makrozyklische Laktone Die Makrozyklischen Laktone haben ein breites Wirkungsspektrum, das sowohl vermizide als auch ektoparasitizide Effekte umfasst. Sie werden daher auch als Endektozide bezeichnet. Anfang der Siebziger Jahre wurde die Wissenschaft erstmals auf die anthelminthische Wirkung der Makrozyklischen Laktone aufmerksam. Im Jahre 1981 erlangte Ivermectin als erster Vertreter dieser Gruppe seine Marktzulassung. Makrozyklische Laktone steuern die Öffnung Glutamat-abhängiger Chlorid-Kanäle (CULLY et al. 1996) und verursachen eine Lähmung der neuronalen und 43 2 Literaturübersicht neuromuskulären Übertragung durch die Erhöhung des Ioneneinstroms. Es kommt so zu einer schlaffen Paralyse des Parasiten. Die Makrozyklischen Laktone lassen sich in zwei Hauptgruppen einteilen: die Avermectine und die Milbemycine. Avermectine sind Fermentationsprodukte des in Japan vorkommenden Strahlenpilzes Streptomyces avermitilis (UNGEMACH 2006). Zu den Avermectinen gehören Ivermectin, Doramectin, Eprinomectin, Abamectin und Selamectin. Ivermectin zeichnet sich bei vielen Tierarten wie Pferd, Rind und Schwein durch eine gute Verträglichkeit aus, jedoch reagieren bestimmte Tierarten besonders empfindlich gegenüber Ivermectin. So kommt es bei Schildkröten und bestimmten Hunderassen wie Collies, Australian Shepherds und verschiedenen Schafhundelinien zu Überempfindlichkeitsreaktionen, die mit ZNS-Depression, Somnolenz, Ataxie und Tremor einhergehen. Dabei treten diese Nebenwirkungen schon ab Dosen von 0,05 mg/kg auf (UNGEMACH 2006). Als Grund für die Empfindlichkeit bei Hunden wird ein Gendefekt angegeben (MEALEY et al. 2001), durch den sich Ivermectin im Gehirn anreichern kann. Für die Anwendung bei Hund und Katze in Deutschland ist von den Avermectinen das Selamectin zugelassen, das auch von den Collierassen gut vertragen wird. Die Milbemycine sind Fermentationsprodukte des Strahlenpilzes Streptomyces cyanogriseus oder hygroscopicus var. aureolacrimosus. Chemisch handelt es sich um Aglykone der Avermectine mit einem sehr ähnlichen makrozyklischen Laktonring ohne Disaccharidseitenkette (UNGEMACH 2006). Von den Milbemycinen sind das Moxidectin und das Milbemycinoxim zur Anwendung bei Hund und Katze in Deutschland zugelassen. Milbemycinoxim gilt beim Hund in einer Dosierung von 0,5 mg/kg KGW p.o. einmalig verabreicht als hochwirksam gegen T. canis, T. leonina, A. caninum und T. vulpis (BOWMAN et al. 1988; BOWMAN et al. 1990; WADE et al. 1991; BLAGBURN et al. 1992; REINEMEYER et al. 1995; SANCHEZ BRUNI et al. 2006; SCHENKER et al. 2006). Bei Katzen wirkt es in einer Dosierung von 2 mg/kg KGW oral verabreicht gegen adulte und unreife Stadien von T. cati und A. tubaeforme (HUMBERT-DROZ et al. 2004; SCHENKER et al. 2007). 44 2 Literaturübersicht 2.4.4 Praziquantel Praziquantel ist ein Pyrazinisochinolinderivat, das gegen Zestoden und bestimmte Trematoden wirkt (UNGEMACH 2006). Es zeichnet sich bei Hund und Katze durch geringe Toxizität und gute Verträglichkeit aus. Derzeit kann es als das wirksamste Präparat gegen Zestoden und als das Mittel der Wahl bei Echinokokkeninfektionen der Fleischfresser angesehen werden (UNGEMACH 2006). Der Wirkmechanismus beruht auf einer Tegumentschädigung an den vorderen Bandwurmabschnitten. Dadurch kommt es zu einer Störung der Ca2+-Permeabilität mit der Folge einer starken Kontraktion sowie einer Dysregulation des Stoffwechsels und letztendlich zum Absterben des Parasiten (UNGEMACH 2006). Praziquantel entfaltet seine vermizide Wirkung innerhalb kurzer Zeit nach Verabreichung (ANDREWS et al. 1983). Es ist jedoch nicht ovizid wirksam (THAKUR et al. 1979). Dies ist bei der Behandlung Echinococcus-infizierter Hunde und Katzen zu berücksichtigen, da die medikamentell eliminierten Zestoden noch infektiöse Eier enthalten. Praziquantel kann bei Hund und Katze sowohl oral als auch parenteral appliziert werden, wobei zu beachten ist, dass nach subkutaner Verabreichung gegen Echinococcus spp. eine geringgradig schlechtere Wirkung als nach oraler festzustellen war (GEMMELL et al. 1980). Bei Hunden gilt Praziquantel in einer Dosierung von 5 mg/kg KGW als hoch wirksam gegen Bandwürmer der Gattungen Taenia spp., Dipylidium spp. und Mesocestoides spp. (BAUER 1994). Darüber hinaus wurden Infektionen mit allen Altersstadien von E. granulosus oder E. multilocularis fast stets durch eine einmalige Gabe von 5 mg/kg KGW vollständig eliminiert. In Einzelfällen blieb aber ein geringgradiger Befall mit diesen Zoonoseerregern bestehen (KOBULEJ u. VARGA 1976; GEMMELL et al. 1977, 1980). Bei manifestem Befall mit Echinokokken wird daher eine zweimalige Behandlung mit Praziquantel im Abstand von einem Tag intramuskulär empfohlen (UNGEMACH 2006). Bei Katzen gilt Praziquantel in einer Dosierung von 5 mg/kg KGW als hoch wirksam gegen Bandwürmer der Gattungen Taenia spp., Dipylidium spp. und Joyeuxiella spp. sowie gegen E. multilocularis (BAUER 1994). 45 2 Literaturübersicht Darüber hinaus zeigt Praziquantel in höherer Dosierung und z.T. mehrtägiger Gabe hohe Wirksamkeiten gegen bestimmte Trematoden bei Hund und Katze. So konnte z.B. Opisthorchis spp. mit Praziquantel in einer einmaligen Dosierung von 100 mg/kg KGW erfolgreich bei Hund und Katze bekämpft werden (KOTELNIKOV u. VARENICHEV 1988). 2.5 Anthelminthikaresistenz 2.5.1 Definition Anthelminthikaresistenz ist dann vorhanden, wenn mehr Individuen einer Population therapeutische Konzentrationen eines Wirkstoffes tolerieren als in einer sensiblen Population der gleichen Spezies (PRICHARD et al. 1980). Man versteht darunter also die Fähigkeit einer Parasitenpopulation, Dosierungen eines Anthelminthikums zu tolerieren, die für die Mehrzahl der Individuen einer normal empfindlichen Population letal wären. SANGSTER und GILL (1999) betonen die Unterscheidung der Anthelminthikaresistenz und der Anthelminthikatoleranz. Letztere kann durch mangelnde Wirkstoffkonzentration, Entwicklungsstadien, unterschiedliche geschlechtsabhängige Sensibilität Unterschiede, verschiedener geographische Unterschiede derselben Spezies oder unterschiedliche Eigenschaften einer Spezies in verschiedenen Wirtstieren hervorgerufen werden. 2.5.2 Vorkommen Für Hunde und Katzen gibt es nur wenige Berichte und tatsächlich dokumentierte Fälle über vermutete Resistenzen von Parasiten gegenüber Anthelminthika. In verschiedenen Publikationen wurde über eine verminderte Wirksamkeit von Pyrantel berichtet. 1987 wurde in Neuseeland ein A. caninum-Isolat beschrieben, das sich angeblich gegen Pyrantel als resistent erwiesen hatte (JACKSON et al. 1987). Eine Greyhound-Hündin, die von Australien nach Neuseeland importiert wurde, wurde mit einem Pyrantel-Oxantel-Kombinationspräparat ohne Erfolg behandelt. Die Mitarbeiter 46 2 Literaturübersicht kultivierten infektiöse Larven aus dem Kot dieser Hündin und benutzten diese, um patente Infektionen in zwei Hundewelpen hervorzurufen. Die Behandlung mit dem fünffachen der empfohlenen Dosierung von dem Pyrantel-Oxantel- Kombinationspräparat konnte die Eiausscheidung dieser Welpen nicht senken, wohingegen eine darauf folgende Behandlung mit einer Standarddosis von Ivermectin nach drei Tagen dazu führte, dass keine Eier mehr in den Kotproben nachgewiesen werden konnten (JACKSON et al. 1987). HOPKINS et al. (1989) stellten in einer anderen Studie Wirksamkeiten für drei Pyrantel-OxantelPraziquantel-Kombinationspräparate von 63,4 % bis 76 % fest, verglichen mit einer Wirksamkeit von 99 % für ein Anthelminthikum, welches Pyrantel und Febantel enthielt. 1991 konnten HOPKINS und GYR in einem kritischen Test (Kap. 2.5.3.2) zeigen, dass Pyrantelembonat die Hakenwurmbürde um nur 75,1 % senkte. In einer 2007 durchgeführten Studie von KOPP et al. wurde eine therapeutische Wirksamkeit für Pyrantel von 25,7 % gegen Isolate von A. caninum aus Brisbane festgestellt. Damit wurde die Existenz von Resistenz gegenüber Pyrantel in einer A. caninumPopulation in Hunden aus Brisbane/Australien bewiesen. Weiterführende Felduntersuchungen, die das Ausmaß der Resistenzverbreitung bestimmen könnten, gibt es in Australien bisher nicht (KOPP et al. 2008). In Kombination mit Febantel konnten für Pyrantel, vermutlich aufgrund des angenommenen Synergismus der beiden Wirkstoffe (HOPKINS et al. 1989; HOPKINS u. GYR 1991; MEHLHORN et al. 2003), bisher keine verminderten Wirksamkeiten nachgewiesen werden (KOPP et al. 2008). Für Europa wurde kürzlich in einer multizentrischen Feldstudie gezeigt, dass ein Pyrantel-Oxantel-PraziquantelKombinationspräparat hoch wirksam gegen T. canis, A. caninum, U. stenocephala, T. vulpis, T. leonina, Dipylidium caninum und Taenia spp. war (GRANDEMANGE et al. 2007). Für das Vorhandensein von Pyrantel-Resistenz in einer T. canis-Population sprechen Ergebnisse einer nordamerikanischen Studie (RIDLEY u. DRYDEN 1993). Hier konnte in einem kontrollierten Test (siehe Kap. 2.5.3.1) bei der Autopsie von T. canis-infizierten Hundewelpen nach Behandlung mit Pyrantel eine höhere Wurmbürde festgestellt werden als bei den Kontrolltieren, wohingegen Fenbendazol zu 100 % wirksam war. 47 2 Literaturübersicht Für Katzen liegen bisher keine Mitteilungen über Anthelminthika-resistente Endoparasiten vor. 2.5.3 Diagnostik der Anthelminthikaresistenz Zur Wirksamkeitsbestimmung von Anthelminthika stehen verschiedene Methoden zur Verfügung, die von Experten als Methode der Wahl empfohlen und zur Zulassung von Produkten verlangt werden. Diese sind im Folgenden kurz beschrieben. 2.5.3.1 Kontrollierter Test Nach den Richtlinien der World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) ist der kontrollierte Test eine zuverlässige Methode, um die Wirksamkeit von Anthelminthika zu bestimmen (JACOBS et al. 1994). Eine Gruppengröße von mindestens sechs Tieren wird empfohlen. Die infizierten Tiere werden nach dem Zufallsprinzip in eine Behandlungs- und eine Kontrollgruppe eingeteilt. Abhängig von dem verwendeten Anthelminthikum werden die Tiere bei gastrointestinalen Helminthen ein bis zwei Wochen nach der Behandlung getötet und die Wurmbürde gezählt und identifiziert. Die Wirksamkeit wird nach folgender Formel berechnet: Wirksamkeit % = (mittlere Wurmzahl der Kontrolltiere – mittlere Wurmzahl der behandelten Tiere) x 100 /mittlere Wurmzahl der Kontrolltiere. 2.5.3.2 Kritischer Test Der kritische Test kann für im Darmlumen ansässige gastrointestinale Helminthen angewandt werden (JACOBS et al. 1994). Er wird bei einzeln gehaltenen Tieren durchgeführt, die experimentell oder natürlich infiziert und behandelt werden. Jedes Tier fungiert als eigene Kontrolle. Ein bis drei Tage vor der Behandlung und bis zur Tötung der Tiere nach sieben Tagen werden Kotproben genommen und die Würmer gezählt. An Tag sieben wird die im Tier verbliebene Wurmbürde identifiziert und gezählt. Die Ausgangswurmbürde ergibt sich aus der Summe der einzelnen Zählungen. Die Berechnung der Wirksamkeit wird wie folgt vorgenommen: Wirksamkeit % 48 = Anzahl der ausgeschiedenen Parasiten/ (Anzahl der 2 Literaturübersicht ausgeschiedenen Parasiten + Anzahl der im Tier verbliebenen Parasiten) x 100. Ein Nachteil dieses Tests ist, dass Zestoden und einige Nematoden in der Kotpassage gänzlich oder teilweise verdaut werden, so dass sie schwierig zu finden und zu identifizieren sind. Hinsichtlich solcher Parasiten wird daher nur eine Schätzung der Wirksamkeit möglich sein. Sowohl der kritische als auch der kontrollierte Test sind geeignet, um die Wirksamkeit gegen adulte Würmer zu berechnen, aber nur der letztere ist geeignet, um die Wirksamkeit eines Anthelminthikums gegen larvale Stadien zu bestimmen. Die Nachteile dieser Tests sind der hohe Zeit- und Kostenaufwand und die Notwendigkeit der Tötung von Versuchstieren (JOHANSEN 1989). 2.5.3.3 Eizahlreduktionstest Beim Eizahlreduktionstest (EZRT) erfolgt die Behandlung eines natürlich infizierten Tieres mit einem Antheminthikum. Die Beurteilung der Wirksamkeit des Anthelminthikums erfolgt anhand des Vergleiches der Eizahl pro Gramm Kot vor und nach der Behandlung. Die W.A.A.V.P. gibt Empfehlungen für die Durchführung des EZRT bei Wiederkäuern, Pferden und Schweinen. Für die letzteren beiden wird eine Eizahlreduktion (EZR) von weniger als 90 % als hinweisend für Anthelminthikaresistenz angenommen. Da für Hunde und Katzen Angaben zur Durchführung des EZRT bzw. zur Höhe der EZR bei Vorliegen einer Resistenz fehlen, soll in vorliegender Studie eine EZR von < 90 % als hinweisend für eine Anthelminthikaresistenz gelten. Zur Berechnung der EZR wurden von verschiedenen Autoren unterschiedliche Berechnungsmethoden aufgeführt. Die folgende Art der Berechnung wird von BAUER et al. (1986), CHAPMAN et al. (1991) und YOUNG et al. (1999) empfohlen: EZR= (EpGvB-EpGnB) x 100/EpGvB EpGvB = EpG vor der Behandlung EpGnB = EpG nach der Behandlung 49 2 Literaturübersicht Der EZRT ist einfach durchzuführen und mit geringem Kostenaufwand verbunden (COLES et al. 1992; JOHANSEN 1989). Er lässt sich bei natürlich infizierten Tieren direkt anwenden, ohne dass er eine Stressbelastung für das Tier darstellt oder die Tiere euthanasiert werden müssen. Die Sensitivität des Tests liegt zwischen 50 % und 75 %. Weisen weniger als 25 % der Individuen einer Wurmpopulation Resistenzen auf, kann dies durch den EZRT nicht ermittelt werden (MARTIN et al. 1989). TAYLOR et al. (2002) heben hervor, dass der EZRT die Effizienz eines Anthelminthikums nicht genau wiedergeben kann, da er nur den Effekt auf die Eiausscheidung der adulten/reifen Parasiten misst, diese aber nicht immer mit der aktuellen Wurmzahl korreliert. COLES et al. (1992) empfehlen die Verwendung größerer Tiergruppen, deren EpG-Werte > 150 liegen sollten. Unreife Larvenstadien, die noch keine Eier ausscheiden, werden duch den EZRT nicht erfasst. Der EZRT wird als beste Möglichkeit für Anthelminthikaresistenz-Screening im Feld angesehen (COLES et al. 1992; JOHANSEN 1989; KAPLAN 2002). 50 3 Eigene Untersuchungen 3 Eigene Untersuchungen 3.1 Material 3.1.1 Antiparasitika Bei den im Folgenden gelisteten Antiparasitika, die in der vorliegenden Studie bei Hunden und Katzen zur Anwendung kamen, sind jeweils in Klammern die enthaltenen Wirkstoffe genannt. Als Abkürzungen werden verwendet: FBZ Fenbendazol MBM-O Milbemycinoxim PRZ Praziquantel PYR Pyrantelembonat aniprazol® KH (FBZ/PZQ) aniMedica GmbH, Senden-Bösensell Banminth® - Paste (Hund) (PYR) Pfizer GmbH, Karlsruhe Banminth® - Katze (PYR) Pfizer GmbH, Karlsruhe Droncit® Tabletten (PZQ) Bayer Vital GmbH, Leverkusen Drontal® (PYR/PZQ) Bayer Vital GmbH, Leverkusen Fenquantel® (FBZ/PZQ) Alfavet Tierarzneimittel GmbH, Neumünster Milbemax® für Hunde (MBM-O/PZQ) Novartis Tiergesundheit GmbH, München Milbemax® für Katzen (MBM-O/PZQ) Novartis Tiergesundheit GmbH, München ® Panacur Tabletten (FBZ) Intervet Deutschland GmbH, Unterschleißheim Prazifen-Kombi® (FBZ/PZQ) CEVA Tiergesundheit GmbH, Düsseldorf Praziquasel® (PZQ) Selectavet Dr. Otto Fischer GmbH, Weyarn-Holzolling 51 3 Eigene Untersuchungen 3.1.2 Giardia-Koproantigentest SNAP® Giardia Test 3.1.3 IDEXX GmbH, Ludwigsburg Lösungen Natriumchloridlösung, gesättigt 36 g NaCl (Siedespeisesalz von Esco, 25 kg) in 100 ml H2O, spezifisches Gewicht 1,24 Zinksulfatlösung 76 g ZnSO4 (ZnSO4-Heptahydrat, 5 kg, Fa. Carl Roth, Karlsruhe) in 100 ml H2O, spezifisches Gewicht 1,3 Jod-Kaliumjodidlösung nach Lugol 3.1.4 Carl Roth, Karlsruhe Einwegartikel Plastikkotröhrchen Henry Schein® Medical GmbH, Hamburg Schutzgefäß zum Versand Henry Schein® Medical GmbH, Hamburg Schraubverschluss für Schutzgefäß Henry Schein® Medical GmbH, Hamburg Versandtaschen Henry Schein® Medical GmbH, Hamburg Objektträger VWR International GmbH, Darmstadt Deckgläser, 18x18 mm Carl Roth, Karlsruhe Transferpipette, 3,5 ml Sarstedt AG & Co, Nümbrecht 3.1.5 Mehrwegartikel Drahtöse, rechtwinklig gebogen, Ø 4 mm Carl Roth, Karlsruhe Mörser, Pistill DURAN Group GmbH, Mainz Messzylinder aus Plastik, 100 ml Carl Roth, Karlsruhe 52 3 Eigene Untersuchungen Haushaltssiebe WMF AG, Geislingen/Steige Bechergläser, 250 ml DURAN Group GmbH, Mainz Zentrifugenröhrchen, 15 ml DURAN Group GmbH, Mainz Schliffstopfenflasche, 100 ml Hersteller unbekannt Plastikspritzflasche, 500 ml Carl Roth, Karlsruhe McMaster-Zählkammern FiBL (Forschungsinstitut für biologischen Landbau), Frankfurt Plastiktrichter, Ø oben 80 mm Landgraf Laborsysteme HLL GmbH, Langenhagen Plastiktrichter, Ø oben 120 mm Carl Roth, Karlsruhe Schlauch aus Silikon, Ø innen 10 mm Carl Roth, Karlsruhe Schlauchklemme Hersteller unbekannt Sieb, Ø 110 mm (Maschenweite 200 µm) Hersteller unbekannt Petrischale, Ø 90 mm Carl Roth, Karlsruhe Metallgestell Hersteller unbekannt 3.1.6 Geräte Elektrische Präzisionswaage 1213MP Sartorius Group, Göttingen Mikroskop Axiostar Plus Carl Zeiss GmbH, Jena Megafuge® 1.0 Heraeus, Osterode 3.1.7 Computerprogramme SPSS® 11.5 SPSS® Inc. Chicago, IL, USA 53 3 Eigene Untersuchungen 3.2 Methoden 3.2.1 Auswahl der Tierheime Tierheime in Niedersachsen wurden aus Listen des Deutschen Tierschutzbundes e.V., der Aktion Tier - Menschen für Tiere e.V., des Bundes gegen Missbrauch der Tiere e.V., des Verbandes niedersächsischer Tierschutzvereine e.V., der Bundestierärztekammer, über die Internetseite www.tierheimlinks.de und über mündliche Informationen der befragten Tierheimmitarbeiter ermittelt. Aus jedem Landkreis in Niedersachsen wurde, wenn möglich, ein Tierheim willkürlich ausgewählt und dessen Ansprechpartner, dies waren die Tierheimleiter oder die betreuenden Tierheimtierärzte, kontaktiert. Von 39 kontaktierten Tierheimen zeigten 33 Interesse an der Studie teilzunehmen. Voraussetzung für die Teilnahme an vorliegender Studie war, dass sich die Tierheimmitarbeiter mit dem Versuchsaufbau einverstanden erklärten. Insgesamt gingen 26 Tierheime in die Studie ein (siehe Abb. 1). Zehn Tierheime lagen im Regierungsbezirk Weser-Ems, sieben im Regierungsbezirk Braunschweig, fünf im Regierungsbezirk Lüneburg und vier im Regierungsbezirk Hannover. 54 3 Eigene Untersuchungen Aurich Wilhelmshaven Emden Winsen Rotenburg Uplengen Oldenburg Sedelsberg Lüneburg Hodenhagen Haren Nienburg Hoogstede Celle Lingen Peine Wolfsburg Langenhagen Osnabrück Braunschweig Hameln Hildesheim Wolfenbüttel Goslar Osterode Hannoversch Münden Abb. 1: 3.2.2 Die Standorte der beprobten Tierheime in Niedersachsen Tiere Es wurden Kotproben von solchen Hunden und Katzen untersucht, die als Fundoder Abgabetiere in einem der an der Studie teilnehmenden Tierheime in Niedersachsen (siehe Abb. 1) aufgenommen wurden. Als Fundtiere wurden in vorliegender Studie solche Tiere bezeichnet, die von einem Finder aufgegriffen und im Tierheim abgegeben wurden. Meist können zu solchen Tieren keine anderen anamnestischen Angaben gemacht werden als der Auffindungsort. Es kann sich bei solchen Tieren sowohl um Tiere handeln, die dem Besitzer entlaufen sind, als auch um Tiere, die von ihrem Besitzer ausgesetzt worden sind. Darüber hinaus kann es sich aber auch um herrenlose Tiere handeln. 55 3 Eigene Untersuchungen Als Abgabetiere galten in vorliegender Studie solche Tiere, die von ihrem Besitzer vorübergehend oder dauerhaft nicht mehr gehalten werden konnten, oder die dieser nicht mehr halten wollte. Im Falle der vorübergehenden Abgabe gab der Tierbesitzer sein Tier für einen gewissen Zeitraum im Tierheim ab, z.B. zu Urlaubszeiten des Besitzers. Das Tierheim übernahm dann in dieser Zeit die Funktion einer Tierpension. Im Falle der dauerhaften Abgabe gab der Tierbesitzer sein Tier an das Tierheim ab und nach Unterzeichnung eines Übereignungsvertrages oder auch Abgabevertrages ging das Tier in den Besitz des Tierheimes über, damit das Tierheim für einen neuen Platz für das Tier sorgen konnte. Im Gegensatz zu den Fundtieren sind bei den Abgabetieren in der Regel mehr anamnestische Angaben über das Tier verfügbar, da mehr Details aus dem Leben des Tieres erfragt werden können. Für die Resistenzuntersuchungen wurden bei den Hunden und Katzen auch solche Tiere beprobt, die sich schon über einen längeren Zeitraum (Monate bis Jahre) im Tierheim befanden. Diese Tiere werden in vorliegender Studie als Bestandstiere bezeichnet. Weiterhin wurden für die Resistenzuntersuchungen auch sichergestellte oder beschlagnahmte Hunde und Katzen untersucht. Dazu gehörten die Tiere, deren Besitzern ein Verstoß gegen das Tierschutzgesetz wie Vernachlässigung oder Misshandlung nachgewiesen werden konnte. Sie wurden dem Besitzer durch die zuständige Behörde und den beamteten Tierarzt nach §19 Tierschutzgesetz entzogen und zur Sicherstellung im Tierheim untergebracht. 3.2.3 Probenentnahme und Versand Nach ihrer Einlieferung ins Tierheim ordneten die Tierheimmitarbeiter den Tieren eine fortlaufende Nummer zu oder benannten sie mit einem Namen, so dass eine eindeutige Zuordnung der Tiere erfolgen konnte. Die Tiere wurden in der Regel in der Quarantänestation des Tierheimes in Einzelboxen gehalten. Die Kotproben der Tiere wurden von den Tierheimmitarbeitern mit Hilfe eines Plastikkotröhrchens in der Regel nach dem ersten Kotabsatz des Tieres aus der jeweiligen Box frisch entnommen. Sie wurden daraufhin mit der jeweiligen Nummer oder dem Namen des Tieres kenntlich gemacht, in ein Schutzgefäß zum Versand überführt und mit dem 56 3 Eigene Untersuchungen dazugehörigen Fragebogen zum Tier (siehe Anhang 11.1, Abb. 7) an das Institut für Parasitologie der Tierärztlichen Hochschule Hannover gesandt. Bei den Bestandstieren erfolgte eine Auswahl der Tiere durch die Tierheimmitarbeiter. Diese Tiere waren entweder klinisch durch manifesten Durchfall auffällig oder wurden zur Routineuntersuchung beprobt. Voraussetzung war, dass die letzte anthelminthische Behandlung mindestens sechs Wochen zurücklag. Die Probenentnahme erfolgte wie oben beschrieben. 3.2.4 Antiparasitika Bei ausgewählten Helminthen-positiven Tieren wurde eine mit den jeweiligen Tierheimmitarbeitern abgesprochene Behandlung mit einem Benzimidazol (Fenbendazol), einem Tetrahydropyrimidin (Pyrantel), einem Makrozyklischen Lakton (Milbemycinoxim) oder einem Pyrazinisochinolinderivat (Praziquantel) durchgeführt. Die Antiparasitika wurden vom Tierheimpersonal verabreicht, wobei die Dosierung und Dauer der Therapie nach Empfehlung des Herstellers erfolgte. Bei festgestelltem Capillaria-Befall oder bei Befall mit A. abstrusus wurde die anthelminthische Behandlung mit Fenbendazol durchgeführt und in Absprache mit den Tierheimmitarbeitern auf zehn Tage verlängert (nach FOREYT 2001). Bei festgestelltem Giardia-Befall wurde die anthelminthische Behandlung ebenfalls mit Fenbendazol durchgeführt und in Absprache mit den Tierheimmitarbeitern über drei bis fünf Tage gegeben (nach DEPLAZES 2006). Nach Gabe von Pyrantel, Fenbendazol oder Praziquantel wurde in der Regel 14 Tage nach Behandlung, nach Gabe von Milbemycinoxim in der Regel 21 Tage nach Behandlung eine erneute Kotprobe vom jeweiligen Tier wie unter 3.2.3 beschrieben entnommen. Die Probe wurde beschriftet und mit einem Fragebogen zum Tier (siehe Anhang 11.1, Abb. 7) unter Angabe der Dauer der Antiparasitikagabe und der jeweils verabreichten Menge des Antiparasitikums an das Institut für Parasitologie der Tierärztlichen Hochschule Hannover gesandt. 57 3 Eigene Untersuchungen 3.2.5 Kotuntersuchungen 3.2.5.1 Kombiniertes Sedimentations-Flotationsverfahren Bei dem kombinierten Sedimentations-Flotationsverfahren sedimentieren Parasitenstadien zuerst in Wasser und flotieren anschließend aufgrund ihres geringeren spezifischen Gewichts in Salzlösungen mit höherem spezifischem Gewicht (SCHNIEDER u. EPE 2004b). In vorliegender Studie wurden die Kotproben mittels des kombinierten Sedimentations-Flotationsverfahrens in der Regel an dem Tag untersucht, an dem sie im Institut für Parasitologie der Tierärztlichen Hochschule Hannover ankamen. In wenigen Fällen wurden sie für maximal zwei Tage im Kühlschrank bei +6 °C aufbewahrt. Nach Zuteilung einer institutsinternen Identifikationsnummer wurden grobe Kotbeimengungen wie Katzenstreu entfernt. Von der Kotprobe wurden ca. 5 g Kot entnommen und anschließend mit Wasser im Mörser mit Pistill verrührt. Diese Kotmenge wurde nun auf ein Teesieb gegeben, welches auf einem Becherglas (250 ml) positioniert war. Dann wurde mittels eines harten Wasserstrahls die Kotmenge durch das Teesieb in das Becherglas gespritzt, bis dieses komplett gefüllt war. Die im Teesieb zurückgebliebenen gröberen Kotbestandteile wurden verworfen. Die Suspension wurde nun 30 min stehen gelassen, damit darin enthaltene Parasitenstadien sedimentieren konnten. Der Überstand wurde nun ohne abzusetzen dekantiert und ca. ein ml des Sediments wurde in ein Zentrifugenröhrchen (15 ml) überführt. Dieses Zentrifugenröhrchen wurde dann mit ZnSO4-Lösung gefüllt und anschließend fünf min bei 189 x g zentrifugiert. Mit Hilfe einer rechtwinklig gebogenen Drahtöse wurde die Flüssigkeitsoberfläche vollständig auf einen Objektträger überführt und ein Deckglas aufgelegt. Die gesamte Fläche des Deckglases wurde dann sofort bei 160-facher Vergrößerung mikroskopiert und alle Parasitenstadien darin wurden erfasst. Mit dem kombinierten Sedimentations-Flotationsverfahren lassen sich sämtliche Nematodenund Zestodeneier und Protozoenzysten sicher nachweisen, unsicher ist jedoch der Nachweis von Nematodenlarven, Trematodeneiern, Protozoentrophozoiten oder Amöbenzysten (SCHNIEDER u. EPE 2004b). 58 3 Eigene Untersuchungen 3.2.5.2 Auswanderverfahren nach Baermann Beim Auswanderverfahren nach Baermann wandern lebende Larven von Nematoden aus Kot in umgebendes Wasser aus, sinken aufgrund der Schwerkraft im Wasser ab und können so leicht in einem konisch zulaufenden Gefäß angereichert werden. In vorliegender Studie wurden Kotproben von solchen Tieren mit dem Auswanderverfahren nach Baermann untersucht, bei denen im kombinierten Sedimentations-Flotationsverfahren Larven nachgewiesen wurden. Dazu wurde ein Silikonschlauch über den Trichterstutzen eines Kunststofftrichters gezogen. Das freie Ende dieses Schlauches wurde nun spitzwinkelig abgeschnitten und mit einer schräg aufgesetzten Schlauchklemme so verschlossen, dass die Klemmgriffe der Schlauchklemmen nach unten gerichtet waren. Der Trichter wurde nun in ein Gestell eingehängt und bis zwei bis drei cm unter den Rand mit Leitungswasser gefüllt. Anschließend wurde sorgfältig auf Dichtheit überprüft. Nun wurde von der betreffenden Kotprobe je nach vorhandener Restkotmenge fünf bis zehn g abgewogen und in flacher Schicht in ein feinmaschiges Sieb mit flachem Boden verbracht. Dieses Sieb wurde so in den mit Wasser gefüllten Trichter eingelegt, dass nur die Unterseite in das Wasser eintauchte. Die Probe wurde über Nacht bei Raumtemperatur stehen gelassen. Am nächsten Tag wurde die Schlauchklemme vorsichtig geöffnet und einige Tropfen aus der Schlauchspitze in eine Petrischale aufgefangen. Das Präparat wurde zuerst bei 25facher, dann bei 160facher Vergrößerung untersucht. Um die Larven zu fixieren und anzufärben, wurde ein Tropfen Jod-Kaliumjodidlösung nach Lugol zugegeben. Nun wurden die wesentlichen morphologischen Merkmale erfasst und dokumentiert. Mit dem Auswanderverfahren nach Baermann können u.a. Larven von Lungennematoden (z.B. A. abstrusus, Crenosoma spp.), im älteren Kot auch Larven von Strongyloides und Strongyliden nachgewiesen werden (BAUER 2006). 3.2.5.3 Ei- bzw. Oozystenzählung nach McMaster Zur quantitativen Kotuntersuchung eignet sich das McMaster-Verfahren nach GORDON und WHITLOCK (1939) in der Modifikation von WETZEL (1951). Bei diesem quantitativen Flotationsverfahren werden alle parasitären Gebilde erfasst, die in gesättigten Salzlösungen flotieren (SCHNIEDER u. EPE 2004a). In vorliegender 59 3 Eigene Untersuchungen Studie wurden alle Kotproben, die in dem kombinierten Sedimentations- Flotationsverfahren (siehe 3.2.5.1) Helminthen- bzw. Kokzidien-positiv waren, weiterführend mit dem modifizierten McMaster-Verfahren untersucht, sofern genügend Kotmaterial vorhanden war. Dazu wurden pro Probe vier g Kot in einem Mörser abgewogen und dann mit etwa zehn ml gesättigter NaCl-Lösung mittels Pistill verrührt. Die Kot-Suspension wurde dann durch ein Teesieb und einen Trichter in einen Standzylinder gegossen und mit gesättigter Kochsalzlösung auf 60 ml aufgefüllt. Diese Lösung wurde dann in eine Schliffstopfenflasche überführt. Nach gründlichem Durchmischen der Suspension durch Schwenken und Einblasen von Luft mittels einer Transferpipette wurden jeweils drei Abteilungen der Zählkammer nach McMaster in der Modifikation von WETZEL (1951) beschickt. Dabei wurde für jede Abteilung die Pipette erneut befüllt, nachdem die Schliffstopfenflasche vorher erneut geschwenkt und Luft eingeblasen wurde. Die Eier bzw. Oozysten wurden nach drei Minuten Flotationszeit in den drei Zählfeldern bei 63facher bis 160facher Vergrößerung unter dem Mikroskop ausgezählt. Die Berechnung der Eizahl pro Gramm Kot (EpG) bzw. Oozystenzahl pro Gramm Kot (OpG) wurde dabei wie folgt vorgenommen: Eizahl- bzw. Oozystenzahl pro Gramm Kot (EpG bzw. OpG)= Ei- bzw. Oozystenzahl aus drei Zählfeldern x 100/3. Die Empfindlichkeit der Methode liegt bei 33 EpG bzw. OpG. Eine EpG bzw. OpG von <33 wurde berechnet, wenn ein Parasitenstadium gefunden wurde, das nicht innerhalb des Zählfeldes lag. Mit dem McMaster-Verfahren nach GORDON und WHITLOCK (1939) in der Modifikation von WETZEL (1951) gelingt ein sicherer Nachweis für Protozoenoozysten, -zysten und Helmintheneier mit einem spezifischen Gewicht unter dem der gesättigten Kochsalzlösung (SCHNIEDER u. EPE 2004a). Unsicher in NaCl ist der Nachweis von Eiern von Trichuris spp., Capillaria spp. und Taeniiden, kein Nachweis gelingt in NaCl für Zysten von Giardia sp. und Larven von Nematoden (SCHNIEDER u. EPE 2004a). 60 3 Eigene Untersuchungen 3.2.5.4 Prüfung auf Anthelminthikaresistenz mit dem Eizahlreduktionstest Bei diagnostiziertem Nematoden- bzw. Zestodenbefall wurde die Eizahl pro Gramm Kot bestimmt (siehe 3.2.5.3). Die Tiere wurden dann wie unter 3.2.4 beschrieben anthelminthisch behandelt entweder mit Pyrantel, Fenbendazol, Milbemycinoxim oder Praziquantel oder mit einem der drei zuerst genannten Wirkstoffe in Kombination mit Praziquantel. Wenn möglich wurde für den Eizahlreduktionstest 14 bzw. 21 Tage nach Behandlung erneut eine Kotprobe wie unter 3.2.3 beschrieben entnommen und auf Eiausscheidung untersucht. Die Eizahlreduktion wurde wie unter 2.5.3.3 beschrieben bestimmt. 3.2.5.5 Giardia-Koproantigen-Nachweis Der IDEXX SNAP® Giardia Test ist ein schneller Enzym-Immunassay zum Nachweis von Giardia-Antigen im Kot von Hunden und Katzen. Er besteht aus dem Konjugat/Abstrichtupfer und der SNAP®-Testeinheit (siehe Abb. 2). Abb. 2: Konjugat/Abstrichtupfer und SNAP®-Testeinheit des SNAP®-GiardiaTests (Quelle: http://www.idexx.ch/tiergesundheit/praxistests/giardia_includes/productinsert.pdf) 61 3 Eigene Untersuchungen Der Konjugat/Abstrichtupfer besteht im oberen Teil aus dem Reagenzkolben, worin sich 0,7 ml Anti-Giardia-Peroxid-Konjugatlösung und als Konservierungsmittel Gentamicin befinden. Verbunden ist dieser Reagenzkolben mit dem Abstrichtupfer durch einen Kunststoff-Ventilschaft, der als Brechkolben fungiert. Nach Aufbrechen desselben kann durch Drücken auf den Kolben die Konjugatlösung aus dem Kolben durch das Innere des Abstrichtupfers in die Abstrichtupferspitze transferiert werden. Die SNAP®-Testeinheit besitzt eine Probenvertiefung zum Eintropfen der Konjugat/Kotsuspension, ein Ergebnisfenster, ein Aktivierungsauge und einen Aktivator. Sie enthält 0,6 ml Substratlösung und 0,4 ml Waschlösung. Soweit der IDEXX SNAP® Giardia Test lieferbar und genügend Kotmaterial vorhanden war, wurde der Test bei jeder eingesandten Kotprobe wie folgt verwendet: Das Röhrchen, das den Abstrichtupfer bedeckte, wurde abgezogen. Mit dem Abstrichtupfer wurde von der jeweiligen Kotprobe Kotmaterial so aufgenommen, dass die gesamte Spitze des Abstrichtupfers mit einer dünnen Schicht von Kotmaterial bedeckt war. Nun wurde das Röhrchen wieder auf den Abstrichtupfer gesetzt und der Kunststoff-Ventilschaft im Innern des Reagenzkolbens wurde aufgebrochen. Die Abstrichtupferspitze wurde nun senkrecht nach unten gehalten, der Kolben wurde gedrückt und wieder losgelassen, um die Konjugatlösung durch die Abstrichtupferspitze in den Kolben zu transferieren. Dieser Vorgang wurde dreimal wiederholt, um eine ausreichende Mischung des eventuell vorhandenen Antigens mit dem enzymgebundenen Antikörper im Konjugat zu gewährleisten. Nun wurde das Schutzröhrchen des Abstrichtupfers wieder entfernt, die Abstrichtupferspitze als Pipette benutzt und es wurden jeweils fünf Tropfen der Proben-Konjugatlösung in die Probenvertiefung der SNAP®-Testeinheit gegeben. Die Proben-Konjugatmischung lief nun über die Matrix, welche mit antigenspezifischen Antikörpern vorbeschichtet war. Falls in der Probe Giardia-Antigen vorhanden war, konnte der bereits gebundene enzymgekoppelte Antikörper-Antigen-Komplex an den matrixgebundenen Antikörper binden. Sobald die Proben-Konjugatmischung nun im Aktivierungkreis erschien, wurde der Aktivator fest eingedrückt, bis er auf gleicher Ebene mit dem Körper der Testeinheit war. Der sich nun anschließende Waschschritt entfernte unspezifisches, nicht gebundenes Konjugat und Kotbestandteile von der Hintergrundmatrix. Nun konnte das Substrat über die gewaschene Matrix fließen 62 3 Eigene Untersuchungen und, für den Fall, dass sich Giardia-Antigen in der Probe befand, von dem enzymgekoppelten Antikörper-Antigen-Antikörper-Komplex umgesetzt werden. Dies wurde als blaue Farbreaktion in der Giardia-Antigen-Probenanzeige sichtbar. Das Ergebnis wurde als negativ gewertet, wenn die Probenanzeige und die negative Kontrollanzeige keine Färbung aufwiesen oder die Probenanzeige die gleiche Färbung wie die negative Kontrollanzeige hatte. Ein positives Ergebnis lag dann vor, wenn die Färbung der Giardia-Probenanzeige dunkler als die Färbung der negativen Kontrollanzeige war. Die Farbentwicklung an der positiven Kontrollanzeige diente zur Anzeige der Funktionsfähigkeit der Testreagenzien und zur unterstützenden Bestätigung der richtigen Testdurchführung. 3.2.6 Statistische Auswertung Die Auswertung der erhobenen Daten erfolgte mit Hilfe des Softwarepaketes SPSS® (Version 11.5) für Windows. Da nicht für alle untersuchten Tiere vollständige Daten vorlagen, schwankt die Anzahl der in die statistische Auswertung einbezogenen Daten von Parameter zu Parameter. Es wurden Kreuztabellen erstellt und die Häufigkeitsverteilung der Variablen mit dem Chi-Quadrat-Test oder dem FisherExakt-Test auf Abhängigkeiten überprüft. Wurden bei den Berechnungen bezüglich der Unterschiede Irrtumswahrscheinlichkeiten von p ≤ 0,05 festgestellt, wurden diese Unterschiede als signifikant eingestuft. Unterschiede mit Irrtumswahrscheinlichkeiten von p ≤ 0,001 wurden als hochsignifikant bewertet. Zur Symbolisierung des Signifikanzniveaus siehe Tabelle 1. Tabelle 1: Irrtumswahrscheinlichkeit, Bedeutung und Symbolisierung Irrtumswahrscheinlichkeit Bedeutung Symbolisierung p > 0,05 nicht signifikant ns p ≤ 0,05 signifikant * p ≤ 0,001 hochsignifikant ** 63 4 Ergebnisse 4 Ergebnisse In den Jahren 2006 und 2007 wurden Kotproben von 445 Fund- und Abgabehunden und 837 Fund- und Abgabekatzen bei ihrem Eintritt in ein Tierheim in Niedersachsen hinsichtlich des Befalls mit Endoparasiten mit dem kombinierten SedimentationsFlotationsverfahren untersucht. Bei positivem Kotbefund schloss sich eine quantitative Kotuntersuchung mit dem McMaster-Verfahren an. Bei 341 bzw. 584 Proben von Hunden bzw. Katzen wurde zusätzlich der IDEXX SNAP® Giardia Test angewendet. Mit Hilfe eines Fragebogens (siehe Anhang 11.1, Abb. 7) wurden Angaben zu den einzelnen beprobten Tieren wie Tierart, Alter, Geschlecht, Gewicht und Aufnahmegrund gemacht. Da bei der Fragebogenauswertung nur in wenigen Fällen Angaben zu vorangegangenen antiparasitären Behandlungen der neuauf- genommenen Tiere vorlagen, konnten diese Daten nicht ausgewertet werden. Bei ausgewählten Helminthen-positiven Tieren wurde der Eizahlreduktionstest zur Abschätzung der Wirksamkeit der Anthelminthika durchgeführt. 4.1 Koproskopische Untersuchung 4.1.1 Parasitenspektrum und -häufigkeit Kotproben von 445 Fund- und Abgabehunden wurden koproskopisch auf das Vorhandensein von Endoparasitenstadien untersucht. Bei 42 Hunden (9,4 %) konnten insgesamt acht verschiedene Parasitenarten bzw. -gattungen nachgewiesen werden, und zwar T. canis in 4,0 %, Isospora spp. in 2,5 %, Giardia sp. in 0,9 %, T. vulpis in 0,9 %, Hakenwürmer in 0,9 %, Capillaria spp. in 0,4 %, T. leonina in 0,2 % und hammondiaähnliche Oozysten1 in 0,2 % (siehe Abb. 3). 1 Morphologisch sind die Oozysten von N. caninum und H.heydorni identisch, daher werden sie hier unter dem Begriff „hammondiaähnliche Oozysten“ zusammengefasst. 64 4 Ergebnisse Abb. 3: Prävalenz (%) von Endoparasiten bei Fund- und Abgabehunden (n=445), bestimmt mit Hilfe des kombinierten SedimentationsFlotationsverfahrens. Die absoluten Zahlen sind in Klammern angegeben (n). Mehrfachbefälle sind einzeln berücksichtigt, daher ist die Summe der positiven Befunde höher als die Gesamtzahl der positiven Proben (n=42). Von 837 untersuchten Kotproben von Fund- und Abgabekatzen erwiesen sich 281 (33,6 %) in der Koproskopie als positiv für Parasitenstadien. Es konnten acht verschiedene Endoparasitenarten, -gattungen bzw. -familien nachgewiesen werden, und zwar T. cati in 27,1 %, Isospora spp. in 7,5 %, Capillaria spp. in 5,0 %, Taeniiden in 2,0 %, Hakenwürmer in 1,1 %, A. abstrusus in 1,0 %, Giardia sp. in 0,7 % und toxoplasmaähnliche Oozysten2 in 0,1 % (siehe Abb. 4). 2 Morphologisch sind die Oozysten von T.gondii und H.hammondi identisch, daher werden sie hier unter dem Begriff „toxoplasmaähnliche Oozysten“ zusammengefasst. 65 4 Ergebnisse Abb. 4: 4.1.2 Prävalenz (%) von Endoparasiten bei Fund- und Abgabekatzen (n=837), bestimmt mit Hilfe des kombinierten SedimentationsFlotationsverfahrens. Die absoluten Zahlen sind in Klammern angegeben (n). Mehrfachbefälle sind einzeln berücksichtigt, daher ist die Summe der positiven Befunde höher als die Gesamtzahl der positiven Proben (n=281). Kombinationen von Parasiten bei Polyinfektionen Von den 445 Fund- und Abgabehunden, von denen Kotproben koproskopisch untersucht wurden, wiesen 8,8 % (39 Hunde) einen Befall mit nur einer und 0,7 % (drei Hunde) mit zwei Endoparasitenarten bzw. -gattungen auf. In zwei Proben waren Eier von Hakenwürmern mit denen anderer Arten kombiniert, einmal mit Eiern von T. vulpis und einmal mit Eiern von T. canis. In einer Probe wurden Oozysten von Isospora spp. und Eier von Capillaria spp. nachgewiesen. Von den 837 koproskopisch untersuchten Kotproben von Fund- und Abgabekatzen wiesen 24,5 % (205 Katzen) einen Befall mit nur einer, 7,6 % (64 Katzen) mit zwei, 66 4 Ergebnisse 1,0 % (acht Katzen) mit drei und 0,5 % (vier Katzen) mit vier Endoparasitenarten, gattungen bzw. -familien auf. Alle Katzen, bei denen drei oder vier Endoparasitenarten -gattungen bzw. -familien vorkamen, waren Fundkatzen. Von den positiven Abgabekatzen wiesen nur drei Tiere einen Befall mit mehr als einer Endoparasitenart, -gattung bzw. -familie auf. In Tabelle 2 sind die Kombinationen der einzelnen Endoparasitenarten, -gattungen bzw. -familien untereinander bei Polyinfektionen dargestellt. 67 4 Ergebnisse Tabelle 2 : Kombinationen von Endoparasiten bei Polyinfektionen von 837 Fundund Abgabekatzen. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Katzen (%). Parasitenarten Anzahl pos. Befunde n % T. cati + Isospora spp. 26 3,1 T. cati + Capillaria spp. 17 2,0 T. cati + Taeniiden 10 1,2 T. cati + Giardia sp. 2 0,2 T. cati + A. abstrusus 2 0,2 T. cati + Hakenwürmer 1 0,1 Capillaria spp. + Isospora spp. 3 0,4 Capillaria spp. + Taeniiden 1 0,1 Capillaria spp. + A. abstrusus 1 0,1 Capillaria spp. + Hakenwürmer 1 0,1 T. cati + Capillaria spp. + Isospora spp. 2 0,2 T. cati + Capillaria spp. + A. abstrusus 2 0,2 T. cati + Isospora spp. + toxoplasmaähnliche Oozysten 1 0,1 T. cati + Capillaria spp. + Hakenwürmer 1 0,1 T. cati + Isospora spp. + Giardia sp. 1 0,1 Capillaria spp. + Isospora spp. + Taeniiden 1 0,1 Capillaria spp. + T. cati + Isospora spp. + Taeniiden 1 0,1 Capillaria spp. + Isospora spp. + Hakenwürmer + A. abstrusus 1 0,1 Capillaria spp. + T. cati + Hakenwürmer + A. abstrusus 1 0,1 Capillaria spp. + T. cati + Hakenwürmer + Taeniiden 1 0,1 Polyinfektionen gesamt 76 9,1 Monoinfektionen 205 24,5 Negativ 556 66,4 68 4 Ergebnisse 4.1.3 Parasitenbefall in unterschiedlichen Altersgruppen Bei 434 von 445 Fund- und Abgabehunden lag eine Angabe zum geschätzten Alter vor. Die Hunde waren fünf Wochen bis 16 Jahre alt (arithmetischer Mittelwert 4,0 Jahre, Median drei Jahre). Zur besseren Darstellbarkeit erfolgt eine Einteilung der Hunde in Alterskategorien von bis einschließlich einem Jahr und von über einem Jahr. 26,0 % (n=113) der 434 Fund- und Abgabehunde waren bis einschließlich ein Jahr und 74,0 % (n=321) über ein Jahr alt. Die Hunde bis zu einem Jahr waren mit 20,4 % (n=23) hochsignifikant häufiger mit Endoparasiten befallen als die Hunde über einem Jahr mit 5,9 % (n=19; p < 0,001). Bei den Hunden bis einschließlich einem Jahr konnten sechs, bei den Hunden über einem Jahr acht Endoparasitenarten bzw. -gattungen nachgewiesen werden (siehe Abb. 5). Abb. 5: Prävalenz (%) von Endoparasiten bei Fund- und Abgabehunden (n=434) in den Altersklassen von bis einschließlich einem Jahr und über einem Jahr. Ein Stern (*) symbolisiert signifikanten Unterschied (p ≤ 0,05); zwei Sterne (**) symbolisieren hochsignifikanten Unterschied (p ≤ 0,001). 69 4 Ergebnisse T. canis und Isospora spp. konnten mit 8,8 % (n=10) bzw. 5,3 % (n=6) signifikant häufiger bei den Hunden bis einschließlich einem Jahr nachgewiesen werden als mit 2,5 % (n=8) bzw. 1,6 % (n=5) bei den Hunden über einem Jahr (p < 0,05). Auch Giardia sp., Hakenwürmer und Capillaria spp. wurden jeweils häufiger bei den jüngeren Tieren nachgewiesen, jedoch konnte für diese Endoparasiten kein statistisch signifikanter Zusammenhang in der Häufigkeit des Auftretens in den beiden Altersklassen nachgewiesen werden. T. vulpis trat mit 0,9 % gleich häufig in beiden Altersklassen auf (n=1 bzw. n=3). T. leonina und hammondiaähnliche Oozysten wurden jeweils mit 0,3 % (n=1) nur bei den Hunden über einem Jahr nachgewiesen. Für die genauen Daten siehe auch Tabelle 8 im Anhang. Bei 814 von 837 Fund- und Abgabekatzen lag eine Angabe zum geschätzten Alter vor. Die Katzen waren drei Wochen bis 15 Jahre alt (arithmetischer Mittelwert 2,35 Jahre, Median ein Jahr). Auch die Katzen werden im Folgenden in Alterskategorien eingeteilt. 54,5 % (n=444) der 814 Fund- und Abgabekatzen waren bis einschließlich ein Jahr und 45,5 % (n=370) waren über ein Jahr alt. Die Katzen bis zu einem Jahr waren mit 46,6 % (n=207) hochsignifikant häufiger mit Endoparasiten befallen als die Tiere über einem Jahr mit 18,4 % (n=68; p < 0,001). Bei den Katzen bis einschließlich einem Jahr konnten acht, bei den Katzen über einem Jahr sieben Endoparasitenarten, -gattungen bzw. -familien nachgewiesen werden (siehe auch Abb. 6). T. cati und Isospora spp. konnten mit 39,4 % (n=175) bzw. 11,5 % (n=51) hochsignifikant häufiger bei den jüngeren Katzen nachgewiesen werden als mit 12,4 % (n=46) bzw. 3,2 % (n=12) bei den Katzen über einem Jahr Lebensalter (p < 0,001). Auch Capillaria spp., Hakenwürmer und A. abstrusus wurden jeweils häufiger bei den jüngeren Tieren nachgewiesen, jedoch konnte für diese Endoparasiten kein statistisch signifikanter Zusammenhang in der Häufigkeit des Auftretens in den beiden Altersklassen nachgewiesen werden. Eier von Taeniiden und Zysten von Giardia sp. konnten mit 2,2 % (n=8) bzw. 1,1 % (n=4) häufiger bei den älteren Tieren nachgewiesen werden als bei den jüngeren Tieren mit 2,0 % (n=9) bzw. 0,5 % (n=2). Dieser Unterschied war jedoch nicht statistisch signifikant. Toxoplasmaähnliche Oozysten wurden mit 0,2 % (n=1) nur einmal bei einer Katze 70 4 Ergebnisse mit einem Alter von sechs Wochen nachgewiesen. Für die genauen Daten siehe auch Tabelle 9 im Anhang. Abb. 6: 4.1.4 Prävalenz (%) von Endoparasiten bei Fund- und Abgabekatzen (n=814) in den Altersklassen von bis einschließlich einem Jahr und über einem Jahr. Ein Stern (*) symbolisiert signifikanten Unterschied (p ≤ 0,05); zwei Sterne (**) symbolisieren hochsignifikanten Unterschied (p ≤ 0,001). Parasitenbefall in Abhängigkeit vom Geschlecht Da nicht immer verlässliche Daten darüber vorlagen, ob die Hunde bzw. Katzen bereits kastriert waren, als sie im Tierheim aufgenommen wurden oder ob eine Kastration erst bei der Aufnahme erfolgte, soll im Folgenden nur zwischen den unkastrierten Geschlechtern differenziert werden. 71 4 Ergebnisse Von 443 Fund- und Abgabehunden, bei denen eine Angabe des Geschlechts vorlag, waren 62,1 % (n=275) männlichen und 37,9 % (n=168) weiblichen Geschlechts. Bei männlichen Hunden konnten in 9,1 % (n=25) und weiblichen Hunden in 10,1 % (n=17) der Kotproben koproskopisch Endoparasiten nachgewiesen werden. Ein signifikanter Zusammenhang zwischen Geschlecht und Endoparasitenbefall konnte weder allgemein noch für die einzelnen Endoparasitenarten bzw. -gattungen festgestellt werden. Die genauen Daten sind Tabelle 10 im Anhang zu entnehmen. Bei 795 Fund- und Abgabekatzen lag eine Angabe des Geschlechts vor. Von diesen waren 47,9 % (n=381) männlich und 52,1 % (n=414) weiblich. Bei männlichen Tieren konnten in 32,8 % (n=125) und weiblichen Tieren in 32,4 % (n=134) der Kotproben koproskopisch Endoparasiten nachgewiesen werden. Ein signifikanter Zusammenhang zwischen Geschlecht und Endoparasitenbefall konnte weder allgemein, noch für die einzelnen Endoparasitenarten, -gattungen bzw. -familien festgestellt werden. Die genauen Daten sind Tabelle 11 im Anhang zu entnehmen. 4.1.5 Parasitenbefall in Abhängigkeit vom Aufnahmegrund Die untersuchten Hunde waren zu 59,3 % (n=264) Fundhunde und zu 40,7 % (n=181) Abgabehunde. Aufgrund der starken Altersabhängigkeit des Befalles mit einigen Endoparasitenarten bzw. -gattungen (siehe Auswertungen unter 4.1.3) wird die Darstellung des Parasitenbefalles in Abhängigkeit vom Aufnahmegrund unter Berücksichtigung der Alterskategorien (wie unter 4.1.3 beschrieben) dargestellt. Von den 264 Fundhunden lag bei 253 Tieren eine Altersangabe vor. 28,1 % (n=71) der Fundhunde waren bis einschließlich ein Jahr und 71,9 % (n=182) waren über ein Jahr alt. Bei den 181 Abgabehunden lag bei allen Tieren eine Altersangabe vor. 23,2 % (n=42) der Abgabehunde hatten ein Alter von bis einschließlich einem Jahr und 76,8 % (n=139) von über einem Jahr. Ein signifikanter Zusammenhang zwischen Aufnahmegrund und Endoparasitenbefall konnte bei den Hunden bis einschließlich einem Jahr weder allgemein noch für die einzelnen Endoparasitenarten bzw. gattungen festgestellt werden. Die genauen Daten sind Tabelle 12 im Anhang zu 72 4 Ergebnisse entnehmen. Bei den Hunden mit einem Lebensalter von über einem Jahr war die Befallsrate mit Endoparasiten allgemein bei den Fundhunden mit 8,8 % (n=16) signifikant höher als bei den abgegebenen Hunden mit 2,2 % (n=3; p < 0,05). Für die einzelnen Endoparasitenarten bzw. -gattungen konnte bei den Hunden über einem Jahr Lebensalter kein signifikanter Zusammenhang zwischen Aufnahmegrund und Endoparasitenbefall festgestellt werden. Die genauen Daten sind der Tabelle 13 im Anhang zu entnehmen. Bei den Katzen handelte es sich bei 90,6 % (n=758) um Fundkatzen und bei 9,4 % (n=79) um Abgabekatzen. Aufgrund der starken Altersabhängigkeit des Befalles mit einigen Endoparasitenarten, -gattungen bzw. -familien (siehe Auswertungen unter 4.1.3) wird die Darstellung des Parasitenbefalles in Abhängigkeit vom Aufnahmegrund ebenfalls unter Berücksichtigung der Alterskategorien (wie unter 4.1.3 beschrieben) dargestellt. Für 735 von 758 Fundkatzen lag eine Altersangabe vor. 57,6 % (n=423) der Fundkatzen waren bis einschließlich ein Jahr und 42,4 % (n=312) über ein Jahr alt. Für alle 79 Abgabekatzen lag ebenfalls eine Altersangabe vor. 26,6 % (n=21) der abgegebenen Katzen hatten ein Alter von bis einschließlich einem Jahr und 73,4 % (n=58) von über einem Jahr. Ein signifikanter Zusammenhang zwischen Aufnahmegrund und Endoparasitenbefall konnte bei den Katzen bis einschließlich einem Jahr weder allgemein noch für die einzelnen Endoparasitenarten, -gattungen bzw. -familien festgestellt werden. Die genauen Daten sind Tabelle 14 im Anhang zu entnehmen. Bei den Katzen über einem Jahr war die Befallsrate mit Endoparasiten allgemein bei den Fundkatzen mit 20,5 % (n=64) signifikant höher als bei den abgegebenen Katzen mit 6,9 % (n=4; p < 0,05). Für die einzelnen Endoparasitenarten, -gattungen bzw. -familien konnte bei den Katzen über einem Jahr kein signifikanter Zusammenhang zwischen Aufnahmegrund und Endoparasitenbefall festgestellt werden. Die genauen Daten sind Tabelle 15 im Anhang zu entnehmen. 73 4 Ergebnisse 4.2 Quantitative Kotuntersuchung mit McMaster In vorliegender Studie wurden alle Kotproben, die in dem kombinierten Sedimentations-Flotationsverfahren Helminthen- bzw. Kokzidien-positiv waren und von denen genügend Material für die quantitative Kotuntersuchung vorhanden war, weiterführend mit dem modifizierten McMaster-Verfahren untersucht. Insgesamt kamen von den Fund- und Abgabehunden 34 Kotproben zur quantitativen Untersuchung. Bei 17 Hunden konnte eine EpG für T. canis bestimmt werden, diese Tiere hatten ein geschätztes Alter von fünf Wochen bis zu sieben Jahren (gemitteltes Alter: 1,7 Jahre). Bei neun Hunden wurde eine OpG für Isospora spp. bestimmt. Diese Hunde waren gemäß geschätzter Altersangabe sechs Wochen bis sechs Jahre alt (gemitteltes Alter: 1,6 Jahre). Eine EpG für T. vulpis konnte bei allen vier T. vulpis-positiven Hunden bestimmt werden. Das geschätzte Alter dieser Hunde wurde mit ein bis acht Jahren angegeben (gemitteltes Alter: 4,5 Jahre). Auch bei allen Hakenwurm-positiven Hunden konnte eine EpG bestimmt werden, die Altersangaben für diese Hunde lagen zwischen vier Monaten und zwei Jahren (gemitteltes Alter: 1,1 Jahre). Die zwei Capillaria-positiven Hunde, bei denen eine EpG bestimmt werden konnte, hatten ein geschätztes Alter von einem Jahr und sechs Jahren. Der Hund, der T. leonina-positiv war, war drei Jahre alt und besaß eine EpG von 1733. Zur Darstellung der minimalen und maximalen EpG bzw. OpG sowie der arithmetischen Mittelwerte und Mediane siehe Tabelle 3. 74 4 Ergebnisse Tabelle 3: Eier- bzw. Oozystenausscheidung pro einem Gramm Kot bei Fund- und Abgabehunden. (n=Anzahl der Fund- und Abgabehunde, bei denen eine EpG/OpG für den jeweiligen Parasiten bestimmt werden konnte; Minimum: minimale Anzahl von Eiern bzw. Oozysten pro Gramm Kot; Maximum: maximale Anzahl von Eiern bzw. Oozysten pro Gramm Kot) Parasitenspezies n Minimum Maximum Arithmetischer Mittelwert Median T. canis 17 <33 4033 788,2 100 Isospora spp. 9 33 16200 3059,2 333 T. vulpis 4 33 1367 500 300 Hakenwürmer 4 <33 167 91,8 100 Capillaria spp. 2 <33 267 133,5 133,5 Bei den Fund- und Abgabekatzen gelangten insgesamt 244 Proben zur quantitativen Kotuntersuchung. Bei 205 Katzen konnte eine EpG für T. cati bestimmt werden, diese Tiere hatten ein geschätztes Alter von vier Wochen bis zu zwölf Jahren (gemitteltes Alter: 1,1 Jahre). Eine OpG für Isospora spp. konnte bei 41 Katzen bestimmt werden, diese Tiere waren gemäß geschätzter Altersangabe vier Wochen bis acht Jahre alt (gemitteltes Alter: 0,8 Jahre). Bei 40 Katzen konnte eine EpG für Capillaria spp. bestimmt werden. Die Altersangaben für diese Katzen lagen zwischen acht Wochen und zehn Jahren (gemitteltes Alter: 1,6 Jahre). Bei 16 von den Taeniiden-positiven Katzen konnte eine EpG bestimmt werden, diese Katzen hatten ein geschätztes Alter von neun Wochen bis acht Jahren (gemitteltes Alter: 2,3 Jahre). Bei allen Hakenwurm-positiven Katzen konnte eine EpG bestimmt werden. Das geschätzte Alter dieser Katzen wurde mit sechs Monaten bis acht Jahren angegeben (gemitteltes Alter: 2,3 Jahre). Eine Katze war in dem kombinierten Sedimentations-Flotationsverfahren positiv für toxoplasmaähnliche Oozysten. Diese Katze hatte ein geschätztes Alter von sechs Wochen, die OpG für die toxoplasmaähnlichen Oozysten betrug 64333. Zur Darstellung der minimalen und maximalen EpG bzw. OpG sowie der arithmetischen Mittelwerte und Mediane siehe Tabelle 4. 75 4 Ergebnisse Eier- bzw. Oozystenausscheidung pro einem Gramm Kot bei Fund- und Abgabekatzen. (n=Anzahl der Fund- und Abgabekatzen, bei denen eine EpG/OpG für den jeweiligen Parasiten bestimmt werden konnte; Minimum: minimale Anzahl von Eiern bzw. Oozysten pro Gramm Kot; Maximum: maximale Anzahl von Eiern bzw. Oozysten pro Gramm Kot) Tabelle 4: n Minimum Maximum Arithmetischer Mittelwert Median T. cati 205 33 24500 2702,2 933 Isospora spp. 41 33 103600 10102,6 1133 Capillaria spp. 40 <33 2967 190,8 67 Taeniiden 16 <33 200 43,7 16,5 Hakenwürmer 9 <33 4767 975,8 333 Parasiten 4.3 Wirksamkeit der Antiparasitika bei Hunden Da die ehemals positiven Fund- und Abgabehunde nicht immer für eine Nachuntersuchung zur Verfügung standen, wurden für den EZRT auch Bestandshunde und beschlagnahmte Hunde untersucht. Von 88 untersuchten Kotproben von Bestandshunden wurden bei 15 (17,0 %) koproskopisch Parasitenstadien nachgewiesen. Es wurden fünf verschiedene Parasitenarten gefunden, und zwar T. canis in 5,7 % (n=5), Isospora spp. in 2,3 % (n=2), Giardia sp. in 8,0 % (n=7), T. vulpis in 3,4 % (n=3) und Hakenwürmer in 1,1 % (n=1). Von 25 untersuchten Kotproben von beschlagnahmten Hunden wurde bei 12 % (n=3) T. canis nachgewiesen. Aufgrund der in dieser Studie festgestellten relativ niedrigen Prävalenz von Helminthen bei Hunden standen für den EZRT bei Hunden nur begrenzt Tiere zur Verfügung. Daher wurden nur Pyrantel und Fenbendazol im EZRT eingesetzt, auf die Anwendung von Milbemycinoxim musste verzichtet werden. 76 4 Ergebnisse 4.3.1 Eizahlreduktionstest mit Fenbendazol Insgesamt 11 Hunde mit T. canis-Befall, drei Hunde mit Hakenwurm-Befall und drei Hunde mit T. vulpis-Befall wurden mit Fenbendazol behandelt und im Rahmen des EZRT nachuntersucht. Vor der Behandlung hatten die T. canis-positiven Proben eine EpG von 33 bis 4033 (arithmetischer Mittelwert: 1058), die Hakenwurm-positiven Proben von 33 bis 167 (arithmetischer Mittelwert: 122) und die T. vulpis-positiven Proben von 33 bis 167 (arithmetischer Mittelwert: 78). 14 Tage nach der Behandlung mit Fenbendazol konnten im EZRT keine Eier mehr im Kot dieser Hunde nachgewiesen werden, die EZR betrug in allen Fällen 100 %. 4.3.2 Eizahlreduktionstest mit Pyrantel Zwei Hunde mit T. canis-Befall, ein Hund mit T. leonina-Befall und ein Hund mit Hakenwurm-Befall wurden im Rahmen des EZRT mit Pyrantel behandelt. Vor der Behandlung hatten die T. canis-positiven Proben eine EpG von 300 und 2967, die T. leonina-positive Probe eine EpG von 1733 und die Hakenwurm-positive Probe eine EpG von 33. 14 Tage nach Behandlung mit Pyrantel konnten im EZRT im Kot dieser Hunde keine Eier mehr nachgewiesen werden, die EZR betrug in allen Fällen 100 %. Die arithmetischen Mittelwerte der EpG vor und nach der Behandlung mit Fenbendazol bzw. Pyrantel sowie die EZR-Werte sind in Tabelle 16 im Anhang angegeben. 4.4 Wirksamkeit der Antiparasitika bei Katzen Auch die ehemals positiven Fund- und Abgabekatzen standen nicht immer zur Nachuntersuchung zur Verfügung, daher wurden für den EZRT auch Bestandskatzen und beschlagnahmte Katzen untersucht. Von 40 untersuchten Kotproben von Bestandskatzen wurden bei 13 (32,5 %) koproskopisch drei verschiedene Parasitenarten bzw. -gattungen nachgewiesen, und zwar T. cati in 17,5 % (n=7), Isospora spp. in 10,0 % (n=4) und Giardia sp. in 5,0 % (n=2). Von 44 untersuchten 77 4 Ergebnisse Kotproben von beschlagnahmten Katzen wurden bei 9,1 % (n=4) koproskopisch drei verschiedene Parasitenarten gefunden, und zwar T. cati in 6,8 % (n=3), Isospora spp. in 2,3 % (n=1) und Capillaria spp. in 2,3 % (n=1). 4.4.1 Eizahlreduktionstest mit Fenbendazol 27 mit T. cati-infizierte Katzen wurden drei Tage lang mit Fenbendazol behandelt und im EZRT nachuntersucht. Vor der Behandlung besaßen die T. cati-positiven Proben eine EpG von 67 bis 8067 (arithmetischer Mittelwert: 1644). 14 Tage nach der Behandlung betrug die EZR in allen getesteten Fällen 100 % (siehe auch Tabelle 17 im Anhang). Zwölf mit Capillaria-infizierte Katzen wurden zehn Tage lang mit Fenbendazol behandelt und im EZRT nachuntersucht. Vor der Behandlung besaßen die Capillariapositiven Proben eine EpG von 33 bis 233 (arithmetischer Mittelwert: 69). 14 Tage nach der Behandlung betrug die EZR in allen Fällen 100 % (siehe auch Tabelle 18 im Anhang). 4.4.2 Eizahlreduktionstest mit Milbemycinoxim Mit Milbemycinoxim konnten 27 mit T. cati-, drei mit Hakenwurm- und fünf mit Capillaria-infizierte Katzen im Rahmen des EZRT behandelt und nachuntersucht werden. Vor der Behandlung besaßen die T. cati-positiven Proben eine EpG von 33 bis 6833 (arithmetischer Mittelwert: 1190), die Hakenwurm-positiven Proben eine EpG von 33 bis 633 (arithmetischer Mittelwert: 300) und die Capillaria-positiven Proben eine EpG von 33 bis 2967 (arithmetischer Mittelwert: 780). 21 Tage nach der Behandlung betrug die gemittelte EZR für T. cati 96,01 %, für Hakenwürmer 100 % und für Capillaria spp. 98,35 % (siehe auch Tabelle 19, Tabelle 20 und Tabelle 21 im Anhang). 4.4.3 Eizahlreduktionstest mit Pyrantel Insgesamt 26 Katzen mit T. cati-Befall und zwei mit Hakenwurm-Befall konnten mit Pyrantel behandelt und im Rahmen des EZRT nachuntersucht werden. Vor der 78 4 Ergebnisse Behandlung hatten die T. cati-positiven Proben eine EpG von 33 bis 12833 (arithmetischer Mittelwert: 2583) und die Hakenwurm-positiven Proben eine EpG von 600 bzw. 2050. 14 Tage nach der Behandlung lag die gemittelte EZR von T. cati bei 94,98 % (siehe auch Tabelle 22 im Anhang) und die von Hakenwürmern bei 100 %. 4.4.4 Wirksamkeit von Praziquantel gegen Taeniiden Insgesamt zehn Katzen mit Taeniiden-Befall wurden mit Praziquantel behandelt und sowohl im Rahmen des EZRT als auch im kombinierten SedimentationsFlotationsverfahren nachuntersucht. Vor der Behandlung hatten die Taeniidenpositiven Proben eine EpG von <33 bis 200 (arithmetischer Mittelwert: 63). 14 Tage nach der Behandlung konnten weder im kombinierten Sedimentations- Flotationsverfahren noch in der quantitativen Kotuntersuchung Eier von Taeniiden festgestellt werden, die EZR lag bei 100 % (siehe auch Tabelle 23 im Anhang). 4.4.5 Wirksamkeit von Fenbendazol gegen A. abstrusus Drei mit A. abstrusus-infizierte Katzen wurden zehn Tage lang mit Fenbendazol behandelt. 14 Tage nach der Behandlung wurden Kotproben von diesen Tieren sowohl mit dem Auswanderverfahren nach Baermann als auch mit dem kombinierten Sedimentations-Flotationsverfahren untersucht. Mit den genannten Verfahren waren keine Parasitenstadien mehr nachweisbar. 79 4 Ergebnisse 4.5 Giardia-Koproantigennachweis Da der IDEXX SNAP® Giardia Test nicht immer lieferbar war, konnte er nicht bei allen in vorliegender Studie untersuchten Hunden und Katzen zur Anwendung kommen. Insgesamt wurden Kotproben von 341 Fund- und Abgabehunden und 584 Fund- und Abgabekatzen vergleichend mit dem kombinierten SedimentationsFlotationsverfahren und dem IDEXX SNAP® Giardia Test untersucht. 4.5.1 Vergleich des Giardia sp.-Nachweises in dem kombinierten Sedimentations-Flotationsverfahren und dem Giardia- Koproantigennachweis Kotproben von 341 Fund- und Abgabehunden und 584 Fund- und Abgabekatzen wurden vergleichend mit dem kombinierten Sedimentations-Flotationsverfahren und mit dem IDEXX SNAP® Giardia Test zum Nachweis von Giardia-Infektionen untersucht. Bei Untersuchung mit dem Flotationsverfahren wurden Giardia-Zysten in 1,2 % (n=4) und 0,9 % (n=5) der Hunde- bzw. Katzenkotproben nachgewiesen. Dagegen war der IDEXX SNAP® Giardia Test in 11,4 % (n=39) der Hunde- und 6,8 % (n=40) der Katzenkotproben positiv. Alle Hunde und Katzen, bei denen Giardia-Zysten in der Koproskopie nachgewiesen werden konnten, waren auch im Giardia-Koproantigennachweis positiv. Zum Vergleich der Häufigkeiten des GiardiaNachweises in den unterschiedlichen Nachweisverfahren bei Hunden bzw. Katzen siehe Tabelle 5 bzw. Tabelle 6. 80 4 Ergebnisse Vergleich des kombinierten Sedimentations-Flotationsverfahrens mit dem IDEXX SNAP® Giardia Test zum Nachweis von Giardia-Infektionen bei 341 Fund- und Abgabehunden; angegeben sind die absoluten Zahlen (n) und prozentualen Anteile (%) der untersuchten Hunde. Tabelle 5: Flotationsmethode Positiv ® SNAP GiardiaTest Tabelle 6: Negativ Total Positiv 4 (1,2) 35 (10,3) 39 (11,4) Negativ 0 (0,0) 302 (88,6) 302 (88,6) Total 4 (1,2) 337 (98,8) 341 (100,0) Vergleich des kombinierten Sedimentations-Flotationsverfahrens mit dem IDEXX SNAP® Giardia Test zum Nachweis von Giardia-Infektionen bei 584 Fund- und Abgabekatzen; angegeben sind die absoluten Zahlen (n) und prozentualen Anteile (%) der untersuchten Katzen. Flotationsmethode Positiv SNAP® GiardiaTest 4.5.2 Negativ Total Positiv 5 (0,9) 35 (5,9) 40 (6,8) Negativ 0 (0,0) 544 (93,2) 544 (93,2) Total 5 (0,9) 579 (99,1) 584 (100,0) Giardia-Koproantigennachweis in Kombination mit in der Koproskopie nachgewiesenen Parasitenstadien Von 341 untersuchten Kotproben von Fund- und Abgabehunden erwiesen sich 11,4 % (n=39) als positiv im IDEXX SNAP® Giardia Test, wohingegen im Flotationsverfahren nur bei 1,2 % (n=4) der untersuchten Proben Giardia-Zysten nachweisbar waren. Bei neun von den Giardia-Koproantigen-positiven Hunden ließen sich in der Koproskopie Parasitenstadien nachweisen, und zwar bei vier Tieren Zysten von Giardia sp., bei vier Tieren Eier von T. canis und bei einem Tier Eier von T. vulpis. 81 4 Ergebnisse Von 584 untersuchten Kotproben von Fund- und Abgabekatzen erwiesen sich 6,8 % (n=40) als positiv im IDEXX SNAP® Giardia Test. Im Flotationsverfahren konnten hingegen nur bei 0,9 % (n=5) der untersuchten Proben Giardia-Zysten nachgewiesen werden. Bei 19 der Giardia-Koproantigen-positiven Katzen ließen sich in der Koproskopie Parasitenstadien nachweisen (siehe Tabelle 7). Tabelle 7: Nachweis von Parasiten in der Koproskopie bei Giardia-Koproantigenpositiven Katzen (n=40). Angegeben sind die absoluten Häufigkeiten (n) und die prozentualen Anteile befallener Katzen. Parasitenarten 4.5.3 Anzahl pos. Befunde n % T. cati 6 15 Zysten von Giardia sp. 2 5 Capillaria spp. 1 2,5 Isospora spp. 1 2,5 T. cati + Isospora spp. 3 7,5 T. cati + Zysten von Giardia sp. 2 5 T. cati + Capillaria spp. 1 2,5 T. cati + Taeniiden 1 2,5 T. cati + A. abstrusus 1 2,5 T. cati + Isospora spp. + Zysten von Giardia sp. 1 2,5 Giardia-Koproantigennachweis in Abhängigkeit zum Alter Von 331 Fund- und Abgabehunden, die mit dem IDEXX SNAP® Giardia Test untersucht wurden und bei denen eine Angabe des Alters vorlag, hatten 26,9 % (n=89) ein Alter von bis einschließlich einem Jahr und 73,1 % (n=242) von über einem Jahr. Giardia-Koproantigen konnte mit 16,9 % (n=15) häufiger bei den Hunden bis zu einem Jahr Lebensalter festgestellt werden als bei den über ein Jahr alten Hunden mit 9,9 % (n=24). Ein signifikanter Zusammenhang zwischen Alter und Giardia-Koproantigennachweis konnte jedoch nicht festgestellt werden (p > 0,05). Von 571 Fund- und Abgabekatzen, die mit dem IDEXX SNAP® Giardia Test untersucht wurden und bei denen eine Angabe des Alters vorlag, waren 52,5 % 82 4 Ergebnisse (n=300) bis einschließlich ein Jahr und 47,5 % (n=271) über ein Jahr alt. GiardiaKoproantigen konnte mit 7,3 % (n=22) häufiger bei den Katzen bis einschließlich einem Jahr nachgewiesen werden als bei den über ein Jahr alten Katzen mit 6,6 % (n=18). Ein signifikanter Zusammenhang zwischen Alter und Giardia- Koproantigennachweis konnte jedoch ebenfalls nicht festgestellt werden (p > 0,05). 4.5.4 Giardia-Koproantigennachweis in Abhängigkeit zum Geschlecht Von 340 Fund- und Abgabehunden, die mit dem IDEXX SNAP® Giardia Test untersucht wurden und bei denen eine Angabe des Geschlechts vorlag, waren 60,3 % (n=205) männlichen und 39,7 % (n=135) weiblichen Geschlechts. GiardiaKoproantigen konnte bei 13,2 % (n=27) der Rüden und 8,9 % der Hündinnen (n=12) nachgewiesen werden. Ein signifikanter Zusammenhang zwischen Geschlecht und Giardia-Koproantigennachweis konnte nicht festgestellt werden. Von 555 Fund- und Abgabekatzen, die mit dem IDEXX SNAP® Giardia Test untersucht wurden und bei denen eine Angabe des Geschlechts vorlag, waren 47,4 % (n=263) männlichen und 52,6 % (n=292) weiblichen Geschlechts. GiardiaKoproantigen konnte häufiger bei Katern mit 8,4 % (n=22) als bei weiblichen Katzen mit 5,1 % (n=15) nachgewiesen werden. Ein signifikanter Zusammenhang zwischen Geschlecht und Giardia-Koproantigennachweis wurde jedoch ebenfalls nicht festgestellt. 4.5.5 Giardia-Koproantigennachweis in Abhängigkeit zum Aufnahmegrund Eine Darstellung des Giardia-Koproantigennachweises in Abhängigkeit zum Aufnahmegrund wird unter Berücksichtigung der Alterskategorien (wie unter 4.1.3 beschrieben) vorgenommen. Bei 189 Fundhunden und 142 Abgabehunden, die mit dem IDEXX SNAP® Giardia Test untersucht wurden, lag eine Altersangabe vor. 28,6 % (n=54) der Fundhunde hatten ein Alter von bis einschließlich einem Jahr und 71,4 % (n=135) von über einem Jahr. Von den Abgabehunden waren 24,6 % (n=35) 83 4 Ergebnisse bis einschließlich ein Jahr und 75,4 % (n=107) über ein Jahr alt. GiardiaKoproantigen konnte in beiden Alterskategorien mit jeweils 22,2 % (n=12) bei den bis zu einem Jahr alten Tieren bzw. mit 14,1 % (n=19) bei den über ein Jahr alten Tieren häufiger bei den Fundhunden nachgewiesen werden als bei den Abgabehunden mit 8,6 % (n=3) bzw. 4,7 % (n=5). Für die Hunde mit einem Alter von über einem Jahr war der Unterschied im Giardia-Koproantigennachweis in Abhängigkeit vom Aufnahmegrund signifikant (p < 0,05). Bei 516 Fundkatzen und 55 Abgabekatzen, die mit dem IDEXX SNAP® Giardia Test untersucht wurden, lag eine Altersangabe vor. 55,4 % (n=286) der Fundkatzen waren bis einschließlich ein Jahr und 44,6 % (n=230) über ein Jahr alt. Von den Abgabekatzen hatten 25,5 % (n=14) ein Alter von bis einschließlich einem Jahr und 74,5 % (n=41) ein Alter von über einem Jahr. Giardia-Koproantigen konnte bei den bis einschließlich ein Jahr alten Katzen mit 14,3 % (n=2) häufiger bei den Abgabekatzen nachgewiesen werden als bei den Fundkatzen mit 7,0 % (n=20). Bei den über ein Jahr alten Katzen konnte Giardia-Koproantigen mit 7,8 % (n=18) häufiger bei den Fundkatzen nachgewiesen werden als bei den 41 Abgabekatzen, bei denen Giardia-Koproantigen überhaupt nicht nachgewiesen werden konnte. Ein signifikanter Zusammenhang zwischen dem Giardia-Koproantigennachweis und dem Aufnahmegrund bei Katzen beider Alterskategorien konnte dennoch nicht festgestellt werden. 84 5 Diskussion 5 Diskussion 5.1 Verwendete Methoden Um das Vorkommen von Endoparasiten bei Fund- und Abgabehunden und -katzen aus Niedersachsen zu untersuchen, wurde eine einmalige Kotprobe von Hunden und Katzen bei ihrem Eintritt in ein Tierheim entnommen und mit verschiedenen parasitologischen Untersuchungsmethoden untersucht. Bei der Interpretation der Daten muss jedoch berücksichtigt werden, dass durch eine einmalige Kotuntersuchung ein Parasitenbefall nicht immer sicher erkannt wird (SEILER et al. 1983; EPE et al. 1993). Mehrmalige Untersuchungen von Kot der noch unbehandelten Tiere waren in dieser Studie jedoch nicht möglich, da die Tiere in den Tierheimen routinemäßig schon bei ihrer Aufnahme anthelminthisch behandelt werden. Auch die Ermittlung des exakten Endoparasitenbefalls mittels Sektion in Kombination mit koproskopischer Untersuchung (LILLIS 1967; VANPARIJS u. THIENPONT 1973; FOK et al. 1988) war in dieser Studie, die wesentlich von der Mitarbeit von Tierschützern abhing, nicht möglich. Aus diesen Gründen musste eine eingeschränkte Aussage zum Endoparasitenbefall in Kauf genommen werden. Weiterhin muss berücksichtigt werden, welche Parasiten sich mit den in vorliegender Studie angewandten Methoden nachweisen lassen und wie sensitiv diese in Bezug auf die nachgewiesenen Parasiten sind. Das in vorliegender Studie stets zur Anwendung gekommene kombinierte Sedimentations-Flotationsverfahren weist sämtliche Nematoden- und Zestodeneier sowie Protozoenzysten sicher, Nematodenlarven, Trematodeneier oder Protozoentrophozoiten jedoch nur unsicher nach (SCHNIEDER u. EPE 2004b). Der Schwerpunkt dieses Verfahrens liegt darin, dass ein positives Tier mit größtmöglicher Sicherheit auch als solches erkannt werden soll. KRAEMER (2005) konnte in einer Validierungsstudie zeigen, dass ab einer EpG von 80 (verwendete Parasiten u.a. T. canis, T. leonina, T. cati, T. vulpis, A. caninum, U. stenocephala) eine 100 %ige Sensitivität des kombinierten Sedimentations-Flotationsverfahrens erwartet werden konnte (also keine falsch negativen Proben). Unter einer EpG von 80 schwankte 85 5 Diskussion jedoch die Menge der falsch negativ getesteten Proben in Abhängigkeit von dem untersuchten Parasiten. Das Auswanderverfahren nach Baermann wurde in vorliegender Studie nur bei den Kotproben durchgeführt, bei denen bereits im kombinierten SedimentationsFlotationsverfahren Nematodenlarven nachgewiesen wurden. In diesen Fällen diente die Nachuntersuchung in erster Linie der Identifizierung der Larven. Daher können aus den Ergebnissen der vorliegenden Studie keine Aussagen zum Vorkommen von Nematodenlarven bei Fund- und Abgabehunden und -katzen aus Niedersachsen (z.B. A. abstrusus, Crenosoma spp., Angiostrongylus vasorum) gemacht werden. Es ist aber zu beachten, dass Lungenwürmer bei Hunden in letzter Zeit gehäuft in Deutschland nachgewiesen wurden. TAUBERT et al. (2009) untersuchten in den Jahren 2003 bis 2007 958 Hunde aus Deutschland mit klinischen Symptomen mit dem Auswanderverfahren nach Baermann und wiesen Lungennematoden in 3,6 % der untersuchten Proben nach. Dabei konnte Crenosoma vulpis mit 2,4 % häufiger als A. vasorum mit 1,2 % nachgewiesen werden. BARUTZKI u. SCHAPER (2008) wiesen Lungenwürmer mit dem Auswanderverfahren in 347 Hunden mit klinischer Symptomatik sogar in 17 % der untersuchten Proben nach. In der genannten Studie waren 9,8 % der Hunde mit A. vasorum, 8,1 % mit Crenosoma vulpis und 0,9 % mit beiden Parasitenspezies infiziert. Es muss jedoch bedacht werden, dass es sich in beiden Studien um vorselektiertes Probenmaterial handelte. Kotproben, die sich in vorliegender Studie in dem kombinierten SedimentationsFlotationsverfahren als Helminthen- bzw. Kokzidien-positiv erwiesen, wurden weiterführend mit dem modifizierten McMaster-Verfahren untersucht, sofern genügend Kotmaterial vorhanden war. Verschiedene Untersuchungen ergaben prinzipiell eine gute Übereinstimmung zwischen tatsächlicher EpG und der durch McMaster-Zählung ermittelten Zahl, d.h. eine gute methodische Sensitivität (BAUER 2006b). Jedoch ist zu beachten, dass die McMaster-Methode in ihrer Eigenschaft als Verdünnungsmethode primär zur Erfassung hoher Eizahlen in Kotproben in der epidemiologischen und experimentellen Parasitologie eingesetzt wird. In der Validierungsstudie von KRAEMER (2005) erwies sich die Verwendung der McMaster-Methode hinsichtlich der Sensitivität nur als sinnvoll, wenn höhere Eizahlen als 500 EpG in einer Probe zu erwarten waren (verwendete Parasiten u.a. 86 5 Diskussion T. canis, T. leonina, T. cati, T. vulpis, A. caninum, U. stenocephala). Für Eizahlen unter 500 EpG lieferte sie in genannter Studie keine zuverlässig positiven Ergebnisse. KRAEMER (2005) kam daher zu dem Schluss, dass niedrige mit der McMaster-Methode oder der modifizierten McMaster-Methode ermittelte Eizahlen (unter 500 EpG) wahrscheinlich als falsch niedrig interpretiert werden müssen. Zur Wirksamkeitsbewertung handelsüblicher Anthelminthika auf bestimmte Helminthen kam der EZRT zur Anwendung. Die Sensitivität des Tests liegt zwischen 50 % und 75 %. Weisen weniger als 25 % der Individuen einer Wurmpopulation Resistenzen auf, kann dies durch den EZRT nicht ermittelt werden (MARTIN et al. 1989). TAYLOR et al. (2002) heben hervor, dass der EZRT die Effizienz eines Anthelminthikums nicht genau wiedergeben kann, da er nur den Effekt auf die Eiausscheidung der adulten/reifen Parasiten misst, diese aber nicht immer mit der aktuellen Wurmzahl korreliert. Unreife Larvenstadien, die noch keine Eier ausscheiden, werden duch den EZRT nicht erfasst. Dennoch ist der EZRT die einzige Möglichkeit für ein Anthelminthikaresistenz-Screening im Feld. Darüberhinaus wurden die Kotproben, soweit der Test verfügbar und genügend Kotmaterial vorhanden war, mit dem IDEXX SNAP® Giardia Test untersucht. Dieser Test besitzt laut Herstellerinformation im Vergleich zum Immunfluoreszenznachweis eine Sensitivität von 95 % und eine Spezifität von 99 %. Verglichen mit dem Microplate ELISA werden eine Sensitivität von 96 % und eine Spezifität von 100 % angegeben. In der Studie von GEURDEN et al. (2008) wurden in einer bayesischen Evaluation drei verschiedene Nachweisverfahren für G. duodenalis sowohl in einer epidemiologischen als auch in einer klinischen Studie verglichen. In der epidemiologischen Studie besaß der IDEXX SNAP® Giardia Test in genannter Studie eine Sensitivität von 52 % (20 % bis 83 %) und eine Spezifität von 95 % (91 % bis 98 %), wohingegen der Immunfluoreszenztest eine Sensitivität von 90 % (80 % bis 99 %) und eine Spezifität von 94 % (90 % bis 99 %) besaß. Weitere Methoden, die für den Nachweis bestimmter anderer Parasiten notwendig wären (z.B. Klebebandmethode zum Nachweis von Bandwürmern, Sedimentationsverfahren zum Nachweis von Trematoden, Kultivierung bzw. PCR zum Nachweis von Trichomonaden im Katzenkot), wurden in der vorliegenden Studie nicht durchgeführt. 87 5 Diskussion Es ist zu beachten, dass Tritrichomonas foetus, ein als Erreger einer protozoären Deckseuche bei Rindern bekannter Parasit, als Verursacher v.a. von DickdarmDurchfällen bei Katzen in letzter Zeit in vielen Ländern gehäuft nachgewiesen wurde. So wiesen GUNN-MOORE et al. (2007) diesen Parasiten in Großbritannien bei 14,4 % von 111 untersuchten Katzen mit klinischer Durchfallsymptomatik nach, und in der Schweiz befundeten FREY et al. (2009) von 45 untersuchten Katzen mit Durchfall 11 Tiere als positiv für T. foetus. In einer von STOCKDALE et al. (2009) durchgeführten Studie aus den USA erwiesen sich 9,8 % der untersuchten 173 Katzen mit oder ohne klinische Anzeichen einer Trichomoniasis als positiv für diesen Parasiten. Da T. foetus mit den in vorliegender Studie verwendeten Methoden nicht nachweisbar ist, kann jedoch keine Aussage zur aktuellen Prävalenz dieses Parasiten bei Fund- und Abgabehunden und -katzen aus Niedersachsen gemacht werden. 5.2 Vorkommen von Endoparasiten Hunde Um den in vorliegender Studie nachgewiesenen Endoparasitenbefall mit denen anderer Studien zu vergleichen, muss die Struktur der untersuchten Hundepopulation berücksichtigt werden. Bei den untersuchten Hunden handelte es sich zu 59,3 % um Fundhunde und zu 40,7 % um Abgabehunde. Da es in Deutschland derzeit praktisch keine echten streunenden Hunde gibt, ist anzunehmen, dass es sich bei fast allen Hunden um Tiere handelt, die aus menschlicher Obhut stammen. Zu berücksichtigen ist weiterhin die in vorliegender Untersuchung herrschende Altersstruktur der Hunde: gut ein Viertel der untersuchten Hunde (26 %) hatten ein Alter von bis zu einem Jahr, knapp drei Viertel der Hunde (74 %) waren älter als ein Jahr. Der bei der vorliegenden Untersuchung in den Jahren 2006 und 2007 koproskopisch ermittelte Endoparasitenbefall bei Fund- und Abgabehunden aus Niedersachsen liegt bei 9,4 %. EMDE (1988), der in den Jahren 1983 bis 1986 1246 Kotproben von Hunden aus einer Tierarztpraxis in Wuppertal mit einem Flotationsverfahren 88 5 Diskussion untersuchte, fand bei ähnlicher Altersstruktur der untersuchten Hundepopulation mit 13,6 % eine ähnliche Befallsrate mit Endoparasiten. Auch STAUB (2004), die in in den Jahren 2000 bis 2002 154 Kotproben von Hunden aus einer Tierarztpraxis im Kreis Mayen-Koblenz untersuchte, fand mit 7,14 % einen ähnlich hohen Befall mit Endoparasiten. HÖRCHNER et al. (1981) untersuchten 605 Kotproben von Hunden unbekannten Alters und Herkunft von den Straßen und Auslaufgebieten Berlins und fanden eine Prävalenz von 7,1 %. In der vorliegenden Studie wurde für die untersuchten Hunde ein Endoparasitenspektrum mit acht verschiedenen Endoparasitenarten bzw. -gattungen nachgewiesen. Dies entspricht dem Endoparasitenspektrum aus anderen epidemiologischen Studien aus Deutschland, in denen mittels Koproskopie sieben bis zehn Endoparasitenarten, -gattungen oder -familien nachgewiesen wurden (HÖRCHNER et al. 1981; EMDE 1988, EPE et al. 2004; STAUB 2004). Das Endoparasitenspektrum, dass in der Studie von EPE et al. (2004) aus dem Institut für Parasitologie der Tierärztlichen Hochschule Hannover in den Jahren 1998 bis 2002 bei 1281 untersuchten Hunden nachgewiesen wurde, ist mit neun Endoparasitenarten, -gattungen oder -familien sehr ähnlich zu dem in vorliegender Studie nachgewiesenen. In der genannten Studie kamen neben dem kombinierten Sedimentations-Flotationsverfahren standardmäßig das Auswanderverfahren nach Baermann und in speziellen Fällen zusätzlich eine modifizierte MIFC-Färbetechnik sowie Proglottidennachweise zur Anwendung. Dabei wurden neben den auch in vorliegender Studie nachgewiesenen Endoparasiten bei Hunden (siehe Kap. 4.1.1) außerdem in 0,6 % der Proben Larven von Crenosoma sp. nachgewiesen (EPE et al. 2004). BARUTZKI u. SCHAPER (2003), die Ergebnisse parasitologischer Kotuntersuchungen eines Tierärztlichen Labors in Süddeutschland aus den Jahren 1999 - 2002 veröffentlichten, wiesen bei 8438 untersuchten Proben von Hunden aus Deutschland 18 Endoparasitenarten, -gattungen oder -familien nach. Zu berücksichtigen dabei ist, dass in genannter Studie eine wesentlich größere Anzahl von Hunden als in vorliegender Studie untersucht wurde, es sich um vorselektiertes Probenmaterial handelte und darüber hinaus auch mehr Untersuchungsmethoden als in vorliegender Studie zur Anwendung kamen. Die Hundekotproben aus der Studie von BARUTZKI u. SCHAPER (2003) wurden mittels Flotations- (spez. 89 5 Diskussion Gewicht 1,3), MIFC-, Auswander- und Sedimentationsverfahren (soweit es die Kotmenge erlaubte), einem Giardia-Koproantigen-ELISA und bei dünnflüssigem Kot auch mit Nativkotausstrich untersucht. Außer den in vorliegender Studie auch nachgewiesenen Parasiten (siehe Kap. 4.1.1) konnten in der Studie von BARUTZKI u. SCHAPER (2003) noch Crenosoma sp., A. vasorum, Eier von Taeniidae, D. caninum,, Diplopylidium/Joyeuxiella spp., Mesocestoides spp., Diphyllobothrium latum und Sarcocystis spp. nachgewiesen werden. Außerdem wurden in der genannten Studie Oozysten von Isospora spp. weiter differenziert in I. ohioensis und I. canis. Der in Niedersachsen für Fund- und Abgabehunde ermittelte Anteil an endoparasitären Polyinfektionen liegt bei 0,7 %. Das entspricht in etwa den Untersuchungsergebnissen, die EMDE (1988) bzw. STAUB (2004) mit 2,2 % bzw. 1,3 % feststellen konnten. T. canis wurde in dieser Studie als häufigster koproskopisch nachweisbarer Endoparasit bei 4,0 % der untersuchten Hunde gefunden. Damit liegt der Befall mit diesem Parasiten im Rahmen der Prävalenzen von 1,95 % bis 11,0 %, die andere Untersucher für Hunde aus Deutschland koproskopisch ermittelt haben (HÖRCHNER et al. 1981; HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004; STAUB 2004). EMDE (1988), der in den Jahren 1983 bis 1986 1246 Kotproben von Hunden aus einer Tierarztpraxis in Wuppertal mit einem Flotationsverfahren untersuchte, fand bei ähnlicher Altersstruktur der untersuchten Hundepopulation mit 6,3 % eine ähnliche Befallsrate mit T. canis. Die Prävalenzen für Isospora spp. lagen mit 2,5 % im Bereich früherer Studien aus Deutschland, die eine Prävalenz von 2,3 % bis 5,2 % angeben (EMDE 1988; EPE et al. 1993; EPE et al. 2004; STAUB 2004). Zysten von Giardia sp. wurden koproskopisch in 0,9 % der Hundekotproben nachgewiesen. Damit wurden sie in vorliegender Studie ähnlich selten nachgewiesen wie bei EMDE (1988) mit 0,2 %. Dabei liegt der wahre Befall mit Giardien vermutlich über dem hier ermittelten Wert, da Giardien intermittierend ausgeschieden werden und so bei einmaliger Untersuchung mit dem kombinierten SedimentationsFlotationsverfahren 90 nicht immer nachgewiesen werden können. Bei der 5 Diskussion vergleichenden Untersuchung eines Teiles der in vorliegender Studie untersuchten Hunde mit dem kombinierten Sedimentations-Flotationsverfahren und dem IDEXX SNAP® Giardia Test wurde Giardia-Koproantigen in 11,4 % der Hundekotproben wesentlich häufiger als Giardia-Zysten in der Koproskopie (1,2 %) nachgewiesen. T. vulpis wurde in 0,9 % der Hundekotproben gefunden und hatte damit eine ähnliche Prävalenz wie in anderen Studien aus Deutschland mit Prävalenzen von 0,2 % – 2,5 % (EMDE 1988; EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004; STAUB 2004). Hakenwürmer wurden in 0,9 % der Kotproben nachgewiesen. Damit kamen sie noch seltener vor als in anderen Studien aus Deutschland mit Prävalenzen von 1,1 % bis 3,2 % (HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). Die gefundene Nachweishäufigkeit von Capillaria spp. liegt mit 0,4 % im Rahmen der Befallsraten von 0 % bis 0,7 %, die andere Untersucher für Hunde in Deutschland festgestellt haben (HINZ u. BLATZ 1985; EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). Auch in anderen europäischen Ländern konnte bei koproskopischen Untersuchungen ein ähnlicher Befall für Capillaria spp. von 0 % bis 1 % festgestellt werden (SUPPERER u. HINAIDY 1986; VANPARIJS et al. 1991; DEPLAZES et al. 1995; O´SULLIVAN 1997; OVERGAAUW 1997c; LeNOBEL et al. 2004; PULLOLA et al. 2006; SAGER et al. 2006; MIRÓ et al. 2007; DUBNÁ et al. 2007). T. leonina wurde in 0,2 % der Hundekotproben gefunden und kam damit ähnlich selten wie in anderen Untersuchungen aus Deutschland mit Prävalenzen von 0 % bis 1,1 % vor (EMDE 1988, EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004). Hammondiaähnliche Oozysten wurden bei 0,2 % der untersuchten Hundekotproben angetroffen. Damit wurden sie etwa so selten gefunden, wie in anderen Untersuchungen in Deutschland, in welchen Prävalenzen von 0 % bis 0,5 % nachgewiesen wurden (EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004; STAUB 2004; SCHARES et al. 2005). Inwiefern es sich es bei den nachgewiesenen Oozysten um Oozysten von Neospora oder Hammondia handelt, 91 5 Diskussion kann nicht beurteilt werden, da die Differenzierung dieser Gattungen mit den verwendeten Methoden nicht möglich ist. In vorliegender Studie wurden bei Hunden Eier von Taeniiden in der koproskopischen Untersuchung nicht nachgewiesen. Zu beachten ist dabei, dass Bandwürmer der Gattung Taenia spp. häufiger durch die sogenannte Klebestreifenmethode als durch koproskopische Verfahren nachgewiesen werden (DEPLAZES et al. 1995), welche jedoch in vorliegender Studie nicht zur Anwendung kam. In anderen Studien von HÖRCHNER et al. (1981), EMDE (1988), EPE et al. (1993), BARUTZKI u. SCHAPER (2003), EPE et al. (2004) und DYACHENKO et al. (2008) wurden mit 0,2 % bis 0,8 % ebenfalls nur sehr niedrige Prävalenzen beschrieben. Jedoch ist zu beachten, dass 81 % der Taeniiden-positiven Proben von Hunden in der Studie von DYACHENKO et al. (2008) E. multilocularis-positiv waren. Dabei wurden E. multilocularis-positive Proben von Hunden auch in Niedersachsen nachgewiesen. Jedoch war die Prävalenz von E. multilocularis in Proben aus Süddeutschland signifikant höher als in Proben aus Norddeutschland. Aufgrund des Infektionsrisikos für den Menschen sollte aber jeder Hund bei Aufnahme ins Tierheim parasitologisch untersucht und gegebenenfalls mit einem geeigneten Zestodizid in ausreichender Dosierung behandelt werden. Bei Hunden, die Jagdverhalten zeigen, empfehlen DYACHENKO et al. (2008) eine monatliche Behandlung mit einem geeigneten Zestodizid, um das Zoonoserisiko zu minimieren. 92 5 Diskussion Katzen Um den in vorliegender Studie nachgewiesenen Endoparasitenbefall mit denen anderer Studien zu vergleichen, muss wiederum die Struktur der untersuchten Katzenpopulation berücksichtigt werden. Bei einem Großteil der hier untersuchten Katzen (90,6 %) handelte es sich um sogenannte Fundkatzen, nur 9,4 % waren sogenannte Abgabekatzen, d.h. Tiere, die von ihrem Besitzer im Tierheim zur vorübergehenden Pflege oder zur weiteren Vermittlung abgegeben worden sind. Da in Deutschland echte streunende Katzen durchaus vorkommen, ist anzunehmen, dass ein Teil der Fundkatzen erst nach einer längeren Zeit des Umherstreunens im Tierheim aufgenommen worden ist, und es sich z.T. um Tiere handelt, die sich nie zuvor in menschlicher Obhut befunden haben. Letztendlich lässt sich aber nichts Genaues über die Herkunft der Tiere sagen. Weiterhin zu berücksichtigen ist die in vorliegender Untersuchung herrschende Altersstruktur der Katzen: gut die Hälfte der untersuchten Katzen (54,5 %) hatten ein Alter von bis einschließlich einem Jahr, knapp die Hälfte der Katzen (45,5 %) waren älter als ein Jahr. Der in vorliegender Studie koproskopisch nachgewiesene Endoparasitenbefall von Fund- und Abgabekatzen aus Niedersachsen liegt bei 33,6 %. UNBEHAUEN (1991), die von 1989 bis 1990 704 Kotproben von Katzen aus dem Raum Lübeck mit einer Flotationsmethode untersuchte (spez. Gewicht 1,30), stellte einen ähnlich hohen Befall mit Endoparasiten von 38,8 % fest. Die von ihr untersuchte Katzenpopulation setzte sich zusammen aus privat gehaltenen Katzen ohne Freigang (n=276) und mit Freigang (n=177), aus verwilderten Katzen (n=120) und aus Tierheimkatzen, die sich seit mindestens zwei Wochen im Tierheim Lübeck aufhielten (n=120). 34,7 % der von ihr untersuchten Katzen hatten ein Alter von unter einem Jahr, 65,3 % von über einem Jahr. In der Studie von HECKING-VELTMAN (1999) wurden im Jahr 1998 300 Kotproben von ausschließlich streunenden Katzen aus dem Raum Mönchengladbach mit einer Flotationsmethode untersucht. Die von ihr untersuchten Tiere hatten zu 13,5 % ein Alter von unter sechs Monaten, 37,8 % waren zwischen einem halben Jahr und zwei Jahren und 49,2 % waren über zwei Jahre alt. In der genannten Studie wurde mit 51,2 % ein höherer Befall mit Endoparasiten als in vorliegender Studie festgestellt. Bedenkt man, dass in vorliegender Studie nicht nur streunende Katzen, sondern auch Katzen aus menschlicher Obhut untersucht 93 5 Diskussion wurden, so ist die von HECKING-VELTMAN (1999) nachgewiesene höhere Prävalenz von Endoparasiten bei ausschließlich streunenden Katzen nicht verwunderlich. In vielen Studien konnte für streunende Katzen ein erhöhtes Risiko für einen Endoparasitenbefall aufgezeigt werden (UNBEHAUEN 1991; OVERGAAUW 1997c; ROBBEN et al. 2004). Mögliche Gründe dafür sind, dass streunende Katzen mehr Gelegenheit zum Erjagen von möglichen paratenischen Wirten oder Zwischenwirten haben oder eher in Kontakt zu infizierten Artgenossen kommen und außerdem nicht regelmäßig anthelminthisch behandelt werden. MUNDHENKE (1998) untersuchte in den Jahren 1996 und 1997 Kotproben von 932 Katzen aus Hannover und Umland mit einer Flotationsmethode. Die von ihr untersuchte Katzenpopulation setzte sich hauptsächlich zusammen aus privat gehaltenen Katzen ohne Freigang (n=544) und mit Freigang (n=332) und zu einem geringen Teil auch aus Tierheimkatzen, die sich wegen Neuaufnahme oder Krankheit in der Quarantänestation befanden (n=51). Fast drei Viertel der von ihr untersuchten Katzen (72,7 %) war über ein Jahr, etwas über ein Viertel (27,3 %) war unter einem Jahr alt. Die von MUNDHENKE (1998) nachgewiesene Prävalenz von Endoparasiten bei diesen Tieren lag bei 11,4 % und ist damit deutlich niedriger als die in vorliegender Studie nachgewiesene. Die Begründung dafür liegt nicht nur in dem hohen Anteil reiner Wohnungskatzen (58,7 %) in der Studie von MUNDHENKE (1998), sondern auch in der Altersstruktur der von ihr untersuchten Population. In ihrer Studie waren nur gut ein Viertel der von ihr untersuchten Katzen (27,3 %) unter einem Jahr alt, in vorliegender Untersuchung waren es jedoch über die Hälfte der untersuchten Katzen (54,5 %). In vielen Studien konnte nämlich gezeigt werden, dass jüngere Katzen häufiger mit Endoparasiten (hier v.a. zu nennen T.cati und Isospora spp.) infiziert sind als ältere (MERZ-SCHENKER et al. 1976; VISCO et al. 1978; EMDE 1991; MUNDHENKE 1998; BARUTZKI u. SCHAPER 2003; ROBBEN et al. 2004). Diese Beobachtung wurde auch in der vorliegenden Studie gemacht. EMDE (1991), der in den Jahren 1983 bis 1986 821 Kotproben von Katzen aus einer Tierarztpraxis in Wuppertal mit einem Flotationsverfahren untersuchte, fand bei ähnlicher Altersstruktur der untersuchten Katzenpopulation mit 17,3 % ebenfalls eine deutlich niedrigere Befallsrate mit Endoparasiten. Bei 77,5 % dieser Katzen handelte es sich um Tiere, die routinemäßig koproskopisch untersucht wurden, ein Großteil 94 5 Diskussion davon vor der Impfung. 22,5 % der Tiere wurden untersucht, weil sie klinisch auffällig waren. Angaben darüber, ob es sich um Freigänger- oder um Wohnungskatzen handelte, wurden nicht gemacht. Zu berücksichtigen ist, dass es sich bei den von EMDE (1991) untersuchten Katzen wahrscheinlich um Tiere handelte, die von ihrem Besitzer regelmäßig beim Tierarzt vorgestellt wurden und dass bei ihnen daher auch eher davon auszugehen ist, dass sie regelmäßig anthelminthisch behandelt wurden. So verwundert die von EMDE (1991) nachgewiesene niedrigere Prävalenz nicht, handelt es sich bei einem Großteil der in vorliegender Studie untersuchten Fundkatzen vermutlich um Tiere, die nicht regelmäßig anthelminthisch behandelt wurden. Außerdem kamen die Katzen aus der Studie von EMDE (1991) aus dem Einzugsgebiet einer Großstadt (Wuppertal). Es könnte sich also bei einem nicht unerheblichen Teil der untersuchten Tiere um reine Wohnungskatzen handeln, die im Gegensatz zu den Fundtieren aus der vorliegenden Studie keine Gelegenheit zum Erjagen von paratenischen Wirten oder Zwischenwirten hatten. In der vorliegenden Studie wurde für die untersuchten Katzen ein Endoparasitenspektrum mit acht verschiedenen Endoparasitenarten, -gattungen oder -familien nachgewiesen. MUNDHENKE (1998) wies bei 932 untersuchten Katzen aus Hannover und Umland ebenfalls acht Endoparasitenarten, -gattungen oder familien nach. Jedoch unterschied sich das von MUNDHENKE (1998) gefundene Spektrum insofern von dem in vorliegender Studie nachgewiesenen, als dass bei MUNDHENKE (1998) keine Zysten von Giardia sp. und auch keine Eier von Hakenwürmern nachgewiesen wurden. In der genannten Studie wurden dagegen Oozysten von Isospora spp. weiter differenziert in I. felis und I. rivolta und es wurden Parasiten der Gattung Sarcocystis spp. nachgewiesen, die in vorliegender Studie nicht gefunden wurden. Das Endoparasitenspektrum, das in der Studie von EPE et al. (2004) aus dem Institut für Parasitologie der Tierärztlichen Hochschule Hannover in den Jahren 1998 bis 2002 bei 441 untersuchten Katzen nachgewiesen wurde, ist mit elf Endoparasitenarten, -gattungen oder -familien jedoch als noch breiter einzustufen. Ein Grund dafür kann sein, dass in dieser Studie neben dem kombinierten Sedimentations-Flotationsverfahren standardmäßig das Auswanderverfahren nach Baermann und in speziellen Fällen zusätzlich eine modifizierte MIFC-Färbetechnik sowie Proglottidennachweise durchgeführt wurden. 95 5 Diskussion Weiterhin muss berücksichtigt werden, dass es sich in dieser Studie um vorselektiertes Probenmaterial handelte. In der Studie von EPE et al. (2004) wurden neben den auch in vorliegender Studie nachgewiesenen Endoparasiten (siehe Kap. 4.1.1) außerdem Eier von T. leonina und Bandwürmer der Gattungen Dipylidium sp. und Mesocestoides spp. nachgewiesen. Der für Fund- und Abgabekatzen aus Niedersachsen ermittelte Anteil an endoparasitären Polyinfektionen entspricht mit 9,1 % der untersuchten Katzen in etwa den Ergebnissen anderer Untersucher, die bei 4,6 % bis 12,9 % der untersuchten Katzen mehr als eine Endoparasitenart nachwiesen (UNBEHAUEN 1991; HECKING-VELTMAN 1999; DIEFFENBACHER 2006). Wie auch bei vielen anderen Studien (MERZ-SCHENKER et al. 1976; EMDE 1991; UNBEHAUEN 1991; MUNDHENKE 1998; HECKING-VELTMAN 1999) war auch bei den Fund- und Abgabekatzen aus Niedersachsen T. cati der am häufigsten an Polyinfektionen beteiligte Parasit, was wegen des häufigen Vorkommens und der weiten Verbreitung dieses Parasiten zu erwarten war. T. cati wurde in dieser Studie als häufigster koproskopisch nachweisbarer Endoparasit bei 27,1 % der untersuchten Katzen gefunden. Damit liegt der Befall mit diesem Parasiten unter den durch koproskopische Untersuchungen ermittelten Prävalenzen, die RASCHKA et al. (1994) mit 55 %, HECKING-VELTMAN (1999) mit 43,3 % und DIEFFENBACHER (2006) mit 44,6 % für streunende Katzen aus Deutschland angeben. Andererseits liegt der ermittelte Befall deutlich über den Ergebnissen von anderen Studien aus Deutschland und benachbarten Ländern, in denen Katzen untersucht wurden, die in der Obhut von Menschen leben (EMDE 1991; OVERGAAUW 1997c; MUNDHENKE 1998). In der Studie von EMDE (1991), in der 821 Katzen einer Tierarztpraxis in Wuppertal koproskopisch untersucht wurden, die eine ähnliche Altersstruktur wie die Katzen aus vorliegender Studie aufwiesen, wurde ein Befall mit T. cati von 14,4 % festgestellt. Zu berücksichtigen dabei ist, dass es sich bei den von EMDE (1991) untersuchten Katzen wahrscheinlich um Tiere handelte, die von ihrem Besitzer regelmäßig beim Tierarzt vorgestellt und zum Teil auch regelmäßig anthelminthisch behandelt wurden. Außerdem stammten die Katzen aus der Studie von EMDE (1991) aus dem Einzugsgebiet von Wuppertal. Es könnte sich also bei einem nicht unerheblichen Teil 96 5 Diskussion der dort untersuchten Tiere um reine Wohnungskatzen handeln, die keine Gelegenheit zum Erjagen von paratenischen Wirten oder Zwischenwirten haben wie die aufgefundenen Tiere aus der vorliegenden Studie. So ist die von EMDE (1991) nachgewiesene niedrigere T. cati-Prävalenz nicht verwunderlich. MUNDHENKE (1998), die 932 Katzen aus dem Großraum Hannover untersuchte, stellte ebenfalls einen deutlich niedrigeren Befall mit T. cati von 6,4 % fest. Dabei muss bedacht werden, dass die untersuchte Katzenpopulation von MUNDHENKE (1998) zu 58,7 % aus reinen Wohnungskatzen bestand und die Altersstruktur sich erheblich von der aus vorliegender Untersuchung unterschied. Die in vorliegender Studie nachgewiesene hohe Prävalenz dieses Spulwurms macht deutlich, wie wichtig adäquate anthelminthische Behandlungen bei Katzen sind, die in ein Tierheim aufgenommen werden. Die Prävalenzen für Isospora spp. lagen mit 7,5 % im Bereich früherer Studien aus Deutschland, die eine Prävalenz von 2,8 % bis 10,7 % angeben (EMDE 1991; MUNDHENKE 1998; HECKING-VELTMAN 1999; EPE et al. 1993; BARUTZKI u. SCHAPER 2003; EPE et al. 2004). Die gefundene Nachweishäufigkeit von Capillaria spp. liegt mit 5,0 % über den Befallsraten, die andere Untersucher für Katzen aus menschlicher Obhut feststellten, so wiesen EMDE (1991) und OVERGAAUW (1997c) diese Parasiten in ihren Studien nicht nach, MUNDHENKE (1998) fand eine Befallshäufigkeit von 0,8 %, BARUTZKI u. SCHAPER (2003) von 1,7 % und EPE et al. (2004) von 0,2 %. Die in vorliegender Studie nachgewiesene Prävalenz entspricht eher den Befallsraten von 3,6 % bis 4,1 %, die andere Untersucher koproskopisch für streunende Katzen in Deutschland ermittelten (HANSEL u. RUSCHER 1980; UNBEHAUEN 1991; RASCHKA et al. 1994). Zu berücksichtigen ist jedoch, dass in einigen Studien nur der koproskopische Nachweis von Capillaria-Eiern gelang, nicht jedoch das Auffinden der dazugehörigen Würmer. So wies KAUFMANN (1990) bei 3,2 % der 248 streunenden Katzen Capillaria spp. koproskopisch nach, ohne bei der Sektion die Capillaria-Würmer zu finden. So muss die Möglichkeit in Betracht gezogen werden, dass es sich bei einem Teil der nachgewiesenen Eier von Capillaria spp. um Darmpassanten gehandelt hat. In vorliegender Studie wurden bei Katzen Eier von Taeniiden in 2 % der koproskopischen Untersuchungen nachgewiesen. Ein ähnlicher Befall von 1 % bis 97 5 Diskussion 4,3 % lag in den Studien von HANSEL u. RUSCHER (1980), EMDE (1991), UNBEHAUEN (1991), EPE et al. (1993), MUNDHENKE (1998) und EPE et al. (2004) vor. In der Studie von DYACHENKO et al. (2008), in der 10650 Kotproben von Katzen aus Deutschland und anderen europäischen Ländern mit einer Flotationsmethode untersucht wurden, gelang der Nachweis von Taeniideneiern in 0,34 % (n=37) der Proben. Mit weiterführenden molekularbiologischen Methoden identifizierten DYACHENKO et al. (2008) 68 % dieser Taeniiden-positiven Proben von Katzen als E. multilocularis-positiv. Dabei wurde E. multilocularis-DNA auch bei Proben von Katzen aus Niedersachsen amplifiziert. In den Echinococcus-negativen, aber zestodenpositiven Proben von Katzen wurde in genannter Studie ausschließlich T. taeniaeformis identifiziert. Da in vorliegender Studie keine molekularbiologischen Methoden, keine Sektionen und auch keine Proglottidennachweise durchgeführt wurden, lässt sich über die Spezieszugehörigkeit der hier nachgewiesenen Taeniiden-Eier keine Aussage machen. Katzen, die Taeniiden-Eier ausscheiden, sollten jedoch aufgrund der Ergebnisse von DYACHENKO et al. (2008) potenziell als E. multilocularis-positiv angesehen werden. Hakenwürmer wurden in 1,1 % der Kotproben nachgewiesen. Der Befall mit diesem Parasiten wird für Deutschland und benachbarte Länder sehr unterschiedlich angegeben. In einigen Studien wurden Hakenwurmeier koproskopisch nicht nachgewiesen (HIEPE et al. 1988; RASCHKA et al. 1994; OVERGAAUW 1997c; MUNDHENKE 1998), in anderen Studien in Prävalenzen von 0,06 % bis 3 % (EMDE 1991; SUPPERER u. HINAIDY 1986; HECKING-VELTMAN 1999; BARUTZKI u. SCHAPER 2003; EPE et al. 2004; DIEFFENBACHER 2006). Untersuchungen aus Brandenburg mit einem Befall von 17 % (SCHUSTER et al. 1997) und Mecklenburg mit 11,7 % (HANSEL u. RUSCHER 1980) deuten auf mögliche endemische Häufungen hin. Vor allem könnten besondere geographische Begebenheiten, wie z.B. das Vorkommen von Feuchtgebieten, eine Rolle spielen. Larven von A. abstrusus wurden in 1,0 % der Katzenkotproben gefunden. Allerdings ist zu beachten, dass in vorliegender Studie das Auswanderverfahren nach Baermann nicht standardmäßig bei jeder untersuchten Kotprobe eingesetzt wurde. Es kam nur zur Anwendung, wenn Nematodenlarven im kombinierten Sedimentations-Flotationsverfahren entdeckt wurden. Daher ist davon auszugehen, 98 5 Diskussion dass der tatsächliche Befall mit A. abstrusus vermutlich über der hier ermittelten Prävalenz liegt. In anderen Untersuchungen aus Deutschland, in denen das Auswanderverfahren nach Baermann standardmäßig eingesetzt wurde, kamen Larven von A. abstrusus mit Prävalenzen von 0,7 % bis 5,6 % vor (EPE et al. 1993; BARUTZKI u. SCHAPER 2003, EPE et al. 2004; TAUBERT et al. 2009). ROBBEN et al. (2004), die 305 Katzen aus niederländischen Tierheimen u.a. mit dem Auswanderverfahren nach Baermann untersuchten, stellten bei 2,6 % der Katzen einen Befall mit A. abstrusus fest. TAUBERT et al. (2009), die 231 Katzen aus Deutschland mit klinischen Symptomen mit dem Auswanderverfahren nach Baermann untersuchten, fanden diesen Parasiten sogar in 5,6 % der untersuchten Proben. Zu beachten ist hier jedoch wiederum die Vorselektion der Proben. Zysten von Giardia sp. wurden koproskopisch in 0,7 % der Katzenkotproben nachgewiesen. Das entspricht den Ergebnissen anderer koproskopischer Studien aus Deutschland, in denen Prävalenzen von 0 % bis 2,4 % nachgewiesen werden konnten (HANSEL u. RUSCHER 1980; HIEPE et al. 1988; EMDE 1991; UNBEHAUEN 1991; EPE et al. 1993; MUNDHENKE 1998; RASCHKA et al. 1994; HECKING-VELTMAN 1999; EPE et al. 2004; DIEFFENBACHER 2006). Dabei liegt der wahre Befall mit Giardien vermutlich über dem hier ermittelten Wert, da Giardien intermittierend ausgeschieden werden und so bei einmaliger Untersuchung mit dem kombinierten Sedimentations-Flotationsverfahren nicht immer nachgewiesen werden können. Bei der vergleichenden Untersuchung mit dem kombinierten Sedimentations-Flotationsverfahren und dem IDEXX SNAP® Giardia Test wurden Giardia-Zysten in 0,9 % und Giardia-Koproantigen in 6,8 % der Katzenkotproben nachgewiesen. Oozysten vom Toxoplasma-/Hammondia-Typ wurden bei 0,1 % der untersuchten Katzenkotproben nachgewiesen. Damit wurden sie noch seltener gefunden als in der Studie von MUNDHENKE (1998), die bei 0,3 % (n=3) von 932 Katzen aus Hannover und Umland toxoplasmaähnliche Oozysten nachweisen konnte. In anderen Untersuchungen aus Deutschland wurden Prävalenzen von 0 % bis 1,1 % nachgewiesen (HIEPE et al. 1988; KNAUS u. FEHLER 1989; EMDE 1991, UNBEHAUEN 1991; EPE et al. 1993; SCHUSTER et al. 1997; HECKING-VELTMAN 1999; BARUTZKI u. SCHAPER 2003; EPE et al. 2004; DIEFFENBACHER 2006; 99 5 Diskussion SCHARES et al. 2008). Lediglich RASCHKA et al. (1994) wiesen eine Prävalenz von 3,6 % nach. Inwiefern es sich bei den in vorliegender Studie nachgewiesenen Oozysten um Oozysten von T. gondii oder H. hammondi handelt, kann nicht beurteilt werden, da der zur Abgrenzung beider zur Verfügung stehende Mäuseinokulationstest oder molekularbiologische Untersuchungen nicht durchgeführt wurden. Zu beachten ist, dass Katzen meist nur nach einer Primärinfektion mit T. gondii koproskopisch nachweisbare Mengen dieses Parasiten ausscheiden (BOCH 1980; BOCH 1984; DUBEY 1986). 5.3 Nachweis von Endoparasiten bei unterschiedlichem Alter Hunde Hunde mit einem Alter von bis einschließlich einem Jahr waren hochsignifikant häufiger mit Endoparasiten befallen als Tiere über einem Jahr (p<0,001). Die generell größere Häufigkeit von Endoparasiten bei Junghunden beschrieben unter anderem auch VISCO et al. (1978), KREBITZ (1982), EMDE (1988) und LeNOBEL et al. (2004). Übereinstimmend mit den Untersuchungsergebnissen von BARUTZKI u. SCHAPER (2003), MARTÍNEZ-MORENO et al. (2007) und BATCHELOR et al. (2008) konnte festgestellt werden, dass Hunde unter einem Jahr häufiger mit T. canis infiziert waren als ältere Tiere. Der höhere Befall von jungen Hunden mit T. canis kann durch die pränatale und galaktogene Übertragung der Larven von T. canis erklärt werden. Infolge Altersresistenz und Immunitätsbildung sinkt der Anteil der Hunde mit patenten T. canis-Infektionen mit zunehmendem Alter (DEPLAZES 2006). Dies hängt aber vom Antigenstimulus ab, und niedrige Infektionsdosen können auch bei älteren Tieren wieder patente Infektionen produzieren (MAIZELS et al. 2006; FAHRION et al. 2008). Außerdem kann es bei alten Hunden mit Immunsuppression wieder zu patenten T. canis-Infektionen kommen (DEPLAZES 2006). Es muss berücksichtigt werden, dass in vorliegender Studie Hunde in der Altersklasse von über einem Jahr noch zu 2,5 % mit T. canis und zu 0,3 % mit T. leonina befallen waren. Um eine 100 5 Diskussion Ausscheidung von Zoonoseerregern wie T. canis zu minimieren, sollten also nicht nur Welpen, sondern auch ältere Tiere regelmäßig parasitologisch untersucht und gegebenenfalls anthelminthisch behandelt werden. Parasiten der Gattung Isospora spp. konnten in vorliegender Untersuchung signifikant häufiger bei Hunden unter einem Jahr nachgewiesen werden als bei älteren Tieren (p<0,001). Diese Ergebnisse bestätigen die Ergebnisse anderer Untersucher, die Isospora spp. ebenfalls gehäuft bei Jungtieren nachweisen konnten (VISCO et al. 1977; EMDE 1988; GOTHE u. REICHLER 1990; BARUTZKI u. SCHAPER 2003; BUEHL 2006; MARTÍNEZ-MORENO et al. 2007; BATCHELOR et al. 2008). Die sich nach einer Primärinfektion ausbildende Immunität ist Grund dafür, dass ältere Tiere weniger häufig befallen sind. Zysten von Giardia sp. wurden mit 2,7 % häufiger bei Hunden mit einem Alter von bis einschließlich einem Jahr nachgewiesen als bei den älteren Tieren mit 0,3 %, dieser Unterschied war jedoch nicht statistisch signifikant. In vielen Studien waren junge Hunde unter einem Jahr häufiger betroffen als ältere Tiere (SWAN u. THOMPSON 1986; SYKES u. FOX 1989; ZISLIN et al. 1999; BARUTZKI 2002; CAPELLI et al. 2003; BATCHELOR et al. 2008; CLAEREBOUT et al. 2008). Die sich bei immunkompetenten Wirten bildende Immunität, die zu einem partiellen Schutz vor Super- und Reinfektionen führt, ist Grund für sinkende Prävalenzen mit steigendem Lebensalter. Allerdings hängen die nachgewiesenen Prävalenzen auch sehr stark von anderen Faktoren wie Haltungsbedingungen und Klima ab. Hakenwürmer wurden mit 2,7 % häufiger bei Hunden mit einem Alter von einem Jahr und jünger nachgewiesen als bei älteren Tieren mit 0,3 %. Dieser Unterschied war jedoch nicht statistisch signifikant. Auch bei BARUTZKI u. SCHAPER (2003) waren junge Hunde bis zu einem Jahr häufiger mit Hakenwürmern befallen als Tiere über einem Jahr. Katzen Bis zu einschließlich einem Jahr alte Katzen waren ebenfalls hochsignifikant häufiger mit Endoparasiten befallen als Tiere über einem Jahr (p<0,001). Die generell größere Häufigkeit von Endoparasiten bei Jungkatzen wurden unter anderem auch VISCO et 101 5 Diskussion al. (1978), EMDE (1991), MUNDHENKE (1998) und HECKING-VELTMAN (1999) beschrieben. Übereinstimmend mit den Untersuchungsergebnissen von z.B. MERZ-SCHENKER et al. (1976), WILSON-HANSON u. PRESCOTT (1982), SEILER et al. (1983), RASCHKA et al. (1994), BARUTZKI u. SCHAPER (2003) und DIEFFENBACHER (2006) konnte festgestellt werden, dass Katzen unter einem Jahr häufiger mit T. cati infiziert waren als ältere Tiere. Der höhere Befall von sehr jungen Katzen mit T. cati kann durch die galaktogene Übertragung der Larven erklärt werden (SWERCZEK et al. 1971). Trotz dieser ausgeprägten Jugendpräferenz stellten EMDE (1991) und RASCHKA et al. (1994) fast ein Viertel aller Toxocara-Funde bei Katzen fest, die älter als ein Jahr waren. Auch in vorliegender Untersuchung werden 20,8 % der Toxocara-Funde bei Katzen über einem Jahr nachgewiesen. Im Gegensatz zum Hund findet auch in einem hohen Prozentsatz adulter Katzen nach Infektion mit Eiern von T. cati eine tracheale Wanderung der Larven statt, wenn auch weniger häufig als in jungen Tieren (VISCO et al. 1978; PARSONS 1987; O´LORCAIN 1994). Nach SARLES und STOLL (1935) bleiben Katzen ein Leben lang empfänglich für Reinfektionen nach Aufnahme infektiöser Eier. Der hohe Prozentsatz von 12,4 % infizierter Katzen in der Altersklasse von über einem Jahr macht deutlich, wie wichtig die anthelminthische Behandlung auch älterer Tiere ist. Parasiten der Gattung Isospora spp. konnten in vorliegender Untersuchung hochsignifikant häufiger bei Katzen unter einem Jahr nachgewiesen werden als bei älteren Tieren (p<0,001). Diese Ergebnisse bestätigen die Ergebnisse anderer Untersucher, die Isospora spp. ebenfalls gehäuft bei Jungtieren nachweisen konnten (EMDE 1991; RASCHKA et al. 1994; HECKING-VELTMAN 1999; BARUTZKI u. SCHAPER 2003). Für Capillaria spp., Taeniidae, Hakenwürmer, Giardia sp., A. abstrusus und toxoplasmaähnliche Oozysten konnte keine Altersdisposition nachgewiesen werden. MUNDHENKE (1998) und HECKING-VELTMAN (1999) beobachteten Capillaria spp. am häufigsten in der Altersgruppe von jungen Katzen bis zu einem Alter von sechs Monaten, UNBEHAUEN (1991) wies diese Endoparasiten etwas häufiger bei über einem Jahr alten Tieren nach. Aufgrund der niedrigen Befallszahlen war in diesen 102 5 Diskussion Untersuchungen jedoch keine statistische Auswertung des Capillaria-Befalls in den einzelnen Altersklassen möglich. Eier von Taeniidae beobachteten andere Untersucher deutlich häufiger bei älteren Katzen (UNBEHAUEN 1991; MUNDHENKE 1998; HECKING-VELTMAN 1999). RASCHKA et al. (1994) wiesen T. taeniaeformis in der parasitologischen Teilsektion bei 19,2 % der Katzen unter einem Jahr und bei 45,8 % der Katzen über einem Jahr nach. Die Autoren letztgenannter Studie begründeten den vermehrten Befall älterer Tiere damit, dass junge Katzen erst allmählich mit dem Fangen von Nagetieren beginnen und somit die Möglichkeit, sich mit diesem Parasiten zu infizieren, wesentlich geringer ist. In vorliegender Untersuchung wurden Eier von Taeniidae ungefähr gleich häufig in den beiden Altersklassen nachgewiesen. Es muss berücksichtigt werden, dass es sich bei den vorliegenden Altersangaben nur um geschätzte Angaben handelte. In vorliegender Studie wurden Hakenwürmer mit 1,1 % etwas häufiger bei den Katzen bis einschließlich einem Jahr nachgewiesen als bei den älteren Tieren mit 0,8 %. Dieser Unterschied war jedoch nicht statistisch signifikant. In anderen Untersuchungen wurde Hakenwurmbefall in unterschiedlichen Altersklassen jeweils am häufigsten nachgewiesen. So fanden VISCO et al. (1978) einen patenten Hakenwurmbefall am häufigsten bei Katzen im Alter von ein bis fünf Jahren. WILSON-HANSON u. PRESCOTT (1982) wiesen Hakenwürmer nur in Katzen über zwei Jahren und UNBEHAUEN (1991) nur in Katzen über einem Jahr nach. HECKING-VELTMAN (1999) hingegen wies diesen Parasiten bereits bei Katzen unter sechs Monaten nach und in dieser Altersgruppe häufiger als bei älteren Katzen, allerdings ließen sich die Ergebnisse ihrer Studie aufgrund zu geringer Fallzahlen nicht statistisch absichern. In der Studie von TRAVERSA et al. (2008) waren junge Katzen unter einem Jahr signifikant häufiger mit A. abstrusus befallen als Tiere über einem Jahr. In vorliegender Studie wurden Larven von A. abstrusus mit 1,4 % auch häufiger bei den Katzen bis einschließlich einem Jahr nachgewiesen als bei den älteren Tieren mit 0,3 %. Jedoch war dieser Unterschied in der statistischen Überprüfung nicht signifikant. 103 5 Diskussion Toxoplasmaähnliche Oozysten wurden in vorliegender Studie nur einmal bei einer Katze bis zu einem Jahr Lebensalter nachgewiesen. Auch RASCHKA et al. (1994) wiesen solche Oozysten nur bei Tieren unter einem Jahr nach, UNBEHAUEN (1991) außerdem auch bei einem Tier von ein bis drei Jahren. 5.4 Nachweis von Endoparasiten bei unterschiedlichem Geschlecht Da für einige kastrierte Tiere keine Angabe darüber vorlag, ob das Tier bereits kastriert war, als es im Tierheim aufgenommen wurde oder ob eine Kastration erst bei der Aufnahme erfolgte, wurde in vorliegender Studie nur zwischen den unkastrierten Geschlechtern differenziert. Hunde Bei Hunden war der Befall mit Endoparasiten bei beiden Geschlechtern ausgeglichen. Dieser Befund bestätigt Ergebnisse anderer Studien (VISCO 1977; KREBITZ 1982; COGGINS 1998; CLAEREBOUT et al. 2008). In vorliegender Studie wurde eine ähnliche Befallsrate für T. canis bei männlichen und weiblichen Hunden nachgewiesen, was auch in vielen anderen Studien gezeigt werden konnte (VISCO 1977; COGGINS 1998; HABLUETZEL et al. 2003; MARTÍNEZ-MORENO et al. 2007; SOWEMIMO u. ASAOLU 2008). Katzen Auch bei den in vorliegender Studie untersuchten Katzen war eine Geschlechtsdisposition nicht feststellbar. Dieser Befund bestätigt Ergebnisse anderer Studien (MERZ-SCHENKER et al. 1976; VISCO et al. 1978; HIEPE et al. 1988; UNBEHAUEN 1991; HECKING-VELTMAN 1999). In verschiedenen Studien wurden jeweils höhere Befallsraten mit T. cati bei weiblichen (RASCHKA et al. 1994; DELAHAY et al. 1998) oder bei männlichen Tieren (KREBITZ 1982; EMDE 1991) beobachtet. In der vorliegenden Untersuchung war der Befall mit T. cati bei beiden 104 5 Diskussion Geschlechtern ausgeglichen, wie auch in vielen anderen Studien beschrieben (MERZ-SCHENKER et al. 1976; VISCO et al. 1978; HIEPE et al. 1988; UNBEHAUEN 1991; MUNDHENKE 1998; HECKING-VELTMAN 1999). 5.5 Nachweis von Endoparasiten bei unterschiedlichem Aufnahmegrund Hunde Bei Hunden mit einem Alter von über einem Jahr war die Befallsrate mit Endoparasiten bei den Fundhunden signifikant höher als bei den abgegebenen Hunden. Auch LeNOBEL et al. (2004) fanden in einer Studie aus Tierheimen in den Niederlanden Fundhunde häufiger infiziert als Abgabe- und Pensionshunde. Vermutlich handelt es sich bei einem großen Teil der Hunde um solche Tiere, die dem Besitzer entlaufen sind oder aber von diesem ausgesetzt wurden. Da sich solche Hunde von Abfall oder Unrat auf den Straßen oder von möglichen Zwischenwirten oder paratenischen Wirten ernähren können, besitzen sie auch ein erhöhtes Risiko für einen Wurmbefall. Wahrscheinlich sind aber viele dieser Hunde erst seit kurzer Zeit auf der Straße. Dann käme die Möglichkeit in Betracht, dass der (ehemalige) Besitzer diese Tiere nicht ausreichend oder adäquat entwurmt und gefüttert hat. Auch die Fundhunde mit einem Alter von unter einem Jahr waren häufiger mit Endoparasiten infiziert als die abgegebenen Hunde, jedoch war dieser Unterschied nicht statistisch signifikant. Katzen Bei den in vorliegender Studie untersuchten Katzen handelte es sich bei einem Großteil (90,6 %) um sogenannte Fundkatzen, nur 9,4 % waren sogenannte Abgabekatzen, d.h. Tiere, die von ihrem Besitzer im Tierheim zur vorübergehenden Pflege oder zur weiteren Vermittlung abgegeben wurden. Da in Deutschland in heutiger Zeit echte streunende Katzen vorkommen, ist anzunehmen, dass es sich bei einem Großteil der Katzen um Tiere handelt, die nicht aus menschlicher Obhut 105 5 Diskussion stammen. In vielen Studien konnte für streunende Katzen ein erhöhtes Risiko für einen Endoparasitenbefall aufgezeigt werden (UNBEHAUEN 1991; OVERGAAUW 1997c; ROBBEN et al. 2004). Bei den Katzen mit einem Alter von über einem Jahr war die Befallsrate mit Endoparasiten bei den Fundkatzen signifikant höher als bei den abgegebenen Katzen. Auch ROBBEN et al. (2004) fanden in einer Studie aus Tierheimen in den Niederlanden Fundkatzen häufiger infiziert als Abgabe- und Pensionskatzen. Bei der Kategorie Fundkatzen ist nicht genau bekannt, um was für Katzen es sich handelt. Vermutlich handelt es sich dabei zu einem großen Teil um Katzen, die nach einer längeren Zeit des Umherstreunens im Tierheim von einem Finder abgegeben worden sind. Solche Katzen haben demnach reichlich Gelegenheit zum Erjagen von möglichen Zwischenwirten oder paratenischen Wirten oder können in Kontakt zu infizierten Artgenossen treten. Außerdem sind dies vermutlich Tiere, die seit längerer Zeit nicht oder sogar noch nie anthelminthisch behandelt wurden. Da in vielen Studien gezeigt werden konnte, dass streunende Katzen häufiger mit Endoparasiten befallen sind als Katzen aus menschlicher Obhut (UNBEHAUEN 1991; VANPARIJS et al. 1991; OVERGAAUW 1997c; MIRÓ et al. 2004; ROBBEN et al. 2004), ist es nicht verwunderlich, dass die Fundkatzen aus vorliegender Studie häufiger mit Endoparasiten befallen waren, als die Abgabe- und Pensionskatzen. In der Studie von MUNDHENKE (1998), in der Katzen aus menschlicher Obhut untersucht wurden, waren 8,5 % der Katzen über einem Jahr mit Endoparasiten befallen. Dies stimmt in etwa mit der Prävalenz überein, die in vorliegender Studie für über ein Jahr alte Abgabe- und Pensionskatzen gefunden wurde. Auch die Fundkatzen unter einem Jahr waren häufiger mit Endoparasiten infiziert als die abgegebenen Katzen, jedoch war dieser Unterschied nicht statistisch signifikant. 5.6 Quantitative Kotuntersuchung mit McMaster Bevor man die Ergebnisse aus der quantitativen Kotuntersuchung mit denen anderer Studien vergleicht, müssen neben der Sensitivität der verwendeteten Methode (siehe Kap. 106 5.1) weitere Faktoren zur Bewertung der Höhe der Ei- bzw. 5 Diskussion Oozystenausscheidung berücksichtigt werden. Allgemein gilt, dass ein Rückschluss auf die vorhandene Wurmbürde nur mit großer Vorsicht gezogen werden kann (STOYE u. BÜRGER 1968). Sind hohe Eizahlen vorhanden, so ist die Wurmbürde in der Regel hoch, soweit die artspezifische Legeleistung berücksichtigt wird. Der umgekehrte Schluss von wenigen Eiern auf eine niedrige Wurmbürde ist dagegen nicht immer berechtigt, da z.B. große Mengen unreifer Stadien vorhanden sein können (STOYE u. BÜRGER 1968). Biologische Faktoren wie Alter, Fütterung und Immunstatus des Wirttieres müssen berücksichtigt werden. Desweiteren hängt die Eiausscheidung von der Tageskotmenge des Tieres und von dem Wassergehalt des Kotes ab. Je wässriger die Faeces, desto mehr werden die Eikonzentrationen verdünnt (THIENPONT et al. 1990). In vorliegender Studie werden Eizahlen unter 500 EpG aufgrund der Ergebnisse von KRAEMER (2005) wahrscheinlich als falsch niedrig interpretiert werden müssen. Weiterhin gilt zu berücksichtigen, dass die EpG für Zestoden lediglich qualitative Aussagekraft besitzen. Hunde Bei den quantitativen koproskopischen Untersuchungen mittels der modifizierten McMaster-Methode sind zwischen < 33 und 4033 T. canis-EpG festgestellt worden. Der arithmetische Mittelwert der EpG bei den 17 T. canis-positiven Hunden lag dabei bei 788,2. Die T. canis-positiven Hunden hatten ein Alter von fünf Wochen bis zu sieben Jahren (gemitteltes Alter: 1,7 Jahre). VANPARIJS et al. (1991), die 30 erwachsene T. canis-positive Hunde aus belgischen Hundezuchten mit der McMaster-Methode untersuchten, stellten einen ähnlichen arithmetischen Mittelwert mit 750 bei einer Variationsbreite von 100 bis 2000 EpG fest. Nähere Angaben zum Alter der untersuchten Hunde wurden in genannter Studie nicht gemacht. SCHIMMEL u. DORN (1998), die eine Feldstudie zur Wirksamkeit von Anthelminthika an Welpen und jungen Hunden durchführten, konnten eine höhere Befallsintensität von Hunden mit T. canis als in vorliegender Studie feststellen. In genannter Studie wiesen 184 T. canis-positiver Hunde einen Mittelwert von 2060 EpG und eine Variationsbreite von 67 bis 52000 auf. Die höhere Befallsintensität mit T. canis in der genannten Studie im Vergleich zu vorliegender Studie ist nicht verwunderlich, da bekannt ist, dass gerade junge Hunde mit T. canis-Befall häufig 107 5 Diskussion große Zahlen von Eiern im Kot ausscheiden, bei Welpen sogar bis über 50000 EpG (DEPLAZES 2006). In der Studie von SCHIMMEL u. DORN (1998) waren die untersuchten Tiere zwei Wochen bis ein Jahr alt, in der vorliegenden Studie jedoch waren sieben der T. canis-positiven Hunde, bei denen ein EpG bestimmt werden konnte, über ein Jahr alt. DUBNÁ et al. (2006), die 3780 Proben von Hunden von den Straßen Prags untersuchten, fanden bei 235 T. canis-positiven Hunden in der McMaster-Methode niedrigere Befallsintensitäten mit einer Variationsbreite von 4 bis 469 und einem Mittelwert von 72,2 EpG. In der genannten Studie wurden aber keine Angaben zu den untersuchten Hunden gemacht, so dass die Möglichkeit besteht, dass es sich bei den T. canis-positiven Tieren aus der Studie von DUBNÁ et al. (2006) um ältere Hunde gehandelt hat als bei den Hunden aus vorliegender Studie, und die Eiausscheidungsraten deshalb niedriger waren. Für die neun Isospora-positiven Hunde konnten in den quantitativen koproskopischen Untersuchungen OpG-Werte zwischen 33 und 16200 bestimmt werden. Der arithmetische Mittelwert der OpG für Isospora spp. lag hier bei 3059,2. Das gemittelte Alter der Isospora-positiven Hunde war 1,6 Jahre (Variationsbreite sechs Wochen bis sechs Jahre). SEELIGER (1999) wies eine durchschnittliche OpG von 16700 für mit I. ohiohensis-Komplex infizierte Hundewelpen mit einer Variationsbreite von 100 bis 230000 OpG nach. Für I. canis-positive Hundewelpen beobachtete sie eine durchschnittliche OpG von 1400 bei einer Variationsbreite von 100 bis 15000 OpG. Da in vorliegender Studie nicht zwischen den einzelnen Isospora-Arten unterschieden wurde, lassen sich die hier ermittelten OpG-Werte nicht vergleichen. Die von SEELIGER (1999) ermittelten Werte zeigen jedoch, dass gerade Welpen hohe Oozystenausscheider sein können und somit Alter und Immunstatus der untersuchten Tiere bei der Interpretation von Oozystenzahlen wichtige zu berücksichtigende Aspekte darstellen. DUBNÁ et al. (2006), die 3780 Kotproben von Hunden von den Straßen Prags untersuchten, fanden bei 92 Isospora-positiven Hunden in der McMaster-Methode niedrigere Befallsintensitäten mit einer Variationsbreite von vier bis 707 und einem Mittelwert von 101,6 OpG. Da in der Studie von DUBNÁ et al. (2006) keine Angaben zu den untersuchten Hunden gemacht wurden, kann es sich bei den Isospora-positiven Tieren um ältere Hunde 108 5 Diskussion gehandelt haben als bei den Hunden aus vorliegender Studie, womit die weitaus niedrigeren Oozystenausscheidungen zu erklären wären. Für die T. vulpis-positiven Hunde wurden in den quantitativen koproskopischen Untersuchungen EpG-Werte zwischen 33 und 1367 bestimmt. Der arithmetische Mittelwert der EpG bei den vier T. vulpis-positiven Hunden lag bei 500. Das Alter der T. vulpis-positiven Hunde lag bei ein bis acht Jahren (gemitteltes Alter: 4,5 Jahre). VANPARIJS et al. (1991) stellten bei 61 erwachsenen T. vulpis-positiven Hunden einen höheren arithmetischen Mittelwert von 1200 bei einer Variationsbreite von 100 bis 14400 EpG fest. Bei dem Vergleich mit genannter Studie ist jedoch die wesentlich höhere Probenanzahl T. vulpis-positiver Hunde als in vorliegender Studie zu berücksichtigen. Die größere Variationsbreite lässt sich sicherlich z.T. dadurch erklären. SCHIMMEL u. DORN (1998) konnten bei acht T. vulpis-positiven Hunden mit einem Alter von bis einschließlich einem Jahr eine ähnliche Variationsbreite wie in vorliegender Studie mit 67 bis 1200 EpG und einen ähnlichen arithmetischen Mittelwert von 512 EpG nachweisen. Die vier Hakenwurm-positiven Hunde wiesen bei den quantitativen koproskopischen Untersuchungen EpG-Werte zwischen unter 33 und 167 (arithmetischer Mittelwert: 91,8). Das gemittelte Alter der Hakenwurm-positiven Hunde betrug 1,1 Jahre (Variationsbreite: vier Monate bis zwei Jahre). SCHIMMEL u. DORN (1998) wiesen bei 75 Hakenwurm-positiven Hunden mit einem Alter von bis einschließlich einem Jahr einen wesentlich höheren Mittelwert von 1785 EpG und eine Variationsbreite von 67 bis 14000 nach. Der höhere arithmetische Mittelwert und die höhere Variationsbreite in der genannten Studie im Vergleich zu vorliegender Studie ist nicht verwunderlich, da bekannt ist, dass gerade junge Hunde bis zu einem Alter von sechs bis acht Monaten mit Hakenwurm-Befall erhebliche Eimengen ausscheiden (DEPLAZES 2006). VANPARIJS et al. (1991) stellten bei 21 erwachsenen Hakenwurm-positiven Hunden ebenfalls einen höheren arithmetischen Mittelwert von 1350 bei einer Variationsbreite von 100 bis 6700 EpG fest. Zu berücksichtigen ist aber die in vorliegender Studie weitaus geringere Anzahl von Hakenwurm-positiven Hunden. Für die zwei Capillaria-positiven Hunde wurden EpG von < 33 und 267 bestimmt. Der arithmetische Mittelwert lag bei 133,5. DUBNÁ et al. (2006), die 3780 Proben von 109 5 Diskussion Hunden von den Straßen Prags untersuchten, fanden bei 23 Capillaria-positiven Hunden in der McMaster-Methode niedrigere Befallsintensitäten mit einer Variationsbreite von 10 bis 27 und einem Mittelwert von 20,3 EpG. Es muss berücksichtigt werden, dass es sich bei den in vorliegender Studie nachgewiesenen Capillaria-Eiern auch um Darmpassanten handeln könnte. Bei dem dreijährigen T. leonina-positiven Hund betrug die EpG 1733 und liegt damit in der Variationsbreite von 100 bis 3500, die VANPARIJS et al. (1991) bei elf T. leonina-positiven Hunden feststellen konnten. Der arithmetische Mittelwert lag in der Studie von VANPARIJS et al. (1991) bei 1300 EpG. Katzen Bei den quantitativen koproskopischen Untersuchungen mittels der modifizierten McMaster-Methode sind für T. cati EpG zwischen 33 und 24500 festgestellt worden. Der arithmetische Mittelwert der EpG bei den 205 T. cati-positiven Katzen lag dabei bei 2702,2. Die T. cati-positiven Katzen hatten ein geschätztes Alter von vier Wochen bis zu zwölf Jahren (gemitteltes Alter: 1,1 Jahre). Ähnliche Eizahlen stellten GETHINGS et al. (1987) mit 46 bis 33800 EpG bei ihren Untersuchungen an 17 infizierten Katzen fest. RASCHKA et al. (1994) fanden bei ähnlicher Altersstruktur der untersuchten Katzenpopulation einen höheren arithmetischen Mittelwert der EpG von 4373,3 bei 54 T. cati-positiven Katzen und eine höhere Variationsbreite der EpG von 70 bis 54600. In der Studie von RASCHKA et al. (1994) kamen Katzen zur Untersuchung, die aus Tierschutzgründen euthanasiert werden mussten, von Jägern wegen Wilderns getötet wurden, Unfallopfer waren oder aber eines natürlichen Todes verstorben waren. Möglicherweise handelte es sich bei den Katzen aus der Studie von RASCHKA et al. (1994) zumindest z.T um Tiere, die in der Immunabwehr stärker geschwächt waren als Tiere aus vorliegender Studie und deshalb höhere Eiausscheidungen aufwiesen. Die neun Hakenwurm-positiven Katzen wiesen bei den quantitativen koproskopischen Untersuchungen EpG-Werte zwischen unter 33 und 4767 (arithmetischer Mittelwert: 975,8) auf. Das gemittelte Alter der Hakenwurm-positiven Katzen betrug 2,3 Jahre (Variationsbreite: sechs Monate bis acht Jahre). 110 5 Diskussion HELLMANN et al. (2003) konnten in einer Feldstudie aus Deutschland und Frankreich bei sechs Hakenwurm-positiven Katzen einen geometrischen Mittelwert der EpG von 259,9 feststellen. Angaben zur Variationsbreite der EpG oder zum Alter der Katzen wurden in genannter Studie nicht gemacht. Die in vorliegender Studie höheren Mittelwerte der EpG könnten im Alter oder Immunstatus der untersuchten Tiere begründet sein. RIDLEY et al. (1991) stellten bei 40 natürlich oder experimentell infizierten Hakenwurm-positiven Katzen einen höheren Mittelwert der EpG-Werte von 2004,8 fest. Hier gilt aber zu berücksichtigen, dass es sich z.T. um Katzen handelte, die zur Wirksamkeitsüberprüfung von einem Anthelminthikum experimentell infiziert worden waren. Bei der sechs Wochen alten Katze, die toxoplasmaähnliche Oozysten ausschied, betrug die OpG 64333. MUNDHENKE (1998), die T. gondii-negativ getestete Katzen mit Oozysten eines Laborstammes oder Zysten eines Feldstammes von T. gondii infizierte, wies bei den unbehandelten Tieren nach einer mittleren Präpatenz von fünf Tagen Oozystenausscheidungen von 0,1 x 106 bis 89,9 x 106 an vier bis zehn Tagen fest. Diese Zahlen machen deutlich, wie hoch die Oozystenausscheidungen bei T. gondii-erstinfizierten Katzen sein können. Die in vorliegender Studie nachgewiesene OpG von 64333 ist also als relativ niedrig einzustufen, allerdings ist nicht klar, in welchem Status der Ausscheidungsphase sich die Katze befand und ob es sich um Oozysten von T. gondii oder von H. hammondii handelte. Angaben zu Oozysten- bzw. Eizahlen pro Gramm Kot waren für Isospora spp. bzw. Capillaria spp. bei Katzen in der hier betrachteten Literatur nicht zu finden. Die Autoren beschränkten sich in der Regel auf qualitative Nachweise, ohne ihre Ergebnisse pro Einzeltier zu quantifizieren. 5.7 Wirksamkeit der verwendeten Anthelminthika Hunde Aufgrund der großen Fluktuation der Hundepopulation in den Tierheimen war es nicht immer möglich, eine Probe von den ehemals positiven Hunden zur Nachuntersuchung zu gewinnen. Daher sind die Fallzahlen für den EZRT bei 111 5 Diskussion Hunden manchmal nur gering, auch wenn versucht wurde, diese Fallzahlen durch die Einbeziehung von Bestandshunden und beschlagnahmten Hunden zu vergrößern. Auch die in vorliegender Studie z.T. geringe Prävalenz vieler Helminthen erschwerte die Felduntersuchung auf die Wirksamkeit von Anthelminthika bei Hunden. Nach Behandlung mit Fenbendazol in einer Dosierung von 50 mg/kg KGW über drei Tage lag die EZR für T. canis bei 100 % (n=11). Außerdem konnte Fenbendazol die Eizahl bei drei Hunden mit festgestelltem Hakenwurmbefall zu 100 % senken. Dieses Ergebnis bestätigt die Ergebnisse anderer Untersucher, die ebenfalls hohe Wirksamkeiten für Fenbendazol gegen Askariden und Hakenwürmer bei Hunden beobachten konnten (BURKE u. ROBERSON 1978; 1979; ROBERSON u. BURKE 1982; CORBA et al. 1993; FISHER et al. 1993). ROBERSON und BURKE (1982) beobachteten für oben genannte Dosierung im kontrollierten Test eine Wirksamkeit von 98 % bis 100 % gegen Askariden, Hakenwürmer und Peitschenwürmer. In der Studie von MIRÓ et al. (2007) lag die EZR 16 Tage nach Behandlung von zehn Hunden mit jeweils T. canis- oder Hakenwurmbefall mit Fenbendazol wie in vorliegender Studie ebenfalls bei 100 %. Bei drei Hunden erwies sich Fenbendazol in vorliegender Studie zudem als hoch wirksam gegenüber T. vulpis (EZR 100 %). Dieses Ergebnis bestätigt Ergebnisse früherer Studien, in denen hohe Wirksamkeiten für Fenbendazol gegenüber T. vulpis gefunden wurden (BURKE u. ROBERSON 1978; ROBERSON u. BURKE 1982; FISHER et al. 1993). Nach Behandlung mit Pyrantel bei zwei mit T. canis-infizierten Hunden, einem Hund mit T. leonina-Befall und einem Hund mit Hakenwurmbefall betrug die Eizahlreduktion 100 %, jedoch ist die sehr geringe Tierzahl zu berücksichtigen. Damit wurden für Pyrantel hohe Wirksamkeiten gegen diese Parasiten wie bei LINDQUIST (1975), TODD et al. (1975) und KLEIN et al. (1978) nachgewiesen. Es muss jedoch darauf hingewiesen werden, dass Pyrantel bei Hunden, in einer Vielzahl von Therapiestudien geprüft, nach oraler Verabreichung einer Dosis von 5 mg/kg KGW gegen geschlechtsreife T. canis recht wechselhafte Wirkungen aufwies, in der Mehrzahl der Untersuchungen blieb ein Großteil medikierter Tiere infiziert (BAUER 1994). Ein Befall mit jugendlichen Darmstadien von Toxocara spp. wird wesentlich 112 5 Diskussion schwerer durch das Pharmakon beeinflusst als ältere Stadien dieses Spulwurms (JACOBS 1987). In einer multizentrischen Feldstudie von SCHIMMEL u. DORN (1998) wurden 184 T. canis-positive Welpen und junge Hunde mit Pyrantel behandelt. In der genannten Studie wurde eine EZR von 83,7 % nachgewiesen. Auch gegen adulte Hakenwürmer sind Intensitäts- und Extensitätseffekte, also die Reduktion der Befallsstärke bzw. der Anteil der nach Behandlung vollständig von einem Endoparasiten befreiten Tiere, der Einmaldosis von 5 mg/kg KGW offenbar recht schwankend (BAUER 1994). Hinweise auf eine Resistenz gab es in vorliegender Studie bei Hunden nicht, zu beachten sind aber die z.T. sehr geringen Fallzahlen. Vor dem Hintergrund neuerer Berichte aus Australien über Pyrantel-resistente A. caninum-Isolate beim Hund (KOPP et al. 2007, 2008, 2009) erscheinen weitere Felduntersuchungen daher zwingend notwendig. Katzen Nach Behandlung mit Fenbendazol lag die EZR von T. cati bei 100 % (n=27). Auch in anderen Studien wurde ein sehr guter Intensitäts- und Extensitätseffekt gegen Spulwürmer dokumentiert (ROBERSON u. BURKE 1980; SCHMID u. DÜWEL 1990). ROBERSON und BURKE (1980) wiesen bei 16 natürlich mit T. cati infizierten Katzen acht Tage nach Behandlung mit Fenbendazol in einer Dosierung von 50 mg/kg KGW keine Stadien von T. cati mehr in der Sektion dieser Katzen nach. Weiterhin konnte bei drei Katzen A. abstrusus erfolgreich mit Fenbendazol, über zehn Tage verabreicht, behandelt werden. Bei Infektionen mit dem Katzenlungenwurm ist v.a. die Dauer einer ausreichend hohen Fenbendazol-Gabe für den Therapieerfolg ausschlaggebend. So wiesen ROBERSON und BURKE (1980) nach, dass eine Gabe von 50 mg/kg KGW an drei aufeinander folgenden Tagen die Larvenausscheidung bei einigen Katzen nur vorübergehend senkte. Andere Autoren erzielten gute Therapieerfolge mit Fenbendazol, wenn sie es in einer Dosierung von 20 mg/kg KGW an fünf Tagen (SMITH 1980; HAMILTON et al. 1984) bzw. von 50 mg/kg KGW an 15 Tagen gaben (GRANDI et al. 2005). 113 5 Diskussion Darüber hinaus wurde nach zehntägiger Behandlung mit Fenbendazol eine Reduktion der Eier von Capillaria spp. um 100 % (n=12) beobachtet. Es gibt Einzelfallberichte bei Hunden, die nach festgestelltem Capillaria-Befall erfolgreich mit Fenbendazol therapiert werden konnten (GILLESPIE 1983; KING et al. 1990; BURGESS et al. 2008). Nach Behandlung mit Pyrantel wurde eine mittlere Reduktion der Eier von T. cati um 94,98 % (n=26) beobachtet. Außerdem konnte Pyrantel die Eizahl bei zwei Katzen mit festgestelltem Hakenwurmbefall zu 100 % senken. REINEMEYER und DeNOVO (1990) und RIDLEY et al. (1991) fanden sieben Tage nach Verabreichung von Pyrantelembonat-Paste bei Katzen ebenfalls hohe Eizahlreduktionen mit 98,6 % bzw. 99,3 % für A. tubaeforme und 96,4 % bzw. 99,7 % für T. cati. CATTON und VAN SCHALKWYK (2003) verwendeten in einem kontrollierten Test eine Kombination von Pyrantelembonat und Praziquantel und fanden für dieses Produkt eine hohe Wirksamkeit (> 99 %) gegen Askariden und Hakenwürmer. HELLMANN et al. (2003) fanden darüber hinaus in einer Feldstudie aus Deutschland und Frankreich für eine Kombination von Pyrantelembonat und Praziquantel hohe Wirksamkeiten dieses Produktes gegen T. cati (99,96 %; n=38) und Hakenwürmer (100 %; n=2). Nach Behandlung mit Milbemycinoxim lag die EZR von T. cati bei 96,01 % (n=27). Auch andere Untersucher stellten hohe Wirksamkeiten für Milbemycinoxim gegenüber T. cati fest (CATTON u. VAN SCHALKWYK 2003; SCHENKER et al. 2006). CATTON und VAN SCHALKWYK (2003) verwendeten in einem kontrollierten Test eine Kombination von Milbemycinoxim und Praziquantel und fanden für dieses Produkt eine Wirksamkeit von 100 % gegenüber T. cati, SCHENKER et al. (2006) fanden im kontrollierten Test für diese Medikamentenkombination eine Wirksamkeit von 95,6 % gegen adulte T. cati. Milbemycinoxim reduzierte zudem in vorliegender Studie bei drei Katzen die Eiausscheidung bei Hakenwurmbefall um 100 %. HUMBERT-DROZ et al. (2004) verwendeten in einem kontrollierten Test bei experimentell mit A. tubaeformeinfizierten Katzen eine Kombination von Milbemycinoxim und Praziquantel und fanden für dieses Produkt ebenfalls eine hohe Eizahlreduktion mit über 99 %. Weiterhin wurde bei fünf mit Capillaria spp. infizierten Katzen nach Behandlung mit Milbemycinoxim in vorliegender Studie eine Reduktion der Eiausscheidung von 114 5 Diskussion 98,35 % beobachtet. Angaben zu Wirksamkeiten von Milbemycinoxim gegen diesen Parasiten wurden in der hier betrachteten Literatur nicht gefunden, daher bleibt in weiteren Versuchen abzuwarten, ob die hier beobachtete Wirksamkeit bestätigt werden kann. Hinweise auf eine Resistenz gab es in vorliegender Studie bei Katzen nicht, zu beachten sind aber die z.T. sehr geringen Fallzahlen. 115 6 Bedeutung für die Tierheime 6 Bedeutung für die Tierheime Zur Bedeutung parasitärer Entwicklungsstadien im Kot von Hunden und Katzen bei der Aufnahme in ein Tierheim sind folgende Punkte zu berücksichtigen: Zum einen sind verschiedene Endoparasiten für den Hund bzw. die Katze selbst pathogen und schädigen deren Gesundheit. Gerade bei Jungtieren kann es bei Befall mit bestimmten Endoparasiten zu hohen Verlusten kommen und die normale Entwicklung der Welpen Endoparasitenbefall als wird beeinträchtigt. begünstigender Außerdem Faktor für ist ein zahlreiche starker andere Infektionserkrankungen zu werten. Gerade in Tierheimen, wo Hunde und Katzen auf engem Raum gehalten werden, kann dies zu Seuchenausbrüchen beitragen. Ein weiteres Problem liegt in der z.T. hohen Persistenz von einigen Parasitenstadien in der Umwelt. Einmal kontaminierte Areale können daher lange als Infektionsquelle dienen, bei Kontamination mit Eiern von Askariden sogar jahrelang. Im Laufe der Jahre kann es so zu einer Anreicherung von parasitären Dauerstadien kommen. Die größte Bedeutung kommt einigen Endoparasiten der Hunde und Katzen jedoch als Zoonoseerreger zu, denn sie stellen eine Gefahr für die Gesundheit des Menschen dar. Als Zoonoseerreger unter den festgestellten Endoparasiten bei Hunden sind T. canis, Giardien, Hakenwürmer und sehr selten T. vulpis anzusehen. Bei Katzen sind als Zoonoseerreger unter den festgestellten Endoparasiten T. cati, Taeniiden, Hakenwürmer, Giardien und toxoplasmaähnliche Oozysten anzusprechen. Im Folgenden soll daher auf die Bekämpfung von Endoparasitenbefall, Hygienemaßnahmen und Dekontamination sowie auf die Prävention zoonotischer Parasitosen eingegangen werden. Bei Hunden waren Giardien mit 11,4 % positiver Proben im Koproantigennachweis die in vorliegender Studie am häufigsten nachgewiesenen Endoparasiten. Bei Katzen waren 6,8 % der untersuchten Proben positiv im Giardia-Koproantigennachweis. Gerade Giardien, die erhebliche Bestandsprobleme in einem Tierheim verursachen können und zudem auch noch zoonotisches Potential aufweisen, lassen sich durch standardmäßige Entwurmungen häufig nicht erfassen. Als wirksam gegen Giardia sp. bei Hund und Katze gilt Fenbendazol in einer Dosierung von 50 mg/kg KGW p.o. an drei bis fünf aufeinander folgenden Tagen (TENTER u. DEPLAZES 116 6 Bedeutung für die Tierheime 2006). Da die Rezidivrate jedoch hoch ist, wird eine wiederholte Behandlung nach zwei bis drei Wochen empfohlen (TENTER u. DEPLAZES 2006). Während der Therapie sollten keine Milchprodukte und kein kohlenhydratreiches Futter verabreicht werden (TENTER u. DEPLAZES 2006). Bedenkt man, dass Giardia-Zysten in feuchtem Milieu lange infektiös bleiben (in kühlem Wasser von 4 °C können sie bis zu drei Monate überleben), ergeben sich daraus hohe Anforderungen an die Reinigungs- und Desinfektionsmaßnahmen in Tierheimen. Neben der regelmäßigen Beseitigung des Kotes muss eine gründliche Reinigung aller fäkal kontaminierten Bereiche mittels Dampfstrahl (> 60 °C) erfolgen. Anschließend ist eine vollständige Abtrocknung der gereinigten Bereiche zu gewährleisten (TENTER u. DEPLAZES 2006). Da die minimale infektiöse Dosis sehr klein ist (zehn bis 100 Zysten), sollten vor allem langhaarige Tiere nach der Behandlung gründlich shampooniert werden (TENTER u. DEPLAZES 2006). Zu beachten ist, dass junge Tiere innerhalb weniger Tage bis zu 107 Zysten pro Gramm Kot ausscheiden können (TENTER u. DEPLAZES 2006). Bei älteren Tieren findet sich meist nur eine geringe, intermittierende, aber oft lang anhaltende Zystenausscheidung. DUBNÁ et al. (2006) beobachteten bei Hunden nach einem längeren Aufenthalt in einem Tierheim einen elffachen Anstieg der Giardien-Prävalenz. Dadurch wird deutlich, wie wichtig parasitologische Eingangsuntersuchungen und darauf folgende adäquate antiparasitäre Behandlungen der Tiere sowie die Hygienemaßnahmen in den Tierheimen sind. Als zweithäufigste Endoparasitenart wurde beim Hund T. canis in 4,0 % der Proben nachgewiesen. In Katzenproben wurde T. cati mit 27,1 % sogar als häufigste Endoparasitenart festgestellt. Dabei waren junge Hunde bzw. junge Katzen mit einem Alter von bis einschließlich einem Jahr zu 8,8 % bzw. zu 39,4 % von Spulwürmern der Gattung Toxocara spp. befallen. Jedoch waren auch ältere Hunde bzw. Katzen in der Altersklasse von über einem Jahr noch zu 2,5 % bzw. 12,4 % mit Toxocara spp. patent infiziert. Um eine Ausscheidung von Zoonoseerregern wie T. canis bzw. T. cati zu minimieren, sollten also nicht nur Welpen, sondern auch ältere Tiere regelmäßig parasitologisch untersucht, gegebenenfalls anthelminthisch behandelt und die Wirksamkeit der Behandlung überprüft werden. Da v.a. bei Jungtieren patente Infektionen durch hohe Eiausscheidungsraten gekennzeichnet 117 6 Bedeutung für die Tierheime sind, kann es zu starker Kontamination der Umgebung kommen. Dabei sollte die hohe Tenazität der Toxocara-Eier berücksichtigt werden. Eine Abtötung der Toxocara-Eier ist durch Hitze über 70 °C möglich (DEPLAZES 2006). Zur chemischen Desinfektion eignen sich allein schwefelkohlenstoffhaltige Substanzen, deren Einsatz aufgrund einer relativ hohen Toxizität nur beschränkt möglich ist (STOYE 1983). Neben der Beseitigung des Kotes und der gründlichen mechanischen Reinigung von Zwingern bzw. Ausläufen empfiehlt sich zur Dekontamination von befestigten Bodenflächen (Stein, Beton) der Einsatz von Dampfstrahlreinigungsgeräten (STOYE 1983). Weiterhin muss berücksichtigt werden, dass sich Toxocara-Eier durch Klebrigkeit auszeichnen und im Fell der infizierten Tiere hängen bleiben können. So wiesen AYDENIZÖZ-ÖZKAYHAN et al. (2008) bei 51 untersuchten Haarproben von Hunden in 21,56 % T. canis-Eier nach. Daher muss das Risiko einer Infektion von Kontakttieren und Menschen mit Toxocara spp. auch durch Kontakt zum Fell infizierter Tiere bedacht und durch entsprechende Hygienemaßnahmen verhindert werden. Eine weitere Spulwurmart, T. leonina, wurde in 0,2 % der Hundekotproben nachgewiesen. Auch die Eier von T. leonina sind sehr resistent gegenüber Umwelteinflüssen. Die Bekämpfung erfolgt wie bei Spulwürmern der Gattung Toxocara spp. beschrieben. Patente Infektionen mit Oozysten von Isospora spp. wurden bei Hunden in 2,5 %, bei Katzen in 7,5 % der untersuchten Proben nachgewiesen. In vorliegender Studie waren jüngere Hunde signifikant (p<0,05) und jüngere Katzen hochsignifikant (p<0,001) häufiger befallen als ältere Tiere. Gerade in Zwingern, in denen Hunde bzw. Katzen auf engem Raum gehalten werden, kann sich die Isosporose explosionsartig ausbreiten (TENTER u. DEPLAZES 2006). DUBNÁ et al. (2006) beobachteten bei Hunden nach einem längeren Aufenthalt in einem Tierheim einen vierfachen Anstieg der Isospora spp.-Prävalenz. Zur medikamentösen Kontrolle der Isosporose bei Hund und Katze eignet sich Toltrazuril, ein Triazintrion, in einer Dosierung von 10 mg/kg KGW p.o. täglich über vier bis fünf Tage (TENTER u. DEPLAZES 2006). Zu beachten ist die hohe Tenazität der Isospora spp.-Oozysten. Neben der Beseitigung des Kotes und der gründlichen mechanischen Reinigung von Zwingern bzw. Ausläufen empfiehlt sich zur Dekontamination von befestigten Bodenflächen auch hier der Einsatz von Dampfstrahlreinigungsgeräten (TENTER u. 118 6 Bedeutung für die Tierheime DEPLAZES 2006). Durch Nagerbekämpfung und bei Vermeidung der Verfütterung von rohem Fleisch an Hunde und Katzen können Infektionen zusätzlich erheblich reduziert werden (TENTER u. DEPLAZES 2006). T. vulpis wurde in 0,9 % der Hundekotproben gefunden. Die Eier von T. vulpis sind sehr widerstandsfähig und langlebig, nur gegen Austrocknung sind sie empfindlich. Zur Bekämpfung eignen sich Fenbendazol (siehe Kap. 2.4.1) oder Milbemycinoxim (siehe Kap.2.4.3.). Prophylaktisch ist die häufige und gründliche Entfernung des Kotes insbesondere in Zwingern notwendig, um die Kontamination des Bodens mit Eiern zu vermindern. Hakenwürmer wurden in 0,9 % der Hunde- und 1,1 % der Katzenkotproben nachgewiesen. Zu beachten ist eine relativ lange Lebensdauer und verhältnismäßig hohe Persistenz der freilebenden infektionsfähigen III. Larven in der Außenwelt (STOYE 1983). Auf feuchten Flächen und im Erdboden vermögen sie mehrere Monate lebens- und infektionsfähig zu bleiben (STOYE 1983). Hunde und Katzen können sich auf kontaminierten Grasflächen ständig neu infizieren. Dies ist v.a. ein Problem bei der Zwingerhaltung von Hundegruppen, z.B. in Zuchtbeständen. Mit Stein- oder Betonböden versehene Zwinger oder Ausläufe können nach gründlicher mechanischer Reinigung mit heißer Sodalösung oder 2 %iger Natronlauge oder durch Absprühen mit Heißwasser-Dampf-Gemisch desinfiziert werden (DEPLAZES 2006). Eier von Capillaria spp. wurden in 0,4 % der Hunde- und 5,0 % der Katzenkotproben nachgewiesen. Da sich die Eier von z.B. C. aerophila in feuchten, warmen Böden gut entwickeln, ist besonders auf Trockenheit zu achten. DUBNÁ et al. (2006) wiesen bei Hunden nach einem längeren Aufenthalt in einem Tierheim einen fünffachen Anstieg der Capillaria spp.-Prävalenz nach. Hammondiaähnliche Oozysten wurden bei 0,2 % der untersuchten Hundekotproben angetroffen. Inwiefern es sich es bei den nachgewiesenen Oozysten um Oozysten von Neospora sp. oder Hammondia sp. handelt, kann nicht beurteilt werden, da die Differenzierung dieser Gattungen mit den verwendeten Methoden nicht möglich ist. Um Infektionen mit N. caninum vorzubeugen, sollten Hunde nicht mit rohem oder ungenügend erhitztem Fleisch, Schlacht- oder Jagdabfällen gefüttert werden. 119 6 Bedeutung für die Tierheime In vorliegender Studie wurden in Kotproben von Hunden Eier von Taeniiden in der koproskopischen Untersuchung nicht, bei Katzen in 2,0 % der untersuchten Proben nachgewiesen. Da in den mit Taeniideneiern kontaminierten Kotproben von Katzen jedoch keine Proglottiden gefunden wurden und auch keine immunologischen oder molekularbiologischen Methoden eingesetzt worden sind, ist unklar, ob es sich um einen Echinococcus-Befall oder um die Infektion mit einer Taenia-Art gehandelt hat. Bedenkt man, dass in der Studie von DYACHENKO et al. (2008) 81 % der Taeniiden-positiven Proben von Hunden und 68 % der Taeniiden-positiven Proben von Katzen E. multilocularis-positiv waren, so sollte aufgrund des Infektionsrisikos für den Menschen jeder Hund bzw. jede Katze bei Aufnahme ins Tierheim parasitologisch untersucht und gegebenenfalls mit einem geeigneten Zestodizid in ausreichender Dosierung behandelt werden. Bei streunenden Tieren empfiehlt sich aufgrund des höheren Infektionsrisikos (Aufnahme von Zwischenwirten) eine prophylaktische Behandlung mit einem geeigneten Zestodizid, um das Infektionsrisiko für den Menschen zu minimieren. Für E. granulosus gilt als prophylaktische Maßnahme, keine rohen Innereien von Schlacht- oder Wildtieren zu füttern, sondern diese zuvor zu kochen oder bei -18 °C mindestens drei Tage zu gefrieren. Zur Bekämpfung von Zestodenbefall bei Hunden und Katzen siehe auch Kap. 2.4.4. Oozysten vom Toxoplasma-/Hammondia-Typ wurden in 0,1 % der untersuchten Katzenkotproben nachgewiesen. Inwiefern es sich bei den in vorliegender Studie nachgewiesenen Oozysten um Oozysten von T. gondii oder H. hammondi handelt, kann nicht beurteilt werden, da die Differenzierung dieser Gattungen mit den verwendeten Methoden nicht möglich ist. Bekämpfungsmaßnahmen haben v.a. die Verhinderung der Ausscheidung der Oozysten von T. gondii durch Katzen zum Ziel. Diese kann durch die ausschließliche Verfütterung von Dosen- oder Trockenfutter, Fisch und ausreichend gekochtem Fleisch weitgehend verhindert werden (TENTER u. DEPLAZES 2006). Da die von der Katze ausgeschiedenen Oozysten noch unsporuliert und damit nicht infektiös sind, führt ein Kontakt mit Katzen in der Regel nicht zu einer Infektion mit T. gondii. Der von den Katzen abgesetzte Kot sollte täglich aus den Zwingern entfernt und die Kotkästen gründlich mit heißem Wasser und Detergenzien gereinigt werden (TENTER u. DEPLAZES 2006). Dabei sollten am 120 6 Bedeutung für die Tierheime besten Einmalplastikhandschuhe getragen werden. Auf diese Weise werden eventuell vorhandene Oozysten beseitigt, bevor sie sporulieren und damit infektiös werden können. Durch Erhitzung auf 70 °C für zehn Minuten werden auch sporulierte Oozysten abgetötet (TENTER u. DEPLAZES 2006). Am zweckmäßigsten zur Entsorgung von Katzenkot und potenziell mit T. gondii-Oozysten kontaminierten Materialien ist daher eine Verbrennung, dies ist jedoch nicht immer praktikabel. 121 7 Abschließende Beurteilung 7 Abschließende Beurteilung Wie aus den vorliegenden Ergebnissen ersichtlich, sind Giardien mit 11,4 % (Koproantigennachweis) die bei Hunden am häufigsten nachgewiesene Parasitenart, gefolgt von T. canis in 4,0 % und Isospora spp. in 2,5 % der Proben. Bei Katzen wurde mit 27,1 % der untersuchten Proben auffallend häufig T. cati nachgewiesen, gefolgt von Giardia sp. (6,8 % im Koproantigennachweis) und Isospora spp. (7,5 %). Vor dem Hintergrund, dass Giardien und Toxocara spp. Zoonoseerreger sind, sind diese Ergebnisse ein Beleg dafür, dass die Erfassung von Parasitosen und deren Behandlung bei Hunden und Katzen nicht nur für das Wohlergehen der Tiere wichtig ist, sondern auch, um das Infektionsrisiko des Menschen zu senken. Mit den in Tierheimen standardmäßig durchgeführten anthelminthischen Behandlungen werden jedoch viele der in vorliegender Studie nachgewiesenen Endoparasiten nicht oder nicht ausreichend erfasst. Die antiparasitäre Behandlung und die Behandlungsdauer müssen dem jeweiligen Parasiten angepasst sein, um zum Behandlungserfolg führen zu können. Insbesondere für Giardien und Echinococcus spp. als Erreger von Zoonosen notwendig. sind zum Teil Parasitologische abgewandelte intensivere Kotuntersuchungen Behandlungsschemata zur Optimierung einer anthelminthischen Behandlung sind auch notwendig, um einer Einschleppung von Parasiten in den Bestand eines Tierheimes vorzubeugen. Dafür ist es unerlässlich, neu aufgenommene Tiere vorerst in einer Quarantänestation unterzubringen. Hier können die Tiere auf Krankheiten untersucht und gegebenenfalls behandelt werden. Da Hunde und Katzen bei der Aufnahme in ein Tierheim häufig gestresst sind, können hier zudem weitere Maßnahmen zur Stärkung der Immunabwehr durchgeführt werden, bevor sie in den Bestand aufgenommen werden. Weiterhin sind parasitologische Nachuntersuchungen wichtig, um den Erfolg der durchgeführten antiparasitären Behandlung zu überprüfen. Die in vorliegender Studie durchgeführten Nachuntersuchungen ehemals positiver Tiere sprechen für eine gute Wirksamkeit der eingesetzten Anthelminthika gegen die bei den Hunden und Katzen diagnostizierten Endoparasiten. Anthelminthikaresistenzen scheinen den Ergebnissen der vorliegenden Studie zufolge derzeit bei Hunden und Katzen kein Problem darzustellen. Jedoch sind vor dem Hintergrund der z.T. sehr geringen 122 7 Abschließende Beurteilung Fallzahlen im Eizahlreduktionstest weitere Felduntersuchungen zwingend notwendig, um die Ergebnisse der vorliegenden Studie zu bestätigen. An dieser Stelle sei noch einmal daran erinnert, dass die Wahrscheinlichkeit von Resistenzentwicklungen in größeren Hunde- oder Katzenbeständen wie Tierheimen oder großen Zuchten im Vergleich zu Einzeltierhaltungen erhöht sein könnte, zumal Berichte über Pyrantelresistente A. caninum-Isolate aus Australien die Möglichkeit einer Resistenzbildung von Endoparasiten bei Hunden und Katzen unterstreichen. Immer dort, wo eine gleichzeitige Behandlung mehrerer Tiere mit demselben Antiparasitikum einen hohen Selektionsdruck auf eine dort etablierte Parasitenpopulation zur Folge haben kann, steigt die Wahrscheinlichkeit einer Entwicklung von Resistenzen (BAUER et al. 2007). Es wird daher empfohlen, die Parasitenbekämpfung in Tierheimen sorgfältig zu planen und durch Untersuchungen von Kotproben zu begleiten. Antiparasitäre Behandlungen sollten nur nach vorherigen Kotuntersuchungen gezielt eingesetzt und der Behandlungserfolg sollte überprüft werden. Idealerweise sollte jedes Tierheim eine individuelle parasitologische Bestandsbetreuung aufbauen, bei der neben der Untersuchung und Behandlung von Neuzugängen auch Tiere, die bereits zum Bestand gehören, zumindest stichprobenartig vor und nach der Behandlung untersucht werden. 123 8 Zusammenfassung 8 Zusammenfassung Monika Rohen (2009): Endoparasitenbefall bei Fund- und Abgabehunden und -katzen in Niedersachsen und Untersuchungen zur Anthelminthikaresistenz Von 445 Fund- und Abgabehunden und 837 Fund- und Abgabekatzen aus 26 Tierheimen in Niedersachsen wurden Kotproben hinsichtlich des Befalls mit Endoparasiten mit dem kombinierten Sedimentations-Flotationsverfahren untersucht. Bei 341 bzw. 584 Proben von Hunden bzw. Katzen wurde zusätzlich der IDEXX SNAP® Giardia Test angewendet. Bei den Hunden konnten in der Koproskopie bei 9,4 % (n=42) der Proben Parasitenstadien nachgewiesen werden, und zwar Toxocara canis in 4,0 %, Isospora spp. in 2,5 %, Giardia sp., Trichuris vulpis und Hakenwürmer in jeweils 0,9 %, Capillaria spp. in 0,4 %, Toxascaris leonina und hammondiaähnliche Oozysten in jeweils 0,2 %. Giardia-Koproantigen wurde bei 11,4 % der untersuchten Hundeproben nachgewiesen. Bei Katzen konnten in 33,6 % (n=281) der Proben koproskopisch Endoparasiten nachgewiesen werden, und zwar Toxocara cati in 27,1 %, Isospora spp. in 7,5 %, Capillaria spp. in 5,0 %, Taeniiden in 2,0 %, Hakenwürmer in 1,1 %, Giardia sp. in 0,7 %, Aelurostrongylus abstrusus in 1,0 % und toxoplasmaähnliche Oozysten in 0,1 %. Giardia-Koproantigen ließ sich bei 6,8 % der untersuchten Katzenproben nachweisen. Hunde bzw. Katzen mit einem Alter von bis zu einschließlich einem Jahr waren hochsignifikant häufiger mit Endoparasiten befallen als Tiere, die älter als ein Jahr waren (p<0,001). Toxocara spp. und Isospora spp. konnten bei den jüngeren Hunden signifikant (p<0,05) und bei den jüngeren Katzen hochsignifikant (p<0,001) häufiger nachgewiesen werden als bei den jeweils älteren Tieren. Fundhunde bzw. katzen in der Altersklasse von über einem Jahr waren signifikant häufiger mit Endoparasiten befallen als Abgabehunde bzw. -katzen (p<0,05) derselben Altersklasse. Mit Hilfe des Eizahlreduktionstests wurden außerdem Aussagen zur aktuellen Wirksamkeit handelsüblicher Anthelminthika gegenüber bestimmten Helminthen getroffen. Alle getesteten Wirkstoffe (Fenbendazol, Pyrantel, Milbemycinoxim, 124 8 Zusammenfassung Praziquantel) zeigten sich gut bis hoch wirksam. Anthelminthikaresistenzen wurden demnach in der vorliegenden Studie bei Fund- und Abgabehunden und -katzen aus Niedersachsen nicht gefunden, allerdings sind aufgrund der z.T. sehr geringen Fallzahlen weitere Felduntersuchungen notwendig. In einigen Fällen zeigte sich, dass das Behandlungsschema des Tierheimes für bestimmte Parasitenarten nicht ausreichend war. Darum wird empfohlen, für jedes aufgenommene Tier eine parasitologische Untersuchung durchzuführen und die antiparasitäre Behandlung entsprechend anzupassen. Darüber hinaus wird eine individuelle Bestandsbetreuung mit Kontrolle des Behandlungserfolges empfohlen, um eine Einschleppung von Parasiten, die z.T. auch zoonotisches Potential besitzen, zu minimieren. 125 9 Summary 9 Summary Monika Rohen (2009): Infections with endoparasites in stray or dropped off dogs and cats in animal shelters in Lower Saxony and investigations of anthelmintic resistance At their arrival at animal shelters in Lower Saxony (n=26) faecal samples of 445 stray or dropped off dogs and 837 stray or dropped off cats were taken and investigated for infections with intestinal parasites by the use of a combined sedimentationflotation method. Additionally, 341 of the canine and 584 of the feline samples were investigated using the IDEXX SNAP® Giardia test. Stages of endoparasites were found coproscopically in 9.4% (n=42) of the canine samples. In detail, 4.0% of the dog samples were positive for Toxocara canis, 2.5% for Isospora spp., 0.9% for Giardia sp., 0.9% for Trichuris vulpis, 0.9% for hookworms, 0.4% for Toxascaris leonina and 0.2% for Hammondia-like oocysts. Giardia-coproantigen was detected in 11.4% of the canine samples. In cats, infections with helminths and/or protozoa were found coproscopically in 33.6% (n=281) of the samples. Toxocara cati was found in 27.1%, Isospora spp. in 7.5%, Capillaria spp. in 5.0%, taeniidae in 2.0%, hookworms in 1.1%, Giardia sp. in 0.7%, Aelurostrongylus abstrusus in 1.0% and Toxoplasma-like oocysts in 0.1%. Coproantigen specific for Giardia sp. was detected in 6.8% of the feline samples. Dogs and cats up to one year of age were more frequently infected with endoparasites than animals over one year in age. This observation was highly significant (p<0.001). Toxocara spp. and Isospora spp. were detected significantly more often in younger dogs and cats (p<0.05 and p<0.001, respectively). Stray dogs or cats older than one year were infected significantly more frequently with endoparasites than dropped off animals (p<0.05) of the same age group. Using the faecal egg count reduction test, the therapeutic efficacy of some commercially available anthelmintic drugs was estimated. All tested anthelmintics (fenbendazole, pyrantel, milbemycin oxime, praziquantel) showed good or even high efficacy. Therefore, no anthelmintic resistance was found in the present study. However, due to the low numbers of cases in some parts, further field studies 126 9 Summary concerning potential resistances are mandatory. In some cases, the treatment commonly used in the animal shelters was not sufficient for certain parasite species. Therefore, a parasitological screening of recently arrived animals and an appropriate treatment is strongly recommended. Furthermore, to avoid the introduction of parasites into animal shelters and to prevent infections of the staff with zoonotic parasites, an individually adapted parasitological treatment plan including the control of success of treatment is recommended. 127 10 Literaturverzeichnis 10 Literaturverzeichnis ANDERSON, R. C. (2000): Nematode Parasites of Vertebrates; Their Development and Transmission. 2. Aufl. Verlag CAB International, Wallingford, Oxon, UK ANDREWS, P., H. THOMAS, R. POHLKE u. J. SEUBERT (1983): Praziquantel. Med. Res. Rev. 3, 147-200 AYDENIZÖZ-ÖZKAYHAN, M., B. B. YAGCI u. S. ERAT (2008): The investigation of Toxocara canis eggs in coats of different dog breeds as a potential transmission route in human toxocariasis. Vet. Parasitol. 152, 94-100 BARBER, J. S., L. VAN HAM, I. POLIS u. A. J. TREES (1997): Seroprevalence of antibodies to Neospora caninum in Belgian dogs. J. Small Anim. Pract. 38, 15-16 BARR, S. C., D. D. BOWMAN u. R. L. HELLER (1994): Efficacy of fenbendazole against giardiasis in dogs. Am. J. Vet. Res. 55, 988-990 BARUTZKI, D. (1989): Giardia-Befall in Hundefamilien. Tierärztl. Prax. Suppl. 5, 13-15 BARUTZKI, D. (2002): Prevalence of Giardia spp. in Dogs in Germany. In: B. E. OLSON, M. E. OLSON u. P. M. WALLIS (Hrsg.): Giardia, The cosmopolitan parasite. Verlag CAB International, Wallingford, Oxon, UK, S. 91-95 BARUTZKI, D. u. R. SCHAPER (2003): Endoparasites in dogs and cats in Germany 1999-2002. Parasitol. Res. 90, S.148-150 BARUTZKI, D. u. R. SCHAPER (2008): Angiostrongylus vasorum and Crenosoma vulpis- new prevalence data for Germany. Verlag Blackwell, Berlin, Suppl. Vet-MedReport, Jahrgang 31, S. 15 128 10 Literaturverzeichnis BATCHELOR, D. J., S. TZANNES, P. A. GRAHAM, J. M. WASTLING, G. L. PINCHBECK u. A. J. GERMAN (2008): Detection of endoparasites with zoonotic potential in dogs with gastrointestinal disease in the UK. Transbound. Emerg. Dis. 55, 99-104 BAUER, C. (1994): Anthelminthika zum Einsatz gegen Helminthen des Verdauungstraktes, der Atemwege und der Harnblase von Hund und Katze - eine Übersicht. Kleintier-Prax. 39, 771-790 BAUER, C. (2006): Untersuchungsmethoden. In: T. SCHNIEDER (Hrsg.): Veterinärmedizinische Parasitologie 6. Aufl. Verlag Parey, Stuttgart, S. 84-103 BAUER, C. (2007): Toxoplasmose. In: E.-G. GRÜNBAUM u. E. SCHIMKE (Hrsg.): Klinik der Hundekrankheiten 3. Aufl. Verlag Enke, Stuttgart, S. 1148 BAUER, C., R. BRAHM, K. HARTMANN, M. KIETZMANN, B. KOHN, A. LAM, A. MORITZ, T. SCHNIEDER (2007): Bekämpfung von Würmern (Helminthen) bei Hunden und Katzen- Deutsche Adaption der ESCCAP (European Scientific Counsel Companion Animal Parasites)-Empfehlung [Internet: URL: http://www.esccap.org/index.php/fuseaction/download/lrn_file/esccapendoparasiten-dezember-2007_neu.pdf] BAUER, C., J. C. MERKT, G. JANKE-GRIMM u. H. J. BURGER (1986): Prevalence and control of benzimidazole-resistant small strongyles on German thoroughbred studs. Vet. Parasitol. 21, 189-203 BEELITZ, P., E. GÖBEL u. R. GOTHE (1992): Fauna und Befallshäufigkeit von Endoparasiten bei Katzenwelpen und ihren Müttern unterschiedlicher Haltung in Süddeutschland. Tierärztl. Praxis 20, 297-300 129 10 Literaturverzeichnis BISSERU, B. (1969): Studies on the liver, lung, brain and blood of experimental animals infected with Toxocara canis. J. Helminthol. 43, 267-272 BJERKÅS, I., S. F. MOHN u. J. PRESTHUS (1984): Unidentified cyst-forming sporozoon causing encephalomyelitis and myositis in dogs. Z. Parasitenkd 70, 271-274 BJÖRKMAN, C., A. LUNDÉN u. A. UGGLA (1994): Prevalence of antibodies to Neospora caninum and Toxoplasma gondii in Swedish dogs. Acta Vet. Scand. 35, 445-447 BLAGBURN, B. L., C. M. HENDRIX, D. S. LINDSAY, J. L. VAUGHAN, D. I. HEPLER u. J. C. WRIGHT (1992): Efficacy of milbemycin oxime against naturally acquired or experimentally induced Ancylostoma spp. and Trichuris vulpis infections in dogs. Am. J. Vet. Res. 53, 513-516 BOCH, J. (1980): Die Toxoplasmose der Haustiere. Vorkommen, Diagnose und hygienische Bedeutung. Berl. Münch. Tierärztl. Wochenschr. 93, 385-394 BOCH, J. (1984): Die Kokzidiose der Katze. Tierärztl. Praxis 12, BOCH, J., E. GÖBEL, J. HEINE u. M. ERBER (1981): Isospora-Infektionen bei Hund und Katze. Berl. Münch. Tierärztl. Wochenschr. 94, 384-391 BODE, K. (1999): Endoparasitenbefall in kommerziellen Hundezuchten unter besonderer Berücksichtigung der Isosporose. Hannover, tierärztl. Hochsch., Diss. BOSSE, M. (1980): Die Wirkung verschiedener Benzimidazolcarbamate auf somatische Larven von Ancylostoma caninum ERCOLANI 1859 (Ancylostomidae) und Toxocara canis WERNER 1782 (Anisakidae) in der Hündin. Hannover, tierärztl. Hochsch., Diss. 130 10 Literaturverzeichnis BOSSE, M. u. M. STOYE (1981): Zur Wirkung verschiedener Benzimidazolcarbamate auf somatische Larven von Ancylostoma caninum ERCOLANI 1859 (Ancylostomidae) und Toxocara canis WERNER 1782 (Anisakidae). 2. Untersuchungen an der graviden Hündin. Zbl. Vet. Med. B 28, 265-279 BOWMAN, D. D., R. C. JOHNSON u. D. I. HEPLER (1990): Effects of milbemycin oxime on adult hookworms in dogs with naturally acquired infections. Am. J. Vet. Res. 51, 487-490 BOWMAN, D. D., J. C. PARSONS, R. B. GRIEVE u. D. I. HEPLER (1988): Effects of milbemycin on adult Toxocara canis in dogs with experimentally induced infection. Am. J. Vet. Res. 49, 1986-1989 BROWN, H. D., A. R. MATZUK, I. R. ILVES, L. H. PETERSON, S. A. HARRIS, L. H. SARETT, J. R. EGERTON, J. J. YAKSTIS, W. C. CAMPBELL u. A. C. CUCKLER (1961): Antiparasitic drugs - IV. 2´-(4´-Thiazolyl)-benzimidazole, a new anthelmintic. J. Amer. Chem. Soc. 83, 1764-1765 BRUNASKA, M., P. DUBINSKY u. K. REITEROVA (1995): Toxocara canis: ultrastructural aspects of larval moulting in the maturing eggs. Int. J. Parasitol. 25, 683-690 BUEHL, I. E., H. PROSL, H. C. MUNDT, A. G. TICHY u. A. JOACHIM (2006): Canine isosporosis - epidemiology of field and experimental infections. J. Vet. Med. B. 53, 482-487 BURGESS, H., K. RUOTSALO, A. S. PEREGRINE, B. HANSELMAN u. A. ABRAMS-OGG (2008): Eucoleus aerophilus respiratory infection in a dog with Addison's disease. Can. Vet. J. 49, 389-392 BURKE, T. M. u. E. L. ROBERSON (1978): Critical studies of fenbendazole suspension (10%) against naturally occurring helminth infections in dogs. Am. J. Vet. Res. 39, 1799-1801 BURKE, T. M. u. E. L. ROBERSON (1979): Use of fenbendazole suspension (10 %) against experimental infections of Toxocara canis and Ancylostoma caninum in beagle pups. Am. J. Vet. Res. 40, 552-554 131 10 Literaturverzeichnis BURREN, C. H. (1968): Experimental toxocariasis. I. Some observations on the histopathology of the migration of Toxocara canis larvae in the mouse. Z. Parasitenkd. 30, 152-161 CACCIÒ, S. M. u. U. RYAN (2008): Molecular epidemiology of giardiasis. Mol. Biochem. Parasitol. 160, 75-80 CACCIÒ, S. M., R. C. THOMPSON, J. McLAUCHLIN u. H. V. SMITH (2005): Unravelling Cryptosporidium and Giardia epidemiology. Trends Parasitol. 21, 430-437 CAPELLI, G., B. PAOLETTI, R. IORIO, A. FRANGIPANE DI REGALBONO, M. PIETROBELLI, P. BIANCIARDI u. A. GIANGASPERO (2003): Prevalence of Giardia spp. in dogs and humans in northern and central Italy. Parasitol. Res. 90, 154-155 CATTON, D. G. u. P. C. VAN SCHALKWYK (2003): The efficacy of two anthelmintics against ascarids and hookworms in naturally infected cats. Parasitol. Res. 90 Suppl 3, S144-145 CHAPMAN, M. R., T. R. KLEI u. D. D. FRENCH (1991): Identification of thiabendazole-resistant cyathostome species in Louisiana. Vet. Parasitol. 39, 293-299 CIRAK, V. Y. u. C. BAUER (2004): Comparison of conventional coproscopical methods and commercial coproantigen ELISA kits for the detection of Giardia and Cryptosporidium infections in dogs and cats. Berl. Münch. Tierärztl. Wochenschr. 117, 410-413 CLAEREBOUT, E., S. CASAERT, A. C. DALEMANS, N. DE WILDE, B. LEVECKE, J. VERCRUYSSE u. T. GEURDEN (2009): Giardia and other intestinal parasites in different dog populations in Northern Belgium. Vet. Parasitol. (2009), [Internet: URL: http://dx.doi.org/10.1016/j.vetpar.2008.11.024], Artikel im Druck COATI, N., T. SCHNIEDER u. C. EPE (2004): Vertical transmission of Toxocara cati (SCHRANK 1788) (Anisakidae) in the cat. Parasitol. Res. 92, 142-146 132 10 Literaturverzeichnis COGGINS, J. R. (1998): Effect of Season, Sex, and Age on Prevalence of Parasitism in Dogs from Southeastern Wisconsin. J. Helminthol. Soc. Wash. 65, 219-224 COLES, G. C., C. BAUER, F. H. BORGSTEEDE, S. GEERTS, T. R. KLEI, M. A. TAYLOR u. P. J. WALLER (1992): World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) methods for the detection of anthelmintic resistance in nematodes of veterinary importance. Vet. Parasitol. 44, 35-44 CORBA, J., M. VÁRADY, O. TOMASOVICOVA u. P. STEFANKO (1993): Efficacy of fenbendazole in dogs with gastrointestinal nematodes. Veterinarstvi 43, 258-259 CRELLIN, J. R., A. A. MARCHIONDO u. F. L. ANDERSEN (1981): Comparison of suitability of dogs and cats as hosts of Echinococcus multilocularis. Am. J. Vet. Res. 42, 1980-1981 CRINGOLI, G., F. CAPUANO, V. VENEZIANO, L. RINALDI, L. ROMANO, R. SOLIMENE, J. S. BARBER u. A. J. TREES (1996): Prevalence of antibodies against Neospora caninum in dog sera. Parasitologia 38, 282 CRINGOLI, G., L. RINALDI, F. CAPUANO, L. BALDI, V. VENEZIANO u. G. CAPELLI (2002): Serological survey of Neospora caninum and Leishmania infantum co-infection in dogs. Vet. Parasitol. 106, 307-313 CROESE, J., S. FAIRLEY, A. LOUKAS, J. HACK u. P. STRONACH (1996): A distinctive aphthous ileitis linked to Ancylostoma caninum. J. Gastroenterol. Hepatol. 11, 524-531 CROSS, J. H. (1994): Nematode-Cestode Zoonoses. In: N. CHOWDHURY, I. TADA (Hrsg.): Helminthology Springer Verlag, Berlin, Heidelberg, S. 121-145 CULLY, D. F., H. WILKINSON, D. K. VASSILATIS, A. ETTER u. J. P. ARENA (1996): Molecular biology and electrophysiology of glutamate-gated chloride channels of invertebrates. Parasitology 113, 191-200 133 10 Literaturverzeichnis DAUGSCHIES, A., H. C. MUNDT u. V. LETKOVA (2000): Toltrazuril treatment of cystoisosporosis in dogs under experimental and field conditions. Parasitol. Res. 86, 797-799 DECOCK, C., M. C. CADIERGUES, M. LARCHER, S. VERMOT u. M. FRANC (2003): Comparison of two techniques for diagnosis of giardiasis in dogs. Parasite 10, 69-72 DELAHAY, R. J., M. J. DANIELS, D. W. McDONALD, K. McGUIRE u. D. BELHARRY (1998): Do patterns of helminth parasitism differ between groups of wild-living cats in scotland? J. Zoology 245, 175-183 DEPLAZES, P. (2006): Helminthosen von Hund und Katze. In: T. SCHNIEDER (Hrsg.): Veterinärmedizinische Parasitologie 6. Aufl. Verlag Parey, Stuttgart, S. 444-517 DEPLAZES, P., P. ALTHER, I. TANNER, R. C. THOMPSON u. J. ECKERT (1999): Echinococcus multilocularis coproantigen detection by enzyme-linked immunosorbent assay in fox, dog, and cat populations. J. Parasitol. 85, 115-121 DEPLAZES, P. u. J. ECKERT (1988): Untersuchungen zur Infektion des Hundes mit Taenia hydatigena. Schweiz. Arch. Tierheilkd 130, 289-306 DEPLAZES, P., F. GUSCETTI, E. WUNDERLIN, H. BUCKLAR, J. SKAGGS u. K. WOLFF (1995): Endoparasitenbefall bei Findel- und Verzicht-Hunden in der Südschweiz. Schweiz. Arch. Tierheilkd 137, 172-179 DESPOMMIER, D. (2003): Toxocariasis: clinical aspects, epidemiology, medical ecology, and molecular aspects. Clin. Microbiol. Rev. 16, 265-272 DIEFFENBACHER, F. (2006): Untersuchung zur Parasitenfauna von verwilderten Hauskatzen und deren Behandlung mit Selamectin und Praziquantel. Berlin, Freie Univ., Fachber. Veterinärmed., Diss. 134 10 Literaturverzeichnis DRYDEN, M. W., P. A. PAYNE u. V. SMITH (2006): Accurate diagnosis of Giardia spp. and proper fecal examination procedures. Vet. Ther. 7, 4-14 DUBEY, J. P. (1986): Toxoplasmosis in cats. Feline Pract. 16, 12-45 DUBEY, J. P. (1993): Toxoplasma, Neospora, Sarcocystis and other tissue-cyst-forming coccidia of humans and animals. In: J. P. KREIER (Hrsg.): Parasitic Protozoa. Bd. 6, 2. Aufl., Academic Press, New York, S. 1-158 DUBEY, J. P. (1995): Duration of immunity to shedding of Toxoplasma gondii oocysts by cats. J. Parasitol. 81, 410-415 DUBEY, J. P. (1996): Infectivity and pathogenicity of Toxoplasma gondii oocysts for cats. J. Parasitol. 82, 957-961 DUBEY, J. P. (1998): Toxoplasmosis, sarcocystiosis, isosporosis, and cyclosporosis. In: S. R. PALMER, E. J. L. SOULSBY u. D. I. H. SIMPSON (Hrsg.): Zoonoses Oxford University Press, Oxford, S. 579-597 DUBEY, J.P. u. C. P. BEATTIE (1988): Toxoplasmosis of Animals and Man. CRC Press, Boca Raton, Florida DUBEY, J. P., B. C. BARR, J. R. BARTA, I. BJERKÅS, C. BJÖRKMAN, B. L. BLAGBURN, D. D. BOWMAN, D. BUXTON, J. T. ELLIS, B. GOTTSTEIN, A. HEMPHILL, D. E. HILL, D. K. HOWE, M. C. JENKINS, Y. KOBAYASHI, B. KOUDELA, A. E. MARSH, J. G. MATTSSON, M. M. McALLISTER, D. MODRY, Y. OMATA, L. D. SIBLEY, C. A. SPEER, A. J. TREES, A. UGGLA, S. J. UPTON, D. J. WILLIAMS u. D. S. LINDSAY (2002): Redescription of Neospora caninum and its differentiation from related coccidia. Int. J. Parasitol. 32, 929-946 135 10 Literaturverzeichnis DUBEY, J. P. u. J. K. FRENKEL (1976): Feline toxoplasmosis from acutely infected mice and the development of Toxoplasma cysts. J. Protozool. 23, 537-546 DUBEY, J. P., M. R. LAPPIN u. P. THULLIEZ (1995): Long-term antibody responses of cats fed toxoplasma gondii tissue cysts. J. Parasitol. 81, 887-893 DUBEY, J. P., G. SCHARES u. L. M. ORTEGA-MORA (2007): Epidemiology and control of neosporosis and Neospora caninum. Clin. Microbiol. Rev. 20, 323-367 DUBNÁ, S., I. LANGROVÁ, J. NÁPRAVNÍK, I. JANKOVSKÁ, J. VADLEJCH, S. PEKÁR u. J. FECHTNER (2007): The prevalence of intestinal parasites in dogs from Prague, rural areas, and shelters of the Czech Republic. Vet. Parasitol. 145, 120-128 DYACHENKO, V., N. PANTCHEV, S. GAWLOWSKA, M. G. VRHOVEC u. C. BAUER (2008): Echinococcus multilocularis infections in domestic dogs and cats from Germany and other European countries. Vet. Parasitol. 157, 244-253 ECKERT, J. u. P. DEPLAZES (2004): Biological, epidemiological, and clinical aspects of echinococcosis, a zoonosis of increasing concern. Clin. Microbiol. Rev. 17, 107-135 ECKERT, J., P. DEPLAZES, P. S. CRAIG, M. A. GEMMELL, B. GOTTSTEIN, D. HEATH, D. J. JENKINS, M. KAMIYA u. M. LIGHTOWLERS (2001): Echinococcosis in animals: clinical aspects, diagnosis and treatment. In: J. ECKERT, M. A. GEMMELL, F. X. MESLIN, Z. PAWLOWSKI (Hrsg.): WHO/OIE Manual on echinococcosis in humans and animals: a public health problem of global concern. Office International des Epizooties, Paris, S. 72-99 ECKERT, J. u. G. LÄMMLER (1972): Angiostrongylose bei Mensch und Tier. Z. Parasitenkd 39, 303-322 136 10 Literaturverzeichnis ECKERT, J. E., K. T. FRIEDHOFF, H. ZAHNER u. P. DEPLAZES (2008): Lehrbuch der Parasitologie für die Tiermedizin. 2. Aufl. Verlag Enke, Stuttgart EMDE, C. (1988): Zum Endoparasitenbefall bei Hunden in einer westdeutschen Großstadt (Wuppertal). Prakt. Tierarzt 3, 19-23 EMDE, C. (1991): Zum Endoparasitenbefall von Katzen in einer westdeutschen Großstadt (Wuppertal). Kleintier-Prax. 36, 246-262 ENGBÆK, K., H. MADSEN, u. S. OLESEN LARSEN (1984): A survey of helmiths in stray cats from Copenhagen with ecological aspects. Z. Parasitenkd 70, 87-94 EPE, C., N. COATI u. T. SCHNIEDER (2004): Ergebnisse parasitologischer Kotuntersuchungen von Pferden, Wiederkäuern, Schweinen, Hunden, Katzen, Igeln und Kaninchen in den Jahren 1998-2002. Dtsch. Tierärztl. Wochenschrift 111, 243-247 EPE, C., P. DEPLAZES, J. GUILLOT, M. FISHER, C. GENCHI, G. MIRÓ, F. VAN KNAPEN, S.M. THAMSBORG (2007): The ESCCAP Guideline for worm control in dogs and cats. Kongreß der W.A.A.V.P August 2007, ESCCAP Symposium EPE, C., S. ISING-VOLMER u. M. STOYE (1993): Ergebnisse parasitologischer Kotuntersuchungen von Equiden, Hunden, Katzen und Igeln der Jahre 1984-1991. Dtsch. Tierärztl. Wochenschrift 100, 421-460 FAHRION, A. S., S. STAEBLER u. P. DEPLAZES (2008): Patent Toxocara canis infections in previously exposed and in helminth-free dogs after infection with low numbers of embryonated eggs. Vet. Parasitol. 152, 108-115 FAYER, R. (1980): Epidemiology of protozoan infections: The coccidea. Vet. Parasitol. 6, 75-103 137 10 Literaturverzeichnis FEILKE, M. (1985): Untersuchungen über die Möglichkeiten pränataler und galaktogener Infektionen mit Uncinaria stenocephala RAILLIET 1884 (Ancylostomidae) beim Hund (Beagle). Hannover, tierärztl. Hochsch., Diss. FISHER, M. (2003): Toxocara cati: an underestimated zoonotic agent. Trends Parasitol. 19, 167-170 FISHER, M. A., D. E. JACOBS, M. J. HUTCHINSON u. E. M. ABBOTT (1993): Efficacy of fenbendazole and piperazine against developing stages of Toxocara and Toxascaris in dogs. Vet. Rec. 132, 473-475 FOK, É., V. SZATMÁRI, K. BUSÁK u. F. ROZGONYI (2001): Prevalence of intestinal parasites in dogs in some urban and rural areas of Hungary. Vet. Q. 23, 96-98 FOK, É., C. TAKÁTS, B. SMIDOVÁ, S. KECSKEMÉTHY u. M. KARAKAS (1988): Prevalence of intestinal helminthoses in dogs and cats II. Post-mortem examinations. Magy. Állatorvosok Lapja 43, 231-235 FOREYT, W. J. (2001): Veterinary Parasitology, Reference Manual 5. Aufl. Iowa State University Press, Ames, Iowa, S. 17-68 FRENKEL, J. K. (2000): Biology of Toxoplasma gondii. In: P. AMBROISE-THOMAS u. P. E. PETERSEN (Hrsg.): Congenital Toxoplasmosis. Springer Verlag, S. 9-25 FRENKEL, J. K., J. P. DUBEY u. N. L. MILLER (1970): Toxoplasma gondii in cats: fecal stages identified as coccidian oocysts. Science 167, 893-896 FREY, C. F., M. SCHILD, A. HEMPHILL, P. STUNZI, N. MULLER, B. GOTTSTEIN u. I. A. BURGENER (2009): Intestinal Tritrichomonas foetus infection in cats in Switzerland detected by in vitro cultivation and PCR. Parasitol. Res. 104, 783-788 138 10 Literaturverzeichnis FREYRE, A., J. P. DUBEY, D. D. SMITH u. J. K. FRENKEL (1989): Oocyst-induced Toxoplasma gondii infections in cats. J. Parasitol. 75, 750-755 GEISER, B., S. ISING-VOLMER, T. SCHNIEDER u. M. STOYE (1992): Umfang und Ablauf der Larvenausscheidung mit der Milch bei Hündinnen nach unterschiedlich starker Infektion mit Ancylostoma caninum (Ancylostomatidae). Angew. Parasitol. 33, 143-150 GEMMELL, M. A., P. D. JOHNSTONE u. G. OUDEMANS (1977): The effect of praziquantel on Echinococcus granulosus, Taenia hydatigena and Taenia ovis infections in dogs. Res. Vet. Sci. 23, 121-123 GEMMELL, M. A., P. D. JOHNSTONE u. G. OUDEMANS (1980): The effect of route of administration on the efficacy of praziquantel against Echinococcus granulosus infections in dogs. Res. Vet. Sci. 29, 131-132 GETHINGS, P. M., G. L. STEPHENS, J. M. WILLS, P. HOWARD, A. H. BALFOUR, A. I. WRIGHT u. K. L. MORGAN (1987): Prevalence of chlamydia, toxoplasma, toxocara and ringworm in farm cats in south-west England. Vet. Rec. 121, 213-216 GEURDEN, T., D. BERKVENS, S. CASAERT, J. VERCRUYSSE u. E. CLAEREBOUT (2008): A Bayesian evaluation of three diagnostic assays for the detection of Giardia duodenalis in symptomatic and asymptomatic dogs. Vet. Parasitol. 157, 14-20 GILLESPIE, D. (1983): Successful treatment of canine Capillaria plica cystitis. Vet. Med. Small Anim. Clin. 78, 681-682 GONDIM, L. F., M. M. McALLISTER, W. C. PITT u. D. E. ZEMLICKA (2004): Coyotes (Canis latrans) are definitive hosts of Neospora caninum. Int. J. Parasitol. 34, 159-161 139 10 Literaturverzeichnis GORDON, H. M. L. u. H. V. WHITLOCK (1939): A new technique for counting nematode eggs in sheep faeces. J. Counc. Sci. Ind. Res. Aust. 12, 50-52 GOTHE, R. u. I. REICHLER (1990): Zur Befallshäufigkeit von Kokzidien bei Hundefamilien unterschiedlicher Haltung und Rassen in Süddeutschland. Tierärztl. Prax. 18, 407-413 GRANDEMANGE, E., E. CLAEREBOUT, C. GENCHI u. M. FRANC (2007): Field evaluation of the efficacy and the safety of a combination of oxantel/pyrantel/praziquantel in the treatment of naturally acquired gastrointestinal nematode and/or cestode infestations in dogs in Europe. Vet. Parasitol. 145, 94-99 GRANDI, G., L. E. CALVI, L. VENCO, C. PARATICI, C. GENCHI, D. MEMMI u. L. H. KRAMER (2005): Aelurostrongylus abstrusus (cat lungworm) infection in five cats from Italy. Vet. Parasitol. 134, 177-182 GREENE, C. E. u. A. K. PRESTWOOD (1984): Coccidial infections. In: C. E. GREENE (Hrsg.): Clinical Microbiology and Infectious Diseases of the Dog and Cat. W.B. Saunders Company, Philadelphia GUNN-MOORE, D. A., T. M. McCANN, N. REED, K. E. SIMPSON u. B. TENNANT (2007): Prevalence of Tritrichomonas foetus infection in cats with diarrhoea in the UK. J. Feline Med. Surg. 9, 214-218 HABLUETZEL, A., G. TRALDI, S. RUGGIERI, A. R. ATTILI, P. SCUPPA, R. MARCHETTI, G. MENGHINI u. F. ESPOSITO (2003): An estimation of Toxocara canis prevalence in dogs, environmental egg contamination and risk of human infection in the Marche region of Italy. Vet. Parasitol. 113, 243-252 HAMILTON, J. M., A. WEATHERLEY u. A. J. CHAPMAN (1984): Treatment of lungworm disease in the cat with fenbendazole. Vet. Rec. 114, 40-41 140 10 Literaturverzeichnis HANSEL, U. u. H. J. RUSCHER (1980): Über das Parasitenvorkommen bei wildernden Katzen aus dem Einzugsgebiet einer Tierkörperverwertungsanstalt. Angew. Parasitol. 21, 69-70 HARALABIDIS, S. T., M. G. PAPAZACHARIADOU, A. F. KOUTINAS u. T. S. RALLIS (1988): A survey on the prevalence of gastrointestinal parasites of dogs in the area of Thessaloniki, Greece. J. Helminthol. 62, 45-49 HECKING-VELTMAN, J. S. (1999): Untersuchungen zum Vorkommen von Endo- und Ektoparasiten bei streunenden Katzen im Großraum Mönchengladbach. Hannover, tierärztl. Hochschule, Diss. HECKING-VELTMAN, J. S., A. M. TENTER u. A. DAUGSCHIES (2001): Studien zur Endoparasitenfauna bei streunenden Katzen im Raum Mönchengladbach. Prakt. Tierarzt 82, 563-569 HELLMANN, K., T. KNOPPE, I. RADELOFF u. J. HEINE (2003): The anthelmintic efficacy and the safety of a combination of imidacloprid and moxidectin spot-on in cats and dogs under field conditions in Europe. Parasitol. Res. 90 Suppl 3, S142-143 HEUKELBACH, J. u. H. FELDMEIER (2008): Epidemiological and clinical characteristics of hookworm-related cutaneous larva migrans. Lancet Infect. Dis. 8, 302-309 HIEPE, T., R. BUCHWALD, A. KRÜGER u. W. SCHINDLER (1988): Untersuchungen zum Endoparasitenbefall streunender Katzen Berücksichtigung der Helminthen. Wien. Tierärztl. Monatsschr. 75, 499-503 unter besonderer HINZ, E. u. I. BLATZ (1985): Intestinal helminths of domestic dogs in the Hessian Neckar Valley, Federal Republic of Germany. Int. J. Zoonoses 12, 211-213 141 10 Literaturverzeichnis HOPKINS, T. J. u. P. GYR (1991): Synergism of a combination of febantel and pyrantel embonate against Ancylostoma caninum on dogs. Vet. Med. Rev. 61, 3-9 HOPKINS, T. J., P. GYR u. A. SCHIMMEL (1989): The effect of pyrantel embonate with oxantel embonate-praziquantal, pyrantel embonate with febantel-praziquantal and milbemycin oxime on natural infestations of Ancylostoma caninum in dogs. Aust. Vet. Practitioner 28, 53-56 HÖRCHNER, F., J. UNTERHOLZNER u. K. FRESE (1981): Zum Vorkommen von Toxocara canis und anderer Endoparasiten bei Hunden in Berlin (West). Berl. Münch. Tierärztl. Wochenschr. 94, 220-223 HUMBERT-DROZ, E., G. BUSCHER, D. CAVALLERI u. P. JUNQUERA (2004): Efficacy of milbemycin oxime against fourth-stage larvae and adults of Ancylostoma tubaeforme in experimentally infected cats. Vet. Rec. 154, 140-143 JACKSON, M. H. u. W. M. HUTCHISON (1989): The prevalence and source of Toxoplasma infection in the environment. Adv. Parasitol. 28, 55-105 JACKSON, R., D. LANCE u. K. TOWNSEND (1987): Isolation of anthelmintic resistant Ancylostoma caninum. N. Z. Vet. J. 35, 215-216 JACOBS, D. E. (1987): Control of Toxocara canis in puppies: a comparison of screening techniques and evaluation of a dosing programme. J. Vet. Pharmacol. Ther. 10, 23-29 JACOBS, D. E., A. ARAKAWA, C. H. COURTNEY, M. A. GEMMELL, J. W. McCALL, G. H. MYERS u. O. VANPARIJS (1994): World Association for the Advancement of Veterinary Parasitology (W.A.A.V.P.) guidelines for evaluating the efficacy of anthelmintics for dogs and cats. Vet. Parasitol. 52, 179-202 142 10 Literaturverzeichnis JENKINS, D. J. u. T. ROMIG (2000): Efficacy of Droncit Spot-on (praziquantel) 4 % w/v against immature and mature Echinococcus multilocularis in cats. Int. J. Parasitol. 30, 959-962 JOHANSEN, M. V. (1989): An evaluation of techniques used for the detection of anthelmintic resistance in nematode parasites of domestic livestock. Vet. Res. Commun. 13, 455-466 KAPEL, C. M., P. R. TORGERSON, R. C. THOMPSON u. P. DEPLAZES (2006): Reproductive potential of Echinococcus multilocularis in experimentally infected foxes, dogs, raccoon dogs and cats. Int. J. Parasitol. 36, 79-86 KAPLAN, R. M. (2002): Anthelmintic resistance in nematodes of horses. Vet. Res. 33, 491-507 KAUFMANN, A. (1990): Untersuchungen zum Endoparasitenbefall streunender Berücksichtigung der Helminthen. Berlin, Humboldt-Univ., Vet.-Med. Fak., Diplomarbeit Katzen unter besonderer KING, R. R., E. C. GREINER, N. ACKERMANN u. J. C. WOODARD (1990): Nasal capillariasis in a dog. J. Am. Anim. Hosp. Assoc. 26, 381-385 KIRKPATRICK, C. E. (1988): Epizootiology of Endoparasitic Infections in Pet Dogs and Cats Presented to a Veterinary Teaching Hospital. Vet. Parasitol. 30, 113-124 KLEIN, J. B., R. E. BRADLEY u. D. P. CONWAY (1978): Anthelmintic efficacy of pyrantel pamoate against the roundworm, Toxocara canis, and the hookworm, Ancylostoma caninum, in dogs. Vet. Med. Small Anim. Clin. 73, 1011-1013 143 10 Literaturverzeichnis KNAUS, B. U. u. K. FEHLER (1989): Toxoplasma gondii-Infektionen und Oozystenausscheidung bei Hauskatzen und ihre Bedeutung für die Epidemiologie und Epizootiologie der Toxoplasmose. Angew. Parasitol. 30, 155-160 KOBULEJ, T. u. I. VARGA (1976): Droncit - a milestone in the control of Echinococcus granulosus in dogs. Acta Vet. Acad. Sci. Hung. 26, 351-355 KOPP, S. R., A. C. KOTZE, J. S. McCARTHY u. G. T. COLEMAN (2007): High-level pyrantel resistance in the hookworm Ancylostoma caninum. Vet. Parasitol. 143, 299-304 KOPP, S. R., A. C. KOTZE, J. S. McCARTHY, R. J. TRAUB u. G. T. COLEMAN (2008): Pyrantel in small animal medicine: 30 years on. Vet. J. 178, 177-184 KOPP, S. R., G. T. COLEMAN, R. J. TRAUB, J. S. McCARTHY u. A. C. KOTZE (2009): Acetylcholine receptor subunit genes from Ancylostoma caninum: Altered transcription patterns associated with pyrantel resistance Int. J. Parasitol. 39, 435-441 KOTELNIKOV, G. A. u. A. A. VARENICHEV (1988): Search for effective anthelmintics for opisthorchosis in domestic carnivores, final hosts of Opisthorchis. Med. Parazit. Paraz. Bol. 2, 24-26 KRAEMER, A. (2005): Validierung ausgewählter koproskopischer Untersuchungsmethoden zum direkten Nachweis parasitärer Stadien verschiedener Parasitenspezies der Haussäugetiere. Hannover, tierärztl. Hochschule, Diss. KRAHENBUHL, J. L. u. J. S. REMINGTON (1982): The immunology of Toxoplasma and toxoplasmosis. In: S. COHEN u. K. S. WARREN (Hrsg.): Immunology of Parasitic Infections. Blackwell Scientific Publications, London, S. 356-421 KREBITZ, M. A. (1982): Parasitenbefall von Hund und Katze in einer Tierärztlichen Praxis in Kärnten. Wien, Veterinärmed. Univ., Diss. 144 10 Literaturverzeichnis LAVIKAINEN, A., M. J. LEHTINEN, T. MERI, V. HIRVELA-KOSKI u. S. MERI (2003): Molecular genetic characterization of the Fennoscandian cervid strain, a new genotypic group (G10) of Echinococcus granulosus. Parasitology 127, 207-215 LeNOBEL, W. E., S. R. ROBBEN, D. DOPFER, W. M. HENDRIKX, J. H. BOERSEMA, F. FRANSEN u. M. EYSKER (2004): Infecties met endoparasieten bij honden in Nederlandse dierenasielen (Infections with endoparasites in dogs in Dutch animal shelters). Tijdschr. Diergeneeskd 129, 40-44 LEPP, D. L. u. K. S. TODD (1974): Life cycle of Isospora canis Nemeséri, 1959 in the dog. J. Protozool. 21, 199-206 LILLIS, W. G. (1967): Helminth survey of dogs and cats in New Jersey. J. Parasitol. 53, 1082-1084 LINDQUIST, W. D. (1975): Drug evaluation of pyrantel pamoate against Ancylostoma, Toxocara and Toxascaris in eleven dogs. Am. J. Vet. Res. 36, 1387-1389 LINDSAY, D. S. u. B. L. BLAGBURN (1991): Coccidial parasites of cats and dogs. Compend. Contin. Educ. Pract. Vet. 13, 759-765 LINDSAY, D. S. u. B. L. BLAGBURN (1994): Biology of mammalian Isospora. Parasitol. Today 10, 214-220 LINDSAY, D. S. u. J. P. DUBEY (2000): Canine neosporosis. J. Vet. Parasitol. 14, 1-11 LINDSAY, D. S., J. P. DUBEY u. B. L. BLAGBURN (1997): Biology of Isospora spp. from humans, nonhuman primates, and domestic animals. Clin. Microbiol. Rev. 10, 19-34 145 10 Literaturverzeichnis LLOYD, S. (1998): Toxocarosis. In: S. R. PALMER, E. J. L. SOULSBY u. D. I .H. SIMPSONS (Hrsg.): Zoonoses Oxford University Press, S. 841-854 LOBATO, J., D. A. SILVA, T. W. MINEO, J. D. AMARAL, G. R. SEGUNDO, J. M. COSTACRUZ, M. S. FERREIRA, A. S. BORGES u. J. R. MINEO (2006): Detection of immunoglobulin G antibodies to Neospora caninum in humans: high seropositivity rates in patients who are infected by human immunodeficiency virus or have neurological disorders. Clin. Vaccine Immunol. 13, 84-89 LOHMANN, K. (1985): Verhalten und Pathogenität von Toxocara canis WERNER 1782 (Anisakidae) in der Maus bei unterschiedlicher Infektionsstärke. Hannover, tierärztl. Hochschule, Diss. LOHMANN, K., T. SCHNIEDER U. M. STOYE (1989): Verhalten und Pathogenität der Larven von Toxocara canis WERNER 1782 (Anisakidae) in der Maus. J. Vet. Med. B. 36, 609-618 LUCIUS, R. u. B. LOOS-FRANK (2008): Biologie von Parasiten. 2. Aufl. Verlag Springer, Berlin, Heidelberg LUTY, T. (2001): Prevalence of species of Toxocara in dogs, cats and red foxes from the Poznan region, Poland. J. Helminthol. 75, 153-156 MAIZELS, R. M., SCHABUSSOVA, I., CALLISTER, D.M., NICOLL, G. (2006): Molecular Biology and Immunology of Toxocara canis. In: C. V. HOLLAND u. H. V. SMITH (Hrsg.): Toxocara -The Enigmatic Parasite CAB International, Wallingford, Oxfordshire, UK, S. 3-17 MARTIN, P. J., N. ANDERSON u. R. G. JARRETT (1989): Detecting benzimidazole resistance with faecal egg count reduction tests and in vitro assays. Aust. Vet. J. 66, 236-240 146 10 Literaturverzeichnis MARTIN, R. J., A. P. ROBERTSON u. H. BJØRN (1997): Target sites of anthelmintics. Parasitology 114, 111-124 MARTÍNEZ-MORENO, F. J., S. HERNÁNDEZ, E. LÓPEZ-COBOS, C. BECERRA, I. ACOSTA u. A. MARTÍNEZ-MORENO (2007): Estimation of canine intestinal parasites in Cordoba (Spain) and their risk to public health. Vet. Parasitol. 143, 7-13 McALLISTER, M. M., J. P. DUBEY, D. S. LINDSAY, W. R. JOLLEY, R. A. WILLS u. A. M. McGUIRE (1998): Dogs are definitive hosts of Neospora caninum. Int. J. Parasitol. 28, 1473-1478 McKELLAR, Q. A., P. HARRISON, E. A. GALBRAITH u. H. INGLIS (1990): Pharmacokinetics of fenbendazole in dogs. J. Vet. Pharmacol. Ther. 13, 386-392 MEALEY, K.L., S.A. BENTJEN, J.M. GAY u. G.H. CANTOR (2001): Ivermectin sensitivity in collies is associated with a deletion mutation of the mdr1 gene 5. Pharmacogenetics 11, 727-733 MEHLHORN, H., E. HANSER, A. HARDER, O. HANSEN, N. MENCKE u. R. SCHAPER (2003): Synergistic effects of pyrantel and the febantel metabolite fenbendazole on adult Toxocara canis. Parasitol. Res. 90, 151-153 MERZ-SCHENKER, R., U. FREUDIGER u. B. HÖRNING (1976): Magen-Darmparasiten (Würmer und Protozoen) bei der Hauskatze. Klinische und epidemiologische Bedeutung. Kleintier-Prax. 21, 141-152 MIRÓ, G., M. MATEO, A. MONTOYA, E. VELA u. R. CALONGE (2007): Survey of intestinal parasites in stray dogs in the Madrid area and comparison of the efficacy of three anthelmintics in naturally infected dogs. Parasitol. Res. 100, 317-320 147 10 Literaturverzeichnis MIRÓ, G., A. MONTOYA, S. JIMENEZ, C. FRISUELOS, M. MATEO u. I. FUENTES (2004): Prevalence of antibodies to Toxoplasma gondii and intestinal parasites in stray, farm and household cats in Spain. Vet. Parasitol. 126, 249-255 MONTOYA, J. G. u. O. LIESENFELD (2004): Toxoplasmosis. Lancet 363, 1965-1976 MUGRIDGE, N. B., D. A. MORRISON, A. R. HECKEROTH, A. M. JOHNSON u. A. M. TENTER (1999): Phylogenetic analysis based on full-length large subunit ribosomal RNA gene sequence comparison reveals that Neospora caninum is more closely related to Hammondia heydorni than to Toxoplasma gondii. Int. J. Parasitol. 29, 1545-1556 MUNDHENKE, H. E. (1998) Untersuchungen zum Vorkommen von Endoparasiten bei der Katze im Großraum Hannover unter besonderer Berücksichtigung von Toxoplasma gondii. Hannover, tierärztl. Hochschule, Diss. NAM, H. W., S. W. KANG u. W. Y. CHOI (1998): Antibody reaction of human anti-Toxoplasma gondii positive and negative sera with Neospora caninum antigens. Korean J. Parasitol. 36, 269-275 NAYLOR, J. R., J. M. HAMILTON u. A. J. WEATHERLEY (1984): Changes in the ultrastructure of feline pulmonary arteries following infection with the lungworm Aelurostrongylus abstrusus. Br. Vet. J. 140, 181-190 NICHOL, S., S. J. BALL u. K. R. SNOW (1981): Prevalence of intestinal parasites in domestic cats from the London area. Vet. Rec. 109, 252-253 NOLAN, T. J. u. G. SMITH (1995): Time series analysis of the prevalence of endoparasitic infections in cats and dogs presented to a veterinary teaching hospital. Vet. Parasitol. 59, 87-96 148 10 Literaturverzeichnis O´SULLIVAN, E. (1997): Helminth infections in owned and stray dogs in Co. Cork, Ireland. Ir. Vet. J. 50, 108-110 O'LORCAIN, P. (1994): Epidemiology of Toxocara spp. in stray dogs and cats in Dublin, Ireland. J. Helminthol. 68, 331-336 OLSEN, O. W. (1962): Organ distribution of Toxocara canis larvae in normal mice and in mice previously infected with Toxocara, Ascaris or Trichinella. Tex. Rep. Biol. Med. 20, 651-657 ORTUŇO, A., J. CASTELLÀ u. S. ALMERÍA (2002): Seroprevalence of antibodies to Neospora caninum in dogs from Spain. J. Parasitol. 88, 1263-1266 OVERGAAUW, P. A. (1997a): Aspects of Toxocara epidemiology: human toxocarosis. Crit. Rev. Microbiol. 23, 215-231 OVERGAAUW, P. A. (1997b): Aspects of Toxocara epidemiology: toxocarosis in dogs and cats. Crit. Rev. Microbiol. 23, 233-251 OVERGAAUW, P. A. (1997c): Prevalence of intestinal nematodes of dogs and cats in The Netherlands. Vet. Q. 19, 14-17 OVERGAAUW, P. A. u. J. H. BOERSEMA (1998): Nematode infections in dog breeding kennels in The Netherlands, with special reference to Toxocara. Vet. Q. 20, 12-15 PAPAZAHARIADOU, M., A. FOUNTA, E. PAPADOPOULOS, S. CHLIOUNAKIS, K. ANTONIADOU-SOTIRIADOU u. Y. THEODORIDES (2007): Gastrointestinal parasites of shepherd and hunting dogs in the Serres Prefecture, Northern Greece. Vet. Parasitol. 148, 170-173 149 10 Literaturverzeichnis PARSONS, J. C. (1987): Ascarid infections of cats and dogs. Vet. Clin. North Am. Small Anim. Pract. 17, 1307-1339 PAYO-PUENTE, P., M. BOTELHO-DINIS, A. M. CARVAJA URUENA, M. PAYO-PUENTE, J. M. GONZALO-ORDEN u. F. A. ROJO-VAZQUEZ (2008): Prevalence study of the lungworm Aelurostrongylus abstrusus in stray cats of Portugal. J. Feline Med. Surg. 10, 242-246 PEARSON, M., T. H. LE, L. H. ZHANG, D. BLAIR, T. H. N. DAI u. D. P. McMANUS (2002): Molecular Taxonomy and Strain Analysis in Echinococcus. In: P. CRAIG u. Z. PAWLOWSKI (Hrsg.): Cestode Zoonoses: Echinococcosis and Cysticercosis, An Emergent and Global Problem. IOS Press, Amsterdam, Netherlands, S. 205-219 PRICHARD, R. K., C. A. HALL, J. D. KELLY, I. C. MARTIN u. A. D. DONALD (1980): The problem of anthelmintic resistance in nematodes. Aust. Vet. J. 56, 239-251 PROCIV, P. u. J. CROESE (1996): Human enteric infection with Ancylostoma caninum: hookworms reappraised in the light of a "new" zoonosis. Acta Trop. 62, 23-44 PULLOLA, T., J. VIERIMAA, S. SAARI, A. M. VIRTALA, S. NIKANDER u. A. SUKURA (2006): Canine intestinal helminths in Finland: prevalence, risk factors and endoparasite control practices. Vet. Parasitol. 140, 321-326 RASCHKA, C., W. HAUPT u. R. RIBBECK (1994): Untersuchungen zum Endoparasitenbefall bei streunenden Katzen. Mh. Vet.-Med. 49, 307-325 RAUSCH, R. L. (1995): Life cycle patterns and geographic distribution of Echinococcus species. In: R. C. A. THOMPSON (Hrsg.): The Biology of Echinococcus and Hydatid Disease. George Allen and Unwin, London, S. 44-80 150 10 Literaturverzeichnis REINEMEYER, C. R. u. R. C. DeNOVO (1990): Evaluation of the efficacy and safety of two formulations of pyrantel pamoate in cats. Am. J. Vet. Res. 51, 932-934 REINEMEYER, C. R., C. T. FAULKNER, A. M. ASSADI-RAD, J. H. BURR u. S. PATTON (1995): Comparison of the efficacies of three heartworm preventives against experimentally induced infections with Ancylostoma caninum and Toxocara canis in pups. J. Am. Vet. Med. Assoc. 206, 1710-1715 RIDLEY, R. K. u. M. W. DRYDEN (1993): Anthelmintic resistance to roundworms and hookworms in greyhound kennels. In: Proc. 38th Meet. Am. Ass. Vet. Parasitologists, Minneapolis, Abstr. 39 RIDLEY, R. K., K. S. TERHUNE u. D. E. GRANSTROM (1991): The efficacy of pyrantel pamoate against ascarids and hookworms in cats. Vet. Res. Commun. 15, 37-44 ROBBEN, S. R., W. E. LeNOBEL, D. DOPFER, W. M. HENDRIKX, J. H. BOERSEMA, F. FRANSEN u. M. E. EYSKER (2004): Infecties met helminthen en/of protozoen bij katten in asielen in Nederland (Infections with helminths and/or protozoa in cats in animal shelters in the Netherlands). Tijdschr. Diergeneeskd 129, 2-6 ROBERSON, E. L. u. T. M. BURKE (1980): Evaluation of granulated fenbendazole (22.2 %) against induced and naturally occurring helminth infections in cats. Am. J. Vet. Res. 41, 1499-1502 ROBERSON, E. L. u. T. M. BURKE (1982): Evaluation of granulated fenbendazole as a treatment for helminth infections in dogs. J. Am. Vet. Med. Assoc. 180, 53-55 SAGER, H., CH. STEINER MORET, F. GRIMM, P. DEPLAZES, M. G. DOHERR u. B. GOTTSTEIN (2006): Coprological study on intestinal helminths in Swiss dogs: temporal aspects of anthelminthic treatment. Parasitol. Res. 98, 333-338 151 10 Literaturverzeichnis SANCHEZ BRUNI, S. F., D. G. JONES u. Q. A. McKELLAR (2006): Pharmacological approaches towards rationalizing the use of endoparasitic drugs in small animals. J. Vet. Pharmacol. Therap. 29, 443-457 SANGSTER, N. C. u. J. GILL (1999): Pharmacology of anthelmintic resistance. Parasitol. Today 15, 141-146 SARLES, M. P. u. N. R. STOLL (1935): On the resistance of the cat to superimposed infection with the ascarid Toxocara cati. J. Parasitol. 21, 277-291 SCHANTZ, P. M., J. CHAI, P. A. CRAIG, J. ECKERT, D. J. JENKINS, C. N. L. MACPHERSON u. A. THAKUR (1995): Epidemiology and control of hydatid disease. In: R. C. A. THOMPSON u. A. J. LYMBERY (Hrsg.): Echinococcus and hydatid disease. CAB International, Wallingford, United Kingdom, S. 233-331 SCHARES, G., N. PANTCHEV, D. BARUTZKI, A. O. HEYDORN, C. BAUER u. F. J. CONRATHS (2005): Oocysts of Neospora caninum, Hammondia heydorni, Toxoplasma gondii and Hammondia hammondi in faeces collected from dogs in Germany. Int. J. Parasitol. 35, 1525-1537 SCHARES, G., M. G. VRHOVEC, N. PANTCHEV, D. C. HERRMANN u. F. J. CONRATHS (2008): Occurrence of Toxoplasma gondii and Hammondia hammondi oocysts in the faeces of cats from Germany and other European countries. Vet. Parasitol. 152, 34-45 SCHENKER, R., D. BOWMAN, C. EPE, R. CODY, W. SEEWALD, G. STREHLAU u. P. JUNQUERA (2007): Efficacy of a milbemycin oxime-praziquantel combination product against adult and immature stages of Toxocara cati in cats and kittens after induced infection. Vet. Parasitol. 145, 90-93 SCHENKER, R., R. CODY, G. STREHLAU, D. ALEXANDER u. P. JUNQUERA (2006): Comparative effects of milbemycin oxime-based and febantel-pyrantel embonate-based anthelmintic tablets on Toxocara canis egg shedding in naturally infected pups. Vet. Parasitol. 137, 369-373 152 10 Literaturverzeichnis SCHIMMEL, A. u. H. DORN (1989): Wirksamkeit der Kombination Febantel + Pyrantelembonat Multizentrische Feldstudie an Welpen und jungen Hunden. Kleintier-Prax. 43, 89-98 gegen Nematoden: SCHMID, K. u. D. DÜWEL (1990): Zum Einsatz von Fenbendazol (Panacur®-Tabletten ad. us. vet.) gegen Helminthenbefall bei Katzen. Tierärztl. Umschau 45, 868-875 SCHNIEDER, T. u. C. EPE (2004a): Handbuch zum Qualitätsmanagement, Tierärztliche Hochschule Hannover, Institut für Parasitologie, Standard Operating Procedures, Geräte/ Methoden/ Verfahrensanweisungen 10.01, Eizählung nach McMaster SCHNIEDER, T. u. C. EPE (2004b): Handbuch zum Qualitätsmanagement, Tierärztliche Hochschule Hannover, Institut für Parasitologie, Standard Operating Procedures, Geräte/ Methoden/ Verfahrensanweisungen 10.02, Kotuntersuchung mit kombiniertem Sedimentations - / Flotationsverfahren SCHÖN, J. u. M. STOYE (1986): Pränatale und galaktogene Infektionen mit Toxocara mystax ZEDER 1800 (Anisakidae) bei der Maus. Zentralbl. Veterinärmed. B 33, 397-412 SCHUSTER, R., A. KAUFMANN u. S. HERING (1997): Untersuchungen zur Endoparasitenfauna der Hauskatze in Ostbrandenburg. Berl. Münch. Tierärztl. Wochenschr. 110, 48-50 SEELIGER, U. (1999): Feldstudie zur Epidemiologie und Bekämpfung der Isosporose des Hundes. Hannover, tierärztl. Hochschule, Diss. SEILER, M., J. ECKERT u. K. WOLFF (1983): Giardia und andere Darmparasiten bei Hund und Katze in der Schweiz. Schweiz. Arch. Tierheilkd 125, 137-148 SMITH, R. E. (1980): Feline lungworm infection. Vet. Rec. 107, 256 153 10 Literaturverzeichnis SOWEMIMO, O. A. u. S. O. ASAOLU (2008): Epidemiology of intestinal helminth parasites of dogs in Ibadan, Nigeria. J. Helminthol. 82, 89-93 SPRENT, J. F. (1952): On the migratory behavior of the larvae of various Ascaris species in white mice. I. Distribution of larvae in tissues. J. Infect. Dis. 90, 165-176 SPRENT, J. F. (1956): The life history and development of Toxocara cati SCHRANK 1788 in the domestic cat. Parasitology 46, 54-78 SPRENT, J. F. (1959): The life history and development of Toxascaris leonina VON LINSTOW 1902 in the dog and cat. Parasitology 49, 330-371 STAUB, M. (2004): Untersuchungen zur Prävalenz und Epidemiologie von Neospora-Infektionen bei Hunden in Rheinland-Pfalz (Kreis Mayen-Koblenz). Hannover, tierärztl. Hochschule, Diss. STEFFE, G. A. (1983): Zum Verhalten galaktogen übertragener Larven von Ancylostoma caninum ERCOLANI 1859 (Ancylostomidae), Toxocara canis WERNER 1782 und Toxascaris leonina LINSTOW 1902 (Ascaridae) in der Maus. Hannover, tierärztl. Hochschule, Diss. STOCKDALE, H. D., M. D. GIVENS, C. C. DYKSTRA u. B. L. BLAGBURN (2009): Tritrichomonas foetus infections in surveyed pet cats. Vet. Parasitol. 160, 13-17 STOYE, M. (1979): Spul- und Hakenwürmer des Hundes - Entwicklung, Epizootiologie, Bekämpfung. Berl. Münch. Tierärztl. Wochenschr. 96, 109-111 STOYE, M. (1983): Askariden- und Ankylostomideninfektionen des Hundes. Tierärztl. Praxis 11, 229-243 154 10 Literaturverzeichnis STOYE, M. (1989): Hundekotentsorgung- parasitologische Aspekte. Dtsch. Tierärztl. Wochenschrift 96, 107-108 STOYE, M. (1992): Biologie, Pathogenität, Diagnostik und Bekämpfung von Ancylostoma caninum. Dtsch. Tierärztl. Wochenschrift 99, 315-321 STOYE, M. u. BÜRGER (1968): Therapogen Praxisdienst: Parasitologische Diagnostik Teil III Therapogenwerk München STOYE, M. u. KRAUSE (1976): Versuche zur Reaktivierung inhibierter Larven von Ancylostoma caninum: Die Wirkung von Östradiol und Progesteron. Zbl. Vet. Med. B 23, 822-839 SUPPERER, R. u. H. K. HINAIDY (1986): Ein Beitrag zum Parasitenbefall der Hunde und Katzen in Österreich. Dtsch. Tierärztl. Wochenschr. 93, 383-386 SWAN, J. M. u. R. C. THOMPSON (1986): The prevalence of Giardia in dogs and cats in Perth, Western Australia. Aust. Vet. J. 63, 110-112 SWERCZEK, T. W., S. W. NIELSEN u. C. F. HELMBOLDT (1971): Transmammary passage of Toxocara cati in the cat. Am. J. Vet. Res. 32, 89-92 SYKES, T. J. u. M. T. FOX (1989): Patterns of infection with Giardia in dogs in London. Trans. R. Soc. Trop. Med. Hyg. 83, 239-240 TAUBERT, A., N. PANTCHEV, M. G. VRHOVEC, C. BAUER u. C. HERMOSILLA (2009): Lungworm infections (Angiostrongylus vasorum, Crenosoma vulpis, Aelurostrongylus abstrusus) in dogs and cats in Germany and Denmark in 2003-2007. Vet. Parasitol. 159, 175-180 TAYLOR, M. A., R. L. COOP u. R. L. WALL (2007): Veterinary Parasitology. 3. Aufl. Blackwell Publishing, Oxford, UK 155 10 Literaturverzeichnis TAYLOR, M. A., K. R. HUNT u. K. L. GOODYEAR (2002): Anthelmintic resistance detection methods. Vet. Parasitol. 103, 183-194 TENTER, A. M. u. P. DEPLAZES (2006): Protozoeninfektionen von Hund und Katze. In: T. SCHNIEDER (Hrsg.): Veterinärmedizinische Parasitologie 6. Aufl. Verlag Parey, Stuttgart, S. 409-443 TENTER, A. M. u. K. FEHLHABER (2002): Toxoplasmose: Eine lebensmittelübertragene Parasitose. Bundesgesundheitsbl. Gesundheitsforsch. Gesundheitsschutz 45, 549-555 TENTER, A. M., A. R. HECKEROTH u. L. M. WEISS (2000): Toxoplasma gondii: from animals to humans. Int. J. Parasitol. 30, 1217-1258 THAKUR, A. S., U. PREZIOSO u. N. MARCHEVSKY (1979): Echinococcus granulosus: ovicidal activity of praziquantel and bunamidine hydrochloride. Exp. Parasitol. 47, 131-133 THIENPONT, D., F. ROCHETTE u. O. F. J. VANPARIJS (1990): Diagnose von Helminthosen durch koproskopische Untersuchung. 2. Aufl. Jansen Research Foundation, Beerse, Belgien THOMPSON, R. C., P. DEPLAZES u. J. ECKERT (2003): Observations on the development of Echinococcus multilocularis in cats. J. Parasitol. 89, 1086-1088 THOMPSON, R. C. u. J. ECKERT (1983): Observations on Echinococcus multilocularis in the definitive host. Z. Parasitenkd 69, 335-345 THOMPSON, R. C., C. M. KAPEL, R. P. HOBBS u. P. DEPLAZES (2006): Comparative development of Echinococcus multilocularis in its definitive hosts. Parasitology 132, 709-716 THOMPSON, R. C. A. (1995): Biology and systematics of Echinococcus. In: R. C. A. THOMPSON u. A. J. LYMBERY (Hrsg.): Echinococcus and hydatid disease. CAB International, Wallingford, United Kingdom, S. 1-50 156 10 Literaturverzeichnis THOMPSON, R. C. A. u. D. P. McMANUS (2002): Towards a taxonomic revision of the genus Echinococcus. Trends Parasitol. 18, 452-457 TODD, A. C., J. CROWLEY, JR., P. SCHOLL u. D. P. CONWAY (1975): Critical tests with pyrantel pamoate against internal parasites in dogs from Wisconsin. Vet. Med. Small Anim. Clin. 70, 936-939 TODD, U. S. u. J. V. ERNST (1979): Coccidia of mammals except man. In: KREIER, K. P. (Hrsg.): Parasitic Protozoa (3). Academic press, London, S. 71-99 TRANAS, J., R. A. HEINZEN, L. M. WEISS u. M. M. McALLISTER (1999): Serological evidence of human infection with the protozoan Neospora caninum. Clin. Diagn. Lab. Immunol. 6, 765-767 TRAVERSA, D. u. C. GUGLIELMINI (2008): Feline aelurostrongylosis and canine angiostrongylosis: A challenging diagnosis for two emerging verminous pneumonia infections. Vet. Parasitol. 157, 163-174 TRAVERSA, D., R. P. LIA, R. IORIO, A. BOARI, P. PARADIES, G. CAPELLI, S. AVOLIO u. D. OTRANTO (2008): Diagnosis and risk factors of Aelurostrongylus abstrusus (Nematoda, Strongylida) infection in cats from Italy. Vet. Parasitol. 153, 182-186 TRAYSER, C. V. u. K. S. TODD (1978): Life cycle of Isospora burrowsi n. sp. (Protozoa: Eimeriidae) from the dog Canis familiaris. Am. J. Vet. Res. 39, 95-98 UNBEHAUEN, I. (1991): Untersuchungen über das Vorkommen von Darmparasiten bei Katzen im Raum Lübeck. Hannover, tierärztl. Hochschule, Diss. UNGEMACH, F. R. (2006): Antiparasitika. In: W. LÖSCHER, F. R. UNGEMACH, R. KROKER (Hrsg.): Pharmakotherapie bei Haus- und Nutztieren 7. Aufl. Verlag Parey, Stuttgart, S. 279-331 157 10 Literaturverzeichnis VÁCLAVEK, P., K. SEDLÁK, L. HÚRKOVÁ, P. VODRÁZKA, R. SEBESTA u. B. KOUDELA (2007): Serological survey of Neospora caninum in dogs in the Czech Republic and a long-term study of dynamics of antibodies. Vet. Parasitol. 143, 35-41 VAN HERWERDEN, L., R. B. GASSER u. D. BLAIR (2000): ITS-1 ribosomal DNA sequence variants are maintained in different species and strains of Echinococcus. Int. J. Parasitol. 30, 157-169 VANPARIJS, O., L. HERMANS u. L. VAN DER FLAES (1991): Helminth and protozoan parasites in dogs and cats in Belgium. Vet. Parasitol. 38, 67-73 VANPARIJS, O. F. u. D. C. THIENPONT (1973): Canine and feline helminth and protozoan infections in Belgium. J. Parasitol. 59, 327-330 VISCO, R. J., R. M. CORWIN u. L. A. SELBY (1977): Effect of age and sex on the prevalence of intestinal parasitism in dogs. J. Am. Vet. Med. Assoc. 170, 835-837 VISCO, R. J., R. M. CORWIN u. L. A. SELBY (1978): Effect of age and sex on the prevalence of intestinal parasitism in cats. J. Am. Vet. Med. Assoc. 172, 797-800 VOGEL, H. (1957): Über den Echinococcus multilocularis Süddeutschlands. I. Das Bandwurmstadium von Stämmen menschlicher und tierischer Herkunft. Z. Tropenmed. Parasitol. 8, 404-454 WADE, C. G., S. H. MERCER, D. I. HEPLER u. T. M. CRAIG (1991): Effect of milbemycin oxime against Ancylostoma caninum in dogs with naturally acquired infection. Am. J. Vet. Res. 52, 951-953 WANHA, K., R. EDELHOFER, C. GABLER-EDUARDO u. H. PROSL (2005): Prevalence of antibodies against Neospora caninum and Toxoplasma gondii in dogs and foxes in Austria. Vet. Parasitol. 128, 189-193 158 10 Literaturverzeichnis WARREN, E. G. (1969): Infections of Toxocara canis in dogs fed infected mouse tissues. Parasitology 59, 837-841 WETZEL, R. (1951): Verbesserte McMaster-Kammer zum Auszählen von Wurmeiern. Tierärztl. Umsch. 6, 209-210 WILSON-HANSON, S. L. u. C. W. PRESCOTT (1982): A survey for parasites in cats. Aust. Vet. J. 59, 194 WOLFF, K. u. J. ECKERT (1979): Giardia-Befall bei Hund und Katze und dessen mögliche Bedeutung für den Menschen. Berl. Münch. Tierärztl. Wochenschr. 92, 479-484 YOUNG, K. E., V. GARZA, K. SNOWDEN, R. J. DOBSON, D. POWELL u. T. M. CRAIG (1999): Parasite diversity and anthelmintic resistance in two herds of horses. Vet. Parasitol. 85, 205-214 ZAJAC, A. M., T. P. LABRANCHE, A. R. DONOGHUE u. T. C. CHU (1998): Efficacy of fenbendazole in the treatment of experimental Giardia infection in dogs. Am. J. Vet. Res. 59, 61-63 ZIMMER, J. F. u. D. B. BURRINGTON (1986): Comparison of four techniques of faecal examination for detecting canine giardiasis. J. Am. Anim. Hosp. Assoc. 22, 161-167 ZIMMERMANN, U., M. D. LÖWENSTEIN u. M. STOYE (1985): Untersuchungen über die Wanderung und Streuung der Larven von Toxocara canis WERNER 1782 (Anisakidae) im definitiven Wirt (Beagle) nach Erst- und Reinfektion. Zentralbl. Vet. Med. B 32, 1-28 ZISLIN, A., M. GOLDSTEIN u. D. HUSTEAD (2002): Prevalence of Giardia in Companion Animal Populations in the USA. In: B. E. OLSON, M. E. OLSON u. P. M. WALLIS (Hrsg.): Giardia, The cosmopolitan parasite. CAB International, Wallingford, Oxon, UK, S. 87-90 159 11 Anhang 11 Anhang 11.1 Fragebogen Abb. 7: Fragebogen, der im Rahmen der Kotuntersuchungen von den Tierheimmitarbeitern zu jedem Tier ausgefüllt wurde Name und Adresse des Tierheimes: 1. Tierart: Hund Katze 2. Name des Tieres: Jahre 3. Alter: 4. Geschlecht: ( männlich geschätzt durch Angaben bekannt) weiblich kastriert 5. Tierkennzeichen (Tätowierung/Mikrochip): 6. Tiernummer: (nicht vom Tierheim auszufüllen) 7. Gewicht: kg 8. Aufgenommen am: (TT/MM/JJ) 9. Grund: Fundtier Abgabetier Beschlagnahmung Sonstiges: 10. Ist ein Vorbericht vom ehemaligen Besitzer zur Entwurmung möglich? Wenn ja, bitte kurz beschreiben: 160 ja nein 11 Anhang 11.2 Tabellen Tabelle 8: Koproskopischer Endoparasitenbefall und Alter von 434 Fund- und Abgabehunden. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Hunde der jeweiligen Altersstufe (%). ≤ 1 Jahr (n=113) > 1 Jahr (n=321) Darmparasiten 23 (20,4 %) 19 (5,9 %) p<0,001 ** T. canis 10 (8,8 %) 8 (2,5 %) p<0,05 * Isospora sp 6 (5,3 %) 5 (1,6 %) p<0,05 * Giardia sp. 3 (2,7 %) 1 (0,3 %) p>0,05 n.s. T. vulpis 1 (0,9 %) 3 (0,9 %) p>0,05 n.s. Hakenwürmer 3 (2,7 %) 1 (0,3 %) p>0,05 n.s. Capillaria spp. 1 (0,9 %) 1 (0,3 %) p>0,05 n.s. T. leonina 0 (0 %) 1 (0,3 %) p>0,05 n.s. hammondiaähnliche Oozysten 0 (0 %) 1 (0,3 %) p>0,05 n.s. Tabelle 9: Signifikanzniveau Koproskopischer Endoparasitenbefall und Alter bei 814 Fund- und Abgabekatzen. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Katzen der jeweiligen Altersstufe (%). ≤ 1 Jahr (n=444) > 1 Jahr (n=370) Signifikanzniveau Darmparasiten 207 (46,6 %) 68 (18,4 %) p<0,001 ** T. cati 175 (39,4 %) 46 (12,4 %) p<0,001 ** Isospora spp. 51 (11,5 %) 12 (3,2 %) p<0,001 ** Capillaria spp. 26 (5,9 %) 15 (4,1 %) p>0,05 n.s. Taeniiden 9 (2,0 %) 8 (2,2 %) p>0,05 n.s. Hakenwürmer 5 (1,1 %) 3 (0,8 %) p>0,05 n.s. Giardia sp. 2 (0,5 %) 4 (1,1 %) p>0,05 n.s. A. abstrusus 6 (1,4 %) 1 (0,3 %) p>0,05 n.s. toxoplasmaähnliche Oozysten 1 (0,2 %) 0 (0 %) p>0,05 n.s. 161 11 Anhang Tabelle 10: Koproskopischer Endoparasitenbefall und Geschlecht bei 443 Fundund Abgabehunden. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Hunde des jeweiligen Geschlechts (%). Männliche Hunde (n= 275) Weibliche Hunde (n=168) Signifikanznivaeu Darmparasiten 25 (9,1 %) 17 (10,1 %) p>0,05 n.s. T. canis 8 (2,9 %) 10 (6,0 %) p>0,05 n.s. Isospora spp. 9 (3,3 %) 2 (1,2 %) p>0,05 n.s. Giardia sp. 3 (1,1 %) 1 (0,6 %) p>0,05 n.s. T. vulpis 3 (1,1 %) 1 (0,6 %) p>0,05 n.s. Hakenwürmer 2 (0,7 %) 2 (1,2 %) p>0,05 n.s. Capillaria spp. 1 (0,4 %) 1 (0,6 %) p>0,05 n.s. 0 (0 %) 1 (0,6 %) p>0,05 n.s. 1 (0,4 %) 0 (0 %) p>0,05 n.s. T. leonina hammondiaähnliche Oozysten Tabelle 11: Koproskopischer Endoparasitenbefall und Geschlecht bei 795 Fundund Abgabekatzen. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Katzen des jeweiligen Geschlechts (%). Männliche Weibliche Katzen Katzen (n=381) (n=414) Darmparasiten 125 (32,8 %) 134 (32,4 %) p>0,05 n.s. T. cati 100 (26,2 %) 107 (25,8 %) p>0,05 n.s. Isospora spp. 32 (8,4 %) 28 (6,8 %) p>0,05 n.s. Capillaria spp. 17 (4,5 %) 21 (5,1 %) p>0,05 n.s. Taeniiden 8 (2,1 %) 7 (1,7 %) p>0,05 n.s. Hakenwürmer 2 (0,5 %) 7 (1,7 %) p>0,05 n.s. Giardia sp. 4 (1,0 %) 1 (0,2 %) p>0,05 n.s. A. abstrusus 3 (0,8 %) 4 (1,0 %) p>0,05 n.s. 162 Signifikanzniveau 11 Anhang Tabelle 12: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 113 Fund- und Abgabehunden mit einem Alter von bis zu einem Lebensjahr. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil (%) befallener Hunde der jeweiligen Aufnahmekategorie. Fundhunde ≤1Jahr Abgabehunde ≤1Jahr Signifikanzniveau (n = 71) (n = 42) Darmparasiten 16 (22,5 %) 7 (16,7 %) p>0,05 n.s. T. canis 8 (11,3 %) 2 (4,8 %) p>0,05 n.s. Isospora spp. 3 (4,2 %) 3 (7,1 %) p>0,05 n.s. Giardia sp. 2 (2,8 %) 1 (2,4 %) p>0,05 n.s. T. vulpis 0 (0,0 %) 1 (2,4 %) p>0,05 n.s. Hakenwürmer 2 (2,8 %) 1 (2,4 %) p>0,05 n.s. Capillaria spp. 1 (1,4 %) 0 (0,0 %) p>0,05 n.s. Tabelle 13: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 321 Fund- und Abgabehunden mit einem Alter von über einem Lebensjahr. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil (%) befallener Hunde der jeweiligen Aufnahmekategorie. Fundhunde >1Jahr (n = 182) Abgabehunde >1Jahr (n = 139) Signifikanzniveau Darmparasiten 16 (8,8 %) 3 (2,2 %) p<0,05 * T. canis 6 (3,3 %) 2 (1,4 %) p>0,05 n.s. Isospora spp. 4 (2,2 %) 1 (0,7 %) p>0,05 n.s. Giardia sp. 1 (0,5 %) 0 (0 %) p>0,05 n.s. T. vulpis 3 (1,6 %) 0 (0 %) p>0,05 n.s. Hakenwürmer 1 (0,5 %) 0 (0 %) p>0,05 n.s. Capillaria spp. 1 (0,5 %) 0 (0 %) p>0,05 n.s. T. leonina 1 (0,5 %) 0 (0 %) p>0,05 n.s. hammondiaähnliche Oozysten 1 (0,5 %) 0 (0 %) p>0,05 n.s. 163 11 Anhang Tabelle 14: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 444 Fund- und Abgabekatzen mit einem Alter bis einschließlich einem Jahr. Angegeben sind die absoluten Zahlen (n) und prozentualen Anteile befallener Katzen (%). Fundkatzen ≤1Jahr (n= 423) Abgabekatzen ≤1Jahr (n=21) Signifikanzniveau Darmparasiten 199 (47,0 %) 8 (38,1 %) p>0,05 n.s. T. cati 168 (39,7 %) 7 (33,3 %) p>0,05 n.s. Isospora spp. 50 (11,8 %) 1 (4,8 %) p>0,05 n.s. Capillaria spp. 25 (5,9 %) 1 (4,8 %) p>0,05 n.s. Taeniiden 8 (1,9 %) 1 (4,8 %) p>0,05 n.s. Hakenwürmer 5 (1,2 %) 0 (0 %) p>0,05 n.s. Giardia sp. 2 (0,5 %) 0 (0 %) p>0,05 n.s. A. abstrusus 6 (1,4 %) 0 (0 %) p>0,05 n.s. toxoplasmaähnliche Oozysten 1 (0,2 %) 0 (0 %) p>0,05 n.s. Tabelle 15: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 370 Fund- und Abgabekatzen mit einem Alter von über einem Jahr. Angegeben sind die absoluten Zahlen (n) und prozentualen Anteile befallener Katzen (%). Fundkatzen >1Jahr (n= 312) Abgabekatzen >1Jahr (n= 58) Darmparasiten 64 (20,5 %) 4 (6,9 %) p<0,05 * T. cati 43 (13,8 %) 3 (5,2 %) p>0,05 n.s. Isospora spp. 12 (3,8 %) 0 (0,0 %) p>0,05 n.s. Capillaria spp. 15 (4,8 %) 0 (0,0 %) p>0,05 n.s. Taeniiden 8 (2,6 %) 0 (0,0 %) p>0,05 n.s. Hakenwürmer 2 (0,6 %) 1 (1,7 %) p>0,05 n.s. Giardia sp. 4 (1,3 %) 0 (0,0 %) p>0,05 n.s. A. abstrusus 1 (0,3 %) 0 (0,0 %) p>0,05 n.s. 164 Signifikanzniveau 11 Anhang Tabelle 16: Ergebnisse aus dem EZRT bei Hunden; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %. Probe Nr. Parasit Antiparasitikum EpGvB EpGnB EZR (%) F 822 T. canis FBZ 33 0 100 H 34 T. canis FBZ 67 0 100 F 823 T. canis FBZ 33 0 100 H 30 T. canis FBZ 67 0 100 H 32 T. canis FBZ 167 0 100 W 867 T. canis FBZ 733 0 100 L 881 T. canis FBZ 2000 0 100 W 887 T. canis FBZ 4033 0 100 W 1117 T. canis FBZ 200 0 100 W 1213 T. canis FBZ 500 0 100 F 1263 T. canis FBZ 3800 0 100 L 950 Hakenwürmer FBZ 33 0 100 F 822 Hakenwürmer FBZ 167 0 100 N 1411 Hakenwürmer FBZ 167 0 100 N 1411 T. vulpis FBZ 33 0 100 W 1379 T. vulpis FBZ 167 0 100 H 34 T. vulpis FBZ 33 0 100 F 759 T. canis PYR 2967 0 100 B 22 T. canis PYR 300 0 100 F 1046 T. leonina PYR 1733 0 100 B 25 Hakenwürmer PYR 33 0 100 165 11 Anhang Tabelle 17: Ergebnisse des EZRT für T. cati mit FBZ bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=27). Probe EpGvB EpGnB EZR (%) Nr. Probe EpGvB EpGnB EZR (%) Nr. F 42 167 0 100 L 660 133 0 100 J 69/a 200 0 100 L 678 833 0 100 J 69/b 133 0 100 L 693 2700 0 100 L 95 800 0 100 L 720 533 0 100 J 100/a 967 0 100 U 778 200 0 100 J 100/b 233 0 100 U 779 8067 0 100 L 189 633 0 100 L 853 5533 0 100 L 203 1067 0 100 V 960 400 0 100 L 245 2600 0 100 C 992 7667 0 100 L 338 533 0 100 F 1100 2567 0 100 L 441 767 0 100 F 1195 3433 0 100 L 444 567 0 100 U 1391 133 0 100 L 602 200 0 100 F 1417 67 0 100 L 633 3267 0 100 166 11 Anhang Tabelle 18: Ergebnisse des EZRT für Capillaria spp. mit FBZ bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)=Eizahlreduktion in %, (n=12). Probe Nr. EpGvB EpGnB EZR (%) L 95 233 0 100 L 245 100 0 100 F 336 33 0 100 L 602 67 0 100 L 659 67 0 100 L 660 33 0 100 U 778 67 0 100 U 779 67 0 100 L 1240 33 0 100 L 1340 33 0 100 L 1341 33 0 100 L 1387 67 0 100 167 11 Anhang Tabelle 19: Ergebnisse des EZRT für T. cati mit MBM-O bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)=Eizahlreduktion in %, (n=27). Probe EpGvB EpGnB EZR (%) Nr. Probe EpGvB EpGnB EZR (%) Nr. R 22 100 0 100 F 935 33 0 100 F 179 533 0 100 C 999 6833 0 100 F 217 1067 0 100 C 1011 133 0 100 F 401 67 0 100 V 1021 3967 0 100 F 402 1733 0 100 V 1098 33 0 100 F 498/a 1800 0 100 V 1145 200 0 100 F 498/b 967 0 100 V 1202 1067 0 100 R 675 867 0 100 F 1233 3467 0 100 V 723 1533 0 100 WL 1250 300 0 100 F 740 300 0 100 C 1273 433 33 92,38 F 756 667 0 100 R 1277 1933 0 100 M 804 1600 0 100 F 1315 67 0 100 V 840 1133 1233 0 V 1418 67 0 100 U 905 1233 0 100 Tabelle 20: Ergebnisse des EZRT für Hakenwürmer mit MBM-O bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=3). 168 Probe Nr. EpGvB EpGnB EZR (%) F 1180 633 0 100 R 1277 33 0 100 F 1315 233 0 100 11 Anhang Tabelle 21: Ergebnisse des EZRT für Capillaria spp. mit MBM-O bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=5). Probe Nr. EpGvB EpGnB EZR (%) V 261 2967 0 100 F 738 33 0 100 F 1180 267 0 100 R 1277 233 0 100 F 1315 400 33 91,75 Tabelle 22: Ergebnisse des EZRT für T. cati mit PYR bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=26). Probe EpGvB EpGnB EZR (%) Nr. Probe EpGvB EpGnB EZR (%) Nr. G 17 333 667 0 L 1061 200 0 100 G 18 100 0 100 L 1082 2833 0 100 V 227 333 0 100 L 1133 2533 0 100 R 889 1533 0 100 V 1144 700 0 100 K 892 12833 0 100 V 1267 567 33 94,18 K 893 6867 0 100 Q 1318 200 0 100 L 932 7533 0 100 L 1363 800 0 100 L 933 3967 0 100 L 1364 33 0 100 L 951 33 0 100 F 1366 1633 0 100 L 953 67 0 100 U 1368 10033 0 100 L 1005 233 0 100 U 1370 2233 0 100 L 1006 9067 0 100 R 1385 133 33 75,19 L 1040 2100 0 100 L 1390 267 0 100 169 11 Anhang Tabelle 23: Ergebnisse des EZRT für Taeniidae mit PZQ bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)=Eizahlreduktion in %, (n=10). 170 Probe Nr. EpGvB EpGnB EZR (%) L 196 133 0 100 R 889 33 0 100 F 1057 <33 0 100 L 1061 <33 0 100 L 1082 <33 0 100 F 1100 67 0 100 V 1250 <33 0 100 L 1341 200 0 100 U 1368 <33 0 100 L 1396 <33 0 100 11 Anhang 11.3 Abbildungsverzeichnis Abb. 1: Abb. 2: Abb. 3: Abb. 4: Abb. 5: Abb. 6: Abb. 7: Die Standorte der beprobten Tierheime in Niedersachsen Konjugat/Abstrichtupfer und SNAP®-Testeinheit des SNAP®Giardia-Tests (Quelle: http://www.idexx.ch/tiergesundheit/praxistests/giardia_includes/pr oductinsert.pdf) Prävalenz (%) von Endoparasiten bei Fund- und Abgabehunden (n=445), bestimmt mit Hilfe des kombinierten SedimentationsFlotationsverfahrens. Die absoluten Zahlen sind in Klammern angegeben (n). Mehrfachbefälle sind einzeln berücksichtigt, daher ist die Summe der positiven Befunde höher als die Gesamtzahl der positiven Proben (n=42). Prävalenz (%) von Endoparasiten bei Fund- und Abgabekatzen (n=837), bestimmt mit Hilfe des kombinierten SedimentationsFlotationsverfahrens. Die absoluten Zahlen sind in Klammern angegeben (n). Mehrfachbefälle sind einzeln berücksichtigt, daher ist die Summe der positiven Befunde höher als die Gesamtzahl der positiven Proben (n=281). Prävalenz (%) von Endoparasiten bei Fund- und Abgabehunden (n=434) in den Altersklassen von bis einschließlich einem Jahr und über einem Jahr. Ein Stern (*) symbolisiert signifikanten Unterschied (p ≤ 0,05); zwei Sterne (**) symbolisieren hochsignifikanten Unterschied (p ≤ 0,001). Prävalenz (%) von Endoparasiten bei Fund- und Abgabekatzen (n=814) in den Altersklassen von bis einschließlich einem Jahr und über einem Jahr. Ein Stern (*) symbolisiert signifikanten Unterschied (p ≤ 0,05); zwei Sterne (**) symbolisieren hochsignifikanten Unterschied (p ≤ 0,001). Fragebogen, der im Rahmen der Kotuntersuchungen von den Tierheimmitarbeitern zu jedem Tier ausgefüllt wurde 55 61 65 66 69 71 160 171 11 Anhang 11.4 Tabellenverzeichnis Tabelle 1: Irrtumswahrscheinlichkeit, Bedeutung und Symbolisierung 63 Tabelle 2 : Kombinationen von Endoparasiten bei Polyinfektionen von 837 Fund- und Abgabekatzen. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Katzen (%). 68 Tabelle 3: Eier- bzw. Oozystenausscheidung pro einem Gramm Kot bei Fundund Abgabehunden. (n=Anzahl der Fund- und Abgabehunde, bei denen eine EpG/OpG für den jeweiligen Parasiten bestimmt werden konnte; Minimum: minimale Anzahl von Eiern bzw. Oozysten pro Gramm Kot; Maximum: maximale Anzahl von Eiern bzw. Oozysten pro Gramm Kot) 75 Tabelle 4: Eier- bzw. Oozystenausscheidung pro einem Gramm Kot bei Fundund Abgabekatzen. (n=Anzahl der Fund- und Abgabekatzen, bei denen eine EpG/OpG für den jeweiligen Parasiten bestimmt werden konnte; Minimum: minimale Anzahl von Eiern bzw. Oozysten pro Gramm Kot; Maximum: maximale Anzahl von Eiern bzw. Oozysten pro Gramm Kot) 76 Tabelle 5: Vergleich des kombinierten Sedimentations-Flotationsverfahrens mit dem IDEXX SNAP® Giardia Test zum Nachweis von GiardiaInfektionen bei 341 Fund- und Abgabehunden; angegeben sind die absoluten Zahlen (n) und prozentualen Anteile (%) der untersuchten Hunde. 81 Tabelle 6: Vergleich des kombinierten Sedimentations-Flotationsverfahrens mit dem IDEXX SNAP® Giardia Test zum Nachweis von GiardiaInfektionen bei 584 Fund- und Abgabekatzen; angegeben sind die absoluten Zahlen (n) und prozentualen Anteile (%) der untersuchten Katzen. 81 Tabelle 7: Nachweis von Parasiten in der Koproskopie bei GiardiaKoproantigen-positiven Katzen (n=40). Angegeben sind die absoluten Häufigkeiten (n) und die prozentualen Anteile befallener Katzen. 82 Tabelle 8: Koproskopischer Endoparasitenbefall und Alter von 434 Fund- und Abgabehunden. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Hunde der jeweiligen Altersstufe (%). 161 Tabelle 9: Koproskopischer Endoparasitenbefall und Alter bei 814 Fund- und Abgabekatzen. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Katzen der jeweiligen Altersstufe (%). 161 Tabelle 10: Koproskopischer Endoparasitenbefall und Geschlecht bei 443 Fund- und Abgabehunden. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Hunde des jeweiligen Geschlechts (%). 162 172 11 Anhang Tabelle 11: Koproskopischer Endoparasitenbefall und Geschlecht bei 795 Fund- und Abgabekatzen. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil befallener Katzen des jeweiligen Geschlechts (%). Tabelle 12: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 113 Fund- und Abgabehunden mit einem Alter von bis zu einem Lebensjahr. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil (%) befallener Hunde der jeweiligen Aufnahmekategorie. Tabelle 13: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 321 Fund- und Abgabehunden mit einem Alter von über einem Lebensjahr. Angegeben sind die absoluten Häufigkeiten (n) und der prozentuale Anteil (%) befallener Hunde der jeweiligen Aufnahmekategorie. Tabelle 14: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 444 Fund- und Abgabekatzen mit einem Alter bis einschließlich einem Jahr. Angegeben sind die absoluten Zahlen (n) und prozentualen Anteile befallener Katzen (%). Tabelle 15: Koproskopischer Endoparasitenbefall und Aufnahmegrund bei 370 Fund- und Abgabekatzen mit einem Alter von über einem Jahr. Angegeben sind die absoluten Zahlen (n) und prozentualen Anteile befallener Katzen (%). Tabelle 16: Ergebnisse aus dem EZRT bei Hunden; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %. Tabelle 17: Ergebnisse des EZRT für T. cati mit FBZ bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=27). Tabelle 18: Ergebnisse des EZRT für Capillaria spp. mit FBZ bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)=Eizahlreduktion in %, (n=12). Tabelle 19: Ergebnisse des EZRT für T. cati mit MBM-O bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)=Eizahlreduktion in %, (n=27). Tabelle 20: Ergebnisse des EZRT für Hakenwürmer mit MBM-O bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=3). Tabelle 21: Ergebnisse des EZRT für Capillaria spp. mit MBM-O bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=5). Tabelle 22: Ergebnisse des EZRT für T. cati mit PYR bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)= Eizahlreduktion in %, (n=26). 162 163 163 164 164 165 166 167 168 168 169 169 173 11 Anhang Tabelle 23: Ergebnisse des EZRT für Taeniidae mit PZQ bei Katzen; EpGvB=EpG vor der Behandlung; EpGnB=EpG nach der Behandlung; EZR (%)=Eizahlreduktion in %, (n=10). 174 170 11 Anhang 11.5 Abkürzungsverzeichnis bzw. beziehungsweise ca. zirka °C Grad Celsius EpG Eizahl pro einem Gramm Kot bzw. Eier pro Gramm Kot (als Maßeinheit) et al. lat: et alii e.V. eingetragener Verein EZR Eizahlreduktion (wird angegeben in %) EZRT Eizahlreduktionstest Fa. Firma FBZ Fenbendazol g Gramm xg Vielfaches der Erdbeschleunigung (Gravitation) IFAT Immunfluoreszenz-Antikörpertest kg Kilogramm KGW Körpergewicht lat. lateinisch MBM-O Milbemycinoxim MIFC Merthiolate-Iodine-Flotation-Concentration min Minute mg Milligramm ml Milliliter ML Makrozyklische Laktone OpG Oozystenzahl pro einem Gramm Kot p Irrtumswahrscheinlichkeit bei der Analyse der Ähnlichkeit zweier Datengruppen p.i. lat. post infectionem (nach der Infektion) p.o. lat. per os PYR Pyrantel PZQ Praziquantel 175 11 Anhang sp. lat. species (Spezies, Art) spp. mehrere species (mehrere Spezies, Arten) syn. synonym v.a. vor allem W.A.A.V.P. World Association Parasitology z.B. zum Beispiel z.T. zum Teil 176 for the Advancement of Veterinary 11 Anhang Danksagung Zu guter Letzt möchte ich mich bei all jenen bedanken, die das Entstehen dieser Arbeit erleichtert, unterstützt oder überhaupt erst möglich gemacht haben. Mein herzlicher Dank gilt: …Prof. Dr. Thomas Schnieder für die Überlassung des Themas, die Bereitstellung des Arbeitsplatzes, die freundliche Aufnahme in seine Arbeitsgruppe sowie die stets gewährte Möglichkeit eines Gesprächs während der Betreuung der Dissertation. …Dr. Christian Epe für die Einführung in das Thema und zahlreiche Hilfestellungen zu dieser Arbeit. …Claudia Welz, Ph.D., für unermüdliches Korrekturlesen und ihre wertvollen fachlichen Anregungen. …allen MitarbeiterInnen des Instituts für Parasitologie, die zum Gelingen dieser Arbeit beigetragen haben. Dr. Janina Demeler danke ich für ihre Hilfe bei der englischen Übersetzung. Petra Thomas danke ich für die angenehme Arbeitsatmosphäre im Labor. …Prof. L. Kreienbrock, Dr. M. Beyerbach und Herrn J. Schäl vom Institut für Biometrie, Epidemiologie und Informationsverarbeitung der Stiftung Tierärztliche Hochschule Hannover für ihre Beratung. …allen TierheimmitarbeiterInnen und betreuenden TierheimtierärztInnen, die mich bei vorliegender Studie tatkräftig unterstützt haben. …meinen lieben MitdoktorandInnen, hier vor allem zu nennen Kecke, Stefan, Dani und Victor für ihre Unterstützung und Freundschaft und manch schönen Tag zusammen. …allen meinen Freunden für ihre Freundschaft in guten und schlechten Tagen! Mirja, Corina und Jana danke ich für ihre stets wertvollen Anregungen und ihre Unterstützung in jeglicher Lebenslage. Micha danke ich für seine Hilfe bei allen statistischen und epidemiologischen Fragestellungen. Mirja danke ich außerdem für die Durchsicht des Manuskripts und ihre Hilfe bei der Formatierung der Arbeit. …meiner Familie für ihre immerwährende Unterstützung und ihr Vertrauen in mich. Ganz besonders danke ich meinem Bruder Kalle für seine unendliche Geduld und seine grosse Hilfe zu jeder Tages- und Nachtzeit! 177