Probeseiten 1 PDF
Werbung
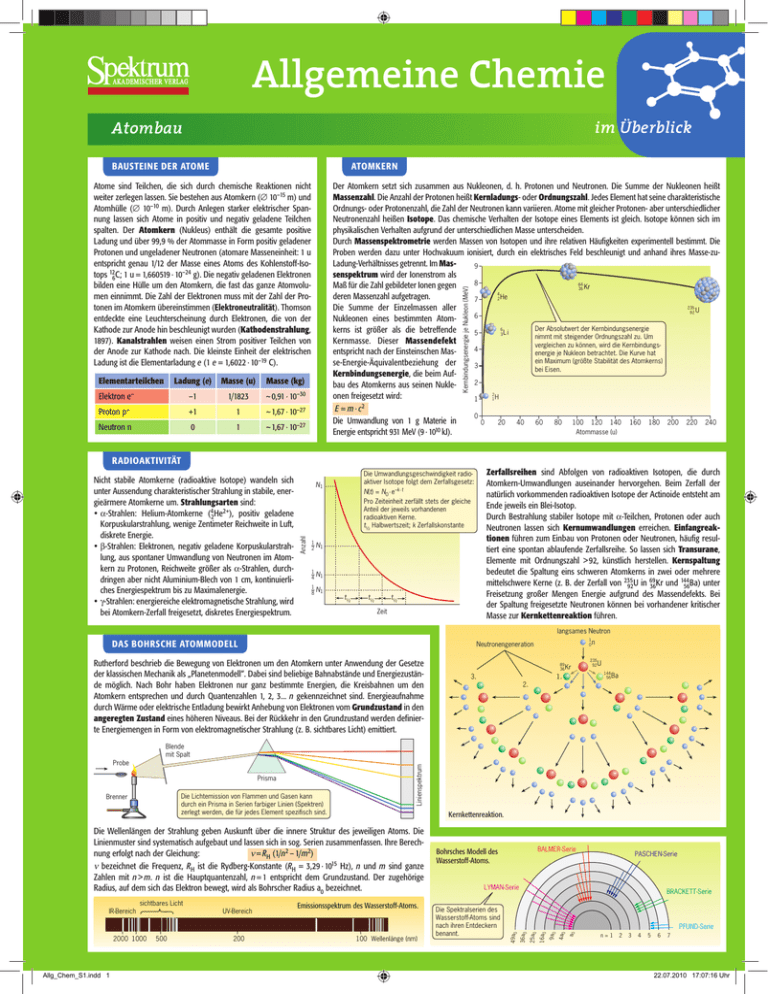
Allgemeine Chemie im Überblick Atombau Atomkern Bausteine der Atome Atome sind Teilchen, die sich durch chemische Reaktionen nicht weiter zerlegen lassen. Sie bestehen aus Atomkern (∆ 10–15 m) und Atomhülle (∆ 10–10 m). Durch Anlegen starker elektrischer Spannung lassen sich Atome in positiv und negativ geladene Teilchen spalten. Der Atomkern (Nukleus) enthält die gesamte positive Ladung und über 99,9 % der Atommasse in Form positiv geladener Protonen und ungeladener Neutronen (atomare Masseneinheit: 1 u entspricht genau 1/12 der Masse eines Atoms des Kohlenstoff-Isotops 126C; 1 u = 1,660519 ∙ 10–24 g). Die negativ geladenen Elektronen bilden eine Hülle um den Atomkern, die fast das ganze Atomvolumen einnimmt. Die Zahl der Elektronen muss mit der Zahl der Protonen im Atomkern übereinstimmen (Elektroneutralität). Thomson entdeckte eine Leuchterscheinung durch Elektronen, die von der Kathode zur Anode hin beschleunigt wurden (Kathodenstrahlung, 1897). Kanalstrahlen weisen einen Strom positiver Teilchen von der Anode zur Kathode nach. Die kleinste Einheit der elektrischen Ladung ist die Elementarladung e (1 e = 1,6022 ∙ 10–19 C). Ladung (e) Masse (u) Masse (kg) Elektron e– –1 1/1823 ~0,91 ∙ 10–30 Proton p+ +1 1 ~1,67 ∙ 10–27 Neutron n 0 1 ~1,67 ∙ 10–27 Kernbindungsenergie je Nukleon (MeV) Elementarteilchen Der Atomkern setzt sich zusammen aus Nukleonen, d. h. Protonen und Neutronen. Die Summe der Nukleonen heißt Massenzahl. Die Anzahl der Protonen heißt Kernladungs- oder Ordnungszahl. Jedes Element hat seine charakteristische Ordnungs- oder Protonenzahl, die Zahl der Neutronen kann variieren. Atome mit gleicher Protonen- aber unterschiedlicher Neutronenzahl heißen Isotope. Das chemische Verhalten der Isotope eines Elements ist gleich. Isotope können sich im physikalischen Verhalten aufgrund der unterschiedlichen Masse unterscheiden. Durch Massenspektrometrie werden Massen von Isotopen und ihre relativen Häufigkeiten experimentell bestimmt. Die Proben werden dazu unter Hochvakuum ionisiert, durch ein elektrisches Feld beschleunigt und anhand ihres Masse-zuLadung-Verhältnisses getrennt. Im Mas9 senspektrum wird der Ionenstrom als 8 84 Maß für die Zahl gebildeter Ionen gegen 36 Kr 4 He deren Massenzahl aufgetragen. 2 7 235 Die Summe der Einzelmassen aller 92 U 6 Nukleonen eines bestimmten AtomDer Absolutwert der Kernbindungsenergie 6 kerns ist größer als die betreffende 5 3L i nimmt mit steigender Ordnungszahl zu. Um Kernmasse. Dieser Massendefekt vergleichen zu können, wird die Kernbindungs4 entspricht nach der Einsteinschen Masenergie je Nukleon betrachtet. Die Kurve hat ein Maximum (größte Stabilität des Atomkerns) se-Energie-Äquivalentbeziehung der 3 bei Eisen. Kernbindungsenergie, die beim Auf2 bau des Atomkerns aus seinen Nukle2 onen freigesetzt wird: 1H 1 2 E = m ∙ c 0 Die Umwandlung von 1 g Materie in 0 20 40 60 80 100 120 140 160 180 200 220 240 10 Atommasse (u) Ener­gie entspricht 931 MeV (9 ∙ 10 kJ). Radioaktivität Zerfallsreihen sind Abfolgen von radioaktiven Isotopen, die durch Atomkern-Umwandlungen auseinander hervorgehen. Beim Zerfall der natürlich vorkommenden radioaktiven Isotope der Actinoide entsteht am Ende jeweils ein Blei-Isotop. Durch Bestrahlung stabiler Isotope mit a-Teilchen, Protonen oder auch Neutronen lassen sich Kernumwandlungen erreichen. Einfangreaktionen führen zum Einbau von Protonen oder Neutronen, häufig resultiert eine spontan ablaufende Zerfallsreihe. So lassen sich Transurane, Elemente mit Ordnungszahl > 92, künstlich herstellen. Kernspaltung bedeutet die Spaltung eins schweren Atomkerns in zwei oder mehrere 69 144 mittelschwere Kerne (z. B. der Zerfall von 235 92U in 36Kr und 56Ba) unter Freisetzung großer Mengen Energie aufgrund des Massendefekts. Bei der Spaltung freigesetzte Neutronen können bei vorhandener kritischer Masse zur Kernkettenreaktion führen. Die Umwandlungsgeschwindigkeit radioaktiver Isotope folgt dem Zerfallsgesetz: N(t) = N0 e–k t N1 • • Pro Zeiteinheit zerfällt stets der gleiche Anteil der jeweils vorhandenen radioaktiven Kerne. t½ Halbwertszeit; k Zerfallskonstante Anzahl Nicht stabile Atomkerne (radioaktive Isotope) wandeln sich unter Aussendung charakteristischer Strahlung in stabile, energieärmere Atomkerne um. Strahlungsarten sind: • a-Strahlen: Helium-Atomkerne (42He2+), positiv geladene Korpuskularstrahlung, wenige Zentimeter Reichweite in Luft, diskrete Energie. • b-Strahlen: Elektronen, negativ geladene Korpuskularstrahlung, aus spontaner Umwandlung von Neutronen im Atomkern zu Protonen, Reichweite größer als a-Strahlen, durchdringen aber nicht Aluminium-Blech von 1 cm, kontinuierliches Energiespektrum bis zu Maximalenergie. • g-Strahlen: energiereiche elektromagnetische Strahlung, wird bei Atomkern-Zerfall freigesetzt, diskretes Energiespektrum. 1 2 N1 1 4 N1 1 8 N1 t½ t½ t½ Zeit langsames Neutron Das Bohrsche Atommodell 1 0 Neutronengeneration Rutherford beschrieb die Bewegung von Elektronen um den Atomkern unter Anwendung der Gesetze der klassischen Mechanik als „Planetenmodell“. Dabei sind beliebige Bahnabstände und Energiezustände möglich. Nach Bohr haben Elektronen nur ganz bestimmte Energien, die Kreisbahnen um den Atomkern entsprechen und durch Quantenzahlen 1, 2, 3... n gekennzeichnet sind. Energieaufnahme durch Wärme oder elektrische Entladung bewirkt Anhebung von Elektronen vom Grundzustand in den angeregten Zustand eines höheren Niveaus. Bei der Rückkehr in den Grundzustand werden definierte Energiemengen in Form von elektromagnetischer Strahlung (z. B. sichtbares Licht) emittiert. 89 36 3. Kr 1. 2. n 235 92 U 144 56 Ba Kernkettenreaktion. Allg_Chem_S1.indd 1 200 100 Wellenlänge (nm) PFUND-Serie a0 500 Die Spektralserien des Wasserstoff-Atoms sind nach ihren Entdeckern benannt. BRACKETT-Serie 4a0 2000 1000 UV-Bereich Emissionsspektrum des Wasserstoff-Atoms. PASCHEN-Serie LYMAN-Serie 9a0 IR-Bereich sichtbares Licht BALMER-Serie Bohrsches Modell des Wasserstoff-Atoms. 16a0 Die Wellenlängen der Strahlung geben Auskunft über die innere Struktur des jeweiligen Atoms. Die Linienmuster sind systematisch aufgebaut und lassen sich in sog. Serien zusammenfassen. Ihre Berechnung erfolgt nach der Gleichung: n = RH (1/n2 – 1/m2) n bezeichnet die Frequenz, RH ist die Rydberg-Konstante (RH = 3,29 ∙ 1015 Hz), n und m sind ganze Zahlen mit n > m. n ist die Hauptquantenzahl, n = 1 entspricht dem Grundzustand. Der zugehörige Radius, auf dem sich das Elektron bewegt, wird als Bohrscher Radius a0 bezeichnet. 25a0 Die Lichtemission von Flammen und Gasen kann durch ein Prisma in Serien farbiger Linien (Spektren) zerlegt werden, die für jedes Element spezifisch sind. Brenner 36a0 Prisma 49a0 Probe Linienspektrum Blende mit Spalt n=1 2 3 4 5 6 7 22.07.2010 17:07:16 Uhr