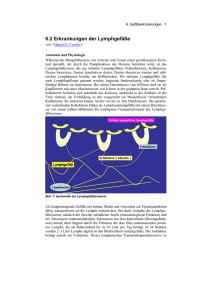
Indirekt-lymphographische Befunde bei Lymphödemen und
Werbung

Aus der Abteilung für Radiologie und Nuklearmedizin der St. Elisabeth-Hospital gGmbH Bochum Direktor: Prof. Dr. med. Dr. h.c. K. U. Tiedjen Indirekt-lymphographische Befunde bei Lymphödemen und Lipödemen der unteren Extremitäten unter besonderer Berücksichtigung ihrer Mischformen Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Siegfried Knorz aus Duisburg 1999 Dekan: Prof. Dr. med. G. Muhr 1. Referent: Prof. Dr. med. Dr. h.c. K. U. Tiedjen 2. Referent: Prof. Dr. med. O. Köster Tag der mündlichen Prüfung: 13.7.2000 - ii - Meinen Eltern - iii - INHALTSVERZEICHNIS 1. Einleitung und Aufgabenstellung .................................................................... 1 2. Grundlagen..................................................................................................... 4 2.1. Historie ........................................................................................................... 4 2.2. Anatomie ........................................................................................................ 5 2.2.1. Lymphkapillaren ............................................................................................. 6 2.2.2. Präkollektoren................................................................................................. 7 2.2.3. Lymphkollektoren ........................................................................................... 7 2.2.4. Lymphstämme............................................................................................... 8 2.3. Physiologie des Lymphgefäßsystems........................................................... 9 2.3.1. Lymphpflichtige Lasten .................................................................................. 9 2.3.2. Lymphtransport ............................................................................................ 12 2.4. Pathophysiologie des Lymphgefäßsystems................................................ 14 2.4.1. Die Insuffizienz des Lymphgefäßsystems................................................... 14 2.4.2. Das Lymphödem.......................................................................................... 17 2.4.3. Kompensationsmechanismen bei Lymphostase........................................ 18 2.4.4. Klassifikation der Lymphoedeme................................................................. 19 2.4.5. Klinik lymphostatischer Ödeme................................................................... 22 2.4.6. Epidemiologie und Geschlechtsverteilung................................................... 22 2.5. Lipödem........................................................................................................ 23 2.5.1. Pathophysiologie des Lipödems .................................................................. 24 2.6. Chronische Veneninsuffizienz (CVI) ............................................................ 24 2.7. Bildgebende Verfahren zur Diagnostik des Lymphgefäßsystems .............. 26 2.7.1. Patentblau - Farbstofftest............................................................................. 26 2.7.2. Direkte Lymphographie ................................................................................ 27 2.7.3. Computertomographie ................................................................................. 29 2.7.4. Sonographie ................................................................................................. 30 - iv - 2.7.5. Magnetresonanztomographie ...................................................................... 31 2.7.6. Fluoreszenz-Mikro-Lymphangiographie....................................................... 32 2.7.7. Isotopenlymphographie ................................................................................ 34 2.7.8. Kapillarszintigraphie ..................................................................................... 36 3. Material und Methode ................................................................................... 37 3.1. Material ......................................................................................................... 38 3.1.1. Patienten ...................................................................................................... 38 3.2. Methode (Indirekte Lymphographie)............................................................. 40 3.2.1. Eigene Methode (Indirekte Xero-Lymphographie)........................................ 40 3.2.2. Kontrastmittel ............................................................................................... 41 3.2.3. Xeroradiographie .......................................................................................... 43 3.2.4. Computertomographie ................................................................................. 47 3.2.5. CT-3D-Rekonstruktion ................................................................................. 47 3.2.6. Digitale Bildverstärker-Radiographie............................................................ 47 3.2.7. Konventionelle Röntgenaufnahmen ............................................................. 48 3.2.8. Folienlose Werkstoffilme.............................................................................. 49 3.2.9. Mammographiefilme..................................................................................... 49 3.2.10. Kernspintomographie................................................................................... 50 3.2.11. Digitale Speicherfolienradiographie.............................................................. 50 3.2.12. Isotopenlymphographie ................................................................................ 52 4. Eigene Untersuchungen............................................................................... 53 4.1. Morphologische Befunde bei der indirekten Lymphographie mit Xeroradiographie-Bildokumentation ............................................................. 53 4.1.1. Extremitäten mit Normalbefund ................................................................... 58 4.1.1.1. Beispiel......................................................................................................... 58 4.1.1.2. Morphologische Befunde.............................................................................. 59 4.1.2. Extremitäten mit chronischen Lymphödemen............................................. 62 4.1.2.1. Beispiel......................................................................................................... 62 4.1.2.2. Morphologische Befunde.............................................................................. 63 -v- 4.1.3. Extremitäten mit Lipödem ............................................................................ 66 4.1.3.1. Beispiel......................................................................................................... 66 4.1.3.2. Morphologische Befunde.............................................................................. 67 4.1.4. Extremitäten mit Lipo-Lymphödemen.......................................................... 69 4.1.4.1. Beispiel......................................................................................................... 69 4.1.4.2. Morphologische Befunde.............................................................................. 70 4.1.5. Extremitäten mit Veno-Lymphödemen ........................................................ 74 4.1.5.1. Beispiel......................................................................................................... 74 4.1.5.2. Morphologische Befunde.............................................................................. 75 4.2. Isotopenlymphographische Befunde............................................................ 77 4.3. Ergebnisse der indirekten Lymphographie mit Xeroradiographie und Isotopenlymphographie ................................................................................ 78 4.3.1. Normalbefunde............................................................................................. 78 4.3.2. Lymphödeme ............................................................................................... 79 4.3.3. Lipödeme...................................................................................................... 83 4.3.4. Lipo-Lymphödeme ....................................................................................... 83 4.3.5. Lymphödem bei CVI..................................................................................... 86 4.4. Validität ......................................................................................................... 88 4.5. Alternative Bildgebung.................................................................................. 89 4.5.1. Indirekte Lymphographie mit Bildverstärkerradiographie............................. 89 4.5.2. Indirekte Lymphographie mit Speicherfolienradiographie ............................ 90 4.5.3. Indirekte Lymphographie und Computertomographie.................................. 93 4.5.4. Indirekte Lymphographie und CT-3D-Rekonstruktion.................................. 94 4.5.5. Indirekte Lymphographie und Magnetresonanztomographie....................... 96 5. Diskussion.................................................................................................... 98 5.1. Andere Untersuchungen .............................................................................. 98 5.2. Morphologische Befunde der Xero-Lymphographie..................................... 99 5.3. Kontrastmittel/Nebenwirkungen ................................................................. 103 5.4. Bildgebung bei der Indirekten Lymphographie ........................................... 104 - vi - 5.5. Isotopenlymphographie .............................................................................. 106 5.6. Grenzen der Methode (Indirekte Lymphographie)...................................... 107 5.7. Wertigkeit der indirekten Lymphographie................................................... 109 6. Zusammenfassung .................................................................................... 112 Literaturverzeichnis .................................................................................................. 115 - vii - Verzeichnis der Abkürzungen BKD = Blutkapillardruck BMI = Body-Mass-Index BV = Bildverstärker CT = Computertomographie CVI = Chronische venöse Insuffizienz ECT = Emissionscomputertomographie FITC = Fluoreszinisothiocyanat G = Gauge HE = Hounsfield-Einheiten ID = Interstitieller Druck ILG = Isotopenlymphographie KM = Kontrastmittel KPE = Komplexe physikalische Entstauungstherapie MBq = Mega-Bequerel mGy = Milli-Gray MRT = Magnetresonanztomographie NPY = Neuropeptid Y VIP = Vasoaktive intestinale Polypeptide Xero = Xeroradiographie - viii - 1. Einleitung und Aufgabenstellung In der Differentialdiagnose von Ödemen der unteren Extremitäten kommt eine Vielzahl von Erkrankungen als auslösende Ursache in Betracht. Die große Gruppe der ”Internistischen Ödeme” umfaßt neben einer kardialen Genese endokrinologische Störungen, Erkrankungen der Niere, Entzündungen sowie hyponkotische Ödeme. Als neurogene Ursachen kommen zentrale und periphere Paresen in Betracht. Eine mögliche traumatische, postoperative oder tumorbedingte Genese muß ebenso bedacht werden, wie das mögliche Vorliegen einer vasalen Erkrankung (chronische venöse Insuffizienz, primäres oder sekundäres Lymphödem). Die generalisierten Ödeme der Frau (zyklisch-idiopathisches Ödem, prämenstruelles Syndrom) gehören ebenso zur Differentialdiagnose, wie das durch einen C1-Esterase-Inhibitor-Mangel bedingte angioneurotische Ödem. Weiterhin muß das Lipödem (Allen u. Hines, 1940), insbesondere bei symmetrischen Schwellungen der unteren Extremitäten, in die differentialdiagnostischen Überlegungen mit einbezogen werden. Alle genannten Erkrankungen können zu einer Vermehrung der interstitiellen Flüssigkeit führen. Ein chronisches sichtbares oder tastbares Ödem entsteht erst, wenn das Lympgefäßsystem überlastet, oder zusätzlich geschädigt ist (siehe Kapitel : Pathophysiologie). Das Lymphgefäßsystem ist in jedem Fall in den Prozeß der Ödembildung mit einbezogen. Die indirekte Lymphographie ermöglicht die Darstellung von Teilen Lymphgefäßsystems. So können mit dieser Methode Lymphkollektoren des und fakultativ auch initiale Lymphgefäße dargestellt werden. Aufgabe der vorliegenden Arbeit ist die systematische Erfassung von morphologischen Veränderungen der Lymphgefäße bei Ödemen unterschiedlicher Genese. Hierzu wurden die Ergebnisse von Untersuchungen mittels der in unserem Hause etablierten Methode der indirekten Lymphographie an einem Patientenkollektiv ausgewertet. Das Verfahren unterscheidet sich u.a. Bildgebung, Wahl und Applikation des hinsichtlich bevorzugter Kontrastmittels von den Untersuchungsverfahren anderer Autoren. -1- Erwartungsgemäß werden Veränderungen an Lymphgebfäßen bei den meisten der oben genannten Ödeme monomorph sein, das heißt, Erkrankungen, die zu einer Vermehrung der interstitiellen Flüssigkeit führen und sekundär eine Überlastung und auch Schädigung des Lymphgefäßssystems nach sich ziehen, können mit dieser Methode in der Regel nicht differenziert werden. Ausnahmen bilden hier die chronische venöse Insuffizienz und das Lipomatosesyndrom. So konnten lymphographisch Destruktionen im präfaszialen Lymphgefäßsystem bei der chronischen venösen Insuffizienz bereits nachgewiesen werden (Nitzsche et al. 1985), des weiteren liegen hierzu indirekt- lymphographische Befunde vor (Partsch 1984, Tiedjen et al. 1992). Beim Lipödem findet sich in der indirekten Lymphographie ein typisches flammenförmiges Injektionsdepot (Partsch et al. 1988). Weiterhin soll untersucht werden, ob sich die indirekte Lymphographie zur Differenzierung zwischen primären und sekundären Lymphödemen eignet. Lassen sich wie in der direkten Lymphographie mit öligen Kontrastmitteln eine Dilatation und Schlängelung, Hypoplasie oder Aplasie (Kinmonth et al. 1957) nachweisen ? Kann die indirekte Lymphographie alleine oder in Kombination mit der Isotopenlymphographie oder xeroradiographischen Gewebeanalyse zwischen einer reinen Überlastung des Lymphgefäßsystems (dynamische Insuffizienz) und einer bereits bestehenden Schädigung der Lymphgefäße (mechanische Insuffizienz) differenzieren ? Als radiologische Bildgebung findet die Xeroradiographie Verwendung, die sich bereits als Nativverfahren in der Diagnostik von Lymphödemen empfohlen hat (Bruna 1981). Neben einer hohen Detailerkennbarkeit ermöglicht diese Methode eine exakte Analyse der Gewebestrukturen und läßt so Rückschlüsse auf die Chronifizierung von Ödemen zu. Welcher Stellenwert kommt dem Verfahren in der Bildgebung bei der indirekten Lymphographie zu und wie ist die Wertigkeit des Verfahrens selbst (NativXeroradiographie) einzuschätzen? Dem gegenübergestellt werden soll auch der Stellenwert der klinischen Untersuchung, so z.B. des Stemmer’schen Hautfaltenzeichens. -2- An Stelle des in manchen Untersuchungen bei der indirekten Lymphographie verwendeten Kontrastmittels Iotrolan (Isovist) wurde unsererseits Iopamidol (Solutrast 200) bevorzugt. Die beiden Kontrastmittel wurden hinsichtlich der Qualität der Kontrastgebung und möglicher Nebenwirungen verglichen. Hierzu wurden bei einigen Patienten beide Substanzen simultan appliziert. Neben der Xeroradiographie wurden z.T. alternative Verfahren zur Bildgebung eingesetzt. Konventionelle Röntgenmethoden wurden modernen bildgebenden Verfahren wie der Computertomographie, digitalen Bildverstärker-Radiographie und digitalen Speicherfolien-Radiographie gegenübergestellt und auf ihre Wertigkeit überprüft. Auch die CT-3D-Rekonstruktion und die Kernspintomographie wurden exemplarisch in Einzelfällen zur Bildgebung bei der indirekten Lymphographie eingesetzt. Können diese Verfahren alternativ zur Xeroradiographie, die in naher Zukunft nicht mehr zur Verfügung stehen wird, sinnvoll eingesetzt werden? Bei allen Patienten wurde zugleich eine Isotopenlymphographie der unteren Extremitäten durchgeführt. Erübrigt sich diese, ebenfalls mit dem Einsatz ionisierender Strahlung einhergehende Untersuchung in Anbetracht der Aussagekraft der indirekten Lymphographie oder, stellt sie eine generell oder im Einzelfall sinnvolle Ergänzung dar? -3- 2. Grundlagen 2.1. Historie Die Existenz des Lymphgefäßsystems war bereits im Altertum bekannt. So berichtet Aristoteles in seinen Schriften über Gebilde, die eine farblose Flüssigkeit enthalten; Hippokrates beschreibt Gefäße, die ”weißes Blut führen”. Für einen Zeitraum von fast zwei Jahrtausenden gerieten diese Erkenntnisse dann in Vergessenheit. Im Jahr 1622 beschrieb der Italiener Asellius (1581-1626) bei der Vivisektion eines Hundes ”weiße Stränge”, aus denen bei der Eröffnung eine ”der Milch oder der Sahne ähnliche Flüssigkeit” floß (Rusznyak 1969). Diese Befunde wurden 1627 von Peirese am Menschen bestätigt. Dies war der Zeitpunkt der Wiederentdeckung und der Beginn der Erforschung des Lymphgefäßsystems. 1651 wurden von Pecquet zum ersten mal Chylusgefäße an einer menschlichen Leiche nachgewiesen. Nachdem Olaus Rudbek den Ductus thoracicus als ”Hauptstamm” beschrieben hatte (1653), und Thomas Bartholinus 1673 die Verbindung des Ductus thoracicus mit der Vena subclavia entdeckt hatte, veröffentlichte Mascagni 1787 mit seiner Schrift ”Vasorum lymphaticorum corporis humani....” die erste systematische Beschreibung des menschlichen Lymphgefäßsystems (Battezzati 1972). Mit dem Nachweis der Eigenkontraktilität der Lymphgefäße durch Sheldon im Jahr 1784 waren gegen Ende des 18. Jahrhunderts die grundlegenden topographisch-anatomischen Studien des Lymphgefäßsystems abgeschlossen. Elektronenmikroskopische Untersuchungen (Casley-Smith 1964, Castenholz 1986) konnten dann die Struktur der prälymphatischen Räume erschließen. Zu den im 20. Jahrhundert entwickelten intravitalen diagnostischen Verfahren am Menschen gehört der Farbstofftest mit Patentblau (Hudack u. Mc. Master, 1933), der heute auf Grund seiner eingeschränkten Aussagefähigkeit und hohen Allergierate obsolet ist. Die 1954 von Kinmonth und Taylor eingeführte direkte Röntgenlymphographie mit öligen Kontrastmitteln bleibt heute onkologischen Fragestellungen vorbehalten und ist in der Diagnostik von Lymphödemen aufgrund der möglichen Komplikationen Fluoreszenz-Mikroangiographie -4- ebenfalls obsolet (Weissleder, H. 1994). Mit der (Bollinger et al. 1985) können kutane Lymphkapillarnetze mikroskopisch untersucht werden, abführende Lymphgefäße kommen nicht zur Darstellung . Im Jahr 1955 führten Hultborn und Mitarbeiter die Lymphszintigraphie mit 198 Au colloidale erstmals in die Klinik ein (Hultborn et al. 1955). Das Verfahren wurde in den folgenden Jahren durch die Einführung vorteilhafterer lymphotroper Kolloide wie Nanokolloide und Zinn-Schwefelkolloide, die sich mit dem 99mTechnetium (Harper et al. 1964) markieren liessen, verbessert und systematisiert (Tiedjen 1989) und eignet sich insbesondere zur Beurteilung der Funktion des Lymphsystems. Nachdem Wenzel und Mitarbeiter (1981) die indirekte Lymphographie mit wasserlöslichen Kontrastmitteln zunächst im Tierversuch erprobt hatten, wurden wenig später erste erfolgreiche Studien am Menschen durchgeführt (Partsch et al. 1984, Wenzel-Hora et al. 1985). In der hiesigen Klinik wird die indirekte Lymphographie seit 1987 in Kombination mit der Xeroradiographie als bildgebendem Verfahren routinemäßig bei lymphangiologischen Fragestellungen durchgeführt. 2.2. Anatomie Das Lymphsystem besteht aus Lymphgefäßen und aus lymphatischem Gewebe, das Lymphgefäßsystem wiederum aus Lymphkapillaren, Präkollektoren, Kollektoren und Lymphstämmen. Lymphkapillaren und Präkollektoren haben eine resorbierende Funktion und werden als ”initiale Lymphgefäße” zusammengefaßt (Berens von Rautenfeld et al. 1984 , Kubik 1993). Lymphkollektoren und Lymphstämme sind ableitende Gefäße. Sie transportieren die Lymphe bis zur Einmündung des Ductus thoracicus in das Venensystem. Ihnen sind Lymphknoten als „Filterstationen“ zwischengeschaltet. Diese gehören als lymphatische Organe ebenso zum lymphatischen Gewebe wie die Schleimhäute des Respirationstraktes, des NasenRachenraumes und des Magen -Darmkanals und das retikuloendotheliale System verschiedener Organe (Leber, Milz, Knochenmark). Das lymphatische Gewebe ist eng in das Immunsystem eingebunden, hier erfolgt die Bildung und Differenzierung von Lymphozyten. -5- Das Lymphsystem wird von einigen Autoren auch in Kompartimente gegliedert (Tiedjen 1989). Dabei bilden die von den Lymphgefäßen drainierten Räume das erste Kompartiment. Die Lymphkollektoren führen zum zweiten Kompartiment, den Lymphknoten. Die großen Lymphstämme schließlich und der Blutkreislauf stellen die Verbindung zum dritten Kompartiment, dem retikuloendothelialen System von Leber, Milz und Knochenmark her. Da die indirekte Lymphographie die Morphologie der die Haut drainierenden Lymphgefäße und deren Veränderungen erschließt, ist die Kenntnis der Anatomie dieser Strukturen (Abb.1) für die Interpretation der Befunde unerläßlich. Epidermis Rete lymphocapillare Corium Subcutis Praecollector Lymphcollector Vas lymphaticum perforans Faszie Vas lymphaticum profundum Muskulatur Abb.1 Mikrostruktur der kutanen Lymphgefäße 2.2.1. Lymphkapillaren Die Lymphkapillaren oder „prelymphatics“ (Casley-Smith 1977) entsprechen Endothelschläuchen mit einer Weite von 10 bis 100 µm und eine Mindestwanddicke von 0,1µm. Die sich überlappenden Endothelzellen sind in mehreren Schichten -6- angeordnet und von einem retikulären Fasernetz umgeben. Von diesem gehen Ankerfilamente aus, die das Gefäß im Bindegewebe fixieren. Diese Fixierung bewirkt eine Weitstellung der Kapillaren und ist eine wichtige Voraussetzung für den Flüssigkeitseinstrom in das Lumen. Die den Lymphkapillaren vorgeschalteten prälymphatischen Kanäle (tissue channels) verfügen nicht über eine Endothelauskleidung und werden nicht zu den eigentlichen Lymphgefäßen gerechnet. Sie verbinden die Lymphkapillaren mit den Blutgefäßen (Hauck 1984). 2.2.2. Präkollektoren Präkollektoren besitzen bereits Klappen und zeigen einen unterschiedlichen Wandaufbau. Die Klappen sind in einem Abstand von 2-3 mm angeordnet und bestimmen die Strömungsrichtung. Die Wand eines jeden Präkollektors enthält sowohl Wandanteile, welche von einer kollagenes Bindegewebe und glatte Muskelzellen enthaltenden Membrana accessoria umgeben sind, als auch solche mit kapillärem Charakter. Hieraus resultiert die resorbierende und zugleich ableitende Funktion der Präkollektoren. Präkollektoren drainieren ein rundes Hautareal von 1,5 - 4 cm Durchmesser, und leiten die Lymphe zu den Kollektoren weiter. Die Hautareale sind überlappend angeordnet und können somit kollateral in mehrere Richtungen drainiert werden. 2.2.3. Lymphkollektoren Die Lymphkollektoren haben im Gegensatz zu den Präkollektoren eine rein ableitende Funktion. Nur vereinzelt konnten interendotheliale Öffnungen nachgewiesen werden. Ihre Wand besteht wie die der Blutgefäße aus drei Schichten : Intima, Media und Adventitia. Zwischen den Schichten sind elastische Fasern angeordnet. In der Intima sind neben Endothelzellen einzelne glatte Muskelzellen und -7- zarte Kollagenfasern angeordnet. Die Media besteht vorwiegend aus Bündeln glatter Muskelzellen und netzartig angeordneten Kollagenfasern. In der Adventitia treten neben glatten Muskelzellen längsverlaufende Bindegewebsbündel und elastische Fasernetze auf. Der Durchmesser der Gefäße liegt zwischen 100 und 600 µm. Im Bereich der unteren Extremitäten enthalten die Lymphkollektoren 80 bis 100 Klappen, die in einem Abstand von 6 bis 20 mm angeordnet sind. Der Abschnitt zwischen zwei Klappen wird auch als Lymphangion bezeichnet (Mislin 1976). Durch die aneinandergereihten Lymphangione erhalten die Kollektoren eine perlschnurartige Konfiguration. In der Wand der Lymphangione befinden sich glatte Muskelzellen, sie besitzen eine Eigenkontraktilität (Castenholz 1986). 2.2.4. Lymphstämme Zu den Lymphstämmen gehören die großen zentralwärts gerichteten Lymphgefäße. Der Ductus thoracicus entsteht aus der Vereinigung von Truncus lymphaticus sinister und Truncus lymphaticus dexter; er drainiert die untere Körperhälfte und mündet in den linken Venenwinkel. Hier münden auch kürzere Lymphstämme, die das Gebiet um die Einmündungsstelle drainieren. Die Lymphe aus der rechten oberen Körperhälfte wird über den Ductus lymphaticus dexter in den rechten Venenwinkel geleitet. Die Wand der Lymphstämme, die keine Lymphknotenstationen mehr passieren, hat den gleichen Aufbau wie die der Lymphkollektoren, sie sind jedoch kaliberstärker. In diesen Gefäßen sind ebenfalls Klappen vorhanden, die den orthograden Fluß der Lymphe beim Gesunden sicherstellen. Die Lymphgefäßklappen sind vorwiegend paarige Semilunarklappen, in der Lunge und im Mesenterium existieren auch vereinzelt Bicuspidalklappen. Es handelt sich um beidseits von Endothel bekleidete Bindegewebsmembranen, die dem Bindegewebspolster der Intima entspringen (Pfleger 1964). Die Klappen der größeren Lymphgefäße sind mehrschichtig und können elastische Fasern enthalten. Sie sind mehr oder weniger regelmäßig angeordnet. Die Entfernung zwischen den einzelnen Klappen ist proportional zur Größe des Lymphgefäßes (Rusznyak 1969). -8- Die Blutversorgung der Lymphgefäße erfolgt durch eigene Vasa vasorum (Evans 1907). Diese entspringen aus Arterien und münden in Venen, die in der Adventitia der Lympkkollektoren verlaufen. Die Lymphkapillaren werden von einem Netz von Blutkapillaren ummantelt. In der Adventitia der Kollektoren bilden vegetative markhaltige und marklose Nervenfasern Plexus , die eine adrenerge Innervation der glatten Muskelzellen vermitteln.Diese Nervenfasern bilden Geflechte, die teils in sensible, teils in motorische Nervenendigungen übergehen. In der Adventitia des Ductus thoracicus wurden kleine Ganglien nachgewiesen (Lawrentjew 1925/26). 2.3. Physiologie des Lymphgefäßsystems 2.3.1. Lymphpflichtige Lasten Die Aufgabe der Lymphgefäße ist der Transport lymphpflichtiger Lasten in das venöse System. Der Begriff ”lymphpflichtige Lasten” wurde von M. Földi 1989 analog zu dem der ”harnpflichtigen Stoffe” geprägt. Es existieren also Substanzen im Körper, die obligat lymphpflichtig sind, und auch bei einer Insuffizienz des Lymphgefäßsystems von keinem anderen Organ entsorgt werden können. Zu den lymphpflichtigen Lasten zählen Eiweiße, Fette, Zellen und Wasser. Der Abtransport von Proteinen ist die wichtigste Aufgabe des Lymphgefäßsystems. Ein vollständiges Versagen dieser Funktion würde bereits nach 24 Stunden letale Folgen haben (Földi, E. 1989). Die im Blut zirkulierende Eiweißmenge beträgt 150200g. Die Hälfte davon verläßt täglich die Blutkapillaren, durchströmt das Interstitium und wird lymphovaskulär in die Blutbahn zurückbefördert. Neben körpereigenen Proteinen ist auch Fremdeiweiß, z.B. injiziertes Serum obligat lymphpflichtig. Das Lymphsystem körperfremdem hat noch Eiweiß eine : In weitere den bedeutende Lymphknoten Funktion induziert gegenüber Fremdeiweiß immunologische Vorgänge. Die lymphpflichtige Zellast bilden neben körpereigenen Blutzellen und abgestorbenen Zellen auch Bakterien, Viren, und gegebenenfalls auch Tumorzellen. Bezüglich -9- letzterer sei auch hier auf die bedeutende immunologische und phagozytäre Funktion der Lymphknoten hingewiesen. Die lymphpflichtige Fettlast hat dem Ductus thoracicus auch den Namen ”Milchbrustgang” gegeben. Die Triglyzeride werden im Darm in Glyzerin und Fettsäuren gespalten, in den Zellen der Darmwand resynthetisiert und als Chylomikronen in das Interstitium abgegeben. Die Chylomikronen sind auf Grund ihrer Größe obligat lymphpflichtig und werden ausnahmslos von den Lymphkapillaren der Darmwand resorbiert. Aus dem ”Starlingschen Gleichgewicht” (Starling 1896) geht hervor, daß bei allen Spezies der durchschnittliche Blutkapillardruck und der kolloidosmotische Druck nahezu identisch sind. Die jedoch vorhandene geringe Differenz bewirkt die ”Ultrafiltration”. Im arteriellen Schenkel liegt der Blutkapillardruck höher als der kolloidosmotische Druck und es erfolgt eine” Druckultrafiltration”. Im venösen kapillären Teil liegt der onkotische Druck höher als der Kapillardruck. Dies bewirkt eine Resorption von Wasser. Das aus den Kapillaren in das Interstitium abgepreßte Ultrafiltrat bezeichnet man als ”Bruttoultrafiltrat”. Hiervon werden 90 % venös resorbiert. Die restlichen 10 % bilden das ”Nettoultrafiltrat”, die lymphpflichtige Wasserlast. Diese wird von den Lymphgefäßen resorbiert und hält das transportierte Eiweiß in Lösung. Das Nettoultrafiltrat (F) errechnet sich aus folgender Formel (Földi, E. 1989): F = k x [(BKD – ID) – σ x (KODPL – KODIF)] k = Blutkapillarfiltrationskoeffizient (Nettoultrafiltrat pro 100 g Gewebe/min, herbeigeführt durch einen Ansteig des Ultrafiltrationsdruckes um 1 mm/Hg) BKD = Blutkapillardruck ID = Interstitieller Druck σ = Kolloidosmotischer Reflexionskoeffizient für Plasmaproteine in der Blutkapillarwand KODP = Kolloidosmotischer Druck des Plasmas L - 10 - KODIF = Kolloidosmotischer Druck der interstitiellen Flüssigkeit - 11 - Eine Erhöhung des Nettoultrafiltrates kann durch folgende Störungen bedingt sein: - aktive Hyperämie, z.B. bei Entzündungen und lokaler Hyperämie mit Erhöhung der Blutkapillarpermeabilität [erhöhter Blutkapillardruck (BKD), erhöhter kolloidosmotischer Druck der interstitiellen Flüssigkeit (KODIF)]. - passive Hyperämie, z.B. bei venöser Insuffizienz [erhöhter Blutkapillardruck (BKD)]. - Hypoproteinämie, z.B. bei Leberzirrhose oder nephrotischem Syndrom [erniedrigter kolloidosmotischer Druck des Plasmas (KODPL)]. - externe Druckerhöhung, z.B. durch Massagen oder Bandagen, führt über eine Erhöhung des interstitiellen Nettoultrafiltrates. Hierauf Druckes (ID) basieren zu einer Abnahme therapeutische des physikalische Therapiestrategien (Komplexe physikalische Entstauungstherapie). 2.3.2. Lymphtransport Zwischen den Endothelzellen der Lymphkapillaren befinden sich interendotheliale Fugen, die den Einstrom von Flüssigkeit und korpuskulären Elementen in die Kapillaren ermöglichen. Dieser Einstrom erfolgt unter physiologischen Bedingungen durch konzenrationsabhängige Diffusion und druckabhängige Reabsorption. Zwischen den Endothelzellen befinden sich ankertauartige Filamente, die bei jeder Erhöhung des Gewebedruckes die Endothelzellen aufspannen, so den Flüssigkeitseinstrom in die Lymphkapillaren erleichtern, und sich bei Erhöhung des intralymphatischen Druckes wieder ventilartig verschließen. Diese Kapillarspalten werden auch als ”inlet valves” bezeichnet (Casley-Smith 1977). Eine weitere wichtige Funktion für den Lymphtransport haben die Klappen der Kollektoren. Sie verhindern einen Rückfluß der Lymphe in die initiale Lymphstrombahn und werden deshalb als ”exit valves” bezeichnet (Casley-Smith). Die von den Lymphkapillaren aufgenommene Gewebeflüßigkeit wird in den Lymphgefäßen und Lymphknoten - 12 - weiter konzentriert. Entsprechend wurde die Lymphe von Donnini und Battezatti (1972) in eine ”tissue lymph” und eine ”lymph proper” eingeteilt. Von wesentlicher Bedeutung für den Lymphtransport ist die Lymphangiomotorik. Dieser Begriff beschreibt die Fähigkeit der Lymphangione, sich zu kontrahieren. Eine Eigenkontraktilität der Lymphgefäße wurde bereits 1784 von Sheldon beobachtet und durch intravitalmikroskopische Beobachtungen an Tieren bestätigt (Carrier 1926, Carleton et al. 1927, Waldeck 1965). Die Innervation der Lymphangione erfogt durch das vegetative Nervensystem. Im Bereich der sympathischen Nervenfasern dienen Noradrenalin, Serotonin und und Neuropeptid Y (NPY) als Überträgerstoffe, als parasympathische Neurotransmitter wurden Acetylcholin und vasoaktive intestinale Polypeptide (VIP) in den Nervenendigungen identifiziert. Weiterhin konnten in dem in der Adventitia der Lymphkollektoren gelegenen Nervengeflecht sensorische Fasern nachgewiesen werden. Letztlich wird die Grundfrequenz der Kontraktionen (10-12/min) dehnungsabhängig gesteigert. Der Dehnungszustand der Lymphangione wird über sogenannte Terminalzellen (analog zu den Pressorezeptorzellen des Sinus caroticus) registriert und bewirkt die pressoregulatorische Autonomie der Klappensegmente. Dieser Vorgang entspricht dem Frank-Starling-Mechanismus des Herzens, der eine Steigerung des Herzeitvolumens in Abhängigkeit von der Dehnung des Vorhofes beschreibt. Des weiteren ist die Frequenz der Lymphangione temperaturabhängig, d.h. eine Temperaturerhöhung, z.B. bei Entzündungen, führt zu einer Frequenzzunahme (Mislin 1961). Die Eigenmotorik der Lymphangione bewirkt bei suffizienten Klappen einen aktiven, orthograden Fluß der Lymphe. Auf Grund der bestehenden Parallelen zur Innervation und Funktion des Herzens werden die Lymphangione auch als ” Mikrolymphherzen” bezeichnet (Földi, E. 1989). Schließlich wird der orthograde Lymphtransport durch weitere Mechanismen unterstützt, die auch im Bereich des venösen Systems eine wichtige Rolle spielen : Gelenk- und Muskelpumpen, arterielle Pulsation im Bereich der Extremitäten, Zwerchfellbewegung und atmungsabhängige Druckschwankungen im Bereich des Thorax. - 13 - Jede Störung des Starlingschen Gleichgewichtes bewirkt eine Erhöhung des Nettoultrafiltrates, d.h. einen Anstieg der lymphpflichtigen Wasserlast. Hierauf reagiert das Lymphsystem kompensatorisch mit einer Erhöhung des Lymphzeitvolumens. Diese, auch unter physiologischen Bedingungen vorhandenen Kompensationsmechanismen, werden als Sicherheitsventilfunktion des Lymphgefäßsystems bezeichnet. Die Steigerung des Lymphzeitvolumens wird gewährleistet durch die oben beschriebene Erhöhung des Lympheinstroms (inlet valves) sowie durch Aktivierung der Lymphangiomotorik (druckabhängige Frequenzsteigerung). Das Lymphgefäßsystem kann so sein Transportvolumen im Bedarfsfall erheblich steigern. Liegt die Menge der physiologischerweise in das Blutgefäßsystem abtransportierten Lymphe bei ca. 2 l/die, so kann das Volumen durch Ausschöpfung der Kompensationsmechanismen bis auf das Zehnfache ansteigen. Bei einem Patienten mit einer Leberzirrhose wurden 25 l/die gemessen (Földi, E.1989). Sind alle Kompensationsmechanismen ausgeschöpft, ist das maximal mögliche Lymphzeitvolumen erreicht. Dieses entspricht der Transportkapazität des Lymphgefäßsystems. Eine Überschreitung der Transportkapazität mündet in eine Insuffizienz des Lymphgefäßsystems. 2.4. Pathophysiologie des Lymphgefäßsystems 2.4.1. Die Insuffizienz des Lymphgefäßsystems Es werden zwei Formen der Insuffizienz des Lymphgefäßsystems unterschieden: eine dynamische und eine mechanische Insuffizienz. Bei der dynamischen Insuffizienz überschreitet das Nettoultrafiltrat die Transportkapazität des Lymphgefäßsystems. Diese Störung wird auch als Hochvolumeninsuffizienz bezeichnet. Hierbei ist das Lymphgefäßsystem selbst vollständig intakt, die anfallende lymphpflichtige Wasserlast oder Wasser -Eiweißlast überschreitet - 14 - jedoch das maximale Lymphzeitvolumen; alle Kompensationsmechanismen im Rahmen der Sicherheitsventilfunktion sind ausgeschöpft. Das Resultat einer dynamischen Insuffizienz ist ein mehr oder weniger eiweißreiches Ödem, je nachdem, ob es sich um eine Störung des Starlingschen Gleichgewichtes mit Erhöhung des Nettoultrafiltrates handelt, oder zusätzlich eine erhöhte Kapillarpermebilität mit Austritt von Eiweiß in das Gewebe (z.B. bei einer Entzündung) besteht. Bei der mechanischen Insuffizienz ist das Lymphgefäßsystem auf Grund einer organischen Schädigung oder funktionellen Beeinträchtigung des Lymphgefäßsystems nicht in der Lage, die unter normalen Bedingungen anfallende lymphpflichtige Wasserlast bzw. Wasser-Eiweißlast abzutransportieren, d.h., die Transportkapazität ist niedriger als die normalerweise anfallende lymphpflichtige Last. Störungen, die eine mechanische Insuffizienz des Lymphgefäßsystems bewirken, können eingeteilt werden in organische und funktionelle Störungen. Ursachen von organischen Störungen sind Klappeninsuffizienzen oder Wandinsuffizienzen. Eine Klappeninsuffizienz kann angeboren oder erworben (z.B. durch Entzündung) sein. Bei einer Klappeninsuffizienz ist der orthograde Lymphabfluß nicht mehr gewährleistet: insuffiziente ”exit valves”. Bei einer Wandinsuffizienz besteht eine Störung im Bereich der Lymphgefäßwände (z.B. entzündlich, rheumatisch, postoperativ oder traumatisch), die zu einem Austritt von Lymphe in das Interstitium führt, oder die Resorption der interstitiellen Flüssigkeit bzw. Proteine erschwert. Lymphangiospasmen und Bei den funktionellen Lymphangioparalysen Störungen unterschieden. werden Ein Lymphgefäßkrampf kann wahrscheinlich durch schmerzbedingte Nervenreizung (Földi 1989) und durch Entzündungsmediatoren (Kinine und Prostaglandine) induziert werden. Aus einem solchen Spasmus resultiert ein völliges Sistieren des Lymphtransportes. Für eine Lymphgefäßparalyse finden sich ursächlich Gifte, Medikamente oder Entzündungsmediatoren (Weissleder et al. 1995). Eine Paralyse der Lymphgefäße bedingt eine maximale Weitstellung der Gefäße mit Versagen des Lymphtransportes. Häufig treten organische und funktionelle Störungen bei der mechanischen Insuffizienz gemeinsam auf (Földi, E. 1989). - 15 - Aus der mechanischen Insuffizienz resultiert in der Regel ein eiweißreiches Ödem. Verletzungen können zu einer Schädigung der Ankerfilamente der Lymphkapillaren, und somit des Systems der ”inlet Valves” führen; auch Entzündungen können die Kapillaren schädigen. So findet man Fibrinthromben in Lymphkapillaren bei der rheumatoiden Arthritis oder perikapilläre Fibrinniederschläge bei der chronischen Veneninsuffizienz (Földi, E. 1989), die eine Behinderung der Eiweißresorption durch die Lymphkapillaren bedingen. Die Kombination von dynamischer und mechanischer Insuffizienz wird als Sicherheitsventilinsuffizienz bezeichnet. Hierbei besteht neben einer mechanischen Insuffizienz mit erniedrigter Transportkapazität zusätzlich eine Erhöhung der lymphpflichtigen Wasser- und Eiweißlast. Das heißt, das bereits unter Ruhebedingungen insuffiziente Lymphgefäßsystem ist bei einer zusätzlichen Erhöhung der lymphpflichtigen Wasser- und Eiweißlast nicht in der Lage, kompensatorisch mit den genannten Sicherheitsventilmechanismen zu reagieren. Bei der Sicherheitsventilinsuffizienz ist die Eiweißaufnahme durch eine Schädigung der Lymphkapillaren (s.o.) behindert, zugleich besteht ein zusätzliches, meist entzündliches, proteinreiches Ödem. Insgesamt ist das Ödem bei dieser kombinierten Störung also besonders eiweißreich. Bei einer Rechtsherzinsuffizienz beteht ein erhöhter zentraler Venendruck. Das venöse System ist nicht in der Lage, die sonst geförderten 90% des Bruttoultrafiltrates abzutransportieren. Hieraus resultiert eine Erhöhung der lymphpflichtigen Wasserlast. Das Lymphgefäßsystem reagiert mit einer Erhöhung des Lymphzeitvolumens durch Einsatz der Sicherheitsventilmechanismen. Erschwerend kommt jedoch hinzu, daß der Druck im linken Venenwinkel und damit im Ductus thoracicus erhöht ist; die Transportkapazität ist reduziert. Erst bei Überschreiten der Transportkapazität entsteht das „cardiale” Ödem. Diese Störung wird als hämodynamische Insuffizienz des Lymphgefäßsystems bezeichnet. - 16 - 2.4.2. Das Lymphödem Unter „Ödem” versteht man eine sicht- oder tastbare Schwellung, welche durch eine Vermehrung der interstitiellen Flüssigkeit bedingt ist. Es werden lokale und generalisierte, eiweißreiche und eiweißarme, intrazelluläre und extrazelluläre Ödeme unterschieden. Intrazelluläre Ödeme führen nicht zu einer äußerlich sichtbaren Schwellung. Das Lymphödem oder lymphostatische Ödem ist definiert als das eiweißreiche Ödem bei der mechanischen Insuffizienz des Lymphgefäßsystems. Es handel sich hier um eine eigenständige Erkrankung, während alle anderen Ödeme Folge einer anderen Erkrankung sind. Der Eiweißgehalt der interstitiellen Flüssigkeit beträgt bei eiweißarmen Ödemen weniger als 1g%, beim lymphostatischen Ödem liegt er im Bereich von mehreren Gramm-Prozent. Ödeme führen zu einer Erhöhung des Gewebedruckes mit konsekutiver Behinderung der Diffusionsprozesse zwischen Zellen und Blukapillaren. Das eiweißreiche Ödem hat zusätzlich weitere schwerwiegende Folgen. Die Proteinakkumulation im Interstitium verursacht eine chronische Entzündungsreaktion mit Immigration von Makrophagen und Fibroblasten und Einsproßen von Blut -und Lymphkapillaren in das Bindegewebe mit resultierender Fibrosklerose (Casley-Smith 1983, 1988). Zu den in diesen Prozeß mit einbezogenen Geweben gehören neben der Cutis und Subcutis auch tieferliegende Strukturen wie Bänder (Ausbildung von Ligamentosen), Sehnen (Entwicklung von Tendinosen), Synovia und Gelenkkapseln (Entstehen einer lymphostatischen Arthropathie). Die Lymphgefäße selbst werden ebenfalls geschädigt, es bildet sich eine lymphostatische Lymphangiopathie mit fortschreitender Verminderung der Transportkapazität aus. Letzlich kommt es durch Ablagerung von Proteinen in der Lymphgefäßwand zur Ausbildung einer Lymphangiosklerose. Aus der Mitbeteiligung der Lymphgefäße der Blutkapillaren resultiert eine lymphostatische Hämangiopathie (Solti 1991) . Die Störungen des lokalen Stoffwechsels durch die chronische Entzündung und Bindegewebsproliferation verursacht eine erhöhte Infektanfälligkeit mit gehäuftem Auftreten von Erysipelen. - 17 - 2.4.3. Kompensationsmechanismen bei Lymphostase Auf eine Lymphostase reagiert der Körper mit verschiedenen Kompensationsmechanismen: Bei einer lokalen Schädigung von Lymphgefäßen kommt die Sicherheitsventilfunktion der gesunden Lymphgefäße zum Tragen. Es kommt bei günstigen anatomischen Voraussetzungen zum Entstehen von Umgehungskreisläufen. Bereits zwei Wochen nach Blockade eines Lymphgefäßes bilden sich lympholymphatische Anastomosen distal der Blockadestelle aus (Földi, E. 1989). Zwischen den Lymphgefäßen und den sie begleitenden Venen entstehen ebenfalls distal der Blockade lympho-venöse Anastomosen. Eine weitere Kompensationmöglichkeit bilden die prälymphatischen Kanäle der Blutgefäße. Im Rahmen der lymphatischen Hämangiopathie (s.o.) kommt es zu einer lymphödematösen Aufquellung der Adventitia der Blutgefäße mit Erweiterung der dort vorhandenen Bindegewebskanäle. In diesen Bindegewebskanälen kann Lymphe abtransportiert werden. Bei der Kollateralisation über das Hautorgan selbst, wie in den dieser Arbeit zugrundeliegenden Untersuchungen häufig beobachtet (s.u.), handelt es sich wahrscheinlich auch um eine Kollateralisation über kutane prälymphatische Kanäle. Als extralymphatische zelluläre Plasmaproteinbewältigung bezeichnet Földi (Földi, E. 1989) die Phagozytose von Proteinen durch aus den Blutkapillaren freigesetzte Makrophagen. Diese metabolisieren die phagozytierten Eiweißmoleküle zu Aminosäuren. Die Makrophagen sterben während dieser Tätigkeit jedoch ab und bleiben im Entzündungsgebiet liegen. Als abgestorbene Zellen sind sie obligat lymphpflichtig und erhöhen die lymphpflichtige Last. - 18 - 2.4.4. Klassifikation der Lymphoedeme Von Wirth werden die Lymphoedeme nach klinischen Gesichtspunkten eingeteilt. (Wirth 1984) : A. Primäres Lymphödem 1. kongenital a) hereditär (Nonne, Milroy) b) nicht hereditär 2. erworben a) Lymphoedema praecox (<35 Jahre) b) Lymphoedema tardum (>35 Jahre) c) hereditär (selten) (Meige) B. Sekundäres Lymphödem, bedingt durch 1. Tumor 2. Entzündung 3. Trauma 4. Therapie C. Kombiniertes Lymphödem-Phlebödem, bedingt durch 1. Tumor 2. Entzündung 3. kongenitale Angiodysplasie Kaindl ordnete die Lymphödeme 1960 nach klinischen, radiologischen und histologischen Kriterien wie folgt: A. Primäre Lymphangiopathien 1. Hypoplasie (Aplasie) 2. Lymphangiopathia obliterans 3. Ektasie (umschrieben, diffus) 4. Milroy disease 5. Lymphangitis - 19 - B. Sekundäre Lymphangiopathien 1. sekundäre Rarefizierung bzw. Obliteration 2. Lymphzysten (posttraumatisch) 3. sekundäre Ektasie 4. Lymphgefäßveränderungen beim postthrombotischen Syndrom 5. lokale Schädigung Eine rein an röntgenmorphologischen Gesichtspunkten orientierte Einteilung reduziert die primären Lymphödeme auf drei Erscheinungsformen (Kinmonth et al. 1955, 1957, 1965): 1. Hypoplasie 2. Dilatation und Schlängelung 3. Aplasie Nach Földi (Föld,E. 1993) gibt es vier verschiedene Lymphödemklassifikationen : 1. Benigne und maligne Lymphödeme 2. Primäre und sekundäre Lymphödeme 3. Lymphödeme mit und ohne Reflux 4. Reine, unkomplizierte Lymphödeme und Kombinationsformen Inwieweit sich die von Kaindl und Kinmonth gefundenen röntgenologischen Kriterien wie Aplasie, Lymphographie Hypoplasie, Dilatation bestätigen und lassen, Schlängelung wird später mit der indirekten ausgeführt. Die Lymphödemklassifikationen von Földi scheinen am besten geeignet, wichtige klinische und therapeutische Aspekte des Lymphoedems in Grundzügen darzulegen. Die erste Klassifikation unterscheidet zwischen benignen und malignen Lymphödemen. Zu den malignen Lymphödemen gehören in erster Linie Lymphödeme als Folge von Tumoren. Ursächlich für das Ödem ist hier entweder eine Occlusion des Gefäßes (Lymphangiosis carcinomatosa), oder eine Kompression durch einen Tumor bzw. Tumormetastasen. Auch das Angiosarkom (Stewart-Treves-Syndrom) verursacht ein malignes Lymphoedem. Die Wichtigkeit - 20 - dieser Klassifikation ergibt sich aus der Tatsache, daß bei allen benignen Lymphödemen eine komplexe physikalische Entstauungstherapie angezeigt ist, diese e j doch bei malignen Lymphoedemen relativ kontraindiziert ist (Gefahr der lymphogenen Ausbreitung von Tumorzellen). Im Rahmen der zweiten Klassifikation wird das primäre Lymphödem von den sekundären Formen unterschieden. Das primäre Lymphödem ist Folge einer Dysplasie der Lymphgefäße. Hier gibt es eine Vielzahl von Erkrankungen, die mit einer Hyperplasie (z.B. Bonnevie-Ullrich-Syndrom), Hypoplasie (z.B. TurnerSyndrom), oder einer Hypoplasie und Aplasie (z.B. Nonne-Milroy-Meige-Syndrom) der Lymphgefäße einhergehen. Kinmonth zählt auch die Lymphknotenfibrose ursächlich zu den primären Lymphödemen ( Kinmonth 1980). Von diesen bereits bei Geburt vorhandenen Erkrankungen unterscheidet man Formen, bei denen eine anlagemäßige Hypoplasie der Lymphgefäße besteht, die sich erst im Laufe des Lebens klinisch manifestiert. Als ”Lymphoedema praecox” werden die vor dem 35. Lebensjahr auftretenden Ödeme bezeichnet, als ”Lymphoedema tardum” jene, die erst später klinisch manifest werden. Die dritte Klassifikation unterscheidet Lymphödeme mit und ohne Reflux, d.h. mit und ohne Klappeninsuffizienz. Ein Reflux von Lymphe kann vielfältige Komplikationen nach sich ziehen (z.B. Lymphzysten und -fisteln, Chylurie bis hin zur Herzbeuteltamponade). Die vierte Klassifikation trennt reine, unkomplizierte Lymphödeme von Kombinationsformen (z.B. Lymphödem und Adipositas, Lymphödem und Lipödem, Lymphödem und chronische venöse Insuffizienz). Hierbei kann das Lymphödem bestehende Erkrankungen verschlimmern, oder durch eine andere Erkrankung weiter fortschreiten (u.a. alle Erkrankungen, die mit einer Erhöhung des Bruttoultrafiltrates einhergehen : z.B. Rechtsherzinsuffizienz, Entzündung). - 21 - 2.4.5. Klinik lymphostatischer Ödeme Das von Kaposi bereits im 19. Jahrhundert beschriebene Hautfaltenzeichen (Kaposi 1887), später nach Stemmer benannt (Stemmer 1976), ist ein wichtiges Kriterium bei der Differentialdiagnose von Lymphödemen. Es beinhaltet eine erschwerte oder fehlende Faltbarkeit und Abhebbarkeit der Haut der proximalen Zehen- oder Fingerrücken. Nach Földi ist das Stemmer’sche Hautfaltenzeichen nie falsch positiv, es kann jedoch falsch negativ sein (Földi, E. 1986, Földi, M. 1982). Häufig sind die Zehen kastenförmig konfiguriert. Die Unterschenkel haben in der Regel eine Säulenform, die Hautfalten der betroffenen Extremität sind vertieft. Das Ödem ist im relativ frischen Stadium weich und auf Druck dellenbildend. Im fortgeschrittenen Stadium (Fibrose) findet sich die Subcutis induriert, läßt sich nur schwer oder gar nicht eindrücken, und es bilden sich keine Dellen aus. Die Hautfarbe ist normal, lediglich bei der besonders ausgeprägten Form, der Elephantiasis, gibt es neben der Elephantiasis alba eine Elephantiasis nigra, die mit einer bräunlichen Hautverfärbung einhergeht. Lymphostatische Ödeme sind in der Regel auch auf Druck schmerzfrei, allein im ganz akuten Stadium können vorübergehend Spannungsschmerzen auftreten. Häufig finden sich bei Lymphödemen zugleich Senk- und Spreizfüße, die dann ihrerseits Schmerzen verursachen können (Brunner 1986). Naturgemäß kann bei einer Miteinbeziehung von Bändern, Sehnen und Gelenken eine entsprechende Schmerzymptomatik resultieren. Die Fußrücken sind regelhaft beteiligt. Fakultativ lassen sich dann Erysipele, Lymphzysten (Papillomatosis cutis lymphostatica) oder lymphokutane Fisteln bis hin zum sichtbaren Austritt von Lymphe aus der Cutis nachweisen. Häufig ist die im Rahmen der klinischen Untersuchung erhobene Anamnese bereits richtungsweisend. 2.4.6. Epidemiologie und Geschlechtsverteilung Umfassende Daten über die Häufigkeit des Vorkommens aller Lymphödemformen existieren in der vorliegenden Literatur nicht. Zum primären Lymphödem liegt eine - 22 - Untersuchung an 1000 Schülern vor, die bei 1,8% der Männer und 12,4% der Frauen ein subklinisches, primäres Beinlymphödem nachweist (Schwarz 1990). Bezüglich des primären Lymphödems gibt Brunner die Geschlechtsverteilung, Männer zu Frauen, mit 13% zu 87% an (Brunner 1986). In der 1985 abgeschloßenen Studie an 536 Patienten mit primärem Lymphödem fanden sich in 83% der Fälle ein Lymphoedema praecox, in 17% ein Lymphoedema tardum. 6,5% der Lymphödeme waren angeboren oder traten familiär auf, 88% entwickelten sich spontan chronisch, 5,5% traten spontan akut auf. Bei der Hälfte der Patienten war das Lymphödem bis zum 21. Lebensjahr manifest, eine auffallende Häufigkeitsspitze der Erstmanifestation bei Frauen fand sich im 17. Lebensjahr. 2.5. Lipödem Als Lipödem zu verstehen ist eine symmetrische, durch Fettablagerung bedingte Schwellung der Beine. Nicht selten besteht zugleich eine Umfangsvermehrung beider Arme. Häufig finden sich Fettpolster subinguinal medial im Bereich der Oberschenkel, in Höhe des Kniegelenkes sowie prä- oder retromalleolar (Brunner 1982). Die Unterschenkel sind meist keulenförmig konfiguriert, der Fußrücken ist in der Regel ödemfrei. Im Gegensatz zum Lymphödem sind die Extremitäten meist sehr druckempfindlich und nicht dellenbildend: ”non pitting edema” (Greer 1974). Lipödeme kommen fast ausschließlich bei Frauen vor, beim Mann nur sehr selten im Rahmen hormoneller Dysfunktionen. So kann bei Patienten mit einer Leberzirrhose (gestörter Östrogenabbau) und unter der Therapie des Prostatakarzinoms mit Östrogenen im Zuge einer dabei auftretenden Feminisierung ein Lipödem entstehen (Weissleder 1995). Häufig besteht ein allgemeines Übergewicht (Allen u. Hines 1940). Es lassen sich klinisch drei Gruppen von Frauen unterscheiden (Schmitz 1980): - junge Mädchen mit Säulenbeinen - fettsüchtige Frauen mit einer Unterkörperstammfettsucht - 23 - - Frauen mit grazilem Körperbau und ungewöhnlich dicken Beinen Neben der durch eine Fettgewebsvermehrung bedingten Schwellung ist das Lipödem durch das Auftreten von orthostatischen Ödemen gekennzeichnet. Insbesondere bei adipösen Patientinnen bildet sich im Laufe der Zeit häufig ein sekundäres Lymphödem aus: Lipo-Lymphödem ( Zaun 1987, Schwarz 1990). 2.5.1. Von Pathophysiologie des Lipödems einigen Autoren wird das Lipödem als eine Normvariante der Fettgewebsverteilung ohne Krankheitswert aufgefaßt (Brunner 1982, Schmitz 1980). Der Vermehrung des Fettgewebes liegt eine Hyperplasie von Fettgewebszellen zu Grunde, die wahrscheinlich durch eine allgemeine Bindegewebsschwäche begünstigt wird. Das lockere subkutane Fettgewebe bedingt einen niedrigen Gewebedruck, und somit eine Erhöhung des Nettoultrafiltrates (siehe Formel Seite 17). Bei längerer Orthostase kommt es so über eine dynamische Insuffizienz des Lymphgefäßsystems zu orthostatischen Ödemen. Nach längerem Bestehen kann sich dann eine mechanische Insuffizienz mit lymphostatischem Ödem ausbilden. Es resultiert das Krankheitsbild des Lipo-Lymphödems. 2.6. Chronische Veneninsuffizienz (CVI) Ontognetisch, morphologisch und physiologisch bestehen enge Zusammenhänge zwischen dem lymphatischen und dem venösen Gefäßsystem. Bei einem nicht unerheblichen Teil der im Rahmen dieser Studie untersuchten Patienten bestand eine chronische Veneninsuffizienz. Da die vielfältigen Beziehungen zwischen Erkrankungen der Lymphgefäße und Venen und die indirekt-lymphographisch faßbaren morphologischen Veränderungen der Lymphgefäße bei der CVI Thema einer eigenen Dissertation sind, soll diese Thema hier insbesondere bezüglich der - 24 - Anatomie, Physiologie und Pathophysiologie des venösen Systems nicht ausführlich abgehandelt werden. Pathogenetisch resultiert das Krankheitsbild der CVI aus einer medizinisch bedeutsamen Varikose oder einer abgelaufenen konsekutiver ambulatorischer venöser Hypertension. Beinvenenthrombose mit Neben der Erkrankung der Venen bestehen typische Hautveränderungen (Atrophie blanche, Ulcus cruris). Nach Földi läßt sich die CVI in drei pathopysiologische Stadien einteilen (Földi, E. 1989): Stadium 1 (ödemfreies Stadium): Der Anstieg der lymphpflichtigen Wasserlast im Rahmen der venösen Hypertension wird durch die Sicherheitsventilfunktion der Lymphgefäße voll kompensiert; es besteht kein Ödem bei jedoch persistierender hämodynamischer Störung. Stadium 2 (phlebo-lympho-dynamische Insuffizienz): Bei noch erhaltener Transportkapazität treten im Laufe der zweiten Tageshälfte eiweißarme Ödeme auf. Es besteht bereits eine Überlastung des Lymphgefäßsystems. Stadium 3 (phlebo-lymphostatische Insuffizienz): Die persistierende venöse Hyperämie führt zu einer Aufweitung der Interendothelzellverbindungen der Blutkapillaren mit konsekutiv erhöhter Permebilität für Eiweiße. Aus der jetzt erhöhten Wasser- und Eiweißlast resultiert eine dynamische Insuffizienz des Lymphgefäßsystems. Die persistierende dynamische Insuffizienz sowie das Übergreifen der Entzündung von erkrankten Venen auf benachbarte Lymphgefäße bedingt schließlich eine zusätzliche mechanische Insuffizienz. Es entsteht somit eine maximale Sicherheitsventilinsuffizienz des Lymphgefäßsystems. Als Zeichen einer regionalen Schädigung des Lymphgefäßssystems lassen sich beim Ulcus cruris Farbstoffaustritte nach subkutaner Injektion von Patentblau in der Nähe des Ulcus im Vorfußbereich nachweisen (Fuchs et al. 1960). Bei der direkten Lymphographie konnten Kontrastmittelaustritte im Bereich von venösen Ulcera nachgewiesen werden (Gregl et al.1966, Jacobsson et al. 1959, Partsch 1984 a ). Isotopenstudien belegen, daß der Lymphtransport bei der CVI ohne zusätzlich bestehendes Lymphödem normal oder gesteigert ist ( Ketterings 1976, Jacobsson et al. 1961, Lofferer et al. 1972), während bei der CVI mit sekundärem Lymphödem (Hoppe et al. 1972, Tiedjen et al. 1977) eine Einschränkung des Lymphtransports besteht. Im Rahmen der Mikrolymphangiographie mit subepidermal injiziertem fluoreszeinmarkiertem Dextran konnte bei Patienten mit einer CVI eine - 25 - Fragmentation des oberflächlichen Lymphkapillarnetzes mit vermehrtem Durchtritt von Makromolekülen durch die Wände der Kapillarbruchstücke sowie eine ausgedehntere Ausbreitung des Farbstoffes im Vergleich zu Gesunden dokumentiert werden (Isenring et al. 1982). 2.7. Bildgebende Verfahren zur Diagnostik des Lymphgefäßsystems Im folgenden Abschnitt werden die bildgebenden Verfahren, die zur Diagnostik des Lymphgefäßssystems zur Verfügung stehen, behandelt. Dabei werden sowohl Verfahren beschrieben, die heute bereits obsolet sind, als auch solche, die zur Zeit noch auf ihre Anwendbarkeit hin überprüft werden müssen. Auf die indirekte Lymphographie und Xeroradiographie wird im Kapitel ”eigene Methode” eingegangen. 2.7.1. Patentblau - Farbstofftest Bei dem Farbstofftest mit Patentblau (Kinmonth 1952, Kaindl et al. 1960) werden 0,5 ml einer 11%igen Lösung von Patentblau-Violett (Molekulargewicht 17.000) in die Interdigitalfalten des Fußrückens injiziert. Alternativ können auch Evans-Blau, Kongorot oder Indigokarmin appliziert werden. Dem Test liegt eine unterschiedliche Farbverteilung der injizierten Lösung am Injektionsort beim Gesunden und bei verschiedenen Erkrankungen zu Grunde. Dabei ist das injizierte Patentblau äußerlich sichtbar, es bedarf keiner zusätzlichen Röntgenverfahren, allenfalls einer Photodokumentation. Brunner faßte die Befunde an 500 untersuchten Patienten mit einem primären Lymphödem anhand eines ”ikonographischen Spektrums” zusammen. Hierbei ließen sich zehn unterschiedliche Phänomene differenzieren: - Farbfleck auf Injektionsstelle beschränkt - Flächenhafte Verteilung über Zehenwurzel, getrennt - Flächenhafte Verteilung über Zehenwurzel, konfluierend - 26 - - Spinngewebige Verteilung über Zehenwurzel - Fleckige Verteilung über Zehenwurzel - Spinngewebige Verteilung über gesamten Fuß - Fleckige Verteilung über gesamtem Fuß - Flächenhafte Verteilung über gesamtem Fuß - Zusätzlich solitäre Bezirke an anderer Stelle - Kutaner Reflux in Zehen Die Phänomene 1 bis 4 fanden sich bei Patienten mit und ohne Lymphödem, die Phänomene 5 bis 10 traten auschließlich bei Patienten mit lymphostatischen Ödemen auf. Einige der hier beschriebenen Injektionsmuster finden sich in ähnlicher Form bei der Bildgebung im Rahmen der indirekten Lymphographie wieder. So entspricht die in Punkt 4 und 6 beschriebene spinngewebige Verteilung der indirekt lymphographischen Darstellung initialer Lymphgefäße in der unmittelbaren Umgebung des Injektionsdepots. Kutane Refluxe (Phänomen 10) kommen bei der indirekten Lymphographie in ähnlicher Form zur Darstellung, eine auf den Injektionsort beschränkte Anfärbung (Punkt 1) entspricht hier dem geschlossenen Injektionsdepot. Wenngleich es sich hier um ein ohne großen Aufwand durchführbares Verfahren handelt, ist diese Untersuchung auf Grund der eingeschränkten Aussagefähigkeit und der hohen Nebenwirkungsrate bis hin zum anaphylaktischen Schock heute zur Diagnostik von Lymphödemen obsolet (Koehler 1968). 2.7.2. Direkte Lymphographie Zur Durchführung der von Kinmonth 1952 entwickelten Technik der direkten Lymphographie mit öligen Kontrastmitteln ist ein relativ aufwendiger mikrochirurgischer Eingriff erfoderlich (Kinmonth 1952). Durch Injektion von Patentblau in das Subkutangewebe des Vorfußes kommt es zu einer erkennbaren Anfärbung von Lymphgefäßen im Bereich des Fußrückens, von denen mikrochirurgisch präpariert wird. Nach Einlegen einer eines speziellen - 27 - Lymphographiekanüle in das Lymphgefäß erfolgt die maschinelle Injektion eines öligen, jodhaltigen Röntgentrastmittels (z.B. Lipiodol). Direkt nach der Injektion werden Röntgenaufnahmen der untersuchten Extremität angefertigt. Bei Injektion im Bereich des Fußrückens kommt hier das ventromediale präfasziale Lymphgefäßbündel der jeweiligen unteren Extremität zur Darstellung. Auf den nach 24 und 48 Stunden angefertigten Röntgenaufnahmen kontrastieren sich dann die entsprechenden inguinalen und pelvinen Lymphknoten, deren Form, Größe und Speicherstruktur beurteilt werden kann. So können anhand des Speichermusters Aussagen zu einem möglichen metastatischen Befall von Lymphknoten gemacht werden. Bezüglich der morphologischen Beurteilung von Lymphknoten ist die direkte Lymphographie allen anderen derzeitigen bildgebenden Verfahren einschließlich CT und MRT weit überlegen (Weissleder 1995). Mit Hilfe der direkten Lymphographie können im Rahmen der Lymphgefäßdiagnostik Lymphkollektoren, Lymphstämme und in einem Drittel der Fälle auch der Ductus thoracicus dargestellt werden (Teske et al. 1978 -1979). Die Untersuchung ermöglicht die Differenzierung zwischen einer Aplasie, Hypoplasie und Hyperplasie von Lymphgefäßen. Bei der Aplasie und Hypoplasie können häufig Kontrastmittelrefluxe in die zuführenden Gefäßabschnitte dargestellt werden, bei traumatischen Schädigungen von Lymphgefäßen finden sich Kontrastmittelextravasate ( Weissleder 1986). Die Untersuchung ist mit einer erheblichen Komplikationsrate behaftet und muß als radiologische Risikountersuchung eingestuft werden (Huth 1983, Oehlert et al. 1966, Földi, M. 1981). Bei einer statistischen Auswertung von 32.000 Lymphographien (Köhler 1968) fanden sich 18 Todesfälle (Häufigkeit 1:1800) und folgende weitere Komplikationen (Anzahl der beobachteten Komplikationen in Klammern) : - Lungeninfarkte (81) - Lungenödeme (10) - Pneumonien (13) - Hämoptysen (10) - Kardiovaskulärer Kollaps (6) - Reaktion auf Kontrastmittel (40) - Farbstoffreaktion (57) - 28 - - Zerebrale Komplikationen (9) Die Indikation zur Durchführung der direkten Lymphographie beschränkt sich heute auf eng umschriebene onkologische Erkrankungen, die ohne ihren Einsatz nicht weiter abzuklären sind (Tiedjen 1993). 2.7.3. Computertomographie Bei der Computertomographie (CT) handelt es sich um ein radiologisches Schnittbildverfahren. Die von einer um den Patienten rotierenden Röntgenröhre ausgesandten Röntgenstrahlen erfahren beim Durchdringen der verschiedenen Gewebestrukturen unterschiedlich starke Abschwächungen, die von einem Detektorkranz gemessen werden. Den unterschiedlichen Meßdaten werden von einem Computer 2000 verschiedene Grauwerte zugeordnet, die dann zu einem Bild verarbeitet werden. Die unterschiedlichen Grauwerte bezeichnet man als HounsfieldEinheiten (HE). Die Computertomographie ist ein etabliertes Verfahren im Rahmen der Diagnostik von Lymphknotenerkrankungen mit einem breiten Einsatzspektrum. So wird die Methode beim Staging von Hodgkin- und Non-Hodgkin-Lymphomen an erster Stelle eingesetzt. Die CT ermöglicht Aussagen über Lokalisation, Größe und Form von Lymphknoten. Eine Dignitätsbeurteilung, sowie die Differenzierung von normalen, reaktiv oder entzündlich veränderten Lymphknoten gelingt jedoch auch an Hand von Dichtemessungen nicht (Frommhold et al. 1979). Auf den Stellenwert des Verfahrens bezüglich verschiedener Untersuchungsregionen im Vergleich zu konkurrierenden bildgebenden Verfahren (MRT, Sonographie) soll an dieser Stelle nicht weiter eingegangen werden. In die Lymphödemdiagnostik wurde die Methode 1986 von Bruna eingeführt. Hier lassen sich im Rahmen einer Nativuntersuchung bei chronischen Lymphödemen Densitätserhöhungen der Subcutis als Hinweis auf eine Fibrosierung des Unterhautfettgewebes Bei nachweisen. frischen Lymphödemen ist die - 29 - Gewebedichte zunächst erniedrigt (Kalima et al. 1982). Die Densität der normalen Cutis beträgt etwa 30HE, bei Lymphödemen liegen die Dichtewerte zwischen 15 und 35HE (Bruna 1989). Eine computertomographisch nachweisbare Fibrosierung bei chronischen Lymphödemen imponiert als ”Honigwabenmuster” (Hadjis et al. 1985). Lymphgefäße können ohne vorherige Kontrastmittelgabe wegen des zu geringen räumlichen Auflösungsvermögens nicht identifiziert werden. Nach zuvor erfolgter öliger Lymphographie können beim chronischen Lymphödem ein Kontrastmittelreflux in die Haut (dermal backflow) und Kollateralen in subfaszialen und subkutanen Lymphbahnen dargestellt werden (Bruna 1986). 2.7.4. Das Sonographie Prinzip der Sonographie beruht auf einer Änderung der Ausbreitungsgeschwindigkeit von Ultraschallwellen im Gewebe und der Reflexion der Schallwellen an Grenzflächen unterschiedlicher Gewebestrukturen. Die Sonographie steht bei der Diagnostik von Lymphknotenerkrankungen als völlig risikoloses, nebenwirkungsfreies und jederzeit schnell verfügbares Verfahren an erster Stelle. Die Methode ermöglicht die Lokalisation, Größenbestimmung und Formbeurteilung von Lymphknoten. Die sonographische Form- und Strukturanalyse im B-Bild (Steinkamp et al. 1993) sowie farbdopplersonographische Untersuchungen (Steinkamp et al. 1994) können zur Dignitätsbeurteilung beitragen. Lymphgefäße von 1-2mm Durchmesser können sonographisch theoretisch erfaßt werden, jedoch ist die Differenzierung gegenüber Venen und Arterien auch bei zusätzlicher Anwendung von gepulstem Doppler und Farbdopplerverfahren äußerst schwierig. Die Sonographie ermöglicht bei Verwendung von hochauflösenden, hochfrequenten Schallköpfen im Bereich der Subcutis eine Beurteilung von Unterschieden der jeweiligen Echodichte im Seitenvergleich. So kann eine erhöhte Echodichte durchaus Hinweise auf eine vermehrte Fibrosierung einer Extremität z.B. bei einem chronischen Lymphödem geben. Ausgeprägte Ödeme imponieren durch eine Minderung der Echodichte und in einigen Fällen können hier streifige, - 30 - flüssigkeitsgefüllte Strukturen im Unterhautfettgewebe dargestellt werden, die offensichtlich ödemgefüllten interstitiellen Räumen entsprechen. Diese Strukturen korrelieren gut mit den xeroradiographisch darstellbaren retikulären ”Fibrosesepten” und den trabekulären signalintensiven Strukturen in der nativen Kernspintomographie (s. 2.7.5). Bei geringer ausgeprägten Befunden sind die sonographisch erfaßbaren Dichteunterschiede für eine diagnostische Verwertung in der Regel nicht geeignet. Moderne Ultraschallgeräte verfügen über Programme zur Dokumentation der jeweils ermittelten Echodichte an Hand von Histogrammen. Auch diese Programme haben sich bisher zur Diagnostik von Veränderungen der Subcutis als nicht ausreichend geeignet erwiesen (Untersuchungen an der hiesigen Abteilung). Definierte ”Echodichtewerte” zu Beurteilung von Weichteilstrukturen, vergleichbar den Hounsfield-Einheiten im CT, existieren zur Zeit für dieSonographie noch nicht. Hier ist allenfalls eine Perspektive für die Zukunft zu sehen. 2.7.5. Magnetresonanztomographie Die Magnetresonanztomographie (MRT) oder Kernspintomographie ist eine Methode, bei der durch ein statisches Magnetfeld zwei Spinzustände von Wasserstoffkernen (Protonen) in unterschiedliche Energieniveaus aufgespalten werden. Ein Hochfrequenzsender regt die Kerne innerhalb der vorgegebenen Energiezustände an. Nach Anregung durch das Hochfrequenzsignal kehren die Protonen in einen niedrigeren Energiezustand zurück. Die dabei freiwerdende Energie wird als Radiowelle abgegeben, gemessen, und in ein Bild umgesetzt. Die native Magnetresonanztomographie beschränkt sich bisher in erster Linie, ähnlich wie die Computertomographie, auf die Darstellung vergrößerter Lymphknoten. Die zusätzliche intravenöse Gabe konventioneller Kontrastmittel (Gadolinum) bringt keine weiteren Vorteile. Bei der MR-Lymphographie (Weissleder, R. et al. 1990 a, Weissleder, R. et al. 1990 b) werden superparamagnetische Eisenoxydpartikel intravenös injiziert und von den Makrophagen in den Randsinus der Lymphknoten Organismus phagozytiert. gleichzeitig zur So kommen Darstellung. Da sämtliche die Lymphknoten des Eisenspeicherkapazität - 31 - metastatisch befallener Lymphknoten im Vergleich zu gesunden Lymphknoten durch Veränderung der normalen Gewebestruktur vermindert ist, gelingt an Hand des unterschiedlichen Speicherverhaltens die Differenzierung zwischen erkrankten und gesunden Lymphknoten. Im Rahmen der Lymphödemdiagnostik sind bei der Nativ-Untersuchung Aussagen über den Flüssigkeitsgehalt und die Struktur des subkutanen Gewebes möglich. So läßt sich bei chronischen Lymphödemen eine Zunahme der Signalintensität der Subcutis nachweisen (Gregl et al. 1985). Weiterhin ist eine Differenzierung zwischen Lipödemen, Lymphödemen und Ödemen bei chronischer venöser Insuffizienz möglich (Duewell et al. 1992). Die Darstellung signalintensiver trabekulärer Strukturen wird von einigen Autoren als eiweißreiche Flüssigkeit im Subkutangewebe interpretiert (Hadjis et al. 1985), andere deuten sie als dilatierte lymphatische Kollateralgefäße (Case et al. 1992). Eine sichere Darstellung von Lymphgefäßen konnte mit der MRT bisher auch bei zusätzlicher intravenöser/intramuskulärer Kontrastmittelapplikation nicht erzielt werden. 2.7.6. Fluoreszenz-Mikro-Lymphangiographie Die von Bollinger (1981) in die Diagnostik des Lymphgefäßsystems eingeführte Methode ermöglicht die Darstellung von Lymphkapillaren der Haut und kann Aussagen zur Permeabilität dieser initialen Lymphgefäße machen. Abführende Lymphgefäße kommen nicht zur Darstellung. Es handelt sich dabei um ein intravitalmikroskopisches Verfahren, dessen Durchführung auf Grund des hohen technischen Aufwandes wenigen spezialisierten Kliniken vorbehalten bleibt. Die Aufnahmeeinheit besteht aus einem mit speziellen Filtersystemen ausgestatteten Fluoreszenz-Auflichtmikroskop, einer Quecksilber-Lichtquelle, einer Schwarz-WeißVideokamera, und einem Videorekorder mit Fernsehmonitor (Pfister 1989). Nach subepidermaler Injektion des fluoreszierenden Farbstoffes Fluoresceinisothiocyanat - 32 - (FITC), gekoppelt an Dextran (Molekulargewicht 150.000), kommt es zunächst zur Ausbildung eines subepidermalen Farbstoffdepots, aus dem sich dann die Lymphkapillaren der Haut füllen. Die Betrachtung des Füllungsablaufes erfolgt durch das Fluoreszenzmikroskop über einen Zeitraum von 60 Minuten; die Untersuchung wird von der Videokamera aufgezeichnet. Der bevorzugte Injektionsort liegt in Höhe des Innenknöchels, es kann jedoch bei entsprechender Fragestellung auch an anderen Stellen ermöglicht durch injiziert werden. zusätzliches Die sogenannte Ankoppeln des Doppel-Indikator-Technik Fluoreszenzfarbstoffes an niedermolekulare Dextrane (Molekulargewicht 40.000) zudem eine Beurteilung der transkapillären Passage (Huber et al. 1985). So können Permeabilitätsstörungen der Lympkhkapillaren als Hinweis für das Bestehen einer lymphatischen Mikroangiopathie nachgewiesen werden. Zur Diagnose werden folgende Beurteilungskriterien herangezogen (Bollinger 1985): 1. Ausbreitung des Farbstoffes Eine Ausbreitung von mehr als 12 mm von der Depotgrenze findet sich bei Lymphödemen und bei der chronischen venösen Insuffizienz. 2. Morphologische Veränderungen der initialen Lymphgefäße Auf Grund von Kaliberschwankungen und Formveränderungen des kapillären Maschenwerkes kann zwischen verschiedenen Lymphödemformen differenziert werden. So zeigen sekundäre Lymphödeme und primäre nicht kongenitale Lymphödeme nur eine verstärkte Ausbreitung des Farbstoffes am Injektionsort, jedoch keine morphologischen Veränderungen. Bei kongenitalen primären Lymphödemen läßt sich eine Aplasie oder Dilatation der Kapillaren nachweisen. Rezidivierende Erysipele bedingen eine Obliteration der Lymphkapillaren mit partieller oder völlig fehlender Darstellung des kapillären Maschenwerkes. Bei der CVI lassen sich stadienabhängig eine verstärkte Diffusion des Farbstoffes im Bereich trophischer Störungen sowie Destruktionen und Permeabilitätsstörungen (Doppel-Indikator-Technik) der Lymphkapillaren nachweisen. - 33 - 2.7.7. Isotopenlymphographie Bei der Isotopenlymphographie oder semiquantitativen Lymphszintigraphie handelt es sich um ein nuklearmedizinisches Untersuchungsverfahren, das in erster Linie zur Funktionsdiagnostik des Lymphsystems eingesetzt wird. Dabei werden obligat lymphpflichtige, radioaktiv markierte Kolloide subkutan injiziert. Die Detektion des inkorporierten Strahlers erfolgt über eine Gamma-Kamera nach Anger. Die Detektoren verfügen über Natrium-Jodid-Kristalle, in denen die auftreffenden Gammaquanten in Fotoquanten umgesetzt werden, die dann zu einem Bild, dem sogenannten Szintigramm, summiert werden. Für die Untersuchung ideale Radiopharmaka bestehen aus 99m Technetium-Pertechnetat (reiner γ-Strahler, Halbwertszeit 6 Stunden), gekoppelt an Human-Serum-Nanokolloid oder ZinnSchwefelkolloid als obligat lymphpflichtige Trägersubstanz (Tiedjen 1985). Die durchschnittlich verabfolgte Radioaktivitätsdosis liegt bei 37MBq je untersuchte Extremität bei einem Injektionsvolumen von je 0,5ml. Bevorzugter Injektionsort bei Untersuchung der unteren Extremität sind die Interdigitalfalten des Vorfußes. Unmittelbar nach Injektion des Radiopharmakons erfolgt die Messung der applizierten Radioaktivitätsdosis an der Injektionsstelle. Es folgen Messungen der Impulsraten über den inguinal-pelvinen Lymphknotenstation nach definierten Zeitintervallen. Dabei werden die Transportzeit des Radiopharmakons vom Injektionsort zu Speicherkapazität den der entsprechenden entsprechnenden Lymphknotenstationen Lymphknoten (Uptake) und die rechnerisch ermittelt. Da der Lymphtransport unter Ruhebedingungen extrem langsam ist, muß die Untersuchung unter standardisierter aktiver oder passiver Bewegung durchgeführt werden. Aus der rechnerischen Ermittlung der inguinal-pelvinen Einflußraten kann eine Aussage über den quantitativen Lymphtranstransport gemacht werden. Es existieren zur Zeit mehrere unterschiedlich standardisierte Untersuchungsverfahren, die Modifikationen bezüglich der Meßregionen, des Meßzeitpunktes und der Bewegung während der Untersuchung aufweisen (Weissleder et al. 1992; Tiedjen 1990; Pecking et al. 1984, Mostbeck et al.1986). Bei einheitlicher Bewertung der Lymphknoten-Uptake-Werte in Prozent, eine Stunde nach Injektionsbeginn, lassen sich die Befunde unterschiedlicher Untersucher miteinander vergleichen (Weissleder et al. 1992). Die an der hiesigen Klinik - 34 - durchgeführte, und zum Vergleich mit den Ergebnissen der indirekten Lymphographie herangezogene Untersuchung, wird in 3.2.1, S.38 beschrieben. - 35 - 2.7.8. Mit Kapillarszintigraphie der Kapillarszintigraphie können Ödeme erfaßt werden, die durch Permeabilitätsstörungen der Kapillaren bedingt sind (idiopathisch-zyklisches Ödem, diabetische Mikroangiopathie). Die Methode basiert auf der Meßung der extravasalen Akkumulation intravenös applizierter, radioaktiv markierter Albuminpartikel. Die zu untersuchende Extremität wird bei Injektion des Radiopharmakons (99m TechnetiumAlbumin) mit 80mmHg proximal der Injektionsstelle gestaut. Retentionswerte nach Lösen des Staus von mehr als 8% der applizierten Dosis werden als pathologisch interpretiert. Die Methode ist zur Lymphödemdiagnostik selbst nicht geeignet. Auch zur Abgrenzung idiopathisch-zyklischer Ödeme gegen Extremitätenödeme unklarer Genese liefert die Untersuchung keine brauchbaren Ergebnisse (Weissleder 1994). - 36 - 3. Material und Methode In dem Zeitraum von 1989 bis zum Ende des Jahres 1997 wurden an unserer Abteilung insgesamt mehr als 400 Patienten mit chronischen Extremitätenödemen indirekt-lymphographisch untersucht. Bei 311 Patienten wurde zusätzlich eine Isotopenlymphographie durchgeführt. Die Untersuchungsergebnisse dieser 311 Patienten wurden im Rahmen der vorliegenden Arbeit ausgewertet. Mit Ausnahme von 3 Patienten wurden bei allen Patienten jeweils beide Beine lymphographiert. Somit liegen der Studie 619 untersuchte untere Extremitäten zu Grunde. Es handelt sich dabei größtenteils um von Fachkliniken, niedergelassenen Phlebologen oder lymphologisch tätigen Arzten zur amulanten Lymphödemdiagnostik zugewiesene Patienten. Bei allen Patienten wurde zunächst eine Anamnese erhoben. Diese beinhaltete: -Eigenanamnese -Familienanamnese -Medikamenteneinahme -Körpergröße -Gewicht Die anschließende körperliche Untersuchung beinhaltete: -Beinumfang (Seitendifferenz) -Beurteilung der Unterschenkelform (normal-Keulenform-Säulenform) -Zehenform (normal-Kastenzehen) -Überprüfung des Stemmer‘schen Zeichens -Schmerzhaftigkeit des Ödems Nach abgeschlossener Isotopenlymphographie Anamnese sowie eine und Untersuchung indirekte wurden eine Lymphographie mit xeroradiographischer Bilddokumentation durchgeführt. Die abschließende Diagnose erfolgte schließlich unter Berücksichtigung der anamnestischen Daten, körperlichen - 37 - Untersuchung und Interpretation von Xeroradiographie und indirekter Lymphographie sowie der Isotopenlymphographie. 3.1. Material 3.1.1. Patienten Das Patientenkollektiv besteht aus 311 Patienten im Alter von 12 bis 85 Jahren. Das Durchschnittsalter beträgt 50,81 Jahre, die Durchschnittsgröße 167,86 cm und das Durchschnittsgewicht 81,12 kg. Der BMI (Body-Mass-Index) beträgt für alle Patienten 28,76 (Broca-Index 1,20). Die Patienten sind bezogen auf den BMI somit der Gruppe der leicht Übergewichtigen zuzuordnen: BMI = Körpergewicht (kg) [Körpergröße (m)]2 Beurteilung der BMI-Werte: <18 extrem untergewichtig 18-20 untergewichtig 20-25 optimaler Bereich 26-30 leichtes Übergewicht >30 extrem übergewichtig Das Durchschnittsalter der 244 Frauen lag bei 50,68 Jahren, die Durchschnittsgröße bei 165,75 cm und das Durchschnittsgewicht bei 76,71 kg. Der BMI beträgt für die Frauen 27,79 (Broca-Index 1,17). Die 67 Männer waren im Durchschnitt 51,31 Jahre alt, 175,58 cm groß und und mit einem Durchschnittsgewicht von 97,16 kg deutlich schwerer als die Frauen. Mit einem BMI von 31,34 sind die Männer im Durchschnitt extrem Übergewichtig (Broca-Index von 1,29) (Tabelle 1). Tabelle 1: Broca-Index und BMI des Patientenkollektivs Durchschnittwerte 311 Patienten - 38 - Größe Gewicht Alter Broca-Ind. BMI 167,68 81,12 50,81 1,20 28,76 244 Frauen 165,75 76,71 50,68 1,17 27,79 67 Männer 175,38 97,16 51,31 1,29 31,34 Bei 9 Patienten ergab sich ein unauffälliger Befund. Ein chronisches Lymphödem einschließlich aller Mischformen (Kombination mit Lipödem oder CVI) wurde bei insgesamt 264 Patienten abschließend diagnostiziert. Diese Gruppe zeigte mit einem Durchschnittsgewicht von 81,60 kg und einer durchschnittlichen Größe von 167,69 kg geringe Abweichungen vom Gesamtkollekiv (BMI 29,0). Deutlichere Abweichungen vom Gesamtkollektiv ergaben sich bei den 132 Patienten mit Lipo-Lymphödemen. Sie waren im Durchschnitt 166,50 cm groß und mit 82,29 kg schwerer als der Durchschnitt (BMI 29,75). Die 38 Patienten mit reinen Lipödemen waren bei einem mittleren Alter von 39,05 Jahren die mit Abstand jüngsten Patienten. Sie waren durchschnittlich 166,50 cm groß und mit 77,73 kg leichter als der Gesamtdurchschnitt (BMI 27,86). Das höchste Körpergewicht wiesen die 53 Patienten mit Lymphödemen bei chronischer venöser Insuffizienz auf. Sie waren bei einer durchschnittlichen Größe von 170,62 cm mit 88,77 kg deutlich schwerer als der Durchschnitt und gehören bezogen auf den BMI (30,40) bereits in die Gruppe der extrem übergewichtigen. Tabelle 2: Broca-Index und BMI nach Diagnosen Durchschnittswerte Diagnosen Gewicht Alter Größe Broca-Ind. BMI (n=38) 77,73 39,05 167,28 1,16 27,86 (n=264) 81,80 52,63 167,69 1,21 29,00 (n=53) 88,77 58,49 170,62 1,26 30,40 Lipo-Lymphödem (n=132) 82,99 47,96 166,50 1,24 29,75 Normal 81,22 47,33 175,33 1,08 26,54 Lipödem Lymphödem CVI (n=9) - 39 - 3.2. Methode (Indirekte Lymphographie) Mit der indirekten Lymphographie steht ein radiologisches Untersuchungsverfahren zur Verfügung, das die bildliche Darstellung epifaszialer Lymphgefäße ermöglicht. Dabei wird ein wasserlösliches, jodhaltiges Röntgenkontrastmittel subepidermal injiziert. Die Kontrastmittelapplikation erfolgt über einen Katheter mit Injektionsnadel und wird über einen elektrisch angetriebenen Injektor maschinell gesteuert. Das Prinzip der Untersuchung basiert auf dem Abtransport des interstitiell applizierten Kontrastmittels durch das Lymphgefäßsystem. An der Injektionsstelle entsteht eine von außen sichtbare Quaddel, unterhalb dieser Quaddel bildet sich ein interstitielles Injektionsdepot aus. Dieses Depot bewirkt eine Erhöhung des Gewebedruckes und bedingt so den lymphogenen Abtransport des Kontrastmittels, das auf Grund seiner Zusammensetzung allein nicht obligat lymphpflichtig ist. Der Übertritt des Kontrastmittels in die Lymphgefäße erfolgt durch die interendothelialen Öffnungen der Kapillaren. Bei hohen Injektionsgeschwindigkeiten (≥4 ml/min) mit entsprechend hohem Gewebedruck ist nach tierexperimentellen Untersuchungen auch ein Transport über porenförmige endotheliale Öffnungen (≤ 5µm) möglich (Berens v. Rautenfeld et. al. 1989). Während der Untersuchung werden Röntgenbilder der zu untersuchenden Extremität angefertigt. Die Bilddokumentation erfolgt hier je nach Untersucher durch unterschiedliche Röntgenverfahren. Untersucherabhängig variabel sind auch : Zeitintervalle der Bilddokumentation, Dauer der Injektion, Injektionsgeschwindigkeit, Injektionskatheter, bevorzugter Injektionsort, sowie das verwendete Kontrastmittel. 3.2.1. Eigene Methode (Indirekte Xero-Lymphographie) Die Untersuchung erfolgt auf dem Bucky-Tisch der Röntgenanlage und wird wahlweise sitzend oder liegend durchgeführt. Es werden zunächst für jede zu untersuchende Extremität je 2 ml Röntgenkontrastmittel in einer 10 ml-Einmalspritze aufgezogen. Zur Infusion benutzen wir den Lymphangiographie-Katheter LCS 30-60 - 40 - der Firma COOK mit einer hypodermen 30 GA-Nadel und einem 60 cm Polyvenylschlauch. Der Katheter wird zuvor mit den gefüllten Einmalspritzen konnektiert und vollständig mit dem Röntgenkontrastmittel gefüllt. Die Einmalspritzen werden dann in einen automatischen regelbaren Lymphographie-Injektomat der Firma ULRICH eingesetzt und entsprechend fixiert. In dem Injektor wird das Kontrastmittel automatisch vorgewärmt. Nach sorfältiger Hautdesinfektion mit Benzalkoniumchlorid Lösung 1% erfolgt die subepidermale Plazierung knapp oberhalb des Innenknöchels der zu untersuchenden Extremität. Um das Einbringen der Nadel zu erleichtern wird die Haut oberhalb der Einstichstelle mit der freien Hand des Untersuchers leicht gespannt. Die subepidermale Lage ist gewährleistet, wenn die Nadel des Katheters nach Plazierung durch die Haut zu erkennen ist und sich am Injektionsort ca. 1 min nach Injektionsbeginn eine gläsern durchscheinende Quaddel ausbildet (Injektionsgeschwindigkeit 0,15 ml/min). Nach 3, 6 und 9 Minuten erfolgt die xeroradiographische Bilddokumentation. Danach ist die Untersuchung in der Regel beendet. Wahlweise wird bei gesonderten Fragestellungen (z.B. subklinisches distales Lymphödem) ein weiterer Injektionsort (z.B. distaler Fußrücken) gewählt. Nach Entfernen der Nadel erfolgt erneut eine Hautdesinfektion und das Abkleben der Einstichstelle mit einem luftdurchlässigen Wundverband. Die Patienten werden aufgefordert, das Pflaster bis zum folgenden Tag dort zu belassen, um einer möglichen Kontamination der Einstichstelle und einem eventuellen Erysipel vorzubeugen. Desgleichen sollen die Patienten bis zum folgenden Tag die Injektionsstelle trocken halten, nicht waschen, duschen und auch keinen Schwimmbad- oder Saunabesuch machen. 3.2.2. Kontrastmittel Die Entwicklung wasserlöslicher, möglichst blutisotoner, interstitiell applizierbarer Röntgenkontrastmittel war Voraussetzung für die Entwicklung der indirekten Lymphographie. Ein hierfür speziell entwickeltes dimeres Kontrastmittel (Iotasul) kam nicht über den klinischen Versuch hinaus, und steht bis heute nicht zur - 41 - Verfügung. Eine andere dimere, hexajodierte Verbindung (Iotrolan), als Isovist im Handel, ist heute als einziges Röntgenkontrastmittel für die indirekte Lymphographie zugelassen und wird von anderen Untersuchern ausschließlich verwendet. Da in der Entwicklungsphase beide der oben genannten Kontrastmittel nicht zur Verfügung standen, wurde an unserer Abteilung Iopamidol (Solutrast 200) auf seine Eignung überprüft und auch im Rahmen dieser Untersuchung bei fast allen Patienten eingesetzt. Es handelt sich um eine nichtionische, monomere, trijodierte Verbindung mit einem Jodgehalt von 49% (200 mg/ml). Die Viskosität ist niedriger als die vergleichbarer dimerer wasserlöslicher Verbindungen bei allerdings höherer Osmolarität (Tabelle 3). Tabelle 3: Röntgenkontrastmittel bei der indirekten Lymphographie (Herstellerangaben) Molekulargewicht Osmolalität bei 37°C Viskosität bei 37°C 777 619 4,5 Iotrolan 1.626 300 9,1 Iotasul 1.608 sehr niedrig 24,0 Iopamidol Die kontrastgebende Wirkung von Iopamidol (Summenformel: C17H22I3N3O8) beruht auf der absorbierenden Wirkung gegenüber Röntgenstrahlen durch die in der Verbindung stabil gebundenen Jodatome. Aufgrund der ausgeprägten Hydrophilie findet praktisch keine Bindung an Plasmaproteine statt, die Elimination erfolgt fast ausschließlich renal. Iopamidol findet breiten Einsatz in der radiologischen Diagnostik, insbesondere bei der Phlebographie. Die Strukturformel von Iopamidol ist in Abb.2 wiedergegeben. Weissleder fordert für das ideale Röntgenkontrastmittel zur indirekten Lymphographie bestimmte Eigenschaften. Neben einer hohen Jodkonzentration zur besseren Kontrastierung kleiner Gefäße sollte die Verbindung möglichst blutisoton sein, mit hieraus resultierender besserer Gewebeverträglichkeit. Weiterhin sollen keine lokalen oder systemischen Nebenwirkungen auftreten (Weissleder H. 1989). - 42 - Eine aufgrund der höheren Osmolarität eventuell zu erwartende schnellere Diffusion aus den Lymphgefäßen mit resultierender schlechterer Darstellbarkeit konnte im Vergleich zu den oben genannten Kontrastmitteln nicht gefunden werden. Auch bezüglich der Nebenwirkungen bzw. Verträglichkeit konnten bisher keine Nachteile gegenüber Iotrolan festgestellt werden (Tiedjen et al. 1990). CH2OH Iopamidol CONH I H 3C CH OH CH CH2OH I COHN CONH I CH CH2OH CH2OH Abbildung 2: Strukturformel von Iopamidol 3.2.3. Xeroradiographie Das der Xeroradiographie zugrundeliegende Verfahren wurde von Carlson 1942 ursprünglich mit dem Ziel entwickelt, Schriftstücke ohne Anwendung eines photochemischen Prozesses zu kopieren (Carlson 1965). Ein wesentlicher Grund für das Interesse an der Methode war die zunehmende Knappheit und Verteuerung von Silber als wesentlichem Bestandteil photographischer Emulsionen. Zum anderen bestand die Befürchtung, daß im Falle einer atomaren Katastrophe durch die ungewollte Einwirkung ionisierender Strahlung alles photographische Aufnahmematerial zerstört werden könnte (Schnepper et al. 1977). In der medizinischen Diagnostik fand die Xeroradiographie seit Anfang der 70er Jahre zumindest in den USA weite Verbreitung in der Mammadiagnostik. Auch zur Bilddokumentation im Rahmen der direkten Lymphographie wurde das Verfahren eingesetzt (Schertel et al. 1975 a). In Deutschland wurde das erste Gerät 1972 am Knappschaftskrankenhaus Dortmund-Brakel in Betrieb genommen. Nachdem die Xeroradiographie zunächst breiten Einsatz z.B. im Rahmen der Thoraxdiagnostik - 43 - (Otto et al. 1975, Schertel et al. 1975 b) oder der Angiographie (Kramann et al. 1977, Franken et al. 1978) fand, ist der Einsatz des Verfahrens heute auf Grund des relativ hohen Dosisbedarfes speziellen Fragestellungen im Rahmen der Weichteildiagnostik vorbehalten. Das Prinzip der Xeroradiographie basiert auf elektrostatischen Eigenschaften von Halbleitern. Hier treten mit Selen beschichtete Aluminiumplatten an die Stelle der photographischen Schicht des herkömmlichen Röntgenfilms. Amorphes Selen ist ein Photohalbleiter, der unter dem Einfluß elektromagnetischer Strahlung elektrisch leitend wird. Die elektromagnetische Strahlung wird durch ein konventionelles Röntgengerät erzeugt. Werden die mit einer gleichmäßigen Schicht positiv geladener Selenteilchen versehenen Aluminiumplatten der Röntgenstrahlung ausgesetzt, erfolgt an den Stellen, die von der Strahlung getroffen werden, eine dosisabhängige Entladung. Die unterschiedliche Schwächung der Röntgenstrahlung durch das durchstrahlte Objekt bedingt unterschiedlich starke Entladungen auf der Selenschicht; es entsteht ein Ladungsrelief, das dem durch Absorptionssprünge im durchstrahlten Objekt enstandenen Strahlenrelief entspricht. Dieses Relief wird durch Bestäuben der Aluminiumplatte mit einem elektrisch geladenen farbigen Puder sichtbar gemacht (”Puderwolken-Entwicklung”). Je nach dem Vorzeichen ihrer Ladung schlagen sich die Pulverpartikel auf den geladenen oder entladenen Stellen nieder. Es besteht so die Möglichkeit einer Positiv- oder Negativentwicklung, wobei die erforderliche Strahlendosis für eine Negativentwicklung geringer ist. Das elektrische Feld bedingt, daß sich das Pulver bevorzugt an den Stellen niederschlägt, an denen sich die Ladung ändert. Hieraus resultiert der besondere Vorteil der Xeroradiographie gegenüber konventionellen Röntgenverfahren. Es kommt zu einer Kontrastverstärkung (Konturanhebung, Kanteneffekt), die zur Anhebung geringster Dichteunterschiede führt (Carlson 1965). Flächenhafte Absorptionsunterschiede kommen hingegen nicht gut zur Darstellung (Flächenunterdrückung). Das Pulverrelief wird von der Aluminiumplatte auf ein Spezialpapier übertragen. Das fertige Bild wird im Auflicht betrachtet. In der Regel wird Pulver mit einem blauen Farbton verwendet. Die Platten können nach entsprechender Reinigung und - 44 - erneutem Aufladen wiederverwendet werden. Die hierzu nötigen Vorgänge sind automatisiert. Bei der Lymphödemdiagnostik kann die Xeroradiographie zur Gewebeanalyse eingesetzt werden. Hier sind ein vergrößerter Transversaldurchmesser der erkrankten Extremität, eine Verbreiterung von Cutis und Subcutis, sowie in fortgeschrittenen Fällen eine Vergrößerung der Muskelloge und netzartige Fibrosierungen des Unterhautfettgewebes pathognomonisch (Bruna 1981). Der Nachweis dieser Fibrosierungen ermöglicht insbesondere eine gute Differenzierung zwischen Lipödemen und Lymphödemen (Tiedjen et al. 1990). Im Rahmen dieser Arbeit wurde das an der hiesigen Abteilung vorhandene Xeroradiographiesystem 126 der Firma Rank Xerox, bestehend aus einer Lade- und Entwicklungseinheit, zur Bilddokumentation benutzt. Das Bildformat der Xeroradiographiekassetten beträgt 23cm X 34,5cm. Die Röntgenbestrahlung erfolgt mit dem Röntgengerät SM 70 mit Bucky-Tisch S4 der Firma Philips im ObertischVerfahren mit einer Röhrenspannung von 90 KV und 20 mAs. Der Film-FocusAbstand beträgt 1m. Vor der Untersuchung werden Nativ-Xeroradiogramme der zu untersuchenden Extremitäten angefertigt. Es folgen dann nach Injektionsbeginn drei Aufnahmen im Abstand von je drei Minuten. Anschließend erfolgt eine Beurteilung der nativ-xeroradiographischen Befunde bezüglich Veränderungen der Cutis und des subkutanen Fettgewebes. Die Xeroradiogramme wurden zur besseren Beurteilbarkeit feiner subkutaner Strukturveränderungen und zur Erleichterung der Vermessung der oft sehr zarten Lymphgefäße mit einem Episkop um den Faktor 8,0 vergrößert auf eine Leinwand projiziert. Die Grenze der Auflösung wurde bei den Vergrößerungen mit 1 mm festgelegt, entsprechend 0,125 mm im Originalbild. Folgende Parameter gingen in die Beurteilung ein: Verbreiterung von Cutis und Subcutis, Fibrosierung und Sklerosierungen der Subcutis sowie der Nachweis von Ulzerationen. Die indirektlymphographischen Befunde umfaßten zunächst eine Beurteilung der Konfiguration des Injektionsdepots. Hierbei wurden den Depots verschiedene Charakteristika zugeordnet: geschlossen, unscharf berandet, flächenhaft, diffus, ausgefranst und flammenförmig. Schließlich erfolgte die Dokumentation von kontrastierten initialen Lymphgefäßen, Präkollektoren und Kontrastmittelrefluxen in die Cutis. Die Analyse der Lymphkollektoren umfaßte die Dokumentation der Anzahl der Gefäße sowie - 45 - deren mittlere Weite und mittlere maximale Weite. Der Verlauf der Lymphkollektoren durch das Unterhautfettgewebe wurde entweder als gestreckt, kurzstreckig geschlängelt (korkenzieherartig) oder langstreckig geschlängelt (grob gewunden) beurteilt. Weiterhin wurden Kreuzungen vom ventromedialen in das dorsale Lymphgefäßbündel, Kollektorabbrüche sowie Kontrastmittelextravasate erfaßt. Anschließend erfolgte die Einteilung der untersuchten Extremitäten bzw. Patienten in fünf Gruppen: Normale Extremitäten, Lymphödeme, Lipödeme, Lipolymphödeme und Veno-Lymphödeme. Für die Diagnose : ”Lymphödem” oder ”Lipödem” existiert kein ”Goldstandard” in Form eines anerkannten apparativen Verfahrens, wie etwa die Phlebographie bei der Diagnose der chronischen venösen Insuffizienz oder die Angiographie zur Diagnose der arteriellen Verschlußkrankheit. Hieraus ergibt sich ein methodisches Problem. So ist es nicht zulässig, die Extremitäten eines Patienten mit eindeutigem klinischem Habitus eines Lipödems bei unauffälliger indirekter Lymphographie Injektionsdepots und mit fehlendem unauffälligem Nachweis Kollektorverlauf flammenförmiger sowie normalen Lymphtransportraten als ”normale Extremität” zu beurteilen. Allgemein anerkannt ist bei der Diagnosestellung o.g. Erkrankungen der klinische Befund führend. Dieser wurde bei der Zuordnung auch besonders stark gewichtet. Hierbei wurden für die Diagnose: ”Lymphödem” neben einer Umfangsvermehrung und typischen Säulenform der betreffenden Extremität insbesondere ein positives Stemmer‘sches Zeichen und eine Kastenform der Zehen berücksichtigt. Für die klinische Diagnose ”Lipödem” war neben der typischen Keulenform mit Umfangsvermehrung der Extremität auch das Vorliegen weiterer lipödematöser Veränderungen (obere Extremitäten, Becken), also der Gesamt-Habitus maßgebend. Anamnestische Angaben des Patienten über rezidivierende Schwellungen der Extremitäten allein erlauben nicht die Diagnose eines Lipödems bzw. Lymphödems. Ebenso kann ein unauffälliger Befund Lymphtransportraten in bei der klinisch Isotopenlymphographie eindeutigem Lymphödem mit mit normalen positivem Stemmer‘schem Zeichen und pathologischer indirekter Lymphographie nicht dazu führen, eine Extremität als ”normal” zu beurteilen. Die Zuordnung erfolgte somit letzlich aus einem Konsens von Klinik, Anamnese, isotopenlymphographischem und indirekt-lymphographischem Befund mit besonderer Gewichtung des klinischen Befundes durch einen Untersucher mit langjähriger klinisch-diagnostischer Erfahrung. - 46 - 3.2.4. Computertomographie Bei dem hier verwendeten Gerät handelt es sich um einen Picker PQ-2000 Computertomographen. Die Untersuchung wird unter laufender Kontrastmittelapplikation durchgeführt. Es werden Scans direkt oberhalb des Injektionsdepots erstellt, die Schichtdicke beträgt 2 mm, der Index 2 bis 20 mm. Insgesamt wurden 10 Extremitäten untersucht. 3.2.5. CT-3D-Rekonstruktion Bei drei Patienten wurden nach Injektion des Kontrastmittels 20 Tomogramme oberhalb des Kontrastmitteldepots mit einer Schichtdicke und einem Index von 2 mm erstellt und eine 3-D-Rekonstruktion angeschlossen. Die Bilddokumentation erfolgte 9 min nach Injektionsbeginn. 3.2.6. Digitale Bildverstärker-Radiographie Zur BV-Radiographie steht uns das Gerät Philips Diagnost 96 mit Generator SP und BV-Imagica FS (Digital Spot Imaging) zur Verfügung. Das System ermöglicht die Nachbearbeitung der Röntgenbilder mit Kontrast- und Kantenanhebung. Die Abbildung erfolgt über einen Kodak-Laserprinter auf Film. Bei 66 der indirekt-lymphographisch untersuchten Extremitäten wurden zusätzlich zur xeroradiographischen Bilddokumentation jeweils drei Aufnahmen mit Bildverstärkerradiographie erstellt. Unmittelbar im Anschluß an die Untersuchung - 47 - wurde mittels Bildnachbearbeitung eine kantenbetonte Bildversion zur Beurteilung der Weichteilstrukturen, sowie eine kontrastbetonte Version zur Analyse der Lymphgefäße erstellt. 3.2.7. Konventionelle Röntgenaufnahmen Die Verwendung konventioneller Röntgengeräte beziehungsweise Röntenröhren mit - 48 - relativ großen Brennflecken in Kombination mit Film-Foliensystemen zeigt unbefriedigende Ergebnisse (eigene grundlegende Voruntersuchungen unserer Klinik). Neben gegebenenfalls kräftig kontrastierten Lymphkollektoren kommen im Bereich des Injektionsdepots nur verwaschene Strukturen zur Darstellung, initiale Lymphgefäße können nicht ausreichend scharf abgebildet werden. 3.2.8. Folienlose Werkstoffilme Folienlose Werkstoffilme sind zur Bilddokumentation hervorragend geeignet und bieten eine besonders hohe Detailerkennbarkeit. Die Verwendung dieser Filme am Menschen ist wegen der hohen erforderlichen Strahlendosis, die um den Faktor 6-10 höher liegt als bei Verwendung von Film-Folien-Kombinationen, heute jedoch obsolet. Sie werden zu Untersuchungen am Menschen nicht mehr eingesetzt. 3.2.9. Mammographiefilme Mammographiefilme mit Kassette und Verstärkerfolie sind für Untersuchungen im Bereich der oberen Extremitäten am Mammographiegerät hervorragend geeignet, weil der hier sehr kleine Brennfleck (0,1-0,3 mm) für eine sehr gute Auflösung und hohe Detailerkennbarkeit sorgt. Der Einsatz im Bereich der unteren Extremitäten ist auf Grund von Lagerungsproblemen jedoch schwierig und für die Routineuntersuchung ungeeignet. Es wurden an unserer Abteilung nur vereinzelte Untersuchungen im Bereich der oberen Extremitäten durchgeführt. - 49 - 3.2.10. Kernspintomographie In Zusammenarbeit mit der Abteilung für Radiologie und Nuklearmedizin der Universitätsklinik des Knappschaftskrankenhauses Bochum-Langendreer wurde mit dem dort stationierten Gerät Siemes Magnetom Vision (1,5 Tesla) bei einem Patienten eine indirekte Lymphographie in Kombination mit einer Kernspintomographie durchgeführt. Unmittelbar im Anschluß an die manuelle Injektion von je 1ml Gadolinum (1:5 Verdünnung mit NACL 0,9%) intrakutan im Bereich des Innen- und Außenknöchels (Injektionsdauer ca. 2 min) einer unteren Extremität mit ausgeprägten lymphödematösen Veränderungen wurden T1- und T2Sequenzen mit und ohne Fettsuppression erstellt. 3.2.11. Digitale Speicherfolienradiographie Bei 16 Patienten wurden analog zur xeroradiographischen Bilddokumentation nach in typischer Weise erfolgter Kontrastmittelinjektion Speicherfolienkassetten zur Bilddokumentation eingesetzt. Die Belichtung erfolgte im Obertischverfahren entsprechend dem Dosisbedarf einer konventionellen Film-Folien-Kombination der Empfindlichkeitsstufe S=200 mit 50 KV und 25 mAs bei einem Folien-Focus-Abstand von 100 cm. In Zusammenarbeit mit der Radiologischen Abteilung des Knappschaftskrankenhauses in Langendreer (s.o) wurden die Folien an der dort vorhandenen Speicherfolien-Radiographie-Einheit Fuji-Computed-Radiography- System AC-1 Plus mit angeschlossener Workstation DMS nachbearbeitet und auf Film ausgedruckt. Die sonst im Vergleich mit konventionellen Filmen geringere Ortsauflösung der Speicherfolien fällt bei Verwendung von Folien der Größe 24x30 nicht ins Gewicht. Da die volle Matrix einem Folienbereich von 18x24 zugeschrieben wird, ist die resultierende Ortsauflösung mit 5 Linienpaaren pro mm sicher ausreichend. Für die Nachbearbeitung der Bilder an der Workstation wurden Standardparameter festgelegt, um zum einen die primär vorhandenen Weichteilstrukturen und zum - 50 - anderen die kontrastierten Lymphkapillarnetze und Lymphkollektoren gesondert herauszuarbeiten und so eine vergleichbare Darstellung zu erhalten: Tabelle 4: Standardparameter für die digitale Speicherfolienradiographie bei der indirekten Lymphographie Bildversion 1 Bildversion 2 (Weichteilstrukturen) (Lymphkapillaren) GA 1,1 1,0 GT B H GC 0,8 1,2 GS -0,50 -0,45 RN 5 8 RT T P RE 3,5 3,0 GA = Rotation Amount. Definiert den Bildkontrast. GT = Contrast Type. Hierdurch wird der Bildkontrast festgelegt. (Nicht lineare Gradienten-Kurve). GC = Rotation Center. Der Parameter variiert den Kontrast in unterschiedlichen Dichteregionen. GS = Density Shift. Durch diese Einstellung wird die Bilddichte optimiert. RN = Frequency Rank. Nimmt Bezug auf die Größe der zu verstärkenden Struktur. (4-5=soft tissue, 6-9= particularly small structures ). RT = Frequency Type (Graininess emphasis type, sharpness emphasis type). Entsprechend der diagnostischen Fragestellung erfolg eine besondere Gewichtung von Schärfe oder Körnung. RT: U<T<P<F (= steigende Schärfebetonung). Hier mit T bzw. P mittlere Schärfebetonung. RE = Frequency Enhancement Degree. Standardwert: =5,0. . - 51 - 3.2.12. Isotopenlymphographie Die im Rahmen dieser Studie augewerteten Isotopenlymphographien wurden alle nach der an der hiesigen Abteilung standardisierten Methode durchgeführt. Es werden 37 MBq 99m Technetium Nanocoll in einem Volumen von 0,5 Millilitern pro Depot injiziert. Die Injektion erfolgt über eine 30G-Nadel subkutan in die Schwimmhäute des ersten Interdigitalraumes der jeweiligen Extremität. Die Messungen werden mit einer Gammakamera mit Photomultiplier und Parallellochkollimator (PHO/Gamma HP, Nuclear Chicago) mit einem 39cm Aufnahmefeld erstellt. Der Kamera ist ein Rechner für die Datenverarbeitung mit der Möglichkeit zur Film- und Photodokumentation (Scintiview 2 von Siemens) angeschlossen. Ein Teil der Untersuchungen wurde mit dem neu in der Abteilung installierten SPECT Starcam 3200i A/CT mit General Purpose Kollimator der Firma General Electric Medical Systems durchgeführt. Unmittelbar im Anschluß an die Injektion wird die Ausgangsaktivität über dem Vorfuß mit der Gammakamera bestimmt. Durch eine anschließende Aktivitätsmessung über Leber und Milz wird eine versehentliche intravenöse Injektion ausgeschlossen. Die Patienten legen dann eine definierte Strecke von 2600m in 60min zu Fuß zurück. Unmittelbar nach Rückkehr des Patienten werden die verbliebene Aktivität im Vorfußbereich sowie die Aktivität über den inguinal-pelvinen Lymphknoten gemessen. Durch eine erneute Messung über Leber und Milz wird die in den Blutkreislauf gelangte Menge des Radionuklids bestimmt. Aus den über dem Depot und den inguinalen Lymphknoten bestimmten Impulsen pro Minute (IpM) und dem Zerfallsfaktor für 99m werden dann die Abflußrate und die Einflußrate in Prozent bestimmt: IpM to = Impulse pro Minute direkt nach Injektion IpM t1 = Impulse pro Minute nach 60 min Zerfallsfaktor für 99m Technetium (Halbwertszeit 6h) nach 60 min = 1,12 Abflußrate (%) = - 52 - IpM t0 (Depot) - IpM t1 (Depot) x Zerfallsfa ktor IpM t0 (Depot) x 0,01 Technetium Einflußrat e (%) = IpM t1 (inguinal - pelvine Lymphknote n) x Zerfallsfa ktor IpM t0 (Depot) x 0,01 Aus der Ab- und Einflußrate wird die Lymphtransportkenngröße, der Quotient Q, nach folgenden Formeln berechnet: Q= (100 - Abflußrat e) % Einflußrat e % oder: Q= IpM t1 (Depot) IpM t1 (inguinal - pelvine Lymphknote n) Der Wert Q ist somit ein reziprokes Maß für die Stärke des Lymphtransportes. Er ist der statistisch aussagefähigste Wert zur Beurteilung der Lymphtransportfunktion (Tiedjen et al. 1990). 4. Eigene Untersuchungen Im Folgenden werden zunächst die Befunde der indirekten Lymphographie mit Xeroradiographie-Bilddokumentation vorgestellt. Anschließend Ergebnisse der Isotopenlymphographie und schließlich die werden die Untersuchungen mit alternativen bildgebenden Verfahren dargelegt. Es werden dabei zur Auswertung jeweils die Befunde der einzelnen untersuchten Extremitäten erfaßt und nicht die patientenbezogenen Diagnosen. Die Tatsache, daß sich bei einigen Patienten seitendifferente Befund ergaben, bzw. nur eine Extremität untersucht wurde bleibt somit unberücksichtigt. 4.1. Morphologische Befunde bei der indirekten Lymphographie mit Xeroradiographie-Bildokumentation Als abschließende Diagnose ergaben sich bei den 619 untersuchten Extremitäten 239 reine Lymphödeme, 92 reine Lipödeme, 146 Lipo-Lymphödeme, 95 VenoLymphödeme und 47 Normalbefunde. An 10 Extremitäten wurde die klinische - 53 - Diagnose: idiopathisch-zyklisches Ödem gestellt. Hierunter befanden sich 6 Extremitäten mit Lipödem und 4 Normalbefunde. Bei einem Normalbefund bestand klinisch eine Dermoepidermitis ohne Beteiligung der Lymphgefäße, bei einem weiteren Patienten mit Dermoepidermitis ließ sich eine Mitbeteiligung der Lymphgefäße nachweisen (Tabelle 5). Tabelle 5: Klinische Diagnosen der 619 untersuchten unteren Extremitäten Klinische Diagnose Lipödem Lymphödem VenoLymphödem LipoLymphödem Normal 92 239 95 146 47 Extremitäten Von allen untersuchten Extremitäten zeigten 20,2% ein geschlossenes und 30,7% ein flammenförmig konfiguriertes Injektionsdepot. Bei 49,1% der Beine war das Depot zumeist ausgefranst, oder aber flächenhaft, diffus oder unscharf berandet (Tabelle 6). Tabelle 6: Injektionsdepot aller untersuchten Extremitäten (n=619) Injektionsdepot Extremitäten n= 125 geschlossen flächenhaft 31 ausgefranst 204 unscharf berandet 45 diffus 24 flammenförmig 190 Initiale Lymphgefäße waren an den untersuchten unteren Extremitäten in 65,3% nachweisbar, - 54 - 27,3% zeigten kontrastierte Präkollektoren. Eine Kontrastmittelanreicherung der Cutis, entsprechend Refluxen in das Rete lymphocapillare der Haut, war in 38,1% vorhanden (Tabelle 7). - 55 - Tabelle 7: Kontrastierung von Strukturen des initialen Lymphgefäßsystems und kutane Kollateralisation bei allen untersuchten Extremitäten (n=619) initiale lymphatische Strukturen Extremitäten n= initiale Lymphgefäße 404 Präkollektoren 169 Kontrastmittel-Eingang in kutane Plexus 236 Die mittlere Kollektorzahl aller untersuchten Extremitäten lag bei 2,21. Die Gefäße waren im Mittel 0,483 mm weit und der mittlere maximale Durchmesser betrug 0,847 mm. Die meisten Lymphgefäße (48,5%) zeigten einen kurzstreckig geschlängelten korkenzieherartigen Verlauf, 18,6% kamen langstreckig geschlängelt zur Darstellung, 26,5% verliefen gestreckt und 2,4% kreuzten nach dorsal. In 7,6% der Fälle waren keine Kollektoren kontrastiert, Gefäßabbrüche wiesen 13,8% auf und bei 1,3% ließ sich eine Kontrasmittel-Extravasation bzw. ein Gefäßabbruch nachweisen(Tabelle 8). Tabelle 8: Charakteristika der Lymphkollektoren aller untersuchten Extremitäten (n=619) Lymphkollektoren Kollektorzahl Anzahl mm 2,21 Mittlere Weite (aller vermessenen Kollektoren) 0,48 Mittlere maximale Weite (der jeweils weitesten Kollektoren) 0,85 Verlauf gestreckt langstreckig geschlängelt 115 kurzstreckig geschlängelt 300 Kreuzung 15 fehlende Darstellung 47 Kollektorabbrüche - 56 - 164 81 Kontrastmittel-Extravasat 8 Ein großer Teil der Extremitäten zeigte in der xeroradiographischen Gewebeanalyse eine Fibrose (69,1%) oder eine Verbreiterung (85,9%) des Unterhautfettgewebes. Bei 79% war eine Verdickung der Cutis selbst nachweisbar. Eine Lymphangio- oder Phlebosklerose kam bei 3,4% zur Darstellung und in 2,6% zeigte sich bereits nativxeroradiographisch ein Ulcus cruris (Tabelle 9). Tabelle 9: Xeroradiographische Befunde aller untersuchten Extremitäten (n=619) Xeroradiographie Fibrose Extremitäten n= 428 verbreiterte Cutis 409 Verbreiterte Subcutis 532 Sklerose 21 Ulcus 16 - 57 - 4.1.1. Extremitäten mit Normalbefund 4.1.1.1. Beispiel Ein indirekt-lymphographischer Normalbefund ist in Abb.3 dargestellt. Neben einem geschlossenen Injektionsdepot findet sich ein gestreckt verlaufender Lymphkollektor. Zarte Präkollektoren kommen hier häufiger zur Darstellung (8%) und sind nicht als pathologisch zu werten. Initiale Lymphgefäße sind nicht kontrastiert, Haut und Unterhautfettgewebe zeigen keine Auffälligkeiten (Abb.3). Abb. 3: W. M., weibl, 36 Jahre. Normalbefund. Geschlossenes Injektionsdepot, zarter, gestreckt verlaufender Kollektor. Cutis und Subcutis zeigen keine Auffälligkeiten. - 58 - 4.1.1.2. Morphologische Befunde Der weitaus größte Teil der normalen Extremitäten zeigte ein geschlossenes, kompaktes Injektionsdepot. Nur bei 3 Extremitäten (6,8%) war das Depot mäßig ausgefranst (Tabelle 10). Tabelle 10: Injektionsdepot der Extremitäten mit Normalbefund (n=47) Injektionsdepot geschlossen Extremitäten n= 44 flächenhaft 0 ausgefranst 3 unscharf berandet 0 diffus 0 flammenförmig 0 Initiale Lymphgefäße kamen bei den Normalen oder Gesunden in keinem Fall zur Darstellung, ebenso ließen sich hier keine kutanen Kollateralisationsphänomene nachweisen. In zwei Fällen kamen zarte Präkollektoren zur Darstellung, die jedoch in der Gesamtbeurteilung als nicht pathologisch gewertet wurden (Tabelle 11). Tabelle 11: Kontrastierung von Strukturen des initialen Lymphgefäßsystems und kutane Kollateralisation bei Extremitäten mit Normalbefund (n=47) initiale lymphatische Strukturen Extremitäten n= initiale Lymphgefäße 0 Präkollektoren 2 Kontrastmittel-Eingang in kutane Plexus 0 - 59 - Bei den normalen Beinen kamen im Mittel 2,6 Kollektoren zur Darstellung. Sie wiesen eine mittlere Weite von 0,46 mm und eine mittlere maximale Weite von 0,79 mm auf. Der Verlauf war größtenteils gestreckt (91,5%), nur bei 4 Extremitäten konnte ein langstreckig geschlängelter Verlauf dokumentiert werden. Kurzstreckige, korkenzieherartige Schlängelung und Kreuzungen, Kollektorabbrüche oder Kontrastmittel-Extravasate waren in keinem Fall nachweisbar (Tabelle 12). Tabelle 12: Charakteristika Normalbefund der (n=47 Lymphkollektoren Extremitäten). bei Extremitäten Mittelwert und mit Standard- abweichung der Kollektorweite(mm) Lymphkollektoren Kollektoranzahl Anzahl mm 2,6 mittlere Weite (aller vermessenen Kollektoren) 0,46±0,15 mittlere maximale Weite (der jeweils weitesten Kollektoren) 0,79±0,21 Verlauf gestreckt 43 langstreckig geschlängelt 4 kurzstreckig geschlängelt 0 Kreuzung 0 fehlende Darstellung 0 Kollektorabbrüche 0 Kontrastmittel-Extravasat 0 - 60 - Bis auf eine angedeutete Fibrose an einem Bein waren pathologische xeroradiographische Befunde bei den als unauffällig befundeten Extremitäten nicht zu erheben (Tabelle 13). Tabelle 13: Xeroradiographische Befunde bei normalen Extremitäten (n=47 Extremitäten) Xeroradiographie Fibrose Extremitäten n= 1 verbreiterte Cutis 0 verbreiterte Subcutis 0 Sklerose 0 Ulcus 0 - 61 - 4.1.2. Extremitäten mit chronischen Lymphödemen 4.1.2.1. Beispiel Abbildung 4 zeigt den typischen Befund eines chronischen Lymphödems. Das Injektionsdepot wirkt ausgefranst und unscharf berandet, bedingt durch die Darstellung von initialen Lymphgefäßen in der Peripherie des Depots. Der abgebildete Lymphkollektor ist ektatisch und hat einen eng geschlängelten, korkenzieherartigen Verlauf. Die Cutis kommt deutlich verbreitert zur Darstellung. Das Unterhautfettgewebe zeigt neben einer Verbreiterung eine honigwabenartige Fibrosierung (Abb.4). Abb. 4: K. C., weibl., 53 Jahre. Lymphödem. Ausgefranstes Injektionsdepot, ektatischer, korkenzieherartig geschlängelt verlaufender Lymphkollektor, verbreiterte und fibrosierte Subcutis und Cutis. - 62 - 4.1.2.2. Morphologische Befunde Diese Gruppe umfaßt Extremitäten mit reinen chronischen Lymphödemen ohne Kombination mit einem Lipödem oder einer chronischen venösen Insuffizienz. Nur bei 38 Extremitäten (15,8%) fand sich ein geschlossenes Depot, flammenförmige Depots kommen in dieser Gruppe nicht vor. Die weitaus meisten Depots sind ausgefranst (66%), ein geringerer Teil kommt flächenhaft oder unscharf berandet zur Darstellung (16,7%). An drei Extremitäten war eine diffuse Ausbreitung des Kontrasmittels nachweisbar (Tabelle 14). Tabelle 14: Injektionsdepot bei Extremitäten mit chronischem Lymphödem (n=239 Extremitäten) Injektionsdepot geschlossen Extremitäten n= 38 flächenhaft 23 ausgefranst 158 unscharf berandet 17 diffus 3 flammenförmig 0 In 223 Fällen (93,3%) erfolgte bei dieser Gruppe die Darstellung initialer Lymphgefäße in der Umgebung des Injektionsdepots. Präkollektoren waren bei 93 Beinen nachweisbar (38,9%) und bei mehr als der Hälfte der Extremitäten kam es zu einem Kontrastmittelreflux in kutane Lymphplexus (53,5%) (Tabelle 15). - 63 - Tabelle 15: Kontrastierung von Strukturen des initialen Lymphgefäßsystems und kutane Kollateralisation bei Extremitäten mit chronischen Lymphödemen (n=239) initiale lymphatische Strukturen initiale Lymphgefäße Extremitäten n= 223 Präkollektoren 93 KM-Eingang in kutane Plexus 128 Bei den reinen Lymphödemen kamen im Mittel 1,9 Kollektoren mit einer mittleren Weite von 0,57 mm und einer mittleren maximalem Weite von 1,05 mm zur Darstellung. Der Verlauf der Gefäße war zumeist kurzstreckig geschlängelt (63,6%), einen gestreckten Verlauf wiesen 21,3% auf, 5,9% verliefen langstreckig geschlängelt. Bei 17,6% zeigten sich Kollektorabbrüche bzw. Verschlüsse. Kreuzungen aus dem ventromedialen in das laterale Lymphgefäßbündel waren an 14 Beinen zu beobachten, bei 22 Beinen (9,2%) kamen keine Lymphkollektoren zur Darsellung. KM-Extravasate waren in 2 Fällen zu beobachten (Tabelle 16). Tabelle 16: Charakteristika der Lymphkollektoren bei Extremitäten mit chronischen Lymphödemen (n=239). Mittelwert und Standardabweichung der Kollektorweite(mm) Lymphkollektoren Kollektoranzahl Anzahl 1,9 mm Mittlere Weite (aller vermessenen Kollektoren) 0,57±0,20 Mittlere maximale Weite (der jeweils weitesten Kollektoren) 1,05±0,44 Verlauf gestreckt 51 langstreckig geschlängelt 14 kurzstreckig geschlängelt 152 Kreuzung 14 fehlende Darstellung 22 Kollektorabbrüche 42 KM-Extravasat 2 - 64 - Bei Extremitäten mit chronischem Lymphödem läßt sich in den weitaus meisten Fällen sowohl eine Fibrosierung (87,8%) und Verbreiterung des Unterhautfettgewebes (91,6%), als auch eine Verdickung der Cutis selbst (85,8%) nativ-xeroradiographisch nachweisen. In 3,8% kommen Sklerosierungen (Lymphangiosklerose) zur Darstellung, Ulzerationen waren nicht nachweisbar (Tabelle 17). Tabelle 17: Xeroradiographische Befunde bei reinen chronischen Lymphödemen (n=239) Xeroradiographie Fibrose Extremitäten n= 210 verbreiterte Cutis 205 verbreiterte Subcutis 219 Sklerose 9 Ulcus 0 - 65 - 4.1.3. Extremitäten mit Lipödem 4.1.3.1. Beispiel Die Abbildung 5 zeigt den charakteristischen Befund eines Lipödems. Aus einem flammenförmig konfigurierten Depot entwickeln sich normalkalibrige Kollektoren, die langstreckig geschlängelt durch das Unterhautfettgwebe verlaufen. Der Unterschenkel zeigt eine deutliche Keulenform mit Verbreiterung der Subcutis bei normal breiter Cutis (Abb.5). Abb. 5: P. S., weibl., 46 Jahre. Lipödem. Flammenförmig konfiguriertes Injektionsdepot, normalkalibrige, weitbogig geschlängelt verlaufende Kollektoren, verbreiterte Subcutis, normal breite Cutis. - 66 - 4.1.3.2. Morphologische Befunde Eine typische Flammenform zeigte das Depot bei den Extremitäten mit Lipödem in 89%. Geschlossene, kompakte Depots war bei 6,5% nachweisbar, und nur 4,3% zeigten eine diffuse, ausgefranste oder unscharf berandete Ausbreitung des Kontrastmittels an der Injektionsstelle (Tabelle 18). Tabelle 18: Injektionsdepot bei Extremitäten mit Lipödem (n=92) Injektionsdepot geschlossen Extremitäten n= 6 flächenhaft 0 ausgefranst 1 unscharf berandet 1 diffus 2 flammenförmig 82 Initiale Lymphgefäße und kutane Kollateralisation waren bei Patienten mit Lipödem in keinem Fall nachweisbar. Bei 6,5% der Extremitäten ließen sich kontrastierte Präkollektoren nachweisen (Tabelle 19). Tabelle 19: Kontrastierung von Strukturen des initialen Lymphgefäßsystems und kutane Kollateralisation bei Extremitäten mit Lipödem (n=92) initiale lymphatische Strukturen initiale Lymphgefäße Extremitäten n= 0 Präkollektoren 6 KM-Eingang in kutane Plexus 0 - 67 - Ein langstreckig geschlängelter Verlauf der großen Lymphgefäße war bei 72% der Beine aus der Gruppe der Lipödeme nachzuweisen, in einem geringeren Prozentsatz (18,5%) war der Verlauf gestreckt und in 9,8% verliefen die Gefäße kurzstreckig geschlängelt (Tabelle 20) . Tabelle 20: Charakteristika der Lymphkollektoren bei Extremitäten mit Lipödem (n=92). Mittelwert und Standardabweichung der Kollektorweite(mm) Lymphkollektoren Anzahl Kollektoranzahl mm 1,85 Mittlere Weite (aller vermessenen Kollektoren) 0,31±0,12 Mittlere maximale Weite (der jeweils weitesten Kollektoren) 0,48±0,16 Verlauf gestreckt 17 Langstreckig geschlängelt 66 Kurzstreckig geschlängelt 9 Kreuzung 0 fehlende Darstellung 0 Kollektorabbrüche 0 KM-Extravasat 0 Bei den Beinen mit der Diagnose Lipödem war die Subcutis in 85,8% der Fälle verbreitert und in 6,5% fibrosiert. Ebenfalls 6,5% der Extremitäten wiesen eine verbreiterte Cutis auf. Sklerosierungen und Ulzerationen kamen hier nicht zur Darstellung (Tabelle 21). Tabelle 21: Xeroradiographische Befunde bei Lipödemen (n=92) Xeroradiographie Extremitäten n= Firbose 6 verbreiterte Cutis 6 verbreiterte Subcutis 79 - 68 - Sklerose 0 Ulcus 0 4.1.4. Extremitäten mit Lipo-Lymphödemen 4.1.4.1. Beispiel Abbildung 6 zeigt ein Lipo-Lymphödem mit dem charakteristischen flammenförmigen Injektionsdepot, in dessen Umgebung sich eine Vielzahl kontrastierter Lymphkapillaren darstellt. Das Depot wirkt durch diese feinen Gefäße zusätzlich ausgefranst und unscharf berandet. Die deutlich verbreiterte und fibrosierte Cutis zeigt eine flächige Kontrastmittelaufnahme im Sinne einer kutanen Kollateralisation. Der Unterschenkel hat eine deutliche Keulenform und das Unterhautfettgewebe ist von retikulären wabenartigen Verdichtungsstrukturen durchsetzt (sogenannte Honeycombs) (Abb.6). - 69 - Abb. 6: A. M., weibl., 52 Jahre. Lipo-Lymphödem. Flammenförmiges, ausgefranstes Injektionsdepot. Deutliche KM-Aufnahme der verbreiterten, fibrosierten Cutis. Retikuläre Verdichtungsstrukturen des Unterhautfettgewebes. 4.1.4.2. Morphologische Befunde Die Extremitäten mit Lipo-Lymphödemen zeigten in den weitaus meisten Fällen (67,1%) ebenfalls eine flammenförmig konfigurierte Verteilung des Kontrastmittels an der Injektionsstelle, in 15% war das Depot kompakt geformt. Unscharf berandete, diffuse oder ausgefranst wirkende Depots kamen in 17,8 % der Fälle zur Darstellung (Tabelle 22). Tabelle 22: Injektionsdepot bei Extremitäten mit Lipo-Lymphödem (n=146) Injektionsdepot Extremitäten n= geschlossen 22 flächenhaft 0 ausgefranst 14 unscharf berandet 8 diffus 4 flammenförmig 98 In dieser Gruppe waren an 89,7% der untersuchten unteren Extremitäten initiale Lymphgefäße darstellbar, 41,1 % zeigten Präkollektoren und eine Kontrastmittelanreicherung in der Cutis war in 48,6 % nachzuweisen (Tabelle 23). Tabelle 23: Kontrastierung von Strukturen des initialen Lymphgefäßsystems und kutane Kollateralisation bei Extremitäten mit Lipo-Lymphödemen (n=146) initiale lymphatische Strukturen - 70 - Extremitäten n= initiale Lymphgefäße 131 Präkollektoren 60 KM-Eingang in kutane Plexus 71 Extremitäten mit Lipo-Lymphödemen weisen im Durchschnitt 2,1 kontrastierte Kollektoren auf. Der mittlere Durchmesser liegt bei 0,49 mm, die mittlere maximale Weite bei 0,85 mm. Zumeist ist der Verlauf korkenzieherartig kurzstreckig geschlängelt (54,8%), in 17,8% der Fälle langstreckig geschlängelt, und 15,1% verlaufen gestreckt. Keine Kollektoren konnten in 12,3 % gefunden werden, 2,7% zeigten Gefäßabbrüche bzw. Verschlüße. Kontrastmittelextravasate waren in dieser Gruppe nicht nachweisbar (Tabelle 24). Tabelle 24: Charakteristika der Lymphkollektoren bei Extremitäten mit LipoLymphödem (n=146). Mittelwert und Standardabweichung der Kollektorweite(mm) Lymphkollektoren Kollektorzahl Anzahl mm 2,1 mittlere Weite (aller vermessenen Kollektoren) 0,49±0,19 mittlere maximale Weite (der jeweils weitesten Kollektoren) 0,85±0,37 Verlauf gestreckt 22 langstreckig geschlängelt 26 kurzstreckig geschlängelt 80 Kreuzung 0 fehlende Darstellung 18 Kollektorabbrüche 4 KM-Extravasat 0 - 71 - Jeweils 80,1% der Extremitäten mit Lipo-Lymphödem wiesen eine Fibrose bzw. verbreiterte Cutis auf. In fast allen Fällen (97,9%) war das Unterhautfettgewebe verbreitert und 1,4% zeigten eine Lymphangio-Phlebosklerose (Tabelle 25). - 72 - Tabelle 25: Xeroradiographische Befunde bei Lipo-Lymphödemen (n=146) Xeroradiographie Extremitäten n= Fibrose 117 verbreiterte Cutis 117 verbreiterte Subcutis 143 Sklerose 2 Ulcus 0 - 73 - 4.1.5. Extremitäten mit Veno-Lymphödemen 4.1.5.1. Beispiel Die Xeroradiographie in Abb.7 zeigt einen typischen Befund für ein Lymphödem bei chronischer venöser Insuffizienz. Das ausgefranst wirkende Depot wird in seiner unmittelbaren Umgebung von zahlreichen kleinen Lymphkapillaren umgeben. Der dilatierte Lymphkollektor zeigt einen eng gewundenen, korkenzieherartigen Verlauf. Neben deutlichen retikulären, streifigen Verdichtungen der Subcutis wird eine deutlich verbreiterte Cutis auffällig. Daneben zeigen sich lymphangio- und phlebosklerotische, kalkige Verdichtungen (Abb.7). Abb. 7: S. B., weibl., 59 Jahre. Veno-Lymphödem. Kontrastierte initiale Lymphgefäße in der Peripherie des Depots, dilatierter, korkenzieherartig geschlängelt verlaufender Kollektor. Verbreiterung von Cutis und Subcutis. phlebosklerotische Verdichtungen im Unterhautfettgewebe. - 74 - Lymphangio- und 4.1.5.2. Morphologische Befunde Extremitäten von Patienten mit der Kombination chronische venöse Insuffizienz und Lymphödem wiesen in den meisten Fällen (73%) ausgefranste, flächenhafte, diffuse oder unscharf berandete Injektionsdepots auf. Ein kompaktes Depot war nur bei 15,8% nachweisbar, in 10,5% kam es flammenförmig zur Darstellung (Tabelle 26). Tabelle 26: Injektionsdepot bei Extremitäten mit Veno-Lymphödem (n=95) Injektionsdepot Extremitäten n= geschlossen 15 flächenhaft 8 ausgefranst 28 unscharf berandet 19 diffus 15 flammenförmig 10 In mehr als der Hälfte der Beine aus dieser Gruppe (52,6%) waren initiale Lymphgefäße kontrastiert und 35,8% wiesen eine kutane Kollateralisation auf. Präkollektoren wurden in 8,4% dokumentiert (Tabelle 27). Tabelle 27: Kontrastierung von Strukturen des initialen Lymphgefäßsystems und kutane Kollateralisation bei Extremitäten mit Veno-Lymphödemen (n=95) initiale lymphatische Strukturen Extremitäten n= initiale Lymphgefäße 50 Präkollektoren 8 KM-Eingang in kutane Plexus 37 - 75 - In dieser Gruppe wurden im Durchschnitt 2,6 Kollektoren pro Extremität kontrastiert. Die mittlere Weite lag bei 0,59 mm und der mittlere maximale Durchmesser betrug 1.06 mm. Die Kollektoren verliefen größten Teils korkenzieherartig durch die Subcutis (62,1%), in 32,6 % war der Verlauf gestreckt und 5,3% waren langstreckig geschlängelt. Häufig kamen hier Kollektorabbrüche (36,8%) vor, in 6,3% ließ sich eine Extravasation nachweisen, und bei 7,4% waren keine Lymphkollektoren kontrastiert (Tabelle 28). Tabelle 28: Charakteristika der Lymphkollektoren bei Extremitäten mit VenoLymphödem (n=95). Mittelwert und Standardabweichung der Kollektorweite(mm) Lymphkollektoren Kollektoranzahl Anzahl mm 2,6 mittlere Weite (aller vermessenen Kollektoren) 0,59±0,23 mittlere maximale Weite (der jeweils weitesten Kollektoren) 1,06±0,44 Verlauf gestreckt 31 langstreckig geschlängelt 5 kurzstreckig geschlängelt 59 Kreuzung 1 fehlende Darstellung 7 Kollektorabbrüche 35 KM-Extravasat 6 Alle Extremitäten mit Veno-Lymphödemen (100%) wiesen eine fibrosierte Subcutis auf, diese war in 83,1% auch verbreitert. Eine Verdickung der Subcutis selbst zeigte sich in 87,3%. Eine Phlebo-Lymphangiosklerose war bei 10,5% nachweisbar und in 16,8% der Fälle zeigten sich Hautdefekte als Ausdruck von Ulzerationen (Tabelle 29). - 76 - Tabelle 29: Xeroradiographische Befunde bei Veno-Lymphödemen (n=95) Xeroradiographie Extremitäten n= Fibrose 95 verbreiterte Cutis 83 verbreiterte Subcutis 79 Sklerose 10 Ulcus 16 4.2. Isotopenlymphographische Befunde An allen 619 Beinen wurde eine Isotopenlymphographie entsprechend der vorbeschriebenen Methode durchgeführt. Dabei wiesen die Extremitäten mit Normalbefund die erwartungsgemäß niedrigsten Werte für den Quotienten Q als inverses Maß für den Lymphtransport auf. Die Mittelwert lag für diese Gruppe bei 5,13, die Standardabweichung betrug ± 2,74. Den nächst höheren Wert zeigten die Beine mit Lipödemen. Hier lag der Mittelwert bei 10 mit einer Standardabweichung von ± 17,41. Bei der chronischen venösen Insuffizienz lag der Mittelwert mit 19,82 deutlich höher bei einer Standardabweichung von ± 33,84. Ein ähnlich hoher Mittelwert fand sich mit 20,31 bei den Lipo-Lymphödemen (Standardabweichung ± 26,93). Den deutlich höchsten Mittelwert für den Quotienten Q wiesen die Extremitäten mit chronischen Lymphödemen ohne Kombinationsformen auf. Er betrug 55,32 bei einer Standdardabweichung von ± 71,64 (Tabelle 30). - 77 - Tabelle 30: Isotopenlymphographie bei n=619 Extremitäten. Mittelwerte und Standardabweichung für Q = (100-Abflußrate)%: Einflußrate% und prozentuale Verteilung in normale (Q<10), eingeschränkte (Q=10-40) und stark eingeschränkte (Q=>40) Lymphtransportraten. Quotient Q Mittelwert Befunde Q=<10 Q=10-40 Q=>40 Normalbefund 5,13 ± 2,74 93% 7% 0% Lipödem 9,99 ± 17,41 83% 15% 2% Lymphödem 55,32 ± 71,64 26% 39% 35% Lipo-Lymphödem 20,31 ± 26,93 50% 40% 10% Veno-Lymphödem 19,82 ± 33,84 54% 24% 22% 4.3. Ergebnisse der indirekten Lymphographie mit Xeroradiographie und Isotopenlymphographie Im Folgenden werden zunächst jeweils die Fälle erläutert, in denen klinisch kein ausreichender Beleg für das Vorliegen eine Lymphödems vorlag (Stemmer‘sches Zeichen negativ). Schließlich werden die Ergebnisse in Bezug auf die Extremitäten mit positivem klinischem Befund (Stemmer’sches Zeichen positiv) dargestellt und abschließend werden die Ergebnisse bezogen auf den „Goldstandard“ (abschließende Diagnose) unabhängig vom klinischen Befund erläutert. 4.3.1. Normalbefunde Keiner der als gesund befundeten Patienten wies ein Stemmer’sches Zeichen im Bereich der Zehen auf. Die indirekte Lymphographie war ausnahmslos unauffällig, diskrete Präkollektordarstellungen waren dabei vereinzelt zu beobachten (8%) und - 78 - wurden nicht als pathologisch gewertet. Bei drei der Patienten lagen die Lymphtransportraten in der Isotopenlymphographie jeweils an einer Extremität im grenzwertig pathologischen Bereich (Q= 10,3%, 12,9%,10,6%) bei hochnormalen Transportraten auf der an deren Seite (Tabelle 31). Tabelle 31: Pathologische Befunde in Untersuchungsverfahren bei einem oder klinischem mehreren Normalbefund (Stemmer’sches Zeichen negativ) (n=47 gesunde Extremitäten) Xer o ILG Indirekte Lymphographie 0 0 0 4.3.2. Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 0 0 Xero+ ILG 0 Indirekte Kein Befund Lymphographie+ ILG 0 0 Lymphödeme In den weitaus meisten Fällen war die Diagnose ”Lymphödem” allein auf Grund des klinischen Befundes zu stellen. So wiesen nur 14 Patienten (5,8%) in dieser Gruppe an einem oder beiden Beinen kein Stemmer‘sches Zeichen auf (19 von 239 Beinen = 7,9%). Zwei Patienten hatten einseitige Lymphödeme (ein Erysipel, eine DermoEpidermitis) mit pathologischer indirekter Lymphographie und Xeroradiographie. Bei vier Patienten war das Stemmer‘sche Zeichen beidseits negativ. Einer dieser Patienten zeigte ebenfalls deutliche pathologische Veränderungen in der indirekten Lymphographie und Xeroradiographie bei unauffälligen Lymphtransportraten. In dem zweiten Fall bestand klinisch beidseits ein induriertes Ödem mit pathologischer indirekter Lymphographie, Xeroradiographie und ILG an einem Bein, während die andere Extremität allein hochpathologische Lymphtransportraten aufwies. Eine weitere Patientin zeigte beidseits Pathologica in allen drei Untersuchungsverfahren, in einem vierten Fall war nur die Is otopenlymphographie beidseits auffällig. Alle drei Untersuchungsparameter waren also bei drei Extremitäten pathologisch (15,8%), - 79 - und bei ebenfalls 15,8 % wurde die Diagnose auf Grund der Isotopenlymphographie gestellt. Von den Patienten mit seitendifferenten klinischen Befunden waren bei sechs Beinen Indirekte Lymphographie und Xeroradiographie auffällig, in 2 Fällen erfolgte die Diagnosestellung auf Grund der indirekt-lymphographischen Befunde. Somit war die Xero-Lymphographie in 57,9% ausschlaggebend für die Diagnose, die indirekte Lymphographie alleine in 10,5%. Es lag hier jeweils offensichtlich eine seitendifferent starke klinische Ausprägung eines präexistenten Lymphödems vor (Tabelle 32). Tabelle 32: Pathologische Befunde Untersuchungsverfahren (Stemmer’sches in bei Zeichen einem klinisch negativ) oder mehreren unauffälligem (n=19 Befund Extremitäten mit Lymphödem) Xer o 0 ILG Indirekt Xero+ e Indirekte Lympho- Lymphographie graphie 3 2 Xero+ Indirekte Lymphographie+ ILG Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 3 0 0 0 11 173 der 220 Extremitäten mit positivem Stemmer‘schem Zeichen, die letztlich als chronisches Lymphödem beurteilt wurden, zeigten in allen drei Untersuchungsverfahren Pathologica (78,63%). In 18 Fällen (8,18%) waren indirekte Lymphographie und Xeroradiographie pathologisch, bei unauffälliger Isotopenlymphographie. Jeweils zwei Beine zeigten nur eine pathologische Xeroradiographie bzw. Isotopenlymhographie und an sieben Extremitäten waren indirekte Lymphographie und Isotopenlymphographie pathologisch. Eine ausschließlich pathologische indirekte Lymphographie fand sich in 5% (elf Beine), und an sieben Extremitäten waren alle Untersuchungsverfahren unauffällig. In fünf dieser Fälle bestanden deutliche Veränderungen an der anderen mituntersuchten Extremität und bei einem Patienten lag klinisch ein akutes (internistisches) Ödem vor (Tabelle 33). - 80 - - 81 - Tabelle 33: Pathologische Befunde bei klinischer Diagnose: Lymphödem (Stemmer’sches Zeichen positiv) (n=220 Extremitäten) Xer o 2 ILG Indirekte Lymphographie 2 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 18 11 173 Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 0 7 7 In Bezug auf die aus klinischer Untersuchung und apparativen Verfahren resultierende abschließende Diagnose waren bei 176 der 239 Extremitäten (73,64%) die Ergebnisse aller Verfahren gleichermaßen pathologisch. In 20 Fällen (8,36%) war nur die indirekte Lymphographie auffällig, und bei 22 Extremitäten (9,2%) ließen sich zusätzlich Weichteilveränderungen in der Xeroradiographie nachweisen. Je sieben Beine (2,92%) waren ohne Befund oder zeigten Veränderungen in der indirekten Lymphographie und Isotopen-Methode zugleich. Erniedrigte Transportraten alleine ergaben sich für fünf Beine (2,1%) und zwei Extremitäten waren ausschließlich xeroradiographisch auffällig (Tabelle 34). Tabelle 34: Pathologische Befunde in einem oder mehreren Untersuchungsverfahren bei Extremitäten mit der abschließenden Diagnose: ”Chronisches Lymphödem” (n=239 Extremitäten) Xer o 2 - 82 - ILG Indirekte Lymphographie 5 20 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 22 176 Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 0 7 7 4.3.3. Lipödeme Alle reinen Lipödeme wiesen ein negatives Stemmer’sches Zeichen auf . In der indirekten Lymphographie konnten neben der häufig zu beobachtenden flammenförmigen Ausbreitung des Kontrastmittels am Injektionsort keine weiteren Auffälligkeiten gefunden werden. Die Xeroradiographie zeigte neben einer Verbreiterung der Subcutis vereinzelt angedeutete zarte Fibrosierungen, die für sich allein als nicht pathologisch im Sinne eines chronischen Lymphödems gewertet wurden. Patienten mit positivem Stemmer’schem Zeichen wurden nicht in die Gruppe der Lipödeme eingeordnet (Tabelle 35). Tabelle 35: Pathologische Befunde in einem oder mehreren Untersuchungsverfahren bei klinisch reinem Lipödem (Stemmer’sches Zeichen negativ) (n=92 Exemitäten) Xer o 0 4.3.4. Bei ILG Indirekte Lymphographie 0 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 0 0 Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 0 0 0 0 Lipo-Lymphödeme den letztlich als Lipo-Lymphödeme befundeten Beinen war das Hautfaltenzeichen in 33,3% der untersuchten Beine negativ, so daß hier in einem hohen Prozentsatz die endgültige Diagnose durch die apparativen Verfahren gestellt wurde. Dabei waren wiederum bei einem Drittel (33,3%) dieser Fälle die indirekte Lymphographie und xeroradiographische normalen Lymphtransportraten. 12,5% Weichteilanalyse zeigten eine pathologisch, unauffällige bei indirekte Lymphographie und Isotopenlymphographie bei deutlichen Fibrosierungen der Subcutis in der Xeroradiographie. Allein auf Grund der indirekten Lymphographie - 83 - wurde die abschließende Diagnose ebenfalls in 12,5 % der Fälle erhoben, bei 4,2 % waren pathologische Lymphtransportraten sowie Weichteilveränderungen in der Xeroradiographie ausschlaggebend. Alle drei Parameter waren bei 14,5% pathologisch und 12,5% zeigten allein eine auffällige Isotopenlymphographie. Bei 10,4 % waren indirekte Lymphographie und Isotopenlymphographie auffällig, bei regelrechtem Befund in der Xeroradiographie. Dabei lagen in 25% der Fälle asymmetrische Befunde vor, in der Hälfte dieser Fälle (50%) mit einem positiven Stemmer’schen Zeichen auf der anderen Seite. Die andere Hälfte der Patienten wies auf der anderen Seite klinisch und in den durchgeführten Untersuchungen ein reines Lipödem auf (Tabelle 36). Tabelle 36: Pathologische Befunde in einem oder mehreren Untersuchungsverfahren bei klinisch reinem Lipödem (Stemmer’sches Zeichen negativ) (n=48 Extremitäten) Xer o 6 ILG Indirekte Lymphographie 6 6 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 16 Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 2 5 0 7 Bei 54 Extremitäten aus der Gruppe der Lipo-Lymphödeme mit positivem Stemmer’schem Zeichen (55,10%) konnten in allen apparativen Verfahren Pathologica nachgewiesen werden. In 33,67% der Fälle waren nur die indirekte Lymphographie und Xeroradiographie auffällig (33 Beine) und bei 10,2 % (10 Beine) war allein die indirekte Lymphographie pathologisch. Bei einer Extremität waren alle Befunde unauffällig, bei deutlichen Veränderungen auf der anderen Seite. Hier lag offensichtlich ein verschieden stark ausgeprägter Befund bei klinisch eindeutig lipödematösem Habitus vor (Tabelle 37). - 84 - Tabelle 37: Pathologische Befunde bei klinischer Diagnose: Lipo-Lymphödem (Stemmer’sches Zeichen positiv) (n=98 Beine) Xer o 0 Bei ILG Indirekte Lymphographie 0 10 41,78% der Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 33 unabhängig 54 vom Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 0 0 1 Vorhandensein des Stemmer’schen Hautfaltenzeichens als Lipo-Lymphödeme beurteilten Extremitäten (61 von 146) ergaben alle Verfahren pathologische Befunde. 49 Extremitäten (33,56%) zeigten eine unauffällige indirekte Lymphographie und Xeroradiographie, während 16 Beine (10,96%) allein Veränderungen in der indirekten Lymphographie aufwiesen. Bei jeweils 6 Extremitäten (4,1%) zeigten nur die Xeroradiographie oder die IsotopenUntersuchung Auffälligkeiten, in fünf Fällen (3,42%) ergaben sich Pathologica in der indirekten Lymphographie und ILG und bei zwei Beinen (1,36%) waren Xeroradiographie und die Szintigraphie zugleich pthologisch. Nur in einem Fall (s.o) waren alle Befund negativ (0,6%) (Tabelle 38). Tabelle 38: Pathologische Befunde aller Extremitäten mit der abschließenden Diagnose:”Lipo-Lymphödem” (n=146 Extremitäten) Xer o 6 ILG Indirekte Lymphographie 6 16 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 49 61 Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 2 5 1 - 85 - 4.3.5. Lymphödem bei CVI Von den 95 Extremitäten der Patienten mit chronischer venöser Insuffizienz und Lymphödem war bei 20 Extremitäten kein Stemmer‘sches Zeichen nachweisbar (21,1%). Dabei fehlte es bei neun Patienten (18 Extremitäten) beidseits. Bei 14 dieser Extremitäten waren indirekte Lymphographie und Xeroradiographie jeweils beidseits pathologisch, zwei Patienten boten Pathologika in allen Untersuchungsverfahren. Bei den beiden asymmetrischen Befunden waren in einem Fall die indirekte Lymphographie und die Weichteilanalyse auffällig, in dem anderen Fall resultierte zusätzlich eine Einschränkung der Lymphtransportraten. Somit wurde in dieser Gruppe die Diagnose in 75% durch die Xero-Lymphographie und in 25% durch eine gleichzeitig bestehende Einschränkung der Lymphtransportraten in der Isotopenlymphographie gestellt (Tabelle 39). Tabelle 39: Pathologische Befunde in einem oder mehreren Untersuchungsverfahren bei klinisch chronischer venöser Insuffizienz ohne Hinweis auf ein Lymphödem (Stemmer’sches Zeichen negativ) (n=20 Extremitäten mit Lymphödem bei chronischer venöser Insuffizienz) Xer o 0 ILG Indirekte Lymphographie 0 0 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 15 5 Xero+ ILG Indirekte Lymphographie+ ILG Kein Befund 0 0 0 In dieser Gruppe ließen sich an 37 Extremitäten (49,33%) typische Veränderungen in Xero-Lymphographie und Isotopenlymphographie nachweisen. 28 Beine (37,33%) zeigten nur Veränderungen in der indirekten Lymphographie und Xeroradiographie, und bei fünf Extremitäten (6,66%) war allein die inirekte Lymphographie pathologisch. - 86 - Ebenfalls fünf Extremitäten boten Veränderungen in der Xeroradiographie und ILG (Tabelle 40). Tabelle 40: Pathologische Befunde bei klinischer Diagnose ”Lymphödem bei chronischer venöser Insuffizienz” (Stemmer’sches Zeichen positiv) (n=75 Beine) Xer o ILG Indirekte Lymphographie 0 0 5 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 28 Xero+ ILG 37 Indirekte Kein Lympho- Befund graphie+ ILG 5 0 0 Bei allen 95 Extremitäten dieser Guppe ergaben sich unabhänig vom klinischen Befund (Stemmer’sches Zeichen) in 94,73% entsprechende Veränderungen in der indirekten Lymphographie. Die Isotopenlymphographie war nur bei 47 Beinen (47,95%) auffällig. Alle drei Methoden zeigten bei 42 Beinen (44,21%) Pathologika und in 45,26 % der Fälle waren indirekte Lymphographie und Xeroradiographie auffällig. Je fünf Extremitäten (5,26%) wiesen nur Veränderungen in der indirekten Lymphographie bzw. Isotopenlymphographie auf (Tabelle 41). Tabelle 41: Pathologische Befunde aller Extremitäten mit der Diagnose ”Lymphödem bei chronischer venöser Insuffizienz” unabhängig vom klinischen Befund (n= 95 Extremitäten) Xer o ILG Indirekte Lymphographie 0 0 5 Xero+ Xero+ Indirekte Indirekte Lympho- Lymphographie graphie+ ILG 43 42 Xero+ ILG 5 Indirekte Kein Befund Lymphographie+ ILG 0 0 - 87 - 4.4. Validität In Ermangelung eines Goldstandards für die Diagnose: „Lymphödem“ kann an Hand der vorliegenden Untersuchungsergebnisse zumindest eine Einschätzung der Validität der klinischen Untersuchung (Stemmer‘sches Hautfaltenzeichen), sowie der apparativen Verfahren erfolgen. Als Goldstandard wird hierzu die endgültige Diagnose resultierend aus dem Befund der klinischen Untersuchung und der Auswertung der Untersuchungsverfahren zu Grunde gelegt. Hier erreicht die indirekte Lymphographie für alle Patientengruppen eine fast gleichermaßen hohe hohe Sensitivität: 94,14% für Lymphödeme, 89,72% für LipoLymphödeme und 94,73% für Lymphödeme bei CVI. Die Xeroradiographie erreicht 83,68% für Lymphödeme, 80,82% für Lipo-Lymphödeme und mit 94,73% eine der indirekten Lymphographie gleichwertige Sensitivität bei Lymphödemen bei CVI. Nur für Lymphödeme liegt die Sensitivität der Isotopen-Lymphographie mit 78,66% noch relativ hoch, während die Werte bei den Mischformen (49,83% bei Lipo- Lymphödemen bzw. 50,52% bei Lymphödem bei CVI) sicher unzureichend sind. Das Stemmer‘sche Hautfaltenzeichen kommt der indirekten Lymphographie bei den chronischen Lymphödemen sehr nahe (92%), erreicht jedoch bei Lipo- Lymphödemen mit 67,12% und bei der Kombinationsform Lymphödem/CVI deutlich niedrigere Werte (Tabelle 42). Tabelle 42: Sensitivität (%) in Bezug auf die endgültige Diagnose: Lymphödem Indirekte Lymphographie Lipo- Lymphödem bei Lymphödem CVI 94,14 89,72 94,73 83,68 80,82 94,73 78,66 49,31 50,52 92,00 67,12 78,94 Xeroradiographie IsotopenLymphographie Stemmer‘sches Zeichen - 88 - Die Spezifität liegt für alle apparativen Verfahren in allen drei Patientengruppen bei 100%. Dem Stemmer‘schen Hautfaltenzeichen ist mit >95% bei allen drei Gruppen ebenfalls eine hohe Spezifität zuzurechnen (Tabelle 43). Tabelle 43: Spezifität (%) in Bezug auf die abschließende Diagnose Lymphödem Indirekte Lymphographie Lipo- Lymphödem bei Lymphödem CVI 100 100 100 100 100 100 100 100 100 95,74 98,50 95,74 Xeroradiographie IsotopenLymphographie Stemmer`sches Zeichen 4.5. Alternative Bildgebung 4.5.1. Indirekte Lymphographie mit Bildverstärkerradiographie Für die Beurteilung der Abbildungsqualität wurde die Xeroradiographie als Goldstandard gewählt. Die Bildverstärker-Radiographieaufnahmen wurden von zwei unabhängigen Untersuchern mit den vorliegenden Xeroradiographien verglichen, und je nach subjektiv empfundener Güte der Übereinstimmung mit den xeroradiographisch zu erkennenden Details wurden Noten von 1 bis 5 vergeben. Dabei bedeutete 1 = sehr gut, 2 = gut, 3 = befriedigend, 4 = noch ausreichend und 5 = nicht ausreichend beurteilbar. Aus den jeweils vergebenen Noten der beiden Untersucher wurde der Mittelwert gebildet. Die Beurteilung erfolgte zum einen - 89 - bezüglich der Abbildungsqualität der Weichteilstrukturen (A), zum anderen bezüglich der Darstellung der kontrastierten Lymphgefäße (B) (Tabelle 44). Tabelle 44: Vergleich Xeroradiographie/Bildverstärker-Radiographie Extremitäten). Xeroradiographie = “Goldstandard“, (n=66 festgelegte Benotung = 1 Xeroradiographie Bildverstärker-Radiographie A B A B 1,0 1,0 3,2 4,5 Während die BV-Radiographie mit einer Note zwischen 4 und 5 nur unzureichenden Aufschluß über die Gewebestrukturveränderungen gibt, ist die Gefäßdarstellung mit einem Mittelwert von 3,2 noch als befriedigend anzusehen (Abb. 8b). Ein Vorteil gegeüber der Xeroradiographie liegt in dem niedrigeren Dosisbedarf. Dieser liegt bei 2,9 mGy je Xeroradiographie-Aufnahme und bei 0,4 mGy für jede einzelne Bildverstärker-Radiographieaufnahme. 4.5.2. Indirekte Lymphographie mit Speicherfolienradiographie Bei neun Patienten (18 Extremitäten) wurden zusätzlich zur Xeroradiographie Speicherfolien belichtet und den oben angegebenen Parametern entsprechend an einer Workstation nachbearbeitet. Hierbei erwies es sich als sinnvoll für die Gewebebeurteilung und die Beurteilung der kontrastierten Gefäßstrukturen jeweils Standardparameter festzulegen und so zwei unterschiedliche Bildversionen auszugeben. Beide Aufnahmen zeichnen sich infolge Gradationsanpassung und Korrektur der optischen Dichte einer gezielten als ausgesprochene Weichteilaufnahmen aus. Durch den großen Dynamikumfang der Folie und die Grauwertoptimierung während des Ausleseprozesses waren bei allen Aufnahmen - 90 - die Weichteilstrukturen gut beurteilbar. Während sich verdickte, streifig-retikuläre Strukturen der Haut und Unterhaut optimal durch einen Kantenbetonungsprozeß bei mittlerer Kernelgröße darstellen lassen, erfordert die kontrastreiche Wiedergabe der feinen netzförmigen Strukturen des subkutanen Lymphkapillarnetzes und der Kollektoren die Verwendung eines kleinen Filterkernels. Die erhaltenen Bilder wurden analog zu den Bildverstärker-Aufnahmen mit den Xeroradiographien verglichen (Tabelle 45). Tabelle 45: Vergleich Xeroradiographie/Speicherfolien-Radiographie Extremitäten). Xeroradiographie = (n ”Goldstandard”, = 18 festgelegte Benotung = 1 Xeroradiographie Es Speicherfolien-Radiographie A B A B 1,0 1,0 1,8 2,3 ergaben sich für die Speicherfolien-Radiographie in Bezug auf die Gewebedarstellung als auch für die Beurteilung der kontrastierten Gefäße jeweils Noten um 2. Auch hier liegt der Doisbedarf (1,0 mGy je Aufnahme) deutlich niedriger als bei der Xeroradiographie (Abb. 8 c und d). - 91 - Abb. 8: chronisches Lymphödem a): Xeroradiographie mit Darstellung initialer Lymphgefäße, ektatischer Kollektoren und simultaner Wiedergabe retikulärer Gewebestrukturen b): digitale Bildverstärker-Radiographie mit ausreichender Beurteilbarkeit der Gefäßstrukturen, jedoch unzureichender Beurteilbarkeit der Gewebestrukturen c): Speicherfolien-Radiographie mit Betonung der Gewebestrukturen d): Speicherfolien-Radiographie mit Betonung der Gefäßstrukturen - 92 - 4.5.3. Indirekte Lymphographie und Computertomographie In Kombination mit der indirekten Lymphographie kann nach Weissleder (Weissleder 1995) keine aussagefähige Darstellung von Lymphgefäßen erzielt werden. Untersuchungen an der hiesigen Abteilung haben jedoch gezeigt, daß die nach indirekter Lymphographie durchgeführte CT bei Lymphödemen durchaus eine Darstellung und annähernde Größenbestimmung der Lymphgefäße ermöglicht. Bei den untersuchten Extremitäten mit chronischen Lymphödemen kamen unscharf berandete Injektionsdepots und kräftig kontrastierte, dilatierte Lymphkollektoren zur Darstellung. Analog läßt sich bei Lipödemen ein flammenförmig konfiguriertes Injektionsdepot nachweisen. Das erhebliche Kontrastmittel-Enhancement der Lymphkollektoren macht jedoch auf Grund der daraus resultierenden rechnerbedingten Artefakte eine exakte Größenbestimmung unmöglich. Initiale Lymphgefäße kommen nur undeutlich zur Darstellung, hier ist die Auflösung des Verfahrens als nicht ausreichend anzusehen. Sehr gut läßt sich hier eine Kontrastmittelaufnahme der verbreiterten Cutis als Ausdruck einer kutanen Kollateralisation erkennen und auch durch Dichtemessungen (in HE) verifizieren. Interessantester Aspekt der axialen Schnittbilder ist die in drei Fällen zu beobachtende Kreuzung von Lymphkollektoren aus dem ventromedialen in das dorsolaterale Lymphgefäßbündel, in einem Fall aus dem epifaszialen in des subfasziale Lymphgefäßsystem. Hier handelt es sich möglicherweise um einen Kompensationsmechanismus des Lymphgefäßsystems bei Lymphostase. Abbildung 9 zeigt ein axiales CT nach indirekter Lymphographie bei chronischem Lymphödem der rechten unteren Extremität. Neben kontrastierten Präkollektoren kommt innenseitig ein quer angeschnittener intrafaszialer Kollektor zur Darstellung. Die Cutis läßt besonders innenseitig eine deutlich Kontrasmittelaufnahme als Zeichen eines kutanen Umgehungskreislaufes erkennen. Die zusätzlich abgebildeten trabekulären Strukturen sind gemäß der Dichtemessung (3 HE) sicher liquide. - 93 - Präkollektor Abb.9: Axiales CT nach indirekter Lymphographie bei chronischem Lymphödem der rechten unteren Extremität. Darstellung von Präkollektoren innenseitig sowie eines quer angeschnittenen intrafaszialen Kollektors. Deutliche KM-Anreicherung der Cutis. Trabekuläre liquide Strukturen. In der Nativ-Darstellung lassen sich bei ausgeprägten Ödemen analog zur Magnetresonanztomographie und Sonographie ebenfalls trabekuläre Strukturen mit Dichtewerten im liquiden Bereich, wahrscheinlich ödemgefüllten interstitiellen Räumen entsprechend, darstellen. Der erhebliche Dosisbedarf und der zeitliche und apparative Aufwand für die Untersuchung limitieren den Einsatz des Verfahrens auf spezielle Fragestellungen wie Therapiekontrollen oder klinisch-wissenschaftliche Fragestellungen. 4.5.4. Indirekte Lymphographie und CT-3D-Rekonstruktion Die 3D-Rekonstruktion zeigt ein flächenhaftes, kutanes Injektionsdepot, das sich unmittelbar in ein weitläufiges kutanes Lymphkapillarnetz fortsetzt. So wird die - 94 - kutane Kollateralbildung über das Rete lymphocapillare besonders eindrucksvoll dargestellt. Die Rekonstruktion in Abb.10 zeigt nach rechnergestützter Analyse nur noch die Knochenstrukturen in Höhe des oberen Sprunggelenkes und Lymphgefäße, so das Lymphkapillarnetz, zahlreiche Präkollektoren im Bereich der Subcutis und einzelne Kollektoren. Da die Injektion unter Druck intrakutan erfolgt, müssen alle Lymphgefäße orthograd aufgefüllt worden sein, das heißt die Kontrastierung des Rete lymphokapillare stellt einen Beleg für die kutane Kollateralisation dar. Prinzipiell erbringt diese Bildgebung keine über die zweidimensionale Darstellung hinausgehende Information, ergänzt jedoch beweisend emissionscomputertomographische Szintigraphien, die in der Deutung problematisch sind. In der Diagnostik der Lymphödeme ergibt sich ansonsten gegenüber den vorangestellten Verfahren kein weitergehender Vorteil bei zudem wesentlich höherer Strahlenbelastung. Abb.10: CT-3D-Rekonstruktion bei chronischem Lymphödem des rechten Unterschenkels (indirekte Lymphographie). Linksseitig geschlossene, kompakte Injektionsdepots mit abführenden Lymphkollektoren. Rechtsseitig flächenhafte KMAnreicherung der Cutis. - 95 - 4.5.5. Indirekte Lymphographie und Magnetresonanztomographie In den nativen fettsupprimierten T2-Bildern (Abb. 11) kommen signalintensive trabekuläre Strukturen in der Subcutis zur Darstellung, die wahrscheinlich den auch sonographisch und computertomographisch faßbaren erweiterten, flüssigkeitsgefüllten interstitiellen Räumen entsprechen (Knorz et al. 1995). Abb.11: Axiales MRT (T2, FS) im Bereich des distalen Unterschenkels bei chronischem Lymphödem. Analog zum CT Darstellung signalintensiver, offensichtlich liquider trabekulärer Strukturen. Die fettsupprimierten T1-Bilder (Abb. 12) zeigen nach Kontrastmittelapplikation schlierenartig konfigurierte kontrastmittelaufnehmende Strukturen, die einerseits den oben beschriebenen interstitiellen Räumen entsprechen dürften, zum anderen handelt es sich hier möglicherweise um kontrastierte erweiterte initiale Lymphgefäße. Die Kontrastmittelaufnahme belegt zusätzlich, daß es sich bei der - 96 - Flüssigkeit offensichtlich um interstitielle Flüssigkeit handelt. Die breitflächige Anreicherung des Kontrastmittels in der Cutis belegt eine kutane Kollateralisation. Zusätzlich kommt inneneseitig ein gewunden verlaufender Kollektor zur Darstellung. Eine weitergehende Analyse dieser Strukturen, sowie Untersuchungen an einem größeren Patientenkollektiv werden den zukünftigen Stellenwert dieser Methode aufzeigen. Da es sich hier um einen besonders ausgeprägten Befund handelte ist insbesondere von Interesse, ob mit der Methode auch erheblich geringer ausgeprägte Veränderungen bei milden Lymphödemen erfaßt werden können. Ein Vorteil der Methode wäre sicher in der nicht vorhandenen Strahlenbelastung für den Patienten zu sehen. Kollektor Abb.12: Axiales MRT(T1,FS) im Bereich des distalen Unterschenkels bei chronischem Lymphödem (indirekte Lymphographie mit Magnevist). Deutliches Enhancement der Cutis. Darstellung eines gewunden verlaufenden Kollektors innenseitig. Schlierenartige kontrastmittelaufnehmende Strukturen. - 97 - 5. Diskussion 5.1. Andere Untersuchungen Die Befunde und Ergebnisse anderer Untersucher decken sich zum Teil mit unseren erhobenen Daten, zum Teil gibt es jedoch auch einige deutliche Unterschiede. Ohnehin ist ein Vergleich mit diesen Untersuchungen nur bedingt möglich, da sich methodisch Differenzen zeigen. So wurden z.B. unterschiedliche Injektionsstellen gewählt, z.T. wurden andere Injektionsnadeln verwendet, und in keinem Fall wurde mit xeroradiographischer Bilddokumentation gearbeitet. Iopamidol wurde ebenfalls von keinem der Autoren als Kontrastmittel verwendet. 1984 untersuchten Partsch und Mitarbeiter (Partsch et al. 1984 b) 38 Patienten mit Lymphödemen mittels indirekter Lymphographie. Als Kontrasmittel verwendeten sie Iotasul. Die Bilddokumentation erfolgte mit konventionellen Röntgenfilmen. Abweichend von unserer Untersuchung erfolgte die Injektion des Kontrastmittels an verschiedenen Stellen, so im Bereich der Zehen- und Fingerrücken bzw. Hand- und Fußrücken. Der Normalbefund wurde hier ebenfalls durch die fehlende Darstellung initialer Lymphgefäße charakterisiert. Bezüglich der dilatierten Kollektoren und der Darstellung initialer Lymphgefäße waren die Befunde ebenfalls identisch. Allerdings fanden sich bei zwei Patienten mit kongenitalen primären Lymphödemen keine initialen Lymphgefäße, sondern nur dilatierte Kollektoren. Abweichend von unserer Studie wurde hier ein Kontrastmitteleingang in kutane Lymphplexus jedoch nicht gesehen. In einer weiteren Studie untersuchten die gleichen Autoren (Partsch et al. 1986) 118 Patienten indirekt-lymphographisch in der zur standardisierten Methode entwickelten ”Simultantechnik” (Wenzel-Hora et al. 1985). Hier wurde u.a Iotasul an bis zu vier Injektionssstellen simultan injiziert. Auf Grund der indirekt-lymphographischen Darstellungen wurden die chronischen Lymphödeme in vier Typen eingeteilt. Typ 1 ist durch das Fehlen von Hautlymphgefäßen bei pathologisch strukturierten großen Kollektoren charakterisiert. Bei den Patienten handelte es sich vorwiegend um kongenitale Lymphödeme. Typ 2 zeigte eine Hyperplasie von initialen Lymphgefäßen bei Hypoplasie der Kollektoren (Patienten mit milden peripheren Lymphödema praecox und tardum). Typ 3 wird durch eine Erweiterung der initialen Lymphgefäße - 98 - als auch der Kollektoren definiert, die Patienten haben ausgeprägte Lymphödeme. Typ 4 schließlich definiert eine Gruppe von Patienten mit schweren indurierten Lymphödemen, bei denen keinerlei Lymphgefäße dargestellt werden können. 1989 untersuchten Weissleder und Mitarbeiter (Weissleder et al. 1989) 65 Patienten mit chronischen Lymphödemen indirekt-lymphographisch mit Iotrolan als Kontrastmittel und konventioneller Röntgendokumentation mit folienlosen Filmen. Übereinstimmend sind die Ergebnisse bei den Normalbefunden. Insbesondere wird auch in dieser Arbeit darauf hingewiesen, daß die Depotform abhängig vom Injektionsort auch bei Normalbefunden stark variieren kann. Bei Patienten mit chronischen Lymphödemen decken sich die erhobenen Befunde ebenfalls weitgehend mit unserern Ergebnissen, wenngleich hier die Ausprägung der pathologisch-morphologischen Veränderungen als direkt abhängig vom lymphszintigraphisch ermittelten Schweregrad der Lymphödeme beschrieben wird. So konnten bei Lymphödemen geringerer Ausprägung nur in 75% der Fälle pathologische Veränderungen der initialen Lymphstrombahn bzw. der Kollektoren nachgewiesen werden, bei ausgeprägten Lymphödemen zeigten dann alle Patienten die entsprechenden Veränderungen. Auch hier wurde ein Kontrastmittel-eingang in die Lymphplexus der Haut in keinem Fall nachgewiesen bzw. beschrieben. Anzumerken ist, daß in einigen Fällen kontrastierte axilläre bzw. inguinale Lymphknoten beschrieben werden. Weitere Veröffentlichungen zum Thema bauen im wesentlichen auf den Studien von Partsch auf (Gmeinwieser et al.1988, Stöberl et al. 1990). 5.2. Morphologische Befunde der Xero-Lymphographie Mit der indirekten Lymphographie lassen sich für den Gesunden wie für die verschiedenen Krankheitsbilder und deren Mischformen typische morphologische Veränderungen im Bereich der initialen Lymphgefäße und Lymphkollektoren regelmäßig nachweisen. - 99 - Kennzeichnend für den Normalbefund ist ein zumeist geschlossenes, kompaktes Injektionsdepot, normalkalibrige, gestreckt verlaufende Kollektoren und der fehlende Nachweis initialer Lymphgefäße. Die Lymphkollektoren lassen sich zumeist über eine Distanz von 40 cm, gelegentlich auch bis in Höhe der Leistenregion verfolgen. Die Analyse der Weichteilstrukturen zeigt eine normal breite Haut und Unterhaut ohne Verdichtungen. Pathognomonisch für das Lipödem ist ein flammenförmiges Injektionsdepot. Das Depot entspricht in seiner Darstellung dabei der Kontrastmittelverteilung zwischen den einzelnen Fettläppchen und einer speziellen Strukturierung der prälymphatischen Räume beim Lipödem (Stöberl et al 1986). Solche Depots lassen sich auch bei experimenteller Injektion von Kontrastmittel in Fettgewebestrukturen Gesunder, zum Beispiel in Höhe der Oberschenkel, regelmäßig nachweisen. Der langstreckig geschlängelte Verlauf der Kollektoren ist ebenfalls durch die Struktur des Unterhautfettgewebes mit einem erheblichen Plus an Fettgewebe zu erklären (Kinmonth 1982). Die Weichteilanalyse zeigt typischerweise eine alleinige Verbreiterung der „fettigen“ Subcutis bei normal breiter Cutis. Bei Lymphödemen kommen neben geschlossenen Injektionsdepots zumeist ausgefranste, aber auch flächenhaft, unscharf berandet oder diffus erscheinende Depots zur Darstellung. Diese Erscheinungsform ist durch Lymphgefäße in unmittelbarer Umgebung des Depots kontrastierte initiale bedingt. Unsere Untersuchungsergebnisse zeigen, daß die Depotform alleine nicht ausreicht, ein Lymphödem zu belegen. Insbesondere sei hier darauf hingewiesen, daß die Depotform analog zu den Befunden von Weissleder (s.o) abhängig vom Injektionsort stark variieren kann. So konnten bei Patienten mit chronischen Lymphödemen, die bei Injektion an der Innenseite des Unterschenkels alle indirekt-lymphographischen Kriterien eines Lymphödems mit deutlich ausgefransten Depots aufwiesen, bei einer zweiten Injektion in Höhe des Fußrückens kleine, kompakte Depots zur Darstellung gebracht werden. Die unterschiedliche Beschaffenheit des subkutanen Fettgewebes sowie die unterschiedliche Verteilung lymphödematöser Bereiche muß bei der Interpretation der Depotform also mit berücksichtigt werden. Die Lymphkollektoren sind deutlich erweitet und verlaufen zumeist geschlängelt. Diese - 100 - Dilatation der Lymphkapillaren und Kollektoren ist einerseits als Kompensationsmechanismus des Lymphgefäßsystems bei Lymphostase mit Erhöhung der Transportkapazität durch Steigerung des Transportvolumens der Lymphgefäße (Sicherheitsventilfunktion) zu interpretieren; andererseits kann bereits eine Schädigung der Lymphgefäße im Sinne einer mechanischen Insuffizienz (z.B. Klappeninsuffizienz, insuffiziente Lymphangiomotorik) vorliegen. Die in über der Hälfte der Fälle erfolgte Kontrastierung der Lymphgefäßplexus der Haut entspricht wahrscheinlich einem Umgehungskreislauf als Ausdruck eines weiteren Kompensationsmechanismus bei Lymphostase (s. 2.4.3.). Hierin finden die nicht selten beobachteten paradox erscheinenden normalen oder sogar hochnormalen Lymptransportraten in der Isotopenlymphographie bei Patienten mit indirektlymphographisch und klinisch eindeutigen Lymphödemen ihr morphologisches Korrelat. So lassen sich auch kamera-szintigraphisch und insbesondere mit der ECT Aktivitätsanreicherungen des Hautorgans nachweisen. Die Weichteile zeigen je nach Ausprägungsgrad der Erkrankung unterschiedlich starke Veränderungen. So kommen neben einer Verbreiterung von Cutis und Subcutis mehr oder weniger stark ausgeprägte retikuläre, zum Teil wabenartig konfigurierte streifige Verdichtungen von Haut und Unterhautfettgewebe zur Darstellung. Bei diesen bisher in der Literatur als Fibrosierungen bezeichneten Strukturen handelt tomographischen, es sich nach den oben beschriebenen magnetresonanztomographischen und computer- sonographischen Befunden jedoch zumindest teilweise um erweiterte flüssigkeitsgefüllte interstitielle Räume. Diese Annahme wird auch durch eine Beobachtung in unserer Arbeitsgruppe unterstützt, die eine vollständige Rückbildung dieser retikulären Verdichtungen in der Xeroradiograpie bei einem Patienten mit Armlymphödemen nach erfolgter manueller Lymphdrainage belegen (Fischer-Barth et al. 1995). Die beschriebene Kontrastmittelaufnahme Magnetresonanztomographie zeigt, daß in diese diese Strukturen interstitiellen in der Räume vom Lymphgefäßsystem drainiert werden. Sonographisch lassen sich diese erweiterten flüssigkeitsgefüllten Räume bei ausgeprägten Lymphödemen ebenfalls gut darstellen und durch leichten Druck beim Aufsetzen des Schallkopfes gut exprimieren (eigene Untersuchungen). Hier zeigt sich das pathologisch-morphologische Substrat für die Indikation zur manuellen Lymphdrainage, insbesondere dann, wenn es sich um ein eiweißreiches Ödem, also ein Lymphödem handelt. Hier muß neben einer Senkung des Gewebedruckes durch Mobilisation der Ödemflüssigkeit die Verhinderung der - 101 - durch Proteinakkumulation im Gewebe induzierten Bindegewebsproliferation mit konsekutiver Fibrose als therapeutisch zwingend indiziert angesehen werden. Kalkdichte Veränderungen im Verlauf von Lymphgefäßen entsprechen einer bisher nicht beschriebenen Verkalkung der Lymphgefäße (Lymphangiosklerose) und sind analog zur bekannten Phlebosklerose als Spätfolge einer lange bestehenden Schädigung von Lymphgefäßen anzusehen. Lipo-Lymphödeme sind durch ein Mischbild aus den oben beschriebenen Veränderungen bei Lymph- bzw. Lipödemen gekennzeichnet. Wie häufig zu beobachten, entwickelt ein großer Teil der Patienten mit Lipödem nach einer gewissen Latenz ein Lymphödem. In der frühen Aufdeckung dieser Kombinationsform kommt der indirekten Lymphographie ein besonderer Stellenwert zu. Denn das Lipo-Lymphödem ist dem Lymphödem als Erkrankung mit sämtlichen Konsequenzen über physikalisch-therapeutische Maßnahmen und entsprechende Prophylaxen bis hin zur möglichen Entstehung eines Angiosarkoms gleichzusetzen. Variabel konfigurierte, selten geschlossene Injektionsdepots mit Kontrastierung initialer lymphatischer Strukturen sind neben typischen Veränderungen der Kollektoren charakteristisch für Veno-Lymphödeme. Neben der auffälligen Dilatation der großen Lymphgefäße ist der eng gewundene, korkenzieherartige Verlauf kennzeichnend, der Varikose der Venen bei der chronischen venösen Insuffizienz ähnelnd. Kollektorabbrüche und Kontrastmittelextravasate sind hier in mehr als einem Drittel der Fälle nachweisbar und Ausdruck einer Mitbeteiligung des Lymphgefäßsystems bei Venenerkrankungen. Eine Beteiligung der subfaszialen Lymphgefäße bei der Thrombophlebitis profunda ist seit Tierexperimenten von Homanns und Zollinger bekannt (Homanns 1929). Die perivaskuläre Entzündung erfaßt hier ebenfalls die Lymphgefäße. Auch isotopenlymphographisch konnten Lymphtransportstörungen beim postthrombotischen Syndrom nachgewiesen werden (Hoppe et al 1972, Tiedjen et al. 1977, Tiedjen et al. 1992). Besonders hervorzuheben ist, daß die hier gefundenen indirekt-lymphographischen Konstellationen bei den chronischen Lymphödemen monomorph sind, das heißt, Rückschlüsse auf die Genese der Erkrankung sind mit dieser Methode nicht möglich. Somit ermöglicht die indirekte Lymphographie keine Unterscheidung zwischen primären und sekundären Lymphödemen. Die klassische Beschreibung - 102 - röntgenmorphologischer Veränderungen nach Kinmonth (Kinmonth 1955) beim Lymphödem mit Aplasie, Dilatation und Schlängelung kann ebenfalls nicht aufrecht erhalten werden. Auch die oben beschriebene Einteilung von Partsch in vier Typen kann mit unseren Untersuchungsergebnissen nicht nachvollzogen werden. So konnte weder eine Hypoplasie der Kollektoren bei Dilatation der initialen Lymphgefäße (Typ 2), noch das Fehlen jeglicher Lymphgefäße (Typ 4) dokumentiert werden. Abweichend zu den anderen Untersuchungen konnten wir in 15 Fällen bei chronischen Lymphödemen eine Kreuzung von Lymphkollektoren aus dem ventromedialen in das dorsale Lymphgefäßbündel nachweisen. Möglicherweise dokumentierte sich hier ein Kompensationsmechanismus bei Lymphostase (Umgehungskreislauf oder lympho-lymphatische Anastomose), oder es handelt sich um physiologische Kollateralverbindungen. 5.3. Kontrastmittel/Nebenwirkungen Das im Rahmen dieser Untersuchung verwendete Kontrastmittel Iopamidol erwies sich im Vergleich mit dem sonst gebräuchlichen Iotrolan bezüglich der Kontrastgebung als völlig gleichwertig. Auffälligster Befund ist, daß wir erheblich weniger Nebenwirkungen in Form lokaler Reaktionen beobachteten, als in anderen Studien dokumentiert wurde. So traten bei Gmeinwieser (s.o.) bei mehreren der insgesamt untersuchten 19 Patienten oberflächliche Epithelnekrosen an der Injektionsstelle auf, zwei Patienten berichteten über ein Exanthem an der Injektionsstelle mit starkem Juckreiz, und bei einem Patienten kam es zu einer zwei Tage dauernden Zunahme der Schwellung des Fußrückens (Nebenwirkungsrate: 26,3%). Inwieweit diese hohe Nebenwirkungsrate durch das Kontrastmittel selbst bedingt ist, muß offen bleiben. Möglicherweise kommt auch der Tatsache eine Bedeutung zu, daß wir im Gegensatz zu den anderen Untersuchern (21-27 Gauge) (Gmeinwieser et al. 1988) ausschließlich eine erheblich dünnkalibrigere Injektionsnadel (Lymphangiographiekatheternadel, 30 Gauge) benutzt haben und auf strengste Asepsis vor, während und nach der Injektion geachtet haben. So konnten - 103 - wir nur bei drei Patienten Nebenwirkungen beobachten. In einem Fall kam es mit einer Verzögerung von etwa 12 Stunden zum Auftreten eines auffallenden kokardenartigen, etwa fünfmarkstückgroßen Exanthems an der Injektionsstelle beidseits, das von Seiten des dermatologischen Konsiliarius als fixes Arzneimittelexanthem gedeutet wurde und nach wenigen Tagen ohne Therapie wieder vollständig abklang. In einem anderen Fall kam es zu einer entzündlichen Reaktion im Bereich beider Injektionsstellen, wahrscheinlich infolge eines unmittelbar im Anschluß an die Untersuchung durchgeführten Schwimmbadbesuches bei reduzierter Compliance des Patienten. Bei einem weiteren Patienten entstand eine kleine oberflächliche Hautnekrose an der Injektionsstelle. Die Nebenwirkungsrate geben wir daher bei bisher insgesamt über 500 untersuchten Patienten mit unter 1% an. Für die Verwendung von Jopamidol spricht neben der guten Kontrastgebung und geringen Nebenwirkungsrate auch der deutlich niedrigere Preis im Vergleich zu Iotrolan. 5.4. Bildgebung bei der Indirekten Lymphographie Die Wertigkeit der xeroradiographische Bilddokumentation ergibt sich aus zweierlei Gesichtspunkten. Zum einen ist die Darstellung der kontrastierten Strukturen, insbesondere der Lymphkapillaren, im Vergleich zu den konventionellen Röntgenverfahren deutlich besser. So konnte die von uns häufig dokumentierte Kontrastmittelanreicherung der Kutis durch Kontrastierung des Rete lymphocapillare von keinem der anderen Untersucher jemals beschrieben werden. Das völlige Fehlen von Lymphgefäßen bei chronischen Lymphödemen (Typ 4 nach Partsch) ist wahrscheinlich als Folge einer unzureichenden Auflösung bei Verwendung von Röntgenfilmen zu interpretieren. Vergleichende Voruntersuchungen im Rahmen dieser Studie haben gezeigt, daß kleinste Lymphgefäße von unter 0,2 mm Durchmesser mit konventionellen Film-Foliensystemen nicht darstellbar sind. Weiterhin ermöglicht die Xeroradiographie die exakte Interpretation von Veränderungen des Unterhautfettgewebes bei chronischen Ödemen (Bruna 1985). Die Methode läßt in idealer Weise ergänzend zu den Befunden der indirekten - 104 - Lymphographie weitere Rückschlüsse auf die Chronizität eines Lymphödems im Sinne einer simultanen Gewebeanalyse zu und komplettiert so die Diagnostik. Da die Xeroradiographie in naher Zukunft nicht mehr zur Verfügung stehen wird, wird sie, den oben vorgestellten Ergebnissen entsprechend, am ehesten durch die digitale Bildverstärker- oder Speicherfolienradiographie ersetzt werden können. Beide Verfahren haben einen deutlich niedrigeren Dosisbedarf als die Xeroradiographie. Die BV-Radiographie liefert dabei insgesamt befriedigende Ergebnisse, ist der Xeroradiographie aber im Bereich der Weichteildarstellung deutlich unterlegen. Die digitale Speicherfolienradiographie kommt in der Abbildungsqualität der Xeroradiographie bezüglich Kontrastgebung und Auflösung sehr nahe und ist auch auf Grund des geringen Dosisbedarfs als bildgebendes Verfahren bei der indirekten Lymphographie derzeit vorzuziehen. Die Computertomographie bietet eine zu geringe Auflösung im Bereich der initialen Lymphgefäße und ist somit zur Detektion von Lymphödem-Frühformen nicht geeignet. Gerade hier liegt jedoch der Stellenwert der indirekt-lymphographischen Diagnostik. Hohe Kosten, erheblicher Dosisbedarf und die Verfügbarkeit limitieren den Einsatz dieses Verfahrens zusätzlich. Die CT-3D-Rekonstruktion erschließt sehr anschaulich kutane und lymphangio-vaskuläre Kollateralisationsphänomene, liefert jedoch letzlich keine über die zweidimensionale Darstellung hinausgehenden Informationen. Die Eignung der Magnetresonanztomographie als bildgebendes Verfahren bei der indirekten Lymphographie muß durch weitere Studien überprüft werden. Die Ergebnisse der bisher einzigen durchgeführten Untersuchung ähneln denen der Computertomographie mit Darstellung eines einzelnen dilatierten Lymphgefäßes, Kontrastmittelanreicherung des Rete lymphocapillare der Cutis und Visualisierung kontrastmittelaufnehmender, interstitieller, ödemgefüllter Räume. Zur Detektion zarter Lymphkapillaren bei Lymphödemfrühformen muß die Auflösung bisher ebenfalls als unzureichend erachtet werden. - 105 - 5.5. Isotopenlymphographie Erwartungsgemäß wiesen die gesunden Patienten die höchsten Lymphtransportraten auf. Bei den lipödematösen Extremitäten lag der durchschnittliche Quotient Q mit 9,99 an der oberen Grenze des Normbereichs. Diese Befunde sind aus anderen Studien bekannt (Tiedjen et al. 1990) und belegen eine bereits vorhandene Störung des Lymphtransports. Ursächlich hierfür ist ein beim Lipödem erniedrigter Gewebedruck mit konsekutiver Erniedrigung des Lymphzeitvolumens anzusehen. Weiterhin bedingt eine bereits bestehende Schädigung der prälymphatischen Räume und Lymphkapillaren sowie der geschlängelte Verlauf der Kollektoren nach Földi eine Einschränkung des Lymphtransportes (Földi, E. 1991). Mit 19,82 lag der mittlere Wert für Q bei den Patienten mit chronischer venöser Insuffizienz und Lymphödem deutlich höher als bei Gesunden und Lipödemen, jedoch erheblich niedriger als bei den chronischen Lymphödemen (55,22). Die im Vergleich zu Gesunden und Lipödemen niedrigeren Transportraten sind durch die oben beschriebene Mitbeteiligung des Lymphgefäßsystems bei Venenerkrankungen zu erklären. Der im Vergleich zu reinen Lymphödemen (Niedrigvolumeninsuffizienz) bessere Transportindex resultiert aus einem gesteigerten Lymphfluß bei erhöhtem Venendruck (Sicherheitsventilfunktion des Lymphgefäßsystems, s. 2.6.). Indikationen zur Durchführung der Isotopenlymphographie ergeben sich nach Schuchardt et al. bei Lipödemen und chronischen venösen Insuffizienzen zur Abkärung einer zusätzlichen lympostatischen Komponente sowie im Anfangsstadium eines primären Lymphödems, wenn ein klinisch weiches, dellenbildendes, noch nicht induriertes Ödem von anderen Ödemzuständen (internistisch, venös, entzündlich) nur schwer abzugrenzen ist (Schuchardt et al. 1997). Aus den hier vorliegenden Untersuchungsergebnissen läßt sich diese Indikation jedoch so nicht ableiten. Nur bei 11 von 619 untersuchten Gliedmaßen (1,77%) fanden sich allein in der Isotpenlymphographie pathologische Transportraten, bei unauffälliger indirekter Lymphograpie und Xeroradiographie. - 106 - Dabei wiesen 9 dieser 11 Patienten kein Stemmer’sches Hautfaltenzeichen auf. Das bedeutet, die Patienten wurden allein auf Grund der erniedrigten Lymphtransportraten in die Gruppe der Lymphödem-Patienten eingeordnet. Bezogen auf das Stemmersche Hautfaltenzeichen als „Goldstandard“ ergäbe sich hier eine Senstivität von nur 0,3% bezüglich der Erkennung von Lymphödemen, die durch die indirekte Lymphograpie und Xeroradiographie nicht diagnostiziert werden können. Die Indikation zur Durchführung einer Isotopenlymphographie im Rahmen der Lymphödemdiagnostik sollte somit sinnvollerweise immer nur in Kombination oder ergänzend zur indirekten Lymphographie gesehen werden. 5.6. Grenzen der Methode (Indirekte Lymphographie) Die Grenzen der Methode liegen in der fehlenden Möglichkeit der Beurteilung von Lymphknoten (Weissleder 1989). Im Rahmen einer anderen an dieser Abteilung durchgeführten Studie zur Beurteilung der Lymphstrombahnen am Hals bei operierten Tumor-Patienten konnten in fast allen Untersuchungen kontrastierte zervicale Lympknoten dargestellt werden. Wahrscheinlich ist die Distanz zwischen Injektionsdepot und Lymphknoten entscheidend, da das wasserlösliche Kontrastmittel auf dem Weg zu den Lymphknoten intravasal verdünnt wird oder abdiffundiert. Die Lymphkollektoren der unteren Extremitäten lassen sich übereinstimmend mit den anderen Untersuchern maximal über eine Distanz von bis zu 40 cm vom Injektionsdepot aus verfolgen und auch bei experimentell erfolgter Injektion in Höhe der Innenseite des Oberschenkels konnte in keinem Fall eine Kontrastierung von inguinalen Lymphknoten erreicht werden. So ist wohl auch die oben beschriebene Leistenlymphknoten-Darstellung (Partsch 1986) am ehesten als Zufallsbefund zu interpretieren. Eine Aussage zu einem fakultativen metastatischen Lymphknotenbefall ist somit nicht möglich. Ebenfalls kann mit der Methode keine Aussage über die Transportfunktion der Lymphgefäße gemacht werden. Ein Differenzierung zwischen primären und sekundären Lymphödemen, mechanicher und dynamischer Insuffizienz und eine Einteilung der Lymphödeme nach indirektlymphographischen Befunden ist nach unseren Erfahrungen mit der Methode nicht möglich, da die Veränderungen insgesamt monomorph sind (s. 5.2.). - 107 - - 108 - 5.7. Wertigkeit der indirekten Lymphographie In der Primärdiagnostik von Lymphödemen steht die klinische Basisdiagnostik allgemein anerkannt an erster Stelle. Anamnese, Inspektion und Palpation (Stemmer’sches Hautfaltenzeichen) erlauben dem erfahrenen Untersucher in den weitaus meisten Fällen bereits die Diagnosestellung. (Allen 1934, Brunner 1969, Mannheimer et al. 1976, Schuchardt 1997, Wokalek 1997). Diese Aussage konnen wir nach den hier ausgewerteten Untersuchungen bezüglich der Erkennung reiner Lymphödeme bestätigen. Hier hat die klinische Untersuchung mit 92% eine annähernd gleich hohe Sensitivität wie die indirekte Lymphographie. Bei den Mischformen jedoch ist die Sensitivität als nicht ausreichend zu erachten. Hier sind die indirekte Lymphographie und die Xeroradiographie als überlegene diagnostische Verfahren anzusehen (s. Tabelle 42). Interessantester Aspekt ist hier, daß die Xeroradiographie als alleiniges bildgebendes Verfahren in der Gruppe der Lipo- Lymphödeme der indirekten Lymphographie bezüglich der Sensitivität sehr nahe kommt und bei der Kombinationsform Lymphödem/CVI sogar gleichwertig ist. Ursächlich hierfür ist am ehesten die auch für den erfahrenen Untersucher schwierige klinische Unterscheidung zwischen einem rein lipödematös verdickten Zehenrücken und und einer Verdickung im Sinne eines Stemmer’schen Hautfaltenzeichens als Ausdruck einer Mitbeteiligung im Rahmen eines bestehenden Lymphödems. Auch kann das Stemmer‘sche Hautfaltenzeichen bei LymphödemFrühformen, proximal beginnenden und auch bei nur milde ausgeprägten Lymphödemen fehlen. Die Isotopenlymphographie erreicht bezüglich der Detektion von reinen Lymphödemen eine Sensitivität von 78,66%, ist aber auch in dieser Patientengruppe der klinischen Untersuchung und den konkurrierenden apparativen Verfahren unterlegen. Bei Mischformen ist die Sensitivität sicher unzureichend, und die Methode ist in der Diagnostik von Lymphödemen als alleiniges Verfahren nicht geeignet. Alle Verfahren und die klinische Untersuchung haben eine sehr hohe Spezifität, nur die indirekte Lymphographie und die Xeroradiographie aber sind ebenfalls hoch sensitiv. Die Wertigkeit der indirekten Lymphographie mit Röntenfilmdokumentation liegt nach Weissleder in der Möglichkeit , exakte Aussagen über die Morphologie der peripheren Lymphkollektoren zu machen und so eine Objektivierung von lokalisierten und - 109 - generalisierten lymphostatischen Ödemen zu erhalten. Die Methode ist jedoch ungeeignet, Frühformen mit „szintigraphischem Schweregrad 1 und 2“ zu erfassen. So konnten hier nur bei 18 von 30 Patienten abnormale Lymphgefäße (Hypoplasie, Hyperplasie, retikuläre Muster oder Refluxe) nachgewiesen werden (Weissleder 1989) . Nach den im Rahmen unserer Untersuchungen erhobenen Ergebnissen kommt der indirekten Lymphographie mit Xeroradiographie aber gerade bezüglich dieser Fragestellung eine besondere Unterschenkelödemen Lymphtransportraten und konnten Bedeutung normalen zu. Bei oder einigen Patienten sogar hochnormalen indirekt-lymphographisch kontrastierte mit initiale Lymphgefäße nachgewiesen werden und somit zumindest der dringende Verdacht auf ein beginnendes Lymphödem gerade durch den Einsatz dieser Methode geäußert werden. So waren in der vorliegenden Studie bei 16 von 19 Extremitäten mit negativem Hautfaltenzeichen (84,2%) die in die Gruppe „Lymphödem“ eingeordenet wurden (s. Tabelle 32) pathologische Befunde in der indirekten Lymphographie zu erheben, während nur bei 6 dieser Extremitäten (31,6 %) erniedrigte Lymphtransportraten gefunden wurden. Dabei muß auch die Wertigkeit der Xeroradiographie hervorgehoben werden, die in 14 Fällen (73,7%) entsprechende Weichteilveränderungen erkennen ließ. Ähnliche Befunde resultierten für die Lipo-Lymphödeme. Hier war die indirekte Lymphographie bei 34 von 48 Extremitäten, die kein Stemmer’sches Hautfaltenzeichen aufwiesen, auffällig (70,83%), ein pathologisches ILG war nur bei 20 Beinen (41,7%) nachweisbar. Xeroradiographische Auffälligkeiten waren hier an 31 Beinen (64,6%) vorhanden (s. Tabelle 36). Auch in der Gruppe der letzlich als „Lymphödem bei chronischer venöser Insuffizienz“ beurteilten Extremitäten waren die indirekte Lymphograpie und die Xeroradiographie die überlegenen Verfahren. Alle 20 Beine zeigten hier jeweils Pathologica (100%), während nur 25% in der Isotopen-Methode pathologische Werte aufwiesen (s. Tabelle 39). Das Einsatzspektrum der indirekten Lymphographie umfaßt nach unseren Ergebnissen und Wertungen die nachfolgenden Indikationen: - 110 - -Abgrenzung gegenüber Lipödemen und Nachweis bzw. Ausschluß einer zusätzlich bestehenden lymphödematosen Komponente auch bei chronischer venöser Insuffizienz -Extremitätenödeme unklarer Genese (besonders frische Ödeme, Abgrenzung gegenüber Ödemen anderer Genese) -posttraumatische Extremitätenödeme im Rahmen BG-licher und versicherungsrechtlicher Fragestellungen -präoperativ vor geplanten Eingriffen am peripheren Lymphgefäßsystem, z.B. vor Lymphgefäßtransplantation und auch vor einer geplanten Varizenchirurgie bei Hinweis auf latente oder manifeste Lymphödeme Weitere Indikationen beinhalten wissenschaftliche Fragestellungen wie z.B. die Untersuchung der Lymphgefäßregeneration nach Extremitätenreplantation (PizaKatzer 1987), Erforschung lymphatischer Metastasierungswege (Kono 1985) und die Pathophysiologie chronischer Extremitätenschwellungen. Die Bedeutung der indirekten Lymphographie und Xeroradiographie wird dadurch unterstrichen, daß aus der Diagnosestellung : “Lymphödem“ erhebliche Konsequenzen bezüglich Therapie, Prävention und zu erwartender Komplikationen bis hin zur Entstehung maligner Erkrankungen resultieren (s.o.). Ein anderer, nach unseren Erfahrungen nicht zu unterschätzender Gesichtspunkt ist das Aufklärungsbedürfnis vieler Patienten bezüglich der Genese ihrer Beinödeme und möglicherweise zu ergreifender prophylaktisch-therapeutischer Maßnahmen. Insbesondere jüngere Frauen mit Lipödem leiden häufig sehr unter den auffällig verdickten Extremitäten und geben sich mit der vielfach (auch hausärztlicherseits) gemachten Äußerung, „dies sei als schicksalhaft anzusehen, und damit müsse man leben“, allein nicht zufrieden. Bemerkenswert ist auch, daß die Untersuchungen insgesamt eine ausnahmslos hohe Akzeptanz bei den Patienten haben. Eine zunehmende Rolle spielen auch gesundheitspolitische Aspekte wie Verschreibungsunwilligkeit der manuellen Lymphdrainage und Absicherung der Diagnose vor KPE. - 111 - 6. Zusammenfassung Mit der indirekten Lymphographie lassen sich für Gesunde, Lipödeme und Lymphödeme charakteristische morphologische Veränderungen regelmäßig nachweisen. Gesunde zeigen zumeist ein geschlossenes Injektionsdepot mit normalkalibrigen, gestreckt verlaufenden Kollektoren ohne Darstellung von initialen Lymphgefäßen. Die xeroradiographische Weichteilanalyse ist unauffällig. Lipödeme sind gekennzeichnet. durch Die ein normal flammenförmig weiten konfiguriertes Lymphkollektoren Injektionsdepot verlaufen auffallend langstreckig geschlängelt durch das verbreiterte Unterhautfettgewebe. Bei chronischen Lymphödemen sind die Depots variabel konfiguriert, meist kommen sie unscharf berandet oder ausgefranst zur Darstellung. In der Umgebung der Depots finden sich häufig kontrastierte initiale Lymphgefäße. Die Kollektoren sind dilatiert und zeigen meist einen kurzstreckig gewundenen Verlauf. In der Weichteildarstellung kommen neben einer Verbreiterung von Cutis und Subcutis streifige, häufig honigwabenartig konfigurierte Verdichtungen zur Darstellung, die neben Fibrosierungen auch flüssigkeitsgefüllten interstitiellen lymphatischen der beschriebenen Räumen entsprechen. Lipo-Lymphödeme sind durch ein Mischbild zuvor Veränderungen gekennzeichnet. Bei Patienten mit Lymphödem und chronischer venöser Insuffizienz bestehen neben den oben beschriebenen Kontrastmittelextravasate, Veränderungen Kollektorabbrüche, fakultativ maximal weitere Auffälligkeiten: dilatierte Kollektoren, Ulkusdefekte, phlebosklerotische Verdichtungen. Mit der indirekten Lymphographie kann keine Differenzierung zwischen den verschiedenen Lymphödem-Formen erfolgen. Insgesamt sind die Veränderungen bei diesem Krankheitsbild monomorph. Es gelingt jedoch eine Abgrenzug gegen reine Lipödeme und charakteristische Befunde. - 112 - auch für die Kombinationsformen ergeben sich Die in der oben beschriebenen Technik durchgeführte indirekte Lymphographie ist eine risikoarme Untersuchung. Entscheidend hierfür ist neben der Wahl einer dünnkalibrigen Injektionsnadel (Lymphangiographiekatheter) möglicherweise auch das verwendete Kontrastmittel. Iopamidol zeigt im Vergleich mit Isovist keine Unterschiede in der Güte der Kontrastgebung. Entscheidend für die Aussagefähigkeit der indirekten Lymphographie ist die Verwendung eines hochauflösenden bildgebenden Verfahrens. Bei der Dokumentation mit konventionellen Röntgenfilmen sind initiale Lymphgefäße kaum darstellbar. Die Darstellung dieser Strukturen ist jedoch von entscheidender Bedeutung für die Erkennung von gering ausgeprägten Lymphödemen und Lymphödem-Frühformen. Gerade hieraus ergibt sich der besondere Stellenwert dieses Verfahrens. Zur Bildgebung bei der indirekten Lymphographie ist die Xeroradiographie das überlegene bildgebende Verfahren. Annähernd vergleichbar gute Ergebnisse lassen sich mit der digitalen Speicherfolien-Radiographie erzielen. Die BildverstärkerRadiographie hingegen erbringt zwar eine befriedigende Darstellung der kontrastierten Lymphgefäße, kann jedoch in der Weichteilanalyse nicht überzeugen. Vorteile gegnüber der Xeroradiographie haben beide Verfahren bezüglich des geringeren Dosisbedarfes. Mit der Computertomographie lassen sich bei der indirekten Lymphographie Kreuzungen vom oberflächlichen in das tiefe Lymphgefäßsystem und Kollateralisationsphänomene (CT-3D-Rekonstruktion) anschaulich darstellen. Die geringe Auflösung ermöglicht jedoch keine suffiziente Analyse der initialen Lymphstrombahn. Ähnlich verhält es sich offensichtlich bei der Kombination der indirekten Lymphographie mit der Kernspintomographie. ausgeprägtem Lympödem kam neben Bei einem Patienten mit schlierenartigen kontrastmittelgefüllten Räumen, die den auch computertomographisch darstellbaren interstitiellen - 113 - Strukturen entsprechen, ein einzelner Kollektor zur Darstellung (s.S.96). Die Auflösung im Bereich der Lymphkapillaren ist auch hier bisher als unzureichend zu erachten. Alle apparativen Verfahren und das Stemmer‘sche Hautfaltenzeichen haben eine hohe Spezifität bei allen Patientengruppen. Die indirekte Lymphographie mit hochauflösender Bildokumentation (s.o.) erreicht bei allen Patientengruppen eine sehr hohe Sensitivität. Die Methode hat auch eine ausnahmslos hohe Akzeptanz bei den Patienten, ist risikoarm, kostengünstig und mit geringem zeitlichem und apparativem Aufwand durchführbar. Somit ist die indirekte Lymphographie als das Untersuchungsverfahren erster Wahl in der Diagnostik klinisch unklarer Extremitätenödeme anzusehen. Für die Isotopenlymphographie resultiert nach unseren Untersuchungen eine insgesamt geringe Sensitivität. Insbesondere bei Lipo-Lymphödemen und VenoLymphödemen läßt sich zwar eine Aussage über das Maß der Störung der Lymphtransportfunktion machen, jedoch ist eine Klassifizierung i. S. einer Diagnosesstellung nicht möglich. Das Stemmer‘sche Hautfaltenzeichen erreicht eine hohe Sensitivität bei reinen Lymphödemen, nicht jedoch bei den Kombinationsformen. Insbesondere bei LipoLymphödemen ist die klinische Untersuchung der indirekten Lymphographie und der Xeroradiographie deutlich unterlegen. Als ursächlich hierfür ist eine erschwerte klinische Beurteilbarkeit lipödematös verdickter Zehenrücken bei z.B. zusätzlich bestehender Lymphödem-Komponente anzusehen. Der Xeroradiographie kommt eine insgesamt hohe Sensitivität zu, bezüglich der Detektion von Veno-Lymphödemen ist sie der indirekten Lymphographie sogar gleichwertig. Somit kann die Durchführung einer Nativ-Xeroradiographie alleine in vielen Fällen bereits zur Diagnosestellung beitragen. - 114 - Literaturverzeichnis Allen, E.V.: Lymphedema of the Extremities, Arch. Intern. Med. 54 (1934) 606-624 Allen, E. V., E. A. Hines: Lipedema of the legs: a syndrom characterized by fat legs and orthostatic edema, Proc. Staff. Mayo Clin. 15 (1940) 184-187 Battezzati, M., I. Dononi: History of The Lymphatic System, in: Battezzati, M., I. Dononi: The Lymphatic System, Pincin Medical Books Padua 1972, S.11-25 Berens von Rautenfeld, D., B. I. Wenzel-Hora: Zur Nomenklatur der Lymphgefäße in der Haut des Menschen, in: Bollinger, A., H. Partsch: Initiale Lymphstrombahn, Thieme Verlag Stuttgart New York 1984, S. 205-209 Berens von Rautenfeld, D., D. Lubach, B. Wenzel-Hora, T. Buchholz, C. Poulsen Nautrup: Neue Techniken und Methoden zur Darstellung des Füllungsablaufes in der Haut, Lymphologika Jahresband Medikon Verlag München 1989, S. 36-43 Bollinger, A., H. Partsch, J. H. N. Wolfe: The initial lymphatics, Thieme Verlag Stuttgart New York 1985, S.110-116 Bollinger, A., A. Isenring, G. Franzeck, U. K. Jäger: Fluorescencemicrolymphography in various forms of primary lymphedema, in: Bollinger, A., H. Partsch, J. H. N. Wolfe: The initial lymphatics, Thieme Verlag Stuttgart New York 1985, S.140146 Bruna, J.: Xeroradiography of Lymphedema, in: Weissleder, H., Bartos, Clodius, Malek: Progress in Lymphology (1981) 223-226 Bruna, J. : Das Lymphödem: Die Haut im Conputertomogramm und in der Xeroradiographie, Lymphologika Jahresband Medikon Verlag 1989, S.47-49 Bruna, J. : Diagnostik des Lymphödems durch die Computertomographie, Ödem Jahresband Perimed Verlag Erlangen 1986, S.117-119 - 115 - Brunner, U.: Das Lymphödem der unteren Extremität, H. Huber Verlag Bern 1969 Brunner, U.: Vaskuläre Erkrankungen beim Lipödem der Beine, Schweiz.med. Wschr. 112 (1982) 1130-1137 Brunner, U.: Klinik und Farbstofftest beim primären Lymphödem der Beine, Ödem Jahresband Perimed Verlag Erlangen 1986, S. 39-47 Carleton, H. M., H. Florey: The Mammalean Lacteal: its Histological Structure in Relation to its Physiological Properities, Pros. Roy. Soc. B. (London) 102 (1927) 110-118 Carlson, C. F.: History of electrostatic recording, in: Dessauer, J. H. , H. E. Clark: Xeroradiography and related processes, Focal Press London 1965 Carrier, E. B.: Observation of living cells in the bat’s wing, in: Physiological Papers Dedicated to Prof. August Krogh, Levin and Munksgard Kopenhagen 1926, 1-8 Case, T. C., C. I. Witte, E. C. Unger, W. H. Williams: MRI in human lymphedema. Comparison with lymphangioszintigraphy, Man. Res. Imaging 10 (1992) 549 Casley-Smith, J. R.: An electron microscopic study of injured and abnormally permeable lymphatics, Ann. J. New York Acad. SC 116 (1964) 803-830 Casley-Smith, J. R.: The Concentrating of Proteins in the Initial Lymphatics and their Rediluting in the Collecting Lymphatics, Fol. Angiol. 25 (1977) 81-89 Casley-Smith, J. R: The Pathophysiology of Lymphoedema, in: L. R. Heim: IXth International Congress of Lymphology, Tel Aviv (Israel) Immunology Research Foundation INC Newburgh, USA (1983) 125-130 Casley-Smith, J. R: The Pathophysiology of Lymhedema and the Action of Benzopyrones in Reducing it, Lymphology 21(1988) 190-194 - 116 - Castenholz, A., Die Lymphbahn im rasterelektronenmikroskopischen Bild, Ödem Jahresband Perimed Verlag Erlangen 1986, S.32-38 Duewell, S., K. D. Hagspiel, J. Zuber, G. K. Schulthess, A. Bollinger, W. A. Fuchs: Swollen lower extremity: Role of MRI Imaging, Radiology 184 (1992) 227-231 Evans, H.: The blood-supply of lymphatic vessels in man, Amer. J. Anat. 7 (1907/08) 195 Eysselein, V. E., M. V. Singer, H. Goebell: Rezidivierend auftretendes akutes Abdomen und subkutane/submuköse Ödeme bei einer 21jährigen Frau, Med. Klin. 81 (1986) 69-72 Fischer-Barth, W., S. el Gammal, K. U. Tiedjen, P. Altmeyer: Verlauf eines artifiziell bedingten Ödems des Armes, Lymphologika Jahresband Kagerer Kommunikation Bonn 1995, S.124-128 Földi, M.: Physiologie des Lymphsystems, in: Frommhold, W, P. Gerhardt: Erkrankungen des Lymphsystems, Klinisch-radiologisches Seminar Bd. 11, Thieme Verlag Stuttgart New York 1981, S.20-27 Földi, M.: Das chronische Lymphödem, Fortschr. Med. 19 (1982) 877-880 Földi, M.: Lymphoedema, in: Földi, M., J. R. Casley-Smith: Lymphangiology, Schattauer Verlag Stuttgart 1985, S. 667-682 Földi, E., M. Földi: Diagnostik und Differentialdiagnostik des Gliedmaßenödems, Z. Allg. Med. 62 (1986) 949-954 Földi, E., M. Földi: Physiologie und Pathophysiologie des Lymphgefäßsystems in: Földi, M., S. Kubik: Lehrbuch der Lymphologie, Gustav Fischer Verlag Stuttgart 1989, S.185-226 Földi, E., M. Földi: Physiologie und Pathophysiologie des Lymphgefäßsystems in: Földi, M., S. Kubik: Lehrbuch der Lymphologie, Gustav Fischer Verlag Stuttgart 1999, S.238-279 - 117 - Franken, TH,. G. Neuhaus, W. Distelmaier: Die transarterielle Xero-Angiographie – Ein Alternativverfahren zur konventionellen Angiographie der Extremitäten, RöntgenBlätter 31 (1978) 562-566 Frommhold, W., K.-J. Wolf, K.-H. Hübener: Die Lymphographie gerät in Agonie, Lymphologie 3 (1979) 23 Fuchs, W. A., A. Rüttimann, M. S. del Buono: Zur Lymphographie bei chronischen sekundären Lymphödemen, Fortschr. Röntgenstr. 92 (1960) 608 Gmeinwieser, J., K. Lehner, W. Golder: Indirekte Lymphographie: Indikationen, Technik, klinische Ergebnisse, Fortschr. Röntgenstr. 149 (1988) 642-647 Greer, K.E.: Lipedema of the legs, Cutis (N. Y.) 14 (1974) 98-100 Gregl, A., J. Kienle: Lymphangiopathie beim peripheren Lymphödem, Fortschr. Röntgenstr. 105 (1966) 622-635 Gregl, A., U. Fischer, D. Heyden: Computertomographie und Kernspintomographie beim peripheren Lymphödem, Fortschr. Röntgenstr. 143 (1985) 219-226 Hadjis, N. S., D. Carr, L. Banks, J. J. Pflug: The role of CT in the diagnosis of primary lymphedema of the lower limb, Amer. J. Radiol. 144 (1985) 361 Hauck, G.: Prälymphatische Bahnen, in: Bollinger, H., A. Partsch: Initiale Lymphstrombahn, Thieme Verlag Stuttgart New York 1984, S. 47-54 Homanns, J., R. Zollinger: Experimental thromophlebitis and Lymphatic obstruktion of the Lower Limb, Arch. Surg. (Chicago) 18 (1929) 992-997 Hoppe, H., K. Alexander: Lymphokinetische Untersuchungen mit Au-198- Mikropartikeln bei Arterio-, Phlebo- und Lymphangiopathien der unteren Extremitäten, Kreislauf 61 (1972) 280-285 - 118 - Huber, M., U. Hess, H. Bollinger: Measurement of the permeability of cutaneous lymph capillaries in healthy subjects and in patients with primary lymphedema, in: Hudack, S. S., P. D. Mc. Master: The lymphatic participation in human cutaneus phenomena, J. Exp. Med. 57 (1933) 751-774 Hultborn, K. A.:, L. G. Larsson, I. Ragnhult: A Study of the Lymphdrainage of the Lower Limb with the Use of Colloidal Radiogold (Au198), Acta radiol. (Stockholm) 43 (1955) 139-144 Huth, F.: General pathology of the lymphovaskular system, in: Foldi, M., J. R. CasleySmith: Lymphangiology, Schattauer Verlag Stuttgart New York 1983, S. 215-334 Isenring, G., U. K. Franzeck, A. Bollinger: Lymphatische Mikroangiopathie bei chronisch-venöser Insuffizienz (CVI), Vasa 11 (1982) 104 Jacobsson, S., S. Johansson: Lymphographic Changes in Lower Limbs with Varicose Veins, Acta chir. Scand. 117 (1955 )346-350 Jacobsson, S., A. Feldmann: Estimation of Lymph Flow in Extremities, Arch. Surg 82 (1961) 99-127 Kaindl, F., E. Mannheimer, l. Pfleger-Schwarz, B. Thurner: Lyphangiographie und Lymphadenographie der Extremitäten, Thieme Verlag Stuttgart 1960 Kalima, T.V., K. Kallroth, K. Sommer: Computed Tomography in the Diagnosis of lower Extremity Oedemas, in: Barthos.V.: Advances in Lymphology, Avicenum Med. Czechosl. Press Prag 1982 Kaposi, M.: Pathologie und Therapie der Hautkrankheiten, Urban und Schwarzenberg Wien Leipzig 1887 Ketterings, C.: A more Functional View on Lymphoedema. An Investigation with Radionucleids, in: Ergebnisse der Angiologie Bd.XII, Basale Lymphologie, Schattauer Verlag Stuttgart New York 1976, S. 121-129 - 119 - Kinmonth, J. B.: Lymphangiography in Man: Method of Outlining Lymphatic Truncs at Operation, Clin. Sc. 11 (1952) 13-20 Kinmonth, J. B., G. W. Taylor, R. Kemp Harper: Lymphangiography - A technique for ist clinical use in the Lower Limb, Brit. Med. J. 1 (1955) 940-941 Kinmonth, J. B., G. W. Taylor, G. D. Tracy, J. D. Marsh: Primary Lymphoedema: Clinical and Lymphangiographic Studies of a Series of 107 Patients in Which the Limbs Were Affected, Brit. J. Surg. 45 (1957) 1-10 Kinmonth, J. B.: Lymphoedema of the Lower Limb, Proc. Roy. Soc. Med. 58 (1965) 1021-1023 Kinmonth, J. B. : The lymphatics, Edward Arnold Ltd.,London 1982, S. 286-288, Knorz, S., K. U. Tiedjen, K.-D. Heimann, M. König: Computertomographie mit 3DRekonstruktion und Magnetresonanztomographie als bildgebende Verfahren bei der indirekten Lymphographie, Lymphologika Jahresband Kagerer Kommunikation Bonn 1995, S. 50-53 Koehler, P. R.: Complications and accidents in lymphography, Lymphology 1 (1968) 116-120 Kono, M., T. Tauchi, H. Suzuki, K. Kurono, M. Hara, M. Matsuo: Mediastinal lymphography using non-ionic, water-soluble contrast medium, Lymphography 18 (1985) 132-135 Kramann, B., N. Christen: Die transvenöse Xero-Angiographie der Extremitäten, Dt. Med. Wschr. 28 (1977) 1031-1033 Kubik, S.: Anatomie des Lymphgefäßsystems, in: Föli, M., S. Kubik: Lehrbuch der Lymphologie, Gustav Fischer Verlag Stuttgart 1993, S.1-198 Lawrentjew, A. P.: Zur Lehre von der Innervation des Lymphsystems. Über die Nerven des Ductus thoracicus beim Hunde, Anat. Anz. 60 (1925/26) 475 - 120 - Lofferer, O., A. Mostbeck, H. Partsch: Nuklearmedizinische Diagnostik von Lymphtransportstörungen der unteren Extremitäten, Vasa 1 (1972) 94-102 Mannheimer, E., L. Pfleger: Periphere Lymphangiopathien –15-Jahre-Follow-up, Acta Med. Austr. 4 (1976) 128-132 Mislin, H.: Active contractility of the lymphangion and coordination of the lymphangion chains, Experientia 32 (1976) 820-822 Mostbeck, A., H. Partsch, O. Lofferer: Erfassung des Lymphtransportes durch die quantitative Isotopenlymphographie, Ödem Jahresband Medikon Verlag Erlangen 1986, S.52-56 Nitzsche, H., O. Petter, S. Anders: Peripheres Lymphabflußsystem der unteren Extremitäten bei chronischer Veneninsuffizienz, Phlebol. u. Proktol. 14 (1985) 135139 Oehlert, W., H. Weissleder, D. Gollasch: Lymphogramm und histologisches Bild normaler und pathologisch veränderter Lymphknoten, Fortschr. Röntgenstr. 104 (1966) 751-758 Otto, R., J. Wellauer: Die Xeroradiographie des Lungenhilus, Fortschr. Röntgenstr. 123 (1975) 1-6 Partsch, H.: Lymphangiopathie bei chronischer Veneninsuffizienz Phlebol. u. Proktol. 13 (1984) 85-89 (a) Partsch, H., A.. Urbanek, B. Wenzel-Hora: The dermal lymphatics in Lymphoedema visualized by indirect lymphography, Brit. J. Dermatol. 110 (1984) 431-438 (b) Partsch, H., A. Urbanek, B. I. Wenzel-Hora: Indirekte Lymphographie beim Lymphödem, Ödem Jahresband Medikon Verlag Erlangen 1986, S. 79-82 Partsch, H., Ch. Stöberl, A. Urbanek, B. I. Wenzel-Hora: Die indirekte Lymphographie zur Differentialdiagnose des dicken Beines - 121 - Phlebol. u. Proktol. 17 (1988) 1-8 Pecking, A., R. Cluzan, A. Deprez-Curley: Indirect Lymphoscintigraphy in patients with limb edema, in: Heim, L. R.: Progress in Lymphology: diagnostic, therapeutic, and research approaches to lymphatic system, structure, and function., Immunology Research Foundation Newburgh 1984, S. 201-208 Pfister, G., B. Saesseli, U. Hoffmann, M. Geiger, A. Bollinger: Differenzierung primärer Lymphödemformen mit der intravitalen Fluoreszenz-Mikrolymphographie, Lymphologika Jahresband Kagerer Kommunikation Erlangen 1989, S.78-83 Pfleger, L., Histologie und Histopathologie cutaner Lymphgefäße der unteren Extremität, Arch. klin. exp. Dermatol. 221 (1964) 22 Piza-Katzer, H., H. Partsch, A. Urbanrk, B. J. Wenzel-Hora: Zur Frage der Lymphgefäßregeneration nach Replantation und freier mikrovaskulärer Lappenplastik, Vasa 16 (1987) 60-66 Robberts, K. B., J. A. Barrowmann: Some Experimental Investigations of Lymphatic Physiology Prior to 1850, in: Weissleder, H., Bartos, Clodius, Malek: Progress in Lympology (1981) 3-4 Rusznyak, I., M. Földi, G. Szabo: Entstehung und Bau des Lymphgefäßsystems, in: Rusznyak, I., M. Földi, G. Szabo: Lymphologie Gustav-Fischer Verlag Stuttgart 1969, S. 17-22, Schertel, L., H. Harbst, K. zum Winkel, S. Lange: Xeroradiography of the Lymphatics, Lymphology 8 (1975) 94-99 (a) Schertel, L., H. Kraska, B. Hüthwohl: Zur Xeroradiographie des Thorax, Fortschr. Röntgenstr. 122 (1975) 417-422 (b) Schnepper, E., J. Schütz, M. Wannenmacher: Xeroradiographie, Med. Klin. 72 (1977) 1091-1097 - 122 - Schmitz, R.: Lipödem - Das dicke Bein der gesunden Frau, Phlebol. u. Pkoktol. 9 (1980) 81-85 Schuchardt, C.: Das Lymphödem, Fortschr. Med. 22-23 (1997) 24-31 Solti, F., H. Jellink, H., E. Lengyel: Lymphostase bei Arteriopathien, Lymphologika Lahresband Kagerer Kommunikation Erlangen 1991, S. 73-75 Schwaz, U. : Die Häufigkeit des primären Lymphödems. Eine epidemiologische Studie an 1000 Probanden, Lymphologoka Jahresband Medikon Verlag München 1990 , S.109-113 Sheldon, J.: The history of the absorbent system, London 1784, zt. n. Robberts und Barrowmann 1981 Starling, E. H.: On the absorption of fluids from the connective tissue spaces, J. physiol. (London) 19 (1896) 312-326 Steinkamp, H. J., Rausch, M., Mäurer, J., Hosten, M., Schedel, H., Langer, R., Felix, R.: Farbcodierte Duplexsonographie in der Differentialdiagnostik zervikaler Lymphknotenvergrößerungen, Fortschr. Röntgenstr.161 ( 1994) 226-232 Steinkamp, H., T. Hein, C. Zwicker, F. Mathe, R. Felix: Möglichkeiten der bildgebenden Differentialdiagnostik der Halslymphome, Akt. Radiol. 3 (1993) 226-237 Stemmer, R.: Ein klinisches Zeichen zur Früh- und Differentialdiagnose des Lymphödems, Vasa 5 (1976) 262-262 Stöberl, CH., H. Partsch, A. Urbanek: Indirekte Lymphographie beim Lipödem, Ödem Jahresband Medikon Verlag Erlangen 1986, S.129-132 Stöberl, C., H. Partsch, M. Wruhs: Diagnose Lymphödembeurteilungskriterien der indirekten Lymphographie, Lymphologika Jahresband Medikon Verlag München 1990, S. 29-33 - 123 - Teske, H. J., N. de Wall, N. Klüken, V. John: Darstellung des Ductus thoracicus und supradiaphragmaler Lymphknoten bei der Lymphographie, Folia angiol. XXVI-XXVII (1978-1979) 246-254 Tiedjen, K. U.: Isotopenlymphographie, in: Holzmann, H., P. Altmeyer, G. Hör, K. Hahn: Dermatologie und Nuklearmedizin, Springer Verlag Berlin Heidelberg 1985, S. 417-425 Tiedjen, K. U., E. Scheidgen, H. Wulff: Isotopenlymphographische (198 Au-colloidale) Untersuchungen des Funktionszustandes des lymphatischen Systems der unteren Extremitäten bei Phlebopathien im Vergleich zu einem Normalkollektiv und lymphostatischen Ödemen unter standardisierter passiver Bewegung, Plebol. u. Proktol. 6 (1977) 170-206 Tiedjen, K. U., A. de Marees: Isotopen-Lymphographie: Versuch einer praxisgrechten Messwert-Standardisierung, Lymphologika Jahresband Medikon Verlag München 1990, S.14-19 Tiedjen, K. U., U. Schultz-Ehrenburg, S. Knorz: Lymphabflußstörungen bei chronischer Veneninsuffizienz, Phlebol. 21 (1992) 63-71 Tiedjen, K. U.: Globale und regionale Störungen der Lymphdrainage der Extremitäten: Isotopenlymphographische Untersuchungen über das Normalverhalten und über Funktionsstörungen der Lymphgefäße der unteren Extremitäten unter besonderer Berücksichtigung des Lympödems und der sogenannten Lipödeme, Habilitationsschrift (1989) 9-13 Tiedjen, K. U., K.-D. Heimann: Die Xeroradiographie als bildgebendes Verfahren bei der indirekten Lymphographie, Lymphologika Jahresband Medikon Verlag München 1990, S.24-28 Tiedjen, K. U.: Strahlendiagnostik bei Gliemaßenschwellungen, in: Földi, M., S. Kubik: Lehrbuch der Lymphologie, Gustav Fischer Verlag Stuttgart Jena New York 1993, S.344-363 - 124 - Waldeck, F.: Zur Motorik der Lymphgefäße bei der Ratte. II. Die kontraktilen Eigenschaften der Muskulatur der Lymphgefäße, Pflügers Arch. Ges. Physiol. 283 (1965) 294-300 Weissleder, H.: Stellenwert der direkten Lymphographie, Ödem Jahresband Medikon Verlag Erlangen 1986, S. 68-76 Weissleder, H., R. Weissleder: Vergleichende indirekte Lymphangiographie und Lymphszintigraphie bei Lymphödemen der Extremitäten, Lymphologika Jahresband Medikon Verlag München 1989, S. 71-77 Weissleder, H., K. Tatsch, K. U. Tiedjen: Stellenwert der Lymphszintigraphie in der Lymphödemdiagnostik – Methodenvergleich, Lymphologika Jahresband Kagerer Kommunikation Bonn 1992, S.175-179 Weissleder, H.: Untersuchungsmethoden, in: Weissleder, H., Ch. Schuchhardt: Erkrankungen des Lymphgefäßsystems, Kagerer Kommunikation Bonn 1994, S.3169 Weissleder, H.: Pathophysiologie des Lymphgefäßsystems, in: Weissleder, H., Ch. Schuchhardt: Erkrankungen des Lymphgefäßsystems, S.29-32 Kagerer Kommunikation Bonn 1996, S.31-69 Weissleder, R., C. J. Fretz: Magnetresonanz-Lymphographie mit superparamagnetischem Kontrastmittel, Lymphologika Jahresband Medikon Verlag München 1990, S. 41-45 (a) Weissleder, R., G. Elizondo, J. Wittenberg, A. S. Lee, L. Josephson, T. J. Brady: Ultrasmall superparamagnetic iron oxyde: An intravenous contrast agent for assessing lymph nodes with MR imaging, Radiology 175 (1990) 494-498 (b) Wenzel-Hora, B. I., B. Kalbas, H. M. Siefert, J. D. Arndt, H. W. Schlösser, f. Huth: Iotasul, a Water-Soluble (Non oily) Contrast Medium for Direct and Indirect Lymphography. Radiological and morphological investigations in dogs, Lymphology 14 (1981) 101-112 - 125 - Wenzel-Hora, B. I., H. Partsch, D. Berens von Rautenfeld : Simultane indirekte Lymphographie, in: Holzmann, H., P. Altmeyer, G. Hör, K. Hahn: Dermatologie und Nuklearmedizin, Springer Verlag Berlin Heidelberg New York Tokio 1985, S.411-413 Wirth, W.: Lymphographie mit Röntgenkontrastmitteln beim Lymphödem der Beine, in: Bollinger, A., H. Partsch: Initiale Lymphstrombahn, Thieme Verlag Stuttgart New York 1984, S.23-31 Wokalek, H.: Lymphödeme, Fortschr. Med., 22-23 (1997) 23 Wolfe, J. H. N.: The initial lymphatics, Thieme Verlag Stuttgart-New York 1985, S. 140-146 Zaun, H.: Diffuse symmetrische lipomatöse Beinschwellungen, Phlebol. u. Proktol. 16 (1987) 3-13 - 126 - - 127 - Lebenslauf Name: Siegfried Knorz Geburtsdatum: 25.1.1955 Geburtsort: Duisburg Staatsangehörigkeit: deutsch Konfession: katholisch Familienstand: verheiratet Eltern: Ursula Knorz, geb. Wiegand und Lothar Knorz Schulausbildung: 1973 Abitur am Lessing-Gymnasium Bochum-Langendreer Studium: 10/1973 - 10/1976 Studium der Geschichte und Pädagogik an der Ruhr-Universität Bochum Zivildienst: 10/1976 - 3/1978 Altenpflege Studium: 9/1979 - 6/1986 Studium der Humanmedizin an der Ruhr-Universität Bochum Approbation: 6/1986 Beruf: 9/1986 - 4/1992 Innere Medizin St.-Elisabeth-Hospital Bochum CA Dr. med. Schürholz 4/1992 – 4/1993 Innere Medizin Evangelisches Krankenhaus Dortmund-Lütgendortmund CA PD. Dr. med. Wellmann Seit 4/1993 Radiologie St.-Elisabeth-Hospital Bochum CA Prof. Dr. Dr. h. c. Tiedjen - 128 - Danksagung: Ich danke den radiologisch-technischen Assistentinnen der Abteilung für Radiologie und Nuklearmedizin des St. Elisabeth-Hospitals in Bochum für Ihre engagierte Mitarbeit. Herrn Dr. med. K.-D. Heimann danke ich für vielerlei technische Ratschläge und Hilfestellung. Herrn Prof. Dr. med. L. Heuser und Herrn Dr. med. M. König möchte ich für die Zusammenarbeit und Hilfestellung bei den Untersuchungen mit digitaler Speicherfolien-Radiographie und Magnetresonanztomographie sehr danken. Mein besonderer Dank gilt Herrn Professor Dr. Dr. h. c. K. U. Tiedjen für seinen fachlichen Rat und seine ständige Gesprächsbereitschaft. - 129 - - 130 -