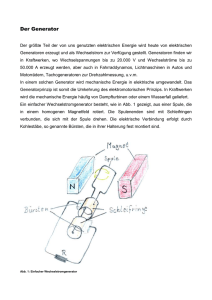
Gynäkologischen Sonographie
Werbung
Empfehlungen zur Gynäkologischen Sonographie Empfehlungen zur Gynäkologischen Sonographie 1 Der Druck dieses Leitfadens wurde freundlicherweise unterstützt von den Firmen: ALOKA Holding Europe AG Digimed SA Acuson GE Medical Systems HITACHI ULTRASOUND Holding AG Kretztechnik, Wiesbaden Schering Schweiz AG Siemens Schweiz AG Toshiba Medical Systems AG Wyeth Gyn Druck: D + D, Druck + Design AG, Chur Schweizerische Gesellschaft für Ultraschall in der Medizin Sektion Gynäkologie und Geburtshilfe (SGUMGG) Vorsitzender PD Dr. med. R. Zimmermann www.sgumgg.ch 2 Gynäkologische Sonographie Ein Leitfaden Herausgegeben von: Dr. med. M. Bajka Oberarzt Klinik für Gynäkologie Dept. für Frauenheilkunde Universitätsspital Zürich Mit Beiträgen von: Dr. med. M. Bajka, Zürich Dr. med. G. Berclaz, Bern PD Dr. med. G. Schär, Aarau Dieser Leitfaden ist aus didaktischen Gründen so aufgebaut, dass zu jedem Thema zunächst die Untersuchungstechnik vorgestellt wird, dann auf die Anatomie und Normalbefunde eingegangen wird, anschliessend eine Reihe von typischen pathologischen Befunden vorgestellt wird. Die Kapitel werden jeweils durch Empfehlungen und Konsequenzen zu den sonographischen Befunden abgerundet. Ausgehend von den pathologischen Diagnosen werden die typischen dazugehörigen Ultraschallbefunde aufzeigt («von der Diagnose zum Befund»), dies eigentlich entgegen dem Arbeitsprozess. Wir gehen davon aus, dass bei wachsender Erfahrung der UntersucherInnen in der gynäkologischen Ultraschalldiagnostik das richtige Zuordnen der sonomorphologischen Befunde zu den Diagnosegruppen und Diagnosen auf diese Weise am sinnvollsten unterstützt werden kann. Jeder Bereich beinhaltet bewusst auch einen Abschnitt zur Differentialdiagnose von Ultraschallbefunden («vom Befund zur Diagnose»). 3 Inhaltsverzeichnis 1 1.1 1.2 1.3 1.4 1.5 1.6 1.7 1.8 1.9 1.10 1.11 Grundlagen der gynäkologischen Ultraschalldiagnostik Rechtliche Grundlage Ziele der gynäkologischen Sonographie und deren Umsetzung Möglicher Nutzen Potentielle Schäden Erfahrungen des Untersuchers Geräteanforderungen Ausstattung des Arbeitsplatzes Vorinformationen für die Patientin Befundbeschreibung Untersuchungsablauf Vorgehen zur schriftlichen Dokumentation 5 5 5 5 6 6 7 7 7 8 11 12 2. 2.1 2.2 2.3 2.4 2.5 2.6 Das innere Genitale – Zyklusdiagnostik Untersuchungstechnik Normale Anatomie und Funktion, Bildbeschreibung Pathologie Häufigste Differentialdiagnosen... Indikationen, Empfehlungen und Konsequenzen Literatur 13 13 15 23 41 44 45 3. 3.1 3.2 3.3 3.4 3.5 3.6 3.7 3.8 Urogynäkologische Sonographie Ziele der urogynäkologischen Sonographie Möglicher Nutzen Qualität der urogynäkologischen Sonographie Ablauf der Untersuchung Dokumentation Auswertung Beispiele mit Interpretation Literatur 49 49 49 49 50 51 52 53 57 4. 4.1 4.2 4.3 4.4 4.5 4.6 4.7 Mammasonographie Allgemeines Indikationen für die Mammasonographie Untersuchungstechnik und Dokumentation Normale Anatomie der Brustdrüse und Axilla Pathologie Empfehlungen und Konsequenzen Literatur 58 58 58 58 59 59 60 61 5. I II III Anhang Dokumentationsblatt gynäkologische Sonographie Dokumentationsblatt urogynäkologische Sonographie Dokumentationsblatt Mammasonographie 61 62 64 66 4 1. Grundlagen der gynäkologischen Ultraschalldiagnostik M. Bajka 1.1 Rechtliche Grundlage Die Sonographie ist gemäss KVG zweckmässig und wirtschaftlich durchzuführen, was die Indikation, die Vorbereitung, die Ausführung und die aus der Untersuchung zu ziehenden Konsequenzen betrifft. Klare Auflagen, wie sie für das Ultraschall-Screening in der Schwangerschaft durch die Krankenpflege-Leistungsverordnung (KLV Art.13) bestehen, existieren für die gynäkologische Sonographie in diesem Sinne nicht. Die Dokumentationspflicht von mindesten 10 Jahren hat selbstverständlich auch für gynäkologische Ultraschalluntersuchungen ihre Gültigkeit. 1.2 ● ● ● ● ● Ziele: Klarheit schaffen bei Beschwerden und (unklaren) klinischen Befunden am inneren Genitale und der Brust der Frau die Stärken der Sonographie ausnützen, ohne die Methode dabei zu überfordern. Umsetzung: möglichst vollständige Befunderfassung bei möglichst geringer Belastung für die Patientin («ALARA»-Prinzip, «as low as reasonably achievable») zielstrebiges Erheben von Befunden, ausgerichtet auf die Beurteilung und die Differentialdiagnose Differenzierung von Prozessen durch … ● Bestimmung der Organzugehörigkeit ● Zuordnung zum entsprechenden pathologischen Formenkreis (funktionell, entzündlich, neoplastisch, degenerativ, schwangerschaftsbedingt, …) ● Artdiagnostik (benigne/maligne, chronisch/akut, …) ● Unterstützung der klinischen Beurteilung ● Unterstützung eines möglichst angemessenen Prozederes (expektative, konservative Behandlung, Punktion, endoskopische Therapie, offene Intervention, …) ● Unterstützung bei der Ausführung eines Prozederes (Punktion, Biopsie, Endoskopie, …) 1.3 ● ● Ziele der gynäkologischen Sonographie und deren Umsetzung Möglicher Nutzen Vermeiden von unnötigen Kontrollen Vermeiden von unnötigen Interventionen 5 ● ● ● Abbau von Ängsten und Unsicherheit Frühzeitiges Erkennen von Veränderungen und damit Möglichkeit frühzeitig zu intervenieren Reduktion von Kosten. Da es sich beim Ultraschall um eine überwiegend diagnostische Leistung handelt, ist nur ein Nutzen zu erwarten, wenn aufgrund des Befundes auch tatsächlich die richtigen Konsequenzen gezogen werden. 1.4 Potentielle Schäden 1.4.1 Technische Sicherheitsaspekte Insbesondere bei der Sonographie des inneren Genitales soll bei Patientinnen im gebärfähigen Alter die Untersuchung nach den Sicherheitsaspekten der Sonographie in der Schwangerschaft durchgeführt werden, d.h. die Schallleistung auf maximal 100 mW/cm 2 beschränkt werden. Damit muss weder von kurzfristigen noch langfristigen schädlichen Einflüssen auf die Patientin oder eine allfällige Schwangerschaft ausgegangen werden. Es gilt grundsätzlich das ALARA-Prinzip. 1.4.2 Psychische Folgen Mögliche psychische Folgen können sein: ● induzierte Angst bei einer vermuteten Veränderung ● induzierte Angst bei einer tatsächlich vorliegenden Veränderung ● induzierter Ärger und Enttäuschung bei einer übersehenen Veränderung ● induzierter Ärger und Enttäuschung bei einer fälschlicherweise diagnostizierten Veränderung. Die Sonographie muss darauf ausgerichtet werden, dass negative Auswirkungen möglichst vermieden werden. Ängste können während der Untersuchung abgebaut werden, in dem die wesentlichen anatomischen Strukturen kurz benannt werden (Blase, Uterus, Ovarien). Pathologische Veränderungen sollen bildlich dokumentiert und erst nach der Untersuchung, wenn die Patientin angekleidet ist, anhand der Bilder erläutert werden. Mit Interpretationen und Diagnosen sollte dabei sehr vorsichtig umgegangen werden. Die sonographischen Befunde sollen möglichst nur im Kontext mit der klinischen Untersuchung, der Anamnese, Laborbefunden und allenfalls weiteren bildgebenden Verfahren validiert werden. 1.5 Erfahrungen des Untersuchers Sie sollen gynäkologisch-geburtshilflichen Ultraschall in einer Praxis nur durchführen, wenn Sie mindesten 50 Untersuchungen pro Jahr durchführen. Regelmässige Besuche von Fortbildungsveranstaltungen zum Thema gynäkologisch-geburtshilflicher Ultraschall sind eine Selbstverständlichkeit. 6 1.6 Geräteanforderungen Um eine differenzierte Betrachtung des Urogenitalsystems vornehmen zu können, müssen sowohl eine Vaginal- (≥ 5 MHz), wie auch eine Abdominal-Sonde (≥ 3,5 MHz) am Ultraschallgerät permanent verfügbar sein. Die Sonde zur Transvaginalsonographie (TVS) soll mindesten über einen Winkel von 120° verfügen und eine Frequenz von 5 MHz aufweisen. Für die Mammasonographie werden speziell hochfrequente Sonden (≥ 7,5 MHz) vorausgesetzt, Linearschallköpfe sind vorzuziehen. Ultraschallgeräte, die es erlauben, alle drei Sonden gleichzeitig anzuschliessen, sind bei häufigem Gebrauch aller drei Sonden von erheblichem Vorteil. Die Geräte müssen insbesondere bei gleichzeitiger Verwendung für die geburtshilfliche Diagnostik der IEC-Norm 1157 entsprechen: Die Schalllaufgeschwindigkeit muss 1540 m/s betragen, der Fehler von Strecken (B-Mode) oder Zeit (M-Mode) darf 3 % nicht übersteigen, für Messstrecken < 17 mm ist ein absoluter Fehler von 1,0 mm zulässig, das Gerät soll mindestens 256 Graustufen darstellen können. Jedes Gerät muss eine adäquate Bilddokumentation ermöglichen. Lassen Sie sich vor dem Kauf eines Gerätes vom Hersteller diese Bedingungen schriftlich bestätigen. 1.7 Ausstattung des Arbeitsplatzes Der gynäkologische Ultraschall kann in jedem Raum durchgeführt werden, der auch für gynäkologische Untersuchungen eingerichtet ist. Mehrere Studien belegen, dass für die Patientin ein optimaler Untersuchungsablauf von grosser Bedeutung ist. Entsprechende Vorkehrungen zur Struktur- und Prozessqualität der Untersuchung sollen getroffen werden. Idealerweise sollte ein zweiter Monitor für die Patientin eingereichtet sein, auf dem sie die Untersuchung mitverfolgen kann. Alternativ kann der Monitor am Ultraschallgerät gedreht werden. Es empfiehlt sich Standardwerke, wie z.B. «Die sonographische Diagnostik in der Gynäkologie und Geburtshilfe», Lehrbuch und Atlas, Band 1 von Eberhard Merz, Thieme-Verlag 1997, oder den «Lehratlas der Mammasonographie» von Michael Friedrich, Edition Gynäkologie und Geburtsmedizin, WVG 1999, griffbereit zu haben. 1.8 Vorinformationen für die Patientin Über die Vorinformation zur Sonographie in der Gynäkologie bestehen keine Vorschriften. Jedoch empfiehlt es sich, dass die Patientin vor der Untersuchung von den UntersucherInnen persönlich begrüsst wird, ihr kurz der Untersuchungsgang erläutert wird, z.B. mit den Worten «Wir werden eine Ultraschalluntersuchung durchführen. Die Untersuchung verläuft wie eine Jahreskontrolle. Es wird dabei eine 7 Ultraschallsonde mit einer Gummihülle überzogen und in die Scheide eingeführt. Bitte machen Sie sich hinter dem Vorhang / in der Umkleidekabine unten ganz frei.» 1.9 Befundbeschreibung 1.9.1 Deskriptive Befundbeschreibung Eine reine Befundbeschreibung, ohne Implikation einer pathologischen, oder gar histologischen Diagnose, bedarf einer gezielten Wortwahl. Sie ist eine wichtige Grundlage für jede objektive Beschreibung bildgebender Verfahren, so auch für die Sonographie. Bei auffälligen sonographischen Befunden sollten folgende Aspekte festgehalten werden: ● Einsehbarkeit / Darstellbarkeit: gut, teilweise, ungenügend, nicht darstellbar ● Organzuordnung ● Grösse (in mind. 2 senkrecht zueinander stehenden Ebenen: Länge, Breite, Höhe) ● Form (rund, oval, länglich, polyzyklisch) ● Struktur (einfach (homogen), komplex (inhomogen)) ● äussere Begrenzung ● Abgrenzbarkeit ● Verformbarkeit ● zystischer Befund oder zystischer Anteil: ● Binnenechos: Lage (wandständig, zentral, ubiquitär), Grösse (fein, mittelgrob, grob), Intensität (schwach, mittel, stark, extrem stark), Abstand (locker, mitteldicht, dicht), Verteilung (ungleichmässig, gleichmässig) ● Anzahl Kammern ● Wanddicke ● Septendicke ● solider Befund oder solider Anteil: ● Binnenecho(s): Nachweis (wandständig, zentral, ubiquitär), Grösse (fein, mittelgrob, grob), Intensität (schwach, mittel, stark, extrem stark), Abstand (locker, mitteldicht, dicht), Verteilung (ungleichmässig, gleichmässig) ● prozentualer Anteil am gesamten Befund ● Beweglichkeit / Verschiebbarkeit in der Umgebung / zu umgebenden Organen ● Schallabschwächung und Schallverstärkung hinter dem Befund ● Bewegungsnachweis innerhalb eines Befundes ● Druckdolenzen. 1.9.2 Interpretation von Ultraschallbefunden Bei der Beurteilung des Ultraschallbefundes seien sich die UntersucherInnen bewusst, dass einer verhältnismässig geringen Anzahl von sonomorphologischen Kriterien eine Vielzahl von pathologischen Diagnosen gegenüber steht. Leider gibt es höchstens pathognomonische Ultraschallkriterien. Seltenst gibt es ein einziges Ultraschallkriterium, dass alleine auf eine sichere histopathologische Diagnose 8 schliessen lässt, z.B. Herzaktion im Adexbereich entspricht eindeutig der Diagnose Extrauteringravidität (EUG). Umgekehrt kann sich auch praktisch jede histopathologische Diagnose in mehr als nur einer einzigen Sonomorphologie präsentieren (Prototyp der Vielfalt: das Dermoid). Ultraschallbefunde sollen deshalb nicht isoliert interpretiert werden, schon gar nicht nur ein einzelnes sonographisches Kriterium. Sondern die erhobenen Befunde sollen möglichst nur im Zusammenhang mit der Anamnese der Patientin, dem Zyklusgeschehen, klinischen Befunden, Laborbefunden und ggf. anderen bildgebenden Verfahren gewertet werden. Wird die Ultraschalluntersuchung als isolierte Dienstleistung angeboten, wobei die UntersucherInnen nur für die Bildgebung zuständig sind, so ist es dringend ratsam, möglichst eine rein deskriptive Bildbeschreibung von der Ultraschalluntersuchung abzugeben (siehe 1.9.1). Die UntersucherInnen dürfen und sollen die sonographischen Befunde im Sinne einer Beurteilung differentialdiagnostisch werten und sich über die klinische Relevanz der Befunde äusseren. 1.9.3 Beispiele Beispiel 1 Klinik: 44-jährige prämenopausale Patientin, prallelastischer Adnexbefund rechts, 5cm gross, wenig mobil, dolent, CA 125 im Normbereich, keine Entzündungszeichen. TVS: 35 x 30 x 28 mm grosse, kugelige, echoleere, glattwandige Raumforderung, in Projektion auf das rechte Ovar, mobil, wenig stossdolent, nicht kompressibel (Abb.32). Beurteilung: DD funktionelle Ovarialzyste, Paraovarialzyste, Saktosalpinx. Pathologie: Corpus luteum des Ovars ohne Anhaltspunkte für Malignität. Beispiel 2 Klinik: 28-jährige prämenopausale Patientin, prallelastischer Adnexbefund links, 6 cm gross, wenig mobil, dolent, CA 125 im Normbereich, CRP leicht erhöht. TVS: 55 x 50 x 50 mm grosse, kugelige, komplexe (inhomogene), teils echodichte, teils echoarme, feinstrukturierte, glattwandige Raumforderung, in Projektion auf das rechte Ovar, nicht mobil, stossindolent, nicht kompressibel (Abb.36). Beurteilung: DD hämorrhagische Ovarialzyste, Endometriom, Dermoid. Pathologie: Endometriom des Ovars ohne Anhaltspunkte für Malignität. 9 Beispiel 3 Klinik: Verlaufskontrolle: 45-jährige prämenopausale Patientin, mit klinisch kugeligem, druckempfindlichem Fundus, auch nach Curettage persistierende Hypermenorrhoe. TVS: 45 x 40 x 40 mm messender, echoarmer, homogener Rundherd, intramural, dorsal, fundal gelegen, an das Endometrium grenzend. Innert 6 Monaten alle drei Durchmesser verdoppelt (Abb.20). Beurteilung: DD intramurales Myom, Sarkom. Pathologie: Hysterektomiepräparat mit intramuralem Leiomyom, ohne Anhaltspunkte für Malignität. Beispiel 4 Klinik: 24-jährige prämenopausale Patientin, starke Unterbauchschmerzen links, 6 4/7 Wochen Amenorrhoe, positiver Schwangerschaftstest, leichte vaginale Blutung, gynäkologische Untersuchung nicht aussagekräftig, wegen schmerzbedingter Abwehrhaltung, hCG 1848 IU/L. TVS: 45 x 35 x 30 mm grosse, inhomogene, komplexe, zentral echoarme, Raumforderung in Projektion auf die linke Adnexe, wenig mobil, sehr stossdolent, wenig kompressibel (Abb.42), im Douglas 40 x 40 x 30 mm echoarmer, bizzar konfigurierte, komplexe Raumforderung, Uterus anteflektiert, Endometrium 15 mm hoch, keine Fruchtblase in utero darstellbar. Beurteilung: dringender Verdacht auf Extrauteringravidität links mit Blutansammlung im Douglas. Pathologie: Ampulläre Eileiterschwangerschaft links. Beispiel 5 Klinik: 41-jährige prämenopausale Patientin mit neuaufgetretenem Knoten in der rechten Mamma in 10h-Achse. Klinisch 15 x 15 mm messend, zur Unterlage und Haut gut verschieblich, Lymphknotenstationen frei. MS: inhomogener, polizyklisch begrenzter, echodichter Rundherd, 12 x 12 x 10 mm, mit dorsaler Schallabschwächung, keine laterale Schallverstärkung, nicht komprimierbar, mit Zerstörung der Architektur (Abb.57). Beurteilung: DD dringender Verdacht auf Mammakarzinom. Pathologie: 10 Mammaprobeexzisat mit invasiv duktalem Mammakarzinom, 10 x 10 x 9 mm, mit peritumoraler DCIS-Komponente, allseits mindestens 1cm Abstand zum Resektionsrand. 1.10 Untersuchungsablauf Zur Diagnostik des inneren Genitales und zur Perinealsonographie sollte auf einem gynäkologischen Stuhl mit Beinstützen in Rückenlage untersucht werden können, alternativ genügt ein hohes Kissen unter das Gesäss gelegt. Für die Mammasonographie empfiehlt sich die Untersuchung auf einer schmalen Liege, ebenfalls in Rückenlage. Die Untersuchungsanordnung sollte so gewählt werden, dass sowohl für die UntersucherInnen als auch die Patientin die Untersuchung in entspannter Haltung vorgenommen werden kann. Es soll auch eine einfach zu handhabende Möglichkeit zur Abdunkelung des Raumes bestehen. Rechtshänder ziehen es im Allgemeinen vor, wenn das Gerät zur rechten der Patientin steht und sie mit ihrer rechten Hand die Sonden führen können und mit der linken Hand das Gerät bedienen. Alle UntersucherInnen sollten ihre Vorgehensweise dahingehend gestalten, dass sie nicht mit Vorwürfen der Belästigung konfrontiert werden können. Es empfiehlt sich für männliche Untersucher bei jeder gynäkologischen Sonographie eine weitere weibliche Person im Raum anwesend zu haben. Wie für jede bildgebende Diagnostik ist die Fragestellung, die mit der Untersuchung geklärt werden soll, ein entscheidender Qualitätsfaktor, insbesondere wenn die Untersuchung, wie der Ultraschall, erheblich von der Erfahrung des Untersuchers abhängt. Deshalb muss in der Gynäkologie vor jeder Ultraschalluntersuchung eine klare Fragestellung an die Ultraschalluntersuchung existieren. Die Patientinnen sollten vor der Untersuchung von den UntersucherInnen persönlich begrüsst werden, ihnen kurz der Untersuchungsgang erläutert werden (siehe 1.8). Die UntersucherInnen sollten sich ihren eigenen Untersuchungsablauf zurechtgelegt haben und diesen, wenn immer möglich, konsequent anwenden. Z.B. kann bei der Diagnostik des inneren Genitales folgendermassen verfahren werden: zuerst die Harnblase, dann der Uterus, sein Myometrium und Endometrium, dann die rechte Adnexe mit dem rechten Ovar, die linke Adnexe mit dem linken Ovar, dann der Darm und zum Schluss der Douglas, ggf. auch von abdominal die Bauchorgane (Leber, Niere, Milz, ...). Dieses Vorgehen bietet Gewähr, dass möglichst keine Befunde dank der Systematik vergessen gehen und Rechts-Links-Verwechslungen möglichst nicht auftreten. Die Patientin sollte am Monitor mit dem Marker die wichtigsten Organe kurz umrissen bekommen, d.h. die Harnblase, den Uterus und die Ovarien. Meistens geschieht nur die Befunderhebung während dem Ultraschall. Es können z.B. Thermoprints zur Dokumentation erstellt werden. Die schriftliche Dokumentation der Untersuchung findet aber meist anschliessend an die Untersuchung statt, sei es auf einem speziellen Formular (z.B. SGUMGG-Blatt, siehe Anhang), als Eintrag in die Krankengeschichte oder in ein PC-gestütztes System. Es bestehen (noch) keine Vorschriften über die Art der Dokumentation. Dennoch empfiehlt es sich auch bei unauffälligen Befunden mindestens einmal im Verlauf die Biometrie des Uterus und beider Ovarien in Bild und Wort zu dokumentieren. Pathologische 11 Befunde sollten immer in zwei Ebenen festgehalten werden, am besten durch Links-Rechts-Bildaufteilung in zwei Hälften auf einem Bild. Zum Abschluss sollte die Patientin kurz über die Konsequenzen aus der Untersuchung informiert werden, auch bei unauffälligen Befunden z.B. «Es sieht alles gut aus», «Ich habe nichts Auffälliges entdeckt», «Wir werden Ihrem Arzt einen Bericht schicken». 1.11 Vorgehen zur schriftlichen Dokumentation Es empfiehlt sich die Dokumentation jeder Untersuchung in Wort und Bild. Die schriftliche Dokumentation richtet sich ganz nach dem systematischen Ablauf der Untersuchung, wie in Kapitel 1.10 dargestellt. Es empfiehlt sich die Gliederung der Dokumentation in Anamnese, Befunde, Beurteilung und Empfehlungen (Prozedere). Die Ultraschalluntersuchung, insbesondere die des inneren Genitales, sollte nur mit bestimmten Vorkenntnissen begonnen werden, welche vorteilhafterweise auch auf der Ultraschalldokumentation festgehalten werden. Diese umfassen den Menopausestatus, den Zyklustag, die Einnahme von hormonal aktiven Medikamenten, gehabte Eingriffe, Beschwerden und/oder klinische Befunde und die Fragestellung. Die letzten beiden Argumente sind von grosser Bedeutung, wenn die Sonographie als alleinige Dienstleistung unabhängig von der klinischen Untersuchung oder Betreuung der Patientin durchgeführt wird. Ein möglicher Ablauf der Dokumentation, resp. der Befunderhebung im kleinen Becken, könnte sein: Blase, Uterus, Myometrium, Endometrium, Adnexe rechts, Ovar rechts, Adnexe links, Ovar links, Douglas, Rektum, übrige Bauchorgane. Bei der Untersuchung des Beckenbodens zuerst das Ruhebild, dann das Pressbild und zum Schluss das Kneifbild. Bei der Untersuchung der Brust: rechte Mamma, rechte Axilla, linke Mamma, linke Axilla. Es soll sich an die Befunddokumentation immer eine sonographische Beurteilung, ev. auch eine Empfehlung zum Prozedere anschliessen, letzteres insbesondere, wenn die Sonographie von anderen, nicht betreuenden ÄrztInnen durchgeführt wird. Optimal ist die Dokumentation in einem PC-basierenden System, mit der Möglichkeit, Daten im Verlauf auch graphisch darzustellen. Die SGUMGG hat für die Sonographie des inneren Genitales, der urogynäkologischen Sonographie und der Mammadiagnostik ein Blatt zur Dokumentation entworfen (siehe Anhang), worauf jeweils eine Untersuchung festgehalten werden kann. Bilder in Form von Thermoprints können auf der Rückseite angeheftet werden. Die SGUMGG-Blätter sollen den weniger erfahrenen UntersucherInnen auch als Stütze beim Erlernen der Untersuchungssystematik dienen. 12 2. Das innere Genitale – Zyklusdiagnostik M. Bajka 2.1 Untersuchungstechnik 2.1.1 Vorbereitungen Bei der Transvaginalsonographie ist auf die Hygiene peinlich genau zu achten. Die Vaginalsonde wird mit einer homogen mit Gel gefüllten Gummihülle überzogen, aussen wird nochmals Gel appliziert (Cave: Allergien auf Gummibestandteile, z.B. Latex-Allergien). Die Abdominalsonde sollte nach jedem Gebrauch desinfizierend gereinigt werden, die transvaginale Sonde mindestens einmal täglich, bei Verunreinigung unmittelbar anschliessend. Für die Transvaginalsonographie (TVS) empfiehlt sich eine leere Harnblase, für die Transabdominalsonographie (TAS) eine gut gefüllte Harnblase. Die Untersuchungen sollen in Rückenlage auf dem Untersuchungsstuhl im abgedunkelten Raum stattfinden. Wahl der Technik (TAS vs. TVS): Zur Darstellung der inneren Organe des weiblichen Beckens kann der transabdominale und der transvaginale, und in Ausnahmefällen der transrektale Zugang gewählt werden. Im Allgemeinen wird in der Beurteilung des inneren Genitale der Untersuchung mittels Vaginalsonde der Vorrang gegeben. Nur bei Prozessen, die über das kleine Becken hinausreichen (z.B. Adnextumoren über 10 cm, grosse Uterusmyome), sollten diese bei möglichst gut gefüllter Blase von abdominal angegangen werden. Die Vorteile der transvaginalen Betrachtung von Uterus und Adnexen gegenüber der transabdominalen wurden mehrfach belegt 1, 2, 3, 4, 5. Dass die sonographisch gemessenen Uterus- und Ovargrössen mit dem anatomischen, resp. pathologischen Korrelat gut übereinstimmen, konnte von verschiedenen Autoren in Studien mit grosser Fallzahl belegt werden 6, 7. 2.1.2 Untersuchungshilfen Gelegentlich kann bei der TVS nicht genügend Einsicht in die Organe des kleinen Beckens gewonnen werden. Oft lässt sich dann mit langsam kontinuierlich verstärktem Druck gegen die Weichteile eine deutliche Verbesserung in der Darstellung einzelner Organe erreichen. Zuvor soll aber die Patientin darauf aufmerksam gemacht werden, dass etwas mehr Druck ausgeübt werde. Sie soll sich äussern, wenn das Vorgehen Schmerzen verursachen würde. Wenn dies noch nicht ausreicht, kann mit der freien Hand zusätzlich sanfter Druck von der Bauchdecke her in Richtung kleines Becken ausgeübt werden. Man beachte, dass dadurch bei schlanken Patientinnen die Sonde der komprimierenden Hand sehr nahe kommen kann (Cave: Schmerzen). Insbesondere regelmässige, bandförmige Reflexe im Abstand von Zentimetern können bei der TVS die Einsicht stark stören (Reverberationsartefakte). Meist liegt dann eine zu sehr gefüllte Harnblase oder ein zystischer Befund vor. Grössere 13 Myome stellen sich oft als enorme «Schallschlucker» dar (Abb.21). Es soll dann auf die TAS umgestiegen werden. 2.1.3 Darstellung am Monitor Der Bildaufbau am Monitor wird in verschiedenster Weise praktiziert. In diesem Leitfaden wird die im deutschsprachigen Raume am häufigsten angewandte Darstellungsweise präsentiert 8, 9, 10, 11. Bei der TVS wird das Bild generell von unten nach oben aufgebaut, im Sagittalschnitt wird ventral im Bild rechts, dorsal im Bild links abgebildet (Abb.1a). Die Bilder werden so orientiert, als würden sie bei der stehenden, nach rechts ausgerichteten Frau aufgenommen. Dadurch schaut der Fundus des anteflektierten Uterus und die Blase immer nach rechts, der Fundus des retroflektierten immer nach links im Bild. Beim transversalen Schnitten (Abb.1b) entspricht links im Bild der rechten Körperseite, rechts im Bild der linken Körperseite (wie in der Radiologie üblicherweise horizontale Schnittbilder betrachtet werden). Bei der TVS sind der mediane und andere Sagittalschnitte wichtige Referenzebenen, die regelmässig dargestellt werden. Man sei sich aber bewusst, dass der exakte Transversalschnitt selten, der exakte Longitudinalschnitt praktisch nie zur Anwendung kommen, jedoch dazwischen liegende steilere oder weniger steile Ebenen (sog. «Querschnitte» oder auch «transversale Schnitte») wichtige Einstellungen ermöglichen. Dennoch ist das bewusste Führen der Sonde in bezug auf die Hauptschnittebenen von grosser Bedeutung, will man die Topographie des Untersuchten richtig in seine Umgebung projizieren. Bei der Darstellung von abdominal (TAS) wird in Sagittalschnitten kranial links im Bild und kaudal rechts im Bild dargestellt, bei Transversalschnitten rechts links im Bild und links rechts im Bild (Abb.2). Abb.1 TVS: Standard-Darstellung des Uterus, Bildaufbau von unten re dorsal a) anteflektierter Uterus im medianen Sagittalschnitt 14 ventral b) Uterus im Querschnitt li Abb.2 TAS: Standard-Darstellung des Uterus, Bildaufbau von oben re li kranial kaudal a) anteflektierter Uterus im medianen Sagittalschnitt 2.2 b) anteflektierter Uterus in einem transversalen Schnitt Normale Anatomie und Funktion, Bildbeschreibung 2.2.1 Uterus Das Vorgehen zur Messung der Uterusgrösse (Abb.3) soll die unterschiedlichen Proportionen zwischen Korpus mit Fundus einerseits und der Zervix anderseits in den verschiedenen Lebensaltern berücksichtigen. Die Uteruslänge soll immer mit der Zervix angegeben werden. Der präpubertäre Uterus ist durchschnittlich 41 mm lang und 9 mm tief. Im gebärfähigen Alter wird für die Uteruslänge transabdominal 76 +/- 7 mm und für die Tiefe 29 +/- 4 mm für Nulliparas angeben 12. Der Uterus einer Mehrgebärenden darf in allen Dimensionen 12 mm mehr betragen, 89 +/- 9 mm Länge und 38 +/- 6 mm Tiefe 12. Transvaginal konnte Merz bedeutend kleinere Werte finden (Tab.1). In ovulatorischen Zyklen scheint die Uterusgrösse gering, jedoch nachweislich zu variieren mit der grössten Ausdehnung am 27. ZT 13. Nach der Menopause nimmt der Uterus wieder kleinere Massen an, was aber sehr unterschiedlich ausfallen kann. Der spät postmenopausale Uterus kann durch Involution bis auf 45 mm Länge und 15 mm Tiefe abnehmen. Die Myometriumdicke postmenopausal soll von einer estrogenhaltigen Hormonsubstitution nicht beeinflusst werden 14. Die Zervix kann von vaginal her meist gut eingesehen und abgegrenzt werden. Das Uterusgewicht kann errechnet werden aus den sonographischen Massen für die Länge, Breite und Tiefe nach der Formel: Schätzgewicht Uterus (g) = Länge (mm) x Tiefe (mm) x Breite (mm) x 0,00038 + 24 15. Tab. 1 Biometrie des Uterus (Richtwerte) TAS 12 Länge, max. (mm) Tiefe, max. Breite, max. Gewicht, max. (g) TVS 16 Nullipara Mehrpara Nullipara Mehrpara 90 50 60 120 100 60 70 150 73 32 40 92 43 51 15 Abb.3 Standardvermessung des Uterus im medianen Sagittalschnitt a) Länge (L, zweigeteilt), Tiefe (T) und Endometriumdicke (Bi), im Querschnitt b) maximale Breite von Zervix und Fundus 2.2.2 Endometrium Es wird von einem normalen weiblichen Zyklus von durchschnittlich 28 Tagen ausgegangen. Messung der Endometriumdicke: Im medianen Sagittalschnitt soll senkrecht zur Uterusoberfläche die dickste Endometriumstelle abgegriffen werden. Sie umfasst beide Endometriumschichten (Abb.3, Bilayer, «Bi») und wird vom echodichten Endometriumrandsaum von der einen bis auf die andere Seite gemessen. Die echoarme, innerste Myometriumschicht wird nicht miteinbezogen. Falls intrakavitär Flüssigkeit oder ein abgrenzbarer Polyp vorliegt, so sollen diese abgezogen und separat beschrieben werden (Abb.4). Maximal zulässige Endometriumdicke siehe Tab. 2. Das Endometrium erscheint physiologischer Weise als gradlinig echodicht begrenzter, kontinuierlicher Schweif, spitz bei der Zervix beginnend. Abweichungen von dieser Form und Begrenzung, insbesondere Kalibersprünge, sind als Hinweis auf eine Uteruspathologie zu werten (Myome, Polypen, …). Abb.4 b) Endometrium-Messung bei intrakavitärer Flüssigkeit: Flüssigkeit (x zu x) ist von der Gesamtdicke (Punkt zu Punkt) abzuziehen Tab. 2 Endometriumdicke, gemessen als Gesamtdicke = Bilayer (Richtwerte)16 max. Gesamtdicke prämenopausal postmenopausal 16 15 mm < 5 mm 2.2.3 Zyklusdiagnostik am Endometrium Am Ende der Menstruation vom 4. – 6. Zyklustag (ZT) ist die Funktionalis abgebaut, das Endometrium kann bis auf 1 mm Dicke schrumpfen (Abb.5). In der TVS kann es dann als dünner echogener Strich dargestellt werden. Im weiteren Verlauf der Proliferationsphase nimmt das Endometrium stetig an Dicke zu. Ab dem 10. ZT lockert sich infolge Ödems der Superfizialzellen das echodichte Endometrium auf. Es weist dann eine typische Schichtung auf mit einem echodichten Randsaum, echoarmem Volumen und einem echodichten, strichförmigen Mittelecho. Präovulatorisch um den 14. ZT (Abb.6) erreicht das Endomertrium eine Dicke von 10 – 12 mm. Unmittelbar postovulatorisch kann das «endometrial ring sign» darstellbar werden, wobei sich unter Progesteroneinfluss das Endometrium in seiner gesamten Dicke im Fundus kugelig ausformt, mit der Schichtung der Proliferationsphase eines echoarmen Kerns und echodichtem Randsaum. In der mittleren Sekretionsphase erreicht die Endometriumdicke durch die sekretorische Umwandlung (20. – 25. ZT) ihr Maximum mit 10 – 15 mm Dicke, wandelt sich in einen zentral echodichten Streifen um. In der späten Sekretionsphase (26. – 28. ZT) nimmt die Endometriumdicke wieder deutlich ab. Mit Beginn der Menstruation findet man echoarme Zonen in Projektion auf das Endometrium als Zeichen der Desquamation. Die Schichtung des Endometriums geht dabei weitgehend verloren. Die Form des Cavum uteri kann sonographisch am besten bei hochaufgebauten Endometrium beurteilt werden, d.h. um den 22. ZT. Dies kann z.B. zur Diagnostik von Uterusanomalien (Uterus bicornis, subseptus, arcuatus, …) gezielt ausgenutzt werden. Eine Endometriumdicke von über 15 mm gilt prämenopausal prinzipiell als abnorm, kann als Hinweis auf eine Pathologie (Endometriumpolyp, submuköses Myom, …) oder eine Schwangerschaft interpretiert werden. Im Falle einer vermuteten Pathologie empfiehlt es sich, eine postmenstruelle Kontrolle (ca. am 6. ZT) durchzuführen, wobei physiologischer Weise ein strichförmiges Endometrium zu erwarten wäre. Postmenopausal (ohne Hormonsubstitution) gilt, dass eine vaginale Blutung histologisch abgeklärt werden muss. Eine Ausnahme kann bei einer sonographischen messbaren Endometriumdicke von < 5 mm gemacht werden, wo vorerst expektative vorgegangen werden kann, unter der Annahme einer atrophiebedingten Blutung 17, 18. Bei regelmässiger, resp. keiner Blutung unter Hormonsubstitution (z.B. Cyclo-Premella ST, resp. Premella ST) besteht bei einer Endometriumdicke von > 8 mm die Möglichkeit, hormonell eine Abbruchblutung auszulösen. Spätesten wenn das Endometrium danach sich nicht deutlich verringert hat, muss eine histologische Abklärung folgen. Generell kann in unklaren Situationen mittels Hydrosonographie eine erste Klärung mit minimal belastenden Mitteln herbeigeführt werden, unabhängig davon, ob die Patientin blutet oder nicht 30. 17 Abb.5 Abb.6 5. ZT. Endometrium niedrig 14. ZT. Endometrium hochaufgebaut. Minimal Flüssigkeit intrakavitär und Schleim im Bereiche des Zervikalkanals 2.2.4 IUD-Lagekontrolle Die TVS stellt heute das Mittel der Wahl zur Lagekontrolle von intrauterinen Pessaren (IUD) dar. Verschiedene Techniken zur IUD-Lagekontrolle wurden vorgeschlagen 19, 20, 21, 22. Wir empfehlen bei der Lagekontrolle der IUD´s, nach folgender Richtlinie vorzugehen 23 : Unmittelbar nach der IUD-Einlage, wie auch bei späteren Kontrollen, erfolgt die Lageverifizierung mittels TVS. Dabei soll in einem Sagittalschnitt der Abstand (x) von der IUD-Spitze bis zum Cavum-Ende abgegriffen werden (Abb.7). Ist dieser Abstand so gering, dass er nicht eindeutig dargestellt werden kann, so darf von einer korrekten Lage ausgegangen werden (Abb.8,9). Ein Abstand «x» von < 5 mm wird als normal bezeichnet, 5 mm als Grenzfall, 6 – 10 mm als Grauzone, > 10 mm als IUD-Tiefsitz. Im Falle einer Distanz von 5 mm soll in 3 Monaten kontrolliert werden. Bei 6 – 10 mm Distanz soll individuell vorgegangen werden. Im Falle eines Tiefsitzes muss das IUD nach eingehender Aufklärung umgehend entfernt werden. Kupferhaltige IUD’s lassen sich direkt durch den echodichten, metallischen Schaft nachweisen, mit kompletter dorsaler Schallauslöschung (Abb.8). Nicht kupferhaltige IUD’s (z.B. Mirena®) lassen sich oft nur an ihrer dorsalen Schallauslöschung indirekt nachweisen (Abb.9). Die Lagebestimmung kann dennoch auch hier sehr zuverlässig erfolgen. 18 Abb.7 IUD-Lagekontrolle Abb.8 Kupfer-IUD, korrekte Lage. x Abstand IUD-Oberpol zum Cavum-Ende Abb.9 Mirena®, korrekte Lage. Beachte das sehr echoarme IUD mit aber deutlichem Schallschatten. 2.2.5 Ovarien Das Auffinden der Ovarien bereitet bei der prämenopausalen Patientin in der Regel dank der spezifischen Ovarmorphologie mit Follikeln und der regelmässigen Lage in der Fossa ovarica nahe den Iliakal-Externen-Gefässen keine Schwierigkeiten. Follikel können dabei von den grossen Gefässen durch das Manöver des «90°-Ausdrehens» der Sonde unterschieden werden, d.h. wenn der dargestellt Kreis nach 90°-Drehung zum länglichen Schlauch wird, handelt es sich am ehesten um ein Gefäss und nicht um einen Follikel. Wenn vorhanden kann auch der Farb-Doppler zum Blutflussnachweis eingesetzt werden, oder nur auf Pulsationen geachtet werden. Bei der postmenopausalen Patientin definieren wird das «sonographische» Ovar, als homogen hypoechogene, ovaläre Struktur von Myometrium-Echogenität, ca. 20 mm lang, mit einem echogenen Randsaum, ohne Peristaltik 7, 24. Das postmenopausal sonographisch nicht darstellbare Ovar ist bei makroskopischer Betrachtung meist klein und atroph. Mikroskopisch ist ihm nur selten eine pathologische Bedeutung beizumessen 7, 25. Zur Vermessung der Ovarien soll die Ellipsoidformel zur Volumenberechnung in vereinfachter Form angewendet werden 26, 27 : Ovarialvolumen (ml) = Durchmesser 1(mm) x Durchmesser 2 (mm) x Durchmesser 3 (mm) x 0,000523. Zu fordern sind dabei drei bildlich erfasste Achsen, die alle senkrecht zu einander stehen. Das Monitorbild wird zu diesem Zweck geteilt, die Vergrösserung so gewählt, dass das Ovar links und rechts jeweils ganz zur Darstellung kommt (Abb.10). 19 Abb.10 Vorgeschlagene, standardmässige Vermessung der Ovarien als Volumen. Stark divergierende Daten in der Literatur existieren bezüglich der Darstellbarkeit der Ovarien. Sie reicht von 99 % 24 bis 85 % für mindestens ein Ovar und 60 % für beide Ovarien bei derselben Patientin 7. Für die Praxis gilt, dass die Ovarien prä- und perimenopausal praktisch immer dargestellt werden können, postmenopausal in mehr als 50 % der Fälle, wenn nach obigen Kriterien vorgegangen wird. Als Ovarialfollikel werden Strukturen bei der prä- und perimenopausalen Frau bezeichnet, deren durchschnittlicher Durchmesser nicht grösser als 3 cm ist. Übersteigt dieser Wert 3 cm, so ist die Verwendung des pathologischen Begriffes «Ovarialzyste» gerechtfertigt. Bei der postmenopausalen Patientin ist jede rundliche echoleere Struktur in Projektion auf das Ovar als Zyste im Sinne eines auffälligen Befundes zu verstehen. Generell gelten die maximalen Ovarialvolumen nach Lebensalter als guter Marker für den Ausschluss einer Pathologie (Tab.3). Eine andere Regel besagt, dass ein Ovar nicht mehr als doppelt so gross sein soll, wie das andere. Tab. 3 Ovarvolumen (Richtwerte) 28 max. Ovar-Volumen prämenopausal postmenopausal 18 ml 8 ml 2.2.6 Zyklusdiagnostik am Ovar Wie beim Endometrium wird beim Ovarialzyklus von duchschnittlich 28 Tagen ausgegangen. Innerhalb der ersten 5 ZT (Menstruation) können im Ovar im Normalfall nur kleine Follikel (< 10 mm) nachgewiesen werden (Abb.11). Diese stellen sich als echoleere, kleine runde Zonen im Ovar dar. Von diesen Follikeln kristallisiert sich einer als der dominante Follikel heraus und wächst linear durchschnittlich 1,5 – 2 mm pro Tag. Die anderen Follikel werden atretisch. Präovulatorisch ist der dominante Follikel bis auf ca. 22 mm angewachsen (Abb.12). Da der Follikel gelegentlich oval statt streng kugelig ist, wird zur Follikulometrie der Durchmesser als Durchschnitt von drei senkrecht zu einander stehenden Innen-Innen-Duchmessern angegeben. Dabei ist eine möglichst grosse Vergrösserung zu wählen. Dieses Mass ist insbesondere für die assistierte Reproduktionsmedizin von Bedeutung. Beim sprungreifen Follikel kann oft (in 40 – 80 % der Fälle) der Cumulus oophorus als wandständige echodichtere Struktur dargestellt werden. 20 Nach der Ovulation lässt sich der gesprungene Follikel meist nicht mehr darstellen, dafür eine kleine, kollabierte zystische Struktur, gefüllt mit wenig Flüssigkeit. Allerdings schliesst die Persistenz einer follikelähnlichen Struktur die stattgefundene Ovulation nicht aus. Als indirekte, allerdings unsichere Zeichen der stattgefundenen Ovulation, lassen sich oft etwas freie Flüssigkeit im Douglas und ein deutlich dilatierter Zervikalkanal mit echoleerem Inhalt darstellen (Abb.6). Durch Einblutung in den gesprungenen Follikel entsteht das Corpus rubrum (haemorrhagicum), charakterisiert durch feine Binnenechos. Durch Einsprossung von Gefässen bildet sich dann das Corpus luteum, dass sich sonographisch sehr variabel präsentieren kann. Entweder handelt es sich um ein vorwiegend echoarmes Corpus luteum mit echoreichem Randsaum oder um ein vorwiegend homogen echoreiches Corpus luteum. Die Grösse kann ebenso variieren. Ein Corpus albicans stellt sich als echodichte, gelappte Rundstruktur, meist ohne direkten Kontakt zur Rinde dar. Unter Ovulationshemmern sollten höchstens «ruhende» Follikel nachzuweisen sein. Andernfalls ist am sicheren Verhütungsschutz zu zweifeln. Abb.11 Abb.12 5. ZT. Alle Follikel messen unter 10 mm 14. ZT. Dominanter Leitfollikel 22mm (im Durchschnitt) 2.2.7 Tuben Für die Darstellbarkeit der Tuben gilt grob, dass sie mit der aktuellen Technik in normalem, nicht pathologisch verändertem Zustand nicht dargestellt, respektive in der Adnexe nicht separiert werden können. Erst eine mit Flüssigkeit gefüllte, wie auch eine von Flüssigkeit umgebene Tube lässt sich darstellen. 2.2.8 Grosse Gefässe Regelmässig kann die A. und V. iliaca externa rechts und links in ihrem Längsverlauf dargestellt werden. Sind sie quer getroffen, so lässt sich der vermeindlich zystische oder doppelzystische Befund durch das Manöver des «90°-Ausdrehens» als längliches, schlauchförmiges selbst oder fortgeleitet pulsierendes Gefäss richtig deuten. Die Aufteilung der A. iliaca communis in die A. iliaca interna und externa ist regelmässig darstellbar. Diese Aufteilung stellt eine Landmarke beim Auffinden der 21 Ovarien dar, denn oft liegen diese in der durch die Gefässe gebildeten Fossa ovarica (Abb.13). Zu bemerken ist, das bei der Bilddarstellung wie oben beschrieben, sowohl die iliakal externen Gefässe von links wie auch rechts immer im Bild von links oben nach rechts unten verlaufen, und nicht etwa die Gefässe von rechts dann von rechts oben nach links unten. Das hängt damit zusammen, dass die TVS Distanzen abbildet, ohne automatisch zu erkennen, ob der Schnitt rechts oder links der medianen Sagittalebene entsteht. Es besteht an manchem US-Gerät die Möglichkeit, das Bild entsprechend der Lage des Schnittes links- rechts zu spiegeln. Diese Möglichkeit wird jedoch als nicht praktikabel angesehen und nicht empfohlen. Somit erscheinen uns Sagittalschnitte in der TVS immer wie von rechts der Patientin durch das Becken hindurchblickend. Abb.13 Abb.14 Darstellung der A. und V. iliaca externa, links längs, rechts quer (Gefässe von links und von rechts werden gleich dargestellt !) M. piriformis. Beachte die Fiederung des Muskels 2.2.9 Muskulatur Die beiden Muskeln, die bei der TVS regelmässig dargestellt werden können, sind der M. obturatorius internus und der M. piriformis. Sie sind bei entsprechend tiefer Sondierung als begrenzende Strukturen des kleinen Beckens dorsal-lateral resp. kaudal-lateral zu erkennen. Sie sind, wie alle quergestreiften Muskeln, gefiedert, d.h. insgesamt echoarm, weisen in eine Richtung ausgerichtete, echodichten feine Streifen auf (Abb.14). 2.2.10 Douglas Dem Douglas kommt eine besondere Bedeutung zu. Er stellt bei der stehenden Frau den tiefsten Punkt der Bauchhöhle dar. Von sämtlichen Flüssigkeiten, die in die Bauchhöhle gelangen und nicht abgekapselt sind, darf erwartet werden, dass sie in den Douglas gelangen, sich dort ggf. punktieren lassen. Physiologischer Weise kann im Douglas sehr oft freie, echoleere bis echoarme Flüssigkeit dargestellt werden (Abb.15). Insbesondere tritt diese mittzyklisch nach der 22 Ovulation auf. An «soliden» Raumforderungen sind physiologischerweise durchaus einmal eines oder beide Ovarien im Douglas anzutreffen. Vergrösserte Adnexen fallen der Schwerkraft folgend oft in den Douglas. Die häufigsten Befunde im Douglas sind Dick- und Dünndarmschlingen, deren Wandung, Kaliber und Peristaltik hier ausgezeichnet beobachtet und beurteilt werden können. Abb.15 Abb.16 Freie Flüssigkeit im Douglas von geringem Ausmass Harnblase, leicht gefüllt 2.2.11 Harnblase Die Harnblase soll bei jeder TVS betrachtet werden (Abb.16). Sie sollte vorzugsweise bei der TVS möglichst leer, bei der TAS möglichst gut gefüllt sein. Urin in der Blase stellt sich immer echoleer dar (Ausnahmen: deutliche Hämaturie, Pyurie). Die Gains am Gerät können an der Harnblase so eingestellt (geeicht) werden, dass der Urin eben echoleer erscheint. Dieser Referenzwert ist in der Beurteilung der Intensität von Binnenechos im kleinen Becken oft von grosser Bedeutung. Ausserdem ist der Kontrast Blaseninhalt zu Blasenwand sehr stark und kann von jeder Patientin leicht erfasst werden. Die Blase soll anlässlich jeder TVS oder TAS der Patientin kurz demonstriert werden. 2.3 Pathologie 2.3.1 angeborene Fehlbildungen Uterusfehlbildungen sind in etwa bei 1 – 2 % der Frauen zu finden. Sie entstehen durch eine unvollständige Vereinigung der paarigen Müller´schen Gänge. Bei Frauen mit Uterusfehlbildung ist die Rate primärer Infertilität und die Abortrate deutlich erhöht. Die Entstehung einer Fehlbildung geht auf eine eng umschriebene Zeit in der embryonalen, resp. fetalen Entwicklung zurück. Uterusaplasien (komplett, inkomplett, …) entstehen in der 8. – 11. SSW, Fehlbildungen bei der Verschmelzung der Müller´schen Gänge (Uterus didelphis, bicornis bicollis, bicornis unicollis, …) in der 12. – 14. SSW, Fehlbildungen bei der inneren Fusion (Abb.17) (Uterus septus, 23 arcuatus, …) in der 15. – 19. SSW. Assoziierte Fehlbildungen des harnableitenden Systems sind bei den „frühen“ Fehlbildungen (Uterusaplasien und Müller’sche Verschmelzungsanomalien) mit bis zu 35 % sehr häufig, bei „späten“ Anomalien der inneren Fusion hingegen sehr selten 29. Abb.17 Uterus subseptus (arcuatus) a) rechter Fundusbereich b) Uterusmitte c) linker Fundusbereich Die Lage des kleinen weissen Punktes alleine lässt nicht zwischen einem Uterus bicornis und subseptus unterscheiden. Beachtet man jedoch die unveränderte Lage des dicken weissen Punktes in der Mitte (b), so schliesst diese unverändert hohe Lage einen Uterus bicornis weitgehend aus. Sonographische Hinweiszeichen auf Uterusanomalien sind bei hochaufgebautem Endometrium in der 2. Zyklushälte meist gut darstellbar. Der Uterus soll von links nach rechts und umgekehrt in sagittalen Schnitten betrachtet werden. Zunächst konzentriert man sich auf das fundale Ende des Endometriums, ob es grosse «Höhenschwankungen» macht, und dann auf Einziehungen der äusseren Funduskontur, jeweils zur Mitte hin. Grobe Hinweiszeichen können sein: ● ● ● ● ● Nachweis zweier klar getrennter Endometriumstreifen auffällige äussere Uteruskontur, v. a. fundal eine übermässige Breite oder eine Einziehung zur Mitte auffällig breites Korpus uteri auffällig breite Zervix uteri Fehlen einer Niere. Führt diese Sonographie nicht schlüssig zu einer Diagnose, kann eine Hydrosonographie durchgeführt werden 30, insbesondere bei der Frage nach Fehlbildungen der inneren Fusion. 2.3.2 Entzündliche Veränderungen Die häufigsten genitalen Ursachen von akuten Bauchschmerzen sind: ● Adnexitis ● Parametritis ● Tuboovarialabszess 24 ● ● ● ● ● ● ● Douglasabszess eingeblutete Ovarialzyste stielgedrehter Ovarialtumor Endometriose(-zyste) rupturierte Ovarialzyste Extrauteringravidität Abortgeschehen. Die entzündlichen Prozesse nehmen dabei eine besonders wichtige Stellung ein. Die akute Adnexitis zeichnet sich sonographisch dadurch aus, dass die Adnexen schlecht einzusehen, die Ovarien schlecht abzugrenzen und druckdolent sind und oft eine deutlich vermehrte Flüssigkeitsansammlung im Douglas nachzuweisen ist. Verschliesst sich das Fimbrienende zur Saktosalpinx, lässt sich in einer verdickten, starren, geschlängelten Tube ein flüssiger Inhalt nachweisen, der echoleer oder diffusverteilte feine Binnenechos aufweisen kann. Je echogener die Binnenechos sind, desto eher geht man von einer Eiterhaltigen Tube (Pyosalpinx) aus. Tuben, die echoleere Flüssigkeit beinhalten, lassen auf eine reine Hydrosalpinx schliessen. Gelegentlich erinnert der Schnitt durch die mäanderförmig aneinander gelagerten, dilatierten Tubenschlingen an ein «Schneckenhaus im Querschnitt» (Abb.18). Zur Abgrenzung der Hydrosalpinx von einem Ovarialbefund muss das gleichseitige Ovar gesucht werden. Abb.18 Abb.19 Hydrosalpinx unilateral rechts. Patientin asymptomatisch Tuboovarialabszess. Klinik: Temp 39,6° C, Erbrechen, Durchfall, Lc 5’000, CRP 17. Intraoperativ: Pelveoperitonitis und Perihepatitis Fitz-Hugh-Curtis. Abstriche: Chlamydien-Nachweis pos Der Tuboovarialabszess (TOA) weist in der Regel das Bild eines bilateral abgekapselten, schlecht abgrenzbaren Prozesses auf (Abb.19). Ein älterer TOA verursacht oft erstaunlich wenig Druckdolenz. Das sonographische Bild entspricht einer einbis mehrkammerigen, dickwandigen Raumforderung auf beiden Seiten des Uterus. Der Innenraum ist von diffusverteilten, dichten, unregelmässigen Echos ausgefüllt. 25 Das Erscheinungsbild von TOA´s ist sehr heterogen. Bildet sich ein postentzündlicher Konglomerattumor, so hebt er sich oft nur gering von seiner Umgebung ab und kann als «träge Darmschlinge» fehlgedeutet werden. Ausgehend vom sonographischen Befund sollen in die Differentialdiagnose des Tuboovarialabszess folgende Ursachen einbezogen werden: ● Endometriosezyste ● Dermoidzyste ● eingeblutete Corpus-Luteum-Zyste ● gestieltes Myom ● stielgedrehter Ovarialtumor ● perityphlitischer Abszess (Appendizitis) ● Hämatom bei EUG ● entzündliche Darmveränderung ● ausgeprägte Koprostase. Bei eitrigen Prozessen in der Bauchhöhle, bei denen es primär nicht zur Abkapselung kommt, oder die sich sekundär eröffnen, kommt es meist zur Eiteransammlung im Douglas (Douglasabszess). Die reichlich echodichten Spots in echoarmer Umgebung lassen sich gelegentlich schwer von Blut unterscheiden. Eine TVS-gesteuerte Punktion der Flüssigkeit im Douglas gelingt meist problemlos und trägt zur Klärung der Befunde bei. 2.3.3 Befunde vom Uterus ausgehend 2.3.3.1 Myome Myome stellen den häufigsten gynäkologischen Tumor dar. Jede dritte Frau im gebärfähigen Alter ist Myomträgerin 31. Auch in der Postmenopause sind Myome anzutreffende Befunde. Myome treten seltener solitär als multipel auf, 90 Prozent davon sind im Fundusbereich lokalisiert. Nebst den lokalisieren Myomen gibt es eine diffuse Myomatose, wobei eine generelle Vergrößerung des Uterus auffällt, ohne eigentlichen Rundherdnachweis. Myome stellen sich kugelig dar und zeigen in der Regel eine glatte Begrenzung zum Myometrium. Ihre Echogenität ist abhängig vom Grad der degenerativen Veränderung. Gut durchblutete Myome haben ein echoarmes Binnenmuster (Abb.20,22). Verkalkungen hingegen führen zu sehr echodichten, inhomogenen Bezirken im Rundherd. Bemerkenswert ist der konstant auftretende, mehr oder weniger dichte Schallschatten hinter Myomen. Deshalb sollte bei einem Durchmesser von mehr als 10 cm derselben das kleine Becken mittels TAS untersucht werden (Abb.21). 26 Abb.20 Abb.21 Uterus myomatosus mit inhomogenem 5cm Rundherd, TVS in zwei Ebenen Riesiges Uterusmyom, TAS, Sagittalschnitt Abb.22 Abb.23 Kleines, echoarmes Vorderwand-Myom, knapp 1 cm im Durchmesser Intraligamentäres Myom (My), breitbasig am Uterus (Ut) anhängend, 4 cm Durchmesser, transversaler Schnitt Rundherde im Myometrium sollten folgendermassen beschrieben werden: 1. Lage (submukös, intramural, subserös, gestielt subserös, intraligamentär (Abb.23)), 2. drei Hauptdurchmesser, 3. Echogenität, 4. Homogenität. Es sei darauf hingewiesen, dass die Vermessung von Myomen eine grosse Variabilität von Untersuchung zu Untersuchung, wie auch von Untersucher zu Untersucher aufweisen kann. Dies ist bei der Beurteilung der Wachstumstendenz unbedingt zu berücksichtigen. 2.3.3.2 Polypen der Korpusschleimhaut Polypen der Korpusschleimhaut sind oft schwierig zu diagnostizieren. Oft fällt nur auf, dass das Mittelecho aufgehoben ist, oder dass die Begrenzung des Endometriums auffällig an einer oder mehreren Stellen «buckelig» verbreitert ist, die glatte, «schweifartige» Begrenzung punktuell aufgehoben erscheint. Nur Gelegentlich erinnert das sonographische Bild mit kugeliger bis zapfenförmiger inhomogener, kleinzystischer Raumforderung an das makroskopische Bild eines Polypen (Abb.24). 27 Liegt gleichzeitig eine Hydrometra vor, fällt die Beurteilung wesentlich einfacher (Abb.25). Sehr hilfreich kann die künstlich erzeugte Hydrometra im Rahmen einer Kontrastmittelsonographie (Hydrosongraphie, Abb.26) bei der sonographischen Unterscheidung zwischen hochaufgebautem Endometrium und Polyp sein 30, 32. Korpuspolypen können sehr lang werden, bis vor die Zervix reichen und im Spekulum fassbar werden. In Ihrer Breite überschreiten sie selten 1,5 cm. Bei unklarem Ursprung des Polypen, der sich im Zervikalkanal zeigt, soll von «Polyp im CK» gesprochen werden. Abb.24 Abb.25 Echodichter Korpuspolyp Hydrometra in senil atrophem Uterus mit Polyp (markiert) Abb.26 Hydrosonographie bei «hochaufgebautem» Endometrium: echodichter Polyp (markiert) Prinzipiell gelten Polypen in der Postmenopause als Indikation für eine histologische Abklärung, insbesondere weil oft Korpuskarzinome mit Polypen vergesellschaftet sind, ohne das die Polypen jedoch der Ursprung des Karzinomes wären. 2.3.3.3 Flüssigkeitsansammlung im Cavum uteri (Hydrometra) Diese können während der Menstruation regelmässig beobachtet werden. Bei Stenosen im Bereich der Zervix tritt eine Hydrometra regelmässig, inbesondere postmenopausal auf (Abb.25). Die Flüssigkeitsansammlung im Cavum uteri selbst ist kein Hinweiszeichen auf ein Malignom 33. Im Gegenteil, sie lässt die Schleimhautkonturen kontrastreich erscheinen und entsprechend besser beurteilen. Bei der Messung der Endometriumdicke (Bilayer) soll intrakavitäre Flüssigkeit abgezogen werden (Abb.4). 28 2.3.3.4 Verkalkungen im Bereiche des Cavum uteri Verkalkungen imponieren als echodichte Spots in Projektion auf das Cavum uteri. Sie kommen selten vor. Sie können als Hinweiszeichen auf eine stattgefundene Curettage verstanden werden, oder postpartal als Ausdruck kleiner degenerativ veränderter Plazetarreste gewertet werden 34. Sie sind selten mit einer schwerwiegenden Pathologie verbunden. Noch seltener kann sich hinter sonographisch ausgedehnten Spots ein histologisch nachweisbar verknöchertes Endometrium verbergen (Abb.27) 34. Abb.27 Abb.28 Histologisch verifiziert verknöchertes Endometrium als Sterilitätsursache (mit freundlicher Genehmigung des Karger-Verlag Basel, Gynäkologisch -geburtshilfliche Rundschau 33-1-93) 3 cm grosse echoleere, kugelige Struktur in Projektion auf die Zervix Ovulum Nabothi 2.3.3.5 Ovula Nabothi Oft findet man bei der prämenopausalen Patientin in Projektion auf die Zervix uteri kugelige, echoleere Strukturen, solitär («wie ausgestanzt»), häufiger multipel, von einer Grösse von bis zu mehreren Zentimetern (Abb.28), mit deutlicher Echoverstärkung hinter dem Befund. Sie liegen nur wenige Millimeter vom Sondenkopf entfernt, verursachen keine Beschwerden. Diese sonographischen Befunde sind pathognomonisch für Ovula Nabothi. Sie können oft kolposkopisch bestätigt werden 35. 2.3.3.6 Korpuskarzinom Es soll sonographisch auch beim Korpuskarzinom keine histologische Diagnose vorweggenommen werden, sondern nur der Verdacht anhand eines übermässig hoch aufgebauten Endometriums und unscharfer Abgrenzung zum Myometrium bei entsprechender Klinik (insbesondere Postmenopauseblutung) geäussert werden (siehe 2.2.3: «Zyklusdiagnostik am Endometrium»). Ist ein Korpuskarzinom histologisch nachgewiesen, kann ein «Sonostaging» bei entsprechender sonographischer Erfahrung vorgenommen werden. Von besonderer Bedeutung ist die Einschätzung der Infiltrationstiefe ins Myometrium (Abb.29). 29 Diese ist mit einer Trefferquote von ca. 80 % richtig voraussagbar, vergleichbar mit der intraoperativen markoskopischen Einschätzung am Präparat 36. Das Wissen um die Infiltrationstiefe kann Auswirkungen auf die Operationsplanung haben, denn bei einer tiefen Infiltration in Myometrium empfiehlt sich eine zumindest pelvine Lymphonodektomie 37. Weiter kann der Verdacht auf einen Zervixbefall (Abb.30), oder Infiltration in umliegende Organe geäussert werden (Blase, Rektum). Abb.29 Abb.30 Korpuskarzinom, exophytisch und infiltrativ wachsend (Pfeil). Myometrium > 50 % infiltriert Korpuskarzinom mit Befall der Zervix (Pfeil) Separat ist das Endometrium unter Tamoxifen zu behandeln (Abb.31). Seit Hinweise existieren, dass unter Tamoxifen gehäuft Korpuskarzinome auftreten, ist die regelmässige, mindestens jährliche, besser halbjährliche, sonographische Kontrolle fester Bestandteil der routinemässigen Nachkontrollen. Bei jeder blutenden Patientin unter Tamoxifen sollte eine histologische Abklärung erfolgen, ebenso bei einer asymptomatischen Patientin mit einer Endometriumdicke von > 8 mm. Regelmässig kommt es aber vor, dass sonographisch der V.a. auf ein hochaufgebautes Endometrium geäussert wird, z.T. mit zystischen Läsionen, hysteroskopisch jedoch ein atrophes Cavum uteri eingesehen wird. Die Diskrepanz dieser Befunde ist noch nicht restlos geklärt. Abb.31 30 Hochaufgebautes, klein-zystisch verändertes Endometrium unter Tamoxifen 2.3.3.7 Uterussarkom Sonographisch können lediglich Verdachtsmomente für das Vorliegen eines Uterussarkomes geäussert werden: kugelige Raumforderung mit inhomogenen echoreichen und echoarmen Arealen 38 und schnellem Wachstum. Die Diagnose wird stets histologisch gestellt. 2.3.3.8 Zervixkarzinom Prinzipiell ist die Sonographie in der Routine bisher nicht geeignet, die Diagnose Zervixkarzinom zu stellen oder wesentlich zum Staging des Zervixkarzinoms beizutragen 39. Auch die Beurteilung eines Befalles der Parametrien ist nicht sonographisch, sondern klinisch zu treffen (FIGO 1994). 2.3.4 Raumforderungen von den Adnexen ausgehend Zentral ist oft die Frage, ob die Raumforderung vom Ovar ausgeht oder nicht. Die UntersucherInnen sollen versuchen, bei jedem Tumor in der Adnexgegend das Ovar separat darzustellen. Gelingt dies, kann bereits das Spektrum der Differentialdiagnose entscheiden eingeschränkt und anders gewichtet werden. Gelingt es z.B. neben einem 5 cm grossen, solid-echoarmen, homogenen, kugeligen Prozess in einer Adnexe das unauffällige Ovar darzustellen, kann bei einer prämenopausalen Patientin oft das subseröse Myom differentialdiagnostisch favorisiert werden. Vor allem bei gleichzeitigem vorliegen einer Raumforderung und akuten Unterbauchschmerzen im kleinen Becken stellt sich die Frage nach einer Adnextorsion. Diese kann prämenopausale, wie postmenopausale Patientinnen betreffen. In einer Untersuchung von Koonings 40 bei postmenopausalen Patientinnen war der kleinste Tumor, welcher intraoperativ torquiert vorgefunden wurde 7 x 7 cm gross, der grösste 30 x 20 cm. Bei den 19 beschriebenen torquierten Tumoren war kein Malignom dabei. Als Faustregel darf gelten, dass Torsionen von Adnexturmoren erst ab etwa «Hühnereigrösse» (4 x 5 x 6 cm) auftreten. Im Folgenden sollen die häufigsten Raumforderungen der Adnexen systematisch in zunehmender Komplexität abgehandelt werden. 2.3.4.1 Einfache Ovarialzysten Als einfache oder simple Ovarialzysten werden vollständig echoleere und glattwandig ausgekleidete Zysten bezeichnet, die nachweislich von einem der Ovarien ausgehen (Abb.32). Sie stellen die häufigste gutartige Veränderung an den Ovarien dar. Zu dieser Gruppe von Zysten gehören die Follikel-, Corpus-Luteum-Zysten (Abb.33) und Retensionszysten. Prä- und perimenopausal sind sie prinzipiell zu kontrollieren, z.B. nach 6 Wochen. Sie sind im überwiegenden Teil der Fälle funktioneller Herkunft und zeigen eine grosse Tendenz zur Spontanremission, gleich ob eine medikamentöse Therapie eingeleitet oder mittels Punktion interveniert oder rein expektative vorgegangen wird. Dieses abwartende Verhalten kann wesentlich zur Senkung von unnötigerweise operierten simplen Zysten beitragen. Osmers 31 berichtet von nur rund 5 % operierten funktionellen Tumoren in einem Kollektiv von 1072 Ovarialtumoren 41. Prämenopausal werden in weniger als 1 % von sonographisch simplen Zysten Malignome gefunden 42,43. Postmenopausal wird zumindest in einer Studie von einer Malignitätsrate einfacher Zysten von fast 10 % berichtet 41, in anderen Studien jedoch deutlich seltener 44, 45. Die Daten sollten Anlass genug sein, auch beim postmenopausal aufgetretenen einfachen zystischen Adnexbefund den Ausschluss eines Malignoms zu erbringen. Auch hier empfiehlt sich zunächst die Bestimmung des CA 125, dann eine kurzfristige sonographische Kontrolle, z.B. nach 6 Wochen. Abb. 32 Abb. 33 5cm grosse simple Ovarialzyste. Man beachte die enorme Echoverstärkung hinter der Zyste Klein-zystisch verändertes Corpus luteum Die Patientinnen dürfen aus der Kontrolle entlassen werden, wenn klar belegt werden kann, dass der Befund sich in seiner einfachen Struktur deutlich zurückgebildet hat. Ist der Befund aber unverändert, respektive gewachsen, oder hat sich seine einfache Struktur geändert, so muss eine rasche, operative Abklärung insbesondere postmenopausal in Erwägung gezogen werden. Eine Leitlinie für die Behandlung von einfachen Ovarialzysten wurde z.B. im Auftrag der ÖGGG 1998 erstellt. Sie unterscheidet zwischen Prä- und Postmenopause und berücksichtigt Ergebnisse aus grösseren Studien, die einen Zusammenhang zwischen Befundgrösse und Malignitätsrate aufzeigen konnten: ● prämenopausal: 32 ● Zystendurchmesser < 5 cm ➯ Sonographiekontrolle postmenstruell, bei Persistenz ➯ endokrine Therapie während 3 Monaten ➯ Sonographische Kontrolle alle 4 Wochen, bei Persistenz nach 3 Therapiemonaten ➯ Operation mit histologischer Abklärung. ● Zystendurchmesser > 5 cm ➯ Sonographiekontrolle postmenstruell ➯ bei Persistenz oder Grössenzunahme ➯ Operation mit histologischer Abklärung. ● postmenopausal: ● Zystendurchmesser < 5 cm ➯ keine Aussage möglich; Kontrolle alle 4 Wochen, während 3 Monaten, bei Persistenz ➯ Operation mit histologischer Abklärung. ● Zystendurchmesser > 5 cm ➯ Operation mit histologischer Abklärung. Die ACOG schlägt in ihrem Bulletin Nummer 15 von April 1996 vor, asymptomatische Ovarialtumore in der Menopause zu operieren, wenn sie eines der folgenden Kriterien aufweisen: solider Tumor jeder Grösse, komplexe Tumore (Septen, Wandauflagerungen), nachweisbares Wachstum des Befundes, Nachweis von Aszites, Nachweis eines fixierten Tumors oder Knoten im Douglas, erhöhtes CA 125. 2.3.4.2 Einfache Zysten, nicht von den Ovarien ausgehend Kann nebst einer echoleeren, glatt- und dünnwandigen Zyste im kleinen Becken das Ovar der entsprechenden Seite einwandfrei identifiziert werden, dann ist differentialdiagnostisch insbesondere an folgende Zysten zu denken: Parovarialzysten (von embryonalen Strukturen des rete ovarii ausgehend), Peritonealzysten (insbesondere als Pseudoperitonealzyste nach Eingriffen im kleinen Becken, v.a. Hysterektomien) und der Hydrosalpinx (z.B. als Restzustand nach entzündlichen Adnexprozessen). 2.3.4.3 Seröse Zystadenome Die serösen Zystadenome präsentieren sich oft als echoleere, einkammerige, glattund dünnwandige Zysten (Abb.34), womit sie sonomorphologisch nicht von den funktionellen Befunden unterschieden werden können. Dies gilt für kleine Befunde genauso (Follikelpersistenz), wie für sehr grosse Raumforderungen (riesige Follikelzyste). Grössere Zystadenome weisen jedoch oft eine Reihe von Septen auf, die meist ausgesprochen dünn sind und keine Auflagerungen aufweisen. Abb.34 Abb.35 Seröses Zystadenom, echoleer Muzinöses Zystadenom, feines Binnenecho 33 2.3.4.4 Muzinöse Zystadenome Wenn sich die simplen Ovarialzysten und die serösen Ovarialadenokystome durch das Fehlen von Binnenechos charakterisieren lassen (Abb.35), dann ist eine ähnliche, jedoch echoarme zystische Raumforderung mit feinen, regelmässigen Binnenechos verdächtig auf ein muzinöses Zystadenom. Muzinöse Zystadenome können grotesk gross werden, septiert sein, und sonographisch je nach Schleimgehalt einen echoärmeren oder echoreicheren Inhalt aufweisen. Bei der Frage, ob Binnenechos überhaupt vorliegen, muss unbedingt der Harnblaseninhalt als Referenz herangezogen werden. Denn moderne, sensitive Ultraschallgeräte können dank verfeinerter Technik bei entsprechender Gain-Einstellung schon konzentrierte Körperflüssigkeiten als fein binnenechohaltige Strukturen darstellen. 2.3.4.5 Endometriosezysten, blutgefüllte Zysten Die Endometriose stellt eine komplexe Erkrankung dar. Die Diagnose dieser Erkrankung ist deshalb von Bedeutung, weil die Endometriose eine unterschätzt häufige Erkrankung ist: fertile Patientinnen sind in 2,5 – 5,9 % betroffen, jedoch infertile Patientinnen in 20 – 50 %, insgesamt 6 – 44 % 46. Immerhin 2 – 4 % der Patientinnen, welche wegen einer Endometriose operiert werden, sind postmenopausal, wobei es sich fast ausschliesslich um Patientinnen unter HRT handelt 46. Der Beitrag des Ultraschalls liegt v.a. in der Erfassung der zystischen und nodulären Endometriose-Läsionen, sowie der Adenomyose bei entsprechenden klinischen Symptomen (zyklusabhängige Schmerzen, Dysmenorrhoe, Blutungsstörungen, Sterilität, ...). Die Endometriose-Diagnostik und ein echtes Endometriose-Staging, wie es zum rAFS-Staging verlangt wird 47, hat endoskopisch, und nicht sonographisch zu erfolgen. Die Sonographie kann das Mittel der Wahl sein, wenn der Erfolg einer medikamentösen Endometriosetherapie gewertet werden soll. Das sonographische Erscheinungsbild der Endometriose kann sehr bunt sein. Es gehört differentialdiagnostisch in das breite Feld der Adnexbefunde mit Binnenecho (siehe 2.4 «häufigste Differentialdiagnosen ...»). Die Endometriosezyste kann sich sonographisch, je nach Zustand des Inhaltes, als vorwiegend solitärer zystischer Befund mit feinen regelmässigen Binnenechos präsentieren. Diese typische Beschreibung trifft aber nur auf weniger als die Hälfte der Fälle zu 48. Mehrheitlich sind die histologisch klassierten Endomtriosezysten sonographisch aufgefallen durch Multilokularität, partiell ganz ohne Binnenecho, teilweise mit eindeutig echodichten Anteilen (Abb.36), oder imponierten als vollständig solide Tumore. Oft kann sonographisch nicht zwischen einer Endometriosezyste und einer blutgefüllten Zyste (Abb.37), z.B. corpus luteum hämorrhagicum, unterschieden werden. 34 Abb. 36 Abb. 37 Endometriom des Ovars Typisches Bild einer eingebluteten Ovarialzyste. Hämatom in Resorption 2.3.4.6 Dermoidzysten Das Dermoid (reifes Teratom) stellt schlechthin das Kamäleon in der sonographischen Differentialdiagnose des Adnexbefundes dar. Erstaunlicherweise machen die Dermoide ca. 20 % aller Ovarialzysten und ca. 10 % aller Ovarialtumoren aus 49. Dermoide können praktisch jedes Bild von simpel zystisch (Abb.39) über komplex bis vollständig solid präsentieren (Abb.38) 50, 51. Damit kann erklärt werden, warum die meisten Scores zur Dignitätseinschätzung von Adnextumoren die Dermoide zu häufig fälschlicherweise den Malignomen auf der einen Seite, oder den funktionellen Zysten auf der anderen Seite, statt den benignen Tumoren zuweisen. Dermoidzysten kommen zudem gehäuft bilateral vor. Bis zu 10 % der Patientinnen sind davon betroffen. Als Komplikation tritt v.a. die Stieldrehung bei 3 – 16 % der Dermoide auf 52, Rupturen sind äusserst selten. Der typische sonographische Befund tritt in etwas mehr als einem Drittel der Fälle auf 53 : Innerhalb einer zystischen Raumforderung mit dicker Wand befindet sich ein sehr echodichtes, bizarr begrenztes Areal, bestehend aus Talg, Epidermis, Haaren, Knorpel, Knochen, usw. Daneben lassen sich meist auch echoärmere, «flüssige» Areale nachweisen. Gelegentlich lässt sich ein echodichtes Sediment mit Spiegel oder Sichel abgrenzen, wobei das «Sediment» durchaus auch kopfwärts zu liegen kommen kann 54. Kleine solide, aber auch grosse Dermoide werden gelegentlich bei der Sonographie übersehen, insbesondere dann, wenn sie sich nicht von den umgebenden, trägen Darmschlingen abheben. Abb. 38 Abb. 39 «Typisches» echokomplexes Dermoid des Ovars Zystisches Dermoid des Ovars 35 2.3.4.7 Malignome des Ovars Das mit Abstand am häufigsten vorliegende Malignom des Ovars ist das Ovarialkarzinom. Eine ganze Reihe von Studien hat sich in den letzten zwei Jahrzehnten mit dem Ausschluss, resp. der Diagnose der Ovarialmalignome befasst (siehe 2.3.4.8: Dignitätseinschätzung von Adnextumoren). Die epidemiologischen Daten sind erdrückend, denn das Ovarialkarzinom wird zu oft erst in einem fortgeschrittenen Stadium diagnostiziert. Rund 70 % der Ovarialkarzinome treten bilateral auf, gutartige Zystadenome nur in rund 5 % 55. Das sonomorphologische Bild ist äusserst bunt 56, umfasst rein zystische Befunde (13 %) (Abb.41), gemischte (68 %) (Abb.40), bis hin zu rein soliden (19 %) Raumforderungen. Der Verdacht auf ein Ovarialmalignom ergibt sich typischerweise dann, wenn der Tumor aus zystischen und teils unregelmässig soliden Anteilen besteht, die Septen auffällig breit sind (> 3 mm), papilläre Wucherungen aufweisen, oder wenn ein vorwiegend solider Tumor unregelmässig begrenzt erscheint. Wichtig sind die weiteren Elemente, wie Vorliegen von grösseren Mengen Aszites oder der Nachweis von Lebermetastasen. Die Ausdehnung kann von wenigen Millimetern bis hin zu riesigen Dimensionen reichen, sodass der Tumor nicht einmal mehr von einem Oberbauchtumor abgegrenzt werden kann. Um einen Tumor möglichst genau zu beschreiben, empfehlen wir die Vermessung in 3 Ebenen, mit jeweils Angabe des grössten Masses, ob der Tumor vollständig eingesehen und abgegrenzt werden kann, ob er klar einem Organ zugeordnet werden kann und ob er bilateral vorliegt. Im weiteren empfehlen wir den Tumor anhand der Kriterien von Merz (Mainzer-Score 43, 45, Tab. 4) zu beschreiben. Die Untersucher sollten bei Malignomverdacht diesen unbedingt dokumentieren. Bei einer allfälligen Frage nach Konsequenzen nicht zögern, die Exploration des Tumors per laparotomiam zu empfehlen. Abb. 40 Abb. 41 Solid-zystisches Ovarialkarzinom Vorwiegend zystisches Ovarialkarzinom 36 2.3.4.8 Dignitätseinschätzung von Adnextumoren Prinzipiell sollen die Bemühungen darauf hin augerichtet werden, dass ein Malignom im Bereiche der Adnexen nicht übersehen wird, andererseits sollen Patientinnen nicht unnötig verängstigt, oder sogar unnötigerweise operiert werden. Zur Tumoreinschätzung empfiehlt sich nach wie vor folgende Dreiteilung vorzunehmen, wie von Bernaschek 1992 vorgeschlagen 57 : ● am ehesten simple Zyste ● am ehesten benigner Tumor ● am ehesten maligner Tumor. Diese Einteilung leitet zu folgendem, anzustrebendem Prozedere über: ● Befund kann beobachtet werden (zusätzlich CA 125 bestimmen) oder ev. transvaginalsonographisch geleitet punktiert werden ● Befund soll operiert werden, kann per Laparoskopie angegangen ● Befund soll direkt per Laparotomie saniert werden. Als grober Leitsatz hat sich folgende Vorgehensweise in der Praxis bewährt. Es soll in erster Linie geprüft werden, ob: ● die simple Adnexzyste kontrolliert (oder punktiert) werden kann ● der benigne erscheinende Befund laparoskopisch angegangen werden kann/muss ● der malignomverdächitge Tumor per laparotomiam angegangen werden muss. Geübte UntersucherInnen sollten Ihre Untersuchung auf die Abgabe einer dieser Empfehlungen hin gestalten. Es soll noch einmal darauf hingewiesen werden, dass die Versuchung, die histologische Typus-Diagnose sonographisch vorwegzunehmen, reizvoll sein kann, jedoch nur von untergeordneter klinischer Bedeutung ist, den Untersucher und die Methode in Verruf bringen kann. Zur Dignitätseinschätzung wurden verschiedene Scores entwickelt. Prinzipiell stützen diese sich auf die B-Bild-Morphologie, oder die Farb-Doppler-Sonographie, oder klinische Angaben (inkl. CA 125), oder auf definierte Kombinationen aus den drei genannten Bereichen. Zu beachten ist dabei, dass auch nur schon die Erhebung der Befunde erheblich von der Erfahrung des Untersuchers abhängt. Die Sektion Gynäkologie und Geburtshilfe der SGUM empfiehlt beim Arbeiten mit einem Score den Mainzer-Score zu verwenden (Tab.4) 43, 45. Er wurde an der grössten, bisher publizierten Fallzahl erarbeitet und erreicht beachtenswerte prädiktive Werte. Die Farb-Doppler-Untersuchung kann offensichtlich die Trefferquote der B-Bild-Diagnostik etwas verbessern, diese aber nicht ersetzen 58. Die guten Ergebnisse der Sonographie zur Dignitätseinschätzung treffen leider nicht für das Screening des Ovarialkarzinoms zu. Hier gibt es aktuell keine zuverlässige Methode, die das frühe Ovarialkarzinom alleine, oder in Verbindung mit anderen Methoden mit einer einigermassen akzeptablen positiven Prädiktion (angestrebt wären nur 10 % !) voraussagen könnte. Das Problem aller anwendbaren Screening-Methoden liegt in der verhältnismässig niedrigen Prävalenz der Ovarialmalignome (ca. 4/1000). 37 Mainzer-Score: Sonomorpholog. Beurteilung von Adnextumoren mittels TVS Kriterien (nach Merz) 0 Pkt 1 2 1. Gesamtstruktur des Tumors – einfach komplex deutlich irregulär 2. Begrenzung des Tumors glatt leicht irregulär 3. Wanddicke < 3 mm ≥ 3 mm, ≤ 5 mm > 5 mm od. n. beur. 4. Binnenechos im zystischen Anteil keine homogen inhomogen 5. Septen keine ≤ 3 mm > 3 mm 6. Form des komplexen oder rein soliden Anteils keine soliden Anteil glatt höckerig 7. Echogenität des komplexen oder rein soliden Anteils kein solider Anteil homogen inhomogen 8. Schallschatten Echoverstärkung teilweise vollständig 9. Aszites keiner wenig mässig nicht nachweisbar nicht schlüssig beurteilbar darstellbar 10. Lebermetastasen/Peritonealkazinose prämenopausal bis 8 Pkt: benigne, ≥ 9 Pkt: maligne, Sens 96%, Spez 81%, ppV 47%, npV 99,6% (Merz et al. 1998) postmenopausal bis 9Pkt: benigne, ≥ 10 Pkt: maligne, Sens 97%, Spez 91%, ppV 91%, npV 97% (Weber et al. 1999) Tab.4 Mainzer Score zur sonomorphologischen Beurteilung von Adnextumoren, max. 20 Pkt 2.3.5 Extrauteringravidität (EUG) Die Sonomorphologie der Extrauteringravidität, meist eine Tubargravidität (96 %), seltener eine intramurale, zervikale, ovariale oder peritoneale, ist geprägt von einer Vielfalt von Befunden, die zudem nur inkonstant auftreten. Prinzipiell muss immer bei positivem Schwangerschaftstest (Urin-hCG) ohne Nachweis der Schwangerschaft in der Gebärmutterhöhle eine EUG angenommen werden. Eine intakte, zeitgerecht entwickelte intrauterine Frucht 59 zeichnet sich aus durch... Fruchtblase ab 1,6 mm nachweisbar, spätestens bei 4 + 4 Wochen Amenorrhoe ● Dottersack nachweisbar, spätestens bei 5 + 0 Wochen Amenorrhoe ● Herzaktion nachweisbar, spätestens bei 5 + 5 Wochen Amenorrhoe. ● Das einzige direkte Zeichen einer vitalen EUG ist der direkte sonographische Nachweis des embryonalen Herzschlags ausserhalb des Cavum uteri. Er ist eine ausgesprochene Seltenheit. Viel häufiger imponiert die EUG durch ihre indirekten Zeichen. Diese sind ... ● hochaufgebautes Endometrium ohne Fruchtblase («leeres» Cavum uteri) ● der Nachweis variabler Mengen von echogener, freier Flüssigkeit (Blut im Bauch) ● ein inhomogener, v.a. zentral echoarmer Tumor, mehr oder weniger stark berührungsempfindlich, gelegentlich mit echodichteren Anteilen (DD: Adnextumor), oder aber auch als Zyste imponierend (DD: zystisches Corpus luteum) (Abb.42). 38 Abb.42 ➞ 1 ➞ 2 a) Inhomogene, zentral echoleere Eileiterschwangerschaft rechts, Corpus luteum (links), hCG i.S. 1848 IU/L b) vitale Eileiterschwangerschaft (Pfeil 1) mit Dottersack (Pfeil 2), umgeben von Hämatom (Cave: DD IUG), hCG i.S. 1460 IU/L Heute leistet die Sonographie einen wesentlichen Beitrag in der Diagnose einer EUG und bei der Wahl der Therapie. Die Entscheidung über das Prozedere soll aber nur im Kontext mit der Klinik und dem hCG-Wert im Serum der Patientin gefällt werden. In der Regel können bei einem hCG-Wert im Serum von über 1’500 IU/L (1.INR) Zeichen der EUG sonographisch dargestellt werden. Ist dies nicht der Fall, wird die EUG mit grosser Wahrscheinlichkeit bei einem operativen Eingriff vorgefunden. Ein hCG-Anstieg im Serum von weniger als 66 % in 48 Std. bedeutet in der Regel eine sich nicht normal entwickelnde Schwangerschaft (meist Abort, EUG). Zu bemerken ist, dass eine EUG bei jedem hCG-Wert rupturieren kann. Echogene freie Flüssigkeit im Bauch der Patientin bei V.a. EUG sollte immer als Zeichen einer intraabdominalen Blutung angesehen werden. Findet sich reichlich Flüssigkeit im Douglas und in der excavatio vesicouterina ist von einer intraabdominalen Blutmenge von über 500 ml auszugehen. Prinzipiell besteht dann eine Notfallsituation, die operativ behoben werden muss. 2.3.6 Extragenitale Tumoren im kleinen Becken Die Kenntnis von diesen Tumoren ist von differentialdiagnostischer Bedeutung bei nicht klar den Adnexen zuordbaren Raumforderungen. Die Listen im Folgenden werden nicht weiter kommentiert, da die benötigten diagnostischen Mittel jeweils weit über die Sonographie hinaus gehen können. Vorwiegend extragenitale zystische Raumforderungen im kleinen Becken sind: Zystennieren ● Peritonealzysten ● dilatierter Ureteren ● flüssigkeitsgefüllte Darmschlingen ● M. Crohn ● Ileus ● retroperitoneale Tumore ● Mukozelen der Appendix ● 39 Vorwiegend extragenitale solide Raumforderungen im kleinen Becken sind: ● gefüllte Darmschlingen als Pseudotumor, Fäkolit ● Beckennieren ● transplantierte Nieren ● Blasen-/Darmedometrioseherde ● perityphlitischer Abszesse ● Rektumkarzinome ● Blasenkarzinom ● Metastasen im kleinen Becken ● retroperitoneale Tumore (Neurinom, Schwannom, Lymphom) ● Milzen bei Splenomegalie (hämatologische Erkrankungen, Infekte) 2.3.7 Ausschluss von Anomalien und Stauungen des Harntraktes Bei einer Dilatation des zentralen Nierenhohlraumsystems von mehr als 15 mm kann ein gestautes Nierenbecken vorliegen. Einteilung nach Swobodnik 60: ● ● ● Grad I : zentrale Erweiterung des Nierenbeckens über 15 mm Durchmesser Grad II : Grad I und Erweiterung der Kelchhälse Grad III : Grad II und Rest-Nierenparenchym-Dicke unter 10 mm (Abb. 43b). Bei den erworbenen Abflussstörung der Frau liegt meist eine supravesikale Harnabflusstörung vor (Konkrement, Striktur, Tumor). Die Ursachen können aber durchaus auch zu einer beidseitigen Stauung führen. Die vesikale und subvesikale Harnabflusstörung werden wesentlich seltener beobachtet. Abb.43 a) Nicht gestaute Niere rechts b) massiv gestaute Niere rechts (Grad III) Prinzipiell sollte vor jedem grösseren Eingriff an den inneren Genitalorganen eine Beurteilung der Nieren und der harnableitenden Wege sonographisch vorgenommen werden, um präexistierende Pathologien richtig einordnen zu können, z.B. ein exophytisch wachsendes Blasenkarzinom (Abb.44) oder ein prävesikales Konkrement (Abb.45). 40 Abb.44 Abb.45 Blasenkarzinom, exophytisch wachsend Hämaturie bei prävesikalem Konkrement (echodicht, kugelig, dorsale Schallauslöschung) 2.4 Häufigste Differentialdiagnosen ... 2.4.1 Allgemeines Die im Folgenden angeführten Differentialdiagnosen basieren auf Symptomen oder Befunden. Sie umfassen auch Diagnosen, die der Sonographie nur wenig, oder gar nicht zugänglich sind. Die Sonomorphologie der in Frage kommenden Diagnosen werden hier nicht weiter angeführt, sie wurde in den einzelnen Kapiteln detailliert beschrieben. 2.4.2 ... der genitalen Blutung prämenopausal ● ● ● ● ● physiologische Regelblutung pathologische Prozesse (Traumata, Entzündungen, Tumoren, Atrophie) ausgehend von: Vagina, Zervix, Endometrium, Uterus, Ovar, Blase, Darm Gerinnungsstörungen medikamentöse Wirkungen, v.a. auf das Endometrium (hormonaktive Präparate, Tamoxifen, Antikoagulantien, ...) schwangerschaftsbedingt. Die TVS vermag vor allem im Bereiche der pathologischen Veränderungen der Zervix, des Endometriums, des Myometriums, der Harnblase und bei schwangerschaftsinduzierten Blutungen weiter zu helfen. 2.4.3 ... der genitalen Blutung postmenopausal Mit Ausnahme der induzierten regelrechten Abbruchblutung bei Hormonsubstitution sind die postmenopausalen Blutungen immer pathologisch. Sie können hervorgerufen werden durch: ● pathologische Prozesse (Traumata, Entzündungen, Tumoren, Atrophie) ausgehend von Vagina, Zervix, Endometrium, Uterus, Ovar, Blase, Darm ● Gerinnungsstörungen 41 ● medikamentöse Wirkungen, v.a. auf das Endometrium (hormonaktive Präparate, Tamoxifen, Antikoagulantien, ...) Bei der sonographischen Abklärung mittels Ultraschall sollte inbesondere an Malignome des Endometriums und der Zervix gedacht werden. Ovarialprozesse führen postmenopausal nur sehr selten zu einer genitalen Blutung. In einem solchen Fall ist vor allem nach hormonaktiven, soliden Adnextumoren zu fahnden. 2.4.4 ... bei akuten Unterbauchschmerzen ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● ● Adnexitis Parametritis Tuboovarialabszess Douglasabszess stielgedrehte Ovarialtumore eingeblutete Ovarialzysten Endometriose rupturierte Ovarialzysten Myome in statu nascendi Hämatometra IUD-Expulsion EUG Abortus incipiens Appendizitis Divertikulitis Gastroenteritis Urolithiasis Zystitis M. Crohn Ileus akute Porphyrie Beckenvenenthrombose 2.4.5 ... der uterinen Raumforderung ● ● ● ● ● Myome (submukös, intramural, subserös) Polypen Fremdkörper (IUD, Schwangerschaftsreste, ...) Uterussarkome Zervixkarzinome 2.4.6 ... des hochaufgebauten Endometriums ● ● ● Polypen der Korpusschleimhaut submuköse Myome Hoch aufgebautes Endometrium unter Hormonsubstitution 42 ● ● ● ● ● Hyperplasien des Endometriums Korpuskarzinom Tamoxifen-induzierte Veränderungen intrauterines Hämatom (Hämatometra) durch die Zervix begründete Veränderungen 2.4.7 ... des einfach zystischen Adnexbefundes ohne Binnenecho ● ● ● ● ● ● ● ● ● Follikelzysten Corpus-Luteum-Zysten Retensionszysten Hydrosalpingen Peritonealzysten Parovarialzysten Seröse Zystadenome Überlaufblase (Malignome) 2.4.8 ... des zystischen Adnexbefundes mit Binnenechos ● ● ● ● ● ● ● ● ● ● ● ● ● ● Corpus-Luteum-Zysten Endometriosezysten Tuboovarialabszesse Stielgedrehtes Ovar mit Einblutungen Dermoide Pyosalpingen Seröses Zystadenom Muzinöses Zystadenome Ovarialkarzinome degenerativ verändertes Myome EUG gefüllte Darmschlingen Ileus Postoperative Hämatome 2.4.9 ... des soliden Adnexbefundes ● ● ● ● ● ● ● ● ● Ovarialkarzinome (v.a. seröse) Keimzell-Tumoren (v.a. reifes zystisches Teratom = Dermoid) Keimstrangstroma-Tumoren (V.a. Granulosazelltumore, Thekome, Androblastome) seltenere Ovarialtumore gestielte subseröse Myome intraligamentäre Myome Endometriosezysten gefüllte Darmschlingen Beckennieren 43 ● ● ● ● ● ● ● Ovarialmetastasen (v.a. bei Mammakarzinom) hyperplastische Lymphknoten Tubenkarzinome Darmtumore Blasenkarzinome Retroperitoneale Tumore Tumorrezidive 2.5 Indikationen, Empfehlungen und Konsequenzen 2.5.1 Indikationen zur sonographischen Beurteilung des kleinen Beckens ● ● ● ● ● ● ● ● ● ● ● Abklärung von Resistenzen im kleinen Becken Abklärung von Unterbauchschmerzen Abklärung bei genitalen Blutungen Abklärung bei genitalen Entzündungen Abklärung von Genitalanomalien Verlaufskontrollen von Befunden im kleinen Becken, mit oder ohne spezifische Therapie Lagekontrolle von IUD Überwachung des Follikelwachstums und des Endometriums bei Sterilitätsdiagnostik und Behandlung Bestimmung der Restharnmenge Abklärung von Aszites, Lebermetastasen, Harnwegsobstruktion postoperative Diagnostik (Hämatome, Abszesse, Heilungsprozesse) 2.5.2 Empfehlungen und Konsequenzen Empfehlungen und Konsequenzen sollen nur mit entsprechender Vorsicht aus den sonographischen Befunden abgeleitet werden. Prinzipiell sollen diese nur im Zusammenhang mit den klinischen Befunden, anamnestischen Daten, der Zyklussituation, resp. dem Menopausestatus, Laborbefunden oder weiteren bildgebenden Verfahren ausgesprochen werden, z.B. je nach Dignitätseinschätzung eines Adnexbefundes oder je nach Mass der Gefährdung der Patientin, z.B. durch eine vermutete EUG. Es stehen die sonographische Verlaufskontrolle, nebst anderen Beobachtungsparametern, die sonographisch geführte Intervention, die operative Intervention endoskopisch oder durch einen offenen Zugang zur Auswahl. Empfehlungen zum Verhalten bei «Endometriumsbefunden», «simplen Ovarialzysten», Verdacht auf «benigne oder maligne Adnexprozesse» und der «Verdacht auf EUG» werden in den entsprechenden Kapiteln abgegeben. 44 2.6 Literatur 1 Merz E: Transvaginale oder transabdominale Ultraschalldiagnostik ? Ein Vergleich zweier Methoden in Gynäkologie und Geburtshilfe. Ultraschall Klin Prax 2;1987:87-94. 2 Degenhardt F: Atlas der vaginalen Ultraschalldiagnostik. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1988. 3 Bernaschek G, Deutinger J, Kratochwil A: Endosonography in obstetrics and gynecology. Springer, Berlin 1990. 4 Sautter T: Transvaginale Sonographie. Lehrbuch und Lehratlas. Enke, Stuttgart 1990. 5 Merz E: Vaginosonographie. Enke, Stuttgart 1992. 6 Van Nagell J, Higgins R V, Donaldson E S, Gallion H H, Powel D E, Pavlik E J, Woods C H, Thompson E A: Transvaginal sonography as a screening method for ovarian cancer. Cancer 65;1990:573- 577. 7 Fleischer A C, McKee M S, Gordon A N, Page D L, Kepple D M, Worrel J A, Jones III H W, Burnett L S, James Jr A E: Transvaginal sonography of postmenopausal ovaries with pathologic correlation. J Ultrasound Med 9;1990:639-644. 8 Bernaschek G, Deutinger J: Endosonography in obstetrics and gynecology: the importance of standardized image display. Obstet Gynecol 74;1989:817-820. 9 Hall D A, McArdle C R: Display of transvaginal and transrectal songraphic images. AJR 151;1988:93. 10 Merz E: Standardisierung der Bilddarstellung bei der transvaginalen Sonographie. Gynäkol Geburtshilfe 1;1991:37-38. 11 Becker R, Entezami M, Vollert W, Hese S, Loy V, Weitzel H K: Gynäkologische Sonographie I – Vorschläge zur standardisierten Befunderhebung, -beschreibung and -darstellung. Ultraschall Klin Prax 8;1994:235-240. 12 Piirionen O. Studies in diagnostic ultrasound. Size of the nonpregnant uterus in women of child-bearing age and uterine growth and foetal development in the first half of pregnancy. Acta Obstet Gynecol Scand (Suppl) 46;1975:49. 13 Piirionen O, Kaihola HL: Uterine size measured by ultrasound during the menstrual cycle. Acta Obstet Gynec Scand 54;1975:247-250. 14 Zalud I, Conway C, Schulman H, Trinca D: Endometrial and myometrial thickness and uterine blood flow in postmenopausal women, the influence of hormonal replacement therapy and age. J Ultrasound Med 12;1993:737-741. 15 Becker R, Entezami M, Hese S, Vollert W, Loy V, Weitzel H K: Gynäkologische Sonographie II – Normalwerte der standardisierten Uterusbiometrie. Ultraschall Klin Prax 8;1994:241-247. 45 16 Merz E, Miric-Tesanic D, Weber G, Bahlmann F: Sonographic size of the uterus and ovaries on pre- and postmenopausal women. Ultrasound Gynecol Obstet 7;1996:1-5. 17 Köchli OR, Schär G, Bajka M, Pok J, Nussbaumer R, Keller P J, Haller U: Analyse der Indikation und Resultate der fraktionierten Kürettage an einem grossen gynäkologischen Krankengut. Schweiz med Wochenschr 126;1996:69-76. 18 Bronz L, Dreher E, Almendral A, Studer A, Haller U: Leitlinie zur Abklärung von postmenopausalen Blutungen (PMPB). SGGG 1999. 19 Bernaschek G, Endler M, Beck A. Zur Lagekontrolle von Intrauterinpessaren. Geb Fra 41;1981:566-569. 20 Cochrane W J. Ultrasonography and the intrauterin device. In Steel W B, Cochrane W J (eds) Gynecological ultrasound. Livingston, New York, 166-167. 21 Merz E: Beurteilung des Uterus. In Merz E (Hrsg) Vaginosonographie. Bücherei des Frauenarztes, Bd 41. Enke, Stuttgart, S25-35. 22 Granberg S, Bundsen P, Bourne T H, Almén M, Grenthe M, Leandersson R, Tönnberg C: The use of transvaginal ultrasonography compared to routine gynecological examination to check the location of an intrauterine contraceptive device. Ultrasound Obstet Gynecol 4;1994: 316-319. 23 Hogg B: Richtlinien der Familienplanungssprechstunde, Poliklinik für Endokrinologie, Universitätsspital Zürich, 1997. 24 Goswamy K, Campell S, Royston J P, Bhan V, Battersby H, Hall V J, Whitehead M I, Collins W P: Ovarian size in postmenopausal women. BJOG 95;1988:795-801. 25 Rodriguez M H, Platt L D, Medearis A L, Lacarra M, Lobo R A: The use of sonography for evaluation of postmenopausal ovarian size and morphology. Am J Obstet Gynecol 159;1987:810- 814. 26 Becker R, Entezami M, Hese S, Vollert W, Hese S, Weitzel H K: Gynäkologische Sonographie III – Normalwerte der standardisierten Ovarialbiometrie. Ultraschall Klin Prax 9;1994:32-42. 27 Sample W F, Lippe B M, Geyepes M T: Gray-scale ultrasonography of the normal female pelvis. Radiology 125;1977:477. 28 Van Naegell J, Higgins R V, Donaldson E S, Gallion H H, Powell D E, Pavlik E J, Woods C H, Thompson E A: Transvaginal sonography as a screening method for ovarian cancer. Cancer 65;1990:573-577. 29 Kaskarelis D B: Restaurative Chirurgie bei angeborenen Missbildungen des Uterus und bei Uterussynechien. Gynäkologe 13;1980:142-151. 46 30 Bronz L, Suter T, Rusca T: The value of transvaginal sonography with saline instillation in the diagnosis of uterine pathology on pre- and postmenopausal women with abnormal bleeding or suspect sonographic findings. Ultrasound Obstet Gynecol 9;1997:53-58. 31 Clark-Pearson D L: Benign disease of the uterus: Leiomyomas, adenomyosis, hyperplasia and polyps. In Clark-Pearson D L, Dawood M Y: Green’s Gynecologic Essentials of Clinical Practice. Little Brown, Boston 1990. 32 Laifer-Narin SL, Ragavendura N, Lu D S, Sayre J, Perrella R R, Grant E G: Transvaginal saline hydrosonography: characteristics distinguishing malignant and various benign conditions. AJR 172;1999:1513-1520. 33 Gull B, Karlsson B, Wikland M, Milsom I, Granberg S: Factors influencing the presence of asymptomatic postmenopausal women. Acta Obstet Gynec Scand 77;1998:751-757. 34 Fehr P, Diener P A, Benz D, Lorenz U: Ossifikation der Endometriums: Ein ungewöhnlicher Befund bei sekundärer Sterilität. Gynäkol Geburtsh Rundsch 33;1993:31-33. 35 Eppel W, Schurz B, Frigo P, Reinold E: Die vaginosongraphische Darstellung der Ovula Nabothi. Ultraschall in Med 12;1991:143-145. 36 Köchli O R, Bajka M, Schär G, Schmidt D, Haller U: Invasionstiefenmessung des Korpuskarzinoms. Präoperative Transvaginalsonographie und Korrelation zu intraoperativen und histopathologischen Befunden - eine prospektive Studie. Ultraschall in Med 16;1995:8-11. 37 Boronow R C, Morrow C P, Creaseman W T, DiSaia P J, Silverberg S G, Miller A, Blessing J A: Surgical Staging on endometrial cancer: clinical-pathological findings of a prospective study. Obstet Gynecol 83;1984:825-828. 38 Cacciatore B, Lehtovirta P, Wahlstrom T, Ylostalo P: Ultrasound findings on uterine mixed mullerian sarcomas and endometrial stromal sarcomas. Gynecol Oncol 35;1989:290-293. 39 Degenhardt F, Böhmer S, Schneider J: Vaginosonographische Kontrolle bei suspektem Abstrichbefund der Portio uteri. Ultraschall in Med 12;1991:139-142. 40 Kooning O, Grimes D A: Adnexal Torsion in Postmenopausal Women. Obstet Gynecol 73;1989:11-12. 41 Osmers R, Osmers M, von Maydell B, Wagner B, Kuhn W: Preoperative evaluation of ovarian tumors in the premenopause by transvaginosonography. Am J Obstet Gynecol 175;1996:428-434. 42 Osmers R: Transvaginale Adnexdiagnostik. Gynäkologe 28;1995:233-239. 43 Weber G, Merz E, Bahlmann F, Leber A M: A new sonomorphologic scoring system (Mainz Score) for the assessment of ovarian tumors using transvaginal ultrasonography – Part II. Ultraschall in Med 20;1999:2-8. 47 44 Prömpeler H J: Transvagnialsonographie und Farbdopplersonographie zur Differenzierung von Ovarial- und Adnextumoren. Habilitation, Freiburg, 1996. 45 Merz E, Weber G, Bahlmann F, Kieslich R: A new sonomorphologic scoring system (Mainz Score) for the assessment of ovarian tumors using transvaginal ultrasonography – Part I. Ultraschall in Med 19;1998:99-107. 46 Revised American Society for Reproductive Medicine classification of endometriosis 1996. Fertility and Sterility 67;1997:817-821. 47 Thomas E J: The clinician’s view of endometriosis Internat J Gynecol Obstet 64 Suppl.1;1999:S1-S3. 48 Suren A, Osmers R, Dietrich M, Kulenkampff D, Kuhn W: Sonomorphology of endometriotic cysts. Internat J Gynecol Obstet 62;1998:155-165. 49 Hansmann M, Hackelöer B J, Staudach A: Ultraschalldiagnostik in der Geburtshilfe und Gynäkologie. Lehrbuch und Atlas. Springer-Verlag, Berlin 1985. 50 Cohen L, Sabbagha R: Echo patterns of benign cystic teratomas by transvaginal ultrasound. Ultrasound Obstet Gynecol 3;1993:120-123. 51 Patel M D, Feldstein V A Lipson S D, Chen D C, Filly R A: Cystic teratomas of the ovary: diagnostic value of sonography. AJR 171;1998:1061-1065. 52 Lawson T L, Albarelli J N: Diagnosis of gynecologic pelvic masses by gray-scale ultrasonography: Analysis of specifity. Amer J Roentgenol 128;1977:1003-1006. 53 Laing FC, Van Dalsem V F, Marks W M, Barton J L, Martinez D A: Dermoid cyst of the ovary: Their ultrasonic appearances. Obstet and Gynecol 57;1981:99-104. 54 Hutton L, Rnakin R: The fat-fluid level: Another feature of dermoid tumors of the ovary. J Clin Ultrasound 7;1979:215-216. 55 Barber H R K: Ovarian cancer. Part I and II. Cancer 29;1979:341-351. 56 Requard C K, Mettler F A, Wicks J D: Preoperative sonography of malignant ovarian neoplasm. AJR 137;1982:79-82. 57 Bernaschek G, Obwegeser R: Sonographische Dignitätsbeurteilung von Ovarialtumoren und therapeutische Konsequenzen. Der Frauenarzt 34;1993: 853-854. 58 Prömpeler H J: Die Abklärung eines Adnexbefundes. Der Gynäkologe 32;1999:467-484. 59 Wisser J: Vaginalsonographie im ersten Schwangerschaftsdrittel. SpringerVerlag Berlin, Heidelberg 1995. 60 Swobodnik W: Diagnostik von Nieren und Oberbauch in Gynäkologie und Geburtshilfe. In Sohn C, Holzgreve W: Ultraschall in Gynäkologie und Geburtshilfe. Thieme Stuttgart 1995. 48 3. Urogynäkologische Sonographie G. Schär 3.1 ● ● ● Ziele der urogynäkologischen Sonographie Dynamische Darstellung der urethrovesikalen Anatomie Informationen über pathophysiologische Zustände im kleinen Becken Dokumentation 3.2 Möglicher Nutzen Die urogynäkologische Sonographie ergänzt die klinische Untersuchung durch feinstrukturelle Informationen über Urethra, Blase und Sphinkter ani. Die dynamisch-anatomische Beurteilung der Bilder verbessert das Verständnis der pathophysiologischen Vorgänge und der zugrundeliegenden Störung im Bereiche des Beckenbodens. Einen weiteren Nutzen findet die urogynäkologische Sonographie in der bildlichen Dokumentation der Befunde für die Krankengeschichte. Wie dies in der gesamten urogynäkologischen Diagnostik der Fall ist, kann der sonographische Einzelbefund für sich keine therapeutischen Schlussfolgerungen nach sich ziehen. Auch die urogynäkologische Sonographie muss in die Gesamtheit der Befunde der urogynäkologischen Diagnostik eingebunden sein. 3.3 Qualität der urogynäkologischen Sonographie Die Qualität der urogynäkologischen Sonographie hängt von folgenden Faktoren ab: ● vom Untersucher ● von der Anatomie ● von der Blasenfüllung ● von der Kooperation der Patientin ● vom Ultraschallgerät 1.Erfahrung des Untersuchers Die urogynäkologische Sonographie bedarf einer gewissen Einarbeitungszeit, um die Handhabung der Ultraschallsonde während der dynamischen Funktionsdiagnostik zu erlernen. Die Interpretation der Befunde gewinnt durch Erfahrung in urogynäkologischer Diagnostik an Qualität. Durch zu hohe Anpressdrucke der Ultraschallsonde auf dem Perineum kann der Untersucher Artefakte an der Lage der Urethra und des Blasenbodens bewirken 1. 2.Anatomie Urethra, Blase, Symphyse und die perianalen muskulären Strukturen können praktisch immer dargestellt werden. In gewissen Fällen sind die Strukturen bei grossen Zystozelen erschwert aufzufinden 2. 49 3.Blasenfüllung Die Blasenfüllung beeinflusst vor allem die Bildqualität. Bei zu geringer Blasenfüllung ist die Beurteilung des Blasenbodens nicht zuverlässig genug, wohingegen die Beurteilung der Urethra praktisch nicht beeinflusst wird. Bei zu grosser Blasenfüllung ist ev. nicht mehr die gesamte Blase sichtbar 1. 4.Kooperation der Patientin Da die urogynäkologische Sonographie vor allem eine funktionelle Sonographie ist, ist die Kooperation der Patientin beim Husten, Pressen und bei der Beckenbodenkontraktion notwendig. 5.Ultraschallgerät Im Fachgebiet Gynäkologie und Geburtshilfe verwendete Ultraschallgeräte können auch für die urogynäkologische Sonographie verwendet werden. Die Schallfrequenzen liegen für die Introitussonographie bei 5 – 7,5 mHz, für die Perinealsonographie bei 3,5 – 5 mHz. Bei der Perinealsonographie sind die gebogenen Linearsonden von Vorteil, da sie besseren Kontakt zum Introitus ermöglichen als gerade Sonden. Für die Bilddokumentation sollte die Software eine freie Bildrotation ermöglichen, damit die unten aufgeführte Bildorientierung eingestellt werden kann. Zur Auswertung des retrovesikalen Winkels ß ist die Winkelmessung erforderlich. Für schnelle Bewegungen wie z.B. Husten oder Pressen ist es von Vorteil, die Autokorrelation auszuschalten, um schlierenartige Phänomene zu vermeiden. Zur Untersuchung der urethrovesikalen Anatomie beim Husten ist die Verwendung des Cinéloop von Vorteil. 3.4 Ablauf der Untersuchung Die Durchführung der urogynäkologischen Sonographie richtet sich nach den Empfehlungen der Deutschen Arbeitsgemeinschaft für Urogynäkologie AUG 2 (Tab. 5). Tab. 5. Empfehlungen der Deutschen Arbeitsgemeinschaft für Urogynäkologie zur standardisierten sonographischen Untersuchung ● Messmethode: Die Symphyse bildet den Referenzpunkt. Der Meatus internus wird entweder in einem Koordinatensystem mit x und y oder mit Distanz und einem Winkel gemessen ● Blasenfüllung: 300 ml ● Untersuchungsposition: Liegend, evt. stehend ● Artefakte: Auflagedruck der Sonde gering halten ● Dynamische Tests: Valsalva, Husten, Kontraktion. Die urogynäkologische Sonographie sollte in die gesamte urogynäkologische Diagnostik eingebunden sein. Entweder findet sie im Rahmen einer Basisdiagnostik mit anamnestischer und klinischer Untersuchung statt, oder sie wird bei der urody- 50 namischen Untersuchung vorgenommen. Vor der Untersuchung wird der Patientin das Prinzip der Untersuchung erklärt. Die urogynäkologische Sonographie wird am besten an der auf dem gynäkologischen Untersuchungsstuhl liegenden Patientin durchgeführt. Nach Applikation von Ultraschallgel wird der Ultraschallscanner in sagitaler Richtung auf den Introitus aufgesetzt, sodass ein sagittales Schnittbild durch das kleine Becken in der Mittellinie entsteht. Der knorpelige Anteil der Symphyse (Discus interpubicus) stellt ein Ultraschallfenster dar, das die Abbildung retrosymphysärer Strukturen ermöglicht und die Referenzebene für die Mittellinie bildet (Abb.46). Zuerst wird ein Überblick gewonnen, um dann das Ruhebild sowie Funktionsbilder beim Pressen, Husten und bei der Beckenbodenkontraktion aufzunehmen. Im Anschluss an die Beurteilung des ventralen Kompartimentes wird die Ultraschallsonde nach dorsal gekippt und um 90° gedreht und es kann der Bereich des Rektums mit dem Sphinkter ani beurteilt werden. Die Ultraschallbilder werden von der Patientin meist gut verstanden. Im Sinne einer Biofeedback-Instruktion wird die Funktion des Beckenbodens gezeigt, womit die Beckenbodenkontraktion besser verstanden und die Übungen zuverlässiger durchgeführt werden. Abb. 46 Sagittale Bildebene im kleinen Becken: Links paramediane Schnittebene – kraniale Schattenbildung, bedingt durch die ossäre Symphyse. Rechts: Perinealsonographiebild durch das knorpelige Fenster. Die Strukturen kranial der Symphyse werden dargestellt 3.5 Dokumentation Folgende Strukturen und Organe können sonographisch dargestellt werden: Blase, Urethra, Symphyse, Vagina, Rektum und Uterus. Dabei bestehen aber methodenbedingte Unterschiede. Mit der Introitussonographie kann die Symphyse im Gegensatz zur Perinealsonographie meist nicht ganz überblickt werden. Eine Markierung der Urethra mittels eines transurethralen Katheters ist nicht notwendig. Entsprechend den Empfehlungen der AUG wird das Bild folgendermassen ausgerichtet: Kraniale Strukturen werden im Bild oben, kaudale Strukturen im Bild unten dargestellt. Ventral wird rechts und dorsal wird links abgebildet (Abb.47). 51 Abb. 47 Bildausrichtung der urogynäkologischen Sonographie gemäss Empfehlungen der AUG 3.6 Auswertung Die Auswertung der urogynäkologischen Ultraschallbilder richtet sich nach quantitativen und qualitativen Parametern. Diese sind wichtig für die prä- und posttherapeutischen Vergleiche und somit auch Faktoren der Qualitätskontrolle und von wissenschaftlichen Fragestellungen. Für die rein klinische Beurteilung der Bilder sind lediglich die qualitativen Parameter von Bedeutung. Dabei geht es um Beurteilung der Bewegungen des Blasenbodens und der Urethra während Pressen, Husten und Beckenbodenkontraktion sowie um die Beurteilung der Trichterbildung und der Knickung der Urethra während intraabdominaler Druckerhöhung. Schon Green hat 1975 typische qualitative Veränderungen der urethrovesikalen Einheit im Lateralen Urethrozystogramm beschrieben 3. Sie haben bis heute Bestand. Bei intraabdominaler Druckerhöhung kann gemäss Green die urethrovesikale Einheit rotatorisch, vertikal oder in Form einer Zystozele deszendieren (Abb.48). Trichterbildungen der proximalen Urethra treten vor allem beim rotatorischen und vertikalen Deszensus auf, während die Urethraknickung vor allem bei der Zystozele aber auch beim rotatorischen Deszensus gefunden werden können. Da dies rein deskriptive Beurteilungen der Bilder sind, fehlen klare Grenzwerte, ab welchen man z.B. von einem rotatorischen Deszensus oder von einer Zystozele sprechen kann. Bedeutung erhält der sonographische Befund deshalb erst zusammen mit der klinischen Symptomatik. Abb. 48 Typische Blasendeszensusformen nach Green Normalbefund 52 rotatorisch vertikal Zystozele Zur quantitativen Auswertung der Ultraschallbilder werden der retrovesikale Winkel ß und die Lage des Meatus urethrae internus bestimmt 2, 4 (Abb.49). Der Meatus urethrae internus wird in einem Koordinatensystem lokalisiert. Das Koordinatensystem basiert auf einer durch die Symphyse gezogenen zentralen Symphysenlinie (X-Achse) und einer Fallgeraden (Y-Achse) zur X-Achse bei der unteren Symphysenkante. Dx ist der Horizontalabstand des kranioventralen Urethraabganges aus der Blase, Dy der vertikale Abstand des kranioventralen Urethraabganges aus der Blase zur Y-Achse. Der retrovesikale Winkel ß wird so gemessen, indem der eine Winkelschenkel entlang dem Blasenboden und der andere entlang der dorsalen Urethraabgrenzung gezogen wird. Abb. 49 Messsystem zur Bestimmung der Lage des Meatus urethrae internus und des retrovesikalen Winkels ß Die Befunde der urogynäkologischen Sonographie können auf einem speziellen Befundformular festgehalten werden (siehe Anhang). 3.7 Beispiele mit Interpretation Die Bilder der Abb.50 stammen von einer kontinenten Frau mit normaler Beweglichkeit der Urethra und des Meatus internus. Die physiologische Mobilität der Urethra wird durch die leichte dorsokaudale Bewegung beim Pressen, aber auch durch die kranioventrale Elevation bei der Beckenbodenkontraktion verdeutlicht. Trotz kräftigem Pressen beträgt die Dorsalbewegung der Urethra nur wenige Millimeter. Dies spricht für intakte Suspensionsstrukturen, womit eine übermässige Dorsokaudalbewegung verhindert wird. Dieses Normalbild verdeutlicht 3 Dinge: ● Die urethrovesikale Einheit ist stabil im kleinen Becken verankert, da die endopelvine Faszie und der Aufhängeapparat von Ligg. sacrouterina und cardinalia intakt ist. ● Eine gewisse Mobilität der Urethra ist physiologisch und dient dem einwandfreien Ablauf der Miktion. Die urethrale Beweglichkeit kommt vor allem beim Pressen zur Geltung, da mit Pressen eine Beckenbodenrelaxation verbunden ist. ● Der Levator ani stabilisiert Blase und Urethra zusätzlich durch die intakte Muskelkontraktion und wirkt der Dorsokaudalbewegung der Urethra aktiv entgegen. 53 Abb. 50 Perinealsonographie bei einer gesunden, d.h. nicht inkontinenten Frau a) b) c) Normale Anatomie in Ruhe (a), geringe, physiologische Urethrabeweglichkeit beim Pressen (b), Urethrale Kranioventralbewegung bei der Beckenbodenkontraktion (c) BB = Blasenboden B = Blase R = Rektum S = Symphyse U = Urethra UT = Uterus V = Vagina Abb. 51 stammt von einer Patientin mit Stressharninkontinenz und paravaginalem Defekt. Urethra und Blase liegen im Ruhebild in einer annähernd normalen Position, zeigen aber während Pressen eine verstärkte Dorsokaudalbewegung (hypermobile Urethra). Der Meatus internus der Urethra befindet sich auf Höhe der Symphysenunterkante und der Blasenboden bildet eine kleine Zystozele. Bei der Beckenbodenkontraktion werden Urethra, Blasenboden und Scheide kräftig nach kranioventral angehoben. Das Pressbild mit der hypermobilen Urethra und dem Blasenbodendeszensus verdeutlicht die Situation eines paravaginalen Defektes, bei welchem die endopelvine Faszie nicht mehr an der Beckenwand verankert ist, womit der passive Aufhängemechanismus derart gestört ist, dass Urethra und Blasenboden eine erhöhte Beweglichkeit aufweisen. In einer solchen Situation vermag meist auch die Beckenbodenkontraktion nicht mehr eine Stabilisierung der urethrovesikalen Einheit zu gewährleisten, womit Blase und Urethra auch beim Husten nach kaudal und dorsal abweichen. Durch die fehlende passive (endopelvine Faszie, Bandapparat) und aktive (Levator ani) Gegenkraft bei abdominaler Druckerhöhung kann es zu einer Störung der Drucktransmission kommen, womit der intravesikale Druck den Urethradruck übersteigt und Harn abgeht. 54 Abb. 51 Perinealsonographie bei einer stressinkontinenten Frau mit paravaginalem Defekt a) b) c) In Ruhe (a) normale sonographische Anatomie. Beim Pressen (b) hypermobile Urethra und Blasenboden trotz intakter kranioventraler Elevation der Urethra bei der Beckenbodenkontraktion (c) Die Bilder der Abb.52 stammen von einer Frau mit vertikalem Deszensus. Während das Ruhebild, mit Ausnahme eines weit offenen retrovesikalen Winkels, keine Pathologie aufweist, zeigt sich beim Pressen eine trichterartige Erweiterung des Blasenhalses mit Tiefertreten desselben (wird auch als Vesikalisation der Urethra bezeichnet). In typischer Weise öffnet sich auch der Winkel ß noch weiter gegenüber dem Ruhebild. Der vertikale Deszensus mit Vesikalisation der Urethra hat wahrscheinlich zwei anatomische Grundlagen; einerseits ist der Support von Blasenboden und proximaler Urethra durch die endopelvine Faszie ungenügend, was zu einem Deszensus mit Eröffnung des Winkels ß führen muss, andererseits kann die urethrale Muskulatur die trichterförmige Eröffnung des Blasenhalses nicht verhindern. Abb. 52 Patientin mit vertikalem Deszensus der urethrovesikalen Einheit a) b) In Ruhe (a) weit offener retrovesikaler Winkel ß bei sonst normaler Anatomie. Beim Pressen (b) trichterartige Erweiterung des Blasenhalses (Pfeil) bei stabilem Blasenboden 55 Abb.53 verdeutlicht die Situation bei einer Frau mit einer reinen Zystozele. Im Ruhebild und im Liegen liegt die Blase in normaler Höhe, während die Urethra in beinahe vertikaler Position steht. Beim Pressen deszendiert die Blase weit nach kaudal und bildet eine grosse Zystozele, während die Urethra in der vertikalen Stellung bleibt. Bei solchen Zystozelenformen liegt meistens ein zentraler Defekt der endopelvinen Faszie vor, während die Urethra selbst entweder genügend fixiert, oder durch die Zystozele in ihrer Position gehalten wird. Der Wert der Sonographie liegt hier gegenüber der klinischen Untersuchung darin, dass Informationen über die Lage der Urethra gewonnen werden können, was bei einer grossen Zystozele in gewissen Situationen schwierig sein kann. Abb.53 Perinealsonographie bei einer Frau mit grosser Zystozele bei zentralem Defekt a) b) In Ruhe (a) vertikale Urethra und weit offenem Winkel ß. Beim Pressen (b) deszendiert der Blasenboden stark nach kaudal. Die Urethra bleibt vertikal stehen Abb.54 zeigt das Bild einer exoanalen Sonographie. Die Sonde ist nach dorsal gekippt und um 90° gedreht, sodass die analen Strukturen zur Darstellung kommen. Innen ist die Mukosa sichtbar, die hypoechogene Struktur entspricht dem M. sphincter ani internus, die zirkuläre echostärkere Struktur entspricht dem M. sphincter ani externus und die U- förmige echostarke Struktur dem Anteil des M. levator ani, welchen wir als M. pubovisceralis bezeichnen. Mittels der exoanalen Sonographie kann die Intaktheit der analen Strukturen beurteilt werden. Defekte des analen Sphinkterapparates sind meistens deutlich erfassbar. Abb. 54 Exoanale Sonographie zur Darstellung der perianalen Strukturen La M Se Si 56 = = = = M. levator ani Mukosa M. Sphincter ani externus M. Sphincter ani internus 3.8 Literatur 1 Schaer GN, Koechli OR, Haller U. Perineal ultrasound - determination of reliable examination procedures. Ultrasound Obst Gynecol 1996;7:347-52. 2 Schaer GN, Koelbl H, Voigt R, Merz E, Anthuber C, Niemeyer R, et al. Recommendations of the German Association of Urogynecology on functional sonography of the lower female urinary tract. Int Urogynecol J Pelvic Floor Dysfunct 1996;7:105-8. 3 Green TH. Urinary stress incontinence:differential diagnosis, pathophysiology and management. Am J Obstet Gynec 1975;122:368-400. 4 Schaer GN, Koechli OR, Schuessler B, Haller U. Perineal ultrasound for evaluating the bladder neck in urinary stress incontinence. Obstet Gynecol 1995;85:220-4 57 4. Mammasonographie G. Berclaz 4.1 Allgemeines Wir empfehlen als eines der aktuellsten Standardwerk der Mammasonographie den Lehratlas von Friedrich 1. 4.2 Indikationen für die Mammasonographie In der Mammadiagnostik stellt die Sonographie eine ergänzende Methode zur Mammographie dar (Ausnahme Patientinnen unter 30 Jahren). Durch ihre unterschiedliche Sensitivität und Spezifität bei verschiedenen Pathologien vermögen sich diese zwei Verfahren positiv zu ergänzen. Die Diagnose kann nach Befundabklärung mit einer Ultraschall-gesteuerten Feinnadelpunktion (FNP) bzw. Stanzbiopsie gestellt werden. Anerkannte Indikationen für die Mammasonographie sind: ● ● ● ● ● ● ● ● ● Unklarer Palpationsbefund Mammographiebefund schwer beurteilbare Mammographie (dichte Drüsenkörper) Karzinom (Multizentrizität) Brustwand, Haut, Axilla bei Mammakarzinom Karzinom Nachkontrolle Mastitis und Abszesse Mamillensekretion Screening von Risikopatientinnen, Frauen unter 30 Jahren, Schwangerschaft und Stillzeit. Weiter können Zysten und Abszesse durch eine sonographisch gesteuerte Punktion behandelt werden. 4.3 Untersuchungstechnik und Dokumentation Die Patientin sollte in Rückenlage oder Schräglage auf einem Kissen gelagert werden, die Arme hochgeschlagen, Gel auf der Haut verteilt werden. Der 5- bis 7,5(10)-MHzLinearschallkopf soll senkrecht zur Haut gehalten werden und der Fokusbereich optimal und einer geeigneten Bildgrösse gewählt werden. Wir empfehlen die radiäre Schallkopfführung (von der Peripherie bis zur Mamille). Es soll mit einer ständigen leichten Kompression des Gewebes gearbeitet werden. Die Befunde sollen schriftlich festgehalten werden, z.B. auf dem SGUMGG- Dokumentationsblatt (siehe Anhang). Es soll sich unbedingt eine Korrelation der Ultraschallbefunde mit klinischen und mammographischen Befunden anschliessen. 58 4.4 Normale Anatomie der Brustdrüse und Axilla Differenziert zu betrachtende Strukturen: Kutis, subkutanes Fettgewebe, Cooper’sche Ligamente, echoreiche Drüsenkörper und echoarme Fettanteile, Mamille, Milchgänge, retromammäres Fettgewebe, Pektoralismuskel mit Faszie, Rippen mit Interkostalmuskulatur, Pleura, Lungen, axilläre Gefässe, Lymphknoten. Zu beachten sind dabei die sich unterschiedlich präsentierenden Drüsenparenchyme: individuelle Variationen bei jeder Patientin, je nach Lokalisation in der Brust, je nach Alter oder hormonalem Status (Zyklus, Gravidität, Menopause, Hormonsubstitution). 4.5 Pathologie Prinzipiell werden alle Befunde in mehreren Ebenen untersucht und dokumentiert. Dabei sollen die folgenden Kriterien untersucht werden: ● Form ● Verformbarkeit ● Kontur ● Verschieblichkeit ● Randecho ● Austrittsecho («Schallschatten») ● Echomuster ● Laterale Randschatten ● Echogehalt ● Strukturstörungen In der Regel sind gutartige Läsionen dadurch gekennzeichnet, dass sie eine runde oder querovale Form aufweisen, eine glatte Kontur, ein scharfes Randecho, ein homogenes Echomuster, ein verstärktes Austrittsecho, laterale Randschatten und eine fehlende Strukturstörung. Zyste: queroval oder rund, glatter Kontur, schmaler Randsaum, echoleerer Inhalt, gute Komprimierbarkeit, dorsale homogene Schallverstärkung, Umgebungsarchitektur unverändert (Abb.55). Cave: Detritushaltige Zysten oft mit echoreichem Gehalt, Karzinome auch mit zystischem Inhalt ! Abb.55 Abb.56 Zyste (echoleer) Fibroadenom (feines Binnenecho) Fibroadenom: queroval oder rund, schmale und regelmässige Kontur, echoarmer homogener Inhalt, häufig gut komprimierbar und verschieblich, homogene leichte Schallverstärkung in ca. 25 %, laterale Randschatten, Umgebung unbeeinflusst (Abb.56). Cave: Es gibt auch Karzinome mit echoarmem homogenem Inhalt ! 59 In der Regel sind Karzinome gekennzeichnet durch eine unregelmässige und hochovale Form, unscharfe Kontur, echoreiche Randechos (hyperechogene Krone), inhomogenes echoarmes Echomuster, fehlende Komprimierbarkeit, schlechte Verschieblichkeit, abgeschwächtes Austrittsecho, fehlende laterale Randschatten und Strukturstörung (Abb.57). Cave: Runde, glatte, homogene Karzinome; medulläre und muzinöse Karzinome umschrieben wachsend; sklerosierende Adenose schwierig vom Karzinom zu unterscheiden. Abb.57 Mammakarzinom a) Beispiel 1 4.6 b) Beispiel 2 Empfehlungen und Konsequenzen In der Mammadiagnostik ist die Sonographie eine ergänzende Methode zur Mammographie (Ausnahme Patientinnen unter 30 Jahren). Wenn die Beurteilbarkeit der Mammographie eingeschränkt ist (beispielweise durch einen dichten Drüsenkörper), können bei unauffälliger Sonographie Pathologien weitgehend ausgeschlossen werden und somit unnötige Biopsien vermieden werden. Verdächtige Mammographiebefunde müssen aber trotz fehlenden sonographischen Malignitätskriterien weiter abgeklärt werden. Zysten werden mit einer annähernd 100-prozentigen Sicherheit diagnostiziert und können auch sofort behandelt werden (Zystenpunktion). In der Regel müssen alle sonographisch pathologischen Befunde mittels FNP resp. Stanzbiopsie weiter abgeklärt werden. Ausgenommen davon sind eindeutig diagnostizierbare Fibroadenome bei jungen Patientinnen. In dieser Situation genügen regelmässige Kontrollen. 4.7 Literatur 1 Michael Friedrich: Lehratlas der Mammasonographie, Edition Gynäkologie und Geburtsmedizin. Herausgegeben von Jörg Schneider und Hans Weitzel. WVG Wissenschaftliche Verlagsgesellschaft mbH Stuttgart 1999. 60 5. 5.1 Anhang Übersicht I Dokumentationsblatt gynäkologische Sonographie II Dokumentationsblatt urogynäkologische Sonographie III Dokumentationsblatt Mammasonographie 61 62 63 64 65 66 67 68