Kurstag 2: Allgemeine Histologie & Zellbiologie des Nervengewebes
Werbung

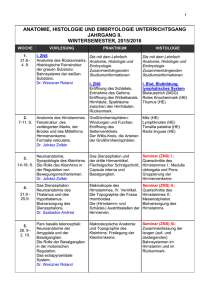
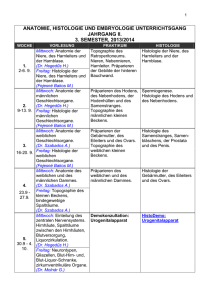
Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript Name: __________________________ Kurstag 2: Allgemeine Histologie & Zellbiologie des Nervengewebes Übersicht 02.01 histol. Färbungen des Nervengew. 02.02 Neuron 02.03 Synapse 02.04 Glia 1 3 5 7 02.05 02.06 02.07 peripherer Nerv Klinik mc-Übungsfragen 9 9 10 Ziele: Vertiefung der histologischen und zellbiologischen Grundlagen, ohne die ein Verständnis der Hirnfunktionen nicht möglich ist. Es ist ein ziemlich theoretischer, aber vom Stoff auch sehr wichtiger Kurstag. Sollten Sie nicht alle Aufgaben im Kurs schaffen, arbeiten Sie sie unbedingt zu Hause nach. Kursmaterial pro Tisch: Binokularlupen, Mikroskope, histologische Präparate Notwendige theoretische Voraussetzungen: Kenntnisse der Histologie des Nervengewebes sowie der allgemeinen Zellbiologie von Neuronen und Gliazellen (Vorlesungen Histologie, Neuroanatomie, Neurophysiologie). Schauen Sie sich im freien Mikroskopieren unbedingt noch einmal die Präparate Nerv quer/längs, Spinalganglion und Rückenmark an. Die spezielle Histologie einzelner ZNSAbschnitte werden wir zu einem späteren Kurstermin behandeln. 02.01 Histologische Färbungen des Nervengewebes (ca. 5-10 min) Es gibt 3 klassische Grundmethoden zur histologischen Darstellung des Nervengewebes, die Sie am Präparat unterscheiden können müssen. Moderne Methoden können im Kurs leider nur theoretisch behandelt werden. 02.01.01 Abbildung Erklären Sie anhand der Tabelle wesentliche Unterschiede zwischen den 3 Grundfärbungen. A: Myelin- oder Markschei- B: Zellkörper- / ZellkernfärC: Versilberungen (z.B. denfärbungen bungen (z.B. Nissl, Golgi, Cajal). Kresylviolett) Myelin, d.h. Nervenfasern +/- alle Perikarien einzelne Neurone Welche Strukturen sind gefärbt? Was ist sicht- Myelindicke einzelner Ner- Form, Größe, Dichte, bar? venfasern, Anteil der Fasern Verteilung der Perikarien, am Nervengewebe, Verlauf der Fasern/Faserbündel Was ist nicht zugehörige Perikarien, zugehörige Axone & Dend- einzelne Perikarien, mit +/allen Axonen, Dendriten, Dornen Dichte und Verteilung der RW 2005 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 1 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript sichtbar? Mögliche Anwendungen? Präparat nichtmyelinisierte Fasern, Dendriten, Gliazellen Untersuchung der Faserdicke und des Verlaufs, Diagnostik von Demyelinisierungserkrankungen, etc. Cerebellum, Übersichtsvergr. riten, Zellkörper von Gliazellen Untersuchung der Neurondichte und -verteilung, Diagnostik div. Erkrankungen (z.B. Alzheimer), etc. Cortex cerebelli, Purkinjezellen Neurone, viele Gliazellen Untersuchung der Gesamtmorphologie eines Neurons, Synapsen, Verschaltungen, etc. Cerebellum, einzelne Purkinjezelle 02.01.02 Auf den Fensterbänken stehen Lupen und Mikroskope mit ausgewählten Präparaten und deren Beschreibung bereit. Schauen Sie sich im Verlauf des Kurses diese Präparate an. Die erste Frage, die Sie sich jeweils stellen müssen, ist die nach dem Färbungstyp. Erst dann können Sie entscheiden was sichtbar ist und sich genauer mit dem Präparat befassen. 02.01.03 Die Färbungstypen werden oft auch auf makroskopische Präparate angewandt. Welche Strukturen sind dann gefärbt/erkennbar? 02.01.04 Diskutieren Sie kurz wie einige moderne histologische Verfahren (Abb.) funktionieren und was mit Ihnen darstellbar ist. A Immuncytochemie (ICC), Immunhistochemie (IHC) Nachweis/Lokalisation bestimmter Moleküle in Zellen/Geweben oder Typisierung von Zellen/Geweben mittels spezifischer Antikörper (typischerweise mit Enzymen, Farbstoffen oder fluoreszierenden Farbstoffen gekoppelt). Mittlerweile Standardmethode der mikroskopischen Pathologie. B Laser-Scanning-Mikroskopie (LSM) Auf Lasern basierende Fluoreszenzmikroskopie mit verbesserter Auflösung, Möglichkeit zu Vielfachmarkierung und, aufgrund der gerasterten Bildaufnahme, Möglichkeit zur 3D-Bildrekonstruktion. Anwendbar z.B. für A, C, D, E. C In situ Hybridisierung (ISH) Nachweis/Lokalisation spezifischer mRNAs oder anderer spezifischer RNA/DNA-Sequenzen über markierte, sequenzspezifische Nukleinsäuresonden. D Single cell injection (SCI) Mikroinjektion einzelner Zellen mit Enzymen, Farbstoffen, fluoreszierenden Farbstoffen, z.B. zur Markierung oder 3D-Darstellung einzelner Zellen, oder zur Analyse von mittels gap junction- erbundener Koppelungsgruppen von Zellen. E Tracing Injektion/Mikroinjektion von speziellen Farbstoffen/Molekülen/Viren, die sich anterograd und/oder retrograd über Synapsen verbreiten können. Primär zur Analyse neuronaler Verbindungen und Netzwerke. F Laser-capture microdissection (LCM, LCMD) RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 2 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript Ausschneiden einzelner Zellen/Zellgruppen aus einem Gewebsverband mittels eines Lasers. Ermöglicht die detaillierte molekulare/biochemische Analyse einzelner Zellen/Zellgruppen. 02.02 Neurone (ca. 15 min) 02.02.01 Kennzeichnen Sie in der Abbildung die folgenden Abschnitte eines Neurons und beschreiben Sie deren Aufgaben. Kennzeichnen sie mit einem Pfeil die Richtung der Erregungsleitung. Welches ist das afferente, welches das efferente Neuron? A Dendrit Afferenter Nervenzellfortsatz, Aufnahme afferenter Erregungen und Generation von synaptischen Potentialen; B Perikarion Neuronzellkörper mit allen essentiellen Organellen und Stoffwechselprozessen. C Axonhügel Übergangsbereich zwischen Perikarion und Axon, Generierung der APs; D Axon Efferenter Nervenzellfortsatz, Leitung der APs zum Zielgebiet. E Synapse Spezialisierte Kontaktstelle zwischen 2 Neuronen für die chemische Erregungsübertragung. Neurit Begriff für einen Nervenzellfortsatz, bei dem nicht klar ist, ob es sich um einen Dendriten oder ein Axon handelt. RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 3 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.02.02 Zeichnen Sie - schematisch - die vier morphologischen Haupttypen von Neuronen (mit Dendrit, Perikarion, Axon, Synapse) und geben Sie jeweils ein Beispiel für das Vorkommen an. 02.02.03 Im Verlauf des Kurses und in den Prüfungen werden Sie immer wieder neuronale Schaltkreise zeichnen müssen. Machen Sie sich zunächst klar, welche 3 Teile und welche Eigenschaft eines Neurons für seine schematisch/funktionelle Darstellung ausreichend sind. Erklären Sie dann anhand von einfachen Schaltzeichnungen die folgenden Begriffe RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 4 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.02.04 Die Elektronenmikroskopie (EM) kann aufgrund der technischen Bedingungen im Grundstudium leider nur theoretisch behandelt werden. Schauen Sie sich in den Lehrbüchern unbedingt nochmals EM-Abbildungen von Neuronen, Synapsen & Gliazellen an. Beschriften Sie in der EMZeichnung eines Neurons die folgenden Strukturen: A – Dendrit B – Perikarion C – Axonhügel D – Axon E – Nucleus F – Nucleolus G – Kernpore H – rER (= Nissl-Schollen) I – Mitochondrien J - Golgi-Apparat K - Microtubuli/Neurofilamente L – synaptisches Endköpfchen M – synaptische Vesikel N – postsynapt. Verdichtung O – synaptischer Dorn P – axo-dendritische Synapse Q – axo-somatische Synapse R – axo-axonale Synapse 02.02.05 Machen Sie sich anhand der Abbildung die Transportvorgänge in Neuronen klar und füllen Sie dann die Tabelle aus. RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 5 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript Richtung ungerichtet Motor Kinesine, Dyneine bzw. ? langsamer axonaler Transport überwiegend anterograd keine bzw. ? schneller anterograder Transport schneller retrograder Transport vom Perikarion Kinesine zur Synapse dendritischer Transport von der Syanpse zum Perikarion Dyneine Leitstruktur Transportgut Microtubuli & ? alle in der Peripherie benötigten Komponenten keine bzw. ? z.B. Filamentproteine, Clathrin, andere cytoplasm. Proteine Microtubuli z.B. Vesikel, von – nach + Mitochondrien Microtubuli von + nach - Geschwindigkeit 0,5 – 100 mm/Tag 0,5 – 5 mm/Tag 100 – 400 mm/Tag z.B. Endoso100 – 400 men, aktivierte mm/Tag Wachstumsfaktoren 02.02.06 Haben Sie eine Vorstellung von der Gesamtlänge aller Neuriten des Nervensystems (d.h. alle Axone und Dendriten und deren Äste aneinander gelegt)?. Können Sie ein halbwegs verständliches Vergleichsbeispiel für diese Zahl nennen? Viele Schätzungen liegen größenordnungsmäßig wirklich bei ca. 700 000 km Das ist nahezu einmal die Strecke Erde – Mond und zurück (= 768 000 km). Pathologischer Vergleich: Bei Alzheimer-Patienten im Endstadium kann die Neuritenlänge auf unter 40% gegenüber dem Normalwert schrumpfen, d.h. noch nicht einmal die einfache Strecke Erde - Mond. 02.03 Synapse (ca. 15 min) 02.03.01 Erklären Sie mittels der Tabelle die wichtigsten Unterschiede zwischen elektrischen und chemischen Synapsen. RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 6 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript Leitungsart Leitstrukturen Richtung Beeinflussbarkeit Vorkommen elektrisch kontinuierl. elektr. Erregungsleitung (Potential * Potential), elektrotonische Leitung Gap junctions ungerichtet, d.h. in beide Richtungen möglich und auch immer erfolgend spezifische Beeinflussung elektrisch schwer (z.B. Defi) und chemisch noch schwerer möglich normal zwischen Herzmuskelzellen; normal zwischen Astrozyten; zwischen Neuronen nur in einigen kleineren Neurongruppen, z.B. des Hypothalamus chemisch diskontinuierliche Erregungsleitung (Potential * Transmitter * Potential), chemische Übertragung Präsynapse, synapt. Spalt, Postsynapse immer gerichtet, d.h. Rückwärtsübertragung grundsätzlich unmöglich über auf Transmitter & Rezeptoren wirkende Medikamente gut und spezifisch beeinflussbar typische, praktisch einzige Synapsenform im NS der Säugetiere 02.03.02 Kennzeichnen Sie in der Abbildung die folgenden Formen chemischer Synapsen. A – Dornsynapse B – Schaftsynapse C – axo-dendritische Synapse D – axo-somatische Synapse E – axo-axonale Synapse. 02.03.03 Zeichnen Sie ein einfaches Schema einer chemischen Synapse mit den folgenden mikroskopischen Strukturen! Welche Aufgaben haben die einzelnen Strukturen? A – synapt. Endköpfchen B – synapt. Vesikel C - Mitochondrien D – präsynapt. Membran E - präsynapt. Verdichtungung F – synapt. Spalt G - freier Neurotransmitter H – postsynapt. Membran I - postsynapt. Verdichtung RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 7 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.03.04 Elektronenmikroskopisch kommen im ZNS 2 Haupttypen chemischer Synapsen vor, Gray I & II. Wie unterscheiden sich die beiden Typen bezüglich Bau und Funktion? 02.03.05 Machen Sie sich klar, dass für die chemische Signalübertragung eine Vielzahl molekularer Vorgänge notwendig ist, z.B. Neurotransmittertypen Neuropeptide Transmittersynthese Transmitterverpackung Transmittertransport potentialabhängige Aktivierung Vesikel-Docking Exocytose Rezeptorbindung 2nd messenger pathways Generation der synapt. Potentiale Transmitterinaktivierung Transmitterendocytose Transmitterrecycling Transmitterabbau Transmitterentsorgung usw. usw. Diese Vorgänge werden in der integrierten Neuranatomie-/Neurophysiologie-Vorlesung in mehreren Beispielen behandelt und sind natürlich Lern- und Prüfungsstoff. Im Kurs können wir darauf nicht detailliert eingehen. Beispielhaft sollen Sie an der folgenden Abbildung kurz ein paar Mechanismen der monoaminergen Neurotransmission rekapitulieren. RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 8 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.03.06 Machen Sie sich anhand der Abbildung die wichtigsten Abschnitte des Vesikelkreislaufs klar. 02.03.07 Machen Sie sich klar, wo und wie Toxine bzw. Medikamente in das synaptische Geschehen eingreifen und was sie bewirken können. Prinzipiell in alle unter 02.03.05 & 06 genannten (und auch nicht genannten) Teilschritte. Wichtigste Aspekte dabei sind die Gängigkeit der Substanz durch die Blut-Hirn-Schranke und die Spezifität des Eingriffs (Beispiele s. Lehrbücher der Neurologie). 02.03.08 Haben Sie eine Vorstellung von der Anzahl der Synapsen im ZNS? Können Sie einen plausiblen Vergleich bringen? Einzelne Neurone können nur 1 Synapse, aber auch bis zu 100 Synapsen haben. Grobe Schätzungen gehen von durchschnittlich 5 Synapsen/Neuron aus, d.h. ca. 500 000 000 000 Synapsen/ZNS. Das sind fast doppelt so viel, wie es Sterne in unserer Milchstraße gibt (ca. 300 000 000 000). RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 9 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.04 Glia (ca. 15 min) 02.04.01 Machen Sie sich anhand der Abbildung klar, wie groß der Anteil der Gliazellen, Neurone und Blutgefäßzellen am ZNS ist. 02.04.02 Machen Sie sich anhand der Abbildung klar, welche Haupttypen von Gliazellen es gibt, welche Aufgaben sie haben und welcher Herkunft sie sind. 02.04.03 Beschriften sie in der Abbildung die wichtigsten Zelltypen des ZNS & PNS. RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 10 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.04.04 Beschreiben Sie Unterschiede zwischen den beiden morphologischen Haupttypen von Astrocyten. 02.04.05 Nennen Sie möglichst viele Aufgaben von Astrocyten. Blut-Hirn-Schranke, Stoffaustausch mit Gefäßen, Stoffaustausch mit Neuronen, Regulation der lokalen Homöostase, Regulation der synaptischen Plastizität, Kompartimentierung, Wachstumsfaktorproduktion, Glianarben, Phagozytose(?), Antigenpräsentation (?), Transmitterabbau / -recycling, usw. usw. 02.04.06 Wie Unterscheiden sich myelinisierende Oligodendrocyten und myelinisierende SchwannZellen morphologisch und bezüglich der Axon-Regeneration? Oliogdendrocyten umscheiden Abschnitte mehrerer Axone und hemmen die Axonregeneration (keine zentrale Regeneration) Schwann-Zellen umscheiden einen Abschnitt eines einzigen Axons und fördern die Axonregeneration (relativ gute periphere Regeneration) 02.04.07 Nennen Sie spezifische Eigenschaften und Funktionen der Mikroglia (auch Mesoglia oder Hortega-Zellen). * mesodermaler Herkunft * einzige nicht ortsständige Zellen des ZNS * mit ca. 5 µm kleinste Zellen des ZNS RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 11 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript * entsprechend dem physiologischen Zustand (ruhend, aktiviert - nicht phagocytierend, aktiviert – phagocytierend) existieren unterschiedliche morphologische Formen * Aktivierung durch Trauma, Detritus, Infektionen, etc. * gehören dem mononucleären phagocytotischem System an (entsprechen funktionell in etwa Makrophagen) 02.04.08 Welche Bedeutung hat Radialglia für die Entwicklung von Neuronschichten (Endhirncortex, Kleinhirncortex, Retina, etc.)? Wo kommt Radialglia auch noch im adulten ZNS vor? Entlang der Fortsätze der Radialglia wandern die Neurone und bilden so die Schichten aus. Bergmann-Glia im Cerebellum; Müller-Glia der Retina 02.05 peripherer Nerv (ca. 5 min) 02.05.01 Beschreiben Sie anhand der Abbildung den Unterschied zwischen unmyelinisierten und myelinisierten Nervenfasern. 02.05.02 Beschriften sie in der Abbildung eines Nervenquerschnitts folgende Strukturen: A – Epineurium B – Blutgefäß C – Perineurium D – unmyelinisiertes Axon E – Myelin F – Schwann-Zelle G – Endoneurium H – Erythrozyt 02.06 Klinik (ca. 10 min., evtl. Hausaufgabe) RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 12 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.06.01 Überlegen Sie, wo an einem Neuron Sie am Besten mit Medikamenten in das neuronale Geschehen eingreifen können. Welche Prozesse lassen sich dort beeinflussen? Kennen Sie schon Medikamente, die hier wirken? Vergl. 02.03.07 02.06.02 Um was handelt es sich bei dem braunen Bereich um die Hirnzyste? Welche Bedeutung hat diese Struktur? 02.06.03 Welche pathologischen Veränderungen erkennen Sie im CT-Scan? Um welche Erkrankung handelt es sich wahrscheinlich? 02.06.04 Auf welchen Zelltyp ist die überwiegende Mehrheit der adulten Hirntumore zurückzuführen? Gliome, häufig Astrocytome 02.06.05 Die Kenntnis der Drogenwirkung im ZNS, Mechanismen der Abhängigkeitsentwicklung, etc. sind mittlerweile ein großes Gebiet der Neurologie und Psychiatrie. Machen Sie sich anhand der Abbildung den Wirkmechanismus von Drogen im ZNS am Beispiel des Cocains klar. 02.07 mc-Übungsfragen (Hausaufgabe) RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 13 Neuroanatomiekurs für HM im SS 2006 * Kurstag 2: Histologie & Zellbiologie des Nervengewebes Dozenten- & Bremserscript 02.07.01 Bei welchem Zelltyp handelt es sich nicht um zentrale Gliazellen? A] Tanyzyten B] Pituizyten C] Ependymzellen D] Satellitenzellen (PNS) E] Astrozyten 02.07.02 Welche Aussage zu Astrocyten ist falsch? A] Sie haben Kontakt zu Blutgefäßen. B] Sie sind am Recycling/Abbau mancher Transmitter beteiligt. C] Sie haben Kontakt zu Schwann-Zellen. (die gibt’s nur im PNS) D] Sie haben Kontakt zu Neuronen. E] Sie sind häufig über Gap junctions untereinander verbunden und bilden so funktionelle Koppelungsgruppen. 02.07.03 Welche Aussage zu Synapsen ist falsch? A] Bei elektrischen Synapsen ist die Erregungsleitung in beiden Richtungen möglich. B] Neurotransmitter werden mittels membranständiger, vesikulärer Transmitter-Transporter aus den Vesikeln freigesetzt. (in die Vesikel aufgenommen) C] Transmitter-Rezeptoren können auch auf der präsynaptischen Membran vorkommen. D] GABA ist typischerweise ein inhibitorischer Neurotransmitter E] Im synaptischen Spalt gibt es Transmitter-abbauende/-inaktivierende Enzyme. 02.07.04 Welche Aussage zu Nerven ist falsch? A] Periphere, nicht-myelinisierte Axone haben keinen Kontakt mit Schwann-Zellen. (sind ebenfalls in Schwann eingebettet) B] Das Epineurium ist die äußere bindegewebige Hülle eines Nerven. C] In einem peripheren Nerv können myelinisierte und unmyelinisierte Fasern nebeneinander vorkommen. D] Die Leitungsgeschwindigkeit einer Nervenfaser steigt mit der Dicke der Myelinschicht. E] Das Endoneurium ist das Bindegewebe zwischen den einzelnen Nervenfasern. 02.07.05 Welche Aussage zu pathologischen Veränderungen des Nervensystems ist falsch? A] Die meisten Hirntumore entwickeln sich aus entarteten Neuronen. (Gliazellen) B] Astrocyten bilden um pathologisch veränderte Regionen eine Trennschicht (= Glia-Narbe) C] Bei Multipler Sklerose werden Myelin/Oligodendrocyten vom körpereigenen Immunsystem zerstört. D] Drogen greifen an unterschiedlichen Stellen in das synaptische Geschehen ein. E] Nach der Durchtrennung einer Nervenfaser degeneriert grundsätzlich der Teil, der keine Verbindung zum Perikarion mehr hat. RW 2006 * Institut für Anatomie & Zellbiologie * Philipps-Universität Marburg 14