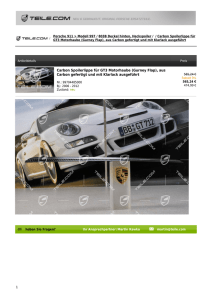
129Xe-NMR-spektroskopische Untersuchungen
Werbung

129 Xe-NMR-spektroskopische Untersuchungen an Carbon Black und Graphit Von der Fakultät für Naturwissenschaften der Universität Duisburg – Essen (Standort Duisburg) zur Erlangung des akademischen Grades eines Doktors der Naturwissenschaften genehmigte Dissertation von Holger Schmidt aus Dinslaken Referent: Prof. Dr. W. S. Veeman Korreferent: Prof. Dr. H. J. Frohn Tag der mündlichen Prüfung: 12. Februar 2003 Danksagung Mein besonderer Dank gilt Herrn Prof. Dr. W. S. Veeman für die Überlassung des interessanten Themas sowie für die vielen hilfreichen Anregungen und Diskussionen die sehr zum Gelingen dieser Arbeit beigetragen haben. Herrn Prof. Dr. H. J. Frohn danke ich für die Übernahme des Korreferates. Bei Herrn Dr. B. Wermeckes bedanke ich mich herzlich für die freundliche Überlassung der Carbon Black- und Graphitproben. Des weiteren gilt mein besonderer Dank Herrn Dipl.-Ing. Manfred Zähres für die Einweisung in die Messtechnik der NMR-Spektroskopie und die stete Hilfsbereitschaft und Geduld bei den vielen Fragen und Problemen, die während den Messungen auftraten. Manfred, die Gefahr einer explodierenden Ruß-Probe im Messkopf ist gebannt! Herrn Dipl.-Ing. Uwe Bachorski danke ich für die tatkräftige Unterstützung beim Umbau des Messkopfes und der Bewältigung zahlreicher elektrotechnischer Probleme. Darüber hinaus möchte ich allen verbliebenen und ehemaligen Mitarbeiterinnen und Mitarbeitern des Fachgebiets Physikalische Chemie für die gute Zusammenarbeit und angenehme Atmosphäre danken. Besonders erwähnen möchte ich Annegret Terheiden, Wassef Al Sekhaneh, Neslihan Altinbas und Michael Vogt, die mir als Büromitarbeiter während der Promotion Gesellschaft geleistet haben, sowie Martin Horstmann, der stets ein offenes Ohr für Soft- und Hardwareprobleme hatte. Mille Grazie a Elena Trezza che mi è stata vicina in questo periodo. Non avrei potuto finire senza di te! Zuletzt gilt ein besonderer Dank meinen Eltern für die immerwährende Unterstützung während des Studiums und der Promotion. Der Wissenschaftler findet seine Belohnung in dem, was Poincaré die Freude am Verstehen nennt, nicht in den Anwendungsmöglichkeiten seiner Erfindung. Albert Einstein I Inhalt Kapitel 1 Einleitung .................................................................................... 1 Kapitel 2 Carbon Black – Struktur und Eigenschaften .................. 4 Kapitel 3 2.1 Graphit – Grundstruktur der Carbon Blacks................................. 2.2 Carbon Black – Mehr als nur ein Ruß ........................................... 2.2.1 Einführung ...................................................................................... 2.2.2 Herstellungsverfahren .................................................................... 2.2.3 Herstellung poröser Carbon Blacks ............................................... 4 7 7 7 10 2.3 Morphologie und Oberflächenchemie .......................................... 2.3.1 Primärpartikel ................................................................................. 2.3.2 Aggregate und Agglomerate .......................................................... 2.3.3 Porosität in Carbon Blacks ............................................................. 2.3.4 Die Dichte ...................................................................................... 2.3.5 Oberflächenchemie ........................................................................ 10 10 12 13 15 16 2.4 Standardanalysemethoden in der Industrie ................................. 2.4.1 Bestimmung der Primärpartikelgröße ............................................ 2.4.2 Bestimmung des Aggregationsgrades ........................................... 2.4.3 Bestimmung der spezifischen Oberfläche ..................................... 17 17 17 18 Adsorption und Diffusion in porösen Festkörpern ..... 20 3.1 Das Konzept der Oberfläche .......................................................... 20 3.2 Adsorption in porösen Festkörpern .............................................. 3.2.1 Adsorptionsenergien in Mikroporen ............................................... 3.2.2 Adsorption in nicht- und makroporösen Strukturen ........................ 3.2.3 Adsorption in Mikroporen ............................................................... 3.2.4 Adsorption von Gasen oberhalb der kritischen Temperatur .......... 3.2.5 Adsorption in Graphit und Carbon Black ........................................ 21 22 25 27 29 30 3.3 Diffusion in porösen Festkörpern ................................................. 3.3.1 Freie und gehinderte Diffusion ....................................................... 3.3.2 Der Diffusionskoeffizient in mikro- und mesoporösen Festkörpern 32 32 NMR -Spektroskopie .................................................................. 38 4.1 Grundlagen der NMR-Spektroskopie ............................................ 4.1.1 Kernspins im Magnetfeld ............................................................... 4.1.1.1 Die Zeeman-Wechselwirkung ..................................................... 4.1.1.2 Die chemische Verschiebung ..................................................... 4.1.1.3 Dipolare Kopplung ...................................................................... 4.1.1.4 Skalare Kopplung ........................................................................ 4.1.2 Relaxationseffekte ......................................................................... 4.1.2.1 Spin-Gitter-Relaxation ................................................................. 4.1.2.2 Spin-Spin-Relaxation .................................................................. 4.1.3 Relaxationseffekte in monoatomaren Gasen ................................. 4.1.3.1 Dipolare Kopplung ...................................................................... 4.1.3.2 Skalare Kopplung ........................................................................ 38 38 39 40 40 41 42 42 42 43 43 43 35 Kapitel 4 Inhalt II 4.1.3.3 Anisotropie der chemischen Verschiebung ................................. 4.1.3.4 Chemischer Austausch ............................................................... 44 45 4.2 PFG-NMR-Spektroskopie ............................................................... 4.2.1 Funktionsweise der PFG-NMR-Spektroskopie .............................. 4.2.2 Mathematische Beschreibung der Diffusion in der PFG-NMRSpektroskopie ................................................................................ 46 46 129 4.3 Xe-NMR-Spektroskopie .............................................................. 4.3.1 Einführung ...................................................................................... 4.3.2 129Xe-NMR-Untersuchungen an Xenon und Xenongasgemischen 4.3.3 Xenon in flüssiger und fester Phase .............................................. 4.3.4 Xenon in Verbindungen ................................................................. 4.3.5 Xenon gelöst in Flüssigkeiten ........................................................ 4.3.6 Xenon als Hohlraumsonde in Festkörpern ..................................... 4.3.6.1 Xenon in Zeolithen....................................................................... 4.3.6.2 Xenon in Clathraten .................................................................... 4.3.6.3 Xenon in Polymeren .................................................................... 4.3.6.4 Xenon in Graphit und amorphen Kohlenstoff .............................. 4.3.7 Modelle zur Berechnung der chemischen Verschiebung ............... 4.3.7.1 Chemischen Verschiebung als Funktion des Porenvolumens..... 4.3.7.2 Chemischen Verschiebung als Funktion der Oberflächenkrümmung ................................................................ 4.3.7.3 Das „Rapid-Exchange“-Modell .................................................... 4.3.7.4 Das Modell der zwei Energiezustände ........................................ 4.3.7.5 Das „Dual-Mode“-Modell …………………………………………… 4.3.8 Magnetische Einflüsse der Graphitstruktur auf chemische Verschiebung und Halbwertsbreite ................................................ 4.3.8.1 Suszeptibilitätsunterschiede ....................................................... 4.3.8.2 Ringstromeffekt in konjugierten π-Systemen .............................. Kapitel 5 51 54 54 54 56 57 58 58 58 60 61 62 62 63 64 65 66 69 70 70 72 Ergebnisse .................................................................................. 74 5.1 Einführung ....................................................................................... 74 129 Xe-NMR-Verschiebung in Graphit und Carbon Black .............. 75 5.3 Druckabhängigkeit der chemischen Verschiebung .................... 78 5.4 Halbwertsbreiten und T2-Relaxation ............................................. 5.4.1 Resonanzlinien des freien und extraporösen Xenons ................... 5.4.2 Resonanzlinien des intraporösen Xenons ..................................... 5.4.3 Druckabhängigkeit der Halbwertsbreite ......................................... 5.4.4 T2-Relaxationszeiten ...................................................................... 82 82 82 82 84 5.5 T1-Relaxation ................................................................................... 86 5.6 Xenon-Diffusion in Carbon Black .................................................. 5.6.1 Einführung ...................................................................................... 5.6.2 Diffusion des freien und extraporösen Xenons .............................. 5.6.3 Diffusion des intraporösen Xenons …………………………………. 5.6.4 Druckabhängige Xenon-Diffusionsmessungen .............................. 5.6.5 Diffusionszeitabhängige Xenon-Diffusionsmessungen .................. 87 87 87 89 91 92 5.7 Quantitative Untersuchung der 129Xe-NMR-Signale ..................... 93 5.8 Temperaturabhängigkeit der chemischen Verschiebung ........... 94 5.2 Inhalt Kapitel 6 III Diskussion .................................................................................. 96 6.1 Einführung ....................................................................................... 96 6.2 Porenmodell für Carbon Blacks .................................................... 96 6.3 Porengrößenbestimmung .............................................................. 99 6.3.1 Intraaggregatporen ........................................................................ 99 6.3.2 Porenradius aus Stampfdichte und spezifischer Oberfläche ......... 100 6.4 Austausch und Diffusion ............................................................... 6.4.1 Austauschprozesse ........................................................................ 6.4.2 Freie Selbstdiffusion ...................................................................... 6.4.3 Diffusion intraporöser Xenonatome …………………………………. 6.4.4 Druckabhängigkeit der Diffusion..................................................... 6.4.5 Gehinderte Diffusion ...................................................................... 102 102 105 105 106 108 6.5 129Xe-NMR-Verschiebung in Carbon Blacks ................................. 6.5.1 Einfluss der spezifischen Oberfläche ............................................. 6.5.2 Einfluss der Porengröße ................................................................ 6.5.2.1 Mittleres V/S-Verhältnis .............................................................. 6.5.2.2 Intraaggregatporen ..................................................................... 6.5.3 Einfluss der Oberflächenchemie .................................................... 6.5.4 Druckabhängigkeit der chemischen Verschiebung ........................ 6.5.5 Signalaufspaltung zu tieferem Feld ................................................ 6.5.6 Anwendung der Dubinin- und Langmuir-Isothermen ..................... 6.5.7 Porengrößenbestimmung aus Füllgrad und chemischer Verschiebung ................................................................................. 109 109 111 111 113 114 116 117 119 6.6 Halbwertsbreiten und T2-Relaxation ............................................. 6.6.1 Porengrößenverteilung .................................................................. 6.6.2 Relaxationseffekte durch dipolare und skalare Kopplungen .......... 6.6.3 Anisotropieeffekte und magnetische Suszeptibilität ....................... 6.6.4 Druckabhängigkeit der T2-Relaxation und Halbwertsbreite ........... 6.6.5 Signalaufspaltung bei Vulcan PF zu höherem Feld ....................... 129 122 127 127 129 130 130 132 Xe-NMR-Spektrum von Graphit ................................................. 133 6.8 Xenon-Adsorption in Carbon Black ………………………………... 6.8.1 Spezifische Adsorbatmenge a ....................................................... 6.8.2 Adsorptionstheorien nach Langmuir, BET und Dubinin-Asthakov.. 6.8.2.1 Oberflächenadsorption ................................................................ 6.8.2.2 Porenfüllen nach Dubinin ............................................................ 6.8.3 Oberflächenspezifische Adsorbatmenge ....................................... 135 135 137 138 139 143 6.7 Kapitel 7 Zusammenfassung ................................................................... 146 Kapitel 8 Experimenteller Teil ................................................................ 149 8.1 Präparation der Xenon/Carbon Black – Proben ........................... 149 8.2 Verwendete NMR-Spektrometer .................................................... 151 8.3 129Xe-NMR-Experimente mit magnetischen Feldgradienten ....... 151 8.3.1 129Xe-NMR-Meßkopf mit Quadrupol-Feldgradientenspule ............. 151 8.3.2 Die Gradienteneinheit .................................................................... 153 IV Inhalt 8.3.3 Kalibration der Feldgradientenspule .............................................. 8.4 129Xe-NMR-Pulsprogramme .............................................................. 8.4.1 Ein-Puls-Experiment ...................................................................... 8.4.2 Inversion-Recovery-Experiment zur T1-Bestimmung ..................... 8.4.3 CPMG-Experiment zur T2-Bestimmung ......................................... 8.4.4 PFG-NMR-Experiment ................................................................... 154 155 155 156 156 157 Literatur ......................................................................................................... 158 Anhang ......................................................................................................... 165 A.1 Eigenschaften und Hersteller der verwendeten Carbon Blacks 166 A.2 Ergebnisse der Xenon-Diffusion ................................................... 167 A.3 Ergebnisse der Xenon-Adsorption ............................................... 168 A.4 Begriffe und Abkürzungen ............................................................ 169 1 Kapitel 1 Einleitung „Carbon Black“ ist die englische Bezeichnung für ein industriell hergestellter Ruß, der sich vom herkömmlichen Ruß in erster Linie durch eine homogenere Struktur und einem höheren Kohlenstoffgehalt von über 96 % unterscheidet.[1] Aus industrieller Sicht besitzen Carbon Blacks eine besondere Bedeutung. Ihre Verwendungsmöglichkeiten sind vielseitig und reichen von Pigmenten in der Druck- und Farbindustrie, über Füllstoffe in der Reifen- und Polymerindustrie bis hin zu Elektrodenmaterialien in der Elektroindustrie. Bereits in der Antike verwendeten Chinesen und Ägypter Ruße in Schreibtinten und Wandfarben. Und auch heute noch ist Carbon Black ein beliebtes Schwarz-Pigment, dass in Farben, Lacken, Druckfarben und Tonerharzen eingesetzt wird. Der Ausdruck dieser Arbeit erfolgte z. B. durch die Verwendung solcher Ruße.[2] Die Entdeckung der stabilisierenden Wirkung der Carbon Blacks als Füllstoff in Kautschuk zu Beginn des 20. Jahrhunderts revolutionierte die Reifenherstellung und kann als Meilenstein in der Entwicklung der Automobilindustrie gesehen werden. Darüber hinaus sind es elektrische Leitfähigkeit und chemische Inertheit, die Carbon Black zu einem idealen Elektrodenmaterial für die Elektroindustrie machen und z. B. bei Elektrolysevorgängen eine wichtige Rolle spielen. Aber auch als Füllstoff verleiht es vielen nichtleitenden Materialien eine elektrische Leitfähigkeit und erlaubt so z. B. die Herstellung antistatischer Gummis.[1-3] Hinzu kommen Molekularsiebeigenschaften und eine hohe Gasadsorptionsfähigkeit, die den Carbon Blacks auch als Filtermaterial ein breites Anwendungsgebiet eröffnen.[2] Zu den charakteristischen Parametern der Carbon Blacks gehören Partikelgröße, Porosität, Aggregations- und Agglomerationsgrad, sowie die sich daraus ergebenden sekundären Eigenschaften, wie spezifische Oberfläche und Stampfdichte.[1-2] Sie bestimmen z. B. die Schwarzzahl, die Leitfähigkeit und den Verstärkungsgrad der Ruße und sind daher von besonderer analytischer Bedeutung. Diese Größen sind aber mit den in der Industrie verwendeten Standardanalysemethoden nur bedingt zugänglich. 2 Einleitung Insbesondere der Aggregations- und Agglomerationsgrad sowie die Porosität der Primärpartikel können nur indirekt und mit spezifischen Methoden bestimmt werden.[3] So kommt es vor, dass zwei Carbon Blacks sich von den analytischen Ergebnissen her nur wenig unterscheiden, sie aber z. B. als Füllstoff in Polymeren zu völlig unterschiedlichen Materialeigenschaften führen können. Hier bietet die kernmagnetische Resonanzspektroskopie (Nuclear Magnetic Resonance(NMR)-Spectroscopy) die Möglichkeit, neue und ergänzende Informationen über die 129 Xenon Morphologie und Oberflächenchemie der Carbon Blacks zu erhalten. Das Isotop wird dabei als „atomare Sonde“ eingesetzt, das in die mikro- und mesoporösen Strukturen eindringen kann und Informationen aus dem Inneren des Festköpers „sendet“. Bevorzugtes Anwendungsgebiet 129 Xe-NMR-Spektroskopie der waren bisher die definierten und ausführlich in der Literatur beschriebenen Strukturen der Zeolithe.[4] Über druck- und temperaturabhängige Bestimmung von 129 Xe-NMR-Untersuchungen wurden Modelle zur Porengrößenverteilung und Oberflächeneigenschaften aus der chemischen Verschiebung entwickelt. Entsprechend wenig ist über die Anwendung der 129 Xe-NMR-Spektroskopie in undefinierten porösen Systeme, wie z. B. den Carbon Blacks, bekannt. Inhomogene Strukturen erschweren hier die Interpretation der mit breiten Porengrößenverteilungen 129 Xe-NMR-Spektren. Ein Ziel dieser Arbeit ist es daher die Erkenntnisse aus den 129 Xe-NMR-Untersuchungen an Zeolithen auf Carbon Blacks zu übertragen und so Informationen über Morphologie und Oberflächechemie zu erhalten. Außerdem wird eine Korrelation der 129 Xe-NMR- Parameter mit den charakteristischen Größen der Carbon Blacks gesucht, so dass sich in Zukunft die 129 Xe-NMR-Spektroskopie als Standardanalysemethode für Carbon Blacks verwenden lässt. Ein Problem stellt hier die Temperatur- und Druckabhängigkeit der chemischen Verschiebung dar, der daher in dieser Arbeit eine besondere Beachtung zuteil wird. Im Einzelnen können die experimentellen 129 Xe-NMR-Untersuchungen an Carbon Black und Graphit, das hier als nichtporöse Referenz dient, sowie die Ziele dieser Arbeit wie folgt zusammenfasst werden: • Korrelation der 129Xe-NMR-Parameter mit den charakteristischen Größen der Carbon Blacks, wie z. B. Partikelgröße, Porengröße und spezifische Oberfläche. • Untersuchung der Druckabhängigkeit der 129Xe-NMR-Experimente • Xenon-Diffusionsmessungen mit Hilfe der PFG-NMR-Spektroskopie in Abhängigkeit von Druck und Diffusionszeit 3 Einleitung • Untersuchung des Relaxationsverhaltens adsorbierter und freier Xenonatome • Anwendung theoretischer und experimenteller Methoden zur Porengrößenbestimmung • Bestimmung des Xenon-Adsorptionsverhaltens in Carbon Black oberhalb der kritischen Temperatur Die Interpretation der 129 Xe-NMR-Spektren erfordert Kenntnisse der morphologischen und oberflächenchemischen Eigenschaften von Graphit und Carbon Black, die im folgenden Kapitel vermittelt werden sollen (Kapitel 2). Im System Xenon/Carbon Black sind außerdem Adsorptions- und Diffusionsvorgänge die vorherrschenden Prozesse, die die 129 Xe-NMR-Parameter beeinflussen. Sie werden mit Bezug auf die Besonderheiten mikroporöser Festkörper in Kapitel 3 ausführlich vorgestellt. Nach einer allgemeinen Einführung in die NMR-Theorie wird in Kapitel 4 die Pulsed Field Gradient-(PFG)-NMRSpektroskopie beschrieben, die bei den Xenon-Diffusionsmessungen angewendet wurde. Anschließend wird ein Überblick über die bisher in der Literatur beschriebenen 129 Xe- NMR-Untersuchungen gegeben und einige Modelle zur Porengrößenbestimmung mikroporöser Systemen erläutert. In Kapitel 5 und 6 werden schließlich die Ergebnisse der 129 Xe-NMR-Untersuchungen an Graphit und Carbon Black vorgestellt und diskutiert. Die Probenvorbereitung und die experimentelle Durchführung der Kapitel 8 beschrieben. 129 Xe-NMR-Experimente sind am Ende dieser Arbeit in 4 Kapitel 2 Carbon Black – Struktur und Eigenschaften 2.1 Graphit – Grundstruktur der Carbon Blacks Graphit ist ein weiches, schwarz-metallisch glänzendes Material, dass sowohl in natürlicher Form gewonnen wird, als auch künstlich hergestellt werden kann. Die Kristallstruktur des Graphits ist durch viele übereinanderliegende parallele Schichten geprägt. Je nach Größe und Anordnung der Graphitkristallschichten spricht man von Graphit, Koks, Faserkohlenstoff, Aktivkohle oder Ruß.[4] Die Ausdehnung einer solchen Graphitschicht kann im atomaren Bereich als unendlich angesehen werden, wobei innerhalb dieser Schichten sp2-hybridisierte Kohlenstoffatome zu aneinandergrenzenden aromatischen Sechsringen kondensiert sind und ein konjugiertes π-System ausbilden. c Ansicht von oben a Abb. 2.1-1 Hexagonale Kristallstruktur im Graphit. Die Kohlenstoffatome können dabei in einer hexagonalen, rhombischen oder turbostatischen Struktur kristallisieren. Die thermodynamisch stabilste Form des Graphits ist in der hexagonalen Kristallstruktur zu finden, in der die Graphitschichten in der Reihenfolge A-B-A-B angeordnet sind (s. Abbildung 2.2-1 und 2.2-2). Die rhombische 5 Graphit – Struktur und Eigenschaften Struktur ist thermodynamisch instabiler und die Schichtfolge lautet A-B-C-A-B-C. Der Anteil an der rhombischen Kristallstruktur kann im natürlichen Graphit bis zu 30 % betragen. Bei der turbostatischen Struktur, wie sie z. B. bei Carbon Blacks zu finden ist, ist hingegen keine Ordnung zwischen den Schichten bzgl. ihrer Normalen zu erkennen. Hier sind es Defekte in der Kristallstruktur, die zu größeren Abständen und einer Abweichung von der idealen hexagonalen Struktur führen.[5] Der Anteil der hexagonalen Kristallstruktur kann durch Tempern der Graphitproben bei Temperaturen von über 2000 K unter Sauerstoffausschluss erhöht werden. Dieser Vorgang wird als Graphitisierung bezeichnet. Der Grad der Graphitisierung nimmt dabei mit steigender Temperatur und Heizrate zu (s. Abbildung 2.1-3).[2] Hexagon Rhombisch Turbostatisch Abb. 2.1-2 Schematischer Vergleich der hexagonalen (A-B-A-B-...), rhombischen (A-BC-A-B-C-...) und turbostatischen Kristallstruktur im Graphit (Seitenansicht). Abb. 2.1-3 Graphitisierungsgrad des Kohlenstoffs in Abhängigkeit von der Temperatur.[2] 6 Kapitel 2 Der Abstand zwischen den Graphitschichten ist im Vergleich zum Bindungsabstand der Kohlenstoffatome innerhalb der Graphitebene relativ groß und kann je nach Ordnungsgrad zwischen 0,335 (hexagonal) und 0,344 nm (turbostatisch) betragen. Aufgrund dessen sind die Kräfte zwischen den Schichten relativ schwach und sie können leicht gegeneinander verschoben werden.[1] Die Schichtstruktur ist dafür verantwortlich, dass viele Eigenschaften des Graphits eine tensorielle Abhängigkeit zeigen.[4] In Tabelle 2.1-1 sind hierzu einige physikalische Eigenschaften des Graphits bzgl. der Richtungsabhängigkeit zusammengefasst. So findet z. B. bei Temperaturen unterhalb von 400 °C eine Expansion des Festkörpers senkrecht und eine Kontraktion parallel zu den Schichten statt. Aber auch die elektrische Leitfähigkeit ist richtungsabhängig. Parallel zu den Schichten verhält sich Graphit wie ein metallischer Leiter. Senkrecht dazu ist der Elektronenübergang durch den größeren Atomabstand erschwert und die elektrische Leitfähigkeit entspricht dem eines Halbleiters. Hinsichtlich der thermischen Leitfähigkeit ähnelt Graphit ebenfalls einem Metall, wobei sie bei Raumtemperatur ist in a-Richtung sogar größer als bei Kupfer. Tab. 2.1-1 Richtungsabhängige Eigenschaften von Graphit. Parallel (a-Richtung) und senkrecht (c-Richtung) zu den Schichten im Einkristall.[4] Physikalische Eigenschaften c-Richtung -3 Dichte /g·cm a-Richtung 2,266 -1 -1 Thermische Leitfähigkeit /W·cm K 0,04-0,06 10-15 1 5·10-5 Magnetische Suszeptibilität /10-6cm3g-1 -21 -0,3 Elastizitätsmodul /Gpa 36 1000 Mohshärte 9 0,5 Elektrischer Widerstand /Ω·cm Carbon Black –Struktur und Eigenschaften 2.2 7 Carbon Black – Mehr als nur ein Ruß 2.2.1 Einführung Was ist Carbon Black und worin unterscheidet er sich von dem uns bekannten Ruß ? Carbon Black ist die englische Bezeichnung für ein Industrieruß, der unter kontrollierten Bedingungen hergestellt wird und physikalisch und chemisch definiert ist. Er besteht zu mehr als 96 % aus feinteiligem Kohlenstoff und enthält geringe Mengen Sauerstoff, Wasserstoff, Stickstoff und Schwefel.[1-3] Dem gegenüber steht der Kamin- bzw. Dieselruß (engl. „soot“), der als nicht genau definiertes Nebenprodukt bei der Verbrennung von Kohle bzw. Kohlenwasserstoffen entsteht. Aufgrund seiner ebenfalls schwarzen Farbe wird auch er als Ruß bezeichnet. Genaue Angaben über die Struktur und Zusammensetzung lassen sich nicht machen, da die wechselnden Bedingungen bei der Bildung keine einheitlichen Produkte entstehen lassen. Der Grad der organischen und anorganischen Verunreinigung ist zudem relativ hoch. So liegt z. B. beim Kaminruß der Gehalt an Kohlenstoff z. T. unter 50 %.[1] Da in der deutschen Sprache für beide Kohlenstoff-Typen die Bezeichnung Ruß verwendet wird, hat sich (auch international) die englische Bezeichnung Carbon Black für den Industrieruß etabliert. Entsprechend werden in dieser Arbeit die Industrieruße ebenfalls mit Carbon Black bezeichnet. Die Bezeichnung „Black“ wird zudem in Verbindung mit dem entsprechenden Herstellverfahren verwendet (z. B. Furnace Black) und dient der einfachen Unterscheidung zwischen den einzelnen Carbon Blacks.[1] 2.2.2 Carbon Black – Herstellungsverfahren Als gemeinsames Prinzip liegt allen Herstellungsverfahren die kontrollierte Zersetzung von flüssigen oder gasförmigen Kohlenwasserstoffen zugrunde. Diese kann in offenen und geschlossenen Systemen, sowohl unter Sauerstoffzufuhr (thermisch-oxidative Spaltung), als auch unter Sauerstoffausschluss (thermische Spaltung), durchgeführt werden (s. Tabelle 2.2-1). Zudem handelt es sich hierbei um endotherme Prozesse, d. h. für die Zersetzung der Kohlenwasserstoffe muss Energie dem System zugeführt werden. Eine Ausnahme bildet das Acetylen-Black-Verfahren, da hierbei der Abbau von Acetylen exotherm verläuft und die Reaktion nach Initialisierung kontinuierlich fortgesetzt wird. 8 Kapitel 2 Durch Variation der verschiedenen Prozessparameter, wie Druck, Temperatur und Luftbzw. Rohstoffzufuhr, können Carbon Blacks mit gewünschten Eigenschaften kontrolliert hergestellt werden. Hierdurch unterscheidet sich die gezielte Carbon Black Produktion von anderen Prozessen, bei denen Carbon Black als Nebenprodukt anfällt.[1] Tab. 2.2-1 Herstellungsprozesse und Ausgangstoffe bei der Carbon Black Produktion.[1,6] Chemischer Prozess Thermisch-oxidative Spaltung • Geschlossenes System • Offenes System Herstellungsprozess Ausgangsstoff Furnace Black - Prozess Aromatische Öle, aus Steinkohle, Teer und Rohöl (Gehalt >90%), Erdgas Lamp Black - Prozess Aromatische Öle aus Teer und Rohöl, Harz Degussa Gas Black – Prozess Steinkohlenteerdestillate Channel Black - Prozess Thermische Spaltung Thermal Black - Prozess • Diskontinuierlich • Kontinuierlich Acetylen Black - Prozess Erdgas Erdgas bzw. Öle Acetylen Als das älteste Verfahren zur Carbon Black Herstellung ist das Flammruß-Verfahren (engl. Lamp Black) zu nennen, bei dem hauptsächlich Baum-Harze unter begrenzter Luftzufuhr verbrannt werden. Obwohl die Ausbeute mit ca. 5 %, bezogen auf die eingesetzte Rohstoffmenge, relativ gering ist, war es bis ins 16. Jahrhundert das einzige bekannte Verfahren zur Rußherstellung. In der zweiten Hälfte des 19. Jahrhunderts kam es in den USA zur Entwicklung des Channel Black - Verfahrens, bei dem erstmals Erdgas als Rohstoff verwendet wurde. Weitere Verfahren, wie das Thermal-Black, das AcetylenBlack und das von Degussa entwickelte Gas Black - Verfahren waren bis zur Mitte des 20. Jahrhunderts wirtschaftlich von Bedeutung.[3,7,8] Heute ist das Verfahren der thermisch-oxidativen Spaltung von Kohlenwasserstoffen mit ca. 98 % an der Weltproduktion beteiligt.[1] Die größte Bedeutung hat dabei der Furnace Black – Prozess („furnace“ = Hoch- oder Schmelzofen), der sich durch besondere Wirtschaftlichkeit und Flexibilität auszeichnet.[1] Es handelt sich hierbei um einen kontinuierlichen, in einem geschlossenen System ablaufenden Prozess. Das Herzstück ist 9 Carbon Black –Struktur und Eigenschaften dabei die sogenannte Reaktorkammer, die in vier Zonen unterteilt werden kann: Verbrennungszone, Mischzone, Reaktionszone und Quenchzone (s. Abbildung 2.2-1). Um die für die Carbon Black Produktion notwendige Energie zu erhalten, wird in der Verbrennungszone der Brennstoff (Erdgase) unter kontrollierter Luftzufuhr zu Kohlenstoffdioxid und Wasser verbrannt. In der Mischzone wird der Rohstoff (Carbo- und Petrochemische Öle mit möglichst hohem aromatischen Anteil) in den, aus der Brennkammer kommenden, heißen Gastrom gesprüht. 1 2 3 4 Abb. 2.2-1 Reaktorkammer der Furnace-Black Produktion. 1 Verbrennungszone, 2 Mischzone, 3 Reaktionszone, 4 Quenchzone. [1] Das heiße Gasgemisch gelangt schließlich in die Reaktionszone, wo bei Temperaturen von 1400 – 1700 °C der größte Teil des Ausgangsmaterials pyrolysiert und in Carbon Black und Abgas aufgespaltet wird. Der Abbruch der Reaktion erfolgt in der Quenchzone, wo das heiße Reaktorgas durch Zugabe von Wasser auf 900 – 1200 °C abgekühlt wird. Die Wasserdüsen sind im ganzen Reaktorraum verteilt, so dass je nach Durchflussgeschwindigkeit des Reaktorgases und gewünschten Carbon Black Eigenschaften, die Reaktion zu jedem beliebigen Zeitpunkt abgebrochen werden kann. Das gereinigte Carbon Black enthält auch nach der Trennung vom pneumatischen System große Mengen an Luft bzw. Reaktorgas („fluffy Carbon Black“), was zu einer relativ geringen Gesamtdichte führt. Vor der kommerziellen Nutzung muss es daher noch weiter verdichtet werden. Dies geschieht z. B. in Rührtanks oder über eine VakuumVerdichtung, in denen das Carbon Black unter Rühren langsam entgast wird. 10 Kapitel 2 Eine weitere Verdichtung wird durch Granulierung bzw. Pelletieren der Carbon Black Aggregate zu kleinen Kügelchen oder Perlen (engl. „pellets“) erreicht. Diese Perlen finden bevorzugt in Systemen Verwendung, in denen verstärkt Scheerkräfte bei der Mischung mit dem aktiven Medium auftreten (z. B. Polymere). Hinzu kommen weitere Vorteile, wie bessere Fließeigenschaften, geringere Staubentwicklung bei der Verarbeitung und - aus ökonomischer Sicht besonders wichtig - ein geringeres Transportvolumen. 2.2.3 Herstellung poröser Carbon Blacks Poröse Carbon Blacks können direkt mit dem Furnace-Black-Verfahren bei großem Volumen des Reaktorraums und ausreichender Reaktionsdauer hergestellt werden. Dabei spielt die Temperatur eine wichtige Rolle. Trotzdem ist eine nachträgliche Behandlung zur Erhöhung der Porosität vorteilhaft, weil dann die Reaktionsbedingungen unabhängig vom Prozess gesteuert werden können. Wie bei der Extraktion unerwünschter Zusätze wird dabei mit heißem Wasserdampf gearbeitet. Die Temperaturen liegen zwischen 900 und 1000°C und Natriumsalze werden als Katalysator hinzugegeben. Der heiße Wasserdampf „greift“ bevorzugt die ungeordneten Bereiche im Innern der Carbon Black Partikel an und es kommt zur Porenbildung. Dies führt schließlich zu einer vollständigen Erosion der Partikel und es können Carbon Blacks mit spezifischen Oberflächen von über 1000 m2/g erhalten werden.[1,9] 2.3 Morphologie und Oberflächenchemie 2.3.1 Primärpartikel Die Bildung der primären Kohlenstoffstruktur der Carbon Blacks ist bestimmt durch eine Polykondensation und Dehydrierung von Kohlenwasserstoffen zu aromatischen Systemen, die denen im Graphit ähneln, sich aber durch eine wesentlich geringere Flächenausbreitung auszeichnen.[1,10,11] Diese Grundbausteine ordnen sich schichtförmig an. Drei bis sechs solcher Schichten können sich zusammenlagern [6] und bilden schließlich feste, sphärische bzw. ovale Kolloidteilchen, die i. A. als Primärteilchen bezeichnet werden. Dabei nimmt der Grad der Ordnung radial von innen nach außen hin zu. Abbildung 2.3-1 gibt etwa die heutige Vorstellung von einem solchen Primärpartikel wieder. Carbon Black –Struktur und Eigenschaften Abb. 2.3-1 11 Mögliche Struktur und Aufbau eines Primärpartikels. (a) Aromatische Molekülgruppen lagern sich schichtförmig zu einem sphärischen kolloidalen Teilchen zusammen. (b) Schematische Darstellung überlappender Graphitschichten.[1] Die Kanten der überlappenden Schichten können als Defektstellen betrachtet werden, an denen bevorzugt Adsorption stattfindet.[8] Der Durchmesser dieser Partikel kann, je nach Produktionsbedingung, ca. fünf bis zu einigen hundert Nanometern betragen.[12] Der Einfluss der Primärpartikelgröße auf die makroskopischen Eigenschaften der Carbon Blacks ist in Abbildung 2.3-2 schematisch dargestellt. So lässt sich mathematisch leicht zeigen, dass die spezifische Oberfläche mit abnehmendem Primärpartikeldurchmesser größer wird. Gleichzeitig aggregieren kleine Teilchen stärker zusammen als große, das wiederum zu einer erhöhten Viskosität und schlechteren Dispergierbarkeit führt. Kleinere Teilchen haben zudem eine größere Gesamtkontaktfläche untereinander, so dass der Elektronentransport und somit die elektrische Leitfähigkeit höher ist. Die Abhängigkeit der Farbe und Farbstärke von der Partikelgröße hängt wiederum mit der Lichtadsorption und brechung zusammen, die mit abnehmendem Partikeldurchmesser stärker werden.[13,14] Klein Groß Niedriger Öladsorption/Viskosität Leichter Dispergierbarkeit Niedriger Elektrische Leitfähigkeit Höher Farbe Braun Farbstärke Stärker Blauer Schwächer Abb. 2.3-2 Höher Schwieriger Abhängigkeit der makroskopischer Eigenschaften von der Primärpartikelgröße. 12 Kapitel 2 2.3.2 Aggregate und Agglomerate Wie bereits erwähnt wurde, liegen die Primärpartikel im Carbon Black nicht in isolierter Form vor, sondern lagern sich vielmehr perlenartig zu Aggregaten unterschiedlicher Größe zusammen. Dabei besitzen kleinere Partikel größere Kontaktflächen, die zu einer Erhöhung der Selbstaggregation führen. Einzelne Primärpartikel werden über Van-derWaals-Kräfte zusammengehalten und sind nur durch starke mechanische Einwirkung aus dem Aggregat zu entfernen. Ein solches Aggregat kann daher als ein separates, festes, kolloides Teilchen definiert werden, das im Carbon Black die kleinste dispergierbare Einheit darstellt und daher als eigentliches Primärpartikel der Carbon Blacks betrachtet werden muss. Die Form der Aggregate kann je nach Einstellung der Produktionsparameter variieren. Man unterscheidet zwischen sphärischen, elliptischen, linearen und verzweigten Aggregaten, die in Abbildung 2.3-3 schematisch dargestellt sind. Die Aggregate selbst bilden wiederum lose Agglomerate, die leicht durch mechanische Einwirkungen oder Dispersion aufgebrochen werden können. Die Aggregate und Agglomerate werden schließlich durch das beschrieben, was als „Struktur“ der Carbon Blacks bezeichnet wird.[1,2,9,15] 1 Sphärisch 2 Elliptisch 3 Linear 4 Verzweigt Abb. 2.3-3 Die vier Grundtypen der Carbon Black Aggregatstruktur.[15] Carbon Black –Struktur und Eigenschaften 13 Der Einfluss des Aggregationsgrades auf die makroskopischen Eigenschaften der Carbon Blacks ist in Abbildung 2.3-4 zusammenfassend dargestellt. Wenn die Primärpartikel größere Aggregate bilden, nimmt die Struktur zu und es bilden sich mehr kleinere als große Poren. Gleichzeitig erhöht sich die Viskosität der Carbon Blacks und die Dichte sowie die höchstmögliche Rußkonzentration nehmen ab. Zudem bilden größere Aggregate schwächere Agglomerate wodurch die Dispergierbarkeit erleichtert wird. In Aggregaten sind die Primärpartikel relativ stark aneinandergelagert. Je stärker der Kontakt und je größer die Kontaktfläche ist, desto leichter ist der Ladungstransport. Mit steigendem Aggregationsgrad ist auch eine Erhöhung der elektrischen Leitfähigkeit zu beobachten, da mit zunehmender Kontaktfläche der Ladungstransport zwischen der Primärpartikel erleichtert wird.[13,14] Hoch Niedrig Niedriger Öladsorption/Viskosität Leichter Schwieriger Dispergierbarkeit Niedriger Elektrische Leitfähigkeit Höher Farbe Blauer Brauner Höher Abb. 2.3-4 Höher Stampfdichte Niedriger Abhängigkeit der makroskopischen Eigenschaften der Carbon Blacks vom Aggregationsgrad.[13] 2.3.3 Porosität in Carbon Blacks Die Porosität der Carbon Blacks entsteht zum einen durch die porösen Strukturen der Primärpartikel selbst und zum anderen durch die Interpartikelräume in den Aggregaten und Agglomeraten. Sie kann zudem in zwei Kategorien unterteilt werden: in eine offene und eine geschlossene Porosität. Zur offenen Porosität gehören Kanäle und Hohlräume, 14 Kapitel 2 die je nach Größe für andere Teilchen zugänglich sind. Dazu zählen sowohl Poren in einer Festkörperoberfläche („äußere Porosität“) als auch innerhalb eines Festkörpers („innere Porosität“). Sind hingegen die inneren Poren auch für kleine Gasmoleküle nicht zugänglich, können sie der geschlossenen Porosität zugeordnet werden.[1,2,9] Innere Poren können z. B. durch oxidative Aushöhlung der Zentren einzelner Partikel innerhalb eines Aggregats entstehen. Dabei nimmt die Gesamtzahl der Aggregate pro Masse aufgrund der oxidativen Entfernung des Kohlenstoffs zu (s. Kapitel 2.2.3). Ein zweiter Typ der inneren Porosität existiert oberflächennah in den eher ungeordneten Bereichen der Carbon Blacks und entsteht insbesondere bei der thermischen Behandlung bei hohen Temperaturen. Die Porengrößen liegen im Nanometerbereich und können wiederum in drei Kategorien unterteilt werden: in Mikro- (< 2 nm), Meso- (2 – 50 nm) und Makroporen (> 50 nm).[16] Des weiteren wird bei Mikroporen noch zwischen Ultra-Mikroporen (< 0,5 nm) und SuperMikroporen (1-2 nm) unterschieden.[17] Tab. 2.3-1 Klassifizierung der Porengrößen.[16] Kategorie Porengröße Mikroporen < 2 nm Mesoporen 2 – 50 nm Makroporen > 50 nm In der sog. „Netzwerk-Theorie“ wird es hingegen als „irrtümliche Annahme“ bezeichnet, dass die Mikroporosität in Carbon Blacks aus miteinander verbundenen Röhren oder Schichtzwischenräumen besteht.[1,18] in diesem Model geht man vielmehr davon aus, dass die Kohlenstoffatome ein kovalentes, dreidimensionales Netzwerk bilden, in dem eine zufällige, lamellenartige Anordnung beobachtet werden kann. Das Netzwerk hat dabei eine geringe Dichte (< 1 g/cm3) und es sind die Volumenelemente zwischen den Kohlenstoffketten, die die Mikroporosität bestimmen. Wenn solche Volumenelemente bestehen, dann haben sie die Ausmaße von Atomen und Molekülen. Die Struktur des Kohlenstoffatomnetzwerks und die Mikroporosität sind somit eng miteinander verbunden. Die Verbindungskanäle der Mikroporen haben dabei unterschiedliche Größen und sind selbst Teil des Porensystems. Das bedeutet, dass alle Poren sowohl Teil des Adsorptions- als auch des Transportsystems sind. 15 Carbon Black –Struktur und Eigenschaften Das dreidimensionale Netzwerkmodell ergibt sich auch aus der logischen Analyse der Carbon Black Formation und den Molekularsiebeigenschaften der Kohlenstoffe. Sie sind in der Lage Moleküle unterschiedlicher Größe zu adsorbieren. Dabei nimmt die Adsorptionsfähigkeit mit zunehmender Molekülgröße ab, da kleinere Poren immer weniger zugänglich sind. Wird dabei ausschließlich ein Röhrensystem zugrunde gelegt, wäre nur eine Adsorption von solchen Moleküle möglich, die durch die kleinsten Passagen gelangen können (Molekularsiebprinzip). Dies konnte bisher aber nicht beobachtet werden. Die wichtigsten Techniken zur Bestimmung des Porositätsgrades in Carbon Black beruhen auf Dichte- und Gasadsorptionsmessungen. Eine häufig angewandte Methode zur Bestimmung der Porosität, die Quecksilberporosimetrie, hat sich für Carbon Blacks nicht bewährt, da insbesondere bei kleinen Partikelgrößen die notwendigen hohen Drücke zu einer Kompression der Probe führen.[1] 2.3.4 Die Dichte Die Dichte von Carbon Black und anderen Feststoffen kann eine Vielzahl unterschiedlicher Bedeutungen haben. Als die wahre oder tatsächliche Dichte wird im Allgemeinen der Wert bezeichnet, der auf die Mikrokristallinität der Substanz beruht. Bei Carbon Black ist dies die Dichte der Primärpartikel, die etwa zwischen 1,81-1,89 g/cm3 liegen kann.[1] Ein Vergleich mit der Dichte des Graphits (2,266 g/cm3) zeigt, dass beim Carbon Black die C-Atome weniger dicht gepackt sind, was u. a. auf die turbostatische Struktur der Primärpartikel zurückzuführen ist. Beim Übergang vom Nanometer- in den Mikrometerbereich sind es die Aggregate, die die Gesamtdichte der Carbon Blacks bestimmen. Je nach Aggregationsgrad und –form bilden sich größere oder kleinere Hohlräume, die zu einer Verringerung der Dichte beitragen. Im Millimeterbereich bilden die Aggregate locker gepackte Agglomerate mit größeren Hohlräumen. Im Gegensatz zu den Aggregaten ist es nun möglich, durch Pelletieren die Dichte zu erhöhen. Dabei kann die Dichte der Perlen fast das Doppelte des Pulvers erreichen und liegt in der Größenordnung von ca. 0,1 - 0,5 g/cm3.[3,7,8] Aus industrieller Sicht hat die sogenannte Stampfdichte eine große Bedeutung. Sie ist das Verhältnis von Masse zu Volumen eines Stoffes nach „Stampfen“ unter festgelegten Bedingungen. Sie bestimmt das Transportvolumen und die Transportkosten der Carbon Blacks und ist somit von wirtschaftlicher Bedeutung.[3,8] 16 Kapitel 2 2.3.5 Oberflächenchemie Je nach Herstellungsverfahren und Nachbehandlung bestehen Carbon Blacks zu 96 - 99 % aus Kohlenstoff (vgl. Tabelle 2.3.2). Die restlichen Anteile sind Wasserstoff, Sauerstoff, Stickstoff und Schwefel, die größtenteils in funktionellen Gruppen an der Oberfläche chemisch gebunden sind. Die Chemisorption der Heteroatome erfolgt hauptsächlich an Defektstellen der Carbon Blacks. Diese sind meist außerhalb der aromatischen Systeme an Ecken und Kanten zu finden, da an diesen Stellen die Oberflächenenergie am größten ist und eine Adsorption von Gasen und Flüssigkeiten, und somit eine Chemisorption, bevorzugt stattfinden kann. Auch Kohlenstoffatome in Defektposition innerhalb einer Graphitebene können als Sorptionsstellen dienen und die Bildung von Heterocyclen innerhalb des aromatischen Systems ermöglichen.[1,2] Abbildung 2.3-5 zeigt schematisch eine solche Rußoberfläche mit Defektstellen und Heteroatomgruppen. Die Oxid-Gruppen auf der Porenoberfläche haben den größten Einfluss auf die physikochemischen Eigenschaften der Carbon Blacks, wie die Wasseradsorptionsfähigkeit und katalytische, chemische und elektrische Reaktivität. Hauptsächlich bilden sich dabei basische Hydroxyl-, saure Carboxyl- sowie Carbonyl- und Lacton-Gruppen auf der Oberfläche. Bei der Herstellung von Aktivrußen können dabei funktionelle Sauerstoffgruppen mit einem Massenanteil von bis zu 15 % eingeführt werden.[2] Bei den hier untersuchten Furnace Blacks liegt der Sauerstoffgehalt unter 2 Gew.% (s. Tabelle A.1-1). O O H3C CH3 C SH N O S O S H3C HO CH3 O O CH3 O O O O CH3 O O O S O S CH3 H3C HS O O H3C OH Abb. 2.3-5 Rußoberfläche mit Defektstruktur. 17 Carbon Black –Struktur und Eigenschaften Tab. 2.3-2 Ergebnisse aus Elementaranalysen von Pigmentrußen.[3] C Gew.% 98,5 H Gew.% 0,4 N Gew.% 0,1 O Gew.% 0,4 97,3 – 98 0,3 – 0,6 0,2 – 0,3 0,5 – 1 Furnace-Ruß (oxidiert) 96,5 – 97 0,4 – 0,6 0,2 – 0,3 2 Ruß-Typ Flamm-Ruß Furnace-Ruß 2.4 Gas-Ruß (grobteilig) 96,5 1 0,1 2 Gas-Ruß (feinteilig) 94,5 – 96 1 0,1 – 0,2 2,5 – 4 Gas-Ruß (oxidiert) 86,0 – 89 1 0,5 – 0,7 9,0 – 15 Standardanalysemethoden in der Industrie 2.4.1 Bestimmung der Primärpartikelgröße Die mittleren Partikelgrößen können mit Hilfe der Elektronenmikroskopie relativ genau bestimmt werden. Diese Methode ist allerdings relativ zeit – und kostenintensiv und somit als analytische Standardmethode eher ungeeignet. Die Partikelgrößen werden daher meist indirekt über die spezifische Oberfläche bestimmt. Unter Berücksichtigung einer mittleren Carbon Black Dichte ρCB (in g/cm3) kann folgende Formel für sphärische Partikel angewendet werden:[1] d= 6000 (2.4-1) ρ CB σ s Hierbei ist d der Partikeldurchmesser in Nanometern und σs die spezifische Oberfläche (in m2/g). Da die Aggregation die spezifische Oberfläche verringert, muss der Hilfe der Aggregationsgrad ebenfalls berücksichtigt werden. 2.4.2 Bestimmung des Aggregationsgrades Die Aggregatform und –größenverteilung kann ebenfalls mit Elektronenmikroskopie bestimmt werden. Eine häufig angewandte, aber weniger spezifische Methode ist die Öladsorptionsmethode.[1,3] Das Prinzip besteht darin, dass zu 18 Kapitel 2 einem Ruß solange ein Öl hinzugegeben wird, bis das Gemisch bestimmte Fließeigenschaften erreicht. Bei dem Öl handelt es sich um Dibutylphthalat (DBP), das zunächst die Poren der Aggregate füllt. Eine weitere Zugabe führt nur noch zu einer Benetzung der Oberfläche, das sich makroskopisch durch eine Abnahme der Viskosität des Ruß-Öl-Gemisches bemerkbar macht. Die benötigte Menge DBP ist schließlich ein Maß für die Aggregatstruktur und wird in cm3 pro 100 g Ruß angegeben. Ein hoher DBPWert kennzeichnet eine hohe, ein kleiner Wert eine niedrige Struktur. Die DBP-Werte der in dieser Arbeit untersuchten Carbon Blacks sind im Anhang in Tabelle A.1-1 aufgeführt. 2.4.3 Bestimmung der spezifischen Oberfläche Die spezifische Oberfläche σs = S/m beschreibt das Verhältnis zwischen der Oberfläche S einer Substanz zu ihrer Masse m (Einheit: m2/g). Bei nichtporösen Medien kann ein direkter Zusammenhang zwischen Partikelgröße und spezifischer Oberfläche hergestellt werden. Bei Carbon Black ist eine solche Korrelation aufgrund der Aggregation nicht möglich. Daher wurden verschiede Methoden entwickelt, die Oberfläche zu ermitteln. Das grundlegende Prinzip der hauptsächlich angewandten Methoden basiert auf der Adsorption von Molekülen aus flüssiger oder gasförmiger Phase. Zu den drei wichtigsten Methoden gehört die Stickstoffadsorption nach Brunnauer, Emmet und Teller (BETAdsorption), die Adsorption von Cetyltrimethyl-ammoniumbromid (CTAB) aus wässriger Lösung und die Iod-Adsorption. Alle drei Methoden haben sich aufgrund ihrer Einfachheit und Reproduzierbarkeit bewährt und werden auch in der Industrie zur Qualitätskontrolle eingesetzt.[1,2,9,12] Die Oberfläche eines Festkörpers lässt sich schließlich aus der Anzahl der adsorbierten Gasteilchen bei vollständiger Monolayerbelegung bestimmen. S = L a0 Smolek (2.4-2) Smolek ist die, von einem Adsorbatmolekül bei vollständiger Monolayerbelegung besetzte Adsorbentoberfläche und L die Avogadro-Konstante. Unter der Annahme, dass die Anlagerung der adsorbierten Gasmoleküle auf einer Oberfläche die gleiche ist, wie die innerhalb einer Flüssigkeit auf einer ebenen Oberfläche, kommt man zu folgender Formel:[17] 2 S molek M 3 = f ρLL (2.4-3) Carbon Black –Struktur und Eigenschaften 19 Dabei ist ρL die Dichte des Adsorbats in der flüssigen Phase und M seine molare Masse. f ist ein Packungsfaktor, der für 12 nächste Nachbarn in einer Flüssigkeit und 6 innerhalb einer Ebene gleich 1,091 ist. Smolek ist aber nicht nur abhängig von der Größe und Form des Adsorbat-Moleküls, sondern auch von den Oberflächeneigenschaften des Adsorbents. Smolek aus einer vollständigen Monolayerbelegung abzuleiten, wäre daher eine zu starke Vereinfachung. Stickstoff-Adsorption Stickstoff ist das am häufigsten zur Oberflächenbestimmung verwendete Adsorbat. Auch Versuche mit Edelgasen, wie z. B. Argon, Krypton und Xenon wurden vorgestellt, haben sich aber, im Gegensatz zum Stickstoff, als industrieller Standard nicht durchsetzen können. Als Grundlage dient die BET-Adsorptionstheorie, die im Vergleich zur LangmuirAdsorption von einer Mehrfachbelegung der Oberfläche ausgeht. Für eine ausführliche Beschreibung beider Theorien wird auf Kapitel 3.2.2 verwiesen. CTAB-Adsorption Die CTAB-Adsorptionsmethode dient zur Bestimmung der äußeren Oberfläche eines porösen Festkörpers. Dabei wird Cetyltrimethyl-ammoniumbromid (CTAB) in Verbindung mit Natrium-di(2-ethyl-hexyl)sulfosuccinat als Adsorbent eingesetzt.[16] Das CTAB-Molekül ist wesentlich größer als z. B. das Stickstoffmolekül und kann daher nicht in kleine Poren eindringen. Der Beitrag der inneren und äußeren Porosität zur Gesamtoberfläche wird praktisch eliminiert und man bestimmt somit nur die „glatte“ Oberfläche eines Substrats, wie sie z. B. von Polymeren bei Carbon Black Partikeln „gesehen“ wird. Die Kombination mit der BET-Methode würde hingegen die innere Oberfläche einer porösen Substanz liefern.[4,8,13] Iod-Adsorptionszahl Die Bestimmung der Iodadsorption in Carbon Black ist ein bei der Qualitätskontrolle häufig angewandtes Verfahren. Die sogenannte Iodzahl gibt dabei die adsorbierte Menge Iod in Milligramm pro Gramm Carbon Black an. Die Konzentration der Iodlösung wird so kalibriert, dass sie mit der N2-Adsorption korreliert werden kann.[3] 20 Kapitel 3 Adsorption und Diffusion in porösen Festkörpern 3.1 Das Konzept der Oberfläche Die Bezeichnung „Oberfläche“ führt bei porösen Festkörpern zu der irreführenden Vorstellung einer zweidimensionale Fläche. Vielmehr handelt es sich hierbei um ein dreidimensionales ungeordnetes Netzwerk aus Kanälen und Poren im Nano- und Mikrometerbereich. Daher ist es sinnvoll bei der Beschreibung des Adsorptionsprozesses von einer Belegung der Porenwände und einem Füllen der individuellen Plätze und Mikroporen zu sprechen.[21,22] Außerdem ist die Bestimmung der Oberfläche eines porösen Festkörpers nicht eindeutig, da keine „Standardmethode“ existiert. Sie ist immer eine Funktion der experimentellen Methode, also systemabhängig. Abbildung 3.1-1 soll dies verdeutlichen. 1 Abb. 3.1-1 2 Schematische Darstellung der Adsorption in einem porösen Festkörper. Bei gleichem Porenvolumen sind je nach Größe des Adsorbats viele (1) kleine Teilchen bzw. (2) wenige große adsorbiert. Für die großen Teilchen sind zudem nicht alle Poren zugänglich. 21 Adsorption in porösen Festkörpern 3.2 Adsorption in porösen Festkörpern Wenn eine Oberfläche einem Gas oder Dampf ausgesetzt ist, dann ist die Konzentration des Gases bzw. Dampfes an der Oberfläche größer als in der Gasphase. Dieses Phänomen wird als Adsorption bezeichnet und darf nicht mit der Absorption verwechselt, dass die Aufnahme eines Stoffes oder Energie usw. in einem Festkörper beschreibt.[17] Bei der Adsorption wird zwischen Physisorption und Chemisorption unterschieden. Bei der Physisorption werden die Gasmoleküle reversibel an der Festkörperoberfläche in mehreren Schichten mehr oder weniger stark adsorbiert. Dieser Prozess findet in allen Gas-Festkörper-Systemen statt und nimmt mit steigendem Druck und abnehmender Temperatur zu. Die für die Physisorption verantwortlichen Kräfte sind Van-der-Waalsbzw. Londonsche Dispersionskräfte, die auf induzierte Dipol-Dipol Wechselwirkungen beruhen. Besitzt das Adsorbat einen permanenten Di- oder Multipol, treten zusätzliche Wechselwirkungen auf. Die Adsorptionsenergien liegen im Bereich der Kondensationswärme, so dass physisorbierte Moleküle leicht durch Druckverminderung (Vakuum) oder Temperaturerhöhung von der Oberfläche entfernt werden können. Wird eine chemische Bindung zwischen den Adsorbent- und Adsorbatmolekülen geknüpft, spricht man von Chemisorption. Dabei kann sich maximal eine Monolayerschicht auf der Adsorbentoberfläche ausbilden. Die Adsorptionsenergien liegen im Bereich chemischer Reaktionsenthalpien und ist somit wesentlich größer als bei der Physisorption. Eine Entfernung der chemisorbierten Schicht ist daher nur durch Aufbrechen chemischer Bindungen und somit unter hohem Energieaufwand möglich. Bei dem in dieser Arbeit untersuchten System Xenon – Carbon Black findet ausschließlich Physisorption statt. Daher bezieht sich die Verwendung des Begriffs der Adsorption im folgenden ausschließlich auf die Physisorption. Der Adsorptionsprozess selbst ist ein dynamischer Prozess, d. h. während der Adsorption diffundieren die Gasteilchen durch das Netzwerk der Mikro- und Mesoporen. Die Verweildauer innerhalb einer Pore kann je nach Größe zwischen einer Pikosekunde und mehreren Jahren betragen. Hat sich erst ein Gleichgewicht zwischen der adsorbierten Phase und dem Adsorbent gebildet, findet innerhalb einer Pore ein kontinuierlicher Austausch zwischen den adsorbierten Atomen und denen in der Gasphase statt. Die Frequenz, mit der ein Atom 3 12 adsorbiert und wieder desorbiert wird, kann zwischen 10 und 10 bzw. Molekül Hz betragen.[2] 22 Kapitel 3 3.2.1 Adsorptionsenergien in mikroporösen Systemen Die potentielle Energie eines Gasmoleküls in der Nähe einer Oberfläche ist abhängig von vom Abstand z und seiner relativen Lage (x,y) zur Oberfläche. Unter der Annahme, dass die Oberfläche chemisch inert ist, wird die Gas-Festkörper-Wechselwirkungsenergie E nur durch die Änderung der potentiellen Energie des Gasmoleküls bestimmt. Zudem wird angenommen, dass die Wechselwirkungsenergie die Summe der paarweise auftretenden Anziehungs- und Abstoßungskräfte ist. Für ein einfaches System, wie z. B. bei der Adsorption eines monoatomaren, unpolaren Gasteilchens auf einer unpolaren Oberfläche, kann die Wechselwirkungsenergie in der allgemeinen Lennard-Jones-Form beschrieben werden:[18] E (z ) = B ij ∑ ij r0 z ij 12 − C ij ∑ ij r0 z ij 6 (3.2-1) Hierbei ist zij der Abstand zwischen dem Adsorbatatom i und dem Adsorbentatom j auf der Festkörperoberfläche und Bij und Cij sind spezifische Abstoßungs- und Anziehungskonstanten im Gas-Festkörper-System. r0 ist der Abstand von der Oberfläche, bei der die Potentialkurve ihr Minimum erreicht und entspricht in den meisten Fällen der Summe der Van-der-Waals-Radien des Adsorbat- und Adsorbentmoleküls. Der Verlauf der Potentialkurve in Abhängigkeit vom Abstand z ist in Abbildung 3.2-1 dargestellt. E(z) z 0 x y Abb. 3.2-1 r0 Abstand z Schematische Darstellung der Adsorption eines Gasatoms auf einer Oberfläche. Zusätzlich ist der Verlauf der Lennard-Jones-Funktion in Abhängigkeit vom Abstand z abgebildet. 23 Adsorption in porösen Festkörpern Das Lennard-Jones-Potential ist nur gültig in nichtporösen und makroporösen Systemen, in denen die Abstände zwischen gegenüberliegenden Porenwänden so groß sind, dass ein Gasmolekül stets nur die Wechselwirkungskräfte einer Oberfläche spürt. In Meso- und Mikroporen ist dies nicht mehr der Fall. Neben der Größe und den chemischen Eigenschaften der Adsorbatmoleküle, sind es vor allem die geometrischen und energetischen Eigenschaften der Mikroporen, die eine wichtige Rolle bei der Adsorption spielen. So nimmt die Adsorbat-Adsorbent-Wechselwirkungsenergie stark zu, wenn die Physisorption in Poren stattfindet, deren Durchmesser in der Größenordnung des Adsorbat-Durchmessers liegen. Im Folgenden werden daher die Potentialkurven exemplarisch für ein Gasteilchen im Raum zwischen zwei unendlich ausgedehnten Ebenen sowie in einer sphärischen Pore vorgestellt (vgl. Abbildung 3.2-2). z Rs z Rsph 2Rs-z 2Rsph-z Abb. 3.2-2 Adsorption eines monoatomaren Gasteilchens (a) in einer sphärischen Pore und (b) zwischen zwei unendlich ausgedehnten Schichten. Die Potentialfunktion Es(z) für ein Gasteilchen zwischen zwei unendlich ausgedehnten Schichten mit dem Abstand d = 2Rs, und dem Adsorptionsenergieminimum E*s einer einzelnen, chemisch äquivalenten Oberfläche, kann geschrieben werden als [19] 10 10 * 1 r0 r + 0 E s (z) = E s 5 2R s − z 3 z 4 r 1 r0 + 0 − z 2 2R s − z 10 4 (3.2-2) Es* ist die Minimumenergie im Lennard-Jones-Potential (z = r0) für einen unendlichen Abstand der Schichtebenen (Rs → ¶) und berechnet sich aus E s* = 6 E 12 π n r 02 5 (3.2-3) 24 Kapitel 3 E12 ist die minimale Wechselwirkungsenergie zwischen einem Adsorbat- und einem Adsorbentatom (Teilchen 1 und 2) , die sich im minimalen Abstand r0 zueinander befinden. n ist die Anzahl der wechselwirkenden Zentren pro Oberfläche. In gleicher Weise liefert die Integration des Lennard-Jones-Potentials über die Anzahl der Adsorptionsplätze einer Kugeloberfläche mit dem Radius Rsph die Gesamtenergie eines Teilchens im kürzesten Abstand z zur Oberfläche.[20] 10 R 1 r 0 20 * r E sph ( z ) = E sph − 0 R − z 10 2R − z 3 z * E sph = 2E s* = mit 10 4 1 r r 0 − 0 − z 4 2R − z 4 12 E12 π n r02 5 (3.2-4) (3.2-5) Für die Adsorption von Xenon auf graphitähnlichen Oberflächen wurden bereits zahlreiche theoretische und experimentelle Untersuchungen zur Bestimmung der Minimumsenergie E und dem dazugehörigen Abstand r0 durchgeführt. Ein Überblick über die bisher in der Literatur veröffentlichten Ergebnisse ist in Tabelle 3.2-1 gegeben. Tab. 3.2-1 Energien und minimale Abstände bei der Adsorption von Xenon auf graphitähnlichen Oberflächen. Vergleich mit Xenon-Benzol und Xenon-Kohlenstoff Wechselwirkungen. System Xe → Graphit Xe → Benzol Xe → C in Graphit E Abstand Methode r0 /nm /kJ⋅mol-1 0,326 15,92 Experimentell Literatur Vidali 1991 [21] 0,352 16,40 Theoret. 0,366 14,46 6-12 Lennard-Jones-Potential Crowell 1963 [22] 0,359 16,07 Experimentell 0,366 16,03 6-Exp Buckingham-Potential Rybolt 1978 [23] 0,340 - Experimentell Klein 1984 [24] 0,375 15,46 4-10 Lennard-Jones-Potential Everett 1976 [19] 0,389 7,20 Ab Initio MP2* Møller-Plesset Theorie 0,381 5,40 6-12 Lennard-Jones-Potential 0,375 4,10 4-10 Lennard-Jones-Potential Everett 1976 [19] Hobza 1992 [25] 25 Adsorption in porösen Festkörpern Mit den Ergebnissen von Everett und Powl,[19] mit r0 = 0.375 nm und E* = 15,46 kJ/mol, ist in Abbildung 3.2-3 der Verlauf der beiden Potentialkurven für ein Xenonatom zwischen zwei unendlich ausgedehnten Schichten und in einer sphärischen Pore für verschiedene Radien R dargestellt. Im Vergleich zu einer einzelnen, ebenen Oberfläche sind die Potentialkurven durch zwei Minima gekennzeichnet, deren Beträge mit abnehmendem Porenradius stark zunehmen. Die Potentialdifferenz zwischen Porenwand und Porenmitte wird dabei mit abnehmendem Radius kleiner. Dies hat zur Folge, dass die Desorption der an der Porenwand adsorbierten Teilchen erleichtert und die Desorptionsrate erhöht wird. Darüber hinaus ist die Adsorptionsenergie einer sphärische Pore bei gleichen Porenwandabständen um ein Vielfaches größer als im Raum zwischen zwei parallelen Schichten. (a) 0,0 (b) 0,0 -2,0 -0,8 R=1 -1,2 R=2 -4,0 E(z)/Es E(z)/Es * * -0,4 R=0,5 R=2 -6,0 R=1 -8,0 -10,0 -1,6 Radius R in nm -2,0 -2,0 -1,5 -1,0 -0,5 0,0 0,5 R=0,5 Radius R in nm 1,0 1,5 Abstand von der Porenmitte /nm Abb. 3.2-3 R=0,4 -12,0 R=0,4 2,0 -14,0 -2,0 -1,5 -1,0 -0,5 0,0 0,5 1,0 1,5 2,0 Abstand von der Porenmitte /nm Lennard-Jones-Potentialkurven für ein Xenonatom (a) zwischen zwei unendlich ausgedehnten Schichten und (b) in einer sphärischen Pore. 3.2.2 Adsorption in nicht- und makroporösen Strukturen Die Quantifizierung der physikalischen Adsorption von Gasen auf Festkörperoberflächen erfolgt über die sogenannte Adsorptionsisotherme. Sie beschreibt die Abhängigkeit der spezifischen Adsorbatmenge - die relative Menge Adsorbat pro Masse, Volumen oder Oberfläche Adsorbent - vom relativen Gleichgewichtsdruck p/ps bei konstanter Temperatur (ps ist der Sättigungsdampfdruck).[17,26] In nicht- bzw. makroporösen Bereichen werden die Anziehungs- und Abstoßungskräfte über das Lennard-JonesPotential einer einzelnen Oberfläche beschrieben und die Adsorptionstheorien von Langmuir bzw. Brunnauer, Emmet und Teller (BET) können angewendet werden.[4] Beim Langmuir-Modell wird die Oberfläche eines Festkörpers im allgemeinen als eine Reihe 26 Kapitel 3 vieler äquivalenter Adsorptionsplätze angesehen, deren Besetzungswahrscheinlichkeit nicht davon abhängt, ob und wie die benachbarten Plätze belegt sind. Es handelt sich hierbei vielmehr um ein kinetisches Model, das davon ausgeht, dass im Gleichgewichtszustand die Adsorptions- und Desorptionsrate gleich groß sind. Zudem lässt dieses Model nur eine Monolayerbelegung der Oberfläche zu, d. h. die Oberfläche wird nur mit einer Adsorbatschicht belegt. Der Belegungsgrad θ in Abhängigkeit vom Druck p lautet schließlich:[27,28] θ = KL p n( p ) = nmax K L p + 1 (3.2-6) n(p) ist die adsorbierte Stoffmenge in Abhängigkeit des Drucks p und nmax die maximale Stoffmenge bzgl. einer Monolayerbelegung. Die Langmuir-Konstante KL beschreibt das Verhältnis der Adsorptions- und Desorptionsrate (KL = kads/kdes) und ist abhängig von der Temperatur.[28] Der Verlauf der Langmuir-Isothermen ist in Abbildung 3.2-3a für verschiedene Werte von KL dargestellt. In der BET-Theorie ist die Adsorption nicht auf eine einzelne Monolayerschicht beschränkt, sondern die einzelnen Substratschichten können jeweils als Oberflächen für eine weitere Adsorption dienen. Die Isotherme verläuft daher mit steigendem Druck gegen unendlich (Abbildung 3.2-3). Die Gleichung lautet dazu:[26] θ = c( p / ps ) a = a0 (1 − ( p / ps ))(1 − (1 − c )( p / ps )) (3.2-7) Anstelle des Drucks p wird hier der relative Druck p/ps verwendet, wobei ps der Sättigungsdampfdruck des Adsorbats ist. c ist eine Konstante, die mit der Adsorptionsenergie E über Gleichung 3.2-8 in Zusammenhang steht. E = RT ln c (3.2-8) Falls die Anzahl der adsorbierten Schichten auch beim Sättigungsdampfdruck auf N begrenzt ist, ergibt sich folgende Gleichung:[17] θ = c ( p / ps ) 1 − (N + 1)( p / ps ) N + N ( p / ps ) N +1 (1 − ( p / ps ))(1 − (1 − c )( p / ps )) 1 + (c − 1)( p / ps ) − c( p / ps )N +1 (3.2-9) Wenn N unendlich groß wird, geht Gleichung 3.2-9 in Gleichung 3.2-7 über. Für N = 1 erhält man die Gleichung der Langmuir-Isothermen. 27 Adsorption in porösen Festkörpern 6 Langmuir KL = 10 bar 1,0 1 bar θ -1 BET 5 -1 4 θ 3 0,5 0,1 bar 2 -1 c = 100 10 0,1 1 B 1 0,0 0 2 4 6 8 10 0 0,0 0,2 Druck p /bar 0,4 0,6 0,8 1,0 Relativer Druck p/ps Abb. 3.2-3 Langmuir- und BET-Isothermen für verschiedene Werte von KL bzw. c. Die BET-Isotherme verläuft bei hohen Drücken gegen unendlich, da die adsorbierten Schichten jeweils als Substrat für eine weitere Adsorption dienen. 3.2.3 Adsorption in Mikroporen Die Adsorption von Gasen und Flüssigkeiten in mikroporösen Festkörpern wurde ausführlich von Dubinin et al. untersucht.[29-34] Aufgrund des geringen Porendurchmessers der Mikroporen (< 2 nm) kann das Adsorbat innerhalb der Poren nicht mehr als separate Phase aufgefasst werden. Der Adsorptionsprozess ist somit dem Lösungsprozess sehr ähnlich, da aus makroskopischer Sicht die Adsorbent – Adsorbat Grenzfläche keine physikalische Bedeutung hat (Einphasensystem). Aus atomarer Sicht stellt sich hingegen die Adsorption als Porenfüllung in Räumen mit Adsorptionskraftfeldern (adsorption force field) dar. Das Konzept der Oberfläche verliert somit seine Bedeutung und der Grenzadsorptionswert a0 der Adsorptionsisothermen ist dem vollständigen Füllen des Mikroporenvolumens gleichzusetzen. Die Adsorption in Mikroporen ist durch eine Änderung im chemischen Potentials des Adsorbats gekennzeichnet. Zudem ist für Mikroporen ein höheres Adsorptionspotential im Vergleich zu einem chemisch äquivalenten meso- bzw. nichtporösen Feststoff charakteristisch (vgl. Kapitel 3.2.2). Die differentielle molare Arbeit der Adsorption A (nicht zu verwechseln mit der Adsorptionsenergie) ist dabei gegeben durch [31] ( A = µ − µ s = µ ∗ − RT ln p − µ ∗ − RT ln ps bzw. A = −∆G = RT ln ps p ) (3.2-10) (3.2-11) 28 Kapitel 3 Wobei µ* das Standardpotential unter Normbedingungen und µs das chemische Standardpotential der flüssigen Phase ist, die bei der Temperatur T und dem Dampfdruck ps mit der Gasphase im Gleichgewicht steht. Anstelle der absoluten Adsorptionsarbeit A wird diese häufig im relativen Verhältnis zur Adsorptionsenergie E dargestellt, die im Lennard-Jones-Potential die charakteristische Minimumenergie bzgl. der Porengröße beschreibt. Für einen bestimmten Füllgrad θ0 ist A = E. Unter der Annahme einer Weibull-Verteilung [35] der Porengrößen haben Dubinin und Astakhov (DA) schließlich folgende Gleichung für die Adsorption in Mikroporen empirisch bestimmt:[31] A n F (A ) = 1 − exp − βE (3.2-12) F(A) gibt den Anteil des freien Adsorptionsvolumens der Mikroporen wieder, d. h. 1-θ, wobei für den Adsorptionsgrad θ somit gilt: θ= A n a = exp− a0 β E (3.2-13) β ist der sog. Ähnlichkeitskoeffizient, der für Benzol als Standard den Wert eins annimmt. Für Xenon ist β = 0,5.[31,32] Für n = 2 geht Gleichung 3.2-13 über in die von Dubinin und Radushkevich (DR) bereits 1947 empirisch ermittelte Gleichung der Adsorption in mikroporösen Kohlenstoffen.[17] I. A. kann der Exponent n, je nach Porengröße und Porengrößenverteilung, Werte zwischen 1.5 und 3 annehmen. Für kleine Poren zwischen 0,4 und 0,5 nm mit Molekularsiebeffekt, ist n = 3.[31,36] Der gleiche Wert wurde auch für größere (0,7 nm), aber homogene Mikroporen gefunden.[37] Größere Poren sowie inhomogenere Porengrößenverteilungen führen zu Werten zwischen 1.5 und 2.[31] In Abbildung 3.2-4 ist die normierte DA-Adsorptionsisotherme aus Gleichung 3.2-13 für verschiedene Adsorptionsenergien E und Exponenten n dargestellt. Alle Kurven erreichen bei höheren Drücken ein Plateau. Je kleiner E und je größer n, desto eher wird der Grenzwert der Adsorption erreicht. 29 Adsorption in porösen Festkörpern 1,00 1,00 (a) (b) E = 4 kJ/mol 0,75 0,75 8 a/a0 12 0,50 16 0 5 10 15 20 0,25 25 30 0,00 0 5 p /bar Abb. 3.2-4 1 2 0,50 0,25 0,00 n=3 a/a0 10 15 20 25 p /bar Graphische Darstellung der DA-Isothermen (Gleichung 3.2-13) mit β = 0,5 und (a) n = 2, (b) E = 12 kJ/mol. 3.2.4 Adsorption von Gasen oberhalb der kritischen Temperatur Experimentelle Ergebnisse zeigen, dass das Adsorptionsverhalten von Gasen in Mikroporen beim Übergang in den superkritischen Bereich keiner sprunghaften Änderung unterliegt.[2] Das ermöglicht für das Konzept des Porenfüllens in Mikroporen oberhalb der kritischen Temperatur einen Standardzustand festzulegen. Unter Verwendung von Gleichung 3.2-14 muss zunächst ein effektiver Wert für den Sättigungsdampfdruck ps ermittelt werden.[31] log ps = M − N T (3.2-14) Die Konstanten M und N in dieser Gradengleichung können aus den superkritischen Werten pk und Tk, sowie aus den Werten des Siedepunktes Tb bei 1 bar Standarddruck ermittelt werden. Für Xenon sind die entsprechenden Ergebnisse in Tabelle 3.2-2 aufgelistet. Der Sättigungsdampfdruck für Xenon oberhalb der kritischen Temperatur beträgt somit ps = 62,57 bar. An anderer Stelle wird ps durch τ2pk ersetzt, wobei τ =T/Tk ist. Für T = 293 K ergibt sich so ein Wert von ps = 60,16 bar.[29] 30 30 Kapitel 3 Tab. 3.2-2 Siedetemperatur und kritische Daten von Xenon, sowie die Parameter M und N aus Gleichung 3.2-14. Parameter Wert Tb (1 bar) 165,00 K 58,77 bar pk Tk 289,75 K M 4,1141 N (1 bar) 679,44 K ps (293 K) 62,57 bar Experimentelle Ergebnisse haben auch gezeigt, dass bei relativ kleinen Füllgraden, die normalerweise bei hohen Temperaturen auftreten, sich die Dampf- bzw. Gasadsorptionsisothermen mikroporöser Adsorbentien praktisch linear verhalten.[38] Für die Adsorptionsisotherme in Gleichung 3.2-13 gilt somit in erster Näherung a ≈ Kp (3.2-15) Die Konstante K lässt sich schließlich berechnen zu [29] a0 E K= exp(n − 1) ps nRGT E nRGT 1 n −1 (3.2-16) 3.2.5 Adsorption in Graphit und Carbon Black Dubinin hat mit der Charakterisierung der Adsorption in Mikroporen und der Theorie des Porenfüllens Pionierarbeit geleistet. Zahlreiche experimentelle Untersuchungen an mikroporösen Carbon Blacks und Active Blacks wurden von ihm durchgeführt. Dabei wurde hauptsächlich Benzol als Adsorbat verwendet und die Isothermen bei Temperaturen unterhalb des kritischen Wertes bestimmt.[30-34] An anderer Stelle wird Stickstoff als Adsorbat zur Charakterisierung mikroporöser und graphitisierter Carbon Blacks benutzt.[39-41] Die Adsorption von Gasen und Dämpfen in porösen Carbon Blacks kann dabei in zwei Prozesse unterteilt werden: [17,42,43] 1. Füllen der Mikroporen, beschrieben durch die Theorie nach Dubinin 2. Physikalische Adsorption an den Oberflächen der Meso- und Makroporen Adsorption in porösen Festkörpern 31 Dabei findet in erster Linie Adsorption in den Mikroporen statt. Poren in der Größenordnung von 0,6 - 0,8 nm zeigen aufgrund des Siebeffektes zusätzlich selektive Eigenschaften. Der relative Beitrag der Meso- und Makroporen zur Adsorption ist insbesondere bei mikroporösen Carbon Blacks als gering einzustufen. Wie andere Kohlenstoffe auch besitzen Carbon Blacks aktive Zentren, die das Adsorptionsverhalten nachhaltig beeinflussen können. Sie können dazu führen, dass die Adsorptionsplätze nicht mehr äquivalent sind, und dass ein erstes Adsorbatmolekül die Adsorption des zweiten steuert. Es ist also wichtig, die Adsorption sowohl von einem strukturellen als auch von einem chemischen Standpunkt aus zu charakterisieren. Weiterhin kann davon ausgegangen werden, dass die Struktur in Carbon Blacks inhomogen ist und zahlreiche energetisch unterschiedliche Adsorptionsplätze vorhanden sind (vgl. Kapitel 2). Unter Berücksichtigung verschiedener Adsorptionsplätze i mit der Adsorptionsenergie Ei kann die gesamte Adsorptionsmenge ages als Summe der einzelnen Fraktionen ai beschrieben werden.[34,44] Aus Gleichung 3.2-13 wird dann ages = ∑ i A a0i exp− βE i n (3.2-17) Anhand experimenteller Ergebnisse aus Adsorptionsmessungen in mikroporösen Kohlenstoffen, legte Dubinin den Exponent auf n = 2 fest.[31] Für Ultramikroporen in Active Carbons ist aber auch ein Wert von n = 3 gefunden worden.[30] Der Mesoporen-Anteil in mikroporösen Carbon Blacks ist meist gering und hat daher kaum Einfluss auf die Adsorption. Er nimmt aber mit zunehmendem Graphitisierungsgrad zu und in bestimmten Fällen ist es sinnvoll, die Menge Adsorbat in den Mesoporen zu bestimmen um so Rückschlüsse auf die Mesoporenoberfläche zu erhalten. Nach Dubinin und Kadlec besteht die gesamte Adsorbatmenge ages in Carbon Blacks aus der Summe der einzelnen Fraktionen ami und ame der Mikro- und Mesoporen.[30,45] ages = ami + ame = ami + γS me (3.2-18) Wobei γ die Adsorbatmenge pro Oberfläche bei einer bestimmten Temperatur und Sme die Oberfläche der Mesoporen ist. Stickstoffadsorptionsmessungen auf graphitisierten Carbon Black Oberflächen zeigen außerdem, dass die Oberflächenheterogenität mit steigender Partikelgröße und Kristallinität zunimmt.[46,47] Die Defektstruktur hat dabei nachhaltigen Einfluss auf das 32 Kapitel 3 Adsorptionsverhalten. So konnte über Computersimulationen gezeigt werden, dass in Oberflächenporositäten zuerst Adsorption an den „Grubenwänden“ stattfindet, gefolgt von einem Füllen der Gruben und eine weiteren Adsorption an den verbliebenen externen Oberflächen.[40,48] Neben dem standardmäßig verwendeten Stickstoff können auch Edelgase als Adsorbate bei der Oberflächenbestimmung eingesetzt werden. Dabei ist zu beachten, dass insbesondere die Xenonatome leichter zu polarisieren sind (α(N2)=1,74⋅10-24 cm3, α(Xe)=4,09⋅10-24 cm3), d. h., die Dispersionswechselwirkungen mit den Oberflächenatomen des Adsorbents sind groß, wodurch ein hohes Maß an Lokalisierung zu erwarten ist.[17] Die von einem Xenonatom belegte Oberfläche SXe kann bei unporösen Medien zwischen 18,2 und 25 Å2 bei 77 und 90 K liegen. Lander und Morrison fanden für Xenon auf Graphit bei 90 K mit 15,7 Å2 einen kleineren Wert in der dichtgepackten Ebene als im Gitter (16,8 Å2).[17] Man schloss daraus, dass die Xenonatome in den Kohlenstoffhexagons eingetragen ist und dadurch eine notwendige laterale Kompression erleidet. 3.3 Diffusion in porösen Festkörpern 3.3.1 Freie und gehinderte Diffusion Als Diffusion wird i. A. die Teilchenwanderung innerhalb eines Systems bezeichnet, wobei zwischen zwei unterschiedlichen Prozessen unterschieden werden muss: erstens der Transportdiffusion und zweitens der Selbstdiffusion. Als Transportdiffusion wird die Wanderung der Teilchen bezeichnet, die durch einen Gradienten im chemischen Potential hervorgerufen wird. Als Ursachen sind partielle Konzentrationsunterschiede innerhalb des Systems zu nennen. Die quantitative Beschreibung erfolgt mit Hilfe des 1. Fickschen Gesetzes:[28] ∂c J i = −D i i ∂x j ≠i (3.3-1) Hierbei ist Ji die Diffusionsstromdichte, Di der Diffusionskoeffizient und (∂ci/∂x) der Konzentrationskoeffizient der Komponente i in x-Richtung. Diffusion in porösen Festkörpern 33 Selbstdiffusion findet hingegen auch in Systemen statt, die sich thermodynamisch im Gleichgewicht befinden. Sie ist eine zufällige, translatorische, auf die interne kinetische Energie beruhende Molekülbewegung in einer gasförmigen oder flüssigen Phase. In der Literatur wird sie auch häufig als Brownsche Molekularbewegung bezeichnet.[39] Man kann davon ausgehen, dass es sich bei der Bewegung von Gasteilchen in geschlossenen Systemen, wie die in dieser Arbeiten untersuchten Xenongas-Proben, ausschließlich um Selbstdiffusion handelt. Die Bezeichnung Diffusion wird sich daher im Folgenden ausschließlich auf die Selbstdiffusion beziehen. In gleicher Weise ist D somit der Diffusionskoeffizienten der Selbstdiffusion. Beim Diffusionsprozess muss außerdem zwischen einer freien und einer gehinderten Diffusion unterschieden werden. Die freie Diffusion tritt in homogenen Systemen, wie z. B. Flüssigkeiten und Gasen, auf, in denen die Wanderung der Teilchen nur durch Stöße untereinander gestört wird. Dabei nimmt die Kollisionswahrscheinlichkeit mit steigender Dichte und Temperatur zu. Von Stokes und Einstein wurde hierzu eine Gleichung aufgestellt, die die Diffusionskonstante D in Abhängigkeit vom hydrodynamischen Radius rh der diffundierenden Teilchen und der Viskosität η des gesamten Mediums beschreibt.[28] D= RT 6 π r hη (3.3-2) Die von einem Teilchen im Zeitraum ∆ zurückgelegte mittlere quadratische Weglänge < r 2 > wird durch die Einstein-Smoluchowski-Gleichung beschrieben [28] < r 2 > = 6D∆ (3.3-3) und gilt für eine Bewegung in alle drei Raumrichtungen. Aus der kinetischen Gastheorie geht hervor, dass die mittlere zurückgelegte freie Weglänge eines freien Gases von seiner mittleren Geschwindigkeit < c 2 > und der Kollisionsfrequenz νS abhängt. <r2 > ≈ < c2 > νS (3.3-4) Die mittlere Geschwindigkeit eines Gases wird hingegen von der Temperatur und der molaren Masse M der Gasmoleküle bestimmt und berechnet sich zu [28] < c2 > = 3RGT M (3.3-5) 34 Kapitel 3 Bei 293 K berechnet sich die mittlere Geschwindigkeit eines Xenonatoms so zu 236 m/s. Gleichung 3.3-5 eingesetzt in 3.3-4 ergibt nach Umstellen einen Ausdruck für die Kollisionsfrequenz νS. νS ≈ 3RGT (3.3-6) M <r2 > Die Druck bzw. Dichteabhängigkeit von νs im Gaszustand ergibt sich aus der Druckabhängigkeit der freien Selbstdiffusion und somit des Selbstdiffusionskoeffizienten (Gleichung 3.3-2). In heterogenen Systemen, wie Gas-Festkörper-Systemen, findet eine gehinderte Diffusion statt, d. h., die diffundierenden Teilchen können nicht nur miteinander kollidieren, sondern auch mit der Oberfläche und den Porenwänden des Festkörpers. Je kleiner die Poren und Kanäle sind und je größer der van-der-Waals-Radius der Moleküle ist, desto höher ist die Kollisionswahrscheinlichkeit mit einer Wand. Ist hingegen der Porenradius groß im Vergleich zur mittleren zurückgelegten Wegstrecke, so überwiegt der Anteil der TeilchenTeilchen-Kollisionen und der Diffusionskoeffizient entspricht dem der freien, ungehinderten Diffusion. Die bisher betrachteten Diffusionsvorgänge beziehen sich ausschließlich auf eine Wanderung durch ein vom Porenradius bestimmten Volumen. Bei einer erhöhten Wechselwirkung zwischen den beobachteten Teilchen und den Porenwänden findet zusätzlich eine Adsorption an den Porenwänden statt. Die adsorbierten Teilchen bilden dabei auf der Oberfläche einen mobilen Film. Die im Vergleich zum freien Volumen stark eingeschränkte Beweglichkeit der Teilchen innerhalb dieses Films führt zur einer Oberflächendiffusion, die mit der Diffusion in einer Flüssigkeit vergleichbar ist. Im Gleichgewicht können die Diffusionsstromdichten in der freien und der adsorbierten Phase in erster Näherung als unabhängig voneinander angesehen werden; sie verhalten sich somit additiv. Für ein System mit gehinderter Diffusion und Adsorption setzt sich der effektive Diffusionskoeffizient wie folgt zusammen:[49] Deff = DP + K ´Da (3.3-7) Dp und Da sind die Diffusionskoeffizienten der gehinderten Diffusion in der Pore und der Oberflächendiffusion in der adsorbierten Phase. K´ ist dimensionslos und gibt das Verhältnis der adsorbierten zur freien Teilchenmenge pro Volumeneinheit wieder. 35 Diffusion in porösen Festkörpern 3.3.2 Der Diffusionskoeffizient in mikro- und mesoporösen Festkörpern Eine wichtige Größe bei der Bestimmung des Diffusionskoeffizienten in mikro- und mesoporösen Medien ist die Diffusionszeit ∆. Für die freie bzw. ungehinderte Diffusion ist D unabhängig von ∆, da die Brownsche Bewegung der Teilchen nur durch Stöße untereinander bestimmt wird. Die mittlere freie Weglänge nimmt nach Gleichung 3.3-3 mit der Wurzel aus ∆ zu. Bei der Betrachtung der Teilchendiffusion in einer begrenzten Umgebung, in der z. B. Porenwände eines porösen Festkörpers als undurchdringliche Hindernisse vorhanden sind, zeigt sich stets eine Abhängigkeit des apparenten Diffusionskoeffizienten von der Diffusionszeit. Mitra et al. verwenden den Begriff „Tortuosität“ (Tortuosity) für eine solche gehinderte Teilchenwanderung innerhalb eines Porensystems, auf die im folgenden noch näher eingegangen wird.[50] d ∆1 ∆2 > ∆1 ∆→∞ Abb. 3.3-1 Qualitative Beschreibung der Teilchendiffusion innerhalb einer zylindrischen Pore mit dem mittleren Durchmesser d und zunehmender Diffusionszeit ∆. Der grau unterlegten Bereich beschreibt die partielle Verteilung aller Teilchen, die in ∆ mit der Porenwand kollidieren und somit einer gehinderte Diffusion unterliegen. In Abbildung 3.3-1 ist die gehinderte Teilchendiffusion innerhalb einer zylindrischen Pore schematisch dargestellt. Der grau unterlegte Bereich beschreibt qualitativ den Anteil der Teilchen, die in ∆ mit der Porenwand kollidieren. Im Kurzzeitbereich wird die Diffusion nur von wenigen Teilchen, die sich unmittelbar in der Nähe der Porenwand befinden, gestört. Der größte Teil kann sich frei im restlichen Porenvolumen bewegen. Mit zunehmender Diffusionszeit nimmt die Fraktion der Teilchen zu, deren Diffusion durch die Kollision mit der Porenwand gehindert werden. Die zurückgelegte mittlere freie Wegstrecke nimmt dabei im Vergleich zur freien Diffusion weniger stark zu, was nach Gleichung 3.3-3 zu 36 Kapitel 3 einer Abnahme im Diffusionskoeffizienten führt (s. a. Abbildung 3.3-2). Im Langzeitbereich (∆ → ∞) treffen alle Teilchen mit der gleichen mittleren Häufigkeit auf die Porenwände und die Diffusion kann als gleichmäßig angesehen werden. Dabei wird der Diffusionskoeffizient wieder unabhängig von ∆ und erreicht einen Grenzwert, der direkt proportional zu <r2>. Bei einer geschlossenen sphärischen Pore entspricht <r2>1/2 genau dem Porendurchmesser und der Diffusionskoeffizient geht für ∆ → ∞ gegen null. In Abbildung 3.3-2 ist die Abhängigkeit des Diffusionskoeffizienten von ∆ für die freie und für die gehinderte Diffusion innerhalb einer unendlich ausgedehnten zylindrischen Poren und einer geschlossenen sphärischen Pore graphisch dargestellt. Dfrei D(∆) Dzyl Dsph 0 Diffusionszeit ∆ Abb. 3.3-2 Abhängigkeit des Diffusionskoeffizienten D von der Diffusionszeit ∆. Dfrei ist unabhängig von ∆. Der Diffusionskoeffizient der gehinderten Diffusion in einer zylindrischen Poren Dzyl erreicht einen Grenzwert für ∆ → ∞. In einer geschlossenen sphärischen Pore nimmt Dsph proportional zu ∆-2 ab und geht im Langzeitintervall (∆ → ∞) gegen null. Eine Theorie zur Abhängigkeit des Diffusionskoeffizienten von der Diffusionszeit liefern Mitra et al.[50,51] Sie besagt, dass bei kurzen Diffusionszeiten nicht die geometrischen Eigenschaften der Poren den Diffusionskoeffizienten beeinflussen, sondern nur ihr Verhältnis der Oberfläche S zum Volumen V. Der Zusammenhang zwischen dem effektiven Diffusionskoeffizienten Deff = D(∆)/Dfrei und S/V lautet dazu 37 Diffusion in porösen Festkörpern 4 1 1 1 Deff = 1 − − + R R 12 9 πDfrei ∆ 1 2 + [ 1 S ς Dfrei ∆ + O (Dfrei ∆ )3 / 2 6 V ] (3.3-8) Hierbei sind R1 und R2 Parameter bzgl. der Oberflächenkrümmung der Poren und ζ die Oberflächenrelaxation. Im Gegensatz dazu lassen sich im Langzeitintervall (D(∆) = konstant) aus dem Diffusionskoeffizienten genauere Informationen über Porosität erhalten. Dazu führten Mitra et al. einen empirischen Parameter ein: die Tortuosität α.[50,51] Die Tortuosität berücksichtigt die Abhängigkeit des Diffusionsverhaltens von der Porenform und –orientierung, sowie die Art der Verzweigungen eines Porensystems. Der Diffusionskoeffizient für ein System mit der Porosität ε kann somit definiert werden als D= ε Dzyl α (3.3-9) Wobei Dzyl der entsprechende Diffusionskoeffizient für eine achsensymmetrische, zylindrische Pore ist, deren Radius der untersuchten Pore entspricht. Für Deff formulierten sie folgenden Ausdruck: Deff = β 1 β1 + − 31/ 2 α ∆ ∆ (3.3-10) mit den, von der Mikrostruktur eines Systems abhängenden Konstanten β1 und β2. Die experimentell ermittelten Werte für α liegen meist zwischen zwei und fünf, wobei i. A. die Tortuosität mit abnehmender Porosität ansteigt. Über den Diffusionskoeffizienten D(∆) lassen sich also, je nach Diffusionszeitintervall, Informationen über das Verhältnis S/V bzw. über die Makrostruktur eines porösen Festkörpers, ausgedrückt durch den Tortuositätsfaktor, erhalten. 38 Kapitel 4 NMR-Spektroskopie 4.1 Grundlagen der NMR-Spektroskopie 4.1.1 Kernspins im Magnetfeld Die physikalischen Grundlagen der NMR-Spektroskopie sind in der Literatur bereits sehr ausführlich behandelt worden.[52-59] Im Folgenden wird daher nur auf die, für die 129 Xe- NMR-Spektroskopie relevanten Aspekte eingegangen. Dazu gehören insbesondere die Wechselwirkungen der Kerne im Magnetfeld untereinander und die dazugehörigen Relaxationsmechanismen. Atomkerne mit einer ungerade Nukleonen- bzw. Ordnungszahl besitzen einen Kernspin v v I ≠ 0 , mit dem über Gleichung 4.1-1 ein magnetisches Dipolmoment µ verbunden ist. v v µ = γ hI (4.1-1) Der Koeffizient γ ist das gyromagnetische Verhältnis des Kerns und h die PlanckKonstante dividiert durch 2π. Befindet sich ein Ensemble dieser Kernspins in einem Magnetfeld der Stärke B0, treten zahlreiche Wechselwirkungen der Kerne untereinander auf, die in Quantenmechanik jeweils durch einen Hamilton-Operatoren Ĥ beschrieben werden können. Der resultierende Hamilton-Operator des gesamten Spinensembles setzt sich schließlich aus der Summe der einzelnen Operatoren zusammen. Hˆ = Hˆ Z + Hˆ CS + Hˆ D + Hˆ J + Hˆ Q ... mit Ĥ Z : (4.1-2) Zeeman-Wechselwirkung mit dem angelegten Magnetfeld Ĥ CS : Die chemische Verschiebung Ĥ DC : Direkte bzw. dipolare Kopplung zwischen den Kernen Ĥ SC : Indirekte bzw. skalare Kopplung zwischen den Kernen (J-Kopplung) Ĥ Q : Quadrupolare Kopplung bei Spins mit I > ½ Grundlagen der NMR-Spektroskopie 39 Darüber hinaus treten Wechselwirkungen mit eingestrahlten Radiofrequenz(rf)-Feldern und magnetischen Feldgradienten auf. In der 129 Xe-NMR-Spektroskopie sind hauptsächlich die Zeeman-Wechselwirkung, die chemische Verschiebung und die dipolare Kopplung von Bedeutung und werden daher im Folgenden ausführlicher behandelt. 4.1.1.1 Die Zeeman-Wechselwirkung Die Zeeman-Wechselwirkung ist der dominierende Teil der Gesamtwechselwirkungen und beschreibt die Aufspaltung der entarteten Spinzustände in einem Magnetfeld durch die v v Wechselwirkungen der magnetischen Momente µ mit dem externen Magnetfeld B0 . Der dazugehörige Operator lautet: v v v v Hˆ Z = − µ ⋅ B0 = − γ h I ⋅ B0 (4.1-3) Entsprechend gilt für ein Magnetfeld parallel zu z-Achse: Hˆ Z = −γ h I z B0 (4.1-4) Für einen Kernspin mit I = ½ erfolgt eine Aufspaltung in zwei Energieniveaus Eα und Eβ. Die Energiedifferenz ist direktproportional zur Magnetfeldstärke B0 und lässt sich aus Gleichung 4.1-4 berechnen zu ∆E = γ h B0 (4.1-5) Die Verteilung der einzelnen Spins auf die Energieniveaus im thermischen Gleichgewicht lässt sich mit Hilfe der Boltzmann-Verteilung bestimmen. ∆E Nα = exp − Nβ k T B (4.1-6) Der Koeffizient kB ist die Boltzmann-Konstante und Nα bzw. Nβ sind die Spin-Populationen im niedrigeren und höheren Energiezustand. Die Energiedifferenz ist relativ klein, so dass eine Frequenz ν im Bereich der Radiowellen (m-1) ausreicht, um einen Spinübergang anzuregen. Die Resonanzbedingung ergibt sich aus Gleichung 4.1-5 und der Beziehung ∆E = hν zu 40 Kapitel 4 ν= γ B0 2π (4.1-7) Die Resonanzfrequenz ν ist also nur von der kernspezifischen Konstante γ und der Stärke des Magnetfeldes B0 abhängig, und es zeigt sich, dass erst durch die ZeemanWechselwirkung eine Unterscheidung zwischen verschiedenen Kernspezies in der kernmagnetischen Resonanzspektroskopie ermöglicht wird. 4.1.1.2 Die chemische Verschiebung Nach der bisherigen Betrachtungsweise ist in der NMR-Spektroskopie für jede Kernsorte nur ein Resonanzsignal zu erwarten. Dabei wird aber der Einfluss der den Kern umgebenen Elektronenhülle vernachlässigt. Durch das externe Magnetfeld wird ein eigenes Feld in die Elektronenhülle induziert, dass dem äußeren entgegen wirkt und so zu einer Abschirmung der Kerne in diamagnetischen Atomen und Molekülen führt. Diese Änderung des lokalen Magnetfeldes der Kerne zum externen B0-Feld wird durch den vv Abschirmungstensor σ beschrieben. Der dazugehörige Hamilton-Operator lautet: v vv v Hˆ CS = γh I ⋅ σ ⋅ B0 (4.1-8) Entsprechend verändert sich die Resonanzbedingung der Kerne bzgl. des effektiven Magnetfeldes Beff = (1-σzz)B0, mit der Tensorkomponente σzz bzgl. der z-Achse (B0 II z), zu ν = γ γ (1 − σ zz )B0 = Beff 2π 2π (4.1-9) Leichte Veränderungen in der chemischen Umgebung der Atome beeinflussen die Elektronenhülle und somit Beff und die dazugehörige Resonanzfrequenz. Dadurch können Kerne gleicher Sorte aber mit unterschiedlicher chemischer Umgebung in einem NMRSpektrum leicht voneinander unterschieden werden. Die Frequenzverschiebung ∆ν bzgl. eines Standards wird schließlich als chemische Verschiebung bezeichnet. 4.1.1.3 Dipolare Kopplung Benachbarte Kerne können unter Vernachlässigung der Elektronenhüllen durch den Raum direkt miteinander in Wechselwirkung treten, d. h., miteinander koppeln. In der 41 Grundlagen der NMR-Spektroskopie klassischen Beschreibung lässt sich die dipolare Wechselwirkungsenergie ED zwischen v v v den Momenten zweier Spins, µ 1 und µ 2 , mit dem Abstandsvektor r12 , formulieren zu v v v v v v µ 1 ⋅ µ 2 3(r12 ⋅ µ 1 ) ⋅ (r12 ⋅ µ 2 ) ED = v 3 − v 5 r12 r12 (4.1-10) Nach Gleichung 4.1-10 hängt ED stark von dem Abstand der Kerne zueinander ab, nicht aber von der Stärke des Magnetfeldes. Der Ausdruck des dazugehörigen HamiltonOperator Ĥ DC lautet Hˆ DC vv ˆ ⋅ D ⋅ Iˆ 2 = γ 1γ 2 h v3 r 2 I1 (4.1-11) vv Der Kopplungstensor D beschreibt die Abhängigkeit der Energie von der Orientierung der Spins zueinander. Die dipolaren Kopplungen sind besonders in der Festkörper-NMRSpektroskopie von Bedeutung, da aufgrund der Anisotropie der Atome im Gitter viele verschiedene Resonanzfrequenzen resultieren, die schließlich zu einer Linienverbreiterung im NMR-Spektrum führen. Aber auch adsorbierte Gastmoleküle können dipolaren Kopplungen mit den Kernen der Adsorbentoberfläche unterliegen und so einer anisotropen Linienverbreiterung unterliegen. 4.1.1.4 Skalare Kopplung Neben den direkten Kopplungen können Atomkerne, insbesondere in chemischen Verbindungen, auch indirekt über die Bindungselektronen miteinander koppeln. Die jeweiligen Dipolmomente der Kerne können die Bindungselektronenwolke verzerren, so dass das magnetische Moment des benachbarten Kerns beeinflusst wird. Für ein monoatomares Gas hat dies scheinbar keine Bedeutung, wie wir aber später sehen werden, können skalare Kopplungen dennoch zu zusätzlichen Relaxationseffekten in Gasen führen. 42 Kapitel 4 4.1.2 Relaxationseffekte Relaxationseffekte in der NMR-Spektroskopie führen nach Anregung mit einem Radiofrequenz(rf)-Puls zu einer Abnahme der Resonanzintensität mit der Zeit. Werden die zuvor beschriebenen zusätzlichen Wechselwirkungen der Kerne untereinander ausgeschlossen, tragen aus thermodynamischer Sicht nur enthalpische (Spin-GitterRelaxation) und entropische (Spin-Spin-Relaxation) Effekte zur Relaxation bei. 4.1.2.1 Spin-Gitter-Relaxation Die Spin-Gitter-Relaxation, oder longitudinale Relaxation, beschreibt nach Anregung der Kernspins die Rückkehr zur ursprünglichen Boltzmann-Verteilung und der damit verbundenen Wiederherstellung der Gleichgewichtsmagnetisierung M0 (= Ê mz aller Spins im Ensemble parallel zu B0). Die dabei freiwerdende Energie wird an die Umgebung (Gitter) abgegeben. Die Zeitabhängigkeit der Magnetisierung bzgl. der z-Achse (z II B0), Mz, wird durch die Relaxationszeit T1 bestimmt und kann mathematisch durch die Blochsche Gleichung beschrieben werden:[52] M − M0 dM z =− z dt T1 (4.1-12) Den wichtigsten Beitrag zur T1-Relaxation leistet i. A. die dipolare Kopplung zwischen den Kernen. In Gasen tritt sie nur bei Kollisionen der Atome untereinander auf und ist daher in der Regel sehr lang und kann bis zu mehreren Stunden betragen. In heterogenen System können zusätzliche Kollisionen z. B. mit einer Oberfläche zu einer verstärkten Abnahme der Magnetisierung beitragen. 4.1.2.2 Spin-Spin-Relaxation Die Spin-Spin-Relaxation, auch transversale Relaxation genannt, ist hingegen ein Effekt, der nach Auslenkung der Gesamtmagnetisierung aus der z-Achse zum Verlust der Phasenkohärenz der Resonanzfrequenzen gleicher Spins führt und in der Blochschen Gleichung durch die Relaxationszeit T2 bestimmt wird. Die zeitliche Änderung der Magnetisierung bzgl. der x- bzw. y-Achse lautet: 43 Grundlagen der NMR-Spektroskopie dM x,y dt =− M x ,y (4.1-13) T2 Die T2-Zeit bestimmt im NMR-Experiment die zeitliche Intensitätsabnahme des Resonanzsignals und somit die Breite der Resonanzlinie im Spektrum. Die Halbwertsbreite ∆ν1/2 einer homogen Verbreiterten Resonanzlinie lässt sich über die Beziehung ∆ν1/2 = 1/(πT2) bestimmen. Im Gegensatz dazu ist T2 nicht aus der Halbwertsbreite zu ermitteln, da zahlreiche andere Relaxationseffekte zu einer inhomogenen Verbreiterung der Resonanzlinie führen können. Die für die 129 Xe-NMR- Spektroskopie relevanten Effekte werden im Folgenden ausführlicher beschrieben. 4.1.3 Relaxationseffekte in monoatomaren Gasen 4.1.3.1 Dipolare Kopplung In einem monoatomaren Gas mit Kernspin I = ½ erfolgt eine Relaxation hauptsächlich über dipolare Kopplungen während der Kollision zwischen zwei Kernen.[54] Die Relaxationsraten 1/T1 und 1/T2 nehmen proportional mit der Kollisionszeit τc und dem Eigenwert des Hamilton-Operators der dipolaren Kopplung zu (Gleichung 4.1-10). Die Wechselwirkungen sind darüber hinaus nur bei sehr kurzen Abständen r der Kerne wirksam und nehmen schnell mit r-6 ab. Die Beiträge der dipolaren Kopplung zur Relaxation in einem monoatomaren Spinsystem mit gleichen Kernen, sind in den Gleichungen 4.1-14 und 4.1-15 zusammengefasst.[53] 1 3 γ 4 h 2 1 4 = τc + 6 2 2 2 2 2 2 T1 10 r 1 + γ B0 τ c 1 + 4 γ B0 τ c 1 3 γ 4 h 2 5 2 = τc 3 + + 6 2 2 2 T2 20 r 1 + γ B0 τ c 1 + 4 γ 2 B02 τ c2 4.1.3.2 (4.1-15) (4.1-15) Skalare Kopplung Zusätzliche magnetische Wechselwirkungen können auftreten, wenn während der Kollision zweier Atome eine Polarisierung der Elektronenhüllen stattfindet. Dazu wird angenommen, dass beide Atome während der Kollisionszeit τc ein diatomares Molekül 44 Kapitel 4 bilden. Die durch die Polarisierung zusätzlich auftretende direkte Kopplung zwischen beiden Spins ist vernachlässigbar klein, wohingegen eine indirekte Kopplung zu verstärkten Relaxationseffekten führen kann. Da sich beide Spins im 1 S0 Zustand befinden, ist diese Kopplung hauptsächlich skalar und der Relaxationsmechanismus entspricht daher dem zwischen zwei ungleichen Kernen. Dieser Relaxationsmechanismus kann bei Gasen mit großer molarer Masse, wie z. B. Xenon, sogar zu stärkeren Relaxationseffekten führen als die dipolare Kopplung.[54] 4.1.3.3 Anisotropie der chemischen Verschiebung vv Eine zusätzliche Relaxation tritt auf, wenn der Abschirmungstensor σ in Gleichung 4.1-8 nicht symmetrisch ist und durch isotrope Bewegungen nicht ausgemittelt werden kann. Dies ist insbesondere bei Kernen im Festkörper zu beobachten. In einem monoatomaren Gas, wie z. B. Xenon, sind im freien Zustand die Komponenten des Abschirmungstensors parallel (σII) und senkrecht (σ^) zum externen Magnetfeld, aufgrund der sphärischen Elektronenhülle, gleich groß. Im adsorbierten Zustand können die Wechselwirkungen mit den Atomen der Festkörperoberfläche zu einer Polarisierung und „Verformung“ der Elektronenhülle und somit zu ungleichen Abschirmungstensorkomponenten führen. Dieser Anisotropieeffekt hat Auswirkungen auf die chemische Verschiebung der Kerne und wird daher mit Chemical Shift Anisotropie (CSA) bezeichnet. Die Beiträge zu den longitudinalen- und transversalen Relaxationsraten sind in den Gleichungen 4.1-16 und 4.1-17 mathematisch dargestellt.[53,55] 1 2 1 = (σ II − σ ⊥ )2 γ 2 B02 τ c 2 2 2 T1 15 1 + γ B0 τ c 1 2 1 (σ II − σ ⊥ )2 γ 2 B02 τ c 3 + 1 = 2 2 2 T2 15 2 2 1 + γ B0 τ c (4.1-16) (4.1-17) Die magnetische Suszeptibilität einiges Stoffes ist ebenfalls bei der CSA von Bedeutung. Bei diamagnetischen wird der Betrag des Abschirmungstensors erhöht und bei paramagnetischen erniedrigt. Der Einfluss auf die chemische Verschiebung im System Xenon/Carbon Black wird im Kapitel 4.3-9 ausführlich behandelt. Grundlagen der NMR-Spektroskopie 4.1.3.4 45 Chemischer Austausch Die Selbstdiffusion von Atomen kann ebenfalls zu zusätzlichen Relaxationseffekten führen. Insbesondere der Austausch zwischen zwei Positionen unterschiedlicher chemischer Verschiebung und der dabei stattfindende Polarisationstransfer kann die chemische Verschiebung und Linienbreite der NMR-Signale beeinflussen. Eine wichtige Größe ist Austauschzeit τe bzw. die Austauschrate W = 1/τe. Wenn W viel kleiner als die Differenz der chemischen Verschiebung ist (W á ∆δ), dann sind im NMR-Spektrum zwei getrennte Resonanzlinien zu finden, die den Atomen in den jeweiligen Bereichen zugeordnet werden können, und die sich im Vergleich zum Spektrum ohne Austausch durch höhere Halbwertsbreiten auszeichnen (s. Abbildung 4.1-1). Für den Fall einer hohen Austauschrate (W à δ) wird nur eine Resonanzlinie mit mittlerer chemischer Verschiebung erhalten, deren Halbwertsbreite mit steigender Austauschrate (z. B. durch steigende Temperatur) abnimmt.[53,55] Vollständiger Austausch Kein Austausch Chemische Verschiebung Abb. 4.1-1 Koaleszenz zweier Resonanzsignale mit zunehmendem chemischen Austausch. Die Position des gemittelten Signals wird auch der Schwerpunkt des Spektrums genannt und hängt von den Populationen Pi der Kerne und der chemischen Verschiebung in Position i ab. Er berechnet sich für einen Austausch zwischen zwei Positionen A und X zu 46 Kapitel 4 ∆= PA δ A + PX δ X PA + PX (4.1-18) Die Linienbreite des Signals ergibt sich schließlich bei schnellem Austausch aus 1 1 = + M 2τ e * T 2 T2 (4.1-19) Hierbei ist M2 die Summe der Momente zweiter Ordnung der Resonanzlinien ohne Austausch: M2 = ∑ P (δ i − ∆) 2 i (4.1-20) i 4.2 PFG-NMR-Spektroskopie Die PFG-NMR-Spektroskopie ist eine Methode zur Untersuchung der translatorischen Bewegung von Molekülen in verschiedenen Phasen und Systemen. Im Vergleich zur hochauflösenden NMR-Spektroskopie, die ein möglichst homogenes Magnetfeld erfordert, werden hier gezielt temporäre Feldinhomogenitäten erzeugt, die zu einer Ortskodierung der Moleküle führen. Die temporären Feldinhomogenitäten werden durch gepulste lineare Magnetfeldgradienten in x-, y- oder z-Richtung zusätzlich zum homogenen B0-Feld erzeugt. In anderen NMR-Experimenten wird dieses Verfahren auch zur Wasserunterdrückung [60] , zur Selektion einzelner Spin-Kohärenzen oder bei der Bildgebung (Magnetic Resonance Imaging)[61-64] verwendet. 4.2.1 Funktionsweise der PFG-NMR-Spektroskopie Ein von Stejskal und Tanner [65] modifiziertes Hahn-Echo (HE)-Experiment bildet die Grundlage der heute verwendeten Pulsprogramme in der PFG-NMR-Spektroskopie. Sie haben die bekannte HE-Sequenz mit zwei Pulsen eines linearen Magnetfeldgradienten erweitert, die den refokussierend wirkenden 180°-Puls umschließen (s. Abbildung 4.2-1). Anhand dieser Pulssequenz soll nun die genaue Funktionsweise der PFG-NMR erläutert werden. 47 PFG-NMR-Spektroskopie 180° 90° Akquisition τ1 δG τ1 G δG G in der ∆ Abb. 4.2-1 Hahn-Echo-Pulssequenz PFG-NMR-Spektroskopie. Die normale HE-Sequenz ist durch zwei Gradientenpulse der Länge δG und Stärke G erweitert (grau unterlegt). ∆ ist die Diffusionszeit der beobachteten Teilchen. In Abbildung 4.2-2 ist zudem das Spinverhalten eines ortsfesten und eines mobilen Kernspins während des Experiments schematisch dargestellt. Man geht zunächst von einem Spin-Ensemble aus, dass sich im thermischen Gleichgewicht befindet und im Magnetfeld B0 II z die Gesamtmagnetisierung Mz aufweist. Ein 90°-Puls eines Radiofrequenz rf-Feldes senkrecht zu z dreht die Gesamtmagnetisierung in die x,yEbene. In einem vollständig homogenen Magnetfeld beginnen schließlich alle Spins mit der gleichen Larmorfrequenz ω0 um B0 zu präzidieren. ω 0 = −γB0 (4.2-1) Wird nun für den Zeitraum δG ein Magnetfeldgradient G eingeschaltet, so wird das Gesamtmagnetfeld inhomogen und die Kernspins präzidieren mit einer ortsabhängig Larmorfrequenz v ( v v ω (r ) = −γ B0 + G ⋅ r ) (4.2-2) v v Wobei G der Magnetfeldgradient und r der Ortsvektor des Volumenelements dV ist (s. v Abbildung 4.2-3). G lässt sich mit den Einheitsvektoren des Laborkoordinatensystems v v v e x , e y , e z schreiben als v ∂B z v ∂B z v ∂B z v G = ∇B 0 = ex + ey + ez ∂z ∂x ∂y und ist dann linear, wenn ∂B z ∂B z ∂B z unabhängig von x, y und z sind. , und ∂x ∂y ∂z (4.2-3) 48 Kapitel 4 X Abb. 4.2-2 ∆φ Schematische Darstellung des PFG-NMR-Experiments nach Stejskal und Tanner anhand zweier Kernspins A und B eines Ensembles und einem Magnetfeldgradienten in x-Richtung. Nach dem Präparationsschritt (1) haben A und B die gleiche x-Koordinate und erfahren durch den gleichen Feldgradienten G⋅x die gleiche Phasenverschiebung (2) (dargestellt durch die Drehung der „Zeiger“). Während der Diffusionszeit ∆ ändert Kern B seine Position bzgl. x (3). Die Phasenverschiebung bleibt erhalten. Nach dem 180°-Puls hat sich das Vorzeichen der Phasenverschiebung beider Spins umgekehrt (4), während Spin B weiter wandert (5). Der zweite Feldgradient G⋅x ist jetzt für Spin A und B unterschiedlich groß (6). A hat seine Position nicht verändert und erfährt den gleichen Feldgradienten wie zuvor, so dass die Phasenverschiebung des ersten Pulses durch den zweiten eliminiert wird und der Zeiger zur Ausgangsposition zurückgekehrt. B ist während ∆ in x-Richtung gewandert und erfährt nun einen stärkeren Magnetfeldgradienten als zuvor, dass heißt die Phasenverschiebung des zweiten Pulses ist größer als die des ersten und der Zeiger wird über die Ausgangsposition hinaus gedreht. Die am Ende der Pulssequenz resultierende Phasenverschiebung ∆φ beeinflusst entsprechend die Signalintensität von A und B (7). 49 PFG-NMR-Spektroskopie z B0 B v r ∆z y A ∆x ∆y v G Abb. 4.2-3 x Brownschen Bewegung eines Teilchens mit der Ortsänderung A → B in der Zeit ∆. Die tatsächlich zurückgelegte Strecke (dünne Linie) wird im PFG-NMR-Experiment nicht erfasst, sondern nur der Abstand vom Start- zum Endpunkt, der gegeben ist durch v v den Vektor r . Die einzelnen Komponenten von r bzgl. der drei Koordinatenachsen lassen sich mit Hilfe eines entsprechenden Magnetfeldgradienten bestimmen. Exemplarisch ist ein x-Gradient mit dem ortsabhängigen Beitrag zu B0 schematisch dargestellt. Mit modernen NMR-Spektrometern ist es möglich, ausreichend starke Magnetfeldgradienten in x-, y- und z-Richtung zu erzeugen und die Diffusion parallel dieser Achsen (oder Linearkombination daraus) zu beobachten. Bei den meisten Anwendungen ist es jedoch ausreichend, die Diffusion nur bzgl. einer Achse zu verfolgen. Für einen Gradienten parallel zur x-Achse vereinfacht sich Gleichung 4.2-2 so zu ω (x ) = −γ (B0 + G ⋅ x ) (4.2-4) Wird also ein homogener Feldgradient bekannter Stärke auf ein System angewendet, erfolgt durch die ortsabhängige Larmorfrequenz eine Ortskodierung der einzelnen Spins. Anders ausgedrückt: Zu der üblichen Phasenverschiebung der Spins, die durch Feldinhomogenitäten in B0 und Spin-Spin-Relaxationseffekte hervorgerufen wird, addiert sich ein weiterer Term in Abhängigkeit von G⋅x. Für die gesamte Phasenverschiebung für Spin i nach der Zeit τ gilt somit δ φ i (τ ) = −γB0τ − γ ⋅ G ∫ x i (t )dt 0 (4.2-5) 50 Kapitel 4 Um nun eine Ortsverschiebung sichtbar zu machen, wird in der Stejskal-TannerPulssequenz zunächst durch einen 180°-Puls das Vorzeichen des Phasenwinkels, bzw. des ersten Feldgradienten, umgekehrt. Anschließend wird ein zweiter Gradientenpuls mit gleicher Länge δG und Intensität G⋅x angewendet, wobei der Zeitraum zwischen dem ersten und dem zweiten Gradientenpuls der Diffusionszeit ∆ entspricht. Wenn die Atomkerne während dieser Zeit ihre relative Position bzgl. der x-Achse nicht verändert haben, hebt der zweite Gradientenpuls die Wirkung des ersten auf und die Spins werden refokussiert (s. Spin A in Abbildung 4.2-2). Wenn die Kerne im Zeitraum ∆ aber eine translatorische Bewegung durchlaufen haben, ist der Grad der Dephasierung proportional zur zurückgelegten Strecke bzgl. der x-Koordinate (s. Spin B). φ ( ∆X ) = γ δ G G ∆X (4.2-6) Der Nachteil der HE-Pulssequenz ist, dass zwischen dem 90°-Puls und der Akquisition Spin-Spin-Relaxation stattfindet. Die zu beobachtende Diffusionszeit kann daher nicht größer als T2 sein, wodurch die Diffusionsmessungen auf kurze Diffusionszeiten im Bereich von wenigen Millisekunden beschränkt sind. Besonders langsame Teilchen, die sich durch eine gehinderte Diffusion auszeichnen und stark mit den Wänden eines Porensystems wechselwirken, können mit dieser Methode nicht erfasst werden. Abhilfe schafft hier das sogenannte Stimulated Echo (SE)-Verfahren, bei dem die Diffusionszeit durch die longitudinale Relaxationszeit bestimmt wird, die z. B. bei Xenon mehrere hundert Sekunden betragen kann. Eine schematische Darstellung der SEPulsfolge ist in Abbildung 4.2-4 dargestellt. Anstelle eines 180°-Pulses werden hierbei zwei 90°-Pulse verwendet. Direkt nach dem ersten Gradientenpuls die Gesamtmagnetisierung Mxy zurück in die z-Richtung gedreht. Die durch den Magnetfeldgradienten hervorgerufene Phasenverschiebung bleibt erhalten. Die Magnetisierung Mz ist somit parallel zu B0 und im Zeitraum τ2 findet nur eine Spin-GitterRelaxation statt. Da meistens T1 àT2 ist und T2-Relaxation nur im kurzen Zeitintervall τ1 auftritt, wird die maximale Diffusionszeit ∆ hauptsächlich von T1 bestimmt und kann so bis zu mehrere Sekunden betragen (∆max ≤ T1).[63,66,67] Die PFG-NMR-Experimente dieser Arbeit werden ausschließlich mit Hilfe der STE-Pulssequenz durchgeführt. 51 PFG-NMR-Spektroskopie 90° 90° 90° τ τ δG Akquisition δG G G ∆ Abb. 4.2-4 Stimulated-Echo-Pulssequenz in der PFG-NMR-Spektroskopie. Die normale SE-Sequenz ist durch zwei Gradientenpulse der Länge δG und Stärke G erweitert (grau unterlegt). ∆ ist die Diffusionszeit der beobachteten Teilchen. 4.2.2 Mathematische Beschreibung der Diffusion in der PFG-NMRSpektroskopie In der PFG-NMR-Spektroskopie wird wie bei der q-Raum-Bildgebung („q-space Imaging“) die über den gesamten Raum gemittelten Bewegungsinformation aus der Echointensität des Signals bestimmt.[63,64,68,69] Für die Herleitung der entsprechenden Diffusionsgleichung wird zunächst die Wanderung eines Teilchen von A nach B betrachtet (Abbildung 4.2-5). Pore v R B A v r v v r +R 0 Abb. 4.2-5 Zweidimensionale Darstellung einer Teilchendiffusion von A nach B. 52 Kapitel 4 v v v Dann ist die mittlere Wahrscheinlichkeit ein Teilchen im Punkt B = r + R nach der Zeit ∆ zu finden gleich ( ( ) ∫ ) r v v vv r P R, ∆ = ρ (r ) P r r + R, ∆ dr (4.2-7) v v (v v r ) ρ (r ) ist die Spindichte in Abhängigkeit vom Raumvektor r und P r r + R, ∆ ist die v v r Wahrscheinlichkeit, dass ein Teilchen in ∆ von r nach r + R wandert. Für die freie, v vv r ungehinderte Diffusion ist P r r + R, ∆ unabhängig von r und Gleichung 4.2-7 vereinfacht ( ) sich zu ( ) ( )∫ ( ) r r r v v P R, ∆ = P R, ∆ ρ (r ) dr = NP R, ∆ (4.2-8) Hierbei ist N der Gesamtzahl der Spins. Die mit der freien Diffusion verbundene Änderung v der Spin-Anzahl in r mit der Zeit t wird durch das zweite Ficksche Gesetz beschrieben: v v ∂N (r , t ) ∂ 2 N (r , t ) =D v ∂t ∂r 2 (4.2-9) Im eindimensionalen Fall der Diffusion parallel zum linearen Magnetfeldgradienten, lautet die Lösung der Gleichung 4.2-9, mit der Anfangsbedingung N(R,0) = N0 für R = 0: ( ) v N R, ∆ = v R2 exp − 4πD∆ 4D∆ N0 (4.2-10) ( ) v In einem isotropen Medium ist die Wahrscheinlichkeit P R, ∆ = P (R, ∆ ) und es gilt P (R, ∆ ) = N (R, ∆ ) = N0 R2 exp − 4πD∆ 4D∆ 1 (4.2-11) Unter der Annahme, dass δG á ∆ (Short Pulse Gradient Limit)[63] und die translatorische Bewegung während δG zu vernachlässigen ist, gilt für die Echointensität E des Signals in v r v r r v E (r ) = P (R, ∆ ) exp i γ δ G G ⋅ R dR ∫ v v Mit q = γ δ G G vereinfacht sich Gleichung 4.2-12 zu (4.2-12) PFG-NMR-Spektroskopie v v r r E (q ) = P (R, ∆ ) exp i q ⋅ R dR ∫ 53 (4.2-13) Und mit Gleichung 4.2-11 eingesetzt in Gleichung 4.2-13 lässt sich schließlich die Echointensität berechnen. E (q ) = +∞ ∫ −∞ R2 exp i q R dR exp − 4πD∆ 4D∆ 1 (4.2-14) E(q) ist eine reelle Zahl und berechnet sich zu ( E (q ) = E (0) exp − q 2 D∆ ) (4.2-15) Hierbei ist E(0) die Signalintensität ohne Magnetfeldgradient. In Abhängigkeit von G ergibt sich für die relative Intensität E(G)/E(0) somit ( E (G ) = exp − γ 2δ G2G 2 D∆ E (0 ) ) (4.2-16) Wenn die Pulslänge δG in der Größenordnung von ∆ liegt (δG ≤ ∆), wird Gleichung 4.2-16 zu ( ) E (G ) = exp − γ 2δ G2G 2 D(∆ − δ / 3 ) E (0 ) (4.2-17) Logarithmieren ergibt die gewünschte Auswertungsgleichung zur Bestimmung des Diffusionskoeffizienten D aus den Signalintensitäten E(G) des NMR-Spektrums: ln E (G ) = −γ 2δ G2G 2 D∆ E (0 ) (4.2-18) ln E (G ) = −γ 2δ G2G 2 D(∆ − δ G / 3 ) E (0 ) (4.2-19) bzw. Trägt man den linken Teil der Gleichung 4.2-18 bzw. 4.2-19 gegen G2 auf, kann schließlich aus der Steigung D ermitteln werden. 54 4.3 Kapitel 4 129 Xe-NMR-Spektroskopie 4.3.1 Einführung Von Xenon existieren neun Isotope, von denen zwei in der NMR-Spektroskopie von Bedeutung sind: Erstens 129 Xenon mit einer Spinquantenzahl I = 1/2, einer natürlichen Häufigkeit von 26,4 % und einer relativ hohen Empfindlichkeit (ca. 31mal größer als bezogen auf natürliche Häufigkeit). Zweitens 13 C, 131 Xenon, ein Quadrupolkern mit I = 3/2 und einer natürlichen Häufigkeit von 21,2 %, der sich durch eine geringere Empfindlichkeit und einer komplizierten Signalform auszeichnet.[4] Aufgrund seiner großen und leicht polarisierbaren Elektronenhülle zeigt Xenon ein besonders sensitives Verhalten bzgl. seiner Umgebung und die kernmagnetische Resonanzspektroskopie ist ein ideales Instrument dieses Verhalten zu beobachten. Bereits leichte Veränderungen in der Elektronenhülle haben einen deutlichen Einfluss auf die Resonanzfrequenz des Xenons, so dass diese in einem Bereich von bis zu 7500 ppm 1 variieren kann. Im Vergleich dazu sind die Bandbreiten von H (12 ppm) und 13 C (200 ppm) relativ gering. Hinzu kommt, dass sich Xenon als Edelgas mit seinen vollbesetzten Elektronenorbitalen relativ inert gegenüber anderen Stoffen verhält.[70-72] Die leichte Polarisierbarkeit, die hohe Empfindlichkeit und die chemische Inertheit machen insbesondere 129 Xenon zu einer idealen „Sonde“ in atomaren Größenordnungen. Die häufigste Anwendung der 129 Xe-NMR-Spektroskopie liegt daher auch in Untersuchungen der Porosität und Oberflächenbeschaffenheit von Festkörpern. Aber auch Messungen an reinem Xenongas und Gasgemischen wurden durchgeführt und die Abhängigkeit der chemischen Verschiebung von Druck und Konzentration bestimmt.[73,74] Im Folgenden wird nun ein Überblick über die bisherigen Anwendungen der 129 Xe-NMR-Spektroskopie gegeben. Der Schwerpunkt liegt dabei in den Untersuchungen amorpher und kristalliner Materialien. 4.3.2 129 Xe-NMR-Untersuchungen an Xenon und Xenongasgemischen Bereits in den frühen 60er Jahren wurden die ersten 129 Xe-NMR-Messungen an Xenon in gasförmiger Phase durchgeführt. Gegenstand der Untersuchungen waren zunächst die Dichte- und Temperaturabhängigkeit der chemischen Verschiebung und der 129 55 Xe-NMR-Spektroskopie longitudinalen Relaxationszeit T1.[73,75-77] Dichteabhängigkeit der chemischen Verschiebung 1970 stellten Jameson et al. ihre Ergebnisse der druckabhängigen 129 Xe-NMR Messungen an reinem Xenongas und Gasgemischen mit Drücken von bis zu 200 bar vor.[74] Sie fanden einen Zusammenhang zwischen der chemischen Verschiebung δ und der Xenon-Dichte ρXe, der mit einem Virialsatz n-ter Ordnung beschrieben werden kann. Unter Berücksichtigung der Temperaturabhängigkeit der Xenonresonanz lautet die Gleichung [78] 2 3 n δ (T , ρ ) = δ 0 + σ 1 (T )ρ Xe + σ 2 (T )ρ Xe + σ 3 (T )ρ Xe + ... + σ n (T )ρ Xe Für T = 298 K ist (4.3-1) σ1 = 0,548 ± 0,0004 ppm/Amagat σ2 = (0,169 ± 0,02)⋅10-2 ppm/Amagat σ3 = -(0,163 ± 0,01)·10-5 ppm/Amagat δ0 ist die chemische Verschiebung bei einer Dichte bzw. einem Druck von null. Ein Amagat ist die Xenondichte unter Standardbedingungen (298 K, 1,013 bar) und entspricht etwa 2,5⋅1019 Atome/cm3.[70] Die während der Kollision zwischen den Xenonatomen nur über kurze Strecken wirkende Elektronenaustauschkräfte sind für die hohe Dichteabhängigkeit der chemischen Verschiebung verantwortlich.[79] Bei Drücken bis 50 bar sind im Übrigen nur Stöße zwischen zwei Xenonatomen von Bedeutung, d. h., die Terme 2-ter und höherer Ordnung in Gleichung 4.2-1 können vernachlässigt werden. Somit ergibt sich ein linearer Zusammenhang zwischen der chemischen Verschiebung und der Dichte bzw. dem Druck. Für Gasgemische aus Xenon und anderen Gasen, wie Argon und Krypton, sowie CO2, HCl, CH4 und perfluoriertem Methan CH3-nFn, wurde ein zu Gleichung 4.1-1 ähnlicher mathematischer Zusammenhang gefunden. Dabei wird neben den Xe-Xe-Stößen auch Xe-A-Stöße (A = Atom/Molekül eines anderen Gases) berücksichtigt. Jameson et al. stellten darüber hinaus fest, dass die chemische Verschiebung im Gegensatz zum reinen Xenon, auch bei Drücken über 50 bar in erster Näherung linear verläuft.[78] δ = δ 0 + σ 1 ( Xe − Xe )ρ Xe + σ 1 ( Xe − A)ρ A (4.3-2) 56 Kapitel 4 Temperaturabhängigkeit der chemischen Verschiebung Die temperaturabhängigen Messungen an reinem Xenongas zeigen eine relativ starke Abhängigkeit der chemischen Verschiebung von T. Jameson et al. konnten anhand experimenteller Ergebnisse zeigen, dass σ1 dabei zwischen 0,68 ppm/amagat (240 K) und 0,47 ppm/amagat (440 K) variieren kann.[78] Spin-Gitter-Relaxation in der Gasphase Die Spin-Gitter-Relaxationszeiten von 129 Xenon als reines Gas in homogener Umgebung sind relativ lang, da eine Relaxation nur über Dipol-Dipol-Wechselwirkungen und skalaren Kopplungen während den Kollisionen zwischen den Xenonatomen erfolgen kann (s. Kapitel 4.1). Für Xenon in der Gasphase wurden T1-Zeiten von z. B. 2600 ± 600 s bei 48 atm und 298 K gefunden.[73] In der Praxis wird daher häufig Xenongas mit Sauerstoff gemischt, dass zu einer Reduzierung der Xenon T1-Zeit und somit zu einer erheblichen Verkürzung der Messzeit führt. Zahlreiche druckabhängige Messungen wurden in den frühen 60er Jahren durchgeführt. Hunt und Carr konnten zeigen, dass sich T1 antiproportional zur Xenongasdichte ρXe (in amagat) verhält:[73] T1 = 2 ⋅ 10 5 1 (4.3-3) ρ Xe 4.3.3 Xenon in flüssiger und fester Phase Die ersten 129 Xe-NMR Untersuchungen an reinem Xenon in flüssiger und fester Phase wurden von Yen et al. [80] und Brinkmann et al. [75] durchgeführt. Gegenstand der Untersuchungen waren druck- und temperaturabhängige Messungen der Spin-SpinRelaxationszeit, der chemischen Verschiebung und des Selbstdiffusionskoeffizienten von Xenon. Für Xenon in flüssiger Phase wurden relativ lange T2-Zeiten und geringe Linienbreiten gefunden. Unterhalb des Schmelzpunktes (163 K) nimmt die Halbwertsbreite bis 118 K linear zu und erreicht einen Wert von ungefähr 300 Hz, der im Einklang mit dem von van Vleck vorhergesagten Wert für einen Festkörper mit DipolDipol-Kopplungen übereinstimmt.[70] Zudem konnte eine Spin-Gitter-Relaxationszeit von 57 ± 2 s (bei 172 K) bestimmt werden.[81] Die Dichteabhängigkeit der chemischen Verschiebung in fester Phase ist linear und beträgt 6.0 ppm/amagat.[75] 129 57 Xe-NMR-Spektroskopie 4.3.4 Xenon in Verbindungen Die ersten 129 Xe-NMR-Untersuchungen wurden von Seppelt und Rupp an Xenonfluoriden und -oxiden sowie an Xenon-Selen- und Xenon-Tellur-Komplexen durchgeführt.[83] XeOF4 dient dabei als Referenzsubstanz, deren 129 Xe-Resonanzlinie auf 0 ppm festgelegt wird und zu der die Resonanzlinie des gasförmigen Xenons bei 0 bar um 5331 ppm zu hohem Feld verschoben ist. Bei Xenon in Verbindungen zeigt sich eine Abhängigkeit der chemischen Verschiebung von der Oxidationsstufe des Xenons, wobei sich zwei Trends beobachten lassen: Erstens nimmt die chemische Verschiebung, mit Ausnahme von XeIV (XeF4, XeF3+), mit zunehmender Oxidationsstufe zu (XeVIII > XeIV > XeVI > XeII, s. Abbildung 4.3-1), und zweitens tragen Sauerstoffliganden im Vergleich zum Fluor zu einer Erhöhung der chemischen Verschiebung bei, was vermutlich auf den ionischen Charakter der Xe+-OBindung zurückzuführen ist.[72] 4- XeO6 2000 + XeF2 -1000 -2000 XeF4 XeOF4 XeF 1000 0 Xe -3000 -4000 -5000 Chemische Verschiebung /ppm Abb. 4.3-1 Abhängigkeit der chemischen Verschiebung von der XeOxidationsstufe.[72] In jüngerer Zeit half die 129Xe-NMR Spektroskopie auch bei der Charakterisierung der ersten Xenon-Kohlenstoffverbindung C6F5Xe enthaltenden Polymers –(Xe–O–TeF4–O)4– [85] [84] sowie eines Xenon , und ist mittlerweile ist zu einer Standardanalysemethode bei der Charakterisierung von Xenon-Verbindungen geworden. 58 Kapitel 4 4.3.5 Xenon gelöst in Flüssigkeiten 129 Stengle et al. führten Xe-NMR-Untersuchungen an in Lösemitteln gelöstem Xenon durch und fanden dabei eine Summe von Faktoren, die die chemische Verschiebung des Xenons beeinflussen:[86] δ = δ A + δ ID + δ PD + δ Dis + δ Re p (4.3-4) Die chemische Verschiebung wird dabei von der Anisotropie (δA) und dem induzierten (δID) bzw. permanenten Dipol (δPD) des Lösemittels bestimmt. δDis und δRep beschreiben den dispersiven und repulsiven Anteil der Van-der-Waals-Wechselwirkung. Sie haben den größten Einfluss auf die chemische Verschiebung, da Xenon keinen permanenten Dipol besitzt und die magnetische Anisotropie und permanenten Dipole des Lösemittels vernachlässigbar klein sind. 4.3.6 Xenon als Hohlraumsonde in Feststoffen Die leicht polarisierbare Elektronenhülle und seine Größe machen das Xenonatom, in Verbindung mit der 129 Xe-NMR-Spektroskopie, zu einer idealen „Sonde“ bei der Charakterisierung von Oberflächen und Porositäten in Feststoffen. So wurden bereits zahlreiche Untersuchungen zur Bestimmung der Oberflächenchemie und Porengrößenverteilungen von Festoffen mit definierter Struktur, wie z. B. Zeolithe, und kristallinen und amorphen Substanzen, wie z. B. Polymere und Ruße, durchgeführt. Im 129 folgenden wird nun ein kleiner Überblick über die bisherigen Anwendungen der Xe- NMR-Spektroskopie in Feststoffen gegeben und einige wichtige Theorien zur Bestimmung der Porengrößen erläutert. 4.3.6.1 Xenon in Zeolithen Zu Beginn der 80er Jahre führten Fraissard und Ito als erste 129 Xe-NMR-Untersuchungen an Zeolithen durch.[87-89] Sie fanden heraus, dass die chemische Verschiebung des 129 Xe innerhalb der Zeolithstruktur von verschiedenen Parametern abhängt: δ = δ 0 + δ P + δ E + δ M + δ Xe − Xe ρ Xe (4.3-5) 129 59 Xe-NMR-Spektroskopie Hierbei ist δ0 die chemische Verschiebung des Xenon-Referenzsignals (z. B. 0 ppm bei 0 bar). δE beschreibt den Einfluss elektrischer Felder auf δ, die innerhalb der Zeolithstruktur z. B. von Kationen hervorgerufen werden können und δM hängt von den magnetischen Eigenschaften des Festkörpers ab. Der letzte Term in Gleichung 4.3-5 berücksichtigt die Xenon-Xenon Wechselwirkungen, die sich proportional zur Xenondichte ρXe innerhalb der Porenstruktur verhalten und ist somit ein Ausdruck für die Druckabhängigkeit der chemischen Verschiebung.[78] δP ist der Beitrag, der durch die Größe der Poren und Kanäle bestimmt und umso größer wird, je eingeschränkter der Bewegungsraum des Xenons ist (s. a. Kapitel 4.3.7.1). Bei 129 Xe-NMR-Untersuchungen an Zeolith Na-A konnte gezeigt werden, dass die chemische Verschiebung stark vom Xenon-Füllgrad der α-Käfige abhängt.[91] Die Xenonatome wurden dazu unter hohem Druck und Temperatur in die Hohlräume des Zeolithen eingebracht und bei Raumtemperatur vermessen. Das Ergebnis ist in Abbildung 4.3-2 dargestellt. (a) (b) (c) Abb. 4.3-2 (a) Xenon-Verteilung in α-Käfigen des Na-A Zeoliths. (b) 129 Xe-NMR- Spektrum von Zeolith Na-A mit Anzahl der Xenonatome pro Hohlraum (vgl. (a)). (c) 129 Xe- NMR-2D-Austauschspektrum von Xenon in Zeolith Na-A. Die Nichtdiagonalpeaks sind auf den Austausch zurückzuführen.[91] zwischen α-Käfigen mit unterschiedlicher Xenon-Belegung 60 Kapitel 4 Jedem einzelnen Signal im 129 Xe-NMR-Spektrum kann ein Xe-Füllgrad der Pore zugeordnet werden. Je mehr Xenon-Atome sich in einer Pore befinden, desto größer ist die chemische Verschiebung. Die Porenzugänge im Zeolithen sind außerdem so klein, dass der Austausch zwischen den Poren stark behindert wird und es zu einer inhomogenen Verteilung der Xenonatome kommt. Die geringen Intensitäten der Nichtdiagonalsignale im 2D-Austausch-Spktrum weisen auf den nur schwachen Austausch hin. Die Spin-Gitter-Relaxationszeit adsorbierter Xenonatome in der Porenstruktur eines Zeolithen kann zwischen einigen hundert Millisekunden und mehreren Sekunden betragen und ist somit im Vergleich zur reinen Xenongasphase um einen Faktor drei bis sechs kleiner. Die T1-Zeit adsorbierter Xenonkerne in NaY-Zeolith wird hauptsächlich durch zwei Komponenten bestimmt:[92] 1 1 z = + T1 T1V T1W (S / V ) (4.3-6) T1W ist die charakteristische Relaxationszeit der Xenonatome mit einem Abstand z von der Porenwand und T1V die der Xenonatome in den NaY-Poren. Der Term S/V ist das Verhältnis der Oberfläche zum Volumen der Pore, für dass in erster Näherung eine lineare Abhängigkeit von der Xenondichte angenommen werden kann. 4.3.6.2 Xenon in Clathraten Als Clathrate oder Edelgashydrate werden Einschlussverbindungen von Edelgasen in Wasser bezeichnet. Sie entstehen durch Ausfrieren des Wassers in Gegenwart eines Edelgases. Dabei bildet sich nicht wie im normalen Eis eine hexagonale Struktur mit vielen kleinen Hohlräumen, sondern eine kubische Struktur mit wenigen großen Hohlräumen, in denen die Edelgasatome, je nach van-der-Waals-Radius, festgehalten werden.[4] Ripmeester et al. untersuchten die Porensymmetrie der Clathraten mit Hilfe der 129 Xe- NMR-Spektroskopie.[20,93,94] Änderungen in der Porengröße und –form können mit einer Änderung der chemischen Verschiebung und Signalform der Xenonresonanz in Verbindung gebracht werden. So hat eine Abnahme im Porenradius der Clathrate eine Zunahme der Wechselwirkungen des Xenons mit der Porenwand zur Folge, wodurch eine Tieffeldverschiebung der 129Xe-NMR-Signale hervorgerufen wird. 129 61 Xe-NMR-Spektroskopie Des Weiteren wurden von Ripmeester et al. Kreuzpolarisationsexperimente von 1 H auf 129Xe zur Porengrößenbestimmung durchgeführt.[95,96] Der Magnetisierungstransfer, und somit die Signalintensität, ist dabei von der Entfernung des Xenonatoms von den Wassermolekülen abhängig und verhält sich antiproportional zum Porenradius. Gleichzeitig kann durch den Magnetisierungstransfer die Aufnahmezeit eines 129 Xe-NMR- Spektrums verringert werden. 4.3.6.3 Xenon in Polymeren Ein weiteres Anwendungsgebiet der 129Xe-NMR-Spektroskopie stellt die Charakterisierung organischer und anorganischer Polymere dar. Xenon ist in vielen Polymeren relativ gut löslich, d. h., es kann leicht in das Material eindringen und somit strukturelle und dynamische Informationen liefern.[86,97] Die Mobilität der Polymerketten hat dabei direkten 129 Xe-NMR-Signale. Oberhalb der Einfluss auf die Form und Verschiebung der Glastemperatur TG sind die Halbwertsbreiten der 129 Xe-Resonanzlinien relativ klein, was auf eine hohe Beweglichkeit der Xenonatome, und somit der Polymerketten, schließen lässt. Bei Temperaturen unterhalb TG nimmt die Mobilität der Polymerketten stark ab und schränkt somit auch die Beweglichkeit der Xenonatome ein. Dadurch kommt es zu einer Erhöhung der Halbwertsbreite und einer deutlichen Tieffeldverschiebung der 129 Xe- Resonanzlinie. Es können aber auch oberhalb TG Mobilitätsunterschiede innerhalb eines Polymers bzw. zwischen verschiedenen Polymeren untersucht werden.[98] Mansfeld und SperlingIschinsky haben 129 Xe-NMR-Untersuchungen an aus Ethylen und Propylen hergestellten Homopolymeren, Block-Copolymeren und Polymer Blends durchgeführt.[99,100] Sie fanden 129 im Xe-NMR-Spektrum vom Polyethylen/Polypropylen-(PE/PP)-Copolymer nur ein Adsorptionssignal, dessen chemische Verschiebung linear mit dem Polyethylenanteil abnimmt. Die Domänen der einzelnen Polymeranteile sind also zu klein, um ein eigenes 129 Xe-NMR Signal liefern zu können. D. h., innerhalb der NMR-Zeitskala kann das Xenonatom schnell zwischen beiden Bereichen austauschen und so ein gemitteltes Signal liefern. Hingegen sind im 129 Xe-NMR-Spektrum vom (PP)-(PE/PP)-Copolymer und (PP)-(PE/PP)-Polymer-Blend zwei getrennte Signale zu erkennen, deren chemische Verschiebungen denen der reinen Komponenten entsprechen und somit eindeutig den einzelnen Domänen zugeordnet werden können. Die Domänenabstände bzw. –größe können über PFG-NMR-Untersuchungen bestimmt werden.[100] 62 Kapitel 4 4.3.6.4 Xenon in Graphit und amorphen Kohlenstoffen 129 Xe-NMR-Untersuchungen an Graphit wurden von Shibanuma et al. und Neue durchgeführt. Shibanuma et al. bestimmten die chemischen Verschiebungen des Xenons in flüssiger und fester Phase auf Graphit und fanden Resonanzlinien im tiefen Feld zwischen 250 und 350 ppm, die auf starke Xenon-Graphit-Wechselwirkungen zurückzuführen sind.[101] Neue hingegen führte 129 Xe-NMR-Messungen an Graphon durch, einem Kohlenstoff mit hohem Graphitanteil.[102] Er untersuchte den auf der Graphitoberfläche adsorbierten Xenonfilm hinsichtlich Dynamik und Struktur und bestimmte dazu die Spin-GitterRelaxationszeiten und chemischen Verschiebungen des Xenons bei Temperaturen von 90 bis 180 K. Seine Ergebnisse zeigen eine hohe Beweglichkeit der Xenonatome innerhalb des adsorbierten Films. Dabei kann zwischen zwei dynamisch stark unterschiedlichen Fraktionen unterschieden werden, von denen die kleinere mit einem Anteil von unter zehn Prozent hoch mobil ist und der obersten Xenonschicht zugeordnet wird. Die zweite, weniger mobile Fraktion, entspricht den mit der Graphitoberfläche wechselwirkenden Xe-Atomen. Druckabhängige al. durchgeführt. eine lineare 129 Xe-NMR-Messungen an amorphen Kohlenstoffen wurden von Suh et [103] Sie fanden bei kleinen Drücken und geringen Oberflächenbelegungen Abhängigkeit der 129 Xe-NMR-Verschiebung von der Oberflächen- konzentration des Xenons. Die Steigung ist dabei unabhängig von der Porengröße und Oberflächenbeschaffenheit der Kohlenstoffe. Der Achsenabschnitt bei pXe = 0 liefert eine chemische Verschiebung δ0, die von der Oberflächenbeschaffenheit der Carbon Blacks abhängt. So führt eine erhöhte Anzahl an Carboxylgruppen auf der Oberfläche zu einem größeren Wert für δ0. Eine direkte Korrelation der chemischen Verschiebung mit der Porengröße bzw. der spezifischen Oberfläche wurde nicht gefunden. 4.3.7 Modelle zur Berechnung der chemischen Verschiebung Die zuvor vorgestellten Ergebnisse der Feststoffen haben gezeigt, dass 129 die Xe-NMR Untersuchungen an mikroporösen chemische Verschiebung des Xenon- Adsorptionssignals von vielen Faktoren, wie Porengröße und Oberflächenbeschaffenheit der Substanzen abhängt. Eine eindeutige Korrelation der chemischen Verschiebung ist aber nur bei definierten Systemen, wie z. B. den Zeolithen möglich. Erste Modelle zur 129 63 Xe-NMR-Spektroskopie Berechnung der chemischen Verschiebung in Abhängigkeit von Druck und Temperatur beziehen sich daher hauptsächlich auf solche Systeme. Hier werden nun die wichtigsten vorgestellt. 4.3.7.1 Chemische Verschiebung als Funktion des Porenvolumens Ausgehend von qualitativen Ergebnissen, die einen linearen Zusammenhang der chemischen Verschiebung mit dem Porenradius in Zeolithen bei unendliche kleiner Xenonkonzentration aufzeigten, versuchten Demarquay und Fraissard durch Computersimulationen der Xenondiffusion in modellhaften Zeolithstrukturen einen quantitativen Zusammenhang zwischen der zurückgelegten mittleren freien Weglänge und der chemischen Verschiebung herzuleiten.[87,88,90] Für einen sphärischen (dS) und einem zylindrischen Holraumdurchmesser (dZ) kann die mittlere frei Weglänge l wie folgt bestimmt werden: l= 1 (d S − d Xe ) 2 l = d Z − d Xe (4.3-7) (4.3-8) Hierbei ist dXe = 0,44 nm der Van-der-Waals-Durchmesser des Xenonatoms. Mit Hilfe der Computersimulationen konnten sie zeigen, dass bei allen untersuchten Strukturen, die mittlere freie Weglänge l für eine endliche Anzahl an Kollisionen mit der Porenwand (<100) konstant bleibt. Bei kleinen freien Weglängen (0,1-0,25 nm) nimmt die chemische Verschiebung der 129 Xe-Resonanzlinie linear mit l ab. Hingegen zeigt sich eine reziproke Abhängigkeit bei Weglängen über 0,25 nm. Anhand dieser experimentellen Ergebnisse entwickelten sie eine empirische Gleichung, die die Abhängigkeit der chemischen Verschiebung δ von der mittleren freien Weglänge beschreibt. Unter der Voraussetzung, dass δ ein gemittelter Wert aus der chemischen Verschiebung im adsorbierten (δa) und freien Zustand (δf) ist, gilt δ = N aδ a + N f δ f Na + Nf (4.3-9) Dabei sind Na und Nf die Anzahl der Xenonatome im adsorbierten und freien Zustand. Daraus formulierten Demarquay und Fraissard schließlich folgende Gleichung für die chemische Verschiebung in einer Pore: 64 Kapitel 4 δ = δa c (4.3-10) c+l Hierbei ist c ist eine Konstante. Bei einer unendlich kleiner Pore ( l → 0) ist δ = δa und bei einer ebenen Oberfläche ( l = ∞) ist δ = 0. 4.3.7.2 Chemische Verschiebung als Funktion der Oberflächenkrümmung Derouane et al. entwickelten ein Physisorptionsmodell, das auf eine Van-der-WaalsAnziehung zwischen einem isotropen Atom bzw. Molekül und einer gekrümmten Oberfläche eines Zeoliths beruht.[104,105] Die chemische Verschiebung wird direkt mit der Adsorptionsenergie korreliert, die wiederum vom Grad der Oberflächenbelegung abhängig ist. Die Van-der-Waals-Energie der Adsorption E (z/Rp) kann beschrieben werden als [104] C E (z / R P ) = − 3 4z z 1 − 2R P −3 (4.3-11) Dabei ist C eine molekulare Konstante, z der Abstand des Moleküls zur Porenwand und Rp der Porenradius. Der Faktor C/4z3 ist die Van-der-Waals-Energie für die Adsorption auf einer ebenen Oberfläche (RP = ∞ und z/Rp = 0). Das Verhältnis E eff = E (z / R p ) E (0 ) z = 1 − 2R P −3 (4.3-12) quantifiziert schließlich den gesuchten Oberflächenbelegungseffekt und hängt über der Konstanten k linear mit der chemischen Verschiebung δ zusammen: δ = kE eff (4.2-13) Dieses Modell beruht quantitativ auf die strukturelle Abhängigkeit der chemischen Verschiebung von Molekülen, die sich in den Kanälen und Hohlräumen von Molekularsieben befinden. Es erlaubt die Vorhersage bestimmter Strukturmerkmale, wie Porenradius und –volumen aus der chemischen Verschiebung. 129 65 Xe-NMR-Spektroskopie 4.3.7.3 Das “Rapid Exchange“- Modell Cheung et al. gehen in ihrem Modell von einem schnellen Austausch („Rapid Exchange“) der adsorbierten und freien Xenonatome innerhalb der NMR-Zeitskala aus, der einen gemittelten Wert der chemischen Verschiebung δ liefert.[106] Die chemische Verschiebung des in der Gasphase befindlichen Xenons δg ist abhängig von der Temperatur und der Xenondichte ρXe innerhalb einer Pore und kann beschrieben werden durch δg = ζg(T)ρXe und wird dabei hauptsächlich durch die Häufigkeit der Xe-Xe-Kollisionen bestimmt. Mit der chemischen Verschiebung der permanent an der Porenwand adsorbierten Xenonatome δa kann δ beschrieben werden durch δ (T , ρ ) = N aθ N − N aθ δa + ς g ρ Xe N N (4.3-14) wobei Na die Anzahl der Adsorptionsplätze und N die Gesamtzahl der Xenonatome in einem Superkäfig sind. θ ist der Anteil der belegten Adsorptionsplätze, für den der Belegungsgrad der Langmuir-Isothermen eingesetzt werden kann. θ = Magusin et al. [107] KL p 1+ KL p (4.3-15) gehen von ähnlichen Voraussetzungen aus und stellten einen direkten Zusammenhang zwischen der chemischen Verschiebung δ und dem Porenradius her. Ausgehend von Gleichung 4.2-14 und 4.2-15, und unter der Annahme, dass das ideale Gasgesetz gilt (Wechselwirkungen der Xenonatome untereinander werden vernachlässigt), sowie δg = 0 ppm, wurde folgende Gleichung bestimmt: δ = δa 1 + λΦ (4.3-16) mit λ= p (4.3-17) θ n k BT Hierbei ist p der Xenongasdruck, n die Anzahl der Adsorptionsplätze pro Flächeneinheit, kB die Boltzmann-Konstante und T die Temperatur. Φ ist das Verhältnis von Volumen zur Oberfläche der Pore mit Φ = V/S und verhält sich proportional zum Porenradius RP, der sich für einfache geometrische Formen leicht bestimmen lässt. Für sphärische Poren ist RP = 3Φ, für einen unendlichen Zylinder Rp = 2Φ und für zwei eben Schichten Rp = Φ. Streng genommen sind die Gleichungen 4.3-15 und 4.3-16 nur für kleine Füllgrade der 66 Kapitel 4 Poren gültig (p → 0 bzw. θ → 0). Für unendlich große Poren (Rp = ∞) nimmt δ den Wert des freien Xenons an. Geht der Porenradius gegen null, bzw. nimmt er den Van-derWaals-Radius des Xenons an (rXe = 0,22 nm), dann ist δ ≈ δa. Der Radius Rp kann Schließlich durch Umstellen der Gleichung 4.3-17 ermittelt werden zu δ i R P = a − 1 δ λ (4.3-18) Die Konstante i ist gleich 1, 2 oder 3, wenn die Pore als Schichtzwischenraum, als zylindrische oder als sphärischen Pore betrachtet wird. Wenn bei ausreichend hohen Drücken von einer vollständigen Belegung der Adsorptionsplätze (θ = 1) ausgegangen wird, lässt sich λ bei gegebenem Druck und Temperatur aus Gleichung 4.3-17 bestimmen. 4.3.7.4 Das Modell der zwei Energiezustände nach Ripmeester und Ratcliffe Ripmeester und Ratcliffe haben ausführliche 129 Xe-NMR-Untersuchungen an Zeolithen und Clathraten durchgeführt.[94,95] Die experimentellen Ergebnisse haben gezeigt, dass in sphärische Poren, deren Radius R > 0,45 nm beträgt, das Xenonatom das Porenvolumen nicht mehr einheitlich ausfüllt, aber im zeitlichen Mittel länger an der Porenwand verweilt als im Porenzentrum. Eine alleinige Korrelation der chemischen Verschiebung mit der Porengröße wird daher ausgeschlossen. Vielmehr wird der Vorschlag von Johnson und Griffith aufgegriffen, die eine Abhängigkeit der chemische Verschiebung vom Volumen/ Oberfläche-Verhältnis (VP/S) der Poren angenommen haben.[124] In kleinen Poren (R < 0,45 nm) verhält sich das adsorbierte Xenon wie ein Feststoff („solid-like“) und in größeren eher gasförmig („gas-like“), indem es sich zeitweise im adsorbierten und freien Zustand befindet. Zudem werden die Wechselwirkungen der Xenonatome mit der Oberfläche in sehr großen Poren (R ~ 10 nm) mit denen einer ebenen Oberfläche gleichgesetzt. Dieses Modell unterscheidet sich somit von Fraissards, bei dem eine einheitliche Verteilung des Xenons in den Poren angenommen wird, und Derouanes, bei dem der Wert der chemische Verschiebung ausschließlich von der Oberflächenbelegung abhängt. Für kleine Poren kann also angenommen werden, dass δ nur durch das von den Xe-Atomen zugänglichen Porenvolumen bestimmt wird, wohingegen bei größeren Poren zunehmend die Adsorptionsenergie, Porenvolumen, Temperatur und Konzentration eine Rolle spielen. 129 67 Xe-NMR-Spektroskopie Xe Xe Xe Pore V Xe Xe V´ V´´ Xe Xe Xe Xe Xe Energie Nf´´ Xe Xe Xe Xe Nf`´ Xe Xe Xe Na Xe Xe Xe Xe r RP ∆E Abb. 4.3-3 Schematische Darstellung adsorbierter Xenonatome in einer sphärischen Pore mit Radius RP und räumlicher Unterteilung nach Ripmeester und Ratcliffe.[20} ∆E ist der Energieunterschied zwischen adsorbiertem und freien Xenon innerhalb der Pore.[20] In ihrem Modell gehen Ripmeester und Ratcliffe zunächst von einer sphärischen Pore mit Radius RP aus, in der das Xenon in Abhängigkeit vom Abstand zur Porenwand in zwei unterschiedlichen Energiezuständen (adsorbiert und frei) vorliegen kann.[20] In Abbildung 4.3-3 ist eine sphärische Pore mit einem Energieunterschied ∆E zwischen Porenwand und freiem Volumen und den möglichen Aufenthaltsorten der Xenonatome schematisch dargestellt. Im Gleichgewichtszustand befinden sich alle Xe-Atome mit dem Abstand < (RP – r) von der Porenwand im Energieminimum. Davon sind Na Xe-Atome direkt an der Porenwand adsorbiert und haben die chemischen Verschiebung δa. Im Volumen V´ befinden sich Ng´ Xe-Atomen ebenfalls in einem niedrigen Energiezustand und können mit den adsorbierten Teilchen austauschen. Im inneren Porenvolumen V´´ befinden sich Nf´´ Xe-Atome mit dem Abstand größer (RP – r) zur Porenwand im Energiemaximum. Die chemische Verschiebung δf entspricht der des freien Xenons in Abhängigkeit vom Druck p. Die Besetzung der Energiezustände kann mit Hilfe der Boltzmann-Verteilung beschrieben werden, Nf = R3 N a exp(− ∆E / RGT ) R3 − r 3 (4.3-19) 68 Kapitel 4 wobei Nf und Na jeweils die Anteile der Xenonatome im freien und adsorbierten Zustand sind. Nf ist die Summe der beiden Fraktionen Nf´ und Nf´´ mit Nf´ = Nf·(RP3-r3)/RP3 und Nf´´= Nf·r3/RP3. Der Anteil aller Xenonatome in der Potentialmulde ist schließlich die Summe aus Nf´ und Na: N f ´+ N a = 1 − N f ´´= 1 − N f r3 R P3 (4.3-20) Für die mittlere chemische Verschiebung δ innerhalb der Pore ergibt sich somit r3 r3 δ = 1 − N f 3 δ a + N f 3 δ f RP RP (4.3-21) Setzt man nun unter Berücksichtigung von Na = 1 - Nf Gleichung 4.2-19 in Gleichung 4.3-21 ein, erhält man für δf = 0 und dem Radienverhältnis RP/r [20] δ = 1 − δa (R P / r ) + (R P / r ) − 1 exp(∆E / RGT ) ( 3 1 3 ) (4.3-22) Bei einer Grenzwertbetrachtung bzgl. T und RP/r lässt sich die chemische Verschiebung des Xenons im adsorbierten Zustand δa sowie das Radienverhältnis z bestimmen: Für T → 0 bzw. RP/r → ∞: δ → δa Für T → ∞: δ → 1 − Für RP/r → 0: δ → [1 + exp(− ∆E / RGT )] δ a (4.3-23) 1 δa 3 2 (R p / r ) − 1 (4.3-24) (4.3-25) Es ist anzumerken, dass bei diesem Modell zahlreichen Vereinfachungen benutzt wurden, die zu der Funktion in Gleichung 4.3-22 führten. Zudem verwenden Ripmeester und Ratcliff die Boltzmann-Verteilung zwischen Nf´ und Na, obwohl nach Ihrer Theorie sich beide Fraktionen im Energieminimum befinden. 129 69 Xe-NMR-Spektroskopie 4.3.7.5 Das „Dual-Mode“-Modell 1954 fand Meares heraus, dass das Adsorptions- und Diffusionsverhalten von adsorbierten Molekülen in Polymeren unterhalb der Glasübergangstemperatur TG von der inhomogenen Polymerstruktur bestimmt wird.[108] In seinem „Dual-Mode“-Modell unterscheidet er zwischen zwei unterschiedlichen Adsorptionsarten: Die eingelagerten Molekülen können zum einen „gelöst“ im Polymer vorliegen („First-Mode“), oder sie sind in Mikroporen bzw. Hohlräumen der Polymere adsorbiert („Second-Mode“). Michaels et al. untersuchten in diesem Zusammenhang das Adsorptionsverhalten von Edelgasen in Polymeren unterhalb TG. Sie fanden Adsorptionsisotherme mit nichtlinearem Verlauf, die sie empirisch mit einer Summe aus dem Henryschen Gesetz und der Langmuirschen Adsorptionsisotherme angleichen konnten.[109] C = CH + CL = k H p + c L KL p 1+ KL p (4.3-26) C ist die Gesamtkonzentration des im Polymer adsorbierten Edelgases, CH und CL die Konzentrationen der Moleküle, die gelöst (First-Mode) bzw. adsorbiert in den Mikroporen (Second-Mode) vorliegen, kH ist die Henrysche Konstante, cL die Molekülkonzentration bei vollständig gefüllten Poren, KL die substanzspezifische Gleichgewichtskonstante der Langmuir-Gleichung und p ist der Partialdruck des Edelgases in der Gasphase.[110,111] Bezogen auf die 129 Xe-NMR-Spektroskopie beschreibt das Dual-Mode-Modell hier also die Druckabhängigkeit der chemischen Verschiebung (δ ∝ C). Bei kleinen Drücken folgt sie dem Henryschen Gesetz, bei höheren Drücken hingegen der Langmuir-Isothermen. Suzuki et al. bestimmten für Poly(2,6-dimethyl-1,4-phenyloxid) die Xenon-Adsorptionsisothermen und ermittelten die Konzentrationen CH und CL der Dual-Mode-Gleichung (Gleichung 4.3-26).[112] Diese trugen sie gegen die jeweilige 129 Xe-NMR-Verschiebung auf und fanden einen linearen Zusammenhang zwischen δ und CL. Die Interpolation der Geraden auf CL = 0 liefert ihrer Meinung nach eine für die Mikroporengröße spezifische chemische Verschiebung. Eine Linearität zwischen δ und der Konzentration CH des Henryschen Beitrags konnte nicht gefunden werden. 70 Kapitel 4 4.3.8 Magnetische Einflüsse der Graphitstruktur auf chemische Verschiebung und Halbwertsbreite In den bisher betrachteten Modellen bestimmten hauptsächlich die Porengrößen und Oberflächeneigenschaften die chemische Verschiebung und Linienbreite der 129 Xe-NMR- Signale. Die auftretenden van-der-Waals-Wechselwirkungen zwischen den Xenonatomen und den Oberflächenmolekülen des Adsorbents zeigen dabei den größten Einfluss. Bei Carbon Black und Graphit treten aber in einem Magnetfeld aufgrund der elektrischen Leitfähigkeit zusätzliche Effekte auf, die die chemische Verschiebung und Linienbreite der 129 Xe-NMR-Signale nachhaltig beeinflussen können. So kann es innerhalb der Proben zu lokalen Magnetfeldänderungen durch Suszeptibilitätsunterschiede zwischen den Rußpartikeln und der Umgebung, sowie zu induzierten Kreisströme in den konjugierten πSystemen der Graphitebenen kommen. 4.3.8.1 Suszeptibilitätsunterschiede Betrachten wir zunächst ein homogenes Magnetfeld mit einer magnetischen Flussdichte B, die sich bildlich als eine flächendurchschreitende Anzahl von Feldlinien beschreiben lässt. Befindet sich nun ein Körper in diesem Magnetfeld, so kann es innerhalb des Körpers entweder zu einer Verdichtung oder zu einer Aufweitung der Feldlinien kommen. Diese beiden gegenläufigen Effekte werden als Paramagnetismus bzw. Diamagnetismus bezeichnet. Die Flussdichten innerhalb (BInnen) und außerhalb (BAußen) des Körpers verhalten sich über die Beziehung BInnen = µ r B Außen (4.3-27) linear zueinander. Die Proportionalitätskonstante mr ist die sog. relative magnetische Permeabilität.[4] Für paramagnetische Stoffe ist sie größer bzw. für diamagnetische Stoffe kleiner als eins. Einen Zusammenhang der Permeabilität mit der Suszeptibilität c liefert Gleichung 4.3-28: µr = 1+ χ (4.3-28) Eine häufig verwendete Schreibweise gibt schließlich die Proportionalität zwischen der Magnetisierung M eines Körpers und der äußeren Magnetfeldstärke HAußen wieder: M = χH Außen (4.3-29) 129 71 Xe-NMR-Spektroskopie Definitionsgemäß gilt für paramagnetische Stoffe χ > 0 und für diamagnetische χ < 0. Organische Stoffe sind i. A. diamagnetisch und Carbon Blacks somit auch. Andererseits besitzen Ruße an der Oberfläche ungepaarte Elektronenspins, die zu paramagnetischen Bereichen führen. Die Leitfähigkeit und die ungeordnete Aggregatstruktur der Carbon Blacks sind schließlich die Gründe für eine stark heterogene magnetische Suszeptibilität mit anisotropem Charakter.[113] Um dies zu verstehen, kann ein homogener, sphärischer Rußpartikel mit der relativen Permeabilität mr1 und einem umgebenden Medium mit mr2 betrachtet werden (mr1 > mr2). In Abbildung 4.3-4 ist der Durchtritt einer Magnetfeldlinie durch ein sphärisches Rußpartikel schematisch dargestellt. Das externe Magnetfeld wird nach Eintritt in das Rußteilchen v v nach B1 und beim Austritt nach B2 abgelenkt. z-Achse v B2 v B1 α mr2 mr1 Abb. 4.3-4 Richtungsverlauf einer Magnetfeldlinie bei der Durchquerung eines β sphärischen Rußpartikels. v B0 v v Die vektorielle Änderung des Magnetfeldes von B0 nach B2 nach der Durchquerung des Rußpartikels lässt sich über einfache geometrische Berechnungen bestimmen zu [114] 2 v v µ r 1 B 2 = B0 sin β + cos 2 β µ r 2 1/ 2 2 µ r2 sin α + cos 2 α µ r 1 1/ 2 (4.3-30) Aus dieser theoretischen Überlegung geht hervor, dass das Magnetfeld an jeder Stelle der Partikeloberfläche, entsprechend den Ein- und Austrittswinkeln, einen anderen Wert aufweist. Die Änderungen sind dabei umso stärker, je größer die Differenz der beiden relativen Permeabilitäten ist. Die ungeordnete Aggregatstruktur der Carbon Blacks, auf 72 Kapitel 4 die bereits hingewiesen wurde, ist schließlich für eine stark anisotrope Verteilung der Magnetfeldlinien innerhalb der Probe verantwortlich, was wiederum eine Verbreiterung der Resonanzlinie zur Folge hat. Aus experimenteller Sicht können diese Suszeptibilitätseffekte durch Rotation der Probe im Magischen Winkel teilweise eliminiert werden.[57] 4.3.8.2 Ringstromeffekt in konjugierten π-Systemen Die Graphitebenen in Carbon Black zeichnen sich durch ein konjugiertes π-System aus, in dem die delokalisierten π-Elektronen zur Leitfähigkeit des Materials beitragen. Befinden sich diese Ebenen in einem Magnetfeld, so wird ein Ringstrom induziert, der wiederum lokale Magnetfelder im aromatischen System erzeugt. In Abbildung 4.3-5 ist der Verlauf der Magnetfeldlinien in einem Benzolring schematisch dargestellt. (a) (b) Xe v B0 Abb. 4.3-5 Schematische Darstellung des Ringstromeffektes im Benzol. (a) Magnetfeldlinien des induzierten Ringstromes. (b) Bereiche mit höherer (+) und geringerer (-) Abschirmung.[52] In der Mitte des Ringes ist das induzierte Feld dem äußeren entgegen gerichtet, am Rand gleichgerichtet. Dies hat zur Folge, dass die Kohlenstoffatome zur Mitte hin eine höhere und am Rand eine kleinere Abschirmung erfahren. Das induzierte Magnetfeld ist dabei am größten, wenn die Flächennormale der Molekülebene parallel zum externen Magnetfeld verläuft und gleich Null, wenn sie senkrecht dazu steht.[52] Für die adsorbierten Xenonatome hat dies zur Folge, dass sie je nach Adsorptionsplatz, in der Mitte oder am Rand eines konjugierten Ringes, ein anderes lokales Magnetfeld erfahren. Dies hätte unmittelbare Auswirkungen auf die chemische Verschiebung der 129 Xe-NMR-Spektroskopie einzelnen Spins und im 129 73 Xe-NMR-Spektrum führt dies zu einer zusätzlichen inhomogenen Verbreiterung der Resonanzlinien. 74 Kapitel 5 Ergebnisse 5.1 Einführung In dieser Arbeit wurden insgesamt 17 unterschiedliche Carbon Blacks und eine GraphitProbe mit Hilfe der 129 Xe-NMR-Spektroskopie untersucht und charakterisiert. Dazu zählen qualitative Untersuchungen der 129 Xe-NMR-Signale in Abhängigkeit von Rußstruktur, Druck und Temperatur, sowie quantitative Untersuchungen der Xenon-Adsorption in Carbon Black. Des Weiteren wurde die Xenon-Selbstdiffusion in ausgewählten Rußen untersucht und der Diffusionskoeffizient in Abhängigkeit von Druck und Diffusionszeit bestimmt. Alle Messungen wurden bei 293 K und somit oberhalb der kritischen Temperatur Tk des Xenons durchgeführt (Tk = 289,75 K). Für einen qualitativen Vergleich der 129 Xe-NMR-Spektren untereinander ist die Referenzierung von besonderer Bedeutung. Bei isobaren Messungen ist es ausreichend, das Signal des freien Xenons auf 0 ppm festzulegen. Bei variablen Drücken muss hingegen die Druckabhängigkeit der chemischen Verschiebung berücksichtigt werden. Dabei erweist sich eine Referenzierung auf das freie Xenongassignal bei 0 bar und 0 ppm als sinnvoll (vgl. Kapitel 4.1). In Kapitel 4.3.2 wurde bereits darauf hingewiesen, dass die chemische Verschiebung des freien Xenons δf(p) ist unterhalb von 50 bar linear von der Xenondichte abhängt. Bezogen auf den Xenondruck pXe ergibt sich daraus folgende Gleichung: δf(p) = 0,542 · pXe + δf(0 bar) (5.1-1) Hierbei wird entsprechend der Referenzierung δf(0) = 0 gesetzt. Durch Umstellen der Gleichung 5.1-1 nach dem pXe kann der Xenondruck einer Probe relativ genau aus der chemischen Verschiebung des Resonanzsignals des freien Xenons bestimmt werden. Der Fehler beträgt ca. ≤ 0,1 bar, bezogen auf einen Fehler bei der Bestimmung der chemischen Verschiebung von ca. ± 5 Hz. Ergebnisse 5.2 129 75 Xe-NMR-Verschiebung in Graphit und Carbon Black Zunächst werden die 129 Xe-NMR-Spektren der untersuchten Carbon Blacks vorgestellt. Der Xenondruck der Ruß-Proben beträgt zwischen 8 und 22 bar. In diesem Bereich kann in erster Näherung die Druckabhängigkeit des Adsorptionssignals vernachlässigt werden (vgl. Kapitel 5.2-3). Die Akquisition der 129 Xe-NMR-Spektren erfolgte mit Hilfe eines einfachen Einpuls-Experiments. Anstelle des üblichen 90°-Anregungspulses wurde ein 30°-Puls verwendet, der zwar bei der Aufnahme eines einzelnen Spektrums zu einem schlechteren Signal/Rausch-(S/N)-Verhältnis führt, die Wartezeit aber soweit herabsetzt, dass pro Zeiteinheit mehr Experimente durchgeführt werden können und dadurch im vergleichbaren Zeitraum ein besseres S/N-Verhältnis im Spektrum zu beobachten ist. Die Anzahl der akkumulierten Spektren ist dabei abhängig von der Xenondichte und liegt zwischen 32 und 512 (s. a. Kapitel 8 Experimenteller Teil). In Abbildung 5.2-1 sind die 129 Xe-NMR-Spektren einiger Carbon Blacks und von Graphit exemplarisch aufgeführt. Die angegebenen spezifischen Oberflächen wurden über BETMessungen ermittelt und sind den Produktinformationen der jeweiligen Hersteller entnommen.[3,7,8,13,14] In den 129 Xe-NMR-Spektren der Carbon Blacks liegen die Resonanzsignale des freien und adsorbierten Xenons getrennt voneinander vor. Im hohen Feld bis ca. 12 ppm ist das 129 Xe-NMR-Signal des freien bzw. außerhalb der porösen Strukturen befindlichen Xenons (extraporöses Xenon) zu finden, dass sich durch eine geringe Linienbreite von 30 bis 60 Hz hervorhebt. Die wesentlich breiteren Resonanzsignale im tieferen Feld können hingegen den innerhalb der Porenstruktur befindlichen Xenonatomen (intraporöses Xenon) zugeordnet werden. Das Signal des intraporösen Xenons ist, je nach spezifischer Oberfläche und Porenstruktur, im tiefen Feld zwischen 48,4 (N550) und 132 ppm (Black Pearls 2000) zu finden, wobei i. A. die chemische Verschiebungen mit der spezifischen Oberfläche zunimmt. Bei Vulcan P, Vulcan PF, Corax L, und Corax L6 existiert zudem ein weiteres, relativ breites Signal geringer Intensität, dass je nach Druck zwischen 190 und 203 ppm zu finden ist. Bei Monarch 1300 ist außerdem eine Überlagerung von zwei Signalen bei 121 und 138 ppm zu beobachten (Abbildung 5.2-1 und Tabelle 5.2-1). Im 129 Xe-NMR-Spektrum von Graphit, das hier als nichtporöse Referenz dient, ist nur ein einziges, inhomogen verbreitertes Signal um 5 ppm zu finden. Die Dekonvolution liefert eine Überlagerung von mindestens drei Resonanzlinien bei 1,8, 4,6 und 6,5 ppm. 76 Kapitel 5 Graphit < 1m2/g Ensaco 350 804 m2/g Vulcan PF 140 m2/g Ketjen Black 950 m2/g Vulcan P 140 m2/g Printex XE2 1000 m2/g Corax L 150 m2/g Conductex 40-220 1075 m2/g Corax L6 265 m2/g Ensaco 53 1100 m2/g Monarch 1300 560 m2/g Black Pearls 2000 1475 m2/g 300 250 200 150 100 50 0 -50 -100 300 250 200 150 50 0 -50 -100 (ppm) (ppm) Abb. 5.2-1 100 129 Xe-NMR-Spektren von Carbon Blacks mit unterschiedlicher spezifischer Oberfläche bei Raumtemperatur (s. Tabelle 5.2-1). Die Ergebnisse der chemischen Resonanzsignale der Spektren in Verschiebungen Abbildung und 5.2-1 Halbwertsbreiten sind in Tabelle der 5.2-1 zusammengefasst, wo sie mit den Ergebnissen von Sperling-Ischinsky verglichen werden können.[100] Des weiteren sind die jeweiligen spezifischen Oberflächen σs, mittleren 77 Ergebnisse Primärpartikelgrößen PG, sowie Stampfdichte ρSD und DBP-Wert der Carbon Blacks aufgeführt. Weitere charakteristische Eigenschaften der Carbon Blacks können im Anhang in Tabelle A.1.1 eingesehen werden. Tab. 5.2-1 Chemische Verschiebung δp und Halbwertsbreiten ∆ν1/2 der 129 Xe-NMR- Verschiebungen adsorbierter und intraporöser Xenonatome in Carbon Black. Vergleich mit den Ergebnissen von Sperling-Ischinsky.[100] (σs: spezifische Oberfläche, PG: mittlere Partikelgröße, ρSD: Stampfdichte, pXe: Xenon-Druck, weitere Parameter s. Tabelle A.1-1). Carbon Black (Abk.) σs* /m g PG* /nm 2 -1 ρSD* -3 /g·dm - /Hz δp /ppm δp [100] 8,4 148/ 110/ 1641 6,5/ 4,6/ 1,8 - pXe /bar ∆ν1/2 /ppm Graphit G <1 >1000 Raven 410 R4 28 - - - - - 33,2 N 550 N5 30 44 345 15,6 293 48,4 44,7 N 330 N3 83 28 370 16,4 461 65,4 56,8 VPF 140 19 190 20,6 822/ 1654 73,3/ 190 - Vulcan P VP 140 19 330 15,2 469/ 1621 90,1/ 191 - N 110 N1 143 - - - - - 64,0 Corax L CL 150 23 200 12,6 805/ 1598 77,0/ 190 72,2 Vulcan XC72R VXC 254 30 100 18,8 776/ 1691 62,8/ 189 - Corax L6 CL6 265 18 120 15,2 1091/ 1644 52,5/ 190 - Monarch 1300 M13 560 13 260 13,3 340/ 282/ 1587 121,4/ 138,0/ 190 122,1 Ensaco 23 E23 640 - - 14,0 652 104,2 - Ensaco 350 E35 804 - - 11,3 762 108,5 - Ketjenblack KB 950 - 110 12,6 366 104,8 - Printex XE2 PX2 1000 30-35 140 14,4 671 99,8 125,3 Conductex 40-220 CON 1075 - - 9,2 505 119,4 119,0 Ensaco 52 E52 1100 - - 15,7 571 80,8 - Black Pearls 2000 BP 1475 12 150 17,7 502 132,3 - Vulcan PF * Abk. Produktdatenblätter der Hersteller [3,7,8,13,14] 78 Kapitel 5 5.3 Druckabhängigkeit der Chemischen Verschiebung Die Druckabhängigkeit der 129 Xe-NMR-Verschiebung des intraporösen Xenons wurde bei den Rußen Vulcan PF, Vulcan P, Printex XE2 und Black Pearls 2000 untersucht. Bei Bis auf Printex XE2, einem Gasblack, handelt es sich bei diesen Rußen um Furnace Blacks mit einem geringen Anteil an Heteroatomgruppen, die sich hauptsächlich in ihrer Partikelgröße und der spezifischen Oberfläche unterscheiden (s. Tabelle 5.2-1). Vulcan P und Vulcan PF stellen die Pulver- und Perlenform des selben Rußes dar. Sie besitzen daher mit 140 m2/g die gleiche spezifische Oberfläche, unterscheiden sich aber in ihrer Stampfdichte, die bei Vulcan P mit 330 g/dm3 fast doppelt so groß ist wie bei Vulcan PF (190 g/dm3). Die 129 Xe-NMR-Spektren von Vulcan PF und Black Pearls 2000, den Rußen mit der kleinsten und größten spezifischen Oberfläche, sind mit steigendem Xenongasdruck in Abbildung 5.3-1 und 5.3-2 exemplarisch dargestellt. Zur Aufnahme der Spektren wurde ein einfaches Ein-Puls-Experiment mit einem 45°-Puls und einer Relaxationszeit von 60 s verwendet. Die Anzahl der akkumulierten Spektren beträgt jeweils 32. Die chemischen Verschiebungswerte sind unter Angabe des jeweiligen Drucks in Tabelle 5.3-1 aufgeführt Tab. 5.3-1 129 Xe-NMR-Verschiebungen von Vulcan P, Vulcan PF, Printex XE2 und Black Pearls 2000 bei verschieden Xenondrücken pXe. Vulcan PF δp1 Vulcan P Printex XE2 Black Pearls 2000 pxe /bar 0,8 /ppm 36,1 /ppm - δp2 pXe /bar 1,8 /ppm 63,2 δp pXe /bar 0,5 /ppm 48,6 δp pXe /bar 0,9 /ppm 43,3 δp 0,9 47,3 - 2,2 75,1 0,9 50,4 1,4 51,6 1,2 56,5 - 2,7 78,6 2,4 73,3 1,9 63,0 2,7 65,8 - 2,7 78,3 5,3 89,3 2,0 65,5 3,1 68,4 123,9 6,7 88,1 10,6 97,0 2,3 72,0 4,6 73,1 156,1 7,5 88,5 13,2 99,8 2,7 78,5 5,1 73,5 157,0 9,6 90,0 22,9 101,4 3,1 84,9 6,2 73,1 163,7 11,1 90,1 23,8 100,1 5,5 107,1 7,0 73,4 170,6 12,5 91,7 - - 7,4 117,4 9,1 72,8 185,0 21,2 89,2 - - 8,2 123,6 20,6 71,5/ 64,0 203,7 - - - - 17,7 132,5 79 Ergebnisse Vulcan PF 0,9 bar 1,2 2,7 3,1 4,6 5,1 6,2 7,0 9,1 VPF2 280 VPF1 240 200 160 120 20,6 80 40 0 -40 (ppm ) Abb. 5.3-1 129 Xe-NMR-Spektren von Vulcan PF (140 m2/g) mit zunehmendem Xenon- Gasdruck (0,9 bis 20,6 bar). Ab ca. 3 bar ist ein zweites Signal (VPF2) im tieferen Feld zu beobachten. 80 Kapitel 5 Black Pearls 2000 0,9 bar 1,4 1,9 2,0 2,3 3,1 5,5 7,4 8,2 17,7 160 140 120 100 80 60 40 20 0 -20 (ppm) Abb. 5.3-2 129 Xe-NMR-Spektren von Black Pearls 2000 (1475 m2/g) mit zunehmendem Xenon-Gasdruck (0,9 bis 17,7 bar). 81 Ergebnisse Bei allen vier Carbon Blacks ist eine deutliche Tieffeldverschiebung des 129 Xe-NMR- Signals der intraporösen Xenonatome mit steigendem Druck zu beobachten. Im Spektrum von Vulcan PF erfolgt zudem ab 3 bar eine Aufspaltung des Resonanzsignals in zwei getrennte Linien (VPF(1) und VPF(2), s. a. Abbildung 5.3-1). In Abbildung 5.3-3 ist die chemische Verschiebung δp als Funktion des Druckes pXe dargestellt. Im Gegensatz zum freien Xenon verläuft die Zunahme der chemischen Verschiebung nur bis ca. 2 bar annähernd linear. Bei höheren Drücken nimmt die Steigung ab und die jeweiligen Kurven erreichen jeweils ein spezifisches Plateau, das umso höher liegt, je größer die spezifische Oberfläche ist. Der Grenzwert von Vulcan P liegt mit 90 ppm trotz gleicher spezifischer Oberfläche über dem von Vulcan PF (1) (ca. 73 ppm). Auch das zweite Resonanzsignale bei Vulcan PF (2) wandert mit zunehmendem Druck zu tiefem Feld und erreicht ca. bei 20,6 bar annähernd einen Grenzwert bei 203,7 ppm. Oberhalb von 20 bar ist bei allen Rußen eine leichte Abnahme der chemische Verschiebung zu beobachten, die bei Vulcan PF von 73 auf 68 ppm am deutlichsten ausfällt. Bei näher Betrachtung der Resonanzlinie ist hier zudem eine inhomogene Verbreiterung zu beobachten. Chemische Verschiebung /ppm 220 200 VPF2 BP PX2 VP VPF1 180 160 140 120 100 80 60 40 0 2 4 6 8 10 12 14 16 18 20 22 24 26 Xenondruck /bar Abb. 5.3-3 Chemische Verschiebung des adsorbierten Xenons δp als Funktion des Xe-Gleichgewichtdrucks für vier verschiedene Carbon Blacks. Black Pearls 2000 (BP, 1475 m2/g), Printex XE2 (PX2, 1000 m2/g), Vulcan P und Vulcan PF (VP bzw. VPF, jeweils 140 m2/g). 82 5.4 Kapitel 5 Halbwertsbreiten und T2-Relaxation 5.4.1 Resonanzlinien des freien und extraporösen Xenons Die Halbwertsbreite ∆ν1/2 der 129 Xe-NMR-Signale einer reinen Xenongasprobe beträgt bei dem in dieser Arbeit verwendeten Probenkopf, und einer Feldstärke des Magnetfeldes von 4,69 Teslar, 35 – 44 Hz und ist bis 18,7 bar druckunabhängig. Die Xenonkerne außerhalb der Carbon Black Struktur liefern hingegen Resonanzlinien, deren Halbwertsbreiten zwischen 40 (Ensaco 350) und 130 Hz (Vulcan PF) liegen. Eine deutliche Druckabhängigkeit ist zudem bei Vulcan PF zu beobachten, bei dem eine Zunahme der Linienbreite von 80 auf 130 Hz im Bereich von 3 bis 20,6 bar erfolgt. 5.4.2 Resonanzlinien des intraporösen Xenons Im Vergleich zum Signal des freien bzw. extraporösen Xenons ist die Halbwertsbreite der intraporösen Xenonatome mit 297-1091 Hz um ein Vielfaches größer und variiert deutlich mit dem Carbon Black Typ. Die 129 Xe-NMR-Signale bei Rußen mit kleinen spezifischen Oberflächen und geringen Stampfdichten besitzen besonders hohe Halbwertsbreiten (> 500 Hz) (s Tabelle 5.2-1). Die größte Linienbreite ist mit 1091 Hz im 129 Xe-NMR-Spektrum von Corax L6 zufinden, die kleinste hingegen bei N 550 mit 293 Hz. Das bei einigen Carbon Blacks auftretende zweite Signal im tieferen Feld um 200 ppm zeigt Linienbreiten zwischen 1587 und 1691 Hz. 5.4.3 Druckabhängigkeit der Halbwertsbreite Die Druckabhängigkeit der Halbwertsbreite wird ebenfalls exemplarisch an Vulcan PF, Vulcan P, Printex XE2 und Black Pearls 2000 untersucht. Bei allen vier Carbon Blacks ist, wie bei der chemischen Verschiebung, eine Zunahme der Halbwertsbreite mit steigendem Druck zu beobachten (Abbildung 5.4-1 und Tabelle 5.4-1). Bereits bei kleinen Drücken unter 3 bar sind deutliche Unterschiede in den Linienbreiten der verschiedenen Carbon Blacks zu erkennen, wobei bei Printex XE2 und Black Pearls 2000 mit < 230 Hz zunächst die kleinsten Werte gefunden werden. Die Resonanzlinien von Vulcan P und PF zeigen hingegen bis 4 bar innerhalb eines Fehlerbereiches gleichgroße Halbwertsbreiten, die durchschnittlich 50 Hz oberhalb der anderen Rußen liegen. 83 Ergebnisse 700 Halbwertsbreite /Hz 600 500 400 300 VPF1 PX2 VP BP 200 100 0 2 4 6 8 10 12 14 16 18 20 22 24 26 Druck /bar Abb. 5.4-1 Halbwertsbreite ∆ν1/2 als Funktion des Xenondrucks für die Carbon Blacks Vulcan PF (140 m2/g), Vulcan P (140 m2/g), Printex XE2 (1000 m2/g) und Black Pearls 2000 (1475 m2/g). Oberhalb von 8 bar erreichen die Halbwertsbreiten einen Grenzwert, der bei Printex XE2 mit ca. 660 Hz über dem von Vulcan P (452 Hz) liegt. Bei Vulcan PF erfolgt durch eine inhomogene Verbreiterung der Resonanzsignal bei 20,6 bar eine sprunghafte Zunahme der mittleren Linienbreite auf 804 Hz. In Black Pearls 2000 nimmt die Linienbreite auch oberhalb von 8 bar weiter zu und erreicht bei 17,2 bar einen Wert von 502 Hz (s. Tabelle 5.4-1). Die Halbwertsbreite des zweiten Adsorptionssignals bei Vulcan PF ist mit durchschnittlich 1600 Hz in dem beobachteten Druckbereich druckunabhängig. 84 Kapitel 5 Tab. 5.4-1 Halbwertsbreiten der 129 Xe-NMR-Signale bei verschieden Xenondrücken pXe der Ruße Vulcan P, Vulcan PF, Printex XE2 und Black Pearls 2000. Vulcan PF pxe ∆ν1/2 /bar /Hz 0,8 150 Vulcan P pXe ∆ν1/2 /bar /Hz 1,8 256 Printex XE2 pXe ∆ν1/2 /bar /Hz 0,5 131 Black Pearls 2000 pXe ∆ν1/2 /bar /Hz 0,9 103 0,9 279 2,2 271 0,9 161 1,4 103 1,2 231 2,7 322 2,4 227 1,9 139 2,7 313 2,7 310 5,3 314 2,0 147 3,1 349 6,7 396 10,6 659 2,3 169 4,6 501 7,5 449 13,2 642 2,7 183 5,1 517 9,6 439 22,9 671 3,1 234 6,2 493 11,1 448 23,8 663 5,5 300 7,0 506 12,5 460 - - 7,4 373 9,1 584 21,2 452 - - 8,2 461 20,6 804 - - - - 17,7 502 5.4.4 T2-Relaxation Die Frage, ob die Resonanzlinien der mit der Carbon Black Oberfläche wechselwirkenden Xenonatome homogen oder inhomogen verbreitert sind, lässt sich über die Bestimmung der transversalen Relaxationszeit T2 beantworten (vgl. Kapitel 4.1.2). Dazu wurden die T2Zeiten mit Hilfe der Carr-Purcell-Meiboom-Gill (CPMG)-Pulssequenz bestimmt.[115] Bei der Verwendung dieser Methode können zusätzliche Relaxationseffekte, wie sie z. B. durch Anisotropie- oder Austauscheffekte hervorgerufen werden können, eliminiert werden. Eine ausführliche Beschreibung der Pulssequenz erfolgt im experimentellen Teil dieser Arbeit in Kapitel 8.5.3. In Tabelle 5.4-2 sind die T2-Zeiten aus dem CPMG-Experiment für zwei verschiedene Carbon Blacks exemplarisch aufgeführt. Neben der Druckabhängigkeit erfolgt zudem ein Vergleich mit der aus der Halbwertsbreite ermittelten T2*-Zeit, die alle Relaxationseffekte berücksichtigt. T2* = 1 π ∆ν 1/ 2 (5.4-1) 85 Ergebnisse Unter isobaren Bedingungen unterscheiden sich die transversalen Relaxationszeiten der intraporösen Xenonatome bei den hier untersuchten Carbon Blacks nur wenig voneinander. Bei ca. 3 bar beträgt sie für Vulcan PF und Black Pearls 2000 jeweils 5,5 ms. Mit zunehmendem Druck nimmt sie bei Vulcan PF bis auf 1,2 ms ab. Für Black Pearls 2000 ist hingegen eine Abnahme von 19,5 auf 3,8 ms bei einer Druckerhöhung von 1,4 auf 7,4 bar zu beobachten. Unter 3 bar sind die transversalen Relaxationszeiten T2* bei beiden Carbon Blacks um den Faktor sechs bis sieben kleiner als T2. Oberhalb von 3 bar sind sie nur noch um den Faktor drei kleiner und nehmen mit steigendem Druck prozentual in gleichem Maße wie T2 ab (Tabelle 5.4-2). Tab. 5.4-2 T2- und T2*-Relaxationszeiten aus den CPMG-Experimenten bzw. der Halbwertsbreite ∆ν1/2 des Adsorptionssignals. Vulcan PF pXe /bar 2,9 T2 (CPMG) /ms 5,5 ± 0,6 T2* = (π∆ν1/2)-1 ± 0,02 /ms 1,14 (140 m2/g) 9,1 1,7 ± 0,3 0,52 20,6 1,2 ± 0,3 0,36 Black Pearls 2000 1,4 19,5 ± 1,5 3,00 (1475 m2/g) 3,1 5,5 ± 0,7 1,74 7,4 3,8 ± 0,2 1,24 Probe 86 5.5 Kapitel 5 T1-Relaxation Insbesondere bei der quantitativen Auswertung der 129 Xe-NMR-Spektren ist eine genaue Kenntnis der Spin-Spin-Relaxationszeit T1 notwendig. Sie bestimmt im NMR-Experiment die Wartezeit zwischen Akquisition und erneuter Anregung, die üblicherweise im Bereich von 5⋅T1 liegen soll. Die T1-Relaxationszeiten der intra- (T1,p) und extraporösen (T1,f) Xenonatome wurden exemplarisch für die Ruße Vulcan PF und Black Pearls 2000 mit Hilfe der sog. Inversion Recovery-(IR)–Methode bestimmt (s. Kapitel 8.5.2). Die Länge des 90°-Pulses betrug 12 – 15 µs und die Wartezeit zwischen Akquisition und Start einer erneuten Pulsfolge betrug maximal 10 min (ca. 5⋅T1). Die Ergebnisse sind in Tabelle 5.4-1 zusammenfassend aufgeführt. In einer reiner Xenongasprobe kann T1 auch bei hohen Drücken mehrere Minuten oder sogar Stunden betragen (s. Kapitel 4.3). Im Vergleich dazu sind die Relaxationszeiten der extraporösen Xenonkerne wesentlich kürzer und liegen z. B. für Vulcan PF und Black Pearls 2000 bei 14,7 und 97 s. Die T1-Zeiten des intraporösen Xenons sind nochmals etwa um einen Faktor zehn kleiner. Sie zeigen zudem eine Druckabhängigkeit, die sich bei Vulcan PF in einer leichten Abnahme von 3,26 auf 1,87 s, und bei Black Pearls 2000 in einer deutlichen Zunahme von 1,23 auf 9,5 s äußert (Tabelle 5.5-1). Tab. 5.5-1 T1-Relaxationszeiten aus Inversion-Recovery-Experimenten der Xenonatome innerhalb (T1,p) und außerhalb (T1,f) der Porenstruktur. Probe Vulcan PF Black Pearls 2000 p /bar 9,1 T1,p /s 3,26 ± 0,10 T1,f /s 16,32 ± 2,18 20,6 1,87 ± 0,31 14,71 ± 2,77 7,4 1,23 ± 0,18 94,73 ± 5,87 17,7 9,50 ± 0,52 97,23 ± 6,08 87 Ergebnisse 5.6 Xenon-Diffusion in Carbon Black 5.6.1 Einführung Die freie Selbstdiffusion der Xenonatome außerhalb und die gehinderte Diffusion innerhalb der porösen Carbon Black Struktur wurde mit Hilfe der PFG-NMRSpektroskopie untersucht und die jeweiligen Diffusionskoeffizienten in Abhängigkeit von Druck, Porengröße und Diffusionszeit bestimmt. Der Diffusionskoeffizient wurde über die relative Intensitätsänderung E(G)/E(0) des 129 Xe-NMR-Signals mit steigender Gradientenfeldstärke G ermittelt (vgl. Kapitel 3.2). ln δ E (G ) = −γ 2δ G2G 2 D ∆ − G E (0 ) 3 (5.6-1) Die PFG-NMR-Untersuchungen an Carbon Black Proben mit geringen Xenon-Drücken und großen Halbwertsbreiten der 129 Xe-NMR-Signale lieferten keine Ergebnisse, da auch bei kurzen Diffusionszeiten ∆ und kleinen Gradientenpulsen δG eine zu schnelle Intensitätsabnahme der Resonanzsignale erfolgte. Nur bei Black Pearls 2000 konnten druck- und diffusionszeitabhängige Messungen erfolgreich durchgeführt werden. 5.6.2 Diffusion des freien und extraporösen Xenons Die freie Selbstdiffusion des Xenons wurde sowohl in einer reinen Xenongas-Probe, als auch in Gegenwart eines Carbon Blacks untersucht und jeweils der Diffusionskoeffizient bestimmt. Bei einer reinen Xenonprobe mit einem Innendruck von 21,2 bar beträgt der Diffusionskoeffizient der freien und ungehinderten Diffusion 2,6⋅10-8 m2/s. Ein Vergleich mit der Literatur zeigt, dass Df bei einer Druckerhöhung von 1 auf 21,2 bar um mehr als zwei Größenordnungen abnimmt (Abbildung 5.6-1a und Tabelle 5.6-1). Der Diffusionskoeffizient des extraporösen Xenons im heterogenen System Xenon– Carbon Black ist im vergleichbaren Druckbereich um ca. eine Größenordnung kleiner als der des freien Xenons (Black Pearls 2000 bei 10,9 bar: 6,6·10-8 m2/s, Xenongas: 72,4·10-8 m2/s bei 12 bar). Hierbei ist ebenfalls ein Abnahme mit steigendem Druck bzw. Dichte zu beobachten, allerdings ist die Änderung weniger stark ausgeprägt als bei der reinen Xenonprobe. So nimmt der Diffusionskoeffizient in Black Pearls 2000 88 Kapitel 5 bei 17,7 bar einen Wert von 1,9·10-8 m2/s an und liegt damit, wie auch bei Vulcan PF mit 1,7·10-8 m2/s (20,6 bar), nur geringfügig unter dem gefunden Wert der freien Diffusion bei 21,2 bar (2,6⋅10-8 m2/s, Tabelle 5.6-1). Die jeweils zurückgelegte mittlere freie Weglänge < r 2 > der Xenonatome lässt sich mit Hilfe von Gleichung 5.6-2 bestimmen (vgl. Kapitel 3.3). < r 2 > = 6∆D (5.6-2) In Tabelle 5.6-1 sind die mittleren freien Weglängen der freien und extraporösen Xenonatome bei einer Diffusionszeit von 10 ms exemplarisch aufgeführt. In Abbildung 5.6-1 ist < r 2 > der freien Xenonatome gegen den Druck aufgetragen. Hier zeigt sich eine annähernd lineare Abnahme der Weglänge mit zunehmendem -6 5,0x10 -6 5 4,0x10 -6 4 3,0x10 -6 3 2,0x10 -6 2 1,0x10 -6 Mair (a) (b) -1/2 0,0 /mm s 1 diese Arbeit 1/2 Junker 6 2 Df /m s 6,0x10 (<r >/∆) 2 -1 Xenondruck. 0 0 4 8 12 Druck /bar 16 20 24 0 4 8 12 16 20 24 Druck /bar Abb. 5.6-1 (a) Diffusionskoeffizient Df und (b) relative freie Weglänge < r 2 > des freien Xenons bei Raumtemperatur als Funktion des Druckes. Vergleich mit den Ergebnissen von Mair et al. [116] und Junker. [97] 89 Ergebnisse Tab. 5.6-1 Xenon-Diffusionskoeffizienten und mittlere freie Weglängen (∆ = 10 ms) des reinen sowie des extraporösen Xenons in Carbon Black. p /bar Df /10-8 m2s-1 <r2 > /µm 1,0 571 585 12,0 72,4 ≤ 2,00 208 ± 34 Diese Arbeit 21,2 2,6 ≤ 0,17 39 ± 10 Extraporöses Xenon: Black Pearls 2000 10,9 6,6 ≤ 0,38 63 ± 15 Black Pearls 2000 17,7 1,9 ≤ 0,15 34 ± 9 Vulcan PF 20,6 1,7 ≤ 0,16 32 ± 10 Printex XE2 23,8 2,2 ≤ 0,13 36 ± 9 Referenz/ Probe Reines Xenongas : (Mair, 1998)[116] (Junker, 2000) [97] 5.6.3 Diffusion des intraporösen Xenons Die Diffusion des intraporösen Xenons wurde in Abhängigkeit von der spezifischen Oberfläche, dem Druck und der Diffusionszeit ∆ untersucht. Dazu wurden die XenonDiffusionskoeffizienten von drei Carbon Blacks mit unterschiedlicher spezifischer Oberfläche bestimmt. Um die Ergebnisse miteinander vergleichen zu können, wurden die gleichen Gradientenpulslängen δG (0,3 ms) sowie die gleichen Diffusionszeiten ∆ (10 ms) verwendet. Die Diffusionskoeffizienten und die nach Gleichung 5.6-2 erhaltenen mittleren, freien Weglängen sind für Vulcan PF, Ketjen Black und Black Pearls 2000 in Tabelle 5.6-2 aufgeführt. Tab. 5.6-2 Ergebnisse der Xenon-Diffusionsmessungen an Carbon Black (δG = 0,3 ms, ∆ = 10 ms). σS pXe Dp /m g /bar /10 m s < r2 > /µm Vulcan PF 140 14,0 28,30 ≤ 0,9 41,2 ≤ 0,7 Ketjen Black 950 12,6 10,20 ≤ 0,7 24,7 ≤ 0,8 Black Pearls 2000 1475 10,9 8,62 ≤ 0,3 22,7 ≤ 0,8 Carbon Black 2 -1 -9 2 -1 90 Kapitel 5 Die Diffusionskoeffizienten Dp des intraporösen Xenons sind im Vergleich zu Df um einen Faktor 1,5 bis 2 kleiner. Zudem zeigt sich eine deutliche Abnahme in Dp mit zunehmender spezifischer Oberfläche (Abbildung 5.6-2). So wurde für Vulcan PF (140 m2/g) ein Wert von 2,8·10-8 m2/s ermittelt. Ketjen Black besitzt hingegen mit 950 m2/g eine fast siebenmal so große spezifische Oberfläche, wobei der Diffusionskoeffizient mit 1.01·10-8 m2/s etwa ein Drittel kleiner ist. Black Pearls 2000, der Ruß mit der größten spezifischen Oberfläche, (1475 m2/g) liefert mit 8,71·10-9 m2/s den kleinsten Wert. Über Gleichung 5.6-2 ist eine Abnahme der mittleren freien Weglänge mit zunehmendem σs verbunden (Tabelle 5.6-2). 30 VPF 20 -9 Dp /10 m s 2 -1 25 15 KB BP 10 5 0 200 400 600 800 1000 1200 1400 1600 2 -1 spezifische Oberfläche /m g Abb. 5.6-2 Xenon-Diffusionskoeffizient Dp in Carbon Blacks mit unterschiedlicher spezifischer Oberfläche σs. Vulcan PF (VPF, 14,0 bar), Ketjen Black (KB, 12,6 bar) und Black Pearls (BP, 10,9 bar) (δ = 0,3 ms, ∆ = 10 ms). 91 Ergebnisse 5.6.4 Druckabhängige Xenon-Diffusionsmessungen Die im letzten Kapitel vorgestellten Ergebnisse sind nur bedingt repräsentativ, da die Diffusionskoeffizienten nur von drei verschieden Carbon Blacks ermittelt wurden, und zudem die Xenongasdrücke zwischen 10,9 – 14 bar variieren. Es ist aber zu erwarten, dass die Kollisionswahrscheinlichkeit der Xenonatome mit der Porenwand, sowie die der Xenonatome untereinander, druck- bzw. dichteabhängig ist. Um dies zu untersuchen wurde der Diffusionskoeffizient von Black Pearls 2000 bei verschiedenen Drücken im Bereich von 1,9 – 17,7 bar bestimmt. Das Diagramm in Abbildung 5.6-3 zeigt den Diffusionskoeffizienten der intraporösen Xenonatome Dp als Funktion des Xenondrucks pXe. Zunächst nimmt Dp im Bereich von 2 bis 8 bar von 10,7·10-9 auf 6,3·10-9 m2/s ab. Bei einer weiteren Druckerhöhung auf über 10 bar wird Dp druckunabhängig und erreicht mit 5,56·10-9 m2/g annähernd einen Grenzwert. Gleichzeitig nimmt die von den Xenonatome zurückgelegte mittlere freie Weglänge während ∆ zunächst linear von ca. 57 auf 43 µm ab und erreicht bei 17,7 bar einen Wert von 40,8 µm (Tabelle 5.6-3). 12 11 9 -9 Dp /10 m s 2 -1 10 8 7 6 5 2 4 6 8 10 12 14 16 18 Xenondruck /bar Abb. 5.6-3 Xenon-Diffusionskoeffizient der gehinderten Diffusion als Funktion des Xenongasdrucks von Black Pearls 2000 (δ = 0,3 ms, ∆ = 50 ms). 92 Kapitel 5 Tab. 5.6-3 Der Xenon-Diffusionskoeffizient Dp von Black Pearls 2000 und die zurückgelegte freie Weglänge in Abhängigkeit vom Xenongasdruck p (δ = 0,3 ms, ∆ = 50 ms). pXe /bar Dp /10-9m2s-1 1,9 10,71 ≤ 0,51 < r2 > /µm 56,7 ≤ 1,33 3,1 10,41 ≤ 0,50 55,9 ≤ 1,33 5,5 8,82 ≤ 0,74 51,4 ≤ 2,11 8,2 6,36 ≤ 0,83 43,7 ≤ 2,76 10,9 6,01 ≤ 0,62 42,5 ≤ 2,14 17,7 5,56 ≤ 0,25 40,8 ≤ 0,91 5.6.5 Diffusionszeitabhängige Xenon-Diffusionsmessungen Diffusionszeitabhängige Messungen des Diffusionskoeffizienten wurden unter isobaren Bedingungen an Black Pearls 2000, dem Ruß mit der kleinsten Poren- und Partikelgrößen, bei 10,9 bar durchgeführt. Die Diffusionszeit ∆ wurde im Bereich von 4 bis 200 ms variiert und Dp(∆) über Gleichung 5.6-1 bestimmt. Die Ergebnisse sind in Tabelle 5.6-4 zusammengefasst und in Abbildungen 5.6-4 graphisch dargestellt. 12 -9 70 2 -1 2 -1/2 /µm 20 40 60 (<r >) Dp /10 m s 11 60 10 9 50 8 7 40 6 30 5 4 20 3 2 10 0 20 40 60 80 100 120 140 160 180 200 220 Diffusionszeit /ms 0 80 100 120 140 160 180 200 220 Diffusionszeit /ms Abb. 5.6-4 Xenon-Diffusionskoeffizient Dp als Funktion der Diffusionszeit ∆. Probe: Black Pearls 2000 (pXe=10,9 bar, δG = 0,3 ms). 93 Ergebnisse Dp nimmt bei einer Erhöhung der Diffusionszeit von 4 auf 200 ms fast um eine Größenordnung ab und erreicht bei 200 ms einen Wert von 3,27·10-9 m2/s. Die mittlere freie Wegstrecke nimmt Diffusionsmessungen entsprechend mit Intensitätsverlustes der mit Diffusionszeiten über 6D∆ zu. 200 ms Experimentell aufgrund eines konnten starken 129 Xe-NMR-Signale und der damit verbundenen geringeren Anzahl an Datenpunkten nicht mehr erfolgreich durchgeführt werden. Tab. 5.6-4 Xenon-Diffusionskoeffizienten der gehinderten Diffusion in Black Pearls 2000 (10,9 bar) für verschiedene Diffusionszeiten ∆ (δG = 0,3 ms). ∆ 5.7 /ms 4 Dp /10 m2/s 10,80 ≤ 0,76 < r2 > /µm 16,1 ≤ 0,57 10 8,62 ≤ 0,31 22,7 ≤ 0,41 16 8,12 ≤ 0,19 27,9 ≤ 0,33 30 8,00 ≤ 0,44 37,9 ≤ 1,04 50 6,01 ≤ 0,62 42,5 ≤ 2,19 100 4,73 ≤ 0,75 53,3 ≤ 4,22 200 3,27 ≤ 0,70 62,6 ≤ 6,71 -9 Quantitative Untersuchung der 129Xe-NMR-Signale Die Integrale der 129 Xe-NMR-Linien liefern die relativen Xenonanteile im intra- und extraporösen Bereich der Carbon Black Strukturen. Voraussetzung ist, dass sich die Xenon/Carbon Black - Probe vollständig im Spulenraum des NMR-Messkopfes befindet (s. Kapitel 8.1). In Abbildung 5.7-1 ist die Zunahme der relativen Signalintensität der intraporösen Xenonatome, bezogen auf die Masse der Carbon Blacks mCB, von Vulcan PF, Printex XE2 und Black Pearls 2000 dargestellt. Bei allen drei Rußen ist ein Anstieg der relativen Signalintensität mit steigendem Druck zu beobachten. Dabei sind die Werte von Printex XE2 und Black Pearls 2000 im vergleichbaren Druckbereich stets größer als die von Vulcan PF und zeigen bis ca. drei bar einen ähnlichen Verlauf. Zwischen 8 und 10 bar erreichen die Kurven annähernd 94 Kapitel 5 einen Grenzwert, der bei Black Pearls 2000 entsprechend der höheren spezifischen Oberfläche über dem von Printex XE2 liegt. Bei Vulcan PF ist hingegen bis 20,6 bar ein nahezu linearer Verlauf zu beobachten. rel. Signalintensität /mCB /g -1 1,0 0,8 0,6 Black Pearls 2000 Printex XE2 Vulcan PF 0,4 0,2 0,0 0 4 8 12 16 20 24 Xenondruck /bar Abb. 5.7-1 Relative Integrale der 129 Xe-NMR-Signale intraporöser Xenonatome mit zunehmendem Xenondruck. 5.8 Temperaturabhängigkeit der chemischen Verschiebung Die temperaturabhängigen 129 Xe-NMR-Experimente an Carbon Black wurden von Frau Sperling-Ischinsky im Rahmen ihrer Dissertation vollständigen Darstellung der [100] durchgeführt und sollen hier nur zur 129 Xe-NMR-Untersuchungen an Carbon Blacks aufgeführt und mit den in dieser Arbeit durchgeführten Experimenten verglichen werden. In Abbildung 5.8-1 ist hierzu die Chemische Verschiebung ∆δ = δp - δf als Funktion der Temperatur für verschiedene Carbon Blacks dargestellt. Die dazugehörigen Zahlenwerte sind in Tabelle 5.8-1 aufgelistet. Insgesamt ist für alle Carbon Blacks ein Anstieg der Chemischen Verschiebung mit abnehmender Temperatur zu beobachten. In dem hier untersuchten Temperaturbereich von 298 - 243 K kann sie dabei um bis zu 100 ppm zunehmen. Auffällig ist, dass die 95 Ergebnisse Kurve für Monarch 1300 nahezu parallel zu denen von Printex XE2 und Conductex 40- 220 verläuft, obwohl die spezifische Oberfläche mit 560 m2/g jeweils nur halb so groß ist. Chemische Verschiebung /ppm 200 180 160 140 1000 560 1075 120 100 80 150 143 83 30 28 60 40 20 240 250 260 270 280 290 300 310 Temperatur /K Abb. 5.8-1 Chemische Verschiebung des intraporösen Xenons als Funktion der Temperatur für Carbon Blacks mit unterschiedlichen spezifischen Oberflächen (in m2/g).[100] Tab. 5.8-1 Chemische Verschiebungswerte ∆δ = δp - δf (in ppm) von Carbon Blacks mit unterschiedlicher spezifischer Oberfläche in Abhängigkeit von der Temperatur.[100] Temp. /K Raven 410 28 m2/g N 550 N 330 30 m2/g 83 m2/g N 110 Corax L 143 m2/g 150 m2/g Monarch 1300 560 m2/g Printex XE2 1000 m2/g Conductex 40-220 1075 m2/g 298 33,2 44,7 56,8 64,0 72,2 122,1 125,3 119,0 283 40,2 -- -- -- 79,4 134,4 134,4 132,8 273 48,7 68,2 77,2 89,7 92,7 144,0 144,0 145,1 263 58,6 79,0 91,4 102,6 101,1 153,9 153,9 160,2 253 75,5 96,1 111,2 116,9 123,6 174,2 174,2 178,9 243 97,0 142,4 157,4 131,6 166,3 185,7 185,7 192,3 96 Kapitel 6 Diskussion 6.1 Einführung Die Eigenschaften der 129 Xe-NMR-Signale von Xenonatomen in mikroporösen Strukturen, wie chemische Verschiebung und Halbwertsbreite, werden in erster Linie von der Porengröße und der Porengrößenverteilung bestimmt. Daher wird zunächst ein Porenmodell für Carbon Blacks vorgestellt, das als Grundlage für die nachfolgende Interpretation der 129 Xe-NMR-Spektren dient. Eine Abschätzung der mittleren Porengröße erfolgt dabei mit Hilfe der Partikelgröße bzw. der spezifischen Oberfläche und Stampfdichte. Ein Model zur Porengrößenbestimmung über die Druckabhängigkeit der chemische Verschiebung wird ebenfalls vorgestellt. Die 129 Xe-Resonanzlinien werden außerdem durch druck- und temperaturabhängige Austauschprozesse beeinflusst, die über die Selbstdiffusion der Xenonatome direkt beobachtet werden können. Des weiteren werden Eigenschaften der Adsorbentoberfläche, wie Porosität und Oberflächenchemie, über die Relaxationszeiten untersucht und charakterisiert. Zuletzt wird das Adsorptionsverhalten auf der Carbon Black Oberfläche quantitativ durch Anwendung der Adsorptionstheorien nach Langmuir, BET und Dubinin untersucht. 6.2 Porenmodell für Carbon Blacks In Kapitel 2 wurden bereits die grundlegenden strukturellen Eigenschaften mikroporöser Ruße ausführlich vorgestellt. Bei genauerer Betrachtung ergeben sich daraus mindestens drei verschiedene Porenarten, die für die Xenonatome zugänglich sind und theoretisch jeweils eine Resonanzlinie im 129 Dazu Intraaggregatporen, gehören Primärpartikeln. Inter- und Xe-NMR-Spektrum hervorrufen (s. Abbildung 6.2-1). sowie Poren in mikroporösen 97 Diskussion Die chemischen Verschiebungen und Halbwertsbreiten der 129 Xe-NMR-Signale sind dabei von der Porengröße und der Porengrößenverteilung abhängig. Kleine Poren führen i. A. zu verstärkten Wechselwirkungen der Xenonatome mit der Adsorbentoberfläche und somit zu höheren chemischen Verschiebungen. Die größten Porenräume bilden sich bei der Agglomeration der Aggregate und werden als Interaggregatporen bezeichnet. Aus makroskopischer Sicht bestimmen sie die Stampfdichte der Carbon Blacks, wobei eine hohe Stampfdichte kleinen Interaggregatporen entspricht und umgekehrt. Das 129 Xe- NMR-Signal ist dabei jeweils zum tiefen bzw. hohen Feld verschoben. Die unregelmäßige Struktur der Aggregate führt zusätzlich zu einer Porengrößenverteilung und somit zu einer inhomogenen Linienverbreiterung, wie es in Abbildung 6.2-1 schematisch dargestellt ist. Kleinere Poren entstehen bei der Aggregation der Primärpartikel, die, wie wir in Kapitel 6.3.1 sehen werden, bei einer kubischdichten Anordnung linear von der mittleren Partikelgröße abhängen. Die Resonanzlinien der in diesen Intraaggregatporen adsorbierten Xenonatome sind aufgrund der stärkeren Wechselwirkungen mit der Porenoberfläche zu tieferem Feld verschoben. Im Gegensatz zu den Interaggregatporen ist hier eine homogenere Porengrößenverteilung zu erwarten, die wiederum zu kleineren Halbwertsbreiten führen. Poröse Primärpartikel liefern schließlich die dritte Porenart, die nur in Carbon Blacks mit hoher spezifischer Oberfläche (> 500 m2/g) zu finden ist.[1-3] Hier befinden sich die Xenonatome innerhalb der Kohlenstoffmatrix in Intrapartikelporen, wo sie direkt von aliphatischen und aromatischen Kohlenstoffatomen umgeben sind (vgl. Netzwerktheorie in Kapitel 2.3.3), so dass man daher auch von einer Absorption der Xenonatome sprechen kann. Aufgrund der hohen Wechselwirkungen mit der Festkörpermatrix ist hierbei die höchste Tieffeldverschiebung der Resonanzsignale zu beobachten. Die chemischen Verschiebung sollte dabei unabhängig von den makroskopischen Eigenschaften sein und somit für alle Carbon Blacks mit mikroporösen Primärpartikeln den gleichen Wert annehmen. Zuletzt sei auf das Resonanzsignal des freien (extraporösen) Xenons hingewiesen, das unter Vernachlässigung von Austauscheffekten stets ein Signal geringer Halbwertsbreite im hohen Feld liefert und dessen chemische Verschiebung zur genauen Bestimmung des Innendrucks der Probe benutzt wird. Anhand dieses Porenmodells und den nun beschriebenen Austausch- und Diffusionsprozessen, werden die einzelnen Carbon Blacks hinsichtlich ihrer Struktur und 98 Kapitel 6 Oberflächenchemie charakterisiert. Die chemische Verschiebung und Halbwertsbreite werden jeweils in einem gesonderten Kapitel betrachtet (Kapitel 6.5 und 6.6). Primärpartikel C Aggregate/ Agglomerate 2- Xe Xe Xe Xe Xe Xe Xe Xe Xe µm Xe nm pm Intraaggregatporen Interaggregatporen rel. Intensität Intrapartikelporen Extraporöser Bereich/ Freies Xenon Chemische Verschiebung 0 ppm Porengröße Abb. 6.2-1 Zuordnung der Resonanzlinien im 129 Xe-NMR-Spektrum für verschiedene Porenarten im Carbon Black. Die chemische Verschiebung nimmt mit abnehmendem Porenradius zu. 99 Diskussion 6.3 Porengrößenbestimmung 6.3.1 Intraaggregatporen Der höchste Aggregationsgrad wird theoretisch durch eine kubisch dichte Anordnung sphärischer Primärpartikel erreicht. Innerhalb der dabei gebildeten Zwischenräume beträgt der maximale Abstand zmax eines punktförmigen Teilchens von der Oberfläche genau z max = 1 PG − 1 . 2 sin(109,5° / 2) (6.3-1) Die Abstände zmax der hier untersuchten Carbon Blacks sind in Tabelle 6.3-1 aufgeführt. Die kleinste mittlere Primärpartikelgröße besitzt Black Pearls 2000 mit 12 nm. Der maximale Abstand zmax beträgt somit 1,35 nm, also etwa das Dreifache eines Xenondurchmessers (= 0,44 nm). Bei N550, dem Ruß mit dem größten Partikeldurchmesser (44 nm) nimmt zmax einen Wert von 4,94 nm an, also etwa das 11-fache eines Xenonatoms. Der Abstand zur Partikeloberfläche innerhalb einer dichtgepackten Primärpartikelebene ist ebenfalls linear von der Partikelgröße abhängig und lässt sich berechnen zu z´ max = PG 1 − 1 . 2 cos 30° (6.3-2) Für Black Pearls 2000 entspricht einem maximalen Abstand z´max von 0,93 nm, also etwa zwei Xenondurchmesser. Bei kleinen Primärartikelgrößen werden also leicht Porenradien in molekularen Größenordnungen erreicht. Zur Erklärung des häufig bei Carbon Blacks beobachteten Molekularsiebeffekts, ist die Verwendung eines Netzwerkmodells daher nicht zwingend erforderlich (vgl. Kapitel 2.3.4). Typische Merkmale einer kubisch dichten Anordnung der Primärpartikel bei Carbon Blacks sind hohe Stampfdichten in Verbindung mit einer geringen spezifischen Oberfläche. Ruße mit stark verzweigten Aggregaten zeichnen sich hingegen durch geringe Stampfdichten und große spezifische Oberflächen aus. Die Anordnung der Primärpartikel innerhalb des Aggregates bestimmt also die mittlere Größe der Intraaggregatporen. Da die Aggregate die kleinste dispergierbare Einheit der Carbon Blacks darstellen, bleiben diese Poren auch bei einer Nachbehandlung unverändert. Hingegen können die bei der Agglomeration gebildeten Aggregatzwischenräume (Interaggregatporen) durch nachträgliche Verdichtung der Probe verkleinert werden. 100 Tab. 6.3-1 Kapitel 6 Maximale Abstände zmax Porenmitte zur Porenwand in einer kubisch dichten Anordnung sphärischer Primärpartikel mit dem Durchmesser PG N 550 N5 PG /nm 44 N 330 N3 28 3,14 VPF 19 2,13 Vulcan P VP 19 2,13 Corax L CL 23 2,58 Vulcan XC-72R VXC 30 3,37 Corax L6 CL6 18 2,02 Monarch 1300 M13 13 1,46 Printex XE2 PX2 33 3,66 Black Pearls 2000 BP 12 1,35 Carbon Black Abk. Vulcan PF zmax /nm 4,94 6.3.2 Porenradius aus Stampfdichte und spezifischer Oberfläche Ein mittlerer Porenradius R P , der alle innerhalb der Carbon Black Struktur vorkommenden Porenarten und –größen berücksichtigt, lässt sich aus der Stampfdichte ρSD und der spezifischen Oberfläche σs erhalten. Ausgehend von einer mittleren Dichte der Primärpartikel von ρCB = 1,85 g/cm3 [1] kann zunächst das spezifische freie Porenvolumen VP/mCB ermittelt werden. VP 1 1 = − mCB ρ SD ρ CB (6.3-3) Hierbei ist mCB die Masse des Carbon Blacks. Mit σs lässt sich nun das mittlere Volumen/Oberfläche-Verhältnis VP/S bestimmen, dass sich direktproportional zum mittleren Porenradius R P verhält. Vp S = VP 1 ⋅ ∝ RP mCB σ s (6.3-4) Die so ermittelten Porenradien sind für einige Carbon Blacks in Tabelle 6.3-2 aufgeführt. Die Werte liegen im Nanometerbereich, sind aber im Vergleich zu den aus der 101 Diskussion Partikelgröße bestimmten Porenradien (Tabelle 6.3-1) um ein Vielfaches größer, da hier nicht nur die kleinstmöglichen Intraaggregatporen, sondern ein über alle Porenarten gemittelter Radius bestimmt wird (s. Porenmodel in Kapitel 6.2). Zudem ist bei Carbon Blacks, die im Vergleich zu Zeolithen eine eher ungeordnete Porenstruktur besitzen, eine breite Porengrößenverteilung mehr als wahrscheinlich, da keines der Aggregate bzw. Agglomerate einem zweiten gleicht und somit weder eine Nah- noch eine Fernordnung zwischen den Primärpartikeln existiert. Der mittlere Porenradius R P lässt sich daher theoretisch auch aus dem Schwerpunkt einer Porengrößenverteilungsfunktion F(RP) bestimmen (s. Abbildung 6.3-1): RP ∫ R F (R )dR = ∫ F (R )dR 3 P P P P (6.3-5) P F(Rp) Abb. 6.3-1 Schematische Darstellung RP Tab. 6.3-2 einer Porengrößenverteilungsfunktion. Rp F(Rp)=Anzahl der Poren mit Radius Rp. Mittlere Porengrößen aus Stampfdichte und spezifischer Oberfläche. Carbon Black σs ρSD N 550 30 345 RP /nm 78,6 N 330 83 370 26,1 Vulcan PF 140 190 33,7 Vulcan P 140 330 17,8 Corax L 150 200 29,7 Vulcan XC-72R 254 100 37,2 Corax L6 265 120 29,4 Monarch 1300 560 260 5,9 Ketjenblack 950 110 9,0 Printex XE2 1000 140 6,6 Black Pearls 2000 1475 150 4,2 /m2g-1 /g⋅l-1 102 6.4 Kapitel 6 Austausch und Diffusion 6.4.1 Austauschprozesse Die Selbstdiffusion der Xenonatome führt während des NMR-Experiments zu Austauschprozessen zwischen energetisch unterschiedlichen Bereichen der Carbon Black Strukturen. Die intraporösen Gasteilchen unterliegen dabei drei unterschiedlichen Austauscheffekten, die die chemische Verschiebung und Halbwertsbreite der Resonanzlinien nachhaltig beeinflussen (s. Abbildung 6.4-1): 1. Austausch zwischen adsorbiertem und freien Zustand innerhalb einer Pore 2. Austausch zwischen den einzelnen Poren 3. Austausch zwischen intra- und extraporösen Bereichen Es ist anzunehmen, dass die Adsorptions- und Desorptionsvorgänge innerhalb einer Pore oberhalb der kritischen Temperatur des Xenons so schnell sind, dass mit der 129 Xe-NMR- Spektroskopie zwischen beiden Zuständen nicht unterschieden werden kann. Daher liefert dieser Austauschprozess nur eine Resonanzlinie mit einer chemischen Verschiebung δP im Schwerpunkt der einzelnen Resonanzsignale ohne Austausch, d. h. der chemischen Verschiebung der adsorbierten (δA) und der in der Porenmitte befindlichen Xenonatome (δM) (s. Prozess 1. in Abbildung 6.4-1). 4 3 2 δM 1 δA Abb. 6.4-1 Austauschprozesse der Xenonatome in porösen Carbon Black Strukturen. 1. innerhalb einer Pore, 2. zwischen verschiedenen Poren, 3. zwischen intra- und extraporösen Bereichen, 4. Adsorption und Desorption an der externen Oberfläche. 103 Diskussion Die Diffusionsmessungen zeigen, dass die intraporösen Xenonatome trotz gehinderter Diffusion, während des NMR-Experiments Entfernungen von mehreren hundert Primärpartikelgrößen zurücklegen können (Tabelle 5.5-2). Sie durchwandern dabei Porenbereiche mit unterschiedlichen chemischen Verschiebungen, wie sie z. B. durch unterschiedliche Porenradien RP hervorgerufen werden können (Prozess 2). Eine schneller Austausch zwischen diesen Bereichen führt zu einer Resonanzlinie mit einer mittleren chemischen Verschiebung δp( R P ) (s. Abbildung 6.4-2). Ein langsamer Austausch führt hingegen zu einer inhomogenen Linienverbreiterung, bzw. bei sehr langsamen bzw. ausbleibendem Austausch zu einer Signalaufspaltung, wobei die einzelnen Resonanzlinien, nach dem zuvor beschriebenen Porenmodell (Abbildung 6.2-1), jeweils einer Porenart zugeordnet werden können. Dies ist z. B. im 129 Xe-NMR-Spektrum von Vulcan P, Vulcan PF, Corax L, Corax L6 und Monarch 1300 bei Drücken über 12 bar zu beobachten. Hier ist jeweils ein zweites Resonanzsignal geringer Intensität und hoher Halbwertsbreite um 200 ppm zu finden, dass erst mit zunehmender Xenondichte und abnehmender Austauschrate sichtbar wird (s. Druckabhängigkeit bei Vulcan PF) und auf eine zweite Porenart schließen lässt. Eine genaue Zuordnung dieses Signals erfolgt in Kapitel 6.5.5). δp( R P ) Chemische Verschiebung Abb. 6.4-2 0 ppm Koaleszenz verschiedener Resonanzlinien durch Austausch- effekte zu einer einzigen Linie im Schwerpunkt des NMR-Spektrums. (vgl. Abbildung 6.2-1). 104 Kapitel 6 Als charakteristische Größe ist hier die Austauschrate zu nennen, die die Anzahl der austauschenden Gasteilchen pro Zeiteinheit angibt und von der Diffusionsgeschwindigkeit der Teilchen und den geometrischen Ausdehnungen der jeweiligen Porenbereiche abhängt. Je größer die einzelnen, homogenen Porenbereiche sind und je kleiner die Diffusionsgeschwindigkeit ist, desto geringer ist die Austauschrate. Ebenso ist das Adsorptions- bzw. Retentionsverhalten der Carbon Blacks von Bedeutung, dass entsprechend dem Lennard-Jones-Potential in Mikroporen mit dem abnehmendem Porenradius zunimmt (vgl. Kapitel 3.2.1). Ein dritter zu erwähnender Austauschprozess ist bei den oberflächennahen Xenonatomen zu erwarten, die zwischen den intra- und extraporösen Bereichen austauschen können (s. 3. in Abbildung 6.4-1). Die Austauschrate ist aber bei porösen Carbon Blacks zu gering, als dass hier ein gemitteltes Resonanzsignal zu beobachten wäre. Daher ist bei den hier untersuchten Carbon Blacks stets eine deutliche Signalaufspaltung in intra- und extraporöse Xenonpools zu beobachten (Abbildung 5.2-1). Adsorptions- und Desorptionsvorgänge der Xenonatome an der externen Festkörperoberfläche bilden einen weiteren Austauschprozess, der aber aufgrund der sehr hohen Austauschrate nur zu einem Resonanzsignal führt, dass aufgrund der chemischen Verschiebung ausschließlich dem freien Xenonatomen zugeordnet wird (Prozess 4). Tab. 6.4-1 Austauschprozesse und Auswirkung auf das 129Xe-NMR-Signal der Intra- und extraporösen Xenonatome (s. Abbildung 6.4-1). Austauschprozess Austausch Auswirkung 1. Innerhalb einer Pore sehr schnell eine schmale Linie, δp(Rp) 2. Zwischen Poren mit sehr schnell langsam eine schmale Linie, δp( R P ) eine inhomogen verbreiterte Linie, δp( R P ) sehr langsam Signalaufspaltung, δp(Rp) verschiedenen Rp 3. Intra- und extraporöser sehr langsam, Bereich vernachlässigbar Signalaufspaltung, δp(Rp), δf(p) 4. an externer Oberfläche sehr schnell eine schmale Linie, δf(p) langsam Linienverbreiterung, δf(p) 105 Diskussion Wie bereits erwähnt wurde, können die Austauschvorgänge innerhalb der Carbon Black Struktur über Diffusionsmessungen der Xenonatome direkt beobachtet werden. Unter diesem Gesichtspunkt sollen im Folgenden die Ergebnisse der druck- und diffusionszeitabhängigen Messungen im einzelnen näher erläutert werden. 6.4.2 Freie Selbstdiffusion Die Selbstdiffusion der Xenonatome in reiner Gasphase ist stark druckabhängig. So ist bei einer Druckerhöhung von 1 auf 21,2 bar eine Abnahme des Xenon-Diffusionskoeffizienten um mehr als zwei Größenordnungen von 5,71·10-6 auf 2,6·10-8m2/s zu beobachten (Tabelle 5.5-1). Die Abnahme erfolgt nach Abbildung 5.5-1a nichtlinear und lässt die Vermutung zu, dass bei Drücken über 21 bar ein Grenzwert erreicht wird, der z. B. dem flüssigen Xenon zugeordnet kann. Die mittlere freie Weglänge < r 2 > nimmt hingegen bis 21 bar direktproportional mit dem Druck ab (s. Abbildung 5.5-1b). Entsprechend der kinetischen Gastheorie Teilchengeschwindigkeit kann dies auf eine lineare Abnahme der mittleren < c 2 > bzw. linearen Zunahme der Stoßfrequenz νs zwischen zwei kollidierenden Xenonatomen zurückgeführt werden. <r2 > ≈ < c2 > νS (6.4-1) In gleicher Weise lässt sich der von Jameson et al. beschriebene lineare Zusammenhang zwischen der erklären. [78] 129 Xe-NMR-Verschiebung und der Xenondichte bzw. -druck für p < 50 bar Auch hier führt die mit dem Druck zunehmende Stoßfrequenz zu einem linearen Anstieg der chemischen Verschiebung (vgl. Kapitel 4.3.2). 6.4.3 Diffusion intraporöser Xenonatome Im heterogenen System Xenon – Carbon Black sind die Diffusionskoeffizienten des intraporösen Xenons mit z. B. 8,6·10-9 m2/s bei Black Pearls 2000 (10,9 bar) und 28,3·10-9 m2/s (Vulcan PF, 14 bar) deutlich kleiner als die der reinen Xenonprobe im vergleichbaren Druckbereich (724⋅10-9 m2/s, s. Tabelle 5.5-1 und 5.5-2). Dennoch liegen sie um zwei bis drei Größenordnungen über den Werten der Xenon-Diffusion in Polymeren, bei denen durch die engmaschigen Polymerketten eine besonders starke 106 Kapitel 6 Behinderung der diffundierenden Xenonatome zu beobachten ist.[117] Die intraporösen Gasteilchen weisen also trotz der Wechselwirkungen mit den Porenwänden eine hohe Mobilität auf und entsprechen daher im Diffusionsverhalten eher dem freien („gas-like“) als dem adsorbierten Xenon („solid-like“) (vgl. Kapitel 4.3.9). Dies wird auch bei der Betrachtung der mittleren freien Weglänge < r 2 > deutlich, die bei einer Diffusionszeit von 10 ms im Mikrometerbereich liegt und entsprechend den abnehmenden mittleren Porenradien von Vulcan PF (41,2 µm), über Ketjen Black (24,7 µm) nach Black Pearls 2000 (22,7 µm) abnimmt (Tabelle 5.5-2). Die Partikelgrößen und Interpartikelabstände liegen aber im Nanometerbereich, so dass davon auszugehen ist, dass die intraporösen Xenonatome, auch in kurzen Zeitintervallen, Distanzen von mehr als tausend Partikeldurchmessern durchwandern und so zwischen zahlreichen Poren und Adsorptionsplätzen austauschen können. Infolgedessen sind alle 129 Xe-NMR- Parameter, wie z. B. chemische Verschiebung, Halbwertsbreite und Relaxationszeiten, stets als Mittelwerte der energetisch unterschiedlichen Positionen inner- und außerhalb der Carbon Black Matrix zu betrachten. Dies ist ebenso für den Diffusionskoeffizienten gültig, der stets als Mittelwert von allen diffundierenden Xenonatomen zu betrachten. Der Austausch zwischen Bereichen schneller (freier) und langsamer (gehinderter) Diffusion kann dabei zu einer Erhöhung bzw. Erniedrigung des Diffusionskoeffizienten führen. Daher werden auch für die extraporösen Xenonatome ein im Vergleich zur freien Diffusion kleinerer Diffusionskoeffizient gefunden (Tabelle 5.5-1), weil ein Teil der Gasteilchen im Zeitraum ∆ an der externen Adsorbentoberfläche adsorbiert wird oder mit den intraporösen Xenonatomen, die einer gehinderten Diffusion unterliegen, austauscht. So ist der Diffusionskoeffizient der extraporösen Xenonatome -8 bei Black Pearls 2000 im 2 vergleichbaren Druckbereich (10,9 bar) mit 6,6·10 m /s deutlich kleiner als in der reinen Gasphase (72,4·10-8 m2/s, 12 bar).[97] 6.4.4 Druckabhängigkeit der Diffusion Die Diffusionsgeschwindigkeit der Gasteilchen innerhalb der Poren nimmt, wie bei der freien Diffusion in einer reinen Xenongasprobe, mit zunehmendem Xenondruck bzw. Xenondichte ab. So ist bei Black Pearls 2000 und einer Druckerhöhung von 1,9 auf 17,7 bar eine Halbierung des Diffusionskoeffizienten von 10,71 auf 5,56⋅10-9 m2/s zu 107 Diskussion beobachten (Tabelle 5.5-3). Die zunehmende Xenondichte führt zu verstärkten XenonXenon- und Xenon-Wand-Stößen, die die in ∆ zurückgelegte freie Weglänge und somit die Diffusionsgeschwindigkeit herabsetzen, und die Aufenthaltsdauer der Xenonatome innerhalb der Porenstrukturen verlängern. Durch die vermehrten Xenon-Wand-Kollisionen innerhalb einer Pore ist mit abnehmendem DP eine Zunahme der chemischen Verschiebung verbunden (Abbildung 6.4-3a). Ebenso verringert sich die Austauschrate zwischen den Bereichen unterschiedlicher chemischer Verschiebung und es ist kommt zu einer inhomogenen Linienverbreiterung des 129 Xe-NMR-Signals, die zwischen 3,1 und 140 550 17,7 bar 130 17,7 bar 8,2 bar 500 8,2 bar 120 110 450 400 5,5 bar 100 90 300 3,1 bar 80 250 3,1 bar 70 (a) 60 50 350 5,5 bar 5 (b) 1,9 bar 6 7 8 -9 9 10 11 5 150 1,9 bar 6 7 8 -9 9 2 -1 10 11 100 DP /10 m s 2 -1 DP /10 m s Abb. 6.4-3 200 Zusammenhang zwischen dem Xe-Diffusionskoeffizienten DP(pXe) und (a) der chemische Verschiebung, (b) der Halbwertsbreite in Black Pearls 2000. Bei Drücken bis 8 bar ist eine deutliche Abnahme des Diffusionskoeffizienten auf ca. zwei Drittel des ursprünglichen Wertes bis zu beobachten. Ab 8 bar ändert sich der Diffusionskoeffizient nur noch geringfügig und erreicht bei 17,7 bar mit 5,56·10-9 m2/s annähernd einen Grenzwert (Abbildung 5.5-3). Letzteres deutet darauf hin, dass auch mit zunehmendem Druck die Xenondichte innerhalb der Porenstruktur konstant bleibt, was schließlich auf eine konstante Austauschrate zwischen intra- und extraporösem Xenon zurückzuführen ist. Der Diffusionskoeffizient und somit die Mobilität der intraporösen Xenonatome ist aber bei hohen Drücken noch relativ groß. Auch Raftery et al. haben bei Xenondiffusionsmessungen in Zeolithen zeigen können, dass trotz hoher Ladungsdichten eine schnelle Diffusion innerhalb der Porenstruktur zu beobachten ist. [67] Sie ermittelten einen Xenon-Diffusionskoeffizienten von 1·10-9 m2/s, der hier mit den Ergebnissen von Halbwertsbreite /Hz Chemische Verschiebung /ppm 17,7 bar linear mit abnehmendem Diffusionskoeffizienten zunimmt (s. Abbildung 6.4-3b). 108 Kapitel 6 Black Pearls 2000 bei 10,9 bar und langen Diffusionszeiten (200 ms) vergleichbar ist (Dp = 3,27⋅10-9m2/g). 6.4.5 Gehinderte Diffusion Die diffusionszeitabhängigen Messungen in Black Pearls 2000 weisen deutlich auf eine gehinderte Diffusion der intraporösen Xenonatome hin (Abbildung 5.5-4). Bei kleinen Diffusionszeiten (≤ 20 ms) ist eine schnelle Abnahme des Diffusionskoeffizienten DP zu beobachten, wobei der weitere Kurvenverlauf das Erreichen eines Grenzwertes bei ∆ > 200 ms vermuten lässt. Während einer kurzen Diffusionszeit kollidieren nur wenige Xenonatome mit den Porenwänden, so dass im Mittel alle Xenonatome einer nahezu freien Selbstdiffusion und ein hoher Diffusionskoeffizient erhalten wird. Mit zunehmender Diffusionszeit nimmt die Zahl der Xenonatome zu, die eine gehinderte Diffusion erfahren, und der Diffusionskoeffizient wird somit kleiner (vgl. Abbildung 3.3-1). Bei langen Diffusionszeiten erleiden alle Xenonatome die gleiche Hinderung ihrer Diffusionsbewegung und Dp erreicht einen Grenzwert, der größer null ist, da es sich um eine offene, aber weitverzweigte Porenstruktur handelt. Diese Abnahme des Diffusionskoeffizienten mit zunehmender Diffusionszeit macht aber auch deutlich, dass die intraporösen Xenonatome nicht mit den extraporösen austauschen, d. h., die Porenstruktur kann für die Xenonatome währen des NMRExperiments als abgeschlossen angesehen werden (s. Dzyl(∆) in Abbildung 3.3-2). Bis 200 ms wird jedoch kein Grenzwert erreicht, der nach der Theorie von Mitra et al. die Tortuosität des Systems beschreiben würde (Kapitel 3.3).[50] Dieser Grenzwert und die dabei zurückgelegte mittlere freie Weglänge entsprächen der Ausdehnung des verzweigten Porensystems und würde die Aggregat- bzw. Agglomeratgröße der Carbon Blacks wiederspiegeln. In 200 ms legen die Xenonatome in Black Pearls 2000 eine mittlere Weglänge von 62,6 µm zurück, die etwa den Durchmessern von etwa 5200 Primärpartikeln (PG = 12 nm) entspricht. Diese Werte liegen in der üblichen Größenordnung für Aggregate und Agglomerate in Carbon Blacks, die eine Ausdehnung von wenigen Mikrometern bis zu einem Millimeter aufweisen können (aus AFMMessungen).[1] Man kann also davon ausgehen, dass die Xenonatome in diesem Zeitraum die Grenzen der Aggregate erreichen und mit benachbarten Inter- und Intraaggregatporen austauschen können. 2D-Austausch-Experimente an Blends aus den Carbon Blacks N110, N347 und N472 haben z. B. gezeigt, dass bis 6 ms kein Austausch 109 Diskussion zwischen den Aggregaten der einzelnen Komponenten stattfindet und erst ab 100 ms ein merklicher Austausch zu beobachten ist.[118] Im Allgemeinen würden großporige und wenig verzweigte Strukturen zu einer nahezu ungehinderten Diffusionsbewegung der Gasteilchen beitragen und so im Langzeitbereich (∆ Ø ¶) größere Diffusionskoeffizienten liefern. Hingegen sind bei stark verzweigten Systemen und kleinen Porengrößen kleine Diffusionskoeffizienten zu erwarten, die bereits bei vergleichsweise kurzen Diffusionszeiten einen Grenzwert erreichen. 6.5 Die 129Xe-NMR-Verschiebung in Carbon Black 6.5.1 Einfluss der spezifischen Oberfläche In der von 129 Xe-NMR-Spektroskopie wird die der Porengröße und 129 Xe-Resonanzverschiebung besonders stark Morphologie eines Festkörpers beeinflusst. Ein charakteristischer Parameter ist die spezifische Oberfläche σs, deren Einfluss auf die chemische Verschiebung δp im Folgenden untersucht wird. Die Arbeiten dazu wurden bereits von Frau Sperling-Ischinsky begonnen und in dieser Arbeit fortgeführt.[100] In Abbildung 6.5-1 ist die chemische Verschiebung δp als Funktion der spezifischen Oberfläche graphisch dargestellt. Bei den Rußen mit geringerer spezifischer Oberfläche (≤ 300 m2/g) ist eine Zunahme von δp mit steigendem σs zu beobachten. Die Werte liegen zwischen ca. 0 ppm für Graphit (< 1 m2/g) und 90 ppm für Vulcan P (140 m2/g). Oberhalb von 500 m2/g nimmt δp unabhängig von σs Werte zwischen 81 ppm (Ensaco 52, 1100 m2/g) und 132 ppm (Black Pearls 2000, 1475 m2/g) an (Tabelle 5.2-1). Wie bereits in anderen Arbeiten darauf hingewiesen wurde, ist zwischen der chemischen Verschiebung der intraporösen Xenonatome und der spezifischen Oberfläche kein direkter Zusammenhang zu beobachten.[103,119] Der Kurvenverlauf in Abbildung 6.5-1 deutet jedoch darauf hin, dass die hier untersuchten Carbon Blacks bzgl. der spezifischen Oberfläche in zwei Kategorien unterteilt werden können: zur ersten Kategorie gehören die Ruße mit bis zu 300 m2/g, deren Xe-NMR-Verschiebung annähernd linear mit σs 129 zunimmt. Zur zweiten Kategorie können schließlich Ruße mit mehr als 500 m2/g gezählt werden, deren chemische Verschiebung scheinbar unabhängig von σs Werte zwischen 110 Kapitel 6 100 und 132 ppm annehmen kann. Die relativ hohen spezifischen Oberflächen dieser Ruße weisen auf poröse Primärpartikel hin, die entsprechend dem hier vorgestellten Porenmodell zu einer Tieffeldverschiebung der aufgrund von Austauscheffekten gemittelten Resonanzlinie führen. Die Intrapartikelporen sind strukturell ähnlich zueinander, so dass die chemische Verschiebung auch bei verschiedenen Carbon Blacks ähnliche Werte annimmt und es so zu einer scheinbaren Unabhängigkeit von der spezifischen Oberfläche kommt. Chemische Verschiebung /ppm 140 120 100 80 60 40 Sperling-Ischinsky diese Arbeit 20 [100] 0 0 200 400 600 800 1000 1200 1400 1600 2 -1 Spezifische Oberfläche /m g Abb. 6.5-1 Chemischen Verschiebung δp als Funktion der spezifischen Oberfläche σs. Vergleich der Ergebnisse dieser Arbeit mit denen von Sperling-Ischinsky.[100] Die unterbrochene Linie gibt nur den im Text beschriebenen Trend wieder und hat keine mathematische Bedeutung. Kleinere chemische Verschiebungen werden beobachtet, wenn relativ große Intra- und Interaggregatporen vorhanden sind, die durch die zuvor beschriebenen Austauschprozesse während des NMR-Experiments zugänglich sind. So liegt δp von Vulcan P (90 ppm) um ca. 20 ppm über dem Wert von Vulcan PF (73 ppm), obwohl beide Ruße mit 140 m2/g die gleiche spezifische Oberfläche besitzen. Sie unterschieden sich aber in der Stampfdichte, die bei Vulcan P mit 330 g/dm3 fast doppelt so groß (Vulcan PF: 190 m2/g) und somit kleinere Interaggregatporen besitzt. Die chemische Verschiebung nimmt also mit steigender Kompression der Probe zu.[139] 111 Diskussion Ähnlich verhält es sich mit Conductex 40-220 (1075 m2/g, 119,4 ppm) und Ensaco 52 (1100 m2/g, 80,8 ppm), die eine vergleichbare spezifische Oberfläche haben, die chemischen Verschiebungswerte aber um ca. 40 ppm voneinander abweichen. Auch bei Corax L6 liegt der experimentell ermittelte Wert mit 52,5 ppm viel niedriger, als es bei einer spezifischen Oberfläche von 265 m2/g zu erwarten ist. Wiederum sind es hier große Interaggregatporen, die zu einer Verringerung der chemischen Verschiebung beitragen. Daraus folgt schließlich, dass die zur ersten Kategorie gehörenden Carbon Blacks nichtporöse Primärpartikeln besitzen, bei denen eine Zunahme der spezifischen Oberfläche nur durch Verringerung der Partikelgröße und somit der Intraaggregatporen erfolgt. Der genaue Zusammenhang zwischen Porengröße und chemischen Verschiebung wird daher in den folgenden Kapiteln ausführlich untersucht. Der Vergleich mit den Ergebnissen von Sperling-Ischinsky zeigt, dass die jeweils ermittelten 129 Xe-NMR-Verschiebungen des selben Carbon Blacks um bis zu 25 % (s. Printex XE2, Tabelle 5.2-1) voneinander abweichen können. Es sei an dieser Stelle darauf hingewiesen, dass unterschiedliche Methoden bei der Spektrenreferenzierung eine Variation der chemischen Verschiebung verursachen können. Im Gegensatz zu dieser Arbeit wird bei Sperling-Ischinsky die Druckabhängigkeit der chemischen Verschiebung nicht berücksichtigt, wobei das Resonanzsignal der extraporösen Xenonatome stets auf 0 ppm festgelegt wird. Dies hat zur Folge, dass die Ergebnisse für δp, je nach Referenzierungsmethode, um ca. 0,542 ppm/bar voneinander abweichen können. Bei einer Probe mit beispielsweise 18 bar Xenongasdruck würde der Unterschied etwa 10 ppm betragen. 6.5.2 Einfluss der Porengröße 6.5.2.1 Mittleres VP/S-Verhältnis In Bezug auf das in Kapitel 6.2 vorgestellte Porenmodell und unter Berücksichtigung der zuvor beschriebenen Austauscheffekten, soll im Folgenden die Abhängigkeit der NMR-Verschiebung von dem mittleren Porenvolumen/Oberfläche-Verhältnis 129 Xe- aus Tabelle 6.3-2 untersucht werden. Es ist zu erwarten, dass die Wechselwirkungen der intraporösen Xenonatome innerhalb einer Pore, und somit die chemische Verschiebung δp, unter isobaren und isothermen Bedingungen mit zunehmender Oberfläche S und abnehmendem Porenvolumen Vp zunimmt. Daraus ergibt sich folgende Proportionalität: 112 Kapitel 6 δp ∝ Dabei wird vorausgesetzt, S 1 ∝ VP RP dass die Austauschprozessen unterliegen und im 129 (6.5-1) intraporösen Xenonatome schnellen Xe-NMR-Spektrum nur eine Resonanzlinie zeigen, mit einer chemischen Verschiebung δp, die einem gemittelten, halben Porenwandabstand R P entspricht. In Abbildung 6.5-2 ist daher δp aus Tabelle 5.2-1 gegen 1/ R P aus Tabelle 6.3-2 aufgetragen. Hierbei zeigt sich eine annähernd lineare Abhängigkeit von δp zum Kehrwert 1/ R P . Als Ursache kann wiederum die Kollisionsfrequenz der Xenonatome mit der Porenoberfläche genannt werden, die umso größer ist, je kleiner die Porenwandabstände und somit der freie Diffusionsweg der Xenonatome ist.[118] Durch die hohen Kollisionsfrequenzen treten vermehrt van-der-WaalsWechselwirkungen zwischen den Adsorbent- und Adsorbatmolekülen auf, die zu einer stärkeren Entschirmung der Xenonatome, und damit zu höheren chemischen Verschiebungen führen. Chemische Verschiebung /ppm 140 BP M13 120 KB 100 PX2 VP 80 60 N5 CL VPF N3 VXC CL6 40 20 0 0,00 0,05 0,10 0,15 1/RP /m Abb. 6.5-2 0,20 0,25 -1 Abhängigkeit der chemischen Verschiebung vom Kehrwert des mittleren halben Porenwandabstand R P (Tabelle 6.3-2). Xenondruck: 8 bis 20 bar (s. Tabelle 5.2-1). Steigung der Geraden: 346,3 ± 45,1 ppm⋅nm. Achsenabschnitt: δP( R P → ∞) = 56,0 ± 4,9 ppm. Diskussion 113 Dennoch ist eine eindeutige Korrelation zwischen δP und R P nach der in Gleichung 6.5-1 gemachten Vorhersage nicht gegeben. Insbesondere bei den Rußen mit kleinen spezifischen Oberflächen (< 200 m2/g) und vergleichbaren mittleren Porenradien sind Unterschiede von bis zu 30 ppm zu beobachten. Diese können u. a. auf eine fehlerhafte spezifische Oberflächen und/oder Stampfdichte zurückzuführen sein. Dabei ist die Stampfdichte eine empfindliche Größe, die leicht bei der Probenvorbereitung durch Mahlen oder Pressen verändert werden kann. 6.5.2.2 Intraaggregatporen Wie bereits erwähnt wurde wird eine hoher Aggregationsgrad der Primärpartikel bei einer kubisch dichten Anordnung erreicht. Die maximalen halben Interpartikelabstände zmax innerhalb dieser Aggregate verhalten sich proportional zum mittleren Partikelradius und sind für einige der hier untersuchten Carbon Blacks in Tabelle 6.3-1 zusammengefasst. In Abbildung 6.5-3 ist die chemische Verschiebung δP gegen 1/zmax aufgetragen und es zeigt sich eine, im Vergleich zum mittleren S/Vp-Verhältnis, eindeutige lineare Abhängigkeit (vgl. Abbildung 6.5-2). Deutliche Abweichungen von der Geraden sind nur bei den Rußen Vulcan PF (VPF), Corax L6 (CL6) und Printex XE2 (PX2) zu beobachten. Die reziproke Abhängigkeit zwischen δP und zmax macht deutlich, dass die Primärpartikel der meisten Carbon Blacks eine regelmäßige Aggregatstruktur bilden, in der die kubischdichte Anordnung vermutlich vorherrschend ist. Die Ausdehnung der homogenen Porenbereiche ist dabei so groß, dass Austauschprozesse mit Bereichen geringerer oder höherer chemischer Verschiebung trotz hoher Diffusionsgeschwindigkeit der Xenonatome nicht stattfinden. Abweichungen von der Linearität weisen bei niedrigeren chemischen Verschiebungen auf höhere Verzweigungs- oder, wie im Fall von Vulcan PF und Corax L6, auf geringere Agglomerationsgrade hin. Die Stampfdichten bei diesen Rußen sind mit 190 bzw. 120 g/dm3 daher relativ gering. Hingegen führt die Mikroporosität der Primärpartikel in Printex XE2 trotz großer Primärpartikelgröße zu verstärkten Wechselwirkungen zwischen den Xenonatomen und der Porenoberfläche und somit entgegen dem Trend zu einer relativ hohen chemischen Verschiebung von 100 ppm. 114 Kapitel 6 -1 1/PG /nm Chemische Verschiebung /ppm 0,00 0,01 0,02 0,03 0,04 0,05 0,06 0,07 0,08 0,09 0,10 140 BP 120 M13 100 PX2 VP CL 80 N3 VXC 60 N5 40 VPF CL6 20 0 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9 -1 1/zmax /nm Abb. 6.5-3 Abhängigkeit der 129 Xe-NMR-Verschiebung vom Abstand zmax bzw. von der Partikelgröße PG. Mit Ausnahme von Corax L6 (CL6), Vulcan PF (VPF) und Printex XE2 (PX2) ist eine lineare Abhängigkeit der chemischen Verschiebung vom Kehrwert 1/zmax bzw. 1/PG zu beobachten. Xenondruck: 8 bis 20 bar (s. Tabelle 5.2-1). Steigung der Geraden: 154,6 ± 1,1 ppm⋅nm. Achsenabschnitt: δP(zmax → ∞) = 16,9 ± 0,5 ppm. Mit Hilfe der Regressionsgeraden aus Abbildung 6.5-3 kann schließlich bei bekannter chemischer Verschiebung, und unter der Annahme eines hohen Aggregationsgrades, die mittlere Primärpartikelgröße eines Carbon Blacks bestimmt werden. Der Achsenabschnitt entspricht dabei unter isobaren und isothermen Bedingungen der 129 Xe-NMR- Verschiebung der Xenonatome, die mit vergleichbarer Kollisionsfrequenz auf eine einzelne Primärpartikeloberfläche auftreffen. 6.5.3 Einfluss der Oberflächenchemie Der Einfluss der Oberflächenchemie auf die chemische Verschiebung ist umstritten und wird meist als ein zu vernachlässigender Faktor angesehen. Springuel-Huet et al. bezeichnen die chemische Verschiebung im Henryschen Druckbereich (δ0) als eine charakteristische Größe für die Oberflächenchemie poröser Feststoffe, weil hierbei die Porengröße und -struktur zu vernachlässigen sind.[71] Für Carbon Blacks mit geringem 115 Diskussion Heteroatomanteil, wie die hier untersuchten Furnace Blacks, kann δ0 als konstant angenommen werden. Weitere 129 Xe-NMR-Untersuchungen der Oberflächenkonzentration von Heteroatom- gruppen und radikalischen Zentren in porösen Festkörper sind in der Literatur zu finden. Simonov beobachtete z. B. bei einer Erhöhung der Oberflächenkonzentration elektronegativer Heteroatome (Sauerstoff, Chlor) um 1 µmol/m , eine Zunahme von δ0 von 2 6-8 ppm.[119] Diese Zunahme ist auf den elektronenziehenden Effekt der Heteroatome zurückzuführen, die eine verstärkte Lokalisierung der aromatischen Elektronen und somit eine Positivierung der Kohlenstoffatome verursachen. In gleicher Weise ist mit steigender Konzentration azider Oberflächengruppen eine Zunahme von δ0 verbunden.[103] Connor et al. untersuchten die Hydroxylgruppenkonzentration auf mikroporösen SilicaOberflächen, konnten aber keinen Einfluss auf die 129 Xe-NMR-Verschiebung feststellen.[120] Sie schlossen daraus, dass die Xenonatome sehr schnell zwischen adsorbiertem und freiem Zustand austauschen und die Oberflächenchemie hinsichtlich der chemischen Verschiebung eine untergeordnete Rolle spielt.[118,120] Es ist jedoch wahrscheinlicher, dass die Beeinflussung der elektrischen Oberflächeneigenschaften durch basische Heteroatomgruppen mit elektronenliefernden Eigenschaften (+M-Effekt), im Vergleich zu sauren Gruppen, im aromatischen bzw. radikalischen System eher gering einzustufen sind. Somit ist eine Änderung der 129 Xe-NMR-Verschiebung mit steigender Hydroxylgruppenkonzentration auch nicht zu erwarten. Kohlenstoffe an den Kanten und in den amorphen Bereichen der Graphitebenen ohne Heteroatome bilden meist radikalische Zentren, die für den paramagnetischen Charakter der Carbon Blacks verantwortlich sind (vgl. Kapitel 4.1.9). Die Stabilität dieser Zentren steigt mit zunehmendem aromatischen Charakter und sie sind daher bei Graphitebenen mit großer Ausdehnung und somit bei großen Primärpartikeln bevorzugt zu finden. Stark lokalisierte Radikale sind hingegen instabil und führen zu einer schnellen Chemisorption elektrophiler Heteroatomgruppen, wie z. B. Sauerstoffgruppen. Diese zeigen durch den elektronenziehenden Effekt wiederum eine stabilisierende Wirkung und tragen so zu einer verstärkten Lokalisierung der Radikale bei. Daher ist mit steigender Oxidgruppenkonzentration eine lineare Abnahme der Radikalkonzentration zu beobachten.[121] Bei den hier untersuchten Furnace Blacks ist die Oberflächenkonzentration der Heteroatome relativ gering. Entsprechend den Herstellerangaben beträgt der Kohlenstoffgehalt zwischen 98 und 99 Gew.% (Tabelle 9.1-1). Die pH-Werte liegen 116 Kapitel 6 hauptsächlich zwischen 7 und 9,5 und weisen auf eine geringe Anzahl an basischen Oberflächengruppen hin, die aber nach den obigen Überlegungen keinen Einfluss auf die 129 Xe-NMR-Verschiebung haben und daher bei der Interpretation der Spektren vernachlässigt werden können. 6.5.4 Druckabhängigkeit der chemischen Verschiebung Die Druck- bzw. Dichteabhängigkeit der 129 Xe-NMR-Verschiebung wird nach McGrath bei Temperaturen oberhalb des kritischen Wertes in erster Linie von der Kollisionsfrequenz der Gasteilchen mit der Porenoberfläche bestimmt.[118] Diese nimmt entsprechend mit zunehmender Dichte innerhalb der Poren zu und steigt umso schneller an je kleiner die mittleren Abstände der Porenwände sind. Bei den hier untersuchten Carbon Blacks nimmt die chemische Verschiebung bis 2 bar linear mit ca. 20 ppm/bar in einem weitaus stärkeren Maße zu, als es bei der homogen Xenongasphase mit 0,542 ppm/bar zu beobachten ist.[78] Die Wechselwirkungen mit der Adsorbentoberfläche führen dabei zu höheren chemischen Verschiebungen, die mit zunehmendem Druck bzw. Dichte linear zunehmen. Die Ergebnisse sind mit denen von Suh et al.[103] vergleichbar, die bei kleinen Xenondichten ebenfalls eine lineare Zunahme der chemischen Verschiebung mit steigender Xenonkonzentration auf der Carbon Black Oberfläche beobachteten. Auch bei der Xenon-Adsorption in Zeolithen wurde bis zu einer massenspezifischen Adsorbatmenge von 3 mmol/g eine linearer Anstieg in δp beobachtet.[122] Dieser Kurvenverlauf ist mit den Isothermen von Langmuir und Dubinin vergleichbar, die bei niedrigen Drücken ebenfalls eine annähernd lineare Zunahme des Adsorptionsgrades mit dem Druck beschreiben (s. Kapitel 6.5.6). Bis 2 bar ist bei den Rußen Vulcan PF, Vulcan PF, Printex XE2 und Black Pearls 2000 jeweils die gleiche chemische Verschiebung zu finden (Abbildung 5.3-3), so dass man davon ausgehen kann, dass sich δp in diesem Druckbereich unabhängig von der Porenstruktur verhält und in erster Linie von der Oberflächenchemie bestimmt wird. Die Wechselwirkungen zwischen Adsorbat und Adsorbent sind also bei kleinen Dichten äquivalent und unabhängig von der Porengröße und zeugen von einer Porengrößen unabhängigen Adsorptions- und Desorptionsrate.[119] Diskussion 117 Bei Raumtemperatur ist die kinetische Energie der Gasteilchen allerdings so groß, dass hohe Diffusionsgeschwindigkeiten von über 1⋅10-8m2/s gefunden werden und somit von einer Aufenthaltsdauer an der Porenwand ausgegangen werden kann, die zu gering ist, als das verstärkte Wechselwirkungen mit Heteroatomgruppen auf der Carbon Black Oberfläche zu einer starken Beeinflussung der chemischen Verschiebung führen könnten. Andererseits kann man davon ausgehen, dass sich genannten Carbon Blacks bzgl. ihrer Oberflächenchemie nicht wesentlich voneinander unterscheiden, da es sich hierbei ausschließlich um Leitfähigkeitsruße mit geringem Heteroatomanteil handelt. Aber auch über die Geometrie der Poren lässt sich die Zunahme der chemischen Verschiebung mit dem Druck erklären. Vereinfacht kann angenommen werden, dass in Carbon Blacks sphärische und zylindrische Poren, sowie Schichtzwischenräume zu finden sind. Das Volumen einer solchen Pore nimmt dabei mit dem Radius jeweils kubisch, quadratisch bzw. linear zu. Unter der Annahme einer gleichmäßigen Verteilung der Xenonatome über den gesamten Porenraum steigt dadurch in sphärischen und zylindrischen Poren die relative Anzahl der Xenonatome in Wandnähe stärker an als in der Porenmitte. Mit zunehmender Xenondichte wird diese Anzahl weiter erhöht und die mittlere chemische Verschiebung wird entsprechend größer. Bei den hier untersuchten Carbon Blacks sind aber keine Unterschiede in der mittleren Porengeometrie zu erwarten, so dass die Zunahme der chemischen Verschiebung im Niederdruckbereich (< 3 bar) bei allen Proben gleich groß ist. Der Grenzwert der chemischen Verschiebung wird schließlich erreicht, wenn die Dichte innerhalb der Poren auch mit zunehmendem Druck konstant bleibt, was auf einen konstanten Austausch der Gasteilchen zwischen intra- und extraporösen Bereichen hindeutet.[120] Dieser Grenzwert liegt umso höher, je kleiner der mittlere Porenradius ist und wird bei den hier untersuchten Rußen in der Reihenfolge Vulcan PF (1) (ca. 5 bar), Vulcan P (ca. 11 bar), Printex XE2 (ca. 13 bar), Black Pearls 2000 (ca. 18 bar) und Vulcan PF (2) (ca. 21 bar) erreicht. Die chemische Verschiebung kann also bei vollständig gefüllten Poren und unter isothermen Bedingen auch als Maß für das VP/S-Verhältnis der Carbon Blacks bezeichnet werden. 6.5.5 Signalaufspaltung bei Vulcan PF zu tieferem Feld Eine zusätzliche Signalaufspaltung zu tieferem Feld ist bei den Rußen Vulcan P und PF, Corax L und L6 sowie Monarch 1300 zu beobachten (Abbildung 5.2-1), wobei jeweils ein 118 weiteres Kapitel 6 129 Xe-NMR-Signal der intraporösen Xenonatome im Bereich von 190 bis 203,7 ppm (10 – 20,6 bar) zu finden ist (Tabelle 5.2-1 u. Abbildung 5.2-1). Bei der Betrachtung der druckabhängigen 129Xe-NMR-Spektren von Vulcan PF wird deutlich, dass diese Resonanzlinie durch Aufspaltung aus der Hauptresonanzlinie im höheren Feld hervorgeht (Abbildung 5.3-3) und im vergleichbaren Druckbereich die gleiche chemische Verschiebung wie die der anderen Ruße aufweist (Tabelle 5.3-1). Es handelt sich also bei allen Rußen um die gleichen Adsorptionsplätze bzw. um die gleiche Porenart. Der mittlere Porenradius bei einer chemische Verschiebung von 203,7 ppm würde unter Berücksichtigung der linearen Regression in Abbildung 6.5-3 etwa 0,83 nm betragen, was ca. 1,85 Xenondurchmessern (0,44 nm) entspricht. Die Druckabhängigkeit zeigt, dass eine zusätzliche Signalaufspaltung erst dann auftritt, wenn die Diffusionsgeschwindigkeit der Xenonatome durch Druck- bzw. Dichteerhöhung oder Temperaturerniedrigung soweit herabgesetzt wird, dass die zurückgelegten Diffusionswege zu kurz sind und ein vollständiger Austausch, auch zwischen benachbarten Porenbereichen (z. B. zwischen Intra- und Interaggregatporen), nicht mehr stattfinden kann. Stark inhomogene Porengrößenverteilungen, wie sie z. B. in Carbon Black Blends beobachtet werden, führen bereits bei Raumtemperatur und relativ kleinen Drücken (< 4 bar) zu einer mehrfachen Signalaufspaltung im 129 Xe-NMR-Spektrum, wobei jeder Komponente des Blends eine Resonanzlinie Signal zugeordnet werden kann.[118] Xenonatome in kleinen Interpartikelporen einer kubisch dichten Anordnung, die aufgrund der hohen Dichten nicht oder nur wenig mit den größeren Intra- und Interaggregatporen austauschen, könnten das Signal um 203 ppm hervorrufen. Ebenso können Oberflächenporositäten, die durch Defektstellen in der Graphitoberfläche entstehen, dafür verantwortlich sein. Diese „rauen“ Oberflächen führen bei adsorbierten Xenonatomen zu verstärkten Wechselwirkungen mit den Adsorbentatomen und somit zu höheren chemischen Verschiebungen.[71,120] Hohe Oberflächendefekte und –porositäten sind besonders bei kleineren Partikelgrößen zu erwarten, wie es hier der Fall ist. Die Partikelgrößen der genannten Carbon Blacks liegen zwischen 13 und 23 nm (Tabelle 5.2-1). Ein Beispiel für Oberflächenporositäten sind Schichtzwischenräume überlappender Graphitebenen, die auf der Oberfläche sog. „Seitentaschen“ („site-pockets“)[20] bilden und groß genug für die Adsorption einzelner Xenonatome sind. Die zu erwartenden hohen Anisotropieeffekte eines Xenonatoms adsorbiert zwischen zwei Graphitebenen, würde durch die beobachtete hohe Halbwertsbreite von über 1600 Hz und der geringen 119 Diskussion Intensität der Resonanzlinie bestätigt werden. Suszeptibilitäts- und Ringstromeffekte würden ebenfalls die hohe Linienbreite erklären. Ein vergleichbarer Wert der chemischen Verschiebung in einem ähnlichen System wurde von Xenon gelöst in Benzol mit 193 ppm gefunden.[71] Andererseits sollte diese Resonanzlinie auch bei Black Pearls 2000 (12 nm) auftreten, was aber im beobachteten Druckbereich bis 17,7 bar nicht der Fall ist. Somit kann ebenfalls der Graphitisierungsgrad eine Rolle spielen, der bei Black Pearls 2000 aufgrund der Mikroporosität der Primärpartikeln im Vergleich zu den anderen Carbon Blacks wesentlich geringer ist. Bei hohen Xenondichten würden dann die lange Adsorptionsdauer der Xenonatome in den graphitähnlichen Bereichen zu dem Resonanzsignal um 203 ppm führen. Fest steht, dass die hohe chemische Verschiebung (ca. 203 ppm) und die hohe Halbwertsbreite (ca. 1600 Hz) auf eine geringe Austauschrate und hohe Wechselwirkungen mit der Adsorbentoberfläche zurückzuführen sind. Vergleichbare chemische Verschiebungswerte sind z. B. nur bei Polymeren gefunden worden. [100,117] 129 Xe-NMR-Untersuchungen an Die hohe Beweglichkeit der Polymerketten oberhalb der Glastemperatur, eine homogenere Porenstruktur und die geringen Austauschraten führen hier aber, im Gegensatz zum Carbon Black, zu kleineren Halbwertsbreite.[100] 6.5.6 Anwendung der Dubinin- und Langmuir-Isothermen Die Druckabhängigkeit der chemischen Verschiebung zeigt im Kurvenverlauf (Abbildung 5.3-3) eine Ähnlichkeit zu den Adsorptionsisothermen von Langmuir bzw. Dubinin und Asthakov (DA). Daher wird im Folgenden die Proportionalität zwischen δP und dem Adsorptions- bzw. Füllgrad θ untersucht und eine Angleichung der experimentellen Datenpunkte δP(p) mit den jeweiligen Adsorptionsisothermen durchgeführt (vgl. Kapitel 3). Im Fall eines schnellen Austausches zwischen adsorbiertem und freien Zustand ist die chemische Verschiebung der Xenonatome innerhalb einer Pore als Mittelwert aus beiden Zuständen anzusehen. Mit der chemischen Verschiebung des an der Porenwand adsorbierten Xenons (δA) sowie des in der Porenmitte befindlichen Xenons (δM) lässt sich die mittlere chemische Verschiebung in Abhängigkeit von Druck p und mittlerem Porenradius R P , wie folgt berechnen: δ P ( p, R P ) = θδ A + (1 − θ )δ M (6.5-2) 120 Kapitel 6 Für θ kann der Adsorptionsgrad der Langmuir bzw. DA-Gleichung eingesetzt werden, je nachdem ob eine Oberflächenadsorption oder ein Porenfüllmechanismus angenommen wird. Zur Erinnerung werden beide Funktionen noch einmal aufgeführt. Kp 1 + Kp Langmuir: θL = DA: RT ln(62,57 / p ) n θ D = exp− 0,5E (6.5-3) (6.5-4) δA und δM sind Funktionen von R P und in erster Näherung druckunabhängig. δA entspricht dem in Abbildung 5.3-3 erreichten Grenzwert der chemischen Verschiebung bei hohen Drücken und ist mit δA ∂ 1/ R P unter isothermen Bedingungen ein Maß für die mittlere Porengröße der Carbon Blacks. Xe δM Abb. 6.5-4 δA Zuordnung der chemischen Verschiebung in der Porenmitte (δM) und an der Xe Porenwand (δA). Unter der Annahme, dass δM im Bereich des freien Xenons liegt (δA à δM) und (1-θ) gegen Null verläuft, ergibt sich eine direkte Proportionalität zwischen δp und θ zu δ P ( p, R P ) ≈ θδ A (6.5-5) Gleichung 6.5-5 entspricht bei der Verwendung der Langmuir-Isothermen dem Dual- Mode-Modell, wenn der Henrysche Beitrag zur Adsorption vernachlässigt wird (s. Kapitel 4.3.7.5). Die Angleichung der DA- (Gleichung 6.5-3) und Langmuir-Isothermen (Gleichung 6.5-4) an die experimentellen Datenpunkte δP(p) ist in Abbildung 6.5-5 graphisch dargestellt. Dabei zeigt sich eine gute Übereinstimmung der Adsorptionsisothermen mit den experimentellen Werten. Die Ergebnisse der jeweils erhaltenen Fitt-Parameter sind in Tabelle 6.5-1 aufgelistet. 121 Chemische Verschiebung /ppm Diskussion 220 200 DA 180 160 140 120 100 80 60 40 20 0 0 2 Langmuir VPF2 BP PX2 4 6 VP VPF1 8 10 12 14 16 18 20 22 24 2 Tab. 6.5-1 6 Xenondruck /bar Xenondruck /bar Abb. 6.5-5 4 220 200 180 160 140 120 100 80 60 VPF2 VP 40 BP VPF1 20 PX2 0 8 10 12 14 16 18 20 22 24 Angleichung der DA- und Langmuir-Isothermen an δp(p). Ergebnisse der DA- und Langmuir-Isothermen (n = 3, T = 293 K) aus Abbildung 6.5-5. Carbon Black δA DA δA Langmuir Vulcan PF (2) /ppm 209,9 ± 3,1 E /kJ⋅mol-1 18,53 ± 3,76 /ppm 230,1 ± 6,1 K /bar-1 0,411 ± 0,040 Black Pearls 2000 136,1 ± 1,8 19,78 ± 2,28 149,7 ± 2,7 0,469 ± 0,025 Printex XE2 101,0 ± 1,9 24,68 ± 6,75 103,6 ± 2,6 1,270 ± 0,176 Vulcan P 93,8 ± 1,2 25,99 ± 8,97 96,0 ± 1,5 1,433 ± 0,169 Vulcan PF (1) 78,8 ± 2,3 25,83 ± 11,63 79,8 ± 2,4 1,568 ± 0,258 Die mit Hilfe der DA-Gleichung erhaltenen δA-Werte sind bei Vulcan PF, Vulcan P und Printex XE2 sind innerhalb der Fehlergrenzen vergleichbar mit denen der Langmuir- Gleichung. Nur bei Black Pearls 2000 und dem zweiten Resonanzsignal von Vulcan PF ist δA mit 136,1 und 209,9 ppm deutlich kleiner (Langmuir: 149,7 und 230,1 ppm). Die Adsorptionsenergie E liegt mit 18,5 bis 25,5 kJ/mol deutlich über dem Wert der Xenonadsorption auf einer einzelnen Graphitoberfläche (14-16 kJ/mol, Tabelle 3.2-1), was im Einklang mit dem Lennard-Jones-Potential in Mikroporen steht. Die Abnahme von E mit dem Porenradius ist dabei auf eine erleichterte Desorption innerhalb der Poren mit abnehmendem Radius zurückzuführen. Wie in Abbildung 3.2-3 bereits gezeigt wurde, nimmt die Energiedifferenz innerhalb einer Pore zwischen 122 Kapitel 6 adsorbiertem und freien Zustand mit sinkendem Porenradius ab. Ebenso ist die LangmuirKonstanten KL bei kleinen Poren in Black Pearls 2000 und Vulcan PF (2) kleiner eins, was nach kads/kdes < 1 ebenfalls auf eine höhere Desorptionsrate hinweist. 6.5.7 Porengrößenbestimmung aus Füllgrad und chemischer Verschiebung Im vorhergehenden Kapitel wurde deutlich, dass sich die Druckabhängigkeit der chemischen Verschiebung theoretisch über die Adsorptionsisothermen beschreiben lassen. Der Grenzwert δA und die Adsorptionsenergie der DA-Gleichung sind hierbei für den mittleren Porenradius charakteristische Größen. In einem Porensystem wird die chemische Verschiebung δp von den Wechselwirkungen der Kerne untereinander und mit der Oberfläche bestimmt. Ersteres ergibt sich in erster Näherung aus der Druckabhängigkeit der 129 Xe-NMR-Verschiebung nach Jameson et al. und kann verkürzt als Funktion des Xenondrucks δf(pXe) angegeben werden.[78] Die mittlere chemische Verschiebung der intraporösen Xenonatome Nges setzt sich schließlich aus der Summe der Xenonatome ∆Nz zusammen, die im Abstand z die chemische Verschiebung δz besitzen. ∆N z δ z +δ f ( p Xe ) N ges (6.5-6) ∑ ∆N (6.5-7) δp = ∑ z N ges = mit z z Weiter wird angenommen, dass sich maximal ∆Nz Gasteilchen, in Abhängigkeit von Druck und Temperatur im Volumen, ∆Vz befinden können. Bei der Betrachtung einer sphärischen Poren mit dem Radius Rsph ist ∆Vz eine Schale im Abstand z von der Porenoberfläche und der Dicke ∆z. ∆Vz = 4π (R sph − z ) 2 ∆z (6.5-8) Entsprechend gilt für das gesamte Porenvolumen Vges Vges = ∑ ∆V z z = 4 π (R sph − r 0 )3 3 (6.5-9) 123 Diskussion r0 ist der Minimale Abstand eines Gasteilchens zur Porenwand der im Folgenden für Xenon auf einer graphitähnlichen Oberfläche mit 0,375 nm angegeben wird (vgl. Kapitel 3.2.1). Wenn man außerdem davon ausgeht, dass sich die Stoffmengen ∆Nz und Nges in erster Näherung direktproportional zu ∆Vz bzw. Vges verhalten, wird aus Gleichung 6.5-6 unter Verwendung der Gleichungen 6.5-8 und 6.5-9, und unter Berücksichtigung eines Adsorptions- bzw. Füllgrades θ der Pore, somit δp = ∑ z θ (R sph − z ) 2 δ +δ ( p ) z ∆ z f Xe (R sph − r 0 ) 3 (6.5-10) Zur Vereinfachung wird in Gleichung 6.5-10 angenommen, dass die Xenondichte im gesamten Porenvolumen gleichgroß und der Füllgrad θ somit für alle Volumenelemente gleich ist. Die chemische Verschiebung δz verhält sich nach Derouane et al. [105] direkt proportional zum Verhältnis der Energien einer konkavgekrümmten (E(z)) und einer einzelnen, ebenen Oberfläche ( E (z ) ) R →∞ δz = δ0 E (z ) E (z ) (6.5-11) R →∞ Hierbei ist δ0 eine Konstante, die die chemische Verschiebung im minimalen Abstand r0 von der Oberfläche beschreibt. Für E(z) lässt sich die Gleichung des Lennard-JonesPotentials in einer sphärischen Pore einsetzten (Kapitel 3.2.1).[20] Somit ergibt sich eine Gleichung für die 129Xe-NMR-Verschiebung δz im Abstand z zur Oberfläche. 5 r 10 R δz = δ0 0 − 3 R z 10 sph 1 1 − (2R − z )10 z 10 sph 1 1 1 − − 4 (2R − z ) 4 z 4 sph (6.5-12) Aus Gleichung 6.5-10 erhält man somit unter Berücksichtigung eines infinitesimalen Abstandes dz eine Abhängigkeit der chemischen Verschiebung in Abhängigkeit von dem mittleren Porenradius. Rsph δp = δ0 ∫ r0 θ (R sph − z ) 2 (R sph − r 0 ) 3 E sph ( z ) dz + δ f ( p ) E sph ( z ) R →∞ (6.5-13) Die Druckabhängigkeit ist durch den Adsorptionsgrad gegeben, für den je nach 124 Kapitel 6 Porengröße die Gleichungen der Langmuir- oder Dubinin-Theorie eingesetzt werden können. Für zylindrische Poren und Schichtzwischenräume lassen sich nach dem obigen Schema zu Gleichung 6.4-15 entsprechende Funktionen aufstellen. R zyl δp = δ0 Zylinder: ∫ r0 δ p = δ0 Zwei Schichten: R2 s ∫ r0 θ (R zyl − z ) (R zyl − r 0 ) 2 E zyl ( z ) dz + δ f ( p ) E zyl ( z ) R →∞ θ E 2s ( z ) 1 dz + δ f ( p ) (R 2 s − r 0 ) E 2s ( z ) R →∞ (6.5-14) (6.5-15) In Abbildung 6.5-6 ist die relative chemische Verschiebung δp/δ0 als Funktion des Xenondrucks für verschiedene Radien R graphisch dargestellt. Zum Vergleich sind die Kurven einer sphärischen Pore mit dem Radius Rsph und eines Schichtzwischenraumes mit dem halben Schichtabstand R2S zusammen aufgeführt (Gleichung 6.5-13 u. 6.5-15). In sphärischen Poren erreicht die relative chemischen Verschiebung einen Grenzwert bei Drücken oberhalb von 8 bar, so wie es auch bei den experimentellen Ergebnissen zu beobachten ist. Die Höhe des Plateaus ist ebenfalls von dem Porenradius abhängig und ist umso größer, je kleiner der Porenradius gewählt wird. Im Vergleich dazu wird bei der Betrachtung eines Schichtzwischenraumes bis 20 bar kein Grenzwert der chemischen Verschiebung erreicht. 1.2 1 δp/δ0 0.8 0.6 0.4 0.2 0 5 10 15 20 Druck p/bar Abb. 6.5-6 Relative chemische Verschiebung δ/δ0 als Funktion des Drucks p für Verschiedene Porenradien einer sphärischen Pore (durchgezogene Linie) und eines Schichtzwischenraumes (unterbrochene Linie). E = 15,46 kJ/mol.[19] Porenradien Rsph bzw. R2S, jeweils beginnend mit der obersten Kurve: 0.5, 0.6, 0.8, 1.0 und 2.0 nm. 125 Diskussion Unter Verwendung des Adsorptionsgrades nach Dubinin für eine Adsorption in Mikroporen, liefert die Integration der Gleichung 6.5-15 eine Funktion, mit der schließlich durch Angleichung an die experimentell ermittelten Datenpunkte δp(p) der mittlere Porenradius Radius Rsph für die Ruße Vulcan PF, Printex XE2 und Black Pearls 2000 bestimmt werden kann. ( )( 2 5 3 2 R T ln( p / p ) n Rsph r0 Rsph − r0 416Rsph − 856R 4r0 + 740Rsph r02 − 320Rsph r03 + 70Rsph r04 − 5r05 G s 9 0.5E 27(2Rsph − r0 ) δ p = δ 016 exp− ) (6.5-16) Das Ergebnis der Angleichung ist in Abbildung 6.5-7 graphisch dargestellt. Das zweite Resonanzsignal mit der höchsten chemischen Verschiebung im 129 Xe-NMR-Spektrum von Vulcan PF dient hier als Referenz, da es sich hierbei offensichtlich um Xenonatome in Poren mit dem kleinsten Radius handelt. Als Grenzwert der chemische Verschiebung bei Raumtemperatur wird jeweils ein Wert von δ0 = 220 ppm angenommen, der als freier Parameter bei der Angleichung der Kurve von Vulcan PF (2) erhalten wurde. Der Exponent in der DA-Gleichung wird auf n = 2 für Mikroporen bzw. n = 3 für Ultramikroporen gesetzt. Die so erhaltenen Ergebnisse für den mittleren Porenradius Rsph sowie der Adsorptionsenergie E der DA-Gleichung sind in Tabelle 6.5-2 aufgelistet. Chemische Verschiebung /ppm 220 200 180 160 140 120 100 80 60 VPF2 BP PX2 40 20 VP VPF1 0 0 2 4 6 8 10 12 14 16 18 20 22 24 26 Xenondruck /bar Abb. 6.5-7 Angleichung der experimentellen Datenpunkte δp(p) mit Hilfe der Adsorptionsgleichung 6.5-16 für sphärische Poren zur Bestimmung des mittleren Porenradius Rsph (Gleichung 6.4-13,r0 = 0,375 nm, n = 3, δ0 = 220 ppm). 126 Tab. 6.5-2 Kapitel 6 Ergebnisse aus Angleichung der Datenpunkte δp(p) mit Gleichung 6.4-13. (δ0 = 220 ppm, rXe = 0,22 nm, r0 = 0.375 nm). Vulcan PF (2) n=2 E Rsph /nm /kJ⋅mol-1 0,63 ≤ 0,01 20,18 ≤ 0,97 n=3 E Rsph /nm /kJ⋅mol-1 0,65 ± 0,01 18,40 ± 0,37 Black Pearls 2000 0,76 ≤ 0,01 19,37 ≤ 0,41 0,80 ± 0,01 19,67 ± 0,23 Printex XE2 0,90 ≤ 0,01 25,64 ≤ 0,88 0,93 ± 0,01 24,56 ± 0,68 Vulcan P 0,95 ≤ 0,01 30,74 ≤ 2,04 0,97 ± 0,01 25,83 ± 0,89 Vulcan PF (1) 1,03 ≤ 0,03 28,16 ≤ 2,56 1,07 ± 0,02 25,70 ± 1,15 Carbon Black Der mittlere Porenradius liegt mit 0,63 bis 1,07 nm in dem für Mikroporen zu erwartenden Bereich und nimmt entsprechend den zuvor erhaltenen Ergebnissen von Vulcan PF (1) nach Black Pearls 2000 ab. Das zweite Signal im 129 Xe-NMR-Spektrum von Vulcan PF (2) weist entsprechend der höchsten chemischen Verschiebung auf die kleinste Porengröße hin (0,63 nm). Die Adsorptionsenergie nimmt ebenfalls mit sinkendem Porenradius ab, was nach dem Lennard-Jones-Potential in Mikroporen auf eine erleichterte Desorption aufgrund der Anziehungskraft der gegenüberliegenden Porenwände zurückzuführen ist (s. Kapitel 3.2.1). Die Änderung des Exponenten n von 2 auf 3 hat bzgl. des Fehlerbereiches eine zu vernachlässigende Auswirkung auf den Porenradius Rsph. Mit n = 3 werden jedoch für die Adsorptionsenergie kleinere Abweichungen gefunden (Tabelle 6.5-2). Insgesamt zeigt sich eine gute Übereinstimmung der theoretischen Kurve mit den experimentell erhaltenen Datenpunkten. Allerdings ist zu beachten, dass die Angleichung mit einer Fitt-Funktion mit fünf freien Parametern im besonders starkem Maße von den Startwerten abhängt und die in Tabelle 6.5-2 erhaltenen Ergebnisse nur als Richtwerte anzusehen sind, da insbesondere die erhaltenen Porenradien wesentlich kleiner sind, als diejenigen, die über die Partikelgröße bzw. aus Stampfdichte und spezifischer Oberfläche bestimmt wurden. 127 Diskussion 6.6 Halbwertsbreiten und T2-Relaxation Im Vergleich zum freien Xenon unterliegen die Xenonatome innerhalb der porösen Carbon Black Struktur zusätzlichen Relaxations- und Austauscheffekten, die zu einer erhöhten Linienverbreiterung führen. Ist eine Relaxation beim Xenon in der reinen Gasphase nur über skalare und dipolare Kopplungen während der Kollisionen untereinander möglich, so tragen beim intraporösen Xenon zusätzliche Kopplungen mit den Kernen der Adsorbentoberfläche zu einer Verringerung der transversalen Relaxationszeit und somit zur homogenen Verbreiterung der Resonanzlinie bei (Kapitel 4.1). Darüber hinaus sind bei Carbon Blacks magnetische Suszeptibilitäts- und Ringstromeffekte von Bedeutung, die zu einer Anisotropie der chemischen Verschiebung und somit zu einer inhomogenen Verbreiterung der Resonanzlinie führen können (Kapitel 4.3.8). Dies gilt ebenso für die bereits vorgestellten Austauscheffekte und Porengrößenverteilungen (s. Kapitel 4.1-3 und 6.4). Dass die Resonanzsignale hauptsächlich einer inhomogenen Linienverbreiterungen unterliegen, zeigt sich beim Vergleich der transversalen Relaxationszeiten T2 und T2*. Die T2-Zeiten aus den CPMG-Experimenten sind mit < 20 ms deutlich größer als die aus den Halbwertsbreiten bestimmten Relaxationszeiten T2*=(π∆ν1/2)-1 mit < 3 ms (s. Tabelle 5.3-2). 6.6.1 Porengrößenverteilung Es wurde bereits in Kapitel 6.3 darauf hingewiesen, dass Austauschprozesse zwischen Bereichen unterschiedlicher können. Ohne Austausch Resonanzsignal im 129 Xe-NMR-Verschiebung zu Linienverbreiterungen führen kann jeder Porengröße bei gleicher Belegung ein 129 Xe-NMR-Spektrum zugeordnet werden. Hohe Austauschraten zwischen den Poren führen schließlich dazu, dass die Signale zu einer einzigen, homogen verbreiterten Resonanzlinie koalieren. Eine Abnahme der Austauschrate, z. B. durch steigender Dichte oder sinkender Temperatur, führt zu einer inhomogenen Linienverbreiterung, die bei sehr langsamen Austauschgeschwindigkeiten zu einer Aufspaltung der Resonanzsignale kann, wie es z. B. bei Vulcan PF mit zunehmendem Druck zu beobachten ist (s. Abbildung 5.2-2). 128 Kapitel 6 Unsymmetrische Linienformen, wie sie im 129 Xe-NMR-Spektrum von Monarch 1300 (13,3 bar) und Vulcan PF (20,6 bar) zu finden sind, deuten auf eine Überlagerung mehrerer Signale hin und sind auf eine inhomogene Verteilung der Adsorptionsplätze bzw. Porengrößen innerhalb der Probe zurückzuführen (Abbildung 6.6-1).[107] Die Austauschrate zwischen diesen Bereichen ist aufgrund der räumlichen Entfernung und der niedrigeren Diffusionsgeschwindigkeit zu gering, als dass sie eine einzelne, homogene Resonanzlinie hervorrufen würden. VP VPF M13 CL6 Abb. 6.6-1 Qualitativer Vergleich der 129 Xe-NMR-Signalen (17 - 21 bar). Die Signale der Ruße Vulcan P (VP), Vulcan PF (VPF), Monarch 1300 (M13) und Corax L6 (CL6) zeigen eine inhomogene Verbreiterung. Bei VPF und M13 ist zudem eine Überlagerung mehrerer Resonanzlinien zu beobachten (s. Abbildung 6.6-2). Eine homogenere Porengrößenverteilung und somit eine Koaleszenz Resonanzsignale kann z. B. durch Mahlen der Probe erreicht werden. [119] der Anfänglich erhöht sich dabei die Austauschrate zwischen den Bereichen unterschiedlicher chemischer Verschiebung, so dass das resultierende 129 Xe-NMR-Signal zunächst einer verstärkten Linienverbreiterung unterliegen. Erst mit zunehmendem Mahlgrad und steigender Homogenität der Probe nimmt die Halbwertsbreite wieder ab. Die Adsorptionslinie im 129 Xe-NMR-Spektrum von Corax L6 besitzt im Vergleich zu den anderen Carbon Blacks eine besonders große Halbwertsbreite von fast 1100 Hz 129 Diskussion (Tabelle 5.2-1, Abbildung 6.6-1). Die kleine Partikelgröße von 18 nm und die geringen Stampfdichte von nur 120 g/dm3 deuten auf eine großporige und besonders inhomogene Aggregatstruktur mit einer breiten Porengrößenverteilung hin. Der verlangsamte XenonAustausch zwischen den intraporösen Bereichen führt hier zu der inhomogenen Verbreiterung. Auch die Halbwertsbreiten der 129 Xe-NMR-Signale von Vulcan PF und Vulcan P zeigen unter isobaren Bedingungen ebenfalls deutliche Unterschiede, die bei gleicher Austauschrate auf verschiedene Porengrößenverteilungen zurückzuführen sind. Bei Vulcan PF (VPF) verursachen die größeren Interaggregatporen eine breitere Porengrößenverteilung, die unter isobaren Bedingungen zu einer um mehr als 150 Hz höheren Halbwertsbreite führen (VPF: 584 Hz, 9,1 bar; VP: 439 Hz, 9,6 bar). Zusätzliche Linienverbreiterungen können durch unterschiedliche Belegungsgrade der Poren auftreten, wenn diese eine stark heterogene Verteilung der Adsorptionsplätze aufweisen.[91] Die lokalen Dichteunterschiede führen dabei zu einer heterogenen Verteilung der chemischen Verschiebung und somit zu größeren Halbwertsbreiten. Bei dem hier betrachteten System ist aber diese Art der Verbreiterung zu vernachlässigen, da die offene Porosität und die hohe kinetische Energie der Gasteilchen zu einem schnellen Austausch, und somit zu einer homogenen Xenondichteverteilung führen. Hingegen kann die Co-Adsorption eines Heteroadsorbats, wie z. B. Wasser oder Benzol, Adsorptionsplätze belegen und Porenräume verkleinert und so zu einer zusätzlichen Porengrößenverteilung beitragen.[119,122,123] Die Carbon Black Proben in dieser Arbeit wurden unter Hochvakuum bis zur Gewichtskonstanz getrocknet, so dass Heteroadsorbate nur noch in chemisorbierter Form an den Porenoberflächen auftreten und zusätzliche Porengrößenverteilungen daher ausgeschlossenen werden können. 6.6.2 Relaxationseffekte durch dipolare und skalare Kopplungen In der reinen Gasphase kann eine Relaxation der Xenonatome nur während der Kollision untereinander über dipolare und skalare Kopplungen erfolgen (vgl. Kapitel 4.1.2). Infolge dessen werden lange transversale Relaxationszeiten und kleine Linienbreiten (30 – 35 Hz) der 129 Xe-NMR-Signale gefunden. Im heterogenen System Xenon - Carbon Black unterliegen die Xenonatome zusätzlichen Kopplungen mit den Atomkernen und Radikalen der Primärpartikeloberfläche, die zu kurzen transversalen Relaxationszeiten T2 von 1– 20 ms und somit größeren Linienbreiten von über 100 Hz führen. 130 Kapitel 6 Bei Vulcan PF und Black Pearls 2000 wurden unter isobaren und isothermen Bedingungen gleichgroße T2-Zeiten gefunden, die sich jeweils um einen Faktor drei bis sechs von T2* unterscheiden. Da es sich bei beiden Rußen um Furnace Blacks handelt, die sich durch einen geringen Heteroatomanteil (< 2 Gew.%) und einer hohen Leitfähigkeit auszeichnen, kann man davon ausgehen, dass die gleichen T2-Zeiten auf ähnliche oberflächenchemische Eigenschaften zurückzuführen sind. 6.6.3 Anisotropieeffekte und Magnetische Suszeptibilität Die auf der Porenoberfläche adsorbierten Xenonatome tragen zu einer Anisotropie der chemischen Verschiebung und somit zu einer Linienverbreiterung der gemittelten [92] NMR-Signale bei (vgl. Kapitel 4.1-3). 129 Xe- Mit abnehmender Mobilität der Xenonatome wird dieser Effekt zunehmend stärker, so dass mit steigendem Druck bzw. abnehmender Temperatur eine Zunahme der Halbwertsbreite zu beobachten ist (Abbildung 5.3-1). Ebenso kann die besonders hohe Linienbreite der Adsorptionssignale im tiefen Feld um 200 ppm (Vulcan P, Vulcan PF, Corax L, Corax L6, Monarch 1300) von etwa 1600 Hz (12-20 bar) auf solche Anisotropieeffekte zurückgeführt werden. Als mögliche Adsorptionsplätze können z. B. Interpartikelräume einer kubischdichten Anordnung in atomarer Größenordnung oder Schichtzwischenräume von zwei überlappenden, oberflächennahen Graphitebenen angenommen werden. Weitere Linienverbreiterungen können den Suszeptibilitätseffekten der radikalischen Zentren sowie dem Ringstromeffekt der aromatischen Struktur zugeschrieben werden, die ebenfalls zur einer ortsabhängigen Verkürzung der transversalen Relaxation und somit zur Erhöhung der CSA beitragen (vgl. Kapitel 4.1.2).[119] 6.6.4 Druckabhängigkeit der T2-Relaxation und Halbwertsbreite Die T2-Messungen an Vulcan PF und Black Pearls 2000 zeigen, dass mit steigendem Druck die transversale Relaxationszeit T2 der intraporösen Xenonatome uneinheitlich mit T2* abnimmt. Bei kleinen Drücken (1,4 bar) sind die Wechselwirkungen mit der Adsorbentoberfläche relativ gering, so dass T2 z. B. bei Black Pearls 2000 fast siebenmal größer als T2*, oberhalb von 3 bar nur noch etwa dreimal und nimmt schließlich im weiteren Druckverlauf gleichmäßig mit T2* ab (s. Tabelle 5.3-2). Daraus folgt, dass bereits 131 Diskussion bei Drücken unter 3 bar Porengrößenverteilungen und Austauscheffekte zu einer inhomogenen Linienverbreiterung führen. Die Xenonproben von Vulcan PF und Black Pearls 2000 mit ca. 3 bar Xenondruck liefern im CPMG-Experiment mit 5,5 ms die gleichen T2-Zeiten (VPF: 2,9 bar, BP: 3,1 bar). Wie es sich bereits durch die gleiche chemische Verschiebung in diesem Druckbereich gezeigt hat, sind die Wechselwirkungen der Xenonatome bei beiden Proben in diesem Druckbereich gleich groß. Das Resonanzsignal bei Vulcan PF unterliegt aber einer stärkeren inhomogenen Verbreiterung (T2* = 1,14 ms, anstatt 3,00 ms bei Black Pearls 2000), was auf eine breitere Porengrößenverteilung zurückzuführen ist. Mit zunehmendem Druck ist unabhängig von der Probe bei T2 und T2* prozentual die gleiche Abnahme zu verzeichnen (Tabelle 5.3-2). D. h., die Zunahme der Linienbreite bei Druckerhöhung ist nur auf die zunehmenden Xenon-Xenon- und Xenon-Wand-Stöße zurückzuführen (s. Abbildung 5.3-1). Unter der Annahme, dass sich die transversale Relaxationszeit aus zwei Komponenten, im adsorbierten Zustand an der Porenwand (T2A) und freien Zustand in der Porenmitte (T2M), zusammensetzt, und sich die Anzahl der Xenonatome im jeweiligen Zustand aus dem Adsorptionsgrad θ bestimmen lässt, kann die Druckabhängigkeit von T2 wie folgt formuliert werden. 1 θ 1− θ = + T 2 T 2 A T 2M (6.6-1) Entsprechend gilt für die Halbwertsbreite ∆ν1/2 ∆ν 1/ 2 = θ ∆ν 1/ 2,A + (1 − θ ) ∆ν 1/ 2,M (6.6-2) Bei der Verwendung der Langmuir- bzw. DA-Gleichung für den Adsorptionsgrad θ , erfährt die T2-Zeit bzw. die Halbwertsbreite einen Grenzwert bei hohen Drücken, wie es auch in Abbildung 5.3-1 beobachtet werden kann. Im Gegensatz zur chemischen Verschiebung wird die Höhe des Plateaus (∆ν1/2,A) nicht durch die Porengröße, sondern bei gleichen Oberflächeneigenschaften nur durch die Porengrößenverteilung und Austauschrate bestimmt. Bei konstanter Austauschrate zwischen intra- und extraporösen Xenonatomen wird schließlich der Grenzwert erreicht. Eine weitere Zunahme der Halbwertsbreite, wie es z. B. bei Vulcan PF (20,6 bar) zu beobachten ist, kann auf eine inhomogene Verbreiterung durch Porengrößenverteilungen zurückgeführt (s. Abbildung 6.6-2). und beginnende Signalaufspaltung 132 Kapitel 6 6.6.5 Signalaufspaltung bei Vulcan PF zu höherem Feld Bei Drücken über 20 bar ist bei den Rußen Vulcan P, Vulcan PF und Printex XE2 eine leichte Abnahme der chemischen Verschiebung der intraporösen Xenonatome um 1-2 ppm zu beobachten (Tabelle 5.2-2). Bei Vulcan PF (20,6 bar) erfolgt eine Abnahme von 73,5 auf 68 ppm, wobei die Resonanzlinie zusätzlich einer heterogenen Verbreiterung unterliegt. Die Dekonvolution liefert zwei Resonanzlinien unterschiedlicher Intensität bei 71,5 und 64 ppm (Abbildung 6.6-2). Folgende Erklärung für diese Hochfeldverschiebung und Signalaufspaltung ist denkbar: Mit steigender Dichte wird der Austausch zwischen den Poren zunehmend behindert und es tritt eine Signalaufspaltung auf, die verschiedenen Xenonpopulationen innerhalb der Pore zuzuordnen ist. Das Signal im tieferen Feld bei 71,5 ppm wird von Xenonatomen hervorgerufen, die weiterhin mit der Adsorbentoberfläche wechselwirken, aber aufgrund der höheren Xenonkonzentration innerhalb der Substratschicht eine homogenere Umgebung erfahren und daher eine leicht zu höherem Feld verschobene chemische Verschiebung aufweisen (Abnahme von 73,5 auf 71,5 ppm). 64 ppm 71,5 ppm Abb. 6.6-2 Dekonvoluierung des 129 Xe-NMR-Signals von Vulcan PF 120 110 100 90 80 70 60 (ppm) 50 40 30 20 (20,6 bar). Das zweite Signal bei 64 ppm kann theoretisch von zwei Populationen hervorgerufen werden: Zum einen kann es sich hierbei um Xenonatome im freien Porenvolumen handeln, die aufgrund der hohe Dichte kaum mit der Oberfläche in Kontakt treten können und daher eine homogenere Umgebung erfahren. Zum anderen kann es sich um Gasteilchen in einer zweiten, größeren Porenart handeln, die aufgrund der hohen Xenondichte nur langsamer mit den Intraaggregatporen austauschen. Zu solchen Poren können die durch Agglomeration entstandenen Interaggregatporen gezählt werden, die z. B. beim geperlten Vulcan P kleiner als bei Vulcan PF sind und daher eine vergleichbare 133 Diskussion Aufspaltung der 129 Xe-NMR-Signale hier nicht zu beobachten ist. Ebenso denkbar ist, dass die bereits erwähnte Oberflächenporosität mit steigender Dichte vollständig belegt wird und so die Oberfläche für weitere Xenonatome „glatter“ erscheinen lässt.[71] Das Resonanzsignal um 203 ppm könnte somit den Xenonatomen innerhalb der Operflächenporosität zugeordnet werden. Durch den fehlenden Austausch mit dem Bereich der hohen chemischen Verschiebung erleiden die restlichen Xenonatome eine Hochfeldverschiebung zu 71,5 und 64 ppm. 6.7 29 Xe-NMR-Spektrum von Graphit Graphit besitzt im Gegensatz zum Carbon Black keine poröse Struktur, in die die Gasteilchen hinein diffundieren können. So sind die Abstände der übereinanderliegenden Graphitebenen mit 0,335 bis 0,344 nm für Xenonatome mit einem Van-der-WaalsDurchmesser von 0,44 nm nicht zugänglich. Adsorption kann daher ausschließlich an den äußeren Partikeloberflächen stattfinden. Der Austausch zwischen adsorbiertem und freien Zustand erfolgt somit ungehindert und so schnell, dass eine Aufspaltung der Resonanzsignale nicht zu beobachten ist. Vielmehr ist ein inhomogen verbreitertes Signal um 5 ppm zu finden, dass nach den Ergebnissen der Dekonvolution aus drei überlagernden Signalen besteht (Abbildung 6.8-1): 1 2 3 50 40 30 20 10 0 -10 -20 -30 -40 (ppm) Abb. 6.7-1 129 Xe-NMR-Spektrum von Graphit (10 bar). 1: freies Xenon (4,6 ppm, 110 Hz), 2: adsorbiertes Xenon an Graphitfehlstellen (6,5 ppm, 148 Hz), 3: adsorbiertes Xenon auf der Graphitoberfläche (1,8 ppm, 1641 Hz). 134 Kapitel 6 Das schmalbandige Signal hoher Intensität bei 4,6 ppm wird von Xenonatomen hervorgerufen, die sich während des NMR-Experiments hauptsächlich im freien Probenvolumen aufhalten und nicht bzw. kaum mit der Adsorbentoberfläche in Wechselwirkung treten. Das als Schulter des freien Gassignals bei 6,5 ppm zu erkennende Signal kann den auf der Graphitoberfläche an energiereichen Zentren adsorbierten Xenonatomen zugeordnet werden, wobei die Schulterbildung und die relativ geringe Linienbreite von 148 Hz auf eine hohe Beweglichkeit der Gasteilchen und somit ebenfalls auf einen schnellen Austausch mit den freien Xenonatomen schließen lässt.[100] Zu diesen energiereichen Adsorptionsstellen zählen Kanten der Graphitebenen, amorphe Bereiche mit chemisorbierten Heteroatomgruppen und andere Defektstellen innerhalb der Graphitoberfläche (s. Kapitel 2.3). Ebenso kann eine partielle Oberflächenporosität zu einer verstärkten Adsorption und somit zu einer höheren chemischen Verschiebung beitragen. Das dritte Signal ist mit 1641 Hz relativ breit und zeigt damit Ähnlichkeiten zum zweiten Resonanzsignal im Spektrum der Carbon Blacks um 200 ppm (Kapitel 6.6). Eine Ursache für die hohe Linienbreite ist in der schuppenartigen Struktur der Graphitpartikel zu finden, die zu einer anisotropen Ausrichtung der Flächennormalen zum Magnetfeld führt und so eine hohe Anisotropie in der chemischen Verschiebung der adsorbierten Xenonatome verursacht. An dieser Stelle sei auf die Ergebnisse von Ripmeester et al. hingewiesen, die den Einfluss der makroskopischen Partikelanordnung in schichtförmigen Tetramethylammonium-Montmorilloniten (Montmorillonit = Bleicherde) auf die 129 Xe-NMR-Signale untersuchten und mit 155 ppm eine ungewöhnlich hohe Anisotropie der chemischen Verschiebung fanden.[92] Das Resonanzsignal bei einer zufälligen Anordnung der Partikel setzt sich dabei aus den einzelnen Signalen für eine ausschließlich parallele bzw. senkrechte Ausrichtung bzgl. der Richtung des externen Magnetfeldes zusammen. Neben den strukturbedingten Anisotropieeffekten tragen auch Suszeptibilitätseffekte der paramagnetischen Zentren, sowie der Ringstromeffekt des konjugierten π-Systems in der Graphitebene, zu einer heterogenen Verteilung der chemischen Verschiebung (CSA) und somit zur Linienverbreiterung bei. Die mittlere chemische Verschiebung von 1,8 ppm deutet wiederum auf einen schnellen Austausch der Xenonatome zwischen adsorbiertem und freien Zustand hin. 135 Dikussion 6.8 Xenon-Adsorption in Carbon Black Nachdem die qualitativen Untersuchungen der Struktur und Porengröße der Carbon 129 Blacks Xe-NMR-Spektren Kenntnisse über geliefert haben, soll nun das Adsorptionsverhalten der Carbon Blacks quantitativ untersucht werden. Aus den relativen Integralen der 129 Xe-NMR-Signale der druckabhängigen Messungen an Vulcan PF, Printex XE2 und Black Pearls 2000 kann die spezifische Adsorbatmenge a in Abhängigkeit vom Xenondruck und Menge Carbon Black bestimmt werden (vgl. Abbildung 5.6-1). Die genannten Ruße sind für quantitative Adsorptionsmessungen besonders geeignet, da sie sich nur in der spezifischen Oberfläche unterscheiden, sonst aber vergleichbare chemische und physikalische Eigenschaften besitzen. Als Leitfähigkeitsruße besitzen sie jeweils eine geringe Heteroatomkonzentration auf der Oberfläche und vergleichbare Stampfdichten von 140 -190 g/dm3 (s. Tabelle A.1-1). 6.8.1 Spezifische Adsorbatmenge a Als spezifische Adsorbatmenge a wird im Allgemeinen der Quotient aus Menge Adsorbat und Menge Adsorbent bezeichnet. Hier wird aM als das Verhältnis der Stoffmenge des in den Poren adsorbierten Xenons np(Xe) zur Masse des Carbon Blacks mCB definiert: aM = n p ( Xe ) (6.8-1) mCB Daraus lässt sich die spezifische Adsorbatmenge aS pro Oberfläche mit Hilfe der spezifischen Oberfläche σs berechnen zu aS = aM (6.8-2) σs Unter der Annahme, dass sich die relativen Integrale der 129 Xe-NMR-Signale proportional zur jeweiligen Xenonpopulation verhalten, lassen sich die Molenbrüche des intra- und extraporösen Xenons, xp und xf, bestimmen. xp = Ip I p + If und xf = If I p + If (6.8.3) 136 Kapitel 6 Die gesamte Masse des im Probenraum befindlichen Xenons, mXe, lässt sich durch Rückwiegen der Probe ermittelten (s. Probenvorbereitung in Kapitel 8.1). Die gesamte Stoffmenge nXe(Xe) kann über die molare Masse M(Xe) bestimmt werden zu n ges ( Xe ) = m Xe , M ( Xe ) (6.8-4) Die Stoffmengen des intra- und extraporösen Xenons lassen sich schließlich aus nges und dem jeweiligen Molenbruch xp bzw. xf berechnen. n p ( Xe ) = x p ⋅ n ges ( Xe ) (6.8-5) n f ( Xe ) = x f ⋅ n ges ( Xe ) (6.8-6) und Bei bekannter Masse des Carbon Blacks können mit Hilfe der Gleichung 6.8-1 bis 6.8-5 die massen- und oberflächenspezifischen Adsorbatmengen aM und aS in Abhängigkeit vom Xenondruck bestimmt werden (s. Anhang Tabelle A.3-1 bis A.3-3). Die Funktionen aM(p) und aS(p) werden entsprechend als massenspezifische bzw. oberflächenspezifische Adsorptionsisotherme bezeichnet. Bei Vulcan PF wird die Summe der zwei Resonanzlinien im tiefen Feld berücksichtigt. In Abbildung 6.8-1 sind die massenspezifischen Xenon-Adsorptionsisothermen von Vulcan PF, Printex XE2 und Black Pearls 2000 dargestellt. Bei allen drei Carbon Blacks erfolgt zunächst eine annähernd lineare Zunahme der Adsorbatmenge aM mit dem Druck. Unter isobaren Bedingungen steigt die spezifische Adsorbatmenge entsprechend der zunehmenden spezifischen Oberfläche von Vulcan PF, über Printex XE2 nach Black Pearls 2000 an. Während aM bei Vulcan PF auch bei Drücken über 10 bar linear ansteigt, erreichen die Isothermen der beiden anderen Carbon Blacks annähernd einen Grenzwert, der bei Black Pearls 2000 (1475 m2/g) mit ca. 12 mmol/g größer ist als bei Printex XE2 (1000 m2/g) mit ca. 10 mmol/g. Das Xenonadsorptionsverhalten der Carbon Blacks entspricht also qualitativ dem der Stickstoffadsorption, die zur Bestimmung der BETOberfläche σs herangezogen wurden. Zur weiteren quantitativen Analyse der Xenonadsorption werden daher im Folgenden die Gleichungen der Langmuir-, BET- und Dubinin-Theorie auf die experimentell erhaltenen Adsorptionsisothermen aus Abbildung 6.8-1 angewendet. 137 Diskussion Adsorbatmenge aM /mmol g -1 12 10 8 6 Black Pearls 2000 Printex XE2 Vulcan PF 4 2 0 0 4 8 12 16 20 24 Xenondruck /bar Abb. 6.8-1 Massenspezifische Adsorbatmenge aM als Funktion des Xenondrucks pxe von Black Pearls 2000 (1475 m2/g), Printex XE2 (1000 m2/g) und Vulcan PF (140 m2/g) ( Messwerte s. Tabelle A.3.1 - A.3-3). 6.8.2 Adsorptionstheorien nach Langmuir, BET und Dubinin-Asthakov Die Adsorptionsisothermen in Abbildung 6.8-1 lassen sich, je nachdem ob es sich um eine Adsorption auf den Porenwänden oder um ein Porenfüllen handelt, mit den Theorien von Langmuir bzw. BET oder von Dubinin beschreiben (vgl. Kapitel 3.2). Welche Theorie die Xenon-Adsorptionsvorgänge in Carbon Blacks, soll im Folgenden näher untersucht werden. Die entsprechenden Adsorptionsgleichungen werden dazu auf die experimentell erhaltenen Punkte aM(p) angewendet und die optimale Angleichung gesucht. Die FitFunktionen werden hier zur Erinnerung noch einmal aufgeführt (Gleichung 6.8-7 bis 6.8-9). Da die 129 Xe-NMR-Spektren jeweils oberhalb der kritischen Temperatur des Xenons aufgenommen wurden, wird in der Dubinin- und BET-Gleichung für den Sättigungsdampfdruck ps = 62,57 bar verwendet (s. a. Kapitel 3.2.7). KL p 1+ K L p Langmuir: a = a0 BET: a = a mon c( p / ps ) (1 − p / ps )(1 − (1 − c )p / ps ) (6.8-7) (6.8-8) 138 Kapitel 6 2RT ln( p / p ) n s a = a0 exp − E0 DA: 6.8.2.1 Oberflächenadsorption Nach den Überlegungen von Ripmeester et al. kann das den (6.8-9) an den Porenwänden adsorbierten 129 Xe-NMR-Signal im tiefen Feld Xenonatomen zugeordnet werden.[20] Entsprechend liefern die desorbierten Xenonatome im Porenraum das Resonanzsignals des freien Xenons. Im Gleichgewicht können die relativen Integrale den einzelnen Populationen im adsorbierten und freien Zustand gleichgesetzt und die Adsorptionsisothermen der Langmuir- und BET-Gleichung verwendet werden. Tab. 6.8-1 Ergebnisse der Langmuir- und BET-Isothermen bzgl. der massenspezifischen Adsorbatmenge aM. a0 ist die maximale Adsorbatmenge und E = RT lnc. Carbon Black Vulcan PF Langmuir a0 K /bar-1 /mmol⋅g-1 - BET amon /mmol⋅g-1 3,38 ≤ 0,58 3,00 ≤ 0,83 E /kJ⋅mol-1 2,68 ≤ 0,64 c Printex XE2 13,72 ≤ 1,03 0,115 ≤ 0,022 6,93 ≤ 0,50 19,19 ≤ 7,02 7,20 ≤ 0,76 Black Pearls 2000 27,21 ≤ 7,81 0,048 ≤ 0,020 12,21 ≤ 1,94 6,97 ≤ 2,39 4,73 ≤ 0,72 Die Langmuir-Theorie verlangt das Erreichen einer Grenzadsorbatmenge mit zunehmendem Druck, was aber nur bei den Isothermen von Printex XE2 und Black Pearls 2000 zu beobachten ist (Abbildung 6.8-2) und daher bei der Isothermen von Vulcan PF nicht angeendet werden kann. Die Konstante K ist bei beiden Rußen < 1, was jeweils auf eine hohe Desorptionsrate hindeutet (kdes > kads). Diese ist bei Black Pearls 2000 größer, da durch die kleineren Porendurchmesser die Energiedifferenz zwischen adsorbiertem und freien Zustand herabgesetzt wird (Kapitel 3.2.1). Die Grenzadsorbatmengen a0 der Langmuir-Gleichung ist bei Black Pearls 2000 etwa doppelt so groß wie bei Printex XE2, obwohl die spezifische Oberfläche aus BET(N2)Messungen nur ein Drittel größer ist. Vergleichbare Werte finden sich auch in den Ergebnissen der BET-Gleichung, wobei die Grenzadsorbatmenge der Monolayerbelegung 139 Diskussion amon jeweils nur halb so groß ist und ebenfalls unverhältnismäßig mit der spezifischen Oberfläche von Vulcan PF nach Black Pearls 2000 zunimmt (Tabelle 6.8-2). Die aus der Konstanten c ermittelten Adsorptionsenergien E liegen bei Black Pearls 2000 und Printex XE2 mit 4,73 und 7,2 kJ/mol in den von Hobza [25] und Everett et al. [19] vorhergesagten Bereich für eine Xenonadsorption auf Aromaten bzw. Graphit (Tabelle 3.2-1). Die kleinere Adsorptionsenergie bei Black Pearls 2000 lässt sich wiederum auf die geringeren Interpartikelabstände und Porengrößen zurückführen. Adsorptionsgrad aM/mmol g -1 14 12 10 8 BP PX2 VPF Langmuir BET 6 4 2 0 0 4 8 12 16 20 24 Xenondruck /bar Abb. 6.8.2 Angleichung der Xenon-Adsorptionsisothermen mit der Langmuir- und BET-Gleichung. 6.8.2.2 Porenfüllen nach Dubinin Die Beschreibung der Ergebnisse mit Hilfe der Dubinin-Theorie erfolgt unter der Annahme, dass die Xenonadsorption in Carbon Black einem Porenfüllen entspricht. Die Angleichung der DA-Funktion an der experimentell erhaltenen Adsorptionsisothermen ist in Abbildung 6.8-3 dargestellt. Der Kurvenverlauf zeigt bei allen drei Rußen eine gute Übereinstimmung mit den experimentellen Daten. Die Ergebnisse der Angleichung sind in Tabelle 6.8-2 aufgelistet und liegen in dem zu erwartenden Bereich für mikroporöse Strukturen. So entspricht der Exponent der DA-Gleichung mit n = 2 bei Vulcan PF dem 140 Kapitel 6 von Dubinin vorhergesagten Wert für Mikroporen (Tabelle 6.8-2).[31] Die Werte von 2,39 und 3,36 bei Printex XE2 und Black Pearls 2000 stimmen mit der Abnahme des mittleren Porenradius in der Reihenfolge dieser Carbon Blacks überein und weisen bei Black Pearls 2000 auf Ultramikroporen hin, die nach Dubinin einen Wert von n = 3 erfordern. Adsorbatmenge aM /mmol g -1 12 10 8 BP PX2 VPF DA-Gleichung 6 4 2 0 0 4 8 12 16 20 24 Xenondruck /bar Abb. 6.8-3 Angleichung der Xenon-Adsorptionsisothermen mit der Hilfe DA- Gleichung. Tab. 6.8-2 Ergebnisse der DA-Isothermen bzgl. der massenspezifischen Adsorbatmenge aM. a0 ist die maximale Adsorbatmenge. Carbon Black Vulcan PF (140 m2/g) Printex XE2 2 (1000 m /g) Black Pearls 2000 (1475 m2/g) Dubinin-Asthakov a0 E0 n -1 /mmol⋅g /kJ⋅mol-1 2,01 ≤ 0,55 4,12 ≤ 0,86 9,17 ≤ 1,22 2 4,14 ≤ 0,25 9,14 ≤ 0,31 2,39 ≤ 0,32 10,63 ≤ 0,53 14,11 ≤ 0,55 2 11,37 ≤ 0,35 13,58 ≤ 0,52 3 9,98 ≤ 0,30 14,49 ≤ 0,50 3,36 ≤ 0,25 12,67 ≤ 0,51 13,41 ≤ 0,25 2 16,89 ≤ 1,14 11,50 ≤ 0,46 3 13,35 ≤ 0,33 13,10 ≤ 0,18 141 Diskussion Die aus der DA-Gleichung erhaltenen Adsorptionsenergien liegen mit 9 kJ/mol bei Vulcan PF und 13-14 kJ/mol bei Black Pearls 2000 und Printex XE2 in dem zu erwartenden Bereich für intraporöse Bereiche mit graphitähnlichen Oberflächen (s. Tabelle 3.2-1). Diese Energiewerte entsprechen dem Minimum der Potentialkurven in Mikroporen und nehmen, wie zu erwarten, mit sinkendem mittleren Porenradius von Vulcan PF nach Black Pearls 2000 zu.[19,20] Außerdem ist eine lineare Zunahme der Grenzadsorbatmengen a0 mit steigender spezifischer Oberfläche zu beobachten (Abbildung 6.8-4), die mit den Ergebnissen aus der BET-Gleichung für die Monolayerbelegung amon vergleichbar sind. Lediglich der Wert für Printex XE2 liegt mit a0 = 10,3 mmol/g etwa um ein Drittel höher. Es zeigt sich also, dass die gleiche Adsorbatmenge einmal einer Oberflächenadsorption und ein anderes Mal einer Porenabsorption zugeschrieben wird, was bei der Bestimmung der spezifischen Oberfläche zu Problemen führen kann. Wenn nämlich die Ergebnisse auch auf Temperaturen unterhalb des kritischen Wertes übertragbar sind, ist es denkbar, dass auch bei Standard-BET-Messungen durch das Porenfüllen den im Porenvolumen befindlichen Adsorbatmolekülen eine zusätzliche Oberfläche zugeordnet, und somit eine größere spezifische Oberflächen als die tatsächliche erhalten wird. Adsorbatmenge a0 /mmol g -1 16 14 12 10 8 6 4 Dubinin BET 2 0 0 200 400 600 800 1000 1200 1400 1600 2 -1 Spezifische Oberfläche /m g Abb. 6.8-4 Xenon-Grenzadsorbatmengen a0 der Dubinin- und BET-Gleichung in Abhängigkeit von der spezifischen N2-Oberfläche 142 Kapitel 6 In der Dubinin-Theorie kommt der Anfangssteigung der Adsorptionsisothermen in weitere Bedeutung zu. Bei der Adsorption in Mikroporen kann der Verlauf der Adsorptionsisothermen bei kleinen Drücken (§ 10 bar) in erster Näherung als linear angesehen werden (a º Kp) (Kapitel 3.2.7). Die Anfangsteigung (∑aM/∑p)T wird dazu über eine lineare Regression der experimentellen Datenpunkte aM(p) im Bereich von 0 bis 10 bar ermittelt (Abbildung 6.8-5a). ∂a a(p ) ≈ p ∂p T (6.8-10) Dabei wird berücksichtigt, dass a(0) = 0 sein muss. Die Ergebnisse sind in Tabelle 6.8-3 aufgelistet. Wie die Grenzadsorbatmenge aus der DA-Gleichung, verhält sich auch die Steigung (∑aM/∑p)T direkt proportional zur spezifischen Oberfläche und kann daher ebenfalls als charakteristische Größe der hier untersuchten Carbon Blacks betrachtet werden (Abbildung 6.8-5b). Mit Hilfe von Gleichung 3.2-18 lässt sich außerdem die 1,2 12 (a) (b) BP 1,0 10 (da/dp)T /mmol g bar PX2 8 0,8 0,6 6 BP PX2 VPF 4 0,4 -1 2 0 0,2 VPF 0 2 4 6 8 0 10 400 600 0,0 800 1000 1200 1400 1600 2 -1 Xenondruck /bar Abb. 6.8-5 200 Spezifische Oberfläche /m g (a) Lineare Regression der Adsorptionsisothermen. (b) Abhängigkeit der Steigung (∑aM/∑p)T von der spezifischen Oberfläche. Tab. 6.8-3 -1 Adsorptionsgrad aM/mmol g -1 Adsorptionsenergie E bei bekannter Grenzadsorbatmenge a0 und Exponent n berechnen. Ergebnisse der linearen Regression der Geraden a = (∑aM/∑p)T ·p Carbon Black σs 2 Vulcan PF /m ⋅g 140 -1 δp /ppm 73,4 (∂aM/∂p)T für a(0)=0 /mmol⋅g-1bar-1 0,1425 ± 0.0065 Printex XE2 1000 100,1 0,8353 ± 0.0410 Black Pearls 2000 1475 132,2 1,0790 ± 0,0264 143 Diskussion 6.8.3 Oberflächenspezifische Adsorbatmenge Betrachtet man nicht die adsorbierte Stoffmenge Xenon pro Masse mCB sondern pro Oberfläche, aS = np/SCB, zeigt sich ein etwas anderes Adsorptionsverhalten der hier untersuchten Carbon Blacks. Printex XE2 und Black Pearls 2000 zeigen aufgrund ihrer mikroporösen Primärpartikel ein ähnliches Adsorptionsverhalten bzgl. ihrer spezifischen Oberfläche. Die Isothermen zeigen den selben Verlauf und erreichen bei ca. 10 bar ein Plateau gleicher Höhe (Abbildung 6.8-6a). Bei beiden Carbon Blacks ist also die Xenonkonzentration auf der Oberfläche bzw. in den Poren unter isobaren Bedingungen etwa gleich groß. Die Adsorptionsisotherme von Vulcan PF ist wiederum im beobachteten Druckbereich linear. Unter Berücksichtigung einer hexagonaldichtesten Packung der Xenonatome auf der Carbon Black – Oberfläche lässt sich die maximale adsorbierte Stoffmenge bzgl. einer Monolayerbelegung aSmax bestimmen.[3] Der Quotient aS/aSmax gibt schließlich den Grad der Oberflächenbelegung θ an, der bei vollständiger Belegung gleich eins ist. In -6 aS /10 mol m (b) (a) VPF PX2 BP 0 2 4 6 8 10 12 14 16 18 20 22 24 0 Xenondruck /bar Abb. 6.8-6 aS/aSmax 2 4 6 8 10 12 14 16 18 20 22 24 2,2 2,0 1,8 1,6 1,4 1,2 1,0 0,8 0,6 0,4 0,2 0,0 max 22 20 18 16 14 12 10 8 6 4 2 0 aS/aS -2 Abbildung 6.8-6b ist aS/aSmax als Funktion des Druckes graphisch dargestellt. Xenondruck /bar (a) Abhängigkeit der Adsorbatmenge aS und (b) des Belegungsgrades vom Xenondruck. aSmax ist die maximale Adsorbatmenge Xenon pro Oberfläche (aus BET-Messungen). Hier zeigt sich deutlich eine Annäherung der Isothermen von Printex XE2 und Black Pearls 2000 an den Wert eins, er wird aber nicht überschritten. Ausgehend von der aus Stickstoffadsorptionsmessungen bestimmten spezifischen Oberfläche wird bei diesen 144 Kapitel 6 beiden Carbon Black maximal eine Monolayerbelegung der Oberfläche beobachtet. Ganz im Gegensatz zu Vulcan PF, dessen Kurve bei etwa 20,6 bar das 2,2-fache des theoretischen Wertes einer Monolayerbelegung erreicht und somit auf ein Füllen des Porenraumes hinweist. Damit wird wiederum bestätigt, dass Vulcan PF eine großporige Agglomeratstruktur besitzt, dessen mittleres Porenvolumen größer als die der anderen beiden Ruße ist, und daher eine Xenonadsorption erlaubt. Abschließend soll im folgenden die Abhängigkeit der chemischen Verschiebung und Halbwertsbreite der intraporösen Xenonatome von der theoretischen Xe-Oberflächenkonzentration betrachtet werden. Hierzu ist in Abbildung 6.8-7 δp und ∆ν1/2 als Funktion der oberflächenspezifischen Adsorbatmenge aS dargestellt. Hier fällt auf, dass bei Belegungsgraden unter 1⋅10-6 mol/m2 die chemischen Verschiebungen von Vulcan PF, Printex XE2 und Black Pearls 2000 gleich große Werte annehmen. Bei kleinen Oberflächenkonzentration bzw. –Dichten hat die Porengröße also keinen Einfluss auf δp. Entsprechend dem Verlauf der massenspezifischen Adsorptionsisothermen wird auch hier bei hohen Drücken in der Reihenfolge Vulcan PF < Printex XE2 < Black Pearls 2000 ein 140 700 (b) (a) 600 120 500 100 400 80 300 60 200 BP PX2 VPF 40 0 2 4 6 8 -6 10 -2 Adsobatmenge aS/10 mol m Abb. 6.8-7 Halbwertsbreite /Hz Chemische Verschiebung /ppm Plateau erreicht. 100 0 0 2 4 6 8 -6 10 -2 Adsorptionsgrad aA /10 mol m (a) Chemische Verschiebung δp und (b) Halbwertsbreite als Funktion der oberflächenspezifischen Adsorbatmenge aS (Oberfläche aus BET-Messungen). In Bezug auf die oberflächenspezifische Adsorbatmenge aS zeigen die Halbwertsbreiten von Printex XE2 und Black Pearls 2000 im Vergleich untereinander keine Unterschiede (s. Abbildung 6.8-7b). Dieses Verhalten ist so zu deuten, dass die Xenonatome bei gleicher Dichte und Oberflächenbelegung die gleiche chemische Umgebung erfahren. Insgesamt Diskussion 145 weisen die Ergebnisse der Adsorptionsmessungen daraufhin, dass innerhalb der mikroporösen Strukturen von Printex XE2 und Black Pearls 2000 eine Adsorption nach Dubinin stattfindet und ein Füllen der Poren anstatt einer reinen Adsorption an den Porenwänden anzunehmen ist. 146 Kapitel 7 Zusammenfassung Mikroporöse Carbon Blacks mit spezifischen Oberflächen von 28 bis 1475 m2/g wurden mit Hilfe der 129 Xe-NMR-Spektroskopie untersucht und charakterisiert. Einzelne Xenonatome dringen in die porösen Strukturen ein und liefern so Informationen über mittlere Porengröße und Oberflächeneigenschaften der Carbon Blacks. Die Ausdehnung der porösen Strukturen können im NMR-Experiment als unendlich angesehen werde, da zwischen den intra- und extraporösen Xenonatomen kein Austausch stattfindet und die Resonanzsignale beider Populationen getrennt voneinander im 129 Xe-NMR-Spektrum vorliegen. Druckabhängige Messungen wurden an den Rußen Vulcan PF, Vulcan P, Printex XE2 und Black Pearls 2000 durchgeführt und hinsichtlich chemischer Verschiebung, Halbwertsbreite und Adsorptionsverhalten untersucht und charakterisiert. Die Porengrößen der Carbon Blacks lassen sich in drei Kategorien unterteilen: Interaggregatporen, Intraaggregatporen und Intrapartikelporen. Die mittleren Porenradien nehmen in der genannten Reihenfolge ab und liegen etwa zwischen 1 und 100 nm. Der Radius der Intraaggregatporen bei kubisch dichter Anordnung lässt sich aus dem Partikelradius bestimmen und liegt bei den hier untersuchten Carbon Blacks zwischen 1,35 (Black Pearls 2000) und 4,94 nm (N550). Die chemische Verschiebung der intraporösen Xenonatome δp ist eine Funktion des Xenondrucks, der Temperatur und der mittleren Porengröße. Oberflächenchemische Eigenschaften können bei Heteroatomkonzentrationen von unter 3 % vernachlässigt werden, da bei den hier untersuchten Carbon Blacks kein messbarer Einfluss auf die chemische Verschiebung nachgewiesen werden konnte. Bei Raumtemperatur erreicht die 129 Xe-NMR-Verschiebung zwischen 5 und 18 bar einen Grenzwert, der sich annähernd reziprok zum mittleren Volumen/Oberfläche-Verhältnis bzw. Porenradius verhält (δP ∂ S/V ∂ 1/ R P ) und Werte zwischen 48,4 ppm bei 78,6 nm (N550) und 132,3 ppm bei 4,2 nm (Black Pearls 2000) annehmen kann. Je größer die Poren sind, desto eher wird der Grenzwert der chemischen Verschiebung erreicht. Unter isothermen und isobaren Bedingungen ist δp daher eine für die Porenstruktur der Carbon Blacks charakteristische Größe. Bei Drücken über 20 bar erfolgt eine Abnahme der chemische Verschiebung um 147 Zusammenfassung 1-3 ppm aufgrund der zunehmend homogeneren Umgebung der Xenonatome. Die kleinsten Abweichungen von der Linearität zum reziproken Radius konnten bei den Intraaggregatporen nachgewiesen werden, was auf eine bevorzugt kubisch dichte Anordnung der Primärpartikel hinweist. Bezogen auf die spezifische Oberfläche und chemische Verschiebung lassen sich die hier untersuchten Carbon Blacks in zwei Kategorien unterteilen: bei Carbon Blacks mit nichtporösen Primärpartikeln nimmt δP von 0 bis 100 ppm proportional mit der spezifischen Oberfläche (< 1 bis 300 m2/g) zu. Bei Rußen mit porösen Primärpartikeln und größeren spezifischen Oberflächen (> 500 m2/g) nimmt die chemische Verschiebung unabhängig von σS Werte zwischen 100 und 132 ppm an. Die Porenstruktur der Carbon Blacks ist im Vergleich zu Zeolithen sehr inhomogen und besitzt daher eine breite Porengrößenverteilung, wodurch sowohl Porenradius als auch chemische Verschiebung durch Austauscheffekte stets als Mittelwerte zu betrachten sind. Mit zunehmendem Druck und abnehmender Temperatur sinkt die Austauschrate, was sich in einer inhomogenen Verbreiterung der Resonanzlinie bzw. in einer Signalaufspaltung bemerkbar macht. Dies ist z. B. bei Vulcan PF zu beobachten dass bei 20,6 bar zwei Signale bei 71 und 203 ppm zeigt. Die Linienbreite gibt unter isobaren und isothermen Bedingungen die Porengrößenverteilung wieder und liegt hier in einem Bereich von 100 bis 1100 Hz. Eine besonders hohe Linienbreite ist bei dem 129 Xe-NMR-Signal um 203 ppm zu beobachten, das von Xenonatomen adsorbiert in porösen Bereichen der Primärpartikeloberfläche hervorgerufen wird. Der mittlere Radius dieser Seitentaschen beträgt nur 0,83 nm, wodurch die adsorbierten Xenonatome einer starken Wechselwirkung mit den Adsorbentatomen unterliegen und die damit verbundenen Anisotropieeffekte zu der Linienverbreiterung führen. Die sinkende Austauschrate mit zunehmendem Xenondruck kann direkt über Diffusionsmessungen mit Hilfe der PFG-NMR-Spektroskopie beobachtet werden, wobei der Xe-Diffusionskoeffizient bei Black Pearls 2000 mit dem Druck abnimmt und über 18 bar einen Grenzwert erreicht, der einer konstanten Austauschrate zugeordnet werden kann. Die Xe-Diffusionskoeffizienten bei verschiedenen Carbon Blacks liegen für kurze Diffusionszeiten (10-50 ms) zwischen 28·10-9 und 5,56·10-9 m2/s und nehmen mit dem 148 Kapitel 7 mittleren Porenradius ab. Die intraporösen Xenonatome erfahren dabei durch Kollisionen mit den Porenwänden ein starke Hinderung ihrer Diffusionsbewegung, die zu einer Abnahme des Diffusionskoeffizienten mit der Diffusionszeit führt. Bei den kleinen Porenradien von Black Pearls 2000 wird bei ∆ = 200 ms ein unterer Grenzwert von 3,26·10-9 m2/s erreicht, der trotz hoher Dichte der Diffusion im gasförmigen Zustand entspricht. Die transversale Relaxationszeit T2 der intraporösen Xenonspins ist unabhängig von der Porenstruktur und beträgt 19,5 ms bei 1,4 bar. Die zunehmenden Wechselwirkungen mit den Atomen der Adsorbentoberfläche mit steigendem Druck führt zu einer Abnahme in T2 auf 1,2 ms (20,6 bar). Bei den temperaturabhängigen 129 Xe-NMR-Messungen unterliegen die intraporösen Xenonatome, aufgrund der sinkenden kinetischen Energie mit abnehmender Temperatur, verstärkten Wechselwirkungen mit den Adsorbentatomen, so dass ihre chemische Verschiebung zunimmt, aufgrund der stattfindenden Austauschprozesse aber weiterhin auf einen mittleren Porenradius bezogen werden kann. Das 129 Xe-NMR-Spektrum von Graphit zeigt aufgrund seiner nichtporösen Struktur keine Signalaufspaltung zu tieferem Feld, sondern nur eine Überlagerung von drei Resonanzsignalen, das jeweils dem freien Xenon und den adsorbierten Xenon auf einer Graphitebene bzw. auf den Defektstellen zugeordnet werden kann. Das Adsorptionsverhalten der Carbon Blacks kann bei Printex XE2 und Black Pearls 2000 mit der Porenfülltheorie nach Dubinin beschrieben werden. Hier zeigt sich eine gute Angleichung der Isothermen an die experimentellen Ergebnisse, wobei das Erreichen des maximalen Füllgrades mit dem Grenzwert der chemischen Verschiebung übereinstimmt. Die Adsorptionsenergie der Poren in Carbon Black lässt sich mit Hilfe des LennardJones-Potentials für Mikroporen beschreiben. Vulcan PF zeigt aufgrund seiner großporigen Struktur eher ein Adsorptionsverhalten nach Brunnauer, Emmet und Teller (BET), und zeichnet sich durch eine Adsorbatmenge aus die, über die Monolayerbelegung hinaus geht. Bei Mikroporösen Carbon Blacks ist hingegen die Verwendung der BET-Isothermen zur Bestimmung der spezifischen Oberfläche in Frage zu stellen, da durch den Effekt des Porenfüllens eine höhere Oberfläche bestimmt wird, als tatsächlich vorhanden ist. 149 Kapitel 8 Experimenteller Teil 8.1 Präparation der Xenon/Carbon Black – Proben Die Präparation der Xenon/Carbon Black Proben wurde in folgender Weise durchgeführt: Ein Glasröhrchen mit 10 mm Durchmesser und einer Wandstärke von 1,5 mm wurde mit Carbon Black auf ca. 2 cm aufgefüllt (100 - 300 mg Carbon Black), von Hand festgedrückt und mit Glaswolle fixiert (Abbildung 8.1-1). Die Fixierung ist notwendig, da insbesondere bei den PFG-NMR-Experimenten während des Ein- und Ausschaltens der magnetischen Feldgradienten, hohe mechanische Kräfte auftreten können, die zu einer Erschütterung der Probe führen und sowohl die Rußpartikel als auch die Xenonatome innerhalb des Probenraumes partiell verschieben können. Diese zusätzliche Ortsveränderung der Partikel simuliert eine schnellere Diffusion und führt zu größeren Diffusionskoeffizienten. Der Fehler ist dabei umso größer, je kleiner die Diffusionszeit ∆ gewählt wird. Abbildung 8.1-1 Vakuum-Apparatur zur Herstellung der Xenongas-Proben 150 Kapitel 8 Nach dem Befüllen der Probe mit Carbon Black wurde das Glasröhrchen in einer Höhe von ca. 3 cm mit einem Gasbrenner verjüngt, so dass sich das spätere Abschmelzen der Probe vereinfachte. Anschließend wurde das so vorbereitete Probenröhrchen an einer Hochvakuumapparatur (HV-Apparatur) angeschlossen, evakuiert und etwa zwei Stunden bei 180 - 200°C und einem Druck von 2 - 4⋅10-7 bar bis zur Gewichtskonstanz getrocknet. Das Gesamtgewicht nahm dabei jeweils um 1 – 3 % ab. In das evakuierte System wurde schließlich das Xenongas über einen Druckmesser kontrolliert eingeleitet und mit flüssigem Stickstoff ausgefroren. Während sich der untere Teil des Glasröhrchens samt Probe noch in flüssigem Stickstoff befand, wurde mit dem Gasbrenner das Probenröhrchen an der bereits verjüngten Stelle abgeschmolzen und langsam auf Raumtemperatur erwärmt. Abschließendes Wiegen der Probe ermöglicht die genaue Bestimmung der zugefügten Menge Xenon. Der genaue Xenongleichgewichtsdruck im Probenraum konnte schließlich über die chemische Verschiebung des 129 Xe- NMR-Signals des freien Xenons bestimmt werden (s. Gleichung 5.1-1). Bei den Carbon Black Proben mit mehr als 8 bar Xenondruck wurde handelsübliches Xenon mit einem natürlichen Isotopenanteil von 26,6 % an 129 Xenon verwendet. Mit sinkendem Xenondruck bzw. –dichte nahm das Signal/Rausch (S/N)-Verhältnis und somit die Messzeit unverhältnismäßig stark zu, so dass insbesondere bei Drücken unter 3 bar die Verwendung von angereichertem Xenongas mit über 87 % 129 Xenon (s. Tabelle 8.1-1) zu einer Verkürzung der Messzeit und einem verbesserten S/N-Verhältnis beitrug. Die Gesamtlänge der Probenröhrchen von nicht mehr als 3 cm gewährleistete, dass sich die Probe während des NMR-Experiments komplett im NMR-Probenraum befand und eine quantitative Auswertung der 129Xe-NMR-Spektren möglich war. Tab. 8.1-1 Verwendetes Xenongas Gas Anteil 129Xe Hersteller Xenon 4.0 26,4 % Messer Griesheim GmbH (Deutschland) Xenon, angereichert > 87 % Chemgas, Boulogne (Frankreich) 151 Experimenteller Teil 8.2 Verwendete NMR-Spektrometer 129 Die Xe-NMR Experimente wurden mit einem Bruker CXP 200 sowie mit einem Bruker MSL 200 der Firma Bruker Messtechnik GmbH durchgeführt. Die Feldstärke betrugt jeweils 4,69 Teslar, was einer Protonenfrequenz von 200 MHz entspricht. Die 129 Xenon- NMR-Frequenz bei dieser Feldstärke beträgt 55,34 MHz. 8.3 8.3.1 Bei 129 Xe-NMR-Messungen mit magnetischen Feldgradienten 129 dem Xe-NMR-Messkopf mit Quadrupol-Feldgradientenspule verwendeten Probenkopf handelte es sich um einen modifizierten 1 Protonenmesskopf Bruker HP 300 H-Sol5, der mit einer im Arbeitskreis entwickelten Quadrupol-Feldgradientenspule und einer neuen Sende-Empfangsspule ausgestattet wurde. Der Aufbau des Spulensystems ist in Abbildung 8.4-1 schematisch dargestellt. Ein massiver Teflon-Zylinder mit einem Durchmesser und einer Länge von jeweils 30 mm. Wurde in der Mitte mit einer 12 mm Bohrung sowie vier dazu konzentrisch angeordnete 2 mm Bohrungen versehen. In der mittleren Bohrung befand sich die RadiofrequenzSpule (RF-Spule), die aus einem 1 mm starken versilberten Kupferdraht bestand. Die Anzahl und der Abstand der Windungen der Spule wurde so gewählt, dass sie in einem Frequenzbereich von 30 bis 58 MHz einsetzbar war und sowohl 2H-NMR- als auch 129 Xe- NMR-Messungen durchgeführt werden konnten (Tabelle 8.3-1). Der innere Spulenraum hatte einen Durchmesser von 10 mm und diente als Probenraum. Tab. 8.3-1 Eigenschaften der in dieser Arbeit relevanten Kerne und Vergleich mit Protonen. KernIsotop Spin I Gyromagnetisches Verhältnis γ /107radT-1s-1 26,752 Resonanzfrequenz bei 4,69 Teslar /MHz 200,14 1 ½ 2 1 4,107 30,702 ½ 7 55,322 H H 129 Xe 7,4·10 152 Kapitel 8 Für die Quadrupol-Spule wurde ein lackierter Kupferdraht mit einer Stärke von 0,55 mm, 27 Mal durch die axialen Bohrungen gewickelt (s. Abbildung 8.3-1) und mit Epoxid-Harz versiegelt. Dadurch wurde der Kupferdraht immobilisiert und es war gewährleistet , dass die magnetischen Feldgradient während einer Messung konstant blieben. Der Verlauf der magnetischen Feldlinien, die von einer solchen Quadrupol-Spule erzeugt werden, ist in Abbildung 8.3-2 und Abbildung 8.3-3 schematisch wiedergegeben. B0 RF-Spule Quadrupol-Spule Abb. 8.3-1 Schematische Darstellung des Teflon-Zylinders mit RF- und Quadrupol-Spule. z B0 - + y + - RF-Spule und Probenraum Quadrupol-Spule Abb. 8.3-2 Seitenansicht des Teflon-Zylinders mit RF- und Quadrupol-Spule. Der Verlauf der von der Quadrupol-Spule erzeugten Feldlinien ist schematischen angedeutet. 153 Experimenteller Teil B0 x 0 Abb. 8.3-3 Schematische Darstellung eines durch eine Quadrupol-Spule erzeugten linearen, magnetischen Feldgradienten in x-Richtung. In Plus-x-Richtung wird das B0Feld verstärkt, in Minus-x-Richtung um den gleichen Betrag erniedrigt. 8.3.2 Die Gradienten-Einheit Zur Steuerung der Gradientenspule wurde eine modifizierte Gradienteneinheit Bruker Z 18 B der Firma Bruker Messtechnik GmbH verwendet. Die Stromversorgung erfolgte über zwei in Reihe geschaltete 12 V Bleiakkumulatoren mit je 45 Ah. Die handelsübliche Gradienten-Einheit erlaubte nur eine manuelle Einstellung der Feldgradientenstärke, d. h., Experimente mit unterschiedlichen Feldgradienten mussten nacheinander aufgenommen werden. Der Nachteil war, dass insbesondere bei langen Messungen, die bis zu drei Tagen dauern konnten, Leistungsschwankungen im Sender zu einem größeren statistischen Fehler im Ergebnis führten. Die hier vorgenommenen Veränderungen erlaubten eine elektronische Steuerung der Feldgradienten. Bis zu 16 verschiedene Widerstände konnten über Relais geschaltet werden und so den Spulenstrom steuern, der schließlich die Feldgradientenstärke bestimmte. Das Signal zur Weiterschaltung auf den nächst höheren Feldgradienten wurde dabei über den Decoupling-Kanal der CXP bzw. MSL-Konsole des Spektrometers zur Gradienten-Einheit übertragen. Somit war eine direkte Steuerung der Feldgradienten über das NMR-Pulsprogramm möglich. Der eigentliche Vorteil war aber, dass NMR-Spektren mit verschiedenen Feldgradienten parallel in einer sogenannten Block-Akquisition aufgenommen werden konnten. Dazu wurde bei einer Spektrenaufnahme nach einem Phasenzyklus von beispielsweise 16 Scans das erhaltene FID (Free Induction Decay) gespeichert und ein weiteres mit der 154 Kapitel 8 nächst höheren Feldgradientenstärke aufgenommen. Nachdem alle Gradientenstärken „abgearbeitet“ waren, wurde wieder auf den ersten Feldgradienten geschaltet und das aufgenommene FID auf das bereits im ersten Durchgang („Block“) erhaltene FID hinzuaddiert. So konnten mehrer Blöcke durchlaufen und Leistungsschwankungen des Senders und andere Störungen ausgemittelt werden. Die Gesamtzahl der Scans für ein Spektrum ergab sich schließlich aus dem Produkt der Anzahl der Scans pro Phasenzyklus und der Anzahl der Blöcke. 8.3.3 Kalibration der Feldgradientenspule Die genauen Feldstärken der selbstgebauten Quadrupol-Spule in Abhängigkeit vom Spulenstrom wurden folgendermaßen bestimmt. Zunächst wurden die zwölf Widerstände mit Hilfe eines Oszilloskops so eingestellt, dass der gesamte Leistungsbereich der Spule abgedeckt wurde, d. h. der erste Gradient wurde auf einen relativ kleinen und der letzte Gradient auf den maximalen Wert eingestellt. Die genaue Kalibration erfolgte über Diffusionsmessungen einer Lösung mit bekanntem Diffusionskoeffizienten, nach dem im Kapitel 4.2 beschriebenen Stimulated-EchoVerfahren. Dazu wurde D2O (Merck, Reinheit >99,9%) mit einem Diffusionskoeffizienten von D(D2O,25°C)=1,87·10-9 m2/g verwendet.[124] Für jeden Gradienten wurden acht Messungen mit unterschiedlichen Gradientenpulslängen δG (0,1 – 1,0 s) und Diffusionszeiten ∆ (50 – 800 ms) durchgeführt und das Ergebnis gemittelt. Die Abweichungen betrugen jeweils 3 – 5 %. Als Referenz dient ein Spektrum, das mit der gleichen Pulssequenz, aber ohne magnetischem Feldgradienten (G = 0) aufgenommen wurde. Die Bestimmung der jeweiligen Gradientenfeldstärke G erfolgte über Gleichung 8.3-1. G= Das Ergebnis der gemittelten ln(I (G ) / I (0)) − γ 2δ G2 D∆ Feldgradientenstärken (8.3-1) ist in Tabelle 8.3-2 zusammengefasst. Zur Überprüfung der Gradientenleistung bei der Resonanzfrequenz des Xenons wurde eine Standardprobe mit einem Innendruck von 12 bar vermessen, deren Xenon-Diffusionskoeffizient bereits bekannt war (D(Xe,12 bar)=7,24·10-7 m2/g).[117] 155 Experimenteller Teil Tab. 8.3-2 Gradient Nr. Feldstärke /T·m-1 8.4 129 Magnetische Feldgradientstärken im PFG-NMR-Experiment. 1 2 3 4 5 6 7 8 9 10 11 12 1,25 1,35 1,66 1,99 2,36 2,50 2,80 3,21 3,47 3,92 4,14 4,61 Xe-NMR-Pulsprogramme 8.4.1 Ein-Puls-Experiment Die Aufnahme der 129 Xe-NMR-Spektren, die zur quantitativen Auswertung der Signale verwendet wurden, erfolgte über ein einfaches Ein-Puls-Experiment (Anregungspuls – Wartezeit – Akquisition – Relaxationszeit). Die Relaxationszeiten im 129 Xe-NMR- Experiment war relativ lang und konnte bis zu 10 Minuten betragen (5⋅T1). Daher wurde aus zeitlichen Gründen, entgegen dem üblichen 90°-Puls, ein 30°-Puls verwendet, der bei ausreichender Signalintensität die Relaxationszeit auf 30 s reduzierte. Vorexperimente haben gezeigt, dass bei einem 30°-Anregungspuls die Signalintensitäten nach einer Relaxationszeit von 30 s konstant blieben. Die Anzahl der akkumulierten Spektren hing von der 129 Xenon-Konzentration in der Probe ab und konnte zwischen 32 und 2000 Scans betragen. Die genauen Pulslängen und Zeiten sind der Tabelle 8.4-1 zu entnehmen. Tab. 8.4-1 129 Xe-NMR-Parametereinstellungen im Ein-Puls- Experiment Parameter Wert 90°-Puls 11 – 15 µs 30°-Puls 4 – 5 µs Akquisitionszeit 60 - 100 ms Relaxationszeit 30 s TD 4096 NS 32 - 2000 156 Kapitel 8 8.4.2 Inversion-Recovery-Experiment zur T1-Bestimmung Die Spin-Gitter-Relaxationszeit T1 wurde mit Hilfe des Inversion-Recovery-(IR)Experiments bestimmt.[52] Die Pulsfolge ist schematisch in Abbildung 8.4-1 wiedergegeben. Nach einem 180°-Puls und einer variablen Wartezeit τ (100 µs – 600 s) folgt ein 90°-Puls (12 - 15 µs) und anschließend die Akquisition. Die Relaxationszeit betrug 5·T1 (maximal 10 min für das freie Xenon). Die Auswertung erfolgt über die integrierte Form der Blochschen Gleichung:[52] τ M (τ ) = M 0 1 − 2 exp − T1 (8.4-1) 90° 180° τ Relaxation Abb. 8.4-1 Pulsfolge im Inversion-Recovery-Experiment. 8.4.3 CPMG-Experiment zur T2-Bestimmung Die Spin-Spin-Relaxationszeit T2 des intraporösen Xenons wurde mit Hilfe der Pulssequenz nach Carr, Purcell, Meiboom und Gill (CPMG) ermittelt (Abbildung 8.4-2).[115] Die Zeit τ zwischen den 180°-Pulsen wurde konstant gehalten und betrug 50 bzw. 100 µs. Die Anzahl der Loops l wurde variiert, wobei das Produkt aus l und τ der variierten Relaxationszeit Zeit t entsprach. Um inhomogene Pulslängen auszumitteln wurde nach jeder geraden Anzahl an Loops (2-20) die Signalintensität des Echos gemessen. T2 wurde schließlich aus der integrierten Form der Blochschen Gleichung ermittelt.[49] t M (t ) = M 0 exp − T2 (8.4-2) 157 Experimenteller Teil τ τ τ 1. Echo FID 180° 180° 180° 90° τ τ 2. Echo τ 3. Echo Pulsfolge im CPMG-Experiment und Echointensität des NMR-Signals. Abb. 8.4-2 8.4.4 PFG-NMR-Experiment Die Bestimmung des Xenon-Diffusionskoeffizienten erfolgte mit Hilfe der PFG-NMRSpektroskopie. Dazu wurde die Stimulated-Echo-Pulssequenz verwendet, die bereits im Kapitel 4.2 ausführlich erläutert wurde. Die verwendeten Pulslängen und Delay-Zeiten sind in Tabelle 8.4-2 aufgelistet. Nach dem ersten 90°-Puls erfolgte mit 0,4 ms Verzögerung der erste Gradientenpuls der Länge δG. Der zweite 90°-Puls wurde 5 – 8 ms (Zeit τ) nach dem ersten geschaltet. Nach einer Diffusionszeit ∆ erfolgte der dritte 90°Puls und wieder mit einer Verzögerung von 0,4 ms der zweite Gradientenpuls mit gleicher Länge, Orientierung und Intensität, wie die des ersten. Die Akquisition begann schließlich nach der Wartezeit τ. Die Relaxationszeit betrug für das Xenon in den Poren 3 – 15 s und für das freie Xenon 100 s. Tab. 8.4-2 Verwendete Parametereinstellung bei der Stimulated-Echo-Pulssequenz Parameter Wert Beschreibung 90°-Puls 11 – 15 µs δG 0,1 – 1,2 ms τ 5 – 8 ms ∆ 6 – 200 ms Diffusionszeit Akquisitionszeit 60 – 100 ms Zeit-Domäne des FID Relaxationszeit 10 – 100 s 90°-Puls für 129Xe Gradientenpulslänge Wartezeit zwischen zwei 90°-Pulsen Relaxationszeit 158 Literatur [1] Donnet, J.-B. ; Bansal, R. C. ; Wang, M.-J.: Carbon Black – Science and Technology, 2nd Ed., Marcel Dekker, New York – Basel – Hong Kong 1993 [2] Bansal, R. C.; Donnet, J.-B.; Stoeckli, F. Active Carbons, Marcel Dekker, New York and Basel 1988 [3] Degussa: Schriftenreihe Pigmente, Nr. 47 [4] Hollemann, A. F.; Wieberg, N.: Lehrbuch der Anorganischen Chemie, 91.-100. Auflage, Walter de Gruyter, Berlin – New York 1985 [5] Ruland, W. in Walker, P.: Chemistry and Physics of Carbon, vol. 4, Marcel Dekker, New York 1968 [6] Göritz, R. Carbon Black Conference Mulhouse 2000, S. 43 [7] Degussa: Pigment Blacks (Technical data) [8] Donnet, J. B.; Custodero, E. Carbon 1992, 30, 5, 813-817 [9] Patrick, J. W. Porosity in Carbons: Characterization and Applications, Edward Arnold, London 1995 [10] Palmer, H. B.; Cullis, C. F. Chem. Phys. Carbon, Marcel Dekker, New York 1965 [11] Hirschler, M. M. J. Fire Sci. 1985, 3, 380-384 [12] Vohler, O.; von Sturm, F.; Wege, E.; von Kienle, H.; Voll, M.; Kleinschmidt, P. Ullmann´s Encyclopedia of Industrial Chemistry 1986, Vol. A5, 95-163 [13] Cabot: Ruße für Spezialanwendungen, Produktübersicht Europa 1996, S. 136 [14] Cabot Technical Report: Carbon Black Selections for Plastics [15] Herd, C. R.; McDonald, G. C.; Hess, W. M. Rubber Chem. Technol. 1991, 65, 1 [16] ASTM D 3765, Annual Book of ASTM Standards 1990, Vol. 9.01, 614 ff. [17] Gregg, S. J.; Sing; K. S. W. Adsorption, Surface Area and Porosity, 2nd Edition, Academic Press Inc. 1991 [18] Bruch, L.W.; Cole, M.W.; Zaremba, E. Intern. Series of Monographs on Chemistry, Vol. 33: “Physical Adsorprtion: Forces and Phenomena”, Oxford Science Publications, Clarendon Press – Oxford 1997 [19] Everett, D. H.; Powl, J. C. J. Chem. Soc. Faraday Trans. I 1976, 72, 619-636 Literatur 159 [20] Ripmeester, J. A.; Ratcliffe, C. I. J. Phys. Chem. 1990, 94, 7652-7656 [21] Vidali, G. Surf. Sci. Rep. 1991, 12, 133-181 [22] Crowell, A. D.; Chang, C. O. J. Chem. Phys. 1963, 38, 2584 [23] Rybolt, T. R.; Pierotti, R. A. J. Chem. Phys. 1979, 70, 9, 4413-4419 [24] Klein, M. L.; O´Shea, S.; Osaki, Y. J. Phys. Chem. 1984, 88, 1420-1425 [25] Hobza, P.; Bludský, O. J. Chem. Phys. 1992, 97, 1, 335-340 [26] Rudzinski, W.; Everett, D. H.: Adsorption of Gases on Heterogeneous Surfaces, Acedemic Press, London – San Diego 1992 [27] Langmuir, I. J. Am. Chem. Soc. 1916, 38, 2221 [28] Atkins, P. W.: Physikalische Chemie, VCH Weinheim 1990 [29] Dubinin, M. M. Chem. Phys. Carbon 1966, 2, 51-120 [30] Dubinin, M. M. Carbon 1985, 23, 373-380 [31] Dubinin, M. M. Progr. Surf. Membr. Sci. 1975, 9, 1-70 [32] Dubinin, M. M. Russ. J. Phys. Chem. 1965, 39, 697-704 [33] Dubinin, M. M. Sitzungsberichte der Deutschen Akademie der Wissenschaften zu Berlin 1966, 1, 1-25 [34] Dubinin, M. M.; Stoeckli, H. F. J. Coll. Interf. Sci. 1980, 75,1, 35-43 [35] Bronštein, I. N.; Semendjaev, K. A.; Musiol, G.; Mühlig, H. Taschenbuch der Mathematik, 3. Auflage, Verlag Harri Deutsch, Frankfurt a. M. – Thun 1997 [36] Finger, G.; Bülow, M. Carbon 1979, 17, 87 [37] Kraehenbuehl, F.; Stoeckli, H. F.; Addoun, A.; Ehrburger, P.; Donnet, J. P. Carbon 1986, 24, 483 [38] Barrer, R. M.; Lee, J. A. Surface Sci. 1968, 12, 341 [39] Hugy-Cleary, D.; Stoeckli, F. Carbon 2000, 38, 1309-1313 [40] Darmstadt, H.; Roy, C. Carbon 2001, 39, 841-848 [41] Gómez-Serrano, V.; González-Garciá, C. M.; González-Martín, M. L. Powder Techn. 2001, 116, 103-108 [42] Stoeckli, H. F.; Huguenin, S.; Laederach, A. Carbon 1994, 32, 7, 1359-1362 [43] Stoeckli, F.; Guillot, A.; Hugi-Cleary, D.; Slasi, A. M. Carbon 2000, 38, 929-941 [44] Dubinin, M. M.; Kadlec, O. Carbon 1975, 13, 263-265 [45] Polyakov, N. S.; Dubinin, M. M.; Kataeva, L. I.; Pethuova, G. A. Pure & Appl. Chem. 1993, 65, 10, 2189-2192 160 Literatur Chem. 1993, 65, 10, 2189-2192 [46] Kruk, M.; Jaroniec, M. Langmuir 1999, 15, 1442-1448 [47] Kruk, M.; Zuojiang, L.; Jaroniec, M.; Betz, W. R. Langmuir 1999, 15, 1435-1441 [48] Turner, A. R.; Quirke, N. Carbon 1998, 36, 10, 1439-1446 [49] Kärger, J. M.; Ruthven, D. M.: Diffusion in Zeolithes and other Microporous Solids, John Wiley & Sons, New York 1992 [50] Mitra, P. P.; Sen, P. N.; Schwartz, L. M.; Le Doussal, P. Phys. Rev. Lett. 1992, 68, 24, 3555-3558 [51] Latour, L. L.; Mitra, P. P.; Kleinberg, R. L.; Sotak, C. H. J. Magn. Res. Series A 1993, 101, 342-346 [52] Friebolin, H.: Ein- und Zweidimensionale NMR-Spektroskopie – Eine Einführung, VCH-Weinheim, 3. Auflage 1999 [53] Goldman, M.: Quantum Description of High Resolution NMR in Liquids, The international series of monographs on chemistry vol. 15, Clarendon Press, Oxford 1992 [54] Abragam, A.: The Principles of Nuclear Magnetism, Clarendon Press, Oxford [u.a.], 1986 [55] Canet, D.: Nuclear Magnetic Resonance – Concepts and Methods, John Wiley & Sons 1996 [56] Ernst, R. R.; Bodenhausen, G.; Wokaun, A.: Principles of nuclear magnetic resonance in one and two dimensions, The international series of monographs on chemistry vol. 14, 2. Auflage, Clarendon Press, Oxford 1987 [57] Mehring, M.: High Resolution NMR Spektroskopy in Solids aus NMR – Basic Principles and Progress, Springer-Verlag, Berlin – Heidelberg – New York 1976 [58] Slichter, C. P.: Principles Oberfläche Magnetic Resonance, Springer Series in Solid-State Science 1, Springer Verlag, Berlin – Heidelberg – New York 1980 [59] Freeman, R.: A Handbook of Nuclear Magnetic Resonance, Longman Scientific & Technical, Essex England 1988 [60] van Zijl, P. C. M.; Moonen, C. T. W. J. Magn. Res. 1990, 87, 18-25 [61] Hurd, R. E. J. Magn. Res. 1990, 87, 422-428 [62] Hurd, R. E.: Encyclopedia of Nuclear Magnetic Resonance, New York 1996, 1990-2005 [63] Callaghan, P. T.: Principles of Nuclear Magnetic Resonance Microscopy, Clarendon Press, Oxford 1993 [64] Callaghan, P. T. Magn. Res. Imaging 1996, 14, 7/8, 701-709 Literatur 161 [65] Stejskal, E. O.; Tanner, J. E. J. Chem. Phys. 1964, 42, 1, 288-292 [66] Kärger, J.; Pfeiffer, H.; Heink, W. Adv. Magn. Res. 1988, 12, 1 [67] Price, W. Pulse-Field Gradient Nuclear Magnetic Resonance as a Tool for Studying Translational Diffusion: Part 1. – Basic Theory, Conepts Magn. Reson. 1997, 9, 299-336 [68] Callaghan, P.T.; Coy, A.; Halpin, T. P. J.; MacGowan, D.; Packer, K. J.; Zelaya, F. O. J. Chem. Phys. 1992, 97, 1, 651-662 [69] Callaghan, P.T.; Coy, A.; MacGowan, D.; Packer, K. J.; Zelaya, F. O. Nature 1991, 351, 467-469 [70] Raftery, D.; Chmelka, B. F. NMR Basic Principles and Progress 1994, 30, 111158 [71] Springuel-Huet, M.-A.; Sun, K. ; Fraissard, J. Mircopor. Mesopor. Mat. 1999, 33, 89-95 [72] Berger, S.; Braun, S.; Kalinowski, H.-O.: NMR-Spektroskopie von Nichtmetallen (Band 1)– Grundlagen 17O-, 33S- und 129Xe-NMR-Spektroskopie, Thieme Stuttgart (u. a.) 1992, 135-144 [73] Hunt, E. R.; Carr, H. Y. Phys. Rev. 1963, 130, 6, 2302-2305 [74] Jameson, A. K. ; Jameson, C. J. ; Gutowsky, H. S. J. Chem. Phys. 1970, 53, 6, 2310-2321 [75] Brinkmann, D.; Carr, H. Y. Phys. Rev. 1966, 150, 1, 174-179 [76] Kanegsberg, E.; Pass, B.; Carr, H. Y. Phys. Rev. Lett. 1969, 23, 11, 572-574 [77] Torrey, H. C. Phys. Rev. 1963, 130, 6, 2306-2312 [78] Jameson, C.J; Jameson, A. K.; Cohen, S. M. J. Chem. Phys. 1973, 59, 4540 [79] Adrian, F. J.: Phys. Rev. 1965, 136, A 980 [80] Yen, W. M.; Norberg, R. E. Phys. Rev. 1963, 131, 269 [81] Streever, R. L.; Carr, H. Y. Phys. Rev. 1961, 121, 1, 20-25 [82] Bartlett, N. Proc. Chem. Soc. 1962, 218 [83] Seppelt, V.K.; Rupp, H. H. Zeitschr. Anorg. Allg. Chemie 1974, 409, 331 [84] Naumann, D.; Tyrra, W. J. Chem Soc. Chem. Comm. 1989, 47 [85] Turowsky, L.; Seppelt, K. Inorg. Chem. 1990, 29, 3226 [86] Stengle, T. R.; Williamson, K. L. Macromolecules 1987, 20, 1428-1431 [87] Ito, T.; Fraissard, J. J. Chem. Phys. 1982, 76, 11, 5225-5229 [88] Fraissard, J.; Ito, T. Zeolithes 1987, 7, 554 162 Literatur [89] Fraissard, J; Gedeon, A; Bonardet, J. L.; Ito, T. J. Phys. Chem. 1989, 93, 2563 [90] Demarquay, J.; Fraissard, J. Chem. Phys. Lett. 1987, 136, 3-4, 314-318 [91] Chmelka, B. F; Raftery, D.; McCormick, A. V.; de Menorval, L. C.; Levine, R. D.; Pines, A. Phys. Rev. Lett. 1991, 66, 5, 580-583 [92] Ripmeester, J. A.; Ratcliffe, C. I. Anal. Chim. Acta 1993, 283, 1103-1112 [93] Cheung, T. T. P. J. Phys. Chem. 1990, 94, 376-380 [94] Ripmeester, J. A. ; Ratcliffe, C. I.; Tse, J. S. J. Chem Soc. Faraday Trans. 1 1988, 84, 11, 3731-3745 [95] Ripmeester, J. A. J. Am. Chem. Soc. 1982, 104, 289-290 [96] Handa, Y. P.; Ratcliffe, C. I.; Ripmeester, J. A. J. Phys. Chem. 1990, 94, 4363 [97] Junker, F.; Veemann, W. S Macromolecules 1998, 31, 7010-7013 [98] Kentgens, A. P. M.; van Boxtel, H. A.; Verweel, R.-J.; Veeman, W. S. Macromolecules 1991, 24, 12, 3712-3712 [99] Mansfeld, M.; Veeman, W. S. Chem. Phys. Lett. 1993, 213, 1-2, 153-157 [100] Sperling-Ischinsky, K.:129Xe-NMR-spektroskopische Untersuchungen an ungefüllten und gefüllten Polymeren“, Dissertation, Gerhard-Mercator-Universität Duisburg 1998 [101] Shibanuma, T.; Asada, H.; Ishi, S.-I.; Matsui, T. Jap. J. Appl. Phys. 1983, 22, 11, 1656-1658 [102] Neue, G. Zeitschrift für Physikalische Chemie Neue Folge 1987, Bd. 152, 13-22 [103] Suh, R.; Park, T.-J.; Ihm, S.-K.; Ryoo, D. J. J. Phys. Chem. 1991, 95, 3767-3771 [104] Derouane, E. G.; Nagy, J. B. Chem. Phys. Lett. 1987, 137, 4, 341-344 [105] Derouane, E. G. ; Andre, J. M. ; Lucas, A. A. Chem. Phys. Lett. 1987, 137, 4, 336 [106] Cheung, T. T. P.; Fu, C. M.; Wharry, S. J. Phys. Chem. 1988, 92, 5170-5180 [107] Magusin, P. C. M. M.; Bolz, A.; Sperling, K.; Veeman, W. S. Geoderma 1997, 80, 449-462 [108] Meares, P. J. Am. Chem. Soc. 1954, 76, 3415 [109] Michaels, A. S. ; Vieth, W. R. ; Barrie, J. A. J. Appl. Phys. 1963, 34, 1 [110] Tsujiata, Y.; Hachisuka, H.; Imai, T.; Takizawa, A.; Kinoshita, T. J. Membr. Sci. 1991, 60, 103-111 [111] Merkel, T. C., Bondar, V., Nagai, K., Freeman, B. D. Makromolecules 1999, 32, 370-374 [112] Suzuki, T.; Miyauchi, M.; Takekawa, M.; Yoshimizu H.; Tsujiati, Y. Kinoshita, T. Polym. J. 2001, 33, 12, 934 Literatur 163 Polym. J. 2001, 33, 12, 934 [113] Landolt-Börnstein, Magnetische Eigenschaften II, Band 2, Teil 10, Springer Verlag, Berlin 1967 [114] Demtröder, W: Experimentalphysik 2, Springer Verlag, Berlin 1995 [115] Meiboom, S.; Gill, D. Rev. Sci. Instrum. 1958, 29, 688 [116] Mair, R. W.; Cory, D. G.; Peled, S. ; Tseng, C.-H.; Patz, S; Walsworth, R. L. J. Magn. Res. 1998, 135, 478-486 [117] Junker, F.: Materialforschung an porösen Festkörpern mittels Diffusionsmessungen – Eine 129Xe-PFG-NMR-Studie, Dissertation, Gerhard-MercatorUniversität Duisburg 2000 [118] McGrath, K. J. Carbon 1999, 37, 1443-1448 [119] Simonov, P. A.; Filimonova, S. V.; Kryokova, G. N.; Moroz, E. M.; Likholobov, V. A.; Kuretzky, T.; Boehm, H. P. Carbon 1999, 37, 591-600 [120] Connor, W.; Weist, E.; Ito, T.; Fraissard, J. J. Phys. Chem. 1989, 93, 4138 [121] Peña, J. M.; Allen, N. S.; Edge, M.; Liauw, C. M.; Hoon, S. R.; Valange, B.; Cherry, R. I. Polym. Degr. Stabil. 2001, 71, 153-170 [122] Fraissard, J.; Ito, T. Zeolithes 1988, 8, 350-361 [123] Terskikh, V. V.; Mudrakovskii, I. L.; Mastikhin, M. J. Chem. Soc. Faraday Trans. 1993, 89, 23, 4239-4243 [124] Johnson, D. W.; Griffith, L. Zeolithes 1987, 7, 484 [125] Bruker Almanac 1995, Bruker Meßtechnik GmbH 164 165 Anhang A.1 Eigenschaften und Hersteller der verwendeten Carbon Blacks ........... 166 A.2 Ergebnisse der Xenon-Diffusion .............................................................. 167 A.3 Ergebnisse der Xenon-Adsorption ........................................................... 168 A.4 Begriffe und Abkürzungen ........................................................................ 169 166 A.1 Anhang Eigenschaften und Hersteller der verwendeten Carbon Blacks Tab. A.1-1 Spezifische Eigenschaften der Carbon Blacks (aus Produktdatenblätter der Hersteller [6-8,13,14])n Carbon Blacks Abk. σS /m2·g-1 PG /nm G N5 N3 <1 30 83 >1000 40-48 26-30 ρSD /g·dm-3 Pulver / Perlen - / 345 - / 370 VPF 140 19 VP 140 Corax L Vulcan XC-72R Corax L6 Monarch 1300 Ensaco 23 CL VXC CL6 M13 E23 Ensaco 350 7 7 CGehalt /% 99,0 99,0 Spez. Kapazität /F·g-1 - 116 8,5 99,0 - / 330 118 8,5 23 30 18 13 - 200 / 100 / 120 / 260 / - 114 185 120 100 - 804 - - KB 950 - PX2 1000 CON DBP /cm ·(100g)-1 pHWert 121 102 190 / - 19 150 254 265 560 640 E35 Ketjenblack Printex XE2 Carbon Black Graphit N 550 N 330 Vulcan PF Vulcan P Conductex 40220 Ensaco 52 Black Pearls 2000 Hersteller Typ Degussa Degussa Graphit Furnace-Ruß Furnace-Ruß - Cabot Furnace-Ruß 99,0 - Cabot Furnace-Ruß 9,5 5,0 9,5 7,0 - 98,5 98,5 98,5 98,0 - 22 43 99 80 Degussa Cabot Degussa Cabot MMM Carbon Furnace-Ruß Furnace-Ruß Furnace-Ruß Furnace-Ruß - - - - 115 MMM Carbon - 110 / - 55 - - 150 AKZO - 30-35 - / 140 385 8,0 98,0 154 Degussa Gas-Ruß 1075 - - - - - 168 E52 1100 - - - - - BP 1475 12 150 / - 330 8,6 98,0 3 Verwendung/ Eigenschaften Halbaktiv-Ruß Halbaktiv-Ruß UV-Schutz Leitfähig UV-Schutz Leitfähig Leitfähig Leitfähig Leitfähig Leitfähig Leitfähig Granulat Leitfähig Besonders leitfähig - Leitfähig 175 Columbian Chemicals MMM Carbon - Leitfähig 240 Cabot Furnace-Ruß Leitfähig 167 Anhang A.2 Ergebnisse der Xenon-Diffusion Tab. A.2-1 Experimentelle Ergebnisse der PFG-NMR-Messungen an intra- und extraporösem (freiem) Xenon in Carbon Black. Probe Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 (frei) Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 Black Pearls 2000 (frei) Ketjen Black Printex XE2 (frei) Printex XE2 (frei) Vulcan PF Vulcan PF Vulcan PF (frei) Xenongas (pur) δG ∆ pXe /bar 10,9 10,9 10,9 10,9 10,9 10,9 10,9 10,9 10,9 /ms 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,4 0,4 /ms 4 10 16 30 50 100 200 4 4 1,9 3,1 5,5 7,4 8,1 17,7 17,7 12,6 23,8 23,8 14,0 20,6 20,6 21,2 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,3 0,2 50 50 50 50 50 50 50 10 10 30 10 50 50 30 D ± Fehler in D /10 m2s-1 /10-9 m2s-1 10,80 0,76 8,62 0,31 8,12 0,19 8,00 0,44 6,10 0,61 4,73 0,75 3,27 0,70 9,28 0,79 66,10 3,80 -9 10,71 10,41 8,82 9,33 6,36 5,56 18,80 10,20 22,82 21,53 28,34 17,81 17,02 25,80 0,54 0,50 0,25 0,38 0,42 0,25 4,45 0,70 1,94 0,37 0,90 3,53 1,61 1,71 <r2> /10-9m2 0,259 0,517 0,780 1,440 1,830 2,838 3,924 0,223 1,586 (<r2>)1/2 /10-6 m 16,10 22,74 27,92 37,95 42,78 53,27 62,64 14,92 39,83 3,213 3,123 2,646 2,799 1,908 1,668 5,640 0,612 1,368 3,870 1,698 5,340 5,100 4,644 56,68 55,88 51,44 52,91 43,68 40,84 75,10 24,74 36,99 62,21 41,21 73,08 71,41 68,15 168 A.3 Anhang Ergebnisse der Xenon-Adsorption Tab. A.3-1 Experimentelle Ergebnisse Vulcan PF (140 m2/g). pXe /bar 0,8 0,9 1,3 2,7 3,3 4,3 4,6 4,9 7,0 9,2 20,6 δf δp1 /ppm 0,44 0,50 0,70 1,48 1,80 2,35 2,48 2,63 3,79 5,00 10,84 Tab. A.3-2 pXe /bar 0,6 0,9 2,5 5,2 5,4 10,7 13,5 23,4 24,4 /ppm 30,6 47,3 56,5 64,9 67,8 73,1 73,5 71,2 73,4 72,8 66,3 δp2 /ppm 123,9 158,5 157,6 170,5 143,3 184,7 203,7 aM /10-3mol·g-1 0,0056 0,0061 0,0842 0,1695 0,3447 0,9107 0,8407 1,1869 0,7087 1,6809 3,0148 aS /10-6mol·m-2 0,0400 0,0436 0,6017 1,2110 2,4624 6,5051 6,0048 8,4778 6,2301 12,0065 21,5340 θ 0,004 0,004 0,061 0,122 0,249 0,657 0,606 0,856 0,511 1,212 2,174 Experimentelle Ergebnisse Printex XE2 (1000 m2/g). δf /ppm 0,30 0,50 1,33 2,79 2,92 5,83 7,29 12,65 13,17 δa /ppm 48,6 50,4 73,3 71,6 89,4 97,0 98,9 101,4 100,1 aM aS /10-3mol·g-1 /10-6mol·m-2 0,3261 0,3261 0,6532 0,6532 3,2588 3,2588 5,8787 5,8787 4,9401 4,9401 8,2813 8,2813 8,1089 8,1089 9,8301 9,8301 9,9339 9,9339 θ 0,033 0,066 0,329 0,593 0,498 0,835 0,818 0,992 1,002 Tab. A.3-3 Experimentelle Ergebnisse Black Pearls (1475 m2/g). pXe /bar 0,9 1,2 1,4 1,5 1,9 2,7 3,1 5,5 7,4 8,2 15,8 17,7 δf /ppm 0,50 0,67 0,77 0,83 1,05 1,49 1,71 3,04 4,10 4,53 8,72 9,78 δa /ppm 46,3 51,6 63,0 65,5 72,0 78,5 84,9 107,1 117,4 123,6 130,9 132,3 aM aS -1 -6 /10 mol·g /10 mol·m-2 0,4007 0,2716 3,8936 0,2640 1,2145 0,8234 1,5027 1,0188 2,0162 1,3669 2,6809 1,8176 3,3036 2,2400 6,2029 4,2053 7,9495 5,3895 9,6719 6,5572 9,2152 6,9476 11,6430 7,8936 -3 θ 0,027 0,266 0,083 0,103 0,138 0,183 0,226 0,424 0,544 0,661 0,630 0,796 Begriffe und Abkürzungen A.4 Begriffe und Abkürzungen Begriff/ Abkürzung: A Adsorbat Adsorbent Adsorptiv aM aS a0 amax α B0 BET β CSA CTAB d D, Dp, Df Deff DA DBP DS vv D δ0 δA δp δf δG ∆ ∆δ ∆ν1/2 v e E E* Ea Es Esph ESR ε η FID Φ G γ h h Ĥ Hz I v I vvJ J Erklärung: Mittlere molare Arbeit der Adsorption auf einer Oberfläche adsorbierter gasförmiger, flüssiger oder fester Stoff Feststoff, auf dem Adsorption stattfindet Stoff in der Gasphase, der adsorbiert werden kann massenspezifische Adsorbatmenge oberflächenspezifische Adsorbatmenge maximale spezifische Adsorbatmenge theoretische maximale, spezifische Adsorbatmenge Tortuosität Stärke des externen Magnetfeldes Brunnauer, Emmet und Teller Ähnlichkeitskoeffizient in der Dubinin-Theorie Chemical Shift Anisotropy Cetyltrimethyl-ammoniumbromid Durchmesser bzw. Schichtabstand Diffusionskoeffizient (des intraporösen (p), des freien (f) Xenons) effektiver Diffusionskoeffizient Dubinin - Astakhov Dibutylphthalat Dubinin - Stöckli Tensor der dipolaren Kopplung Grenzwert der Chemische Verschiebung Chemische Verschiebung des adsorbierten Xenons Chemische Verschiebung des intraporösen Xenons Chemische Verschiebung des extraporösen bzw. freien Xenons Gradientenpulslänge Diffusionszeit δp - δf Halbwertsbreite Einheitsvektor Energie Energiebetrag im Minimum der Lennard-Jones-Potentialkurve Adsorptionsenergie Energie zwischen zwei unendlich ausgedehnten Schichten Energie in einer sphärischen Pore Elektron Spin Resonance Porosität Viskosität Free Induction Decay Verhältnis von Volumen zu Oberfläche V/S Gradientenfeldstärke Gyromagnetisches Verhältnis Plancksche Konstante: 6,62618·10-34 J·s = h/(2π) Hamilton-Operator Hertz Spinquantenzahl Spin-Operator Joule Tensor der skalaren Kopplung 169 170 Begriffe und Abkürzungen KL kB kH χ L mCB µ µs µ* µr v µ N, Na, Nf NMR NS ν νs ω0 p, pXe PFG PG pk ps < r2 > r0 RG rh rm Rp, Rsph, Rzyl Rs ρCB ρSD rXe S Smolek Sgeom σDisp σs σTheoret. vv σ σII σ^ T Tk Tb T1 T2 T2* τ τc τe θ TD V, Vf, Vp VL xp, xf z Langmuir-Konstante Boltzmann-Konstante: 1,38066·10-23 J K-1 Henry-Konstante Suszeptibilität Avogadro-Konstante: 6,022·1023 mol-1 Masse Carbon Black Chemisches Potential Chemisches Standardpotential Chemisches Standardpotential unter Normbedingungen magnetische Permeabilität magnetisches Moment Anzahl der Xenonatome im adsorbierten (a) bzw. freien (f) Zustand Nuclear Magnetic Resonance Number of Scans Resonanzfrequenz Stossfrequenz Lamor-Frequenz Druck, Xe-Druck Pulsed Field Gradient mittlere Partikelgröße, Partikeldurchmesser kritischer Druck Sättigungsdampfdruck mittlere zurückgelegte freie Weglänge minimaler Abstand zwischen Adsorbat- und Adsorbentmolekül (= Summe der jeweiligen Van-der-Waals-Radien) Gaskonstante: 8,31441 J·mol-1K-1 hydrodynamischer Radius Belegungsradius des Meniskus Radius einer Pore, Radius einer sphärischen bzw. zylindrischen Pore halber Abstand zwischen zwei Schichten Dichte der Carbon Black Primärpartikel Stampfdichte Van-der-Waals-Radius des Xenons Oberfläche von einem Adsorbatmolekül belegte Adsorbentoberfläche geometrische Oberfläche Dispersionsgrad Spezifische Oberfläche aus BET-Messungen Theoretische spezifische Oberfläche Abschirmungstensor Komponente des Abschirmungstensors parallel zum Magnetfeld Komponente des Abschirmungstensors parallel zum Magnetfeld Temperatur Kritische Temperatur Siedetemperatur Spin-Gitter-Relaxationszeit Spin-Spin-Relaxationszeit Spin-Spin-Relaxationszeit bei zusätzlichen Relaxationseffekten Evolutionszeit im NMR-Experiment Korrelationszeit Austauschzeit Belegungsgrad Time Domaine Volumen, freies Volumen, Porenvolumen Mittleres molare Volumen einer Flüssigkeit Molenbruch der intra- (p) und extraporösen (f) Xenonatome Abstand des Adsorbatmoleküls von der Adsorbentoberfläche