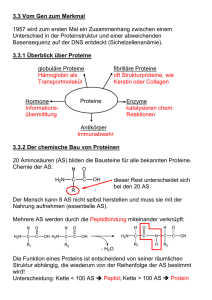
XV. Aminosäuren, Peptide Nach Terpenen und
Werbung

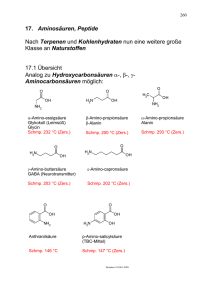
279 XV. Aminosäuren, Peptide Nach Terpenen und Kohlenhydraten nun eine weitere große Klasse an Naturstoffen 1. Übersicht Analog zu Hydroxycarbonsäuren α-, β-, γAminocarbonsäuren möglich: O O O OH H2N H3C OH NH2 NH2 α-Amino-essigsäure Glykokoll (Leimsüß) Glycin Schmp. 232 °C (Zers.) β-Amino-propionsäure β-Alanin α-Amino-propionsäure Alanin Schmp. 200 °C (Zers.) Schmp. 293 °C (Zers.) O O H2N OH H2N OH γ-Amino-buttersäure GABA (Neurotransmitter) ε-Amino-capronsäure Schmp. 203 °C (Zers.) Schmp. 202 °C (Zers.) O O OH NH2 OH OH H2N OH Anthranilsäure p-Amino-salicylsäure (TBC-Mittel) Schmp. 146 °C Schmp. 147 °C (Zers.) Grundvor / Fo18-1.CW3 280 Was ist auffällig? Anormal hoher Schmelzpunkt! Grund: H2N R COOH H3N R COO Zwitter-ion Ad18-01.CW3 In Proteinen nur α-Aminosäuren: COO H3N H R Ad18-01.CW3 chiral, L-Form ca. 20 in Proteinen Grundtypen: - Neutrale AS: R = Alkyl - Heterosubstituierte aliphatische AS Besonders wichtig Cystein - Aromatische AS R = CH2Ar - Saure AS - Basische AS 281 Neutrale Aminosäuren H2N CO 2H H2N CO 2H CH3 Glycin H2N H2N CO 2H H3C CH3 Valin * Alanin CO 2H H2N CH3 CO 2H CH3 H3C CH3 Leucin * Isoleucin * Substituierte aliphatische Aminosäuren H2N CO 2H H2N CO 2H OH H3C OH Threonin * Serin H2N H2N CO 2H CO 2H - 2H S SH + 2H S HO 2C Cystein H2N CO 2H S CH3 NH2 Cystin Methionin Grundvor / Fo18-2.CW3 * essentielle Aminosäuren 282 Saure Aminosäuren H2N H2N CO 2H CO 2H CO 2H CO 2H Asparaginsäure Glutaminsäure H2N H2N CO 2H CO 2H NH2 O H2N Asparagin O Glutamin Basische Aminosäuren H2N CO 2H H2N CO 2H NH2 NH2 Ornithin H2N Lysin CO 2H H2N CO 2H N N H NH HN NH2 Arginin * Histidin Fo18-3.CW3 283 Aromatische und heterocyclische Aminosäuren H2N CO 2H H2N CO 2H H2N CO 2H I OH OH I Phenylalanin * H2N CO 2H Tyrosin H2N CO 2H N H N H2N CO 2H I I OH O I NH N H Tryptophan * Jodgorgosäure I Histidin Thyroxin CO 2H Grundvor / Fo18-4a.CW3 Prolin Ein weiterer wichtiger Begriff - Essentielle AS: Nicht von Säugetier synthetisierbar, Aufnahme aus pflanzlicher Nahrung notwendig Val Phe Met Lys Leu Trp Thr Ile 284 Nachweis, quantitative Bestimmung - Ninhydrin Ninhydrin-Reaktion O H2N O CO 2H OH R OH - 2 H2O O - CO2 N N CO 2H O O R R O O O H2O H NH2 - 2 H2O O H N − RCHO O O R O O H O -H N N blauviolett O O O O Grundvor / Fo18-4b.CW3 - Van Slyke Gasvolumetrische Bestimmung COOH H2N H R L NaNO2 CH3COOH H2O COO N N H R H2O COOH HO H + N2 R L! Ad18-02.CW3 285 2. Synthese von Aminosäuren - Aus Halogencarbonsäuren Reaktion mit Ammoniak möglich, da die NH2-Gruppe in der Aminosäure relativ schwach nukleophil (-I von COO-) Br H3C C COOH H + NH 4 OH H2O RT NH3 − + NH 4+ Br − H3C C COO H Ala 56 % Ad18-01.CW3 - Strecker-Synthese Analog Cyanhydrin-Synthese NH2 H R C O + NH3 + HCN R C CN NH3 + H / H2O R C COO H H α-Aminonitril − H 2O H R C NH + HCN Imin Ad18-01.CW3 Beispiel: CH2 O C + NH3 + HCN H NH2 CH2 C CN H + H 3O NH3 CH2 C COO Ad18-01.CW3 H Phe 74 % 286 3. Peptide, Schutzgruppen 3.1 Übersicht Grundprinzip des Lebens anhand Prinzip der Peptidstruktur Bildung eines Peptids (schematisch) H H O N OH R H R2 H 1 R2 O N H H 3 O R4 O N OH N R3 O OH N H H N R1 R4 OH R H H N O H - 3 H2O H OH N O O H Bildung eines Peptids (schematisch) R1 H2N CO OH H HN H R2 CO OH H HN H R1 H2N CO OH H HN H R2 CONH H R3 R3 CONH H COOH H R4 COOH CONH H R4 H Grundvor / Fo18-1b.CW3 287 Beispiel Peptid: Süßstoff Aspartam OOC Ph O H3N N H COOCH3 H H Aspartam Allgemein: Synthese von Peptiden erfordert Schutzgruppen, Einfaches Beispiel: Naive Amidbildung gibt Gemisch: Ph CH3 H2N Ala Phe + Phe Phe + CO OH H H2N COOH + Phe Ala Ala Ala H Ad18-03.CW3 3.2. Derivate von Aminosäuren, Schutzgruppen Beispiel von Peptid oben, damit Synthesestrategie erkennbar. - COOH Veresterung nach Fischer und Speier COO H3N H R CH3OH HCl unreaktiv - NH2 Cbo-Derivate Base COOCH3 H2N H R reaktiv Abspaltung mit NaOH Ad18-02.CW3 288 O Reagens: CH2 OH + Cl O Base CH2 O C Cl Cl Chlorkohlensäurebenzylester Einf. HN Schutzgr. 3 COO COO NaOH H H2N R 1. − HCl 2. H H R O H2 / Pd − CO2 − CH2 O COOH N H CH2 H Cbo oder Z Ad18-03.CW3 3.3. Synthese von Peptiden Durchführung der Synthese von Ala-Phe CH3 • Aktivierung Cbo N COOH SOCl2 H H CH3 O Cbo N C Cl H H Ph H2N • Kopplung COOCH3 H Ph CH3 Cbo N CONH H H H • Entfernung Schutzgruppen Pd / H2 R und /oder Weiterbau höhere Peptide CboHN COCl H COOCH3 Ph CH3 H2N CONH H COOCH3 H NaOH Ph CH3 H3N Ad18-03b.cw2 CONH H COOH H H R 289 Hinweis Merrifield R1 Σ N H Cl CH2 COO P H R1 O Σ N H C O CH2 P H Schutzgruppe abspalten R1 O H2N C O CH2 P H R2 O H X Σ N H R2 O Σ N H H C N H Kondensation R1 O C O CH2 P H Schutzgruppe abspalten Kondensation Nat05-17.CW2 Σ = Schutzgruppe P = Polystyrol-Harz 290 Proteine: Sequenz, Raumstruktur - Primärstruktur Reihenfolge der Aminosäuren (gentisch bestimmt) H CH3 H N H3N O N H O N-Terminus H CH2SH COO H C-Terminus H Ala Phe Cys OH Org18-05.CW3 Hormon aus der Hypophyse: 5 Ser 10 Tyr Ser Met Glu His Phe Arg Trp Gly 25 Lys Pro Val 20 Ala Asp Pro Tyr Val Lys Gly Glu Asp Glu Ser 15 Val Pro Arg Arg Lys Lys Gly Ala Glu Ala Phe Pro Leu Glu Phe 30 35 39 humanes Adrenocorticotropin Org18-05.CW3 - Sekundärstruktur Konformation der Proteinkette; wichtigste Typen: α-Helix , Faltblatt R O C R O N H O N C N H H O R R R R O C C R N N H HO R O C N C R O R H O C N N H C R H O H R R H OR N H O OR H H N O O H H N H N H H R H N H N O H R H H H R H R H N R H N H N O H N H O R Org18-05.CW3 Falt.CW2 291 - Tertiärstruktur Konformation der gesamten Proteinkette; Beispiel Myoglobin - Quartärstruktur Zusammenlagerung mehrerer Ketten zu übergeordneter Struktur 292 20 Leu Asp Asn Try Arg Gly Gly Try Ser His Arg Leu Gly Asn Tyr 120 Lys Ala Gln Val Asp Thr Try Met Ala Gly S Lys Cys Arg Ala 6 S S Arg OH C O Leu Cys 129 Ala Lys Phe Glu Arg Ser Try Asn Arg 110 Ala Phe Gly H N H Ala Asn 127 Cys Glu S Arg Gly Leu 30 Cys Ileu Ala 10 Val Val Phe Lys Val Asn Try Thr 40 1 Ala 100 Ser Asp Gly Asp Gly Thr Arg Asn Lys Arg Asn Lys Ala Cys Asn S S Cys Val 80 Gly 76 Thr Gly Asn Asp Asp Cys S S Try Cys 64 Ser Ala Gly Try Ileu Leu Try Arg Ser Leu Leu 50 Ser Arg Pro Ileu Asp Thr Ileu Thr Thr Gly 70 Pro Asn Ala Asp Ser Ser Leu Ser 90 Ala Asn Val Ileu 94 Gln Asn Met Ser Asn Ileu Gln 60 Lysozym Org18_06.cw2 Beispiel für die Variationsmöglichkeiten beim Aufbau von Polypeptiden: Ein Polypeptid, aufgebaut aus 50 Aminosäureeinheiten, die 19 verschiedene Aminosäuren umfassen: 1 Art 4 Arten 10 Arten 4 Arten 10 x 4x 2x 1x 1048 Sequenzmöglichkeite Zum Vergleich: Der Durchmesser unsere Milchstraßensystems beträgt 300.000 Lichtjahre, in mm: 3·1024. 293 Cyclische Amide: Lactame H N R O Penicilline (Fleming) S N O β-Lactam => gespannt, reaktiv CO2H => reaktion mit dem Protein, das für den Aufbau H der Bakterienzellwand verantwortlich ist strukturell verwandt: O H N HO NH2 O S N O O Cephalosporin C CO 2H O Resistenzentwicklung durch das Enzym Penicillase; dieses öf fnet den β-Lactamring hydrolytisch und verhindert somit die Desaktivierung des für den Zellwandauf bau verantwortlichen Proteins