Atombau und Atommodelle – ein Stationenzirkel
Werbung

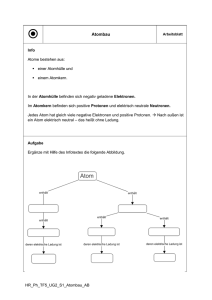
10. Atombau und Atommodelle – ein Stationenzirkel 1 von 18 Atombau und Atommodelle – ein Stationenzirkel Martina Grosty, Berlin Niveau: Sek. I Dauer: 3 Unterrichtsstunden (Stationenlernen) I/B Bezug zu den KMK-Bildungsstandards Fachwissen: Die Schülerinnen und Schüler beschreiben den Bau von Atomen mithilfe verschiedener Modelle, die sich im Laufe der Geschichte entwickelt haben. Des Weiteren sollen sie erkennen, dass Modelle nur Hilfsvorstellungen sind, die ihre Grenzen haben. Erkenntnisgewinnung: Die Schülerinnen und Schüler überprüfen die Vermutungen an einzelnen Stationen. Kommunikation: Vorstellung der Arbeitsergebnisse gegenüber der Lehrkraft und den Mitschülerinnen und Mitschülern Der Beitrag enthält Materialien für: T H C I S N A R O V ü Mindmapping ü Stationenlernen ü Wortsuchrätsel ü verschiedene Methodenwerkzeuge Hintergrundwissen Die Themen „Atombau“ und „Atommodelle“ stellen Schwerpunkte in der Chemie dar. Der Lernzirkel ist in erster Linie eine Möglichkeit, den Aufbau eines Atoms aus Kern und Hülle auf spielerische Weise zu wiederholen und zu festigen. Hinweise zur Didaktik und Methodik Die Schüler sollen diese Stationenarbeit in Einzel- bzw. Partnerarbeit durchlaufen. Die Reihenfolge der Stationen ist völlig beliebig. Die einzelnen Stationen bedürfen eines unterschiedlichen Zeitumfangs. Für besonders schnelle Schüler stehen die Stationen 6 und 7 optional zur Verfügung, die ansonsten auch als Hausaufgabe bzw. Lernzielkontrolle eingesetzt werden können. Den Schülern wird die Vorgabe gegeben, dass sie alle Stationen innerhalb von drei Unterrichtsstunden bearbeiten sollen. Sie sollen den Arbeitsfortgang auf dem Protokollblatt insofern dokumentieren, dass sie jeweils das Datum der Bearbeitung eintragen. Zu Beginn des Unterrichts werden kurz die Prinzipien eines Stationenlernens erklärt und der zeitliche Bearbeitungsrahmen abgesteckt. Stationenlernzirkel Laufzettel zu den Stationen (M 1) Der Laufzettel macht auf die bevorstehenden Stationen neugierig und dient sowohl als Orientierung für die bereits durchgeführten Stationen als auch für die Ergebnissicherung. Die Gruppen beschäftigen sich in freier Zeiteinteilung mit den vorgegebenen Stationen. Checkliste zum Stationenlernen (M 2) Die Checkliste enthält detaillierte Anweisungen für die Schüler. Es werden ihnen die einzelnen geforderten Arbeitsschritte aufgezeigt. 48 RAAbits Chemie, August 2014 10. Atombau und Atommodelle – ein Stationenzirkel 4 von 18 M 1 Laufzettel zu den Stationen Stationsnummer / Stationstitel Stationsbeschreibung Station Zeitdauer bearbeitet? für die Bearbeitung (Datum / Zeit) I/B Stationsfazit Anregung / Kritik Bitte ankreuzen! Station 1 Ihr führt dieses Domino in Partnerarbeit durch. Ende: ..........……… Ihr führt dieses Domino in Partnerarbeit durch. Atombau Lückentext Station 4 Station 5 V Kettenquiz Atombau Station 6 (optional) Wortsuchrätsel Station 7 (optional) Mindmap Beginn: ..................... Ende: ..................... Diese Station wird als Einzelarbeit durchgeführt. Die Kontrolle kann danach selbstständig erfolgen. r ja Diese Station wird als Einzelarbeit durchgeführt. Die Kontrolle kann danach selbstständig erfolgen. r ja Ihr führt dieses Quiz in einer Gruppe von vier Personen durch. r ja T H C Beginn: ..................... r nein Ende: ..................... I S N A R O Atombau Klammerkarte r ja r nein Atommodell Domino Station 3 Beginn: ..................... r nein Atombau Domino Station 2 r ja r nein Ende: ..................... Beginn: ..................... r nein Ende: ..................... Eine Station zum Raten, r ja Wissen wiedergeben, r nein Knobeln, Spaßhaben, sich konzentrieren … und ... nur nicht aufgeben! Bitte in Einzelarbeit! Fertige eine Mindmap zum Thema „Atombau und Atommodelle“ an. Bitte in Einzelarbeit! Beginn: ..................... r ja Beginn: ..................... Ende: ..................... Beginn: ..................... r nein Ende: ..................... 48 RAAbits Chemie, August 2014 10. Atombau und Atommodelle – ein Stationenzirkel 6 von 18 Station 1 Rund um den Atombau – ein Domino Mischt die Dominokärtchen und verteilt sie gleichmäßig an die beiden Spieler (jeder bekommt 11 Kärtchen). Auf den Kärtchen sind zum Thema „Atombau“ jeweils eine Frage und eine Antwort angegeben. Der Spieler, der in seinen Karten die Startkarte indet, beginnt das Spiel. I/B Vergleicht euer Ergebnis mit der Lösung am Pult! Kontrolliert am Ende nochmals die Zahl der Kärtchen (es müssen 22 sein) und bringt dann bitte alles zurück an seinen Platz! START elektrisch negativ Welche Elementarteilchen beinden sich im Atomkern? T H C I S N Warum heißt das Neutron so? Weil es elektrisch neutral ist. A R O z. B. Stickstoff, Phosphor, Arsen, Antimon, Bismut Welches ElementIon kann auch als Proton bezeichnet werden? zweifach positiv geladene Heliumkerne Anderer Begriff für β-Teilchen? Ernest Rutherford Welchen Energiebetrag muss man aufbringen, um ein Elektron aus der Atomhülle zu entfernen? V Wie ist die elektrische Ladung von β-Teilchen? Protonen und Neutronen Nennt drei Elemente der V. Hauptgruppe! das Wasserstofion Was sind α-Teilchen? Elektronen Welcher Forscher „beschoss“ Goldfolie mit α-Strahlen? Ionisierungsenergie Zustand eines Teilchens mit 8 (Ausnahme 2) Valenzelektronen? 48 RAAbits Chemie, August 2014 10. Atombau und Atommodelle – ein Stationenzirkel Edelgaskoniguration Wo im Atom beinden sich Elektronen? 7 von 18 Was besagt die Kernladungszahl? Atomhülle I/B Was ist ein Kation? positiv geladenes Ion Welche Elemente stehen im PSE in der gleichen Periode? Elemente mit Valenzelektronen auf derselben Schale Welche physikalische Größe entscheidet, zu welchem Element ein Atom gehört? Die Anzahl der Protonen im Kern (= Kernladungszahl) Deinition der Oktettregel? Teilchen versuchen durch Aufnahme oder Abgabe von Elektronen, 8 Elek tronen auf der Außenschale zu erreichen. Wie ist der Atomkern geladen? elektrisch positiv Was ist ein Anion? negativ geladenes Teilchen Welche Elemente gehören zur gleichen Hauptgruppe im PSE? Elemente mit der gleichen Anzahl an Valenzelektronen Was sind Isotope? Atome gleicher Protonenzahl, aber unterschiedlicher Neutronenzahl Wie viele Hauptgruppen gibt es im Periodensystem? Es gibt 8 Hauptgruppen. ENDE Anzahl der Protonen im Atomkern I S N A R O V T H C 48 RAAbits Chemie, August 2014 10. Atombau und Atommodelle – ein Stationenzirkel 9 von 18 Station 3 Wähle richtig! Ein Lückentext zum Atombau Aufgabe: Setzt die folgenden Begriffe an der richtigen Stelle im Text ein: Atomhülle | Atomkern | Atomkern | Atommasse | Edelgaskoniguration | Elektronen | Elek tronenabgabe | Elektronenaufnahme | Elementarteilchen | Energiestufen | Isotope | negativ | Neutronen | Nukleonenzahl | Protonen | Rutherford | unterschiedliche | Valenzelektronen I/B Nach dem Kern-Hülle-Modell von _ _ _ _ _ _ _ _ _ _ _ _ _ ist ein Atom aus einem _ _ _ _ _ _ _ _ _ _ und einer _ _ _ _ _ _ _ _ _ _ _ aufgebaut. Der 3 Atomkern ist sehr klein, positiv geladen und enthält fast die gesamte _ _ _ _ _ _ _ _ _ _ _ ; die Atomhülle ist nahezu massefrei, in ihr beinden sich die _ _ _ _ _ _ _ geladenen _ _ _ _ _ _ _ _ _ _ . 6 Atome sind aus _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ T H C aufgebaut. Den _ _ _ _ _ _ _ _ _ bilden positiv geladene _ _ _ _ _ _ _ _ _ und ungeladene _ _ _ _ _ _ _ _ _ , die Atomhülle besteht aus negativ geladenen Elektronen. 9 _ _ _ _ _ _ _ I S N eines Elements besitzen aufgrund ihrer gleichen Elektronen- und Protonenzahl gleiche chemische Eigenschaften und gleiches Reaktionsverhalten. A R O Isotope eines Elements besitzen aber eine _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ Anzahl 12 an Neutronen. Deshalb unterscheiden sie sich in der _ _ _ _ _ _ _ _ _ _ _ _ _ . V Nach dem Atommodell von Bohr beinden sich die Elektronen eines Atoms in der Atomhülle auf festgelegten _ _ _ _ _ _ _ _ _ _ _ _ _ . 15 Als _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ werden die Elektronen der jeweils höchst be- setzten Energiestufe eines Atoms bezeichnet. Sie bestimmen das chemische Reaktionsverhalten eines Atoms. 18 In chemischen Reaktionen erreichen Atome durch _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ oder _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ die stabile _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ . 48 RAAbits Chemie, August 2014 10. Atombau und Atommodelle – ein Stationenzirkel 10 von 18 Station 4 Entscheide dich! Eine Klammerkarte zum Atombau Anleitung zur Bearbeitung der Klammerkarte I/B r Im rechten Bereich der Karte ist ein Feld, welches leer ist. Bearbeite die Karte und entscheide, welche der drei Antworten richtig ist/sind. Befestige an dem entsprechenden Feld/den entsprechenden Feldern eine Büroklammer am Rand. r Wenn du jedem richtigen Feld eine Klammer zugeordnet hast, drehst du die Klammerkarte um. r Die grauen Felder auf der Rückseite ermöglichen dir die Selbstkontrolle. r Wenn die grauen Felder mit den Klammern übereinstimmen, ist alles richtig. Wenn nicht, dann nimmst du die Klammer ab, drehst die Karte um und bearbeitest die betreffende Aufgabe noch einmal. r Wenn alles richtig ist, überträgst du die Lösung, z. B. in Form einer Tabelle oder eines kurzen zusammenfassenden Textes, in deine Mappe bzw. auf deinen Arbeitszettel. T H C Achtung: Es können mehrere Antworten richtig sein! I S N Viel Spaß und viel Erfolg! A R O V 48 RAAbits Chemie, August 2014 10. Atombau und Atommodelle – ein Stationenzirkel 11 von 18 Befestige an jedes richtige Feld auf der rechten Seite eine Büroklammer! Welche Strahlung verwendete Rutherford für seinen Streuversuch? positiv geladene α-Strahlen negativ geladene α-Strahlen positiv geladene β-Strahlen Mit diesen Teilchen beschoss er eine ca. 1000 Atomschichten dicke I/B Bleifolie Goldfolie PVC-Folie Er beobachtete dabei, dass alle Teilchen abgelenkt wurden fast alle Teilchen ungehindert durchkamen kein Teilchen abgelenkt wurde Aus dem Versuchsergebnis schloss er, dass ein Atom einen riesigen Kern besitzt T H C aus nahezu leerem Raum besteht einen Atomkern und eine Atomhülle besitzt Weiterhin folgerte er, dass der Atomkern I S N positiv geladen ist negativ geladen ist A R O keine Ladung besitzt Weil Atome elektrisch neutral sind, muss die Atomhülle V Positiv geladene Elementarteilchen nennt man negativ geladen sein keine Ladung besitzen positiv geladen sein Neutronen Elektronen Protonen Damit Protonen sich nicht gegenseitig abstoßen, beinden sich im Kern weitere Elementarteilchen, die Positronen Die Atommasse berechnen wir aus der Summe der Masse von Elektronen und Protonen Leptronen Neutronen Neutronen und Protonen Neutronen und Elektronen Wenn ein Atomkern einen Durchmesser von 5 mm hätte, dann hätte das Atom insgesamt einen Durchmesser von 5 cm 50 m 5 km 48 RAAbits Chemie, August 2014 10. Atombau und Atommodelle – ein Stationenzirkel 17 von 18 Erläuterungen und Lösungen Erläuterung (M 1) Vor Beginn des Lernzirkels sollte mit den Schülern verabredet werden, wie viel Zeit ihnen zur Verfügung steht. I/B Erläuterungen (Station 1) und (Station 2) Die Dominokarten werden laminiert (wenn möglich) und wie angegeben auseinander geschnitten. Drucken Sie jedes Domino auch jeweils einmal für sich aus und lassen Sie es, ohne es zu zerschneiden, vorn am Pult als Lösung liegen. Erläuterung (Station 3) In dem vorliegenden Fachtext sind fachdidaktische Lücken eingebaut. Es wird so die Anwendung neuer Fachtermini geübt. Der Schwierigkeitsgrad lässt sich durch Vorgabe der einzusetzenden Teile variieren: Es besteht die Möglichkeit, die Lückenwörter im oberen Teil des Arbeitsbogens zu löschen (im Word-Dokument auf CD 48). Damit wird das Ausfüllen natürlich schwieriger. T H C Lösung (Station 3) Nach dem Kern-Hülle-Modell von Rutherford ist ein Atom aus einem Atomkern und einer Atomhülle aufgebaut. Der Atomkern ist sehr klein, positiv geladen und enthält fast die gesamte Atommasse; die Atomhülle ist nahezu massefrei, in ihr befinden sich die negativ geladenen Elektronen. I S N Atome sind aus Elementarteilchen aufgebaut. Den Atomkern bilden positiv geladene Protonen und ungeladene Neutronen; die Atomhülle besteht aus negativ geladenen Elek tronen. A R O Isotope eines Elements besitzen aufgrund ihrer gleichen Elektronen- und Protonenzahl gleiche chemische Eigenschaften und gleiches Reaktionsverhalten. Isotope eines Elements besitzen aber eine unterschiedliche Anzahl an Neutronen. Deshalb unterscheiden sie sich in der Nukleonenzahl. V Nach dem Atommodell von Bohr befinden sich die Elektronen eines Atoms in der Atomhülle auf festgelegten Energiestufen. Als Valenzelektronen werden die Elektronen der jeweils höchst besetzten Energiestufe eines Atoms bezeichnet. Sie bestimmen das chemische Reaktionsverhalten eines Atoms. In chemischen Reaktionen erreichen Atome durch Elektronenabgabe oder Elektronenaufnahme die stabile Edelgaskonfiguration. Erläuterung (Station 4) Fragen und Antworten werden 2-seitig kopiert oder zusammengeklebt (Vorder- und Rückseite deckungsgleich zusammenkleben) und laminiert (wenn möglich). Pro Gruppe (am besten als Partnerarbeit) werden 20 Büroklammern benötigt (ersatzweise kleine Wäscheklammern). Erläuterung (Station 5) Die Teamkarten werden kopiert und zusammengeklebt (Vorder- und Rückseite deckungsgleich zusammenkleben), laminiert (wenn möglich) und wie angegeben auseinander geschnitten. 48 RAAbits Chemie, August 2014