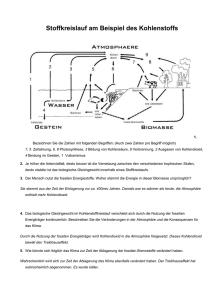
Anhang
Werbung

Regionale Verteilung chlorierter Kohlenwasserstoffe (CKW) und polycyclischer aromatischer Kohlenwasserstoffe (PAK) im Pelagial und Oberflächensediment der Ostsee 2003 Detlef Schulz-Bull Michael S. McLachlan Kilian Smith Ines Hand Astrid Lerz Erika Trost Institut für Ostseeforschung An der Universität Rostock Im Auftrag des Bundesamtes für Seeschifffahrt und Hydrographie Hamburg, Rostock Warnemünde Juni 2004 Inhaltsverzeichnis Seite Einleitung 3 Material und Methoden 6 In-situ Pump System (IPS) – Probenahme und Extraktion 6 C8-Säulen – Probenahme und Extraktion 9 Glaskugelschöpfer - Probenahme und Extraktion 10 Sediment – Probenahme und Extraktion 11 Aufbereitung der Hexanextrakte von IPS, GKS, C8 und Sediment 11 Quantifizierung von CKW und PAK der IPS-, GKS-,C8- und Sedimentproben 12 Ergebnisse und Diskussion der Daten aus der Wassersäule Isomere des HCH 14 14 Qualitätsabschätzung (C8-Säulen und Glaskugelschöpfer) 14 Konzentrationsübersicht 16 Vergleich von Oberflächen und Tiefenwasser 17 Räumliche Verteilung 18 Zeitreihen 20 DDT und Metabolite 22 Qualitätsabschätzung 22 Konzentrationsübersicht 23 Räumliche Verteilung 23 Zeitreihen 25 PCB-Kongenere 26 Qualitätsabschätzung 26 Konzentrationsübersicht 27 Räumliche Verteilung 28 Zeitreihen 30 PAK 31 Qualitätsabschätzung 31 Konzentrationsübersicht 33 Räumliche Verteilung 33 Zeitreihen 35 Forschung und Entwicklung 36 I. Ergebnisse und Diskussion der Sedimentdaten 36 -1- PCB und DDE 36 Qualitätsabschätzung 36 Konzentrationsübersicht 37 Räumliche Verteilung 38 PAK 39 Qualitätsabsicherung 39 Konzentrationsübersicht 40 Räumliche Verteilung 40 II. PBDE – Polybromierte Diphenylether 41 Einführung 41 Material und Methoden 42 Aufarbeitung 43 Quantifizierung 45 Wiederfindungstest 46 Ergebnisse und Disskusion 47 Qualitätsabschätzung 47 Konzentrationsübersicht 53 Schlussfolgerung und Ausblick 54 Zusammenfassung 54 Verzeichnis der Abbildungen 55 Verzeichnis der Tabellen 56 Danksagung 58 Literatur 58 -2- Einleitung Im Februar 2003 wurden zur Ermittlung langfristiger Trends der Belastung der Ostsee mit organischen Schadstoffen Seewasserproben gesammelt und auf verschiedene Schadstoffklassen untersucht. Seit dem Jahr 2002 erfolgt die Probenahme mit einem in-situ Pumpsystem (IPS). Die Erfahrungen hatten gezeigt, dass diese Sammelmethode aufgrund des größeren Probenvolumens eine deutlich bessere Datenqualität liefert. Ferner werden die im Wasser gelösten und an SPM sorbierten Schadstoffe getrennt erfasst, welches ganz neue und aussagekräftige Interpretationsmöglichkeiten bietet. Die Proben wurden am fahrenden Schiff aus der Glaspumpenleitung genommen; dieses Verfahren ermöglicht eine viel repräsentativere Probenahme und spart teure Stationszeit. Die beprobten Transekte verliefen durch die westliche Ostsee, Arkonasee, Bornholmsee, Gotlandsee und durch die Oderbucht. In diesen Proben wurden PCB, DDT und dessen Metaboliten sowie PAK analysiert (s. unten). Für eine Substanzgruppe, die HCH, wurde in diesem Jahr eine neue Methode der Probenahme und Aufarbeitung durchgeführt. Die Probenahme erfolgte mittels Filtration über eine mit Octyl-modifiziertes Kieselgel gefüllte Glassäule (C8). Zur Absicherung dieser Methode wurden an drei Stationen Parallelproben mit der herkömmlichen Methode, dem Glaskugelschöpfer, genommen. Die Probenahme mit dem in-situ Pumpsystem bringt hier keine Vorteile, da die HCH fast ausschließlich in gelöster Form vorliegen und verhältnismäßig hohe Konzentrationen aufweisen. Es wurden die im Trendmonitoring festgelegten Stationen beprobt, die weder vom Übergangsgebiet Nordsee-Ostsee noch durch Flusseinträge direkt beeinflusst werden und somit in reduziertem Ausmaß kurzfristigen Schwankungen des Belastungsgrades unterliegen. Diese Stationen befinden sich westlich Bornholm (6) und östlich Bornholm (5). Zusätzlich wurde die Pommersche Bucht mit einer küstennahen Station beprobt. Neu im Messprogramm aufgenommen wurde das Sedimentmonitoring. Dafür wurden im Juni 2003 6 Trendmonitoringstationen beprobt und auf PCB, DDT und dessen Metaboliten sowie PAK analysiert. Diese Stationen liegen in der Bornholmsee (1) und in der Gotlandsee (5). Als Vertreter für die organischen Schadstoffe wurden, wie bisher, die chlorierten Kohlenwasserstoffe (CKW) sowie die polycyclischen aromatischen Kohlenwasserstoffe (PAK) untersucht. Durch ihren vielseitigen Einsatz in geschlossenen und offenen Systemen gelangten bzw. gelangen weiterhin beide Stoffklassen in die Umwelt. -3- Als Ursache der Belastung der Meere mit diesen Stoffen ist, neben den Einleitungen von industriellen und kommunalen Abwässern über die Flusssysteme (Punktquellen), die atmosphärische Deposition (diffuse Quelle) als wichtiger Eintragspfad anzusehen, so dass die CKW und PAK in der Umwelt mittlerweile weltweit (u.a. Europa, Arktis und Antarktis) in verschiedenen Matrices (Atmosphäre, Wasserkörper, Sedimente, Böden) aufgespürt werden. Die CKW zählen zu den problematischen Umweltgiften rein anthropogenen Ursprungs, die sich in der Biosphäre nur sehr langsam umwandeln bzw. abbauen (Kohler et al. 1992). Dagegen werden bei den PAK die niedermolekularen bi- und tri-cyclischen Verbindungen teilweise durch bakterielle, photolytische oder biologische Prozesse abgebaut, während die höhermolekularen PAK sich gegenüber diesen Einwirkungen weitgehend resistent zeigen (Readman et. al. 1984). Diese Persistenz steigt mit zunehmendem Molekulargewicht. Die CKW und PAK sind auf Grund ihrer ökotoxischen Relevanz (Akkumulation über Nahrungsketten in höheren Organismen) Bestandteil des Baltic Monitoring Programme (BMP) der Baltic Marine Environment Protection Commission (HELCOM, 1997). Als relevante Verbindungen der CKW wurden neben den polychlorierten Biphenylen (PCB) das Dichlordiphenyltrichlorethan (DDT) und dessen primäre Abbauprodukte DDE und DDD sowie die Isomere des Hexachlorcyclohexans (HCH) in die Untersuchungen einbezogen. Die Liste der zu untersuchenden PAK umfasst mit den 16 EPA-PAK die niedermolekularen 2und 3-cyclischen Verbindungen (z.B. Anthracen) sowie die höhermolekularen 4- bis 6cyclischen Komponenten (u.a. das kanzerogene penta-cyclische Benzo(a)pyren). Hexachlorcyclohexan, seit dem Ende des 2. Weltkrieges als technisches Gemisch produziert, wird gegenwärtig noch in vielen Ländern als Insektizid angewendet. Hierbei kommt zum einen nur der isolierte Wirkstoff γ-HCH (Lindan) als Insektizid zum Einsatz, zum anderen wird das technische Gemisch der HCH Isomere (60-70% α-HCH, 10-15% β-HCH und 1215% γ-HCH) ausgebracht. Als weiteres Insektizid wurde weltweit technisches DDT eingesetzt, das in tropischen Ländern immer noch breite Anwendung findet. In der Umwelt wurden neben dem Hauptbestandteil p,p´-DDT ebenso dessen Isomer o,p´-DDT gefunden. Des weiteren lassen sich deren primäre Abbauprodukte o,p´- und p,p´-DDD sowie o,p´- und p,p´-DDE nachweisen. -4- Polychlorierte Biphenyle (PCB) wurden seit den frühen 30er Jahren des 20. Jh. industriell erzeugt und fanden als technische Gemische wegen ihrer Eigenschaften - elektrischer Nichtleiter, nicht brennbar, nicht entflammbar, hohe Temperaturbeständigkeit und chemische Inertheit - vielfältige Anwendungsmöglichkeiten in geschlossenen Systemen z.B. als Kühlmittel, Dielektrika, Hydraulikflüssigkeit sowie in offenen Systemen z.B. in Farben, Kunststoffen oder Schmiermitteln (Kohler et al. 1992). Der Einsatz der PCB ist, nach Produktionsverboten (z.B. USA 1977, BRD 1983) aufgrund von bekannt gewordenen Umweltrisiken, nach einem Produktionsmaximum Anfang der 70er Jahre von 50000 Tonnen/Jahr rückläufig. Aufgrund der Persistenz der PCB und wegen des weiträumigen Transportes über die Atmosphäre bleiben die Risiken dieser Stoffklasse jedoch bestehen, eine Überwachung dieser Verbindungsklasse bleibt damit notwendig. In die Meere werden weltweit jährlich ca. 200.000 Tonnen von den polyaromatischen Kohlenwasserstoffen (PAK) eingetragen. Die Hauptquelle der anthropogenen PAK in der Umwelt ist dabei wahrscheinlich der atmosphärische Eintrag von pyrolisiertem fossilen Brennmaterial. Zusätzlich zum Eintrag durch die Flüsse und der atmosphärischen Deposition spielt bei den PAK der Eintrag von Erdöl oder Erdölprodukten durch die Schifffahrt eine weitere Rolle. Natürliche Synthese-Prozesse, hervorgerufen durch z.B. Bakterien, Algen oder Schwämme, führen, verglichen mit der anthropogenen Produktion, nur in sehr geringem Umfang zu einer weiteren PAK-Belastung der Meere (Lipiatou and Saliot 1991). Die untersuchten PAK, bestehend aus 2 bis 6 kondensierten aromatischen Ringen, werden, basierend auf ihren Eigenschaften und ihren Molekulargewichten, in zwei Klassen von PAK unterteilt, und zwar in die 2- und 3- Ringaromaten (Naphthalen bis Anthracen) und die 4- bis 6- Ringaromaten (Fluoranthen bis Indeno-(1,2,3-c,d)pyren). Die niedermolekularen Aromaten zeigen eine signifikant akute Toxizität, während einige der höher molekularen PAK ein hohes cancerogenes bzw. mutagenes Potential aufzeigen (Neff 1979, Lipiatou and Saliot 1991). Mit steigendem Molekulargewicht nimmt die geringe Wasserlöslichkeit der PAK ab. Sie treten, wegen ihrer Hydrophobie (log Kow = 3-8), im Meerwasser überwiegend an suspendiertem partikulärem Material (SPM) gebunden auf. -5- Mit diesem Hintergrund wurden in 2003 die seit 1992 vom Institut für Ostseeforschung Warnemünde (IOW) im Rahmen der Verwaltungsvereinbarung mit dem Bundesamt für Seeschifffahrt und Hydrographie (BSH) Hamburg durchgeführten Untersuchungen zur Verteilung von CKW und PAH im Pelagial der Ostsee fortgesetzt. Material und Methoden Im Februar 2003 wurden für die Stoffklassen der PCB, PAK und DDT 10 Transekte mit dem in-situ Pumpsystem beprobt (s. Abb. 1). Die Probenahme erfolgte mit dem Forschungsschiff „A. v. Humboldt“. Während der Fahrt des Forschungsschiffes zwischen ausgewählten Stationen wurde das Oberflächenwasser mit Hilfe des IPS kontinuierlich beprobt, wobei der gelöste und der an Partikel gebundene Anteil der Substanzen getrennt erfasst wurde. Für die Stoffklasse der HCH wurde eine neue Methode der Probenahme bzw. Probenaufarbeitung eingeführt. Die Probenahme erfolgte mittels Filtration über eine mit Octyl-modifiziertem Kieselgel gefüllte Glassäule (C8). Dazu wurden an ausgewählten Stationen aus dem Glaspumpensystem des Forschungsschiffes Proben entnommen und filtriert. Da die HCH in fast ausschließlich gelöster Form und in hohen Konzentrationen vorliegen, ist ein Volumen von 1 L Seewasser ausreichend. Zur Absicherung dieser Methode wurden an drei Stationen Parallelproben mit dem Glaskugelschöpfer (GKS) genommen (s. Abb. 1). Für das Sedimentmonitoring erfolgte die Probenahme im Juni 2003 mit dem Forschungsschiff „Professor Albrecht Penck“ an 7 ausgewählten Stationen (siehe Abb. 2) mittels Kastengreifer. In-situ Pump System (IPS) – Probenahme und Extraktion Zur Gewinnung von Informationen zur Verteilung der untersuchten Schadstoffe zwischen der gelösten und der partikulären Phase wurde ein in-situ Pumpsystem (IPS) verwendet, da die im Zuge des bestehenden Monitorings mit Glaskugelschöpfern gewonnenen Proben keine Aussagen über diese Verteilung von Schadstoffen ermöglichen. Der eingesetzte Glaskugelschöpfer lieferte nur die Summe aus beiden Phasen. Beim IPS wurden die Partikel von einem Glasfaserfilter zurückgehalten, während die gelösten CKW und PAK unter Verwendung von XAD-2-Harz-Kartuschen aus dem Meerwasser extrahiert wurden (Petrick et al. 1988, Schulz et al. 1995). -6- Im Gegensatz zum Glaskugelschöpfer, dessen Nachweisgrenze bei einem Probenvolumen von 20-22 Litern 2 pg/L betragen hatte, konnte beim IPS durch das Heraufsetzen der untersuchten Wassermenge auf mehr als 200 Liter die Nachweisgrenze auf unter 200 fg/L verringert werden, mit der Folge einer verbesserten Reproduzierbarkeit der Ergebnisse. Das IPS wurde zur integrierenden Probennahme während der Fahrt des Forschungsschiffes zwischen ausgewählten BMP-Stationen im Nasslabor eingesetzt. Dazu wurde das Meerwasser aus 5 m Wassertiefe per Glaspumpensystem möglichst kontaminationsfrei in einen Zwischenspeicher (4 L Glasflasche) gepumpt, von dort vom IPS angesogen und wie zuvor beschrieben extrahiert. Zur Gewährleistung einer gleichmäßigen räumlichen Gewichtung innerhalb eines Transekts fand die Probenahme nur bei fahrendem Schiff statt. An Zwischenstationen (Monitoringstationen anderer Arbeitsgruppen) wurde deshalb die Transektbeprobung unterbrochen. Zur Absicherung der Analysenergebnisse wurde mit dem IPS immer eine Doppelbeprobung durchgeführt. Bis zur weiteren Aufarbeitung im IOW-Labor wurden die beladenen Filter im Gefrierschrank bei –20 °C aufbewahrt, während die beladenen Kartuschen bei 4 - 6 °C im Kühlschrank gelagert wurden. Die mit den ehemals im Meerwasser gelöst vorliegenden CKW und PAK beladenen XADKartuschen wurden in einem ersten Schritt 1 Stunde lang mit 180 ml Aceton im EhrhardtExtraktor extrahiert (1. Extrakt), um das verbliebene Ostseewasser vollständig aus der Kartusche zu entfernen. Im zweiten Extraktionsschritt wurden die am XAD-Harz adsorbierten CKW und PAK mit 330 ml eines Aceton-Wasser-Gemisches (10:1, v/v) 12 Stunden lang eluiert und als 2. Extrakt anschließend weiter verarbeitet, in dem der Extrakt nach Zugabe von 20 ml Hexan bis zur vollständigen Entfernung des Acetons am Rotationsverdampfer eingeengt wurde. Dabei trat eine Phasentrennung (Hexan und Wasser) auf. Dieser Extrakt wurde zweimal mit je 10 ml destilliertem Hexan ausgeschüttelt. Nach Zugabe des 1. Extraktes zur Wasserphase wurde erneut zweimal ausgeschüttelt. Die organischen Phasen wurden vereinigt, über Natriumsulfat getrocknet und auf ca. 150 µl am Rotationsverdampfer eingeengt. Die vormals im Meerwasser an Partikel gebundenen CKW und PAK wurden mit Hilfe eines Accelerated Solvent Extraktors (ASE) von den Filtern extrahiert. Dazu wurden die beladenen, feuchten Filter in zwei statischen Zyklen mit einem Hexan/Aceton Gemisch (60:40, V/V) einem Druck von 140 bar bei einer Temperatur von 100 °C ausgesetzt (15 min). Die -7- 256 12 10 I 11 41 46 II X 30 104 69 113 III 132 IX 109 OB4 32 IV 213 26 SF46 222 SF48 V VIII 259 253 263 VII 89b VI 271 HCH – Beprobung während des Transektes HCH – Beprobung während des Transektes, Tiefenstation und Kugelschöpfer Abb. 1 Karte der Probenahmestationen (IOW-Code) im Februar 2003 BMP-Stationen (rot) und IPS-Beprobungstransekte I - X -8- 285 240 270 271 272 260 213 Abb. 2: Karte der Probenahmestationen (IOW-Code) für Sediment im Juni 2003 vereinigten Extrakte wurden mit 20 ml dest. Hexan und 20 ml Mineralwasser versetzt und zweimal ausgeschüttelt. Der Wasserphase wurden 20 ml Hexan zugegeben und das Aceton wurde per Rotationsverdampfer abgezogen. Nach Zugabe von weiteren 20 ml Hexan wurde die Wasserphase erneut zweifach ausgeschüttelt. Alle im Zuge dieser Aufarbeitung anfallenden Hexanphasen wurden vereinigt, über Natriumsulfat getrocknet und auf ca. 150 µl am Rotationsverdampfer eingeengt. C8-Säulen – Probenahme und Extraktion Um Aussagen über die Verteilung der HCH – Konzentrationen zu treffen, wurde eine neue Methode der Probenahme und Probenaufarbeitung einführt. Der Vorteil dieser Methode liegt vor allem bei geringerer Stationszeit und größerer Flexibilität beim Schiffseinsatz, da die Probenahme für organische Schadstoffe nunmehr keine Arbeiten an Deck erfordert. Das ist ein großer Vorteil bei den Wetterbedingungen, die im Februar oft angetroffen werden. Ferner zeichnet sich die Methode durch einen geringen Lösungsmittelverbrauch aus. -9- Während der Transektbeprobung wurden auf den Positionen ausgewählter BMP-Stationen aus dem Glaspumpensystem bzw. an Tiefenstationen aus den Schöpfern der CTD-Sonde jeweils Parallelproben von je 1 l in Braunglasflaschen abgefüllt. Die Proben wurden mittels einer modifizierten Filtrationseinheit (siehe Anhang, Abb. I) über eine mit Octyl-modifiziertem Kieselgel gefüllte Glassäule (C8) filtriert. In dieser Filtrationseinheit lag ein SPM-Filter vor, der den partikulären Anteil auffing. Da die HCH fast ausschließlich in gelöster Form vorliegen, wird der partikuläre Anteil nicht berücksichtigt und dieser Filter wurde für die Bestimmung des SPM-Gehaltes genutzt. Bis zur weiteren Aufarbeitung im Labor wurden die beladenen C8-Säulen verpackt und bei –20 °C eingefroren. Zur Aufarbeitung im Labor wurden die aufgetauten C8-Säulen mit N2 getrocknet. Auf die Säule wurde ein interner Standard mit deuteriertem α-HCH, γ-HCH und dem nicht in der Umwelt vorkommenden ε-HCH gegeben. Anschließend wurde die C8-Säule mit 20 ml eines Gemisches aus Aceton/Hexan (1:1) eluiert und das aufgefangene Extrakt am Rotationsverdampfer eingeengt. Die nun vorliegende Hexanphase wurde über Na2SO4 getrocknet und nochmals am Rotationsverdampfer auf 150 µl eingeengt. Glaskugelschöpfer - Probenahme und Extraktion Um Aussagen über die Vergleichbarkeit beider Methoden für die HCH-Analytik zu treffen, wurden auf dieser Fahrt an 3 Stationen Wasserproben mit der herkömmlichen Methode genommen. Dazu wurden die Wasserproben mit einem 22 L Glaskugelschöpfer aus 10 m Tiefe entnommen. Zur Absicherung der Analysenergebnisse wurde jeweils eine Doppelbeprobung durchgeführt. Die Extraktion der Wasserproben mit dem unpolaren, mit Wasser nicht mischbaren, organischen Lösungsmittel Hexan wurde zur Verringerung der Gefahr der Probenkontamination direkt in der Glaskugel durchgeführt. Den Proben wurden zuvor die im Ostseewasser nicht nachweisbare Komponente ε-HCH sowie ein Mix aus deuterierten α-HCH und γ-HCH als interner Standard zur Bestimmung der Wiederfindungsraten zugesetzt. Die Extraktion der HCH sowie des internen Standards aus der 22 L - Wasserprobe erfolgte durch 15-minütiges Ausrühren mit 250 ml Hexan (Reinheitsgrad: zur Rückstandsanalyse) bei vollständiger Durchmischung. Die HCH-haltige spezifisch leichtere Hexanphase wurde nach erfolgter Phasentrennung mit Hilfe eines Verdrängers abgenommen und nach Zugabe von Natriumsulfat (8 Stunden geglüht - 10 - bei 450 °C) bei -20 °C im Gefrierschrank aufbewahrt. Die weitere Probenaufarbeitung erfolgte im Spurenanalytiklabor am IOW. Sediment – Probenahme und Extraktion Die Sedimentbeprobung wurde mit einem Kastengreifer vorgenommen. Für die Aufarbeitung im IOW-Labor wurden die Sedimentproben in Aluschalen abgefüllt und bei – 20 °C eingefroren. Zur Aufarbeitung im Labor wurden die Proben aufgetaut, ca. 5 g Probe eingewogen und mit Na2SO4 verrieben. Mit Hilfe eines Accelerated Solvent Extraktors (ASE) wurden die CKW und PAK aus dem Sediment extrahiert. Dazu wurden die eingewogenen Proben in zwei statischen Zyklen mit einem Hexan/Aceton Gemisch (60:40, V/V) einem Druck von 140 bar bei einer Temperatur von 100 °C ausgesetzt (10 min). Es erfolgte eine Nachextraktion von einem statischen Zyklus (5 min) bei 100 °C und 140 bar. Die Extrakte wurden anschließend mit Na2SO4 getrocknet, bei der Filtration über eine PTFE-Fritte in einer Glassäule im Baker-Bond-Gestell vereinigt und auf ca. 1 ml eingeengt. Jetzt erfolgte das Entschwefeln mit Kupfer. Dazu wurden ca. 0,5 g aktiviertes Kupfer in das Zentrifugengläschen mit dem zu reinigenden Hexanextrakt gegeben und kurz mit dem Rüttler geschüttelt. Anschließend kamen die Proben für 30 min ins Ultraschallbad. Nach dem Absetzen des Kupfers wurde das Extrakt über eine PTFE-Fritte in einer Glassäule im BakerBond-Gestell filtriert und auf ca. 1 ml eingeengt. Die ganze Prozedur wurde dann ein zweites Mal wiederholt. Aufbereitung der Hexanextrakte von IPS, GKS, C8 und Sediment Das Einengen der Hexanextrakte auf ein Volumen von ca. 150 µl erfolgte am Rotationsverdampfer bei 30 °C Wasserbadtemperatur und einem Unterdruck von ca. 220 mbar. Zur Aufreinigung der Extrakte wurde ein Baker-Bond Doppelsäulen-Cleanup aus 3 g Aluminiumoxid (desaktiviert mit 15 % dest. Wasser) in der oberen und 3 g Kieselgel (desaktiviert mit 3,5 % dest. Wasser) in der unteren Säule verwendet. Dazu wurde die Probe auf die Aluminiumoxidsäule aufgegeben und anschließend mit 12 ml Hexan sowie mit 40 ml Dichlormethan/Hexan (1+9) eluiert. Die so erhaltene CKW/PAK-Fraktion wurde auf ein Volumen von ca. 50 µl eingeengt. - 11 - Quantifizierung von CKW und PAK der IPS-, GKS-,C8- und Sedimentproben Zur Bestimmung der CKW und PAK per Kapillargaschromatographie (GC) wurden die gereinigten Extrakte auf einer unpolaren Trennsäule in die Einzelkomponenten aufgetrennt (Tab. 1) und mit Hilfe eines gekoppelten Massenspektrometers (MS) quantifiziert. Die GCMS-Bedingungen sind in der Tabelle 2 aufgeführt. Die Ergebnisse wurden korrigiert unter Berücksichtigung der Wiederfindungsraten, die aus den bereits vor der Probenextraktion zugegebenen internen Standardsubstanzen ermittelt wurden. Der gesamte Arbeitsablauf von der Probennahme bis zur massenselektiven gaschromatographischen Bestimmung der CKW und PAK ist in der Abbildung 3 zusammengefasst. an Bord Probenahme: 22 L Glaskugelschöpfer In-situ Pumpsystem XAD Filter C-8 Säule Interner Standard: ε-HCH deuterierte HCH (Tab. 1) ⇓ ⇓ ⇓ Extraktion: flüssig-flüssig Extration mit 250 ml Hexan ⇓ ⇓ ⇓ Trocknung: mit Na2SO4 Aufbewahrung: bei –20 °C bei –20 °C bei +4 °C bei –20 °C im Labor Interner Standard: Extraktion: ε-HCH C markierte PCB deuterierte PAK (Tab. 1) ⇓ ε-HCH deuterierte HCH (Tab. 1) ⇓ Elution mit Aceton/Hexan Gemisch (1:1) EhrhardtExtr. per Rotationsverdampfer auf ca. 150 µl per Rotationsverdampfer auf ca. 150 µl 13 Einengen: per Rotationsverdampfer auf ca. 150 µl Clean up: Baker Bond Aluminiumoxid und Kieselgel Dopplelsäule Elution mit 12 ml Hexan + 40 ml Dichlormethan/Hexan (1+9) Einengen: ⇓ auf 50 µl Analysenmethode: ⇓ GC-MS ⇓ CKW und PAK Ergebnis: Abb. 3 ASEExtr. Probenahme-, und Aufarbeitungsschema zur CKW und PAK Bestimmung in C-8-Säulen-, Glaskugelschöpfer- und in-situ Pumpsystem-Proben - 12 - Tabelle 1 Mittels GC-MS-Detektion quantifizierte CKW und PAK Extern m/z MS Stoff PCB 28 * • PCB 31 PCB 52 * • PCB 101 * • PCB 105 PCB 110 PCB 118 PCB 138 * • PCB 149 PCB 153 * • PCB 180 * • 2,4,4’ Trichlorbiphenyl 2,4’,6 Trichlorbiphenyl 2,2’,5,5’ Tetrachlorbiphenyl 2,2’4,5,5’ Pentachlorbiphenyl 2,3,3’,4,4’ Pentachlorbiphenyl 2,3,3’,4’,6 Pentachlorbiphenyl 2,3’,4,4’,5 Pentachlorbiphenyl 2,2’,3,4,4’,5’- Hexachlorbiphenyl 2,2’,3,4’,5’,6- Hexachlorbiphenyl 2,2’,4,4’,5,5’- Hexachlorbiphenyl 2,2’3,4,4’,5,5’ Heptachlorbiphenyl 256 256 292 326 326 326 326 360 360 360 394 a,a,e,e,e,e-Hexachlorcyclohexan e,e,e,e,e,e- Hexachlorcyclohexan a,e,a,e,a,e- Hexachlorcyclohexan 219 219 219 HCB p,p’-DDT* o,p’-DDT p,p’-DDD p,p’-DDE* Hexachlorbenzol 4,4’-Dichlordiphenyltrichlorethan 2,4’-Dichlordiphenyltrichlorethan 4,4’-Dichlordiphenyldichlorethan 4,4’-Dichlordiphenyldichlorethylen 284 235 235 235 246 Naph Ace Acy Fl Phe Ant Flu Pyr BaA Chr BbF BkF BaP Ind DBA BP ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! ! Naphthalin Acenaphthen Acenaphthylen Fluoren Phenanthren Anthracen Fluoranthen Pyren Benzo(a)anthracen Chrysen Benzo(b)fluoranthen Benzo(k)fluoranthen Benzo(a)pyren Indeno(1,2,3-c,d)pyren Dibenzo(a,h)anthracen Benzo(g,h,i)perylen 128 154 152 166 178 178 202 202 228 228 252 252 252 276 278 276 * ! als 13C markierte Komponente im internen Standard als deuterierte Komponente im internen Standard a e • axiale Stellung des Chloratoms äquatoriale Stellung des Chloratoms DIN-PCB α-HCH ! β-HCH γ-HCH ! PCB-Nomenklatur nach Ballschmiter & Zell (1980) - 13 - Intern m/z MS 268 306 338 372 372 406 224 224 247 258 136 162 158 175 188 188 212 212 240 240 264 264 264 288 292 288 Tabelle 2 GC-MS – Bedingungen zur CKW und PAK-Quantifizierung PCB, HCH, DDT und PAK Gaschromatograph : Trace GC der Fa. Thermo Finnigan GmbH Injektion : Autosampler CTC A200SE PTV 2 µl solvent split 0,4 min, splitless 4 min 10 °C/sec 8 min PTV 50 -----------> 280 °C Trennung : Kapillarsäule XTI-5, 30 m x 0,25 mm; Filmdicke 0,25 µm (Fa. Restek, USA) Temperaturprogramm : PCB, HCH und DDT PAK Detektion : 3,5 min 10 °C/min 15 min 50 °C ----------------------> 310 °C 3,5 min 12 °C/min 3 min 5 °C/min 10 min 50 °C ----------------> 190 °C ---------------> 300 °C Automass GC-MS der Fa.Thermo Finnigan GmbH, SIM-Modus, Massen siehe Tabelle 1 Ergebnisse und Diskussion der Daten aus der Wassersäule Isomere des HCH Qualitätsabschätzung (C8-Säulen und Glaskugelschöpfer) Wiederfindungen Die Wiederfindungsrate lag für die C8-Säulen im Mittel zwischen 52 und 69 %, für die Glaskugelschöpfer (GKS) bei 55 bis 69 %. (Anhang Tab. I a/b) Blindwerte In nachfolgender Tabelle 3 sind die höchsten Blindwerte in pg/L und der mittlere prozentuale Anteil des mittleren Blindwertes an der Substanzmenge in der Probe dargestellt. - 14 - Tabelle 3 Höchster Blindwert und mittlerer Anteil bezogen auf die Menge in der Probe Höchster Blindwert (pg/L) % Blindwert (Mittelwert) α - HCH β - HCH γ - HCH C8 41,4 36,7 24,5 GKS 13,0 6,3 4,6 C8 7 6 5 GKS 2 1 1 Im Vergleich der beiden Aufarbeitungsmethoden lag der Blindwert bei den C8-Säulen etwas höher als bei den Glaskugelschöpfern, aber noch unter 8 %. Die einzelnen Blindwerte, die aus Tabelle II im Anhang ersichtlich sind, waren relativ homogen. Reproduzierbarkeit Die Resultate der zur Abschätzung der Qualität der Analysenergebnisse durchgeführten Parallelbeprobungen für die C8-Säulen und Glaskugelschöpfer sind in Tabelle 4 aufgeführt. Tabelle 4 Ergebnisse der Doppelbeprobung für HCH im Oberflächenwasser der Ostsee Mittlere Abweichung der Parallelbeprobung (%) Anzahl der Proben α - HCH β - HCH γ - HCH C8-Säule 14 8* 8 8 GKS 3 4 14 2 * n = 12 Die Übereinstimmung bei den C8-Säulen (8%) ist sehr gut und beweist die hohe Reproduzierbarkeit der Methode. Bei den Glaskugelschöpfern ist mit maximal 14 % die Reproduzierbarkeit als gut einzustufen. Vergleich der Probenahme von Glaskugelschöpfer(GKS) und C8-Säule Die Stationen 213, 271 und 259 wurden parallel mit dem Glaskugelschöpfer und der Filtration über die C8-Säule beprobt, wobei die Probe für die C8-Filtration aus dem Glaspumpensystem des Schiffes entnommen wurde. Die Ergebnisse sind in Abb. 4 dargestellt. - 15 - Prozentueller Anteil der GKS -Konzentrationen an den Konzentrationen der C8-S äule 100 Prozent 80 60 40 20 0 a-HCH b-HCH S tation 213 Abb. 4 S tation 271 g-HCH S tation 259 Ergebnisse des Vergleichs der Probenahme von Glaskugelschöpfer (GKS) und C8-Säule Bei den Konzentrationen von α-HCH an den Stationen 213 und 271 betrug die Abweichung zwischen beiden Methoden < 9 %, während an Station 259 nur eine Übereinstimmung von 72 % vorlag. Für β-HCH und γ-HCH betrugen die Konzentrationen aus den Glaskugelschöpfern an allen Stationen etwa 80 % der Konzentrationen aus den C8-Säulen. Dieses kann auf eine nicht vollständige Extraktion bei den Glaskugelschöpfern zurückzuführen sein. Im Vorjahr wurden eine 2. und 3. Extraktion der Glaskugelschöpfer vorgenommen. Dort wurden Werte von bis zu 30 % der Substanzmenge vorgefunden. Andererseits mögen die höheren Blindwerte bei den C8-Säulen (s. Tab. 3) zu den Unterschieden beigetragen haben. Im Zuge einer Interkalibrierungsfahrt im Juni 2004 mit dem BSH werden die Methoden der HCHProbenahme und Aufarbeitung verglichen und auch der oben geschilderten Problematik nachgegangen. Konzentrationsübersicht In Tabelle 5 sind die HCH-Konzentrationen für das Ostsee-Oberflächenwasser im Februar 2003 als Übersicht dargestellt. - 16 - Tabelle 5 Konzentrationen der HCH-Isomere im Oberflächenwasser der Ostsee im Februar 2003 Westlich Bornholm Bereich Mittel Median pg/L pg/L pg/L 6 362 - 381 372 372 6 411 - 453 442 6 458 - 609 515 n αHCH βHCH γHCH Östlich Bornholm Oderbucht Bereich Mittel Median pg/L pg/L pg/L 5 420 – 531 458 448 1 363 449 5 421 – 492 462 477 1 401 509 5 487 - 585 553 566 1 578 n Bereich n pg/L Im Mittel lagen im Februar 2003 die Konzentrationen für den Wirkstoff (γ-HCH) über denen der Hauptkomponente technischer Hexachlorcyclohexan-Gemische (α-HCH). Die Meerwasserkonzentrationen von α-, β- und γ-HCH waren, verglichen mit anderen organischen Spurenstoffen wie PCB oder DDT, im Oberflächenwasser der Ostsee um zwei bis drei Größenordnungen höher. Vergleich von Oberflächen und Tiefenwasser Die Vertikalverteilung der HCH-Isomere im Wasserkörper wurde anhand der Stationen 213, 259 und 271 untersucht, an denen wie in den Vorjahren eine ausgeprägte Salzsprungschicht angetroffen wurde (Tabelle 6). Tabelle 6 Vertikalverteilung (Oberflächen- und Tiefenwasser) der HCH-Isomere im Ostseepelagial im Februar 2003 an den Stationen 213, 259 und 271 Konzentrationsangaben in pg/L Wassertiefe Station 213 Station 259 Station 271 91m 90m 249m 80m % (von 5m) 5m 420 325 77 β-HCH 421 313 γ-HCH 487 499 Probenahmetiefe 5m α-HCH % (von 5m) 80m % (von 5m) 5m 210m 531 517 97 458 713 156 74 492 583 118 479 743 155 102 552 758 137 585 379 65 - 17 - In der Bornholmsee wurden für α-HCH und β-HCH deutlich niedrigere Konzentrationen unterhalb der Halocline beobachtet, wogegen der Gehalt an γ-HCH im Tiefenwasser annähernd gleich dem des Oberflächenwassers war. In der Gotlandsee (Stationen 259 und 271) waren in diesem Jahr die Konzentrationen im Tiefenwasser deutlich höher als im Oberflächenwasser, eine Ausnahme bildet hier das γ-HCH an Station 271, hier wurde, ähnlich wie im Vorjahr, ein deutlich geringerer Gehalt an γ-HCH vorgefunden. Räumliche Verteilung Die räumliche Verteilung der HCH - Konzentrationen war in diesem Jahr recht homogen, wobei die Konzentrationen im Gebiet westlich Bornholm niedriger als in der Gotlandsee waren (s. Abb. 5). Eine Ausnahme bildet das γ-HCH, hier wurden in der Lübecker Bucht höhere Belastungen beobachtet. In der Pommerschen Bucht war, ähnlich wie im Vorjahr, die Konzentration an γ-HCH höher als in der Arkonasee, allerdings ähnlich hoch wie in der Gotlandsee. Dagegen war die Belastung mit α-HCH annähernd der Konzentrationen im Gebiet westlich Bornholm. Da die Pommersche Bucht nur zu einem Zeitpunkt an einer Station beprobt wurde, kann man keine Aussage darüber treffen, ob hier ein Eintrag an HCH über die Oder erfolgt ist. - 18 - α-HCH pg/l 58 460 57 448 56 531 420 433 370 381 374 370 55 362 375 363 54 10 12 14 16 18 20 γ-HCH pg/l 58 22 24 22 24 585 57 575 56 552 487 55 609 458 566 516 516 502 488 578 54 10 Abb. 5 12 14 16 18 20 Räumliche Verteilung der α-HCH und γ-HCH Konzentrationen in pg/L im Februar 2003 im Ostsee-Oberflächenwasser westlich Bornholm (rot), östlich Bornholm (grün), Pommersche Bucht (braun) - 19 - Zeitreihen Für die Komponenten α-HCH und γ-HCH liegen Konzentrationswerte für die ArkonaseeStation 109 (BMP K4) seit 1975 vor (Gaul 1984, 1991; Brügmann et al. 1992; Dannenberger et al. 1995; Witt et al. 1998 a,b; Wodarg et al. 1999, 2000, 2001; McLachlan et al. 2002). Die 2003er Messwerte zeigen für beide Komponenten Konzentrationen unter 1 ng/L (Abb. 6). Ein rückläufiger Trend wird seit Beginn dieser Messungen für das α-HCH festgestellt. Nach dem starken Rückgang zwischen 1975 und 1990 hatte sich das Konzentrationsniveau, ausgehend von Maximalkonzentrationen von ca. 10 ng/L für α-HCH, auf Werte von ca. 1 ng/L je Komponente in den 90er Jahren eingepegelt. 14 14 12 10 a-HCH 10 a- + g- HCH 8 8 Abb. 6 Feb_2003 Feb_2002 Feb_2001 Feb_2000 Feb_1999 Feb_1998 Feb_1997 Aug_1996 Feb_1995 Nov_1994 Mai_1994 Nov_1993 Nov_1992 Jun_1990 Mai_1988 0 Sep_1987 0 Nov_1985 2 Mai_1983 2 Sep_1980 4 Jun_1978 4 Aug_1976 6 Okt_1975 6 a- + g- HCH (ng/L) g-HCH HCH-Konzentration (ng/L) 12 HCH-Konzentrationen an der Station 109 (Arkonasee) zwischen 1975 und 2003 Für die Abschätzung von langfristigen Trends der Belastung der gesamten Ostsee mit Schadstoffen wurde das Beprobungsraster 1997 umgestellt und der Schwerpunkt seit dem auf die Betrachtung der von direkten Flusseinträgen unbeeinflussten Stationen gelegt. Daraus ergeben sich eine Gruppierung der Stationen in Transekt 1 in der östlichen Gotlandsee sowie Transekt 2 in der Arkona- und Bornholmsee. Diese Probenahmestrategie stellt einen fundierteren Datensatz als bisher dar, um Trendaussagen zu treffen. Der bisher auf diese Weise erhaltene Datensatz umfasst 7 Jahre. Inzwischen scheint die Belastung aller Komponenten rückläufig zu sein (Abb. 7). Die Daten von 2003 bestätigen den in den Vorjahren angedeuteten abnehmenden Trend. Die leichte Zunahme mancher Komponenten in 2003 gegenüber 2002 mag auf die Umstellung der analytischen Methode (s. oben) - 20 - zurückzuführen sein. Weitere Untersuchungen werden klären, ob eine nachträgliche Korrektur der alten bzw. neuen Daten erforderlich ist. Dieser rückläufige Trend wird allgemein darauf zurückgeführt, dass technische Gemische der HCH-Isomere mit einem Anteil von etwa 60-70 % α-HCH zugunsten des reinen Wirkstoffs γHCH (Lindan) in weiten Teilen Europas verdrängt worden ist. Die Tatsache, dass auch die γHCH Konzentrationen jetzt zurückgehen, deutet darauf hin, dass der Einsatz von HCH insgesamt zurückgegangen ist. α-HCH T2 T1 pg/L β-HCH T2 T1 γ-HCH T1 T2 1600 1400 1200 1000 800 600 400 + stabw Abb. 7 mittel - stabw HCH-Mittelwertkonzentrationen in pg/L für Februar 1997-2003 für Transekt 1 (T1) und Transekt 2 (T2) - 21 - 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 0 1997 200 DDT und Metabolite Qualitätsabschätzung Wiederfindungen Die Wiederfindungsraten lagen im Mittel für die partikulären Phase bei 75 % und für die gelöste Phase bei 58 %. Der Bereich erstreckte sich, von einigen Ausreißern abgesehen, von 60 – 105 % (partikulär) bzw. 49 – 64 % (gelöst) (Anhang Tab. III a/b). Blindwerte Die Obergrenzen der Blindwerte lagen für p,p’-DDE bei 80 pg/Probe (Filter) und 92 pg/Probe (XAD) und für p,p’-DDT bei 87 pg/Probe (Filter) und 153 pg/Probe (XAD). Im Durchschnitt betrugen die Blindwerte 18 % (p,p’-DDE) und 15 % (p,p’-DDT) in der partikulären Phase. In der gelösten Fraktion lagen die Blindwerte bei 5 % (p,p’-DDE), 1 % (p,p’-DDD) und 3 % (p,p’-DDT). Der prozentuale Anteil der Filterblindwerte war höher, da die Konzentrationen auf den Filtern geringer waren (Anhang Tab. IV). Der Einfluss der Blindwerte war für die gelöste Konzentration vernachlässigbar, während die Ergebnisse der Filterproben mit einer größeren Unsicherheit behaftet sind. Wenn die Menge in der Probe den dreifachen Blindwert nicht überschritt, wurde das Ergebnis mit „<“ versehen und in der weiteren Auswertung nicht berücksichtigt. p,p’-DDD im Filter und o,p’-DDT in Filter und XAD konnten aufgrund der geringen Konzentrationen nicht quantifiziert werden. Reproduzierbarkeit Auf 8 der 10 Transekte wurden jeweils Parallelproben gewonnen. In Tabelle 7 wird der prozentuale Konzentrationsunterschied zwischen den Probenpaaren - gemittelt über alle Transekte – angegeben. Die Übereinstimmung der Parallelproben war in diesem Jahr (8 –14 %) sehr gut und beweist die Reproduzierbarkeit der Methode. Tabelle 7 Ergebnisse der Doppelbeprobung für DDT und Metabolite im Oberflächenwasser der Ostsee Mittlere Abweichung der Parallelproben (%) Anzahl der Proben p,p’-DDE p,p’-DDD p,p’-DDT Filter 8 14 - 8 XAD 8 8 10 10 - 22 - Konzentrationsübersicht Tabelle 8 gibt eine Übersicht über die Belastung des Oberflächenwassers mit p,p’-DDE und p,p’-DDT. Tabelle 8 DDE und DDT Konzentrationen im Oberflächenwasser der Ostsee im Februar 2003 Westlich Bornholm Filter + XAD Östlich Bornholm n Bereich pg/L Mittelwert pg/L Median pg/L n Bereich pg/L Mittelwert pg/L Median pg/L p,p’-DDE 4 5-7 6 6 5 3-4 4 4 p,p’-DDT 4 7 - 16 13 14 5 9 - 14 11 11 Im Jahr 2003 ist ein leichter Anstieg der p,p’-DDT Konzentrationen für das ganze Untersuchungsgebiet zu erkennen, während die Konzentrationen für p,p’-DDE im Gebiet westlich Bornholm etwas zurück gingen. Die Proben wurden mit dem IPS genommen und es wurde die Summe aus Filter- und XAD-Proben für den Vergleich herangezogen. Räumliche Verteilung Die räumliche Verteilung der Belastung des Oberflächenwassers mit DDT + Metaboliten wird in Abb. 8 dargestellt. Die Transekte sind wie folgt angeordnet: Westliche Ostsee, Arkonasee, Bornholmsee, Östliche Gotlandsee und Pommersche Bucht. Die räumliche Verteilung von DDT + Metaboliten in der partikulären Fraktion ist durch höhere Konzentrationen in der westlichen Ostsee (T1, T2, T10) und Arkonasee (T3) und deutlich höhere Konzentrationen in der Pommersche Bucht (T9) gekennzeichnet. Dies ist vor allem auf die höhere Partikelfracht zurückzuführen, wobei in der Pommerschen Bucht vermutlich ein Eintrag durch die Oder erfolgt war, da hier der Partikelgehalt nicht höher als in der westlichen Ostsee ist. Die gelösten Konzentrationen von p,p’-DDE und p,p’-DDD sind im Untersuchungsgebiet homogen verteilt, eine Ausnahme bildet die Pommersche Bucht mit höheren Konzentrationen beider Komponenten. Bei p,p’-DDT ist, wie im Vorjahr, ein deutlicher räumlicher Trend zu erkennen: die Konzentrationen sind in der westlichen Ostsee am niedrigsten, die höchsten Konzentrationen sind in den Gebieten der Arkonasee und der Bornholmsee zu verzeichnen, eine Abnahme der Konzentrationen erfolgt dann im Gebiet der östlichen Gotlandsee. Die räumliche Verteilung der Gesamtkonzentration ergibt sich aus der räumlichen Verteilung der gelösten Konzentrationen und der Verteilung an das vorhandene SPM. - 23 - pg/l Filter 18 16 14 12 10 8 6 4 2 0 Westlich Bornholm T1 Östlich Bornholm Oderbucht T2 T10 T3 T4 T5 T8 T6 T7 T9 T2 T10 T3 T4 T5 T8 T6 T7 T9 T3 T4 T5 T8 T6 T7 T9 pg/l XAD 18 16 14 12 10 8 6 4 2 0 T1 pg/l XAD+Filter 18 16 14 12 10 8 6 4 2 0 T1 T2 T10 p,p`-DDE Abb. 8 p,p`-DDD p,p`-DDT Konzentrationen von DDT und Metaboliten in der partikulären Phase (oben), gelösten Phase (Mitte) und Summe (unten) - 24 - Zeitreihen In Abb. 9 ist die zeitliche Entwicklung der p,p’-DDE und p,p’-DDT Belastung im Oberflächenwasser nach dem Schema der letzten Jahre dargestellt. Die Daten werden in zwei Gruppen aufgeteilt: T1 ist die Gotlandsee, T2 die Arkonasee und die Bornholmsee. Die Gesamtkonzentrationen (XAD + Filter) werden dargestellt, da eine getrennte Analyse der gelösten und partikulären Fraktionen erst seit 2002 erfolgt und noch nicht ausreichend Daten der gelösten Fraktionen für eine aussagekräftige Darstellung vorhanden sind. Die Konzentrationen von p,p’-DDE waren im Jahr 2003 niedriger als im Vorjahr. Es ist eine geringe Variabilität der Ergebnisse auf beiden Transekten zu verzeichnen. Die Konzentrationen von p,p’-DDT lagen in diesem Jahr auf dem Niveau von 2001. Eine höhere Variabilität auf beiden Transekten ist zu beobachten. p,p´-DDE pg/L p,p´-DDT T1 T2 T1 T2 120 100 80 60 40 + stabw Abb. 9 mittel 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 1997 2003 2002 2001 2000 1999 1998 0 1997 20 - stabw DDT und DDE Mittelwert-Konzentrationen (gesamt) in pg/L Februar 1997 – 2003, Transekt 1 (T1) und Transekt 2 (T2) - 25 - PCB-Kongenere Qualitätsabschätzung Wiederfindungen Die Wiederfindungsraten lagen im Mittel für die partikuläre Phase bei 64 % und für die gelöste Phase bei 51 %. Der Bereich erstreckte sich, von einigen Ausreißern abgesehen, von 42 – 99 % (partikulär) und von 30 - 74 % (gelöst) (Anhang Tab. III a/b). Dies ist zufrieden stellend. Blindwerte In nachfolgender Tabelle sind die höchsten Blindwerte in pg/Probe und der mittlere prozentuale Anteil des mittlere Blindwertes an der Substanzmenge in der Probe dargestellt. Tabelle 9 Höchster Blindwert und mittlerer Anteil bezogen auf die Menge in der Probe BlindwertObergrenze (pg/l) % Blindwert (Mittelwert) PCB 28 PCB 52 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 Filter 221 50 62 42 131 101 91 XAD 136 68 47 22 86 116 41 Filter 73 34 41 30 29 23 26 XAD 5 5 6 4 9 17 10 Bei den niederchlorierten Kongeneren ist der prozentuale Anteil der Filterblindwerte höher, da die Konzentration in den Filtern gering ist (Anhang Tab. IV b). Wenn die Menge in der Probe den dreifachen Blindwert nicht überschritt, wurde das Ergebnis mit „<“ versehen und in der weiteren Auswertung nicht berücksichtigt. Dies betraf in diesem Jahr vor allem die Kongenere 28, 52 und 101 in den Filterproben. Blindwerte sind ein bekanntes Problem bei der Ultraspurenanalytik von PCB, die durch die ubiquitäre Belastung der Umwelt mit diesen Substanzen verursacht wird. Obwohl unsere Blindwerte im Vergleich mit anderen Laboren sehr gut sind, sind sie trotzdem noch ein limitierender Faktor bei der Analytik. Um auch hier eine Qualitätssteigerung zu erreichen, wird die Probenaufbereitung demnächst in ein neugebautes Reinstlabor für die Analytik von organischen Schadstoffen verlagert. - 26 - Reproduzierbarkeit Auf 8 der 10 Transekte wurden Parallelproben gewonnen. In Tabelle 10 wird der prozentuale Konzentrationsunterschied zwischen den Probenpaaren – gemittelt über alle Stationen – angegeben. Tabelle 10 Ergebnisse der Doppelbeprobung für HCB und PCB im Oberflächenwasser der Ostsee Mittlere Abweichung der Parallelbeprobung (%) Anzahl n HCB PCB 28 PCB 52 Filter 8 12 34 18 8 8 10 16 12 XAD 9 14 24 12 16 12 18 22 20 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 * n = 3, In der partikulären Phase lag die Reproduzierbarkeit der höher chlorierten PCB bei 8 - 16 %. Für die Analyse im sub-pg/L Bereich ist dies ein gutes Ergebnis. Für die niedriger chlorierten Kongenere lagen die Werte deutlich höher. Dies ist zum Teil auf die geringen Konzentrationen und die dazu höheren Blindwerte im partikulären Anteil zurückzuführen. Die gelöste Phase weist im Mittel eine Reproduzierbarkeit von 18 % auf. Es ist kein Unterschied zwischen höher und niedriger chlorierten PCB festzustellen. Die Reproduzierbarkeit von 18 % wird als Indiz dafür gewertet, dass die Extraktion dieser Substanzen noch nicht hoch reproduzierbar ist. Konzentrationsübersicht In Tabelle 11 werden die Ergebnisse der PCB-Konzentrationen im Oberflächenwasser der Ostsee zusammengefasst. Tabelle 11 PCB Konzentrationen im Oberflächenwasser der Ostsee im Februar 2003 Westlich Bornholm Filter + XAD n PCB 28 Östlich Bornholm Bereich Mittelwert Median pg/L pg/L pg/L - - - - PCB 52 2 2,1–2,2 2,1 PCB 101 2 1,6–2,3 PCB 118 4 PCB 153 Bereich Mittelwert Median pg/L pg/L pg/L 1 4,8 4,8 2,1 3 1,6-2,3 2,0 1,9 1,9 1 1,2 1,2 1,1-1,4 1,2 1,2 3 0,6-0,9 0,8 0,8 4 2,7-3,6 3,1 3,0 3 1,2-2,2 1,8 2,0 PCB 138 4 2,7-3,1 2,9 2,9 4 1,2-2,2 1,9 2,1 PCB 180 4 1,1-1,3 1,2 1,2 3 0,5-1,0 0,8 0,8 - 27 - n 2,0 Die Konzentrationen lagen im unteren pg/L Bereich oder darunter. Westlich Bornholm war die Belastung geringfügig höher. Räumliche Verteilung Die räumliche Verteilung der Belastung des Oberflächenwassers mit PCB wird in Abb. 10 dargestellt. Die Transekte sind wie folgt angeordnet: Westliche Ostsee, Arkonasee, Bornholmsee, Östliche Gotlandsee und Pommersche Bucht. Die räumliche Verteilung von PCB in der partikulären Fraktion ist durch höhere Konzentrationen in der westlichen Ostsee und der Arkonasee (T1, T2, T10, T3) und sehr hohe Konzentrationen in der Pommerschen Bucht (T9) gekennzeichnet. Eine ähnliche Verteilung wurde für p,p’-DDT, p,p’-DDE und die PAK beobachtet. Aufgrund der niedrigen Konzentrationen in der östlichen Gotlandsee (T5, T6, T7, T8), die oftmals im Bereich der Blindwerte lagen, kann die partikuläre Phase, die an die Partikelfrachten in den verschiedenen Untersuchungsgebieten gebunden ist, nicht zu weiteren Aussagen herangezogen werden. Die gelöste Konzentration ist das wichtigste Maß der PCB-Belastung, da die Bioakkumulation und infolgedessen die Gefährdung der Nahrungskette dadurch gesteuert wird. Die gelösten Konzentrationen waren 2003 recht homogen verteilt, wobei die Konzentrationen in der Arkonasee, der Bornholmsee und in der Pommerschen Bucht geringfügig höher lagen. Die räumliche Verteilung der Gesamtkonzentrationen ergibt sich aus der räumlichen Verteilung der gelösten Konzentrationen und der Verteilung an das vorhandene SPM. - 28 - Filter 7,0 Westlich Bornholm 6,0 Östlich Bornholm pg/l 5,0 Oderbucht 4,0 3,0 2,0 1,0 0,0 T1 T2 T10 T3 T4 T5 T8 T6 T7 T9 T10 T3 T4 T5 T8 T6 T7 T9 T3 T4 T5 T8 T6 T7 T9 XAD 7,0 6,0 pg/l 5,0 4,0 3,0 2,0 1,0 0,0 T1 T2 XAD+Filter 7,0 6,0 pg/l 5,0 4,0 3,0 2,0 1,0 0,0 T1 PCB 28 Abb. 9 T2 PCB 52 T10 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 PCB-Konzentrationen in der partikulären Phase (oben), gelöste Phase (Mitte) und Summe (unten) von Transekt - Beprobung mit IPS - 29 - Zeitreihen Erstmals wird in diesem Jahr eine Zeitreihe für die gelösten Konzentrationen der PCB der Jahre 2001 bis 2003 betrachtet. In Abbildung 10 werden die Transekte T1 (östliche Gotlandsee) und T2 (Arkonasee und Bornholmsee) dargestellt. Für die PCB ergab sich für beide Transekte für die zu untersuchende Komponente ermittelten Mittelwerte ein ähnliches Konzentrationsniveau wie im Jahr 2002. Es ist leichter Abfall der niedriger chlorierten PCB zu sehen, wobei die Variabilität der Konzentrationen im Untersuchungsgebiet Arkonasee-Bornholmsee in diesem Jahr geringer ist. Die höher chlorierten PCB lassen einen leichten Anstieg erkennen; auch hier sind die Konzentrationen in Transekt 2 homogener verteilt. Das Untersuchungsgebiet der östlichen Gotlandsee unterliegt in diesem Jahr einer etwas größeren Variabilität als in den Vorjahren. PCB 28 PCB 52 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 6,00 Östliche Gotlandsee 5,00 3,00 2,00 1,00 - 30 - 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 0,00 2001 pg/L 4,00 PCB 28 PCB 52 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 6,00 Arkonasee - Bornholmsee 5,00 pg/L 4,00 3,00 2,00 1,00 Abb. 10 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 2001 2003 2002 2001 0,00 PCB-Konzentrationen (gelöst) im Februar für die Jahre 2001 – 2003 Transekt 1 (Östliche Gotlandsee) und Transekt 2 (Arkonasee & Bornholmsee) Mittelwert, Standardabweichnung (+/-) PAK Qualitätsabschätzung Wiederfindungen Die Wiederfindungen von Naphthalen, Acenaphthylen, Acenaphthen und Fluoren waren im Mittel unter 50 % und bei Naphthalen sogar unter 25 %. Diese Substanzen wurden daher für die Auswertung nicht berücksichtigt (Anhang Tab. Va/b). Für die anderen Substanzen lagen die Wiederfindungen im Mittel bei 89 % (partikulär) und 55 % (gelöst). Blindwerte In nachfolgender Tabelle 12 sind die höchsten Blindwerte in ng/Probe und der mittlere prozentuale Anteil des mittleren Blindwertes an der Substanzmenge in der Probe dargestellt. - 31 - Tabelle 12 Höchster Blindwert und mittlerer Anteil bezogen auf die Menge in der Probe Phen Anth Fluo Pyr BaA Chr BbF BkF BaP Ind DBA BP Höchster F 4,67 Blindwert (ng/Probe) X 15,91 0,20 2,55 1,62 0,72 11,8 1,85 0,97 0,69 0,88 0,23 1,13 0,66 10,94 5,71 1,76 3,51 1,77 0,59 0,10 0,44 0,14 0,20 22 11 8 6 4 15 3 5 3 2 3 3 2 1 0 1 1 1 1 2 1 3 3 3 F % Blindwert (Mittelwert) X F-Filter; X- XAD Die Blindwerte für die XAD-Kartuschen waren, bis auf eine Ausnahme, niedrig. Im Mittel lagen sie unter 2 % der Substanzmenge. Bei Chrysen ist ein hoher Mittelwert auffällig, der aus einem sehr hohen Wert innerhalb der 5 Blindwerte resultiert. Die Filterblindwerte waren etwas höher; dennoch blieben sie im Mittel unter 10 % der Substanzmenge in den Proben (Anhang Tab VI). Phenanthren bildet hierzu eine Ausnahme, die durch dessen sehr niedrige Konzentrationen auf den Filtern begründet war. Da diese Substanz fast ausschließlich gelöst vorkommt, hatte der hohe Blindwert einen vernachlässigbaren Einfluss auf die Gesamtkonzentrationen. Wenn die Menge in der Probe den dreifachen Blindwert nicht überschritt, wurde das Ergebnis mit „<“ versehen und in der weiteren Auswertung nicht berücksichtigt. Reproduzierbarkeit Auf 9 der 10 Transekte wurden jeweils 2 Parallelproben gewonnen. In Tabelle 13 wird der prozentuale Konzentrationsunterschied zwischen den Probenpaaren – gemittelt über alle Stationen – angegeben. Tabelle 13 Ergebnisse der Doppelbeprobung für PAK im Oberflächenwasser der Ostsee Mittlere Abweichung der Parallelbeprobung (%) Anzahl n Phen Anth Fluo Pyr BaA Chr Filter 7 6*1 10 12 10 12 10*2 12 XAD 9 10 6 6 8 6 6 12 BbF BkF BaP Ind DBA BP 14 12 14 16 14 12 16 16 28 24 *1 n = 4, *2 n = 7 Die Reproduzierbarkeit der PAK auf den Filtern und den XAD-Proben war in diesem Jahr gut. - 32 - Konzentrationsübersicht Die Konzentrationsbereiche, Median und Mittelwerte der PAK im Oberflächenwasser sind, für die Proben Westlich Bornholm und Östlich Bornholm, in Tabelle 14 dargestellt. Tabelle 14 Gesamtkonzentrationen (Filter + XAD) ausgewählter PAK im OstseeOberflächenwasser (Februar 2003) Westlich Bornholm Östlich Bornholm Bereich Mittelwert Median Bereich Mittelwert Median ng/L ng/L ng/L ng/L ng/L ng/L 3 1,47-1,58 1,52 1,49 3 0,64-1,41 0,90 0,66 Ant 4 0,05-0,07 0,06 0,06 5 0,04-0,07 0,05 0,05 Fluo 4 2,61-2,91 2,72 2,69 5 1,34-2,47 2,02 2,08 Pyr 4 0,84-1,03 0,96 0,97 5 0,57-0,93 0,80 0,81 BaA 4 0,09-0,14 0,12 0,13 5 0,10-0,16 0,14 0,15 Chr 4 0,41-0,54 0,49 0,50 5 0,35-0,54 0,49 0,53 BbF 4 0,19-0,27 0,25 0,27 5 0,23-0,32 0,29 0,31 BkF 4 0,06-0,09 0,08 0,09 5 0,09-0,10 0,09 0,10 BaP 4 0,03-0,04 0,04 0,04 5 0,03-0,05 0,04 0,04 Ind 4 0,08-0,09 0,08 0,08 5 0,07-0,10 0,08 0,08 DBA 4 0,01-0,02 0,01 0,01 5 0,01-0,02 0,02 0,01 BP 4 0,07-0,08 0,07 0,07 5 0,06-0,09 0,07 0,07 Gesamt n Phen n Räumliche Verteilung Die räumliche Verteilung wird anhand von einem leichtflüchtigen (Pyren), einem mittelflüchtigen (Benzo(b)fluoranthen) und einem schwerflüchtigen (Benzo(g,h,i)perylen) PAK in Abb. 11 dargestellt. Die Transekte sind wie folgt angeordnet: Westliche Ostsee, Arkonasee, Bornholmsee, Östliche Gotlandsee und Pommersche Bucht. Bei allen drei PAK ist in diesem Jahr eine weitgehend homogene Verteilung der Konzentrationen zu beobachten. Eine Ausnahme bildet die Oderbucht. Hier ist die an SPM gebundene Konzentration um ein Vielfaches höher. Die gelöste Konzentration dagegen ist annähernd gleich dem gesamten Untersuchungsgebiet. Es scheint eine Quelle von an Partikel gebundenen Schadstoffen – sowohl PAK als auch PCB und DDT – in dieser Gegend zu geben. Dafür kommt z.B. die Oder in Betracht. - 33 - 2,0 1,8 0 1 , 1,6 1,4 1,2 8 1 , 6 1 , 4 1 , 1,0 0,8 0,6 0,4 2 1 , 0 0 , 8 0 , 6 0 , 0,2 0,0 4 0 , 2 0 , 0 - 34 - 0,2 0,0 1,2 1,0 0,8 0,6 0,4 1,6 1,4 2,0 1,8 T1 T2 T2 T3 T4 T5 T8 T10 T3 T4 T5 T8 Pyren gesamt - BMP 2003 T10 Pyren gelöst - BMP 2003 T6 T6 T7 T7 T9 T9 1 T1 2 0 0,2 0,0 1 0,6 0,4 T9 T7 T6 T8 T5 T4 T T3 T T10 T 3 T2 T 4 T1 T 5 2,0 1,8 1,6 1,4 1,2 1,0 0,8 Pyren partikulär - BMP 2003 T 8 ng/l ng/l , ng/l ng/l 2 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 T1 T1 T1 T10 T3 T4 T5 T8 T6 T10 T3 T4 T5 T8 T6 T2 T10 T3 T4 T5 T8 T6 Benzo(b)fluoranthen gesamt - BMP 2003 T2 Benzo(b)fluoranthen gelöst - BMP 2003 T2 T7 T7 T7 Benzo(b)fluoranthen - partikulär - BMP 2003 T9 T9 T9 ng/l ng/l Abb. 11 T 6 ng/l T 7 ng/l T 9 ng/l T Pyren, Benzo(b)fluoranthen und Benzo(g,h,i)perylen-Konzentrationen in der gelösten Phase, partikulären Phase und Summe der Transektbeprobungen 0,00 0,05 0,10 0,15 0,20 0,25 0,00 0,05 0,10 0,15 0,20 0,25 0,00 0,05 0,10 0,15 0,20 0,25 T1 T1 T1 T10 T3 T4 T5 T8 T6 T10 T3 T4 T5 T8 T6 T2 T10 T3 T4 T5 T8 T6 Benzo(g,h,i)perylen gesamt - BMP 2003 T2 Benzo(g,h.i)perylen gelöst - BMP 2003 T2 Benzo(g,h,i)perylen partikulär - BMP 2003 T7 T7 T7 T9 T9 T9 Zeitreihen Für die PAK ergab sich für beide Transekte für die je zu untersuchende Komponente ein ähnliches Konzentrationsniveau. Es ist weder ein eindeutiger Anstieg noch ein Abfall der PAK - Belastung von 1997 auf 2003 festzustellen. (s. Abb. 12). Die Variabilität ist am größten für die hydrophoben PAK auf Transekt 2. Dies ist auf die zwischenjährliche Variabilität der SPM Konzentration in der Arkonasee-Bornholmsee zurückzuführen, die mit dem Wetter zusammenhängt. Diese Quelle der Variabilität wird zukünftig reduziert, wenn Daten für gelöste Konzentrationen mehrerer Jahre vorliegen, um Trendaussagen treffen zu können. pg/L Phen Fluo Pyr BaA Chr BbF 3500 Östliche Gotlandsee 3000 2500 2000 1500 1000 500 0 - 35 - BkF BaP Ind BP pg/L Phen Fluo Pyr BaA Chr BbF BkF BaP Ind BP 3500 Arkonasee-Bornholmsee 3000 2500 2000 1500 1000 500 0 Abb. 12 PAK-Konzentrationen im Februar für die Jahre 1997 – 2003 Transekt 1 (Östliche Gotlandsee) und Transekt 2 (Arkonasee & Bornholmsee) Mittelwert, Standardabweichnung (+/-) Forschung und Entwicklung I. Ergebnisse und Diskussion der Sedimentdaten PCB und DDE Im Rahmen der Begleitforschung sollten die Voraussetzungen für ein Sedimentmonitoring untersucht werden. Ziel ist es, geeignete Stationen und Probenahmestrategien, in Abhängigkeit von anderen Sedimentparametern (wie organischer Kohlenstoffgehalt, Korngröße, kleinskalige Verteilung, beckenweite Verteilung oder bodennahe Partikeltransporte) zu entwickeln. Qualitätsabschätzung Die Beprobung von Sedimenten wurde erstmals im diesem Jahr in das Arbeitsprogramm aufgenommen. Zur Absicherung der Datenqualität wurde am Quasimeme-Programm teilgenommen. Blindwerte - 36 - Im Durchschnitt lagen die Blindwerte unter 10 % der Substanzmenge, Ausnahmen bildeten PCB 28 (25 %) und PCB 52 (16 %). Reproduzierbarkeit Die Resultate der zur Abschätzung der Qualität der Analysenergebnisse durchgeführten Mehrfachbestimmungen der Proben von Station 272 und 271 sind in Tabelle 15 aufgeführt.(Anhang Tab. XI a) Tabelle 15 Reproduzierbarkeit der PCB-Bestimmung im Sediment (Juni 2003) % Standardabweichung vom Mittelwert Station PCB 28/31 PCB 52 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 p,p’-DDE 272 2 4 1 7 3 2 3 12 271 5 8 5 5 4 0 6 5 Es ergaben sich, abgesehen von einer Ausnahme, Abweichungen zwischen den Mehrfachbestimmungen, von < 8 %, die in der Umweltanalytik als gut einzustufen sind. Konzentrationsübersicht Tabelle 16 gibt eine Übersicht über die Belastung des Oberflächensediments der Bornholmsee und des Gotlandbeckens im Juni 2003 mit PCB und p,p’-DDE. Tabelle 16 PCB Konzentrationen im Oberflächensediment der Ostsee im Juni 2003 Bornholmsee Filter + XAD n PCB 28 Gotlandsee Bereich Mittelwert Median pg/g pg/g pg/g 1 308 308 - PCB 52 1 278 278 PCB 101 1 533 PCB 118 1 PCB 153 Bereich Mittelwert Median pg/g pg/g pg/g 6 553-1750 964 901 - 6 394-934 737 784 533 - 6 798-1510 1277 1356 401 401 - 6 702-1402 1152 1205 1 992 992 - 6 1435-2833 2130 2142 PCB 138 1 1057 1057 - 6 1335-2959 2039 1809 PCB 180 1 457 457 - 6 619-1431 1024 1000 p,p’-DDE 1 2598 2598 - 6 3614-8248 7045 7545 - 37 - n In der Gotlandsee waren die Konzentrationen deutlich höher als in der Bornholmsee. Die Belastung im Untersuchungsgebiet der Gotlandsee war sehr unterschiedlich. Räumliche Verteilung Die räumliche Verteilung der Belastung des Oberflächensediments mit PCB und p,p’-DDE wird in Abb. 13 und Abb. 14 dargestellt. Die Ergebnisse der Stationsbeprobung sind wie folgt angeordnet: Bornholmsee, Östliche Gotlandsee und Westliche Gotlandsee. Im Gebiet von Bornholm und der Westlichen Gotlandsee sind niedrigere Konzentrationen von PCB und p,p’-DDE anzutreffen, die sich anscheinend auf den niedrigeren Anteil an organischem Kohlenstoff begründen. In der Östlichen Gotlandsee ist der prozentuale Anteil an organischem Kohlenstoff annähernd gleich, wobei hier an der tiefsten Station (271) die höchsten Konzentrationen gemessen werden. 3500 15 Bornholmsee Westliche Gotlandsee Östliche Gotlandsee 3000 pg/g TS 2500 9 2000 1500 6 1000 3 500 0 0 213 260 272 271 270 285 240 Station PCB 28/31 Abb. 13 PCB 52 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 PCB – Konzentrationen im Oberflächensediment der Ostsee - 38 - C-org. (%) % organischer Kohlenstoff 12 9000 Bornholmsee Östliche Gotlandsee Westliche Gotlandsee 15 12 8000 pg/g TS 7000 9 6000 5000 6 4000 3000 3 2000 % organischer Kohlenstoff 10000 1000 0 0 213 Abb.14 260 272 271 270 285 240 p,p’-DDE - Konzentrationen im Oberflächensediment der Ostsee PAK Qualitätsabsicherung Blindwerte Im Durchschnitt lagen die Blindwerte unter 3 % der Substanzmenge, Ausnahmen bildeten hier Phenanthren und Anthracen mit 11 %. Diese sind auf deren niedrige Konzentrationen im Sediment begründet. Beide Substanzen kommen fast ausschließlich gelöst vor. Reproduzierbarkeit Die Resultate der zur Abschätzung der Qualität der Analysenergebnisse durchgeführten Mehrfachbestimmungen der Proben von Station 272 und 271 sind in Tabelle 17 aufgeführt. (Anhang Tab. XI b) Tabelle 17 Reproduzierbarkeit der PAK- Bestimmung (Juni 2003) % Standardabweichung vom Mittelwert Station Phen Anth Fluo Pyr BaA Chr BbF BkF BaP Ind DBA BP 272 4 3 6 2 4 4 3 5 3 2 4 4 271 14 10 11 3 17 16 31 34 11 31 - 28 Die Reproduzierbarkeit der Doppelbestimmung der Probe von Station 272 war mit < 7 % sehr gut, wogegen die Mehrfachbestimmung der Probe von Station 271 Abweichungen einiger - 39 - Substanzen bis zu 34 % aufweist. Das deutet darauf hin, dass eventuell die Extraktion nicht ausreichend war. Hier sollte die Methode durch Nachextraktionen überprüft werden. Konzentrationsübersicht In Tabelle 18 werden die Ergebnisse der PAK- Konzentrationen im Oberflächensediment der Ostsee zusammengefasst. Tabelle 18 Konzentrationen ausgewählter PAK im Oberflächensediment der Ostsee (Juni 2003) Bornholmsee Gesamt n Phen Bereich Mittelwert Gotlandsee Median ng/g ng/g 1 45 45 - Ant 1 10 10 Fluo 1 94 Pyr 1 BaA n Bereich Mittelwert Median ng/g ng/g 6 44-103 72 70 - 6 9-23 18 19 94 - 6 117-310 228 236 74 74 - 6 80-199 159 174 1 48 48 - 6 41-98 80 83 Chr 1 47 47 - 6 53-102 79 81 BbF 1 173 173 - 6 230-673 461 450 BkF 1 73 73 - 6 71-178 130 128 BaP 1 76 76 - 6 74-205 158 167 Ind 1 172 172 - 6 280-716 505 481 DBA 1 35 35 - 6 42-82 63 64 BP 1 152 152 - 6 241-538 420 419 ng/g ng/g Auch die PAK weisen deutlich höhere Konzentrationen im Gebiet der Gotlandsee auf. Eine ähnliche Variabilität wie bei den PCB ist zu erkennen. Räumliche Verteilung Die räumliche Verteilung der Belastung des Oberflächensediments mit PAK wird in Abb. 15 dargestellt. Die Ergebnisse der Stationsbeprobung sind wie folgt angeordnet: Bornholmsee, Östliche Gotlandsee und Westliche Gotlandsee. - 40 - Bei der räumlichen Verteilung der PAK ist eine ähnliche Konzentrationsverteilung wie bei den PCB und p,p’-DDE zu beobachten. Auch hier sind die Konzentrationen teilweise auf den niedrigen Anteil an organischem Kohlenstoff begründet. 800 15 Bornholmsee Östliche Gotlandsee Westliche Gotlandsee 700 12 ng/g TS 500 9 400 6 300 % organischer Kohlenstoff 600 200 3 100 0 0 213 260 272 271 270 285 240 Station Phen Abb. 15 Ant Fluo Pyr BaA Chr BbF BkF BaP Ind DBA BP C-org. (%) PAK- Konzentrationen im Oberflächensediment der Ostsee II. PBDE – Polybromierte Diphenylether Einführung Im Rahmen der Monitoringbegleitforschung sollte geprüft werden, ob mit der am IOW vorhandenen analytischen Ausstattung und Probenahmetechnik polybromierte Diphenylether (PBDE) im Wasser der Ostsee verlässlich nachgewiesen werden können. Diese Substanzklasse ist von potentiell hoher Relevanz für das Ökosystem der Ostsee aufgrund ihrer hohen Persistenz und der hohen Belastung, die in Meeressäugern und Menschen im Ostseeraum gemessen wird und der Tatsache, dass die Belastung mit PBDE in den letzten Jahren deutlich angestiegen ist. - 41 - Bei den PBDE handelt es sich um bromhaltige synthetische Substanzen, die als Flammschutzmittel eingesetzt werden. PBDE werden vorwiegend in der Textil und Kunststoff verarbeitenden Industrie eingesetzt, sie werden in Plastikgehäusen elektrischer Geräte, Möbeln, Kabelisolierungen etc. gefunden. Ein Eintrag in die Umwelt kann schon bei der Herstellung und Verarbeitung, auch bei der Entsorgung und Verbrennung auf der Deponie erfolgen. Durch Verbrennungsprozesse können sich PBDE zersetzen und hoch toxische bromierte Substanzen bilden. PBDE sind durch ihre Persistenz und die Akkumulation über die Nahrungskette in höhere Organismen, sowie durch eine hormonelle Wirksamkeit einiger PBDE ein Grund zur Besorgnis geworden. PDBE wurden in tierischem Gewebe, sowie in Wasser- und Sedimentproben, weit entfernt von ihrer Entstehungsquelle nachgewiesen (Convaci et al, 2003). Die PBDE-Konzentrationen in der Umwelt sind stark angestiegen und nähern sich den PCB-Konzentrationen einiger Regionen der Welt an (www.wwf.de). In der Literatur finden sich keinerlei Angaben zu PBDE-Konzentrationen in der Ostsee. Die einzige Literaturangabe mit Meerwasserkonzentrationen bezieht sich auf Konzentrationen in der Nordsee, welche aus Aufnahmeraten in SPMD welches dort ausgebracht wurde, abgeleitet wurden. Die in dieser Studie ermittelten Werte liegen im Bereich von 0,1 - 1 pg L-1 (Booij et al, 2002). Material und Methoden Zur Entwicklung und Erprobung einer analytischen Methode der PBDE-Analytik in Seewasser wurden 6 Oberflächenwasserproben auf Transekten von der Darßer Schwelle durch die Arkonasee und in die Gotlandsee in einer Tiefe von 1,5 Metern über die Seewasserleitung des Forschungsschiffes „Prof. A. Penck“ genommen. Hierbei kamen die gleichen Probenahmetechniken wie für die PCB im Monitoringprogramm zum Einsatz. Zur Gewinnung von Informationen zur Verteilung der untersuchten Schadstoffe zwischen der gelösten und der partikulären Phase wurde ein in-situ Pumpsystem (IPS) verwendet. Beim IPS wurden die Partikel von einem Glasfaserfilter zurückgehalten, während die gelösten CKW und PAK unter Verwendung von XAD-2-Harz-Kartuschen aus dem Meerwasser extrahiert wurden (Petrick et al. 1988, Schulz et al. 1995). Diese Fraktionen wurden getrennt extrahiert, aufgereinigt und analysiert. In Tabelle 19 sind die Einzelheiten für die einzelnen Probenarten dargestellt. - 42 - Tabelle 19: Transekt Nummer 1 2 3 4 5 6 Feld-Blindwert Probenahme – Details für PBDE Datum Probennahmegebiet Probenvolumen(L) 30.03.2004 30.03.2004 31.03.2004 31.03.2004 31.03.2004 31.03.2004 31.03.2004 Darßer Schwelle Arkona See GotlandSee GotlandSee Arkona See Darßer Schwelle - 426 185 280 192 256 270 - Der Feldblindwert wurde in genau der gleichen Weise wie eine “echte” Probe behandelt, d.h. die XAD-Kartusche und der Filter wurden im Pumpensystem installiert und für die gleiche Zeitdauer wie für eine „echte“ Probe darin belassen, jedoch ohne dass dabei Wasser hindurchgepumpt wurde. Die Filter wurden in Aluminiumfolie verpackt und bei –20°C bis zur Analyse gelagert. Die XAD-Kartuschen wurden bis zur Aufarbeitung bei 4°C gelagert. Aufarbeitung Die Extraktion der XAD-Kartuschen und Filterproben erfolgte wie bereits oben für die PCB und PAK beschrieben. Auch die Aufreinigung war mit der für PCB und PAK bis auf einen weiteren Aufreinigungsschritt durch die Gel Permeations Chromatographie (GPC) identisch. Für diesen GPC Aufreinigungsschritt wurde eine 30 cm lange Glassäule mit einem Innendurchmesser von 20 mm auf 20 cm Füllhöhe mit Bio Beads SX3 in einer Mischung aus Hexan: DCM (7:3) gepackt. Die erste Fraktion (0-120 mL), welche die ungewollten CoExtrakte beinhaltete, wurde verworfen. Die zweite Fraktion (120-300 mL) welche die gesuchten Komponenten enthielt, wurde aufgefangen und vor der Messung am GC-MS auf ein Endvolumen von 50 µL eingeengt. Die Vermessung am GC-MS erfolgte unter den in Tabelle 20 angegebenen Bedingungen. Die verwendeten Ionen sind in Tabelle 21 aufgelistet. - 43 - Tabelle 20: GC-MS Bedingungen zur PBDE Quantifizierung Gaschromatograph: Trace GC der Fa. Thermofinnigan GmbH Injektion: Autosampler CTC A200SE PTV 3 µL Solvent split 1 min. Splitless 4 min. 1 min -------------------------------- 6 min 500C -------- 120C min-1 --------- 3200C Trennung: Kapillarsäule DB-5MS, 30 m x 0.25 mm ID; Filmdicke 0.25 µm (Fa. Agilent, USA) Temperaturprogramm: 500C für 2min 400C min-1 bis 1800C; 2 min 150C min-1 bis 3000C; 15 min Detektion: Automass GC-MS der Fa. Thermo Finnigan GmbH, SIMModus. Tabelle 21: Verwendete Ionen Kongener Verwendete m/z Entsprechendes Ion 2-Mono 3-Mono 4-Mono Interner Standard 2,6-Di 2,4-Di Interner Standard 3,3’-Di 2,4’Di 3,4-Di 3,4’-Di 4,4’-Di Interner Standard 2,4,6-Tri A 248 248 248 268 328 328 304 328 328 328 328 328 336 246 B 250 250 250 270 330 330 306 330 330 330 330 330 338 248 C PBDE_1 PBDE_2 PBDE_3 13C_PCB_28 PBDE_10 PBDE_7 13C_PCB_52 PBDE_11 PBDE_8 PBDE_12 PBDE_13 PBDE_15 13_PCB_101 PBDE_30 D 406 408 (M-Br2+2)+, (M-Br2+4)+, (M+2)+, (M+4)+ PBDE_32 2,4’,6-Tri 246 248 406 408 (M-Br2+2)+, (M-Br2+4)+, (M+2)+, (M+4)+ PBDE_17 2,2’,4-Tri 246 248 406 408 (M-Br2+2)+, (M-Br2+4)+, (M+2)+, (M+4)+ PBDE_25 PBDE_33/28 2,3’,4-Tri 2’,3,4-Tri 2,4,4’-Tri 246 246 248 248 406 406 408 408 (M-Br2+2)+, (M-Br2+4)+, (M+2)+, (M+4)+ (M-Br2+2)+, (M-Br2+4)+, (M+2)+, (M+4)+ PBDE_35 3,3’,4-Tri 246 248 406 408 (M-Br2+2)+, (M-Br2+4)+, (M+2)+, (M+4)+ 13C_PCB_153 PBDE_37 Interner Standard 3,4,4’-Tri 372 246 374 248 406 408 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ 13C_PCB_138 Interner Standard 372 374 M+, (M+2)+ M+, (M+2)+ M+, (M+2)+ (M+2)+, (M+4)+ (M+2)+, (M+4)+ (M+2)+, (M+4)+ (M+2)+, (M+4)+ (M+2)+, (M+4)+ (M+2)+, (M+4)+ (M+2)+, (M+4)+ - 44 - Kongener Verwendete m/z Entsprechendes Ion PBDE_75 2,4,4’,6-Tetra 324 326 482 484 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_49 2,2’,4,5’-Tetra 324 326 482 484 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_71 2,3’,4’,6-Tetra 324 326 482 484 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ 13C_PCB_180 PBDE_47 Interner Standard 2,2’,4,4’-Tetra 406 324 408 326 482 484 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_66 2,3’,4,4’-Tetra 324 326 482 484 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_100 2,2’,4,4’,6-Penta 404 406 562 564 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_119 2,3’,4,4’,6-Penta 404 406 562 564 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_99 2,2’,4,4’,5-Penta 404 406 562 564 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_116 2,3,4,5,6-Penta 404 406 562 564 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_118 2,3’,4,4’,5-Penta 404 406 562 564 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_85 2,2’,3,4,4’-Penta 404 406 562 564 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE_126 3,3’,4,4’,5-Penta 404 406 562 564 (M-Br2+2)+, (M-Br2+4)+, (M)+, (M+2)+ PBDE154 2,2’,4,4’,5,6’-Hexa 482 484 (M-Br2+2)+, (M-Br2+4)+ PBDE_153 2,2’,4,4’,5,5’-Hexa 482 484 (M-Br2+2)+, (M-Br2+4)+ PBDE_138 2,2’,3,4,4’,5’-Hexa 482 484 (M-Br2+2)+, (M-Br2+4)+ PBDE_166 2,3,4,4’,5,6-Hexa 482 484 (M-Br2+2)+, (M-Br2+4)+ PBDE_183 2,2’,3,4,4’,5’,6-Hepta562 564 (M-Br2+4)+, (M-Br2+6)+ PBDE_181 2,2’,3,4,4’,5,6-Hepta 562 564 (M-Br2+4)+, (M-Br2+6)+ PBDE_190 2,3,3’,4,4’,5,6-Hepta 562 564 (M-Br2+4)+, (M-Br2+6)+ Quantifizierung Da keine 13 C markierten PBDE Kongenere zur Quantifizierung durch Isotopen-Verdünnung GC-MS vorhanden waren, wurden die 13C markierten PCB Kongenere, welche für die PCBAnalytik eingesetzt sind, als Interne Standards angewendet (13C PCB 28, 52, 101, 138, 153, 180). Die Quantifizierung erfolgte durch eine 4-Punkt-Kalibrierung. Einzelheiten hierzu finden sich in Tabelle 22. - 45 - Tabelle 22: Kalibrierungsstandards PBDE Calibr. Std. 4 PBDE_1 PBDE_2 PBDE_3 13C_PCB_28 PBDE_10 PBDE_7 13C_PCB_52 PBDE_11 PBDE_8 PBDE_12 PBDE_13 PBDE_15 13_PCB_101 PBDE_30 PBDE_32 PBDE_17 PBDE_25 PBDE_33/28 PBDE_35 13C_PCB_153 PBDE_37 13C_PCB_138 PBDE_75 PBDE_49 PBDE_71 13C_PCB_180 PBDE_47 PBDE_66 PBDE_100 PBDE_119 PBDE_99 PBDE_116 PBDE_118 PBDE_85 PBDE_126 PBDE154 PBDE_153 PBDE_138 PBDE_166 PBDE_183 PBDE_181 PBDE_190 25.0 25.0 25.0 6.4 25.0 25.0 6.4 25.0 25.0 25.0 25.0 25.0 6.4 25.0 25.0 25.0 25.0 50.0 25.0 6.4 25.0 6.4 25.0 25.0 25.0 6.4 25.0 25.0 37.5 37.5 37.5 37.5 37.5 37.5 37.5 50.0 50.0 75.0 50.0 62.5 62.5 62.5 PBDE Calibr. Std. 3 PBDE Calibr. Std. 2 Concentration (pg/ul) 10.0 10.0 10.0 6.4 10.0 10.0 6.4 10.0 10.0 10.0 10.0 10.0 6.4 10.0 10.0 10.0 10.0 20.0 10.0 6.4 10.0 6.4 10.0 10.0 10.0 6.4 10.0 10.0 15.0 15.0 15.0 15.0 15.0 15.0 15.0 20.0 20.0 30.0 20.0 25.0 25.0 25.0 3.5 3.5 3.5 4.5 3.5 3.5 4.5 3.5 3.5 3.5 3.5 3.5 4.5 3.5 3.5 3.5 3.5 7.0 3.5 4.5 3.5 4.5 3.5 3.5 3.5 4.5 3.5 3.5 5.3 5.3 5.3 5.3 5.3 5.3 5.3 7.0 7.0 10.5 7.0 8.8 8.8 8.8 PBDE Calibr. Std. 1 1.0 1.0 1.0 6.4 1.0 1.0 6.4 1.0 1.0 1.0 1.0 1.0 6.4 1.0 1.0 1.0 1.0 2.0 1.0 6.4 1.0 6.4 1.0 1.0 1.0 6.4 1.0 1.0 1.5 1.5 1.5 1.5 1.5 1.5 1.5 2.0 2.0 3.0 2.0 2.5 2.5 2.5 Wiederfindungstest Um mögliche Verluste während der Aufarbeitung/Analytik und Meßartefakte besser einschätzen zu können, wurde ein Wiederfindungstest durchgeführt. Zur Berechnung der Wiederfindungsrate wurden 3 Proben (Transekt No. 1, 5, 6 ) geteilt und eine Hälfte mit 500 1250 pg jedes einzelnen PBDE Kongener versetzt (50 µl mal der Tabelle 22 angegebenen Konzentration für das entsprechende PBDE-Kongener im 10 pg µl-1 Kalibrierungsstandard 3). - 46 - Diese Menge liegt um ein Vielfaches über der für Seewasser aus Literaturangaben geschätzten Konzentration für einzelne PBDE-Kongenere ~ 1 pg L-1. Die XAD-Proben wurden nach der Soxhlet-Extraktion, aber noch vor dem Aufreinigungsschritt mit PBDE Standard versetzt. Die Filter wurden halbiert und eine Hälfte wurde mit PBDE versetzt, bevor beide extrahiert und aufgereinigt wurden. Zu den mit PBDE versetzten XAD Proben wurde der 13 C PCB interne Standard vor dem Extraktionsschritt zugegeben. Sie fungierten daher als „echte“ interne Standards. Bei den mit PBDE versetzten Filterproben wurde der 13C PCB interne Standard-Mix versehentlich jedoch erst nach Extraktion und Aufreinigung der Proben zugegeben. Hier fungierten die 13 C- markierten PCB-Standards daher nicht als interne Standards, sondern vielmehr als Injektionsstandards. Im Nachhinein betrachtet erwies sich dieses Versehen jedoch als glückliche Fügung, da die mit PBDE versetzten XAD-Proben eine Einschätzung der Eignung von 13 C-markierten PCB-Standards als interne Standards für die PBDE-Analytik ermöglichten, wohingegen die mit PBDE versetzten Filter eine Einschätzung der Gesamtverluste an PBDE während der Extraktion und Aufreinigung ermöglichte. Die Wiederfindungsraten wurden dann wie folgt berechnet: % Wiederfindung = (mit PBDE versetzte Probe – „normale“ Probe) / (Menge an PBDE) x 100 Ergebnisse und Disskusion Qualitätsabschätzung Nachweisgrenzen Setzt man die Nachweisegrenze bei einem Verhältnis Signal zu Geräusch von 3:1 fest, so waren die mono- bis hexa- PBDE im Kalibrierungsstandard 1 verlässlich quantifizierbar (das entspricht 3 – 9 pg auf der Säule bei einem Injektionsvolumen von 3 µL). Die hepta- PBDE waren nur in Kalibrierungsstandard 2 quantifizierbar (das entspricht 27 pg auf der Säule bei einem Injektionsvolumen von 3 µL). Abbildung 16 zeigt ausgewählte PBDE-Kongenere im Kalibrierungsstandard 1. - 47 - #1 #2 #10 #30 #3 #7 #32 #11&8 #12&13 #17&25 #33/28 - 48 - #35 #15 #37 #75 #100 #154 #49 #119 #71 #99 #47 #66 #116 #153 #118 #85 #138 - 49 - #126 #166 #181 #183 #190 Abbildung 16: GC-MS SIM Spur für ausgewählte PBDE-Kongenere im Kalibrierungsstandard 1 (mono- bis hexa-PBDEs)und 2 (hepta-PBDEs). Nimmt man diese Werte als grobe Einschätzung der Nachweisgrenzen für die PBDE GC-MS Methode, würde dies einer Nachweisgrenze in einer Probe von 0,6 - 5 pg L-1 entsprechen (250 L Probenvolumen, eingeengt auf ein Endvolumen von 50 µL, 3 µL injiziert). Bei den oben genannten Nachweisgrenzen müssen jedoch zwei Dinge berücksichtigt werden: Für Kalibrierungsstandards werden sie zu hoch eingeschätzt, für die Proben aufgrund ungewollter Co-Extrakte/Matrixeffekte hingegen zu niedrig. Daher sollten die genannten Nachweisgrenzen nur als Näherungswerte betrachtet werden. Wiederfindungstest. Für die tri- und tetra-PBDE wurden trotz der größeren Menge der A und B Massen, die C und D Massen zur Quantifizierung herangezogen, da das Verhältnis Signal/Rauschen in den Proben besser war. - 50 - Abbildung 17: Chromatogramm einer mit PBDE-Standard versetzten Filter-Probe Abbildung 18: Chromatogramm einer mit PBDE-Standard versetzten XAD-Probe. Die Ergebnisse des Wiederfindungstests für die Filter und XAD Proben sind in Tabelle 23 aufgelistet. - 51 - Tabelle 23: Wiederfindung (WFR) %, Standardabweichung (Stabw) und relative Standardabweichung (RSD) für die Wiederfindung der mit PBDE versetzten Filter und XAD-Proben. Filter A or C mass % WFR PBDE_1 PBDE_2 PBDE_3 PBDE_10 PBDE_7 PBDE_11 PBDE_8 PBDE_12 PBDE_13 PBDE_15 PBDE_30 PBDE_32 PBDE_17 PBDE_25 PBDE_33/28 PBDE_35 PBDE_37 PBDE_75 PBDE_49 PBDE_71 PBDE_47 PBDE_66 PBDE_100 PBDE_119 PBDE_99 PBDE_116 PBDE_118 PBDE_85 PBDE_126 PBDE154 PBDE_153 PBDE_138 PBDE_166 PBDE_183 PBDE_181 PBDE_190 40 41 44 67 73 86 50 75 66 72 77 82 83 84 84 88 86 105 98 94 113 65 79 79 88 77 85 77 101 96 95 94 144 nq nq nq XAD B or D mass A or C mass Stabw RSD % WFR Stabw RSD 4 6 6 9 9 10 7 11 9 9 12 14 13 11 16 15 17 31 19 19 17 11 14 16 15 14 18 11 17 22 20 19 119 nq nq nq 11 13 13 14 12 11 13 15 13 13 16 17 15 13 19 17 20 30 20 20 15 17 18 20 17 18 21 14 16 23 21 21 83 nq nq nq 43 48 42 65 72 78 58 68 72 73 78 78 86 85 84 86 82 100 96 94 119 100 81 81 85 78 84 82 111 93 92 92 126 nq nq nq 7 5 6 9 11 11 12 9 9 8 13 13 13 17 15 14 15 22 20 16 19 18 11 12 11 14 13 10 20 20 18 19 28 nq nq nq 15 10 15 14 15 14 20 13 13 11 17 17 15 20 18 17 18 22 21 17 16 18 13 15 13 18 15 12 18 22 19 21 22 nq nq nq B or C mass % WFR Stabw RSD % WFR Stabw RSD nq nq nq 67 83 75 57 70 66 69 66 69 72 69 110 76 72 76 75 85 90 55 70 70 62 69 71 nq 91 76 82 nq nq nq nq nq nq nq nq 9 9 18 14 16 8 9 8 11 9 9 29 7 8 16 12 27 17 10 12 11 15 12 13 nq 20 15 16 nq nq nq nq nq nq nq nq 13 11 24 25 22 12 14 13 16 13 13 26 9 11 21 16 32 19 18 17 15 25 17 18 nq 22 20 19 nq nq nq nq nq nq nq nq 58 63 64 51 62 54 62 69 68 74 73 109 77 71 78 77 70 93 79 70 72 61 70 77 nq 96 78 81 nq nq nq nq nq nq nq nq 16 20 15 0 3 10 5 11 10 15 9 29 6 7 15 13 19 17 14 7 10 16 14 17 nq 24 17 14 nq nq nq nq nq nq nq nq 27 32 23 0 4 18 8 16 15 20 13 27 8 10 19 17 27 18 18 10 14 26 20 22 nq 25 21 17 nq nq nq nq nq Für die Filterproben wurde die ganze Bandbreite der PBDE bis zu und einschließlich der hexabromierten Verbindungen gemessen (Abbildung 17). Da das 13 C PCB interne Standardgemisch nach Extraktion und Aufreinigung der Proben zugegeben wurde, fungierten die einzelnen 13 C-markierten PCB-Verbindungen als Injektionsstandards und die Wiederfindungsraten in % spiegeln die absoluten Verluste der PBDE-Verbindungen wieder. Die Übereinstimmung der 3 Parallelproben war hervorragend mit einer relativen Standardabweichung unter 30 %. Außerdem waren die Mengen an PBDE in den Proben, welche mit zwei verschiedenen Ionen ermittelt worden waren, nahezu identisch – dies spiegelt sich in den ähnlichen Werten der relativen Wiederfindungsraten für eine gegebene - 52 - Verbindung wieder, wenn man diese für beide Ionen bestimmt. Dies weist darauf hin, dass keinerlei Interferenzen die Meßmethoden beeinflussten. Die absoluten Wiederfindungsraten der mono-PBDE lagen bei 40-50 %. Für die di- bis hexaPBDE lagen die Wiederfindungsraten im Bereich von 50 – 120 %. Die einzige Ausnahme bildete PBDE 166. Für diese Verbindung lagen die Wiederfindungsraten deutlich über 100 %; auch war hier eine geringere Übereinstimmung der 3 Parallelproben gegeben. Hier scheinen Interferenzen die Quantifizierung dieser Verbindung beeinträchtigt zu haben. Eine Tendenz von zunehmender Wiederfindung mit zunehmendem Bromierungsgrad wurde deutlich. Die hepta-PBDE konnten nicht nachgewiesen werden, wofür wahrscheinlich die hohe methodische Nachweisgrenze verantwortlich sein dürfte. Zieht man in Betracht, dass die Wiederfindungsraten für die Filter die absoluten Verluste der PBDE wiederspiegeln, so deuten die erhaltenen Ergebnisse darauf hin, dass die angewandte Extraktion und Aufreinigung für die Filter für die PBDE-Analytik angemessen war. Für die XAD-Proben (Abbildung 18) war dies nicht so zufriedenstellend. Die mono-PBDEs wurden nicht quantifiziert, da das Signal/Noise-Verhältnis in diesem Teil des Chromatogrammes zu hoch war. Ähnlich verhielt es sich für PBDE 85, 138 und 166. Die hepta-bromierten PBDE konnten in den mit PBDE versetzten XAD Proben nicht nachgewiesen werden, was wahrscheinlich auf die hohen methodischen Nachweisgrenzen für diese Verbindungen zurückzuführen ist. Für die XAD-Proben wäre eine Änderung der Aufarbeitung nötig. Ansonsten war die Situation ähnlich derer der Filterproben mit Wiederfindungsraten von 51 – 110 %, eine gute Übereinstimmung der 3 Parallelproben und ein Trend zunehmender Wiederfindung mit zunehmender Bromierung. Interessanterweise zeigte die Verwendung von 13 C PCB als Interner Standard keinerlei Verbesserung im Quantifizierungsprozeß. Konzentrationsübersicht Einzelne PBDE-Kongenere konnten in den Filter- oder XAD-Proben nicht verlässlich nachgewiesen werden. Dies würde darauf hindeuten, dass die im Meerwasser vorhandenen Mengen weit unter den oben berechneten Nachweisgrenzen liegen. Dies mag für die höher bromierten Verbindungen vielleicht nicht überraschen, würde für die leichteren Verbindungen - 53 - jedoch bedeuten, dass deren Konzentrationen im Meerwasser – falls vorhanden – unter der pg L-1 Marke liegen. Schlussfolgerung und Ausblick PBDE konnten weder in der partikulären noch in der gelösten Phase im Meerwasser nachgewiesen werden. Der Nachweis von PBDE in Meerwasser würde einer erheblichen Verbesserung der analytischen Methoden bedürfen, um die methodischen Nachweisgrenzen herabzusetzen. Dies gilt insbesondere für die höher bromierten Verbindungen. Eine Herabsetzung der Nachweisgrenze könnte unter anderem erreicht werden durch eine Erhöhung des Probenahmevolumens, eine effizientere Aufreinigung um das Verhältnis Signal/Noise (vor allem für die XAD Proben) zu verbessern, sowie die Anwendung anderer MS Ionisierungstechniken wie z.B. ECNI für die Messung. Das Letztere würde insbesondere zu einer Verringerung der Nachweisgrenzen vor allem für die heptabromierten PBDE führen. Die Verwendung von 13 C markierten PBDE als interne Standards wäre empfehlenswert. Ohne beträchtliche Bemühungen zur Verbesserung der analytischen Methode scheint eine Aufnahme der PBDE als Verbindungsklasse in das existierende BMP Programm derzeit nicht realistisch. Zusammenfassung Die Ergebnisse der Belastung von Ostseewasser mit den organischen Schadstoffen ergaben für das Jahr 2003 ähnliche Konzentrationen wie im Jahr 2002. Insgesamt konnten die deutlich zurückgegangenen Belastungen für HCH (Messreihe seit 1975) und auch für die PCB und DDT (Messreihen seit 1997) bestätigt werden. Für die PAK sowie DDE wurde eine geringere Abnahme beobachtet. Die HCH Konzentrationen (440- 600 pg/L) lagen deutlich höher als die für PCB (1-5 pg/L) und DDT/DDE (3-16 pg/L). Die regionalen Unterschiede waren gering, als Eintragsquelle konnte nur die Oder für partikulär eingetragene Schadstoffe identifiziert werden. - 54 - Im Rahmen der Monitoring Begleitforschung sollte geprüft werden, ob mit der am IOW vorhandenen analytischen Ausstattung und Probenahmetechnik polybromierte Diphenylether (PBDE) im Ostseewasser nachgewiesen werden können. Die Anreicherung aus Seewasser erfolgte mit Festphasenextraktion (XAD-2), die Messung mit GaschromatographieMassenspektrometrie (SIM-Modus). Die Aufarbeitung (Reinigung mit GPC), Quantifizierung und Wiederfindungsraten wurden mit Standardverbindungen optimiert. Die Nachweisgrenzen für PBDE Kongenere im Seewasser lagen zwischen 1-5 pg/L. Sechs Proben aus der Arkona See, Gotland See und von der Darßer Schwelle wurden untersucht, in keiner Probe konnten PBDE oberhalb der Nachweisgrenzen nachgewiesen werden. Im Rahmen von Forschung und Entwicklung sollte auch die Grundlage für ein Sedimentmonitoring studiert werden. Ziel ist es, geeignete Stationen und Probenahmestrategien in Abhängigkeit von den Sedimentparametern (z.B. organischer Kohlenstoffgehalt) zu entwickeln. In 2003 wurden erste Untersuchungen zur beckenweiten Verteilung von PCB, PAK und DDE im Gotlandbecken durchgeführt. Die Belastung der Sedimente mit Schadstoffen war wie erwartet hoch, es zeigte sich eine deutliche Abhängigkeit der Verteilung vom Corg Gehalt. Weitere Untersuchungen in anderen Regionen der Ostsee und besonders auch die kleinskalige Variabilität sollten in den nächsten Jahren Forschungsziel in den Monitoring Arbeitsprogrammen sein. Verzeichnis der Abbildungen Abb. 1 Karte der Probenahmestationen im Februar 2003 Abb. 2 Karte der Probenahmestationen für Sediment im Juni 2003 Abb. 3 Probenahme- und aufarbeitungsschema zur CKW und PAK Bestimmung Abb. 4 Ergebnisse des Vergleichs der Probenahme von Glaskugelschöpfer und C8Säulen Abb. 5 Räumliche Verteilung der α-HCH und γ-HCH Konzentrationen im Februar 2003 im Ostsee-Oberflächenwasser Abb. 6 HCH Konzentrationen an der Station 109 (Arkonasee) zwischen 1975 – 2003 Abb. 7 HCH Mittelwertkonzentrationen in pg/L für Februar 1997 – 2003 für die Transekte 1 und 2 Abb. 8 Konzentrationen von DDT und Metaboliten in der partikulären Phase, gelösten Phase und Summe Abb. 9 PCB-Konzentrationen in der partikulären Phase, gelöste Phase und Summe von Transekt - Beprobung mit IPS - 55 - Abb. 10 PCB-Konzentrationen (gelöst) im Februar für die Jahre 2001 – 2003 Transekt 1 (Östliche Gotlandsee) und Transekt 2 (Arkonasee & Bornholmsee) Abb. 11 Pyren, Benzo(b)fluoranthen und Benzo(g,h,i)perylen-Konzentrationen in der gelösten Phase, partikulären Phase und Summe der Transektbeprobungen Abb. 12 PAK-Konzentrationen im Februar für die Jahre 1997 – 2003 Transekt 1 (Östliche Gotlandsee) und Transekt 2 (Arkonasee & Bornholmsee) Abb. 13 PCB – Konzentrationen im Oberflächensediment der Ostsee Abb. 14 p,p’-DDE – Konzentrationen im Oberflächensediment der Ostsee Abb. 15 PAK – Konzentrationen im Oberflächensediment der Ostsee Abb. 16 GC-MS SIM Spur ausgewählter PBDE Kongenere im Kalibrierungsstandard 1 Abb. 17 Chromatogramm einer mit PBDE - Standard versetzten Filter-Probe Abb. 18 Chromatogramm einer mit PBDE - Standard versetzten XAD-Probe Verzeichnis der Tabellen Tab. 1 Mittels GC-MS-Detektion quantifizierte CKW und PAK Tab. 2 GC-MS-Bedingungen zur CKW und PAK Quantifizierung Tab. 3 Obergrenze Blindwerte und mittlere prozentuale Abweichung für HCH Tab. 4 Ergebnisse der Doppelbeprobung für HCH im Oberflächenwasser der Ostsee Tab. 5 HCH Konzentrationen im Oberflächenwasser der Ostsee Tab. 6 Verteilung der HCH-Isomere im Ostseepelagial im Februar 2003 an den Stationen 213,259 und 271 Tab. 7 Ergebnisse der Doppelbeprobung für DDT und Metabolite im Oberflächenwasser der Ostsee Tab. 8 DDE und DDT Konzentrationen im Oberflächenwasser der Ostsee im Februar 2003 Tab. 9 Obergrenze Blindwerte und mittlere prozentuale Abweichung für PCB Tab. 10 Ergebnisse der Doppelbeprobung für HCB und PCB im Oberflächenwasser der Ostsee Tab. 11 PCB Konzentrationen im Oberflächenwasser der Ostsee im Februar 2003 Tab. 12 Obergrenze Blindwerte und mittlere prozentuale Abweichung für PAK Tab. 13 Ergebnisse der Doppelbeprobung für PAK im Oberflächenwasser der Ostsee Tab. 14 Gesamtkonzentrationen (Filter + XAD) ausgewählter PAK im OstseeOberflächenwasser (Februar 2003) Tab. 15 Reproduzierbarkeit der PCB – Bestimmung im Sediment (Juni 2003) - 56 - Tab. 16 PCB – Konzentrationen im Oberflächensediment der Ostsee im Juni 2003 Tab. 17 Reproduzierbarkeit der PAK – Bestimmung im Sediment (Juni 2003) Tab. 18 Konzentrationen ausgewählter PAK im Oberflächensediment der Ostsee (Juni 2003) Tab. 19 Probenahme - Details für PDBE Tab. 20 GC-MS Bedingungen zur PBDE Quantifizierung Tab. 21 Verwendete Ionen Tab. 22 Kalibrierungsstandards Tab. 23 Wiederfindungsraten, Standardabweichungen und relative Standardab- weichungen für die Wiederfindung der mit PBDE versetzten Filter- und XADProben Anhang Abb. I Aufbau der Filtrationseinheit zur Probenahme der HCH Tab. I a Wiederfindungsraten der HCH der C8-Säulen im Februar 2003 Tab. I b Wiederfindungsraten der HCH der GKS im Februar 2003 Tab. II Blindwerte HCH im Februar 2003 Tab. III a Wiederfindungsraten der partikulären PCB und DDT im Februar 2003 Tab. III b Wiederfindungsraten der gelösten PCB und DDT im Februar 2003 Tab. IV a Blindwerte DDT im Februar 2003 Tab. IV b Blindwerte PCB im Februar 2003 Tab. V a Wiederfindungsraten der partikulären PAK im Februar 2003 Tab. V b Wiederfindungsraten der gelösten PAK im Februar 2003 Tab. VI Blindwerte PAK im Februar 2003 Tab. VII HCH – Konzentrationen im Februar 2003 Tab. VIII DDT – Konzentrationen (gelöst und partikulär) im Februar 2003 Tab. IX a PCB – Konzentrationen (partikulär) im Februar 2003 Tab. IX b PCB – Konzentrationen (gelöst) im Februar 2003 - 57 - Tab. X a PAK – Konzentrationen (partikulär) im Februar 2003 Tab. X b PAK – Konzentrationen (gelöst) im Februar 2003 Tab. XI a Reproduzierbarkeit der PCB-Bestimmung im Sediment (Juni 2003) Tab. XI b Reproduzierbarkeit der PAK-Bestimmung im Sediment (Juni 2003) Tab. XII a PCB und DDE – Konzentrationen im Oberflächensediment der Ostsee (Juni 2003) Tab. XII b PAK – Konzentrationen im Oberflächensediment der Ostsee (Juni 2003) Tab. XIII POC- und Salzgehalte im Februar 2003 Danksagung Die Autoren danken dem Bundesamt für Seeschifffahrt und Hydrographie in Hamburg und Rostock für die Unterstützung der Untersuchungen im Rahmen des Monitoring-Programms. Den Kapitänen und der Besatzung der Forschungsschiffe „A. v. Humboldt“ und „Professor A. Penck“ sind die Autoren für ihren Einsatz bei der Probenahme zu Dank verpflichtet. Literatur Andrulewicz, E., Dahlmann, G., Hägerhäll, B., Witt, G., (1997): Petroleum hydrocarbons. Third periodic assessment of the state of the marine environment of the Baltic Sea 1989-1993. Backround document. Balt.Sea Environ. Proc. No. 64 B. Helsinki, 1997. Axelman, J., Näf, C., Bandh, C., Ishaq, R., Pettersen, H., Zebühr, Y., Broman, D., (1997): Significane of bacteria in marine waters of the distribution of hydrophobic organic contaminants. In: Biological, physico-chemical and biogeochemical dynamics of hydrophobic organic compounds. By Axelman, A., doctoral dissertation, Stockholm University, Sweden. Ballschmiter, K. and Zell, M. (1980): Analysis of chlorinated biphenyls by gas capillary chromatography. Fresenius Z. Anal. Chem. 302, 20-31. Booij K, Zegers B.N, Boon J.P. “Levels of some polybrominated diphenyl ethers (PBDE) flame retardants along the Dutch coast as derived from their accumulation in SPMDs and blue mussels (Mytilus edulis)“. Chemosphere 46 (2002), 683 – 688. Broman, D., Näf, C., Axelman, J., Bandh, C., Pettersen, H., Johnstone, R., Wallberg, P., (1996): Significane of bacteria in marine waters of the distribution of hydrophobic organic contaminants. Environmental Science & technilogy. 30, No. 4 1238-1241. - 58 - Brügmann, L., Gaul, H., Rohde, K.H. and Ziebarth, U. (1992): Regional distribution and temporal trends of some contaminants in the water of the Baltic Sea, Dt. hydrogr. Z. 44, 161183. Covaci, A., Voorspoels, S., de Boer, J. (2003) : Determination of brominated flame retardants, with emhasis on polybrominated diphenyl ethers (PBDEs) in enviromental and human samples – a review. Environmetal International 29, 735-756 Dannenberger, D., Lerz, A. (1995): The distribution of selected chlorinated microcontaminants in Baltic Waters , 1992 to 1994. Dt.hydrogr.Z., 47, No.4 (1995), 301-311. Dannenberger, D. (1995). Chlorierte Kohlenwasserstoffe im Wasserkörper und in Sedimenten der Ostsee 1993 und 1994. Im Auftrag des Bundesamtes für Seeschiffahrt und Hydrographie Hamburg, Rostock, 29 Seiten. Dannenberger, D., Lerz, A. (1996): Chlorierten Kohlenwasserstoffe im Wasserkörper und in Sedimenten der Ostsee. Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschiffahrt und Hydrographie Hamburg, Rostock, 29 Seiten. Gaul, H. (1984) : The distribution of several organochlorine compounds in the Baltic Sea, Dt. Hydrogr. Z. 37, 129-145. Gaul, H. (1991): Temporal and spatial trends of organic micropollutants in sea water of the Baltic sea, North sea and NE-atlantic, ICES, Variability Symp. No.8, Session 1. Kohler et al. (1992): GAIA, Vol.1, no.3, 153-165 Lipiatou, E., Saliot, A. (1991) : Fluxes and transport of anthropogenic and natural polycyclic aromatic hydrocarbons in the western Mediterranean Sea. Mar Chem. 32, 51-71. McLachlan, M.S., Lerz, A., Petersohn, I., Trost, E. (2003): Regionale Verteilung chlorierter Kohlenwasserstoffe (CKW) und polycyclischer aromatischer Kohlenwasserstoffe (PAK) im Pelagial der Ostsee 2002. Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschifffahrt und Hydrographie Hamburg, Rostock, 44 Seiten. Neff, J. M., 1979: Polycyclic aromatic hydrocarbons in the aquatic environment. Applied Science Publishers, London. Petrick, G. Schulz, D. Duinker, J.C. (1988): Clean up of environmental samples by HPLC for analysis of organochlorine compounds by gas chromatography with ECD, J. Chromatogr. 435, 241-248. Schulz, D.E., Petrick, G., Kannan, N., Duinker, J.C. (1995): Distribution of individal chlorobiphenyls in solution and suspension in the Baltic Sea. Mar. Chem. 48 , 245-270. Theobald, N. und Ziebarth, U. (1998): Organic contaminants in the western and southern Baltic Sea in August 1997. In: HELCOM scientific workshop: The effects of the 1997 flood of the Odra and Vistula rivers, Berichte aus dem Bundesamt für Seeschiffahrt und Hydrographie Nr.13. Wania, F., Broman, D., Axelman, J., Näf, C., Agrell, C., (im Druck): A multi-compartmental, multi-basin fugacity model describing the fate of PCBs in the Baltic Sea. In: A system analysis of the changing Baltic Sea. Wulff, F., Larsson, P., Rahm, L. (editors). Witt, G., Dannenberger, D., Lerz, A., Trost, E. (1998a): Verteilung von Erdölkohlenwasserstoffen und chlorierte Kohlenwasserstoffe im Wasserkörper der Ostsee 1996. - 59 - Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschiffahrt und Hydrographie Hamburg, Rostock, 24 Seiten. Witt, G., Lakaschus, S., Bruhn, R. (1998b): Verteilung von Erdölkohlenwasserstoffen und chlorierte Kohlenwasserstoffe im Wasserkörper der Ostsee 1997. Im Auftrag des Bundesamtes für Seeschiffahrt und Hydrographie Hamburg, Rostock, 28 Seiten. Witt, G., (1995): Polycyclic aromatic hydrocarbons in water and sediments of the Baltic Sea. Mar. Pollut. Bull., 31, 237-248. Witt, G., (1995): Distribution of petroleum hydrocarbons in Baltic Sea water, 1992-1994. Dt.hydrogr.Z., 47, No.3 (1995), 231-245. Witt, G., Trost, E. (1996): Polycyclische Aromatische Kohlenwasserstoffe im Wasser der Ostsee. Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschiffahrt und Hydrographie Hamburg, Rostock, 29 Seiten. Wodarg, D., Lerz, A., Trost, E., McLachlan, M.S. (1999): Regionale Verteilung von chlorierten Kohlenwasserstoffen (CKW) und polycyclischen aromatischen Kohlenwasserstoffen (PAK) im Pelagial der Ostsee 1998. Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschifffahrt und Hydrographie Hamburg, Rostock, 43 Seiten. Wodarg, D., Lerz, A., Trost, E., McLachlan, M.S. (2000): Regionale Verteilung von chlorierten Kohlenwasserstoffen (CKW) und polycyclischen aromatischen Kohlenwasserstoffen (PAK) im Pelagial der Ostsee 1999. Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschifffahrt und Hydrographie Hamburg, Rostock, 45 Seiten. Wodarg, D., Lerz, A., Trost, E., McLachlan, M.S. (2001): Regionale Verteilung chlorierter Kohlenwasserstoffe (CKW) und polycyclischer aromatischer Kohlenwasserstoffe (PAK) im Pelagial der Ostsee 2000. Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschifffahrt und Hydrographie Hamburg, Rostock, 47 Seiten. Wodarg, D., Lerz, A., Trost, E., McLachlan, M.S. (2002): Regionale Verteilung chlorierter Kohlenwasserstoffe (CKW) und polycyclischer aromatischer Kohlenwasserstoffe (PAK) im Pelagial der Ostsee 2001. Jahresbericht des Institutes für Ostseeforschung. Im Auftrag des Bundesamtes für Seeschifffahrt und Hydrographie Hamburg, Rostock, 65 Seiten. www.wwf.de. Faktenblätter zu nachgewiesenen Chemikalien Blutprobenuntersuchung von Europaparlamentariern (2004), 2-4 - 60 - in der WWF Anhang Stativ 1 l Schütteltrichter als Wasservorrat 250 200 150 250 ml Satoriuseinheit 100 Teflonadapter C-8 Säule Tefloneinsatz mit Metallhahn Membranpumpe Wittscher Topf Abb. I Aufbau der Filtrationseinheit zur Probenahme der HCH Tabelle I a Wiederfindungsraten (%) des internen Standards für die C8-Säulen im Februar 2003 Mittelwert Stabwn Stabwn% N min max a-HCH 55 15 28 12 36 81 g-HCH 64 14 21 12 45 90 e-HCH 69 11 16 12 50 91 Tabelle I b Wiederfindungsraten (%) des internen Standards für die GKS im Februar 2003 Mittelwert Stabwn Stabwn% N min max a-HCH 52 8 16 6 41 57 g-HCH 63 10 16 6 49 75 e-HCH 69 11 16 6 54 85 Tab. II Blindwerte HCH für die Proben im Februar 2003 a-HCH b-HCH g-HCH pg/L pg/L pg/L BW C8-Säule (Schiff) 31,1 34,7 * BW C8-Säule (Schiff) < 12,0 36,7 * BW C8-Säule (Schiff) < 12,0 27,1 * BW C8-Säule 12,3 < 12,0 < 24,0 BW C8-Säule 20,8 < 12,0 < 24,0 BW C8-Säule 41,4 < 12,0 < 24,0 BW C8-Säule 40,7 12,9 24,5 BW BB 13,0 0,4 4,6 BW Hexan (Kugel) Schiff 2,0 6,3 2,2 BW Hexan (Kugel) Schiff < 2,0 < 0,4 < 2,2 * Quantifizierung nicht möglich Tabelle III a Wiederfindungsraten des externen Standards in der partikulären Phase im Februar 2003 partikuläre Phase Mittelwert Stabwn Stabwn% N min max HCB 42 8 20 5 32 53 PCB 28 54 12 22 5 42 68 PCB 52 61 14 23 5 47 79 PCB 101 66 15 22 5 52 83 PCB 118 67 16 23 5 52 85 PCB 153 78 20 25 5 56 99 PCB 138 73 16 21 5 58 96 PCB 180 67 15 22 5 51 86 pp-DDE 66 18 28 5 46 86 pp-DDT 79 19 24 5 60 105 Tabelle III b gelöste Phase Wiederfindungsraten des externen Standards in der gelösten Phase im Februar 2003 Mittelwert Stabwn Stabwn% N min max HCB 18 4 23 4 13 23 PCB 28 38 10 26 4 30 50 PCB 52 44 12 27 4 31 58 PCB 101 51 15 29 4 34 70 PCB 118 52 16 31 4 31 69 PCB 153 57 16 29 4 36 72 PCB 138 58 15 26 4 40 74 PCB 180 55 16 29 4 35 70 pp-DDE 58 6 11 4 49 64 pp-DDT 57 7 12 3 49 62 Tabelle IV a Blindwerte DDT für die Proben vom Februar 2003 pp-DDE pp-DDD op-DDT pp-DDT pg/Probe pg/Probe pg/Probe pg/Probe BW Filter 46,3 59,3 < 3,0 < 24,0 BW Filter 64,5 < 9,0 < 3,0 < 24,0 BW Filter Schiff 57,1 < 9,0 < 3,0 < 24,0 BW Filter Schiff 80,2 45,6 < 3,0 87,5 BW Filter 41,6 26,8 < 3,0 56,2 BW Filter ausschüttel 42,5 8,9 6,7 73,0 BW Extraktor 19,9 < 9,0 < 3,0 38,4 BW Extraktor 20,8 < 9,0 < 3,0 24,7 BW Extraktor 18,8 < 9,0 < 3,0 39,0 BW Extraktor 23,1 < 9,0 < 3,0 38,2 BW XAD Schiff 52,9 23,9 < 3,0 65,2 BW XAD 36,0 < 9,0 < 3,0 55,2 BW XAD 25,1 < 9,0 7,0 106,8 BW XAD 35,8 9,4 4,5 < 24,0 BW XAD Schiff 91,8 < 9,0 < 3,0 152,8 BW XAD 1. Extr. 47,2 < 9,0 6,5 74,0 BW XAD 2. Extr. 59,8 < 9,0 < 3,0 53,1 BW XAD 32,5 < 9,0 4,5 43,0 BW XAD 17,7 12,6 3,1 27,8 Tabelle IV b Blindwerte PCB für die Proben vom Februar 2003 PCB 28 PCB 52 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 pg/Probe pg/Probe pg/Probe pg/Probe pg/Probe pg/Probe pg/Probe BW Filter 104,1 36,2 39,1 25,1 44,6 32,9 29,1 BW Filter 220,0 33,1 41,0 19,9 64,3 61,5 34,3 BW Filter Schiff 220,5 44,9 39,6 16,6 60,4 49,5 21,8 BW Filter Schiff 102,9 50,2 61,7 41,7 131,1 101,1 90,8 BW Filter 71,0 24,3 24,6 15,4 46,2 41,7 < 8,5 BW Filter ausschüttel 38,8 15,5 49,3 15,7 57,4 51,2 < 8,5 BW Extraktor 27,3 11,0 17,0 < 14,0 21,1 < 32,0 < 8,5 BW Extraktor 24,9 11,3 20,3 < 14,0 18,6 < 32,0 8,6 BW Extraktor 26,4 17,2 22,9 < 14,0 17,5 < 32,0 < 8,5 BW Extraktor 39,4 16,7 13,0 < 14,0 24,9 < 32,0 < 8,5 BW XAD 58,6 19,8 23,2 < 14,0 47,5 63,9 < 8,5 BW XAD 32,6 25,0 20,5 < 14,0 27,6 36,2 21,5 BW XAD 37,8 15,9 20,0 14,9 40,9 46,6 16,8 BW XAD 36,4 < 11,0 < 13,0 < 14,0 < 17,0 < 32,0 < 8,5 BW XAD Schiff 136,9 67,5 47,3 22,6 86,1 83,6 36,2 BW XAD 1. Extr. 41,2 19,2 29,0 18,9 55,6 55,4 41,2 BW XAD 29,7 14,5 16,5 < 14,0 33,6 < 32,0 < 8,5 BW XAD 2. Extr. < 24,0 < 11,0 < 13,0 < 14,0 < 17,0 115,8 < 8,5 BW XAD 27,7 9,3 < 13,0 < 14,0 < 17,0 < 32,0 < 8,5 Tabelle Va Wiederfindungsraten des internen Standards in der partikulären Phase im Februar 2003 Mittelwert Stabwn Naph 29 10 33 14 11 41 Ace 52 9 17 14 39 66 Acy 56 8 13 14 46 65 Fl 62 5 9 14 54 70 Phen 65 7 10 14 51 76 Ant 64 7 11 14 49 74 Fluo 71 7 9 14 58 81 Pyr 68 6 9 14 56 81 BaA 89 9 11 14 74 103 Chr 81 8 9 14 69 94 BbF 101 10 10 14 83 120 BkF 100 10 10 14 82 122 BaP 107 13 12 14 87 135 Ind 111 12 11 14 86 132 DBA 108 14 13 14 77 137 BP 101 12 12 14 75 123 Tabelle Vb Stabwn% N min max Wiederfindungsraten des internen Standards in der gelösten Phase im Februar 2003 Mittelwert Stabwn Stabwn% N min max Naph 16 9 55 17 6 33 Ace 51 27 53 17 23 127 Acy 37 12 33 17 19 64 Fl 45 12 26 17 24 68 Phen 65 14 21 17 41 88 Ant 38 8 21 17 26 51 Fluo 52 13 25 17 28 83 Pyr 52 11 22 17 26 76 BaA 58 12 21 17 41 91 Chr 56 12 21 17 40 88 BbF 61 16 25 17 40 106 BkF 60 14 23 17 42 100 BaP 45 11 24 17 30 76 Ind 62 16 26 17 43 115 DBA 56 16 29 17 35 107 BP 54 12 22 17 36 89 5,97 4,88 5,06 5,92 3,27 4,67 3,88 5,76 10,02 26,30 104,55 26,27 25,91 31,06 129,49 35,04 34,12 124,93 18,17 0,19 0,18 0,22 0,20 0,11 0,14 0,17 0,27 0,28 0,30 0,83 0,95 0,18 0,27 0,57 0,29 0,26 1,02 0,18 0,36 0,46 0,39 0,54 0,27 0,33 0,31 0,41 0,66 1,06 1,77 1,02 0,85 0,79 2,48 0,90 0,48 0,69 0,48 0,82 0,95 1,03 1,16 0,67 0,83 0,67 0,87 1,46 2,65 6,05 2,02 1,97 1,88 8,15 2,45 1,13 1,08 1,13 3,12 3,61 3,92 4,67 2,40 2,85 2,24 3,76 5,71 4,66 15,91 3,94 4,10 5,48 15,33 5,61 3,89 3,44 3,10 Blindwerte PAK für die Proben vom Februar 2003 Naph Acy Ace Fl Phen BW Filter Labor BW Filter Schiff BW Filter Schiff BW Filter Schiff BW Filter aussch. BW Extraktor BW Extraktor BW Extraktor BW Extraktor BW XAD Labor BW XAD Schiff BW XAD Labor BW XAD Labor BW XAD Labor BW XAD Schiff BW XAD Schiff (1. Extr.) BW XAD Schiff (2. Extr) BW XAD Schiff BW XAD Labor Tabelle VI 0,10 0,10 0,13 0,20 0,06 0,06 0,06 0,07 0,08 0,11 0,25 0,07 0,06 0,17 0,66 0,07 0,06 0,05 0,04 Ant 0,80 1,84 1,63 2,55 0,93 0,56 0,38 0,89 0,72 3,32 4,62 2,00 1,48 3,18 10,94 2,37 0,66 0,60 0,67 Fluo Pyr ng/Probe 0,49 0,82 0,87 1,62 0,57 0,23 0,17 0,35 0,35 1,66 2,53 0,80 0,63 1,36 5,71 0,92 0,28 0,30 0,31 0,16 0,07 0,21 0,72 0,13 0,04 0,04 0,05 0,06 0,18 0,28 0,06 0,05 0,29 1,76 0,07 0,05 0,04 0,04 BaA 0,64 11,83 0,93 2,20 0,53 0,21 0,15 0,30 0,38 1,02 1,30 0,42 0,42 0,81 3,51 0,46 0,51 0,46 0,42 Chr 0,44 0,37 0,64 1,85 0,20 0,10 0,08 0,18 0,17 0,64 0,60 0,16 0,17 0,34 1,77 0,16 0,09 0,09 0,10 BbF 0,17 0,47 0,34 0,97 0,25 0,02 0,01 0,04 0,00 0,17 0,20 0,05 0,07 0,16 0,59 0,09 0,04 0,10 0,03 BkF 0,12 0,08 0,15 0,69 0,01 0,01 0,03 0,06 0,06 0,05 0,07 0,01 0,00 0,03 0,10 0,01 0,00 0,00 0,00 BaP 0,26 0,12 0,25 0,88 0,03 0,02 0,02 0,07 0,04 0,10 0,11 0,02 0,03 0,09 0,44 0,02 0,01 0,01 0,01 Ind 0,05 0,02 0,05 0,23 0,01 0,00 0,00 0,00 0,00 0,02 0,02 0,00 0,00 0,02 0,14 0,00 0,00 0,00 0,00 DBA 0,42 0,37 0,46 1,13 0,03 0,03 0,04 0,07 0,06 0,12 0,18 0,03 0,03 0,05 0,20 0,03 0,02 0,01 0,02 BP Tabelle VII HCH - Konzentrationen im Februar 2003 C8-Säule Tiefe a-HCH b-HCH Volumen: 1 L m pg/L pg/L 46 a 5 355,5 409,6 46 b 5 395,0 411,8 Durchschnitt 375,2 410,7 30 a 5 381,1 447,5 30 b 5 366,8 457,8 Durchschnitt 374,0 452,6 109 a 5 382,4 454,5 109 b 5 379,0 446,4 Durchschnitt 380,7 450,5 69 5 370,4 451,0 113 a 5 394,5 471,6 113 b 5 345,1 402,9 Durchschnitt 369,8 437,2 222 a 5 423,8 401,0 222 b 5 442,3 483,8 Durchschnitt 433,0 442,4 213 a 5 443,4 444,2 213 b 5 395,9 397,8 Durchschnitt 419,6 421,0 213 a 80 301,9 311,2 231 b 80 347,4 315,2 Durchschnitt 324,7 313,2 263 a 5 479,6 475,5 263 b 5 416,6 477,8 Durchschnitt 448,1 476,7 271 a 5 455,0 476,3 271 b 5 460,9 481,6 Durchschnitt 457,9 478,9 271a 210 715,6 797,6 271 b 210 709,5 689,0 Durchschnitt 712,5 743,3 259 a 5 530,5 474,6 259 b 5 509,8 Durchschnitt 530,5 492,2 259 a 80 554,4 536,5 259 b 80 480,4 629,3 Durchschnitt 517,4 582,9 OB 4 a 5 397,7 OB 4 b 5 362,6 403,5 Durchschnitt 362,6 400,6 12 a 5 369,7 477,2 12 b 5 354,2 417,0 Durchschnitt 362,0 447,1 g-HCH pg/L 441,8 474,6 458,2 519,7 483,4 501,6 500,0 531,6 515,8 516,0 514,5 460,9 487,7 564,4 566,9 565,6 478,0 496,2 487,1 520,9 477,3 499,1 605,4 545,5 575,4 554,2 616,7 585,4 346,6 411,4 379,0 578,0 526,2 552,1 770,6 744,5 757,5 598,9 556,6 577,7 628,2 590,6 609,4 Tabelle XIII Station Nr. 46 30 69 113 109 213 213 222 263 271 271 259 259 OB4 10 12 POC- und Salzgehalte Februar 2003 POC POC Wassertiefe 2003 2003 m µM C mg/L 10 10 10 10 9,12 0,11 10 6,77 0,08 10 6,37 0,08 85 7,18 0,09 10 10 10 4,44 0,05 200 3,41 0,04 10 5,66 0,07 85 5,9 0,07 10 27,52 0,33 10 10 16,23 0,19 Salz 2003 PSU 11,00 7,64 7,77 7,75 7,57 7,32 18,53 7,08 6,96 7,11 11,86 7,07 10,49 7,16 16,67 14,32 * Quantifizierung nicht möglich Tabelle IX a PCB - Konzentrationen (partikulär) im Februar 2003 partikulär Volumen HCB PCB 28/31 L pg/L pg/L T1 a 189 0,652 <0,788 T1 b 230 0,583 <0,650 Durchschnitt D 0,617 T2 a 256 0,304 <0,663 T2 b 186 * * Durchschnitt D 0,304 T3 a 157 0,515 <1,923 T3 b 185 0,487 <1,068 Durchschnitt D 0,501 T4 a 398 <0,160 <0,354 T4 b 359 <0,161 <0,335 Durchschnitt D T5 a 285 0,418 <0,757 T5 b 286 0,325 <0,610 Durchschnitt D 0,371 T6 a 485 <0,147 <0,324 T6 b 468 <0,118 <0,244 Durchschnitt D T7 a 404 0,198 <0,263 T7 b 337 0,244 <0,687 Durchschnitt D 0,221 T8 a 432 <0,168 1,099 T8 b 262 <0,173 <1,086 Durchschnitt D 1,099 T9 a 199 * * T9 b 138 1,428 <1,464 Durchschnitt D 1,428 T10 a 192 0,676 <0,751 T10 b 193 0,626 <1,223 Durchschnitt D 0,651 0,217 <0,223 0,217 0,529 0,611 0,570 * 1,117 1,117 <0,402 <0,486 0,267 0,317 0,292 <0,316 0,387 0,387 <0,184 <0,195 PCB 52 pg/L 0,560 0,465 0,512 0,462 * 0,462 <0,500 <0,446 0,369 <0,393 0,369 * 1,292 1,292 <0,541 <0,555 <0,176 <0,207 0,174 <0,209 0,174 * 0,777 0,777 0,475 0,472 0,473 0,148 0,149 0,149 <0,157 <0,159 <0,186 <0,175 <0,313 <0,310 <0,696 0,690 0,690 <0,257 <0,259 PCB 118 pg/L 0,541 0,422 0,482 0,373 * 0,373 0,470 0,506 0,488 0,186 <0,180 0,186 <0,205 <0,196 PCB 101 pg/L 0,791 0,592 0,692 <0,476 * 0,683 <0,622 0,683 * 4,223 4,223 1,203 1,206 1,204 PCB 153 pg/L 1,740 1,228 1,484 1,403 * 1,403 1,619 1,483 1,551 0,584 0,604 0,594 0,819 0,706 0,763 0,393 0,403 0,398 <0,423 <0,472 PCB 138 pg/L 1,599 1,293 1,446 1,526 * 1,526 1,673 1,594 1,633 0,644 0,676 0,660 0,743 0,757 0,750 0,481 0,489 0,485 0,472 <0,483 0,472 0,407 0,946 0,676 * 3,852 3,852 1,151 1,307 1,229 0,240 <0,273 0,240 * 1,843 1,843 0,540 0,539 0,540 PCB 180 pg/L 0,633 0,449 0,541 0,641 * 0,641 0,741 0,711 0,726 0,318 0,320 0,319 0,477 0,385 0,431 0,233 0,243 0,238 <0,211 <0,254 * Quantifizierung nicht möglich PCB - Konzentrationen (gelöst) im Februar 2003 Volume HCB PCB 28/31 L pg/L pg/L T1 a 189 9,466 3,598 T1 b 230 7,471 3,925 Durchschnitt D 8,468 3,761 T2 a 256 8,350 3,801 T2 b 186 10,931 4,878 Durchschnitt D 9,641 4,339 T3 a 157 8,027 4,456 T3 b 185 10,342 4,798 Durchschnitt D 9,185 4,627 T4 a 398 10,733 4,004 T4 b 359 9,260 5,680 Durchschnitt D 9,997 4,842 T5 a 285 10,452 3,788 T5 b 286 * * Durchschnitt D 10,452 3,788 T6 a 485 * * T6 b 468 7,603 2,857 Durchschnitt D 7,603 2,857 T7 a 404 8,316 3,020 T7 b 337 9,020 4,117 Durchschnitt D 8,668 3,569 T8 a 432 8,218 3,096 T8 b 262 9,381 4,281 Durchschnitt D 8,800 3,689 T9 a 199 11,124 4,023 T9 b 138 11,152 5,491 Durchschnitt D 11,138 4,757 T10 a 192 8,632 3,582 T10 b 193 7,208 4,175 Durchschnitt D 7,920 3,879 Tabelle IX b gelöst PCB 52 pg/L 1,533 1,546 1,539 1,652 1,786 1,719 1,937 2,088 2,012 1,761 2,260 2,010 1,660 * 1,660 * 1,367 1,367 1,378 1,452 1,415 1,329 1,570 1,449 1,735 2,328 2,032 1,621 1,635 1,628 PCB 101 pg/L 0,982 0,859 0,920 1,286 1,458 1,372 1,539 1,633 1,586 1,126 1,488 1,307 1,066 * 1,066 * 0,798 0,798 0,766 0,884 0,825 0,805 0,861 0,833 1,397 1,371 1,384 1,082 1,078 1,080 PCB 118 pg/L 0,619 0,610 0,614 0,773 0,899 0,836 0,900 0,881 0,890 0,656 0,808 0,732 0,614 * 0,614 * 0,435 0,435 0,569 0,564 0,566 0,574 0,663 0,618 0,921 0,849 0,885 0,689 0,687 0,688 PCB 153 pg/L 1,235 1,128 1,182 1,734 1,998 1,866 2,016 2,140 2,078 1,349 1,506 1,428 1,053 * 1,053 * 0,867 0,867 0,926 1,085 1,006 1,038 1,528 1,283 1,950 1,989 1,970 1,759 1,437 1,598 PCB 138 pg/L 1,004 0,955 0,980 1,359 1,237 1,298 1,156 1,060 1,108 0,963 1,249 1,106 0,702 * 0,702 * 0,748 0,748 0,801 1,014 0,907 0,764 0,885 0,824 1,388 1,550 1,469 1,394 1,028 1,211 0,625 0,625 PCB 180 pg/L 0,532 0,596 0,564 0,578 0,607 0,593 0,555 0,568 0,561 0,398 0,587 0,492 0,464 * 0,464 * 0,300 0,300 0,430 0,510 0,470 0,446 0,608 0,527 0,455 0,636 0,545 * Quantifizierung nicht möglich PAK - Konzentrationen (partikulär) im Februar 2003 Phen Ant Fluo Pyr partikulär Volumen [L] ng/L ng/L ng/L ng/L T1a 189 0,072 0,007 0,160 0,088 T1b 230 0,073 0,006 0,144 0,079 Durchschnitt D 0,073 0,007 0,152 0,083 T2a 256 0,064 0,008 0,112 0,075 T2b 186 * * * * Durchschnitt D 0,064 0,008 0,112 0,075 T3a 157 <0,056 0,004 0,087 0,054 T3b 185 <0,047 0,004 0,075 0,050 Durchschnitt D 0,004 0,081 0,052 T4a 398 0,035 0,002 0,041 0,027 T4b 359 <0,031 0,002 0,056 0,035 Durchschnitt D 0,035 0,002 0,049 0,031 T5a 285 <0,042 0,004 0,063 0,043 T5b 286 <0,039 0,003 0,059 0,041 Durchschnitt D 0,003 0,061 0,042 T6a 485 0,027 0,002 0,041 0,032 T6b 468 0,026 0,002 0,036 0,028 Durchschnitt D 0,027 0,002 0,039 0,030 T7a 404 <0,026 0,002 0,042 0,031 T7b 337 <0,034 0,003 0,042 0,031 Durchschnitt D 0,002 0,042 0,031 T8a 432 0,031 0,003 0,051 0,036 T8b 262 0,062 0,004 0,059 0,039 Durchschnitt D 0,047 0,003 0,055 0,037 T9a 199 * * * * T9b 138 0,326 0,044 0,800 0,562 Durchschnitt D 0,326 0,044 0,800 0,562 T10a 192 0,068 0,005 0,172 0,091 T10b 193 0,065 0,004 0,158 0,091 Durchschnitt D 0,066 0,005 0,165 0,091 Tabelle X a BaA ng/L 0,033 0,027 0,030 0,033 * 0,033 0,024 0,022 0,023 0,014 0,017 0,016 0,024 0,024 0,024 0,017 0,014 0,016 0,016 0,017 0,016 0,018 0,019 0,019 * 0,249 0,249 0,039 0,036 0,038 Chr ng/L 0,106 0,096 0,101 0,096 * 0,096 0,155 <0,068 0,155 0,040 0,053 0,046 0,066 0,058 0,062 0,041 0,035 0,038 0,043 0,043 0,043 0,048 0,049 0,048 * 0,578 0,578 0,127 0,124 0,126 BbF ng/L 0,120 0,105 0,113 0,129 * 0,129 0,117 0,093 0,105 0,068 0,091 0,080 0,109 0,111 0,110 0,076 0,064 0,070 0,076 0,077 0,076 0,089 0,074 0,081 * 0,615 0,615 0,137 0,134 0,136 BkF ng/L 0,040 0,034 0,037 0,042 * 0,042 0,040 0,031 0,035 0,023 0,030 0,027 0,038 0,039 0,038 0,026 0,024 0,025 0,028 0,027 0,028 0,031 0,027 0,029 * 0,211 0,211 0,045 0,044 0,045 BaP ng/L 0,029 0,025 0,027 0,033 * 0,033 0,027 0,021 0,024 0,015 0,019 0,017 0,029 0,032 0,030 0,025 0,021 0,023 0,023 0,024 0,023 0,023 0,020 0,022 * 0,228 0,228 0,030 0,031 0,030 Ind ng/L 0,074 0,064 0,069 0,077 * 0,077 0,077 0,053 0,065 0,046 0,054 0,050 0,076 0,082 0,079 0,056 0,048 0,052 0,059 0,060 0,060 0,063 0,052 0,058 * 0,266 0,266 0,076 0,070 0,073 DBA ng/L 0,012 0,010 0,011 0,013 * 0,013 0,012 0,009 0,010 0,007 0,009 0,008 0,013 0,013 0,013 0,009 0,007 0,008 0,009 0,009 0,009 0,009 0,008 0,009 * 0,058 0,058 0,012 0,010 0,011 BP ng/L 0,067 0,056 0,062 0,073 * 0,073 0,071 0,052 0,062 0,041 0,051 0,046 0,071 0,076 0,074 0,054 0,044 0,049 0,055 0,055 0,055 0,057 0,045 0,051 * 0,235 0,235 0,065 0,061 0,063 * Quantifizierung nicht möglich PAK - Konzentrationen (gelöst) im Februar 2003 Phen Ant Fluo gelöst Volumen [L] ng/L ng/L ng/L T1a 189 1,389 0,041 2,343 T1b 230 1,438 0,040 2,576 Durchschnitt D 1,413 0,041 2,460 T2a 256 1,424 0,053 2,313 T2b 186 1,603 0,064 2,685 Durchschnitt D 1,513 0,058 2,499 T3a 157 1,582 0,060 2,821 T3b 185 1,273 0,060 2,545 Durchschnitt D 1,428 0,060 2,683 T4a 398 1,370 0,063 2,567 T4b 359 1,370 0,071 2,272 Durchschnitt D 1,370 0,067 2,419 T5a 285 0,850 0,052 2,248 T5b 286 0,762 0,054 2,205 Durchschnitt D 0,806 0,053 2,226 T6a 485 * * * T6b 468 0,610 0,034 1,304 Durchschnitt D 0,610 0,034 1,304 T7a 404 0,751 0,041 1,794 T7b 337 0,781 0,042 1,931 Durchschnitt D 0,766 0,041 1,862 T8a 432 0,662 0,044 2,001 T8b 262 0,571 0,041 2,037 Durchschnitt D 0,616 0,043 2,019 T9a 199 1,615 0,063 4,244 T9b 138 1,580 0,069 4,094 Durchschnitt D 1,597 0,066 4,169 T10a 192 1,525 0,042 2,728 T10b 193 1,330 0,042 2,754 Durchschnitt D 1,428 0,042 2,741 Tabelle X b Pyr ng/L 0,718 0,796 0,757 0,856 1,006 0,931 1,045 0,919 0,982 0,889 0,915 0,902 0,873 0,883 0,878 * 0,540 0,540 0,718 0,796 0,757 0,764 0,776 0,770 1,261 1,398 1,330 0,854 0,854 0,854 BaA ng/L 0,055 0,057 0,056 0,092 0,116 0,104 0,119 0,112 0,116 0,127 0,124 0,125 0,134 0,132 0,133 * 0,087 0,087 0,131 0,129 0,130 0,137 0,126 0,131 0,078 0,082 0,080 0,085 0,084 0,084 Chr ng/L 0,295 0,316 0,306 0,381 0,473 0,427 0,500 0,466 0,483 0,475 0,491 0,483 0,474 0,483 0,479 * 0,311 0,311 0,438 0,464 0,451 0,486 0,470 0,478 0,294 0,308 0,301 0,416 0,410 0,413 BbF ng/L 0,078 0,079 0,079 0,121 0,164 0,143 0,174 0,158 0,166 0,190 0,173 0,181 0,226 0,171 0,198 * 0,165 0,165 0,241 0,249 0,245 0,230 0,223 0,227 0,058 0,066 0,062 0,129 0,132 0,130 BkF ng/L 0,025 0,026 0,026 0,036 0,053 0,045 0,056 0,048 0,052 0,055 0,062 0,059 0,064 0,066 0,065 * 0,048 0,048 0,069 0,073 0,071 0,067 0,074 0,070 0,021 0,026 0,023 0,038 0,041 0,040 BaP ng/L 0,003 0,003 0,003 0,008 0,011 0,009 0,012 0,010 0,011 0,015 0,018 0,017 0,019 0,022 0,020 * 0,016 0,016 0,023 0,027 0,025 0,016 0,014 0,015 0,006 0,007 0,006 0,004 0,005 0,005 Ind ng/L 0,008 0,008 0,008 0,009 0,012 0,011 0,017 0,013 0,015 0,015 0,023 0,019 0,020 0,026 0,023 * 0,017 0,017 0,025 0,027 0,026 0,022 0,023 0,023 0,007 0,007 0,007 0,011 0,010 0,011 DBA ng/L 0,001 0,001 0,001 0,002 0,003 0,002 0,004 0,003 0,004 0,004 0,006 0,005 0,005 0,005 0,005 * 0,005 0,005 0,006 0,007 0,006 0,005 0,006 0,006 0,001 0,003 0,002 0,003 0,002 0,002 BP ng/L 0,008 0,006 0,007 0,007 0,011 0,009 0,014 0,012 0,013 0,014 0,023 0,019 0,017 0,024 0,021 * 0,017 0,017 0,022 0,023 0,022 0,018 0,019 0,019 0,006 0,007 0,006 0,008 0,008 0,008 Station 272 272 272 272 Mittelwert Stabw % Stabw 271 271 271 Mittelwert Stabw % Stabw Tabelle XI b Reproduzierbarkeit der PAK - Bestimmung im Sediment (Juni 2003) Phen Ant Fluo Pyr BaA Chr ng/g TS ng/g TS ng/g TS ng/g TS ng/g TS ng/g TS 92 21 207 182 85 85 88 22 248 185 90 84 85 21 224 180 81 90 83 23 233 177 88 81 87 22 228 181 86 85 4 1 15 3 3 3 4 3 6 2 4 4 129 27 296 184 122 124 116 22 262 171 95 100 91 28 228 177 81 84 112 26 262 177 99 103 16 3 28 6 17 17 14 10 11 3 17 16 Tabelle XI a Reproduzierbarkeit der PCB - Bestimmung im Sediment (Juni 2003) PCB_28/31 PCB_52 PCB_101 PCB_118 PCB_153 PCB_138 Station pg/g TS pg/g TS pg/g TS pg/g TS pg/g TS pg/g TS 272 748,8 684,2 1242,3 1265,9 1888,9 2289,5 272 724,4 743,8 1259,7 1100,3 2009,1 2371,3 Mittelwert 736,6 714,0 1251,0 1183,1 1949,0 2330,4 Stabw 12,2 29,8 8,7 82,8 60,1 40,9 % Stabw 2 4 1 7 3 2 271 846,8 894,9 1406,5 1310,4 2686,3 271 905,9 779,5 1564,7 1490,4 2883,6 2972,7 271 955,5 752,5 1558,0 1406,0 2927,5 2945,5 Mittelwert 902,7 809,0 1509,7 1402,2 2832,5 2959,1 Stabw 44,4 61,7 73,0 73,5 104,9 13,6 % Stabw 5 8 5 5 4 0 427 440 14 3 920 688 412 673 207 31 454 BbF ng/g TS PCB_180 pg/g TS 1005,2 948,7 976,9 28,2 3 1500,2 1481,2 1311,5 1431,0 84,9 6 BkF ng/g TS 129 120 121 112 120 6 5 281 214 113 202 69 34 pp-DDE pg/g TS 9222,6 7274,1 8248,3 974,2 12 7925,6 8589,3 8896,0 8470,3 405,0 5 BaP ng/g TS 176 181 178 168 176 5 3 208 189 158 185 21 11 493 468 468 476 12 2 1004 935 448 796 247 31 Ind ng/g TS 66 66 0 0 DBA ng/g TS 65 66 60 65 64 2 4 BP ng/g TS 445 432 409 403 422 17 4 786 570 387 581 163 28 Station 213 260 272 271 270 285 240 PAK - Konzentrationen im Oberflächensediment der Ostsee (Juni 2003) Phen Ant Fluo Pyr BaA Chr ng/g TS ng/g TS ng/g TS ng/g TS ng/g TS ng/g TS 45 10 94 74 48 47 61 16 235 146 81 77 87 22 228 181 86 85 103 23 241 173 95 102 78 23 310 199 98 97 60 16 238 174 80 64 44 9 117 80 41 53 * Quantifizierung nicht möglich Tabelle XII b BbF ng/g TS 173 454 440 673 525 446 230 Tabelle XII a PCB und DDE - Konzentrationen im Oberflächensediment der Ostsee (Juni 2003) PCB 28/31 PCB 52 PCB 101 PCB 118 PCB 153 PCB 138 PCB 180 Station pg/g TS pg/g TS pg/g TS pg/g TS pg/g TS pg/g TS pg/g TS 213 307,5 277,8 533,1 400,8 992,3 1057,4 457,2 260 1749,6 813,8 1341,3 1145,0 2160,4 1763,5 934,8 272 736,6 714,0 1251,0 1183,1 1949,0 2330,4 976,9 271 902,7 809,0 1509,7 1402,2 2832,5 2959,1 1431,0 270 900,0 759,6 1370,5 1227,2 2279,1 1809,1 1157,6 285 939,8 933,6 1391,4 1249,4 2122,5 * 1023,9 240 552,5 394,3 797,7 701,8 1434,6 1335,1 619,2 BkF ng/g TS 73 129 120 178 156 127 71 p,p'-DDE pg/g TS 2598 7117 8248 8470 7973 6843 3616 BaP ng/g TS 76 165 176 159 205 169 74 Ind ng/g TS 172 484 476 716 596 478 280 DBA ng/g TS 35 66 64 59 82 65 42 BP ng/g TS 152 383 422 538 518 416 241 Tabelle XIII Station Nr. 46 30 69 113 109 213 213 222 263 271 271 259 259 OB4 10 12 POC- und Salzgehalte Februar 2003 POC POC Wassertiefe 2003 2003 m µM C mg/L 10 10 10 10 9,12 0,11 10 6,77 0,08 10 6,37 0,08 85 7,18 0,09 10 10 10 4,44 0,05 200 3,41 0,04 10 5,66 0,07 85 5,9 0,07 10 27,52 0,33 10 10 16,23 0,19 Salz 2003 PSU 11,00 7,64 7,77 7,75 7,57 7,32 18,53 7,08 6,96 7,11 11,86 7,07 10,49 7,16 16,67 14,32