Fact Sheet Hanta-Fieber
Werbung

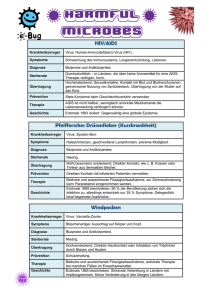
LABOR SPIEZ CH-3700 Spiez Tel Fax +41 33 228 14 00 +41 33 228 14 02 e-mail internet [email protected] www.labor-spiez.ch Hanta-Fieber Erreger: Hantaviren (HV) Hanta-Fieber (HF) wird durch Hantaviren (HV) ausgelöst. HV bilden mit vier weiteren Serogruppen (Bunya-, Phlebo-, Nairound Tospovirus) die Familie der Bunyaviren (nach dem Bunyamwera-Virus benannt, welches in Bunyamwera, Uganda, entdeckt wurde). Der Name Hanta geht auf einen Fluss (Hantaan) in Korea zurück, wo in den 1950er Jahren während des Koreakrieges Tausende UN-Soldaten an einer Infektion mit HV erkrankten. HV bestehen aus einer Lipidhülle, welche drei Nukleokapside (schraubenförmige Proteinhülle) umgibt, und weisen einen Durchmesser von 80-115 nm auf. Das Genom ist eine Negativ-Strang-RNA und besteht aus den drei Segmenten S BILD: Hantavirus (1’700 Basen), M (3’600 Basen) und L (6’500-8’500 Basen). Die Quelle: College of American Pathologists. S-RNA kodiert für ein Nucleokapsidprotein, welches mit RNA Segmenten assoziiert ist, die M-RNA für zwei Glycoproteine (G1 und G2), welche in der Virusmembran eingelagert werden. Die L-RNA kodiert für ein Polypeptid (L), welches als Enzym für die Virusreplikation notwendig ist. Die Viren werden durch Exozytose (Ausschleusen aus der Zelle) freigesetzt. Vorkommen Im Westen wurde HF mit dem Koreakrieg (1951-53) bekannt, als über 3’000 US-Soldaten eine Krankheit mit Fieber und Nierenversagen entwickelten. Die Krankheit wurde als koreanisches hämorrhagisches Fieber bekannt und wies eine Sterberate von 10% auf. Es dauerte aber über 20 Jahre, bis der Krankheitserreger 1976 in Mäusen (Apodemus agararius) isoliert werden konnte. Einige Jahre später bewiesen finnische Forscher eine Verwandtschaft mit einem in Rötelmäusen (Clethrionomys glareolus) isolierten Virus, welches beim Menschen eine epidemische Nephropathie (Nierenerkrankung) verursacht. Obwohl die Symptome denjenigen des koreanischen hämorrhagischen Fiebers sehr ähnlich sind, kommen Hämorrhagien nur selten vor und die Rötelmaus (Clethrionomys glareolus), Sterberate beträgt 0,2%. Erst in den frühen Achtzigerjahren BILD: Quelle: www.hlasek.com wurde der Krankheitserreger, das Puumala-Virus (PUU), isoliert. Seoul- und Hantaan-Viren (in Asien, über 100’000 jährliche Fälle) und Puumala-, Tula- und Dobrava-Viren (Europa) sind die häufigsten HV, welche hämorrhagisches Fieber mit Nierensyndrom (HFRS) verursachen können. Das Dobrava-Virus ist der virulenteste Subtyp in Europa und weist eine Sterberate von 12% auf. In Europa wurde seit dem Frühling 2005 ein vermehrtes Auftreten von HV-Erkrankungen sowohl in Belgien, Deutschland und Frankreich festgestellt. Der in Deutschland dominierende HV-Serotyp PUU verursachte im Jahre 2005 über 300 Fälle. PUU-Infektionen wurden ebenfalls aus einer Reihe anderer europäischer Länder gemeldet, unter anderem aus Schweden, Finnland, Russland, Italien, Tschechische Republik, Slowenien, Kroatien sowie Griechenland. In den USA wurde man im Mai des Jahres 1993 mit den HV konfrontiert, als 32 von 55 jungen Mitgliedern des Navajo Stammes in Neu Mexiko innert kurzer Zeit an einer bisher unbekannten Krankheit verstarben. Das lokale Gesundheitswesen gab der Krankheit den Namen "unexplained adult respiratory distress syndrome" (ARDS). Wenige Wochen später wurde das Virus von Forschern identifiziert und den HV zugeteilt, obwohl es neu mit Lungensymptomen gekoppelt war. Im selben Jahr wurde das Virus Muerto Canyon Virus, später Sin Nombre Virus genannt. Die 2 Krankheit wird heute noch Hantavirus Pulmonary Syndrom (HPS) genannt. Die Gründe für das Auftauchen von HV in Amerika scheinen ein durch El Nino (1991-92) erwärmter Winter und ein regnerischer Frühling zu sein, welche zu einem zehnfachen Anstieg der infizierten Mäusepopulation führten. Übertragung (Transmission) Im Gegensatz zu allen anderen Bunyaviren, welche durch Insekten übertragen werden, sind die Überträger bei HV Nagetiere. Ansteckungsquellen für den in Europa vorkommenden Puumala-Virus sind Urin, Fäzes und Speichel infizierter Rötelmäuse (Clethrionomys glareolus), seltener Brandmäuse (Apodemus agrarius) oder Wanderratten (Rattus norvegicus). Das Habitat der Rötelmäuse sind insbesondere Buchenwälder sowie waldnahe Gebiete. Verschiedene Studien ergaben, dass das Vorkommen von PUU-Infektionen beim Menschen eng mit der Populationsgrösse der Nagetiere korreliert. Die Tierbestände unterliegen zyklischen Veränderungen in Abhängigkeit von Klima und Nahrungsangebot. Durch eine ausgeprägte Buchen- oder Eichenmast, die in Abständen von 6 bis 8 Jahren auftritt, kann es zu einem massiven Anstieg der Mäusepopulation kommen. Dieser Umstand erklärt die regionalen epidemischen Häufungen von Infektionen beim Menschen. Der Mensch infiziert sich durch direkten oder indirekten Kontakt mit den Ausscheidungen infizierter Mäuse. Da HV auch in ausgetrocknetem Zustand, zum Beispiel im Staub, über längere Zeit infektiös bleiben, sind typische Ansteckungswege das Kehren von befallenen Kellern, Speichern oder Holzschuppen. Auch bei Arbeiten an Holzstapeln kann es zur Exposition mit Nagerexkrementen kommen. Weitere Ansteckungsmöglichkeiten sind infektiöse Aerosole sowie der Genuss von Lebensmitteln oder Wasser, welche mit Nagerexkrementen kontaminiert wurden. Obwohl eine HV-Übertragung von Mensch zu Mensch als unwahrscheinlich betrachtet wird, wurde im Jahre 1998 eine solche Transmission mit der Spezies Andes-Virus molekularbiologisch belegt. Krankheitsverlauf (Symptomatik) Nach einer Inkubationszeit von 5 bis 35 Tagen beginnt die Erkrankung charakteristisch für alle Verlausformen mit akutem Fieber (3 bis 4 Tage über 38°C) und einem schweren Krankheitsgefühl mit Kopf-, Muskel- und Flanken- bzw. Rückenschmerzen. Auch Schwindel, Sehstörungen, Bauchschmerzen, Diarrhöen, ein petechiales Exanthem (Hautausschlag mit kleinen Blutungen) und ein trockener Reizhusten können auftreten. Häufig verläuft die Infektion bei uns aber asymptomatisch oder lediglich mit leichten grippeähnlichen Beschwerden und wird selten als HF erkannt. HV werden mit zwei unterschiedlichen Krankheiten assoziiert. In Europa ist das typische Krankheitsbild einer Infektion mit HV vorherrschend die Nephropathia epidemica (NE) mit Nierenfunktionsstörungen bis hin zur dialysepflichtigen (benötigt künstliche Blutreinigung) Niereninsuffizienz. Die NE ist eine mildere Form des hämorrhagischen Fiebers mit renalem Syndrom (HFRS), welches seltener in Europa auftritt. Im amerikanischen und im asiatischen Raum herrschen das HFRS, seltener das HV-Lungensyndrom (HPS) vor. HFRS: Bei einem Teil der Erkrankten kommt es nach wenigen Tagen zu einem Anstieg des Serumkreatinins, einer Proteinurie (Vorhandensein von mehr als 150 mg Eiweiss in einem Liter Harn), konsekutiver Oligurie (ausgeschiedene Menge von Urin pro Tag weniger als 500 ml), Ödemen sowie einem Blutdruckabfall und schliesslich zum akuten Nierenversagen. Typisch sind zudem kolikartige uni- oder bilaterale Flankenschmerzen. Es kommt bereits mit dem Fieberbeginn zum Anstieg der Retentionswerte (Messung der Konzentration von Kreatinin und Harnstoff im Blut), die nach 4 bis 10 Tage ihr Maximum erreichen. Das Ausmass der Nierenfunktioneinschränkung reicht bis zur Dialysepflichtigkeit. Die Letalität der Nephropathia epidemica beträgt etwa 1%. In etwa 16% der Fälle kommt es neben dem akuten Nierenversagen auch noch zur Lungenbeteiligung mit peribronchialen Infiltraten und Pleuraerguss (Flüssigkeitsansammlung um die Lungen). Die Sterberate für HFRS liegt bei 10%. HPS: Das HV-Lungensyndrom (HPS) mit interstitieller (zwischengeweblicher) Pneumonie, schwerem Lungenödem, Schock und ARDS (Atemnotsyndrom der Erwachsenen) wird durch in Europa bisher nicht vorkommende Serotypen ausgelöst. In Amerika und Asien ist die Erkrankung selten, weist aber eine hohe Sterberate von bis zu 50% auf. Fact Sheet Hanta-Fieber LABOR SPIEZ, Februar 2006 3 Nachweis (Diagnostik) Da der behandelnde Arzt mit HV-Erkrankungen in der Regel nicht vertraut ist, wird die korrekte Diagnose selten gestellt. Spezifische IgM-Antikörper können bereits ab dem 4. Krankheitstag mittels ELISA (enzyme-linked immune assay) nachgewiesen werden und überleben bis zu sechs Monaten. Die Diagnose wird durch den Anstieg oder die Konversion der später (zwei Wochen nach Krankheitsbeginn) auftretenden HV-spezifischen IgG-Antikörper bestätigt. In der Routinediagnostik findet die Virus-Anzucht in der Zellkultur kaum Anwendung. Sie ist aus Blut nur kurz nach Krankheitsbeginn erfolgreich und an besondere Vorkehrungen der Laborsicherheitsstufe 3 gebunden. Bei Nephropathie (Nierenerkrankung) und Lungenversagen (insbesondere mit hämorrhagischem Syndrom) wird der qualitative PCR (Polymerase-Kettenreaktion)-Nachweis in den ersten Tagen nach Krankheitsbeginn aus Urin, Leukozyten oder Biopsien durchgeführt. Bei HPS können HV bis 10 Tage nach Krankheitsbeginn mittels PCR nachgewiesen werden. Neue immunchromatographische Nachweismethoden sind weniger aufwendig als ELISA und teilweise sogar sensitiver. Da eine erhebliche Zahl von HV-Infektionen nur eine unspezifische Symptomatik aufweisen, kann angenommen werden, dass die gemeldeten Zahlen nur einen geringen Anteil der Erkrankungen erfassen. Therapie Die Therapie von HV-Infektionen ist in erster Linie symptomatisch. Obwohl schwer verlaufende Fälle erfolgreich mit dem Virostatikum (Medikament, das die Vermehrung von Viren hemmt) Ribavirin behandelt wurden, ist dessen Einsatz laut diversen Studien sehr umstritten. Prävention Kommerzielle Impfstoffe sind aktuell noch nicht erhältlich. Diverse Studien mit HFRS-Patienten wurden erfolgreich mit einem kommerziellen koreanischen Hantaan-Virus-Impfstamm (HantavaxTM) durchgeführt (HJELLE 2002). Der Impfstamm wurde aus Formalin-inaktivierten Viren aus Nagerhirnzellen gewonnen. Die Wirkung ist stark von der Dosierung (Impfwiederholungen) abhängig und eine Langzeitwirkung ist umstritten. Bei weiteren Impfstoffentwicklungen wurden diverse HV gentechnisch verändert. Der Einsatz bei Mäusen ergab viel versprechende Resultate. Neuste Fortschritte wurden bei Nagetieren mit DNAImmunisierung erzielt: Dabei werden Teile von Viren-DNA BILD: U.S. Army Center for Health Promotion and Preveninjiziert, was durch Expression eines oder mehrerer Proteine tive Medicine Quelle: www.cdc.gov eine Immunantwort herbeiführt. Bei Mäusen wurden Interferon-beta-Behandlungen (IFN-β; immunstimulierendes Gewebehormon) als präventive Massnahme mit Erfolg getestet. Die Überlebenschance konnte von 20% auf 90% gesteigert werden. HV-Infektionen können verhindert werden, indem der Kontakt zu Mäusen und deren Ausscheidungen vermieden und bestimmte Verhütungsmassnahmen berücksichtigt werden. An erster Stelle steht die Bekämpfung von Mäusen innerhalb von Wohnungen, Häusern und deren näherer Umgebung. In den USA wird die Mäusepopulation regelmässig auf das Vorhandensein von HV untersucht. Hantaviren als biologische Kampfstoffe HV werden international als potentielle biologische Kampfstoffe eingeteilt, jedoch in der untersten Wichtigkeitsstufe. HV sind weltweit problemlos erhältlich, jedoch sehr schwer über Zellkultur zu züchten. Die Verteilung der HV könnte über ein Aerosol oder über das Ausbreiten von infizierten Mäusen erfolgen. Da infizierte Mäuse nur äusserst selten Symptome zeigen, ist ein gründliches Monitoring unerlässlich. Fact Sheet Hanta-Fieber LABOR SPIEZ, Februar 2006 4 Literatur PADULA P.J. et al.: Hantavirus pulmonary syndrome outbreak in Argentina: molecular evidence for person-to-person transmission of Andes virus. Virology. 1998; 241:323–330. ZHENG L.Y. et al.: Enhancing DNA vaccine potency against hantavirus by co-administration of interleukin-12 expression vector as a genetic adjuvant. Chin Med J (Engl). 2005 Feb 20; 118(4):313-9. HJELLE B.: Vaccines against hantaviruses. Expert. Rev. Vaccines. 2002; 1:373–384. Fact Sheet Hanta-Fieber LABOR SPIEZ, Februar 2006