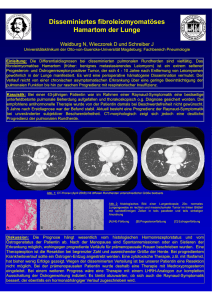
Aus der Klinik für Kleintiere der Veterinärmedizinischen
Werbung

Aus der Klinik für Kleintiere der Veterinärmedizinischen Fakultät der Universität Leipzig Möglichkeiten und Grenzen von Projektionsradiographie und Computertomographie bei der Detektion pulmonaler Rundherde bei Hund und Katze Inaugural-Dissertation zur Erlangung des Grades eines Doctor medicinae veterinariae (Dr. med. vet.) durch die Veterinärmedizinische Fakultät der Universität Leipzig eingereicht von Wolf-Christian Niesterok aus Göttingen Leipzig, 2016 1 Einleitung Mit Genehmigung der Veterinärmedizinischen Fakultät der Universität Leipzig Dekan: Prof. Dr. med. vet. Walter Brehm Betreuer: Prof. Dr. med. vet. Michaele Alef Gutachter: Prof. Dr. med. vet. Dr. h.c. Martin Kramer Klinikum Veterinärmedizin Klinik für Kleintiere Justus-Liebig-Universität Gießen Prof. Dr. med. vet. Michaele Alef Klinik für Kleintiere Veterinärmedizinische Fakultät Universität Leipzig Tag der Verteidigung: 25.10.2016 2 Meiner Mutter 1 Einleitung 4 Inhaltsverzeichnis 1 EINLEITUNG 1 2 LITERATURÜBERSICHT 3 2.1 Neoplasien der Lunge bei Hund und Katze 3 2.2 Bildgebende Diagnostik bei pulmonalen Neoplasien 7 2.2.1 Definition des pulmonalen Rundherdes 13 2.2.2 Detektion von pulmonalen Rundherden in der Projektionsradiographie 2.2.3 Detektion von pulmonalen Rundherden in der CT-Untersuchung 15 17 2.2.4 Stellenwert der computerassistierten Detektion zur Erkennung pulmonaler Rundherde 3 PUBLIKATIONEN 18 20 3.1 Vergleich von Projektionsradiographie und Computertomographie zur Detektion pulmonaler Rundherde bei Hund und Katze 20 3.2 CT-Untersuchungen zur computerassistierten Detektion von pulmonalen Rundherden bei Hund und Katze 28 4 DISKUSSION 36 4.1 Diskussion der Methodik 36 4.2 Diskussion der Ergebnisse 45 5 ZUSAMMENFASSUNG 50 6 SUMMARY 52 7 LITERATURVERZEICHNIS 54 Einleitung 1 Einleitung Die durchschnittliche Lebenserwartung von Hund und Katze ist in den letzten Jahrzehnten deutlich gestiegen (KRAFT 1998). Gleichzeitig ist unbestritten, dass mit zunehmenden Alter die Inzidenz von Tumoren signifikant zunimmt (ADAMS et al. 2010, DOBSON 2013). Auch die Erwartungen der Tierbesitzer an eine adäquate Diagnostik und umfassende Einschätzung der möglichen Therapieoptionen sind zunehmend höher. Zudem sind immer mehr Tierbesitzer dazu bereit, ihr Tier einer anschließenden Tumortherapie wie einer Chemotherapie oder Bestrahlung zu unterziehen (ZENKER 2005, BERGMANN et al. 2011, HILL et al. 2014). Der Früherkennung von pulmonalen Rundherden kommt insofern eine Schlüsselrolle zu, da eine Metastasenbildung Einfluss auf das Staging hat und damit die Prognose und Behandlungsoptionen bei Hund und Katze wesentlich beeinflusst (MILES 1988, MILES et al. 1990, BOLLIGER 2012). In der Humanmedizin ist belegt, dass sowohl in der Projektionsradiographie als auch in der CT-Diagnostik Tumore bei der Erstbefundung häufig übersehen werden (QUEKEL et al. 1999, ARMATO et al. 2002, WHITE et al. 2009). Ähnliches muss nach bisherigem Kenntnisstand insbesondere für die Röntgendiagnostik in der Tiermedizin angenommen werden (SUTER et al. 1974, HOLT et al. 1992, NEMANIC et al. 2006). Für die Detektionsrate bzw. für die Rate an falsch negativen Rundherdbefunden in einer CT-Untersuchung liegen nach derzeitigem Wissensstand keine Daten für die Veterinärmedizin vor. Gegenstand der vorliegenden Arbeit war es unter anderem herauszufinden, ob die klassische Röntgenuntersuchung als Screeningverfahren bei der Suche nach pulmonalen Rundherden überhaupt noch zeitgemäß ist, oder ob sie durch eine CTUntersuchung ersetzt werden sollte. Zusätzlich wurde überprüft, inwiefern eine automatische Rundherddetektion – wie sie vielfach in der Humanmedizin angewendet wird – auch für die Tiermedizin sinnvoll erscheint. Nachfolgend wurden dazu folgende Hypothesen überprüft: 1 Einleitung 1) Die Projektionsradiographie Detektionsrate, um als verfügt primäres über eine ausreichend Screeningverfahren bei hohe pulmonalen Rundherden eingesetzt zu werden. 2) Die CT-Untersuchung ist der Projektionsradiographie bei der Detektion pulmonaler Neoplasien überlegen. 3) Mit dem Einsatz eines computerassistierten Detektionssystems lässt sich auch für die Tiermedizin eine höhere Detektionsrate für pulmonale Rundherde in der CT erzielen. Darüber hinaus werden die Limitationen der einzelnen Verfahren dargestellt. Außerdem wird besprochen, welche Komponenten möglicherweise für eine fehlende Rundherddetektion in der Projektionsradiographie als auch in der computerassistierten Detektion verantwortlich sein könnten. 2 Literaturübersicht 2 Literaturübersicht 2.1 Neoplasien der Lunge bei Hund und Katze Der weitaus größte Teil primärer Lungentumore bei Hund und Katze sind maligne, selten finden sich auch benigne Neoplasien pulmonalen Ursprungs. Daneben präsentieren sich häufig Metastasen eines anderen Primärtumors als neoplastische Rundherde der Lunge (MILES 1988, OGILVIE et al. 1989, MAROLF et al. 2011, BOLLIGER 2012, AARSVOLD et al. 2015). Primäre Lungentumore machen beim Hund und bei der Katze etwa 1 % an neu diagnostizierten Neoplasien aus, wobei bei der Katze der Wert tendenziell etwas darunter liegt (BRODEY und CRAIG 1965, KOBLIK 1986, OGILVIE et al. 1989, PAOLONI et al. 2006). Andere Autoren beziffern die Inzidenz pulmonaler Primärtumore beim Hund mit 1,24 % und bei der Katze mit 0,38 % (MOULTON et al. 1981). Weitere Literaturstellen gehen für Hunde von einer Inzidenz bei primären Lungentumoren von 4,17 Fällen/100 000 Hunden aus, bei Katzen wird eine Inzidenz von 2,2/100 000 Tieren angegeben (RISETTO et al. 2008, BOLLIGER 2012). Im Vergleich zur Humanmedizin, wo die Wahrscheinlichkeit an einem pulmonalen Primärtumor zu erkranken bei 70 Fällen/100 000 Menschen liegt, ist die Inzidenz bei Hund und Katze somit sehr gering (MACEWEN 1990, RISETTO et al. 2008, BOLLIGER 2012). Beim Menschen wird ein großer Teil der Lungentumore auf karzinogene Substanzen (wie z. B. auf Zigarettenkonsum) zurückgeführt (MACEWEN 1990, BOLLIGER 2012). In der Tiermedizin gibt es bislang nur eine Studie, die einen Zusammenhang zwischen Passivrauchen und Lungentumoren bei brachyzephalen Hunden nachweist (REIF et al. 1992). Allerdings werden auch bei Hunden und Katzen primäre Lungentumore in zunehmendem Maße diagnostiziert (MILES 1988, MCNIEL et al. 1997, PAOLONI et al. 2006). Es ist fraglich, ob die tatsächliche Häufigkeit pulmonaler Neoplasien ansteigt: Viele Autoren gehen vielmehr davon aus, dass eine zunehmend bessere diagnostische Aufarbeitung als auch eine erhöhte Lebenserwartung für die steigende Anzahl festgestellter Lungentumore verantwortlich sind (MEHLHAFF und MOONEY 1985, OGILVIE et al. 1989, MCNIEL et al. 1997, PAOLONI et al. 2006). 3 Literaturübersicht In der Literatur wird das Durchschnittsalter des Auftretens primärer Lungentumore beim Hund mit 10-11 Jahren angegeben, für die Katze liegt sie mit 11-12 Jahren etwas höher (BRODEY und CRAIG 1965, MEHLHAFF und MOONEY 1985, KOBLIK 1986, OGILVIE et al. 1989, MCNIEL et al. 1997, RISETTO et al. 2008). Bei Katzen wurde keine Rasseprädisposition für Lungentumore gefunden (GRAF et al. 2016). Ebenso liegen für den Hund nach derzeitigem Kenntnisstand keine Rasseprädispositionen für primäre Lungentumore als solches vor. Ausnahme bildet das histiozytäre Sarkom, welches unter anderem seinen primären Ursprung im Lungengewebe haben kann und eine Rasseprädisposition insbesondere für Berner Sennenhunde, aber auch für Rottweiler und Golden Retriever, aufweist (SHAIKEN et al. 1991, SCHWENS et al. 2011, TSAI et al. 2012). Histologisch besteht der überwiegende Anteil pulmonaler Primärtumore aus Karzinomen, das heißt malignen Neoplasien epithelialen Ursprungs. Pulmonale Karzinome werden eingeteilt nach ihrem Ursprungsgewebe in bronchial, bronchioalveolär und alveolär, sowie nach ihrer Zellmorphologie in Plattenepithelkarzinome, Adenokarzinome und undifferenzierte Karzinome (HAHN und MCENTEE 1997, LOPEZ 2009). Eine einheitliche Nomenklatur der Lungentumore für die Tiermedizin fehlt allerdings (LOPEZ 2009). Adenokarzinome stellen die mit Abstand häufigsten primären pulmonalen Neoplasien bei Hunden und Katzen dar und machen bei beiden Spezies etwa 70 bis 80 % aller malignen primären Lungenneoplasien aus (BRODEY und CRAIG 1965, COHEN et al. 1974, MOULTON et al. 1981, MILES 1988, OGILVIE et al. 1989, MAROLF et al. 2011, AARSVOLD et al. 2015). Daneben sind in absteigender Reihenfolge als maligne Primärtumore das bronchio-alveoläre Karzinom, das Plattenepithelkarzinom und das anaplastische Karzinom der Lunge bei Hund und Katze bedeutsam (MILES 1988, OGILVIE et al. 1989, BOLLIGER 2012). Letzteres ist selten und zeigt eine hohe Metastasierungsrate von 90 bis 100 % der Fälle (BRODEY und CRAIG 1965, BOLLIGER 2012). Im Unterschied zu Hund und Katze tritt beim Menschen als häufigster Primärtumor der Lunge das Plattenepithelkarzinom auf (BOLLIGER 2012). Sarkome der Lunge sind im Gegensatz zu malignen epithelialen Primärtumoren der Lunge bei Hund und Katze sehr selten (MOULTON et al. 1981, KOBLIK 1986, OGILVIE et al. 1989, HAHN und MCENTEE 1997). Einzelbeschreibungen von primären pulmonalen Sarkomen beinhalten ein primäres pulmonales Osteosarkom assoziiert mit einer hypertrophen 4 Literaturübersicht Osteopathie, ein pulmonales Chondrosarkom und ein pulmonales Fibrosarkom assoziiert mit einer Spirocerca lupi Infektion (SEILER 1979, STEPHENS et al. 1983, WELLER et al. 1992, RISETTO et al. 2008, BOLLIGER 2012). Auch benigne primäre pulmonale Neoplasien bilden eher die Ausnahme. Hierzu zählen insbesondere Adenome oder Zubildungen des Bindegewebes (BRODEY und CRAIG 1965, MOULTON et al. 1981, OGILVIE et al. 1989, WATSON et al. 1993, RISETTO et al. 2008). Unter den Fallberichten finden sich als benigne Veränderungen eine Beschreibung von zwei Hamartomen (WATSON et al. 1993). Eine spezielle und relativ seltene Tumorentität stellt die pulmonale lymphomatoide Granulomatose (syn. angioinvasives Lymphom) dar, das auch vermehrt bei Tieren jungen und mittleren Alters auftritt (OGILVIE et al. 1989). Diese Neoplasie kommt unter zahlreichen Synonymen auch beim Menschen vor. Die Ursache ist bis heute ungeklärt. Diskutiert wird ein immunmediiertes Geschehen (POSTORINO et al. 1989, BERRY et al. 1990, FITZGERALD et al. 1991, RISETTO et al. 2008). Die klinischen Symptome eines pulmonalen Primärtumors sind oft unspezifisch oder asymptomatisch: Hauptsymptome bei der Katze umfassen unspezifische Anzeichen wie Anorexie und Inappetenz sowie pulmonale Symptome (insbesondere Husten). Knapp 10 % der Katzen mit pulmonalem Primärtumor erscheinen symptomlos (BALLEGEER et al. 2002, AARSVOLD et al. 2015). Beim Hund wird am häufigsten ein seit Wochen bis Monaten bestehender Husten beschrieben, die nächst häufigeren Symptome sind Dyspnoe und Lethargie (BOLLIGER 2012). Bei bis zu 30 % der Hunde und Katzen treten keine für einen Lungentumor spezifische Symptome auf, so dass diese mitunter einen Zufallsbefund bei der Abklärung anderer Fälle darstellen (BOLLIGER 2012). Generell metastasieren maligne Primärtumore der Lunge häufig. Metastasierungen können hämatogen, lymphogen, kanalikulär oder transpleural erfolgen (BOLLIGER 2012). Häufiger als bei anderen Karzinomen kommt es zur extrathorakalen Metastasierung. Eine Sonderform nimmt hierbei das Lungen-Zehen-Syndrom der Katze ein. Dabei kommt es ausgehend von einem pulmonalen Primärtumor zu einer metastatischen Läsion des Krallenbeines oder zum Befall des Weichteilgewebes des Ballens, das dann zu einem sekundären Knochenbefall führt (BOLLIGER 2012). Therapeutisch ist die chirurgische Exzision bei primären pulmonalen Neoplasien in der Regel das Mittel 5 Literaturübersicht der Wahl. Insbesondere dann, wenn es sich um einen einzelnen Herd handelt (BOLLIGER 2012). Neben Primärtumoren der Lunge sind auch metastatische Veränderungen zu erwarten. Die Inzidenz von Tumoren insgesamt – und damit auch die Wahrscheinlichkeit metastatische Prozesse in der Lunge vorzufinden – ist bei Hund und Katze ungleich höher als das Vorliegen von Primärtumoren (BOLLIGER 2012). Insgesamt wird bei den Neoplasien im Allgemeinen von einer steigenden Anzahl an diagnostizierten Fällen bei Hund und Katze ausgegangen (MEHLHAFF und MOONEY 1985, DOBSON 2013). Im Gegensatz zu den meisten primären Lungentumoren betreffen metastatische Läsionen der Lunge das interstitielle Gewebe und nicht Alveolen und Bronchien, so dass respiratorische Symptome insgesamt sehr selten zu erwarten sind (BOLLIGER 2012). Bei Hunden zeigt sich, dass große Rassen und Riesenrassen wesentlich früher an Neoplasien sterben als kleine und mittelgroße Rassen (ADAMS et al. 2010). Darüber hinaus beschreiben Studien Rasseprädispositionen für einzelne Neoplasien (SHAIKEN et al. 1991, BONNETT et al. 2005, SCHWENS et al. 2011, TSAI et al. 2012, DOBSON 2013). Neben den verschiedenen Rasseprädispositionen scheinen wiederum bei den einzelnen Tumorarten deutlich unterschiedliche Metastasierungsneigungen zu bestehen (MILES et al. 1990, OTONI et al. 2010, EBERLE et al. 2011, BOLLIGER 2012). Zu den beiden Tumorarten mit einer frühen und häufigen Metastasierung in die Lunge werden bei Hund und Katze das Schilddrüsenkarzinom und das Übergangszellkarzinom der Harnblase gezählt. Die Metastasierungswahrscheinlichkeit des Übergangszellkarzinoms wird mit einer Spanne von ca. 25 bis 75 % angegeben (BOLLIGER 2012). Die dritthäufigste Metastasierungswahrscheinlichkeit hat das Mammakarzinom mit einer Spanne von etwa 5 bis 50 % (BAUMANN et al. 2004, BOLLIGER 2012). Daneben ist eine hohe Metastasierungsrate für das Hämangiosarkom und das Osteosarkom des Hundes belegt (MILES et al. 1990, EBERLE et al. 2011, BOLLIGER 2012). Alle übrigen Neoplasien weisen laut Literatur eine Metastasierungswahrscheinlichkeit unter 10 % auf (BOLLIGER 2012). In den meisten Fällen metastasieren Tumore von anderen Organsystemen in die Lunge. Ausnahmen bilden die hypertrophe Osteopathie (Akropachie) und das Lungen-Zehen-Syndrom der Katze (KESSLER et al. 2007, BOLLIGER 2012). Auch 6 Literaturübersicht für Lungentumore des Menschen ist diese sogenannte Akrometastasierung bekannt (BOLLIGER 2012). Beim Lungen-Zehen-Syndrom der Katze zeigt sich klinisch häufig eine Weichteilschwellung und Entzündungserscheinungen im Krallenbereich (GOTTFRIED et al. 2000, BOLLIGER 2012). Der genaue Pathomechanismus für diesen ungewöhnlichen Metastasenort ist nicht bekannt (BOLLIGER 2012). 2.2 Bildgebende Diagnostik bei pulmonalen Neoplasien Ziel der bildgebenden Diagnostik der Lunge ist es, eine Einschätzung über die Ausdehnung und den möglichen Ursprung pulmonaler Rundherde zu erhalten, um daraus weitere diagnostische Schritte ableiten zu können. Insgesamt gibt es einzelne Befunde oder eine Kombination von Befunden, die einen Hinweis darauf liefern können, ob es sich bei pulmonalen Rundherden um einen Primärtumor oder um Metastasen handelt. So sind im Vergleich zu Primärtumoren Metastasen öfter schärfer begrenzt, häufiger multifokal in den Lungenlappen verteilt und verursachen im Gegensatz zu den meisten pulmonalen Primärtumoren eher selten eine Dislokation oder Obstruktion eines Bronchus (SUTER et al. 1974, MILES 1988, BOLLIGER 2012). Die Inzidenz von röntgenologisch sichtbaren Metastasen bei vorhandenem Primärtumor wurde in einer Untersuchung an 76 Hunden mit 33 % angegeben (LANG et al. 1986). Primäre Lungentumore stellen sich beim Hund – und etwas unregelmäßiger auch bei der Katze – bezüglich der Lokalisation klassischerweise als einzelner Rundherd oder Masse in den kaudalen Lungenlappen dar (MEHLHAFF und MOONEY 1985, KOBLIK 1986, MILES 1988, OGILVIE et al. 1989, HAHN und MCENTEE 1997, BALLEGEER et al. 2002, KESSLER et al. 2007, MAROLF et al. 2011). Die Prädilektion der primären Lungentumore für die kaudalen Lungenlappen macht je nach Literatur bis zu 80 % aus (AARSVOLD et al. 2015). Zusätzlich scheint nach der Literatur mehrheitlich der rechte kaudale Lungenlappen häufiger betroffen zu sein als der linke (MILES 1988, BALLEGEER et al. 2002, MAROLF et al. 2011, AARSVOLD et al. 2015). Einige Autoren gehen allerdings davon aus, dass dies aufgrund des größeren Volumens des rechten kaudalen Lungenlappens im Vergleich zum linken kaudalen Lungenlappen zustande kommt (MILES 1988). Einzelne Autoren hingegen 7 Literaturübersicht fanden in ihrer Untersuchung zwar ebenfalls eine Prädisposition für die kaudalen Lungenlappen, aber keine Prädilektion für den rechten oder den linken Lungenlappen (BALLEGEER et al. 2002). Beim Menschen wird der hilusnahe Bereich als wahrscheinlichster Ort für die Lokalisation von Primärtumoren angegeben (MOULTON et al. 1981, MEHLHAFF und MOONEY 1985). Vereinzelt wird insbesondere der rechte Oberlappen der Lunge als Prädilektionsstelle pulmonaler Primärtumoren angesprochen. Allerdings ist zu bedenken, dass beim Menschen – anders als das Adenokarzinom bei Hund und Katze - als häufigster Lungentumor das Plattenepithelkarzinom vorkommt (BOLLIGER 2012). Eine besondere Prädilektionsstelle ist für das pulmonale histiozytäre Sarkom beschrieben, welches typischerweise im rechten mittleren Lungenlappen lokalisiert ist (BOLLIGER 2012, TSAI et al. 2012). Zusätzlich weist das histiozytäre Sarkom für Berner Sennenhunde eine im Vergleich zu anderen Rassen über 200-fach höhere Inzidenz auf (SHAIKEN et al. 1991, SCHWENS et al. 2011). Bei solchen Patienten können die Bildgebungsmerkmale zusammen mit dem Signalement und einer entsprechenden Klinik einen deutlichen Hinweis auf die zu Grunde liegende Tumorentität liefern (SHAIKEN et al. 1991, SCHWENS et al. 2011, BOLLIGER 2012, TSAI et al. 2012). Solche deutlichen Befundkombinationen sind jedoch eher selten und sollten nicht als absolute Kriterien angesehen werden. Primärtumore sind meist relativ scharf abgegrenzt und gehen oft mit einer Veränderung der involvierten Bronchien im Sinne von Dislokationen oder Obstruktionen derselben einher (AARSVOLD et al. 2015). Daneben finden sich häufig kavitäre Veränderungen im Zentrum, die von den Autoren histologisch als Zentralnekrose oder Pseudonekrose angesprochen werden (BALLEGEER et al. 2002, MAROLF et al. 2011). Mineralisationen hingegen stellen kein konstantes Merkmal für pulmonale Primärtumore dar. Nach Kontrastmittelgabe zeigen die pulmonalen Neoplasien im CT größtenteils (ca. 60 %) eine geringgradige bis mittelgradige inhomogene Kontrastmittelanreicherung (MAROLF et al. 2011). Weder mithilfe der Röntgen- noch der CT-Untersuchung kann eine sichere Korrelation zwischen der histologischen Diagnose des pulmonalen Primärherdes und den morphologischen Bildgebungsmerkmalen hergestellt werden (HAHN und MCENTEE 1997). Auch wenn in mindestens 50 % der Fälle pulmonale Primärtumore 8 Literaturübersicht als gut begrenzte singuläre Rundherde im kaudalen Lungenlappen erscheinen, so gibt es doch eine Vielzahl an Überschneidungen und variablen Befunden, so dass eine definitive Diagnose über den Ursprung eines pulmonalen Rundherdes im Regelfall nur über eine histologische Absicherung zu erreichen ist (HAHN und MCENTEE 1997, KESSLER et al. 2007, LANG und BRÜHSCHWEIN 2008, AARSVOLD et al. 2015). Beispielsweise liegen pulmonale Primärtumore bei der Katze neben der Gestalt eines Rundherdes häufig als lobuläre Konsolidierungen vor (BALLEGEER et al. 2002). Daneben beschreiben einzelne Autoren in Anlehnung an die Humanmedizin für das bronchio-alveoläre Karzinom des Hundes neben der solitären Form ebenfalls eine pneumonische sowie eine diffus auftretende Form (MAROLF et al. 2011). Für das pulmonale Lymphosarkom des Hundes hingegen wird überwiegend ein strukturiert retikuläres Muster mit diffuser Verteilung beschrieben, das Erscheinungsbild kann aber sehr vielfältig sein (SUTER et al. 1974, LANG und BRÜHSCHWEIN 2008). Besonders variabel stellt sich das Erscheinungsbild bei der lymphomatoiden Granulomatose Lungenlappenkonsolidierungen, des Hundes alveoläre oder dar: Röntgenologisch interstitielle können Infiltrationen oder schlecht abgrenzbare Massen vorliegen (LANG und BRÜHSCHWEIN 2008, BOLLIGER 2012). Das röntgenologische Aussehen primärer Lungentumore ist also vielfältig und es existiert keine sichere Korrelation zwischen der Histologie und dem röntgenologischen Erscheinungsbild (HAHN und MCENTEE 1997). Erschwert wird die Diagnostik noch dadurch, dass pulmonale Primärtumore häufig zu einer Metastasierung in die Lunge neigen, so dass Primärherde und Metastasen gleichzeitig vorliegen. Die Metastasierungswahrscheinlichkeit für das Plattenepithelkarzinom und das anaplastische Karzinom bei Hund und Katze wird zum Teil mit über 90 % angegeben (BRODEY und CRAIG 1965). Adenokarzinome weisen eine Metastasierungswahrscheinlichkeit von ca. 50 % auf (MILES 1988, AARSVOLD et al. 2015). Häufigste Metastasierungsorte sind die Lunge selbst und die tracheobronchialen Lymphknoten (MILES 1988, KESSLER et al. 2007). Die häufigsten extrapulmonalen röntgenologischen Befunde, die mit pulmonalen Primärtumoren bei Hund und Katze einhergehen, sind in absteigender Reihenfolge der Pleuraerguss, eine Lymphadenomegalie der Tracheobronchiallymphknoten 9 Literaturübersicht sowie (insbesondere bei der Katze) knochenassoziierte Veränderungen (MILES 1988). Die Anzahl der Tiere mit Pleuraerguss wird in der Literatur vor allem bei der Katze mit relativ hohen Prozentsätzen von ca. 30 bis 50 % angegeben (KOBLIK 1986, BALLEGEER et al. 2002). Ebenso weisen die bronchio-alveolären Karzinome der Katze zu fast 50 % eine lymphogene Streuung in die tracheobronchialen Lymphknoten auf (BALLEGEER et al. 2002). Wesentliche Bedeutung erlangt haben für die reine Detektion von Rundherden insbesondere die Projektionsradiographie und die Computertomographie. Prinzipiell können jedoch alle bildgebenden Modalitäten zur Lungendiagnostik (Projektionsradiographie, Ultraschall, CT, MRT und Szintigraphie) eingesetzt werden. Die Art der angewandten Modalität ist dabei abhängig von den Vor- und Nachteilen der jeweiligen Untersuchungsmethode und der Art der vermuteten Erkrankung. Die klassische Röntgenuntersuchung stellt die am häufigsten durchgeführte bildgebende Untersuchungsmethode zur Evaluierung der Lunge und ihrer Erkrankungen dar (ABOLMAALI und VOGL 2004, PÖTTER-LANG et al. 2014). Insgesamt wird die Inzidenz von projektionsradiographisch sichtbaren Metastasen bei vorhandenem Primärtumor von Lang et al. bei einer Untersuchung an 76 Hunden mit 33 % angegeben (LANG et al. 1986). Als natürliches „Hochkontrastorgan“ ist die Lunge für die Projektionsradiographie besonders geeignet. Hauptproblem bei der Wahl dieser Untersuchungsmethode ist allerdings, dass es sich hierbei um ein Summationsbild der verschiedenen dargestellten Organe und Strukturen handelt. Dabei ergibt sich insbesondere für die Tiermedizin die Limitation, dass Pathologien, in den unten liegenden, weniger belüfteten Lungenarealen leichter übersehen werden können (AHLBERG et al. 1985). Dies könnte insofern eine wichtige Rolle spielen, als dass einige Autoren als Prädilektionsstelle für pulmonale Metastasen bei Hund und Katze die peripheren Lungenanteile und insbesondere den rechten kaudalen Lungenlappen benennen (MOULTON et al. 1981, KOBLIK 1986, HAHN und MCENTEE 1997). Es wird beschrieben, dass ca. 25 % aller Lungenherde, die in der Projektionsradiographie nicht detektiert wurden in den kaudalen Lungenlappen aufzufinden waren (SUTER et al. 1974). Neben der Projektionsradiographie stellt die Computertomographie die häufigste Untersuchungsmethode zur Detektion pulmonaler Rundherde dar. Vorteil der CT 10 Literaturübersicht gegenüber der Summationsbild, Projektionsradiographie sondern um ein ist, dass es Schnittbildverfahren sich nicht handelt. um ein Durch die Akquirierung einzelner Schichten gibt es keine Überlagerung anatomischer Strukturen, kein „anatomisches Rauschen“ (KALENDER 2006). Darüber hinaus zeichnen sich die CT-Bilder gegenüber den Röntgenbildern durch einen deutlich erhöhten Weichteilkontrast aus. Dabei kann mit Hilfe der Hounsfield-Skala den einzelnen Graustufen ein relativ genauer Zahlenwert zugeordnet werden. Dies stellt auch einer der rechnerischen Grundlagen der computerassistieren Detektion zur Abgrenzung eines (weichteildichten) Rundherdes gegenüber dem regulären Lungengewebe dar. Zudem weisen einzelne tiermedizinische Studien darauf hin, dass in der CT-Untersuchung wesentlich kleinere Rundherde als in der Projektionsradiographie detektiert werden können (NEMANIC et al. 2006, EBERLE et al. 2011). Der Schwellenwert zur Detektion weichteildichter Rundherde wird in der tiermedizinischen Literatur für die CT-Untersuchung zum Teil mit 1 mm angegeben, für die Projektionsradiographie schwankt diese Angabe zwischen etwa 3 mm und 7 bis 9 mm (SUTER et al. 1974, NEMANIC et al. 2006, EBERLE et al. 2011). Auch in der Tiermedizin ist die CT mittlerweile zunehmend verfügbar, so dass auch hier prinzipiell beide Modalitäten – die CT und die klassische Röntgenuntersuchung – für die Detektion pulmonaler Rundherde zur Verfügung stehen. Bislang ist die Frage nach pulmonalen Metastasen/Rundherden bei Haustieren in erster Linie eine Domäne der Projektionsradiographie, was zumindest teilweise dem finanziellen Aspekt geschuldet ist, aber auch der Tatsache, dass für eine CT-Untersuchung eine Narkose erforderlich ist. Dies stellt einen bedeutsamen Unterschied zur humanmedizinischen CT-Diagnostik dar und impliziert einen größeren apparativen, finanziellen sowie zeitlichen Aufwand (SONNTAG und MIHALJEVIĆ 2009). Zudem bedeutet eine Narkose gerade für kranke Patienten ein erhöhtes Untersuchungsrisiko und muss im Hinblick auf Kosten und Nutzen der Untersuchung kritisch abgewogen werden (ALEF und OECHTERING 1998, BILLE et al. 2014). Aufgrund ihrer Artefaktanfälligkeit (Bewegungsartefakte, Lagerung etc.) sind CT-Untersuchungen am wachen Tier nur eingeschränkt möglich und bleiben speziellen Anwendungsgebieten vorbehalten (SONNTAG und MIHALJEVIĆ 2009, OLIVEIRA et al. 2011). Dennoch gibt es für die Tiermedizin mittlerweile Studien, die den Mehrgewinn einer CT-Untersuchung 11 gegenüber einer klassischen Literaturübersicht Röntgenuntersuchung bei der Suche nach pulmonalen Rundherden belegen, wobei der Nutzen je nach Fragestellung und Studiendesign unterschiedlich hoch ausfällt (NEMANIC et al. 2006, EBERLE et al. 2011). Für einige Humanmediziner stellt die Detektion von Rundherden durch die CTUntersuchung den Goldstandard dar (ARMATO et al. 1999). Zunehmend fordern einige Autoren auch die Etablierung des Low-dose CT als Standard- Detektionsverfahren zur Darstellung pulmonaler Rundherde. Einzelne Studien belegen, dass sich infolge einer früheren Erkennung von pulmonalen Veränderungen die Mortalität von Lungenkrebs reduzieren lässt (MUNDEN und GODOY 2013). Dennoch wird derzeit auch in der Humanmedizin vielfach die Projektionsradiographie als primäres Detektionsverfahren eingesetzt, während die CT-Untersuchung zur Charakterisierung und für Verlaufskontrollen von Rundherden Verwendung findet. Gerade die Verlaufskontrollen könnten jedoch in Zukunft zunehmend durch MRTUntersuchungen abgelöst werden (ABOLMAALI und VOGL 2004). Insbesondere in der Pädiatrie wird die MRT aufgrund der fehlenden Strahlenbelastung auch zunehmend zur Detektion pulmonaler Rundherde eingesetzt (ABOLMAALI und VOGL 2004). In der Veterinärmedizin ist der Einsatz des MRT zur Rundherddiagnostik stark begrenzt, da mit artefaktarmen und diagnostischen MRT-Aufnahmen des Thorax aufgrund von Bewegungsunschärfen etc. nur ab einer Magnetfeldstärke von ca. 1 Tesla zu rechnen ist (BIEDERER et al. 2008, KURIHARA et al. 2014). Derartige MRT-Geräte sind aufgrund des extrem hohen finanziellen und technischen Aufwandes in der Tiermedizin derzeit nur wenigen Einrichtungen vorbehalten. Neben den bisher beschriebenen Modalitäten ist in eingeschränktem Maße auch die Sonographie eine Modalität, welche – kostengünstig am wachen Patienten durchgeführt – zur Detektion pulmonaler Rundherde beitragen kann. Die sonographische Lungendiagnostik beschränkt sich jedoch im Regelfall auf die Peripherie der Lunge. Eine Ultraschalluntersuchung der Lunge bietet sich vor allem bei pleuranahen Herden an und wird im Gegensatz zu einer Projektionsradiographie zusätzlich erleichtert, wenn umliegende Flüssigkeitsansammlungen wie etwa ein Pleuraerguss vorhanden sind. Hier kann die Ultraschalldiagnostik unter Umständen der Projektionsradiographie überlegen sein, da einige Untersuchungen belegen, 12 Literaturübersicht dass eine Maskierung durch Atelektasen oder Flüssigkeitsansammlungen ein wesentlicher Grund für eine fehlende Detektion von pulmonalen Rundherden sein kann (SUTER et al. 1974, AHLBERG et al. 1985, KESSLER et al. 2007). Dennoch werden relativ selten die beschriebenen Voraussetzungen optimal erfüllt, so dass die klassische Röntgenuntersuchung in den allermeisten Fällen die Screeningmethode der Wahl ist. Lediglich in den Fällen, in denen die Eigenschaften der Lunge als Hochkontrastorgan verloren gehen, kann eine Ultraschalluntersuchung als komplementäres Verfahren vorteilhaft sein. Neben den oben genannten Möglichkeiten zur Rundherddetektion und Rundherdklassifizierung stehen solche bildgebende Verfahren zur Verfügung, die zusätzlich biochemische und physiologische Vorgänge abbilden. Das PET/CT und das PET/MRT sind ebenso wie die Szintigraphie Verfahren aus dem Bereich der funktionellen Bildgebung. Auch in der Tiermedizin kommt es zu einem zunehmendem Einsatz von PET/CT Untersuchungen (MATTOON und BRYAN 2013, LEBLANC und PEREMANS 2014, RANDALL et al. 2014). Allerdings liegen für die Tiermedizin im Wesentlichen nur zwei klinische Fallberichte bezogen auf pulmonale Läsionen vor (BALLEGEER et al. 2006, KIM et al. 2014). Diese Modalitäten dienen jedoch, vor allem im Bereich der Lunge, eher zu einer nichtinvasiven Möglichkeit einer Charakterisierung einer Läsion als einer initialen Detektion (BALLEGEER et al. 2006, KIM et al. 2014). 2.2.1 Definition des pulmonalen Rundherdes Bisher wurde die Detektion pulmonaler Rundherde bereits im Kontext neoplastischer Veränderungen aufgeführt. Prinzipiell kann es sich bei pulmonalen Rundherden jedoch um Metastasen, Primärtumore, Hämatome, Granulome oder Abszesse handeln (KOBLIK 1986, MAROLF et al. 2011, FINA et al. 2014, MESQUITA et al. 2015). Bei der Definition der Rundherde wurde in der vorliegenden Arbeit eine allseits gängige Definition von der Fleischner Society aus der Humanmedizin übernommen. Ein allseits von Luft umgebenes dreidimensionales Gebilde von annähernd rundlicher Form (HANSELL et al. 2008). Die exakte Begriffsbestimmung eines pulmonalen Rundherdes umfasst darüber hinaus lediglich 13 Literaturübersicht Veränderungen mit einem Durchmesser von 3 mm bis 3 cm; kleinere Herde werden als Mikroläsionen (micronodules) bezeichnet, größere Herde als Massen (HANSELL et al. 2008). Viele pulmonale Rundherde werden als Zufallsbefund bei einer aus anderen Gründen angefertigten projektionsradiographischen Thoraxuntersuchung detektiert (HOFFMANN und DIENEMANN 2000). Ähnliches gilt für CT-Untersuchungen (HARTMANN 2011). Bei einem zufällig entdeckten pulmonalen Rundherd muss in der Humanmedizin in 20 % bis 50 % der Fälle von einem malignen Rundherd ausgegangen werden (HOFFMANN und DIENEMANN 2000). Im weiteren Verlauf der Diagnostik wird bei den derart detektierten Rundherden zunächst entschieden, ob es sich um einen singulären Rundherd oder multiple Rundherde handelt und es muss eine Differenzierung zwischen benignen und neoplastischen Prozessen erfolgen. Grundsätzlich wird von einigen Autoren in der Humanmedizin jeder Lungenrundherd solange als malignitätsverdächtig eingestuft, bis nicht das Gegenteil bewiesen ist (HOFFMANN und DIENEMANN 2000). Die meisten Autoren empfehlen, solche Rundherde zumindest nachzuverfolgen (JEONG et al. 2007, RUBIN 2015). Dies ist insbesondere vor dem Hintergrund zu sehen, dass bei dem Bronchialkarzinom, aber auch bei anderen Tumorentitäten die Prognose stark mit dem Tumorstadium korreliert ist. Damit hängt die Heilungsaussicht also maßgeblich von einer frühzeitigen Detektion des pulmonalen Rundherdes ab. Der weitere diagnostische Umgang mit pulmonalen Rundherden wird in der Humanmedizin von verschiedenen Faktoren beeinflusst. Hierzu zählen z. B. das Vorhandensein von Primärtumoren, eine Raucheranamnese, sowie Alter und Morphologie des Rundherdes (RUBIN 2015). Generell gelten insbesondere Herde größer 1 cm als malignitätsverdächtig. Bei kleineren Herden kann eine zweijährige Verlaufskontrolle des Rundherdes ausreichend sein, wobei in Abhängigkeit von der Größe die Malignitätswahrscheinlichkeit steigt (ABOLMAALI und VOGL 2004, JEONG et al. 2007, GIRVIN und KO 2008). Für die Tiermedizin liegen nach bisherigem Kenntnisstand keine Studien vor, die eine positive Korrelation zwischen der Größe eines pulmonalen Rundherdes und dessen Malignität belegen. 14 Literaturübersicht 2.2.2 Detektion von pulmonalen Rundherden in der Projektionsradiographie Auch wenn viele Autoren davon ausgehen, dass die Computertomographie insbesondere bei der Detektion kleinerer Rundherde der Projektionsradiographie deutlich überlegen ist, so bleibt die klassische Röntgenuntersuchung vielfach in der Humanmedizin als Primärdiagnostik bestehen (HOFFMANN und DIENEMANN 2000). Dies mag zum einen darin begründet sein, dass wie bereits oben beschrieben viele radiologische Rundherde als Zufallsbefund erfasst werden, zum anderen, dass die klassische Röntgendiagnostik für viele Autoren als kosteneffizientes und vergleichsweise strahlungsarmes Diagnostikum seine Berechtigung hat (PÖTTERLANG et al. 2014). Eine eindeutige pauschale Regelung zur Detektion pulmonaler Rundherde findet sich bis heute in der humanmedizinischen Literatur nicht. Mit steigender Verfügbarkeit der Schnittbildverfahren scheint jedoch die Anzahl der durchgeführten Projektionsradiographien rückläufig (ABOLMAALI und VOGL 2004). Dennoch bleibt diese Modalität aufgrund der oben genannten Vorteile weiterhin zumeist die initiale Methode zur Abklärung von Lungenerkrankungen, so dass auch für Projektionsradiographie weiterhin eine permanente Verbesserung der digitalen Aufnahmesysteme angestrebt wird. Dies betrifft zum einen die Hardware mit zunehmend verbessertem Signal-Rausch-Verhältnis und steigender Dosiseffizienz, zum anderen aber auch die Software (LUDEWIG et al. 2010). Die Weiterentwicklungen im Bereich der Software sind unter anderem darauf ausgerichtet, die der Projektionsradiographie inhärenten Nachteile eines Summationsbildes auszugleichen. Hierzu zählen Techniken wie die Zweispektren Technik (Dual-Energy Technik) als auch digitale und zeitlich versetzte Subtraktionsaufnahmen. Alle diese Methoden zeigten bei der Detektion pulmonaler Rundherde gegenüber der herkömmlich prozessierten Thoraxröntgenuntersuchung eine deutliche Sensitivitätssteigerung (PÖTTER-LANG et al. 2014). Daneben spielt auch die computerassistierte Detektion (CAD) in der Thoraxradiologie der Humanmedizin eine wichtige Rolle. Seit den ersten CADStudien für die Projektionsradiographien in den 1960er-Jahren wurden viele 15 Literaturübersicht Generationen von CAD-Systemen auch für die klassischen Röntgenuntersuchungen entwickelt mit dem hauptsächlichen Ziel einer besseren Detektion von pulmonalen Rundherden. In der Literatur wird eine vergleichende Bearbeitung einer Datenbank von Thoraxröntgenbildern der Japanischen Radiologischen Gesellschaft von 1999 und 2012 beschrieben, wobei sich eine Steigerung der Sensitivität von 35 % bei 6 falsch positiven Befunden pro Bild auf 75 % bei 0,5 falsch positiven Befunden pro Bild ergab (PÖTTER-LANG et al. 2014). Auch für die klassische Thoraxröntgenuntersuchung findet also eine ständige Weiterentwicklung der Aufnahmesysteme statt, was den weiterhin bestehenden Nutzen der Röntgendiagnostik als primäres Diagnostikum bei der Detektion pulmonaler Rundherde widerspiegelt. Vorteil der Projektionsradiographie ist, dass es ein kostengünstiges Verfahren darstellt, das am wachen Patienten durchgeführt werden kann (LANG und BRÜHSCHWEIN 2008, ALEXANDER et al. 2012). Vor diesem Hintergrund stellt sich in der tiermedizinischen Literatur die Frage, wie viele Projektionsebenen für die Detektion von pulmonalen Rundherden notwendig sind. In der tiermedizinischen Literatur werden schon seit längerer Zeit von manchen Autoren bei der Suche nach pulmonalen Rundherden drei Projektionsebenen bevorzugt (LANG et al. 1986, OBER und BARBER 2006). Die Diskussion um zwei versus drei Ebenen ist in der Literatur jedoch nicht unumstritten. Einzelne Autoren stellten in einem Gruppenvergleich fest, dass sich die Diagnose zwischen positiver und negativer Befundung mit der Verwendung von drei anstatt zwei Projektionsebenen um 12 bis 15 % unterscheidet (OBER und BARBER 2006). Am schlechtesten schnitten zwei orthogonale Projektionen ab. Als sensitiver für die Beurteilung erwiesen sich die beiden seitlichen Projektionen, gefolgt von den drei Ebenen als empfohlenes Standardprotokoll bei der Metastasensuche (OBER und BARBER 2006). Auch andere Autoren beurteilten die Untersuchung in den beiden seitlich anliegenden Projektionen im Vergleich zu zwei orthogonalen Projektionsebenen als sensitiver, eine Projektion in drei Ebenen brachte eine zusätzliche Sensitivitätssteigerung (LANG et al. 1986). Eine weitere Studie hingegen konnte keinen statistisch signifikanten Unterschied zwischen einer, zwei oder drei Ebenen feststellen (BARTHEZ et al. 1994). Daneben beschränkt sich der Vorteil von drei Projektionsebenen nicht nur auf pulmonale Rundherde, sondern zeigt sich für 16 Literaturübersicht einzelne Autoren auch bei anderweitigen Pathologien, wie etwa Pneumonien (FORREST 1992). 2.2.3 Detektion von pulmonalen Rundherden in der CT-Untersuchung Vorteile der CT-Untersuchung gegenüber der Projektionsradiographie stellen vor allem ein erhöhter Weichteilkontrast als auch die überlagerungsfreie Darstellung von Rundherden gegenüber anderen Strukturen/Organen dar (GIRVIN und KO 2008). Dennoch werden auch in der CT-Untersuchung einige Rundherde übersehen, insbesondere wenn diese zentral gelegen oder dicht mit Gefäßen assoziiert sind. Daneben können umliegende Gewebeveränderungen oder die geringe Größe zur fehlenden Darstellbarkeit von Rundherden beitragen (ARMATO et al. 2002). Für die Humanmedizin wird davon ausgegangen, dass die Detektionsrate von nichtkalzifizierten Lungenrundherden in der Low-dose CT dreimal höher ist als in der Projektionsradiographie (HENSCHKE et al. 1999). Tendenziell scheint eine zunehmende Verschiebung der Projektionsradiographie in Richtung CT stattzufinden. Trotzdem stellt in der Humanmedizin die Projektionsradiographie für viele Lungenveränderungen das primäre bildgebende Verfahren dar, so dass viele Rundherde als Zufallsbefund bei anderweitigen Fragestellungen im Zuge der Projektionsradiographie entdeckt werden (HOFFMANN und DIENEMANN 2000). Auch in der Tiermedizin gibt es einige Untersuchungen, die einen diagnostischen Mehrwert der CT-Untersuchung gegenüber der Projektionsradiographie zum Nachweis pulmonaler Rundherde belegen. Hierüber sind sich die Autoren einig (NEMANIC et al. 2006, EBERLE et al. 2011, ALEXANDER et al. 2012). Allerdings geben die einzelnen Studien – je nach Fragestellung und Studienaufbau – unterschiedliche Zahlen an hinsichtlich des Mehrgewinns einer CT-Untersuchung gegenüber der Projektionsradiographie. Eine Untersuchung an 18 Hunden legt dar, dass im direkten Vergleich von klassischer Röntgenuntersuchung und CT nur 9 % aller Rundherde vorab projektionsradiographisch detektierbar waren: Für diese Studie wurden klassische Röntgenuntersuchungen in zwei Projektionsebenen durchgeführt, die untere detektierbare Größe von pulmonalen Rundherden betrug in dieser Untersuchung 17 Literaturübersicht 7 bis 9 mm (NEMANIC et al. 2006). Ähnliches beschreiben auch Eberle et al (2011) in einer Untersuchung mit 39 Hunden, die histologisch bestätigt ein appendikuläres Osteosarkom aufwiesen. Nur 5 % dieser Tiere wiesen in der Projektionsradiographie Metastasen auf, in der CT-Untersuchung hingegen 28 %. Die Anzahl der Rundherde korrelierte hierbei signifikant mit einer kürzeren Überlebenszeit der Tiere (EBERLE et al. 2011). Eine weitere Studie, die sich mit der Rundherdsuche bei Hunden mit Mammakarzinomen beschäftigt, projektionsradiographischen zeigt, dass Untersuchung im bei der Vergleich vorangegangenen zur CT von zwei Rundherden keiner sichtbar war (OTONI et al. 2010). Zusätzlich weisen einige Studien darauf hin, dass in der CT-Untersuchung wesentlich kleinere Rundherde als in der klassischen Schwellenwert zur Röntgenuntersuchung Detektion detektiert weichteildichter werden Rundherde können. wird in Der der tiermedizinischen Literatur für die CT-Untersuchung zum Teil mit 1 mm angegeben, für die Projektionsradiographie schwankt diese Angabe zwischen etwa 3 mm und 7 bis 9 mm (NEMANIC et al. 2006, EBERLE et al. 2011). 2.2.4 Stellenwert der computerassistierten Detektion zur Erkennung pulmonaler Rundherde Die computerassistierten Detektionssysteme (CAD) bestehen aus einer Software, die dem Befunder aufgrund von unterschiedlichen Rechenalgorithmen Rundherde als „Zweitmeinung“ präsentieren soll. Es gibt computerassistierte Detektionssysteme, die in erster Linie für die reine Detektion von pulmonalen Rundherden gedacht sind (CADe). Daneben existieren insbesondere neuere CAD-Systeme, die als zusätzliche Meinung für die Charakterisierung und Diagnose (CADx) von pulmonalen Läsionen ihre Anwendung finden. Die vorliegende Arbeit beschäftigt sich ausschließlich mit dem Aspekt der computerassistierten Detektion (CADe) von pulmonalen Rundherden. Daneben stellt in der Humanmedizin die Größenzunahme eine wichtige Entscheidungshilfe für das weitere Vorgehen bei allen fraglichen Rundherden dar. Dabei ermöglicht es die CAD-Software, jeden Rundherd auf Wunsch als dreidimensionales Bild abzuspeichern und 18 das Volumen des dargestellten Literaturübersicht Rundherdes anzugeben. In einer späteren Folgeuntersuchung kann dann eine mögliche Größenzunahme nachgewiesen werden. Zur Beurteilung des Malignitätsgrades eines Rundherds wird als Referenz die in der CAD ermittelte Verdopplungszeit (doubling time) gemessen (WORMANNS et al. 2004, MARTEN et al. 2005, WIEMKER et al. 2005, FRAIOLI et al. 2006, MARTEN und ENGELKE 2007, NIETERT et al. 2009). Dies findet insbesondere bei Patienten mit kleinen Rundherden Anwendung, da in einigen Studien gezeigt werden konnte, dass die Größe positiv mit Malignität korreliert ist (HOFFMANN und DIENEMANN 2000, GIRVIN und KO 2008). Für die Tiermedizin ist diese Aussage nicht belegt. Auch in vorliegender Arbeit wurden keine Untersuchungen zur Volumetrie angestellt. Die ersten erfolgreichen Versuche zum Einsatz computerassistierter Detektionssysteme existieren seit den 80er Jahren. Dies gilt sowohl für die Projektionsradiographie als auch für die CT (DOI 2007). Seitdem gibt es ein stetiges Bestreben zur Verbesserung der CAD-Systeme, was sich bis heute an der hohen Zahl an Veröffentlichungen zu neuen Algorithmen niederschlägt (LEE et al. 2001, ACHENBACH 2003, BROWN et al. 2003, BAE et al. 2005, LI et al. 2008, GODOY et al. 2013). In der Humanmedizin wird die computerassistierte Detektion bereits seit einigen Jahren sowohl in der CT- als auch in der klassischen Röntgenuntersuchung auf der Suche nach pulmonalen Rundherden erfolgreich eingesetzt und zählt für einige Autoren mittlerweile zum Standard (GOLDIN et al. 2008). Auch die Untersuchungen zu den Sensitivitäten der einzelnen CAD-Systeme sind in der Humanmedizin zahlreich (AWAI et al. 2004, DAS et al. 2006, BEIGELMANAUBRY et al. 2007, BEYER et al. 2007, BOGONI et al. 2012, CHRISTE et al. 2013). Für die Tiermedizin liegen allerdings nach Wissensstand des Autors keine Untersuchungen zur Anwendbarkeit eines computerassistierten Detektionssystems pulmonaler Rundherde vor. 19 Publikationen 3 Publikationen 3.1 Vergleich von Projektionsradiographie und Computertomographie zur Detektion pulmonaler Rundherde bei Hund und Katze 20 Publikationen 21 Publikationen 22 Publikationen 23 Publikationen 24 Publikationen 25 Publikationen 26 Publikationen 27 Publikationen 3.2 Computertomographische Untersuchungen mit computerassistierter Detektion von pulmonalen Rundherden bei Hund und Katze 28 Publikationen 29 Publikationen 30 Publikationen 31 Publikationen 32 Publikationen 33 Publikationen 34 Publikationen 35 Diskussion 4 Diskussion 4.1 Diskussion der Methodik Die Untersuchungen der vorliegenden Arbeit beschäftigen sich sowohl mit den Grenzen der radiologischen Rundherddiagnostik der Lunge als auch mit neueren Detektionsmöglichkeiten für die Tiermedizin. Bei der Detektion pulmonaler Rundherde gibt es eine Reihe von Variablen, die die Detektionsrate beeinflussen. In chronologischer Reihenfolge lassen sie sich initial in technische Aspekte einteilen (Parameter der Bildentstehung) und nachfolgend in solche, die untersucherabhängig sind (Parameter der Bildbeurteilung). Eine dieser technischen Variablen ist die Wahl der Ein- und Ausschlusskriterien. Zur Definition der Rundherde wurde für die vorliegende Arbeit eine gängige Begriffsbestimmung aus der Humanmedizin übernommen. Ein allseits von Luft umgebenes dreidimensionales Gebilde von annähernd rundlicher Form (HANSELL et al. 2008). Als Größendefinition wurde für die erste Studie die exakte Begriffsbestimmung eines Rundherdes verwendet – eine rundliche Struktur mit einem Durchmesser von 3 mm bis 3 cm (HANSELL et al. 2008). Dieses konservative Kriterium wurde bewusst gewählt, um die Leistungsfähigkeit der Projektionsradiographie besser beurteilen zu können. Die Tatsache, dass für die erste Untersuchung nur pulmonale Rundherde mit einem Durchmesser zwischen 3 mm und 3 cm Berücksichtigung fanden, dürfte zu einer Unterschätzung der Projektionsradiographie beigetragen haben. Es ist anzunehmen, dass die Detektionsrate für pulmonale Rundherde ohne diese Einschränkung für die Projektionsradiographie deutlich höher ausgefallen wäre. Durch diese Vorselektion fanden einige Rundherde keine Berücksichtigung in der Statistik. Die genaue Anzahl der nicht mit gewerteten Rundherde mit einem Durchmesser größer als 3 cm waren nicht Gegenstand der Untersuchung. Einige tiermedizinische Studien weisen jedoch darauf hin, dass eine höhere röntgenologische Detektionsrate pulmonaler Rundherde positiv mit der Größe der zu detektierenden Struktur korreliert ist (NEMANIC et al. 2006, EBERLE et al. 2011, ALEXANDER et al. 2012). Ebenso wurden homogen verkalkte Herde im Sinne von Osteomen nicht berücksichtigt, auch wenn mit deren 36 Diskussion erhöhten Abgrenzbarkeit infolge der besseren Kontrastierung zum umliegenden Gewebe eine verbesserte Detektionsrate einhergehen würde (NAIDICH et al. 1993). Es ist anzunehmen, dass unter Einbezug verkalkter Rundherde die computerassistierte Detektion in unserer Studie eine höhere Sensitivität aufweisen würde. In der zweiten Veröffentlichung zur Untersuchung des CAD-System wurden auch Herde größer als 3 cm mit eingeschlossen. Hierbei ging es im Unterschied zur ersten Studie um einen Absolutwert bezüglich der Detektionsrate der CAD. Um das Ergebnis nicht negativ zu verfälschen, wurden demnach auch Rundherde größer als 3 cm berücksichtigt. Eine Größe unter 3 mm wurde nicht untersucht, da das angebotene CAD-System nicht für eine Auflösung kleinerer Strukturen ausgelegt ist, und zudem aufgrund der gewählten CT-Parameter (Schichtdicke 2 mm, Pitch 0,7) wesentlich kleinere Strukturen als 3 mm einer Detektionen entgehen können. Abhängig von der technischen Auflösung des Film-Folien-Systems aber auch in Abhängigkeit von dem anatomischen Rauschen und Überlagerung liegt die Detektionsgrenze bei der Projektionsradiographie zwischen etwa 2 bis 7 bzw. 9 mm (NEMANIC et al. 2006, ALEXANDER et al. 2012). Andere Autoren geben ähnlich wie in unserer Untersuchung eine Untergrenze von 3 mm an, allerdings wurden gemäß der vorliegenden Einschlusskriterien Herde mit einer Größe von unter 3 mm nicht untersucht (SUTER et al. 1974, ARMBRUST et al. 2012). Auch das Auflösungsvermögen des CT ist abhängig von technischen Einstellungsparametern, unterliegt aber im Gegensatz zur Projektionsradiographie nicht der Limitation Summationsschatten darzustellen. Darüber hinaus zeichnet sich die CT durch eine höhere Kontrastauflösung aus, so dass Dichtemessungen für die einzelnen Organe/Strukturen mithilfe der Hounsfield Einheiten vorgenommen werden können (SCHWARZ und O`BRIEN 2011). Die in den vorliegenden Untersuchungen aufgeführten klassischen Röntgenuntersuchungen wurden ausnahmslos am wachen Patienten, die CTUntersuchungen hingegen in Narkose durchgeführt. Nachteile der Untersuchung in Narkose sind potentielle Atelektasen (AHLBERG et al. 1985). In der CTUntersuchung können Atelektasen je nach Körperposition in den unterschiedlichen Lungenarealen auftreten und die Detektion von Rundherden erschweren (AHLBERG 37 Diskussion et al. 1985). In der Tiermedizin ist – anders als in der Humanmedizin – für die CTUntersuchung der Lunge grundsätzlich eine Narkose vonnöten (SCHWARZ und O`BRIEN 2011). Allerdings wurden solche Herde von unserer Untersuchung ausgeschlossen, die sich in vollständig atelektatischen Bezirken befanden. Um Bewegungsartefakte, wie sie bei der Atembewegung des Thorax entstehen, zu minimieren, wurde eine Hyperventilation mit kurzer Apnoephase eingeleitet und für den Scan genutzt. Allerdings waren Atembewegungen nicht immer vermeidbar und spielten, wie die eigenen Studienergebnisse zeigen, insbesondere bei der CADUntersuchung eine erhebliche Rolle: Von den insgesamt 707 falsch positiv detektierten Rundherden der automatischen Rundherddetektion waren nach Einschätzung der beiden Radiologen in 358 bzw. 410 Fällen Gefäßanschnitte in Kombination mit einer leichten Bewegungsunschärfe ursächlich. Dies liegt darin begründet, dass der Rechenalgorithmus eines automatischen Detektionssystems darauf basiert, weichteildense, rundliche Formen zu erkennen. In der CT als Schnittbildverfahren können sich jedoch infolge der Atmung ehemals zusammenhängende Strukturen in ihrer Position zueinander verschieben. In den aufeinanderfolgenden Bilderserien werden Gefäße von der CAD somit nicht mehr als längliche Struktur erkannt, sondern fälschlicherweise als rundliche Struktur interpretiert. Untersuchungen aus der Humanmedizin zu dem Einfluss von Bewegungsunschärfen auf die Leistungsfähigkeit der CAD sind rar. Die Tatsache ist vermutlich darauf zurückzuführen, dass dieses Problem der Bewegungsunschärfe von untergeordneter Bedeutung ist, da die Patienten im Gegensatz zur Tiermedizin im Regelfall wach untersucht werden und zudem die Atmung willentlich anhalten können. Zum Einfluss der Bewegungsunschärfe auf die Leistungsfähigkeit der computerassistierten Detektion liegt nach eigenem Erkenntnisstand nur eine humanmedizinische Untersuchung vor. Allerdings beschäftigt sich diese Studie mit der computerassistierten Detektion pulmonaler Thromben (WITTENBERG et al. 2011). Damit ist diese Studie nicht direkt mit unserer Untersuchung vergleichbar. Dennoch mag es als ein Anhaltspunkt gelten, dass ähnlich wie in unserer Studie etwa 45 % der durch die CAD falsch angezeigten Läsionen auf Gefäße und Bewegungsunschärfen zurückzuführen sind (WITTENBERG et al. 2011). Für die 38 Diskussion Tiermedizin liegen derzeit keine Untersuchungen zum Einsatz der CAD vor. Somit gibt es auch keine Studien, die sich mit möglichen Einschränkungen der Leistungsfähigkeit der CAD infolge Bewegungsunschärfen bei Hund und Katze beschäftigen. Als maximal erlaubten Zeitraum zwischen der projektionsradiographischen Untersuchung und der CT-Studie des gleichen Patienten wurden 14 Tage gewählt. Dies spielt dahingehend eine Rolle, da für das Tumorwachstum als Funktion der Zeit initial eine exponentielle Größenzunahme angenommen wird und damit eine echte Vergleichbarkeit der Modalitäten nicht mehr gegeben ist (GIRVIN und KO 2008). In vorliegender Studie wurden zwei zueinander orthogonale Projektionsebenen gewählt. Bei der Frage nach der Anzahl der Projektionsebenen spielt auch die Aufnahmetechnik eine entscheidende Rolle. Eine adäquat in der Inspirationsphase angefertigte Thoraxröntgenaufnahme dürfte die röntgenologische Detektionsrate von Rundherden erhöhen, da nur dann die Vorteile der Lunge als „Hochkontrastorgan“ ausgeschöpft werden und sich die (weichteildichten) Rundherde von dem umliegenden (gasdichten) Lungengewebe deutlicher abgrenzen lassen (AHLBERG et al. 1985, MONNIER-CHOLLEY et al. 2001). Zumindest konnte in unserer Untersuchung zur Leistungsfähigkeit der Projektionsradiographie gezeigt werden, dass insbesondere Atelektasen und Überlagerungen mit anderen Strukturen maßgeblich zu einer fehlenden Detektierbarkeit der Rundherde beitragen. Die Überlagerung durch anatomische Strukturen wie dem Herz oder Zwerchfell hatte in vorliegender Untersuchung sogar einen größeren Einfluss auf die fehlende Detektion als die Rundherdgröße allein. So wurden in unserer Studie in „überlagerungsfreien“ Lungenarealen Herde von 3 mm Größe erkannt, andererseits wurden im Falle eines hochgradigen Pneumothorax auch Herde von etwa 1,5 cm Größe in der Projektionsradiographie übersehen. Dieses Resultat unserer Untersuchung wird durch eine weitere Studie unterstützt, in der aufgezeigt wurde, dass die Detektionsgrenze für Rundherde abhängig vom anatomischen Rauschen, das heißt abhängig von dem umgebenden Hintergrund (wie z. B. Gefäßen), deutlich variieren kann (SAMEI et al. 2003). Eine zusätzliche Studie aus der Humanmedizin belegt, dass 65 % aller im Hilusbereich gelegenen Rundherde initial übersehen worden waren. Dabei handelte es sich nicht um Mikroläsionen, sondern die Herde wiesen 39 Diskussion einen Durchmesser größer als 3 cm auf (MUHM et al. 1983). Als Grund spielt auch hier insbesondere die Überlagerung mit anderen weichteildichten Strukturen in dieser Körperregion eine Rolle. Daneben weisen andere Autoren darauf hin, dass die Rundherdgröße nicht allein ausschlaggebend ist, sondern die Lokalisation ebenfalls eine bedeutende Rolle spielt. Daher empfehlen diese Autoren insbesondere auf eine gute Bildqualität zu achten; hierzu zählt beispielsweise eine Thoraxaufnahme, die in der Inspirationsphase angefertigt wird und somit die Abgrenzbarkeit einzelner Strukturen besser gewährleistet (MONNIER-CHOLLEY et al. 2001). Zu dieser Schlussfolgerung kommen wir auch in unserer Untersuchung. Der maßgebliche Effekt des anatomischen Hintergrundrauschens auf die Detektierbarkeit von pulmonalen Rundherden legt nahe, dass mehrere Projektionsebenen das Potential haben, die Detektionsrate von Lungenrundherden zu erhöhen (SAMEI et al. 2003). In diesem Zusammenhang ist zu diskutieren, wie viele Projektionsebenen als Standard bei der Suche nach pulmonalen Rundherden angefertigt werden sollten. Hierbei muss der Nutzen/Mehrwert einer zusätzlichen dritten Aufnahme gegenüber dem Strahlenschutz des Haltepersonals abgewogen werden. Für die vorliegende Untersuchung muss kritisch hinterfragt werden, ob die Durchführung der Projektionsradiographie in zwei Ebenen dazu geführt hat, dass pulmonale Rundherde übersehen werden. In der Literatur werden schon seit längerer Zeit von vielen Autoren bei der Suche nach pulmonalen Rundherden drei Projektionsebenen bevorzugt. Dies ist dem Umstand geschuldet, dass nur die während der Untersuchung oben liegenden Lungenanteile gut ventiliert sind, und damit der eigentliche Vorteil der Lunge als „Hochkontrastorgan“ verloren geht oder zumindest eingeschränkt wird (AHLBERG et al. 1985, LANG et al. 1986, PECHMAN 1987, FORREST 1992). Die Diskussion um zwei versus drei Ebenen bleibt in der Literatur jedoch kontrovers. Einzelne Autoren stellten in einem Gruppenvergleich fest, dass sich die Diagnose zwischen positiver und negativer Befundung gegenüber der von zwei Ebenen um 12 bis 15 % unterscheidet (OBER und BARBER 2006). Einschränkend muss jedoch gesagt werden, dass kein Goldstandard als Bezugsgröße (CT oder pathologische Untersuchung) herangezogen wurde. Als am schlechtesten erwiesen 40 Diskussion sich in der zitierten Studie zwei orthogonale Projektionen. Als sensitiver erwies sich die Beurteilung der beiden seitlichen Projektionen, gefolgt von den drei Ebenen als empfohlenen Standardprotokoll bei der Metastasensuche. Andere Autoren beschreiben ebenfalls die beiden seitlich anliegenden Projektionen unter den zwei Ebenen am sensitivsten, eine Projektion in drei Ebenen brachte eine zusätzliche Sensitivitätssteigerung (LANG et al. 1986). Eine weitere Studie hingegen konnte keinen statistisch signifikanten Unterschied zwischen einer, zwei oder drei Ebenen feststellen (BARTHEZ et al. 1994). Bei vorliegender Untersuchung wurden zwei orthogonale Projektionsebenen verwendet. Dies liegt darin begründet, dass es sich nicht um eine prospektive Untersuchung handelt, die speziell auf die Detektion von Rundherden ausgelegt war. Vielmehr wurden retrospektiv Thoraxröntgenbilder ausgewertet, die allgemein darauf ausgerichtet waren Thoraxpathologien zu erkennen. Eine ventrodorsale Projektion bietet dafür andere Vorteile im klinischen Alltag, wie etwa die Detektion kleinerer Flüssigkeitsmengen im Pleuralspalt (SUTER et al. 1974). Eine weitere Möglichkeit, den Limitationen durch Überlagerung von Strukturen entgegenzuwirken, stellt die Anwendung eines Schnittbildverfahrens wie der CT dar, mit der anatomische Strukturen überlagerungsfrei dargestellt werden. Für die Veterinärmedizin liegt nur eine Studie vor, die den Einfluss technischer Parameter auf die Bildgüte der CT-Untersuchung und damit die Detektierbarkeit von Rundherden näher beleuchtet: In dieser Studie war die Rundherddetektion umso höher, je kleiner die Kollimation gewählt wurde (JOLY et al. 2009). In unserer Studie wurde der Einfluss unterschiedlicher Kollimationen nicht untersucht, es kam jedoch eine einheitlich enge Kollimation von 1,5 mm zur Anwendung. In humanmedizinischen Studien zur Detektion pulmonaler Rundherde kommen in der Regel wesentlich breitere Kollimationen von bis zu 10 mm zum Einsatz (EL-BAZ et al. 2013). Ein weiterer technischer Einflussfaktor sowohl für die CT-Auswertung als solches als auch bei der automatischen Rundherddetektion stellt vor allem die gewählte Schichtdicke dar. In der Humanmedizin gibt es zahlreiche Studien, die eine positive Korrelation zwischen hoher Detektionsrate und einer geringen Schichtdicke belegen (BROWN et al. 2003, KIM et al. 2005, GURUNG et al. 2006, GODOY et al. 2013). 41 Diskussion Abgesehen von den Parametern der Bildentstehung ist die Detektionsrate auch von den unterschiedlichen CAD-Systemen abhängig und je nach zugrunde liegendem Algorithmus fällt die Detektionsrate unterschiedlich hoch aus (ARMATO et al. 1999, ACHENBACH 2003, BAE et al. 2005, DAS et al. 2006, EL-BAZ et al. 2013). Allerdings sind die einzelnen Untersuchungen zur Leistungsfähigkeit der unterschiedlichen CAD-Systeme aufgrund der sehr unterschiedlichen Studiendesigns schwer miteinander vergleichbar und weisen deswegen in der Literatur hohe Schwankungen in der Sensitivität auf. Die Literaturangaben reichen von 38 % bis 100 % bei einer Studie am Phantom (WORMANNS et al. 2002, ACHENBACH 2003, BAE et al. 2005, EL-BAZ et al. 2013). Einig sind sich jedoch sämtliche Studien inklusive unserer, dass die CAD – unabhängig vom CAD-System – die Sensitivität des Untersuchers steigern kann. Die Art des CAD-Systems spielt hierbei sogar nur eine untergeordnete Bedeutung für einige Untersucher (DAS et al. 2006, CHRISTE et al. 2013, EL-BAZ et al. 2013, FIRMINO et al. 2014). Unabhängig von den beschriebenen technischen Einflussfaktoren und den unterschiedlichen Algorithmen der CAD-Systeme hängt die Detektionsrate grundsätzlich von den Untersuchern ab. Hierbei zeigte sich in einer tiermedizinischen Untersuchung, dass die Detektionsrate pulmonaler Veränderungen in der CT sogar mehr von den Untersuchern als von der Technik beeinflusst wird (JOLY et al. 2009). Auch aus der Humanmedizin ist beschrieben, dass der Erfahrungsgrad eines Radiologen einen maßgeblichen Einfluss auf die Detektionsrate pulmonaler Rundherde hat (MARTEN et al. 2005). Einigkeit herrscht bei den meisten Autoren darüber, dass nicht nur unerfahrene Begutachter von dem CAD-System profitieren (AWAI et al. 2004, MARTEN et al. 2005, BEYER et al. 2007). Kontrovers hingegen wird diskutiert, wie groß die Leistungssteigerung mithilfe des CAD-Systems ausfällt und inwiefern die CAD einen Zweitbefunder ersetzen kann (MARTEN et al. 2005). Einzelne Autoren gehen davon aus, dass sowohl jüngere Assistenzärzte als auch langjährig erfahrene Radiologen gleichermaßen von den CAD-Systemen profitierten (AWAI et al. 2004, FRAIOLI et al. 2007). Allerdings wiesen die „unerfahrenen“ Radiologen zum Teil einen Erfahrungsschatz von 4–5 Jahren in der Thoraxradiologie auf. Andere Autoren hingegen gehen davon aus, dass ein CAD- System einen Zweitbefunder bei einem erfahrenen Radiologen 42 Diskussion ersetzen kann, die Kombination aus einem weniger erfahrenen Radiologen mit einem CAD-System hingegen wurde als unzureichend beurteilt (MARTEN et al. 2005). Der Einfluss unterschiedlicher Erfahrungsstufen auf die Detektion von pulmonalen Rundherden wurde in unserer Studie nicht explizit untersucht, allerdings konnten auch in unserer Studie in Übereinstimmung mit der humanmedizinischen Literatur beide Radiologen eine Sensitivitätssteigerung bei ihrer Detektionsrate verzeichnen. Schlussfolgerung ist, dass die CAD angewendet werden sollte, wenn nur ein Untersucher zur Verfügung steht. Vorteil der CAD gegenüber einem Untersucher ist dabei die Tatsache, dass die CAD nach strengen (physikalischen) Rechenalgorithmen vorgeht (AWAI et al. 2004, BAE et al. 2005). So verwundert es auch nicht, dass die Anzahl der detektierten Rundherde bei allen Durchgängen zu hundert Prozent zuverlässig reproduzierbar war. Die Intraobservervariabilität wurde bei unserer Studie für die beiden Radiologen nicht untersucht, da es Ziel der vorliegenden Arbeit war das CAD-System zu testen und nicht die Untersucher. In der Literatur wird allerdings beschrieben, dass die Intraobservervariabilität natürlicherweise Schwankungen unterworfen ist – zumal auch bekannt ist, dass Zeitdruck ein wesentlicher Parameter bei falschen Befundungen darstellt (MARTEN et al. 2005, ZHAO et al. 2012). Gleichzeitig liegt in der unterschiedlichen „Vorgehensweise“ zwischen CAD und Mensch die Limitation des CAD-Systems, das nur sehr eingeschränkt in der Lage ist, die Krankheitswertigkeit von Läsionen einzustufen. Beispielsweise fällt es diesem schwer, subsolide Veränderungen wie etwa milchglasartige Verdichtungen und schlecht abgrenzbare, konfluierende Rundherde zu erkennen und zu bewerten (JEONG et al. 2007, FUNAMA et al. 2009, EL-BAZ et al. 2013, MUNDEN und GODOY 2013, FIRMINO et al. 2014). Dies ist wahrscheinlich auch der Hauptgrund, warum die CAD keinen menschlichen Befunder ersetzen kann, sondern nur bei dessen Limitation (wie z. B. eine schwankende Intraobservervariabilität) ergänzend beistehen kann. Unsere erste Studie weist ein retrospektives Studiendesign auf, das heißt, es wurden erst die Röntgenbefunde evaluiert und anschließend die dazugehörigen CTUntersuchungen. Vorteil hierbei ist, dass die initialen Röntgenbefunde nicht mehr nachträglich angepasst wurden, auch wenn retrospektiv ein Rundherd gesehen 43 Diskussion worden war – das Studiendesign spiegelt also die tatsächlichen klinischen Gegebenheiten wider. Es bleibt zu spekulieren, ob eine prospektive Studie von Vorteil gewesen wäre. Für die Untersuchung der Leistungsfähigkeit der Projektionsradiographie wurde als Goldstandard die CT-Untersuchung gewählt. Diese ist aufgrund der zuvor dargelegten Unterschiede in den Modalitäten allgemein als Goldstandard auch in der Rundherdsuche in der Humanmedizin akzeptiert (ABOLMAALI und VOGL 2004, MUNDEN und GODOY 2013). Es stellt sich die Frage, inwiefern eine pathologische Untersuchung einen besseren Goldstandard dargestellt hätte. Diese Frage ist aufgrund des klinischen Studiendesigns unserer Untersuchung nicht zu beantworten und Untersuchungen zum direkten Vergleich zwischen Pathologie und CT sind vermutlich aufgrund derselben Limitationen rar oder nicht existent. Auch für den zweiten Untersuchungsabschnitt zur Bewertung der CAD ergibt sich als Limitation die Frage nach dem Goldstandard. Dieser wurde durch die beiden Untersucher unter Zuhilfenahme der CAD-Ergebnisse festgesetzt – bei fehlendem Konsensus wurde ein dritter Radiologe in die Entscheidung mit einbezogen. Je nachdem, welche Radiologen den Goldstandard definieren und damit die „wahre" Anzahl an Rundherden festlegen, kann die Sensitivität der einzelnen Radiologen sehr unterschiedlich ausfallen – tendenziell umso niedriger, wenn der Goldstandard nicht selbst festgelegt wurde (ARMATO et al. 2009). Die Sensitivitäten lagen je nach Definition der wahren Anzahl von Rundherden in dieser groß angelegten Studie zwischen 51 % und 83,2 % (ARMATO et al. 2009). Darüber hinaus zeigt sich, dass in der zitierten Studie zwar die gleiche Anzahl an Rundherden benannt wurde, dass aber stellenweise unterschiedliche Rundherde markiert worden waren. In unserer Studie wurde der Goldstandard definiert als Konsensusentscheidung der beiden Radiologen, die an der Untersuchung zur Sensitivität beteiligt waren. Diese Bias erklärt möglicherweise, warum unsere Studie so hohe Sensitivitäten aufwies. Um eine größtmögliche Objektivität zu erreichen wurde unser Referenzstandard unter Erkenntnis/Einbezug der CAD-Ergebnisse und in fraglichen Fällen auch unter Zuhilfenahme eines dritten Radiologen festgesetzt. Der hier gewählte Weg zur Festsetzung eines Goldstandards ist eine etablierte Methode zur Evaluierung eines CAD-Systems (BAE et al. 2005, BEIGELMAN-AUBRY et al. 2007, 44 Diskussion BROCHU et al. 2007, BLEY et al. 2008, HARTMANN 2011, BOGONI et al. 2012, CHRISTE et al. 2013, FIRMINO et al. 2014). In unserer Untersuchung erklärt sich die initiale Diskrepanz in der Detektionsrate der beiden Untersucher in einem Teil der Fälle lediglich in der unterschiedlichen Größenwahrnehmung der Rundherde mit einem Durchmesser von etwa 3 mm. Das heißt, aufgrund der beschriebenen Einschlusskriterien musste sich jeder Untersucher entscheiden, ob der detektierte Rundherd einen Durchmesser von 3 mm oder mehr aufweist (und damit in die Statistik der detektierten Herde aufgenommen wird) oder ob dieser kleiner als 3 mm ist. Hier lassen sich Messfehler bei der Größenbeurteilung der Rundherde nicht ausschließen, so dass möglicherweise die Anzahl der Rundherde, welche bei 3 mm lagen, nicht korrekt eingeschätzt wurden. Zusätzlich hängt mit der Frage nach der Größenbeurteilung der Rundherde auch die Frage nach der Intraobservervariabilität zusammen. In vorliegender Studie wurde die Intraobservervariabilität der menschlichen Befunder nicht untersucht. Die tatsächliche klinische Bedeutung der möglichen Intraobservervariabilität bleibt zweifelhaft. Williams et al. untersuchten in einer Studie mit 22 Hunden und 7 Katzen die Intraobservervariabilität von acht Radiologen hinsichtlich der Größenbeurteilung pulmonaler Rundherde für die Projektionsradiographie. Die Intraobservervariabilität betrug 16 %. Die Autoren der Studie kommen zu dem Schluss, dass die gefundene Intraobservervariabilität vermutlich nicht signifikant ist (WILLIAMS et al. 2014). Die Intraobservervariabilität der CAD lag in unserer Studie zuverlässig bei 100 %. 4.2 Diskussion der Ergebnisse In der hier vorliegenden ersten Studie war bezogen auf eine ja/nein Entscheidung mit der CT-Untersuchung als Referenzstandard eine Röntgensensitivität von insgesamt 61 % nachweisbar. Dabei sind die Ergebnisse der Untersuchungen zur Projektionsradiographie vermutlich etwas optimistischer zu werten als sie hier dargestellt werden: Es wurden nur Patienten in die Studie mit aufgenommen, deren klassische Röntgenuntersuchung pulmonale Rundherde aufwies und bei denen innerhalb von 14 Tagen sowohl eine Röntgen- als auch CT-Untersuchung des Thorax durchgeführt wurden. Problematisch zu sehen ist, dass bei jenen Tieren, bei 45 Diskussion denen die Lungenrundherde bereits in der Projektionsradiographie zweifelsfrei detektiert worden waren, in der Regel auf Besitzerwunsch keine nachfolgende CTUntersuchung mehr zum Einsatz kam. Aufgrund der Vorselektion des Patientengutes gemäß den genannten Leistungsfähigkeit der Einschlusskriterien ist anzunehmen, dass die Projektionsradiographie mit einer Detektionsrate von durchschnittlich 61 % in unserer Studie deutlich unterschätzt wird. Es gibt bislang zwei tiermedizinische Untersuchungen mit einem ansatzweise vergleichbaren Studiendesign wie in vorliegender Arbeit, wobei die dortigen Fallzahlen deutlich kleiner ausfielen (NEMANIC et al. 2006, ALEXANDER et al. 2012). Gleichzeitig wurden mit vorliegender Studie erstmals Daten zur Detektionsrate bei der Rundherdsuche der Katzenlunge mit einbezogen. Auch wurde in unserer Studie die Priorität auf die Einschätzung der Leistungsfähigkeit der Projektionsradiographie bei der Rundherdsuche als solches gelegt – losgelöst von einzelnen Tumorentitäten (HOLT et al. 1992, BAUMANN et al. 2004, EBERLE et al. 2011). Alexander et al (2012) vergleichen die Leistungsfähigkeit von Röntgen- und CT-Untersuchung für die Suche nach pulmonalen Rundherden von 21 Hunden, wobei für die Detektionsrate im Sinne einer qualitativen ja/nein Entscheidung kein Unterschied verzeichnet werden konnte. Allerdings zeigte die CT-Untersuchung bezogen auf die absolute Anzahl an Rundherden eine deutliche Überlegenheit (ALEXANDER et al. 2012). Betrachtet man die Ergebnisse getrennt für Hund und Katze, so wies die Projektionsradiographie bei Katzen eine Detektionsrate von 55 % auf, bei Hunden betrug diese 64 %. In einer Studie von Armbrust et al (2012) wurden die Sensitivitäten zwischen Röntgen- und CT-Untersuchungen anhand der Thoraxaufnahmen von 33 Hunden gegenübergestellt. Verglichen mit der CT als Referenzstandard betrug die Detektionsrate für die Projektionsradiographie im Sinne einer ja/nein Entscheidung insgesamt 80 %. Allerdings schwankte die Detektionsrate für die Projektionsradiographie je nach Anzahl der angefertigten Projektionsebenen zwischen 71 % und 95 % (ARMBRUST et al. 2012). In unserer ersten Studie, welche die Detektionsrate der Projektionsradiographie im Vergleich zur CT-Untersuchung für Hunde und Katzen erfasst, ergibt sich mit der Sensitivität von 61 % ein Wert, der zwischen denen der genannten Untersuchungen liegt. Dies könnte in der wesentlich höheren Fallzahl unserer Untersuchung begründet liegen. 46 Diskussion Zum Einfluss der Rundherdgröße auf die Detektionsrate pulmonaler Rundherde gibt es unterschiedliche Einschätzungen. Nemanic et al. (2006) geben in ihrer Studie als Hauptgrund für eine fehlende Detektion eine geringe Rundherdgröße an. Anders als in der Studie von Nemanic et al. (2006) stellt die Kleinheit der Objekte in unserer Untersuchung zwar einen wesentlichen Faktor, aber nicht das herausstechende Merkmal dar. Vielmehr zeigt sich auch ein erheblicher Einfluss der anatomischen Umgebung für das Röntgenbild als Summationsbild. Unterstützt werden unserer Studienergebnisse durch die tiermedizinische Studie von Alexander et al. (2012), die der Lokalisation bzw. der anatomischen Umgebung eine wesentliche Bedeutung beimessen. Auch in der humanmedizinischen Literatur wird dieses Ergebnis unserer Arbeit unterstützt (SAMEI et al. 2003). Für die CT als Schnittbildverfahren scheint dies vordergründig keine Rolle mehr zu spielen, wobei die anatomische Umgebung wiederum bei der CAD ein zentrales Thema ist. In vorliegender Arbeit zeigte sich eine hohe Anzahl an falsch positiven Rundherdbefunden, wobei Gefäße, zum Teil in Verbindung mit einer geringgradigen Bewegungsunschärfe, die häufigste Fehlerquelle für die automatische Rundherddetektion darstellen. Dieses Ergebnis steht im Einklang mit der humanmedizinischen Literatur. Eine hohe Sensitivität der CAD erhöht gleichzeitig die Anzahl falsch positiver Befunde. Diese Ambivalenz stellt in der Humanmedizin ein bekanntes Problem dar. Wie in der vorliegenden Untersuchung zeigt auch die humanmedizinische Literatur die Problematik des automatische Detektionssystem auf, Rundherde von benachbarten Strukturen (Gefäßen, Pleura) mithilfe der Hounsfield Einheiten abzugrenzen (BAE et al. 2005, GOO 2011, EL-BAZ et al. 2013). Seitdem gibt es zahlreiche Versuche mit unterschiedlichen CAD-Algorithmen diese Limitationen zu minimieren (MACMAHON 2000, LEE et al. 2001, ACHENBACH 2003, BAE et al. 2005, LI et al. 2008, EL-BAZ et al. 2013). Dennoch ist diese Ambivalenz – ein möglichst hohe Detektionsrate bei einer möglichst niedrigen falsch positiv Rate – trotz aller Verbesserungen bis heute ein wichtiges Ziel in der Weiterentwicklung der CAD- Systeme geblieben (SIEREN et al. 2010, EL-BAZ et al. 2013). In unserer Untersuchung ist diese Anzahl an falsch positiven Befunden relativ hoch verglichen mit Studien aus der Humanmedizin (BROWN et al. 2003, BAE et al. 47 Diskussion 2005, WIEMKER et al. 2005). Dies ist vermutlich darauf zurückzuführen, dass für die CT-Untersuchung eine Narkose notwendig ist, was möglicherweise mit einem gewissen Anteil an minderbelüfteten, transparenzgeminderten Arealen einhergeht. Zudem ist eine willentliche Beeinflussung der Atmung bei unseren Patienten nicht möglich. Beide Tatsachen erschweren zusätzlich zu den bereits bekannten Problemen aus der Humanmedizin die scharfe Abgrenzung pulmonaler Rundherde von umliegenden Strukturen. Die in der eigenen Studie gefundene Sensitivität des CAD-Systems hingegen war relativ gering. In den späten 90er Jahren wurde die Detektion von 1–2 mm großen pulmonalen Rundherden in der Humanmedizin schon fast zur Routine, gleichzeitig fällt die Einordnung dieser kleinen Rundherde in ihrer Krankheitswertigkeit schwer (MARTEN et al. 2005). Es ist aber davon auszugehen, dass viele dieser Herde in ihrer klinischen Bedeutsamkeit eher eine untergeordnete klinische Relevanz nach sich ziehen – viele dieser kleinen Herde stellen einen Zufallsbefund dar und sind mehrheitlich benigne. Im Vergleich zur vorliegenden Studie scheinen in der Humanmedizin seltener eine große Anzahl von pulmonalen Rundherden bei der initialen Detektion zeitgleich vorzuliegen. Stattdessen gibt es einige humanmedizinische Untersuchungen, die sich mit dem Umgang bzw. der weiteren Vorgehensweise bei einem zufällig detektierten einzelnen Lungenrundherd beschäftigen (HOFFMANN und DIENEMANN 2000). Allerdings ist für die Tiermedizin belegt, dass die CT-Untersuchung genauer als die projektionsradiographische Untersuchung nicht nur die Anzahl der Läsion zu bestimmen vermag, sondern häufig auch Vorteile bei der Einschätzung von Ausmaß und Lokalisation einer Läsion aufweist. Dies wiederum hat in vielen Fällen Auswirkung auf das weitere therapeutische Vorgehen (PRATHER et al. 2005). Als klinische Konsequenz ergibt sich, dass sich die Projektionsradiographie nach wie vor als kostengünstiges und effizientes Untersuchungsverfahren als primäres Diagnostikum zur Detektion pulmonaler Rundherde eignet. Insgesamt kann für die Projektionsradiographie für die Detektion pulmonaler Rundherde von einer Sensitivität von mindestens 61 % bei Hund und Katze ausgegangen werden. In denjenigen Fällen, in denen ein genaues Staging für den Patienten notwendig ist, sollte jedoch auf die klassische Röntgenuntersuchung eine CT-Untersuchung folgen. 48 Diskussion Darüber hinaus konnte gezeigt werden, dass sich die Sensitivität der CTUntersuchung bei der Detektion pulmonaler Rundherde durch den Einsatz eines automatischen Detektionssystems steigern lässt. Die CAD eignet sich insbesondere dann, wenn nur ein Befunder vorhanden ist. Nachteil der CAD ist die hohe Anzahl an falsch positiven und falsch negativen Ergebnissen, so dass diese sich zum jetzigen Zeitpunkt nur sehr eingeschränkt zum Einsatz in der Veterinärmedizin eignet. 49 Zusammenfassung 5 Zusammenfassung Christian Niesterok Möglichkeiten und Grenzen von Projektionsradiographie und Computertomographie bei der Detektion pulmonaler Rundherde bei Hund und Katze Klinik für Kleintiere der Veterinärmedizinischen Fakultät der Universität Leipzig Eingereicht im Juni 2016 (53 Seiten, 5 Abbildungen, 3 Tabellen, 128 Literaturangaben, 2 Publikationen) Schlüsselwörter: Computertomographie, Röntgen, Metastasen, Hund, Katze, Lungenherde Einleitung: Der frühzeitigen Detektion pulmonaler Rundherde kommt eine Schlüsselrolle bei neoplastischen Erkrankungen von Hund und Katze zu, indem sie maßgeblich Prognose und Behandlungsoptionen beeinflusst. Ziel unserer ersten Studie war, die aktuelle diagnostische Wertigkeit und mögliche Limitationen der klassischen Röntgenuntersuchung bei der Detektion pulmonaler Rundherde darzustellen. Unsere zweite Untersuchung beschäftigt sich mit dem Ziel der computerassistierten Detektion (CAD) und deren Einsatz in der Tiermedizin. Material und Methoden: Der Untersuchungszeitraum umfasste die Jahre 2005–2011. In die erste Studie wurden Hunde und Katzen mit pulmonalen Rundherden aufgenommen, an denen zunächst eine klassische Röntgenuntersuchung und anschließend innerhalb von 14 Tagen eine computertomographische Untersuchung (CT) durchgeführt wurde. Neben der Darstellung möglicher Limitationen der klassischen Röntgenuntersuchung wurde auch deren Sensitivität hinsichtlich des Vorliegens pulmonaler Rundherde im Vergleich zur CT als Goldstandard untersucht. Gemäß den Einschlusskriterien wurden 50 Hunde und 20 Katzen in die erste Studie aufgenommen. Die zweite Untersuchung beschäftigt sich mit der Sensitivität eines computerassistierten Detektionssystems sowie dessen möglichen Mehrgewinns für den Radiologen bei der Detektion pulmonaler Rundherde in der Tiermedizin. Darüber 50 Zusammenfassung hinaus wurden die möglichen Limitationen eines solchen Systems untersucht. In die Untersuchung wurden nicht nur Tiere mit Rundherden eingeschlossen, sondern auch solche mit Massen (Herde größer 3 cm). Ausgeschlossen waren Patienten mit mehr als 50 Rundherden pro Lungenhälfte sowie Rundherde/Massen, die vollständig in Atelektasen eingebettet waren. Gemäß den Einschlusskriterien wurden bei 51 Hunden und 16 Katzen insgesamt 586 Rundherde als Referenzwert für die CAD zugrunde gelegt. Ergebnisse: Als ein Ergebnis aus der vorliegenden ersten Studie zeigt sich für die Projektionsradiographie eine Detektionsrate von insgesamt 61 % (64 % für Hunde und 55 % für Katzen) verglichen mit der CT als Goldstandard. Gründe für eine fehlende Detektion liegen vor allem darin, dass die Röntgenuntersuchung im Ergebnis ein Summationsbild liefert. Daneben spielt auch die Rundherdgröße eine (untergeordnete) Rolle. Das in der zweiten Studie eingesetzte Detektionssystem zur computerassistierten Detektion pulmonaler Rundherde wies für die Tiermedizin eine Sensitivität von 69,4 % auf. Gleichzeitig wurde eine hohe Anzahl falsch positiver sowie falsch negativer Befunde durch die CAD verzeichnet. Dennoch ließ sich durch den Einsatz der CAD die Sensitivität von Untersucher 1 von 89,2 % auf 94,7 % steigern, die von Untersucher 2 von 87,4 % auf 90,8 %. Schlussfolgerungen: Aufgrund der engen Einschlusskriterien dieser Studie kann für die Detektion pulmonaler Rundherde in der Projektionsradiographie als Mindestwert die hier ermittelte durchschnittliche Sensitivität von 61 % zugrunde gelegt werden. Die klassische Röntgenuntersuchung eignet sich weiterhin als erstes bildgebendes Verfahren für die pulmonale Rundherddetektion, für ein genaues Staging sollte allerdings die CT angewandt werden. Für eine fehlende Rundherddetektion war nicht primär die geringe Größe der Rundherde ursächlich, sondern vielmehr Begleiterkrankungen, die mit einer Transparenzminderung der Lunge einhergingen. Daher sollte insbesondere dann die CT zum Einsatz kommen, wenn zusätzliche Veränderungen wie beispielsweise ein Pleuraerguss vorliegen. Für die Detektion pulmonaler Rundherde in der CT-Untersuchung gilt, dass die Sensitivität des Radiologen grundsätzlich durch ein automatisches Detektionssystem gesteigert werden kann. Somit eignet es sich insbesondere dann, wenn kein zweiter radiologischer Befunder vorhanden ist. Allerdings weist die CAD eine sehr hohe Anzahl falsch positiver sowie einige falsch negative Befunde auf, so dass sich für ihren routinemäßigen Einsatz in der Tiermedizin derzeit noch Limitationen ergeben. 51 Summary 6 Summary Christian Niesterok Prospects and limitations of projection radiography and computed tomography in detection of pulmonary nodules in dogs and cats Department of Small Animal Medicine, University of Leipzig Submitted in June 2016 (53 pages, 5 figures, 3 tables, 128 references, 2 papers) Keywords: computed tomography, radiographs, metastases, dog, cat, pulmonary nodules Introduction: The early detection of pulmonary nodules plays a key role in neoplastic conditions of dogs and cats substantially influencing prognosis and therapy options. The aim of our first study was to outline the actual diagnostic value as well as the potential limitations of projection radiography for detection of pulmonary nodules. Our second study addresses the newer aspect of computer assisted detection (CAD) and its possible application in veterinary medicine. Materials and methods: The investigation period was between 2005 and 2011. In our first study we included those dogs and cats with pulmonary nodules that underwent a radiographic examination as well as a computed tomographic examination (CT) within a period of 14 days. Aside from the description of possible limitations of projection radiography, we also evaluated its sensitivity for detection of pulmonary nodules compared to CT as gold standard. According to the inclusion criteria 50 dogs and 20 cats were admitted to this study. The second study dealt with the sensitivity of a computer assisted detection system and its potential benefit for radiologists for the detection of pulmonary nodules in veterinary medicine. Furthermore, we outlined possible limitations of the detection system. This study not only comprised dogs and cats with pulmonary nodules, but also those with pulmonary masses (i.e. nodules > 3 cm). We excluded patients with more than 50 nodules either in the right or the left lung as well as nodules/masses embedded in a massive atelectasis. 52 Summary According to our inclusion criteria, we determined 586 nodules in total, distributed on 51 dogs and 16 cats used as reference value for the CAD. Results: As one result of our first study, we found a detection rate of 61 % (64 % for dogs and 55 % for cats) for projection radiography in comparison to CT as gold standard. Reasons for a missing detection of pulmonary nodules are predominantly limitations that come along with superimpositions using projection radiography; apart from that, nodule size is of some subsidiary meaning. The detection system for the computer assisted detection of pulmonary nodules used in the second study showed a sensitivity of 69.4 % in veterinary medicine. Additionally a high number of false positive findings as well as false negative findings was detected by CAD. However, due to the use of CAD the sensitivity of examiner 1 increased from 89.2 % to 94.7 %, the sensitivity of examiner 2 increased from 87.4 % to 90.8 %. Conclusions: Based on the strict inclusion criterion in this study the average sensitivity of 61 % can be used as a minimum for the detection of pulmonary nodules using radiographs. Projection radiography is suitable as first line diagnostic tool for the detection of pulmonary nodules. For accurate tumor staging CT should be used. Since predominant reasons for a missing detection of pulmonary nodules consisted of limitations that come along with superimpositions (like pleural effusion) CT is especially recommended in those cases. In general, the sensitivity of radiologists can be improved by an automatic detection system concerning the detection of pulmonary nodules using CT. Especially in those cases, when no second reader is available, CAD is suitable. However, the CAD system we used herein yielded a high number of false positive findings as well as false negative findings; therefore, its use in veterinary medicine on a routine basis still has some limitations. 53 Literaturverzeichnis 7 Literaturverzeichnis Aarsvold S, Reetz JA, Reichle JK, Jones ID, Lamb CR, Evola MG, Keyerleber MA, Marolf AJ. Computed tomographic findings in 57 cats with primary pulmonary neoplasia. Vet Radiol Ultrasound. 2015;56(3):272-277. Abolmaali ND, Vogl TJ. Moderne Diagnostik von Lungenrundherden. Radiologe. 2004;44(5):472-483. Achenbach T. Computerunterstützte Diagnostik in der Thoraxradiologie- aktuelle Schwerpunkte und Techniken. RöFo. 2003(175):1471-1481. Adams VJ, Evans KM, Sampson J, Wood JLN. Methods and mortality results of a health survey of purebred dogs in the UK. J Small Anim Pract. 2010;51(10):512-524. Ahlberg N-E, Hoppe F, Kelter U, Svensson L. A Computed Tomographic Study of volume and x-ray attenuation of lungs of beagles in various body positions. Vet Radiol Ultrasound. 1985;26(2):43-47. Alef M, Oechtering 1998;26(5):302-314. G. Überlegungen zum Narkoserisiko. Tierärztl Prax. Alexander K, Joly H, Blond L, D'Anjou M-A, Nadeau M-È, Olive J, Beauchamp G. A comparison of computed tomography, computed radiography, and film-screen radiography for the detection of canine pulmonary nodules. Vet Radiol Ultrasound. 2012;53(3):258-265. Armato SG, 3rd, Giger ML, Moran CJ, Blackburn JT, Doi K, MacMahon H. Computerized detection of pulmonary nodules on CT scans. Radiographics. 1999;19(5):1303-1311. Armato SG, 3rd, Li F, Giger ML, MacMahon H, Sone S, Doi K. Lung cancer: performance of automated lung nodule detection applied to cancers missed in a CT screening program. Radiology. 2002;225(3):685-692. Armato SG, 3rd, Roberts RY, Kocherginsky M, Aberle DR, Kazerooni EA, Macmahon H, van Beek EJ, Yankelevitz D, McLennan G, McNitt-Gray MF, Meyer CR, Reeves AP, Caligiuri P, Quint LE, Sundaram B, Croft BY, Clarke LP. Assessment of 54 Literaturverzeichnis radiologist performance in the detection of lung nodules: dependence on the definition of "truth". Acad Radiol. 2009;16(1):28-38. Armbrust LJ, Biller DS, Bamford A, Chun R, Garrett LD, Sanderson MW. Comparison of three-view thoracic radiography and computed tomography for detection of pulmonary nodules in dogs with neoplasia. J Am Vet Med Assoc. 2012;240(9):10881094. Awai K, Murao K, Ozawa A, Komi M, Hayakawa H, Hori S, Nishimura Y. Pulmonary nodules at chest CT: effect of computer-aided diagnosis on radiologists' detection performance. Radiology. 2004;230(2):347-352. Bae KT, Kim JS, Na YH, Kim KG, Kim JH. Pulmonary nodules: automated detection on CT images with morphologic matching algorithm--preliminary results. Radiology. 2005;236(1):286-293. Ballegeer EA, Forrest LJ, Jeraj R, Mackie TR, Nickles RJ. PET/CT following intensitymodulated radiation therapy for primary lung tumor in a dog. Vet Radiol Ultrasound. 2006;47(2):228-233. Ballegeer EA, Forrest LJ, Stepien RL. Radiographic appearance of bronchoalveolar carcinoma in nine cats. Vet Radiol Ultrasound. 2002;43(3):267-271. Barthez PY, Hornof WJ, Theon AP, Craychee TJ, Morgan JP. Receiver operating characteristic curve analysis of the performance of various radiographic protocols when screening dogs for pulmonary metastases. J Am Vet Med Assoc. 1994;204(2):237-240. Baumann D, Hauser B, Hubler M, Fluckiger M. Signs of metastatic disease on thoracic radiographs of dogs suffering from mammary gland tumours: a retrospective study (1990-1998). Schweiz Arch Tierheilkd. 2004;146(9):431-435. Beigelman-Aubry C, Raffy P, Yang W, Castellino RA, Grenier PA. Computer-aided detection of solid lung nodules on follow-up MDCT screening: evaluation of detection, tracking, and reading time. AJR Am J Roentgenol. 2007;189(4):948-955. Bergmann M, Sauter-Louis C, Hirschberger J. Lebensqualität und Lebenserwartung am malignen Lymphom erkrankter Hunde unter Chemotherapie. Eine Besitzerumfrage. Tierärztl Prax. 2011;39(4):229-236. Berry CR, Moore PF, Thomas WP, Sisson D, Koblik PD. Pulmonary lymphomatoid granulomatosis in seven dogs (1976–1987). J Vet Intern Med. 1990;4(3):157-166. 55 Literaturverzeichnis Beyer F, Zierott L, Fallenberg EM, Juergens KU, Stoeckel J, Heindel W, Wormanns D. Comparison of sensitivity and reading time for the use of computer-aided detection (CAD) of pulmonary nodules at MDCT as concurrent or second reader. Eur J Radiol. 2007;17(11):2941-2947. Biederer J, Hintze C, Fabel M. MRI of pulmonary nodules: technique and diagnostic value. Cancer Imaging. 2008;8(1):125-130. Bille C, Auvigne V, Bomassi E, Durieux P, Libermann S, Rattez E. An evidencebased medicine approach to small animal anaesthetic mortality in a referral practice: the influence of initiating three recommendations on subsequent anaesthetic deaths. Vet Anaesth Analg. 2014;41(3):249-258. Bley TA, Baumann T, Saueressig U, Pache G, Treier M, Schaefer O, Neitzel U, Langer M, Kotter E. Comparison of radiologist and CAD performance in the detection of CT-confirmed subtle pulmonary nodules on digital chest radiographs. Invest Radiol. 2008;43(6):343-348. Bogoni L, Ko JP, Alpert J, Anand V, Fantauzzi J, Florin CH, Koo CW, Mason D, Rom W, Shiau M, Salganicoff M, Naidich DP. Impact of a computer-aided detection (CAD) system integrated into a picture archiving and communication system (PACS) on reader sensitivity and efficiency for the detection of lung nodules in thoracic CT exams. J Digit Imaging. 2012;25(6):771-781. Bolliger C. Lungentumore. In: Kessler M. Kleintieronkologie: Diagnose und Therapie von Tumorerkrankungen bei Hund und Katze. Stuttgart: Enke; 2012. p. 315-323. Bonnett BN, Egenvall A, Olson P, Hedhammar Å. Mortality in over 350,000 insured Swedish dogs from 1995–2000: I. Breed-, gender-, age- and cause-specific rates. Acta Vet Scand. 2005;46. Brochu B, Beigelman-Aubry C, Goldmard JL, Raffy P, Grenier PA, Lucidarme O. Computer-aided detection of lung nodules on thin collimation MDCT: impact on radiologists' performance. J Radiol. 2007;88(4):573-578. Brodey RS, Craig PH. Primary pulmonary neoplasms in the dog: a review of 29 cases. J Am Vet Med Assoc. 1965;147(12):1628-1643. Brown MS, Goldin JG, Suh RD, McNitt-Gray MF, Sayre JW, Aberle DR. Lung micronodules: automated method for detection at thin-section CT—initial experience. Radiology. 2003;226(1):256-262. 56 Literaturverzeichnis Christe A, Leidolt L, Huber A, Steiger P, Szucs-Farkas Z, Roos JE, Heverhagen JT, Ebner L. Lung cancer screening with CT: Evaluation of radiologists and different computer assisted detection software (CAD) as first and second readers for lung nodule detection at different dose levels. Eur J Radiol. 2013;82(12):873-878. Cohen D, Reif JS, Brodey RS, Keiser H. Epidemiological analysis of the most prevalent sites and types of canine neoplasia observed in a veterinary hospital. Cancer Res. 1974;34(11):2859-2868. Das M, Muhlenbruch G, Mahnken AH, Flohr TG, Gundel L, Stanzel S, Kraus T, Gunther RW, Wildberger JE. Small pulmonary nodules: effect of two computer-aided detection systems on radiologist performance. Radiology. 2006;241(2):564-571. Dobson JM. Breed-predispositions to cancer in pedigree dogs. ISRN Vet Sci. 2013;2013:941275. Doi K. Computer-aided diagnosis in medical imaging: historical review, current status and future potential. Comput Med Imaging Graph. 2007;31(4-5):198-211. Eberle N, Fork M, von Babo V, Nolte I, Simon D. Comparison of examination of thoracic radiographs and thoracic computed tomography in dogs with appendicular osteosarcoma. Vet Comp Oncol. 2011;9(2):131-140. El-Baz A, Beache GM, Gimel'farb G, Suzuki K, Okada K, Elnakib A, Soliman A, Abdollahi B. Computer-aided diagnosis systems for lung cancer: challenges and methodologies. Int J Biomed Imaging. 2013;2013:942353. Fina C, Vignoli M, Terragni R, Rossi F, Wisner E, Saunders JH. Computed tomographic characteristics of eosinophilic pulmonary granulomatosis in five dogs. Vet Radiol Ultrasound. 2014;55(1):16-22. Firmino M, Morais AH, Mendoça RM, Dantas MR, Hekis HR, Valentim R. Computeraided detection system for lung cancer in computed tomography scans: Review and future prospects. Biomed Eng Online. 2014;13:41-41. Fitzgerald SD, Wolf DC, Carlton WW. Eight cases of canine lymphomatoid granulomatosis. Vet Pathol. 1991;28(3):241-245. Forrest LJ. Radiology corner advantages of the three view radiographic examination Iin instances other than metastasis. Vet Radiol Ultrasound. 1992;33(6):340-341. 57 Literaturverzeichnis Fraioli F, Bertoletti L, Napoli A, Calabrese FA, Masciangelo R, Cortesi E, Catalano C, Passariello R. Volumetric evaluation of therapy response in patients with lung metastases. Preliminary results with a computer system (CAD) and comparison with unidimensional measurements. Radiol Med. 2006;111(3):365-375. Fraioli F, Bertoletti L, Napoli A, Pediconi F, Calabrese FA, Masciangelo R, Catalano C, Passariello R. Computer-aided detection (CAD) in lung cancer screening at chest MDCT: ROC analysis of CAD versus radiologist performance. J Thorac Imaging. 2007;22(3):241-246. Funama Y, Awai K, Liu D, Oda S, Yanaga Y, Nakaura T, Kawanaka K, Shimamura M, Yamashita Y. Detection of nodules showing ground-glass opacity in the lungs at low-dose multidetector computed tomography: phantom and clinical study. J Comput Assist Tomogr. 2009;33(1):49-53. Girvin F, Ko JP. Pulmonary nodules: detection, assessment, and CAD. AJR Am J Roentgenol. 2008;191(4):1057-1069. Godoy MC, Kim TJ, White CS, Bogoni L, de Groot P, Florin C, Obuchowski N, Babb JS, Salganicoff M, Naidich DP, Anand V, Park S, Vlahos I, Ko JP. Benefit of computer-aided detection analysis for the detection of subsolid and solid lung nodules on thin- and thick-section CT. AJR Am J Roentgenol. 2013;200(1):74-83. Goldin JG, Brown MS, Petkovska I. Computer-aided diagnosis in lung nodule assessment. J Thorac Imaging. 2008;23(2):97-104. Goo JM. A computer-aided diagnosis for evaluating lung nodules on chest CT: the current status and perspective. Korean J Radiol. 2011;12(2):145-155. Gottfried S, Popovitch C, Goldschmidt M, Schelling C. Metastatic digital carcinoma in the cat: a retrospective study of 36 cats (1992-1998). J Am Anim Hosp Assoc. 2000;36(6):501-509. Graf R, Grüntzig K, Boo G, Hässig M, Axhausen KW, Fabrikant S, Welle M, Meier D, Guscetti F, Folkers G, Otto V, Pospischil A. Swiss feline cancer registry 1965–2008: the influence of sex, breed and age on tumour types and tumour locations. J Comp Pathol. 2016;154(2–3):195-210. Gurung J, Maataoui A, Khan M, Wetter A, Harth M, Jacobi V, Vogl TJ. Automated detection of lung nodules in multidetector CT: influence of different reconstruction protocols on performance of a software prototype. Rofo. 2006;178(1):71-77. 58 Literaturverzeichnis Hahn KA, McEntee MF. Primary lung tumors in cats: 86 cases (1979-1994). J Am Vet Med Assoc. 1997;211(10):1257-1260. Hansell DM, Bankier AA, MacMahon H, McLoud TC, Müller NL, Remy J. Fleischner Society: glossary of terms for thoracic imaging. Radiology. 2008;246(3):697-722. Hartmann DM. Computer- assistierte Diagnose von intrapulmonalen Rundherden in der Mehrschicht-Spiral Computertomographie: Evaluierung der Sensitivität in Bezug zur Rundherdgröße [Dissertation hum.med.]. Aachen: RWTH Aachen; 2011. Henschke CI, McCauley DI, Yankelevitz DF, Naidich DP, McGuinness G, Miettinen OS, Libby DM, Pasmantier MW, Koizumi J, Altorki NK, Smith JP. Early lung cancer action project: overall design and findings from baseline screening. The Lancet. 1999;354(9173):99-105. Hill M, Hirschberger J, Zimmermann K, Dörfelt R, Reese S, Wergin M. Lebensqualität der Patienten nach primärer und adjuvanter Strahlentherapie in der Kleintieronkologie. Eine Besitzerumfrage. Tierärztl Prax. 2014;42(3):157-165. Hoffmann H, Dienemann H. Der pulmonale Rundherd: Prinzipien der Diagnostik. Dtsch Arztebl International. 2000;97(16):1065-1071. Holt D, Van Winkle T, Schelling C, Prymak C. Correlation between thoracic radiographs and postmortem findings in dogs with hemangiosarcoma: 77 cases (1984-1989). J Am Vet Med Assoc. 1992;200(10):1535-1539. Jeong YJ, Yi CA, Lee KS. Solitary pulmonary nodules: detection, characterization, and guidance for further diagnostic workup and treatment. AJR Am J Roentgenol. 2007;188(1):57-68. Joly H, d'Anjou MA, Alexander K, Beauchamp G. Comparison of single-slice computed tomography protocols for detection of pulmonary nodules in dogs. Vet Radiol Ultrasound. 2009;50(3):279-284. Kalender WA. X-ray computed tomography. Phys Med Biol. 2006;51(13):29-43. Kessler M, Tassani-Prell M, Kandel B. Röntgenologische Erscheinungsformen primärer Lungentumoren bei der Katze - Eine retrospektive Untersuchung von 48 Fällen. Tierärztl Prax. 2007;35(1):47-54. 59 Literaturverzeichnis Kim J, Kwon SY, Cena R, Park S, Oh J, Oui H, Cho KO, Min JJ, Choi J. CT and PETCT of a dog with multiple pulmonary adenocarcinoma. J Vet Med Sci. 2014;76(4):615-620. Kim JS, Kim JH, Cho G, Bae KT. Automated detection of pulmonary nodules on CT images: effect of section thickness and reconstruction interval--initial results. Radiology. 2005;236(1):295-299. Koblik PD. Radiographic appearance of primary lung tumors in cats. Vet Radiol Ultrasound. 1986;27(3):66-73. Kraft W. Geriatrics in canine and feline internal medicine. Eur J Med Res. 1998;3(12):31-41. Kurihara Y, Matsuoka S, Yamashiro T, Fujikawa A, Matsushita S, Yagihashi K, Nakajima Y. MRI of Pulmonary Nodules. AJR Am J Roentgenol. 2014;202(3):210216. Lang J, Brühschwein A. Für Studium und Praxis: Röntgendiagnostik und Indikationen für alternative Verfahren bei Lungenerkrankungen. Tierärztl Prax. 2008;36(6):450460. Lang J, Wortman JA, Glickman LT, Biery DN, Rhodes WH. Sensitivity of radiographic detection of lung metastases in the dog. Vet Radiol Ultrasound. 1986;27(3):74-78. LeBlanc AK, Peremans K. PET and SPECT imaging in veterinary medicine. Semin Nucl Med. 2014;44(1):47-56. Lee Y, Hara T, Fujita H, Itoh S, Ishigaki T. Automated detection of pulmonary nodules in helical CT images based on an improved template-matching technique. IEEE Trans Med Imaging. 2001;20(7):595-604. Li Q, Li F, Doi K. Computerized detection of lung nodules in thin-section CT images by use of selective enhancement filters and an automated rule-based classifier. Acad Radiol. 2008;15(2):165-175. Lopez A. Atmungsorgane. In: McGavin MD, Zachary J. Pathologie der Haustiere. München: Elsevier GmbH; 2009. p. 433-521. Ludewig E, Hirsch W, Bosch B, Gäbler K, Sorge I, Succow D, Werrmann A, Gosch D. Untersuchungen zur Qualität von Thoraxaufnahmen bei Katzen mit einem auf einer 60 Literaturverzeichnis Nadelstruktur basierenden Speicherfoliensystem – Modelluntersuchungen zur Bewertung der Bildqualität bei Neugeborenen. Fortschr Röntgenstr. 2010;182(02):122-132. MacEwen EG. Spontaneous tumors in dogs and cats: models for the study of cancer biology and treatment. Cancer Metastasis Rev. 1990;9(2):125-136. MacMahon H. Improvement in detection of pulmonary nodules: digital image processing and computer-aided diagnosis. Radiographics. 2000;20(4):1169-1177. Marolf AJ, Gibbons DS, Podell BK, Park RD. Computed tomographic appearance of primary lung tumors in dogs. Vet Radiol Ultrasound. 2011;52(2):168-172. Marten K, Engelke C. Computer-aided detection and automated CT volumetry of pulmonary nodules. Eur Radiol. 2007;17(4):888-901. Marten K, Rummeny EJ, Engelke C. Computerassistierter Nachweis und automatisierte Volumetrie pulmonaler Rundherde in der Multislice-CT: Aktueller Stand und Perspektiven. RöFo: Fortschritte auf dem Gebiete der Röntgenstrahlen und der Nuklearmedizin. 2005;177(2):188-196. Mattoon JS, Bryan JN. The future of imaging in veterinary oncology: learning from human medicine. Vet J. 2013;197(3):541-552. McNiel EA, Ogilvie GK, Powers BE, Hutchison JM, Salman MD, Withrow SJ. Evaluation of prognostic factors for dogs with primary lung tumors: 67 cases (19851992). J Am Vet Med Assoc. 1997;211(11):1422-1427. Mehlhaff CJ, Mooney S. Primary pulmonary neoplasia in the dog and cat. Vet Clin North Am Small Anim Pract. 1985;15(5):1061-1067. Mesquita L, Lam R, Lamb CR, McConnell JF. Computed tomographic findings in 15 dogs with eosinophilic bronchopneumopathy. Vet Radiol Ultrasound. 2015;56(1):3339. Miles KG. A review of primary lung tumors in the dog and cat. Vet Radiol Ultrasound. 1988;29(3):122-128. Miles KG, Lattimer JC, Jergens AE, Krause GF. A retrospective evaluation of the radiographic evidence of pulmonary metastatic disease on initial presentation in the dog. Vet Radiol Ultrasound. 1990;31(2):79-82. 61 Literaturverzeichnis Monnier-Cholley L, Arrivé L, Porcel A, Shehata K, Dahan H, Urban T, Febvre M, Lebeau B, Tubiana JM. Characteristics of missed lung cancer on chest radiographs: a French experience. Eur Radiol. 2001;11(4):597-605. Moulton JE, von Tscharner C, Schneider R. Classification of lung carcinomas in the dog and cat. Vet Pathol. 1981;18(4):513-528. Muhm JR, Miller WE, Fontana RS, Sanderson DR, Uhlenhopp MA. Lung cancer detected during a screening program using four-month chest radiographs. Radiology. 1983;148(3):609-615. Munden RF, Godoy MCB. Lung cancer screening: state of the art. J Surg Oncol. 2013;108(5):270-274. Naidich DP, Rusinek H, McGuinness G, Leitman B, McCauley DI, Henschke CI. Variables affecting pulmonary nodule detection with computed tomography: evaluation with three-dimensional computer simulation. J Thorac Imaging. 1993;8(4):291-299. Nemanic S, London CA, Wisner ER. Comparison of thoracic radiographs and single breath-hold helical CT for detection of pulmonary nodules in dogs with metastatic neoplasia. J Vet Intern Med. 2006;20(3):508-515. Nietert PJ, Ravenel JG, Leue WM, Miller JV, Taylor KK, Garrett-Mayer ES, Silvestri GA. Imprecision in automated volume measurements of pulmonary nodules and its effect on the level of uncertainty in volume doubling time estimation. Chest. 2009;135(6):1580-1587. Ober CP, Barber D. Comparison of two- vs. three-view thoracic radiographic studies on conspicuity of structured interstitial patterns in dogs. Vet Radiol Ultrasound. 2006;47(6):542-545. Ogilvie GK, Haschek WM, Withrow SJ, Richardson RC, Harvey HJ, Henderson RA, Fowler JD, Norris AM, Tomlinson J, McCaw D, et al. Classification of primary lung tumors in dogs: 210 cases (1975-1985). J Am Vet Med Assoc. 1989;195(1):106-108. Ogilvie GK, Weigel RM, Haschek WM, Withrow SJ, Richardson RC, Harvey HJ, Henderson RA, Fowler JD, Norris AM, Tomlinson J, et al. Prognostic factors for tumor remission and survival in dogs after surgery for primary lung tumor: 76 cases (1975-1985). J Am Vet Med Assoc. 1989;195(1):109-112. 62 Literaturverzeichnis Oliveira CR, Mitchell MA, O'Brien RT. Thoracic computed tomography in feline patients without use of chemical restraint. Vet Radiol Ultrasound. 2011;52(4):368376. Otoni CC, Rahal SC, Vulcano LC, Ribeiro SM, Hette K, Giordano T, Doiche DP, Amorim RL. Survey radiography and computerized tomography imaging of the thorax in female dogs with mammary tumors. Acta Vet Scand. 2010;52 (1) 20 Paoloni MC, Adams WM, Dubielzig RR, Kurzman I, Vail DM, Hardie RJ. Comparison of results of computed tomography and radiography with histopathologic findings in tracheobronchial lymph nodes in dogs with primary lung tumors: 14 cases (1999– 2002). J Am Vet Med Assoc. 2006;228(11):1718-1722. Pechman RD. Effect of dependency versus nondependency on lung lesion visualisation. Vet Radiol Ultrasound. 1987;28(5):185-190. Postorino NC, Wheeler SL, Park RD, Powers BE, Withrow SJ. A syndrome resembling lymphomatoid granulomatosis in the dog. J Vet Intern Med. 1989;3(1):1519. Pötter-Lang S, Schalekamp S, Schaefer-Prokop C, Uffmann M. Detektion pulmonaler Rundherde. Radiologe. 2014;54(5):455-461. Prather AB, Berry CR, Thrall DE. Use of radiography in combination with computed tomography for the assessment of noncardiac thoracic disease in the dog and cat. Vet Radiol Ultrasound. 2005;46(2):114-121. Quekel LGBA, Kessels AGH, Goei R, van Engelshoven JMA. Miss rate of lung cancer on the chest radiograph in clinical practice. Chest. 1999;115(3):720-724. Randall E, Loeber S, Kraft S. Physiologic variants, benign processes, and artifacts from 106 canine and feline FDG-PET/ computed tomography scans. Vet Radiol Ultrasound. 2014;55(2):213-226. Reif JS, Dunn K, Ogilvie GK, Harris CK. Passive smoking and canine lung cancer risk. Am J Epidemiol. 1992;135(3):234-239. Risetto KC, Lucas P, Fan TM. An update on diagnosing and treating primary lung tumors. Vet med. 2008;103(3):154-169. 63 Literaturverzeichnis Rubin GD. Lung nodule and cancer detection in computed tomography screening. J Thorac Imaging. 2015;30(2):130-138. Samei E, Flynn MJ, Peterson E, Eyler WR. Subtle lung nodules: influence of local anatomic variations on detection. Radiology. 2003;228(1):76-84. Schwarz S, O`Brien R. CT acquisition principles. In: Schwarz T, Saunders J. Veterinary computed tomography. Ames, Iowa: Wiley-Blackwell; 2011. p. 25-27. Schwens C, Thom N, Moritz A. Reaktive und neoplastische histiozytäre Erkrankungen beim Hund. Tierärztl Prax. 2011;39(3):176-190. Seiler RJ. Primary pulmonary osteosarcoma in dog with associated hypertrophic osteopathy. Vet Pathol. 1979;16(3):369-371. Shaiken LC, Evans SM, Goldschmidt MH. Radiographic findings in canine malignant histiocytosis. Vet Radiol Ultrasound. 1991;32(5):237-242. Sieren JC, Ohno Y, Koyama H, Sugimura K, McLennan G. Recent technological and application developments in computed tomography and magnetic resonance imaging for improved pulmonary nodule detection and lung cancer staging. J Magn Reson Imaging. 2010;32(6):1353-1369. Sonntag F, Mihaljević M. Grundlagen der Computertomografie. In: Mihaljević M, Kramer M, Gomerčić H. CT- und MRT-Atlas: Transversalanatomie des Hundes. Stuttgart: Parey; 2009. p. 6. Stephens LC, Gleiser CA, Jardine JH. Primary pulmonary fibrosarcoma associated with Spirocerca lupi infection in a dog with hypertrophic pulmonary osteoarthropathy. J Am Vet Med Assoc. 1983;182(5):496-498. Suter PF, Carrig CB, O'Brien TR, Koller D. Radiographic recognition of primary and metastatic pulmonary neoplasms of dogs and cats. Vet Radiol Ultrasound. 1974;15(2):3-24. Tsai S, Sutherland-Smith J, Burgess K, Ruthazer R, Sato AMY. Imaging characteristics of intrathoracic histiocytic sarcoma in dogs. Vet Radiol Ultrasound. 2012;53(1):21-27. Watson AD, Young KM, Dubielzig RR, Biller DS. Primary mesenchymal or mixedcell-origin lung tumors in four dogs. J Am Vet Med Assoc. 1993;202(6):968-970. 64 Literaturverzeichnis Weller RE, Dagle GE, Perry RL, Park JF. Primary pulmonary chondrosarcoma in a dog. Cornell Vet. 1992;82(4):447-452. White CS, Flukinger T, Jeudy J, Chen JJ. Use of a computer-aided detection system to detect missed lung cancer at chest radiography. Radiology. 2009;252(1):273-281. Wiemker R, Rogalla P, Blaffert T, Sifri D, Hay O, Shah E, Truyen R, Fleiter T. Aspects of computer-aided detection (CAD) and volumetry of pulmonary nodules using multislice CT. Br J Radiol. 2005;78(suppl 1):46-56. Williams JM, Graham JP, Wang C. Interobserver variability of radiographic pulmonary nodule diameter measurements in dogs and cats. J Am Anim Hosp Assoc. 2014;50(2):83-88. Wittenberg R, Peters JF, Sonnemans JJ, Bipat S, Prokop M, Schaefer-Prokop CM. Impact of image quality on the performance of computer-aided detection of pulmonary embolism. Am J Roentgenol. 2011;196(1):95-101. Wormanns D, Fiebich M, Saidi M, Diederich S, Heindel W. Automatic detection of pulmonary nodules at spiral CT: clinical application of a computer-aided diagnosis system. Eur Radiol. 2002;12(5):1052-1057. Wormanns D, Kohl G, Klotz E, Marheine A, Beyer F, Heindel W, Diederich S. Volumetric measurements of pulmonary nodules at multi-row detector CT: in vivo reproducibility. Eur Radiol. 2004;14(1):86-92. Zenker I. Für Studium und Praxis: Allgemeine Aspekte der Chemotherapie in der Kleintierpraxis. Tierärztl Prax. 2005;33(5):384-388. Zhao Y, de Bock GH, Vliegenthart R, van Klaveren RJ, Wang Y, Bogoni L, de Jong PA, Mali WP, van Ooijen PMA, Oudkerk M. Performance of computer-aided detection of pulmonary nodules in low-dose CT: comparison with double reading by nodule volume. Eur Radiol. 2012;22(10):2076-2084. 65 Literaturverzeichnis Danksagung Ohne die Hilfe und den Beistand meiner Freunde, meiner ehemaligen Kollegen aus der Kleintierklinik der Universität Leipzig und vor allem meiner Familie wäre diese Arbeit nicht entstanden. Ihnen allen gilt mein herzlichster Dank! An erster Stelle möchte ich mich bei Herrn Prof. Dr. Gerhard Oechtering und bei Frau Prof. Dr. Michaele Alef bedanken. Herr Prof. Oechtering gab mir die Chance wertvolle Erfahrungen für meine berufliche Zukunft zu sammeln und gewährte mir spannende Einblicke in seine Errungenschaften auf dem Forschungsgebiet der Brachyzephalie. Daneben gewährte mir Herr Prof. Oechtering jederzeit seine Unterstützung und ermöglichte mir die Ausbildung zum Fachtierarzt für kleine Hausund Heimtiere, wofür ich ihm sehr dankbar bin. Nicht weniger Dank gebührt Frau Prof. Alef für die Betreuung dieser Arbeit. Sie schuf darüber hinaus oftmals die organisatorischen Rahmenbedingungen, die zur Entstehung dieser Arbeit beigetragen haben. Mein ganz besonderer Dank gebührt Herrn Dr. Ingmar Kiefer - nicht nur für die vielfältige fachliche Unterstützung bei dieser Arbeit - sondern auch für seine weit darüber hinaus gehende freundschaftliche Betreuung. Mit seiner fast grenzenlosen Geduld und seinem Optimismus war er mir stets eine helfende Hand und motivierte mich auch in schwierigen Zeiten mit der Arbeit voranzuschreiten. Nicht zuletzt verdanke ich Herrn Dr. Kiefer meine Ausbildung in der sonographischen Diagnostik womit er auch mein Interesse an der Radiologie als solches weckte und den Grundstein für meine berufliche Zukunft legte. Ohne seine enormen fachlichen und menschlichen Kompetenzen wäre diese Arbeit sicher nicht zustande gekommen. Ich bedanke mich auch bei Frau Dr. Susann Piesnack für ihre große Hilfsbereitschaft bei der Auswertung der Daten. Frau Dr. Köhler danke ich für Ihre sowohl freundschaftliche als auch fachliche Unterstützung insbesondere in schwierigen Zeiten bei der Fertigstellung der Arbeit. Durch ihr großes Engagement und ihre unglaubliche Hilfsbereitschaft hat sie ganz wesentlich dazu beigetragen, dass diese Arbeit fertiggestellt werden konnte. 66 Literaturverzeichnis Weiterhin möchte ich den Mitarbeitern und Mitarbeiterinnen der Klinik für Kleintiere der Universität Leipzig für die Unterstützung bei der Erfüllung der organisatorischen Voraussetzungen für die Durchführung der praktischen Untersuchungen danken. Besonders herzlich möchte ich mich bei meiner Mutter und bei meinen Geschwistern bedanken. Ihr unerschütterliches Vertrauen in mich und ihr seelischer Beistand haben mich in allen Lebenslagen motiviert. Insbesondere für die grenzenlose Unterstützung meines Bruders Benedikt, die in dieser Art und Weise nicht selbstverständlich ist, bin ich sehr dankbar. Meiner Mutter und meinen Geschwistern gilt mein Stolz und mein Dank. Nicht zuletzt möchte ich mich bei meiner Freundin Cornelia Peuckert bedanken. Ohne ihren Rückhalt, Ihr Vertrauen und ihre Fürsorge wäre diese Arbeit nicht zum Abschluss gekommen. 67