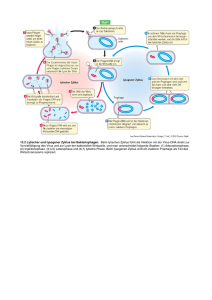
Erhebung der Lebensqualität unter Chemotherapie bei Patientinnen
Werbung

Universitätsklinikum Ulm Klinik für Frauenheilkunde und Geburtshilfe ärztlicher Direktor: Prof. Dr. med. Rolf Kreienberg Erhebung der Lebensqualität unter Chemotherapie bei Patientinnen mit gynäkologischen Malignomen zur internen Qualitätssicherung Dissertation zur Erlangung des Doktorgrades der Medizin der Medizinischen Fakultät der Universität Ulm Kathrin Scheffelmeier (Krumbach) Ulm 2012 Amtierender Dekan: Prof. Dr. Thomas Wirth 1. Berichterstatter: Prof. Dr. Kreienberg 2. Berichterstatter: Prof. Dr. Adolf Tag der Promotion: 12.12.2013 „ Es ergibt sich also, dass die Krebskrankheit auf dem Wege ist, eine Volkskrankheit zu werden und zwar aller Stände[…]. Können wir hoffen, durch gemeinsame Arbeit ein Heilmittel zu schaffen?“ ( Ernst August von Leyden, 18. Februar 1900, Berlin) Inhaltsverzeichnis Abkürzungsverzeichnis ........................................................................................................ iii 1. Einleitung .......................................................................................................................... 1 1.1 Epidemiologie und Ätiologie des Mammakarzinoms ................................................. 2 1.2 Morphologische und therapeutische Grundlagen des Mammakarzinoms ................... 3 1.3 Epidemiologie und Ätiologie des Ovarialkarzinoms ................................................... 5 1.4 Morphologische und therapeutische Grundlagen des Ovarialkarzinoms .................... 6 1.5 Lebensqualität in der Medizin, Begriffsdefinition und Geschichte ............................. 8 1.6 Grundlagen und Methoden der Lebensqualitätserfassung ......................................... 10 1.7 Fragestellung und Zielsetzung ................................................................................... 12 2. Material und Methoden ................................................................................................... 14 2.1 Studienaufbau ............................................................................................................ 14 2.2 Der symptomspezifische EORTC-QLQ-C30-Fragebogen Version 3.0 .................... 15 2.3 Patientenkollektiv ...................................................................................................... 18 2.4 Statistische Auswertung ............................................................................................. 23 3. Ergebnisse........................................................................................................................ 24 3.1 Einfluss der Chemotherapie auf die Lebensqualität .................................................. 24 3.2 Einfluss individueller Faktoren auf die Lebensqualität während der Chemotherapie25 3.3 Vergleich der Lebensqualität der Patientinnen in Abhängigkeit der individuellen Faktoren ........................................................................................................................... 32 3.4 Auswertung der weiteren EORTC-Items im Verlauf der Therapie ........................... 40 3.5 Auswertung der weiteren EORTC-Items im Verlauf der Therapie innerhalb der unterschiedlichen Altersklassen .......................................................................................... 54 i 3.6 Vergleich der weiteren EORTC-Items im Verlauf der Therapie zwischen den unterschiedlichen Altersklassen ....................................................................................... 64 3.7 Auswertung der weiteren EORTC-Items im Verlauf der Therapie unter Berücksichtigung der subjektiven Einschätzung der Lebensqualität zu Beginn der Therapie ........................................................................................................................... 82 4. Diskussion ....................................................................................................................... 98 4.1 Einfluss der Chemotherapie auf die Lebensqualität .................................................. 99 4.2 Einfluss individueller Faktoren auf die Lebensqualität ........................................... 101 4.3 Vergleich der Lebensqualität zwischen den Merkmalsausprägungen der unterschiedlichen Einflussfaktoren ................................................................................ 102 4.4 Einfluss der Chemotherapie auf die unterschiedlichen Lebensqualitätsbereiche .... 105 4.5 Vergleich des Einflusses auf die unterschiedlichen Lebensqualitätsbereiche innerhalb der Altersklassen ............................................................................................................ 108 4.6 Vergleich des Einflusses auf die unterschiedlichen Lebensqualitätsbereich zwischen den Altersklassen ........................................................................................................... 111 4.7 Einfluss der subjektiven Lebensqualität zu Beginn der Therapie auf die einzelnen Lebensqualitätsbereiche ................................................................................................. 113 5. Zusammenfassung ......................................................................................................... 117 6. Literaturverzeichnis ....................................................................................................... 119 Anhang .............................................................................................................................. 128 Danksagung ....................................................................................................................... 130 Lebenslauf .....................................................................Fehler! Textmarke nicht definiert. ii Abkürzungsverzeichnis ASA: american society of anesthesiologists (Klassifikation des körperlichen Zustandes von Patienten) AT-Gen: ataxia teleangiectatica Gen (Auf dem Chromosom 11 lokalisiertes Gen das in mutierter Form bei homozygoten Trägern zum LouisBar-Syndrom führt) BRCA1/2: breast cancer 1/2 (Tumorsuppressorgene auf den Chromosomen 17 und 13 die bei Mutation zu einer erhöhten Gefahr für Brustkrebs führen) BET: brusterhaltende Therapie (Chirurgisches Verfahren zur Entfernung tumorösen Brustgewebes) BMI: body-mass-index (Index für die Bewertung des Körpergewichts im Verhältnis zur Körpergröße) BRENDA: quality of breast cancer care under evidence-based guidelines (Zusammenschluss mehrerer deutscher Brustkrebszentren zur anwendungsorientierten Brustkrebsforschung) CTC Score: common toxicity criteria score (engl. für: “Allgemeine Toxizitätskriterien”, Klassifikationssystem unerwünschter Ereignisse, die während einer Zytostatikatherapie auftreten) CMF-Schema: Cyclophosphamid-Methotrexat-5-Fluorouracil (Systemtherapie des Mammakarzinoms, adjuvant) DEGRO: deutsche Gesellschaft für Radioonkologie DKG: deutsche Krebsgesellschaft EORTC-QLQ-C30: european organization for research and treatment of cancer-quality of life questionnaire-C30 (Kernfragebogen zur Bestimmung der symptomspezifischen Lebensqualität) iii EORTC: european organization for research and treatment of cancer FACT-Fragebogen: functional assessment of cancer therapy (Fragebogen zur Ermittlung der Lebensqualität) FEC-Schema: Epirubicin-Cyclophosphamid-5-Fluorouracil (Systemtherapie des Mammakarzinoms, adjuvant) FEC-Doc-Schema: Epirubicin-Methotrexat-5-Fluorouracil-Docetaxel (Systemtherapie des Mammakarzinoms, adjuvant) ETC-Schema: Epirubucin-Cyclophosphamid-Paclitaxel (Systemtherapie des Mammakarzinoms, adjuvant) TAC-Schema: Docetaxel-Cyclophosphamid-Doxorubicin (Systemtherapie des Mammakarzinoms, adjuvant) DC-Schema: Docetaxel-Cyclophosphamid (Systemtherapie des Mammakarzinoms, adjuvant) TCH-Schema: Docetaxel, Carboplatin, Herceptin (Systemtherapie des Mammakarzinoms, adjuvant) FIGO: fédération internationale de gynécologie et d'obstétrique (franz. für: „Internationale Vereinigung für Gynäkologie und Geburtskunde“) G1 /G2: grading1/2 (Einteilung, die das Ausmaß der Veränderung tumorösen Gewebes im Verhältnis zu gesundem Gewebe beschreibt, G1=gut differenzierte Zellen, G2=mäßig differenzierte Zellen) Her2 neu: human epidermal growth factor receptor 2 (epidermaler Wachstumsfaktorrezeptor mit zentraler Bedeutung bei Diagnostik und Behandlung des Mammakarzinoms) HNPCC: hereditäres nicht-Polyposis-assoziiertes kolorektales Karzinom iv ICF: international classification of functioning, disability and health (Klassifikation zur Gesundheitszustandes, Beeinträchtigung Beschreibung der sowie der des Behinderung, relevanten funktionalen der sozialen Umweltfaktoren von Menschen) Intervall q14d: Zeitspanne zwischen der Gabe zweier Chemotherapiezyklen, 14 Tage Intervall q21d: Zeitspanne zwischen der Gabe zweier Chemotherapiezyklen, 21 Tage KID: Krebs in Deutschland (Veröffentlichung des Robert-Koch-Instituts zum Thema Krebs) LQ: quality of life (engl. für: “Lebensqualität“) MLH1: mutL homolog1 (Genlokus des Chromosom 3, der häufig mit hereditären nicht-Polyposis-assoziierten kolorektalen Karzinomen in Verbindung gebracht wird.) MSH2 : mutS homolog2 (Genlokus des Chromosom 2, der häufig mit hereditären nicht-Polyposis-assoziierten kolorektalen Karzinomen in Verbindung gebracht wird.) NHP: Nottingham health profile (Fragebogen zur Ermittlung des allgemeinen Gesundheitzustandes) QL: quality of life (engl. für: “Lebensqualität”) QLQ-BR23: quality of life questionnaire-breast cancer module 23 (Zusatzmodul des EORTC-QLQ-C30 Lebensqualitätsbogen für Patienten/-innen mit Brustkrebs) QLQ-ES24: quality of life questionnaire-esophageal-cancer module 24 (Zusatzmodul des EORTC-QLQ-C30 Lebensqualitätsbogen für Patienten/-innen mit Speiseröhrenkrebs) v QLQ-LC13: quality of life questionnaire-lung cancer module 13 (Zusatzmodul des EORTC-QLQ-C30 Lebensqualitätsbogen für Patienten/-innen mit Lungenkrebs) QLQ-OV28: quality of life questionnaire-ovarian cancer module 24 (Zusatzmodul des EORTC-QLQ-C30 Lebensqualitätsbogen für Patientinnen mit Eierstockkrebs) QOL: quality of life group (Gruppe, die von der EORTC ins Leben gerufen wurde um Lebensqualitätsstudien effizienter zu gestalten) R0 / R1 Resektion: Entfernungsgrad Tumorgewebes (R0=Tumorgewebe komplett entfernt, R1= Tumorgewebe makroskopisch komplett entfernt mit nachweisbaren Tumorresten im Resektionsrand) RKI: Robert-Koch-Institut (Bundesinstitut für Infektionskrankheiten und nicht übertragbare Krankheiten und zudem zentrale Überwachungsund Forschungseinrichtung mit Sitz in Berlin) S3 Leitlinien: Stufe 3 Leitlinien (Leitlinien zur Behandlung des Mammakarzinoms) SF-36 Health Survey: short form (36) Gesundheitsfragebogen (Krankheitsunspezifischer Fragebogen zur Erhebung der Lebensqualität) SIP: sickness impact profile (Fragebogen zur Ermittlung des allgemeinen Gesundheitszustandes) SPSS: statistical package for the social sciences (Statistiksoftware) TNM Klassifikation: Tumor, Node (engl. für: „Lymphknoten“), Metastase (Medizinische Klassifikation, die der Stadieneinteilung maligner Tumore dient) Tp53: Tumorsuppresorgen p53 (Protein 53 induziert die Apoptose in beschädigten Zellen) WHO: Weltgesundheitsorganisation (Koordinationsbehörde der Vereinten Nationen für das internationale öffentliche Gesundheitswesen) PF: physical functioning (engl. für: “physische Funktion”) RF: role functioning (engl. für: „Rollenfunktion“) vi EF: emotional functioning (engl. für: „emotionale Funktion“) SF: social functioning (engl. für: „soziale Funktion”) CF: cognitive functioning (engl. für: “kognitive Funktion”) FA: fatigue (engl. für: „Müdigkeit“) PA: pain (engl. für: „Schmerzen“) NV: nausea and vomiting (engl. für: „Übelkeit und Erbrechen“) DY: dyspnoea (engl. für: „Atemnot“) IN: insomnia (engl. für: „Schlaflosigkeit“) AP: appetite loss (engl. für: “Appetitverlust”) CO: constipation (engl. für: “Obstipation”) DI: diarrhoea (engl. für: „Diarrhoe“) FI: financial difficulties (engl. für: „finanzielle Schwierigkeiten“) AK: Altersklasse UE: unerwünschtes Ereignis OUE: ohne unerwünschtes Ereignis NIT: nicht intensivierte Therapie IT: intensivierte Therapie M: Median MW: Mittelwert SD: Standartabweichung OE: ohne Einflussfaktor vii 1. Einleitung Die Frage, die sich Ernst August von Leyden schon im Jahr 1900 gestellt hat, ob sich ein Heilmittel gegen Krebs finden lässt, ist auch hundert Jahre später nicht eindeutig mit einem Ja zu beantworten. Um Heilmittel zu entwickeln, arbeiten die Wissenschaftler und Ärzte unserer Zeit hart daran die Therapie von Krebserkrankungen immer weiter zu verbessern. Im Fokus vieler Arbeiten steht dabei vor allem, zunächst einen Weg zur Verbesserung der Prognose der Patienten zu finden. Hierfür gibt es zum einen den rein wissenschaftlichen Aspekt, der sich mit dem Ursprung der Erkrankungen beschäftigt und sich dabei spezifisch mit der genetischen Pathologie auseinandersetzt. Dazu gehört als Beispiel die veränderte Genexpression, die bei Krebserkrankungen eine Rolle spielt (Weigelt et al, 2010). Zum anderen gibt es den psychologischen Aspekt, der auch das subjektive Empfinden der Patienten als entscheidend für den Ausgang der Erkrankung erachtet (Montazeri et al, 2009). In folgender Dissertation soll nun das Hauptaugenmerk auf dem subjektiven Empfinden der Patienten liegen. Dabei wird die Lebensqualität von Mamma- und von Ovarialkarzinompatientinnen im Mittelpunkt stehen. Untersucht wird, wie stark diese im Verlauf der Chemotherapie beeinflusst wird und welche weiteren Faktoren, wie Alter und Komorbiditäten, dabei Einfluss haben. Zu Beginn der Arbeit folgt ein Überblick über das Krankheitsbild des Mamma- sowie des Ovarialkarzinoms. Des Weiteren wird der Begriff der Lebensqualität definiert und in seinen geschichtlichen Kontext gesetzt. Bevor dann die Ergebnisse und die daraus resultierenden Schlussfolgerungen der Untersuchung vorgestellt werden, werden die genaue Fragestellung und die Zielsetzung dieser Arbeit definiert. 1 1.1 Epidemiologie und Ätiologie des Mammakarzinoms Im Jahr 2006 betrafen laut der neuesten Krebs-in-Deutschland-Veröffentlichung (KID) des Robert-Koch-Instituts 29% aller Krebsneuerkrankungen die weibliche Brustdrüse. Damit war und ist das Mammakarzinom die häufigste und bedeutendste Krebserkrankung der Frau. Dies gilt nicht nur für Deutschland, sondern auch für die ganze westliche Welt. Viel seltener tritt die Erkrankung in Entwicklungsländern auf (Sehouli, 2009). Im Schnitt erkrankten im Jahr 2006 58.000 Frauen, mit einem mittleren Erkrankungsalter von 64 Jahren. Allgemein steigt das Brustkrebsrisiko mit zunehmendem Alter an. Das Lebenszeitrisiko zu erkranken liegt bei 10,9%, wobei das Risiko, daran zu versterben mit 3,5% deutlich niedriger ist. Diese Tatsache zeigt sich auch darin, dass bei steigender Brustkrebsinzidenz, in den Jahren 1980 bis 2000, die Mortalität seit 1990 zurückgegangen ist. Momentan beträgt die relative 5-Jahres-Überlebensrate in Deutschland zwischen 83% und 87% (RKI, 2010). Auch wenn die 5-Jahres–Überlebensrate im Vergleich zu anderen malignen Erkrankungen eine günstige Prognose anzeigt, so ist das Mammakarzinom dennoch vor allem bei jungen Frauen im Alter zwischen 35 und 55 Jahren die häufigste krebsbedingte Todesursache (Kaufmann et al, 2008). Die Ätiologie des Mammakarzinoms ist bis heute noch nicht vollständig aufgeklärt, es konnten jedoch eine Reihe bestimmter Risikofaktoren identifiziert werden. Bei prämenopausalen Frauen geht man vor allem von einer genetischen Prädisposition aus. Insgesamt kann man bei 5-10% aller Frauen mit Mammakarzinom entweder Mutationen im p53-Gen, im AT-Gen (Ataxia teleangiectatica) oder in den BRCA-1 (Chromosom 17) oder BRCA 2- (Chromosom 13) Genen nachweisen. Zudem wurden in den letzten Jahren weitere so genannte Brustkrebssuszeptibilitätsgene auf den Chromosomen 9, 10 und 11 identifiziert (Turnbull et al, 2010). Bei postmenopausalen Frauen sind es vor allem Adipositas, Ernährung und endokrine Interaktionen, die als risikohaft bewertet werden (Bastert et al, 2003). Weitere allgemeine Risikofaktoren sind unter anderen ein vorangegangenes Mammakarzinom auf derselben oder gegenüberliegenden Seite, das Alter über 60, die Menarche vor dem 12. Lebensjahr und keine oder späte Schwangerschaft (>30 Jahre) (Kreienberg et al, 2002). 2 Man geht davon aus, dass auch die Ernährung eine Rolle bei der Entwicklung eines Mammakarzinoms spielen kann, was eine Erklärung für geographische Unterschiede in der Inzidenz des Mammakarzinoms sein könnte. So erkranken in Japan weniger Frauen im Vergleich zu Europa (6:1) (Weyerstahl et al, 2007). Negative Auswirkung scheinen hingegen Hormonsubstitution, Verzehr von stark gegrilltem Fleisch und, vor allem bei jungen Frauen in der Pupertät, der Genuss von Alkohol und Zigaretten zu haben (Breckwoldt et al, 2008). 1.2 Morphologische und therapeutische Grundlagen des Mammakarzinoms Histologisch wird das Mammakarzinom in eine invasive und eine nicht invasive (Carcinoma in situ) Form unterteilt. Anhand ihrer Histogenese kann man diese Formen weiter unterteilen in duktale (von den Milchgängen ausgehend) und lobuläre (von den Drüsenlobuli ausgehend) Karzinome. Allgemein machen duktale Karzinome, sowohl bei den invasiven Karzinomen mit über 70%, als auch bei den nicht invasiven Karzinomen mit bis zu 95%, den größten Teil aus. Zu weiteren selteneren Formen des Mammakarzinoms zählen das muzinöse, das medulläre und das tubuläre Karzinom. Diese besitzen eine günstigere Prognose als die duktalen und lobulären Karzinome (Regierer et al, 2005). Das Mammakarzinom tritt am häufigsten im oberen äußeren Quadranten (55%) der linken Brust auf. Von dort erfolgt die Metastasierung lymphogen in die regionären Lymphknoten der Axilla und hämatogen unter anderem in die Knochen, die Lunge und die Leber (Sehouli, 2009). Anhand der TNM Klassifikation wird das Mammakarzinom in Stadien eingeteilt. Diese gibt Aufschluss über die Größe (T), den Lymphknotenstatus (N) und die Fernmetastasierung (M) des Karzinoms (Singletary, 2002). Zusammen mit Aspekten wie Alter, HER-2-Status oder Hormonrezeptorstatus (Östrogen/Progesteron) erfolgt so die Risikostratifizierung und die Therapieentscheidung. Zudem wird auf diese Weise eine Aussage über die Prognose und das Rezidivrisiko ermöglicht. So ist für die Prognose vor allem entscheidend, ob bei Diagnosestellung bereits Metastasen vorliegen oder nicht (Sehouli, 2009). 3 Liegen noch keine Metastasen vor, so stehen als therapeutische Möglichkeiten der chirurgische Eingriff und die (neo-) adjuvante Therapie, bestehend aus Strahlen-, Chemo-, und/oder Hormontherapie zur Verfügung. Chirurgisch wird die brusterhaltende Therapie (BET) von der Mastektomie unterschieden. Die Gesamtüberlebensrate ist bei beiden Optionen annähernd gleich hoch, vorausgesetzt, die BET wird mit einer postoperativen Bestrahlung kombiniert. Dennoch bleibt zu beachten, dass die Lokalrezidivrate bei einer BET 3- 4 fach erhöht ist (Sehouli, 2009). Aus diagnostischen bzw. therapeutischen Gründen schließen beide Operationsformen die Lymphonodektomie entweder als Sentinel-Node Biopsie oder Axilladissektion mit ein. Die adjuvante Therapie ist ein adäquates Mittel, um ein Rezidiv aus möglicherweise bestehenden Metastasen zu verhindern. Sie schließt sich der chirurgischen Therapie an, oder geht dieser in bestimmten Fällen als neoadjuvante Therapie voraus. Indikation zu einer Strahlentherapie besteht wie in den S-3 Leitlinien vermerkt bei einer R0-Resektion nach BET oder einer R1 Resektion mit fehlender Möglichkeit zur Nachresektion (DEGRO, 2006). Desweiteren werden Zytostatika, endokrine Substanzen und monoklonale Antikörper adjuvant verwendet. Für die Anwendung von Zytostatika gelten die Anwendungskriterien internationaler Konferenzen wie der letztmalig 2007 in St. Gallen stattgefundenen Konsensus-Konferenz. Etablierte adjuvante Chemotherapeutika bei der Therapie des Mammakarzinoms sind: FEC, FEC-Doc, ETC, TAC, DC und CMF (Kreienberg, 2010). An endokrinen wirksamen Substanzen werden Tamoxifen vor allem bei prämenopausalen Frauen und Aromatasehemmer vor allem bei postmenopausalen Frauen eingesetzt. Der monoklonale Antikörper Trastuzumab kommt bei Frauen mit HER2-neu positivem Rezeptor zur Anwendung. Laut den S-2 Leitlinien besteht bei Frauen mit einem metastasierten Mammakarzinom eine günstigere Prognose, wenn es sich um solitäre Knochen- oder Hautmetastasen handelt, der Hormonrezeptorstatus positiv, der HER-2-Status negativ und der Differenzierungsgrad des Tumors hoch ist (G1 oder G2). Oberstes Ziel bei der Behandlung ist es, die Lebensqualität der Patientinnen zu erhalten und die Frauen möglichst von allen Symptomen zu befreien. Deshalb sollte die systemische Therapie anhand des individuellen Zustands und der Prognose der Patientin ausgewählt werden. Als Erstlinientherapie eignet sich die nebenwirkungsärmere endokrine Therapie nach oben genannten Kriterien (DKG, 2008). 4 Immer zu beachten sind die Nebenwirkungen, die im Rahmen der Therapie des Mammakarzinoms auftreten können. Bestrahlung und Lymphonodektomie beinhalten das Risiko stark beeinträchtigender Ödeme der betroffenen Körperstellen. Die chirurgischen Eingriffe können zu Wundheilungsstörungen führen und die antiöstrogene Therapie kann eine Endometriumskarzinose hervorrufen (Sehouli, 2009). Die zytostatischen Substanzen können unter anderem eine schwerwiegende toxische Wirkung auf die Blutbildung, den Gastrointestinaltrakt, die Lunge und die Niere haben (Schneeweiss, 2009). 1.3 Epidemiologie und Ätiologie des Ovarialkarzinoms Mit 4,9% aller bösartigen Neubildungen der Frau ist das Ovarialkarzinom deutlich seltener als das Mammakarzinom. Eine von fünfundvierzig Frauen erkrankt im Verlauf ihres Lebens an Eierstockkrebs, das sind 1,8% der Frauen in Deutschland. Im Jahr 2006 waren es 9.670 Frauen. Im Vergleich zu anderen gynäkologischen Malignomen hat das Ovarialkarzinom die höchste Mortalität. Verglichen mit allen malignen Neoplasien hat es die zweitschlechteste Prognose nach dem Bronchialkarzinom (Klar et al, 2009). Die 5Jahres-Überlebensrate beträgt derzeit 35-49%. Ein Grund für die hohe Mortalität ist, dass es in der Regel erst in fortgeschrittenen Stadien zum Auftreten von Symptomen und so dementsprechend relativ spät zu Diagnose und Therapie der Erkrankung kommt. Ein wichtiger Einflussfaktor für die Prognose ist das Alter. Während unter den Unter 45Jährigen 70% der Frauen überleben sind dies unter den Über-65-Jährigen nur noch 30%. Allgemein können Frauen jeden Alters von einem Ovarialkarzinom betroffen sein. Dennoch nimmt die Wahrscheinlichkeit im Alter zu. Im Durchschnitt liegt das Erkrankungsalter der Frauen bei 68 Jahren, aber mindestens 10% der betroffenen Frauen sind unter 40 Jahren (Maaßen et al, 2007), (RKI, 2010). Bezüglich der Ätiologie des Ovarialkarzinoms geht man generell von zwei Hypothesen aus. Die eine besagt, dass die durch den Eisprung hervorgerufenen Defekte und Reparaturvorgänge epitheliale Mutationen begünstigen. Die andere, dass ein erhöhter Gonadotropinspiegel indirekt zu gesteigerter Östrogen-Ausschüttung führt und damit eine maligne Zelltransformation hervorruft (Mahner et al, 2009). 5 Des Weiteren bestehen bestimmte Risikofaktoren, die die Entstehung eines Ovarialkarzinoms begünstigen. So sind 10% der Ovarialkarzinome genetisch bedingt. Auf einen genetischen Ursprung der Erkrankung deuten das gehäufte familiäre Auftreten von Brust-, Darm- und Gebärmutterkrebs (HNPCC) oder Tumore im Rahmen eines LiFraumeni-Syndroms im Zusammenhang mit einem Ovarialkarzinom hin. Bei Frauen, die diesbezüglich eine positive Anamnese aufweisen, sollte eine genetische Diagnostik mit Abklärung von möglicherweise verantwortlichen Genen (BRCA1, 2, MLH1, MSH2, TP53) angestrebt werden. Eine Keimbahnmutation in diesen Genen erhöht das Risiko an einem Ovarialkarzinom zu erkranken um das 3- bis 50fache (DKG, 2007). Die Erkrankungswahrscheinlichkeit negativ beeinflussend sind außerdem bestehende Infertilität und eine frühe Menarche oder späte Menopause. Positiven Einfluss haben hingegen unter anderem Schwangerschaft und orale Kontrazeption, sowie Tubenligatur oder Hysterektomie (Kreienberg et al, 2009). 1.4 Morphologische und therapeutische Grundlagen des Ovarialkarzinoms Die Klassifizierung der Ovarialkarzinome verläuft anhand von histologischen Merkmalen. In 2/3 der Fälle liegt bei einer primären Ovarialneoplasie ein epitheliales Ovarialkarzinom vor. Dieses wird weiterhin unterteilt in seröse, muzinöse, endometroide und klarzellige Tumore, undifferenzierte und unklassifizierte epitheliale Tumore und die Brenner-Tumore. An zweiter Stelle stehen mit 25 % aller Ovarialkarzinome die Keimzelltumore, die differenziert werden in Dysgerminome, Dottersacktumore, embryonale Karzinome, Chorionkarzinome, Polyembryome und Teratome. 10-15% aller malignen Ovarialtumore sind Metastasen anderer Malignome. In 30% Prozent der Fälle ist hierbei der Primärtumor ein Endometriumkarzinom oder, wie in bis zu 20% der Fälle, ein Mammakarzinom. Stammen die Tumorzellen von einem Siegelringkarzinom des Magens ab, so spricht man von einem Krukenberg-Tumor. Insgesamt unterscheidet die Welt-Gesundheits- Organisation (WHO) neun verschiedene Arten, zu denen unter anderen noch Tumore der Stroma-, Lipid-, und Bindegewebszellen zählen. Von klinischer Bedeutung sind vor allem die TNM- und die FIGO- (Fédération Internationale de Gynécologie et d'Obstétrique; franz. für „Internationale Vereinigung für Gynäkologie und Geburtskunde“) Klassifikation der Ovarialkarzinome (Schwarz et al, 2009). 6 Der Unterschied der beiden Unterteilungen liegt darin, dass sich die FIGO-Stadien an den Staging Ergebnissen orientieren während sich die TNM-Klassifikation auf chirurgische und pathologische Gesichtspunkte konzentriert. Tumoröse Streuung kann bei den Ovarialkarzinomen auf mehrere Arten erfolgen. Zum einen können sich Tumorzellen von der Ovarialoberfläche lösen und sich dann über die Peritonealflüssigkeit im Bauchraum verteilen. Dabei kann es zur Implantation der Zellen auf dem Peritoneum kommen. Außerdem kommt es bereits in frühen Stadien in 20-30% der Fälle zur lymphogenen Ausbreitungen in die pelvinen und paraaortalen Lymphknoten. Selten sind jedoch organüberschreitende Infiltrationen und eine hämatogene Metastasierung (<5%). Der Metastasierungsgrad spielt auch eine Rolle bei der Beurteilung der Prognose. So kann man ohne manifeste Metastasen von einem Erkrankungsstadium der Stufen 1-2 (FIGOKlassifizierung) ausgehen. Bestehende Peritoneale-Metastasen hingegen entsprechen bereits dem Stadium 3 (FIGOKlassifizierung) und verringern die 5-Jahres-Überlebensrate auf 10-40%. Ein entscheidender Prognosefaktor in diesem Stadium ist der postoperative Tumorrest. Des Weiteren nehmen Alter, histologische Tumoridentität und das Ansprechen auf eine postoperative Chemotherapie Einfluss auf den weiteren Verlauf der Erkrankung (Schwarz et al, 2009). Die Therapie des Ovarialkarzinoms besteht aus einem radikalen chirurgischen Eingriff, bei dem beide Adnexen, der Uterus, das pelvine Peritoneum, das infra- und suprakolische Netz, die pelvinen und paraaortalen Lymphknoten sowie ggf. die Appendix entfernt werden. Zudem sollte vor der Operation eine Aufklärung über eine mögliche Darmteilresektion oder die Anlage eines Anus Praeter stattfinden. Dies stellt im Falle einer gleichzeitig bestehenden Darminfiltration eine notwenige Konsequenz dar, die in 25-50% der Fälle zu Darmresektionen und 10% der Fälle zu Anlage eines Anus Praeter führt (Klar et al, 2009). Für eine Verbesserung der Prognose ist es unbedingt notwendig, eine vollständige Entfernung des Tumors anzustreben. In den Fällen, in denen dies nicht möglich ist, sollte zumindest eine Tumorreduktion auf unter 2 cm Tumorrest erreicht werden (Maaßen et al, 2007). 7 Die bei der chirurgischen Exploration erfolgte Stadien-Einteilung entscheidet über die Empfehlung der weiteren adjuvanten Therapie. Dabei ist ab dem Zeitpunkt eines oberflächlichen Tumorbefalls des Ovars oder beider Ovarien (FIGO 1c) davon auszugehen, dass zur Eliminierung noch bestehender proliferativer Tumorzellen eine Chemotherapie nötig ist (Maaßen et al, 2007). Bei frühen Stadien kommt dabei eine Monotherapie mit Carboplatin (4 - 6 Zyklen) in Frage. Bei fortgeschrittenen Stadien (FIGO 2b - 4) eine Polychemotherapie mit Carboplatin und Paclitaxel (6 Zyklen). Bei gleicher Wirkung und besserer Verträglichkeit ist Carboplatin im Gegensatz zu Cisplatin die Therapie der Wahl beim Ovarialkarzinom. Unter genannter Therapie konnte man bereits einen Rückgang der Tumoren um 70% und bestehender Aszites um 80% beobachten (Maaßen et al, 2007), (DKG, 2007). Nebenwirkungen der Therapie ergeben sich ähnlich wie beim Mammakarzinom sowohl durch den chirurgischen Eingriff, als auch die adjuvante Chemotherapie. 1.5 Lebensqualität in der Medizin, Begriffsdefinition und Geschichte Allgemein kann die Lebensqualität als ein subjektives, psychologisches Konstrukt, das den Gesundheitszustand aus der Perspektive des Individuums einschätzt, beschrieben werden. Gesundheit beschreibt dabei nur einen Teilaspekt der allgemeinen Lebensqualität und steht neben Einflussfaktoren wie Wohlstand, Freiheit, Politik, Bildung, Kultur und Religion (Amelung et al, 2012). Die Lebensqualität im Kontext der gynäkologischen Onkologie kann definiert werden durch die subjektive Einschätzung der gegenwärtigen Anpassungfähigkeit an die Situation in körperlicher, sozialer, emotionaler und funktioneller Hinsicht (Härtl, 2009). Ähnlich ist auch die Defintion der funktionalen Gesundheit der Weltgesundheitsorganisation (WHO), formuliert in der Internationalen Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit (International Classifiacation of Functioning, Disability and Health, ICF). In diesem Konzept sind unter Berücksichtigung ihrer gegenseitigen Wechselwirkungen, Gesundheitszustand, Körperfunktionen. Akitivitäten, Partizipationen und persönliche Faktoren eingeschlossen (Internationalen Klassifikation der Funktionsfähigkeit, 2005). 8 An Bedeutung in der Medizin gewann der Begriff der Lebensqualität in den 80iger-Jahren. Hierzu erschienen 1974 die ersten Untersuchungsergebnisse bei Frauen mit Brustkrebs, die einen Zusammenhang der objektiven Krankheitssituation mit der subjektiven Einschätzung ergaben (Moore et al, 1974). Zwei Jahre später zeigten Priestman und Baum, dass es anhand der Selbsteinschätzung von Patientinnen mit Brustkrebs möglich ist, ein Bild über den subjektiven Therapieverlauf der Frauen zu erhalten und zudem einen Vergleich zwischen unterschiedlichen Therapieregimen aus Sicht der Patientinnen stellen zu können (Priestman et al, 1976). Trotz dieser Ergebnisse dauerte es noch bis in die frühen 90igerJahre bis die Forschung das Thema verstärkt für sich entdeckte. Ein Grund, der wohl mit entscheidend für das Vorantreiben der Forschung im Bereich Lebensqualität war, könnte die Tatsache sein, dass es mittlerweile verschiedene Therapieschemata mit gleicher Effektivität gibt. Die Lebensqualität nimmt somit im Verlauf der Therapie und auch danach eine sehr wichtige Rolle ein (Küchler et al, 2009), (Gunnars et al, 2001). Vor allem in der palliativen Situation ist die Frage nach der Art der Behandlung und den damit zusammenhängenden Folgen von großer Bedeutung. Die Therapie kann die Qualität der verbleibenden Zeit der Patienten entscheidend beeinflussen (Byrne et al, 1992). Mittlerweile ist die Fülle an Artikeln bedeutend angewachsen. So fanden sich allein im Medline-Suchsystem bis 2002 bereits 39.873 Einträge zum Thema Lebensqualität (Bullinger et al, 2006). Der Fokus der Arbeiten lag vor allem auf dem Zusammenhang zwischen der Lebensqualität und der Prognose bezüglich der Überlebenszeit. Häufig konnte dabei gezeigt werden, dass sich durch die Erhebung der Lebensqualität und der damit verbundenen funktionellen und symptomatischen Aspekte, darunter bedeutend vor allem Müdigkeit, Appetitverlust und Schmerzen, eine prognostische Aussage treffen lässt (Montazeri et al, 2009). Außerdem von Interesse ist die Frage, wie weit sich die Daten auf den klinischen Alltag übertragen lassen. Die Ergebnisse dazu waren, dass ein umfassenderes Bild über die aktuelle physischen und psychischen Verfassung des Patienten nicht nur eine valide Aussage über eine Prognose ermöglicht, sondern dem behandelnden Arzt als Mittel zur individuellen Anpassung der Therapie an die Bedürfnisse des Patienten dienen kann ( Efficace et al, 2008), (Efficace et al, 2009). 9 1.6 Grundlagen und Methoden der Lebensqualitätserfassung Unbestreitbar ist die Tatsache, dass Studien zur Lebensqualitätsforschung vor allem dann von Nutzen sind, wenn die Erhebung der Daten ordnungsgemäß durchgeführt wurde. (Coons et al, 2007). Da die Lebensqualität nichts Greifbares ist, sondern ein Konstrukt der psychologischen Terminologie, muss man, um wissenschaftlich arbeiten zu können, eine operationale Definition der Lebensqualität einführen. In diese sollten eingehen: - die körperliche Verfassung, - das psychische Befinden, - die mentale Kompetenz, - die sozialen Beziehungen, - und die Funktionsfähigkeit im Alltag der Patienten. Damit ist die gesundheitsbezogene Lebensqualität ein mulitdimensionales Konstrukt, indem die genannten Ebenen aus Sicht der Patienten oder der eines Beobachters eingehen (Bullinger et al, 1997). Zur Erfassung der Lebensqualität scheint die Selbstbeurteilung der Patienten, unter Berücksichtigung von mehreren Komponenten der Lebensqualität anhand von Fragebögen oder Interviews, sehr gut geeignet zu sein. Die Frage nach dem Wahrheitsgehalt der Angaben beim Thema des Empfindens des Betroffenen erübrigt sich dabei, da die Patienten ihren Zustand am besten einschätzen können. Somit kann eine Entscheidung über richtig oder falsch in diesem Zusammenhang nicht getroffen werden. Eine weitere Möglichkeit zur Erfassung der Lebensqualität ist die Fremdeinschätzung durch Ärzte oder Angehörige. Diese kann jedoch nur bedingt als Maß der tatsächlichen Gefühlslage der Betroffenen gelten (Bullinger et al, 2006), (Macquart-Moulin et al, 1997). Bevor nun eine Fragensammlung als Meßinstrument zu verwenden ist, muss sie bestimmte psychometrische Kriterien erfüllen. Diese beziehen sich auf die Zuverlässigkeit (Reliabilität), die bei einem hohen Grad an Zusammenhang der Fragen und einer Wiederholbarkeit des Tests gegeben ist. 10 Des Weiteren ist die Gültigkeit (Validität) des Tests entscheidend und ist je nach Ansatz für den Inhalt, ein bestimmtes Kriterium, oder eine Theorie zu erfüllen. Außerdem sollten therapiebedingte Veränderungen zu erfassen sein. Hierfür ist die Sensitivität oder Responsivität ausschlaggebend (Ware et al, 1987). Heutzutage haben sich unter anderen als internationale Standartinstrumente durchgesetzt: - der Sickness Impact Profile (SIP) (Bergner et al, 1981), - der Nottingham Health Profile (NHP) (Kohlmann et al, 1997), - der SF-36 Health Survey (Bullinger et al, 1998). Im Bereich der Onkologie werden vor allem der FACT-Fragebogen (Cella et al, 1993) sowie der EORTC-Fragebogen (Aarsonson et al, 1993) eingesetzt. Insgesamt kann festegstellt werden, dass sich international das Angebot an verlässlichen Meßinstrumenten der Lebensqualität immer weiter verbessert (Bullinger et al, 1997). Zudem gibt es Studien, die durch den Vergleich der verschiedenen Meßinstrumente richtungsweisend für ihren Einsatz sind (Lee et al, 2001). Ein Unterschied zwischen den Fragebögen besteht in ihrem Ansatz die Lebensqualität zu erfassen. So gibt es auf der einen Seite eine krankheitsübergreifende Sichtweise, bei der man davon ausgeht, dass die verschiedenen Ebenen der gesundheitsbezogenen Lebensqualität unabhängig von dem aktuellen Gesundheitszustand betrachtet werden können. Da sie einen Behandlungsmaßnahmen Wirtschaftlichkeitsprüfung Vergleich erlauben, von sind verschiedener sie Bedeutung. vor Ein Patientengruppen allem im Beispiel Bereich für und der einen krankheitsübergreifenden Fragebogen ist der SF-36 Health Survey. Auf der anderen Seite gibt es die krankheitsspezifische Sichtweise. Diese ermöglicht bei geringen Kosten und leichter Handhabung mitunter die Interpretation von Veränderungen in der Lebensqualität. Als wichtigstes Beispiel hierfür ist der EORTC-QLQ- Fragebogen zu nennen (Patrick et al, 1989). Hat man sich für ein Untersuchungsinstrument entschieden, ist weiterhin wichtig, die Zeitpunkte für die Messung sowie Messparameter festzulegen. Als ersten Messzeitpunkt sollte man die Lebensqualität prätherapeutisch erheben. So schafft man die Möglichkeit eines Vergleichspunktes für die Entwicklung von Veränderungen. 11 Des Weiteren sollte zur Mitte oder im Verlauf der Therapie eine weitere Erhebung folgen, um eine Einschätzung des direkten Einflusses therapiebedingter Nebenwirkungen zu erlangen. Letztlich kann eine follow-up Untersuchung Aufschluss über die Langzeitauswirkungen geben (Bullinger et al, 2006). Die Messparameter können je nach Fragestellung ausgewählt werden. So kann man unter anderem den Einfluss präventiver Massnahmen, wie der bilateralen Mastektomie (Brandberg et al, 2008), oder die Auswirkung einer adjuvanten Chemotherapie nach Mastektomie (Palmer et al, 1980) auf die Lebensqualiät untersuchen. Nicht vergessen sollte man Faktoren, die die Lebensqualität unabhängig von der Therapie beeinflussen. So unterscheidet sich als Beispiel die Einschätzung der Lebensqualität während einer adjuvanten Chemotherapie zwischen italienischen Frauen und schweizerischen Frauen signifikant. Wahrscheinlich ist dies Ausdruck der kultureller Unterschiede. Des Weiteren ist von entscheidender Bedeutung, in welchem sozialen Umfeld die Frauen sich bewegen. Ledige oder verwitwete Patientinnen fühlen sich emotional stärker belastet als Patientinnen, die umgeben sind von ihrem Ehemann oder Kindern. Außerdem können unter anderem als weitere Einflussfaktoren der Bildungsgrad und das Alter der Patientinnen angesehen werden (Bernhard et al, 1998), (Park et al, 2011). 1.7 Fragestellung und Zielsetzung Mit dem Ziel, eine optimale Therapie für Patientinnen mit Brustkrebs zu erreichen, wurde unter der Leitung von Prof. Dr. Rolf Kreienberg, Ärztlicher Direktor der Klinik für Frauenheilkunde und Geburtshilfe am Universitätsklinikum Ulm, die BRENDA Studie ins Leben gerufen. Dafür wurde das BRENDA Studiennetzwerk, ein Zusammenschluss zur anwendungsorientierten Brustkrebsforschung, bestehend aus insgesamt 16 zertifizierten Brustkrebszentren in Deutschland, gegründet und die Bedeutung der Leitlinienkonformen Therapie erforscht (Antragskennzeichen: 01ZP0301/B). Ergebnis war, dass bereits fünf Abweichungen von den aktuellen Leitlinien zu einer Verringerung der Überlebensrate von bis zu 40% führen. Um dieser Auswirkung entgegenwirken zu können, wird nun in dem Projekt BRENDA2 nach den Ursachen für das Abweichen von den Leitlinien, während der Behandlung der Patientinnen, geforscht. Hierbei werden nun sozioökonomische, emotionale und die subjektive, physische und psychische Einschätzung der Situation der Patientin mit dem Verlauf der Therapie und der Erkrankung korreliert. 12 Seit 2007 wird in der onkologischen Tagesklinik der Universitätsfrauenklinik Ulm bei Patientinnen, die eine Chemotherapie erhalten, die Lebensqualität im Verlauf ihrer Therapie mittels des EORTC-Fragenbogens erfasst. Die hierbei erhobenen Daten wurden nun im Rahmen dieser Arbeit ausgewertet. In vorliegender Arbeit wurden diesbezüglich folgende Fragestellungen erörtert: 1. Welchen Einfluss nimmt die Chemotherapie in ihrem Verlauf auf die Lebensqualität? 2. Unterscheidet sich die Lebensqualität der Patientinnen in Abhängigkeit von Alter, Gesundheitsstatus, Gewicht, Auftreten von unerwünschten Ereignissen und Intensität der Chemotherapie? 3. Welche einzelnen Aspekte der Lebensqualität sind am stärksten durch die Chemotherapie beeinträchtigt? 4. Gibt es zwischen diesen einzelnen Aspekten Unterschiede in Abhängigkeit vom Alter? 5. Spielt die Einschätzung der Patientinnen ihrer Lebensqualität zu Beginn der Therapie im weiteren Verlauf eine Rolle? Die genannten Zielsetzungen wurden im Folgenden zuerst für alle Patientinnen untersucht. Hierfür wurden die Daten sämtlicher EORTC-Bögen ausgewertet, unabhängig davon ob es sich dabei um Bögen von Mamma- oder Ovarialkarzinompatientinnen handelte. Danach wurden, im Hinblick auf die Fragestellung, ausschließlich die Bögen der Patientinnen mit Mammakarzinom betrachtet und dann nur die Bögen der Ovarialkarzinompatientinnen. Anschließend wurden die Ergebnisse der Frauen mit Mammakarzinom mit denen der Frauen mit Ovarialkarzinom verglichen. Um den Einfluss der Chemotherapie auf die Lebensqualität im Verlauf einschätzen zu können, wurde diese anhand der standardisierten EORTC-QLQ-C30 Fragebögen zu Beginn der Therapie (1. Zyklus) und an zwei weiteren festgesetzten Zeitpunkten (3. und 6. Zyklus) der Therapie erhoben. Dann wurden die erhobenen Werte miteinander verglichen. 13 2. Material und Methoden 2.1 Studienaufbau In der Einrichtung der onkologischen Tagesklinik der Universitätsfrauenklinik Ulm wurde im Zeitraum der Jahre 2007 bis 2011 bei Frauen, die dort eine Chemotherapie erhielten, die Lebensqualität standardisiert mittels EORTC–QLQ-C30-Fragebogen erhoben. Befragt wurden Patientinnen mit Mamma- oder Ovarialkarzinom, die eine Chemotherapie erhielten und sich bereit erklärten den Fragebogen auszufüllen. Dies erfolgte wiederholt, im Verlauf ihrer Therapie zur Gabe ihres 1., 3. und 6. Zyklus. Nicht in die Untersuchung eingeschlossen wurden all jene Frauen: • die nicht mit der Teilnahme einverstanden waren, • die nicht über ausreichende sprachliche Kenntnisse verfügten, um den Fragebogen richtig verstehen zu können, • deren psychische oder physische Verfassung zu schlecht war, um den Fragebogen beantworten zu können. Zuletzt wurden nur die Bögen der Patientinnen, die alle drei Fragebögen im Verlauf ihrer Behandlung ausgefüllt haben, ausgewertet. Die festgesetzten Zeitpunkte der Erhebung entsprachen: • der ersten Gabe der Chemotherapie, Zyklus 1 • der dritten Gabe der Chemotherapie, Zyklus 3 • und der sechsten Gabe der Chemotherapie. Zyklus 6 Die Gabe des 1. Zyklus entsprach dabei dem Beginn der Chemotherapie. Dieser Erhebungszeitpunkt diente der Erfassung der Lebensqualität der Patientinnen unbeeinflusst von den Auswirkungen der Therapie. Somit war ein Ausgangswert geschaffen, um stattgefundene Veränderungen in der Lebensqualität im Verlauf der Behandlung sichtbar werden zu lassen. 14 Der 6. Zyklus entsprach bei dem größten Teil der Patientinnen dem Ende der Therapie. Bei Frauen, die eine palliative Therapie erhielten oder eine Therapie, die nicht auf sechs Zyklen beschränkt war, wurde die Chemotherapie nach Standartprotokoll fortgesetzt. Die Befragung der Patientinnen zu mehreren Zeitpunkten ermöglichte es die Auswirkungen der Chemotherapie auf die Lebensqualität im Behandlungsverlauf zu beobachten. Den Frauen wurde zu Anfangs ausdrücklich erklärt, dass die Befragung auf freiwilliger Basis stattfindet und es sich im Weiteren um eine anonyme Auswertung der Daten handelt. Um konstante Bedingungen bei der Datenerhebung zu gewährleisten, wurden die Fragebögen allen Frauen zu allen drei Zeitpunkten kurz vor der Gabe der Chemotherapie ausgehändigt. Nach Abschluss der Befragung der Patientinnen in der onkologischen Tagesklinik wurden die Fragebögen per Hand in eine vorgefertigte, dem EORTC-QLQC30-Fragebogen entsprechende Maske im Computer übertragen. Nach vollständiger Übertragung der Fragebögen und Übernahme der weiteren Daten bezüglich Alter, Gewicht, Chemotherapie-Schema, Gesundheitszustand (ASA-Status) und dem Auftreten eines unerwünschten Ereignisses wurde den Frauen Fallnummern zugeteilt. Anhand der Fallnummern (fortlaufend von 1 bis 180) wurden die Daten anschließend anonymisiert ausgewertet. 2.2 Der symptomspezifische EORTC-QLQ-C30-Fragebogen Version 3.0 Im Jahr 1980 wurde die QOL (Quality of Life Group) von der EORTC (European Organisation for Research and Treatment of Cancer) ins Leben gerufen. Ziel dieser Gruppe war und ist es, Forscher bei der Umsetzung von Lebensqualitätsstudien zu beraten und somit die Qualität dieser Studien zu verbessern. Sieben Jahre später wurde der EORTCQLQ-C36-Fragebogen entwickelt (Aarsonson et al, 1993). Dieses Vorläufermodell des nun aktuellen symptomspezifischen EORTC-QLQ-C30 war schon damals dazu konzipiert, genau definierten Anforderungen gerecht zu werden. 15 Der EORTC-QLQ-Fragebogen sollte: • krebsspezifisch, • multidimensional, • kulturell unabhängig verwendbar, • und für die Selbstverwaltung geeignet sein. Heute hat sich der EORTC-QLQ-C30-Fragebogen (Version 3.0) als Standardinstrument in ganz Europa etabliert und wurde bereits in mehr als 2200 Studien verwendet (Aarsonson et al, 1993). Erhältlich ist die neueste Version momentan in über 35 Sprachen. Der Erfolg des Fragebogens beruht nicht zuletzt darauf, dass Studien seine Reliabilität bewiesen haben. So liegt die interne Konsistenz als Maß der Reliabilität außer für die Symptomskala Übelkeit, im Wertebereich zwischen 0,87-0,97 (Hermstad et al. 1995). Diese gute Reliabilität wurde auch bei der Betrachtung unterschiedlicher Krebserkrankungen gefunden (Patter et al, 1997). Die Möglichkeit, auch spezifischer auf bestimmte Krebsarten einzugehen wird von der QOL durch zusätzliche Module des EORTC-Fragebogen gewährleistet. Diese decken zusätzlich charakteristische Symptome, Nebenwirkungen und Einschränkungen der einzelnen Krebserkrankungen ab. So gibt es unter anderem Zusatzmodule für Lungen(QLQ-LC13), Ösophagus- (QLQ-ES24), Brust- (QLQ-BR23) und Eierstockkrebs (QLQOV28), die dem Kernfragebogen angeschlossen werden können. Für unsere Untersuchung der Lebensqualität während einer Chemotherapie eignete sich der Gebrauch des Kernfragebogens ohne Zusatzmodul am besten. Da unser Fokus auf dem generellen Einfluss der Chemotherapie auf die Lebensqualität lag und nicht auf dem der spezifischen Erkrankung der Frauen. Die Auswertung erfolgte standardisiert anhand eines Scoring Manuals, welches direkt bei der QOL erhältlich ist. Dieses wurde auf Anfrage für die wissenschaftliche Auswertung der Daten an uns verschickt. Anhand dieses Manuals wurden die Ergebnisse linear transformiert und in Werten zwischen 0 und 100 angegeben (Fayers et al, 2001). Auch die weitere statistische Verarbeitung der Daten erfolgte analog den Vorgaben mit dem Datenverarbeitungsprogramm SPSS. Auf diese Weise konnte über speziell für dieses Programm vorgegebene Befehle sichergestellt werden, dass unbeantwortete Fragen im Fragebogen keinen verfälschenden Effekt auf die Ergebnisse hatten. 16 Dabei geht man von der Annahme aus, dass, wenn mindestens die Hälfte der Items beantwortet wurde, die fehlenden Items den gleichen Werten entsprechen (Fayers et al, 2001). Bestandteil des EORTC-QLQ-C30-Fragebogens sind sowohl einzeln für sich stehende und zu bewertende Fragen als auch komplexere, zusammenhängende Fragenbereiche. Dadurch werden die körperlichen, psychischen und sozialen sowie symptomspezifischen Bereiche der Krebserkrankung abgedeckt (Aarsonson et al, 1993). Im Ganzen besteht der Fragebogen aus 30 Fragen, die angeordnet sind in: • fünf funktionelle Skalen, die physische (Item Nummer 1-5), emotionale (Item Nummer 21-24), kognitive (Item Nummer 20 und 25), soziale (Item Nummer 26 und 27) Funktionsfähigkeit und Rollenfunktionen (Item Nummer 6 und 7) abfragen. • drei symptomatische Skalen, die Müdigkeit (Item Nummer 10, 12 und 18), Übelkeit (Item Nummer 14 und 15) und Schmerzen (Item Nummer 9 und 19) abfragen. • sechs Einzelitems, die Atemnot (Item Nummer 8), Schlaflosigkeit (Item Nummer 11), Appetitverlust (Item Nummer 13), Obstipation (Item Nummer 16), Diarrhoe (Item Nummer 17) und finanzielle Schwierigkeiten (Item Nummer 28) abfragen. 17 • zwei abschließende Skalen, die Gesundheitszustand (Item Nummer 29) und momentane Lebensqualität (Item Nummer 30) abfragen. Aus den letzten beiden Fragen (Item 29 und 30) nach Gesundheitszustand und momentaner Lebensqualität errechnet sich im Schnitt die globale Lebensqualität (QL). Wird im Folgenden Bezug auf die Lebensqualität genommen, so ist damit immer die globale Lebensqualität gemeint. Bei der Auswertung der Ergebnisse ist zu beachten, dass sowohl in den Funktionsskalen als auch in den Skalen zu Gesundheitszustand und Lebensqualität ein hoher Wert einer geringen Einschränkung in den Funktionen und der Lebensqualität entspricht. Damit ist eine Steigerung in den Werten im Verlauf mit einer Verbesserung der dazugehörenden Funktionen gleichzusetzten. Umgekehrt verhält es sich in den Symptomskalen sowie in den Einzelitems. Hier drückt ein hoher Wert eine höhere Einschränkung aus und somit eine Steigerung in den Werten im Verlauf eine Verschlechterung der dazugehörenden Funktionen (Macquart-Moulin, 1999), (Galalae, 2005). 2.3 Patientenkollektiv Insgesamt haben 180 Frauen den Fragebogen ausgefüllt. 100 Patientinnen wurden mit der Diagnose Mammakarzinom behandelt (55,6%). 80 Patientinnen wurden mit der Diagnose Ovarialkarzinom behandelt (44,4%). Es bestand kein signifikanter Unterschied in der Anzahl der beiden Gruppen (p=0,136). Das mittlere Alter der Frauen mit Mammakarzinom lag bei 53,8 Jahren und das der Frauen mit Ovarialkarzinom bei 59,4 Jahren. Auch das mittlere Alter betreffend ließ sich kein signifikanter Unterschied finden (p=0,303). Insgesamt erstreckte sich das Alter von 21 bis 74 Jahren bei den Patientinnen mit Mammakarzinom und von 25 bis 85 Jahren bei den Ovarialkarzinompatientinnen. Um die Ergebnisse des Fragebogens, hinsichtlich der Variable Alter, besser vergleichen zu können, wurden die Patientinnen zusätzlich in drei Altersklassen aufgeteilt: 18 • Altersklasse 1: Frauen im Alter zwischen 20 - 40 Jahren. • Altersklasse 2: Frauen im Alter zwischen 41 - 60 Jahren. • Altersklasse 3: Frauen im Alter zwischen 61 - 85 Jahren. Zur Altersklasse 1 zählten jeweils 7 Frauen der Mamma- und der Ovarialkarzinompatientinnen. In der Altersklasse 2 hatten 64 Frauen ein diagnostiziertes Mammakarzinom und 34 Frauen ein diagnostiziertes Ovarialkarzinom. Somit gab es in dieser Altersklasse signifikant (p=0,002) mehr Mammakarzinompatientinnen. In der Altersklasse 3 waren mit 39 Ovarialkarzinompatientinnen im Vergleich zu 29 Mammakarzinompatientinnen tendenziell mehr Frauen mit Ovarialkarzinom. Auch das Gewicht betreffend wurden die Frauen in zwei Gruppen unterteilt: • Gewichtsklasse 1: BMI unter 30 (einschließlich Präadipositas). • Gewichtsklasse 2: BMI über 30 (einschließlich Adipositas Grad 1, 2 und 3). Die meisten Frauen hatten einen BMI unter 30 (N=155). Das war sowohl bei den Mammakarzinompatientinnen der Fall (85%) als auch bei den Patientinnen mit Ovarialkarzinom (87,5%). Somit war in diesem Punkt kein signifikanter Unterschied feststellbar (p=0,228). Folglich war auch nur ein sehr begrenzter Teil in beiden Gruppen als krankhaft adipös einzustufen (N=25) und es ergab sich auch hierbei kein signifikanter Unterschied zwischen den Gruppen (p=0,317). Eine weitere Unterteilung des Patientenkollektivs wurde im Bezug auf den Gesundheitszustand vorgenommen. Dieser wurde anhand der ASA Klassifikation eingeteilt. Dies ist die Klassifizierung der American Society of Anesthesiologists, um den körperlichen Zustand von Patienten, abhängig von systemischen Erkrankungen präoperativ zu definieren. Laut dieser Definition entspricht: • ASA 1 Patient ohne Allgemeinerkrankung. • ASA 2 Patient mit leichter Allgemeinerkrankung. • ASA 3 Patient mit schwerer Allgemeinerkrankung. • ASA 4 Patient, der dauerhaft vital durch seine Erkrankung gefährdet wird. 19 Ein Unterschied der beiden Patientengruppen bestand darin, dass es signifikant (p=0,001) mehr Frauen mit Mammakarzinom gab, die einen unbeeinträchtigten Gesundheitszustand (ASA 1, N=25, 25%) hatten, als Ovarialkarzinompatientinnen (ASA 1, N=6, 7,5%). Einen leicht beeinträchtigten Gesundheitszustand hatten 51% (ASA 2, N=51) der Mammakarzinompatientinnen und 42,5% (ASA 2, N=34) der Patientinnen mit Ovarialkarzinom. Schwer gesundheitlich beeinträchtigt waren 24% (ASA 3, N=24) der Patientinnen mit Mammakarzinom und 48,8% (ASA 3, N=39) der Ovarialkarzinompatientinnen. Eine einzige Patientin mit Ovarialkarzinom hatte einen mit ASA 4 klassifizierten Gesundheitszustand, konnte die Fragebögen aber ohne Probleme ausfüllen. Bei der Untersuchung der Lebensqualität in Abhängigkeit des Gesundheitszustandes wurde diese Frau nicht mit einbezogen. Ein weiterer Punkt, die Chemotherapie betreffend, wurde nur bei Frauen mit Mammakarzinom untersucht. Dabei wurden die Frauen anhand der Intensität ihrer Chemotherapie in zwei Gruppen unterteilt: Nicht intensivierte Chemotherapie (N=75) : • FEC (Epirubicin, Cyclophosphamid, 5 - FU) im Intervall q21d. • FEC - Doc (Epirubicin, Cyclophosphamid, 5 - FU, Docetaxel) im Intervall q21d. • TCH (Docetaxel, Carboplatin, Herceptin) im Intervall q21d. • DC (Docetaxel, Cyclophosphamid) im Intervall q21d. • Paclitaxel – Avastin® im Intervall q21d. Intensivierte Chemotherapie (N=25) : • ETC (Epirubicin, Cyclophosphamid, Paclitaxel) im Intervall q14d. • TAC (Docetaxel, Cyclophosphamid, Doxorubicin) im Intervall q21d. Insgesamt erhielten signifikant (p<0,001) mehr Frauen eine nicht intensivierte Chemotherapie. 20 Außerdem war in beiden Patientengruppen von Interesse, ob das Vorkommen von unerwünschten Ereignissen mit der Lebensqualität in Zusammenhang stand. Definiert wurden unerwünschte Ereignisse als die Gesundheit beeinträchtigende Vorkommnisse, die zur zusätzlichen Belastung der Frauen führten und das normale Maß an SymptomBelastung einer Chemotherapie überschritten. Dies konnten therapieassoziierte Gesundheitsverschlechterungen sein, die nach den allgemeinen Toxizitätskriterien (CTC Version 4.0) in fünf Grade eingeteilt werden. Bewertet werden dabei sehr viele unterschiedliche Bereiche, unter anderem der Hämatologie, Gastroenterologie, Kardiologie, Infektiologie und Dermatologie (CTC,2009). Der Grad an Toxizität der Patientinnen, bei denen eine Gesundheitsverschlechterung als unerwünschtes Ereignis gewertet wurde, war meistens größer Grad 3. Außerdem als unerwünschtes Ereignis gewertet wurde das Auftreten von Paravasaten. Diese werden definiert als das akzidentelle Verabreichen von Zytostatika in die Unterhaut oder tiefer gelegene Gewebeschichten bei insuffizientem venösem Zugang (Kreienberg et al, 2010). Zuletzt wurden noch die gesundheitlichen Einschränkungen, die durch den Tumor oder durch andere Komorbiditäten bedingt wurden, berücksichtigt. Dazu gehören tiefe Beinvenenthrombosen, Lungenarterienembolien, Schlaganfälle und ambulant erworbene Infekte. Bei der Aufteilung der Frauen in eine Gruppe, bei der es im Verlauf der Therapie zu unerwünschten Ereignissen kam und eine Gruppe, bei der dies nicht der Fall war, kam es zu keinen signifikanten Unterschieden zwischen den beiden Patientengruppen. Einen komplikationslosen Verlauf hatten 67 Frauen mit Mammakarzinom und 51 Frauen mit Ovarialkarzinom. Im Durchschnitt waren es also mehr als 60% der Frauen, die kein unerwünschtes Ereignis hatten. Umgekehrt hatten 33 Mammakarzinompatientinnen und 29 Patientinnen mit Ovarialkarzinom ein unerwünschtes Ereignis im Verlauf ihrer Behandlung. Zuletzt wurden die Patientinnen je nach Einschätzung ihrer Lebensqualität in zwei Gruppen eingeteilt. Entscheidend war der Wert, den die Frauen in den Item Nummern 29 und 30 des EORTC–QLQ-C30-Fragebogen angekreuzt hatten. Ergab dieser im Mittel einen Wert über vier, so wurden sie der Gruppe zugeteilt, die ihre Lebensqualität als gut oder sehr gut bewertet hat. Werte gleich oder kleiner vier führten zur Einteilung der Frauen in die Gruppe, die ihre Lebensqualität als schlecht oder sehr schlecht eingeschätzt hat. Der größere Anteil der Frauen war sowohl bei den Frauen mit diagnostiziertem Mammakarzinom (N=79, 79%) als auch bei den Frauen mit Ovarialkarzinom (N=59, 73,8), der Meinung, dass sich ihre Lebensqualität als gut bewerten lässt. 21 Tab. 1: Überblick über das Patientenkollektiv – Teil 1 Mammakarzinom Ovarialkarzinom Fallzahl Prozent Fallzahl Prozent chi2 100 55,6 80 44,4 0,136 1 7 7 7 8,8 1,000 2 64 64 34 42,5 0,002 3 29 29 39 48,8 0,225 1 85 85 70 87,5 0,228 2 15 15 10 12,5 0,317 Altersklasse Gewichtsklasse Gesundheitszustand (ASA) 1 25 25 6 7,5 0,001 2 51 51 34 42,5 0,065 3 24 24 39 48,8 0,095 1 1,3 4 Unerwünschtes Ereignis Ja 67 67 51 63,8 0,141 Nein 33 33 29 36,3 0,611 gut 79 79 59 73,8 0,089 schlecht 17 17 18 22,5 0,886 Lebensqualität 22 Tab. 2: Überblick über das Patientenkollektiv – Teil 2 Therapie Mammakarzinom Fallzahl Prozent Standard 75 75 Intensiviert 25 25 Chi2 <0,001 2.4 Statistische Auswertung Sämtliche statistischen Berechnungen und Auswertungen erfolgten anhand des Programms SPSS mit der Statistics Student Version 18.0 für Windows. Die deskriptive Statistik des Patientenkollektivs erfolgte anhand von Kreuztabellen mit einem Konfidenzintervall das nach oben mit 95 % und nach unten mit 5 % begrenzt war. Ziel war es Zusammenhänge zwischen den Mammakarzinom und den Ovarialkarzinompatientinnen zu ermitteln. Signifikante Unterschiede zwischen den Patientinnen wurden mit dem Qui-Quadrat Test nach Pearson ermittelt. Dieser Test prüft ob ein Merkmal identisch in den Stichproben verteilt ist. Zur Auswertung der einzelnen Fragestellungen erfolgte die Berechnung anhand von Medianen innerhalb des oben genannten Konfidenzintervalls. Die Berechnung der Mediane eignet sich vor allem dank ihrer geringen Anfälligkeit für Ausreißer. Um signifikante Unterschiede zwischen den einzelnen Gruppen zu ermitteln wurde der Wilcoxon-Mann-Withney Test durchgeführt. Mit diesem Test lässt sich sehr gut der Zusammenhang zwischen zweistufigen nominalskalierten Variablen testen. Statistisch signifikant gelten die Ergebnisse bei einer Irrtumswahrschienlichkeit von p<0,05. 23 3. Ergebnisse 3.1 Einfluss der Chemotherapie auf die Lebensqualität Der Einfluss der Chemotherapie auf die Lebensqualität wurde zunächst zusammen für ein gemischtes Patientenkollektiv aus Patientinnen mit Mamma- oder Ovarialkarzinom und anschließend getrennt nach jeweiliger Diagnose untersucht. Die Betrachtung erfolgte ohne Berücksichtigung externer Einflussfaktoren über die Zeit der Chemotherapie (Zyklus 1, 3 und 6). Das Augenmerk lag dabei auf den beiden letzten Fragen des EORTC-QLQ-C30Fragebogens: - „Wie würden Sie insgesamt Ihren Gesundheitszustand der letzten Woche einschätzen?“ (Item Nummer 29) - „Wie würden Sie insgesamt Ihre Lebensqualität während der letzten Woche einschätzen?“ (Item Nummer 30) Es gilt zu beachten, dass sowohl in den Funktionsskalen als auch in den Skalen zu Gesundheitszustand und Lebensqualität ein hoher Wert einer geringen Einschränkung in den Funktionen und der Lebensqualität entspricht und damit im Verlauf einer Verbesserung der Lebensqualität. Umgekehrt verhält es sich in den Symptomskalen sowie in den Einzelitems. Hier drückt ein hoher Wert eine höhere Einschränkung aus, was im Verlauf einer Verschlechterung der Lebensqualität entspricht. Bei der Auswertung sämtlicher EORTC-Bögen, sowohl von den Mamma- als auch von den Ovarialkarzinompatientinnen (N=180), zeigte sich, dass es vom 1. zum 3. Zyklus zu einer signifikanten Verbesserung der Lebensqualität (p=0,045) kam. Diese nahm tendenziell zum 6. Zyklus hin wieder ab [vgl. Abb. 1]. Innerhalb der Gruppe der Mammakarzinompatientinnen (n=100) kam es tendenziell auch zu einer Verbesserung vom 1. zum 3. Zyklus, die zum 6. Zyklus wieder abnahm [vgl. Tab. 3]. Bei der Gruppe der Ovarialkarzinompatientinnen (N=80) war die Verbesserung vom 1. zum 3. Zyklus erneut signifikant sichtbar (p=0,013). Zum 6. Zyklus zeichnete sich wiederum eine tendenzielle Abnahme der Lebensqualität ab [vgl. Tab. 4]. 24 Der Wert zum 6. Zyklus war beim gemischten Patientenkollektiv genauso wie bei den Ovarialkarzinompatientinnen allein, im Gegensatz zum 3. Zyklus zwar wieder niedriger, fiel jedoch nicht mehr auf den Ausgangswert ab. Somit war die Lebensqualität der Patientinnen zum Ende ihrer Behandlung tendenziell besser als zu Beginn [vgl. Abb.1], [vgl. Tab.4]. Bei den Mammakarzinompatientinnen war der Wert jedoch zum 6. Zyklus tendenziell schlechter als zu Beginn [vgl. Tab.3]. Abb. 1: Einfluss der Chemotherapie auf die Lebensqualität der Patientinnen mit Mamma- oder Ovarialkarzinom (N=180) 3.2 Einfluss individueller Faktoren auf die Lebensqualität während der Chemotherapie Um den Einfluss verschiedener Faktoren auf die Lebensqualität während der Chemotherapie zu untersuchen, wurden die Patientinnen dann je nach Gesundheitszustand, Gewicht, Alter, dem Auftreten unerwünschter Ereignisse während der Therapie und der Intensität der Chemotherapie in Gruppen unterteilt. 25 Anhand dieser Gruppen erfolgte die Betrachtung zum einen für das gemischte Patientenkollektiv bestehend aus Patientinnen mit Mamma- oder Ovarialkarzinom und zum anderen getrennt nach jeweiliger Diagnose. Anschließend wurden Mamma- und Ovarialkarzinompatientinnen miteinander verglichen. Von Interesse war, ob sich die Lebensqualität während der Chemotherapie innerhalb der Gruppen unterschiedlich veränderte. Einfluss des Gesundheitszustands auf die Lebensqualität Bei der Auswertung aller EORTC-Bögen ergab sich bei den Frauen ohne Allgemeinerkrankungen (ASA 1, N=85) und bei den Frauen mit leichten Allgemeinerkrankungen (ASA 2, N=31) eine tendenzielle Verbesserung vom 1. bis zum 3. Zyklus. Bei den Frauen mit schweren Allgemeinerkrankungen (ASA 3, N=63) war die Verbesserung der Lebensqualität vom 1. zum 3. Zyklus signifikant (p=0,042). Des Weiteren war zum 6. Zyklus eine tendenzielle Verschlechterung innerhalb aller Gruppen erkennbar, die mit Ausnahme der ASA Gruppe 3 stärker war als zu Beginn der Therapie [vgl. Abb.2]. Auch bei nach Diagnose getrennter Betrachtung der Bögen ergab sich die Tendenz, dass die Lebensqualität von Beginn der Therapie bis zum 3. Zyklus hin anstieg und zum 6. Zyklus wieder abfiel. Diese Tendenz zeigte sich bei den Mammakarzinompatientinnen der Gruppen ASA 1 (N=25) und ASA 3 (N=24). In der Gruppe ASA 1 verschlechterte sich der Wert zum 6. Zyklus relativ zum 1. Zyklus. In der Gruppe ASA 3 zeigte sich zum 6. Zyklus der gleiche Wert wie zu Beginn der Therapie. Die Gruppe ASA 2 (N=51) der Mammakarzinompatientinnen behielt zum 3. Zyklus ihren Ausgangswert bei und verschlechterte sich tendenziell vom 1. bis zum 6. Zyklus [vgl. Tab.3]. Bei den Ovarialkarzinompatientinnen bestätigten sich die gemeinsamen Tendenzen bei den Gruppen ASA 2 (N=34) und ASA 3 (N=39) während die Gruppe ASA 1 (N=6) ab dem 3. Zyklus ihr Niveau hielt [vgl. Tab.4]. 26 Einfluss des Gewichts auf die Lebensqualität In Abhängigkeit von ihrem Gewicht wurden alle Patientinnen zum einen in eine Gruppe von Frauen mit einem BMI unter 30 (Normal- bis leichtes Übergewicht, N=155) und zum anderen in eine Gruppe von Frauen mit einem BMI über 30 (schweres Übergewicht, N=25) eingeteilt. Dabei ließ sich bei Betrachtung in beiden Gewichtsgruppen eine Tendenz zu einer besseren Lebensqualität zum Zeitpunkt des 3. Zyklus erkennen, die zum 6. Zykluszeitpunkt wieder schlechter war. Ein Unterschied bestand zwischen den Gewichtsgruppen beim Vergleich der Werte vom 1. und 6. Zyklus. Hierbei ergab sich für die Frauen mit Normalgewicht ein höherer Endwert und für die Frauen mit Übergewicht einen niedrigerer Endwert. Damit hatte sich die Lebensqualität für die normalgewichtigen Frauen von Beginn der Therapie an verbessert und für die übergewichtigen Frauen verschlechtert [vgl. Abb.3]. Analog verhielten sich die Werte bei getrennter Auswertung nur der Mammakarzinompatientinnen. Sowohl bei den normalgewichtigen Frauen (N=85) als auch bei den übergewichtigen Frauen (N=15) stieg die Lebensqualität tendenziell zum 3. Zyklus an und fiel zum 6. Zyklus hin wieder ab. In beiden Gruppen war dabei der Wert und somit die Lebensqualität der Frauen zum 6. Zyklus im Vergleich zum 1. Zyklus erniedrigt [vgl. Tab.3]. Bei den Ovarialkarzinompatientinnen mit einem BMI unter 30 (N=70) war die Verbesserung zum 3. Zyklus hin signifikant (p=0,029). Zum 6. Zyklus kam es dann tendenziell wieder zu einer Verschlechterung. Bei den Ovarialkarzinompatientinnen mit einem BMI über 30 (N=10) zeigte sich tendenziell der gleiche Verlauf. Beide Gewichtsgruppen zeigten eine bessere Lebensqualität zum Ende der Behandlung im Vergleich zu deren Beginn [vgl. Tab.4]. Einfluss des Alters auf die Lebensqualität Bei der Betrachtung der EORTC-Bögen aller Patientinnen im Hinblick auf ihr Alter kam es zu signifikanten Veränderungen im Verlauf der Zeit bei den Frauen im Alter zwischen 20 und 40 (Altersklasse 1, N=14). Hier ergab sich sowohl von Therapiebeginn zum 3. Zyklus als auch zum 6. Zyklus eine signifikante Verbesserung (p=0,006, p=0,022). 27 Allgemein war damit die Lebensqualität zum 6. Zyklus zwar besser als zu Beginn der Therapie, verglichen mit dem 3. Zyklus waren die Werte dennoch niedriger. Bei den Frauen im Alter zwischen 41 und 60 (Altersklasse 2, N=98) und den Frauen im Alter zwischen 61 und 80 (Altersklasse 3, N=68) war eine tendenzielle Verbesserung des Ausgangswertes zum 3. Zyklus vorhanden. Zum 6. Zyklus war der Wert dann jedoch schlechter als zu Beginn [vgl. Abb.4]. Bei ausschließlicher Betrachtung der Mammakarzinompatientinnen ergaben sich in der Altersklassen 1 (N=7) gleiche Tendenzen wie bei der gerade beschriebenen Auswertung aller Patientinnen zusammen. In der Altersklasse 2 (N=64) der Mammakarzinompatientinnen zeigte sich eine tendenzielle Verschlechterung vom 1. über den 3. bis zum 6. Zyklus. In der Altersklasse 3 stiegen die Werte zum 3. Zyklus und sanken zum 6. Zyklus auf ein Niveau unterhalb des Ausgangswertes [vgl. Tab.3]. Auch in der Gruppe der Ovarialkarzinompatientinnen ergab sich das oben beschriebene Bild. In der Altersklasse 1 (N=7) war die Verbesserung zum 3. Zyklus signifikant (p=0,010). In der Altersklasse 2 (N=34) wie auch in der Altersklasse 3 (N=39) waren die Veränderungen tendenziell vorhanden. Einziger Unterschied bei den Ovarialkarzinompatientinnen zu den Mammakarzinompatientinnen war, dass die Lebensqualität der Frauen aller drei Altersklassen zum Ende der Therapie tendenziell besser war als zum Anfang [vgl. Tab4]. Einfluss unerwünschter Ereignisse auf die Lebensqualität Um die Frage beantworten zu können, ob und wie sich die Lebensqualität durch das Auftreten von unerwünschten Ereignissen, die während der Chemotherapie auftraten, verändert, wurden die Patientinnen in zwei Gruppen aufgeteilt. Zum einen in eine Gruppe, die während ihrer Therapie ein unerwünschtes Ereignis hatte (N=62) und zum anderen in eine Gruppe, die einen komplikationslosen Therapieverlauf hatte (N=118). Als ein unerwünschtes Ereignis wurden dabei Paravasate, therapieassoziierte Gesundheitsverschlechterungen, bewertet nach den allgemeinen Toxizitätskriterien (CTC Version 4.0) oder sonstige akut auftretende Gesundheitseinschränkungen gewertet. Die Auswertung aller EORTC-Bögen zeigte sowohl in der Gruppe der Frauen mit als auch in der Gruppe der Frauen ohne Komplikationen während der Behandlung eine tendenzielle Steigerung der Lebensqualität bis zum 3. Zyklus. 28 Danach sanken die Werte auf ein im Vergleich zum Ausgangswert höheres Niveau bei den Frauen ohne Komplikationen und auf ein im Vergleich zum Ausgangswert niedrigeres Niveau bei den Frauen mit Komplikationen [vgl. Abb.5]. Auch bei den Mammakarzinompatientinnen sah man tendenziell bei den Frauen, die kein unerwünschtes Ereignis hatten (N=67), eine Verbesserung zum 3. Zyklus hin. Danach verschlechterte sich die Lebensqualität und war dann zudem noch schlechter als zu Beginn der Therapie. Bei den Frauen, die ein unerwünschtes Ereignis hatten (N=33), verschlechterte sich der Mittelwert vom 1. über den 3. zum 6. Zyklus [vgl. Tab.3]. Bei den Patientinnen mit Ovarialkarzinom, die ein unerwünschtes Ereignis hatten (N=29), konnte man eine signifikante Verbesserung der Lebensqualität zum 3. Zyklus hin erkennen (p=0,017). Bei den Patientinnen ohne unerwünschtes Ereignis (N=51) war die Verbesserung tendenziell auch vorhanden. Die Tendenz zu einer Verschlechterung der Lebensqualität ab dem 3. Zyklus zeigte sich in beiden Gruppen. Die Werte zum Ende der Therapie im Vergleich zum 1. Zyklus waren bei den Frauen ohne unerwünschtes Ereignis tendenziell höher, bei den Frauen mit unerwünschtem Ereignis gleich hoch [vgl. Tab4]. Einfluss der Intensität der Chemotherapie auf die Lebensqualität Die Frage, ob die Intensität der Chemotherapie Einfluss auf die Lebensqualität hat, wurde nur bei den Frauen mit Mammakarzinom untersucht, da hier intensivierte Therapieregime erfolgten. Es ergab sich dabei eine tendenzielle Verbesserung der Lebensqualität zum 3. Zyklus bei den Patientinnen mit nicht intensivierter Therapie (N=75). Danach sank die Lebensqualität der Frauen jedoch wieder ab und war dann schlechter als zu Beginn der Therapie. Bei den Patientinnen, die eine intensivierte Therapie (N=25) erhielten, sank die Lebensqualität bereits zum 3. Zyklus hin tendenziell ab und verschlechterte sich noch weiter zum 6. Zyklus [vgl. Tab3]. 29 Tab. 3: Einfluss der Chemotherapie auf die Lebensqualität der Mammakarzinompatientinnen in Abhängigkeit bestimmter Variablen LQ:Lebensqualität, M/SD:Median/ Standartabweichung, MW:Mittelwert, p=1/3:Asymptomatische Signifikanz nach Mann-Whitney-U-Test im Vergleich 1. und 3. Zyklus, p=1/6:Asymptomatische Signifikanz nach Mann-Whitney-U-Test im Vergleich 1. und 6. Zyklus, p=3/6:Asymptomatische Signifikanz nach Mann-Whitney-U-Test im Vergleich 3. und 6. Zyklus, OE:ohne Einflussfaktor (N=100), ASA1:ohne Allgemeinerkrankung (N=25), ASA2:mit leichter Allgemeinerkrankung (N=51), ASA3:mit schwerer Allgemeinerkrankung (N=24), BMI1:BMI<30 (N=85), BMI2:BMI>30(N=15), AK1:20-40 Jahre (N=7), AK2:41–60 Jahre (N=64), AK3:61–85 Jahre (N=29), OUE:ohne unerwünschtes Ereignis (N=67), UE:mit unerwünschtem Ereignis (N=33), NIT:keine intensivierte Chemotherapie (N=75), IT:mit intensivierter Chemotherapie (N=25) LQ 1. Zyklus LQ 3. Zyklus LQ 6. Zyklus M/SD MW p=1/3 M/SD MW M/SD MW p=1/6 p=3/6 OE 66,66/22,74 62,72 0,578 66,66/22,94 64,14 66,66/19,69 60,41 0,310 0,101 ASA1 66,66/20,25 67,33 0,754 66,66/17,88 68,66 66,66/16,19 65,66 0,776 0,483 ASA2 66,66/22,51 64,79 0,815 66,66/23,34 64,16 66,66/20,40 61,27 0,378 0,541 ASA3 62,50/24,06 53,03 0,227 66,66/26,50 59,37 50,00/20,09 53,12 0,719 0,066 BMI1 66,66/22,21 63,75 0,774 66,66/23,82 63,88 66,66/19,61 61,27 0,328 0,205 BMI2 66,66/25,94 56,41 0.373 66,66/17,78 65,55 58,33/20,08 55,55 0,869 0,191 AK1 58,33/21,20 57,14 0,136 75,00/16,66 75,00 66,66/6,55 70,23 0,182 0,391 AK2 66,66/22,85 64,94 0,922 66,66/24,45 63,67 66,66/19,96 61,71 0,345 0,388 AK3 66,66/22,96 58,97 0,609 66,66/20,47 62,50 50,00/20,21 55,17 0,293 0,118 OUE 62,50/22,68 61,48 0,376 66,66/22,37 63,88 58,33/17,38 60,57 0,635 0,117 UE 66,66/23,02 65,55 0,922 66,66/24,38 64,64 66,66/24,00 60,10 0,336 0,439 NIT 66,66/21,92 64,12 0,208 70,83/22,48 67,90 66,66/18,54 63,11 0,507 0,056 IT 85,33/25,11 58,68 0,447 50,00/20,95 53,00 50,00/21,18 52,33 0,374 0,882 30 Tab. 4: Einfluss der Chemotherapie auf die Lebensqualität der Ovarialkarzinompatientinnen in Abhängigkeit bestimmter Variablen LQ:Lebensqualität, M/SD:Median/ Standartabweichung, MW:Mittelwert, p=1/3:Asymptomatische Signifikanz nach Mann-Whitney-U-Test im Vergleich 1. und 3. Zyklus, p=1/6:Asymptomatische Signifikanz nach Mann-Whitney-U-Test im Vergleich 1. und 6. Zyklus, p=3/6:Asymptomatische Signifikanz nach Mann-Whitney-U-Test im Vergleich 3. und 6. Zyklus, OE:ohne Einflussfaktor (N=80), ASA1:ohne Allgemeinerkrankung (N=6), ASA2:mit leichter Allgemeinerkrankung (N=34), ASA3:mit schwerer Allgemeinerkrankung (N=39), BMI1:BMI<30 (N=70), BMI2:BMI>30(N=10), AK1:20-40 Jahre (N=7), AK2:41–60 Jahre (N=34), AK3:61–85 Jahre (N=39), OUE:ohne unerwünschtes Ereignis (N=29), UE:mit unerwünschtem Ereignis (N=51) LQ 1. Zyklus LQ 3. Zyklus LQ 6. Zyklus M/SD MW p=1/3 M/SD MW M/SD MW p=1/6 p=3/6 OE 58,33/16,76 55,41 0,013 66,66/17,49 62,17 58,33/18,12 59,61 0,170 0,323 ASA1 62,50/6,80 61,11 0,198 66,66/18,25 66,66 66,66/15,81 66,66 0,402 0,866 ASA2 50,00/16,40 54,79 0,092 66,66/19,59 62,00 54,16/19,99 58,33 0,405 0,448 ASA3 50,00/ 18,37 54,72 0,117 66,66/15,47 61,03 58,33/16,87 59,23 0,301 0,493 BMI1 50,00/16,99 54,71 0,029 66,66/17,42 61,11 58,33/18,14 59,28 0,151 0,495 BMI2 66,66/14,04 61,45 0,177 66,66/16,72 70,37 66,66/18,89 62,50 0,748 0,428 AK1 66,66/9,27 60,71 0,010 83,33/8,90 76,19 66,66/15,10 70,23 0,099 0,475 AK2 58,33/20,10 54,54 0,192 66,66/19,26 60,85 50,00/19,33 59,59 0,456 0,697 AK3 50,00/14,61 55,18 0,131 66,66/16,19 60,74 58,33/17,26 57,67 0,332 0,521 OUE 58,33/16,08 58,84 0,127 66,66/18,11 63,94 66,66/16,32 62,92 0,258 0,693 UE 50,00/16,50 24,44 0,017 66,60/16,26 24,44 50,00/19,87 24,44 0,408 0,172 31 3.3 Vergleich der Lebensqualität der Patientinnen in Abhängigkeit der individuellen Faktoren Nachdem der Einfluss verschiedener Faktoren auf die Lebensqualität im zeitlichen Verlauf der Chemotherapie aufgezeigt wurde, sollte untersucht werden ob es einen Unterschied darin gab, auf welche Weise sich die Einflussfaktoren auf die Lebensqualität auswirkten. Unterschiede der Lebensqualität in Abhängigkeit des Gesundheitszustandes Beim Vergleich der Lebensqualität aller Patientinnen mit unterschiedlichen Gesundheitszuständen zeigte sich, dass die Frauen ohne Allgemeinerkrankungen (ASA 1, N=85) ihre Lebensqualität zu allen drei Zykluszeitpunkten als besser einschätzten als Frauen mit schweren Allgemeinerkrankungen (ASA 3, N=63). Signifikant war dieser Unterschied zum Zeitpunkt des 1. und 6. Zyklus (p=0,013, p=0,026). Tendenziell konnte zudem zu allen drei Zykluszeitpunkten festgestellt werden, dass die Frauen mit leichten Allgemeinerkrankungen (ASA 2, N=31) ihre Lebensqualität als schlechter einschätzten als die Frauen der ASA Gruppe 1, aber als besser als die Frauen der ASA Gruppe 3 [vgl. Abb.2]. Auch beim Vergleich der unterschiedlichen Gruppen jeweils nur der Mammakarzinomoder nur der Ovarialkarzinompatientinnen zeigte sich der oben beschriebene Effekt zwischen allen drei ASA Gruppen. Zum Zeitpunkt des 6. Zyklus war der Unterschied zudem signifikant zwischen den Frauen mit Mammakarzinom aus der ASA Gruppe 1 und 3 (p=0,028) [vgl. Tab.5 / Tab.6]. 32 Abb. 2: Unterschiede der Lebensqualität der Patientinnen mit Mamma- oder Ovarialkarzinom in Abhängigkeit des Gesundheitszustandes ASA1:ohne Allgemeinerkrankung (N=85), ASA2:mit leichter Allgemeinerkrankung (N=31), ASA3:mit schwerer Allgemeinerkrankung (N=63) Unterschiede der Lebensqualität in Abhängigkeit des Gewichts Bei Betrachtung der Lebensqualitätseinschätzung aller Patientinnen abhängig vom Gewicht zeigten sich beim Vergleich der Frauen mit einem BMI unter 30 (Normal- bis leichtes Übergewicht, N=155) tendenziell bessere Werte als bei den Frauen mit einem BMI über 30 (schweres Übergewicht, N=25). Ausnahme war der 3. Zykluszeitpunkt, zu dem die übergewichtigen Frauen ihre Lebensqualität als tendenziell besser wahrnahmen [vgl. Abb.3]. 33 Abb. 3: Unterschiede der Lebensqualität der Patientinnen mit Mamma- oder Ovarialkarzinom in Abhängigkeit des Gewichts BMI unter 30:Normalgewicht bis leichtes Übergewicht (N=155), BMI über 30:schweres Übergewicht (N=25) Auch bei der separaten Auswertung der Lebensqualität der Frauen mit Mammakarzinom hatten die Frauen mit einen BMI unter 30 (N=85) mit Ausnahme des 3. Zykluszeitpunktes die besseren Werte im Vergleich zu den Frauen mit einem BMI über 30 (N=15) [vgl. Tab.5]. Umgekehrt verhielt es sich bei ausschließlicher Betrachtung der Ovarialkarzinompatientinnen. Hier wiesen die Frauen mit einem BMI unter 30 (N=70) tendenziell zu allen drei Zykluszeitpunkten die schlechteren Werte im Vergleich zu den Frauen mit einem BMI über 30 auf (N=10) [vgl. Tab.6]. 34 Unterschiede der Lebensqualität in Abhängigkeit des Alters Bei Betrachtung der Lebensqualität aller Frauen in Abhängigkeit vom Alter zeigte sich, dass Frauen mit steigendem Alter ihre Lebensqualität als schlechter einschätzten. Damit nahmen die Frauen unter 40 (Altersklasse 1, N=14), ihre Lebensqualität tendenziell am positivsten war, gefolgt von den Frauen zwischen 40 und 60 (Altersklasse 2, N=98), die ihre Lebensqualität als besser als die Frauen über 60 einschätzten (Altersklasse 3, N=68). Signifikant bestand dieser Unterschied zum 3. Zykluszeitpunkt (p=0,043, p=0,006). Zum 6. Zyklus bestand der Unterschied noch signifikant zwischen den Altersklassen 1 und 3 weiter (p=0,005). Ausnahme war der Therapiebeginn, da hier die Frauen im Alter zwischen 20 und 40 Jahren (Altersklasse 1, N=14) ihre Lebensqualität tendenziell als schlechter einschätzten als die Frauen im Alter zwischen 40 und 60 Jahren (Altersklasse 2, N=98) [vgl. Abb.4]. Abb. 4: Unterschiede der Lebensqualität der Patientinnen mit Mamma- oder Ovarialkarzinom in Abhängigkeit des Alters 20–40 Jährige (N=14), 41–60 Jährige (N=98), 61–85 Jährige (N=29) 35 Analog dazu verhielten sich die Werte bei der getrennten Auswertung der Fragebögen der Mammakarzinompatientinnen. Die Frauen der Altersklasse 1 (N=7) wiesen tendenziell außer zum 1.und zum 3. Zykluszeitpunkt im Vergleich zu den Frauen der Altersklasse 2 (N=64) die besseren Werte auf. Die Frauen der Altersklasse 3 (N=29) zeigten außer zum 1. Zyklus zu dem sie bessere Werte hatten als die Frauen der Altersklasse 1 allgemein die schlechtesten Werte. Ein signifikanter Unterschied bestand zum 6. Zykluszeitpunkt zwischen den besseren Werten der Frauen der 1. Altersklasse im Vergleich zur 3. Altersklasse (p=0,030) [vgl. Tab.5]. Innerhalb der Gruppe der Ovarialkarzinompatientinnen hatten die Frauen der Altersklasse 1 (N=7) tendenziell zum 1. und 6. Zykluszeitpunkt und signifikant zum 3. Zykluszeitpunkt die besseren Werte im Gegensatz zu den Frauen der Altersklasse 2 (N=34) und der Altersklasse 3 (N=39) (p=0,047, p=0,017). Als Abweichung zu den eben beschriebenen Ergebnissen ergab sich zum 6. Zyklus eine tendenziell schlechtere Lebensqualität bei den Frauen der Altersklasse 2 verglichen mit den Frauen der Altersklasse 3 [vgl. Tab. 6]. 36 Tab. 5: Vergleich der Lebensqualität der Patientinnen in Abhängigkeit der individuellen Faktoren bei Mammakarzinompatientinnen LQ:Lebensqualität, M/MW: Median/Mittelwert, p1: Asymptomatische Signifikanz nach Mann-Whitney-U Test im Vergleich der Gruppen zum 1.Zyklus, p3: Asymptomatische Signifikanz nach Mann-Whitney-U Test im Vergleich der Gruppen zum 3.Zyklus, p6: Asymptomatische Signifikanz nach Mann-Whitney-U Test im Vergleich der Gruppen zum 6.Zyklus OE:ohne Einflussfaktor (N=100), ASA1:ohne Allgemeinerkrankung (N=25), ASA2:mit leichter Allgemeinerkrankung (N=51), ASA3:mit schwerer Allgemeinerkrankung (N=24), BMI1:BMI<30 (N=85), BMI2:BMI>30(N=15), AK1:20-40 Jahre (N=7), AK2:41–60 Jahre (N=64), AK3:61–85 Jahre (N=29), OUE:ohne unerwünschtes Ereignis (N=67), UE:mit unerwünschtem Ereignis (N=33), NIT:keine intensivierte Chemotherapie (N=75), IT:mit intensivierter Chemotherapie (N=25) LQ 1.Zyklus M/MW ASA1 66,66/67,33 ASA2 66,66/64,79 ASA2 66,66/64,79 ASA3 62,50/53,03 ASA3 62,50/53,03 ASA1 66,66/67,33 BMI1 66,66/63,75 BMI2 66,66/56,41 AK1 58,33/57,14 AK2 66,66/64,94 AK2 66,66/64,94 AK3 66,66/62,50 AK3 66,66/62,50 AK1 58,33/57,14 OUE 62,50/61,48 UE 66,66/65,55 NIT 66,66/64,12 IT 85,33/58,68 LQ 3.Zyklus p1 M/MW LQ 6.Zyklus p3 66,66/68,66 0,822 66,66/64,16 66,66/59,37 0,453 66,66/68,66 0,713 66,66/65,55 0,369 66,66/63,67 0,906 66,66/62,50 0,287 75,00/63,88 0,630 66,66/64,64 0,149 50,00/53,00 37 58,33/55,55 0,278 66,66/61,71 0,200 50,00/55,17 0,082 66,66/61,27 0,030 58,33/60,57 0,795 70,83/67,90 0,288 0,028 50,00/55,17 66,66/63,88 0,226 66,66/65,66 66,66/61,71 66,66/62,50 0,876 0,072 66,66/70,23 66,66/63,67 0,302 50,00/53,12 66,66/61,27 75,00/75,00 0,401 0,511 50,00/ 53,12 66,66/63,88 0,346 66,66/ 61,27 66,66/61,27 66,66/59,37 0,077 p6 66,66/65,66 66,66/ 64,16 0,078 M/MW 66,66/60,10 0,644 66,66/63,11 0,003 50,00/52,33 0,040 Tab. 6: Vergleich der Lebensqualität der Patientinnen in Abhängigkeit der individuellen Faktoren bei Ovarialkarzinompatientinnen LQ:Lebensqualität, M/MW: Median/Mittelwert, p1: Asymptomatische Signifikanz nach Mann-Whitney-U Test im Vergleich der Gruppen zum 1.Zyklus, p3: Asymptomatische Signifikanz nach Mann-Whitney-U Test im Vergleich der Gruppen zum 3.Zyklus, p6: Asymptomatische Signifikanz nach Mann-Whitney-U Test im Vergleich der Gruppen zum 6.Zyklus OE:ohne Einflussfaktor (N=80), ASA1:ohne Allgemeinerkrankung (N=6), ASA2:mit leichter Allgemeinerkrankung (N=34), ASA3:mit schwerer Allgemeinerkrankung (N=39), BMI1:BMI<30 (N=70), BMI2:BMI>30(N=10), AK1:20-40 Jahre (N=7), AK2:41–60 Jahre (N=34), AK3:61–85 Jahre (N=39), OUE:ohne unerwünschtes Ereignis (N=29), UE:mit unerwünschtem Ereignis (N=51) LQ 1.Zyklus M/MW ASA1 62,50/61,11 ASA2 50,00/54,79 ASA2 50,00/54,79 ASA3 50,00/54,72 ASA3 50,00/54,72 ASA1 62,50/61,11 BMI1 50,00/54,71 BMI2 66,66/61,45 AK1 66,66/60,71 AK2 58,33/54,54 AK2 58,33/54,54 AK3 50,00/55,18 AK3 50,00/55,18 AK1 66,66/60,71 OUE 58,33/58,84 UE 50,00/49,40 LQ 3.Zyklus p1 M/MW LQ 6.Zyklus p3 66,66/66,66 0,342 66,66/62,00 66,66/61,03 0,603 66,66/66,66 0,689 66,66/70,37 0,362 66,66/60,85 0,120 66,66/60,74 0,047 83,33/76,19 0,796 66,66/59,19 38 0,270 66,66/62,50 0,634 50,00/59,59 0,164 58,33/57,67 0,972 58,33/57,67 0,017 66,66/63,94 0,015 66,66/66,66 50,00/59,59 66,66/60,74 0,213 0,838 66,66/70,23 66,66/60,85 1,000 58,33/59,23 58,33/59,28 83,33/76,19 0,377 0,345 58,33/59,23 66,66/61,11 0,187 54,16/58,33 54,16/58,33 66,66/ 61,03 0,224 p6 66,66/66,66 66,66/62,00 0,867 M/MW 66,66/70,23 0,064 66,66/62,92 0,218 50,00/54,02 0,039 Unterschiede der Lebensqualität in Abhängigkeit des Auftretens eines unerwünschten Ereignisses Um den Einfluss von unerwünschten Ereignissen auf die Lebensqualität zu evaluieren, wurden die Frauen in zwei Gruppen aufgeteilt. Dann wurden die Werte der Gruppe der Frauen, bei denen im Verlauf der Therapie ein unerwünschtes Ereignis auftrat (N=62), (siehe Kapitel 2), mit den Werten von Frauen, die einen komplikationslosen Verlauf hatten (N=118), verglichen. Ergebnis war, dass die Frauen ohne Komplikationen ihre Lebensqualität zu allen drei Zeitpunkten tendenziell als besser eingeschätzt haben [vgl. Abb.5]. Abb. 5: Unterschiede der Lebensqualität der Patientinnen mit Mamma- oder Ovarialkarzinom in Abhängigkeit des Auftretens eines unerwünschten Ereignisses unerwünschtes Ereignis nicht vorhanden (N=118), unerwünschtem Ereignis vorhanden (N=62) 39 Das Gegenteil dazu zeigte sich bei Betrachtung der Werte innerhalb der Gruppe der Mammakarzinompatientinnen. Hier schätzten die Frauen, die kein unerwünschtes Ereignis hatten (N=67), ihre Lebensqualität zu allen Zykluszeitpunkten tendenziell als schlechter ein als die Frauen, bei welchen ein unerwünschtes Ereignis auftrat (N=33). Bei ausschließlicher Betrachtung der Patientinnen mit Ovarialkarzinom konnte man wieder das anfänglich beschriebene Bild erkennen. Die Frauen mit unerwünschtem Ereignis (N=51) empfanden ihre Lebensqualität als schlechter als die Frauen mit einem komplikationslosen Therapieverlauf (N=29). Diese Tatsache zeigte sich in signifikant unterschiedlichen Werten zum 1. und 6. Zyklus (p=0,015, p=0,039) [vgl. Tab.5 / Tab.6]. Unterschiede der Lebensqualität in Abhängigkeit der Intensität der Chemotherapie Mit Ausnahme des 1. Zyklus, bei dem die Tendenz genau umgekehrt vorlag, war die Lebensqualität der Mammakarzinompatientinnen, die keine intensivierte Therapie erhielten, zum 3. und 6. Zyklus signifikant besser als die der Patientinnen mit Mammakarzinom mit intensivierter Therapie (p=0,003, p=0,040) [vgl. Tab.5]. 3.4 Auswertung der weiteren EORTC-Items im Verlauf der Therapie Der nun folgende Teil beschäftigt sich mit der Auswertung der Funktions- und Symptomskalen des EORTC-QLQ-C30-Fragebogens im Verlauf der Therapie. Die einzelnen Bereiche wurden für das gemischte Patientenkollektiv, bestehend aus den Patientinnen mit Mamma- oder Ovarialkarzinom und dann anhand der Diagnosen, in zwei Gruppen ausgewertet. Anschließend wurden Mamma- und Ovarialkarzinompatientinnen miteinander verglichen. 40 Auswertung bei den Mamma- und den Ovarialkarzinompatientinnen Zuerst erfolgte die Auswertung der EORTC-Bögen aller Patientinnen (N=180). Im Bereich der Funktionsskala zeigte sich eine signifikante Verbesserung der emotionalen Funktion (p=0,016, p=0,035) im Vergleich des 1. zum 3. Zyklus genauso wie im Vergleich des 1. Zyklus zum 6. Zyklus. Der selbe Trend war in den Werten im Bereich der sozialen Funktion zu erkennen. Im Gegensatz dazu verschlechterten sich die Werte im Bereich der kognitiven Funktion signifikant (p=0,002, p=0,005) im Vergleich vom 1. und vom 3. Zyklus zum 6. Zykluszeitpunkt. Zudem signifikant verschlechtert haben sich die Werte im Bereich der physischen Funktion (p=0,027) vom 3. zum 6. Zyklus. Bei der Rollenfunktion ließ sich erneut die Tendenz erkennen, dass die Werte zum 3. Zyklus hin besser und zum 6. Zyklus hin wieder schlechter wurden. Im Bereich der Symptomskala verschlechterten sich signifikant die Symptome Übelkeit und Obstipation im Verlauf des 1. zum 3. Zyklus (p<0,001, p<0,001) und des 1. und 6. Zyklus (p=0,007, p=0,001). Außerdem verschlechterten sich sowohl die Müdigkeit als auch die Atemnot signifikant (p=0,042, p<0,001) zwischen 1. und 6. Zyklus. Die Atemnot verschlechterte sich zudem auch in der Zeit zwischen dem 3. und 6. Zyklus signifikant (p<0,001). Zum 3. Zyklus waren die Werte im Bereich Atemnot jedoch noch unverändert erhalten während sie sich im Bereich Müdigkeit zu diesem Zeitpunkt bereits zum Ausgangswert verschlechtert hatten. Innerhalb des restlichen Bereiches der Symptomskala waren tendenzielle Veränderungen zu erkennen. So nahmen die Schmerzen tendenziell im Therapieverlauf zunächst ab und dann zum 6. Zyklus wieder zu ohne sich dabei im Vergleich zum Ausgangswert zu verschlechtern. Die Werte in den Bereichen Diarrhoe und finanziellen Probleme nahmen bei den Frauen konstant zu. Probleme mit Schlaflosigkeit waren tendenziell vor allem zum 3. Zykluszeitpunkt vorhanden. Über den gesamten Therapieverlauf gleich blieben die Werte im Bereich des Appetitverlusts, der nur gering vorhanden war [vgl. Tab.7]. 41 Tab. 7: Auswertung der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) im Verlauf der Therapie bei den Mamma- (N=100) und bei den Ovarialkarzinompatientinnen (N=80) + :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus), ++ :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, - :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus), -- : Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, / :Kein Unterschied zum Ausgangsmittelwert (1. Zyklus), ! :Unterschied zum Ausgangsmittelwert (1. Zyklus) signifikant PF:physical functioning (physische Funktion), RF:role functioning (Rollenfunktion), EF:emotional functioning (emotionale Funktion), CF:cognitive functioning (kognitive Funktion), SF:social functioning (soziale Funktion), FA:fatigue (Müdigkeit), NA:nausea and vomiting (Übelkeit), PA:pain (Schmerzen), DY:dyspnoea (Atemnot), IN:insomnia (Schlaflosigkeit), AP:appetite loss (Appetitverlust), CO:constipation (Obstipation), DI:diarrhoea (Diarrhoe), FI:financial difficulties (finanzielle Schwierigkeiten) Alle Patientinnen Mammakarzinom Ovarialkarzinom Zyklus 3 6 3 6 3 6 PF / - - - -! + +! + RF + / - -- + +! + EF + +! +! ++ + + +! +! CF / -! - - -! / - SF ++ + / - ++ + FA - - -! - - -! ++ + NA - -! -! - -! -! + + PA ++ + / / + +! + DY / -! - - -! + - IN - + / - + - AP / / -! - -! +! + +! CO - -! -! - -! -! -- - DI - -- -- - / - FI - -- - -- - -- 42 Auswertung bei den Mammakarzinompatientinnen Als nächstes folgte die Betrachtung der Gruppe der Mammakarzinompatientinnen (N=100). Hier ergab sich im Bereich der Funktionsskala eine signifikante Verschlechterung in den Werten der physischen (p<0,001, p=0,022) und der kognitiven Funktion (p=0,007, p=0,018) im Verlauf des 1. zum 6. Zyklus und auch des 3. zum 6. Zyklus. Weitere Verschlechterungen in den Werten konnten tendenziell bei der Rollenfunktion über den gesamten Verlauf der Therapie festgestellt werden sowie bei der sozialen und emotionalen Funktion ab dem 3. Zykluszeitpunkt. Dabei handelte es sich im Bereich der emotionalen Funktion jedoch um eine Verschlechterung der Werte nach erfolgter Verbesserung zum 3. Zyklus bei der der Ausgangswert nicht wieder erreicht wurde. Im Bereich der sozialen Funktion hatte sich der Wert zum 3. Zyklus noch nicht verändert und verschlechterte sich erst zum 6. Zyklus auf einen Wert unterhalb des Ausgangsniveaus. Innerhalb der Symptomskalen verschlechterten sich signifikant die Übelkeit (p<0,001, p=0,002), der Appetitverlust (p=0,010, p=0,004) und die Obstipation (p=0,001, p= 0,003) vom 1. zum 3. und zum 6. Zyklus. Zudem wurde die Atemnot im Verlauf des 1. und 3. Zyklus zum 6. Zyklus hin signifikant stärker (p<0,001, p=0,001). Außerdem nahm die Müdigkeit signifikant (p=0,001) vom 1. Zyklus zum 6. Zyklus zu. Des Weiteren nahmen die finanziellen Probleme über den gesamten Therapieverlauf zu. Ab dem 3. Zyklus gaben die befragten Frauen zudem vermehrt das Problem der Schlaflosigkeit an. Im Gegensatz dazu wurden die Probleme mit Diarrhoe bis zum 3. Zyklus schlimmer und verbesserten sich danach wieder ohne jedoch den Wert zu Beginn der Therapie zu erreichen. Die Angaben zur Höhe der Schmerzen blieben unverändert [vgl. Tab.7]. Auswertung bei den Ovarialkarzinompatientinnen Nun folgt die Auswertung der Gruppe der Ovarialkarzinompatientinnen (N=80). Dabei verbesserten sich signifikant innerhalb der Funktionsskala die physische Funktion (p=0,033), die Rollenfunktion (p=0,039) und die emotionale Funktion (p=0,030) im Verlauf des 1. zum 3. Zyklus. Zum 6. Zyklus hin waren die Werte in diesen Bereichen tendenziell wieder schlechter. 43 Dieselben Tendenzen zeigten sich zu den drei Zykluszeitpunkten auch im Bereich der sozialen Funktion. Die kognitive Funktion veränderte sich zum 3. Zyklus nicht und fiel zum 6. Zyklus ab. Als Ausnahme innerhalb der Funktionsskala war die emotionale Funktion auch zum Zeitpunkt des 6. Zyklus noch signifikant besser im Vergleich zum 1. Zyklus (p=0,042). Innerhalb der Symptomskala nahmen die Schmerzen (p=0,024) und der Appetitverlust signifikant (p=0,006) vom 1. zum 3. Zyklus ab. Im Verlauf des 1. Zyklus zum 6. Zyklus blieb die Verbesserung im Bereich Appetitverlust signifikant (p=0,001). Die Schmerzen fielen auf ein zum Ausgangsniveau höheren Wert ab. Tendenziell der gleiche Verlauf wie im Bereich Schmerzen zeigte sich bei der Müdigkeit. Im Bereich der Übelkeit kam es zum 3. Zyklus zu einer Verbesserung des Wertes der konstant zum 6. Zyklus erhalten blieb. Tendenziell zum 3. Zyklus besser und zum 6. Zyklus schlechter im Vergleich zum 1. Zyklus waren die Werte im Bereich Atemnot und Schlaflosigkeit. Signifikant war die Verschlechterung vom 3. zum 6. Zyklus im Bereich der Atemnot (p=0,030). Im Bereich Obstipation kam es zu keiner Veränderung des Wertes zum 3. Zyklus. Zum 6. Zyklus verschlechterte sich der Wert dann zum Ausgangswert. Im Bereich finanzielle Schwierigkeiten kam es zu einer konstanten Verschlechterung der Werte [vgl. Tab.7]. Vergleich der Mamma- und der Ovarialkarzinompatientinnen Zu Beginn der Therapie bewerteten die Frauen mit Mammakarzinom (N=100) sowohl in der Funktionsskala als auch in der Symptomskala die meisten Bereiche signifikant als besser als die Frauen mit Ovarialkarzinom (N=80). Dazu gehörten die physische Funktion (p<0,001), die Rollenfunktion (p=0,011) und die soziale Funktion (p=0,003). Tendenziell hatten die Mammakarzinompatientinnen auch die besseren Werte im Bereich der kognitiven Funktion, aber schlechtere Werte in der emotionalen Funktion [vgl. Abb.6]. Des Weiteren gaben die Mammakarzinompatientinnen signifikant weniger Einschränkungen innerhalb der Symptomskala in den Bereichen Müdigkeit, Schmerzen und Appetitlosigkeit an (p<0,001, p=0,007, p<0,001). Tendenziell waren sie auch in den restlichen Bereichen Schlaflosigkeit, Atemnot, Übelkeit, Diarrhoe und Obstipation weniger eingeschränkt. Ausnahme waren tendenziell größere finanzielle Probleme [vgl. Abb.7 / Abb.8]. 44 Abb. 6: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 1. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) 45 Abb. 7: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 1. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) 46 Abb. 8: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 1. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) Zum Zeitpunkt des 3. Zyklus war die Einschränkung der physischen Funktion bei den Ovarialkarzinompatientinnen immer noch signifikant größer (p=0,004) als bei den Patientinnen mit Mammakarzinom. Zudem waren sie tendenziell stärker in ihrer kognitiven und sozialen Funktion eingeschränkt. Gleiche Werte bestanden in den beiden Gruppen im Bereich der Rollenfunktion. Bessere Werte hatten die Ovarialkarzinompatientinnen tendenziell im Bereich der emotionalen Funktion [vgl. Abb.9]. Innerhalb der Symptomskala hatten die Ovarialkarzinompatientinnen signifikant weniger Probleme mit Übelkeit (p=0,028). Tendenziell hatten sie zudem weniger Atemnot, Diarrhoe und finanzielle Probleme. Kein Unterschied bestand zwischen den beiden Gruppen im Appetitverlust. In den restlichen Bereichen der Symptomskala wie Müdigkeit, Schmerzen, Schlaflosigkeit und Obsitpation, traten bei den Mammakarzinompatientinnen tendenziell die besseren Werte auf [vgl. Abb.10 / Abb.11]. 47 Abb. 9: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 3. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) 48 Abb. 10: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 3. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) 49 Abb. 11: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 3. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) Zum Zeitpunkt des 6. Zyklus schätzten die Mammakarzinompatientinnen erneut ihre Einschränkungen in der physischen und sozialen Funktion sowie der Rollenfunktion tendenziell als geringer ein. Im Gegensatz dazu waren die Werte der emotionalen und kognitiven Funktion bei den Ovarialkarzinompatientinnen tendenziell besser [vgl. Abb.12]. Im Bereich der Symptomskala gaben die Ovarialkarzinompatientinnen tendenziell weniger Einschränkungen in den Bereichen Müdigkeit, Übelkeit, Atemnot, Appetitverlust und finanzielle Probleme an. Tendenziell stärker hingegen waren sie durch Schmerzen, Schlaflosigkeit, Obstipation und Diarrhoe beeinträchtigt als die Patientinnen mit Mammakarzinom [vgl. Abb.13 / Abb.14]. 50 Abb. 12: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 6. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) 51 Abb. 13: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 6. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) 52 Abb. 14: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Mamma- (N=100) und der Ovarialkarzinompatientinnen (N=80) zum 6. Behandlungszyklus (Universitätsklinikum Ulm 2007-2011) 53 3.5 Auswertung der weiteren EORTC-Items im Verlauf der Therapie innerhalb der unterschiedlichen Altersklassen In diesem Abschnitt werden nun die Symptom- und Funktionsskalen des EORTC-QLQC30-Fragebogens anhand von drei unterschiedlichen Altersklassen im Verlauf der Therapie ausgewertet. Die Analyse erfolgt erst gemeinsam für alle Patientinnen mit Mamma- oder Ovarialkarzinom. Dann getrennt anhand der Diagnose in zwei Gruppen. Auswertung innerhalb der Altersklasse 1 der Patientinnen mit Mamma- oder Ovarialkarzinom Die Auswertung bei allen Frauen der Altersklasse 1 (N=14) zeigte sowohl in der Funktions- als auch in der Symptomskala signifikante Verbesserungen.Die emotionale Funktion verbesserte sich signifikant vom 1. Zyklus zum 3. Zyklus und noch einmal im Vergleich zum 6. Zyklus (p=0,017, p=0,028). Die soziale Funktion verbesserte sich signifikant von der ersten Befragung bis zum 6. Zyklus (p=0,036). Tendenziell verbesserten sich weiterhin die physische, die kognitive und die Rollenfunktion zum 3. Zyklus. Zum 6. Zykluszeitpunkt wurden alle Werte, bis auf die der sozialen und der kognitiven Funktion, wieder leicht schlechter. Die Werte der sozialen Funktion stiegen weiter an während die der kognitiven Funktion auf Werte unterhalb des Ausgangsniveaus sanken. In der Symptomskala nahmen die Beschwerden im Bereich der Müdigkeit und der Schmerzen signifikant vom 1. Zyklus im Vergleich zum 3. Zyklus ab (p=0,022, p=0,026). Danach näherten sich die Werte wieder dem Ausgangswert an. Die gleiche Tendenz zeigte sich auch bei der Schlaflosigkeit und dem Appetitverlust. Auch die Werte im Bereich der Atemnot verbesserten sich zum 3. Zyklus, fielen dann aber zum 6. Zyklus auf Werte unterhalb des Ausgangswertes. Die Werte im Bereich der Übelkeit nahmen über den gesamten Therapieverlauf ab. Zum 3. Zyklus verbesserten sich die Werte im Bereich Obstipation und blieben dann konstant besser. Die finanziellen Probleme nahmen stetig zu während die Werte im Bereich der Diarrhoe sich bis zum 3. Zyklus verschlechterten und dann wieder leicht verbesserten [vgl. Tab.8]. 54 Auswertung innerhalb der Altersklasse 2 der Patientinnen mit Mamma- oder Ovarialkarzinom Bei der Auswertung der Altersklasse 2 (N=98) zeigte sich eine signifikante Verschlechterung in der Funktionsskala im Bereich der kognitiven Funktion (p=0,017) im Vergleich von 1. und 6. Zyklus. Die physische, die emotionale, die soziale und die Rollenfunktion stiegen, genauso wie die kognitive Funktion, tendenziell zum 3. Zyklus an und fielen zum 6. Zyklus wieder ab. Die physische und die soziale Funktion fielen dabei im Gegensatz zu den anderen Werten zum 6. Zyklus auf Werte unterhalb des Ausgangswertes ab. In der Symptomskala verschlechterten sich die Werte signifikant im Bereich Übelkeit und Obstipation, zum einen im Vergleich vom 1. und 3. Zykluszeitpunk (p<0,001, p=0,001) und zum anderen im Vergleich des 1. und 6. Zykluszeitpunkt (p=0,002, p=0,010). Signifikant stiegen auch die Werte der eingeschätzten Müdigkeit (p=0,015) und Atemnot (p=0,002) von Beginn der Therapie zum 6. Zyklus hin an. Bei der Atemnot war diese Veränderung auch im Vergleich des 3. und 6. Zyklus signifikant (p=0,003). Außerdem verschlechterten sich tendenziell die Schlaflosigkeit, die Diarrhoe und die finanziellen Probleme. Im Bereich der Diarrhoe waren die Werte jedoch zum 6. Zyklus wieder gleich hoch wie zu Beginn der Therapie. Tendenziell verbesserten sich konstant die Schmerzen und ab dem 3. Zyklus der Appetitverlust [vgl. Tab.8]. Auswertung innerhalb der Altersklasse 3 der Patientinnen mit Mamma- oder Ovarialkarzinom Die Werte der Frauen der Altersklasse 3 (N=68) zeigten in der Funktionsskala eine tendenzielle Verschlechterung in den Bereichen der physischen, der kognitiven und der Rollenfunktion. Im Bereich der Rollenfunktion verschlechterten sich die Werte dabei stetig und in den Bereichen der physischen und kognitiven Funktion erst ab dem 3. Zyklus. Tendenziell nahmen die Werte nach anfänglicher Steigerung in den Bereichen der emotionalen und der sozialen Funktion nach dem 3. Zyklus wieder ab. Bei der emotionalen Funktion entsprach der Wert dann wieder dem Wert des 1. Zyklus. 55 Innerhalb der Symptomskala war zum einen eine tendenzielle Besserung in den Bereichen Übelkeit, Schmerzen, Schlaflosigkeit und finanzielle Schwierigkeiten zum 3. Zyklus feststellbar, die dann zum 6. Zyklus wieder abnahm. Im Bereich der Übelkeit war der Wert dann trotzdem noch besser als zum Beginn der Therapie während er im Bereich der Schmerzen auf das Ausgangsniveau absank und sich in den Bereichen der Schlaflosigkeit und der finanziellen Schwierigkeiten zum Ausgangswert noch verschlechterte. Zum anderen war eine konstante Zunahme der Beschwerden in den Bereichen Müdigkeit, Obstipation und Diarrhoe und ab dem 3. Zyklus in den Bereichen Atemnot und Appetitverlust sichtbar. Die Werte im Bereich Atemnot waren zum 6. Zyklus sowohl im Vergleich zum 1. als auch zum 3. Zyklus signifikant schlechter (p=0,016, p=0,021). Ebenso verschlechterten sich die Werte signifikant im Bereich Diarrhoe vom Anfang der Therapie zum 6. Zyklus (p=0,023) [vgl. Tab.8]. 56 Tab. 8: Auswertung der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) im Verlauf der Therapie innerhalb der unterschiedlichen Altersklassen bei den Mamma- und den Ovarialkarzinompatientinnen + :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus), ++ :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, - :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus), -- :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, / :Kein Unterschied zum Ausgangsmittelwert (1. Zyklus), ! :Unterschied zum Ausgangsmittelwert (1. Zyklus) signifikant Altersklasse 1 : 20-40 Jahre (N=14), Altersklasse 2 : 41–60 Jahre (N=98), Altersklasse 3 : 61–85 Jahre (N=68) PF:physical functioning (physische Funktion), RF:role functioning (Rollenfunktion), EF:emotional functioning (emotionale Funktion), CF:cognitive functioning (kognitive Funktion), SF:social functioning (soziale Funktion), FA:fatigue (Müdigkeit), NA:nausea and vomiting (Übelkeit), PA:pain (Schmerzen), DY:dyspnoea (Atemnot), IN:insomnia (Schlaflosigkeit), AP:appetite loss (Appetitverlust), CO:constipation (Obstipation), DI:diarrhoea (Diarrhoe), FI:financial difficulties (finanzielle Schwierigkeiten) Altersklasse 1 Altersklasse 2 Altersklasse 3 Zyklus 3 6 3 6 3 6 PF ++ + + - / - RF ++ + ++ + - -- EF + +! +! ++ + + / CF + - - - -! / - SF + + +! + - ++ + FA + +! + - - -! - -- NA + ++ - -! -! ++ + PA + +! + + ++ + / DY + - - - -! / - ! IN ++ + - -- + - AP ++ + / + / - CO + + --! -! -- - DI -- - - / - - -! FI - -- - -- + - 57 Auswertung innerhalb der Altersklasse 1 der Mammakarzinompatientinnen Bei alleiniger Betrachtung der Mammakarzinompatientinnen unter 40 (Altersklasse 1, N=7) zeigten sich in der Funktionsskala tendenzielle Verbesserungen in den Bereichen der emotionalen und der sozialen Funktion. Die emotionale Funktion sank dabei zum 6. Zyklus wieder leicht ab während die soziale Funktion noch weiter anstieg. Des Weiteren verbesserte sich tendenziell ab dem 3. Zyklus die Rollenfunktion während sich die kognitive Funktion verschlechterte. Konstant schlechte Werte zeigten sich im Bereich der physischen Funktion, die vor allem zum 3. Zyklus verstärkt vorhanden waren. Innerhalb der Symptomskala verbesserten sich über den gesamten Therapieverlauf die Übelkeit und zumindest bis zum 3. Zyklus die Müdigkeit, die Schmerzen und die Schlaflosigkeit. Nach dem 3. Zyklus verschlechterten sich die Werte in diesen Bereichen wieder. Die Werte der Müdigkeit waren dann schlechter als zu Beginn der Therapie, die Werte der Schmerzen immer noch besser und die der Schlaflosigkeit waren gleich hoch. Die Atemnot und die finanziellen Schwierigkeiten wurden konstant als schlimmer als zu Beginn der Therapie bewertet. Ab dem 3. Zyklus verschlimmerten sich zudem noch der Appetitverlust und die Obstipation bei den jungen Frauen mit Mammakarzinom. Keine Veränderung zeigte sich im Bereich Diarrhoe [vgl. Tab.9]. Auswertung innerhalb der Altersklasse 2 der Mammakarzinompatientinnen Die Frauen zwischen 40 und 60 (Altersklasse 2, N=64) mit Mammakarzinom gaben in ihren EORTC-Bögen signifikante Verschlechterungen in der Funktionsskala an. So verschlechterten sich signifikant die Werte der physische Funktion vom 1. und 3. Zyklus zum 6. Zyklus (p=0,001, p=0,046). Des Weiteren sanken die Werte signifikant im Bereich der kognitiven Funktion im Verlauf vom 1. Zyklus zum 6. Zyklus (p=0,036). Die Tendenz zur konstanten Verschlechterung zeigte sich auch in den Werten der Rollen- und der sozialen Funktion. Ausnahme war die emotionale Funktion, die sich zum 3. Zyklus besserte und die guten Werte beibehielt. Die Symptomskala zeigte signifikant schlechtere Werte bei der Übelkeit und der Obstipation (p<0,001, p=0,008) von Beginn der Therapie bis zum 3. Zyklus. 58 Dieser Unterschied bestand auch zum 6. Zyklus noch signifikant weiter trotz leichter Verbesserung der Werte (p=0,004, p=0,042). Der gleiche Trend zeigte sich auch in den Werten des Appetitverlusts. Im Bereich der Atemnot verschlechterten sich die Werte stetig vom 1. und 3. Zyklus zum 6. Zyklus hin (p=0,004, p=0,016). Ähnlich verschlechterte sich die Müdigkeit signifikant von Anfang der Therapie im Verlauf bis zum 6. Zyklus (p=0,011). Tendenziell nahmen die Beschwerden bei der Schlaflosigkeit und den finanziellen Schwierigkeiten konstant zu. Die Schmerzen und die Diarrhoe traten zusätzlich verstärkt ab dem 3. Zyklus auf. Beide Bereiche verbesserten sich jedoch wieder tendenziell zum 6. Zyklus [vgl. Tab.9]. Auswertung innerhalb der Altersklasse 3 der Mammakarzinompatientinnen Bei den Mammakarzinompatientinnen über 60 (Altersklasse 3, N=29) zeigte sich in der Funktionsskala zwar keine signifikante jedoch eine tendenzielle Verschlechterung in den Bereichen der physischen Funktion und der Rollenfunktion im Verlauf der Therapie. Die kognitive, die emotionale und die soziale Funktion verbesserten sich erst zum 3. Zyklus und verschlechterten sich dann wieder zum 6. Zyklus. Im Bereich der emotionalen Funktion lag der Wert dann auf Höhe des Ausgangswertes und in den anderen Bereichen darunter. In der Symptomskala verschlechterten sich signifikant sowohl der Appetitverlust (p=0,018, p<0,001) als auch die Obstipation (p=0,037, p=0,027) vom 1. Zyklus zum 3. und zum 6. Zyklus. Die Atemnot steigerte sich signifikant sowohl vom 1. zum 6. Zyklus als auch vom 3. zum 6. Zyklus (p=0,018, p=0,027). Des Weiteren nahm die Müdigkeit signifikant vom 1. zum 6. Zyklus zu (p=0,031). Tendenziell verschlechterten sich die Schmerzen, die Diarrhoe und die finanziellen Schwierigkeiten über den gesamten Therapieverlauf und ab dem 3. Zyklus zusätzlich die Übelkeit. Im Bereich der Schlaflosigkeit zeigten sich zum 3. Zyklus bessere Werte, die sich zum 6. Zyklus jedoch im Vergleich zum Ausgangswert verschlechterten [vgl. Tab.9]. 59 Tab. 9: Auswertung der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) im Verlauf der Therapie innerhalb der unterschiedlichen Altersklassen bei den Mammakarzinompatientinnen + :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus), ++ :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, - :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus), -- :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, / :Kein Unterschied zum Ausgangsmittelwert (1. Zyklus), ! :Unterschied zum Ausgangsmittelwert (1. Zyklus) signifikant Altersklasse 1 : 20-40 Jahre (N=7), Altersklasse 2 : 41–60 Jahre (N=64), Altersklasse 3 : 61–85 Jahre (N=29) PF:physical functioning (physische Funktion), RF:role functioning (Rollenfunktion), EF:emotional functioning (emotionale Funktion), CF:cognitive functioning (kognitive Funktion), SF:social functioning (soziale Funktion), FA:fatigue (Müdigkeit), NA:nausea and vomiting (Übelkeit), PA:pain (Schmerzen), DY:dyspnoea (Atemnot), IN:insomnia (Schlaflosigkeit), AP:appetite loss (Appetitverlust), CO:constipation (Obstipation), DI:diarrhoea (Diarrhoe), FI:financial difficulties (finanzielle Schwierigkeiten) Altersklasse 1 Altersklasse 2 Altersklasse 3 Zyklus 3 6 3 6 3 6 PF -- - - - -! - -- RF / + - -- - -- EF ++ + + + + / CF / - - - -! + - SF + ++ - -- + - FA + - - - -! - - -! NA + ++ - -! -! / - PA ++ + - + - -- DY - - - - -! - - -! IN + / - -- + - AP / - -- - -! - -! CO / - - -! -! -! -! DI / / - / - -- FI - -- - -- - -- 60 Auswertung innerhalb der Altersklasse 1 der Ovarialkarzinompatientinnen Bei den Frauen unter 40 mit Ovarialkarzinom (Altersklasse 1, N=7) verbesserten sich innerhalb der Funktionsskala signifikant die Werte im Bereich der physischen und der sozialen Funktion (p=0,039, p=0,047) von Beginn der Therapie bis zum 3. Zyklus. Diese Verbesserungen zeigten sich tendenziell auch in den Bereichen der Rollen-, der kognitiven und der emotionalen Funktion. Während die Werte allgemein in den genannten Bereichen nach dem 3. Zyklus wieder abfielen blieb ihr Niveau innerhalb der emotionalen und sozialen Funktion erhalten. In der Symptomskala verbesserte sich signifikant die Müdigkeit vom 1. zum 3. Zyklus (p=0,005). Die gleiche Tendenz zeigte sich in den Bereichen Schmerzen und Appetitverlust. Dabei kam es zum 6. Zyklus in diesen Bereichen wieder zu einer leichten Verschlechterung der Werte. Über den gesamten Therapieverlauf hinweg waren die Werte im Bereich der Diarrhoe und der finanziellen Schwierigkeiten schlechter als zu Beginn der Therapie. Verbesserte Werte zeigten sich ab dem 3. Zyklus in den Bereichen der Atemnot, der Obstipation und der Schlaflosigkeit. Im Bereich der Atemnot verschlechterte sich der Wert zum 6. Zyklus wieder auf das Ausgangsniveau. Im Bereich der Schlaflosigkeit blieb der Wert konstant erhalten und im Bereich des Appetitverlust kam es zu einer leichten Verschlechterung. Gleichbleibend problemlos war die Übelkeit [vgl. Tab.10]. Auswertung innerhalb der Altersklasse 2 der Ovarialkarzinompatientinnen Auch bei den Ovarialkarzinompatientinnen im Alter zwischen 40 und 60 (Altersklasse 2, N=34) kam es zu signifikant besseren Werten der physischen Funktion vom 1. Zyklus zum 3. und auch zum 6. Zyklus (p=0,047, p=0,047). Im Bereich der Rollenfunktion verbesserten sich die Werte vom 1. zum 3. Zyklus signifikant (p=0,033). Zumindest bis zum 3. Zyklus verbesserten sich auch die emotionale, die kognitive und die soziale Funktion. Nach dem 3. Zyklus fielen die Werte in diesen Bereichen jedoch wieder leicht ab. Im Bereich der kognitiven Funktion war der Werte dann schlechter als zu Beginn der Therapie. 61 Innerhalb der Symptomskala verbesserten sich signifikant die Werte im Bereich Schmerzen im Vergleich vom 1. Zyklus zum 3. Zyklus (p=0,045) wie auch die Werte im Bereich Appetitverlust vom 1. Zyklus zum 6. Zyklus (p=0,006). Die Werte in den Bereichen Müdigkeit und Atemnot verbesserten sich zum 3. Zyklus und fielen zum 6. Zyklus auf Werte unterhalb des Ausgangswertes ab. Konstant schlechte Werte bestanden in den Bereichen der Schlaflosigkeit, der Obstipation und der finanziellen Schwierigkeiten. Dabei wurden die Werte in den Bereichen der Schlaflosigkeit und der finanziellen Schwierigkeiten zum 6. Zyklus noch schlechter und im Bereich der Obstipation leicht besser. Verstärkt zum 3. Zyklus zeigten sich verbesserte Werte im Bereich der Diarrhoe. Die Übelkeit zeigte keine Veränderungen in den Werten über die Zeit [vgl. Tab.10]. Auswertung innerhalb der Altersklasse 3 der Ovarialkarzinompatientinnen Bei den Frauen über 60 mit Ovarialkarzinom (Altersklasse 3, N=39) kam es innerhalb der Funktionsskala zu tendenziellen Verbesserungen in den Bereichen der physischen, der emotionalen, der sozialen und der Rollenfunktion zum 3. Zyklus. Im Bereich der physischen Funktion fielen die Werte zum 6. Zyklus wieder auf das Ausgangsniveau ab. Die anderen Bereiche konnten ihre besseren Werte erhalten. Allein im Bereich der kognitiven Funktion verschlechterten sich die Werte konstant. Innerhalb der Symptomskala zeigten sich konstant bessere Werte in den Bereichen Müdigkeit und Übelkeit im Vergleich zum Ausgangswert. Verstärkt zum 3. Zyklus waren die Werte in den Bereichen Schmerzen und finanzielle Schwierigkeiten besser als zum 1. Zyklus. Nach einer Verbesserung zum 3. Zyklus fielen die Werte in den Bereichen Atemnot, Schlaflosigkeit und Diarrhoe auf Werte unterhalb des Ausgangswertes ab. Eine zum 3. Zyklus stärkere Verschlechterung als zum 6. Zyklus im Vergleich zu Beginn der Therapie ließ sich im Bereich der Obstipation feststellen. Im Bereich Appetitverlust verbesserten sich die Werte zum 3. Zyklus tendenziell und konnten den positiven Trend zum 6. Zyklus noch weiter steigern [vgl. Tab.10]. 62 Tab. 10: Auswertung der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) im Verlauf der Therapie innerhalb der unterschiedlichen Altersklassen bei den Ovarialkarzinompatientinnen + :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus), ++ :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, - :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus), -- :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, / :Kein Unterschied zum Ausgangsmittelwert (1. Zyklus), ! :Unterschied zum Ausgangsmittelwert (1. Zyklus) signifikant Altersklasse 1 : 20-40 Jahre (N=7), Altersklasse 2 : 41–60 Jahre (N=34), Altersklasse 3 : 61–85 Jahre (N=39) PF:physical functioning (physische Funktion), RF:role functioning (Rollenfunktion), EF:emotional functioning (emotionale Funktion), CF:cognitive functioning (kognitive Funktion), SF:social functioning (soziale Funktion), FA:fatigue (Müdigkeit), NA:nausea and vomiting (Übelkeit), PA:pain (Schmerzen), DY:dyspnoea (Atemnot), IN:insomnia (Schlaflosigkeit), AP:appetite loss (Appetitverlust), CO:constipation (Obstipation), DI:diarrhoea (Diarrhoe), FI:financial difficulties (finanzielle Schwierigkeiten) Altersklasse 1 Altersklasse 2 Altersklasse 3 Zyklus 3 6 3 6 3 6 PF + +! + +! +! + / RF + / + +! + + + EF + + ++ + + + CF + / + - - -- SF +! + ++ + ++ + FA + +! + + - + + NA / / / / + + PA ++ + + +! + ++ + DY + / + - + - IN + + - -- + - AP ++ + + + +! + ++ CO + ++ -- - -- - DI -- - ++ + + - FI - - - -- ++ + 63 3.6 Vergleich der weiteren EORTC-Items im Verlauf der Therapie zwischen den unterschiedlichen Altersklassen Nachdem die Auswertung der Funktions- und Symptomskalen des EORTC-QLQ-C30 Fragebogens im Verlauf der Therapie innerhalb der Altersklassen erfolgt war, wurde nun ein Vergleich zwischen den Altersklassen vorgenommen. Die Gruppenaufteilung und Analyse der Daten erfolgte wie gehabt. Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mammaoder Ovarialkarzinom In der Funktionsskala zeigte sich im Bereich der physischen Funktion der Trend, dass die Frauen der Altersklasse 1 zu allen drei Zykluszeitpunkten weniger eingeschränkt waren als die Frauen der Altersklasse 2 und die wiederum weniger als die Frauen der Altersklasse 3. Signifikant bestand dieser Unterschied dabei zum 1. und 3. Zyklus zwischen den Frauen der Alterslasse 2 und 3 (p=0,010, p=0,010) und ab dem 3. Zyklus zudem zwischen den Frauen der Altersklasse 1 und 3 (p=0,010). Weitere signifikante Werte ergaben sich in diesem Bereich zum 6. Zyklus zwischen den Frauen der Altersklasse 1 im Vergleich zu den Frauen der Altersklasse 2 und 3 (p=0,005, p=0,024). Im Bereich der Rollenfunktion ergab sich das gleiche Bild mit der Ausnahme, dass zum Zeitpunkt des 1. Zyklus die Frauen der Altersklasse 3 weniger eingeschränkt waren als die Frauen der Altersklasse 2 und 1 [vgl. Abb.15]. 64 Abb. 15: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mamma- (N=100) oder Ovarialkarzinom (N=80) 20-40 Jahre (N=14), 41–60 Jahre (N=98), 61–85 Jahre (N=68) Im Bereich der emotionalen Funktion waren zum 1. Zyklus die Werte der Frauen der Altersklasse 3 am besten und die Werte der Frauen der Altersklasse 1 am schlechtesten. Ab dem 3. Zyklus war es dann genau umgekehrt. Im Bereich der kognitiven Funktion waren die Frauen der Altersklasse 1 mit Ausnahme des 1. Zyklus, zu dem es genau umgekehrt war, weniger eingeschränkt als die Frauen der Altersklasse 3 und die wiederum waren zu allen drei Zeitpunkten weniger eingeschränkt als die Frauen der Altersklasse 2 [vgl. Abb.16]. 65 In der sozialen Funktion gaben die Frauen der Altersklasse 1 zunächst die stärkste Einschränkung im Vergleich zu den Frauen der höheren Altersklassen an. Zum 3. Zyklus verbesserten sich ihre Werte aber so, dass sie sich nun als am wenigsten von allen Frauen eingeschränkt wahrnahmen, gefolgt von den Frauen der Altersklasse 2, die zum 6. Zyklus jedoch die schlechtesten Werte in diesem Bereich hatten, während die Frauen der Altersklasse 1 ihre guten Werte beibehielten [vgl. Abb.16]. Abb. 16: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mamma- (N=100) oder Ovarialkarzinom (N=80) 20-40 Jahre (N=14), 41–60 Jahre (N=98), 61–85 Jahre (N=68) In der Symptomskala waren die Frauen der Altersklasse 1 tendenziell im Bereich Müdigkeit zu allen drei Zeitpunkten am wenigsten belastet, danach folgten die Frauen der Altersklasse 2 vor den Frauen der Altersklasse 3. Signifikant bestand dieser Unterschied zwischen den Frauen der Altersklasse 1 im Vergleich zu den Altersklassen 2 und 3 sowohl zum 3. Zyklus (p=0,005, p=0,001) als auch zum 6. Zyklus (p=0,018, p=0,008). 66 Zum 1. Zykluszeitpunkt waren die Frauen der Altersklasse 2 weniger durch Übelkeit belastet als die Frauen der Altersklasse 1 und die wiederum weniger als die Frauen der Altersklasse 3. Zum 3. Zykluszeitpunkt verbesserten sich die Werte der Frauen der Altersklasse 1 so, dass sie nun weniger durch die Übelkeit belastet waren als die Frauen der Altersklasse 2. Die Frauen der Altersklasse 2 waren dann zudem stärker eingeschränkt als die Frauen der Altersklasse 3. Dieser Trend blieb auch zum 6. Zyklus bestehen. Was den Bereich Schmerzen anbelangte, so hatten die Frauen der Altersklasse 2 und 3 zum 1. Zyklus niedrigere Werte als die Frauen der Altersklasse 1. Ab dem 3. Zyklus hatten dann die Frauen der Altersklasse 1 die niedrigsten Werte, also auch die wenigsten Schmerzen, gefolgt von den Frauen der Altersklasse 2 und 3 [vgl. Abb.17]. Abb. 17: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mamma- (N=100) oder Ovarialkarzinom (N=80) 20-40 Jahre (N=14), 41–60 Jahre (N=98), 61–85 Jahre (N=68) 67 Von Atemnot waren die Frauen der Altersklasse 1 zu allen drei Zeitpunkten am geringsten betroffen, gefolgt von den Frauen der Altersklasse 3. Die Frauen der Altersklasse 2 waren somit zu allen drei Zykluszeitpunkten am stärksten von Atemnot betroffen. Signifikant weniger Einschränkungen hatten die Frauen der Altersklasse 1 in diesem Bereich zum 3. und 6. Zyklus im Vergleich zu den Frauen der Altersklasse 2 (p=0,032, p=0,007) und nur zum 6. Zyklus im Vergleich zu den Frauen der Altersklasse 3 (p=0,019). Die Schlaflosigkeit betraf zum 1. Zyklus am stärksten die Frauen der Altersklasse 1, gefolgt von den Frauen der Altersklasse 2. Zum 3. Zyklus gaben die Frauen der Altersklasse 1 dann jedoch die geringsten Probleme an, gefolgt von den Frauen der Altersklasse 3. Zum 6. Zyklus hatten die Frauen der Altersklasse 1 immer noch die geringsten Werte, gefolgt von den Frauen der Altersklasse 2. Die meisten Probleme mit Schlaflosigkeit hatten also zum 6. Zyklus die Frauen der Altersklasse 3. Die wenigsten Probleme mit Appetitverlust zum 1. und zum 3. Zyklus hatten die Frauen der Altersklasse 1 gefolgt von den Frauen der Altersklasse 2, die wiederum weniger Probleme hatten als die Frauen der Altersklasse 3 (p=0,001). Zum 6. Zyklus gaben dann die Frauen der Altersklasse 2 tendenziell weniger Probleme als die Frauen der Altersklasse 1 und signifikant weniger Probleme als die Frauen der Altersklasse 3 an (p=0,001) [vgl. Abb.18]. 68 Abb. 18: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mamma- (N=100) oder Ovarialkarzinom (N=80) 20-40 Jahre (N=14), 41–60 Jahre (N=98), 61–85 Jahre (N=68) 69 Über den gesamten Therapieverlauf die geringsten Probleme mit Diarrhoe gaben die Frauen der Altersklasse 1 an, gefolgt von den Frauen der Altersklasse 2, die wiederum weniger Probleme hatten als die Frauen der Altersklasse 3. Zum 6. Zyklus bestand dieser Unterschied signifikant zwischen den Frauen der Altersklasse 2 und 3 (p=0,005). Im Gegensatz dazu waren die Frauen der Altersklasse 3 zu allen drei Zykluszeitpunkten am geringsten durch finanzielle Probleme eingeschränkt und die Frauen der Altersklasse 1 am meisten. Nur zum 1. Zyklus am stärksten von Obstipation betroffen waren die Frauen der Altersklasse 1. Die geringsten Probleme zu diesem Zeitpunkt gaben die Frauen der Altersklasse 2 an. Ab dem 3. Zyklus verhielt es sich genau umgekehrt in diesem Bereich [vgl. Abb.19]. Abb. 19: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mamma- (N=100) oder Ovarialkarzinom (N=80) 20-40 Jahre (N=14), 41–60 Jahre (N=98), 61–85 Jahre (N=68) 70 Vergleich der unterschiedlichen Altersklassen der Mammakarzinompatientinnen Tendenziell zeigte sich zwischen den unterschiedlichen Altersklassen der Mammakarzinompatientinnen eine geringere Belastung vor allem bei den Frauen der Altersklasse 1. Innerhalb der Funktionsskala hatten sie zu allen drei Zykluszeitpunkten die besten Werte in den Bereichen der physischen-, der Rollen- und der kognitiven Funktion. Signifikant bestand der Unterschied in dem Bereich der physischen Funktion zum 1. und zum 6. Zyklus zwischen den Frauen der Altersklasse 1 und 3 (p=0,050, p=0,003). Zum 6. Zyklus waren die Frauen der Altersklasse 1 in diesem Bereich dann zudem noch signifikant besser als die Frauen der Altersklasse 2 (p=0,033). Danach folgten die Frauen der Altersklasse 2, die wiederum bessere Werte hatten als die Frauen der Altersklasse 3, außer zum 3. Zykluszeitpunkt in der kognitiven Funktion. Im Bereich der emotionalen Funktion zeigte sich ab dem 3. Zyklus das gleiche Bild [vgl. Abb.20 / Abb.21]. Abb. 20: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mammakarzinom (N=100) 20-40 Jahre (N=7), 41–60 Jahre (N=64), 61–85 Jahre (N=29) 71 Zum 1. Zyklus waren die Frauen der Altersklasse 1 jedoch am stärksten und die Frauen der Altersklasse 2 am geringsten emotional eingeschränkt. Im Bereich der sozialen Funktion waren die Frauen der Altersklasse 1 zum 1. und zum 3. Zykluszeitpunkt am stärksten eingeschränkt, im Gegensatz zu den Frauen der Altersklasse 2, die am wenigsten eingeschränkt waren. Zum 6. Zyklus hatten dann die Frauen der Altersklasse 1 die besten Werte gefolgt von den Frauen der Altersklasse 2, die dann wiederum die besseren Werte hatten als die Frauen der Altersklasse 3 [vgl. Abb.21]. Abb. 21: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mammakarzinom (N=100) 20-40 Jahre (N=7), 41–60 Jahre (N=64), 61–85 Jahre (N=29) Innerhalb der Symptomskala ergaben sich tendenziell bei den Frauen der Altersklasse 1 die kleinsten Werte und damit die geringste Einschränkung zu allen drei Zeitpunkten in den Bereichen Müdigkeit, Atemnot, Appetitverlust, Obstipation und Diarrhoe. 72 Die Frauen der Altersklasse 3 waren in diesen Bereichen mit einer Ausnahme zum 1. Zykluszeitpunkt im Bereich Appetitverlust, zu dem sie bessere Werte erzielten als die Frauen der Altersklasse 2, immer am meisten eingeschränkt. Signifikant bestand dieser Unterschied zwischen den Frauen der Altersklasse 1 und 3 zum 3. und 6. Zyklus im Bereich der Müdigkeit (p=0,021, p=0,021) und zum 6. Zyklus zudem im Bereich der Atemnot (p=0,013). Auch die Frauen der Altersklasse 2 waren zum 6. Zyklus signifikant mehr von Atemnot betroffen als die Frauen der Altersklasse 1 (p=0,043). In den Bereichen Appetitverlust und Diarrhoe hatten die Frauen der Altersklasse 2 zum 6. Zyklus wiederum die besseren Werte als die Frauen der Altersklasse 3 (p<0,001, p=0,007). Im Bereich Übelkeit hatten die Frauen der Altersklasse 3 zum 1. Zyklus noch die meisten Beschwerden während die Frauen der Altersklasse 2 die geringsten Einschränkungen angaben. Ab dem 3. Zyklus kehrte sich diese Bild dann so um, dass die Frauen der Altersklasse 2 stärker eingeschränkt waren als die Frauen der Altersklasse 3 und die wiederum stärker als die Frauen der Altersklasse 1 [vgl. Abb.22/ Abb.23]. Abb. 22: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mammakarzinom (N=100) 20-40 Jahre (N=7), 41–60 Jahre (N=64), 61–85 Jahre (N=29) 73 Im Bereich Schmerzen hatten die Frauen der Altersklasse 1 mit Ausnahme des 1. Zyklus über den gesamten Therapieverlauf hinweg die geringsten Beschwerden. Die Frauen der Altersklasse 3 hatten hingegen in diesem Bereich immer die meisten Probleme. Auch im Bereich Schlaflosigkeit gaben die Frauen der Altersklasse 3 zu allen drei Zeitpunkten die stärksten Einschränkungen an, gefolgt von den Frauen der Altersklasse 1, die außer zum 3. Zyklus die zweit stärksten Beschwerden angaben. Die wahrgenommenen finanziellen Schwierigkeiten der Patientinnen variierten über die Zeit. So gaben die Frauen der Altersklasse 3 zum 1. Zyklus noch die kleinsten Werte an während sie ab dem 3. Zyklus dann die größten Werte und damit die meisten Probleme aufwiesen. Die Frauen der Altersklasse 2 hingegen waren über den gesamten Therapieverlauf am geringsten von den finanziellen Schwierigkeiten belastet. Die Frauen der Altersklasse 1 lagen nach dem 1. Zyklus zu dem sie am stärksten finanzielle Probleme angaben mit ihrem Werten zwischen den zwei anderen Altersklassen [vgl.Abb.23 / Abb.24]. Abb. 23: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mammakarzinom (N=100) 20-40 Jahre (N=7), 41–60 Jahre (N=64), 61–85 Jahre (N=29) 74 Abb. 24: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Mammakarzinom (N=100) 20-40 Jahre (N=7), 41–60 Jahre (N=64), 61–85 Jahre (N=29) Vergleich der unterschiedlichen Altersklassen der Ovarialkarzinompatientinnen Die Tendenzen der Werte im Vergleich der unterschiedlichen Altersklassen der Ovarialkarzinompatientinnen zeigten vor allem ab dem 3. Zyklus eine geringere Einschränkung der Frauen der Altersklasse 1. Innerhalb der Funktionsskala hatten sie ab dem 3. Zyklus in allen Bereichen die höchsten Werte und damit die geringste Einschränkung. Ansonsten hatten sie zum 1. Zyklus außer in der sozialen Funktion im Vergleich zu den anderen Altersklassen die zweit höchsten Werte. Im Bereich der sozialen Funktion hatten sie also zum 1. Zyklus die schlechtesten Werte während die Frauen der Altersklasse 3 die besten Werte hatten. 75 Ab dem 3. Zyklus verhielt es dich dann so, dass die Frauen der Altersklasse 1 die besten Werte hatten gefolgt von den Frauen der Altersklasse 3, die wiederum besser waren als die Frauen der Altersklasse 2. Im Bereich der physischen Funktion hatten die Frauen der Altersklasse 2 verglichen mit der Altersklasse 1 zum 1. Zyklus die besseren Werte und ab dem 3. Zyklus die schlechteren Werte. Die Altersklasse 3 hatte in diesem Bereich durchgehend die schlechtesten Werte. Signifikant schlechtere Werte hatten sie zum 3. Zyklus verglichen mit den Frauen der Altersklasse 1 (p=0,022). In den Bereichen der emotionalen, der kognitiven und der sozialen Funktion hatten die Frauen der Altersklasse 2 verglichen mit der Altersklasse 3 immer die schlechteren Werte. Signifikant höhere Werte hatten die Frauen der Altersklasse 3 dabei zum 1. und 3. Zyklus in der kognitiven Funktion (p=0,010, p=0,027). Zum 1. Zyklus hatten die Frauen der Altersklasse 3 zudem in diesen Bereichen höhere Werte als die Altersklasse 1. Eine Ausnahme zu oben beschriebener Verteilung, dass die Frauen der Altersklasse 1 ab dem 3. Zyklus die besten Werte hatten, bestand zum 6. Zyklus im Bereich der Rollenfunktion. Zu diesem Zeitpunkt waren sie in diesem Bereich am stärksten eingeschränkt. Ansonsten hatten die Frauen der Altersklasse 2 außer zum 1. Zyklus die zweit höchsten Werte in diesem Bereich [vgl. Abb.25 / Abb.26]. 76 Abb. 25: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Ovarialkarzinom (N=80) 20-40 Jahre (N=7), 41–60 Jahre (N=34), 61–85 Jahre (N=39) 77 Abb. 26: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Ovarialkarzinom (N=80) 20-40 Jahre (N=7), 41–60 Jahre (N=34), 61–85 Jahre (N=39) Innerhalb der Symptomskala hatten die Frauen der Altersklasse 1 zu allen drei Zykluszeitpunkten die geringste Einschränkung in den Bereichen Übelkeit und Atemnot. Im Bereich Übelkeit waren am stärksten die Frauen der Altersklasse 3 und im Bereich Atemnot die Frauen der Altersklasse 2 über den Therapieverlauf hinweg eingeschränkt [vgl. Abb.27]. 78 Abb. 27: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Ovarialkarzinom (N=80) 20-40 Jahre (N=7), 41–60 Jahre (N=34), 61–85 Jahre (N=39) Ansonsten waren die Frauen der Altersklasse 1 ab dem 3. Zyklus am wenigsten in den Bereichen Müdigkeit, Schlaflosigkeit und Obstipation eingeschränkt. Im Bereich Müdigkeit waren nach den Frauen der Altersklasse 1 zum 3. Zyklus und vor ihnen zum 1. Zyklus am wenigsten die Frauen der Altersklasse 2 belastet. Zum 6. Zyklus waren die Frauen der Altersklasse 2 dann aber in diesem Bereich sogar stärker eingeschränkt als die Frauen der Altersklasse 3, die sonst immer die meisten Belastungen angaben. Zum 3. Zyklus waren sie signifikant müder als die Frauen der Altersklassen 1 und 2 (p=0,008, p=0,010). Die Schlaflosigkeit beeinträchtigte nach den Frauen der Altersklasse 1 ab dem 3. Zyklus die Frauen der Altersklasse 3 am geringsten. Zum 1. Zykluszeitpunkt gaben sie sogar noch weniger Probleme mit der Schlaflosigkeit an als die Frauen der Altersklasse 1. Im Gegensatz zu den anderen Altersklassen hatten die Frauen der Altersklasse 2 mit Obstipation zum 1. Zyklus das geringste Problem. 79 Ab dem 3. Zyklus hatten sie jedoch im Vergleich mit den anderen das größte Problem. In den Bereichen Schmerzen, Appetitverlust, Diarrhoe und finanzielle Schwierigkeiten variierten die Werte zwischen den unterschiedlichen Altersklassen der Ovarialkarzinompatientinnen stark über die Zeit [vgl. Abb.28]. Abb. 28: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Ovarialkarzinom (N=80) 20-40 Jahre (N=7), 41–60 Jahre (N=34), 61–85 Jahre (N=39) Bei den Schmerzen gaben die Frauen der Altersklasse 3 zum 1. Zyklus noch die niedrigsten Werte im Gegensatz zu den Frauen der Altersklasse 1 an während ab dem 3. Zyklus das Gegenteil der Fall war. Zum 6. Zyklus hatten dann die Frauen der Altersklasse 2 die niedrigsten Werte gefolgt von den Frauen der Altersklasse 1. Im Bereich Appetitverlust waren zum 1. und 3. Zyklus die Frauen der Altersklasse 1 am wenigsten im Gegensatz zu den Frauen der Altersklasse 3 eingeschränkt. Zum 6. Zyklus waren es dann die Frauen der Altersklasse 2, die die niedrigsten Werte hatten, gefolgt von den Frauen der Altersklasse 1. 80 Die Diarrhoe war zum 1. und 6. Zyklus für die Frauen der Altersklasse 1 im Gegensatz zu den Frauen der Altersklasse 2 zum 1. Zyklus und der Altersklasse 3 zum 6. Zyklus am wenigsten einschränkend. Zum 3. Zyklus waren es die Frauen der Altersklasse 3, die die niedrigsten Werte in diesem Bereich angaben während die Frauen der Altersklasse 1 zu diesem Zeitpunkt dann am meisten davon belastet waren. Finanzielle Schwierigkeiten waren zu allen drei Zykluszeitpunkten vor allem bei den Frauen der Altersklasse 1 ein Problem. Weniger davon beeinträchtigt waren zum 1. Zykluszeitpunkt vor allem die Frauen der Altersklasse 2 und ab dem 3. Zyklus die Frauen der Altersklasse 3 [vgl. Abb.29]. Abb. 29: Vergleich der unterschiedlichen Altersklassen der Patientinnen mit Ovarialkarzinom (N=80) 20-40 Jahre (N=7), 41–60 Jahre (N=34), 61–85 Jahre (N=39) 81 3.7 Auswertung der weiteren EORTC-Items im Verlauf der Therapie unter Berücksichtigung der subjektiven Einschätzung der Lebensqualität zu Beginn der Therapie Zum Abschluss wurden die Frauen nicht anhand von Einflussfaktoren, sondern anhand ihrer Lebensqualität zu Beginn der Therapie in Gruppen eingeteilt. Die erste Gruppe bestand aus den Frauen, die zu Beginn der Therapie ihre Lebensqualität als sehr gut oder gut bewertet hatten (LQ>4, LQ=Mittelwert aus den EORTC-Fragen 29 und 30). Die zweite Gruppe aus jenen Frauen, die ihre Lebensqualität als schlecht erachtet hatten (LQ<4). Anhand dieser Gruppeneinteilung wurden die Werte der Frauen wie gehabt zusammen innerhalb des gemischten Patientenkollektivs und dann getrennt anhand ihrer Diagnosen analysiert. Zusätzlich wurden dabei jedes Mal die Frauen mit guter Lebensqualität den Frauen mit schlechter Lebensqualität vergleichend gegenübergestellt. Auswertung bei den Patientinnen mit Mamma- oder Ovarialkarzinom mit guter Lebensqualität zu Beginn der Therapie Tendenziell gab es innerhalb der Funktionsskala bei den Frauen, die ihre Lebensqualität als gut eingeschätzt hatten, in den Bereichen der physischen, der Rollen-, der emotionalen, und der sozialen Funktion eine Steigerung innerhalb der Werte und damit also eine Verbesserung der Funktionen zum 3. Zyklus hin, die jedoch zum 6. Zyklus wieder abnahm. Im Bereich der emotionalen Funktion war die Verbesserung signifikant (p=0,028). Außer bei der emotionalen Funktion waren die Werte zum 6. Zyklus in den genannten Bereichen dann schlechter als zu Beginn der Therapie. Signifikant waren die Verschlechterungen in der Funktionsskala im Bereich der physischen Funktion vom 3. Zyklus zum 6. Zyklus (p=0,023) genauso wie in der kognitiven Funktion, die sich vom 1. und vom 3. Zyklus im Vergleich zum 6. Zyklus signifikant verschlechterte (p=0,016, p=0,013). Bis zum 3. Zyklus waren die Werte im kognitiven Bereich unverändert geblieben. Innerhalb der Symptomskala ließ sich im Bereich Schmerzen ebenfalls eine Verbesserung zum 3. Zyklus erkennen, die zum 6. Zyklus hin wieder abnahm. Mit Ausnahme des Bereichs Appetitverlust, in dem sich gleichbleibende Werte zeigten, verschlechterten sich über den Therapieverlauf alle restlichen Bereiche. 82 Signifikant waren die Verschlechterungen in den Werten der Übelkeit (p=0,007, p=0,020) und der Obstipation (p<0,001, p<0,001) vom 1. Zyklus im Verlauf zum 3. und 6. Zyklus. Zudem nahmen Atemnot (p<0,001) und finanzielle Sorgen (p=0,030) im Vergleich des 1. Zyklus mit dem 6. Zyklus signifikant zu. Die Atemnot erhöhte sich außerdem signifikant vom 3. Zyklus zum 6. Zyklus (p<0,001) [vgl. Tab.11]. Auswertung bei den Patientinnen mit Mamma- oder Ovarialkarzinom mit schlechter Lebensqualität zu Beginn der Therapie Tendenziell zeigten die Werte innerhalb der Funktionsskala bei den Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, sowohl Verbesserungen als auch Verschlechterungen über die Zeit. Verschlechtert hatten sich die Werte in der physischen und der kognitiven Funktion über die Zeit wobei sich die physische Funktion erst zum 3. Zyklus verschlechterte. Stetig verbessert hatten sich dagegen die emotionale und die soziale Funktion. Zum 3. Zyklus schlechter waren die Werte in der Rollenfunktion, die dann aber zum 6. Zyklus wieder besser wurden. Innerhalb der Symptomskala verschlechterten sich die Werte in den Bereichen Müdigkeit und Übelkeit verstärkt zum 3. Zyklus und nahmen dann leicht zum 6. Zyklus wieder ab wobei sie den Ausgangswert nicht wieder erreichten. Signifikant war dabei die Verschlechterung der Übelkeit zum 3. Zyklus (p=0,034). Unveränderte Werte zeigten sich zum 3. Zyklus in den Bereichen Atemnot, Appetitverlust und Diarrhoe. Danach verschlechterten sich die Werte in den Bereichen Atemnot und Diarrhoe im Vergleich zum Ausgangswert und die Werte im Bereich Appetitverlust verbesserten sich. Zum 3. Zyklus schlechtere Werte und zum 6. Zyklus bessere Werte als zu Beginn der Therapie zeigten sich in den Bereichen Obstipation und finanzielle Schwierigkeiten. Stetig sich verbessernde Werte kamen in den Bereichen Schmerzen und Schlaflosigkeit vor. Zum 6. Zyklus war die Verbesserung in beiden Bereichen signifikant (p=0,019, p=0,036) [vgl. Tab.11]. 83 Tab. 11: Auswertung der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) im Verlauf der Therapie bei den Patientinnen mit Mamma- oder Ovarialkarzinom mit guter (N=144) und schlechter (N=33) Lebensqualität zu Beginn der Therapie + :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus), ++ :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, - :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus), -- :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, / :Kein Unterschied zum Ausgangsmittelwert (1. Zyklus), ! :Unterschied zum Ausgangsmittelwert (1. Zyklus) signifikant LQ: Lebensqualität, PF:physical functioning (physische Funktion), RF:role functioning (Rollenfunktion), EF:emotional functioning (emotionale Funktion), CF:cognitive functioning (kognitive Funktion), SF:social functioning (soziale Funktion), FA:fatigue (Müdigkeit), NA:nausea and vomiting (Übelkeit), PA:pain (Schmerzen), DY:dyspnoea (Atemnot), IN:insomnia (Schlaflosigkeit), AP:appetite loss (Appetitverlust), CO:constipation (Obstipation), DI:diarrhoea (Diarrhoe), FI:financial difficulties (finanzielle Schwierigkeiten) gute LQ Schlechte LQ Zyklus 3 6 3 6 PF + - / - RF + - - + EF + +! + + ++ CF / -! - -- SF + - + ++ FA / - -- - NA -! -! - -! - PA ++ + + + +! DY - - -! / - IN - -- + + +! AP / / / + CO - -! -! - + DI -- - / - FI - - -! - + 84 Vergleich der Patientinnen mit Mamma- oder Ovarialkarzinom mit guter und schlechter Lebensqualität Im Vergleich der beiden Gruppen ging es den Frauen, die ihre Lebensqualität als schlechter eingeschätzt hatten, auch tendenziell in allen Bereichen schlechter als den Frauen, die ihre Lebensqualität als gut eingeschätzt hatten.. In den unterschiedlichen Bereichen der Funktionsskala sind die Werte dazu in allen drei Zykluszeitpunkten signifikant (p<0,001 bis p=0,022) [vgl. Abb.30]. Abb. 30: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Mamma- oder Ovarialkarzinom (N=80) mit guter (N=144) und schlechter (N=33) Lebensqualität zu Beginn der Therapie 85 In der Symptomskala waren die Werte in den Bereichen Schmerz, Müdigkeit und Atemnot zu allen Zeitpunkten signifikant unterschiedlich (p<0,001 bis p=0,023). Nur zu Beginn der Therapie signifikant war der Unterschied in den Bereichen Schlaflosigkeit, Appetitverlust und Obstipation (p<0,001 bis p=0,035). Unterschiede im Bereich finanzielle Probleme waren sowohl zu Beginn als auch zum 3. Zyklus signifikant (p=0,015, p=0,003). Außerdem war zwischen den Frauen ein weiterer signifikanter Unterschied im Bereich Übelkeit zum 3. Zyklus erkennbar (p=0,008) [vgl. Abb.31 / Abb.32]. Abb. 31: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Mamma- oder Ovarialkarzinom mit guter (N=144) und schlechter (N=33) Lebensqualität zu Beginn der Therapie 86 Abb. 32: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Mamma- oder Ovarialkarzinom mit guter (N=144) und schlechter (N=33) Lebensqualität zu Beginn der Therapie Auswertung bei den Patientinnen mit Mammakarzinom mit guter Lebensqualität zu Beginn der Therapie Tendenziell zeigten die Werte innerhalb der Funktionsskala bei den Mammakarzinompatientinnen, die ihre Lebensqualität als gut eingeschätzt hatten, eine stetige Verschlechterung über die Zeit. Ausnahme waren die emotionale Funktion, die sich zum 3. Zyklus hin steigerte dann aber wieder abfiel und die kognitive Funktion, die zum 3. Zyklus noch unveränderte Werte zeigte bevor sich diese zum 6. Zyklus verschlechterten. Die physische Funktion verschlechterte sich signifikant vom 3. zum 6. Zyklus (p=0,019). Innerhalb der Symptomskala kam es auch in allen Bereichen tendenziell zu einer meist konstanten Verschlechterung. Ausnahme bildete hier der Bereich Schmerzen, in dem eine Verbesserung zum 3. Zyklus erkennbar war, die zum 6. Zyklus wieder abnahm. 87 Signifikant waren die Verschlechterungen vom 1. zum 3. Zyklus im Bereich der Übelkeit (p=0,003) und der Obstipation (p=0,015).Vom 1. und vom 3. Zyklus im Verlauf zum 6. Zyklus nahmen zudem signifikant die Atemnot (p=0,003, p=0,010) und der Appetitverlust (p=0,042) zu [vgl. Tab.12]. Auswertung bei den Patientinnen mit Mammakarzinom mit schlechter Lebensqualität zu Beginn der Therapie Tendenziell zeigten die Werte innerhalb der Funktionsskala bei den Mammakarzinompatientinnen, die ihre Lebensqualität als schlecht eingeschätzt hatten, über den gesamten Therapieverlauf Verschlechterungen in den Bereichen der kognitiven Funktion und Verbesserungen in den Bereichen der emotionalen und der sozialen Funktion. Die physische Funktion zeigte zum 3. Zyklus unveränderte Werte und zum 6. Zyklus schlechtere Werte als zu Beginn der Therapie. Signifikant war die Verschlechterung zum 6. Zyklus sowohl in der physischen (p=0,019) als auch in der kognititven Funktion (p=0,037). Nach anfänglicher Verschlechterung zum 3. Zyklus verbesserten sich die Werte im Bereich der Rollenfunktion tendenziell zum 6. Zyklus. Innerhalb der Symptomskala waren in den Bereichen Müdigkeit, Übelkeit, Atemnot und Appetitverlust im Vergleich zu Therapiebeginn nur schlechtere Werte vorhanden. Signifikant war der Anstieg der Werte in den Bereichen Übelkeit (p=0,004, p=0,004) und Appetitverlust (p=0,015, p=0,031) vom 1. zum 3. Zyklus und zum 6. Zyklus. Es zeigte sich jedoch eine leichte Abnahme der Beschwerden zum 6. Zyklus in allen Bereichen außer der Atemnot, die zum 6. Zyklus noch signifikant weiter anstieg (p=0,005). Trotz der Besserung in den Werten waren die genannten Bereiche aber immer noch schlechter als zu Beginn der Therapie. Signifikant war der Unterschied vom 1. zum 6. Zyklus bei der Müdigkeit (p=0,002). Immer weiter ab nahmen die Beschwerden im Bereich Schlaflosigkeit. Zum 3. Zyklus hin verstärkten sich die Probleme in den Bereichen Schmerzen, Obstipation und finanzielle Schwierigkeiten. Danach nahmen die Beschwerden zum 6. Zyklus hin in diesen Bereichen wieder ab. Im Bereich der Obstipation war sowohl der Anstieg in den Werten zum 3. Zyklus signifikant (p=0,023) als auch die Abnahme zum 6. Zyklus (p=0,015). Genau umgekehrt verhielt es sich im Bereich Diarrhoe [vgl. Tab.12]. 88 Tab. 12: Auswertung der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) im Verlauf der Therapie bei den Patientinnen mit Mammakarzinom mit guter (N=82) und schlechter (N=17) Lebensqualität zu Beginn der Therapie + :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus), ++ :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, - :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus), -- :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, / :Kein Unterschied zum Ausgangsmittelwert (1. Zyklus), ! :Unterschied zum Ausgangsmittelwert (1. Zyklus) signifikant PF:physical functioning (physische Funktion), RF:role functioning (Rollenfunktion), EF:emotional functioning (emotionale Funktion), CF:cognitive functioning (kognitive Funktion), SF:social functioning (soziale Funktion), FA:fatigue (Müdigkeit), NA:nausea and vomiting (Übelkeit), PA:pain (Schmerzen), DY:dyspnoea (Atemnot), IN:insomnia (Schlaflosigkeit), AP:appetite loss (Appetitverlust), CO:constipation (Obstipation), DI:diarrhoea (Diarrhoe), FI:financial difficulties (finanzielle Schwierigkeiten) gute LQ schlechte LQ Zyklus 3 6 3 6 PF - -- / -! RF - -- - + EF ++ + + ++ CF / - - - -! SF - -- + + FA - -- -- -! NA -! - - -! -! PA + - - + DY - - -! - - -! IN - -- + ++ AP - - -! - -! -! CO -! -- -! +! DI -- - + - FI - -- - + 89 Vergleich der Patientinnen mit Mammakarzinom mit guter und schlechter Lebensqualität zu Beginn der Therapie Tendenziell gaben die Patientinnen mit Mammakarzinom, die ihre Lebensqualität als gut eingeschätzt hatten, in allen funktionellen Bereichen weniger Beschwerden an als die Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten [vgl. Abb.33]. Abb. 33: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Mammakarzinom mit guter (N=82) und schlechter (N=17) Lebensqualität zu Beginn der Therapie 90 Auch innerhalb der Symptomskala hatten sie tendenziell immer die besseren Werte außer zum 3. Zyklus im Bereich Diarrhoe und zum 6. Zyklus im Bereich finanzielle Schwierigkeiten [Abb.34 / Abb.35]. Abb. 34: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Mammakarzinom mit guter (N=82) und schlechter (N=17) Lebensqualität zu Beginn der Therapie 91 Abb. 35: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Mammakarzinom mit guter (N=82) und schlechter (N=17) Lebensqualität zu Beginn der Therapie Auswertung der Patientinnen mit Ovarialkarzinom mit guter Lebensqualität zu Beginn der Therapie Tendenziell zeigten die Werte innerhalb der Funktionsskala bei den Ovarialkarzinompatientinnen, die ihre Lebensqualität als gut eingeschätzt hatten, in den Bereichen der physischen und sozialen Funktion eine generelle Verbesserung über die Zeit. Die Verbesserung zum 3. Zyklus war im Bereich der sozialen Funktion signifikant (p=0,041). Zum 6. Zyklus nahmen die Einschränkungen in diesen Bereichen wieder leicht zu. Emotional verbesserten sich die Werte zum 3. Zyklus und blieben dann stabil erhalten. In den Bereichen der Rollenfunktion und der kognitiven Funktion verbesserten sich zunächst die Werte zum 3. Zyklus und verschlechterten sich dann zum 6. Zyklus auf Werte unterhalb des Ausgangsniveaus. Im Bereich der Rollenfunktion war die Besserung zum 3. Zyklus signifikant (p=0,033). 92 Innerhalb der Symptomskala nahmen die Werte und damit die Beschwerden in den Bereichen Müdigkeit, Übelkeit und Schmerzen zunächst verstärkt ab und dann wieder leicht zu ohne auf den Wert des 1. Zyklus anzusteigen. Im Bereich Appetitverlust verbesserten sich die Werte signifikant über den Therapieverlauf (p=0,025, p=0,004). Im Gegensatz dazu nahmen die Beschwerden im Bereich Schlaflosigkeit zu. Zum 3. Zyklus waren die Einschränkungen in den Bereichen Atemnot, Diarrhoe und finanzielle Schwierigkeiten geringer als zum 1. Zyklus. Nach dem 3. Zyklus stiegen die Werte in diesen Bereichen jedoch wieder an und waren schlechter als zu Beginn der Therapie. Umgekehrt verhielt es sich im Bereich Obstipation. Hier waren die Beschwerden zum 3. Zyklus erhöht und zum 6. Zyklus hin wieder geringer. Dennoch war auch in diesem Bereich der Wert zum 6. Zyklus schlechter als zum 1. Zyklus [vgl. Tab.13]. Auswertung der Patientinnen mit Ovarialkarzinom mit schlechter Lebensqualität zu Beginn der Therapie Es kam zu keinen signifikanten Veränderungen bei den Frauen mit Ovarialkarzinom, die ihre Lebensqualität als schlecht eingeschätzt hatten. Tendenziell zeigten die Werte innerhalb der Funktionsskala konstante Verbesserungen in den Bereichen der physischen, der emotionalen und der sozialen Funktion und eine konstante Verschlechterung der Werte der kognitiven Funktion. Zum 3. Zyklus hin einen verbesserten Wert, der zum 6. Zyklus hin wieder abfiel, zeigte sich im Bereich der Rollenfunktion. Innerhalb der Symptomskala zeigte sich eine konstante Abnahme der Beschwerden in den Bereichen Schmerzen, Schlaflosigkeit und Appetitverlust, sowie eine punktuelle Verbesserung zum 3. Zyklus in den Bereichen Müdigkeit und Atemnot, die sich bis zum 6. Zyklus im Bereich Müdigkeit wieder auf das Ausgangsniveau hin verschlechterte und im Bereich der Atemnot dann noch schlechter war als zum 1. Zyklus. Eine konstante Zunahme der Beschwerden zeigte sich im Bereich Diarrhoe ebenso wie eine punktuelle Zunahme der Beschwerden in den Bereichen Übelkeit und finanzielle Schwierigkeiten zum 3. Zyklus, die zum 6. Zyklus wieder abnahm. Die Werte im Bereich Übelkeit erreichten dann wieder das Ausgangsniveau während die Werte im Bereich finanzielle Schwierigkeiten immer noch schlechter waren als zu Beginn der Therapie. Im Bereich der Obstipation zeigten sich verstärkt zum 3. Zyklus und leicht abgeschwächt auch noch zum 6. Zyklus Verbesserungen im Vergleich zum 1. Zyklus [vgl. Tab.13]. 93 Tab. 13: Auswertung der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) im Verlauf der Therapie bei den Patientinnen mit Ovarialkarzinom mit guter (N=62) und schlechter (N=16) Lebensqualität zu Beginn der Therapie + :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus), ++ :Mittelwert besser im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, - :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus), -- :Mittelwert schlechter im Vergleich zum Ausgangsmittelwert (1. Zyklus) und zum verbleibenden Zykluszeitpunkt, / :Kein Unterschied zum Ausgangsmittelwert (1. Zyklus), ! :Unterschied zum Ausgangsmittelwert (1. Zyklus) signifikant PF:physical functioning (physische Funktion), RF:role functioning (Rollenfunktion), EF:emotional functioning (emotionale Funktion), CF:cognitive functioning (kognitive Funktion), SF:social functioning (soziale Funktion), FA:fatigue (Müdigkeit), NA:nausea and vomiting (Übelkeit), PA:pain (Schmerzen), DY:dyspnoea (Atemnot), IN:insomnia (Schlaflosigkeit), AP:appetite loss (Appetitverlust), CO:constipation (Obstipation), DI:diarrhoea (Diarrhoe), FI:financial difficulties (finanzielle Schwierigkeiten) gute LQ schlechte LQ Zyklus 3 6 3 6 PF ++ + + ++ RF +! - + - EF + + + ++ CF + - - -- SF + +! + + ++ FA ++ + + / NA ++ + - / PA ++ + + ++ DY + - + - IN - -- + ++ AP +! + +! + ++ CO -- - ++ + DI + - - -- FI + - -- - 94 Vergleich der Patientinnen mit Ovarialkarzinom mit guter und schlechter Lebensqualität Tendenziell hatten die Ovarialkarzinompatientinnen, die ihre Lebensqualität als gut eingeschätzt hatten, zu allen Zykluszeitpunkten bessere Werte innerhalb der Funktionsskala. Signifikant war der Unterschied in der Funktionsskala im Bereich der emotionalen Funktion zu allen drei Zeitpunkten (p=0,036, p=0,030, p=0,032). Außerdem waren die kognitive Funktion zum 6. Zyklus (p=0,022) und die soziale Funktion zum 3. Zyklus (p=0,017) bei den Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, signifikant schlechter. [vgl. Abb.36]. Abb. 36: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Ovarialkarzinom mit guter (N=62) und schlechter (N=16) Lebensqualität zu Beginn der Therapie 95 Auch innerhalb der Symptomskala hatten die Frauen, die ihre Lebensqualität als gut eingeschätzt hatten, die besseren Werte. Signifikant bestand der Unterschied dabei zum 6. Zyklus im Bereich Atemnot (p=0,034). Ausnahmen bestanden zum 1. Zyklus in den Bereichen Diarrhoe, Übelkeit und finanzielle Schwierigkeiten. Hier hatten die Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, die besseren Werte. Der Unterschied im Bereich Übelkeit war dabei signifikant vorhanden (p=0,047) [vgl. Abb.37 / Abb.38]. Abb. 37: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Ovarialkarzinom mit guter (N=62) und schlechter (N=16) Lebensqualität zu Beginn der Therapie 96 Abb. 38: Vergleich der weiteren EORTC-Items (European Organisation for Research and Treatment of Cancer) der Patientinnen mit Ovarialkarzinom mit guter (N=62) und schlechter (N=16) Lebensqualität zu Beginn der Therapie 97 4. Diskussion Ziel der vorliegenden Arbeit war, zunächst mittels des EORTC-QLQ-C30-Fragebogens den Einfluss der Chemotherapie auf die Lebensqualität bei einem gemischten Patientenkollektiv, bestehend aus Frauen mit einem Ovarial- oder Mammakarzinom, im Verlauf der Behandlung zu untersuchen. Des Weiteren war von Interesse, ob bestimmte äußere Faktoren, wie Gesundheitsstatus, Alter, Gewicht, Auftreten von unerwünschten Ereignissen und Intensität der Chemotherapie, die Lebensqualität der Frauen während ihrer Therapie beeinflussten. Ein unerwünschtes Ereignis wurde dabei definiert als eine therapieassoziierte Nebenwirkung (febrile Neutropenie, Hand-Fußsyndrom, Paravasat, etc.) oder eine sonstige akut auftretende Gesundheitseinschränkung (Knochenbrüche, grippaler Infekt, etc) (siehe Kap. 2.3). Außerdem sollte der Einfluss der Chemotherapie auf die funktionellen und symptomatischen Aspekte der Lebensqualität im Verlauf der Therapie untersucht werden. Zudem sollte dargelegt werden, ob das Alter die verschiedenen Aspekte der Lebensqualität während der Dauer der Chemotherapie beeinflusste. Weiterhin sollte der Einfluss der subjektiven, prätherapeutischen Lebensqualität der Patientinnen auf den Verlauf der Therapie und die verschiedenen Aspekte der Lebensqualität untersucht werden. Von Interesse waren jedoch nicht nur die zeitlich gebundenen Veränderungen der Lebensqualität und der dazu gehörenden Aspekte, sondern auch die Frage, ob es diesbezüglich einen Unterschied in der subjektiven Bewertung durch die Frauen in Abhängigkeit von den gerade beschriebenen äußeren Faktoren gab. Dazu wurden die Patientinnen in verschiedene Untergruppen eingeteilt und die Gruppen dann miteinander verglichen. Somit erfolgte jeweils zum 1., 3., und 6. Zyklus ein Vergleich der Lebensqualität zwischen: - den Frauen der ASA Klassen 1, 2 und 3 (ohne, mit leichter, mit schwerer Allgemeinerkrankung), - den Frauen mit einem BMI unter 30 und über 30 (Normal- und Übergewicht), - den Frauen der Altersklassen 1, 2 und 3 (jünger als 41, 41 – 60, älter als 60), - den Frauen mit und ohne unerwünschtem Ereignis, den Frauen mit intensivierter und nicht intensivierter Therapie. 98 Ein weiteres Ziel dieser Arbeit war es, die gerade beschriebenen Fragestellungen nicht nur für das gemischte Patientenkollektiv, sondern auch nach Diagnose getrennt, zuerst ausschließlich für die Mammakarzinompatientinnen und dann isoliert für die Ovarialkarzinompatientinnen, zu untersuchen. Abschließend wurden die Mamma- mit den Ovarialkarzinompatientinnen im Bezug auf ihre Lebensqualität und die damit verbundenen Aspekte verglichen. Das Patientenkollektiv bestand aus insgesamt 180 Patientinnen mit einem diagnostizierten Mamma- oder Ovarialkarzinom. Die Frauen wurden vor Gabe des 1., 3. und 6. Zyklus ihrer Chemotherapie mittels des EORTC-QLQ-C30-Fragebogens befragt. Die Erhebung der Daten zum 1. Zyklus diente dabei der Erfassung der Lebensqualität der Frauen unbeeinflusst von der Chemotherapie. 4.1 Einfluss der Chemotherapie auf die Lebensqualität Im Verlauf der Therapie ließ sich bei gemeinsamer Betrachtung der Mamma- und der Ovarialkarzinompatientinnen eine signifikante Steigerung der Lebensqualität zum 3. Zyklus (p=0,045) feststellen. Diese fiel zum 6. Zyklus wieder auf einen im Vergleich zum Ausgangswert leicht verbesserten Wert ab. Auch bei getrennter Betrachtung der Mamma- und der Ovarialkarzinompatientinnen zeigte sich eine ähnliche Veränderung der Lebensqualität während des Behandlungsverlaufs. Eine Erklärung dafür könnte zum einen sein, dass die Frauen bereits zum 1. Zykluszeitpunkt, also noch vor Gabe der ersten Dosis der Chemotherapie, durch die Diagnose ihrer Krebserkrankung und die damit verbundene psychische Belastung in ihrer Lebensqualität beeinträchtigt waren (Alter et al, 1996), (Lethborg, 2000) (Lakusta, 2001). Zum anderen war die Lebensqualität wahrscheinlich bei vielen Frauen zu diesem Zeitpunkt noch durch die Folgen der Operation, die der Chemotherapie sowohl bei den Mamma- als auch bei den Ovarialkarzinompatientinnen in den meisten Fällen vorausging, beeinträchtigt. Zum 3. Zykluszeitpunkt, an dem die Frauen das zweite Mal befragt wurden, war die Beeinträchtigung der Lebensqualität vermutlich deshalb geringer, da die Frauen in den vergangenen Wochen Zeit hatten, sich mit ihrer Diagnose auseinanderzusetzen und Informationen über die Krankheit und deren Verlauf zu sammeln. 99 So konnten sie möglicherweise die psychische Belastung durch einen höheren Informationsgrad und die persönliche Befassung mit der Krankheit bereits verringern. Ein weiterer Faktor, der den Frauen dabei geholfen haben könnte ihren psychischen Stress weiter abzubauen, könnte die Chemotherapie selbst und die damit verbundene Aussicht auf Heilung gewesen sein (Francisco et al, 2010). Zudem befanden sich die meisten Frauen in einem Stadium der Besserung nach der vorangegangenen Operation, während die Nebenwirkungen der Therapie für sie noch nicht in vollem Ausmaß zu spüren waren. Zum 6. Zykluszeitpunkt traten die Nebenwirkungen der Zytostatika dann wahrscheinlich verstärkt hervor und führten zu einer erneuten Senkung der Lebensqualität. Besonders fiel die Tatsache auf, dass die Lebensqualität von den Mammakarzinompatientinnen im Gegensatz zu den Ovarialkarzinompatientinnen zum 6. Zyklus schlechter bewertet wurde als zum Beginn ihrer Therapie. Ein Grund dafür, dass nur bei den Patientinnen mit Mammakarzinom die Lebensqualität zum 6. Zyklus schlechter war als zum 1. Zyklus, könnte die anthrazyklin- und taxanhaltige Therapie, die ein großer Teil der Frauen erhielt, gewesen sein. Die Ovarialkarzinompatientinnen bekamen überwiegend eine platin- und taxanhaltige Therapie, die vergleichsweise besser verträglich ist. Vergleich der Lebensqualität zwischen den Mamma- und den Ovarialkarzinompatientinnen zu den einzelnen Zykluszeitpunkten In beiden Patientengruppen folgte, wie gerade beschrieben, im Zeitraum der Behandlungsdauer, auf eine Besserung der Lebensqualität eine Verschlechterung dieser. Zu den einzelnen Zykluszeitpunkten wurde deutlich, dass die Patientinnen mit Ovarialkarzinom ihre Lebensqualität dabei immer schlechter eingeschätzt hatten als die Mammakarzinompatientinnen. Signifikant bestand dieser Unterschied zum 1. Zyklus (p=0,006). Ein Grund hierfür könnte sein, dass die notwendige Operation bei den Ovarialkarzinompatientinnen vor Beginn ihrer Chemotherapie weitaus invasiver verläuft als die, der Chemotherapie vorausgehenden Operation bei den Patientinnen mit Mammakarzinom. Zudem wird das Ovarialkarzinom meist erst in fortgeschrittenem Stadium bei den Frauen entdeckt, was dazu führt, dass die Erkrankungsverläufe bei den Ovarialkarzinompatientinnen weitaus schwerwiegender sein können als bei den Mammakarzinompatientinnen. Damit begannen die Patientinnen mit Ovarialkarzinom ihre Therapie wahrscheinlich bereits mit deutlich mehr funktionellen und symptomatischen Beeinträchtigungen als die Mammakarzinompatientinnen. möglicherweise in der Bewertung ihrer Lebensqualität wieder. 100 Dies spiegelte sich 4.2 Einfluss individueller Faktoren auf die Lebensqualität Die unter 4.1 besprochene zeitliche Veränderung der Lebensqualität bestand bei gemeinsamer Betrachtung der Mamma- und der Ovarialkarzinompatientinnen auch unter Berücksichtigung individueller Faktoren der Patientinnen, die ihr Alter, ihr Gewicht, ihren Gesundheitszustand und das Auftreten unerwünschter Ereignisse während der Therapie betrafen, weiter. Die Lebensqualität stieg im Durchschnitt zum 3. Zyklus bei allen Frauen unabhängig davon, nach welchen äußeren Faktoren sie eingeteilt waren und sank danach zum 6. Zyklus wieder ab. Signifikant war die Verbesserung der Lebensqualität dabei in der ASA Gruppe 3 (p=0,042) und in der Altersklasse 1 (p=0,006). In der Altersklasse 1 war zudem die Verschlechterung zum 6. Zyklus signifikant (p=0,022). Ein ähnliches Ergebnis zeigte sich nach Aufteilung des Patientenkollektivs in Mammaund in Ovarialkarzinompatientinnen. Bei den Patientinnen mit Ovarialkarzinom kam es erneut unabhängig von den äußeren Faktoren zu einem Anstieg der Lebensqualität zum 3. Zyklus, der zum 6. Zyklus wieder rückläufig war. Signifikant war die Verbesserung der Lebensqualität zum 3. Zyklus in der Altersklasse 1 (p=0,010), in der Gruppe der Frauen mit einem BMI unter 30 (p=0,029) und in der Gruppe der Frauen, die ein unerwünschtes Ereignis im Verlauf ihrer Therapie hatten (p=0,013). Allgemein schien es demnach so, dass die Patientinnen unabhängig von externen Einflussfaktoren, auf ähnliche Weise durch ihre Krebsdiagnose und ihre Chemotherapie in der Wahrnehmung ihrer Lebensqualität im Verlauf der Behandlung beeinflusst wurden. Dass externe Faktoren dennoch eine Rolle spielen konnten, zeigte sich in den Gruppen der Frauen mit Mammakarzinom, die ein unerwünschtes Ereignis hatten, die zur Altersklasse 2 gehörten und die eine intensivierte Therapie erhielten. In diesen Gruppen trat eine tendenzielle Verschlechterung der Lebensqualität bereits zum 3. Zyklus ein. Eine tendenzielle Verschlechterung zum 6. Zyklus ohne vorausgehende Verbesserung war in der Gruppe der Altersklasse 3 zu erkennen. Dieses Ergebnis könnte in der Gruppe der Frauen, die eine intensivierte Chemotherapie erhielten, durch die verstärkt auftretenden Nebenwirkungen erklärt werden (Brandberg et al, 2008), die die Patientinnen vor allem in den funktionellen Bereichen ihrer Lebensqualität einschränken und mit vermehrter Müdigkeit verbunden sind (MacquartMoulin et al, 2000) (Fife et al, 2000). 101 In der Gruppe der Frauen, die ein unerwünschtes Ereignis hatten, könnte dieses bei Auftreten vor dem 3. Zyklus dazu geführt haben, dass die Frauen weniger Zeit hatten sich zu erhohlen als die Frauen mit einem komplikationslosen Verlauf, da sie nach Diagnose und Operation mit Auftreten des unerwünschten Ereignisses eine erneute Belastung zu bewältigen hatten. Den unterschiedlichen Verlauf zwischen den Altersklassen könnte man vermutlich dadurch erklären, dass die Frauen der Altersklasse 2 vermehrt von der Chemotherapie betroffen wurden, da sie sich im Alter zwischen 40 und 60 in einem Lebensabschnitt befinden in dem sie viele Dinge gleichzeitig erfüllen müssen. Sie können sich nicht mehr so intensiv um Haushalt und Kinder kümmern und auch beruflich werden sie stark durch die Therapie eingeschränkt (Kornblith, 2007). Letzteres führt dann natürlich auch zu finanziellen Einbußen, die wiederum einen Belastungfaktor darstellen können (Mor et al, 1994). Die Tatsache, dass es innerhalb der Gruppe der Altersklasse 3 zu keiner Verbesserung zum 3. Zyklus gekommen ist, könnte sich dadurch erklären lassen, dass die älteren Frauen sich aufgrund ihres Alters nicht mehr so schnell von den operationsbedingten Anstrengungen erholen konnten und deshalb keine Verbesserung in der Lebensqualität erlebten. 4.3 Vergleich der Lebensqualität zwischen den Merkmalsausprägungen der unterschiedlichen Einflussfaktoren Insgesamt ließ sich also feststellen, dass sich die Lebensqualität im Behandlungsverlauf unabhängig von den im Voraus definierten äußeren Faktoren (Gewicht, Alter, Gesundheitszustand, Auftreten unerwünschter Ereignisse) mit Ausnahme der genannten Gruppen der Mammakarzinompatientinnen zunächst verbesserte und danach wieder verschlechterte. Beim Vergleich der Frauen, die zuvor anhand der äußeren Faktoren eingeteilt wurden, konnte man jedoch entscheidende Unterschiede zu den einzelnen Zykluszeitpunkten finden. Innerhalb des gemischten Patientenkollektivs stieg die Lebensqualität der Frauen mit ihrem Gesundheitszustand. Die Frauen der ASA Gruppe 1 schätzten ihre Lebensqualität im Durchschnitt als besser ein als die Frauen der ASA Gruppe 2 und die wiederum besser als die Frauen der ASA Gruppe 3. Signifikant bestand dieser Unterschied zwischen den Frauen der ASA Gruppe 1 und 3 (p=0,013, p=0,026). 102 Ein Grund dafür könnte zum einen sein, dass Patientinnen mit bereits bestehenden Gesundheitseinschränkungen bedeutend stärker, durch die zusätzliche Belastung der Krebserkrankung, in ihren körperlichen Funktionen eingeschränkt werden als Patientinnen, die ausschließlich ihre Krebserkrankung zu bewältigen haben (Bernhard et al, 1998). Zum anderen spielt sehr wahrscheinlich auch die steigende psychische Belastung, die durch die Krebsdiagnose entsteht bei den Frauen, die bereits durch andere Komorbiditäten belastet sind, eine größere Rolle (Ahn et al, 2007), (Elliott et al, 2004). Darüber hinaus schätzten die Frauen, die einen komplikationslosen Behandlungsverlauf hatten, ihre Lebensqualität im Durchschnitt als besser ein als die Frauen, bei denen ein unerwünschtes Ereignis während ihrer Therapie auftrat. Da in unserer Untersuchung ein unerwünschtes Ereignis mit einer akuten Gesundheitsverschlechterung gleichzusetzen ist, könnte man dieses Ergebnis als zusätzliche Bestätigung der gerade beschriebenen These, dass sich ein schlechter Gesundheitszustand negativ auf die Lebensqualität auswirkt, werten. Zudem konnte bereits am Beispiel von Therapie induzierter Neutropenie und dem dazu führenden Aufschub der Chemotherapie-Gabe gezeigt werden, dass ein unerwünschtes Ereignis (in diesem Fall die Neutropenie) zu vermehrter Anspannung, Depressionen und Wut und somit zu einem höheren Verlust an Lebensqualität führen kann (Calhoun et al, 2003). Was den äußeren Faktor Alter betrifft so konnte diesbezüglich bereits oft ein signifikanter Zusammenhang mit der Lebensqualität gefunden werden (Figueiredo, 2004), (Clough-Gorr et al, 2007), (Tannenbaum, 2007). In unserer Untersuchung war die Lebensqualität der Frauen umso besser je jünger sie waren. Im Vergleich zu den Altersklassen 2 und 3 hatten die Frauen der Alterslasse 1 ab dem 3. Zykluszeitpunkt die beste Lebensqualität (p=0,043, p=0,006). Damit widersprechen die Ergebnisse zumindest teilweise unter anderem der Studie von Kornblinth et al., die eine schlechtere Lebensqualität assoziiert mit jungem Alter ergeben hatte (Kornblith et al, 2007), (Kwan et al, 2010). Eine Ursache für diese unterschiedlichen Erkenntnisse könnte gewesen sein, dass in unserer Untersuchung die Altersklasse 1 zum einen aus einer sehr geringen Fallzahl (N=7) und zum anderen nur aus sehr jungen Patientinnen im Alter unter 40 bestand, wohingegen andere Studien oft Frauen unter 50 als junge Frauen definieren. Somit ist eine Vergleichbarkeit nur bedingt gegeben. Zudem war zumindest im Behandlungsverlauf eine größere Einschränkung der Frauen der Altersklasse 2 im Gegesatz zur Altersklasse 3 vorhanden, die die These von der größeren Belastung bei jüngeren Frauen wiederum eher bestätigt. 103 Außerdem könnte man eine zusätzliche Bestätigung der These darin sehen, dass die Frauen der Altersklasse 1 zum 1. Zyklus noch tendenziell stärker in ihrer Lebensqualität eingeschränkt waren als die älteren Frauen. Abgesehen davon konnte festgestellt werden, dass die normalgewichtigen Frauen (BMI unter 30) ihre Lebensqualität außer zum 3. Zyklus als schlechter einschätzten als die übergewichtigen Frauen (BMI über 30). Was das Gewicht der Frauen betrifft, so könnte man mutmaßen, dass ein niedrigeres Gewicht bei den Frauen zu mehr Nebenwirkungen führte da sie im Verhältnis eine höhere Dosis pro Körpergewicht bekamen als Frauen mit einem höheren Gewicht. Betrachtete man ausschließlich Mamma- oder Ovarialkarzinompatientinnen ergaben sich ähnliche Ergebnisse. Erneut hatten die jüngeren und gesünderen Frauen die bessere Lebensqualität im Verlauf ihrer Therapie. Zum 6. Zyklus bestand dieser Unterschied signifikant zwischen den Mammakarzinompatientinnen der Altersklasse 1 und 3 (p=0,030) und der ASA Gruppe 1 und 3 (p=0,028). Bei den Ovarialkarzinompatientinnen bestand dieser Unterschied signifikant zum 3. Zykluszeitpunkt zwischen den Frauen der Altersklasse 1 und 2 (p=0,047) und den Frauen der Altersklasse 1 und 3 (p=0,017). Ausnahme war erneut der 1. Zyklus zwischen den unterschiedlichen Altersklassen bei den Mammakarzinompatientinnen. Wieder hatten die Frauen der Altersklasse 1 zu diesem Zeitpunkt die schlechtesten Werte. Diese Ergebnisse korrelieren überwiegend relativ gut mit der klinischen Situation der Patientinnen und lassen sich wie gerade beschrieben auch in vernünftigen Zusammenhang mit der Literatur setzten. Das gleiche gilt für die Patientinnen mit Ovarialkarzinom und komplikationslosem Verlauf, die im Gegensatz zu den Frauen mit Ovarialkarzinom und unerwünschten Ereignissen weniger Belastungen ausgesetzt waren. Verwunderlich erschien jedoch die Tatsache, dass die Frauen mit Mammakarzinom, die ein unerwünschtes Ereignis hatten, ihre Lebensqualität zu allen drei Zykluszeitpunkten tendenziell als besser einschätzten als die Mammakarzinompatientinnen mit einem komplikationslosen Verlauf. Aufgrund der zusätzlichen Belastung einer Komplikation müsste die Lebensqualität eigentlich wie bei den Ovarialkarzinompatientinnen schlechter sein. Eine Erklärung hierfür könnte sein, dass die Patientinnen das unerwünschte Ereignis so früh innerhalb ihrer Therapie erlebten, dass sie sich bis zum 3. Zyklus bereits wieder erholt hatten oder so spät, dass es bis zum 6. Zyklus noch nicht in vollem Ausmaß als Belastung aufgetreten war. 104 Durch die Anonymisierung der Datensammlung konnte eine genaue zeitliche Einordnung der unerwünschten Ereignisse und somit eine weitere Erklärung der Ergebnisse jedoch nicht erfolgen. Ein weiterer Unterschied bestand darin, dass die Ovarialkarzinompatientinnen mit einem BMI über 30 tendenziell die bessere Lebensqualität angaben als die Ovarialkarzinompatientinnen mit einem BMI unter 30 während es sich bei den Mammakarzinompatientinnen genau umgekehrt verhielt. Nun könnte für die Ovarialkarzinompatientinnen genauso wie für das gesamten Patientenkollektiv die Erklärung gelten, dass normalgewichtigen Frauen im Verhältnis zu den übergewichtigen Frauen eine höhere Dosis pro Körpergewicht bekommen und deswegen stärker durch Nebenwirkungen beeinträchtigt waren. Da es sich bei den Mammakarzinompatientinnen genau umgekehrt verhielt könnte eine Erklärung bei diesen Frauen sein, dass ihr starkes Übergewicht bereits zu weiteren Adipositas assoziierten Erkrankungen geführt hatte (Diabetes, KHK, pAVK, etc.) und somit im Sinne einer weiteren Gesundheitseinschränkung, wie zu Anfang des Kapitel beschrieben, zu einer Einschränkung der Lebensqualität. Schließlich ergab sich bei den Patientinnen mit Mammakarzinom, die keine intensivierte Chemotherapie erhielten, zum 3. und zum 6. Zykluszeitpunkt noch eine signifikant bessere Lebensqualität als bei den Frauen, die eine intensivierte Chemotherapie erhielten (p=0,003, p=0,040). Damit bestätigt sich die These, dass die Frauen mit intensivierter Therapie größere Einschränkungen in der Lebensqualität hatten also auch im direkten Vergleich mit den Frauen, die keine intensivierte Therapie bekamen und nicht nur im Verlauf wie unter 4.2 beschrieben. 4.4 Einfluss der Chemotherapie auf die unterschiedlichen Lebensqualitätsbereiche Die Auswertung der EORTC-Fragebögen aller Patientinnen unabhängig von ihrer Diagnose zeigte, dass die Frauen in vielen Bereichen zum Zeitpunkt des 6. Zyklus deutlich eingeschränkter waren als zu Beginn ihrer Behandlung (kognitive Funktion, p=0,002, Müdigkeit, p<0,001, Übelkeit, p=0,007, Obstipation, p=0,001, Atemnot, p=0,042). Eine Zunahme der Beschwerden war dabei häufig ab dem 3. Zyklus zu beobachten. 105 Eine Erklärung dafür, dass die Beschwerden der Frauen mit der Zeit immer stärker wurden könnte sein, dass die Nebenwirkungen der Chemotherapie erst allmählich über die Zeit zunahmen. Der negative Einfluss auf die kognitiven Fähigkeiten der Frauen kann dabei oft noch Jahre nach der Therapie erkennbar sein (Ahles et al, 2002), (Brezden CB, 2000). Dabei handelte es sich laut Debess et.al jedoch überwiegend um einen nicht messbaren, subjektiven Eindruck den die Frauen von ihren kognitiven Fähigkeiten haben (Debess et al, 2009). Eine weitere Nebenwirkung, die die Frauen oft nach Jahren noch belastet ist die Müdigkeit (Arndt et al, 2005). Sie wird außerdem von den Frauen bereits während ihrer Therapie als das belastendste Symptom beschrieben (Bower et al, 2008). Ein Grund hierfür könnte auch sein, dass es bis jetzt relativ wenig Möglichkeiten gibt die Müdigkeit der Frauen zu behandeln (Carroll et al, 2007). Emotional konnten sich die Frauen hingegen über die Zeit signifikant stabilisieren (p=0,016). Clough-Gorr et al konnten diesbezüglich jedoch keine signifikanten Unterschiede bei Frauen über 65 feststellen (Clough-Gorr et al, 2007). Tendenziell ähnlich verhielten sich die Werte in dem Bereich der sozialen Funktion. Einen Zusammenhang zwischen einem guten sozialen Umfeld und einer guten Lebensqualität fanden auch Wissenschaftler in Kalifornien die über 4 Jahre hinweg die Daten von Frauen mit Mammakarzinom gesammelt und bezüglich der Lebensqualität ausgewertet hatten (Kwan et al, 2010). Man könnte des Weiteren davon ausgehen, dass die Frauen mit guten sozialen Verbindungen aufgrund der vermehrten Unterstützung die sie erfahren auch emotional stabiler sind. Außerdem hatten die Frauen immer weniger Schmerzen im Verlauf der Therapie. Hierfür könnte der immer größer werdende zeitliche Abstand zu der, der Chemotherapie vorausgehenden Operation ein Grund sein. Auch in den gerade beschriebenen Bereichen, die sich über die Zeit besserten, zeichnete sich jedoch zum 6. Zyklus wieder eine leichte Verschlechterung im Vergleich zum 3. Zyklus ab. Man könnte darin einen direkten Zusammenhang mit den zeitlichen Veränderungen der Lebensqualität vermuten. Diese verbesserte sich demnach mit Nachlassen der Beschwerden zum 3. Zyklus und verschlechterte sich zum 6. Zyklus wieder mit deren erneuten Anstieg. Bei anschließender Betrachtung der Entwicklungen der funktionellen und symptomatischen Lebensqualitätsbereiche einmal nur bei den Mamma- und einmal nur bei den Ovarialkarzinompatientinnen zeigten sich unterschiedliche Behandlungsverläufe zwischen den beiden Gruppen. So war die emotionale Funktion bei den Mammakarzinompatientinnen der einzige Bereich in dem sich zum 6. Zyklus Besserungen abzeichneten. 106 Alle anderen Bereiche verschlechterten sich deutlich im Verlauf der Therapie (physische Funktion, p<0,001, kognitive Funktion, p=0,007, Müdigkeit, p=0,001, Übelkeit, p=0,002, Atemnot, p<0,001, Obstipation, p=0,003, Appetitverlust, p=0,010, p=0,004) und waren dann meist noch schlechter als zum 3. Zyklus. Daraus lässt sich sehr wahrscheinlich eine immer weiter ansteigende Belastung der Frauen mit Mammakarzinom durch ihre Therapie schließen. Die Patientinnen mit Ovarialkarzinom konnten sich hingegen bis zum 3. Zyklus in vielen Bereichen verbessern (physische Funktion, p=0,033, emotionale Funktion, p=0,030, Rollenfunktion, p=0,039, Schmerzen, p=0,024, Schlaflosigkeit, p=0,024). Diese Tendenz hielt in allen Funktionsbereichen außer der kognitiven Funktion bis zum 6. Zyklus an. Im Gegensatz dazu stiegen ihre Beschwerden in den symptomatischen Bereichen zum 6. Zyklus wieder an und waren dann teilweise schlimmer als zum 1. Zyklus (Atemnot, p=0,001). Dass sich die Einschränkungen der Mammakarzinompatientinnen im Behandlungsverlauf verstärkten und bei den Ovarialkarzinompatientinnen besser wurden, lag wahrscheinlich an den unterschiedlichen Chemotherapien der Frauen. Mit einer Kombination aus Anthrazyklinen und Taxanen erhielten die Patientinnen mit Mammakarzinom zum Teil deutlich aggressivere Zytostatika, was die ansteigenden Beschwerden über die Zeit erklären könnte. Vergleich der Lebensqualität zwischen Mamma- und Ovarialkarzinompatientinnen zu den einzelnen Zykluszeitpunkten Nicht nur bei der Gegenüberstellung der Behandlungsverläufe kam es zu Unterschieden zwischen den beiden Patientengruppen. Betrachtete man die Werte zu den einzelnen Zykluszeitpunkten, wurde deutlich, dass die Mammakarzinompatientinnen vor allem zu Beginn der Therapie weniger Einschränkungen hatten als die Ovarialkarzinompatientinnen (physische Funktion, p<0,001, soziale Funktion, p=0,003, Rollenfunktion, p=0,011, Müdigkeit, p<0,001, Appetitverlust, p=0,007, Schmerzen, p<0,001). Bereits zum 3. Zyklus näherten sich die Werte der Ovarialkarzinompatientinnen und der Mammakarzinompatientinnen aber tendenziell einander an. Im Bereich der Übelkeit waren die Ovarialkarzinompatientinnen sogar signifikant weniger eingeschränkt (p=0,028). Zum 6. Zyklus blieb dieser Trend erhalten. Tendenziell erreichten sie in den Bereichen der kognitiven und emotionalen Funktion sowie der Atemnot und dem Appetitverlust sogar bessere Werte. Erneut könnte die Erklärung für diese Ergebnisse, wie auch für die unterschiedliche Lebensqualität zwischen den beiden Patientengruppen (siehe Kapitel 4.1), in dem Unterschied in der Behandlung der beiden Krebserkrankungen liegen. 107 Zunächst ging es den Mammakarzinompatientinnen wahrscheinlich deshalb besser, da sie eine weit weniger invasive Operation hatten als die Ovarialkarzinompatientinnen. Zudem sind die Patientinnen mit einem Ovarialkarzinom meist in einem höheren Erkrankungsstadium als die Frauen mit Mammakarzinom. Die Tatsache, dass die Werte der Mammakarzinompatientinnen im Verlauf schlechter und die der Ovarialkarzinompatientinnen besser wurden, lag möglicherweise wie auch gerade beschrieben an den unterschiedlichen Chemotherapien. 4.5 Vergleich des Einflusses auf die unterschiedlichen Lebensqualitätsbereiche innerhalb der Altersklassen Patientinnen unter 40 Allgemein erschien es so, dass sich alle jungen Patientinnen relativ schnell an die belastende Situation während ihrer Behandlung anpassen konnten. Bis zum 3. Zyklus verringerten sich die Einschränkungen bei ihnen, bis auf konstant weiterbestehenden Probleme mit Diarrhoe und finanziellen Schwierigkeiten, in allen Bereichen der Lebensqualität (emotionale Funktion, p=0,028, Müdigkeit, p=0,022, Schmerzen, p=0,026). Diese Verbesserungen bestanden zwar zum 6. Zyklus nicht mehr auf selben Niveau fort, waren aber im Vergleich zum Ausgangswert immer noch vorhanden (emotionale Funktion, p=0,028, soziale Funktion, p=0,036). Einen Zusammenhang zwischen finanziellen Schwierigkeiten und einem jungen Alter, wie er sich in der Untersuchung gezeigt hatte, wurde bereits von van Mor et al dargelegt (Mor et al, 1994). Im Verlauf der Behandlung nahmen dann zusätzlich noch die Atemnot und die kognitiven Einschränkungen zu. Ein junges Alter erschien dennoch ein günstiger Faktor für die Patientinnen dieser Untersuchung in der Bewältigung ihrer Chemotherapie zu sein. Bei ausschließlicher Betrachtung der Mammakarzinomaptientinnen waren Verbesserungen nicht so häufig vorhanden wie bei Auswertung des gemischten Patientenkollektivs. Die Werte in den einzelnen Bereichen blieben bei den Patientinnen mit Mammakarzinom überwiegend unverändert. Verschlechtert hatten sich zum 3. Zyklus die physische Funktion, die Atemnot und die finanziellen Schwierigkeiten. 108 Bis zum 6. Zyklus blieben diese Funktionen sowie dann zusätzlich die kognitive Funktion, der Appetitverlust und die Obstipation eingeschränkt. Bei den Ovarialkarzinompatientinnen kam es mit Ausnahme des Bereichs Diarrhoe und finanzielle Schwierigkeiten nur zu Verbesserungen (physische Funktion, p=0,039, sozialen Funktion, p=0,047, Müdigkeit, p=0,005). Zum 6. Zyklus konnten aber auch die Ovarialkarzinompatientinnen in den meisten Bereichen ihre Verbesserungen nicht erhalten. Damit waren den beiden Patientengruppen eine emotionale und soziale Stabilisierung über den Behandlungsverlauf hinweg sowie steigende finanzielle Schwierigkeiten gemeinsam. Wie gerade beschrieben sind die finanziellen Schwierigkeiten am ehesten durch das Alter der Patientinnen bedingt. Ansonsten fiel jedoch auf, dass der Unterschied zwischen den Mamma- und Ovarialkarzinompatientinnen, der in einer relativen Verschlechterung der Lebensqualität bei den Frauen mit Mammakarzinom und einer relativen Verbesserung bei den Frauen mit Ovarialkarzinom besteht (siehe 4.1), im Behandlungsverlauf auch bei den Frauen der Altersklasse 1 vorhanden ist. Patientinnen 40 und 60 Mit Ausnahme ihrer sich stetig verschlechternden kognitiven Funktion (p=0,017) waren die Frauen funktionell weniger eingeschränkt zum 3. Zyklus als zu Beginn der Therapie. Begünstigend könnte sich hierbei die konstante Abnahme der Schmerzen ausgewirkt haben. In der Symptomskala hingegen stiegen die Beschwerden in dem überwiegenden Teil der Bereiche an (Müdigkeit, p=0,015, Übelkeit, p=0,002, Obstipation, p=0,010, Atemnot, p=0,002). Vermutlich waren die funktionellen Fähigkeiten zum 6. Zyklus wieder mit davon betroffen und sanken im Vergleich zum 3. Zyklus wieder ab. Negative Auswirkungen der Chemotherapie zeigten sich auch bei ausschließlicher Betrachtung der Mammakarzinompatientinnen. Hier stiegen die Beschwerden mit Ausnahme der emotionalen Funktion in allen funktionellen und vielen symptomatischen Bereiche konstant über die Therapie hinweg an (physischen Funktion, p=0,001, kognitiven Funktion, p=0,036, Übelkeit, p<0,001, Obstipation, p=0,008) waren zum 3. Zyklus verstärkt bei den Patientinnen vorhanden und wurden danach leicht besser. Die Müdigkeit (p=0,011) und die Atemnot (p=0,004) der Patientinnen nahmen immer weiter zu. Es ist anzunehmen, dass die von der Therapie ausgehenden Nebenwirkungen, die über die Zeit anstiegen, die Frauen indirekt in ihren funktionellen Bereichen einschränkten. 109 Bei den Patientinnen mit Ovarialkarzinom verbesserten sich die meisten Bereiche im Behandlungsverlauf (physische Funktion, p=0,047, Rollenfunktion, p=0,033, Schmerzen, p=0,045, Appetitverlust, p=0,006). Dabei fand sich nach dem 3. Zyklus jedoch öfter die Tendenz, dass sich die Funktionen wieder verschlechterten. Tendenziell als belastender als zu Beginn ihrer Therapie empfanden die Ovarialkarzinompatientinnen zum 6. Zyklus die Müdigkeit, Atemnot, Schlaflosigkeit, Obstipation, Diarrhoe und die Einschränkung ihrer kognitiven Funktion. Erneut ließ sich also eine verstärkte Einschränkung der funktionellen Bereiche der Frauen ab dem Zeitpunkt feststellen ab dem auch ihre symptomatische Belastung anstiegen. Somit zeigte sich zum 6. Zyklus in beiden Gruppen vermehrt Probleme mit Müdigkeit, Atemnot und der kognitiven Funktion. Im Vergleich zur Altersklasse 1 waren den Frauen der Altersklasse 2 also vor allem symptomatische Beschwerden gemeinsam. Der unterschiedliche Verlauf, der sich zum 3. Zyklus vor allem durch Verschlechterungen bei den Mammakazinompatientinnen und Verbesserungen bei den Ovarialkarzinompatientinnen feststellen ließ blieb auch in der Altersklasse 2 bestehen. Patientinnen über 60 Bei den Patientinnen über 60 zeigte sich eine Verbesserung zum 3. Zyklus in den Bereichen Schmerzen, Übelkeit, Schlaflosigkeit, finanzielle Schwierigkeiten sowie in der emotionalen und sozialen Funktion, die sich jedoch nicht bis zum 6. Zyklus auf ihrem Niveau halten konnte. In den restlichen funktionellen und symptomatischen Bereichen blieb eine anhaltende Verschlechterung der Werte bestehen oder steigerte sich noch (Atemnot, p=0,021, Diarrhoe, p=0,023). Auch bei, Betrachtung der Frauen über 60 mit Mammakarzinom kam es zu einer ansteigenden Belastung während der Therapie. Mit Ausnahme der emotionalen, kognitiven und sozialen Funktion und der Schlaflosigkeit, die zum 3. Zyklus noch verbesserte Werte zeigten, kam es überwiegend zu stetig steigenden Einschränkungen (Appetitverlust, p<0,001, Obstipation, p=0,027, Müdigkeit, p=0,031, Atemnot, p=0,018). Da den Patientinnen die nun bereits häufig beschriebene Besserung zum 3. Zyklus in den meisten Bereichen fehlte, könnte man annehmen, dass sie nicht genug Zeit hatten, sich zwischen Operation und Chemotherapie zu erholen. Dies könnte sich möglicherweise durch ihr gehobenes Alter und die damit verbundene schlechtere körperliche Regenerationskraft erklären lassen. Die Patientinnen mit Ovarialkarzinom zeigten hingegen nur in der kognitiven Funktion und der Obstipation konstante Einschränkungen. 110 Die anderen Bereiche verbesserten sich alle zum 3. Zyklus und fielen nur in den Bereichen der Atemnot, der Schlaflosigkeit und der Diarrhoe auf zum Ausgangswert schlechtere Werte ab. Erneut hatten die Mamma- und die Ovarialkarzinompatientinnen also Beschwerden, die beide Gruppen zum 6. Zyklus betrafen. Wieder war es die Atemnot. die sich verschlimmert hatte und zudem kam bei den Frauen im Alter über 60 die Obstipation als weiterer belastender Faktor hinzu. Gleich blieb außerdem der Unterschied in den Veränderungen innerhalb der Bereiche über die Zeit. Auch bei den Frauen der Altersklasse 3 bewerten die Ovarialkarzinompatientinnen vor allem zum 3. Zyklus ihre Situation positiver als die Mammakarzinompatientinnen. Nun wurde bereits mehrfach beschrieben, dass die Ovarialkarzinompatientinnen wahrscheinlich schon vor der Therapie beeinträchtigter waren als die Mammakarzinompatientinnen und dies möglicherweise der Grund dafür war, dass sie im direkten Vergleich stärkere Beeinträchtigungen angaben als die Mammakarzinompatientinnen. Dennoch erscheint es so als ob die Frauen mit Ovarialkarzinom während ihrer Therapie die Veränderungen ihrer Lebensqualität eher in einer positiven Weise wahrnahmen während die Mammakarzinompatientinnen ihre Lebensqualität und die dazu gehöhrenden Bereiche immer negativer über die Zeit beurteilten. Es wäre denkbar, dass dieser Unterschied darauf beruht, dass die Patientinnen, die ihre Chemotherapie in einem sehr schlechten Zustand beginnen, der als Beispiel aufgrund einer invasiven Operation oder eines neoplastisch verursachten Syndroms besteht, die vergleichsweise geringeren negativen Folgen der Chemotherapie besser tolerieren. Im Gegensatz dazu erscheinen den dazu relativ unbeeinträchtigt Patientinnen möglicherweise die Nebenwirkungen als gravierender da sie auftretende Einschränkungen viel klarer wahrnehmen. 4.6 Vergleich des Einflusses auf die unterschiedlichen Lebensqualitätsbereich zwischen den Altersklassen Beim Vergleich der Altersklassen zu den einzelnen Zyklus Zeitpunkten zeigte sich deutlich, dass die jüngeren Frauen in einem körperlich besseren Zustand waren als die älteren Frauen. Signifikant bestand dieser Unterschied zu allen drei Zeitpunkten zwischen den Altersklassen 2 und 3 (p=0,010, p=0,010, p=0,024) und ab 3. Zyklus zusätzlich zwischen den Altersklassen 1 und 3 (p=0,010, p=0,005). 111 Außerdem waren die Frauen der Altersklasse 1 ab dem 3. Zyklus signifikant weniger müde als die Frauen der Altersklassen 2 und 3 (Müdigkeit, p=0,005, p=0,001, p=0,018, p=0,008) und litten weniger unter Appetitverlust, Diarrhoe und Atemnot (p=0,001, p=0,005, p=0,007, p=0,019). Dafür konnten sie zumindest zu Beginn der Therapie die Situation anscheinend psychisch schlechter bewältigen. Sie waren vor allem emotional, sozial und kognitiv beeinträchtigter als die Frauen der höheren Altersklasse. Eine Erklärung hierfür könnte sein, dass Frauen unter 40 in einem Lebensabschnitt stehen, in dem sie noch nicht richtig in ihrem Arbeits- oder Familienleben gefestigt sind. So ist gut denkbar, dass sie sich teilweise noch um kleine Kinder kümmern müssen oder, dass sie nicht ohne Weiteres von ihrem Arbeitsplatz fernbleiben können. Damit war die Anfangszeit der Therapie, zu der die Belastungen noch nicht überschaubar waren, für diese Frauen schwerer zu ertragen. Außerdem ist es für eine jüngere Frau wohl auch schwerer zu akzeptieren, dass sie in ihrer Gesundheit und Vitalität eingeschränkt wird und damit von der allgemeinen Norm abweicht (Chan, 2001). Dennoch scheint sich die positive Auswirkung eines jüngeren Alters, die sich bereits bei der Betrachtung der Behandlungsverläufe gezeigt hatte, bei den Patientinnen dieser Untersuchung, die der Altersklasse 1 zugeteilt wurden, auch in den einzelnen Lebensqualitätsbereichen widerzuspiegeln. Nach Aufteilung der Patientinnen anhand ihrer Diagnosen zeigte sich im Vergleich der Altersklassen innerhalb der beiden Patientengruppen ein ähnliches Bild. Die Frauen der Altersklasse 1 mit Mammakarzinom waren meistens weniger eingeschränkt im Vergleich zu den Altersklassen 2 (physischen Funktion, p=0,033, Atemnot, p=0,043) und 3 (physische Funktion, p=0,050, p=0,021, Müdigkeit, p=0,021, p=0,021, Atemnot, p=0,013). Dieser Unterschied war vor allem ab dem 3. Zyklus gut erkennbar. Dass jüngere im Vergleich zu älteren Frauen teilweise weniger belastet waren, zeigte sich auch zwischen den Altersklassen 2 und 3. Hier hatten die Frauen der Altersklasse 2 signifikant weniger Appetitverlust (p<0,001) und Diarrhoe (p=0,007). Dennoch schienen die Frauen der Altersklasse 1 zum 1. Zyklus sowohl emotional als auch sozial stärker beeinträchtigt gewesen zu sein als die Frauen der Altersklassen 2 und 3. Außerdem waren es die Schmerzen, die Übelkeit und die Schlaflosigkeit, die zum 1. Zyklus den Frauen der Altersklasse 1 noch mehr Probleme bereiteten als den Frauen der anderen Altersklassen. Eine Erklärung hierfür könnte wie bereits mehrfach beschrieben sein, dass die Frauen unter 40 weniger in ihrem Leben gefestigt sind und deswegen zu Beginn der Therapie stärker beeinträchtigt waren. 112 Als klassisches Zeichen für die psychische Belastung könnte die Schlaflosigkeit in diesem Zusammenhang gesehen werden. Auch die verstärkte Übelkeit und die vermehrten Schmerzen könnten ein Ausdruck der psychischen Belastung sein. Auch bei den Ovarialkarzinompatientinnen ließ sich erkennen, dass die Frauen der Altersklasse 1 und 2 ab dem 3. Zyklus weniger müde (p=0,008, p=0,010) und gleichzeitig körperlich (p=0,022) und geistig fitter waren (p=0,010) als die Frauen der Altersklasse 3. Tendenziell galt dieser Unterschied auch für die anderen Bereiche. Erneut war jedoch zum 1. Zyklus die tendenziell stärkere emotionale und soziale Belastung der Frauen zu erkennen. Die stärkere psychische Belastung könnte auch hier mit ein Grund dafür gewesen sein, dass die Frauen zum 1. Zyklus auch schlechter schlafen konnten und mehr Müdigkeit angaben als die Frauen der höheren Altersklassen. 4.7 Einfluss der subjektiven Lebensqualität zu Beginn der Therapie auf die einzelnen Lebensqualitätsbereiche Über den Therapieverlauf verbesserten sich bei den Frauen, die ihre Lebensqualität als gut eingeschätzt hatten, die Werte in den Bereichen der emotionalen Funktion (p=0,028) und der Schmerzen. Innerhalb der restlichen Bereiche stiegen ihre Einschränkungen jedoch an (kognitive Funktion, p=0,013, Übelkeit, p=0,020, Atemnot, p<0,001, Obstipation, p<0,001, finanzielle Sorgen, p=0,030). Bei den Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, verbesserten sich die emotionale und soziale Funktion. Außerdem konnten sie besser schlafen (p=0,036) und hatten weniger Schmerzen (p=0,023). Funktionell verbesserte sich auch ihre Rollenfunktion zum Ausgangswert und sie hatten weniger Probleme mit Appetitverlust, Obstipation und finanziellen Schwierigkeiten. Mehr Probleme hatten sie unter anderen mit vermehrter Müdigkeit, Atemnot sowie ihrer kognitiven und physischen Funktion. Bei Betrachtung der beiden Gruppen im Verlauf könnte man meinen, dass die Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, im Verlauf der Behandlung weniger Beschwerden hatten als die Frauen, die ihre Lebensqualität als gut eingeschätzt hatten. Da bei letzteren deutlich mehr signifikante Verschlechterungen über die Zeit zu erkennen waren. 113 Vergleicht man nun die beiden Gruppen miteinander, waren jedoch sämtliche Werte der Funktionsskala bei den Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, auch signifikant schlechter im Gegensatz zu den Frauen, die ihre Lebensqualität als gut eingeschätzt haben (p<0,001 bis p=0,022). Außerdem waren die Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, in vielen symptomatischen Bereichen stärker belastet. Dazu gehörten Schmerzen, Müdigkeit, Atemnot, Appetitverlust, Obstipation, Übelkeit und finanzielle Probleme (p<0,001 bis p=0,035). Als Erklärung für diesen Unterschied könnte man annehmen, dass die Frauen ihre Lebensqualität als schlechter eingeschätzt hatten, da sie von Beginn der Therapie an in einer schlechteren Verfassung waren und sich dieser Nachteil über den gesamten Verlauf der Therapie bei ihnen ausgewirkt hat. Eine andere Erklärung könnte sein, dass die Frauen, die ihre Lebensqualität als gut bewertet hatten von Grund auf eine positivere Lebenseinstellung hatten. Dass diese sich günstig auf die Lebensqualität auswirken kann, wurde bereits mehrfach dargelegt (Friedman, 2006), (Matthews et al, 2004). Die positiven Auswirkungen können dabei unter anderen darin bestehen, dass es diesen Frauen leichter fällt soziale Unterstützung anzunehmen und einzufordern (Sollner et al, 2004). Des Weiteren führt die positive Einstellung der Frauen oft dazu, dass sie bessere Coping Strategien entwickeln können als Frauen, die eine negativere Sichtweise der Dinge besitzen (Ben-Zur et al, 2001). Die Frauen mit Mammakarzinom, die ihre Lebensqualität zu Beginn ihrer Therapie als gut eingeschätzt hatten, wurden immer mehr in sämtlichen Bereichen der Lebensqualität im Verlauf der Behandlung eingeschränkt (Übelkeit, p=0,003, Atemnot, p=0,010, Appetitverlust, p=0,042, Obstipation, p=0,015). Allein emotional fühlten sich die Frauen im Verlauf der Therapie tendenziell besser als zu Beginn. Die Mammakarzinompatientinnen, die ihre Lebensqualität als schlecht eingeschätzt hatten, hatten funktionell in den kognitiven und physischen Bereichen zum 6. Zyklus noch Defizite im Vergleich zu Beginn der Therapie (p=0,037, p=0,019). Symptomatisch hingegen waren sie am Ende der Behandlung vor allem durch Müdigkeit (p=0,002), Übelkeit (p=0,004), Atemnot (p=0,005) und Appetitverlust (p=0,031) eingeschränkt. Dafür hatten sie weniger Obstipation (p=0,015). Somit waren sowohl bei den Frauen, die ihre Therapie mit guter Lebensqualität begonnen hatten, wie auch bei den Frauen, bei denen dies nicht der Fall war, mitunter dieselben Bereiche von einer Verschlechterung über die Zeit betroffen (unter anderen Übelkeit, Atemnot, Appetitverlust). 114 Im direkten Vergleich der beiden Gruppen zu den einzelnen Zykluszeitpunkten wurde aber ersichtlich, dass die Frauen mit Mammakarzinom, die eine positivere Einstellung zu ihrer Lebensqualität hatten, tendenziell in allen Bereichen und zu allen Zeitpunkten bessere Bewertungen abgaben als die Mammakarzinompatientinnen, die bereits vor der Therapie ihre Lebensqualität als schlecht eingeschätzt hatten.Die Frauen mit Ovarialkarzinom, die ihre Lebensqualität als gut eingeschätzt hatten, verbesserten sich tendenziell zum 3. Zyklus, mit Ausnahme der Schlaflosigkeit und der Obstipation, in allen Bereichen (Appetitverlust, p=0,025, sozialen Funktion, p=0,041). Überwiegend kam es bis zum 6. Zyklus jedoch wieder zu einer Verschlechterung der Funktionen (Rollenfunktion, p=0,033). Ausnahme bestand diesbezüglich bei dem Appetitverlust (p=0,004). Auch bei den Ovarialkarzinompatientinnen, die ihre Lebensqualität als schlecht eingeschätzt hatten, verbesserten sich die meisten Bereiche immer weiter über den Therapieverlauf hinweg. Konstant schlechter als zu Beginn der Therapie waren die kognitive Funktion, die Diarrhoe und die finanziellen Schwierigkeiten. Auch bei den Frauen mit Ovarialkarzinom wurde, mit einer Ausnahme im Bereich Diarrhoe, von den Frauen mit guter Lebensqualität die verschiedenen Lebensqualitätsbereiche als besser eingeschätzt als von den Ovarialkarzinompatientinnen, die eine schlechtere Lebensqualität hatten. Signifikant war dies vor allem in der emotionalen (p=0,036, p=0,030, p=0,032), der sozialen (p=0,017) und der kognitiven Funktion (p=0,022). Außerdem war ihnen signifikant mehr übel (p=0,047), sie hatten signifikant mehr Obstipation (p=0,052) und mehr Atemnot (p=0,034). Somit ergab sowohl die Untersuchung des gemischten Patientenkollektivs sowie die der Mamma- und Ovarialkarzinompatientinnen getrennt voneinander einen deutlichen Unterschied zwischen den Frauen, die ihre Lebensqualität als gut eingeschätzt hatten und den Frauen, die dies nicht getan hatten. Stuften die Frauen ihre Lebensqualität zum 1. Zyklus bereits als schlecht ein, bestand eine größere Wahrscheinlichkeit, dass sie über den gesamten Therapieverlauf in allen Bereichen stärker eingeschränkt waren. Nebenbei wäre es demnach denkbar, dass die Frauen mit der guten Lebensqualität über die Behandlungsdauer häufiger signifikante Verschlechterungen der Werte hatten da sie die besseren Ausgangswerte aufwiesen und der Spielraum für Verschlechterungen größer war. 115 Zusammenfassend kam es sowohl im gemischten Patientenkollektiv als auch bei Betrachtung der Mamma- und der Ovarialkarzinompatientinnen getrennt voneinander im Therapieverlauf zunächst zu einer Verbesserung der Lebensqualität zum 3. Zyklus, die zum 6. Zyklus wieder rückläufig war. Diese Veränderung war in ihrem Verlauf meistens unabhängig von äußeren Faktoren wie Alter, Gewicht, Gesundheitszustand und Auftreten unerwünschter Ereignisse. Ausnahmen dazu bestanden in einzelnen Gruppen der Mammakarzinompatientinnen. Zwischen den Untergruppen der einzelnen äußeren Faktoren bestanden jedoch Unterschiede beim Vergleich dieser untereinander zu den einzelnen Zykluszeitpunkten. Demnach zeigten sich ein junges Alter, ein guter Gesundheitszustand und ein komplikationsloser Verlauf als günstiger Einflussfaktor auf die Lebensqualität. Abweichungen Mammakarzinompatientinnen. dazu Bei bestanden Auswertung nur in der der Gruppe der unterschiedlichen Lebensqualitätsbereiche konnte man eine Zunahme der symptomatischen Beschwerden (vor allem Müdigkeit, Atemnot, Übelkeit) feststellen, während sich auf emotionaler und sozialer Ebene eine stetige Verbesserung einstellte. Häufig waren zudem zum 3. Zyklus geringere funktionelle Einschränkungen und weniger Beschwerden zu erkennen als zu Beginn der Therapie. Diese stiegen jedoch zum 6. Zyklus wieder an. Damit könnte man auf einen direkten Zusammenhang der Bereiche und der Lebensqualität, die ähnliche Veränderungen über die Zeit zeigte, schließen. Auch bei Untersuchung der einzelnen Lebensqualitätsbereiche innerhalb der unterschiedlichen Altersklassen zeigte sich ein ähnliches Bild. Ausnahme bildeten hier die Frauen der Altersklasse 1, die sich konstant in fast allen Bereichen verbessern konnten. Beim Vergleich der Frauen, die ihre Lebensqualität als gut eingeschätzt hatten, mit den Frauen, die ihre Lebensqualität als schlecht eingeschätzt hatten, zeigte sich eine positive Bewertung der Lebensqualität zu Beginn der Therapie über den gesamten Behandlungsverlauf als günstiger Einflussfaktor auf die Lebensqualitätsbereiche. Außerdem war von Bedeutung, dass sowohl zwischen den Behandlungsverläufen als auch im direkten Vergleich zu den einzelnen Zykluszeitpunkten ein Unterschied zwischen den Mamma- und den Ovarialkarzinompatientinnen bestand. Dabei hatten die Ovarialkarzinompatientinnen trotz ihrer Verbesserungen in den einzelnen Bereichen während der Therapie meist schlechtere Werte als die Mammakarzinompatientinnen, die sich hingegen über den Behandlungsverlauf meist in vielen Bereichen verschlechterten. 116 5. Zusammenfassung In der vorliegenden Arbeit wurde die Lebensqualität von Mamma- und von Ovarialkarzinompatientinnen anhand des EORTC-QLQ-C30 (European Organization for Research and Treatment of Cancer – Quality of Life Questionnaire - C30) Fragebogens untersucht. Zielgrößen dabei waren der Einfluss der Chemotherapie sowie der Einfluss äußerer Faktoren wie Alter, Gewicht, Komorbidität, Chemotherapieintensität und Auftreten unerwünschter Ereignisse auf die Lebensqualität der Frauen. Des Weiteren sollte gezeigt werden, welche einzelnen Aspekte der Lebensqualität am meisten durch die Chemotherapie beeinträchtigt wurden und ob diese Beeinträchtigungen mit dem Alter der Patientin korreliert sind. Zuletzt war noch von Interesse, inwiefern die Einschätzung der Lebensqualität der Patientinnen zu Beginn der Therapie eine Rolle im Therapieverlauf hat. Insgesamt wurde im Verlauf der Jahre 2007 bis 2011 bei 100 Mamma- und 80 Ovarialkarzinompatientinnen, die in der onkologischen Tagesklinik der Universitätsfrauenklinik Ulm eine Chemotherapie erhielten, die Lebensqualität mittels standardisierter EORTC-QLQ-C30-Fragebögen erhoben. Die Befragung erfolgte gemäß dem Protokoll vor Gabe der ersten, dritten und sechsten Chemotherapie. Um den Einfluss äußerer Faktoren untersuchen zu können, wurden die Frauen in drei verschiedene Alters-, zwei verschiedene Gewichts- und vier verschiedene Gesundheitsklassen unterteilt. Zudem wurde unterschieden ob die Patientinnen eine intensivierte Chemotherapie erhielten oder nicht, ob sich ein unerwünschtes Ereignis während der Therapie ereignete oder nicht und ob sie ihre Lebensqualität zu Beginn der Therapie als gut oder schlecht bewertet hatten. Anschließend wurden die Daten bezüglich der Fragestellungen mittels des Datenverarbeitungsprogrammes SPSS (Statistical Package for the Social Sciences) auf Signifikanzen untersucht. Der dabei verwendete statistische Test war der Wilcoxon-MannWhitney Test. Die Auswertung der Daten zeigte eine signifikante Steigerung (p=0,045) der Lebensqualität bei allen Patientinnen von der ersten zur dritten Gabe der Chemotherapie. Dieser positive Trend hielt nicht bis zum sechsten Zyklus an und war unabhängig von äußeren Einflussfaktoren. Beim Vergleich der unterschiedlichen Alters-, Gewichts- und Gesundheitsklassen zeigte sich eine signifikant bessere Lebensqualität bei den Gesünderen (p=0,013, p=0,026), bei den Jüngeren (p=0,043, p=0,006), bei den Patientinnen, die keine 117 intensivierte Chemotherapie erhielten (p=0,003, p=0,040), und tendenziell auch bei den normalgewichtigen Frauen sowie den Frauen ohne unerwünschtes Ereignis. Bei Auswertung der unterschiedlichen Lebensqualitätsbereiche zeigte sich zur Gabe der sechsten Chemotherapie eine signifikante Verschlechterung in den Bereichen kognitive Funktion (p=0,002), Müdigkeit (p<0,001), Übelkeit (p=0,007), Obstipation (p=0,001) und Atemnot (p=0,042). Im emotionalen Bereich kam es bei den Patientinnen jedoch zu einer signifikanten Stabilisierung (p=0,016). Beim Vergleich der unterschiedlichen Lebensqualitätsbereiche zwischen den Altersklassen ergab sich eine signifikant bessere physische (p=0,005) und vegetative (p=0,008) Funktion der jüngeren Patientinnen. Tendenziell schienen die jüngeren Frauen jedoch zu Beginn der Therapie im emotionalen Bereich eingeschränkter zu sein als die älteren. Des Weiteren hatten die Patientinnen, die zu Beginn ihrer Therapie ihre Lebensqualität als gut eingeschätzt hatten, signifikant bessere Werte in allen Funktionsbereichen im Vergleich zu den Patientinnen, die ihre Lebensqualität als schlecht eingeschätzt hatten. Zusammengefasst kann man feststellen, dass die Lebensqualität bei den untersuchten Frauen ein durchaus sensibler Indikator für die sich aus der Therapie ergebenden Einschränkungen war. Diese These stützt sich vor allem auf die durchweg vorhandene Verbesserung sowohl der Lebensqualität, wie auch deren einzelner Bereiche zum dritten Zyklus, die eine plausible Erklärung darin findet, dass sich die Nebenwirkungen zu diesem Zeitpunkt noch nicht manifestiert hatten und die akute psychische Belastung durch die Diagnosestellung, sowie Folgen einer Operation im Abklingen begriffen waren. Auffällig ist zudem, dass sich die Einschätzungen der Frauen bezüglich ihrer Lebensqualität im Verlauf zwar ähnlich sind, aber im direkten Vergleich zu den einzelnen Erhebungszeitpunkten dennoch unterschieden. So schwankt auch die Lebensqualität der Frauen ohne Einschränkungen, wie einer intensiveren Therapie oder einem höherem Lebensalter, entsprechend den oben beschriebenen Trends. Dennoch wurde sie ohne diese Risikofaktoren im Vergleich durchweg besser eingeschätzt als bei zusätzlich belasteten Patientinnen. Zudem zeigte sich, dass die Einschätzung der Lebensqualität zu Beginn der Therapie positiv mit der Einschätzung bei Therapieende korrelierte. Somit könnte diese anfängliche Einschätzung der Lebensqualität als möglicher Prognosefaktor dienen. Die vorliegende Arbeit bestätigt die Vermutung, dass die Lebensqualität ein bedeutender Faktor für die Behandlung von Patienten sein kann. Erkenntnisse über die positive Beeinflussung der Lebensqualität könnten somit zukünftig die Therapieergebnisse verbessern. 118 6. Literaturverzeichnis 1: Aarsonson NK, Ahmedzai S, Bergman B, Bullinger M, Cull A, Duez NJ, Filiberti A, Flechtner H, Fleishman SB, de Haes JCJM, Kaasa S, Klee MC, Osoboa D, Razavi D, Rofe PB, Schraub S, Sneeuw KCA, Sullivan M, Takeda F: The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology. J Natl Cancer Inst 85: 365-376 (1993) 2: Ahles TA, Saykin AJ, Furstenberg CT, Cole B, Mott LA, Skalla K, Whedon MB, Bivens S, Mitchell T, Greenberg ER, Silberfarb PM: Neuropsychologic impact of standard dose systemic chemotherapy in long-term survivors of breast cancer and lymphoma. J Clin Oncol 20: 485–493 (2002) 3: Ahn SH, Park BW, Noh DY, Nam SJ, Lee ES, Lee MK, Park SM, Yun YH: Health-related quality of life in disease-free survivors of breast cancer with the general population. Ann Oncol 18: 173-182 (2007) 4: Allgemeine Toxizitätskriterien Version (CTC) nach NCI CTC Version 4.0 Stand Mai 2009. Guide to Grading Coding Adverse Events, http://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-0614_QuickReference_8.5x11.pdf (20.07.2012) 5: Alter CL, Pelcovitz D, Axelrod A, Goldenberg B, Harris H, Meyers B, Grobois B, Mandel F, Septimus A, Kaplan S: Identification of PTSD in Cancer Survivors. Psychosomatics 37: 137–143 (1996) 6: Amelung VE, Mühlbacher A, Krauth C : Gabler Wirtschaftslexikon. http://wirtschaftslexikon.gabler.de/Archiv/18103/gesundheitsbezogenelebensqualitaet-v9.html. (20.07.2012) 7: Arndt V, Merx H, Stegmaier C, Ziegler H, Brenner H: Persistence of restrictions in quality of life from the first to the third year after diagnosis in women with breast cancer. J Clin Oncol 23: 4945–4953 (2005) 119 8: Bastert G, Grischke EM: Prämaligne und maligne Mammatumoren. In: Dudenhausen JW, Schneider HPG, Bastert G (Hrsg.) Frauenheilkunde und Geburtshilfe. 2. Aufl., Walter de Gryter, S. 537 (2003) 9: Ben-Zur H, Gilbar O, Lev S: Coping with breast cancer: patient, spouse, and dyad models. Psychosom Med 63: 32-39 (2001) 10: Bergner M, Bobbit Ra, Carter WB, Gilson BS: The Sickness Impact Profile: development and final revision of a health status measure. Med Care 19: 787-805 (1981) 11: Bernhard J, Hürny C, Coates AS, Peterson HF, Castiglione-Gertsch M, Gelber RD, Galligioni E, Marini G, Thürlimann B, Forbes JF, Goldhirsch A, Senn HJ, Rudenstam CM: Factors affecting baseline quality of life in two international adjuvant breast cancer trials. International Breast Cancer Study Group (IBCSG). Br J Cancer 78: 686-693 (1998) 12: Bower JE: Behavioral symptoms in patients with breast cancer and survivors. J Clin Oncol 26: 768–777 (2008) 13: Brandberg Y, Sandelin K, Erikson S, Jurell G, Liljegren A, Lindblom A, Lindén A, von Wachenfeldt A, Wickman M, Arver B: Psychological reactions, quality of life, and body image after bilateral prophylactic mastectomy in women at high risk for breast cancer: a prospective 1-year follow-up study. J Clin Oncol 26: 3943-3949 (2008) 14: Brandberg Y, Michelson H, Nilsson B, Bolund C, Erikstein B, Hietanen P, Kaasa S, Nilsson J, Wiklund T, Wilking N, Bergh J; Scandinavian Breast Group Study 9401: Quality of life in women with breast cancer during the first year after random assignment to adjuvant treatment with marrow-supported highdose chemotherapy with cyclophosphamide, thiotepa, and carboplatin or tailored therapy with Fluorouracil, epirubicin, and cyclophosphamide: Scandinavian Breast Group Study 9401. J Clin Oncol 21: 3659-3664 (2003) 15: Brezden CB, Phillips KA, Abdolell M, Bunston T, Tannock IF: Cognitive function in breast cancer patients receiving adjuvant chemotherapy. J Clin Oncol 18: 2695–2701 (2000) 120 16: Bullinger M, Kirschberger J: Das SF-36 Health Survey Handbuch. HogrefeGöttingen. (1998) 17: Bullinger M, Schmidt S: Methoden zur Lebensqualitätsbewertung in der Onkologie. In: Schmoll HJ, Höffken K, Possinger K. (Hrsg.) Kompendium Internistische Onkologie. 4. Aufl., Springer, S. 2505-2516 (2006) 18: Bullinger M: Gesundheitsbezogene Lebensqualität und subjektive Gesundheit. Überblick über den Stand der Forschung zu einem neuen Evaluationskriterium in der Medizin. Psychother Psychosom Med Psychol 47: 76-91 (1997) 19: Byrne M: Cancer chemotherapy and quality of life. Br Med J 304: 1523–1524 (1992) 20: Calhoun EA, Chang C-H, Welshman EE, Cella D: The impact of chemotherapy delays on quality of life in patients with cancer. Poster presented at the 45th Annual Meeting of the American Society of Hematology. SanDiego, Calif. Abstract 2763 (2003) 21: Carey MS, Bacon M, Tu D, Butler L, Bezjak A, Stuart GC: The prognostic effects of performance status and quality of life scores on progression-free survival and overall survival in advanced ovarian cancer. Gynecol Oncol 108:100-105 (2008) 22: Carroll JK, Kohli S, Mustian KM, Roscoe JA, Morrow GR: Pharmacologic treatment of cancer-related fatigue. Oncologist 12, 43–51 (2007) 23: Cella DF, Tulsky DS, Gray G, Sarafian B, Linn E, Bonomi A, Silberman M, Yellen SB, Winicour PJ: The Functional Assessment of Cancer Therapy scale: development and validation of the general measure. J Clin Oncol 11: 570-579 (1993) 24: Chan YM, Ngan HY, Li BY, Yip AM, Ng TY, Lee PW, Yip PS, Wong LC: A longitudinal study on quality of life after gynecologic cancer treatment. Gynecol Oncol 83: 10-19 (2001) 25: Clough-Gorr KM, Ganz PA, Silliman RA: Older breast cancer survivors: factors associated with change in emotional well-being. J Clin Oncol 25: 1334-1340 (2007) 26: Coons SJ: Health-related quality of life: let's measure and report it appropriately. Clin Ther 29: 2746-2747 (2007) 121 27: Debess J, Riis JO, Pedersen L, Ewertz M: Cognitive function and quality of life after surgery for early breast cancer in North Jutland, Denmark. Acta Oncol 48: 532–540 (2009) 28: DEGRO Deutsche Gesellschaft der Radioonkologie: Radiotherapy of breast carcinoma. 2005 Version. Strahlenther Onkol 182: 4-28 (2006) 29: DKG ( Deutsche Krebsgesellschaft e.V.) und DGGG ( Deutsche Gesellschaft für Geburtshilfe und Gynäkologie): Interdisziplinäre S-3 Leitlinie für Diagnostik, Therapie und Nachsorge des Mammakarzinoms. C4. (111), C4.3.1. (113) (2008) 30: Donovan KA, Jacobsen PB, Andrykowski MA, Winters EM, Balducci L, Malik U, Kenady D, Mcgrath P: Course of fatigue in women receiving chemotherapy and/or radiotherapy for early stage breast cancer. J Pain Symptom Manage 28: 373– 380 (2004) 31: Efficace F, Kemmler G, Vignetti M, Mandelli F, Molica S, Holzner B: Healthrelated quality of life assessment and reported outcomes in leukaemia randomized controlled trials: a systematic review to evaluate the added value in supporting clinical decision making. Eur J Cancer 44: 1497–1506 (2008) 32: Efficace F, Vignetti M, Mandelli F: Asking patients with hematological malignancies: 'how do you fee?' Does it really provide independent prognostic information for survival? Eur J Haematol 82: 484–485 (2009) 33: Elliott BA, Renier CM, Haller IV, Elliott TE: Health-related quality of life (HRQoL) in patients with cancer and other concurrent illnesses. Qual Life Res 13: 457-462 (2004) 34: Fayers PM, Aarsonson NK, Bjordal K, Groenvold M, Curran D, Bottomley A, on behalf of the EORTC Quality of Life Group: The EORTC QLQ-C30 Scoring manual (3rd Edition) European Organisation for Research and Treatment of Cancer (2001) 35: Fife BL, Huster GA, Cornetta KG, Kennedy VN, Akard LP, Broun ER: Longitudinal study of adaptation to the stress of bone marrow transplantation. J Clin Oncol 18: 1539-1549 (2000) 122 36: Figueiredo MI, Cullen J, Hwang YT, Rowland JH, Mandelblatt JS: Breast cancer treatment in older women: does getting what you want improve your longterm body image and mental health? J Clin Oncol 22: 4002-4009 (2004) 37: Friedman LC, Kalidas M, Elledge R, Chang J, Romero C, Husain I, Dulay MF, Liscum KR: Optimism, social support and psychosocial functioning among women with breast cancer. Psychooncology 15: 595-603 (2006) 38: Galalae RM, Michel J, Siebmann JU, Küchler T, Eilf K, Kimmig B: Significant negative impact of adjuvant chemotherapy on health-related quality of life (HR-QoL) in women with breast cancer treated by conserving surgery and postoperative 3-D radiotherapy. A prospective measurement. Strahlenther Onkol 181: 645-651 (2005) 39: Gil F, Costa G, Pérez FJ: Does chemotherapy reduce stress? Palliat Support Care 8: 455-460 (2010) 40: Gunnars B, Nygren P, Glimelius B, Swedish Council of Technology Assessment in Health and Care, SBU-group: Assessment of quality of life during chemotherapy. Acta Oncol 40: 175-184 (2001) 41: Gupta D, Granick J, Grutsch JF, Lis CG: The prognostic association of healthrelated quality of life scores with survival in breast cancer. Support Care Cancer 15: 387-393 (2007) 42: Gupta D, Grutsch JF, Lis CG: Patient satisfaction with quality of life as a prognostic Indicator in ovarian cancer patients treated in an integrative treatment setting. J Soc Integr Oncol 6: 98-104 (2008) 43: Härtl K: Psychosomatische Aspekte in der gynäkologischen Onkologie. In: Strauss A, Janni W, Maas N (Hrsg.) Klinikmanual Gynäkologie und Geburtshilfe. Springer Verlag, Heidelberg. S. 206 (2009) 44: International Classifiacation of Functioning, Disability and Health, ICF: Internationale Klassifikation der Funktionsfähigkeit, Behinderung und Gesundheit der ICF wurde abgedruckt mit dem Einverständnis der Weltgesundheitsorganisation (WHO). Alle Rechte liegen bei der WHO (2005). 123 45. Kaufmann M, Pfleiderer A: Erkrankungen der Mamma. In: Breckwoldt M, Kaufmann M, Pfleiderer A. (Hrsg) Gynäkologie und Geburtshilfe. 5. Aufl., Georg Thieme Verlag Stuttgart, S. 241 (2008) 46: Klar M, Stickeler E: Neoplastische Veränderungen der Eileiter und Eierstöcke. In: Strauss A, Janni W, Maas N (Hrsg.) Klinikmanual Gynäkologie und Geburtshilfe. Springer Verlag, Heidelberg. S. 157, 162 (2009) 47: Kohlmann T, Bullinger M, Raspe HH: Die deutsche Version des Nottingham Health Profile (NHP)-Skalenstruktur, Übersetzungsmethode und psychometrische Validierung. Soz Präventivmed 42: 175-185 (1997) 48: Kommission Ovar der Arbeitsgemeinschaft Gynäkologische Onkologie e.V.: Interdisziplinäre S2k-Leitlinie für die Diagnostik und Therapie maligner Ovarilatumore. (2007) 49: Kornblith AB, Powell M, Regan MM, Bennett S, Krasner C, Moy B, Younger J, Goodman A, Berkowitz R, Winer E: Long-term psychosocial adjustment of older vs younger survivors of breast and endometrial cancer. Psychooncology 16: 895-903 (2007) 50: Kreienberg R, Volm T, Alt D.: Krankheitsbild Mammakarzinom. In: Kreienberg R, Volm T, Möbus V, Alt A (Hrsg.) Management des Mammakarzinoms. 2. Aufl., Springer-Verlag Berlin Heidelberg, S. 4 (2002) 51: Kreienberg R, Gossmann S, Wickert S, Bartusek G, de Gregorio N, Kurzeder Ch: Manual Onkologische Therapie der Universitäts Frauenklinik Ulm, 8. Aufl., Kap. 2, (2010) 52: Küchler T, Bestmann B: Lebensqualität in der Uroonkologie. In: Rübben H. (Hrsg.) Uroonkologie. 5. Aufl., Springer Medizin Verlag Heidelberg, S. 39 (2009) 53: Kwan ML, Ergas IJ, Somkin CP, Quesenberry CP Jr, Neugut AI, Hershman DL, Mandelblatt J, Pelayo MP, Timperi AW, Miles SQ, Kushi LH: Quality of Life among Women Recently Diagnosed with Invasive Breast Cancer: The Pathways Study. Breast Cancer Res Treat 123: 507–524 (2010) 124 54: Lakusta CM, Atkinson MJ, Robinson JW, Nation J, Taenzer PA, Campo MG: Quality of life on ovarian cancer patients receiving chemotherapy.Gynecol Oncol 81: 490–495 (2001) 55: Lee CW, Chi KN: The standart of reporting health-related quality of life in clinical cancer trials. J Clin Epidemiol 53: 451-458 (2000) 56: Lethborg CE, Kissane D, Burns WI, Snyder R: “Cast adrift": The experience of completing treatment among women with early stage breast cancer. J Psychosoc Oncol 18: 73–90 (2000) 57: Maaßen V, Pietschmann D: Epitheliale Ovarialtumoren. In: Stauber M, Weyerstahl T (Hrsg.) Gynäkologie und Geburtshilfe. 3. Aufl., Thieme Stuttgart. S. 293, 297,298 (2007) 58: Macquart-Moulin G, Viens P, Genre D, Bouscary ML, Resbeut M, Gravis G, Camerlo J, Maraninchi D, Moatti JP: Concomitant chemoradiotherapy for patients with non-metastic breast carcinoma: side effects, quality of life, and organization. Cancer 85: 2190-2199 (1999) 59: Macquart-Moulin G, Viens P, Palangié T, Bouscary ML, Delozier T, Roché H, Janvier M, Fabbro M, Moatti JP: High-dose sequential chemotherapy with recombinant granulocyte colony-stimulating factor and repeated stem cell support for inflammatory breast cancer patients: Does impact on quality of life jeopardize feasibility and acceptability of treatment? J Clin Oncol 18: 754-764 (2000) 60: Macquart-Moulin G, Viens P, Bouscary ML, Genre D, Resbeut M, Gravis G, Camerlo J, Maraninchi D, Moatti JP: Discordance between physicians' estimations and breast cancer patients' self-assessment of side-effects of chemotherapy: an issue for quality of care. Br J Cancer 76: 1640–1645 (1997) 61: Mahner S, Schwarz J, Jänicke F: Früherkennung, Vorsorge und Prophylaxe. In: Kreienberg R, du Bois A, Pfisterer J, Schindelmann S, Schmalfeldt B (Hrsg.) Management des Ovarialkarzinoms: Interdisziplinäres Vorgehen. Springer Medizin Verlag, Heidelberg, S. 60-62 (2009) 125 62: Matthews KA, Raikkonen K, Sutton-Tyrrell K, Kuller LH: Optimistic attitudes protect against progression of carotid atherosclerosis in healthy middle-aged women. Psychosom Med 66: 640-644(2004) 63: Montazeri A: Quality of life data as prognostic indicators of survival in cancer patients: an overview of the literature from 1982 to 2008. Health Qual Life Outcomes 7: 102 (2009) 64: Moore FD, Vanter SB, Boyden van de CM, Lokich J, Wilson RE: Adrenalectomy with chemotherapy in the treatment of advanced breast cancer: objective and subjective response rates, duration and quality of life. Surgery 76: 376-390 (1974) 65: Mor V, Allen S, Malin M: The psychosocial impact of cancer on older versus younger patients and their families. Cancer 74: 2118-2127. (1994) 66: Palmer BV, Walsh GA, McKinna JA, Greening WP: Adjuvant chemotherapy for breast cancer side effects and quality of life. Br Med J 281: 1594-1597 (1980) 67: Park BW, Lee S, Lee AR, Lee KH, Hwang SY: Quality of Life Differences between Younger and Older Breast Cancer Patients. J Breast Cancer. 14: 112-118 (2011) 68: Patrick DL, Deyo RA: Generic and disease-specific measures in assessing health status and quality of life. Med Care 27: 217-232 (1989) 69: Priestman TJ, Baum M: Evaluation of quality of life in patients receiving treatment for advanced breast cancer. Lancet. 1: 899-900 (1976) 70: Regierer AC, Possinger K: Mammakarzinom Manual Diagnostik Therapie. Deutscher Ärzte Verlag Köln, S. 19 (2005) 71: RKI : Krebs in Deutschland 2005/2006 Häufigkeiten und Trends. Berlin : Robert Koch-Institut und die Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V., S. 56 (2010) 72: Schneeweiss A: Grundlagen der zytostatischen Systembehandlung in der gynäkologischen Onkologie. In: Strauss A, Janni W, Maas N (Hrsg.) Klinikmanual Gynäkologie und Geburtshilfe. Springer Verlag, Heidelberg. S. 140-144 (2009) 126 73: Schwarz J, Mahner S: Tumorartige Läsionen und Tumoren der Ovarien. In: Bühling KJ, Friedmann W (Hrsg.) Intensivkurs Gynäkologie und Geburtshilfe. Elsevier - München ,Urban und Fischer. S. 413-415, S. 421 (2009) 74: Sehouli J: Tumorartige Läsionen und Tumoren der Brustdrüse. In: Bühling KJ, Friedmann W (Hrsg.) Intensivkurs Gynäkologie und Geburtshilfe. Elsevier München ,Urban und Fischer, S. 432 (2009) 75: Singletary SE, Allred C, Ashley P, Bassett LW, Berry D, Bland KI, Borgen PI, Clark G, Edge SB, Hayes DF, Hughes LL, Hutter RV, Morrow M, Page DL, Recht A, Theriault RL, Thor A, Weaver DL, Wieand HS, Greene FL: Revision of the American Joint Committee on Cancer staging system for breast cancer. J Clin Oncol. 20: 3628-3636 (2002) 76: Söllner W, Maislinger S, König A, Devries A, Lukas P: Providing psychosocial support for breast cancer patients based on screening for distress within a consultation-liaison service. Psychooncology 13: 893-897 (2004) 77: Tannenbaum C, Ahmed S, Mayo N: What drives older women’s perceptions of health-related quality of life? Qual Life Res 16: 593-605 (2007) 78: Turnbull C, Ahmed S, Morrison J, Pernet D, Renwick A, Maranian M, Seal S, Ghoussaini M, Hines S, Healey CS, Hughes D, Warren-Perry M, Tapper W, Eccles D, Evans DG: The Breast Genome-wide association study identifies five new breast cancer susceptibility loci. Nature Genetics 42: 504–507 (2010) 79: Ware JE: Standards for validating health measures. Definition and content. J Chronic Dis 40: 473-480 (1987) 80: Weigelt B, Baehner FL, Reis-Filho JS: The contribution of gene expression profiling to breast cancer classification, prognostication and prediction: a retrospective of the last decade. J Pathol. 220: 263-280 (2010) 81: Weyerstahl Th, Genz Th: Mammakarzinom. In: Stauber M, Weyerstahl T (Hrsg.) Gynäkologie und Geburtshilfe. 3. Aufl., Thieme Stuttgart. S. 372 (2007) 127 Anhang 128 129 Danksagung Ich möchte mich von Herzen bedanken bei allen Frauen, die sich dazu bereit erklärt haben an unserer Untersuchung teilzunehmen Herrn Prof. Dr. Rolf Kreienberg, der es mir ermöglicht hat in seiner Abteilung zu promovieren Frau Miriam Deniz, die mir stets mit Rat und Tat zur Seite stand Meinen Eltern, Ludger, Sandra und Rila für die liebevolle Unterstützung 130 Lebenslauf aus Gründen des Datenschutzes entfernt. 131