GEBRAUCHSINFORMATION: INFORMATION FÜR
Werbung

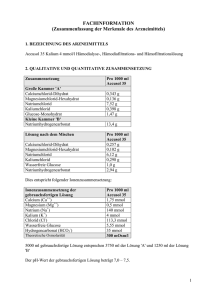
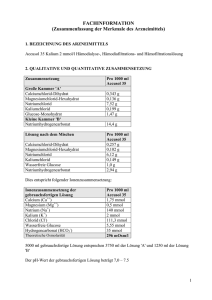
GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Prismasol 4 mmol/l Kalium Lösung für Hämofiltration/Hämodialyse Kalziumchloriddihydrat/ Magnesiumchloridhexahydrat/ Glucose-Monohydrat/ Milchsäurelösung 90 % w/w/Natriumchlorid/Kaliumchlorid/ Natriumbicarbonat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Ihnen dieses Arzneimittels verabreicht wird, denn sie enthält wichtige Informationen. . Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal . Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4. Was in dieser Packungsbeilage steht 1. Was ist Prismasol 4 mmol/l Kalium und wofür wird es angewendet? 2. Was sollten Sie beachten, bevor Ihnen Prismasol 4 mmol/l Kalium verabreicht wird? 3. Wie ist Prismasol 4 mmol/l Kalium anzuwenden? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Prismasol 4 mmol/l Kalium aufzubewahren? 6. Inhalt der Packung und weitere Informationen 1. Was ist Prismasol 4 mmol/l Kalium und wofür wird es angewendet? Die Wirkstoffe von Prismasol sind Kalziumchloriddihydrat, Magnesiumchloridhexahydrat, GlucoseMonohydrat, Milchsäurelösung 90 % w/w, Natriumchlorid, Kaliumchlorid und Natriumbicarbonat. Prismasol wird eingesetzt zur Behandlung bei Nierenversagen als Lösung für die Hämofiltration oder Hämodiafiltration (als Ersatz für die Flüssigkeit, die beim Filtern des Blutes verloren geht) sowie bei der kontinuierlichen Hämodialyse oder Hämodiafiltration (das Blut fließt auf einer Seite einer Dialysemembran, während auf der anderen Seite der Membran eine Hämodialyselösung fließt). Die Prismasol-Lösung kann auch bei Vergiftungen mit dialysierbaren oder filtrierbaren Wirkstoffen verwendet werden. Prismasol 4 mmol/l Kaliumlösung ist besonders für normokaliämische Patienten (normale Kaliumkonzentration im Blut) indiziert. 2. Was sollten Sie beachten, bevor Ihnen Prismasol 4 mmol/l Kalium verabreicht wird? Prismasol 4 mmol/l Kalium darf nicht verwendet werden: • Hyperkaliämie (hohe Kaliumkonzentration im Ihr Blut) • Metabolische Alkalose (Prozess, bei dem in erster Linie der Bicarbonatkonzentration im Plasma erhöht ist) Hämofiltration/Dialyse darf in folgenden Fällen nicht durchgeführt werden: • Nierenversagen mit ausgeprägtem Hyperkatabolismus (abnorm gesteigerter Katabolismus), wenn die urämischen Symptome (Symptome, die durch die erhöhte Harnstoffkonzentration im Blut verursacht werden) nicht durch Hämofiltration behandelt werden können • Unzureichender arterieller Blutdruck im Gefäßzugang • Systemische Antikoagulation (verminderte Blutgerinnung), wenn ein hohes Risiko für eine Blutung besteht 1/14 Warnhinweise und Vorsichtsmaßnahmen Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder dem medizinischen Fachpersonal, bevor Ihnen Prismasol verabreicht wird. Die Lösung darf nur durch einen Arzt oder unter der Anleitung eines Arztes, der speziell für die Behandlung bei Nierenversagen mit Hämofiltration, Hämodiafiltration und kontinuierlicher Hämodialyse ausgebildet ist, verwendet werden. Vor und während der Behandlung werden Ihre Blutwerte ständig überwacht, z. B. das Säure-BasenGleichgewicht und die Konzentrationen von Elektrolyten (Blutsalze). Der Blutzuckerkonzentration muss insbesondere bei Diabetikern ebenfalls ständig überwacht werden. Anwendung von Prismasol zusammen mit anderen Arzneimitteln Informieren Sie Ihren Arzt oder Apotheker, wenn Ihnen andere Arzneimittel verabreicht werden, kürzlich andere Arzneimittel verabreicht wurden oder andere Arzneimittel verabreicht werden sollen. Während der Behandlung kann die Blutkonzentration einiger der von Ihnen eingenommenen Medikamente verringert sein. Ihr Arzt wird entscheiden, ob ggf. die Medikamentenbehandlung angepasst werden muss. Informieren Sie Ihren Arzt insbesondere in den folgenden Fällen: • Digitalispräparate (zur Behandlung bestimmter Herzerkrankungen), da das Risiko einer Herzrhythmusstörung (unregelmäßige oder zu schnelle Herzfrequenz) durch die Einnahme von Digitalispräparaten in Kombination mit einer Hypokaliämie (niedrige Kaliumkonzentration im Blut) erhöht ist. • Vitamin D und Medikamente, die Kalzium enthalten, da diese das Risiko einer Hyperkalziämie (hohe Kalziumkonzentration im Blut) erhöhen können. • Jeglicher Zusatz von Natriumhydrogencarbonat, der in anderen Medikamenten enthalten ist, da dieser zu einem erhöhten Risiko einer metabolischen Alkalose (überschüssiges Bicarbonat im Blut) führen kann. Schwangerschaft und Stillzeit Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein, oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat. Wie bei allen Arzneimitteln gilt, falls Sie schwanger sind oder stillen, entscheidet Ihr Arzt über die Behandlung mit Prismasol. Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen Prismasol hat keine bekannte Wirkung auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen. 3. Wie ist Prismasol 4 mmol/l Kalium anzuwenden? Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind. Das verwendete Prismasol-Lösung Volumen hängt von Ihrem klinischen Zustand und der angestrebten Flüssigkeitsbilanz ab. Das Dosisvolumen wird daher vom zuständigen Arzt festgelegt. Darreichungsform: Intravenös, zur Hämodialyse. Eine Gebrauchsanleitung finden Sie im Abschnitt „Die folgenden Informationen sind nur für medizinisches Fachpersonal bestimmt“. Wenn Ihnen eine größere Menge von Prismasol 4 mmol/l Kalium verabreicht wurde als verabreicht werden sollte Ihre Flüssigkeitsbilanz, der Elektrolythaushalt und das Säure-Basen-Gleichgewicht werden sorgfältig 2/14 überwacht. Eine Überdosierung führt bei Nierenversagen zu Hypervolämie. Eine Überdosierung kann schwerwiegende Folgen haben, z. B. Stauungsinsuffizienz oder Entgleisung des Elektrolyt- oder Säure-Basen-Haushalts. Bei der kontinuierlichen Hämofiltration werden überschüssige Flüssigkeit und Elektrolyte entzogen. Bei einer Hyperhydratation müssen die Ultrafiltration erhöht und die Häufigkeit der Verabreichung der Lösung für die Hämofiltration verringert werden. Bei einer schweren Dehydratation muss die Ultrafiltration abgesetzt und der Zufluss der Lösung für die Hämofiltration entsprechend erhöht werden. Wenn Ihnen eine größere Menge von Prismasol verabreicht wird, kontaktieren Sie sofort Ihren Arzt, Apotheker, Pflegefachkraft oder das Antigiftzentrum (070/245 245). Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal . 4. Welche Nebenwirkungen sind möglich? Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Folgende unerwünschte Nebenwirkungen können bei der Behandlung mit der Lösung auftreten: Hyper- oder Hypohydratation (abnorm hohes oder niedriges Wasservolumen im Körper), Elektrolytentgleisung (Blutsalze), Hypophosphatämie (abnorm niedrige Phosphatkonzentration im Ihr Blut), Hyperglykämie (abnorm hoher Blutzuckerkonzentration) und metabolische Alkalose (Prozess, bei dem in erster Linie der Bicarbonatkonzentration im Plasma erhöht ist). Außerdem können unerwünschte Nebenwirkungen auftreten, die auf die Dialysebehandlung zurückzuführen sind, beispielsweise Übelkeit, Erbrechen, Muskelkrämpfe und niedriger Blutdruck. Meldung von Nebenwirkungen Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt anzeigen über: Belgien Föderalagentur für Arzneimittel und Gesundheitsprodukte Abteilung Vigilanz EUROSTATION II Victor Hortaplein, 40/40 B-1060 BRUSSEL Website: www.fagg-afmps.be E-Mail: [email protected] Luxemburg Direction de la Santé – Division de la Pharmacie et des Médicaments Villa Louvigny – Allée Marconi L-2120 Luxembourg Site internet: http://www.ms.public.lu/fr/activites/pharmaciemedicament/index.html Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden. 5. Wie ist Prismasol 4 mmol/l Kalium aufzubewahren? Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf. Nicht bei Temperaturen unter +4 °C lagern. Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und der Verpackung angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats. 3/14 Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei. 6. Inhalt der Packung und weitere Informationen Was Prismasol 4 mmol/l Kalium enthält Die Wirkstoffe sind: Vor der Mischung: 1000 ml Elektrolytlösung (kleine Kammer (A)) enthält: Kalziumchloriddihydrat 5,145 g Magnesiumchloridhexahydrat 2,033 g Glukose, wasserfrei 22,000 g (S)-Milchsäure 5,400 g 1000 ml Pufferlösung (große Kammer (B)) enthält: Natriumchlorid 6,450 g Natriumbicarbonat 3,090 g Kaliumchlorid 0, 314g Nach der Mischung: Die Lösungen in den Kammern A (250 ml) und B (4750 ml) werden zu einer gemeinsamen Lösung (5000 ml) vermischt. Diese ist folgendermaßen zusammengesetzt: Calcium Magnesium Natrium Chlorid Laktat Bicarbonat Kalium Glukose Theoretische Osmolarität: mmol/l 1,75 0,50 140,00 113,50 3,00 32,00 4,00 6,10 301 mOsm/l 2+ Ca Mg2+ Na+ ClHCO3K+ mEq/l 3,50 1,00 140,00 113,50 3,00 32,00 4,00 Die sonstigen Bestandteile sind: Kohlendioxid, Wasser für Injektionszwecke pH-Wert der rekonstituierten Lösung: 7,0–8,5 Darreichungsform und packungsinhalt Hämofiltrations-/Hämodialyselösung Prismasol ist in einem Beutel mit zwei Kammern verfügbar. Die kleine Kammer (A) enthält die Elektrolytlösung; die große Kammer (B) die Pufferlösung. Für die fertige gemeinsame Lösung müssen die Versiegelung geöffnet und die beiden Lösungen vermischt werden. Die gemeinsame Lösung ist klar und leicht gelblich. Jeder Beutel (A+B) enthält 5000 ml Lösung für die Hämofiltration und Hämodialyse. Der Beutel befindet sich in einer Umverpackung aus transparenter Folie. Jede Packung enthält zwei Beutel und eine Packungsbeilage. Pharmazeutischer Unternehmer und Hersteller Pharmazeutischer Unternehmer: Gambro Lundia AB, Magistratsvägen 16, SE-220 10 LUND, Schweden 4/14 Hersteller: Gambro Dasco S.p.A. Sondalo Plant, Via Stelvio 94, 23035 SONDALO (SO), Italien Zulassungsnummer: BE335501 Art der Abgabe: Verschreibungspflichtig. Diese Packungsbeilage wurde zuletzt überarbeitet im: 04/2016 --------------------------------------------------------------------------------------------------------------------------Die folgenden Informationen sind nur für medizinisches Fachpersonal bestimmt: Prismasol 4 mmol/l Kalium Hämofiltrations-/Hämodialyselösung Vorsichtsmaßnahmen: Befolgen Sie die Gebrauchsanweisungen genau. Die Elektrolytlösung muss vor der Verwendung mit der Pufferlösung vermischt werden, um eine für Hämofiltration, Hämodiafiltration oder kontinuierliche Hämodialyse geeignete rekonstituierte Lösung zu erhalten. Das Erwärmen der Lösung auf Körpertemperatur (+37 ºC) muss sorgfältig überwacht werden. Dabei ist darauf zu achten, dass die Lösung klar ist und keine Partikel enthält. Die Kaliämie muss sorgfältig überwacht werden, um sicherzustellen, dass die optimale Kaliumkonzentration ausgewählt wird. Die anorganische Phosphatkonzentration muss regelmäßig kontrolliert werden. Bei einer Hypophosphatämie muss das anorganische Phosphat ersetzt werden. Bei Flüssigkeitsschwankungen muss der klinische Zustand sorgfältig überwacht und der Flüssigkeitsbilanz wieder ausgeglichen werden. Bei der Verwendung kontaminierter Hämofiltrations- und Hämodialyselösung kann es zur Sepsis oder zu einem Schock kommen. Darreichungsform: Intravenös, zur Hämodialyse. Als Substitutionslösung wird Primasol vor (Prädilution) oder nach dem Hämofilter (Postdilution) zugeführt. Dosierung: Das verwendete Prismasol-Volumen hängt vom klinischen Zustand des Patienten und der angestrebten Flüssigkeitsbilanz ab. Das Dosisvolumen wird daher vom zuständigen Arzt festgelegt. Es gelten folgende Flussraten für die Substitutionslösung bei der Hämofiltration und Hämodiafiltration: Erwachsene und Jugendliche: 500–3000 ml/Stunde Kinder: 15–35 ml/kg/Stunde Für die Dialyselösung (Dialysat) bei der kontinuierlichen Hämodialyse und der kontinuierlichen Hämodiafiltration gelten folgende Flussraten: Erwachsene und Jugendliche: 500–2500 ml/Stunde Kinder: 15–30 ml/kg/Stunde Üblicherweise wird bei Erwachsenen eine Flussrate von 2000 ml/Stunde angewendet. Das entspricht einer Menge von 55 l/Tag. 5/14 Instruktionen für die Anwendung, Handhabung und Elimination: Die Lösung befindet sich in einem Beutel mit zwei Kammern. Bei der Verabreichung ist stets auf aseptische Bedingungen zu achten. Die Lösung darf nur verwendet werden, wenn sie klar und die Umverpackung unversehrt ist. Alle Versiegelungen müssen intakt sein. Wird eine Leckage festgestellt, ist die Lösung sofort zu entsorgen, da die Sterilität nicht mehr gewährleistet werden kann. Die große Kammer (B) ist mit einem Injektionsanschluss ausgestattet, über den nach der Rekonstitution der Lösung bei Bedarf weitere Medikamente verabreicht werden können. Es liegt in der Verantwortung des behandelnden Arztes, die Kompatibilität der zusätzlichen Medikation mit der Prismasol-Lösung zu beurteilen. Dabei ist auf Farbänderungen und/oder Ausfällung, nicht lösliche Bestandteile oder Kristalle zu achten. Die Gebrauchsanweisung des zusätzlichen Medikaments ist zu berücksichtigen. Bevor ein Medikament verabreicht wird, muss geprüft werden, dass dieses löslich und bei dem pHWert der Primasol-Lösung (7,0–8,5 in der gemeinsamen Lösung) stabil ist. Zusätzliche Medikamente dürfen nur auf Anweisung eines Arztes zur Lösung hinzugefügt werden. Vorgehensweise: Entfernen Sie vorhandene Flüssigkeit aus dem Injektionsanschluss. Halten Sie den Beutel falsch herum, und fügen Sie das gewünschte Medikament über den Injektionsanschluss hinzu. Mischen Sie die Lösung sorgfältig. Die Lösung muss sofort verabreicht werden. I Entfernen Sie unmittelbar vor der Verwendung die Umverpackung des Beutels, und mischen Sie die Lösungen der beiden Kammern: Halten Sie die kleine Kammer mit beiden Händen, und üben Sie Druck darauf aus, bis in der Versiegelung zwischen den beiden Kammern eine Öffnung entsteht (Abbildung I). II Drücken Sie die große Kammer mit beiden Händen, bis die Versiegelung zwischen den beiden Kammern vollständig geöffnet ist (Abbildung II). III Die Lösung muss durch leichtes Schütteln gut gemischt werden. Die Lösung kann nun verwendet werden. Hängen Sie sie am Gerät auf (Abbildung III). IV Der Substituat- oder Dialysatschlauch kann beliebig mit einem der beiden Zugangsanschlüsse verbunden werden. IV.a Entfernen Sie bei Verwendung des Luer-Zugangs die Kappe, und verbinden Sie den Luer-LockKonnektor des Dialysat- oder Substituatschlauchs mit dem Luer-Anschluss des Beutels, und achten Sie darauf, dass die Verbindung fest ist. Brechen Sie den blauen Dorn mit der Hand direkt am Ansatz ab, und bewegen Sie ihn hin und her. Verwenden Sie keine Werkzeuge. Stellen Sie sicher, dass der Dorn vollständig abgetrennt ist und die Flüssigkeit ungehindert fließen kann. Der Dorn verbleibt während der Behandlung im Luer-Anschluss (Abbildung IV.a). IV.b Entfernen Sie bei Verwendung des Injektionsanschlusses zuerst den Schnappverschluss. Führen Sie dann die Spitze durch den Gummistopfen ein. Stellen Sie sicher, dass die Flüssigkeit ungehindert fließen kann (Abbildung IV.b). Verwenden Sie ausschließlich geeignete Geräte für eine Nierenersatztherapie. Besondere Vorsichtsmaßnahmen zur Aufbewahrung: Die chemische und physikalische Anbruchstabilität der rekonstituierten Lösung wurde für 24 Stunden bei +22 °C belegt. Aus mikrobiologischer Sicht sollte die rekonstituierte Lösung sofort verwendet werden. Wird die Lösung nicht sofort verwendet, liegen andere Zeiten und Bedingungen für die Lagerung nach Herstellung einer gebrauchsfertigen Lösung in der Verantwortung des Anwenders. Die Lösung darf maximal 24 Stunden verwendet werden (einschließlich Behandlungsdauer). Die rekonstituierte Lösung ist nur für den Einmalgebrauch bestimmt. Entsorgen Sie verbleibende Lösung sofort nach der Verwendung. 6/14 7/14 GEBRAUCHSINFORMATION: INFORMATION FÜR ANWENDER Prismasol 4mmol/l Kalium Lösung für Hämofiltration/Hämodialyse Kalziumchloriddihydrat/ Magnesiumchloridhexahydrat/ Glucose-Monohydrat/ Milchsäurelösung 90 % w/w/Natriumchlorid/Kaliumchlorid/ Natriumbicarbonat Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Ihnen dieses Arzneimittels verabreicht wird, denn sie enthält wichtige Informationen. . Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen. Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4. Was in dieser Packungsbeilage steht 1. Was ist Prismasol 4 mmol/l Kalium und wofür wird es angewendet? 2. Was sollten Sie beachten, bevor Ihnen Prismasol 4 mmol/l Kalium verabreicht wird? 3. Wie ist Prismasol 4 mmol/l Kalium anzuwenden? 4. Welche Nebenwirkungen sind möglich? 5. Wie ist Prismasol 4 mmol/l Kalium aufzubewahren? 6. Inhalt der Packung und weitere Informationen 1. Was ist Prismasol 4 mmol/l Kalium und wofür wird es angewendet? Die Wirkstoffe von Prismasol sind Kalziumchloriddihydrat, Magnesiumchloridhexahydrat, GlucoseMonohydrat, Milchsäurelösung 90 % w/w, Natriumchlorid, Kaliumchlorid und Natriumbicarbonat. Prismasol wird eingesetzt zur Behandlung bei Nierenversagen als Lösung für die Hämofiltration oder Hämodiafiltration (als Ersatz für die Flüssigkeit, die beim Filtern des Blutes verloren geht) sowie bei der kontinuierlichen Hämodialyse oder Hämodiafiltration (das Blut fließt auf einer Seite einer Dialysemembran, während auf der anderen Seite der Membran eine Hämodialyselösung fließt). Die Prismasol-Lösung kann auch bei Vergiftungen mit dialysierbaren oder filtrierbaren Wirkstoffen verwendet werden. Prismasol 4 mmol/l Kaliumlösung ist besonders für normokaliämische Patienten (normale Kaliumkonzentration im Blut) indiziert. 2 Was sollten Sie beachten, bevor Ihnen Prismasol 4 mmol/l Kalium verabreicht wird? Prismasol 4 mmol/l Kalium darf nicht angewendet werden: • Hyperkaliämie (hohe Kaliumkonzentration im Ihr Blut) • Metabolische Alkalose (Prozess, bei dem in erster Linie der Bicarbonatkonzentration im Plasma erhöht ist) Hämofiltration/Dialyse darf in folgenden Fällen nicht durchgeführt werden: • Nierenversagen mit ausgeprägtem Hyperkatabolismus (abnorm gesteigerter Katabolismus), wenn die urämischen Symptome (Symptome, die durch die erhöhte Harnstoffkonzentration im Blut verursacht werden) nicht durch Hämofiltration behandelt werden können • Unzureichender arterieller Blutdruck im Gefäßzugang • Systemische Antikoagulation (verminderte Blutgerinnung), wenn ein hohes Risiko für eine Blutung besteht 8/14 Warnhinweise und Vorsichtsmaßnahmen Bitte sprechen Sie mit Ihrem Arzt, Apotheker oder dem medizinischen Fachpersonal, bevor Ihnen Prismasol verabreicht wird. Die Lösung darf nur durch einen Arzt oder unter der Anleitung eines Arztes, der speziell für die Behandlung bei Nierenversagen mit Hämofiltration, Hämodiafiltration und kontinuierlicher Hämodialyse ausgebildet ist, verwendet werden. Vor und während der Behandlung werden Ihre Blutwerte ständig überwacht, z. B. das Säure-BasenGleichgewicht und die Konzentrationen von Elektrolyten (Blutsalze). Der Blutzuckerkonzentration muss insbesondere bei Diabetikern ebenfalls ständig überwacht werden. Anwendung von Prismasol zusammen mit anderen Arzneimitteln Informieren Sie Ihren Arzt oder Apotheker, wenn Ihnen andere Arzneimittel verabreicht werden, kürzlich andere Arzneimittel verabreicht wurden oder andere Arzneimittel verabreicht werden sollen. Während der Behandlung kann die Blutkonzentration einiger der von Ihnen eingenommenen Medikamente verringert sein. Ihr Arzt wird entscheiden, ob ggf. die Medikamentenbehandlung angepasst werden muss. Informieren Sie Ihren Arzt insbesondere in den folgenden Fällen: • Digitalispräparate (zur Behandlung bestimmter Herzerkrankungen), da das Risiko einer Herzrhythmusstörung (unregelmäßige oder zu schnelle Herzfrequenz) durch die Einnahme von Digitalispräparaten in Kombination mit einer Hypokaliämie (niedrige Kaliumkonzentration im Blut) erhöht ist. • Vitamin D und Medikamente, die Kalzium enthalten, da diese das Risiko einer Hyperkalziämie (hohe Kalziumkonzentration im Blut) erhöhen können. • Jeglicher Zusatz von Natriumhydrogencarbonat, der in anderen Medikamenten enthalten ist, da dieser zu einem erhöhten Risiko einer metabolischen Alkalose (überschüssiges Bicarbonat im Blut) führen kann. Schwangerschaft und Stillzeit Wenn Sie schwanger sind oder stillen, oder wenn Sie vermuten, schwanger zu sein, oder beabsichtigen, schwanger zu werden, fragen Sie vor der Anwendung dieses Arzneimittels Ihren Arzt oder Apotheker um Rat. Wie bei allen Arzneimitteln gilt, falls Sie schwanger sind oder stillen, entscheidet Ihr Arzt über die Behandlung mit Prismasol. Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen Prismasol hat keine bekannte Wirkung auf die Verkehrstüchtigkeit oder die Fähigkeit zum Bedienen von Maschinen. 3. Wie ist Prismasol 4 mmol/l Kalium anzuwenden? Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt oder Apotheker an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind. Das verwendete Prismasol-Lösung Volumen hängt von Ihrem klinischen Zustand und der angestrebten Flüssigkeitsbilanz ab. Das Dosisvolumen wird daher vom zuständigen Arzt festgelegt. Darreichungsform: Intravenös, zur Hämodialyse. Eine Gebrauchsanleitung finden Sie im Abschnitt „Die folgenden Informationen sind nur für medizinisches Fachpersonal bestimmt“. 9/14 Wenn Ihnen eine größere Menge von Prismasol 4 mmol/l Kalium verabreicht wurde als verabreicht werden sollte Ihre Flüssigkeitsbilanz, der Elektrolythaushalt und das Säure-Basen-Gleichgewicht werden sorgfältig überwacht. Eine Überdosierung führt bei Nierenversagen zu Hypervolämie. Eine Überdosierung kann schwerwiegende Folgen haben, z. B. Stauungsinsuffizienz oder Entgleisung des Elektrolyt- oder Säure-Basen-Haushalts. Bei der kontinuierlichen Hämofiltration werden überschüssige Flüssigkeit und Elektrolyte entzogen. Bei einer Hyperhydratation müssen die Ultrafiltration erhöht und die Häufigkeit der Verabreichung der Lösung für die Hämofiltration verringert werden. Bei einer schweren Dehydratation muss die Ultrafiltration abgesetzt und der Zufluss der Lösung für die Hämofiltration entsprechend erhöht werden. Wenn Ihnen eine größere Menge von Prismasol verabreicht wird, kontaktieren Sie sofort Ihren Arzt, Apotheker, Pflegefachkraft oder das Antigiftzentrum (070/245 245). Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt, Apotheker oder das medizinische Fachpersonal . 4. Welche Nebenwirkungen sind möglich? Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen. Folgende unerwünschte Nebenwirkungen können bei der Behandlung mit der Lösung auftreten: Hyper- oder Hypohydratation (abnorm hohes oder niedriges Wasservolumen im Körper), Elektrolytentgleisung (Blutsalze), Hypophosphatämie (abnorm niedrige Phosphatkonzentration im Ihr Blut), Hyperglykämie (abnorm hoher Blutzuckerkonzentration) und metabolische Alkalose (Prozess, bei dem in erster Linie der Bicarbonatkonzentration im Plasma erhöht ist). Außerdem können unerwünschte Nebenwirkungen auftreten, die auf die Dialysebehandlung zurückzuführen sind, beispielsweise Übelkeit, Erbrechen, Muskelkrämpfe und niedriger Blutdruck. Meldung von Nebenwirkungen Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder das medizinische Fachpersonal. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt anzeigen über: Belgien Föderalagentur für Arzneimittel und Gesundheitsprodukte Abteilung Vigilanz EUROSTATION II Victor Hortaplein, 40/40 B-1060 BRUSSEL Website: www.fagg-afmps.be E-Mail: [email protected] Luxemburg Direction de la Santé – Division de la Pharmacie et des Médicaments Villa Louvigny – Allée Marconi L-2120 Luxembourg Site internet: http://www.ms.public.lu/fr/activites/pharmaciemedicament/index.html Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden. 5. Wie ist Prismasol 4 mmol/l Kalium aufzubewahren? Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf. Nicht bei Temperaturen unter +4 °C lagern. 10/14 Sie dürfen dieses Arzneimittel nach dem auf dem Etikett und dem der Verpackung angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats. Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei. 6. Inhalt der Packung und weitere Informationen Was Prismasol 4 mmol/l Kalium enthält Die Wirkstoffe sind: Vor der Mischung: 1000 ml Elektrolytlösung (kleine Kammer (A)) enthält: Kalziumchloriddihydrat 5,145 g Magnesiumchloridhexahydrat 2,033 g Glukose, wasserfrei 22,000 g (S)-Milchsäure 5,400 g 1000 ml Pufferlösung (große Kammer (B)) enthält: Natriumchlorid 6,450 g Natriumbicarbonat 3,090 g Kaliumchlorid 0, 314g Nach der Mischung: Die Lösungen in den Kammern A (250 ml) und B (4750 ml) werden zu einer gemeinsamen Lösung (5000 ml) vermischt. Diese ist folgendermaßen zusammengesetzt: Calcium Magnesium Natrium Chlorid Laktat Bicarbonat Kalium Glukose Theoretische Osmolarität: mmol/l 1,75 0,50 140,00 113,50 3,00 32,00 4,00 6,10 301 mOsm/l Ca2+ Mg2+ Na+ ClHCO3K+ mEq/l 3,50 1,00 140,00 113,50 3,00 32,00 4,00 Die sonstigen Bestandteile sind: Kohlendioxid, Wasser für Injektionszwecke pH-Wert der rekonstituierten Lösung: 7,0–8,5 Darreichungsform und packungsinhalt Hämofiltrations-/Hämodialyselösung Prismasol ist in einem Beutel mit zwei Kammern verfügbar. Die kleine Kammer (A) enthält die Elektrolytlösung; die große Kammer (B) die Pufferlösung. Für die fertige gemeinsame Lösung müssen die Versiegelung geöffnet und die beiden Lösungen vermischt werden. Die gemeinsame Lösung ist klar und leicht gelblich. Jeder Beutel (A+B) enthält 5000 ml Lösung für die Hämofiltration und Hämodialyse. Der Beutel befindet sich in einer Umverpackung aus transparenter Folie. Jede Packung enthält zwei Beutel und eine Packungsbeilage. Pharmazeutischer Unternehmer und Hersteller: 11/14 Pharmazeutischer Unternehmer: Gambro Lundia AB, Magistratsvägen 16, SE 220 10 LUND, Schweden Hersteller: Gambro Dasco S.p.A. Sondalo Plant, Via Stelvio 94, 23035 SONDALO (SO), Italien Zulassungsnummer: BE335501 Art der Abgabe: Verschreibungspflichtig. Diese Packungsbeilage wurde zuletzt überarbeitet im: 04/2016 --------------------------------------------------------------------------------------------------------------------------Die folgenden Informationen sind nur für medizinisches Fachpersonal bestimmt: Prismasol 4 mmol/l Kalium Hämofiltrations-/Hämodialyselösung Vorsichtsmaßnahmen: Befolgen Sie die Gebrauchsanweisungen genau. Die Elektrolytlösung muss vor der Verwendung mit der Pufferlösung vermischt werden, um eine für Hämofiltration, Hämodiafiltration oder kontinuierliche Hämodialyse geeignete rekonstituierte Lösung zu erhalten. Das Erwärmen der Lösung auf Körpertemperatur (+37 ºC) muss sorgfältig überwacht werden. Dabei ist darauf zu achten, dass die Lösung klar ist und keine Partikel enthält. Die Kaliämie muss sorgfältig überwacht werden, um sicherzustellen, dass die optimale Kaliumkonzentration ausgewählt wird. Die anorganische Phosphatkonzentration muss regelmäßig kontrolliert werden. Bei einer Hypophosphatämie muss das anorganische Phosphat ersetzt werden. Bei Flüssigkeitsschwankungen muss der klinische Zustand sorgfältig überwacht und der Flüssigkeitsbilanz wieder ausgeglichen werden. Bei der Verwendung kontaminierter Hämofiltrations- und Hämodialyselösung kann es zur Sepsis oder zu einem Schock kommen. Darreichungsform: Intravenös, zur Hämodialyse. Als Substitutionslösung wird Primasol vor (Prädilution) oder nach dem Hämofilter (Postdilution) zugeführt. Dosierung: Das verwendete Prismasol-Volumen hängt vom klinischen Zustand des Patienten und der angestrebten Flüssigkeitsbilanz ab. Das Dosisvolumen wird daher vom zuständigen Arzt festgelegt. Es gelten folgende Flussraten für die Substitutionslösung bei der Hämofiltration und Hämodiafiltration: Erwachsene und Jugendliche: 500–3000 ml/Stunde Kinder: 15–35 ml/kg/Stunde Für die Dialyselösung (Dialysat) bei der kontinuierlichen Hämodialyse und der kontinuierlichen Hämodiafiltration gelten folgende Flussraten: Erwachsene und Jugendliche: 500–2500 ml/Stunde Kinder: 15–30 ml/kg/Stunde 12/14 Üblicherweise wird bei Erwachsenen eine Flussrate von 2000 ml/Stunde angewendet. Das entspricht einer Menge von 55 l/Tag. Instruktionen für die Anwendung, Handhabung und Elimination: Die Lösung befindet sich in einem Beutel mit zwei Kammern. Bei der Verabreichung ist stets auf aseptische Bedingungen zu achten. Die Lösung darf nur verwendet werden, wenn sie klar und die Umverpackung unversehrt ist. Alle Versiegelungen müssen intakt sein. Wird eine Leckage festgestellt, ist die Lösung sofort zu entsorgen, da die Sterilität nicht mehr gewährleistet werden kann. Die große Kammer (B) ist mit einem Injektionsanschluss ausgestattet, über den nach der Rekonstitution der Lösung bei Bedarf weitere Medikamente verabreicht werden können. Es liegt in der Verantwortung des behandelnden Arztes, die Kompatibilität der zusätzlichen Medikation mit der Prismasol-Lösung zu beurteilen. Dabei ist auf Farbänderungen und/oder Ausfällung, nicht lösliche Bestandteile oder Kristalle zu achten. Die Gebrauchsanweisung des zusätzlichen Medikaments ist zu berücksichtigen. Bevor ein Medikament verabreicht wird, muss geprüft werden, dass dieses löslich und bei dem pHWert der Primasol-Lösung (7,0–8,5 in der gemeinsamen Lösung) stabil ist. Zusätzliche Medikamente dürfen nur auf Anweisung eines Arztes zur Lösung hinzugefügt werden. Vorgehensweise: Entfernen Sie vorhandene Flüssigkeit aus dem Injektionsanschluss. Halten Sie den Beutel falsch herum, und fügen Sie das gewünschte Medikament über den Injektionsanschluss hinzu. Mischen Sie die Lösung sorgfältig. Die Lösung muss sofort verabreicht werden. I Entfernen Sie unmittelbar vor der Verwendung die Umverpackung des Beutels, und mischen Sie die Lösungen der beiden Kammern: Halten Sie die kleine Kammer mit beiden Händen, und üben Sie Druck darauf aus, bis in der Versiegelung zwischen den beiden Kammern eine Öffnung entsteht (Abbildung I). II Drücken Sie die große Kammer mit beiden Händen, bis die Versiegelung zwischen den beiden Kammern vollständig geöffnet ist (Abbildung II). III Die Lösung muss durch leichtes Schütteln gut gemischt werden. Die Lösung kann nun verwendet werden. Hängen Sie sie am Gerät auf (Abbildung III). IV Der Substituat- oder Dialysatschlauch kann beliebig mit einem der beiden Zugangsanschlüsse verbunden werden. IV.a Bei Verwendung des Luer-An-schlusses entfernen Sie die Kappe durch Drehen und Ziehen der Kappe, verbinden Sie den Luer-Lock-Konnektor des Dialysat- oder Substituatschlauchs mit dem Luer-Anschluss des Beutels durch Drücken und Drehen, und achten Sie darauf, dass die Verbindung fest ist. Der Konnektor ist nun geöffnet. Stellen Sie sicher, dass die Flüssigkeit ungehindert fließen kann. (Abbildung IV.a) Wenn der Dialysat- oder Substituatschlauch vom Luer-Konnektor getrennt wird, schließt sich der Konnektor und der Fluss der Lösung wird gestoppt. Beim Luer-Anschluss handelt es sich um einen abtupfbaren, nadellosen Anschluss. IV.b Entfernen Sie bei Verwendung des Injektionsanschlusses zuerst den Schnappverschluss. Führen Sie dann die Spitze durch den Gummistopfen ein. Stellen Sie sicher, dass die Flüssigkeit ungehindert fließen kann (Abbildung IV.b). Verwenden Sie ausschließlich geeignete Geräte für eine Nierenersatztherapie. Besondere Vorsichtsmaßnahmen zur Aufbewahrung: Die chemische und physikalische Anbruchstabilität der rekonstituierten Lösung wurde für 24 Stunden bei +22 °C belegt. Aus mikrobiologischer Sicht sollte die rekonstituierte Lösung sofort verwendet werden. Wird die Lösung nicht sofort verwendet, liegen andere Zeiten und Bedingungen für die Lagerung nach Herstellung einer gebrauchsfertigen Lösung in der Verantwortung des Anwenders. Die Lösung darf maximal 24 Stunden verwendet werden (einschließlich Behandlungsdauer). Die rekonstituierte Lösung ist nur für den Einmalgebrauch bestimmt. Entsorgen Sie verbleibende 13/14 Lösung sofort nach der Verwendung. 14/14