Schulcurriculum Chemie - Sekundarstufe II (Std
Werbung
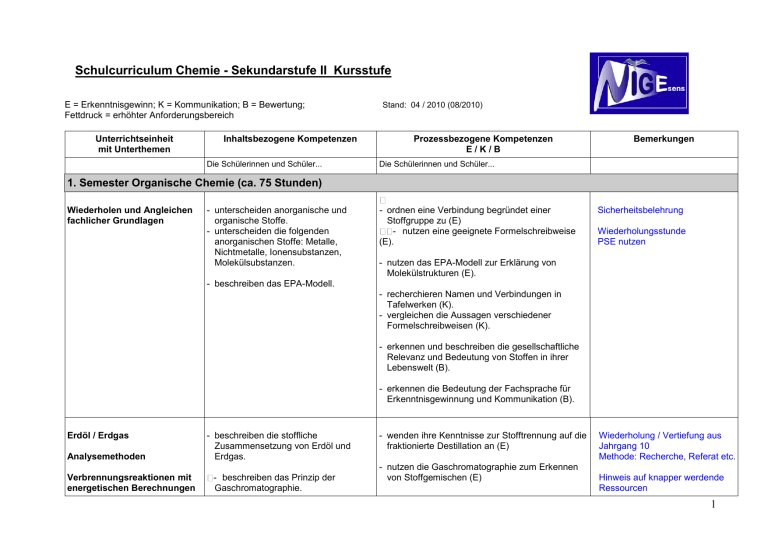
Schulcurriculum Chemie - Sekundarstufe II Kursstufe E = Erkenntnisgewinn; K = Kommunikation; B = Bewertung; Fettdruck = erhöhter Anforderungsbereich Unterrichtseinheit mit Unterthemen Inhaltsbezogene Kompetenzen Die Schülerinnen und Schüler... Stand: 04 / 2010 (08/2010) Prozessbezogene Kompetenzen E/K/B Bemerkungen Die Schülerinnen und Schüler... 1. Semester Organische Chemie (ca. 75 Stunden) Wiederholen und Angleichen fachlicher Grundlagen - unterscheiden anorganische und organische Stoffe. - unterscheiden die folgenden anorganischen Stoffe: Metalle, Nichtmetalle, Ionensubstanzen, Molekülsubstanzen. - ordnen eine Verbindung begründet einer Stoffgruppe zu (E) - nutzen eine geeignete Formelschreibweise (E). Sicherheitsbelehrung Wiederholungsstunde PSE nutzen - nutzen das EPA-Modell zur Erklärung von Molekülstrukturen (E). - beschreiben das EPA-Modell. - recherchieren Namen und Verbindungen in Tafelwerken (K). - vergleichen die Aussagen verschiedener Formelschreibweisen (K). - erkennen und beschreiben die gesellschaftliche Relevanz und Bedeutung von Stoffen in ihrer Lebenswelt (B). - erkennen die Bedeutung der Fachsprache für Erkenntnisgewinnung und Kommunikation (B). Erdöl / Erdgas Analysemethoden Verbrennungsreaktionen mit energetischen Berechnungen - beschreiben die stoffliche Zusammensetzung von Erdöl und Erdgas. - beschreiben das Prinzip der Gaschromatographie. - wenden ihre Kenntnisse zur Stofftrennung auf die fraktionierte Destillation an (E) - nutzen die Gaschromatographie zum Erkennen von Stoffgemischen (E) Wiederholung / Vertiefung aus Jahrgang 10 Methode: Recherche, Referat etc. Hinweis auf knapper werdende Ressourcen 1 Unterrichtseinheit mit Unterthemen Inhaltsbezogene Kompetenzen - beschreiben die innere Energie eines stofflichen Systems als Summe aus Kernenergie, chemischer Energie und thermischer Energie dieses Systems. - ordnen ausgewählte Stoffklassen in Form homologer Reihen. - nennen die Definition der StandardBildungsenthalpie. - nennen den ersten Hauptsatz der Thermodynamik. Prozessbezogene Kompetenzen E/K/B - erläutern schematische Darstellungen technischer Prozesse (K). Bemerkungen Treibhauseffekt - übersetzen die Alltagsbegriffe Energiequelle, Wärmeenergie, verbrauchte Energie und Energieverlust in Fachsprache (K). - reflektieren die Unschärfe von im Alltag verwendeten energetischen Begriffen (B). - nutzen tabellierte Daten zur Berechnung von Standard-Reaktionsenthalpien aus StandardBildungsenthalpien (E). - stellen die Enthalpieänderungen in einem Enthalpiediagamm dar (K). - interpretieren Enthalpiediagramme (K). - nutzen ihre Kenntnisse zur Enthalpieänderung ausgewählter Alltags- und Technikprozesse (B). - beurteilen die Energieeffizienz ausgewählter Prozesse ihrer Lebenswelt (B). - bewerten die gesellschaftliche Relevanz verschiedener Energieträger (B). Halogenalkane - beschreiben den Reaktionsmechanismus der radikalischen Substitution. radikalische Substitution - beschreiben, dass bei chemischen Reaktionen unterschiedliche Reaktionsprodukte entstehen können. - nutzen tabellierte Daten zur Berechnung von StandardReaktionsenthalpien aus StandardBildungsenthalpien. - führen Experimente zur radikalischen Substitution durch (E) - stellen Zusammenhänge zwischen den während der Reaktion konkurrierenden Teilchen und den Produkten her (E). - versprachlichen mechanistische Darstellungsweisen (K). - stellen die Aussagen eines Textes in Form eines Reaktionsmechanismus dar (K). - analysieren Texte in Bezug auf die beschriebenen Reaktionen (K). - argumentieren sachlogisch und begründen hier sind erste Enthalpieberechnungen möglich 2 Unterrichtseinheit mit Unterthemen Inhaltsbezogene Kompetenzen Prozessbezogene Kompetenzen E/K/B Bemerkungen schlüssig die entstehenden Produkte (K). - reflektieren mechanistische Denkweisen als wesentliches Prinzip der organ. Chemie (B). - reflektieren die Bedeutung von Nebenreaktionen organischer Synthesewege (B). - erkennen die Bedeutung der Fachsprache für Erkenntnisgewinnung und Kommunikation (B). Halogenalkane im Alltag - erklären Stoffeigenschaften anhand ihrer Kenntnisse über zwischenmolekulare Wechselwirkungen. auch später vergleichend möglich - planen Experimente zur Ermittlung von Stoffeigenschaften und führen diese durch (E). - nutzen ihre Kenntnisse zur Erklärung von Siedetemperaturen und Löslichkeiten(E). - verwenden geeignete Formelschreibweisen zur Erklärung von Elektronenverschiebungen(E). - stellen den Zusammenhang zwischen Molekülstruktur und Stoffeigenschaft fachsprachlich dar (K). - stellen die Elektronenverschiebung in angemessener Fachsprache dar (K). Alkene - beschreiben den Reaktionsmechanismus der elektrophilen Addition von symmetrischen Verbindungen. elektrophile Addition - beschreiben den Reaktionsmechanismus der elektrophilen Addition von asymmetrischen Verbindungen (eA). - unterscheiden zwischen homolytischer - nutzen ihre Erkenntnisse zu zwischenmolekularen Wechselwirkungen zur Erklärung von Phänomenen in ihrer Lebenswelt (B). chemische Reinigung Flammschutz - führen Experimente zur elektrophilen Addition durch (E). - leiten die Reaktionsmechanismen aus experimentellen Daten ab (E). - nutzen induktive Effekte zur Erklärung von Reaktionsmechanismen(E). - stellen Zusammenhänge zwischen den während der Reaktion konkurrierenden Teilchen und den Produkten her (E). - führen Nachweisreaktionen durch (E). jetzt Schwerpunkt Alkene mit Mechanismus keine Alkine Markownikoff nucleopiles Teilchen über Carbenium- bzw. Bromonium-Ion oder in Weiterführung der 3 Unterrichtseinheit mit Unterthemen Inhaltsbezogene Kompetenzen Prozessbezogene Kompetenzen E/K/B und heterolytischer Bindungsspaltung. Benzol aromatischer Zustand - diskutieren die Aussagekraft von Nachweisreaktionen (K). - unterscheiden radikalische, - versprachlichen mechanistische elektrophile, nucleophile Teilchen. Darstellungsweisen (K). - stellen die Aussagen eines Textes in Form - beschreiben die Reaktion mit Brom als eines Reaktionsmechanismus dar (K). Nachweis für Doppelbindungen. - analysieren Texte in Bezug auf die beschriebenen Reaktionen (K). - unterscheiden Einfach- und - argumentieren sachlogisch und begründen Mehrfachbindungen. schlüssig die entstehenden Produkte (K). Alkoholsynthese aus Halogenalkanen (hier bietet sich SN an) - beschreiben, dass bei chemischen Reaktionen unterschiedliche Reaktionsprodukte entstehen können. Halogenierung, Hydrierung, Alkoholsynthese, Polymerisation - reflektieren die Bedeutung von Nebenreaktionen organischer Synthesewege (B). - reflektieren mechanistische Denkweisen als wesentliches Prinzip d. organischen Chemie (B). - erklären die Mesomerie mithilfe von Grenzstrukturen in der LewisSchreibweise für das Benzolmolekül. - wenden das Mesomeriemodell zur Erklärung des aromatischen Zustands des Benzol-Moleküls an (E). - diskutieren die Grenzen und Möglichkeiten von Modellen (K) - beschreiben die Mesomerieenergie des Benzols (eA). - stellen die Mesomerieenergie des Benzols in einem Enthalpiediagramm dar (eA) (K). - erkennen die Bedeutung der Fachsprache für Erkenntnisgewinnung und Kommunikation (B). Makromoleküle Polymerisation Polykondensation Bemerkungen - beschreiben die Reaktionstypen Polymerisation und Polykondensation zur Bildung von Makromolekülen. - beschreiben den Reaktionsmechanismus der radikalischen Polymerisation. - beschreiben, dass bei chemischen Reaktionen unterschiedliche Reaktionsprodukte entstehen können. - führen Experimente zur Polykondensation durch (E). - nutzen ihre Kenntnisse zur Struktur von Makromolekülen zur Erklärung ihrer Stoffeigenschaften (E). - nutzen geeignete Modelle zur Veranschaulichung von Reaktionsmechanismen (E). - diskutieren die Aussagekraft von Modellen (K). Hexen, Cyclohexen, Benzol Vergleich der Reaktivität mit Brom Alternativ nach Polymerisation:Vergleich der Reaktionsfähigkeit von Styrol und Polystyrol mit Brom Polykondensation auch im 4. Semester Möglich Thermoplast, Duroplast, Elastomer 4 Unterrichtseinheit mit Unterthemen Kunststoffe Inhaltsbezogene Kompetenzen Prozessbezogene Kompetenzen E/K/B - teilen Kunststoffe in Duroplaste, Thermoplaste und Elastomere ein. - untersuchen experimentell die Eigenschaften von Kunststoffen (E). - unterscheiden die Konstitutionsisomerie und die cis-trans-Isomerie. - recherchieren zu Anwendungsbereichen makromolekularer Stoffe und präsentieren ihre Ergebnisse (K). - beurteilen und bewerten den Einsatz von Kunststoffen im Alltag (K). Bemerkungen - beurteilen und bewerten wirtschaftliche Aspekte u. Stoffkreisläufe im Sinne der Nachhaltigkeit (B). Reaktionsmechanismen Synthesewege - unterscheiden die Reaktionstypen Substitution, Addition, Eliminierung und Kondensation. Stoffkreisläufe - begründen anhand funktioneller Gruppen die Reaktionsmöglichkeiten organischer Moleküle. - stellen Flussdiagramme technischer Prozesse fachsprachlich dar (K). Aspirin-Synthese - beurteilen und bewerten die gesellschaftliche Bedeutung eines ausgewählten organischen Synthesewegs (B). - reflektieren die gesundheitlichen Risiken beim Einsatz organischer Verbindungen (B). - nutzen chemische Kenntnisse zur Erklärung der Produktlinie ausgewählter techn. Synthesen (B). - beurteilen wirtschaftliche Aspekte und Stoffkreisläufe im Sinne der Nachhaltigkeit (B). - planen Experimente für einen Syntheseweg zur Überführung einer Stoffklasse in eine andere (E). - ermitteln den Stoffumsatz bei chemischen Reaktionen (E). - beschreiben den Stoffumsatz bei chemischen Reaktionen. Inhalte auch im 4. Sem. möglich PVC-Synthese Polyethylenterephthalat Erdölprodukte CO2 Methanhydrate Müllteppich (Kunststoffabfälle in den Ozeanen) Alkan - Alken – Polymer - reflektieren Alltagszusammenhänge anhand stöchiometrischer Berechnungen (B). - planen Experimente zur Identifizierung einer Stoffklasse und führen diese durch (E). Doppelbindung Beilstein 5 Unterrichtseinheit mit Unterthemen Inhaltsbezogene Kompetenzen Prozessbezogene Kompetenzen E/K/B Bemerkungen Carbonylgruppe - diskutieren die Reaktionsmöglichkeiten funktioneller Gruppen (K). - stellen einen Syntheseweg einer organischen Verbindung dar (K). Stoffklassen / Stoffsystematik - beschreiben die Molekülstruktur und die funktionellen Gruppen folgender Stoffklassen: Alkane, Alkene, Alkanole, Ether, Alkanale, Alkanone, Alkansäuren, Aminosäuren, Ester*, Aromaten, Halogenkohlenwasserstoffe, - ordnen ausgewählte Stoffklassen in Form homologer Reihen Naturstoffe - klassifizieren folgende Naturstoffe: Proteine, Kohlenhydrate (Glucose, Fructose, Saccharose, Stärke), Fette. - ordnen ausgewählte Stoffklassen in Form homologer Reihen (E). - wenden die IUPAC-Nomenklatur zur Benennung organischer Verbindungen an (E). - nutzen geeignete Anschauungsmodelle zur Visualisierung der Struktur von Verbindungen (E). - unterscheiden Fachsprache und Alltagssprache bei der Benennung chemischer Verbindungen (K). - diskutieren die Grenzen und Möglichkeiten der Anschauungsmodelle (K). - erkennen die Bedeutung der Fachsprache für Erkenntnisgewinnung und Kommunikation (B). - untersuchen experimentell die Eigenschaften von Naturstoffen (E). - erörtern und bewerten Verfahren zur Nutzung und Verarbeitung ausgewählter Naturstoffe vor dem Hintergrund knapper werdender Ressourcen (B). Vergleich von Siedetemperatur und Löslichkeit *Ester bei chem. GGW Stärkenachweis Fehling (vgl. Redoxreaktionen im 3. Semester) Löslichkeit Schmelzverhalten Iodzahl Bioenergie Kunststoffe 6 2. Semester: Kinetik und Donator-Akzeptor-Reaktionen (ca. 65 Stunden) Kinetik und chemisches Gleichgewicht (ca. 25 Stunden) Reaktionsgeschwindigkeit - definieren den Begriff der Reaktionsgeschwindigkeit als Änderung der Konzentration pro Zeiteinheit. - planen geeignete Experimente zur Überprüfung von Hypothesen zum Einfluss von Faktoren auf die Reaktionsgeschwindigkeit und führen diese durch (E). Magnesium / Salzsäure (volumetrisch) Kalkstein / Salzsäure (gravimetrisch) Abhängigkeitsfaktoren - beschreiben die Abhängigkeit der Reaktionsgeschwindigkeit von Temperatur, Druck, Konzentration und Katalysatoren. - vergleichen den Geschwindigkeitsbegriff in Alltags- und Fachsprache (K). Internet, Literatur, außersschulische Lernorte - recherchieren zu technischen Verfahren in unterschiedlichen Quellen und präsentieren ihre Ergebnisse (K). BOLTZMANN und ARRHENIUS sind nicht vorgesehen! Katalysatoren Aktivierungsenergie Energiediagramm - beschreiben, dass Katalysatoren die Einstellung des chemischen Gleichgewichts beschleunigen. - beschreiben die Aktivierungsenergie als Energiedifferenz zwischen Ausgangszustand und Übergangszustand. - beschreiben den Einfluss eines Katalysators auf die Aktivierungsenergie. Estersynthese - beschreiben das chemische Gleichgewicht auf Stoff- und - erkennen und beschreiben die Bedeutung unterschiedlicher Reaktionsgeschwindigkeiten alltäglicher Prozesse (B). - beurteilen die Möglichkeiten der Steuerung von chemischen Reaktionen in technischen Prozessen (B). - beurteilen den Einsatz von Katalysatoren in technischen Prozessen (B). - zeichnen Energiediagramme (E). - nutzen die Modellvorstellung des Übergangszustands zur Beschreibung der Katalysatorwirkung (E). - stellen die Aktivierungsenergie als Energiedifferenz zwischen Ausgangszustand und Übergangszustand dar (K). - stellen die Wirkung eines Katalysators in einem Energiediagramm dar (K). - recherchieren zu Katalysatoren in technischen Prozessen (K). - leiten aus Versuchsdaten Kennzeichen des Modell: Stechheber oder Urnen 7 Teilchenebene. Einflüsse auf das chemische GGW Le Chatelier Massenwirkungsgesetz MWG - wenden das Prinzip von Le Chatelier an. - formulieren das MWG. - können anhand der Gleichgewichtskonstanten Aussagen zur Lage des Gleichgewichts machen. chemischen Gleichgewichts ab (E). - leiten anhand eines Modellversuchs Aussagen zum chemischen Gleichgewicht ab (E). - diskutieren die Übertragbarkeit der Modellvorstellung (K). Haber-Bosch (Anknüpfung Katalysatoren, Stoffkreisläufe, Nachhaltigkeit - übertragen chemische Sachverhalte in mathematische Darstellungen und umgekehrt (eA) (E). - berechnen Gleichgewichtskonstanten und -konzentrationen in wässrigen Lösungen (eA) (E). - argumentieren mithilfe des MWG (K). - beschreiben mathematisch Beeinflussungen des Gleichgewichts anhand des MWG (eA) (K). - beurteilen die Bedeutung der Beeinflussung von Gleichgewichten in der chemischen Industrie und in der Natur (B). Protonenübertragungsreaktionen (ca. 40 Stunden) pH-Wert - nennen die Definition des pH-Werts. - messen pH-Werte verschiedener wässriger Lösungen (E). - messen pH-Werte von Alltagsprodukten (E). - erkennen den Zusammenhang zwischen pHWert-Änderung und Konzentrationsänderung (E). - recherchieren pH-Wert-Angaben im Alltag (K). - reflektieren die Bedeutung von pH-Wert-Angaben in ihrem Alltag (B). Säuren und Base nach - erläutern die Säure-Base-Theorie - reflektieren den historischen Weg der Oxonium-Ion = H3O + 8 Brönsted nach Brönsted. Entwicklung des Säure-Base-Begriffs bis Brönsted (B). - stellen korrespondierende SäureBase-Paare auf. - verwenden die Begriffe Hydronium/ Oxonium-Ion. In bestimmten Fällen darf auch + mit H gearbeitet werden, da dieses den SuS leichter fällt. Dieses wäre ein Wasserstoff-Ion unbekannten Hydratationsgrades. veraltet: Hydronium-Ion - beschreiben die Autoprotolyse des Wassers als Gleichgewichtsreaktion. - erklären den Zusammenhang zwischen der Autoprotolyse des Wassers und dem pH-Wert. - wenden das Ionenprodukt des Wassers auf Konzentrationsberechnungen an (eA) (E). Festgelegt (20.04.2010) - beschreiben die Säurekonstante als spezielle Gleichgewichtskonstante. - erklären die Bedeutung des pKsWertes. - differenzieren starke und schwache Säuren bzw. Basen anhand der pKsund pKB-Werte. - beschreiben die Basenkonstanten als spezielle Gleichgewichtskonstante (eA). - erklären die Bedeutung des pKBWertes (eA). - lesen aus Tabellen die Säure- und Basestärke ab (E). - nutzen Tabellen zur Vorhersage von SäureBase-Reaktionen (E). - berechnen pH-Werte starker und schwacher einprotoniger Säuren (E). - wählen aussagekräftige Informationen aus (K). - argumentieren sachlogisch unter Verwendung der Tabellenwerte (K). - wenden den Zusammenhang zwischen pKS-, pKB- und pKW-Wert an (eA) (E). - schätzen anhand des pH-Werts das Gefahrenpotenzial von wässrigen Lösungen ab (B). - erklären induktive Effekte. - erklären mesomere Effekte (eA) Starke Säuren pKS < 3,5 Verdauung, Laugenbrezel - nutzen induktive Effekte zur Erklärung der Stärke organischer Säuren (E) - nutzen induktive und mesomere Effekte zur Erklärung der Stärke organischer Säuren (eA) (E). - ermitteln experimentell die Säurestärke einprotoniger Säuren (E). 9 - stellen Protolysegleichungen dar (K). - recherchieren zu Säuren und Basen in Alltags-, Technik- und Umweltbereichen und präsentieren ihre Ergebnisse (K). - beurteilen exemplarisch die physiologische Bedeutung von sauren und alkalischen Systemen (B). - wenden ihre Kenntnisse über Säuren und Basen in Alltags-, Technik- und Umweltbereichen an (B). - beurteilen und bewerten den Einsatz und das Auftreten von Säuren und Basen in Alltags-, Technik- und Umweltbereichen (B). Säure-Base-Indikatoren - beschreiben die Funktion von Säure-Base-Indikatoren. - nutzen Tabellen zur Auswahl eines geeigneten Indikators (E). - beschreiben Indikatoren als schwache Brönsted-Säuren bzw. -Base (eA). Säure-Base-Puffer - beschreiben Puffersysteme. - interpretieren Puffersysteme (eA). - deuten qualitativ Puffersysteme mit der Säure-Base-Theorie nach Brönsted. - ermitteln die Funktionsweise von Puffern im Experiment (E). - wenden die Henderson-HasselbalchGleichung an (eA) (E). - recherchieren exemplarisch zu Puffergleich- - deuten Puffergleichgewichte gewichten in Umwelt und biologischen Systemen und präsentieren ihre Ergebnisse (K). quantitativ als Säure-BaseGleichgewichte (eA). - nutzen ihre Kenntnisse über Puffergleichgewichte Puffersysteme im Blut zur Erklärung von Beispielen aus Umwelt und biologischen Systemen (B). - beurteilen exemplarisch die physiologische Bedeutung von sauren und alkalischen Systemen (B). 10 Titrationen - erklären die Neutralisationsreaktion. Titrationskurven - ermitteln titrimetrisch die Konzentration verschiedener Säure-Base-Lösungen (E). - nehmen Titrationskurven einprotoniger Säuren auf (E). - wenden ihre Kenntnisse zu einprotonigen Säuren auf mehrprotonige Säuren an (E). - erklären qualitativ den Kurvenverlauf (E). - erklären quantitativ charakteristische Punkte des Kurvenverlaufs (eA) (E). Salzsäure, Essigsäure-Lösung Natronlauge, Ammoniak-Lösung - stellen Daten in geeigneter Form dar (K). - präsentieren und diskutieren Titrationskurven (K). - erkennen und beschreiben die Bedeutung maßanalytischer Verfahren (B). verschiedene Titrationskurven Schwefelsäure-Lösung Phosphorsäure-Lösung Möglichkeit der Wiederholung: Induktiver Effekt an chlorierten Essigsäuren - berechnen charakteristische Punkte der - Titrationskurven einprotoniger Säuren (eA) (E). ermitteln grafisch den Halbäquivalenzpunkt (eA) (E). - werten Titrationskurven in Hinblick auf den - Energetik - ermitteln Reaktionsenthalpien kalorimetrisch. - nutzen tabellierte Daten zur Berechnung von StandardReaktionsenthalpien aus StandardBildungsenthalpien. Pufferbereich aus (eA) (K). stellen Puffergleichgewichte in Form von Protolysegleichungen, HendersonHasselbalch-Gleichung und Abschnitten von Titrationskurven dar und verknüpfen diese (eA) (K). Neutralisationsreaktion aus energetischer Sicht 11 3. Semester: Elektronenübertragungsreaktionen (Redoxreaktionen / Elektrochemie) (ca. 75 Stunden) Redoxreaktionen - erläutern Redoxreaktionen als Elektronenübertragungsreaktionen. - stellen Redoxgleichungen in Form von Teil- und Gesamtgleichungen dar (K). - beschreiben mithilfe der Oxidationszahlen korrespondierende Redoxpaare. - wenden Fachbegriffe zur Redoxreaktion an (K). - wenden ihre Kenntnisse zu Redoxreaktionen auf Alkanole und ihre Oxidationsprodukte an. Galvanische Zelle - reflektieren die historische Entwicklung des Oxidationsbegriffs (B). - erkennen und beschreiben die Bedeutung von Redoxreaktionen im Alltag (B). - beschreiben die Fehling-Probe als Nachweise für reduzierend wirkende organische Verbindungen. - beschreiben die Iod-Stärke-Reaktion. - planen Experimente zur Aufstellung der Redoxreihe der Metalle und führen diese durch (E). - erläutern den Bau von galvanischen Zellen. - erläutern die Funktionsweise von galvanischen Zellen. - messen die Spannung unterschiedlicher galvanischer Zellen (E). - planen Experimente zum Bau funktionsfähiger galvanischer Zellen und führen diese durch (E). - stellen galvanische Zellen in Form von Skizzen dar (K). Iodnachweis mit Stärkelösung nach Iodidoxidation - beschreiben die elektrochemische - stellen die elektrochemische Doppelschicht als Doppelschicht als Redoxgleichgewicht. Modellzeichnung dar (K). - beschreiben die galvanische Zelle als Kopplung zweier Redoxgleichgewichte. Standardelektroden-Potential - beschreiben den Aufbau der Standard- - lesen aus Tabellen die Standard-Potenziale ab Wasserstoffelektrode. (E). - nennen die Definition und die - nutzen Tabellen zur Vorhersage des Ablaufs von Bedeutung des Standard-Potenzials. Redoxreaktionen (E). - berechnen die Spannung galvanischer Elemente unter Standardbedingung (E). 12 - wählen aussagekräftige Informationen aus (K). - argumentieren sachlogisch unter Verwendung der Tabellenwerte (K). - stellen die Potenzialdifferenzen in einer grafischen Übersicht dar (K). NERNSTsche Gleichung - beschreiben die Abhängigkeit der Standard-Potenziale von der Konzentration anhand der vereinfachten NERNST-Gleichung (eA). - berechnen die Potenziale von MetallHalbzellen verschiedener Konzentrationen (eA) (E). - stellen die Konzentrationsabhängigkeit des Potenzials in einem Diagramm dar (eA) (E). Elektrolyse - erläutern den Bau von Elektrolysezellen. - erläutern das Prinzip der Elektrolyse. - führen Experimente zur Umkehrbarkeit der Reaktionen der galvanischen Zelle durch (E). - stellen Elektrolysezellen in Form von Skizzen dar (K). - deuten die Elektrolyse als Umkehr des galvanischen Elements. - vergleichen Elektrolysezelle und galvanische Zelle (K). Nichtmetall, pH-Abhängigkeit möglich - erläutern Darstellungen zu technischen Anwendungen (K). - recherchieren zu Redoxreaktionen in Alltag und Technik und präsentieren ihre Ergebnisse (K). - nutzen ihre Kenntnisse über Redoxreaktionen zur Erklärung von Alltags- und Technikprozessen (B). - bewerten den Einsatz und das Auftreten von Redoxsystemen in Alltag und Technik (B). Primär- und Sekundärelemente: Batterien, Akkumulatoren, Brennstoffzellen - nennen die prinzipiellen Unterschiede zwischen Batterien, Akkumulatoren und Brennstoffzellen. - strukturieren ihr Wissen zu Batterien, Akkumulatoren und Brennstoffzellen (E). - entwickeln Kriterien zur Beurteilung von technischen Systemen (E). Energiespeicher Aufladbarkeit - recherchieren exemplarisch zu Batterien, 13 Akkumulatoren und Brennstoffzellen und präsentieren ihre Ergebnisse (K). - nutzen ihre Kenntnisse über elektrochemische Energiequellen zur Erklärung ausgewählter Alltags- und Technikprozesse (B). - beurteilen und bewerten den Einsatz elektrochemischer Energiequellen (B). Donator-Akzeptor-Prinzip - vergleichen Säure-Base- und Redoxreaktionen. - erfassen, dass Donator-AkzeptorReaktionen chemische Gleichgewichte sind. Energiebegriff - beschreiben die innere Energie eines stofflichen Systems als Summe aus Kernenergie, chemischer Energie und thermischer Energie dieses Systems. - übersetzen die Alltagsbegriffe Energiequelle, Wärmeenergie, verbrauchte Energie und Energieverlust in Fachsprache (K). - reflektieren die Unschärfe von im Alltag verwendeten energetischen Begriffen (B). Reaktionsenthalpie - beschreiben die Enthalpieänderung als ausgetauschte Wärme bei konstantem Druck. - nennen die Definition der StandardBildungsenthalpie. Gibbs-Helmholtz - nennen die Gibbs-HelmholtzGleichung (eA). - beschreiben die Entropie als Maß der Unordnung eines Systems (eA). - erläutern das Wechselspiel zwischen Enthalpie und Entropie als Kriterium für den freiwilligen Ablauf chemischer Prozesse (eA). - beschreiben Energieentwertung als Zunahme der Entropie (eA). Entropie - führen Berechnungen mit der Gibbs-Helmholtz-Gleichung durch (eA) (E). - nutzen ihre Kenntnisse zur Entropie für eine philosophische Sicht auf unsere Welt (eA) (B). 14 4. Semester: Chemie im Alltag (ca. 30 Stunden) Mögliche Inhalte: Kunststoffe Polyaddition, Polykondensation Rohstoff, Müll, Recycling Spezialkunststoffe Waschmittel Lösungsvorgänge Struktur-Eigenschafts-Beziehungen Löslichkeitsgleichgewichte Duft- Aromastoffe Ester (Synthese, Reaktionsmechanismus) Carbonylverbindungen Carbonsäureester Amine MAILLARD-Reaktion Mobilität im Alltag Energieträger, Energetik, Elektrochemie Rohstoffe Verbrennungsmotoren Autoabgaskatalysator Brennstoffzelle Aluminium Wasser Trinkwasser, Belastung von Gewässern (Einfluss der Landwirtschaft, umweltgerechtes Handeln im Alltag) Wasserhärte Kläranlage Analytische Verfahren als Redoxtitrationen (Rücktitration, Mangano-, Iodmetrie, Leitfähigkeit) Genaue Festlegung der Themen erfolgt in Absprache mit dem jeweiligen Kurs Biomembran 15