Document
Werbung

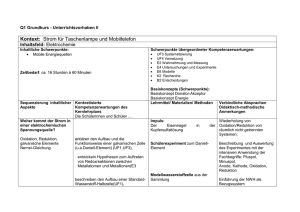
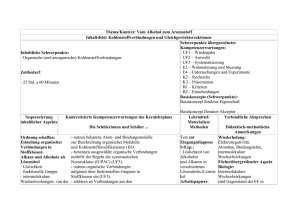
Schulinterner Lehrplan AFG zum Kernlehrplan für die gymnasiale Oberstufe Chemie (Entwurfsstand: 19.03.2014) 1.1 Übersichtsraster Unterrichtsvorhaben Einführungsphase Unterrichtsvorhaben II: Unterrichtsvorhaben I: Kontext: Nicht nur Graphit und Diamant – Erscheinungsformen des Kontext: Kohlenstoffdioxid und das Klima – Die Bedeutung der Ozeane Kohlenstoffs Schwerpunkte übergeordneter Kompetenzerwartungen: Schwerpunkte übergeordneter Kompetenzerwartungen: UF4 Vernetzung E6 Modelle E7 Arbeits- und Denkweisen K3 Präsentation E1 Probleme und Fragestellungen E4 Untersuchungen und Experimente K4 Argumentation B3 Werte und Normen B4 Möglichkeiten und Grenzen Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltlicher Schwerpunkt: Nanochemie des Kohlenstoffs Inhaltliche Schwerpunkte: (Organische und) anorganische Kohlenstoffverbindungen Gleichgewichtsreaktionen Stoffkreislauf in der Natur Zeitbedarf: ca. 8 Std. à 45min Unterrichtsvorhaben III: Zeitbedarf: ca. 22 Std. à 45 min Unterrichtsvorhaben IV: Kontext: Methoden der Kalkentfernung im Haushalt Kontext: Vom Alkohol zum Aromastoff Schwerpunkte übergeordneter Kompetenzerwartungen: Schwerpunkte übergeordneter Kompetenzerwartungen: UF1 Wiedergabe UF3 Systematisierung E3 Hypothesen E5 Auswertung K1 Dokumentation Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltlicher Schwerpunkt: Gleichgewichtsreaktionen Zeitbedarf: ca. 18 Std. à 45 min UF2 Auswahl UF3 Systematisierung E2 Wahrnehmung und Messung E4 Untersuchungen und Experimente K 2 Recherche K3 Präsentation B1 Kriterien B2 Entscheidungen Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltlicher Schwerpunkt: Organische (und anorganische) Kohlenstoffverbindungen Zeitbedarf: ca. 38 Std. à 45 min Summe Einführungsphase: 86 Stunden 1.2 Einführungsphase - Unterrichtsvorhaben I Kontext: Vom Alkohol zum Aromastoff Basiskonzepte (Schwerpunkt): Basiskonzept Struktur – Eigenschaft, Basiskonzept Donator - Akzeptor Basiskonzept Chemisches Gleichgewicht Schwerpunkte übergeordneter Kompetenzerwartungen: Die Schülerinnen und Schüler können Kompetenzbereich Umgang mit Fachwissen: ausgewählte Phänomene und Zusammenhänge erläutern und dabei Bezüge zu übergeordneten Prinzipien, Gesetzen und Basiskonzepten der Chemie herstellen, (UF1). zur Lösung von Problemen in eingegrenzten Bereichen chemische Konzepte auswählen und anwenden und dabei Wesentliches von Unwesentlichem unterscheiden (UF2). die Einordnung chemischer Sachverhalte und Erkenntnisse in gegebene fachliche Strukturen begründen (UF3). Kompetenzbereich Erkenntnisgewinnung: kriteriengeleitet beobachten und erfassen und gewonnene Ergebnisse frei von eigenen Deutungen beschreiben (E2). zur Klärung chemischer Fragestellungen begründete Hypothesen formulieren und Möglichkeiten zu ihrer Überprüfung angeben (E3), unter Beachtung von Sicherheitsvorschriften einfache Experimente zielgerichtet planen und durchführen und dabei mögliche Fehler betrachten (E4). Daten bezüglich einer Fragestellung interpretieren, da-raus qualitative und quantitative Zusammenhänge ab-leiten und diese in Form einfacher funktionaler Beziehungen beschreiben (E5), Modelle begründet auswählen und zur Beschreibung, Erklärung und Vorhersage chemischer Vorgänge verwenden, auch in einfacher formalisierter oder mathematischer Form (E6). Kompetenzbereich Kommunikation: Fragestellungen, Untersuchungen, Experimente und Daten nach gegebenen Strukturen dokumentieren und stimmig rekonstruieren, auch mit Unterstützung digita-ler Werkzeuge (K1), 3 in vorgegebenen Zusammenhängen selbstständig chemische und anwendungsbezogene Fragestellungen mithilfe von Fachbüchern und anderen Quellen bearbeiten (K 2). chemische Sachverhalte, Arbeitsergebnisse und Er-kenntnisse adressatengerecht sowie formal, sprach-lich und fachlich korrekt in Kurzvorträgen oder kurzen Fachtexten darstellen (K3). Kompetenzbereich Bewertung: bei Bewertungen in naturwissenschaftlich-technischen Zusammenhängen Bewertungskriterien angeben und begründet gewichten (B 1). für Bewertungen in chemischen und anwendungsbezogenen Zusammenhängen kriteriengeleitet Argumente abwägen und einen begründeten Standpunkt beziehen (B 2). Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Organische (und anorganische) Kohlenstoffverbindungen Gleichgewichtsreaktionen Zeitbedarf: ca. 38 Std. à 45 Minuten 1.2 Konkretisierte Unterrichtsvorhaben Einführungsphase Unterrichtsvorhaben I Kontext: Vom Alkohol zum Aromastoff Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Schwerpunkte übergeordneter Kompetenzerwartungen: Organische (und anorganische) Kohlenstoffverbindungen UF 1 Wiedergabe Gleichgewichtsreaktionen UF 2 Auswahl UF 3 Systematisierung E2 Wahrnehmung und Experimente E3 Hypothesen Zeitbedarf: 38 Std. à 45 Minuten E4 Untersuchungen und Experimente E5 Auswertung E6 Modelle K1 Dokumentation K2 Recherche K3 Präsentation B1 Kriterien B2 Entscheidungen Sequenzierung inhaltlicher Aspekte Konkretisierte Kompetenzerwartungen des Kernlehrplans Die Schülerinnen und Schüler ... Basiskonzepte (Schwerpunkt): Basiskonzept Struktur-Eigenschaft Basiskonzept Chemisches Gleichgewicht Basiskonzept Donator-Akzeptor Lehrmittel/ Materialien/ Methoden Verbindliche Absprachen Didaktischmethodische Anmerkungen 5 Reagenzglas ohne Etikett – ein Organik–Praktikum Lernprogramm: ordnen organische Verbindungen aufgrund ihrer funktionellen Gruppen in Stoffklassen ein (UF3), benennen ausgewählte organische Verbindungen mithilfe der Regeln der systematischen Nomenklatur (IUPAC) (UF3), erläutern ausgewählte Eigenschaften organischer Verbindungen mit Wechselwirkungen zwischen den Molekülen (u.a. Wasserstoffbrücken, Van-der-Waals-Kräfte) (UF1, UF3), führen qualitative Versuche unter vorgegebener Fragestellung durch und protokollieren die Beobachtungen (u.a. zur Untersuchung der Eigenschaften organischer Verbindungen) (E2, E4), nutzen bekannte Atom- und Bindungsmodelle zur Beschreibung orga-nischer Moleküle und Kohlenstoffmodifikationen (E6), stellen anhand von Strukturformeln Vermutungen zu Eigenschaften ausgewählter Stoffe auf und schlagen geeignete Experimente zur Überprüfung vor (E3), dokumentieren Experimente in angemessener Fachsprache (u.a. zur Untersuchung der Eigenschaften 28RAAbits Chemie, August 2009 Der Einstieg dient zur Anknüpfung an die Vorkenntnisse aus der SI und anderen Fächern: Nomenklatur, Stoffeigenschaften, Molekülstruktur und Bindungsmodelle, Experimentalmetho den organischer Verbindungen, zur Einstellung eines chemischen Gleichgewichts, zu Stoffen und Reaktionen eines natürlichen Kreislaufes) (K1), nutzen angeleitet und selbstständig chemiespezifische Tabellen und Nachschlagewerke zur Planung und Auswertung von Experimenten und zur Ermittlung von Stoffeigenschaften (K2), beschreiben und visualisieren anhand geeigneter Anschauungsmodel-le die Strukturen organischer Verbindungen (K3), Ordnung schaffen: Einteilung organischer Verbindungen in Stoffklassen 1. Teil o Kettenförmige Kohlenwasserstoffe (Alkane, Alkene, Alkine) wählen bei der Darstellung chemischer Sachverhalte die jeweils angemessene Formelschreibweise aus (Verhältnisformel,Summenformel, Strukturformel) (K3), erklären an Verbindungen aus den Stoffklassen der Alkane und Alkene das C-C-Verknüpfungsprinzip (UF2), beschreiben den Aufbau einer homologen Reihe und die Strukturisomerie (Gerüstisomerie und Positionsisomerie) am Beispiel der Alkane (UF1, UF3), benennen ausgewählte organische Verbindungen mithilfe der Regeln der o Die homologe Reihe systematischen Nomenklatur (IUPAC) Lernprogramm: WEKA Chemie, Kettenförmige Kohlenwasserstoffe WEKA Chemie, 7 der n-Alkane o Nomenklaturregeln für einfache Alkane Große Vielfalt durch ein einfaches Bauprinzip Die homologe Reihe der n-Alkane (UF3), erläutern ausgewählte Eigenschaften organischer Verbindungen mit Wechselwirkungen zwischen den Molekülen (u.a. Wasserstoffbrücken, Van-der-Waals-Kräfte) (UF1, UF3), Lernprogramm: RAAbits Chemie IIC 4. Lernprogramm: 25 RAAbits Chemie IIH 15., nutzen bekannte Atom- und Bindungsmodelle zur Beschreibung orga-nischer Moleküle (E6), stellen anhand von Strukturformeln Vermutungen zu Eigenschaften ausgewählter Stoffe auf und schlagen geeignete Experimente zur Überprüfung vor (E3), nutzen angeleitet und selbstständig chemiespezifische Tabellen und Nachschlagewerke zur Planung und Auswertung von Experimenten und zur Ermittlung von Stoffeigenschaften (K2), beschreiben und visualisieren anhand geeigneter Anschauungsmodel-le die Strukturen organischer Verbindungen (K3), Bioethanol – ein brauchbarer wählen bei der Darstellung chemischer Sachverhalte die jeweils angemessene Formelschreibweise aus (Verhältnisformel,Summenformel, Strukturformel) (K3), beschreiben Zusammenhänge zwischen Vorkommen, Verwendung Benzinersatz und Eigenschaften wichtiger Vertreter der Stoffklassen der Alkohole (UF2), ordnen organische Verbindungen aufgrund ihrer funktionellen Gruppen in Stoffklassen ein (UF3), erläutern ausgewählte Eigenschaften organischer Verbindungen mit Wechselwirkungen zwischen den Molekülen (u.a. Wasserstoffbrücken, Van-der-Waals-Kräfte) (UF1, UF3), führen qualitative Versuche unter vorgegebener Fragestellung durch und protokollieren die Beobachtungen (u.a. zur Untersuchung der Eigenschaften organischer Verbindungen) (E2, E4), stellen anhand von Strukturformeln Vermutungen zu Eigenschaften ausgewählter Stoffe auf und schlagen geeignete Experimente zur Überprüfung vor (E3), zeigen Vor- und Nachteile ausgewählter Produkte des Alltags (Alkohole) und ihrer Anwendung auf, gewichten diese und beziehen begründet Stellung zu deren Einsatz (B1, B2), beschreiben und bewerten die gesellschaftliche Relevanz prognostizierter Folgen des anthropogenen Treibhauseffektes (B3), 9 Chemie der Alkanole o Oxidation von Alkoholen o Redoxreaktionen von Carbonylverbindungen o Aufstellung von Redoxschemata unter Verwendung von Oxidationszahlen o Regeln zum Aufstellen von Redoxschemata o Strukturisomerie und Nomenklatur einfacher und mehrwertiger Alkohole, Aldehyde, Ketone und Carbonsäuren beschreiben Zusammenhänge zwischen Vorkommen, Verwendung und Eigenschaften wichtiger Vertreter Experimente der Stoffklassen der Alkohole, Aldehyde, Ketone, Carbonsäuren (UF2), TOLLENS-Probe, FEHLING-Reaktion erklären die Oxidationsreihen der Alkohole auf molekularer Ebene und ordnen den Atomen Oxidationszahlen zu (UF2), ordnen organische Verbindungen aufgrund ihrer funktionellen Gruppen in Stoffklassen ein (UF3), beschreiben den Aufbau einer homologen Reihe und die Strukturisomerie (Gerüstisomerie und Positionsisomerie) am Beispiel der Molekülbaukasten Alkohole (UF1, UF3), benennen ausgewählte organische Verbindungen mithilfe der Regeln der systematischen Nomenklatur (IUPAC) (UF3), erläutern ausgewählte Eigenschaften organischer Verbindungen mit Wechselwirkungen zwischen den Molekülen (u.a. Wasserstoffbrücken, Van-der-Waals-Kräfte) (UF1, UF3), stellen anhand von Strukturformeln Vermutungen zu Eigenschaften ausgewählter Stoffe auf und schlagen geeignete Experimente zur Überprüfung vor (E3), Quantitative Betrachtungen chemischer Reaktionen am Beispiel von Octan beschreiben Beobachtungen von Experimenten zu Oxidationsreihen der Alkohole und interpretieren diese unter dem Aspekt des Donator-AkzeptorPrinzips (E2, E6), nutzen angeleitet und selbstständig chemiespezifische Tabellen und Nachschlagewerke zur Planung und Auswertung von Experimenten und zur Ermittlung von Stoffeigenschaften (K2), beschreiben und visualisieren anhand geeigneter Anschauungsmodel-le die Strukturen organischer Verbindungen (K3), analysieren Aussagen zu Produkten der organischen Chemie (u.a. aus der Werbung) im Hinblick auf ihren chemischen Sachgehalt und korrigieren unzutreffende Aussagen sachlich fundiert (K4), zeigen Vor- und Nachteile ausgewählter Produkte des Alltags (u.a. Aromastoffe, Alkohole) und ihrer Anwendung auf, gewichten diese und beziehen begründet Stellung zu deren Einsatz (B1, B2), führen grundlegende stöchiometrische Arbeitsblätter Berechnungen durch (UF1, E5) 11 Alkohol im menschlichen Körper (fakultativ) o Ethanal als Zwischenprodukt der Oxidation o Nachweis der Alkanale o Biologische Wirkungen des Alkohols o Berechnung des Blutalkoholgehaltes o Alkoteströhrchen Am Ziel: Mit Alkoholen und Carbonsäuren zu den Aromastoffen Estersynthese, Esterhydrolyse Natürliche, naturidentische und künstliche Aromastoffe recherchieren angeleitet und unter vorgegebenen Fragestellungen Eigenschaften und Verwendungen ausgewählter Stoffe und präsentieren die Rechercheergebnisse adressatengerecht (K2, K3), zeigen Vorund Nachteile ausgewählter Produkte des Alltags (u.a. Aromastoffe, Alkohole) und ihrer Anwendung auf, gewichten diese und beziehen begründet Stellung zu deren Einsatz (B1, B2), beispielhafte Darstellung alkoholischer Getränke in der Geschichte (Bier, Wein, Branntwein) beschreiben Zusammenhänge zwischen Vorkommen, Verwendung und Eigenschaften wichtiger Vertreter der Stoffklassen der Alkohole, Aldehyde, Ketone, Carbonsäuren und Ester (UF2), beschreiben und visualisieren anhand geeigneter Anschauungsmodel-le die Strukturen organischer Verbindungen (K3), benennen ausgewählte organische Verbindungen mithilfe der Regeln der systematischen Nomenklatur (IUPAC) (UF3), ordnen Veresterungsreaktionen dem Reaktionstyp der Kondensations- Exp. Estersynthesen im Reagenzglas Einsatz von Alkoteströhrchen Demo-Exp. Esterhydrolyse im Reagenzglas Exp.: gleiche Ansätze Essigsäure/Ethanol und Ethansäureethylester/Wasser, Bestimmung des Gehaltes an Essigsäure nach drei Tagen durch Titration, Rückschluss auf Stoffmengenkonzentration aller Reaktionsteilnehmer, Entdeckung und Erklärung des chem. Gleichgewichts Wasserheberversuch Exp. z. B. mit Eisenchlorid und „Sie tranken den Met, bis keiner mehr steht!“ Veresterung und Esterhydrolyse – umkehrbare Reaktionen und das chemische Gleichgewicht Modelle zum chemischen Gleichgewicht reaktion begründet zu (UF1), zeigen Vorund Nachteile ausgewählter Produkte des Alltags (u.a. Aromastoffe, Alkohole) und ihrer Anwendung auf, gewichten diese und beziehen begründet Stellung zu deren Einsatz (B1, B2), dokumentieren Experimente in angemessener Fachsprache (u.a. zur Untersuchung der Eigenschaften organischer Verbindungen, zur Einstellung eines chemischen Gleichgewichts, zu Stoffen und Reaktionen eines natürlichen Kreislaufes) (K1), erläutern die Merkmale eines chemischen Gleichgewichtszustands an ausgewählten Beispielen (UF1), stellen für Reaktionen zur Untersuchung der Reaktionsgeschwindigkeit den Stoffumsatz in Abhängigkeit von der Zeit tabellarisch und graphisch dar (K1), formulieren für ausgewählte Gleichgewichtsreaktionen das Massenwir-kungsgesetz (UF3), interpretieren Gleichgewichtskonstanten in Bezug auf die Gleichge-wichtslage (UF4), beschreiben und erläutern das chemische Gleichgewicht mithilfe von Kaliumthiocyanat zum chem. Gleichgewicht (Nachweis, Existenz, Wiederholung Merkmale des chem. Gleichgewichts, Beeinflussung durch Konzentrationsänderungen 13 an ausgewählten Beispielen Modellen (E6), erläutern an ausgewählten Reaktionen die Beeinflussung der Gleichgewichtslage durch eine Konzentrationsänderung (bzw. Stoffmen-genänderung), Temperaturänderung (bzw. Zufuhr oder Entzug von Wärme) und Druckänderung (bzw. Volumenänderung) (UF3), formulieren für ausgewählte Gleichgewichtsreaktionen das Massenwir-kungsgesetz (UF3), interpretieren Gleichgewichtskonstanten in Bezug auf die Gleichge-wichtslage (UF4), Diagnose von Schülerkonzepten: Protokolle, Auswertung Trainingsausgaben Leistungsbewertung: Klausur, Schriftliche Übung, mündliche Beiträge, Versuchsprotokolle 1.2 Einführungsphase - Unterrichtsvorhaben II Kontext: Methoden der Kalkentfernung im Haushalt Basiskonzepte (Schwerpunkt): Basiskonzept Struktur – Eigenschaft Basiskonzept Chemisches Gleichgewicht Schwerpunkte übergeordneter Kompetenzerwartungen: Die Schülerinnen und Schüler können Kompetenzbereich Umgang mit Fachwissen: ausgewählte Phänomene und Zusammenhänge erläutern und dabei Bezüge zu übergeordneten Prinzipien, Gesetzen und Basiskonzepten der Chemie herstellen (UF1), die Einordnung chemischer Sachverhalte und Erkenntnisse in gegebene fachliche Strukturen begründen (UF3). Kompetenzbereich Erkenntnisgewinnung: zur Klärung chemischer Fragestellungen begründete Hypothesen formulieren und Möglichkeiten zu ihrer Überprüfung angeben (E3), Daten bezüglich einer Fragestellung interpretieren, daraus qualitative und quantitative Zusammenhänge ableiten und diese in Form einfacher funktionaler Bezie-hungen beschreiben (E5). Kompetenzbereich Kommunikation: Fragestellungen, Untersuchungen, Experimente und Daten nach gegebenen Strukturen dokumentieren und stimmig rekonstruieren, auch mit Unterstützung digitaler Werkzeuge (K1). Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Gleichgewichtsreaktionen Zeitbedarf: ca. 18 Std. à 45 Minuten 15 1.2 Konkretisierte Unterrichtsvorhaben Einführungsphase Unterrichtsvorhaben II Kontext: Methoden der Kalkentfernung im Haushalt Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Schwerpunkte übergeordneter Kompetenzerwartungen: Gleichgewichtsreaktionen UF1 Wiedergabe UF3 Systematisierung E3 Hypothesen E5 Auswertung Zeitbedarf: 18 Std. à 45 Minuten K1 Dokumentation Sequenzierung inhaltlicher Aspekte Kalkentfernung - Reaktion von Kalk mit Säuren - Beobachtungen eines Reaktionsverlau fs - Reaktionsgesch windigkeit berechnen Konkretisierte Kompetenzerwartungen Kernlehrplans Basiskonzepte (Schwerpunkt): Basiskonzept Chemisches Gleichgewicht Basiskonzept Energie Lehrmittel/ Materialien/ Methoden des Die Schülerinnen und Schüler ... planen quantitative Versuche (u.a. zur Untersuchung des zeitlichen Ablaufs einer chemischen Reaktion), führen diese zielgerichtet durch und dokumentieren Beobachtungen und Ergebnisse (E2, E4). stellen für Reaktionen Untersuchung Reaktionsgeschwindigkeit zur der den Verbindliche Absprachen Didaktischmethodische Anmerkungen Brainstorming: Kalkentfernung im Haushalt Der Einstieg dient zur Anknüpfung an Schülerversuch: Entfernung von Kalk mit die Vorkenntnisse Säuren aus der SI und anderen Fächern Ideen zur Untersuchung des zeitlichen Verlaufs Implizite Wiederholung: Schülerexperiment: Stoffmenge n, Planung, Durchführung und Auswertung Masse m und Stoffumsatz in Abhängigkeit von der eines entsprechenden Versuchs (z. B. molare Masse M Zeit tabellarisch und graphisch dar Auffangen des Gases) (K1), (Haus)aufgabe: Ermittlung von erläutern den Ablauf einer chemischen Reaktionsgeschwindigkeiten an einem Reaktion unter dem Aspekt der Beispiel Geschwindigkeit und definieren die Reaktionsgeschwindigkeit als Differenzenquotient Δc/Δt (UF1). Einfluss auf die formulieren Hypothesen zum Einfluss Geht das auch schneller? Reaktionsgeschwind verschiedener Faktoren auf die igkeit Reaktionsgeschwindigkeit und Arbeitsteilige Schülerexperimente: - Einflussmöglich entwickeln Versuche zu deren Abhängigkeit der Reaktionsgeschwindigkeit keiten Überprüfung (E3). von - Parameter - der Konzentration (Konzentration, interpretieren den zeitlichen Ablauf - vom Zerteilungsgrad Temperatur, chemischer Reaktionen in - von der Temperatur Zerteilungsgrad Abhängigkeit von verschiedenen ) Parametern (u.a. Oberfläche, Lerntempoduett: Stoßtheorie, Deutung der - Kollisionshypot Konzentration, Temperatur) (E5). Einflussmöglichkeiten hese Ggf. Simulation - Geschwindigkei erklären den zeitlichen Ablauf Erarbeitung: Einfaches tsgesetz für chemischer Reaktionen auf der Basis Geschwindigkeitsgesetz, Vorhersagen bimolekulare einfacher Modelle auf molekularer reaktion Ebene (u.a. Stoßtheorie für Gase) Diskussion: RGT-Regel, Ungenauigkeit der - RGT-Regel (E6). Vorhersagen beschreiben und beurteilen Chancen und Grenzen der Beeinflussung der Reaktionsgeschwindigkeit und des chemischen Gleichgewichts (B1). Einfluss der 17 Temperatur - Ergänzung erläutern die Merkmale eines Kollisionshypot chemischen Gleichgewichtszustands hese an ausgewählten Beispielen (UF1). - Aktivierungsene rgie - Katalyse beschreiben und erläutern das chemische Gleichgewicht mithilfe von Modellen (E6). Chemisches Gleichgewicht - Wiederholung Gleichgewicht - Hinund Rückreaktion - MWG - Beispielreaktion formulieren Hypothesen zur Wiederholung: Beeinflussung natürlicher Meeren Stoffkreisläufe (u.a. KohlenstoffdioxidCarbonat-Kreislauf) (E3). erläutern an ausgewählten Reaktionen die Beeinflussung der Gleichgewichtslage durch eine Konzentrationsänderung (bzw. Stoffmengenänderung), Temperaturänderung (bzw. Zufuhr oder Entzug von Wärme) und Druckänderung (bzw. Volumenänderung) (UF3). CO2- Aufnahme in den Hier nur Prinzip von Le Chatelier, kein MWG Schülerexperimente: Einfluss von Druck und Temperatur auf die Löslichkeit von CO2 ggf. Einfluss des Salzgehalts auf die Löslichkeit Beeinflussung von chemischen Gleichgewichten (Verallgemeinerung) Puzzlemethode: Einfluss von Druck, Temperatur und Konzentration auf formulieren Fragestellungen zum Gleichgewichte, Vorhersagen Problem des Verbleibs und des Einflusses anthropogen erzeugten Erarbeitung: Wo verbleibt das CO2 im Kohlenstoffdioxids (u.a. im Meer) unter Ozean? Einbezug von Gleichgewichten (E1). Fakultativ: Mögliche Ergänzungen (auch zur individuellen Förderung): - Tropfsteinhöhlen - Kalkkreislauf Partnerarbeit: Physikalische/Biologische - Korallen veranschaulichen chemische Kohlenstoffpumpe Reaktionen zum KohlenstoffdioxidCarbonat-Kreislauf grafisch oder Arbeitsblatt: Graphische Darstellung des durch Symbole (K3). marinen Kohlenstoffdioxid-Kreislaufs Diagnose von Schülerkonzepten: Protokolle, Auswertung Trainingsausgaben Leistungsbewertung: Klausur, Schriftliche Übung, mündliche Beiträge, Versuchsprotokolle 19 1.2 Einführungsphase - Unterrichtsvorhaben III Kontext: Kohlenstoffdioxid und das Klima – Die Bedeutung der Ozeane Basiskonzepte (Schwerpunkt): Basiskonzept Struktur – Eigenschaft Basiskonzept Chemisches Gleichgewicht Schwerpunkte übergeordneter Kompetenzerwartungen: Die Schülerinnen und Schüler können Kompetenzbereich Erkenntnisgewinnung: in vorgegebenen Situationen chemische Probleme beschreiben, in Teilprobleme zerlegen und dazu Fragestellungen angeben (E1). unter Beachtung von Sicherheitsvorschriften einfache Experimente zielgerichtet planen und durchführen und dabei mögliche Fehler betrachten (E4). Kompetenzbereich Kommunikation: chemische Aussagen und Behauptungen mit sachlich überzeugenden Argumenten begründen bzw. kritisieren (K4). fundierten und Kompetenzbereich Bewertung: in bekannten Zusammenhängen ethische Konflikte bei Auseinandersetzungen mit chemischen Fragestellungen darstellen sowie mögliche Konfliktlösungen aufzeigen (B3). Möglichkeiten und Grenzen chemischer und anwendungsbezogener Problemlösungen und Sichtweisen mit Bezug auf die Zielsetzungen der Naturwissenschaften darstellen (B4). Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: (Organische und) anorganische Kohlenstoffverbindungen Gleichgewichtsreaktionen Stoffkreislauf in der Natur Zeitbedarf: ca. 22 Std. à 45 Minuten 1.2 Konkretisierte Unterrichtsvorhaben Einführungsphase Unterrichtsvorhaben III Kontext: Kohlenstoffdioxid und das Klima – Die Bedeutung für die Ozeane Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Stoffkreislauf in der Natur Gleichgewichtsreaktionen Schwerpunkte übergeordneter Kompetenzerwartungen: E1 Probleme und Fragestellungen E4 Untersuchungen und Experimente K4 Argumentation B3 Werte und Normen B4 Möglichkeiten und Grenzen Zeitbedarf: 22 Std. à 45 Minuten Sequenzierung inhaltlicher Aspekte Konkretisierte Kompetenzerwartungen des Kernlehrplans Die Schülerinnen und Schüler ... Kohlenstoffdioxid - Eigenschaften - Treibhauseffekt - Anthropogene Emissionen - Reaktionsgleichu ngen - Umgang mit Größengleichung en unterscheiden zwischen dem natürlichen und dem anthropogen erzeugten Treibhauseffekt und beschreiben ausgewählte Ursachen und ihre Folgen (E1). Basiskonzepte (Schwerpunkt): Basiskonzept Struktur – Eigenschaft Basiskonzept Chemisches Gleichgewicht Lehrmittel/ Materialien/ Methoden Verbindliche Absprachen Didaktischmethodische Anmerkungen Kartenabfrage Begriffe zum Thema Der Einstieg dient zur Kohlenstoffdioxid Anknüpfung an die Vorkenntnisse aus Information Eigenschaften / Treibhauseffekt der SI und anderen z.B. Zeitungsartikel Fächern Berechnungen zur Bildung von CO2 aus Kohle und Treibstoffen (Alkane) - Aufstellen von Reaktionsgleichungen - Berechnung des gebildeten CO2 - Vergleich mit rechtlichen Vorgaben - weltweite CO2-Emissionen Implizite Wiederholung: Stoffmenge n, Masse m und molare Masse M 21 Information Aufnahme von CO2 u.a. durch die Ozeane Löslichkeit von CO2 in führen qualitative Versuche unter Schülerexperiment: Löslichkeit von CO2 in Wiederholung der Wasser vorgegebener Fragestellung durch und Wasser (qualitativ) Stoffmengenkonzen- qualitativ protokollieren die Beobachtungen (u.a. zur tration c - Bildung einer Untersuchung der Eigenschaften sauren Lösung organischer Verbindungen) (E2, E4). Aufstellen von Reaktionsgleichungen Wiederholung: - quantitativ Kriterien für - Unvollständigkeit dokumentieren Experimente in Lehrervortrag: Löslichkeit von CO2 (quantitativ): Versuchsprotokolle der Reaktion angemessener Fachsprache (u.a. zur - Löslichkeit von CO2 in g/l - Umkehrbarkeit Untersuchung der Eigenschaften - Berechnung der zu erwartenden Oxonorganischer Verbindungen, zur Einstellung iumionen -Konzentration Vorgabe einer einer Gleichgewichtsreaktion, zu Stoffen - Nutzung einer Tabelle zum erwarteten pH- Tabelle zum und Reaktionen eines natürlichen Wert Zusammenhang von Kreislaufes) (K1). - Vergleich mit dem tatsächlichen pH-Wert pH-Wert und Ergebnis: Oxoniumionenkonzen nutzen angeleitet und selbstständig Unvollständigkeit der ablaufenden Reaktion tration chemiespezifische Tabellen und Lehrer-Experiment: Löslichkeit von CO2 bei Nachschlagewerke zur Planung und Auswertung von Experimenten und zur Zugabe von Salzsäure bzw. Natronlauge Ergebnis: Ermittlung von Stoffeigenschaften (K2). Umkehrbarkeit / Reversibilität der Reaktion Chemisches Lehrervortrag: Gleichgewicht Chemisches Gleichgewicht als allgemeines - Definition erläutern die Merkmale eines chemischen Prinzip vieler chemischer Reaktionen, Definition - Beschreibung auf Gleichgewichtszustands an ausgewählten Arbeitsblatt: Teilchenebene Beispielen (UF1). - Modellvorstellung Umkehrbare Reaktionen auf Teilchenebene en ggf. Simulation Modellexperiment: z.B. Stechheber-Versuch, Kugelspiel beschreiben und erläutern das chemische Vergleichende Betrachtung: Gleichgewicht mithilfe von Modellen (E6). Chemisches Gleichgewicht auf der Teilchenebene, im Modell und in der Realität Ozean und Gleichgewichte - Aufnahme CO2 - Einfluss der Bedingungen der Ozeane auf die Löslichkeit von CO2 - Prinzip von Le Chatelier - Kreisläufe formulieren Hypothesen zur Beeinflussung Wiederholung: CO2- Aufnahme in den Meeren natürlicher Stoffkreisläufe (u.a. Kohlenstoffdioxid-Carbonat-Kreislauf) (E3). Schülerexperimente: Einfluss von Druck und erläutern an ausgewählten Reaktionen die Temperatur auf die Löslichkeit von CO2 Beeinflussung der Gleichgewichtslage ggf. Einfluss des Salzgehalts auf die Löslichkeit durch eine Konzentrationsänderung (bzw. von chemischen Stoffmengenänderung), Temperatur- Beeinflussung änderung (bzw. Zufuhr oder Entzug von Gleichgewichten (Verallgemeinerung) Wärme) und Druckänderung (bzw. Puzzlemethode: Einfluss von Druck, Temperatur Volumenänderung) (UF3). und Konzentration auf Gleichgewichte, Vorhersagen formulieren Fragestellungen zum Problem des Verbleibs und des Einflusses Erarbeitung: Wo verbleibt das CO2 im Ozean? anthropogen erzeugten Kohlenstoffdioxids Physikalische/Biologische (u.a. im Meer) unter Einbezug von Partnerarbeit: Gleichgewichten (E1). Kohlenstoffpumpe Hier nur Prinzip von Le Chatelier, kein MWG Fakultativ: Mögliche Ergänzungen (auch zur individuellen Förderung): - Tropfsteinhöhlen - Kalkkreislauf - Korallen Graphische Darstellung des veranschaulichen chemische Reaktionen Arbeitsblatt: zum Kohlenstoffdioxid-Carbonat-Kreislauf marinen Kohlenstoffdioxid-Kreislaufs grafisch oder durch Symbole (K3). Klimawandel recherchieren Informationen (u.a. zum Recherche - Informationen in Kohlenstoffdioxid-Carbonat-Kreislauf) aus - aktuelle Entwicklungen den Medien unterschiedlichen Quellen und - Versauerung der Meere - Möglichkeiten zur strukturieren und hinterfragen die - Einfluss auf den Golfstrom/NordatlantikLösung des Aussagen der Informationen (K2, K4). strom CO2-Problems beschreiben die Vorläufigkeit der Aussagen von Prognosen zum Podiumsdiskussion Klimawandel (E7). - Prognosen - Vorschläge zu Reduzierung von beschreiben und bewerten die Emissionen gesellschaftliche Relevanz prognostizierter - Verwendung von CO2 Folgen des anthropogenen Treibhaus- 23 effektes (B3). Zusammenfassung: z.B. Film „Treibhaus Erde“ zeigen Möglichkeiten und Chancen der aus der Reihe „Total Phänomenal“ des SWR Verminderung des Kohlenstoffdioxidausstoßes und der Speicherung des Kohlenstoffdioxids auf Weitere Recherchen und beziehen politische und gesellschaftliche Argumente und ethische Maßstäbe in ihre Bewertung ein (B3, B4). Diagnose von Schülerkonzepten: Lerndiagnose: Stoffmenge und Molare Masse Leistungsbewertung: Klausur, Schriftliche Übung zum Puzzle Beeinflussung von chemischen Gleichgewichten Beispielhafte Hinweise zu weiterführenden Informationen: Ausführliche Hintergrundinformationen und experimentelle Vorschläge zur Aufnahme von CO2 in den Ozeanen findet man z.B. unter: http://systemerde.ipn.uni-kiel.de/materialien_Sek2_2.html ftp://ftp.rz.uni-kiel.de/pub/ipn/SystemErde/09_Begleittext_oL.pdf Die Max-Planck-Gesellschaft stellt in einigen Heften aktuelle Forschung zum Thema Kohlenstoffdioxid und Klima vor: http://www.maxwissen.de/Fachwissen/show/0/Heft/Kohlenstoffkreislauf.html http://www.maxwissen.de//Fachwissen/show/0/Heft/Klimarekonstruktion http://www.maxwissen.de/Fachwissen/show/0/Heft/Klimamodelle.html Informationen zum Film „Treibhaus Erde“: http://www.planet-schule.de/wissenspool/total-phaenomenal/inhalt/sendungen/treibhaus-erde.html 1.2 Einführungsphase – Unterrichtsvorhaben IV Kontext: Nicht nur Graphit und Diamant – Erscheinungsformen des Kohlenstoffs Basiskonzepte (Schwerpunkt): Basiskonzept Struktur – Eigenschaft Schwerpunkte übergeordneter Kompetenzerwartungen: Kompetenzbereich Umgang mit Fachwissen: bestehendes Wissen aufgrund neuer chemischer Erfahrungen und Erkenntnisse modifizieren und reorganisieren (UF4). Kompetenzbereich Erkenntnisgewinnung: Modelle begründet auswählen und zur Beschreibung, Erklärung und Vorhersage chemischer Vorgänge verwenden, auch in einfacher formalisierter oder mathematischer Form (E6). an ausgewählten Beispielen die Bedeutung, aber auch die Vorläufigkeit naturwissenschaftlicher Regeln, Gesetze und Theorien beschreiben (E7). Kompetenzbereich Kommunikation: chemische Sachverhalte, Arbeitsergebnisse und Erkenntnisse adressatengerecht sowie formal, sprachlich und fachlich korrekt in Kurzvorträgen oder kurzen Fachtexten darstellen (K3). Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltlicher Schwerpunkt: Nanochemie des Kohlenstoffs Zeitbedarf: ca. 8 Std. à 45 Minuten 25 1.2 Konkretisierte Unterrichtsvorhaben Einführungsphase Unterrichtsvorhaben IV Kontext: Nicht nur Graphit und Diamant – Erscheinungsformen des Kohlenstoffs Inhaltsfeld: Kohlenstoffverbindungen und Gleichgewichtsreaktionen Inhaltliche Schwerpunkte: Nanochemie des Kohlenstoffs Schwerpunkte übergeordneter Kompetenzerwartungen: UF4 Vernetzung E6 Modelle E7 Arbeits- und Denkweisen K3 Präsentation Zeitbedarf: 8 Std. à 45 Minuten Basiskonzept (Schwerpunkt): Basiskonzept Struktur – Eigenschaft Lehrmittel/ Materialien/ Methoden Sequenzierung inhaltlicher Aspekte Konkretisierte Kompetenzerwartungen des Kernlehrplans Die Schülerinnen und Schüler ... Graphit, Diamant und mehr - Modifikation - Elektronenpaarbindung - Strukturformeln nutzen bekannte Atom- und Bindungsmodelle zur Beschreibung organischer Moleküle und Kohlenstoffmodifikationen (E6). stellen anhand von Strukturformeln Vermutungen zu Eigenschaften ausgewählter Stoffe auf und schlagen geeignete Experimente zur Überprüfung vor (E3). erläutern Grenzen der ihnen bekannten Bindungsmodelle (E7). beschreiben die Strukturen von Diamant 1. Test zur Selbsteinschätzung Atombau, Bindungslehre, Kohlenstoffatom, Periodensystem 2. Gruppenarbeit „Graphit, Diamant und Fullerene“ Verbindliche Absprachen Didaktischmethodische Anmerkungen Der Einstieg dient zur Angleichung der Kenntnisse zur Bindungslehre, ggf. muss Zusatzmaterial zur Verfügung gestellt werden. Beim Graphit und beim Fulleren werden die Grenzen der einfachen Bindungsmodelle deutlich. (Achtung: Nanomaterialien - Nanotechnologie - Neue Materialien - Anwendungen - Risiken und Graphit und vergleichen diese mit neuen Materialien aus Kohlenstoff (u.a. Fullerene) (UF4). recherchieren angeleitet und unter vorgegebenen Fragestellungen Eigenschaften und Verwendungen ausgewählter Stoffe und präsentieren die Rechercheergebnisse adressatengerecht (K2, K3). stellen neue Materialien aus Kohlenstoff vor und beschreiben deren Eigenschaften (K3). ohne Hybridisierung) 1. Recherche zu neuen Materialien aus Kohlenstoff und Problemen der Nanotechnologie (z.B. Kohlenstoff-Nanotubes in Verbundmaterialien zur Verbesserung der elektrischen Leitfähigkeit in Kunststoffen) - Aufbau - Herstellung - Verwendung - Risiken - Besonderheiten bewerten an einem Beispiel Chancen und Risiken der Nanotechnologie (B4). 2. Präsentation (Poster, Museumsgang) Die Präsentation ist nicht auf Materialien aus Kohlenstoff beschränkt. Unter vorgegebenen Rechercheaufträge n können die Schülerinnen und Schüler selbstständig Fragestellungen entwickeln. (Niveaudifferenzieru ng, individuelle Förderung) Die Schülerinnen und Schüler erstellen Lernplakate in Gruppen, beim Museumsgang hält jeder / jede einen Kurzvortrag. Diagnose von Schülerkonzepten: Selbstevaluationsbogen zur Bindungslehre Leistungsbewertung: Präsentation zu Nanomaterialien in Gruppen Beispielhafte Hinweise zu weiterführenden Informationen: Eine Gruppenarbeit zu Diamant, Graphit und Fullerene findet man auf den Internetseiten der Eidgenössischen Technischen Hochschule Zürich: http://www.educ.ethz.ch/unt/um/che/ab/graphit_diamant, Zum Thema Nanotechnologie sind zahlreiche Materialien und Informationen veröffentlicht worden, z.B.: FCI, Informationsserie Wunderwelt der Nanomaterialien (inkl. DVD und Experimente) Klaus Müllen, Graphen aus dem Chemielabor, in: Spektrum der Wissenschaft 8/12 27 Sebastian Witte, Die magische Substanz, GEO kompakt Nr. 31 http://www.nanopartikel.info/cms http://www.wissenschaft-online.de/artikel/855091 http://www.wissenschaft-schulen.de/alias/material/nanotechnologie/1191771 29