22 - Medi
Werbung

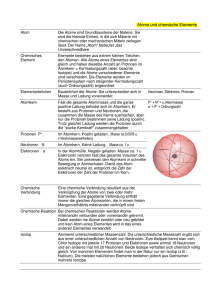
5 Struktur der Materie 5 Struktur der Materie Fragen in den letzten 10 Examen: 3 Es ist zwar nicht unbedingt nötig zu wissen, woraus Materie eigentlich besteht, um Physik zu betreiben (das haben Physiker Jahrhunderte lang bewiesen), aber es hilft ungemein. 5.1 5 Atome Bereits in der Antike waren manche Naturphilosophen der Meinung, dass Materie aus kleinsten Bausteinen, den Atomen bestehen müsse. Den Durchbruch schaffte diese Theorie erst, als John Dalton (1766–1844) mit Hilfe von Atomen erklären konnte, wie chemische Reaktionen funktionieren: –– Materie besteht aus Atomen. –– Jedes chemische Element besteht aus einer charakteristischen Atomsorte. –– Bei einer chemischen Reaktion werden Atome miteinander verbunden oder Verbindungen getrennt. –– Die Eigenschaften von Verbindungen (Molekülen) hängen vom Anzahlverhältnis der beteiligten Atome ab. 5.1.1 Kern-Hülle-Modell Hülle – Kern + + Proton (Ladung +1, Masse 1) – Elektron Neutron (Ladung 0, Masse 1) (Ladung −1, Masse 0,0005) Atoms befindet sich ein positiv geladener Atomkern, der von einer Hülle mit negativ geladenen Elektronen umgeben ist. Die Ladungen gleichen sich gerade aus und das Atom erscheint nach außen neutral. Die Elektronenhülle nimmt den größten Teil des Atomvolumens ein: Hätte der Atomkern die Größe eines Fußballs, wäre die Elektronenhülle so groß wie ein Fußballstadion. In dem winzigen Atomkern ist aber fast die gesamte Masse des Atoms konzentriert. 5.1.2 Atomkerne Atomkerne bestehen aus Protonen und Neutronen. Diese Teilchen werden Nukleonen (Kernteilchen) genannt. Die Protonen tragen eine positive Elementarladung, die Neutronen sind elektrisch neutral. Protonen und Neutronen haben fast dieselbe Masse: eine atomare Masseneinheit (s. Tab. 6, S. 23). Elektronen tragen eine negative Elementarladung. Sie wiegen nur etwa 1/2000 einer atomaren Masseneinheit, also fast nichts. Die Anzahl der Nukleonen in einem Atomkern, also der Protonen und Neutronen zusammen, heißt Massenzahl. Die Ordnungszahl gibt die Anzahl der Protonen in einem Atomkern an. Sie bestimmt, zu welchem chemischen Element das Atom gehört. Die Anzahl der Neutronen kannst du als Differenz von Massen- und Ordnungszahl berechnen: Neutronenzahl = Massenzahl – Protonenzahl Abb. 13: Kern-Hülle-Modell medi-learn.de/6-phy-13 Atome haben – anders als Dalton vermutete – eine innere Struktur. Im Zentrum eines 22 Ein Atomkern mit genau festgelegter Massenund Ordnungszahl wird in der Physik als Nuklid bezeichnet. Die Kurzschreibweise für ein Nuklid ist das Elementsymbol mit der Mas-