12.1 Ein Überblick
Werbung
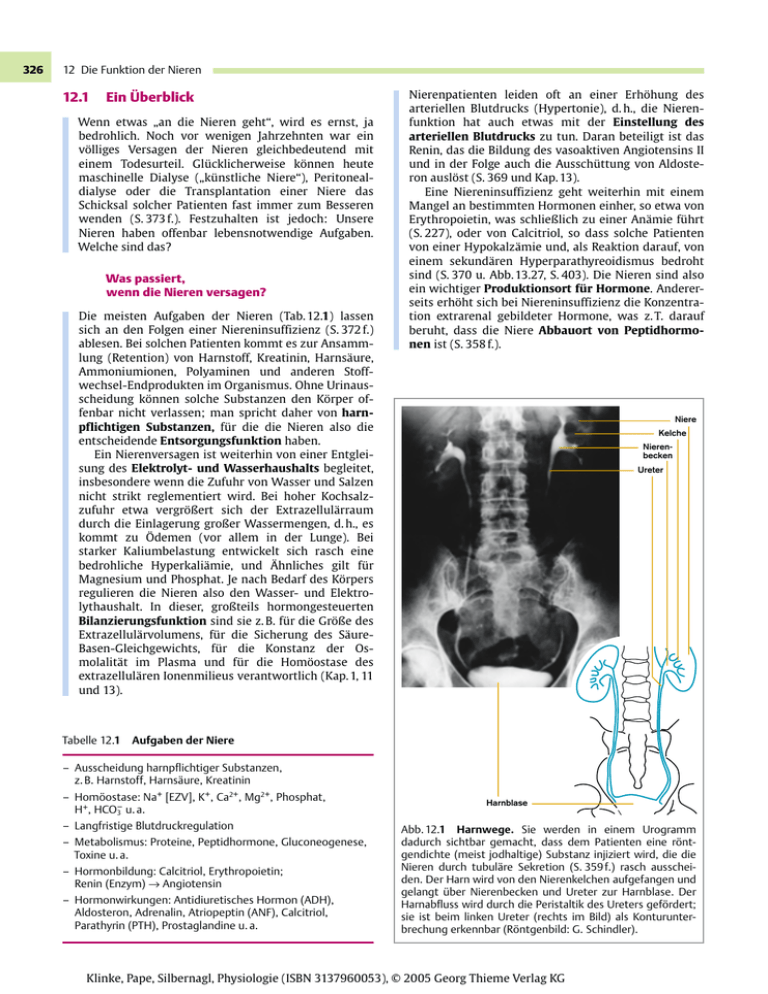
326 12 Die Funktion der Nieren 12.1 Ein berblick Wenn etwas „an die Nieren geht“, wird es ernst, ja bedrohlich. Noch vor wenigen Jahrzehnten war ein vlliges Versagen der Nieren gleichbedeutend mit einem Todesurteil. Gl cklicherweise knnen heute maschinelle Dialyse („k nstliche Niere“), Peritonealdialyse oder die Transplantation einer Niere das Schicksal solcher Patienten fast immer zum Besseren wenden (S. 373 f.). Festzuhalten ist jedoch: Unsere Nieren haben offenbar lebensnotwendige Aufgaben. Welche sind das? Was passiert, wenn die Nieren versagen? Die meisten Aufgaben der Nieren (Tab. 12.1) lassen sich an den Folgen einer Niereninsuffizienz (S. 372 f.) ablesen. Bei solchen Patienten kommt es zur Ansammlung (Retention) von Harnstoff, Kreatinin, Harns8ure, Ammoniumionen, Polyaminen und anderen Stoffwechsel-Endprodukten im Organismus. Ohne Urinausscheidung knnen solche Substanzen den Krper offenbar nicht verlassen; man spricht daher von harnpflichtigen Substanzen, f r die die Nieren also die entscheidende Entsorgungsfunktion haben. Ein Nierenversagen ist weiterhin von einer Entgleisung des Elektrolyt- und Wasserhaushalts begleitet, insbesondere wenn die Zufuhr von Wasser und Salzen nicht strikt reglementiert wird. Bei hoher Kochsalzzufuhr etwa vergrßert sich der Extrazellul8rraum durch die Einlagerung großer Wassermengen, d. h., es kommt zu ?demen (vor allem in der Lunge). Bei starker Kaliumbelastung entwickelt sich rasch eine bedrohliche Hyperkali8mie, und Ahnliches gilt f r Magnesium und Phosphat. Je nach Bedarf des Krpers regulieren die Nieren also den Wasser- und Elektrolythaushalt. In dieser, großteils hormongesteuerten Bilanzierungsfunktion sind sie z. B. f r die Grße des Extrazellul8rvolumens, f r die Sicherung des S8ureBasen-Gleichgewichts, f r die Konstanz der Osmolalit8t im Plasma und f r die Homostase des extrazellul8ren Ionenmilieus verantwortlich (Kap. 1, 11 und 13). Tabelle 12.1 Nierenpatienten leiden oft an einer Erhhung des arteriellen Blutdrucks (Hypertonie), d. h., die Nierenfunktion hat auch etwas mit der Einstellung des arteriellen Blutdrucks zu tun. Daran beteiligt ist das Renin, das die Bildung des vasoaktiven Angiotensins II und in der Folge auch die Aussch ttung von Aldosteron auslst (S. 369 und Kap. 13). Eine Niereninsuffizienz geht weiterhin mit einem Mangel an bestimmten Hormonen einher, so etwa von Erythropoietin, was schließlich zu einer An8mie f hrt (S. 227), oder von Calcitriol, so dass solche Patienten von einer Hypokalz8mie und, als Reaktion darauf, von einem sekund8ren Hyperparathyreoidismus bedroht sind (S. 370 u. Abb. 13.27, S. 403). Die Nieren sind also ein wichtiger Produktionsort fr Hormone. Andererseits erhht sich bei Niereninsuffizienz die Konzentration extrarenal gebildeter Hormone, was z. T. darauf beruht, dass die Niere Abbauort von Peptidhormonen ist (S. 358 f.). Niere Kelche Nierenbecken Ureter Aufgaben der Niere – Ausscheidung harnpflichtiger Substanzen, z. B. Harnstoff, Harns!ure, Kreatinin – Homostase: Na+ [EZV], K+, Ca2+, Mg2+, Phosphat, H+, HCO3– u. a. – Langfristige Blutdruckregulation – Metabolismus: Proteine, Peptidhormone, Gluconeogenese, Toxine u. a. – Hormonbildung: Calcitriol, Erythropoietin; Renin (Enzym) fi Angiotensin – Hormonwirkungen: Antidiuretisches Hormon (ADH), Aldosteron, Adrenalin, Atriopeptin (ANF), Calcitriol, Parathyrin (PTH), Prostaglandine u. a. Harnblase Abb. 12.1 Harnwege. Sie werden in einem Urogramm dadurch sichtbar gemacht, dass dem Patienten eine rntgendichte (meist jodhaltige) Substanz injiziert wird, die die Nieren durch tubul!re Sekretion (S. 359 f.) rasch ausscheiden. Der Harn wird von den Nierenkelchen aufgefangen und gelangt *ber Nierenbecken und Ureter zur Harnblase. Der Harnabfluss wird durch die Peristaltik des Ureters gefrdert; sie ist beim linken Ureter (rechts im Bild) als Konturunterbrechung erkennbar (Rntgenbild: G. Schindler). Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 12.1 Ein Iberblick Nierenrinde Schließlich haben die Nieren weitere wichtige Aufgaben im Zwischenstoffwechsel des Gesamtorganismus. Gluconeogenese (aus Glutamin u. a.) und Argininsynthese (aus Citrullin) sind zwei Beispiele daf r (S. 370 f.). Ein kurzer Blick auf die Anatomie Nierenmark A. renalis Kelch V. renalis Nierenbecken Ureter Abb. 12.2 Bau der Niere. Die R*ckseite der rechten Niere ist hier abgetragen, um die Schichten des Nierenparenchyms (Nierenrinde und -mark) sowie das Kelchsystem und das Nierenbecken sichtbar zu machen. Die gesamte Niere ist von einer widerstandsf!higen Kapsel umgeben. Glomeruli BowmanKapsel-Raum peritubuläre Kapillaren Um zu beantworten, wie die Nieren ihre Aufgaben bew8ltigen, m ssen wir uns kurz mit dem Bau dieses paarigen Organs besch8ftigen (Abb. 12.1 u.12.2). Jede Niere hat einen arteriellen Zufluss (A. renalis), einen vensen Abfluss (V. renalis), Lymphgef8ße und einen Harnleiter (Ureter), in dem der in der Niere gebildete Urin kontinuierlich abfließt. Lber den linken und rechten Ureter gelangt der Urin in die Harnblase, sammelt sich dort an, um schließlich von Zeit zu Zeit ber die Harnrhre (Urethra) ausgeschieden zu werden (Miktion; Steuerung Kap. 27). Im histologischen Schnitt unter dem Mikroskop (Abb. 12.3) sieht man in der oberfl8chennahen Nierenrinde (Kortex) ein Gewirr von Kan8lchen, die Tubuli, und dazwischen ab und zu ein rundes Nierenkrperchen, in das ein Kn8uel von Blutkapillaren, der Glomerulus, eingest lpt ist. Der Glomerulus samt dort entspringendem Tubulus wird Nephron genannt. Jede Niere besitzt mehr als 1 Million solcher Nephrone. Wie entsteht der Harn? Diese Frage hat der deutsche Physiologe Carl Ludwig (Abb. 12.4) in der Mitte des vorigen Jahrhunderts erstmals richtig beantwortet (44). Er postulierte, dass der Harn prim8r durch Filtration in den Glomeruli entsteht, wobei es der Blutdruck in den glomerul8ren Kapillaren sei, der den Prim8rharn aus diesen abpresst. Danach entspr8che der dabei gebildete Prim-rharn (Ultrafiltrat) in seiner Zusammensetzung weitgehend dem Plasmawasser. Der endg ltige Urin ist allerdings ganz anders zusam- größeres Blutgefäß proximaler Tubulus (Pars convoluta) Abb. 12.3 Feinbau der Niere. In diesem Schnitt durch die Nierenrinde sind drei Glomeruli (Durchmesser ca. 0,2 mm) sichtbar, um die sich die Konvolute proximaler und distaler Tubuli kn!ueln (s. auch Abb. 12.10, S. 332; histologischer Schnitt: U. Pfeifer). Dazwischen verlaufen die peritubul!ren Kapillaren. Ein Teil dieser Strukturen ist zur Verdeutlichung dunkelgrau hervorgehoben. Abb. 12.4 Carl F. Ludwig (1816 – 1895; Physiologe in Marburg, Z*rich, Wien und Leipzig) stellte 1842 erstmals die Hypothese auf (44), dass der Harn durch Ultrafiltration am Glomerulus entsteht und anschließend durch tubul!re Resorption modifiziert wird (Lithographie von M. Brdel nach einer Zeichnung von Ludwig Knaus, 1867). Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 327 12 Die Funktion der Nieren Glomerulus 1,0 » glomerulär filtrierte Menge/Zeit = fraktionelle Ausscheidung (FE) 0 Abb. 12.5 Filtriert wird (fast) alles; ber die Ausscheidung entscheiden Tubulus und Sammelrohr. Wird weder resorbiert noch sezerniert, was z. B. (mit kleinen Einschr!nkungen) f*r Kreatinin zutrifft, so gilt: filtrierte Menge/Zeit = ausgeschiedene Menge/Zeit, d. h., die fraktionelle Ausscheidung (FE) betr!gt 1,0 oder 100%. Harnstoff wird teilweise mengesetzt. Das erkl8rte Ludwig damit, dass die Stoffe, die im Endurin fehlen, entlang des Tubulusrohres resorbiert werden, d. h. vom Tubuluslumen in die peritubularen Kapillaren und damit wieder zur ck ins Blut gelangen. Er machte daf r Diffusionsvorg8nge verantwortlich, doch wissen wir heute, dass dies nur teilweise richtig ist und eine Reihe von Stoffen mittels aktiver Transportmechanismen (S. 28 f.) aus dem Tubuluslumen entfernt wird. Bleibt noch zu erkl8ren, warum die Menge einiger Stoffe im Endurin grßer ist als die im glomerul8ren Filtrat: Tubuluszellen resorbieren nicht nur, sondern sie knnen zus8tzlich bestimmte Stoffe in der Gegenrichtung aktiv sezernieren, d. h. aus dem peritubul8ren Blut ins Tubuluslumen schaffen. Damit ergibt sich folgendes Bild: Sieht man von Makromolek len ab, enth8lt das Glomerulusfiltrat alle im Plasma gelsten Stoffe, und zwar in praktisch der gleichen Konzentration.* Da die glomerul-re Filtrationsrate (GFR) beider Nieren rund 180 l pro Tag betr8gt (Tab. 12.2, S. 333), filtrieren unsere Nieren die im Filtrat gelsten Stoffe in riesigen Mengen. (Die filtrierte Menge/Zeit errechnet sich aus der jeweiligen Plasma(-Wasser)-Kon* Wegen des Gibbs-Donnan-Potenzials von ca. 1,5 mV (Blutseite negativ), das durch die ungleiche Verteilung der zumeist anionischen Proteine am glomerul8ren Filter entsteht, enth8lt das Filtrat im Vergleich zum Plasma eine um ca. 5 % hhere Konzentration an filtrierbaren Anionen (z. B. Cl–, HCO3–) und eine um ca. 5 % niedrigere Konzentration an filtrierbaren Kationen (z. B. Na+, K+). Kreatinin 1,0 0,5 Glucose » 0 Ausscheidung Harnstoff 0,4 keine Ausscheidung p-Aminohippurat 5,0 geregelte Ausscheidung 1,5 1,0 ausgeschiedene Menge/Zeit 20 mmol/d hohe Ausscheidung 2,0 + Sammelrohr 1.000 mmol/d extrem hohe Ausscheidung K 0,03 1,5 Sekretion 800 mmol/d 4,5 + geregelte Resorption 26.000 mmol/d Na 0,002 0,07 Resorption 180 l/d 5,0 Tubulus geregelte Sekretion 800 mmol/d Wasser 0,003 0,1 Filtration fraktionelle Ausscheidung (FE) 328 resorbiert (FE = ca. 0,4; s. auch Legende zu Abb. 12.27), Glucose praktisch vollst!ndig (FE = 0,0005) und Wasser, Na+, K+ und andere nach Bedarf (Regelung u. a. durch Hormone). Durch tubul!re Sekretion kann die FE auf *ber 1 steigen, im Extremfall (Hippurat, p-Aminohippurat) sogar auf etwa 5. zentration mal GFR; s. u.) F r Na+ z. B. sind das t8glich etwa 26 000 mmol, f r Glucose und Harnstoff rund 800 bzw. 1000 mmol! Davon erscheinen allerdings ganz unterschiedliche Anteile im Endurin (fraktionelle Ausscheidung = fraktionelle Exkretion, FE, Abb. 12.5). Mit dieser Kombination von immens hoher Filtrationsrate und mehr oder minder stark ausgepr8gter Resorption sind alle Anforderungen an die Niere erf llt: „Harnpflichtige“ Stoffwechsel-Endprodukte wie Kreatinin, Sulfat und Harnstoff knnen den Krper in großen Mengen verlassen, w8hrend die Ausscheidung von Wasser und Elektrolyten je nach Bedarf in einem weiten Ausmaß variiert werden kann. F r Stoffe, die entlang des Tubulus zus8tzlich sezerniert werden (z. B. Hippurat), bietet das hohe Filtrat zudem ein großes Lsungsvolumen, was ihrer raschen Ausscheidung im Urin zugute kommt (Abb. 12.5). Woher weiß man, was in der Niere vorgeht? Unzug8nglich, wie das Innere der Niere ist, war man bei ihrer Erforschung bis ins 17. Jahrhundert auf die Untersuchung des Urins angewiesen. Ihr Ergebnis bildete dann zusammen mit histologischen Erkenntnissen in der Mitte des 19. Jahrhunderts die Grundlage, eine fundierte Hypothese ber die intrarenale Urinbildung aufzustellen (44). Erst im 20. Jahrhundert wurden moderne Untersuchungstechniken entwickelt, die ein besseres Verst8ndnis der Nierenfunktion ermglichten. So wurde um 1930 mit der Clearancemessung eine noch heute ben tzte Methode zur quantitativen Erfassung dessen entwickelt, was die ganze Niere leistet. Die ersten Versuche zu erfahren, was in dieser Black Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 12.2 Menge ist Volumen mal Konzentration: die Clearance Nierenoberfläche 1 Öl Glomerulus und Mikroperfusion (75) einzelner Nierentubuli der Ratte in vivo (Abb. 12.6) brachten dann eine F lle neuer Erkenntnisse ber die Niere und zeigten andererseits, wie heterogen die Tubulusabschnitte arbeiten. Sp8ter wurden isolierte Tubuli in vitro perfundiert, die B rstensaum- und Basolateralmembranen in Form von Vesikeln isoliert und getrennt untersucht sowie Nierenzellen in Kultur gez chtet (Abb. 1.4, S. 7). Es gelang auch, die durch einzelne Membrankan8le fließenden Ionenstrme mit der Patchclamp-Methode zu messen (Abb. 2.8 u. 2.9, S. 26 f.), f r deren Entwicklung 1991 der Nobelpreis f r Physiologie an E. Neher und B. Sakmann verliehen wurde. Schließlich konnten k rzlich Kanalund Carriermolek le isoliert und deren molekulare Struktur bestimmt werden. Das Wissen ber tubul8re, zellul8re, subzellul8re und molekulare Mechanismen der Nierenfunktion wuchs dadurch in den letzten Jahrzehnten immens, doch sind integrative Leistungen der Niere wie z. B. die Blutdruckregulation nach wie vor nur am intakten Organ im lebenden Tier zu untersuchen. Moderne, empfindliche und gleichzeitig schonende Messmethoden haben auch hier große Fortschritte gebracht (z. B. 23, 24, 38). Leider ist in einem solchen Lehrbuch kein Platz, die Geschichte und die Methoden der Nierenforschung ausf hrlicher zu schildern, so dass dem interessierten Leser daf r die spannende Schilderung der Historie (7) und die methodischen Kapitel in ausf hrlicheren Werken (9,11, 13) empfohlen werden. Glaskapillare 2 Tubulus 3 Nierenrinde 12.2 peritubuläres Kapillarnetz 4 Abb. 12.6 Die Mikropunktion einzelner Nierentubuli (beim narkotisierten Versuchstier, meist bei der Ratte; s. Foto) erlaubt es, die Funktion des einzelnen Tubulus in vivo in der intakten Niere zu untersuchen. Unter dem Mikroskop wird mit feinen Glaskapillaren (Kapillare Nr. 1 – 4 im Bild, Spitzendurchmesser ca. 10 Mm) in oberfl!chliche Tubuli eingestochen. (Das Foto zeigt die Aufsicht auf die Nierenoberfl!che.) Eine in Kapillare 1 gesammelte Probe z. B. gibt, verglichen mit dem Plasma, Aufschluss dar*ber, wie sich die Zusammensetzung des Prim!rharns zwischen Glomerulus und Punktionsstelle ge!ndert hat (z. B. Abb. 12.19/1, 12.21, 12.22, 12.27, 12.32 und 12.36). Kapillare 2 ist mit einer Mikroperfusionspumpe verbunden (75). Damit kann dem Tubulus eine Fl*ssigkeit angeboten werden, die eine vorgew!hlte Zusammensetzung hat und deren Ver!nderung nach der Tubuluspassage (Probe wird in Kapillare 3 gesammelt) analysiert wird (z. B. Konzentrationsabfall eines Stoffes im Vergleich zu mitperfundiertem Inulin = Resorption dieses Stoffes). Ein stromaufw!rts der Kapillare 2 injizierter Nlblock (im Foto schwarz) verhindert dabei die Vermischung mit dem nat*rlichen Tubulusharn. Mit Kapillare 4 kann schließlich auch das peritubul!re Kapillarnetz durchstrmt werden, so dass z. B. die Sekretion eines Stoffes vom Blut ins Tubuluslumen verfolgt werden kann. Box vor sich geht, wurden bereits in den 20er Jahren gemacht, als am Frosch das erste Mal einzelne Nierentubuli punktiert wurden (55). Dass diese Methode erst 40 Jahre sp8ter wirkliche Fr chte brachte, lag daran, dass dazu Ultramikromethoden entwickelt werden mussten, mit denen man in den winzigen Harnproben von einigen Nanolitern (10– 9 l!) Stoffe wie Na+, Glucose, Inulin usw. quantitativ messen konnte. Mikropunktion, Mikroinfusion Menge ist Volumen mal Konzentration: die Clearance Fr die inerte Substanz Inulin ist die Tubuluswand dicht, so dass die filtrierte Inulinmenge gleich der ausgeschiedenen Menge ist. Aus dieser Bilanz folgt: GFR = InulinClearance = V̇U · U/P (ml/min). Da die endogene Kreatinin-Clearance » GFR, ist die Kreatininplasmakonzentration theoretisch ein reziprokes Maß fr die GFR, hat aber praktisch nur eine beschr:nkte Aussagekraft. Die Clearance (C) kann fr jeden frei filtrierten Stoff (X) bestimmt werden. Ist CX/GFR < 1, wird der Stoff nettoresorbiert (z. B. Na+, Glucose), gilt CX/GFR > 1, wird er nettosezerniert (z. B. PAH). Der Quotient CX/GFR ist identisch mit der fraktionellen Ausscheidung (FE). Die fraktionelle Resorption = 1 – FE. Nach dem im vorigen Abschnitt Gesagten ist eine ausreichend hohe glomerul8re Filtrationsrate (GFR) f r eine normale Nierenfunktion entscheidend. Normalerweise betr8gt die GFR 85 – 135 ml/ min pro 1,73 m2 K8rperoberfl-che. Viele Nierenerkrankungen werden vor allem deshalb gef8hrlich, weil in ihrem Verlauf die GFR auf zu geringe Werte abzusinken droht (S. 372). Die GFR-Bestimmung steht daher im Zentrum, wenn die Nierenfunktion beurteilt werden soll. Wie aber l8sst sich die intrarenal ablaufende Filtration beim Patienten von außen messen? Nach einem von Adolf Fick eingef hrten Prinzip kann aus der Mengenbilanz eines Indikators, dessen Konzentrationen an den Ein- und Ausg8ngen des jeweiligen Organs gemessen werden, auf die Flussraten der Medien geschlossen werden, in denen der Indikator gelst ist (Abb. 12.7). Was heißt das im Fall der Niere? Prinzipiell sind es drei Arten, auf die sich die Menge einer Substanz im Tubuluslumen erhhen kann, n8mlich durch Filtration, Sekretion und metabolische Bildung, sowie drei Wege, auf denen die Menge im Lumen verringert werden kann, n8mlich Resorption, Ausscheidung (Exkretion) Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 329 H2O keine Sekretion, keine Resorption H2O filtrierte Inulinmenge Zeit = ausgeschiedene Inulinmenge Zeit Inulinkonzentration im Plasma GFR × GFR Pin = = V×U Uin × × VU Uin × Pin 8 700 7 600 6 500 5 400 4 obere Normgrenze für Kreatininkonzentration 3 300 200 2 0 100 0 20 40 60 80 100 120 140 160 2 0 180 Inulin-Clearance = GFR (ml/min pro 1,73 m ) Urinzeitvolumen und metabolischer Abbau. Kreist nun im Blut ein Stoff, z. B. das Polysaccharid Inulin, der – frei filtriert, – nicht resorbiert, – nicht sezerniert und – weder im Tubuluslumen gebildet noch abgebaut wird, so kann er nur durch Filtration ins Tubuluslumen gelangen und aus diesem nur durch Ausscheidung mit dem Urin wieder verschwinden. Es muss also gelten: filtrierte Inulin-Menge/Zeit = ausgeschiedene Inulin-Menge/Zeit 800 untere Normgrenze für die GFR blinder Bereich Abb. 12.7 Inulin-Clearance = glomerul:re Filtrationsrate (GFR), da Inulin frei filtriert, aber weder resorbiert noch sezerniert wird. Die GFR errechnet sich aus einer Mengenbilanz, wie sie Adolf Fick (1829 – 1901, Physiologe in Marburg, Z*rich und W*rzburg) 1872 erstmalig f*r die unblutige Bestimmung des Herzzeitvolumens angewandt hat (FickOsches Prinzip). Die normale GFR betr!gt ca. 85 – 135, durchschnittlich rund 125 ml/min pro 1,73 m2 Krperoberfl!che (nach 67). (12.1) Da Menge/Zeit = (Volumen/Zeit) mal Konzentration und außerdem die Konzentrationen eines frei filtrierbaren Stoffes wie Inulin in Plasma und Filtrat praktisch gleich groß sind (PIn [g/l]), lautet Gleichung 12.1 nun: GFR · PIn = V̇u · UIn 9 1 Inulinkonzentration im Endurin Endurin Kreatininkonzentration im Plasma (mg/dl) Adolf Fick Inulin Kreatininkonzentration im Plasma (µmol/l) 12 Die Funktion der Nieren Inulinkonzentration steigt wegen H2O-Resorption 330 (12.2) wobei GFR in ml/min, V̇u = Urinzeitvolumen (ml/min) und UIn = Inulinkonzentration im Endurin (g/l) ist. Praktisch infundiert man dazu Inulin und misst anschließend (z. B. photometrisch) seine Konzentrationen in Plasma und Urin. F r die Bestimmung von V̇u wird initial die Harnblase geleert (und dieser Harn verworfen: Volumen = 0, Zeit = 0) und anschließend mglichst lange (12 – 24 Stunden) der Urin gesammelt. Aus dem gesammelten Urinvolumen geteilt durch den Zeitabstand zur initialen Abb. 12.8 Die Kreatininkonzentration im Plasma (PKr) ist ein einfacher, aber nur relativ ungenauer Indikator fr die GFR. Bei konstanter Kreatininbildung (in den Muskeln) ist PKr theoretisch umgekehrt proportional der GFR. Allerdings streuen die Einzelwerte um diese hyperbolische Funktion so stark, dass die obere Normgrenze von PKr (waagrechte, gestrichelte Linie) im Durchschnitt erst bei einer GFREinschr!nkung auf 40 – 50% und im Einzelfall sogar erst bei 20% *berschritten wird. Ein Absinken der GFR unter ihre untere Normgrenze (senkrechte gestrichelte Linie) wird also bei allen Patienten nicht erkannt, deren PKr-Werte im linken unteren Quadranten liegen: „blinder“ Bereich (nach 43). Blasenentleerung ergibt sich V̇u. Mit dieser Anwendung des Fick;schen Prinzips l8sst sich so erstaunlicherweise die auf direktem Wege praktisch unbestimmbare Grße GFR aus der umgeformten Gleichung 12.2 berechnen: GFR = V̇u · UIn/PIn (12.3) Man nennt die rechte Seite der Gleichung 12.3 auch Clearance, so dass festzustellen ist: Inulin-Clearance = GFR. Da die Infusion von Inulin ein relativ aufwendiges Verfahren ist, wird die Inulin-Clearance nur ausnahmsweise bestimmt. Einfacher ist die GFR-Messung mit einem Indikator, der normalerweise schon im Plasma vorhanden ist, dem Kreatinin; es entsteht im Muskelstoffwechsel aus Phosphokreatin. Endogenes Kreatinin erf llt die oben genannten Kriterien (vor allem die der Nichtsekretion) nicht so streng wie Inulin, doch ist die endogene Kreatinin-Clearance f r die Routine berpr fung der renalen Filtrationsleistung vllig ausreichend. Angenommen, die Kreatininproduktion im Krper ist konstant (was außer nach starker Muskelt8tigkeit meist der Fall ist), so steigt die Kreatininkonzentration im Plasma (PKr) bei einer abfallenden GFR so lange an, bis die filtrierte (Menge/Zeit) (GFR · PKr) wieder der der produzierten Menge/Zeit gleicht. Je niedriger die GFR, desto hher steigt also PKr . Kann Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 12.3 Die Nierendurchblutung man sich also die Clearancebestimmung sparen und schon allein aus der PKr eines Patienten auf die Hhe seiner GFR schließen? Wie Abb. 12.8 zeigt, geht dies leider nur ungenau, es sei denn, die GFR ist schon auf etwa ein Viertel ihrer normalen Grße abgesunken. Einen grßeren Aussagewert hat die (einfach zu messende) PKr allerdings dann, wenn bei ein und demselben Patienten der Verlauf seiner Nierenfunktion in engen Zeitabst8nden verfolgt werden soll. 12.3 ungesättigt 0 p-Aminohippurat-Konzentration im Plasma (mmol/l) 2 4 6 8 10 700 5 4 500 p-Aminohippurat (PAH) 400 3 300 2 200 Inulin fraktionelle Ausscheidung 600 Clearance (ml/min) 1 100 Glucose 0 0 ungesättigt Auch f r einen x-beliebigen Stoff im Filtrat l8sst sich eine Clearance (Cx) bestimmen, wobei jede renale Clearance formal das bei der Nierenpassage vom Stoff X vllig befreite oder „gekl8rte“ Plasmavolumen/Zeit ist (daher der Name Clearance). Anschaulicher ist wohl der Clearancequotient (CX/CIn). Er ist identisch mit der Fraktion der filtrierten Stoffmenge/Zeit, die ausgeschieden wird. Man nennt ihn daher auch fraktionelle Ausscheidung oder fraktionelle Exkretion, kurz FE. Bei Inulin und Kreatinin wird die gesamte filtrierte Menge ausgeschieden: FE = 1. Ist FE < 1, wird der betreffende Stoff entlang des Tubulus und des Sammelrohrs nettoresorbiert. (Eine solche Netto- oder Per-saldo-Resorption kann u. U. auch das Ergebnis einer Resorption in einem Tubulusabschnitt und einer im Vergleich dazu geringeren Sekretion in einem anderen Tubulusabschnitt sein; s. u.) Der Teil der filtrierten Menge/Zeit, der wieder resorbiert wird, heißt fraktionelle Resorption; sie errechnet sich aus 1 – FE (Abb. 12.5, S. 328). F r bestimmte Substanzen wird eine FE > 1 gefunden. Wenn ein solcher Stoff nicht im Tubuluslumen gebildet wird, muss daraus geschlossen werden, dass er durch Sekretion ins Lumen gelangt ist (Abb. 12.5). Das ist typisch f r Substanzen, die besonders rasch aus dem Organismus entfernt werden sollen. Bestimmte Abfall-, Gift- und Fremdstoffe, z. B. Hippurat oder Penicillin, gehren dazu. Aber auch schon bei einer FE von 0,2 – 0,7, wie sie f r Harnstoff gemessen wird (Abb. 12.5, S. 328), ist die absolute Ausscheidung bereits sehr hoch, da ja die Bezugsgrße (filtrierte Menge/Zeit = GFR · Harnstoffplasmakonzentration = 180 l/d · 5 mmol/l = 900 mmol/d) so gewaltig ist. Die FE von p-Aminohippurat (PAH) betr8gt, als Extremfall, sogar rund 5 oder 500 %, d. h., die sezernierte PAH-Menge/Zeit ist rund viermal so groß wie die filtrierte Menge/Zeit. 100% Filtration + 400 % Sekretion ermglichen eine so schnelle Ausscheidung, dass in der Nierenvene kaum mehr PAH zu finden ist (s. u.). Da die Sekretion von PAH und anderen organischen S8uren und Basen durch s8ttigbare Carrier vermittelt wird (Abb. 12.35, S. 350 f.), sinkt die FE dieser Stoffe allerdings, wenn ihre Plasmakonzentration ansteigt (Abb. 12.9, obere Kurve). Sekretion zunehmend gesättigt 20 40 60 80 100 120 0 Glucosekonzentration im Plasma (mmol/l) Resorption zunehmend gesättigt Abb. 12.9 Hohe Plasmakonzentrationen s:ttigen die tubul:ren Carrier. Im Falle der Glucose (Resorptionscarrier) steigt dadurch die fraktionelle Ausscheidung (FE) von praktisch 0 bei normalen Plasmawerten gegen 1 an. Beim pAminohippurat (PAH; Sekretionscarrier) hingegen, das zur Bestimmung des renalen Plasmaflusses infundiert wird, f!llt die FE von ca. 5 (bei niedriger Plasmakonzentration) in Richtung 1 ab. Die PAH-Clearance ist daher nur bei unges!ttigter Sekretion als Maß f*r den renalen Plasmafluss g*ltig (nach 54). die GFR der meisten Glomeruli weitgehend blutdruckunabh:ngig ist und ganz den Anforderungen des SalzWasser-Haushalts angepasst werden kann. Als Mechanismen liegen der Autoregulation die myogene Reaktion der pr:glomerul:ren Gef:ße und ein tubuloglomerul:res Rckkopplungssignal im juxtamedull:ren Apparat sowie der Renin-Angiotensin-Mechanismus zugrunde. Eine Blutdruckabh:ngigkeit der Nierenmarkdurchblutung ist Ursache der Druckdiurese, die fr die Langzeitregulation des Blutdrucks wichtig ist. Die Nierendurchblutung Die hohe renale Durchblutung (RBF » 1,2 l/min) kommt zu 90 % der Rinde zugute, wo O2 grKßtenteils fr Resorptionsprozesse verbraucht wird. Da PAH von der Niere fast vollst:ndig extrahiert wird, ist die PAHClearance ein Maß fr den renalen Plasmafluss (RPF), aus dem sich mit dem H:matokrit der renale Blutfluss (RBF) errechnet. RBF und GFR sind autoreguliert, so dass Das Wundernetz Jede der beiden Nieren bekommt ihr arterielles Blut durch die A. renalis, das ber die Aa. interlobares in die Aa. arcuatae gelangt. Aus ihnen zweigen senkrecht in Richtung Nierenoberfl8che die Aa. interlobulares ab, von denen w8hrend des ganzen Verlaufs durch die Rinde allseits afferente Arteriolen abgehen, an denen die Glo- Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 331 332 12 Die Funktion der Nieren B Rinde Vas afferens peritubuläres Kapillarnetz Bürstensaum Verbindungsstück A. interlobularis distaler Tubulus (Konvolut) Glomerulus A. arcuata ®F proximaler Tubulus (Konvolut) kortikales Nephron äußeres Mark ®D juxtamedulläres Nephron Vasa recta proximaler Tubulus (Pars recta) inneres Mark D proximaler Tubulus (Konvolut) distaler Tubulus (dicker, aufsteigender Teil der Henle-Schleife) Henle-Schleife E Papille Mark dünner Teil der Henle-Schleife ®E Rinde Schaltzelle dünner Teil der Henle-Schleife A Hauptzelle A. renalis C Abb. 12.10 Feinstruktur der Niere. Die Nierenrinde enth!lt pro Niere ca. eine Million Glomeruli, die großteils kortikal (C links) und zu rund 20% marknah (juxtamedull!r, C rechts) angeordnet sind. Zu jedem Glomerulus gehrt ein Tubulus (zusammen Nephron genannt), dessen Henle-Schleife bei juxtamedull!ren Nephronen bis ins innere Nierenmark hinab- meruli wie Apfel am Stiel h8ngen (Abb. 12.10). Die afferente Arteriole (Vas afferens) verzweigt sich im Glomerulus in die glomerul-ren Kapillaren. Im Unterschied zu anderen Organkreisl8ufen schließen sich jetzt keine Venolen an, sondern die Glomeruluskapillaren treten wieder zu einer efferenten Arteriole (Vas efferens) zusammen, die sich in den oberfl8chlichen und mittelkortikalen Glomeruli anschließend erneut zu den peritubul-ren Kapillaren verzweigt (daher die alte Bezeichnung „Wundernetz“). Sie versorgen vor allem die Tubuluszellen der Nierenrinde. Das Nierenmark wird nicht durch Arterien, sondern durch die efferenten Arteriolen der marknahen, sog. juxtamedull8ren Glomeruli versorgt. Diese Arteriolen verzweigen sich im Mark in die absteigenden Vasa recta (Abb. 12.10). Von den peritubul8ren Kapillaren (Nierenrinde) sowie ber aufsteigende Vasa recta (Nierenmark) gelangt das vense Blut nacheinander in die Vv. arcuatae, die Vv. interlobares und die V. renalis und erreicht schließlich die V. cava. Sammelrohr F kortikales Sammelrohr reicht. Der distale Tubulus m*ndet *ber ein Verbindungsst*ck in ein Sammelrohr. Das Kapillarnetz der Rinde wird von den Vasa efferentia der kortikalen Glomeruli, die Vasa recta des Marks von den Vasa efferentia juxtamedull!rer Glomeruli gespeist (B) (elektronenmikroskopische Aufnahmen: W. Kriz). Die Nierenrinde ist stark durchblutet Zu den Nieren fließen etwa 15 – 25 % des Herzzeitvolumens (im Mittel rund 1,2 l/min, s. Tab. 12.2, S. 333), eine enorm starke Durchblutung (renaler Blutfluss, RBF) also, wenn man bedenkt, dass sie am Krpergewicht nur mit ca. 0,4 % beteiligt sind. Ihre auf das Organgewicht bezogene Durchblutung von 3 – 5 ml/min pro g Gewebe wird z. B. vom Myokard nur bei maximaler Koronardilatation erreicht. W8hrend es beim Herzmuskel aber der Sauerstoffbedarf ist, der die hohe Durchblutung erfordert, steht die hohe renale Durchblutung ganz im Dienste der Filtratbildung und damit letztendlich in dem der Regulations- und Ausscheidungsaufgaben der Nieren. Da die Filtratbildung eine Aufgabe der Rinde ist, verwundert es nicht, dass diese rund 90 % des RBF erh8lt, w8hrend das 8ußere Mark ca. 10 % und das innere Mark gar nur 1 – 2% bekommt. Die renale arterioven8se O2-Differenz betr8gt wegen der vergleichsweise extrem hohen Durchblutung nur etwa 14 ml/l Blut, d. h., dem arteriell herangef hrten Blut (mit ca. 200 ml O2/l Blut) werden nur 7% seines O2 entnommen Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 12.3 Die Nierendurchblutung Voraussetzung f r die Bestimmung des RBF mit der PAHClearance ist, dass die Nieren auch wirklich die oben genannten 90 % des arteriellen PAH extrahieren. Das tun sie allerdings nur bei relativ niedriger PAH-Plasmakonzentration (KM » 10 mmol/l), bei der die PAH-Sekretion noch nicht ges8ttigt ist (Abb. 12.9, obere Kurve). Wird der Urin nicht durch Miktion aus der Harnblase, sondern mittels eines Katheters aus einem der beiden Ureteren gesammelt, kann die Nierendurchblutung mit der PAH-Clearance auch seitengetrennt bestimmt werden. Mit Radioisotopen oder Rntgenkontrastmitteln, die sich in der Niere 8hnlich wie PAH verhalten, ist es mglich, die Nierendurchblutung auch mit Scannern bzw. am Rntgenschirm abzusch8tzen und vor allem einen Vergleich zwischen den beiden Nieren anzustellen. Tabelle 12.2 Globale Funktionswerte der Nieren – Renaler Plasmafluss (RPF, autoreguliert): 480 – 800 ml/min pro 1,73 m2 KO* – Renale Durchblutung (RBF) = RPF/(1 – Hkt**) = 870 – 1540 ml/min pro 1,73 m2 KO* – Glomerul!re Filtrationsrate (GFR, autoreguliert): ca. 120 ml/min pro 1,73 m2 KO* – Filtrationsfraktion (FF = GFR/RPF): ca. 0,19 (u. a. Atriopeptin-abh!ngig) – Urinzeitvolumen (V̇U): 0,7 – 1,8 l/d – Harnosmolalit!t: Normalbereich ca. 250 – 1000 mosm/kgH2O – Harn-pH-Wert: 4,5 – 8,2 – Fraktionelle Ausscheidung im Harn (FE): s. Tab. 12.3 (S. 338) und Abb.12.5 (S. 328) Blutdruckabfall entlang der Nierengef1ße * Krperoberfl!che ** H!matokrit, hier 0,45 eingesetzt (s. a. Tab. 10.7, S. 302). Bentigt wird der Sauerstoff haupts8chlich f r die prim8r-aktive, d. h. ATP-verbrauchende Resorption des filtrierten Na+. In einer nicht filtrierenden und daher nicht resorbierenden Niere sinkt der O2Verbrauch auf einen basalen Wert von etwa 10 % des normalen Wertes. Das heißt, wenn RBF und GFR kleiner werden, sinkt die Na+-Resorption und folglich auch der O2-Bedarf. Hier bestimmt also die Durchblutung den O2-Verbrauch und nicht umgekehrt – wie etwa beim Myokard – der O2-Bedarf die Durchblutung. Damit wird auch klar, dass die renale Durchblutung nicht (wie etwa die von Herz und Gehirn) metabolisch geregelt sein kann, sondern im Dienste der spezifischen Nierenfunktionen, n8mlich Filtration, Resorption und Ausscheidung, steht. Durchblutungsmessung mit PAH Wie bereits oben erw8hnt, wird p-Aminohippurat (PAH) nicht nur filtriert, sondern auch sehr stark sezerniert, so dass fast die gesamte (90 %) arteriell ankommende PAHMenge mit dem Urin ausgeschieden wird. Setzt man also die arteriell ankommende mit der ausgeschiedenen PAHMenge/Zeit (ungef8hr) gleich, so ergibt sich: RPF · PPAH » V̇u · UPAH RPF » (V̇u · UPAH)/PPAH oder (12.4) (12.5) Mit anderen Worten: Der renale Plasmafluss (RPF) entspricht in etwa der PAH-Clearance (S. 331). Das heißt, nach Messung der drei Grßen auf der rechten Seite der Gleichung 12.5 kann der RPF errechnet werden. Wird auch noch ber cksichtigt, dass im Urin nicht 100%, sondern nur 90% des arteriell herangef hrten PAH erscheinen, so muss die PAH-Clearance noch durch 0,9 geteilt werden, um den RPF zu erhalten. Und nun der letzte Schritt, die Umrechnung von renalem Plasmafluss (RPF) in renale Durchblutung (renaler Blutfluss, RBF) mit Hilfe des H8matokrits (Hkt; S. 224): RBF = RPF/(1 – Hkt) Der Druck am Ende der Aa. arcuatae betr8gt rund 96 mmHg. Wie groß der Druckabfall in den anschließenden Aa. interlobulares ist, h8ngt nun von deren einbezogener L8nge ab, d. h., wie fr h die betrachtete afferente Arteriole abzweigt: 90 mmHg marknah und 67 mmHg unter der Nierenoberfl8che sind Werte, die bei der Ratte gemessen wurden. Andern sich diese unterschiedlichen Werte entlang dieses Gef8ßes absolut und/oder relativ zueinander, sei es durch Widerstands8nderung entlang der A. interlobularis selbst oder im Verlauf der nachgeschalteten Gef8ße, so wird sich der Druck in den marknahen und markfernen Glomeruli unterschiedlich 8ndern. Dies ist eine der Mglichkeiten, wie sich der Anteil der Markdurchblutung an der gesamten Nierendurchblutung sowie der jeweilige Beitrag der kortikalen und der juxtamedull8ren Glomeruli zur gesamten glomerul8ren Filtrationsrate (GFR) ver8ndern kann. In den glomerul8ren Kapillaren herrscht ein Druck von ca. 48 mmHg. (Dieser Druck wurde an der Ratte direkt gemessen und d rfte beim Menschen sehr 8hnlich sein.) Dieser Kapillardruck ist die treibende Kraft f r die glomerul8re Filtration (S. 337 f.). Der Druckabfall innerhalb der Glomeruluskapillaren ist sehr gering (ca. 1 – 2 mmHg). Andert sich der pr-glomerul-re Widerstand (A. interlobularis und Vas afferens) alleine, so variieren Durchblutung und GFR gleichsinnig, w8hrend eine gleichzeitige Anderung des postglomerul-ren Widerstands (v. a. Vas efferens) eine weitgehend unabh8ngige Regulation der beiden Grßen ermglicht (S. 338 f.). Zum postglomerul8ren Widerstand tragen auch die intrarenalen Venen bei. W8hrend die Gef8ßweite der A. interlobularis und der Arteriolen vorwiegend durch deren glatte Muskulatur eingestellt wird, ist die Weite der intrarenalen Venen sehr stark vom interstitiellen Druck in der Niere abh8ngig. Eine Abflussbehinderung z. B. in den ableitenden Harnwegen (S. 363 f.) oder eine osmotische Diurese (S. 353), bei der die Lumina der Tubuli vergrßert sind, erhhen diesen Druck in der gesamten Niere, weil sie von einer widerstandsf8higen Kapsel umgeben ist. (12.6) Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 333 GFR 4 2 3 1 4 3 5 6 7 0,4 Autoregulationsbereich 2 0,2 RBF 1 0 0 40 120 160 200 mittlerer arterieller Blutdruck (mmHg) 180 240 0 7 6 150 Blutdruck (mmHg) 80 GFR (ml/min pro g Gewebe) 0,6 5 120 Kapillardruck konstant 4 3 90 2 60 1 Harnzeitvolumen in % der GFR 12 Die Funktion der Nieren RBF (ml/min pro g Gewebe) 40 30 20 Druckdiurese 10 0 Anurie 0 80 160 240 mittlerer arterieller Blutdruck (mmHg) 320 Abb. 12.12 Druckdiurese. Trotz Autoregulation von RBF und GFR (Abb. 12.11) steigt bei einer Blutdruckerhhung die fraktionelle Wasserausscheidung (Harnzeitvolumen/GFR) (54). Verantwortlich daf*r ist eine druckabh!ngige Underung der Nierenmarkdurchblutung. Obwohl die Mechanismen der Druckdiurese nicht ganz gekl!rt sind (u. a. Beteiligung vasodilatatorischer Prostaglandine?), spielt sie eine entscheidende Rolle bei der langfristigen Blutdruckregulation (23, 29). Zu beachten ist auch, dass die Urinproduktion versiegt (Anurie), wenn der arterielle Mitteldruck auf ca. 50 mmHg abgesunken ist. Glomerulus Vas afferens 0 A. interlobularis 30 A. arcuata 334 Abb. 12.11 Autoregulation der Niere. Die Nieren(rinden)durchblutung (RBF) bleibt bei Schwankungen des systemischen mittleren Blutdrucks im Bereich von ca. 80 – 170 mmHg weitgehend konstant. Die Folge davon ist eine ebenfalls konstante glomerul!re Filtrationsrate (GFR). Diese autoregulatorische Underung der intrarenalen Strmungswiderst!nde scheint bei kleinen Abweichungen (3 und 5) vom Normaldruck (4) in den Aa. interlobulares und bei st!rkeren Underungen (2 und 6) zus!tzlich in den Vasa afferentia zu geschehen. Bei noch grßeren Druckabweichungen f!llt bzw. steigt RBF (1 und 7). (Der hier im Tierversuch gefundene Ausgangsdruck bei 4 von 120 mmHg betr!gt beim Menschen normalerweise ca. 100 mmHg) (nach 52 und 64). Autoregulation im Dienst von Filtration und Salzausscheidung Die Nierendurchblutung (RBF) steigt zwar mit dem mittleren Blutdruck bis etwa 80 mmHg linear an, bleibt dann aber trotz weiterer Steigerung des Mitteldrucks bis ca. 170 mmHg weitgehend konstant. Ahnliches gilt f r die GFR, doch steigt diese, im Gegensatz zum RBF, auch bei sehr hohem Blutdruck kaum weiter an (Abb. 12.11), weil es entlang der Glomeruluskapillaren dann fr hzeitig zum Filtrationsgleichgewicht kommt (Abb. 12.14, S. 337). Die zunehmende Drucksteigerung zwischen 80 und 170 mmHg wird also offenbar mit einer zunehmenden Erhhung des renalen Strmungswiderstands beantwortet. Da diese Regulation auch ohne Innervation und ohne extrarenale Hormone funktioniert, ist sie ein intra- renaler Prozess: Autoregulation der Nierendurchblutung (S. 189). Dass trotz der im Regelbereich konstanten GFR die renale Ausscheidung von Salz und Wasser mit dem Blutdruck etwas ansteigt (Druckdiurese, Abb. 12.12), wird damit erkl8rt, dass die juxtamedull8ren Glomeruli – und damit deren GFR sowie die von ihnen ausgehende Markdurchblutung – nicht oder nicht im gleichen Umfang wie die kortikalen Glomeruli autoreguliert sind (s. o.). Eine Verminderung der renalen Konzentrierungsf8higkeit (unter eventueller Mitwirkung von Angiotensin II und Prostaglandinen) ist daran beteiligt. Die Druckdiurese spielt eine entscheidende Rolle bei der Langzeitregulation des Blutdrucks. Steigt er volumenbedingt an, wird der Extrazellul8rraum via Druckdiurese verkleinert, was den Blutdruck wieder senkt usw. (S. 385). Die Mechanismen der renalen Autoregulation sind noch nicht vllig gekl8rt. Sicher daran beteiligt sind zwei Prozesse: 1. Die myogene Reaktion (Bayliss-Effekt) der pr8glomerul8ren Nierengef8ße. Die Aa. interlobulares und die afferenten Arteriolen beantworten eine Blutdruckerhhung mit einer Konstriktion. Bei nur geringer Druckerhhung reagieren von diesen in Serie geschalteten Gef8ßabschnitten die am weitesten stromaufw8rts liegenden, so dass die Druckerhhung gar nicht bis zu den afferenten Arteriolen durchdringt. Steigt der Blutdruck st8rker an, werden zunehmend auch die weiter stromabw8rts liegenden Gef8ßabschnitte in die Reaktion mit einbezogen. Erst bei Dr cken jenseits der Autoregulationsgrenze von ca. 170 mmHg schl8gt die Druckerhhung auf Glomerulus und postglomerul8re Gef8ße durch (Abb. 12.11). 2. Der tubuloglomerul-re Rckkopplungs-(Feedback-) Mechanismus (TGF; S. 338 f.). Voraussetzung f r ihn Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 12.3 Die Nierendurchblutung Vas afferens distaler Tubulus Nervenfasern Vas efferens Macula densa granulierte Zellen Mesangiumzellen Endothel dreischichtige Basalmembran Endothelpore Epithelzelle Filtration BowmanKapsel-Raum Schlitzmembran Fußfortsatz proximaler Tubulus Fußfortsatz Filtrat Abb. 12.13 Glomerul:res Filter und juxtaglomerul:rer Apparat. Das glomerul!re Filter besteht aus drei Schichten, dem gefensterten Kapillarendothel, der Basalmembran und dem harnseitigen Epithel mit Podozyten, zwischen deren Fußforts!tzen Schlitzmembranen mit kleinen Poren ausgespannt sind. Durch dieses Filter werden pro Glomerulus ca. 70 Ml/d und in beiden Nieren zusammen 180 l/d abfiltriert (GFR). Zum juxtaglomerul!ren Apparat (JGA) gehren die ist die anatomische Tatsache, dass die in der Wand des distalen Tubulus gelegene Macula densa innerhalb des juxtaglomerul-ren Apparats mit dem eigenen Glomerulus in direktem Kontakt steht (Abb. 12.13). Informationen ber die Zusammensetzung des distalen Tubulusharns knnten somit, so besagt eine 50 Jahre alte Idee, ber Macula-densa- und Mesangiumzellen v. a. die afferente Arteriole erreichen und dort den Strmungswiderstand ver8ndern. Tats8chlich konnte dann (viel sp8ter) gezeigt werden, dass eine Erhhung der luminalen NaCl-Konzentration an der Macula densa die Filtrationsrate am zugehrigen Glomerulus senkt. Da die distale NaCl-Konzentration (unter anderem) von der filtrierten NaCl-Menge/Zeit (= GFR · Plasma-Na+-Konzentration) und somit von der Filtrationsrate des eigenen Glomerulus abh8ngt, kann diese R ckkopplungsschleife der Autoregulation von RBF und GFR dienen. reninhaltigen, sog. granulierten Zellen (in der Wand des Vas afferens), die Macula-densa-Zellen des zu diesem Glomerulus gehrigen distalen Tubulus und die extraglomerul!ren Mesangiumzellen (Polkissen). Der JGA bietet die Mglichkeit, die GFR der Zusammensetzung (NaCl!) des fr*hdistalen Tubulusharns anzupassen: tubuloglomerul!rer R*ckkopplungsmechanismus (nach 10 und 47; rasterelektronenmikroskopische Aufnahmen: W. Kriz). Trotz einiger noch offener Fragen l8sst sich ber die physiologische Bedeutung der beiden Mechanismen vereinfachend Folgendes sagen: Der myogene Mechanismus h8lt ber eine Widerstands8nderung pr8glomerul8rer Gef8ße den RBF und (davon abh8ngig) die GFR trotz stark wechselndem (vor allem erhhtem) systemischen Blutdruck konstant (Reaktionszeit ca. 1 s). Der TGF-Mechanismus hingegen passt im normalen Blutdruckbereich die GFR den Salz-Wasser-Ausscheidungsbed rfnissen an, wobei die Gef8ßweite v. a. der afferenten Arteriole verstellt wird (Reaktionszeit ca. 10 s). Sind diese Bed rfnisse konstant, werden GFR und RBF durch den TGF-Mechanismus stabilisiert (s. a. S. 338 f.). Zu den beiden genannten Mechanismen kommt ein weiterer Regelkreis hinzu: der Renin-Angiotensin-Mechanismus (S. 369 f. und S. 384 f.). Zusammen mit den beiden obigen Mechanismen verhindert er am unteren Ende des Autoregulationsbereichs (80 – 90 mmHg) wahrscheinlich dadurch ein Absinken der GFR, dass er den Widerstand in der efferenten Arteriole erhht, wobei die Filtrationsfraktion (s. u.) ansteigt. Klinke, Pape, Silbernagl, Physiologie (ISBN 3137960053), K 2005 Georg Thieme Verlag KG 335