Grundwissen Chemie
Werbung

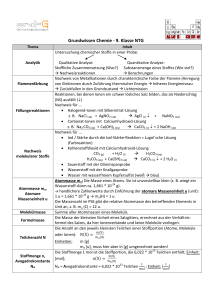
Grundwissen Chemie - 9 Klasse NTG Thema Inhalt Analytik Untersuchung chemischer Stoffe in einer Probe: Qualitative Analyse: Stoffliche Zusammensetzung (was?) Flammenfärbung Fällungsreaktionen Nachweis molekularer Stoffe Masse ma Molekülmasse Formelmasse Teilchenzahl N Quantitative Analyse: Substanzmenge eines Stoffes (Wieviel?) Nachweisreaktionen Berechnungen Nachweis von Metallkationen durch charakteristische Farbe der Flamme (Anregung von Elektronen durch Zuführung thermischer Energie höheres Energieniveau Zurückfallen in den Grundzustand Lichtemission Reaktionen, bei denen Ionen ein schwer lösliches Salz bilden, das als Niederschlag (NS) ausfällt () Nachweis für ... Halogenid-Ionen mit Silbernitrat-Lösung z.B. NaCl (aq) + AgNO3 (aq) AgCl (s) + NaNO3 (aq) Carbonat-Ionen mit Calciumhydroxid-Lösung z.B. Na2 CO3(aq) + Ca(OH)2 (aq) CaCO3 (aq) + 2 NaOH(aq) Nachweis für ... Iod / Stärke durch die Iod-Stärke-Reaktion = Lugol´sche Lösung (Farbreaktion) Kohlenstoffdioxid mit Calciumhydroxid-Lösung CO2(g) + H2O (l) H2CO3 (aq) H2CO3 (aq) + Ca(OH)2 (aq) CaCO3 (s) + 2 H2O(l) Sauerstoff mit der Glimmspanprobe Wasserstoff mit der Knallgasprobe Wasser mit wasserfreiem Kupfersulfat (weiß blau) Die Masse eines Atoms. Die Masse eines Atoms ist unvorstellbar klein (z.B. wiegt ein Wasserstoff-Atom ca. 1,661 . 10-24 g) handlichere Zahlenwerte durch Einführung der atomare Masseneinheit m a mit der Einheit [u] (unit): 1u = 1,661 * 10-24g ma(H) = 1u Die Massenzahl im PSE gibt die relative Atommasse des betreffenden Elements in Unit an. Beispiel: ma (C) = 12 u Summe aller Atommassen in einem Molekül Die Masse der kleinsten Einheit eines Salzgitters, errechnet aus der Verhältnisformel des Salzes, da hier Ionenverbände und keine Moleküle vorliegen Die Anzahl an den jeweils kleinsten Teilchen einer Stoffportion (Atome, Moleküle oder Ionen) Einheiten: m [g] ma [u], muss aber hier in [g] umgerechnet werden!!! Stoffmenge n Einheit Mol, Einheitszeichen [mol] Die Stoffmenge 1 mol ist die Stoffportion, die 6,022 . 1023 Teilchen enthält: Avogadrokonstante NA = 6,022 . 1023 Teilchen . 1/mol Einheit (NA): Molare Masse M Molares Volumen Vm Molekülstruktur Elektronenpaarbindung Lewis-Schreibweise Elektronenpaarabstoßungsmodell (EPA = VSEPR) Elektronegativität Polare Elektronenpaarbindung Masse der Stoffmenge 1 mol eines Stoffes X; Einheit [g/mol] n [mol] (Die Masse eines Teilchens in Unit hat den gleichen Zahlenwert wie die Masse von 6,022 .1023 Teilchen in Gramm) Satz von Avogadro: "Gleiche Volumina verschiedener Gase enthalten bei gleichem Druck und gleicher Temperatur gleich viele Teilchen" Vm = das Volumen, das 1 mol eines Gases einnimmt. Normbedingungen (0°C, 1 bar): Vm beträgt bei allen Gasen 22,4 L/mol Standardbedingungen (25°C, 1 bar): Vm beträgt bei allen Gasen 24 L/mol Vm = V/n [Einheiten: L/mol] Molekülgeometrie: räumliche Anordnung von Atomen oder Atomgruppen in einem Molekül = Atombindung (echte chemische Bindung): Atome binden miteinander, indem sie Valenzelektronen der äußersten Energiestufe gemeinsam benutzen Erreichen der Edelgaskonfiguration. Bindungsart der Nichtmetallatome Moleküle = Valenzstrichformel: Ein Strich zwischen zwei Atomen stellt das gemeinsam benutzte Elektronenpaar dar und somit die Elektronenpaarbindung Zwei Atome durch ... eine Elektronenpaarbindung miteinander verbunden = Einfachbindung zwei Elektronenpaarbindungen miteinander verbunden = Doppelbindung drei Elektronenpaarbindungen miteinander verbunden = Dreifachbindung Freie Elektronenpaare (= nicht an der Bindung beteiligt) werden ebenfalls als Strich dargestellt, jedoch nur dem jeweiligen Atom zugeordnet. Modell zur Ermittlung des räumlichen Baus von Molekülen: Bindende und nichtbindende Elektronenpaare werden so um die Atome eines Moleküls angeordnet, dass sie im größtmöglichen Abstand zueinander stehen (Nichtbindende Elektronenpaare benötigen mehr Platz als Bindende die Bindungswinkel zwischen den bindenden Elektronenpaaren [EP] werden kleiner) Beispiele: Methan (CH4) : 4 bindende EP Tetraeder Ammoniak (NH3): 3 bindende und 1 nichtbindendes EP trigonale Pyramide Wasser (H2O): 2 bindende und 2 nichtbindende EP gewinkeltes Molekül Maß, wie stark ein Atom Bindungselektronen an sich zieht steigt innerhalb einer Periode von links nach rechts steigt innerhalb einer Hauptgruppe von unten nach oben elektronegativstes Element: Fluor Sind in einem Molekül Atome unterschiedlicher Elektronegativität (EN) miteinander verbunden, ist das bindende Elektronenpaar stärker zum elektronegativeren Atom verschoben polare Bindung: Das elektronegativere Dipol Unpolares Molekül Zwischenmolekulare Kräfte Van der WaalsWechselwirkungen Dipol-DipolWechselwirkungen Wasserstoffbrücken Stoffeigenschaften Atom hat eine negative Partialladung (δ-), das elektropositivere Atom hat eine positive Partialladung (δ+) Polares Molekül, bei welchem die Ladungsschwerpunkte nicht symmetrisch verteilt sind, d.h. die Ladungsverschiebungen im Molekül heben sich nicht auf (z.B. HF, H2O, NH3). Moleküle ohne polare Elektronenpaarbindungen oder Moleküle mit polaren Elektronenpaarbindungen, bei denen die Ladungsschwerpunkte symmetrisch verteilt sind (z.B. CH4, CO2). = intermolekulare Wechselwirkungen: Elektrostatische Anziehungskräfte zwischen Molekülen. Man unterscheidet u.a.: Van der Waals- und Dipol-Dipol- Wechselwirkungen sowie Wasserstoffbrücken Wirken zwischen unpolaren Molekülen als Folge der Bildung von induzierten Dipolen schwächste zwischenmolekulare Wechselwirkung Anziehungskräfte zwischen Dipolen Herrschen zwischen (mindestens) zwei Dipolmolekülen Wasserstoffbrücken ergeben sich zwischen der Anziehung eines positiv polarisierten H-Atom und eines negativ polarisierten Atoms zweier Dipolmoleküle. δ+ δδ+ δ.............. Beispiel: H _ F ........ H _ F = Wasserstoffbrücke Ergeben sich aus den zwischenmolekularen Wechselwirkungen eines Teilchenverbands Protolysereaktionen Reaktionen, bei welchen Proton(en) von einer Säure auf eine Base übertragen werden (Brönsted-)Säuren = Protonendonatoren; geben Protonen (= H+-Ionen) ab (Brönsted-)Basen = Protonenakzeptoren; nehmen Protonen auf Wichtige Säuren Name des SäurerestsSäure Formel Säurerest(e) und ihre SäurerestIons Ionen Salzsäure HCl Cl Chlorid HSO4 Hydrogensulfat Schwefelsäure H2SO4 2SO4 Sulfat SchwefelwasserstoffHS Hydrogensulfid H2S säure S2Sulfid HCO3 Hydrogencarbonat Kohlensäure H2CO3 2CO3 Carbonat H2PO4 Dihydrogenphosphat Phosphorsäure H3PO4 HPO42Hydrogenphosphat 3PO4 Phosphat Salpetersäure HNO3 NO3 Nitrat Ampholyte Stoffe, die je nach Reaktionspartner als Säure oder als Base reagieren können Korresponierendes Säure-Base-Paar Saure Lösungen Alkalische Lösung Indikatoren Säure-BaseIndikatoren pH-Wert In einer Protolysereaktion bezeichnet man die Säure und die nach Protonenabgabe daraus entstandene Base als korresponierendes Säure-Base-Paar. Sie unterscheiden sich um ein Proton. Beispiel: H2O/OH- sowie NH4+/ NH3 Lösungen, die Oxoniumionen (H3O+) enthalten. = Laugen; Lösungen, die Hydroxidionen enthalten (OH-) Stoffe oder Geräte, die den Zustand eines chemischen Systems anzeigen können Farbstoffe, die durch ihre Eigenfarbe anzeigen, ob eine saure, alkalische oder neutrale Lösung vorliegt. Beispiele: Phenolphthalein (saure Lösung farblos; neutral farblos; alkalische Lösung pink) Lackmus (saure Lösung rot; neutral violett; alkalische Lösung blau) Bromthymolblau (saure Lösung gelb; neutral grün; alkalische Lösung blau) Das Maß für die Oxoniumionen- und Hydroxidionenkonzentration in einer Lösung. Die pH-Skala umfasst die Zahlen von 0-14. pH < 7: saure Lösung (Oxoniumionenkonzentration > Hydroxidionenkonzentration) pH = 7: neutrale Lösung (Oxoniumionenkonzentration = Hydroxidionenkonzentration) pH > 7: alkalische Lösung (Oxoniumionenkonzentration < Hydroxidionenkonzentration) Neutralisation Die Konzentration einer Lösung Saure und alkalische Lösungen neutralisieren sich, wenn die Stoffmenge der Oxoniumionen der Stoffmenge der Hydroxidionen und dies zu Wasser reagieren: H3O+ + OH- 2 H2O Daneben entsteht das jeweilige Salz (in gelöster Form). Die Stoffmengenkonzentration c gibt die Stoffmenge des gelösten Stoffes pro Volumen der Lösung an. Die Stoffmengenkonzentration lässt sich durch eine Titration ermitteln. Einheit: mol/l Titration Redoxreaktionen Oxidation Reduktion Elektronendonator Elektronenakzeptor Konzept der Oxidationszahl (OZ) = Maßanalyse Prinzip: Zur Lösung eines Stoffs unbekannter Konzentration (Probelösung) wird so viel von einer Lösung bekannter Konzentration (Maßlösung) zugefügt, bis ein Indikator den Endpunkt der Umsetzung (Äquivalenzpunk) anzeigt. Aus dem Verbrauch an Maßlösung wird die Stoffmengen-konzentration an Probelösung ausgerechnet. = Reduktions-Oxidations-Reaktionen: Reaktionen, bei welchen Elektronen von einem Elektronendonator auf einen Elektronenakzeptor übertragen werden. = Abgabe von Elektronen = Aufnahme von Elektronen = Reduktionsmittel gibt Elektronen ab ( wird oxidiert) und reduziert den Reaktionspartner = Oxidationsmittel nimmt Elektronen auf ( wird reduziert) und oxidiert den Reaktionspartner Formales Hilfsmittel um zu entscheiden, ob eine Reaktion eine Redoxreaktion ist oder nicht Redoxreihe Galvanische Elemente Elektrolyse Vorgehensweise: In einer Elektronenpaarbindung ordnet man die Bindungselektronen formal jeweils dem elektronegativeren Atom zu. Es ergeben sich fiktive, also formale Ladungen = Oxidationszahlen ändern sich in der Reaktionsgleichung die OZ einzelner Atome, handelt es sich um eine Redoxreaktion Metalle werden nach ihrem Reduktionsvermögen in eine Reihe eingeordnet werden, die sog. Redoxreihe der Metalle. Galvanische Elemente liefern elektrischen Strom. Sie wandeln chemische Energie in elektrische Energie um (Batterie). = erzwungene Redoxreaktion die Reaktionsabläufe in galvanischen Elementen werden durch Anlegen einer Gleichspannung umgekehrt. Allgemeine Elektrodenbezeichnung: 1) Kathode: hier findet die Reduktion statt. 2) Anode: hier findet die Oxidation statt.