Wasser-, Lebensmittel- und Betriebshygiene
Werbung

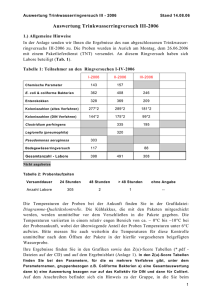
Wasser-, Lebensmittel- und Betriebshygiene Dezember 2013 1 ALLGEMEINE VERHALTENSWEISEN IM MIKROBIOLOGISCHEN LABOR • Rauch-, Eß- und Trinkverbot • Äußerste Sauberkeit und Ordnung im Raum und am Arbeitsplatz • vor Beginn der Arbeit und nach Beendigung der Arbeit Hände desinfizieren • Schutzkleidung (weißer Arbeitsmantel) • Arbeitsfläche vor Beginn und nach Beendigung der Arbeit desinfizieren (Wischtechnik!) • Sachgemäße Entsorgung der kontaminierten Gegenstände SACHGEMÄSSE ENTSORGUNG! (Nur Agarplatten, Plastikpipette, Handschuhe) KEIN GLAS OBJEKTTRÄGER 2 Vortexer Stomacher Drigalskispatel 3 Bunsenbrenner nicht unbeaufsichtigt lassen (nur bei Bedarf anzünden) 4 BAKTERIOLOGISCHE WASSERUNTERSUCHUNG BAKTERIOLOGISCHE WASSERUNTERSUCHUNG 1. Anahl koloniebildender Einheiten/ml (KBE/ml) 2. Qualitative Untersuchung auf das Vorhandensein von coliformen Bakterien und E. coli in einer Probenmenge von 100 ml Wasser 2.1.: Ansatz eines Presence-Absence-Tests mit Eijkman-Bouillon 2.2.: Ansatz eines Presence-Absence-Tests mit LMX-Bouillon 2.3.: Ansatz eines Presence-Absence-Tests mit Readycult Coliforms 3. Qualitative Untersuchung auf das Vorhandensein von Enterokokken in einer Probenmenge von 100 ml Wasser (Presence/Absence) mit Chromocult-Enterokokken- Bouillon. 4. Quantitative Untersuchung auf das Vorhandensein von E.coli and Coliformen Bakterien in einer Probenmenge von 100 ml Wasser (Membranfiltration) mit CC Agar 5. Quantitative Untersuchung auf das Vorhandensein von Enterokokken in einer Probenmenge von 100 ml Wasser (Membranfiltration) mit Kanamycin-Äsculin-Azid-Agar 6. Quantitative Untersuchung auf das Vorhandensein von P.aeruginosa in einer Probenmenge von 100 ml Wasser (Membranfiltration) mit Pseudomonas Agar 7. Semiquantitative Untersuchung auf das Vorhandensein von coliformen Bakterien in einer Probenmenge von 100 ml (Most Probable Number, MPN) mit Eijkman-Bouillon 5 1. Anzahl koloniebildender Einheiten/ml: Probenvolumen: PCA 0 -1 Dextrose 0 -1 0,1 ml 1 ml 0,1 ml 1 ml Plate-Count-Agar (PCA), Inkubation: 22°C, 48 h. Caseinpepton-Glucose-Hefeextrakt-Agar (PCA): Hemmstoff- und indikatorfreier Nährboden, zur Bestimmung der Gesamtkeimzahl in Milch, Milchprodukten, Wasser und anderen Materialien. Dextrose-Agar (D), Inkubation: 37°C, 48 h. Bromthymolblau dient zur Hemmung der Gram-positiven Bakterien, Säurebildung durch Verwertung von Zucker sichtbar durch Farbumschlag des Indikators (orange/gelb). Angabe der Ergebnisse: KBE/ml bei 22°C ...........KBE/ml bei 37°C (Gesamt/Säurebildner) .................. INDIKATORWERTE 2. Qualitative Untersuchung auf das Vorhandensein von coliformen Bakterien und E. coli in einer Probenmenge von 100 ml Wasser 2.1.: Ansatz eines Presence-Absence-Tests mit Eijkman-Bouillon 100 ml Wasserprobe in 2-fach konzentrierte Lactose-Bouillon mit Gärfänger, 37°C/2d wenn positiv (Säure- und Gasbildung) Chromocult-Coliform-Agar, frakt. Ausstrich, 37°C/1d blaue - violette Kolonien: E. coli, Indol-positiv, Cytochromoxidase-negativ API 10E rosa - rote Kolonien:coliforme Bakterien, Cytochromoxidase-negativ API 10E Lactose-Bouillon: Lactoseverwertung wird durch Umschlag von Chlorphenolrot angezeigt, Gasbildung ist im Gärfänger sichtbar. Angabe der Ergebnisse: Coliforme Bakterien/100 ml (nachweisbar/nicht nachweisbar)..... E. coli/100 ml (nachweisbar/nicht nachweisbar)........................... 6 100 ml Wasserprobe in 2-fach konzentrierte Lactose-Bouillon mit Gärfänger, 37°C/1-2d Beurteilung von Säure- und Gasbildung Lactose-Bouillon: Lactoseverwertung wird durch Umschlag von Chlorphenolrot angezeigt, Gasbildung ist im Gärfänger sichtbar. 7 2.2.: Ansatz eines Presence-Absence-Tests mit LMXBouillon 100 ml Wasserprobe in 2-fach konzentrierte LMX-Bouillon, 37°C/1d Beurteilung von Blaufärbung und Fluoreszenz: wenn positiv, weitere Bestätigung CCA, frakt. Ausstrich, 37°C/1d blaue - violette Kolonien:E. coli, Indol-positiv, Cytochromoxidase-negativ API 10E rosa - rote Kolonien:coliforme Bakterien, Cytochromoxidase-negativ API 10E Angabe der Ergebnisse: Coliforme Bakterien/100 ml (nachweisbar/nicht nachweisbar) ...................... E. coli/100 ml (nachweisbar/nicht nachweisbar) ............................................ 100 ml Wasserprobe in 2-fach konzentrierte LMX-Bouillon, 37°C/1d Beurteilung von Grün-Blaufärbung (coliforme Bakterien) Fluoreszenz (unter UV LICHT): E.coli 8 2.3.: Ansatz eines Presence-Absence-Tests mit Readycult Coliforms • Ein Blister von Readycult in 100 ml Wasserprobe geben, 37°C/1d • • • • • Beurteilung von Blaufärbung und Fluoreszenz: wenn positiv, weitere Bestätigung CCA, frakt. Ausstrich, 37°C/1d blaue - violette Kolonien:E. coli, Indol-positiv, Cytochromoxidase-negativ API 10E rosa - rote Kolonien:coliforme Bakterien, Cytochromoxidase-negativ API 10E • • • Angabe der Ergebnisse: Coliforme Bakterien/100 ml (nachweisbar/nicht nachweisbar) ...................... E. coli/100 ml (nachweisbar/nicht nachweisbar) ............................................ 9 Readycult Coliforms MEMBRANFILTERVERFAHREN • Das Membranfilterverfahren ist eine Methode zur mechanischen Anreicherung von Mikroorganismen aus einer beliebigen Menge eines filtrierbaren Untersuchungsmaterials. Dies erlaubt selbst bei minimalem Keimgehalt eine exakte Keimzahlbestimmung. 10 Trichter mit Alkohol befeuchten Abflammen 11 mit sterilem Wasser befeuchten sterilen Filter entnehmen und auflegen 12 Wasserprobe filtrieren Filter ablösen und auf Agar legen 13 3. Quantitative Untersuchung auf das Vorhandensein von E.coli and Coliformen Bakterien in einer Probenmenge von 100 ml Wasser (Membranfiltration auf CC Agar) • je 100 ml Wasser werden durch Membranfilter (0,45 µm) filtriert • • CCA, 37°C/1d • • rote Kolonien weisen auf die Coliformen hin, violette Kolonien auf E.coli • • Oxidase Test • blau-violette Kolonien weisen auf die E. coli und rote Kolonien auf Coliforme hin. Angabe der Ergebnisse: • Coliforme / E.coli .................... 14 4. Semiquantitative Untersuchung auf das Vorhandensein von coliformen Bakterien in einer Probenmenge von 100 ml (MPN Test) mit EijkmanBouillon • • 3 x je 10 ml Wasserprobe 3 x je 1 ml Wasserprobe 3 x je 0,1 ml Wasserprobe • in Galle-Lactose Bouillon Röhrchen mit Gärfänger pipettieren, 37C°/2d • • Beurteilung von Säure- und Gasbildung (Gas und Säurebildung POSITIV) = coliforme Bakterien • Galle-Lactose Bouillon: Galle hemmt grampositive Bakterien Lactoseverwertung durch Umschlag von Bromthymolblau angezeigt, Gasbildung im Gärfänger sichtbar Auswertung: 10 ml 1. - 2. - 3. - KBE/100ml <3........................ 10 ml 10 ml 10 ml + + + + + + 3 ....................... 6........................ 20....................... 1 ml 1 ml 1 ml + + + + + + 40....................... 100....................... 200....................... 0,1 ml 0,1 ml 0,1 ml + + + + + + 400....................... 1000 ...................... >2000....................... Angabe der Ergebnisse.............................................................................. 15 5. Qualitative Untersuchung auf das Vorhandensein von Enterokokken in einer Probenmenge von 100 ml Wasser (Presence/Absence) • • • • • • • 100 ml Wasser in 2-fach konzentrierte Chromocult-Enterokokken-Bouillon 44°C/2d Beurteilung von Blaufärbung: wenn positiv, Frakt. Ausstrich auf KANA Schwarze Kolonien weisen auf die Enterokokken hin, weitere Bestätigung mit Katalase-Test • Kanamycin-Äsculin-Azid-Agar: Kanamycin und Azid hemmen die Begleitflora, Äsculin wird von Enterokokken (ß-Glucosidase) zu Äsculetin hydrolysiert, welches mit Fe3+ einen schwarzen Komplex bildet. Chromocult-Enterokokken Bouillon: 5-Bromo4-Chloro-3-Indolyl-ß-D-Glucopyranosid wird durch das Enzym ß-D-Glucosidase abgespalten. Der Farbumschlag der Bouillon nach blau weisen auf die Enterokokken hin. 6. Quantitative Untersuchung auf das Vorhandensein von Enterokokken in einer Probenmenge von 100 ml Wasser (Membranfiltration) • je 100 ml Wasser werden durch Membranfilter (0,45 µm) filtriert • • Agar:Kanamycin-Äsculin-Azid (KANA) , 44°C/1d. Schwarze Kolonien die Katalasenegativ sind Enterokokken • Angabe der Ergebnisse:Enterokokken pro 100 ml Wasser:…………………………………… 16 7. Quantitative Untersuchung auf das Vorhandensein von C. perfringens in einer Probenmenge von 100 ml Wasser (Membranfiltration) • je 100 ml Wasser werden durch Membranfilter (0,45 µm) filtriert • • TSC-Agar, 44°C/1d (anaerob) • • Schwarze Kolonien weisen auf sulift-reduzierende Clostridien hin. C. perfringens zeigt Fluoreszenz unter der UV-Lampe. • • Angabe der Ergebnisse: KBE/100ml ................... 8. Quantitative Untersuchung auf das Vorhandensein von P. aeruginosa in einer Probenmenge von 100 ml Wasser (Membranfiltration) • je 100 ml Wasser werden durch Membranfilter (0,45 µm) filtriert • • PSM Agar, 44°C/1d • • grünliche Kolonien weisen auf die P. aeruginosa hin. • Angabe der Ergebnisse: KBE/100ml ................... 17 TSC-Agar CC-Agar 18 LMX-Bouillon EK-Bouillon 19 MIKROBIOLOGISCHE UNTERSUCHUNG EINER LEBENSMITTELPROBE Verdünnungsreihe • Verdünnungsreihen müssen angelegt werden, um bei der späteren Kultivierung auswertbare Koloniezahlen auf dem Agar zu erhalten. In der Praxis ist die dezimale Verdünnung am gebräuchlichsten. • Aus der zuvor hergestellten Verdünnungsreihe werden genau abgemessene Mengen zur Anzüchtung von Mikroorganismen verwendet. Üblicherweise werden Plattenguß- und Oberflächenverfahren verwendet. 20 Verdünnungsreihe • Zum Anlegen einer Verdünnungsreihe wird die Originalprobe (Verdünnungsstufe 0) 1:10 verdünnt (z.B. 10 g auf 100 ml mit Verdünnungsflüssigkeit auffüllen, Verdünnungsstufe 1). • Aus dieser Stufe wird 1 ml entnommen und zu 9 ml Verdünnungsflüssigkeit pipettiert (Verdünnungsstufe 2). Nach dem Durchmischen auf dem Vortexer werden weitere Dezimalverdünnungen angelegt. • Für jede Verdünnungsstufe wird eine frische Pipette verwendet. • Die Pipetten dürfen nicht in die Flüssigkeit der Verdünnungsstufen getaucht werden. • Benutzte Pipetten werden in einer Desinfektionslösung abgestellt. 21 QUANTITATIVE UNTERSUCHUNG Homogenisat: 10 g Probe mit 90 ml gepufferter Peptonlösung homogenisieren= H H= Verdünnung 1:10 = Stufe –1, Verdünnungsreihe: -1, -2, -3, -4, -5 Anzahl KBE: Plattengußverfahren, Plate Count Agar E. coli, Coliforme: Oberflächenspatelverfahren, CCA, Enterokokken: Oberflächenspatelverfahren, KANA Hefen und Schimmelpilze: Oberflächenspatelverfahren,YGC Staphylococcus aureus: Oberflächenspatelverfahren, BP B. cereus: Oberflächenspatelverfahren, BC Stufen: Stufen: Stufen: Stufen: Stufen: Stufen: -1, -2, -3, -4, -5 -1, -2, -3, -4, -5 -1, -2, -3, -4, -5 -1, -2, -3, -4, -5 -1, -2, -3, -4, -5 -1, -2, -3, -4, -5 YGC-Agar: Chloramphenicol unterdrückt die bakterielle Begleitflora. Baird-Parker-Agar: Tellurit und Lithiumchlorid hemmen die Begleitflora. Eigelb wird durch Lipolyse und Proteolyse abgebaut (Bildung eines Doppelhofes), Tellurit wird zu Tellur reduziert, es kommt zur Schwarzfärbung.Verdächtige Kolonien werden durch positiven Katalase-Test und durch positiven Koagulase-Test (Latex-Agglutinationstest) bestätigt. Ergebnis: Anzahl KBE/g..................................................Coliforme/g ..................................................... E. coli/g............................................................Hefen/Schimmelpilze/g.................................... Enterokokken/g................................................Staphylococcus aureus/g.................................B.cereus/g……….. QUALITATIVE BESTIMMUNG VON SALMONELLEN/10 G 10 g Probe mit 90 ml Rappaport-Vassiliadis-Bouillon (RV) homogenisieren, 44°C/5d Ausstrich auf SMID-Agar, 37°C/1d rote Kolonien, Cytochromoxidase-negativ, salmonellenverdächtige Kolonien, serologische Bestätigung RV-Bouillon: Malachitgrün und pH 5,5 hemmen andere Darmbakterien und fördern das Wachstum von Salmonellen. Ergebnis: Salmonellen/10 g (nachweisbar / nicht nachweisbar) .......... 22 PERSONAL-, und BETRIEBSHYGIENE HÄNDEDESINFEKTIONSVERSUCH • Die Testperson drückt beide Handflächen auf die vorbereiteten Abklatschschwämme, danach reinigt und desinfiziert sie die Hände und wiederholt den Versuch nachdem die Hände luftgetrocknet sind. • • Abklatschschwämme inkubieren, Auszählen der KBE • • Ergebnis: • Handabklatsch vor Desinfektion: nach Desinfektion: • • PCA, 37°C/1-3 d .......................... .............................. 23 BESTIMMUNG DER KEIMZAHL VON OBERFLÄCHEN • Verschiedene Oberflächen (Arbeitsplatz, Sterilbank, etc.) werden mittels Rodac-Platten abgeklatscht. • Inkubation: 37°C, 1d; Auszählen der KBE • Ergebnis:..................................................... BESTIMMUNG DER LUFTKEIMZAHL • • • • • • • • • • • • 1. Sedimentationstest: Grobe Abschätzung des Keimgehaltes der Luft Verwendeter Nährboden: Agarplatte mit geöffnetem Petrischalendeckel 30 min exponieren, Bebrütung 30°C, 3d. Auszählen der KBE ….Ergebnis: 2. Impaktion-Verfahren Die zu untersuchende Luft wird mittels eines Zentrifugalsammlers angesaugt und durch einen Spalt auf einen im Inneren des Gerätes befindlichen Nährbodenstreifen aufgeschleudert. Verwendetes Gerät: Biotest-Luftkeimsammler (Abscheidevolumen 40 l/min) Nährbodenstreifen in den Zentrifugalsammler einlegen Zentrifugalsammler 1 min betreiben , Nährbodenstreifen entnehmen und inkubieren: 30°C, 2d KBE KBE/m3 = KBE x 1000 : 40 = ........................... 24 BESTIMMUNG DER KEIMZAHL IN FLÜSSIGKEITEN • Eintauchverfahren • Schnellverfahren zur orientierenden Abschätzung von Keimgehalten in Flüssigkeiten, geeignet für die Betriebskontrolle, AIPC-Slides (Agar Immersion Plating and Contact-Slides), erfaßte Probenmenge ist 1 ml • Einheit öffnen, Objekträger in die Probe tauchen, Überschuß abtropfen lassen, Objekträger im Behälter inkubieren: 2 d/37°C, Auszählen der KBE • Ergebnis: Anzahl E. coli/ml ...................... 25 Hygiene Test Strip • Die HYRiSE repräsentiert eine Methode zur Oberprüfung der allgemeinen Sauberkeit von Oberflächen. • Der Test zeigt die Sauberkeit von Oberflächen an, indem er organische Verunreinigungen in Form von Produktrückständen nachweist, die nach unzureichender Reinigung der Oberflächen zurückbleiben. • Verunreinigungen können zu ungewolltem Wachstum von Mikroorganismen führen. • Messergebnisse mit dem HYRiSE können schon früh vor möglichen Verunreinigungen auf spezifischen Oberflächen warnen und erlauben sofortige Korrekturmaßnahmen, z. B. das Beseitigen der Lebensmittel- und Getränkerückstände. • Auf sichtbar sauberen Oberflächen kann der Test die Anwesenheit solcher Produktrückstände entdecken, die für das Auge unsichtbar sind. Er kann deshalb die versteckte Gefahr für mikrobielles Wachstum anzeigen. 26 HY-RiSE ‘The 3-drop strip test’ CLEAN Wet and Wipe Chemistry DIRTY Colour Result 27 Before cleaning After cleaning DIRTY CLEAN FOOD BACTERIA Einen Tropfen Reagenz A Einen Tropfen Reagenz B (Substratlösung, gelbe Schraubkappe) Einen Tropfen Reagenz C (Enzymlösung, blaue Schraubkappe) Gelbe Farbe der Testzone zeigt einen sauberen Zustand an (Test bestanden). Rosa/purpur bis blauviolette Verfärbung der Testzone zeigt einen schmutzigen Zustand an (Test nicht bestanden). 28