Atomaufbau nach Rutherford - Lehrgang - kienzlers
Werbung

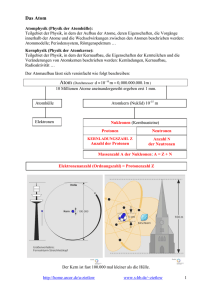
Rutherfords Streuversuch 1911 Alphastrahlen Goldfolie Bleiblock mit Radium Leuchtschirm Im Jahre 1911 führte der englische Physiker Sir Ernest Rutherford folgenden Versuch durch: In einem Bleiblock befand sich radioaktives Radium, das positiv geladene Alphastrahlung aussandte. Die Strahlung lenkte er auf hauchdünnes Blattgold. Auf dem Leuchtschirm konnte er auftreffende Strahlung beobachten. Ergebnisse und Deutungen aus dem Versuch: 1. Genaue Messungen ergeben, dass nur ein winziger Teil der Strahlung abgelenkt wird, der größte Teil durchdringt die Goldfolie ungehindert. 2. Die Strahlung wird abgelenkt, wenn sie sich einem zentralen Bereich innerhalb eines Goldatoms nähert. Dieser Bereich wird als Atomkern bezeichnet. Er enthält positive Ladung. Dort befinden sich auch die positiv geladenen Protonen (p+). 3. In der Atomhülle halten sich negativ geladene Elektronen auf (e-). Diese bewegen sich mit hoher Geschwindigkeit um den Atomkern, damit sie nicht in den Kern fallen. Aufgrund der nach außen wirkenden Neutralität eines Atoms gilt: p+ n n p+ e Protonenzahl = Elektronenzahl e 4. Später entdeckte man eine weitere Atomkomponente im Atomkern, die elektrisch neutralen Neutronen (n). Heliumatom Der Aufbau eines Atoms In der Atomhülle halten sich die Elektronen auf Im Atomkern sind Protonen und Neutronen Die Komponenten Protonen, Neutronen und Elektronen sind zu einem wesentlichen Anteil am Aufbau des Systems Atom beteiligt. Die Physiker wählten für diese Komponenten den Begriff „Elementarteilchen“: Ladung: Abkürzung: Atomkern: -- Protonen -- Protonen -- Neutronen -- Neutronen positiv neutral + p n Atomhülle: Atomhülle: -- Elektronen -- Elektronen negativ e Die Atome unterschiedlicher chemischer Elemente unterscheiden sich in ihrer Zahl der Protonen und Elektronen: Ein Atom des Elements Nr.1, Wasserstoff, besitzt 1 Proton und 1 Elektron Ein Atom des Elements Nr.2, Helium, besitzt 2 Protonen und 2 Elektronen Ein Atom des Elements Nr.3, Lithium, besitzt 3 Protonen und 3 Elektronen usw. Das Arbeiten mit dem Periodensystem Im Periodensystem der Elemente (PSE) sind die chemischen Elemente nach der Protonenzahl in aufsteigender Reihenfolge geordnet. Links nach unten versetzt neben einem Elementsymbol steht die Ordnungszahl, bzw. die Elementnummer im Periodensystem. Dabei gilt folgende Regel: Ordnungszahl im PS = Protonenzahl = Elektronenzahl des Elements Links nach oben versetzt neben dem Elementsymbol (oder darüber) steht die sogenannte Massenzahl für das entsprechende Element. Oft wird die Massenzahl auch rechts neben das Symbol mit einem Trennstrich geschrieben, z.B. Na-23. Die Massenzahl ergibt sich aus der Summe der Protonen und der Neutronen: Massenzahl = Protonenzahl + Neutronenzahl des Elements Beispiel für das Element Nr. 11, Natrium: links oben: Massenzahl = Protonenzahl (11) + Neutronenzahl (12) links unten: Ordnungszahl (11) = Elektronenzahl (11) = Protonenzahl 23 11 Na Die Zahl der Neutronen ergibt sich durch folgende Rechnung: Neutronenzahl = Massenzahl - Protonenzahl 2. Übungsbeispiel: Das nebenstehende Element Nr. 9, Fluor, besitzt die Ordnungszahl 9 und hat im Atomkern eines Atoms 9 Protonen und in der Hülle 9 Elektronen. Die Massenzahl beträgt 19. Dadurch ergibt sich eine Neutronenzahl von 10. (19 - 9 = 10) 19 9 F Übungsaufgabe: Gib die Zahl der Protonen, Neutronen und Elektronen für die folgenden Atomsorten an und vervollständige die Tabelle. Periodensystem der Elemente (Nr. 1-18) Hauptgruppen: I 1 1 II III IV V VI VII VIII 4 2 H Wasserstoff 7 3 Li Lithium 23 11 Helium 9 4 11 Be 5 B Beryllium 24 Bor 27 Na 12 Mg 13 Al Natrium He Magnesium Aluminium Ordnungs- Atomzahl sorte 12 6 C Kohlenstoff 28 14 Si Silicium Protonenzahl + p 14 7 16 8 N Stickstoff 31 15 Phosphor 19 9 Sauerstoff 32 16 P O S Schwefel Elektronenzahl e 20 10 F Fluor 35 17 Cl Chlor Ne Neon 40 18 Ar Argon Neutronenzahl n 1 H-1 1 1 0 2 He-4 2 2 2 3 Li-7 4 Be-9 5 B-11 6 C-12 7 N-14 8 O-16 9 F-19 Hinweis: Im PSE wird in der Regel nur die Ordnungszahl links neben dem Element angegeben. Die sogenannte Atommasse ist nicht identisch mit der Massenzahl. Die Atommasse bezieht sich auf ein Zwölftel der Masse eines Kohlenstoffatoms.