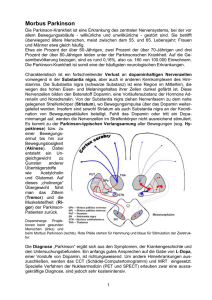
Magnetresonanztomographische Vermessung der Substantia
Werbung

Aus dem Institut für Diagnostische und Interventionelle Radiologie und Nuklearmedizin des St. Josef-Hospital Bochum -Universitätsklinikder Ruhr-Universität Bochum Direktor: Prof. Dr. med. Odo Köster Magnetresonanztomographische Vermessung der Substantia nigra mit Inversion-Recovery-Sequenzen in der klinischen Routine bei idiopathischen Parkinson-Syndromen Inaugural-Dissertation zur Erlangung des Doktorgrades der Medizin einer Hohen Medizinischen Fakultät der Ruhr-Universität Bochum vorgelegt von Alexej Titschert aus Lünen 2009 Dekan: Prof. Dr. med. Gert Muhr 1.Referent: Prof. Dr. med. Odo Köster 2.Referent: PD Dr. Gunawan Notohamiprodjo Tag der mündlichen Prüfung: 21.01.2010 Inhaltsverzeichnis 1. Einleitung 9 1.1. Morbus Parkinson 9 1.2. Architektur und Funktion der Basalganglien 12 1.3. Symptomatik 16 1.4. Klassifikation und Symptomatik der atypischen Parkinson-Syndrome 20 1.5. Diagnostik 22 1.6. Weitere diagnostische Möglichkeiten 25 2. Zielsetzung 26 3. Material und Methoden 28 3.1. Patientengut 28 3.2. Methoden 29 4. Ergebnisse 35 5. Diskussion 44 5.1. Methodenwahl 44 5.2. Forschungsansätze 45 5.3. T2- und T2*-gewichtete Bildgebung 49 5.4. Sequenzen in Protonendichte-Wichtung 50 5.5. Diffusion Tensor Imaging und diffusionsgewichtete Bildgebung 51 5.6. T1-gewichtete Bildgebung und Inversion Recovery-Sequenzen 51 5.7. Ergebnisdiskussion 54 5.8. Methodendiskussion 59 6. Zusammenfassung 65 6.1. Zielsetzung 65 3 6.2. Methodik 66 6.3. Ergebnisse 66 6.4. Schlussfolgerungen 67 7. Literaturverzeichnis 70 8. Danksagung 9. Lebenslauf 4 Abkürzungen: 18F-6-Flourodopa 6-[18F]Fluoro-L-3,4-Dihydroxyphenylalanin 18F-DOPAC [18F]3,4-Dihydroxyphenylessigsäure 18F-FDG [18F]-Flourodeoxyglukose 18F-HVA [18F]-Homovanillinsäure Abb. Abbildung ADC Diffusionskoeffizient (apparent diffusion coefficient) APS Atypische Parkinson-Syndrome Äq Äquivalenztyp Bd Breite dorsal der Substantia nigra Bv Breite ventral der Substantia nigra bzw. beziehungsweise ca. zirka CBD Kortikobasale Degeneration (corticobasal degeneration) CIT 2-Beta-Carbomethoxy-3-Beta-(4-Iodophenyl)tropan CT Computertomographie d. h. das heißt D1 Dopamin-D1-Rezeptor D2 Dopamin-D2-Rezeptor DA Dopamin-Agonisten DAT Dopamintransporter DICOM Digital Imaging and Communications in Medicine DLB Lewy-Körper-Demenz (dementia with Lewy bodies) DP Dopamin DTI Diffusion Tensor Imaging DWI Diffusionsgewichtete Bildgebung (diffusion weighted imaging) EMG Elektro-Myographie et al. et alteri 5 Fe+ Eisen-Ionen FOV Field of view FP Ioflupane FR Formatio reticularis g Gramm GABA !-Aminobutyrat Glu Glutamat GPl Globus pallidus pars lateralis GPm Globus pallidus pars medialis HWS Halswirbelsäule I-123 Iod123 IBZM Iodobenzamid IPS Idiopathische Parkinson-Syndrome IR Inversion Recovery L-DOPA Levodopa = L-3,4-dihydroxyphenylalanin mg Milligramm MLS Motorische Leistungsserie nach Schoppe MRT Magnetresonanztomographie ms Millisekunden MSA Multisystematrophie MSA-A Multisystematrophie, autonomer Typ MSA-C Multisystematrophie, cerebellärer Typ MSA-P Multisystematrophie, Parkinson-Typ n Anzahl der Personen NPH Normaldruckhydrozephalus (Norm pressure hydrocephalus) o. g. oben genannte OPCA Olivopontocerebelläre Atrophie PET Positronenemissionstomographie PSP Progressive supranukleäre Paralyse 6 Q1 Quotient Fläche nicht betroffene/Fläche betroffene Seite Q2 Quotient (Bv + Bd) nicht betroffene/(Bv + Bd) betroffene Seite ROI Region of interest ROId dorsal gemessene ROI in der Substantia nigra ROIv ventral gemessene ROI in der Substantia nigra ROIv/d Quotient aus ROIv und ROId rSI Relative Signalintensität s. c. subcutan SAE Subkortikale arteriosklerotische Enzephalopathie SD Standardabweichung (standard deviance) SDd Standardabweichung der dorsal gemessenen ROI in der Substantia nigra SDv Standardabweichung der ventral gemessenen ROI in der Substantia nigra SE Spinecho SI Signalintensität SN Substantia nigra SN1 Sequenz Substantia Nigra 1 SN2 Sequenz Substantia Nigra 2 SNc Substantia nigra pars compacta SNdiv Sequenz Substantia Nigra dividiert SNr Substantia nigra pars reticulata SNsub Sequenz Substantia Nigra subtrahiert SPECT Single-Photon-Emissionscomputertomographie STIR Short-TI-Inversion-Recovery STN Nucleus subthalamicus (subthalamic nucleus) T Tesla Tab. Tabelle TE Time to echo, Echozeit 7 TI Time of inversion, Inversionszeit TOF Time of flight TR Time of repetition, Repetitionszeit TSE Turbo-Spinecho z. B. zum Beispiel z. T. zum Teil 8 1. Einleitung 1.1. Morbus Parkinson Die Parkinson-Krankheit wurde erstmals 1817 von dem englischen Arzt James Parkinson (1755 – 1824) beschrieben und ist neben dem M. Alzheimer heute die häufigste degenerative Erkrankung des zentralen Nervensystems bis dato ungeklärter Ätiologie in der Mehrzahl der Fälle [87]. Zwei der drei sogenannten klassischen „Kardinalsymptome“, nämlich Akinese und Tremor, wurden von Parkinson bereits in seiner berühmten und viel zitierten Originalarbeit „An Essay on the Shaking Palsy“ erwähnt, die Beschreibung des Rigors fällt hingegen auf Charcot zurück [50]. Die Erkrankung manifestiert sich überwiegend in der zweiten Lebenshälfte; die Prävalenz liegt für die Altersgruppe der 60- bis 70-jährigen bei ca. 200/100000 Einwohner mit einem deutlichen Anstieg in zunehmendem Alter [133, 134]. Männer sind etwas häufiger von der Erkrankung betroffen [74]. In 5-10 % der Fälle liegt eine familiäre Prädisposition vor mit autosomaldominantem Erbgang [48, 106]. Über 90 % der Fälle sind idiopathisch mit unklarer Ätiopathogenese [107]. Nach neuerer Nomenklatur werden derzeit statt der klassischen Begriffe „Morbus Parkinson“ und „Parkinson-Krankheit“ die Bezeichnungen „idiopathisches Parkinson-Syndrom“ oder „primäres Parkinson-Syndrom“ verwendet, um der Tatsache Gewichtung zu verleihen, dass die Genese größtenteils unbekannt ist. Die Parkinson-Syndrome, deren Ätiologie bekannt ist, werden als „sekundäre Parkinson-Syndrome“ oder „symptomatische Parkinson-Syndrome“ bezeichnet [41]. 9 Die genetisch bedingten Parkinson-Syndrome oder familiären ParkinsonSyndrome werden überwiegend noch den idiopathischen Parkinson-Syndromen zugerechnet, wahrscheinlich wird sich dieser Umstand aber in absehbarer Zeit aber aufgrund des enormen Wissenszuwachses auf diesem Gebiet und der dann zu vermutenden besseren Klassifizierbarkeit ändern [50]. Nach den Kriterien der United Kingdom Parkinson’s Disease Society Brain Bank [31] werden als Kriterien für das Vorliegen eines idiopathischen ParkinsonSyndromes das Symptom Bradykinese sowie das zusätzliche Vorhandensein eines der weiteren Symptome wie Rigor, Tremor oder posturale Instabilität verlangt. Von der Parkinson-Krankheit im eigentlichen Sinne (Parkinson’s disease) kann gesprochen werden, wenn zusätzlich zu den o. g. Symptomen noch mindestens drei weitere Symptome wie einseitiger Beginn, progredienter Verlauf, gutes Ansprechen auf L-Dopa-Medikation, langjähriger Verlauf und Dopa-induzierbare Hyperkinesen vorliegen. Parkinsonkranke können auch unter klinischen Gesichtspunkten eingeteilt werden. Patienten mit Parkinson-Syndromen vom Äquivalenztyp weisen alle gängigen Symptome auf; weitere klinische Subtypen sind in diesem Zusammenhang die Parkinson-Syndrome vom Rigor-Akinese-Typ sowie der Tremordominanztyp [50], wobei die Begriffe selbsterklärend sind. Allgemein anerkannt ist auch die Einteilung der Patienten mit idiopathischen Parkinson-Syndromen nach Hoehn und Yahr. Stadium I bedeutet einen einseitigen Befall; Stadium II ist durch einen beidseitigen Befall gekennzeichnet, während Stadium III sich durch eine zusätzliche posturale Instabilität auszeichnet. Erkrankte im Stadium IV benötigen demgegenüber eine Hilfestellung bei Verrichtungen des täglichen Lebens. Patienten im Stadium V 10 sind pflegebedürftig und überwiegend auf die Benutzung eines Rollstuhls angewiesen [50]. Zur Klassifikation anderer neurodegenerativer Erkrankungen, die mit einer Parkinsonsymptomatik einhergehen, der sogenannten atypischen ParkinsonSyndrome, wird unter 1.4. Stellung genommen. Bei den idiopathischen Parkinson-Syndromen kommt es zu einem progredienten Zellverlust neuromelaninhaltiger Zellen in der Pars compacta der Substantia nigra. Dies führt zu einer schon makroskopisch erkennbaren Depigmentierung dieses Areals. Am deutlichsten erkennbar sind diese Veränderungen in der Substantia nigra bzw. der Substantia nigra pars compacta selbst, aber auch in anderen Arealen wie Nucleus ruber, Nucleus dentatus, Globus pallidus, Putamen und im Caput nuclei caudati finden sich degenerative Veränderungen [50, 97]. Hierdurch kommt es zu einer Abnahme der Speicherkapazität für Dopamin mit resultierendem Dopaminmangelsyndrom, die Dopamin-Konzentration ist im Striatum stark vermindert und korreliert mit den morphologisch nachgewiesenen Nervenzellverlusten. Klinisch manifest wird ein Parkinson-Syndrom, wenn ca. 50 % der dopaminergen Neurone degeneriert sind bzw. eine Verminderung des striatalen Dopamin-Gehaltes von ca. 80 % eingetreten ist [11]. Von der Neurodegeneration sind die präsynaptischen Neuronenanteile betroffen, die postsynaptischen Rezeptoren sind nicht betroffen, was für die nuklearmedizinische Bildgebung bei Parkinson-Syndromen eine wichtige Rolle spielt. Ein weiteres neuropathologisches Korrelat zeigt sich in den sogenannten LewyKörperchen [74]. Bei Vorliegen einer Degeneration der Substantia nigra lassen sich in 80 % der Fälle diese Einschlusskörperchen finden. Darüber hinaus 11 lassen sie sich aber auch bei anderen neurodegenerativen Erkrankungen wie z. B. dem Morbus Alzheimer, der kortikobasalen Degeneration, der Ataxia teleangiectasia und der Hallervorden-Spatz-Erkrankung nachweisen [111]. Es handelt sich dabei um eosinophile konzentrische, zytoplasmatische Einschlüsse in noch vitalen Nervenzellen der Substantia nigra [46, 114]. Lewy-Körperchen finden sich bei Parkinson-Syndromen aber auch außerhalb der Substantia nigra, so z. B. in bestimmten Regionen des limbischen Systems, im Locus coeruleus, in der Raphe nuclei, im Nucleus basalis Meynert, im Thalamus, im Hypothalamus, im zerebralen Neokortex sowie in Regulationszentren autonomer Funktionen [15, 74]. Bei neuropathologischen Untersuchungen von Patienten ohne Parkinson-Syndrome nahm das Auftreten von Lewy-Körperchen von 3,8 % auf 12,8 % zwischen dem 60. und 90. Lebensjahr zu. Begleitende pathologische Veränderungen deuten daraufhin, dass diese Lewy-Körperchen Zeichen eines präsymptomatischen Stadiums des Parkinson-Syndromes sind [16, 74]. 1.2. Architektur und Funktion der Basalganglien Parkinson-Syndrome stellen eine Erkrankung des extrapyramidal-motorischen Systems dar. Hierbei wird nach dem klassischen Modell davon ausgegangen, dass zwei verschiedene motorische Systeme koexistieren, zum einen das extrapyramidale (unwillkürliche) System und zum anderen das pyramidale (willkürliche) System. Nach dieser Vorstellung hat das extrapyramidal-motorische System keine direkte Verbindung zum Rückenmark und es erhält auch keine Afferenzen von dort. Die zentrale Einheit stellen die Basalganglien dar. Dem gegenüber steht der Tractus corticospinalis als Kernsystem des pyramidalen Systems. 12 Nach neueren Erkenntnissen kann eine derart strikte Trennung zwischen beiden Systemen aber nicht vorgenommen werden, es existieren zahlreiche funktionelle Verbindungen zwischen beiden Systemen, die mit dem oben genannten ursprünglichen Modell nicht vereinbar sind [50, 75, 152]. Da über die genaue Verschaltung und Funktionsweise der Basalganglien noch keine eindeutig gesicherten Erkenntnisse bestehen [15, 75], soll an dieser Stelle noch auf das klassische, oben angeführte Modell zurückgegriffen werden. Das extrapyramidale System ist ein indirektes System, in dem die Verschaltung zwischen Gehirn und "-Motoneuronen über viele synaptische Verbindungen zwischen Neuronen verschiedener Kerne des Großhirns läuft. Dies sind speziell die Kerne der Basalganglien und die mit diesen assoziierten Kerngebiete (Striatum; d. h. Nucleus caudatus und Putamen, Pallidum, Substantia nigra, Nucleus subthalamicus) [50, 152]. Im Rahmen einer motorischen Aktion erhält das Striatum als Eingangskern über den Tractus corticostriatalis corticofugale, afferente Impulse aus dem präfrontalen Assoziationskortex, dem motorischem Kortex und dem posterioren, parietalen Kortex. Transmitter sind exzitatorische Substanzen wie Glutamat und Aspartat. Efferente striatale Fasern ziehen zum Pallidum (Globus pallidus), welches in ein laterales und ein mediales Segment aufgeteilt ist (Globus pallidus pars lateralis und Globus pallidus pars medialis). Beide Kompartimente erfahren durch die striatofugalen Fasern eine Hemmung mit !-Aminobutyrat (GABA), kolokalisiert mit dem Neuropeptid Enkephalin (Globus pallidus pars lateralis) sowie GABA, kolokalisiert mit den Peptiden Substanz P und Dynorphin (Globus pallidus pars medialis) als inhibitorische Transmitter. 13 Die efferenten Impulse des Striatums wirken GABAerg auch inhibitorisch auf die Substantia nigra pars reticulata. Globus pallidus pars medialis und Substantia nigra pars reticulata sind die Hauptausgangskerne der Basalganglien; sie werden exzitatorisch über Glutamat durch den Nucleus subthalamicus innerviert. Der Nucleus subthalamicus wiederum erhält aus dem Globus pallidus pars lateralis GABAerge, inhibitorische Fasern. Der Globus pallidus pars medialis und die Substantia nigra pars reticulata wirken über GABA inhibitorisch auf den Thalamus. Der Thalamus projiziert über exzitatorische Bahnen, mit Glutamat als Transmitter, zurück zum Kortex. Die Substantia nigra pars compacta ist über einen Schaltkreis an das Striatum angebunden, Afferenzen aus dem Striatum wirken inhibitorisch über GABA, nigrostriatale Fasern sind inhibitorisch mit Dopamin als Transmitter. Eine entscheidende, noch größtenteils unbekannte Bedeutung haben die nigralen, dopaminergen Projektionen. Über D1-Dopaminrezeptoren besteht die Möglichkeit, direkt über Glutamat als exzitatorischem Transmitter auf die Ausgangskerne Substantia nigra pars reticulata und Globus pallidus pars medialis einzuwirken, sodass im Endeffekt deren hemmende Wirkung noch verstärkt wird; hingegen führt die Aktivierung der Dopamin-D2-Rezeptoren über GABA indirekt über den Globus pallidus pars lateralis und den Nucleus subthalamicus zu einer Hemmung der inhibitorischen Wirkung und so zu einer Abschwächung der inhibitorischen Wirkung der Ausgangskerne [72]. Ausgehend vom Kortex über das Striatum zu Pallidum und Substantia nigra sowie über den Thalamus zurück zum Kortex in das supplementär-motorische und das primär motorische Areal liegt insgesamt also eine schleifenartige Verschaltung vor [136], eine kortiko-striato-nigro-thalamo-kortikale Verbindung des extrapyramidal-motorischen Systems [152], oder die sogenannte motorische Schleife [50]. 14 Eine Übersicht zum Schaltkreis der Basalganglien nach dem klassischen Modell zeigt Abbildung 1. Die Anordnung der integrierten Schaltkreise zu einem System der Inhibition inhibitorischer Fasern und Systeme („Hemmung der Hemmung“) wird auch als Disinhibition bezeichnet [50, 55, 152]. Die Funktion der Basalganglien ist noch weitgehend unverstanden; sie sind Bestandteil rückgekoppelter nervaler Schaltkreise, die Daten aus zahlreichen Arealen des Kortex verarbeiten, um sie dann modifiziert gezielt kortikal wieder zuzuführen. Sie stellen im Grunde ein System dar, das die Inhibition willkürlicher kortikaler Motorikprogramme unter dopaminerger Kontrolle aufhebt [92]. 15 Abb. 1: Schema zur Verschaltung der Basalganglien. +, exzitatorische Fasern; -, inhibitorische Fasern; Glu, Glutamat; GABA, !-Aminobutyrat; DP, Dopamin; D1, Dopamin-D1-Rezeptor; D2, Dopamin-D2-Rezeptor; FR, Formatio reticularis; Roter Pfeil, hemmender Gesamteffekt des indirekten Systems; Grüner Pfeil, aktivierender Gesamteffekt des direkten Systems; Blauer Pfeil, Pyramidenbahn. Erstellt nach Golenhofen, van de Graaff und Gerlach [50, 55, 137]. 1.3. Symptomatik Der unter 1.1. beschriebene Dopaminmangel führt bei idiopathischen ParkinsonSyndromen dazu, dass es zu einem Ungleichgewicht zwischen dem direkten System, bestehend aus den striatofugalen Bahnen zu den Ausgangskernen der Basalganglien, d. h. Substantia nigra pars reticulata und Globus pallidus pars medialis, und dem indirekten System mit der Umleitung der striatofugalen 16 Fasern über den Globus pallidus pars lateralis und den Nucleus subthalamicus, kommt. Entsprechend stellt sich bei idiopathischen Parkinson-Syndromen eine Änderung der Aktivität der Ausgangskerne ein; durch die Degeneration der dopaminergen nigrostriatalen Neurone ergibt sich ein Übergewicht des indirekten Systems. Es kommt zu einer Reduktion der inhibitorischen Wirkung des Striatums auf das indirekte System, was eine verstärkte Wirkung GABAerger putaminaler Neurone auf den Globus pallidus pars lateralis mit sich bringt. Dies wiederum reduziert die pallidale Hemmung auf den Nucleus subthalamicus, dessen glutamaterge Fasern zu einer Verstärkung der inhibitorischen Wirkung der Ausgangskerne herbeiführen [30, 72]. Letztlich ergibt sich so eine Inhibition des Motorkortex, es resultieren motorische Störungen im Sinne der klassischen Parkinson-Trias mit den Kardinalsymptomen Rigor, Tremor und Akinese [122], wobei andere Autoren betonen, dass nach diesem klassischen Modell lediglich hypokinetische bzw. akinetische Störungen erklärbar seien [75]. Neben den oben genannten drei klassischen Kardinalsymptomen kommt als viertes Kardinalsymptom die posturale Instabilität vor, welche allerdings erst in späteren Krankheitsstadien auftreten sollte. Frühe Manifestation dieses Symptoms deutet eher auf das Vorliegen eines atypischen Parkinson-Syndromes hin und geht mit einer schlechten Prognose einher [69]. Eine bei nahezu allen idiopathischen Parkinson-Syndromen auftretende Riechstörung wird als fünftes Kardinalsymptom bezeichnet [93, 94]. Ein Parkinsonpatient fällt typischerweise durch eine vornübergebeugte Haltung und ein kleinschrittiges Gangbild mit Propulsionsneigung auf. Des Weiteren sind 17 eine Flexions- und Supinationsstellung der Unterarme und Hände und eine Flexion in den Kniegelenken zu beobachten. Das Schriftbild ist durch eine Verkleinerung und Verlangsamung der Schrift zum Satzende hin gekennzeichnet, dies stellt die klassische Mikrographie dar. Weiterhin werden Betroffene durch einen emotions- und ausdruckslosen Gesichtsausdruck, die Hypomimie, auffällig. Die Artikulation ist monoton und leise (Hypophonie). Häufig kommt es zu Dysphagien durch Beteiligung der Schlundmuskulatur mit Auslaufen von Speichel, eine vermehrte Speichelproduktion im Sinne einer Hypersalivation liegt dagegen nicht vor [50]. Darüber hinaus kommt es in ca. 75 % der Fälle zu einer Tremorsymptomatik, die sich vorwiegend in einem einseitigem mittelfrequentem Ruhetremor mit einer Frequenz von ca. 4 – 6 Hz manifestiert [18]. In einigen Fällen kommt zudem ein Haltetremor vor, in seltenen Fällen ein Intentionstremor. Dies führt dann zu differenzialdiagnostischen Schwierigkeiten zur Abgrenzung eines essenziellen Tremors. Pathophysiologisch handelt es sich beim Parkinsontremor um einen zentralen Tremor, der in den Basalganglien entsteht [32], das klassische Modell der Basalganglienarchitektur (siehe Kapitel 1.2.) liefert aber keine eindeutige Erklärungsmöglichkeit [75]. Mit fortgeschrittener Krankheitsdauer kann es jedoch auch zu Störungen, die nicht-motorischen Systeme betreffend, kommen. In erster Linie sind dies vegetative Begleiterscheinungen. Blasenstörungen im Sinne von hyperaktiven Detrusorfunktionsstörungen, gastrointestinale Dysfunktionen mit Gastroparese und Neigung zu Obstipation sind zu nennen. Darüber hinaus werden autonome Funktionsstörungen wie Thermoregulationsstörungen, sexuelle Funktionsstörungen und Schlafstörungen 18 beobachtet. Letztgenannte sind häufiger bei längerer Krankheitsdauer in fortgeschrittenen Stadien anzutreffen [50]. Demenzen und Depressionen kommen bei idiopathischen ParkinsonSyndromen als kognitive und neuropsychiatrische Störungen gehäuft vor. Bis zu 40 % der Patienten mit idiopathischen Parkinson-Syndromen erleiden depressive Störungen [37], was auf die nicht ausschließliche Manifestation der Erkrankung im Bereich der Basalganglien schließen lässt, vielmehr sind weitere Systeme, wie z. B. das limbische System betroffen [15]. Schließlich kommt es bei Parkinsonpatienten in ca. 20-40 % der Fälle zur Entwicklung einer Demenz im Vergleich zu Normalkollektiven [43, 86]. Aufgrund der zunehmenden Lebenserwartung muss mit einem Anstieg der Neuerkrankungen gerechnet werden [134]. Ausgehend von der momentanen Entwicklung ist damit zu rechnen, dass neurodegenerative Erkrankungen im Jahr 2040 die kanzerösen Erkrankungen als zweithäufigste Todesursache bei älteren Menschen abgelöst haben werden [78]. Die Erkrankung führt in einer Vielzahl von Fällen zu den unterschiedlichsten Fehldiagnosen, allen voran HWS-Syndrom, Schulter-Arm-Syndrom, Rheumatismus und Lumboischialgien sowie Lumbago. Hierdurch wird eine adäquate Therapie häufig lange versäumt. In den letzten Jahren konnten jedoch große Erfolge in den symptomatischen Behandlungsmöglichkeiten verzeichnet werden, so stehen mittlerweile eine ganze Reihe von Antiparkinson-Medikamenten zur Verfügung, die in Abhängigkeit der Erkrankungsschwere, des Alters und der Symptomatik differenziert eingesetzt werden können [95]. Aus diesem Grunde wird eine korrekte und frühzeitige Diagnosestellung immer wichtiger. 19 1.4. Klassifikation und Symptomatik der atypischen Parkinson-Syndrome: Differenzialdiagnostisch sind von den idiopathischen Parkinson-Syndromen andere neurodegenerative Erkrankungen mit Beteiligung der Basalganglien abzugrenzen. Hierzu zählen die früher sogenannten Parkinson-Plus-Syndrome, das Spektrum umfasste die Multisystematrophien (MSA) mit den Varianten der progressiven supranukleären Blickparese (PSP, Steele-Richardson-Olszewski-Syndrom), der Shy-Drager-Symptomatik und der olivopontocerebellaren Atrophie (OPCA). Darüber hinaus wurden hierzu die kortikobasale Degeneration (corticobasal degeneration, CBD) und die Lewy-Körperchen-Demenz (Dementia with Lewy bodies, DLB) gezählt. Die ebenfalls hinzugehörige striatonigrale Degeneration ist klinisch nur schwer von Parkinson-Syndromen abzugrenzen. Nach den neueren Klassifikationen [36], die sich in den Leitlinien für Diagnostik und Therapie in der Neurologie widerspiegeln [41], werden die ParkinsonSyndrome derzeit in vier Klassen eingeteilt. Neben den bereits erwähnten idiopathischen Parkinson-Syndromen und den familiären Parkinson-Syndromen (PARK-Genorte 1-11) [47, 50] umfassen die atypischen Parkinson-Syndrome bzw. die Parkinson-Syndrome im Rahmen anderer neurodegenerativer Erkrankungen hiernach die striatonigrale Degeneration mit Parkinsonsymptomatik (Multisystematrophie vom ParkinsonTyp, MSA-P), die OPCA mit cerebellären Symptomen (Multisystematrophie vom cerebellären Typ, MSA-C) sowie das Shy-Drager-Syndrom mit autonomen Dysfunktionen (MSA-A). Zugehörig sind ebenfalls die PSP, die CBD sowie die DLB [79], wobei das Konzept einer eigenständigen Entität der DLB in letzter Zeit kontrovers debattiert wurde [12, 41, 105, 126]; dennoch gelten in dieser Hinsicht nach wie vor die Konsensuskriterien von 1996 nach McKeith et al. [88]. 20 Schließlich sind die sekundären Parkinson-Syndrome abzugrenzen. Hier handelt es sich um Läsionen der Basalganglien, die eine parkinsonähnliche Symptomatik bieten, jedoch nicht neurodegenerativer Genese sind. Hierzu werden u.a. der Morbus Fahr, der durch beidseitige Verkalkungen im Bereich der Basalganglien charakterisiert ist, und der Morbus Wilson gerechnet, bei dem es zu parkinsonähnlichen Symptomen durch Störungen im Kupferstoffwechsel kommt. Weitere Erkrankungen, die parkinsonähnliche Symptome hervorrufen, jedoch nicht mit spezifischen Läsionen der Basalganglien einhergehen, stellen der Normaldruckhydrocephalus (Norm pressure hydrocephalus, NPH), die subkortikale arteriosklerotische Enzephalopathie (SAE) sowie die toxischen Parkinson-Syndrome dar, die ätiologisch entweder metabolischer oder pharmakogener Genese sind, z. B. hepatische Enzephalopathie bzw. Antiemetika- oder Neuroleptikatherapie [18]. Vom klinischen Bild her ist die MSA durch autonome bzw. urogenitale Dysfunktion und Parkinsonismus (MSA-P, ca. 80 % der Fälle) oder cerebelläre Ataxie (MSA-C, ca. 20 % der Fälle) gekennzeichnet, während die MSA-A durch schwere orthostatische Dysregulationen auffällt. Eine PSP charakterisiert sich durch Gangataxie und vertikale Blickparesen sowie posturale Instabilität, während bei der CBD Demenz und ein asymmetrisch hypokinetisch-rigides Syndrom mit Kombinationen aus Rigidität, Dystonie, Akinesien und Apraxien bei kortikal sensorischem Defizit, resultierend in einem “alien limb”, vorherrschen [79, 147, 148]. 21 1.5. Diagnostik Dieser heterogenen Gruppe extrapyramidal-motorischer Bewegungsstörungen steht eine begrenzte Anzahl an klinischen Tests und apparativer Diagnostik gegenüber, sodass es selbst für einen erfahrenen Untersucher mitunter zu diagnostischen Schwierigkeiten kommt. Besonders im Anfangsstadium der Erkrankung ist die differenzialdiagnostische Einordnung schwierig, da die frühen Symptome sich teilweise nur unvollständig in die bereits bekannten Kriterien wie Brady- bzw. Akinese, verminderte Armmitbewegung, Hypophonie, Hypomimie, Tremor, Obstipation, Schlafstörungen und Depression einordnen lassen. Die Diagnose eines idiopathischen Parkinson-Syndromes ist somit in vielen Fällen nur als Verdachtsdiagnose zu stellen [107]. Die klassischen motorischen Symptome wie Rigor, Tremor und Akinese lassen häufig eine zuverlässige differenzialdiagnostische Einordnung zu. Die übrigen, den nicht-motorischen Systemen zuzuordnenden Symptome, weisen eine wesentlich geringere Spezifität auf und führen, wie bereits eingangs erwähnt, zu einer erheblichen Rate an Fehldiagnosen mit einer Fehlzuweisung der Patienten besonders in Orthopädische und Psychiatrische Fachabteilungen aufgrund von Muskelverspannungen oder depressiven Verstimmungen. Darüber hinaus wird ein Großteil der Patienten mit vegetativen Dysfunktionen im Bereich der gastrointestinalen Beschwerdesymptomatik sowie Schlafstörungen in Bereiche der Allgemein- und Inneren Medizin fehlgeleitet. Die Diagnose eines idiopathischen Parkinson-Syndromes ist also vorwiegend von klinischen Parametern bestimmt, da die Computertomographie (CT) und die standardisierte Magnetresonanztomographie (MRT) des Schädels in der Regel, insbesondere in früheren Krankheitsstadien, keine wegweisenden pathologischen Befunde zeigen; von den seltenen sekundären ParkinsonSyndromen abgesehen [74]. 22 Demgegenüber steht an apparativer Diagnostik eine Reihe nuklearmedizinischer Untersuchungstechniken zur Verfügung, deren Einsatz aber in der Regel aufgrund hoher Kosten und eingeschränkter Verfügbarkeit limitiert ist, so ist z. B. die Diagnostik mittels Positronenemissions-tomographie (PET) wenigen Zentren vorbehalten und steht in der Routinediagnostik nicht zur Verfügung. Hilfreiche Untersuchungsverfahren wie Single-Photon-Emissionscomputertomographie (SPECT) stehen zwar in größeren Kliniken als differenzialdiagnostisches Werkzeug bereit, der Einsatz wird jedoch durch den Kostenfaktor beschränkt [50]. Mithilfe der FP-CIT-SPECT (Ioflupane-2-Beta-Carbomethoxy-3-Beta-(4Iodophenyl)tropan-SPECT) bzw. DATScan® lassen sich Parkinson-Syndrome von anderen parkinsonoiden Erkrankungen, die nicht mit strukturellen Veränderungen der Basalganglien einhergehen, differenzieren [25, 102-104]. Die idiopathischen Parkinson-Syndrome und die atypischen ParkinsonSyndrome gehen im Gegensatz zu den unter 1.4 genannten Erkrankungen wie z. B. Morbus Wilson und essenzieller Tremor mit dem Verlust der dopaminergen Nervenendigungen einher. I-123 FP-CIT ist ein Marker des dopaminergen Systems im Gehirn, mit dieser Substanz gelingt eine Darstellung der präsynaptischen Dopamintransporter im Striatum, wodurch sich der Verlust dopaminerger Zellen durch den Nachweis einer verminderten Dichte an Dopamintransportern bei Parkinson-Syndromen darstellen lässt. Parkinsonoide weisen somit keine verminderte Dichte auf und lassen sich daher differenzieren [20]. Eine weitere nützliche nuklearmedizinische Untersuchungsmethode stellt die I-123 IBZM-SPECT (Iodobenzamid-SPECT) dar. Idiopathische Parkinson-Syndrome bewirken eine isolierte Degeneration der präsynaptischen Anteile der dopaminergen Synapsen im Gehirn, die postsynaptische Dopaminsynapsendichte ist hingegen normal oder sogar 23 erhöht. Die atypischen Parkinson-Syndrome gehen im Gegensatz hierzu mit einer Degeneration der prä- und postsynaptischen Anteile des Striatum einher [25, 102-104]. I-123 IBZM ist ein D2-Rezeptorligand des dopaminergen Systems, in welchem die striatalen dopaminergen D2-Rezeptoren größtenteils postsynaptisch gefunden werden. Die Differenzierung zwischen idiopathischen ParkinsonSyndromen und atypischen Parkinson-Syndromen gelingt also durch den Nachweis einer verminderten Bindung des Tracers im Striatum bei letztgenannter Gruppe, bei idiopathischen Parkinson-Syndromen zeigt sich im Regelfall eine normale bis reaktiv erhöhte Bindung [3, 20, 138]. Die PET ist ein zusätzliches sensitives Mittel, um den eingeschränkten Dopaminstoffwechsel im Striatum darzustellen und den Verlauf zu dokumentieren [20]. Die 18F-6-Flourodopa-PET (6-[18F]Fluoro-L-3,4Dihydroxyphenylalanin-PET) stellte die erste Möglichkeit dar, die dopaminergen Nervenendigungen funktionell darzustellen. Nach der i.v.-Applikation wird 18F-6Flourodopa von den nigro-striatalen Nervenendigungen aufgenommen und zu 18F-Dopamin und den Metaboliten 18F-DOPAC ([18F]3,4Dihydroxyphenylessigsäure) und 18F-HVA ([18F]Homovanillinsäure) decarboxiliert [45, 54]. Bei Patienten mit idiopathischen Parkinson-Syndromen ist der Nuklid-Uptake im Bereich des Putamens bilateral vermindert, in den meisten Fällen stärker kontralateral zu der betroffenen Körperseite [21, 77]. Dieses charakteristische Verteilungsmuster hinsichtlich des Verlustes der striatalen dopaminergen Funktion erlaubt es, mittels PET zu 100 % Patienten mit idiopathischen Parkinson-Syndromen von gesunden Probanden unter Berücksichtigung klinischer Kriterien zu differenzieren [120]. Die 18F-Flourodeoxyglukose-PET (18F-FDG-PET) stellt zudem eine Möglichkeit dar, MSA-P und MSA-C von idiopathischen Parkinson-Syndromen abzugrenzen [73]. 24 1.6. Ergänzende diagnostische Möglichkeiten Abgesehen von der cerebralen Bildgebung steht zur Diagnostik der extrapyramidal-motorischen Erkrankungen eine weitere Anzahl an apparativer Diagnostik zur Verfügung. Hierbei handelt es sich vorwiegend um klinische Tests, wie z. B. die motorische Leistungsserie nach Schoppe (MLS) und die Diadochometrie. Darüber hinaus kann eine apparative Tremoranalyse weitere Rückschlüsse auf die differenzialdiagnostische Zuordnung zu einem essenziellen Tremor oder einem Parkinsontremor zulassen. Die motorische Leistungsserie nach Schoppe besteht aus einer Folge von Einzeltests, wie z. B. dem Liniennachfahren und dem Tapping. Erfasst wird die feinmotorische Leistungsfähigkeit zur Therapie- und Verlaufskontrolle bzw. Früh- oder Differenzialdiagnostik (z. B. Ansprechen auf L-DOPA bei idiopathischen Parkinson-Syndromen). Die Diadochometrie beinhaltet das Erfassen und Auswerten schneller Drehbewegungen der Hände (Diadochokinese) mit maschineller Auswertung [107]. Kipptischuntersuchungen, Sphinkter-EMG und Riechtests stellen weitere Möglichkeiten zur differenzialdiagnostischen Einordnung der Symptomatik dar [41]. Hilfreich kann auch der sogenannte Apomorphin-Test sein. Hierbei wird nach entsprechender Vorbereitung des Patienten mit einem Antiemetikum, z. B. Domperidon, Apomorphin s. c. bzw. lösliches L-DOPA (z. B. Madopar® LT) oral verabreicht, um ein rasches Ansprechen mit Reduktion der drei klassischen Kardinalsymptome nachzuweisen [41, 50]. In letzter Zeit mehren sich die Hinweise, dass mithilfe kranieller UltraschallUntersuchungen zur Differenzialdiagnose eines idiopathischen ParkinsonSyndromes beigetragen werden kann, das Verfahren ist jedoch, wie UltraschallUntersuchungen im Allgemeinen, stark untersucherabhängig [9, 10]. Letztlich sollte in unklaren Fällen der Ausschluss einer Kupferstoffwechselstörung (Morbus Wilson) erfolgen [41, 50]. 25 2. Zielsetzung Die Entdeckung des striatalen Dopaminmangels bei verstorbenen Parkinsonkranken im Jahre 1960 führte als Therapiegrundlage zunächst zur Anwendung von Levodopa [13]. Im Verlaufe wurden auch andere Wirkstoffe, z. B. Amantadin, Monoamin-Oxidase-B- und Catechol-O-Methyl-TransferaseInhibitoren eingesetzt. In den letzten Jahren wurden weitere bedeutende Fortschritte in der Pharmakotherapie der idiopathischen Parkinson-Syndrome erzielt, vor allem im Hinblick auf die medikamentöse Therapie mit DopaminAgonisten. Ihre besondere Bedeutung liegt in dem kontrovers diskutierten neuroprotektiven Potenzial dieser Substanzgruppe [15, 50, 51, 75]. Diese Präparate sind nicht wie L-DOPA auf präsynaptische Dopamin-Synthese angewiesen [99], sie reduzieren den mit dem Dopaminstoffwechsel assoziierten oxidativen Stress, darüber hinaus können Dopamin-Agonisten direkt prä- und postsynaptische Rezeptoren stimulieren. Die frühzeitige und korrekte Diagnose wird in diesem Kontext immer wichtiger, möglicherweise könnten mittels einer adäquaten Bildgebung sogar präsymptomatische Parkinson-Syndrome detektiert werden [66]. Aufgrund der postulierten neuroprotektiven Wirkung der Dopamin-Agonisten könnten bei frühzeitiger Diagnosestellung schwerwiegende Krankeitsverläufe gemildert und die Progression verzögert werden [51, 135]. Wie bereits erwähnt, liefern CT und Standard-MRT des Kopfes aber keine zuverlässigen bzw. spezifischen Befunde, zusätzlich ist selbst für erfahrene Neurologen die klinische Diagnose und Differenzialdiagnose mitunter schwierig und häufig nur als Verdachtsdiagnose zu stellen [107]. Vor diesem Hintergrund soll nun überprüft werden, ob die technischen Fortschritte in der MRT mit der Entwicklung von aufwendigen Spezialsequenzen in modifizierter Form in ein MR-Routineprotokoll implementiert werden können, 26 um so zu einer frühzeitigen Diagnose eines Parkinson-Syndromes beitragen zu können. Dies ist Intention der vorliegenden Dissertation, die auf Studien von Hutchinson, Raff et al. basiert [66-68]. Hutchinson et al. verwendeten in ihren Untersuchungen zur MRtomographischen Vermessung der Substantia nigra Inversion-RecoverySequenzen. In diesem Ansatz wurde ein kleines Kollektiv von sechs Patienten mit idiopathischen Parkinson-Syndromen im Vergleich zu sechs alterskorrelierten Probanden unter definierten, im klinischen Betrieb nicht zu realisierenden Bedingungen untersucht, so wurden die Patienten im Tomographen mit Hilfe von Gurten fixiert und immobilisiert, um Bewegungsartefakte aufgrund der langen Scanzeiten zu vermeiden. Weiterhin wurden spezielle Einstelltechniken und aufwendige Auswertungsalgorhythmen angewandt. 27 3. Material und Methoden 3.1. Patientengut Zur Durchführung der o. g. Zielsetzung wurden insgesamt 50 Personen untersucht. Bei 15 dieser Personen handelte es sich um freiwillige, gesunde Probanden ohne relevante Vorerkrankungen. Die Probanden wurden vor der Untersuchung aufgeklärt, und das Einverständnis zur Untersuchung wurde eingeholt. 27 Personen waren Patienten, die an Parkinson-Syndromen erkrankt waren mit jeweils unterschiedlicher Erkrankungsdauer von acht bis 120 Monaten und verschiedenen Hoehn und Yahr-Stadien I - III. Bei 13 Patienten herrschte der Äquivalenztyp vor, zehn Patienten litten an Parkinson-Syndromen vom Rigor-Akinese-Typ und vier Patienten waren an einem Parkinson-Syndrom vom Tremordominanztyp erkrankt. Weiterhin wurden 8 Patienten nach demselben Protokoll untersucht, die an parkinsonoiden Erkrankungen litten, u.a. an essenziellem Tremor und Multisystematrophien vom Typ MSA-P. Bei den Probanden handelte es sich um ein alterskorreliertes Normalkollektiv im Vergleich zum Patientenkollektiv. In den Patientengruppen wurden 13 Frauen und 14 Männer untersucht, in der Probandengruppe wurden die Daten von 11 Männern und vier Frauen akquiriert. Der mittlere Altersdurchschnitt in der Probandengruppe betrug 56,8 Jahre, in der Patientengruppe wurde ein Altersdurchschnitt von 57,8 Jahren ermittelt. Alle Daten sind in Tabelle 1 zusammengestellt. 28 Tabelle 1: Deskription des Alters der einzelnen Gruppen, n = Anzahl der Personen. Gruppe Idiopathische ParkinsonSyndrome Probanden andere Äquivalenztyp Rigor-Akinese-Typ Tremordominanztyp n 27 15 8 13 10 4 Mittelwert Standardabweichung Minimum Median Maximum 61,2 54,0 60,1 63,1 59,8 58,8 13,7 17,6 12,5 10,9 17,3 15,1 30,0 29,0 39,0 44,0 30,0 38,0 64,0 60,5 62,5 64,5 67,5 69,5 80,0 80,0 76,0 79,0 80,0 73,0 3.2. Methoden Die Datenakquisition wurde an einem 1,5 Tesla-Gerät vorgenommen (Siemens Magnetom Symphony®). Die Patienten und Probanden wurden jeweils mit zwei verschiedenen Inversion-Recovery-Sequenzen untersucht, die Einstellungen wurden so gewählt, dass die weiße und graue Hirnsubstanz jeweils konträr zur Darstellung kam. Sequenz 1 wurde als Substantia nigra 1 (SN1) bezeichnet, die Repetitonszeit (TR) betrug 1450 ms, als Inversionszeit (TI) wurden 250 ms gewählt, als EchoZeit (TE) wurden 20 ms festgelegt. Die zweite Inversion-Recovery-Sequenz wurde als Substantia nigra 2 (SN2) bezeichnet, hier betrugen die Parameter TR 2000 ms, TE 20 ms und TI 420 ms. Bei beiden Sequenzen wurde eine Voxelgröße von 1,0 x 1,0 x 3,0 mm festgelegt, das Field of view (FOV) war 230 mm. Zusätzlich wurde sowohl bei den Patienten als auch bei den Probanden eine Doppelechosequenz in Protonendichte- und T2-Wichtung akquiriert, die Parameter betrugen TR 3430 ms und TE 14 ms. Hier lag die Voxelgröße bei 0,9 x 0,9 x 3,0 mm, das FOV war ebenfalls 230 mm. Abbildung 2 zeigt die verwendeten Inversion-Recovery-Sequenzen am Beispiel einer 69-jährigen Probandin ohne relevante Vorerkrankungen. 29 Abb. 2: (A), Sequenz SN1. Repetitonszeit TR 1450 ms, Inversionszeit TI 250 ms, Echo-Zeit TE 20 ms. (B), Sequenz SN2. TR 2000 ms, TE 20 ms und TI 420 ms. Voxelgröße jeweils 1 x 1 x 3 mm und Field of view (FOV) 230 mm. Nach Hutchinson sind die so definierten Inversion-Recovery-Sequenzen sensitiv auf Veränderungen des Zellvolumens, um so den Zellverlust bzw. –tod darzustellen, auf der Annahme beruhend, dass die T1-Bildgebung auf der Darstellung des Intrazellularraumes basiert [67]. Konträr zu den Spinecho- bzw. Turbo-Spinecho-Standardsequenzen, wobei primär ein 90°-Impuls ausgestrahlt wird, der die longitudinale Magnetisierung in die transversale Ebene klappt, um dann durch einen nachgeschalteten 180°Impuls rephasiert zu werden, wird bei Inversion-Recovery-Sequenzen primär ein 180°-Impuls ausgesandt. Hierdurch kommt es zu einer Umkehr der Magnetisierung in Längsrichtung, d. h. zu einer Invertierung, woraus sich das Sequenzakronym ableitet. Anschließend erfolgt die transversale T1-Spin-Gitter-Relaxation der invertierten Magnetisierung; bevor die Ausgangsrichtung der Magnetisierung erreicht ist, 30 wird ein 90°-Impuls eingestrahlt, sodass eine Magnetisierungsauslenkung in transversaler Richtung mit Dephasierung und Relaxation erfolgt und so ein Signal ausgelesen werden kann. Somit entstehen Bilder mit starker T1-Wichtung. Die Inversionszeit TI ist als Zeit zwischen der Einsendung des 180°-Impulses und des 90°-Impulses definiert. Über die Inversionszeit kann der T1-Kontrast eingestellt werden; falls die TI so definiert wird, dass der 90°-Impuls zu dem Zeitpunkt eingestrahlt wird, wenn ein Gewebe mit kurzer T1-Zeit hinsichtlich der longitudinalen Magnetisierung relaxiert ist, d.h. in die Ursprungsrichtung zurückgeklappt ist, hat ein Gewebe mit einer langen T1-Zeit noch eine starke transversale Magnetisierung, sodass es insgesamt zu Signalunterschieden der beiden untersuchten Gewebe kommen wird. Bestimmte Signale lassen sich also eliminieren, in der Routinediagnostik wird dies z. B. in Short-TI-Inversion-Recovery-Sequenzen (STIR) zur Unterdrückung des Fettsignals ausgenutzt, andererseits lassen sich so kontrastreiche T1Aufnahmen erzeugen [116, 146]. Abbildung 3 verdeutlicht die Unterschiede der Sequenztypen. 31 Abb. 3: Zeitlicher Verlauf von Inversion-Recovery- und konventionellen SE-Sequenzen im Vergleich. TR, Repetitionszeit; TE, Echozeit; TI, Inversionszeit; SE, Spinecho. Erstellt nach Rummeny und Weishaupt [116, 146]. Die entstandenen Aufnahmen des Schädels wurden an der Bedienkonsole mit einer Syngo® MR2004a-Benutzeroberfläche verblindet bearbeitet und ausgewertet. Hierzu wurden die entsprechenden Hirnabschnitte des Mesenzephalon herausvergrößert und die Fensterung so gewählt, dass die Substantia nigra in ausreichender Größe und Kontrastierung erkennbar war. In jeweils zwei Schichten wurden seitengetrennt Breite der Substantia nigra ventral und dorsal, Fläche, Signalintensität der Gesamtfläche sowie die Signalintensität in zwei definierten kreisförmigen Regions of interests (ROI) ventral und dorsal vermessen. Daraus wurden jeweils für das Kriterium Signalintensität Mittelwert, Minimal- und Maximalwert sowie die Standardabweichung berechnet. Bei der Doppelechosequenz in Protonendichteund T2-Wichtung wurde nur die Protonendichte-Sequenz in die Analyse einbezogen. Die eingangs erwähnten Messparameter wurden anschließend mittels der Copy and Paste-Funktion auf die übrigen auszuwertenden Sequenzen übertragen, zusätzlich wurden diese Sequenzen manuell korrigiert nach den o. g. Kriterien 32 ausgewertet. Da die Aufnahmen als MR-Daten im Digital Imaging and Communications in Medicine-Format (DICOM®) in digitaler Form vorliegen, sind mathematische Operationen zur Bildnachbearbeitung möglich. Die SN1 und SN2 wurden jeweils voneinander subtrahiert (SNsub) bzw. dividiert (SNdiv). Im Fall der neu entstandenen dividierten Sequenz SNdiv wurde zur Verbesserung der optischen Auswertung der jeweilige Datensatz noch mit einem subjektiv bestimmten Bildverstärkungsfaktor f=500 multipliziert. Abbildung 4 zeigt die manipulierten Aufnahmen. Abb. 4: (A), Sequenz SNdiv, Division der beiden Inversion-Recovery-Sequenzen SN1 und SN2 sowie Multiplikation mit einem Bildverstärkungsfaktor f=500. (B), Sequenz SNsub, Subtraktion der SN1 und SN2 voneinander. In die schließliche statistische Analyse gingen die Daten der ProtonendichteSequenz, der SN1, der SNsub und der SNdiv ein. 33 Bei den Probanden und den Patienten mit beidseitiger Symptomatik wurde für die statistische Analyse eine Seite zufällig ausgewählt. Die Werte der Patienten mit beidseitiger Symptomatik wurden bei der Analyse der Quotienten der Flächen nicht berücksichtigt. Pro Sequenz lagen pro Patient und Proband die Daten zweier Schichten vor. In die Analyse gingen die Mittelwerte pro Patient, Proband und Sequenz ein. Mit statistischen Tests wurden nur die Gruppen verglichen, die eine ausreichende Größe (n = 10) besaßen. Die Aufnahmen der Gruppe der heterogenen parkinsonoiden Erkrankungen wurden im Vergleich zu den idiopathischen Parkinson-Syndromen und den Probanden verblindet einer visuellen Inspektion durch den Autor der Studie unterzogen. Die Werte der Probanden und Patienten wurden mithilfe des Mann-Whitney-UTests (zweiseitig zum Niveau " = 0,05) miteinander verglichen. Die Auswertung erfolgte an einem Standard-PC aktueller Bauart mit implementiertem Windows®-Betriebssystem von Microsoft® unter Verwendung der Software Excel® für Windows und SPSS® für Windows. 34 4. Ergebnisse Der Mann-Whitney-U-Test oder äquivalent Rangsummentest nach Wilcoxon kann als Test zum Vergleich zweier allgemeiner empirischer Verteilungen verwendet werden und dient zur Signifikanzprüfung der Übereinstimmung. Ein Unterschied zwischen beiden Gruppen ist dann signifikant, wenn der p-Wert des Testes <= 0,05 ist. Folgende Signifikanzniveaus wurden festgelegt: Nicht signifikant p # 0,05; signifikant p < 0,05; sehr signifikant p < 0,01; hoch signifikant p < 0,001. Tabelle 2 zeigt die p-Werte des Mann-Whitney-U-Tests zum Vergleich der Gruppen Patienten mit idiopathischen Parkinson-Syndromen und Probanden. Statistisch signifikant waren die dorsal gemessene Breite der Substantia nigra (Bd) in SNdiv (p = 0,028), die Standardabweichung der Signalintensität der Protonendichte-Sequenz (p = 0,039), die dorsal gemessenen ROI der Substantia nigra (ROId) der SNdiv und der SN1 (p = 0,010 respektive p = 0,020), die Standardabweichung der dorsalen ROI (SDd) der SNsub (p = 0,012) sowie der Quotient der Fläche der betroffenen und der Fläche der gesunden Seite (Q1) mit p = 0,014. Die Werte der dorsalen Breite Bd in SNdiv erstreckten sich von 0,2 cm bis 0,4 cm bei idiopathischen Parkinson-Syndromen mit einem Mittelwert von 0,28 cm und einer Standardabweichung von 0,056 bei einem Median von 0,25 cm. Probanden erreichten minimal 0,2 cm; maximal 0,45 cm bei einem Mittelwert von 0,323 cm und einer Standardabweichung von 0,065. Der Median betrug 0,3 cm. 35 Tabelle 2: P-Werte des Mann-Whitney-U-Tests idiopathische Parkinson-Syndrome versus Probanden. Die Tests wurden zweiseitig durchgeführt. Fett markiert sind die p-Werte unter 0,05. Variable Breite ventral (Bv) Breite dorsal (Bd) Fläche Intensität Standardabweichung Intensität Region of interest ventral (ROIv) Standardabweichung ROIv (SDv) Region of interest dorsal (ROId) Standardabweichung der ROId (SDd) Region of interest ventral (ROIv) korrigiert Standardabweichung der ROIv (SDv) korrigiert Region of interest dorsal (ROId) korrigiert Standardabweichung der ROId (SDd) korrigiert Quotient Breite ventral und dorsal (Bv/d) Quotient Region of interest ventral und dorsal (ROIv/d) Quotient Region of interest ventral und dorsal (ROIv/d) korrigiert Quotient Fläche betroffene und gesunde Seite (Q1) Quotient (Bv + Bd) gesunde und (Bv + Bd) betroffene Seite (Q2) ProtonendichteSequenz 0,628 0,392 0,353 0,001 SN1 dividiert (SNdiv) 0,695 0,028 0,052 0,645 0,067 0,002 0,788 0,535 SN1 subtrahiert (SNsub) 0,077 0,004 0,792 0,322 0,039 0,666 0,886 0,872 0,001 0,216 0,956 0,329 0,808 0,326 0,665 0,537 0,001 0,010 0,020 0,008 0,183 0,085 0,925 0,012 - 0,365 0,892 0,653 - 0,176 0,749 0,536 - 0,319 0,962 0,427 - 0,720 0,615 0,060 0,170 0,057 0,257 0,270 0,252 0,002 0,007 0,007 - 0,839 0,958 0,551 0,383 0,014 0,544 0,523 0,801 0,664 0,459 0,711 36 SN1 Bei der dorsal gemessenen ROI (ROId) in SNdiv waren bei idiopathischen Parkinson-Syndromen Werte relativer Signalintensität von 400 bis 2606 zu verzeichnen bei einem Mittelwert von 1253, einer Standardabweichung von 470 und einem Median von 1206. Probanden wurden mit Werten relativer Signalintensität von 50 bis 1460 mit einem Mittelwert von 814 gemessen, die Standardabweichung betrug 435 und der Median lag bei 950. Die Quotienten aus der Fläche der betroffenen und gesunden Seite (Q1) wurden für SNdiv bei den idiopathischen Parkinson-Syndromen mit 0,83 bis 1,26 berechnet, der Mittelwert bei einer Standardabweichung von 0,12 war 1,06; Median 1,02. Für die Probanden ergaben sich Quotienten von 0,78 bis 1,16 mit einem Mittelwert von 0,97 bei einer Standardabweichung von 0,10. Der Median war 0,97. Die Werte der relativen Signalintensität für die dorsal gemessene ROI (ROId) der SN1 lagen bei minimal 52, maximal 147, der Mittelwert betrug 88 mit einer Standardabweichung von 22 und einem Median von 87 für idiopathische Parkinson-Syndrome; Probanden wurden mit einem Minimalwert von 32 und einem Maximalwert von 104 gemessen, daraus ergaben sich ein Mittelwert von 70 bei einer Standardabweichung von 21 und ein Median von 68. Für die Standardabweichung der dorsalen ROI (SDd) der SNsub bei den idiopathischen Parkinson-Syndromen ergaben sich Werte von minimal 6 und maximal 45, der Mittelwert war 25 mit einer Standardabweichung von 9 und einem Median von 24. Die Probanden lagen bei minimal 0, maximal 44, einem Mittelwert von 17, einer Standardabweichung von 11 und einem Median von 16. Schließlich war bei der Standardabweichung der Signalintensität der Protonendichte-Sequenz der Minimalwert bei 29, der Maximalwert bei 43, der Mittelwert betrug 35 mit einer Standardabweichung von 4 und einem Median von 35 für idiopathische Parkinson-Syndrome, die Werte für die Probanden errechneten sich mit minimal 21, maximal 44 und einem Mittelwert von 32. Die Standardabweichung betrug 6 bei einem Median von 31. Die Werte sind in Abbildung 5 graphisch dargestellt. 37 Abb. 5: Verteilung der Standardabweichungen der Signalintensitäten der Gruppe der Patienten mit idiopathischen Parkinson-Syndromen (IPS) sowie der Kontrollgruppe aus gesunden Probanden. Sehr signifikante p-Werte erreichten die dorsal gemessene Breite (Bd) der SN1 und SNsub mit p = 0,002 bzw. p = 0,004; die ventral gemessene ROI (ROIv) der Protonendichte-Sequenz (p = 0,001), die dorsale ROI (ROId) der Protonendichte-Sequenz und der SNsub mit p = 0,001 und p = 0,008, sowie der Quotient aus ventral und dorsal gemessener Breite der Substantia nigra (ROIv/d) der SNdiv, der SN1 und der SNsub (p = 0,002 bzw. p = 0,007 und p = 0,007). Hier lag der Bereich der gemessenen relativen Signalintensitäten für die Protonendichte-Sequenz in der ventralen ROI (ROIv) der idiopathischen Parkinson-Syndrome von 704 bis 846 bei einem Mittelwert von 781 und einer Standardabweichung von 39, der Median lag bei 787. Bei den Probanden lagen die relativen Signalintensitäten in einem Bereich von 398 bis 811 mit einem Mittelwert von 638. Die Standardabweichung betrug 157, der Median 701. 38 Die relativen Signalintensitäten der dorsalen ROI (ROId) der idiopathischen Parkinson-Syndrome in der Protonendichte-Sequenz waren minimal 707, maximal 858, der Mittelwert war 776. Die Standardabweichung wurde mit 39 und der Median mit 779 errechnet. Die Probanden hingegen erreichten hier relative Signalintensitäten von 400 bis 837; daraus ergaben sich ein Mittelwert von 640 bei einer Standardabweichung von 153 und einem Median von 695. Für idiopathische Parkinson-Syndrome lagen die berechneten Quotienten aus ventraler und dorsaler Region of interest (ROIv/d) in der SNdiv von minimal 0,23 bis 2,26 maximal, es ergab sich ein Mittelwert von 0,99 mit einer Standardabweichung von 0,50 bei einem Median von 0,85. Die Probanden lagen bei 0,86 minimal und bei 11,45 maximal, woraus sich ein Mittelwert von 2,62 mit einer Standardabweichung von 3,17 und ein Median von 1,47 errechnete. Die dorsale Breite Bd in der SN1 der idiopathischen Parkinson-Syndrome wurde mit einem Minimalwert von 0,15 cm und einem Maximalwert von 0,4 cm gemessen, woraus ein Mittelwert von 0,269 cm, eine Standardabweichung von 0,064 und ein Median von 0,25 cm berechnet wurde; in den Probandenserien wurden Breiten von 0,25 cm bis 0,45 cm abgelesen. So ergab sich für die Probanden ein Mittelwert von 0,337 cm mit einer Standardabweichung von 0,064 und ein Median von 0,3 cm. Die Verteilung ist aus Abbildung 6 ersichtlich. 39 Abb. 6: Verteilung der Werte der dorsal gemessenen Breiten (Bd) der Substantia nigra in der Inversion-Recovery-Sequenz SN1 für die Gruppe der Patienten mit idiopathischen Parkinson-Syndromen (IPS) und der Probanden-Kontrollgruppe. Werte von 0,54 bis 2,58 mit einem Mittelwert von 1,03 und einer Standardabweichung von 0,38 ergaben sich für die Quotienten aus der ventralen und dorsalen Region of interest (ROIv/d) der idiopathischen Parkinson-Syndrome in der SN1, der Median war 0,96. Diesbezüglich waren Quotienten von 0,69 bis 2,75 mit einem Mittelwert von 1,37 und einer Standardabweichung von 0,56 für die Probanden zu verzeichnen, der Median betrug 1,14. In der SNsub konnten für die idiopathischen Parkinson-Syndrome dorsale Breiten (Bd) von 0,1 cm bis 0,35 cm gemessen werden, dies ergab einen Mittelwert von 0,27 cm mit einer Standardabweichung von 0,061 und einem Median von 0,3 cm. Hingegen ergaben die Messungen der Probanden dorsale Breiten (Bd) von 0,25 cm bis 0,45 cm, einen Mittelwert von 0,33 cm, eine Standardabweichung von 0,059 und einen Median von 0,3 cm. 40 Die relativen Signalintensitäten der dorsalen ROI (ROId) der Gruppe der idiopathischen Parkinson-Syndrome ergab für die SNsub Minimalwerte von 6 bis zu Maximalwerten von 89, der Mittelwert lag bei 43, Standardabweichung und Median waren 19 bzw. 44. Die Probanden wurden mit minimalen relativen Signalintensitäten von 0, maximalen relativen Signalintensitäten von 63 und einem Mittelwert von 25 bei einer Standardabweichung von 18 mit einem Median von 27 vermessen. Die Quotienten aus der ventralen und dorsalen ROI (ROIv/d) der SNsub wurden letztendlich mit minimal 0,14, maximal 4,54 und einem Mittelwert von 1,10 für die Gruppe der idiopathischen Parkinson-Syndrome bestimmt; woraus sich eine Standardabweichung und ein Median von 0,88 bzw. 0,95 ergaben. Die Probanden erreichten Quotienten von 0,24 bis 29,68 mit einem Mittelwert von 4,0, einer Standardabweichung von 7,77 und einem Median von 2,04. Hohe statistische Signifikanzen ergaben sich für die relativen Signalintensitäten der Substantia nigra in der Protonendichte-Sequenz mit p = 0,001. Für die Gruppe der idiopathischen Parkinson-Syndrome lagen die Minimalintensitäten bei 695, die Maximalintensitäten bei 814, der Mittelwert bei 760, die Standardabweichung bei 37; der Median war 768. Das Kontrollkollektiv wurde mit minimalen relativen Signalintensitäten von 384 und maximalen relativen Signalintensitäten von 806 sowie einem Mittelwert von 624 vermessen. Hieraus ergaben sich eine Standardabweichung von 150 und ein Median von 675. Die relativen Signalintensitäten sind in Abbildung 7 graphisch dargestellt. 41 Abb. 7: Verteilung der relativen Signalintensitäten in der Protonendichte-Sequenz für die Gruppe der Patienten mit idiopathischen Parkinson-Syndromen (IPS) und das Kontrollkollektiv aus Probanden. Keine statistische Signifikanz ergab sich hingegen für die dorsale Breite (Bd) der Protonendichte-Sequenz mit p = 0,392. Hier lagen entsprechend Abbildung 8 die gemessenen Werte dicht beieinander, so ergaben sich für die Gruppe der Patienten mit idiopathischen Parkinson-Syndromen Minimalwerte von 0,15 cm bis zu Maximalwerten von 0,4 cm. Weiterhin ergaben sich ein Mittelwert von 0,285, eine Standardabweichung von 0,062 sowie ein Median von 0,3 cm. Die Probanden wurden mit einem Wertebereich der Breiten dorsal (Bd) von 0,2 cm bis 0,4 cm vermessen. Der Mittelwert lag bei 0,307, die Standardabweichung ebenfalls bei 0,062 und der Median bei 0,3 cm. 42 Abb. 8: Verteilung der gemessenen Breiten dorsal (Bd) der Substantia nigra in der Protonendichte-Sequenz für die Gruppe der Patienten mit idiopathischen ParkinsonSyndromen (IPS) und das Probanden-Normalkollektiv. Als Quotient Q2 wurde der Quotient aus ventraler Breite (Bv) plus dorsale Breite (Bd) der Substantia nigra pars compacta der nicht betroffenen Seite und ventraler Breite (Bv) plus dorsale Breite (Bd) der betroffenen Seite bezeichnet; auch hier ergaben sich, ähnlich wie in einer Arbeit zur linearen Vermessung des Mittelhirnes zur Differenzialdiagnose der MSA [108], keine statistischen Signifikanzen. 43 5. Diskussion 5.1. Methodenwahl Bis vor einem Zeitraum von ca. 10 Jahren ist man davon ausgegangen, dass mit bildgebenden Verfahren wie CT oder MRT keine hinreichenden pathologischen Veränderungen bei Patienten mit Parkinson-Syndromen nachzuweisen sind, die zur Differenzialdiagnose beitragen können, abgesehen von symptomatischen bzw. sekundären Parkinson-Syndromen, die z. B. durch einen Normaldruckhydrozephalus oder eine SAE hervorgerufen werden [19]. Lediglich mit kostenintensiver, den Patienten durch eine relativ hohe Strahlenexposition belastende und in der Regel schlecht verfügbare nuklearmedizinische Diagnostik wie PET und SPECT gelingt ein Ausschluss bzw. der Nachweis mit hoher Sensitivität und Spezifität [8, 112]. Diese Art der bildgebenden Diagnostik ist, insbesondere im Hinblick auf die PET, im Regelfall nur wenigen Zentren vorbehalten [112]. Erschwerend kommt noch hinzu, dass für die vorgenannte Diagnostik eine eventuell bereits eingeleitete medikamentöse Antiparkinson-Therapie unterbrochen werden muss, da die entsprechenden Präparate vorher abgesetzt werden müssen [76, 138]. Nach wie vor wird die Diagnose eines Parkinson-Syndromes zunächst klinisch gestellt [41]. Dass die Komplexität der Symptomatik aber hinsichtlich der klinischen Diagnose schwierig bleibt, wurde autoptisch bestätigt. So konnte lediglich in 76 % der Fälle die Diagnose eines idiopathischen Parkinson-Syndromes bestätigt werden [63, 64]. 44 Es wurde also ein kostengünstiges, weitverbreitetes und -verfügbares, bildgebendes Verfahren gesucht, das möglichst schonend, also ohne Verwendung ionisierender Strahlung, hinreichend genau morphologische Veränderungen am Gehirn darstellt, um Patienten mit idiopathischen ParkinsonSyndromen von anderen zu differenzieren. Vor den oben genannten Hintergründen empfiehlt sich dennoch eine bildgebende Diagnostik mittels MRT, da sich diese in der Zwischenzeit aufgrund des weiterführenden technischen Fortschrittes vom teuren Spezialverfahren zum mittlerweile klinisch etablierten, relativ preiswerten Routineverfahren entwickelt hat und ohne ionisierende Strahlung auskommt [146]. Deshalb hat sich in der Zwischenzeit eine Vielzahl von Studien und Arbeitsgruppen mit der kernspintomographischen Schnittbildgebung bei Patienten mit Parkinson-Syndromen beschäftigt; die Arbeiten, die sich mit den morphologischen Veränderungen der Substantia nigra auseinandersetzten, waren dabei in der Unterzahl [1]. Bis zum jetzigen Zeitpunkt konnte jedoch noch kein optimales MR-Protokoll entwickelt werden [1], um Veränderungen bei Patienten mit ParkinsonSyndromen bzw. Alterationen der Substantia nigra darzustellen und auswertbar zu machen, da Routinesequenzen, etwa in T2-Wichtung, die Substantia nigra nicht hinreichend genau darstellen [38, 42, 113]. 5.2. Forschungsansätze: In den letzten Jahren wurde also an einer Vielzahl neuer MR-Techniken gearbeitet, die sich im Wesentlichen in vier Gruppen aufteilen lassen [91]: 45 Verschiedene Arbeitsgruppen beschäftigten sich mit der Messung von T2- und T2*-Relaxationszeiten, die sich mit der Akkumulation von Eisen in den Basalganglien bei Parkinson-Syndromen verändern [56, 57, 100]. Andere Forschungsprojekte untersuchten die Substantia nigra mit Messungen an T2- und Protonendichte-gewichteten Sequenzen [1, 98]. Die nächste Gruppierung umfasst die Diffusion-Tensor-Imaging (DTI)Bildgebung, bei der die Darstellung und Auswertung der Verschaltung der Basalganglien im Vordergrund stand [123, 124, 127, 150]. Schließlich in die letzte Gruppe einzuordnen sind Ansätze, strukturelle Veränderungen der Basalganglien und der Substantia nigra bei ParkinsonPatienten mittels T1- und Inversion-Recovery-Bildgebung zu untersuchen [6668, 110]. Die Studienlage ist unübersichtlich, da viele Autoren bzw. Arbeitsgruppen zu verschiedenen, teils widersprüchlichen Ergebnissen kamen, sodass die Datenlage insgesamt sehr heterogen ist. Die Signalveränderungen in der MRT bei Patienten mit idiopathischen Parkinson-Syndromen wurden mit der Änderung des Eisengehaltes der Basalganglien in Zusammenhang gebracht. Ein eindeutiger Konsensus über Eisengehalt und Auswirkungen auf die Bildgebung konnte bisher nicht erreicht werden [1]. Nach Antonini et al. [4] und Gorell et al. [56] kommt es bei Parkinsonerkrankten zu einer Signalabsenkung im Putamen, Globus pallidus und der Substantia nigra, hervorgerufen durch vermehrte Eisenablagerung. Diese Erkenntnisse konnten durch verschiedene Arbeitsgruppen um Drayer et al. [39], Stern et al. [132], Sofic et al. [130], Dexter et al. [35], Hirsch et al. [58] und Youdim et al. [151] bestätigt werden; die Studien bestätigten zudem eine Akkumulation von Eisen-III in der Zona compacta der Substantia nigra. 46 Die Forschergruppen schlugen vor, dass der erhöhte Gesamteisengehalt eine exzessive Ansammlung toxischer Radikale darstellt, die zum Zelltod führt. Dexter et al. postulieren jedoch in einer anderen Studie [33], dass verminderte Spiegel an mehrfach ungesättigten Fettsäuren zu einer vermehrten Fettperoxidation und so sekundär zusätzlich zum Zelltod dopaminerger Zellen in der Substantia nigra beitragen. Andere Autoren berichteten hingegen von einer Signalverminderung eines primär hyperintensen Gewebsstranges zwischen dem Nucleus ruber und der weiter ventral gelegenen pars reticulata der Substantia nigra [17, 40, 62]. Rutledge et al. [117] beschrieben eine Signalanhebung im Sinne einer sogenannten Signalwiederherstellung (d. h. eigentliche Signalabsenkung mit sekundärer Signalsteigerung) in den dorsolateralen Anteilen der Substantia nigra, die einerseits durch eine Eisenentleerung (und den dadurch erhöhten Zellstoffwechsel), andererseits durch lokalen Zelltod und ein erhöhtes extrazelluläres Volumen zustande kommen könnte. Braffmann et al. [17] fanden im Gegensatz keine signifikanten Differenzen in der putaminalen Signalintensität im Vergleich von Probanden mit ParkinsonPatienten unter Verwendung von T2- gewichteten Spinecho- und T2*gewichteten Gradientenecho-Sequenzen. Auf die Theorie der Eisenakkumulation und dieses Modells der Eisenstoffwechselstörung in Zusammenhang mit Parkinson-Syndromen sowie des dadurch vermuteten oxidativen Stresses, der dann zum Zelltod dopaminerger Zellen führt, z. B. durch u. a. Calne et al. [26] in Frage gestellt, legt sich trotz der Kontroverse [1, 91] eine größere Anzahl von Forschern und Forschungsgruppen fest. Hier sind Arbeitsgruppen wie Ordidge et al. [100], Gorell et al. [56], Graham et al. [57], Brooks et al. [22], Drayer et al. [38, 39], Stern et al. [132], Sofic et al. 47 [130], Dexter et al. [34, 35], Hirsch et al. [58], Youdim et al. [151], Vymazal et al. [140], Fahn et al. [44], Semchuk et al. [125], Ben-Schachar et al. [7], sowie Sian et al. [129] zu nennen. Deshalb sollen die Veränderungen im Eisenstoffwechsel und die Eisenakkumulation theoretische Grundlage der vorliegenden Untersuchung sein. Nach Vymazal et al. [139-145] führen Unterschiede im Eisengehalt in der grauen Substanz zu Veränderungen der T2- und T1-Zeiten und somit naturgemäß auch zur Änderung der Signalintensität; darüber hinaus ist die Eisenmenge verschiedener Strukturen unterschiedlich und altersabhängig [142]. Die höchsten Eisenkonzentrationen finden sich im gesunden Gehirn im Globus pallidus mit einer Konzentration von ca. 21 mg pro 100 g Gewebe [143]. Etwa ein Drittel des Eisengehaltes des Gehirns ist in Form von Ferritin gespeichert, in den eisenhaltigen Kernen der Basalganglien wie dem Globus pallidus jedoch liegt der Anteil wesentlich höher und beträgt bis zu 80 % [139]. Über den Eisengehalt hinausgehend, spielt die vorliegende Form bzw. Speicherform des Eisens eine entscheidende Rolle [143]. Die Signalveränderungen betreffend, wird dem Ferritin der wesentliche Anteil des T2-Effektes zugerechnet, der auf den superparamagnetischen Kerneigenschaften des Ferritins beruhen soll, eine lineare Abhängigkeit von der Feldstärke aufweist und im Vergleich zum T1-Effekt stärker ist [5, 6, 14, 23, 121, 140, 149]. Der T1-Effekt wiederum, d. h. die T1-Zeitverkürzung, wird wahrscheinlich von den paramagnetischen Eigenschaften der Eisenatome der Kernoberfläche des Ferritins verursacht [23, 24, 139, 141, 142, 145]. Eisenkonzentration und Bindungsform sollen gemeinsam die entscheidende Rolle in der Pathogenese der idiopathischen Parkinson-Syndromen spielen, vor 48 allem im Hinblick auf den postulierten Zelltod der dopaminergen Neurone der Basalganglien durch oxidativen Stress [140]. Freies, zweiwertiges Eisen soll zytotoxisch wirken, während an Hämosiderin oder Ferritin gebundenes, dreiwertiges Eisen eine “sichere” Speicherform darstellen soll [7, 44, 125, 129]. Hutchinson, Raff et al. postulierten [66, 67], dass die T1- und InversionRecovery-Bildakquisition, also die Spin-Gitter-Relaxation, im wesentlichen die intrazellulären Räume und Makromoleküle repräsentiert; also den protein- und lipidreichen Raum, in dem der Großteil der anzunehmenden pathologischen Prozesse im Rahmen der Neurodegeneration abläuft und so T1-Veränderungen plausibel werden, im Gegensatz zu dem vermutlich zum größten Teil aus Wasser bestehenden Extrazellularraum [68]. Die so mit der Neurodegeneration assoziierten Veränderungen der Spin-GitterRelaxation, der T1-Zeit, wirken sich in den stark T1-gewichteten InversionRecovery-Sequenzen als T1-Zeitverkürzung und damit Signalerhöhung in der implementierten Inversion-Recovery-Technik aus; pathologische Veränderungen werden also hyperintens dargestellt [68, 109]. 5.3. T2- und T2*-gewichtete Bildgebung der Basalganglien: Die T2- und T2*-Bildgebung betreffend, kamen Ordidge et al. [100], Gorell et al. [56] und Graham et al. [57] zu ähnlichen Ergebnissen, nach denen signifikante Signalveränderungen durch einen erhöhten nigralen Eisengehalt bei Parkinsonpatienten nachgewiesen werden konnten. Wiederum Rutledge et al. [118], in einer anderen Studie als [117], betonen, dass es im Laufe des Lebens zu wechselnden und schwankenden Eisenspiegeln kommt, während Brooks et al. [22] vorschlagen, dass eine direkte Bindung von H2O an Fe+-Ionen zum Mechanismus der Signalveränderungen beiträgt. 49 Chen et al. [29] hingegen vermuten, dass Zustand, Form, und mikroskopische Distribution gleichermaßen zur Veränderung der T2-Zeiten beitragen und dass die verschiedenen Speicherformen mehr als die Gesamtkonzentration entscheidend sind. Koenig et al. [70], erweitert durch Bizzi et al. [14] führten die Signalabsenkungen wiederum auf den T2*-Effekt des Ferritins zurück und zeigten, dass die T2Zeitverkürzung nicht quadratisch mit der Feldstärke einhergeht, sondern der Signalverlust durch die antiferromagnetischen und superparamagnetischen Eigenschaften des Kerns des Ferritins bedingt ist. Den Eisenstoffwechsel betreffende T2-Signalveränderungen in der Substantia nigra konnten aktuell auch bei Restless legs syndrome-Patienten gefunden werden [53]. Darüber hinaus wurden kürzlich durch McNeill et al. [89] Eisenakkumulationen in den Basalganglien auch bei anderen, genetisch bedingten neurodegenerativen Systemerkrankungen wie der Pantothenatkinase assoziierten Neurodegeneration (früher Hallervorden-Spatz-Erkrankung), der infantile neuroaxonalen Dystrophie und der Azeruloplasminämie zuverlässig anhand T2gewichteter Turbo-Spinecho-Bildgebung erkannt. 5.4. Sequenzen in Protonendichte-Wichtung: Mit der Bildgebung in Protonendichte-Wichtung beschäftigten sich vor allem Oikawa et al. [98]. Einhergehend mit der Meinung von Drayer et al. [38, 39] und Rutledge et al. [117, 118] gehen sie von einer Signalabsenkung der Substantia nigra infolge Eisenakkumulation aus. Den Untersuchungsergebnissen der Gruppe um Oikawa zufolge, kann die Substantia nigra in herkömmlicher T2-Spinecho-Bildgebung nicht hinreichend genau abgebildet werden, in Protonendichte-Wichtung bzw. in Aufnahmen in 50 Short-TI-Inversion-Recovery (STIR)-Technik sei eine bessere Detektion gewährleistet. Bei Parkinsonerkrankten konnte in der vorgenannten Studie kein Volumenverlust der Substantia nigra nachgewiesen werden, was den Autoren zufolge vereinbar mit neueren neuropathologischen Untersuchungen wäre [52, 81]. 5.5. Diffusion Tensor Imaging (DTI) und diffusionsgewichtete Bildgebung: Die Forschungsergebnisse um Arbeitsgruppen wie Schocke und Seppi et al. [123, 124, 127] und Yoshikawa et al. [150] sollen hier nur kurz abgehandelt werden, da sich ihre Ansätze im Rahmen des DTI auf die Struktur und Verschaltungen der Basalganglien und der Substantia nigra beziehen; die Erkenntnisse spiegeln hierbei naturgemäß nicht den Grad der Degeneration der Substantia nigra bzw. die Veränderungen in der Bildgebung und der Signalintensitäten wider. Entsprechend den Veröffentlichungen soll es sich bei DTI um eine vielversprechende Möglichkeit handeln, Probanden von Erkrankten mit Parkinson-Syndromen bzw. PSP zu differenzieren [28, 71]. Diffusionsgewichtete Bildgebung (Diffusion weighted imaging, DWI) mit der Kalkulation von Diffusionskoeffizienten (Apparent diffusion coefficient, ADC) verschiedener Hirnregionen kann zur Abgrenzung von idiopathischen Parkinson-Syndromen gegenüber MSA herangezogen werden [101]. 5.6. T1-gewichtete Bildgebung und Inversion Recovery-Sequenzen: Die oben angeführten Studien und Arbeitsgruppen beschäftigten sich vorwiegend mit den morphologischen und strukturellen Veränderungen der Substantia nigra in T2-gewichteter Bildgebung. 51 Einen gänzlich unterschiedlichen Ansatz verwenden Hutchinson et al. [66-68] und Raff et al. [110], indem sie T1-gewichtete Bildgebung in InversionRecovery-Technik verwenden. Die Untersuchungen basieren auf der Annahme der Arbeitsgruppe um Hutchinson, dass es im Rahmen der Degeneration der Substantia nigra und der Eisenakkumulation bei idiopathischen Parkinson-Syndromen zu degenerativen Veränderungen des intrazellulären Kompartiments und so zu Änderungen der Spin-Gitter-Relaxationszeit, also der T1-Zeit, kommt [68]. In den vorliegenden Untersuchungen der Gruppen um Hutchinson und Raff [6668, 110] konnten Kontrollpersonen von Patienten mit idiopathischen ParkinsonSyndromen gut abgegrenzt werden, was im Folgenden durch Minati et al. [91] reproduziert wurde. Initial konnte von Hutchinson und Raff et al. mit Inversion-Recovery-Sequenzen, die an sechs Patienten mit idiopathischen Parkinson-Syndromen angewandt wurden, eine deutliche Abgrenzung zu sechs alterskorrelierten Probanden vorgenommen werden. In den o. g. Studien war bereits bei der visuellen Inspektion eine Degeneration der Substantia nigra bei Parkinsonerkrankten von lateral nach medial und von rostral nach caudal erkannbar. Darüber hinaus war beim Patientenkollektiv bereits ohne rechnergestützte Auswertung eine Ausdünnung der Substantia nigra in den lateralen Anteilen sowie ein gewisser “Mottenfraß”-Aspekt zu beobachten. Bei der Auswertung der Signalintensitäten in ROI-Technik und anschließender Quotientenbildung konnte das Normalkollektiv mit p < 0,001 hochsignifikant von Parkinsonpatienten abgegrenzt werden [66]. Zusätzliche Datennachverarbeitung und –manipulation mittels Umwandlung der monochromen Bilddaten in eine Pseudofarbskala in Rendering-Technik und wiederum die Bestimmung von Indices durch Quotientenbildung konnten die grundlegenden Erkenntnisse bestätigen und zeigten erneut eine hochsignifikante Differenzierung von gesunden Probanden gegenüber einem Patientenkollektiv (n = jeweils 6; p = 0,0005) [67]. 52 Unter Verbesserung der Auswertungstechnik und der Erkennbarkeit der Substantia nigra konnten in einer weiteren Studie mit jeweils n = 12 unter Verwendung eines Algorithmus zur automatischen Erkennung und Segmentation der Substantia nigra der Mechanismus der Degeneration von lateral nach medial sowie die Ausdünnung der Substantia nigra im Sinne einer Rückbildung von hyperintensen Arealen bei Parkinsonerkrankten im Vergleich zum Normalkollektiv bestätigt werden. Im Gegensatz zu den vorherigen Erkenntnissen stellte sich die Substantia nigra beim Patientenkollektiv nun in den ventralen Abschnitten ausgedehnt dar [68]. Im Folgenden wurde versucht, die Abgrenzung der Substantia nigra weiter zu verbessern, um eine genauere Evaluation der neurodegenerativen Veränderungen der Substantia nigra im Rahmen des Parkinson-Syndromes zu gewährleisten, u. a. durch Anwendung von automatisierten Segmentations- und Bildfusionstechniken [110, 115] sowie der weiteren sekundären Bilddatenverarbeitung, um Bewegungsartefakte zu minimieren bzw. aus den Daten herauszurekonstruieren, ähnlich der bekannten Technik eines Pixelshift bei digitalen Subtraktionsangiographien. Die vorgenannten Ziele konnten jedoch nur partiell erreicht werden; es scheint vielmehr so, dass die zurzeit standardmäßigen Feldstärken von 1,5 T keine dünnere Schichtakquisition bei akzeptablem Bildrauschen (Signal-RauschVerhältnis) zulassen, um die Veränderungen an der Substantia nigra bzw. die Substantia nigra selbst, in höherer Auflösung darzustellen [109]. Die Fallzahlen der vorgenannten Arbeiten waren jedoch relativ gering, außerdem handelte es sich bei den Untersuchungsbedingungen um nahezu ideale “Laborbedingungen” ohne zeitliche Einschränkung hinsichtlich der Patienten- und Probandenlagerung, der Positionierung sowie der Einstellungen. Zusätzlich wurden die Patienten und Kontrollpersonen mit Haltegurten fixiert, um Bewegungsartefakte zu vermeiden. 53 Im klinischen und praktischen Alltag sind solche Bedingungen jedoch nicht vorzufinden, sodass die grundlegenden Erkenntnisse der T1- und InversionRecovery-Bildgebung bei idiopathischen Parkinson-Syndromen in der vorliegenden Arbeit anhand eines größeren Kollektivs und unter Routinebedingungen überprüft wurden. Sasaki et al. und Shibata et al. beschreiben in zwei aktuellen Publikationen die direkte Darstellbarkeit von Neuromelanin bzw. der strukturellen Veränderungen des Locus coeruleus und der Substantia nigra pars compacta durch den Pigmentverlust bei idiopathischen Parkinson-Syndromen durch T1-gewichtete, spezielle Turbo-Spinecho-Sequenzen [119, 128]. 5.7. Ergebnisdiskussion: Die eigenen Ergebnisse entsprechen nur zum Teil den Erkenntnissen, über die im Vorfeld berichtet wurde. So wurde von den Hutchinson, Raff, et al. angegeben, dass bereits bei rein visueller Auswertung bildmorphologische Veränderungen der Substantia nigra bei Parkinson-Patienten erkennbar waren [68], in diesem Kontext erschienen die lateralen Anteile der Substantia nigra bei an idiopathischen ParkinsonSyndromen Erkrankten ausgedünnt, in den ventralen Anteilen war sogar eine gewisse hyperintense Aufweitung zu erkennen. Insgesamt lag bei dem Patientenkollektiv der Eindruck einer “mottenfraßartigen” Veränderung der Substantia nigra vor. Bei atypischen Parkinson-Syndromen waren optisch bereits medial Verschmächtigungen der Substantia nigra abgrenzbar; jeweils im Vergleich zum gesunden Kontrollkollektiv. Am eigenen Bildmaterial konnte durch den Autor der Studie ohne rechnergestützte Analyse keine visuelle Einschätzung vorgenommen werden, 54 ob es sich um einen gesunden Probanden, einen Patienten mit idiopathischem Parkinson-Syndrom oder um ein atypisches Parkinson-Syndrom handelte. Abbildung 9 zeigt die SNdiv eines langjährigen Parkinsonpatienten im Vergleich zu einer Person aus dem Kontrollkollektiv. Darüber hinaus konnten die Autoren an ihrem Kollektiv die bekannte Degeneration der Substantia nigra von lateral nach medial und ventral nach dorsal nachvollziehen; dies jeweils hochsignifikant mit p < 0,001 [66-68], sodass Patienten mit idiopathischen Parkinson-Syndromen von Gesunden spezifiziert werden konnten. Am eigenen Datenmaterial spiegelt sich zwar die Neurodegeneration mit einem Gradienten von lateral nach medial wider, im Gegensatz zu den vorangestellten Erkenntnissen ergab sich jedoch eine Verschmächtigung der Substantia nigra in den dorsalen Anteilen, da die Messwerte der dorsalen Breite Bd der ParkinsonPatienten sowohl in den primären Schichten der Inversion-Recovery-Sequenzen (SN1), als auch am manipulierten Datenmaterial (SNsub und SNdiv) signifikant bzw. hochsignifikant geringer waren als die des Vergleichskollektivs. 55 Abb. 9: Sequenz SN1 in Detailvergrößerung. Vergleich 67-jähriger Parkinsonpatient mit linksseitigem idiopathischem Parkinson-Syndrom vom Äquivalenztyp, 96-monatige Krankheitsdauer, Hoehn und Yahr-Stadium I (A), mit einer gesunder, 69-jähriger Kontrollperson (B). Keine ohne rechnergestützte Analyse erkennbaren Unterschiede. Interessant in diesem Zusammenhang ist, dass die Messungen an den Primärdaten hochsignifikante (p = 0,002) Unterschiede ergaben im Vergleich zu den manipulierten Sekundärdaten mit p = 0,004 und dem nur signifikanten Unterschied in der SNdiv mit p = 0,028, die ja eigentlich zur besseren Erkennbarkeit und Abgrenzbarkeit der Substantia nigra generiert wurde. Dies scheint im oben angegebenen Kontext nicht der Fall zu sein. Nach [68] waren die gemessenen Signalintensitäten in den Inversion-RecoverySequenzen in der Substantia nigra pars compacta bei Parkinsonkranken signifikant höher als bei gesunden Vergleichspersonen, der Mechanismus wurde bereits unter 5.2. erörtert. Die eigenen Ergebnisse weisen für die Inversion-Recovery-Bildgebung für die unmanipulierten Primärdaten als auch für die Sekundärrekonstruktionen signifikante Unterschiede hinsichtlich der absoluten Signalintensitäten zwischen dem Parkinsonkollektiv und den gesunden Personen auf. Bei Parkinsonkranken lagen die absoluten Signalintensitäten signifikant (SNdiv, SN1) bzw. hochsignifikant über denen des gesunden Kollektivs. 56 Dies war allein bei den ROId der Fall, die ROIv hingegen zeigten in keiner der Inversion-Recovery-Sequenzen signifikante Unterschiede. Die absoluten Signalintensitäten in der MRT zeigen keine (annähernd) lineare und reproduzierbare Abhängigkeit vom untersuchten Material bzw. Gewebe wie z. B. die Hounsfield-Einheiten in der CT. Zur besseren Vergleichbarkeit wurden deshalb Signalintensitäts-Quotienten gebildet, so aus den dorsal (ROId) und ventral (ROIv) gemessenen Einzel-ROI, die neue Variable wurde als ROIv/d bezeichnet. Für alle ROIv/d der Inversion-Recovery-Reihe ergaben sich hochsignifikante Differenzen hinsichtlich der Quotienten, was einerseits die Untersuchungsergebnisse von Hutchinson, Raff et al. bestätigt. Der postulierte Zusammenhang der intrazellulär ablaufenden Neurodegeneration und die Darstellbarkeit in T1-Bildgebung bzw. Inversion-Recovery-Technik konnte also nachvollzogen werden, die Ergebnisse stehen jedoch im Widerspruch zu den bekannten neurodegenerativen Gradienten von ventrodorsal und lateromedial. Die hier vorliegenden Resultate stehen im Einklang mit der gemessenen Verschmächtigung der Substantia nigra in den dorsalen Anteilen, suggerieren jedoch ein neurodegeneratives Muster von lateral nach medial und dorsal nach ventral. Für eine tatsächliche Verschmächtigung der Substantia nigra im Rahmen der Neurodegeneration spricht auch der intraindividuell signifikant differente Quotient Q1 der Fläche der betroffenen Hemisphäre bei einseitiger Ausprägung des Krankheitsbildes zur “gesunden” bzw. nicht betroffenen Seite. In der SNdiv war Q1 signifikant kleiner als bei gesunden Vergleichspersonen. Die Analysen der Protonendichte-Wichtungen widersprechen hingegen den Resultaten der Inversion-Recovery-Auswertungen. Weder für Bv und Bd sowie die Flächenvermessung ergaben sich signifikante Unterschiede zwischen den Gruppen. Signifikante und höchst signifikante 57 Differenzen hinsichtlich der Signalintensitäten ergaben sich dagegen in den Einzel-ROI (ROIv und ROId) sowie in der Flächen-ROI. Die gemessenen Signalintensitäten waren bei Erkrankten deutlich höher im Vergleich zu gesunden Personen, sowohl in den ventralen Abschnitten als auch dorsal. Eine neurodegenerative Größenänderung bzw. Verschmächtigung der Substantia nigra im Rahmen eines idiopathischen Parkinson-Syndromes ist hieraus also nicht abzulesen bzw. erkennbar. Hinsichtlich der Signalintensitäten können Patienten mit idiopathischen Parkinson-Syndromen signifikant von Probanden abgegrenzt werden, aber das bereits beschriebene neurodegenerative Muster der Parkinson-Syndrome in der Substantia nigra ist nicht darstellbar, da sich keine signifikanten Differenzen der Signalintensitäten zwischen ROIv und ROId nachweisen ließen. Diese Ergebnisse bestätigen wiederum Autoren wie Oikawa et al. [98], nach denen bei Untersuchungen der Substantia nigra in Protonendichte-Wichtung entsprechend früherer Veröffentlichungen von Hirsch et al. [59] und Solsberg et al. [131] eine bessere Identifikation der Substantia nigra gegeben ist, es jedoch bei Parkinsonkranken zu keinem Volumenverlust der Substantia nigra kommt. Ma et al. [80, 81] und German et al. [52] konnten dies in neuropathologischen Studien bestätigen, trotz des beträchtlichen Zellverlustes war kein Volumenverlust der Substantia nigra pars compacta bei idiopathischen Parkinson-Syndromen zu verzeichnen. Es konnten bei Erkrankten lediglich Lewy-Körperchen sowie eine Abblassung der pigmentierten Neurone der Substantia nigra gefunden werden. Die Resultate dieser Dissertation sind in Bezug auf die o. g. Studien nur vordergründig widersprüchlich. Die wesentlichen Differenzen sind methodischtechnisch bedingt und werden im folgenden Kapitel erörtert. 58 Insgesamt scheinen aber die Zusammenhänge der Neurodegeneration und der damit einhergehenden Veränderungen des Eisenstoffwechsel und der intrazellulären Kompartimente bezüglich der Auswirkungen auf die Spin-GitterVerhältnisse, also die T1-Relaxationszeit, aufgrund der kontradiktiven wissenschaftlichen Publikationen noch nicht hinreichend aufgeklärt [91]. 5.8. Methodendiskussion: In den zahlreichen Versuchen und Ansätzen, die Substantia nigra zu vermessen, konnte nie eindeutig belegt werden, dass die Substantia nigra selbst bzw. ihre Kompartimente pars reticulata und pars compacta magnetresonanztomographisch exakt identifiziert, abgegrenzt und vermessen wurden [56, 98]. Vielmehr scheint es so, dass bei der Vermessung der Substantia nigra jeweils, einhergehend mit Minati et al. [91], statt der Substantia nigra bzw. ihrer Anteile pars reticulata und pars compacta ein Bezirk zwischen Nucleus ruber und den Pedunculus cerebri vermessen wurde. Die heterogene Datenlage ist in diesem Zusammenhang durch Messfehler bzw. Verfälschung der Messwerte infolge Teilvolumeneffekten mit Einbeziehung von Signalcharakteristiken des Hirnschenkels und des Nucleus ruber erklärbar. Oikawa et al. [98] liefern einen guten Ansatz zur Differenzierung der Strukturen des Mittelhirnes, in dem die MR-tomografischen Vermessungen des mit formalin-fixierten anatomischen Präparaten verglichen wurden. Die Studie leidet jedoch unter der geringen Fallzahl von n = 4. Auf die vorliegende Arbeit bezogen, wurde in Kenntnis der Schwierigkeiten, insbesondere die Substantia nigra pars compacta, also den Anteil abzugrenzen, in der es bei idiopathischen Parkinson-Syndromen vorwiegend zum Verlust der 59 dopaminergen Neurone kommt, bewusst auf den Versuch einer selektiven Darstellung der Substantia nigra pars compacta verzichtet. Zudem wurden die Inversion-Recovery-Sequenzen in ein Routineprotokoll integriert, d. h. auf eine selektive Angulierung der Zielsequenzen wie bei Raff und Hutchinson et al. in [66-68, 109, 110] senkrecht zur Hirnstamm- bzw. Meynertschen Achse wurde ebenfalls verzichtet. Die Sequenzen wurden, wie in der MR-Routinediagnostik üblich, an der Bikommissurallinie nach Talairach orientiert. Die Unterschiede sind in Abbildung 13 ersichtlich. Da die Substantia nigra anteroinferiolateral des Nucleus ruber liegt, kommt es bei der Vermessung der Substantia nigra in bikommissural orientierten Schichten zu Teilvolumeneffekten, sodass wiederum Anteile der Fasern des Hirnschenkels in die Messungen eingehen [98]. Von einer komplexen Bildnachbearbeitung im Sinne eines Farb-Rendering, diffizilen Segmentationstechniken sowie von aufwendigen Korrekturen von Bildund Bewegungsartefakten wurde ebenfalls abgesehen. 60 Abb. 10: Unterschiede der Studienprotokolle hinsichtlich der Angulation bei Einstellung senkrecht zur Meynertschen Achse (rote Linie) bzw. parallel zur Talairach-Linie (blaue Linie). Meynertsche Achse grau. Erstellt nach Oikawa et al. [98] Die teilweise differenten Ergebnisse im Vergleich zu den Referenzstudien sind am ehesten in den o. g. Zusammenhängen und technischen Unterschieden zu sehen [60, 65]. Sie spiegeln insgesamt die heterogene Datenlage und die derzeitige Schwierigkeit wider, komplexe funktionelle Systeme bildgebend hinreichend genau in ihren Einzelkomponenten darzustellen und erkennbar werden zu lassen, um sie objektiven Mess- und Auswertungsverfahren zugänglich zu machen [2]. Ähnlichen Limitierungen unterliegen aber auch konkurrierende, funktionelle Verfahren wie die bis dato als Goldstandard angesehene Diagnostik mittels PET und SPECT. 61 18F-6-Flourodopa-PET kann zwar verlässlich Gesunde von Patienten mit milden idiopathischen Parkinson-Syndromen trennen [61], sodass diese Modalität diesbezüglich durchaus als Frühdiagnostikum in Frage käme, da sie relativ früh nigrostriatale Transmissionsstörungen aufzeigt; aber auch bei der PET kann bisweilen im Borderline-Bereich zwischen noch-normal und früh-pathologisch eine diagnostische Unschärfe bestehen [50]. Erschwerend können weiterhin auch Erkrankte mit idiopathischen ParkinsonSyndromen einen normalen SPECT-Befund aufweisen [83, 84] Die darüber hinaus bestehenden Einschränkungen sowie der immense Kostenfaktor wurden bereits eingangs diskutiert. Zusammenfassend konnte hier gezeigt werden, dass es bei den neurodegenerativen Veränderungen der idiopathischen Parkinson-Syndrome zu Alterationen der Substantia nigra kommt, die magnetresonanztomographisch zwar erfasst, im Routinebetrieb aber ohne rechnergestützte Analyse nicht visualisiert werden können. Mit den untersuchten Sequenzen in Protonendichte-Wichtung und in InversionRecovery-Technik können gesunde Versuchspersonen aus einem Probandenkollektiv von Patienten mit idiopathischem Parkinson-Syndrom signifikant abgegrenzt werden. Limitierungen dieser Studie ergeben sich hinsichtlich der Untersuchungszahlen von insgesamt n = 50, zudem wurden überwiegend Patienten der Stadien Hoehn und Yahr I – II eingeschlossen. Um die Inversion-Recovery-Technik im Rahmen klinischer und praktischer Routine zu etablieren, bedarf es weiterer Studien mit größeren Fallzahlen, vor allem im Hinblick auf Gruppenanalysen nach Krankheitsdauer. 62 Zudem müssten zukünftige Studien im Besonderen darauf ausgelegt sein, Veränderungen der Basalganglien möglichst frühzeitig zeigen zu können, da zum Zeitpunkt der klinischen Diagnose eines idiopathischen ParkinsonSyndromes bereits 60 % der dopaminergen Neurone der Substantia nigra und bis zu 80 % striataler Neurone abgestorben sind [61]. Es müssten also geeignete Früherkennungsmethoden gefunden werden, um den Zellverlust verhindern und neuroprotektive Maßnahmen [51, 135] einleiten zu können, weil die Diagnose eines idiopathischen Parkinson-Syndromes klinisch ohne das Auftreten von Symptomen bisher nicht gestellt werden kann. Reihenuntersuchungen bzw. Screenings mit SPECT oder PET sind nicht praktikabel und finanzierbar [50]. In aktuellen Publikationen scheint eine in der letzten Dekade zunehmend weniger angewandte Technik, die Magnetresonanz-Spektroskopie, eine gewisse Renaissance zu erfahren; möglicherweise kann die Spektroskopie in Zukunft zur Differenzialdiagnostik der idiopathischen Parkinson-Syndrome beitragen [27]. Weiterhin ergaben sich in den letzten Jahren Hinweise, dass funktionelle MRT nicht nur zum Therapiemonitoring eingesetzt werden kann, sondern auch in der Grundlagenforschung hinsichtlich der Ätiopathogenese wertvolle Erkenntnisse liefert [96]. Letztendlich zeichnet sich ab, dass im Rahmen der weiteren technischen Entwicklung zu höheren Feldstärken der MR-Scanner aufgrund der verbesserten Auflösung und der verringerten Schichtdicke bei akzeptablem Signal-Rausch-Verhältnis eine bessere Differenzierbarkeit intrakranieller anatomischer Strukturen gewährleistet ist; so konnten Geng et al. [49] bei 3 Tesla MR-volumetrisch signifikante Unterschiede zwischen gesunden Probanden, an milden idiopathischen Parkinson-Syndromen Leidenden und schwerer erkrankten Personen mit Parkinson-Syndromen herausarbeiten. 63 Martin et al. [85] fanden mit einer Gradientenechosequenz bei 3 Tesla ebenfalls signifikante Differenzen zwischen Probanden und milden idiopathischen Parkinson-Syndromen. Michaeli et al. arbeiteten bei einer noch höheren Feldstärke von 4 Tesla und Schichtdicken im Submillimeterbereich signifikante Unterschiede zwischen Probanden und Patienten mit idiopathischen Parkinson-Syndromen in T1-und T2-gewichteten Spezialsequenzen heraus [90]. Inwieweit der Trend zur Hochfeld-MRT anhält, wird sich in näherer Zukunft zeigen, in der aktuellen Literatur finden sich erste Berichte über Anwendungen von 7 Tesla-Systemen am Menschen, so veröffentlichten Maderwald et al. [82] eine Arbeit über Time of flight (TOF)-Angiographien bei 7 T. Publikationen hinsichtlich der magnetresonanztomographischen Differenzialdiagnostik der idiopathischen Parkinson-Syndrome bei solchen Feldstärken existieren derzeit nicht. 64 6. Zusammenfassung 6.1. Zielsetzung Die Diagnose eines idiopathischen Parkinson-Syndromes ist bis zum heutigen Zeitpunkt überwiegend von klinischen Parametern bestimmt. Im Regelfall, also außerhalb der größeren Zentren, steht an apparativer Diagnostik eine spezifische Bildgebung des Neurokraniums in Form von nuklearmedizinischen Untersuchungen wie 18F-6-Flourodopa-PET und FP-CITSPECT bzw. DAT-Scan® nicht zur Verfügung; diese Untersuchungsmodalitäten sind zudem kostenintensiv und mit Strahlenexposition verbunden. Kostengünstige kraniale CT zeigen wie strahlenexpositionsfreie Standard-MRT des Kopfes keine wegweisenden Veränderungen. In den letzten Jahren wurden deshalb in unterschiedlichen Ansätzen MRTSpezialsequenzen entwickelt, die zur Differenzierung von Probanden, Patienten mit idiopathischen Parkinson-Syndromen und Patienten mit atypischen Parkinson-Syndromen dienen sollen. Die Bildinformationen kamen jedoch überwiegend unter Laborbedingungen zustande, d. h. unter anderem wiesen die Sequenzen lange Scanzeiten auf, die Probanden bzw. Patienten wurden im Scanner immobilisiert und es wurden z. T. aufwendige Einstelltechniken angewandt, abgesehen von einer komplexen Nachbearbeitung der akquirierten Bilddaten. Unter Routinebedingungen im klinischen und praktischen Alltag sind Messungen unter solchen Bedingungen nicht zu realisieren, weshalb diese technischen Fortschritte in der Praxis noch nicht umgesetzt wurden. Die vorliegende Untersuchung ist der Frage nachgegangen, ob modifizierte und unter klinischen Routinebedingungen angewandte Spezialsequenzen in Inversion-Recovery-Technik geeignet sind, gesunde Probanden von Patienten mit idiopathischen Parkinson-Syndromen zu differenzieren. 65 6.2. Methodik Insgesamt wurden 50 Personen untersucht, hierbei handelte es sich um 15 Probanden, die keinerlei relevante Vorerkrankungen aufwiesen, sowie um 35 Patienten. In dieser Gruppe waren 27 Patienten an einem idiopathischen Parkinson-Syndrom erkrankt, acht Patienten hatten parkinsonoide Erkrankungen wie essenziellen Tremor oder atypische Parkinson-Syndrome. Bei allen Personen wurden Protonendichte-Sequenzen und T2-gewichtete axiale Sequenzen in Doppelecho-Technik sowie zwei verschiedene InversionRecovery-Sequenzen angewandt. Die digitalen Bilddaten der Inversion-Recovery-Sequenzen wurden noch einfachen mathematischen Operationen wie Subtraktion, Division und Multiplikation mit einem Bildverstärkungsfaktor unterzogen. Anschließend erfolgte die lineare Vermessung der Substantia nigra sowie die Messung der verschiedenen Signalintensitäten in ROI-Technik. Die Messdaten der Probanden und Patienten wurden mit dem Mann-Whitney-UTest miteinander verglichen. Pro Patient bzw. Proband lagen für die Analyse die Daten von jeweils zwei axialen Schichten der Substantia nigra vor, die dann gemittelt in die Berechnung eingingen. Das Signifikanzniveau wurde bei p < 0,05 festgesetzt. 6.3. Ergebnisse Die Ergebnisse weisen für die Inversion-Recovery-Sequenzen für die unmanipulierten Daten als auch für die Sekundärdaten signifikante Unterschiede der absoluten Signalintensitäten zwischen den idiopathischen ParkinsonSyndromen und dem Normalkollektiv aus, bei den Patienten lagen die absoluten Signalintensitäten signifikant bzw. hoch signifikant über denen des gesunden Kollektivs. Die linearen Vermessungen der Breite der Substantia nigra waren bei Parkinson-Patienten sowohl in den primären Schichten der Inversion-Recovery- 66 Sequenzen (SN1), als auch am manipulierten Datenmaterial (SNsub und SNdiv) signifikant bzw. hoch signifikant geringer als die des Vergleichskollektivs. Zur besseren Vergleichbarkeit der Signalintensitäten wurden SignalintensitätsQuotienten gebildet, aus den als ROId und ROIv gemessenen Einzel-ROI wurde ROIv/d berechnet. Für alle ROIv/d der Inversion-Recovery-Reihe ergaben sich hochsignifikante Differenzen hinsichtlich der Quotienten, sie waren bei an idiopathischen Parkinson-Syndromen Erkrankten geringer als bei Gesunden. Signifikant different war ebenfalls der Quotient Q1 der Fläche der betroffenen Hemisphäre bei einseitiger Ausprägung des Krankheitsbildes zur nicht betroffenen Seite; Q1 war bei Patienten signifikant kleiner als bei gesunden Vergleichspersonen. Die Analysen der Protonendichte-gewichteten Sequenz unterscheiden sich von den Resultaten der Inversion-Recovery-Auswertungen. Für Bv und Bd sowie die Flächenvermessung ergaben sich keine signifikanten Unterschiede zwischen den Gruppen. Signifikante und höchst signifikante Differenzen hinsichtlich der Signalintensitäten ergaben sich in Protonendichte-Wichtung in den Einzel-ROI ROIv und ROId sowie in der Flächen-ROI,die gemessenen Signalintensitäten lagen bei Erkrankten deutlich höher im Vergleich zum Normalkollektiv. 6.4. Schlussfolgerung Die Studie konnte zeigen, dass sich mit Hilfe von Inversion-RecoverySequenzen Gesunde von Patienten mit idiopathischen Parkinson-Syndromen differenzieren lassen, auch wenn die Daten nicht in einem dedizierten MRTSpezialprogramm akquiriert wurden, sondern im Rahmen klinischer Routine ohne Mehraufwand, etwa hinsichtlich der Patientenlagerung im Scanner oder speziellen Einstelltechniken, generiert wurden. 67 Der in früheren Studien postulierte Zusammenhang der neurodegenerativen intrazellulären Prozesse und die Darstellbarkeit in T1-Wichtung bzw. InversionRecovery-Technik durch Signalsteigerungen im erkrankten Gewebe konnte nachvollzogen werden. Hinsichtlich der linearen Vermessungen der Substantia nigra und der Verschmächtigung des Areals stehen die Ergebnisse jedoch im Widerspruch zu den diskutierten neurodegenerativen Gradienten ventrodorsal und lateromedial, was in der vorliegenden Untersuchung zumindest teilweise durch die abweichende bikommissurale Schichtführung und hieraus resultierende Teilvolumeneffekte zu erklären ist. Insgesamt wird die wissenschaftliche Debatte, neurodegenerative Volumenreduktionen bestimmter Kerngebiete bei idiopathischen Parkinson-Syndromen betreffend, hoch kontrovers geführt und in der Literatur finden sich widersprüchliche Studienergebnisse. Die Resultate in Protonendichte-Wichtung differieren von den Erkenntnissen der Inversion-Recovery-Auswertungen, eine neurodegenerative Verschmächtigung der Substantia nigra bei idiopathischen Parkinson-Syndromen ist hieraus also nicht erkennbar; zwar können idiopathische Parkinson-Syndrome signifikant von Probanden abgegrenzt werden, aber das viel diskutierte neurodegenerative Befundmuster der Substantia nigra ist diesbezüglich nicht darstellbar. Insgesamt lassen sich idiopathische Parkinson-Syndrome durch die in dieser Studie angewandten MRT-Techniken von Normalpersonen aus einem Vergleichskollektiv selektieren, aufgrund der teilweise diametralen Ergebnisse dieser Untersuchung im Vergleich der Inversion-Recovery-Technik mit Protonendichte-Sequenzen scheint aber hervorzugehen, dass die betroffenen Gewebe derzeit mit 1,5-Tesla-Geräten noch nicht hinreichend genau aufgelöst werden können, um eine sichere Abgrenzbarkeit zur Minimierung von Fehlmessungen und Teilvolumeneffekten zu gewährleisten. Zudem handelt es sich bei idiopathischen Parkinson-Syndromen nach dem derzeitigen Wissensstand nicht um eine isolierte Beteiligung der Substantia nigra bzw. von 68 Strukturen des Mesenzephalon. Es ist vielmehr davon auszugehen, dass weitere Kerngebiete und funktionelle Systeme betroffen sind, deren Funktionen, Konnektion und Interaktionen noch weitgehend ungeklärt sind. 69 7. Literatur: [1] Adachi, M., Hosoya, T., Haku, T., Yamaguchi, K., Kawanami, T. (1999). Evaluation of the substantia nigra in patients with Parkinsonian syndrome accomplished using multishot diffusion-weighted MR imaging. AJNR Am J Neuroradiol 20 (8), 1500-1506 [2] Ahsan, R. L., Allom, R., Gousias, I. S., Habib, H., Turkheimer, F. E., Free, S., Lemieux, L., Myers, R., Duncan, J. S., Brooks, D. J., Koepp, M. J., Hammers, A. (2007). Volumes, spatial extents and a probabilistic atlas of the human basal ganglia and thalamus. Neuroimage 38 (2), 261-270 [3] Antonini, A., DeNotaris, R. (2004). PET and SPECT functional imaging in Parkinson's disease. Sleep Med 5 (2), 201-206 [4] Antonini, A., Leenders, K. L., Meier, D., Oertel, W. H., Boesiger, P., Anliker, M. (1993). T2 relaxation time in patients with Parkinson's disease. Neurology 43 (4), 697-700 [5] Bartzokis, G., Aravagiri, M., Oldendorf, W. H., Mintz, J., Marder, S. R. (1993). Field dependent transverse relaxation rate increase may be a specific measure of tissue iron stores. Magn Reson Med 29 (4), 459-464 [6] Bartzokis, G., Cummings, J. L., Markham, C. H., Marmarelis, P. Z., Treciokas, L. J., Tishler, T. A., Marder, S. R., Mintz, J. (1999). MRI evaluation of brain iron in earlier- and later-onset Parkinson's disease and normal subjects. Magn Reson Imaging 17 (2), 213-222 [7] Ben-Shachar, D., Eshel, G., Riederer, P., Youdim, M. B. (1992). Role of iron and iron chelation in dopaminergic-induced neurodegeneration: implication for Parkinson's disease. Ann Neurol 32 Suppl, S105-110 70 [8] Benamer, T. S., Patterson, J., Grosset, D. G., Booij, J., de Bruin, K., van Royen, E., Speelman, J. D., Horstink, M. H., Sips, H. J., Dierckx, R. A., Versijpt, J., Decoo, D., Van Der Linden, C., Hadley, D. M., Doder, M., Lees, A. J., Costa, D. C., Gacinovic, S., Oertel, W. H., Pogarell, O., Hoeffken, H., Joseph, K., Tatsch, K., Schwarz, J., Ries, V. (2000). Accurate differentiation of parkinsonism and essential tremor using visual assessment of [123I]-FP-CIT SPECT imaging: the [123I]-FP-CIT study group. Mov Disord 15 (3), 503-510 [9] Berg, D. (2006). Transcranial sonography in the early and differential diagnosis of Parkinson's disease. J Neural Transm Suppl (70), 249-254 [10] Berg, D., Roggendorf, W., Schroder, U., Klein, R., Tatschner, T., Benz, P., Tucha, O., Preier, M., Lange, K. W., Reiners, K., Gerlach, M., Becker, G. (2002). Echogenicity of the substantia nigra: association with increased iron content and marker for susceptibility to nigrostriatal injury. Arch Neurol 59 (6), 999-1005 [11] Bernheimer, H., Birkmayer, W., Hornykiewicz, O., Jellinger, K., Seitelberger, F. (1973). Brain dopamine and the syndromes of Parkinson and Huntington. Clinical, morphological and neurochemical correlations. J Neurol Sci 20 (4), 415-455 [12] Beyer, M. K., Larsen, J. P., Aarsland, D. (2007). Gray matter atrophy in Parkinson disease with dementia and dementia with Lewy bodies. Neurology 69 (8), 747-754 [13] Birkmayer, W., Hornykiewicz, O. (1961). [The L-3,4-dioxyphenylalanine (DOPA)-effect in Parkinson-akinesia]. Wien Klin Wochenschr 73, 787-788 71 [14] Bizzi, A., Brooks, R. A., Brunetti, A., Hill, J. M., Alger, J. R., Miletich, R. S., Francavilla, T. L., Di Chiro, G. (1990). Role of iron and ferritin in MR imaging of the brain: a study in primates at different field strengths. Radiology 177 (1), 59-65 [15] Braak, H., Braak, E. (2000). Pathoanatomy of Parkinson's disease. J Neurol 247 Suppl 2, II3-10 [16] Braak, H., Del Tredici, K., Bratzke, H., Hamm-Clement, J., SandmannKeil, D., Rub, U. (2002). Staging of the intracerebral inclusion body pathology associated with idiopathic Parkinson's disease (preclinical and clinical stages). J Neurol 249 Suppl 3, III/1-5 [17] Braffman, B. H., Grossman, R. I., Goldberg, H. I., Stern, M. B., Hurtig, H. I., Hackney, D. B., Bilaniuk, L. T., Zimmerman, R. A. (1989). MR imaging of Parkinson disease with spin-echo and gradient-echo sequences. AJR Am J Roentgenol 152 (1), 159-165 [18] Brandt T., Dichgans, J., Diener, H. C. (2003). Therapie und Verlauf neurologischer Erkrankungen. Kohlhammer, Stuttgart, 847-851 [19] Brooks, D. J. (1997). Advances in imaging Parkinson's disease. Curr Opin Neurol 10 (4), 327-331 [20] Brooks, D. J. (2000). Morphological and functional imaging studies on the diagnosis and progression of Parkinson's disease. J Neurol 247 Suppl 2, II11-18 [21] Brooks, D. J., Ibanez, V., Sawle, G. V., Quinn, N., Lees, A. J., Mathias, C. J., Bannister, R., Marsden, C. D., Frackowiak, R. S. (1990). Differing patterns of striatal 18F-dopa uptake in Parkinson's disease, multiple 72 system atrophy, and progressive supranuclear palsy. Ann Neurol 28 (4), 547-555 [22] Brooks, D. J., Luthert, P., Gadian, D., Marsden, C. D. (1989). Does signal-attenuation on high-field T2-weighted MRI of the brain reflect regional cerebral iron deposition? Observations on the relationship between regional cerebral water proton T2 values and iron levels. J Neurol Neurosurg Psychiatry 52 (1), 108-111 [23] Brooks, R. A., Vymazal, J., Bulte, J. W., Baumgarner, C. D., Tran, V. (1995). Comparison of T2 relaxation in blood, brain, and ferritin. J Magn Reson Imaging 5 (4), 446-450 [24] Brooks, R. A., Vymazal, J., Goldfarb, R. B., Bulte, J. W., Aisen, P. (1998). Relaxometry and magnetometry of ferritin. Magn Reson Med 40 (2), 227235 [25] Brucke, T., Djamshidian, S., Bencsits, G., Pirker, W., Asenbaum, S., Podreka, I. (2000). SPECT and PET imaging of the dopaminergic system in Parkinson's disease. J Neurol 247 Suppl 4, IV/2-7 [26] Calne, D. B. (1992). The free radical hypothesis in idiopathic parkinsonism: evidence against it. Ann Neurol 32 (6), 799-803 [27] Camicioli, R. M., Hanstock, C. C., Bouchard, T. P., Gee, M., Fisher, N. J., Martin, W. R. (2007). Magnetic resonance spectroscopic evidence for presupplementary motor area neuronal dysfunction in Parkinson's disease. Mov Disord 22 (3), 382-386 [28] Chan, L. L., Rumpel, H., Yap, K., Lee, E., Loo, H. V., Ho, G. L., FookChong, S., Yuen, Y., Tan, E. K. (2007). Case control study of diffusion 73 tensor imaging in Parkinson's disease. J Neurol Neurosurg Psychiatry 78 (12), 1383-1386 [29] Chen, J. C., Hardy, P. A., Clauberg, M., Joshi, J. G., Parravano, J., Deck, J. H., Henkelman, R. M., Becker, L. E., Kucharczyk, W. (1989). T2 values in the human brain: comparison with quantitative assays of iron and ferritin. Radiology 173 (2), 521-526 [30] Chesselet, M. F., Delfs, J. M. (1996). Basal ganglia and movement disorders: an update. Trends Neurosci 19 (10), 417-422 [31] Daniel, S. E., Lees, A. J. (1993). Parkinson's Disease Society Brain Bank, London: overview and research. J Neural Transm Suppl 39, 165-172 [32] Deuschl, G., Raethjen, J., Lindemann, M., Krack, P. (2001). The pathophysiology of tremor. Muscle Nerve 24 (6), 716-735 [33] Dexter, D. T., Carter, C. J., Wells, F. R., Javoy-Agid, F., Agid, Y., Lees, A., Jenner, P., Marsden, C. D. (1989). Basal lipid peroxidation in substantia nigra is increased in Parkinson's disease. J Neurochem 52 (2), 381-389 [34] Dexter, D. T., Wells, F. R., Agid, F., Agid, Y., Lees, A. J., Jenner, P., Marsden, C. D. (1987). Increased nigral iron content in postmortem parkinsonian brain. Lancet 2 (8569), 1219-1220 [35] Dexter, D. T., Wells, F. R., Lees, A. J., Agid, F., Agid, Y., Jenner, P., Marsden, C. D. (1989). Increased nigral iron content and alterations in other metal ions occurring in brain in Parkinson's disease. J Neurochem 52 (6), 1830-1836 74 [36] Dodel, R. (2005). Multisystem-Atrophien. In Oertel, W. H. (Hrsg.). Die Parkinson-Krankheit und atypische Parkinson-Syndrome. Von der Grundlagenforschung zur vernetzten Therapieforschung. Roche, Grenzach-Wyhlen, 62-67 [37] Dooneief, G., Mirabello, E., Bell, K., Marder, K., Stern, Y., Mayeux, R. (1992). An estimate of the incidence of depression in idiopathic Parkinson's disease. Arch Neurol 49 (3), 305-307 [38] Drayer, B., Burger, P., Darwin, R., Riederer, S., Herfkens, R., Johnson, G. A. (1986). MRI of brain iron. AJR Am J Roentgenol 147 (1), 103-110 [39] Drayer, B. P., Olanow, W., Burger, P., Johnson, G. A., Herfkens, R., Riederer, S. (1986). Parkinson plus syndrome: diagnosis using high field MR imaging of brain iron. Radiology 159 (2), 493-498 [40] Duguid, J. R., De La Paz, R., DeGroot, J. (1986). Magnetic resonance imaging of the midbrain in Parkinson's disease. Ann Neurol 20 (6), 744747 [41] Eggert, K. M., Gasser, T., Oertel, W. H., Arnold, G., Baas, H., Dodel, R., Mehdorn, H. M., Przuntek, H., Reichmann, H., Riederer, P., Spieker, S., Trenkwalder, C. (2005). Leitlinie Parkinson-Syndrome. Leitlinien für Diagnostik und Therapie in der Neurologie. H.C. Diener und Komission, Essen [42] Elkeslassy, A., Miaux, Y., Martin-Duverneuil, N., Brunet, E., Savin, D., Chiras, J. (1996). [MRI of degenerative extrapyramidal syndromes. Parkinson disease, progressive supranuclear palsy and multiple system atrophy]. J Neuroradiol 23 (3), 157-163 75 [43] Fahim, S., van Duijn, C. M., Baker, F. M., Launer, L., Breteler, M. M., Schudel, W. J., Hofman, A. (1998). A study of familial aggregation of depression, dementia and Parkinson's disease. Eur J Epidemiol 14 (3), 233-238 [44] Fahn, S., Cohen, G. (1992). The oxidant stress hypothesis in Parkinson's disease: evidence supporting it. Ann Neurol 32 (6), 804-812 [45] Firnau, G., Sood, S., Chirakal, R., Nahmias, C., Garnett, E. S. (1987). Cerebral metabolism of 6-[18F]fluoro-L-3,4-dihydroxyphenylalanine in the primate. J Neurochem 48 (4), 1077-1082 [46] Gai, W. P., Blessing, W. W., Blumbergs, P. C. (1995). Ubiquitin-positive degenerating neurites in the brainstem in Parkinson's disease. Brain 118 ( Pt 6), 1447-1459 [47] Gasser, T. (2000). Autosomal-dominantly inherited forms of Parkinson's disease. J Neural Transm Suppl (58), 31-40 [48] Gasser, T. (2005). Neues in der Genetik des Parkinsonsyndroms. In Oertel, W. H. (Hrsg.). Die Parkinson-Krankheit und atypische Parkinson-Syndrome. Von der Grundlagenforschung zur vernetzten Therapieforschung. Roche, Grenzach-Wyhlen, 3-17 [49] Geng, D. Y., Li, Y. X., Zee, C. S. (2006). Magnetic resonance imagingbased volumetric analysis of basal ganglia nuclei and substantia nigra in patients with Parkinson's disease. Neurosurgery 58 (2), 256-262; discussion 256-262 [50] Gerlach, M., Reichmann, H., Riederer, P. (2007). Die ParkinsonKrankheit. Grundlagen, Klinik, Therapie. Springer, Wien New York 76 [51] Gerlach, M. (2005). Neuroprotektion: Fakt oder Fiktion? In Oertel, W. H. (Hrsg.). Die Parkinson-Krankheit und atypische Parkinson-Syndrome. Von der Grundlagenforschung zur vernetzten Therapieforschung. Roche, Grenzach-Wyhlen, 79-90 [52] German, D. C., Manaye, K., Smith, W. K., Woodward, D. J., Saper, C. B. (1989). Midbrain dopaminergic cell loss in Parkinson's disease: computer visualization. Ann Neurol 26 (4), 507-514 [53] Godau, J., Klose, U., Di Santo, A., Schweitzer, K., Berg, D. (2008). Multiregional brain iron deficiency in restless legs syndrome. Mov Disord 23(8),1184-1187 [54] Goldstein, D. S., Chang, P. C., Smith, C. B., Herscovitch, P., Austin, S. M., Eisenhofer, G., Kopin, I. J. (1991). Dosimetric estimates for clinical positron emission tomographic scanning after injection of [18F]-6fluorodopamine. J Nucl Med 32 (1), 102-110 [55] Golenhofen, K. (1997). Physiologie. Urban & Schwarzenberg, München Wien Baltimore [56] Gorell, J. M., Ordidge, R. J., Brown, G. G., Deniau, J. C., Buderer, N. M., Helpern, J. A. (1995). Increased iron-related MRI contrast in the substantia nigra in Parkinson's disease. Neurology 45 (6), 1138-1143 [57] Graham, J. M., Paley, M. N., Grunewald, R. A., Hoggard, N., Griffiths, P. D. (2000). Brain iron deposition in Parkinson's disease imaged using the PRIME magnetic resonance sequence. Brain 123 Pt 12, 2423-2431 [58] Hirsch, E. C., Brandel, J. P., Galle, P., Javoy-Agid, F., Agid, Y. (1991). Iron and aluminum increase in the substantia nigra of patients with 77 Parkinson's disease: an X-ray microanalysis. J Neurochem 56 (2), 446451 [59] Hirsch, W. L., Kemp, S. S., Martinez, A. J., Curtin, H., Latchaw, R. E., Wolf, G. (1989). Anatomy of the brainstem: correlation of in vitro MR images with histologic sections. AJNR Am J Neuroradiol 10 (5), 923-928 [60] Hu, M. T., Scherfler, C., Khan, N. L., Hajnal, J. V., Lees, A. J., Quinn, N., Wood, N. W., Brooks, D. J. (2006). Nigral degeneration and striatal dopaminergic dysfunction in idiopathic and Parkin-linked Parkinson's disease. Mov Disord 21 (3), 299-305 [61] Hu, M. T., White, S. J., Herlihy, A. H., Chaudhuri, K. R., Hajnal, J. V., Brooks, D. J. (2001). A comparison of (18)F-dopa PET and inversion recovery MRI in the diagnosis of Parkinson's disease. Neurology 56 (9), 1195-1200 [62] Huber, S. J., Chakeres, D. W., Paulson, G. W., Khanna, R. (1990). Magnetic resonance imaging in Parkinson's disease. Arch Neurol 47 (7), 735-737 [63] Hughes, A. J., Ben-Shlomo, Y., Daniel, S. E., Lees, A. J. (1992). What features improve the accuracy of clinical diagnosis in Parkinson's disease: a clinicopathologic study. Neurology 42 (6), 1142-1146 [64] Hughes, A. J., Daniel, S. E., Kilford, L., Lees, A. J. (1992). Accuracy of clinical diagnosis of idiopathic Parkinson's disease: a clinico-pathological study of 100 cases. J Neurol Neurosurg Psychiatry 55 (3), 181-184 [65] Hutchinson, M., Raff, U. (2007). On false negatives in MRI studies of Parkinson disease. Mov Disord 22 (10), 1521-1522 78 [66] Hutchinson, M., Raff, U. (1999). Parkinson's disease: a novel MRI method for determining structural changes in the substantia nigra. J Neurol Neurosurg Psychiatry 67 (6), 815-818 [67] Hutchinson, M., Raff, U. (2000). Structural changes of the substantia nigra in Parkinson's disease as revealed by MR imaging. AJNR Am J Neuroradiol 21 (4), 697-701 [68] Hutchinson, M., Raff, U., Lebedev, S. (2003). MRI correlates of pathology in parkinsonism: segmented inversion recovery ratio imaging (SIRRIM). Neuroimage 20 (3), 1899-1902 [69] Jankovic, J., McDermott, M., Carter, J., Gauthier, S., Goetz, C., Golbe, L., Huber, S., Koller, W., Olanow, C., Shoulson, I., Stern, M., Tanner, C., Weiner, W. (1990). Variable expression of Parkinson's disease: a baseline analysis of the DATATOP cohort. The Parkinson Study Group. Neurology 40 (10), 1529-1534 [70] Koenig, S. H., Brown, R. D., 3rd, Gibson, J. F., Ward, R. J., Peters, T. J. (1986). Relaxometry of ferritin solutions and the influence of the Fe3+ core ions. Magn Reson Med 3 (5), 755-767 [71] Kollensperger, M., Seppi, K., Liener, C., Boesch, S., Heute, D., Mair, K. J., Mueller, J., Sawires, M., Scherfler, C., Schocke, M. F., Donnemilier, E., Virgolini, I., Wenning, G. K., Poewe, W. (2007). Diffusion weighted imaging best discriminates PD from MSA-P: A comparison with tilt table testing and heart MIBG scintigraphy. Mov Disord 22 (12), 1771-1776 [72] Kopell, B. H., Rezai, A. R., Chang, J. W., Vitek, J. L. (2006). Anatomy and physiology of the basal ganglia: implications for deep brain stimulation for Parkinson's disease. Mov Disord 21 Suppl 14, S238-246 79 [73] Kwon, K. Y., Choi, C. G., Kim, J. S., Lee, M. C., Chung, S. J. (2007). Comparison of brain MRI and 18F-FDG PET in the differential diagnosis of multiple system atrophy from Parkinson's disease. Mov Disord 22 (16), 2352-2358 [74] Lang, A. E., Lozano, A. M. (1998). Parkinson's disease. First of two parts. N Engl J Med 339 (15), 1044-1053 [75] Lang, A. E., Lozano, A. M. (1998). Parkinson's disease. Second of two parts. N Engl J Med 339 (16), 1130-1143 [76] Laulumaa, V., Kuikka, J. T., Soininen, H., Bergstrom, K., Lansimies, E., Riekkinen, P. (1993). Imaging of D2 dopamine receptors of patients with Parkinson's disease using single photon emission computed tomography and iodobenzamide I 123. Arch Neurol 50 (5), 509-512 [77] Leenders, K. L., Palmer, A. J., Quinn, N., Clark, J. C., Firnau, G., Garnett, E. S., Nahmias, C., Jones, T., Marsden, C. D. (1986). Brain dopamine metabolism in patients with Parkinson's disease measured with positron emission tomography. J Neurol Neurosurg Psychiatry 49 (8), 853-860 [78] Lilienfeld, D. E., Perl, D. P. (1993). Projected neurodegenerative disease mortality in the United States, 1990-2040. Neuroepidemiology 12 (4), 219-228 [79] Litvan, I., Bhatia, K. P., Burn, D. J., Goetz, C. G., Lang, A. E., McKeith, I., Quinn, N., Sethi, K. D., Shults, C., Wenning, G. K. (2003). Movement Disorders Society Scientific Issues Committee report: SIC Task Force appraisal of clinical diagnostic criteria for Parkinsonian disorders. Mov Disord 18 (5), 467-486 80 [80] Ma, S. Y., Rinne, J. O., Collan, Y., Roytta, M., Rinne, U. K. (1996). A quantitative morphometrical study of neuron degeneration in the substantia nigra in Parkinson's disease. J Neurol Sci 140 (1-2), 40-45 [81] Ma, S. Y., Roytta, M., Rinne, J. O., Collan, Y., Rinne, U. K. (1997). Correlation between neuromorphometry in the substantia nigra and clinical features in Parkinson's disease using disector counts. J Neurol Sci 151 (1), 83-87 [82] Maderwald, S., Ladd, S. C., Gizewski, E. R., Kraff, O., Theysohn, J. M., Wicklow, K., Moenninghoff, C., Wanke, I., Ladd, M. E., Quick, H. H. (2008). To TOF or not to TOF: strategies for non-contrast-enhanced intracranial MRA at 7 T. MAGMA 21 (1-2), 159-167 [83] Marek, K., Innis, R., van Dyck, C., Fussell, B., Early, M., Eberly, S., Oakes, D., Seibyl, J. (2001). [123I]beta-CIT SPECT imaging assessment of the rate of Parkinson's disease progression. Neurology 57 (11), 20892094 [84] Marek, K., Jennings, D., Seibyl, J. (2003). Single-photon emission tomography and dopamine transporter imaging in Parkinson's disease. Adv Neurol 91, 183-191 [85] Martin, W. R., Wieler, M., Gee, M. (2008). Midbrain iron content in early Parkinson disease: a potential biomarker of disease status. Neurology 70 (16 Pt 2), 1411-1417 [86] Matsui, H., Nishinaka, K., Oda, M., Niikawa, H., Kubori, T., Udaka, F. (2007). Dementia in Parkinson's disease: diffusion tensor imaging. Acta Neurol Scand 116 (3), 177-181 81 [87] McDonald, W. M., Richard, I. H., DeLong, M. R. (2003). Prevalence, etiology, and treatment of depression in Parkinson's disease. Biol Psychiatry 54 (3), 363-375 [88] McKeith, I. G., Galasko, D., Kosaka, K., Perry, E. K., Dickson, D. W., Hansen, L. A., Salmon, D. P., Lowe, J., Mirra, S. S., Byrne, E. J., Lennox, G., Quinn, N. P., Edwardson, J. A., Ince, P. G., Bergeron, C., Burns, A., Miller, B. L., Lovestone, S., Collerton, D., Jansen, E. N., Ballard, C., de Vos, R. A., Wilcock, G. K., Jellinger, K. A., Perry, R. H. (1996). Consensus guidelines for the clinical and pathologic diagnosis of dementia with Lewy bodies (DLB): report of the consortium on DLB international workshop. Neurology 47 (5), 1113-1124 [89] McNeill, A., Birchall, D., Hayflick, S. J., Gregory, A., Schenk, J. F., Zimmerman, E. A., Shang, H., Miyajima, H., Chinnery, P. F. (2008). T2* and FSE MRI distinguishes four subtypes of neurodegeneration with brain iron accumulation. Neurology 70 (18), 1614-1619 [90] Michaeli, S., Oz, G., Sorce, D. J., Garwood, M., Ugurbil, K., Majestic, S., Tuite, P. (2007). Assessment of brain iron and neuronal integrity in patients with Parkinson's disease using novel MRI contrasts. Mov Disord 22 (3), 334-340 [91] Minati, L., Grisoli, M., Carella, F., De Simone, T., Bruzzone, M. G., Savoiardo, M. (2007). Imaging degeneration of the substantia nigra in Parkinson disease with inversion-recovery MR imaging. AJNR Am J Neuroradiol 28 (2), 309-313 [92] Mink, J. W. (1996). The basal ganglia: focused selection and inhibition of competing motor programs. Prog Neurobiol 50 (4), 381-425 82 [93] Muller, A., Mungersdorf, M., Reichmann, H., Strehle, G., Hummel, T. (2002). Olfactory function in Parkinsonian syndromes. J Clin Neurosci 9 (5), 521-524 [94] Muller, A., Reichmann, H., Livermore, A., Hummel, T. (2002). Olfactory function in idiopathic Parkinson's disease (IPD): results from crosssectional studies in IPD patients and long-term follow-up of de-novo IPD patients. J Neural Transm 109 (5-6), 805-811 [95] Müller, T. (2002). Medikamentöse Therapie des Morbus Parkinson. Uni-Med, Bremen [96] Nandhagopal, R., McKeown, M. J., Stoessl, A. J. (2008). Functional imaging in Parkinson disease. Neurology 70 (16 Pt 2), 1478-1488 [97] Nicoletti, G., Fera, F., Condino, F., Auteri, W., Gallo, O., Pugliese, P., Arabia, G., Morgante, L., Barone, P., Zappia, M., Quattrone, A. (2006). MR imaging of middle cerebellar peduncle width: differentiation of multiple system atrophy from Parkinson disease. Radiology 239 (3), 825830 [98] Oikawa, H., Sasaki, M., Tamakawa, Y., Ehara, S., Tohyama, K. (2002). The substantia nigra in Parkinson disease: proton density-weighted spinecho and fast short inversion time inversion-recovery MR findings. AJNR Am J Neuroradiol 23 (10), 1747-1756 [99] Olanow, C. W., Watts, R. L., Koller, W. C. (2001). An algorithm (decision tree) for the management of Parkinson's disease: treatment guidelines. Neurology 56 (11 Suppl 5), S1-S88 83 [100] Ordidge, R. J., Gorell, J. M., Deniau, J. C., Knight, R. A., Helpern, J. A. (1994). Assessment of relative brain iron concentrations using T2weighted and T2*-weighted MRI at 3 Tesla. Magn Reson Med 32 (3), 335-341 [101] Paviour, D. C., Thornton, J. S., Lees, A. J., Jager, H. R. (2007). Diffusionweighted magnetic resonance imaging differentiates Parkinsonian variant of multiple-system atrophy from progressive supranuclear palsy. Mov Disord 22 (1), 68-74 [102] Pirker, W. (2003). Correlation of dopamine transporter imaging with parkinsonian motor handicap: how close is it? Mov Disord 18 Suppl 7, S43-51 [103] Pirker, W., Back, C., Gerschlager, W., Laccone, F., Alesch, F. (2003). Chronic thalamic stimulation in a patient with spinocerebellar ataxia type 2. Mov Disord 18 (2), 222-225 [104] Pirker, W., Holler, I., Gerschlager, W., Asenbaum, S., Zettinig, G., Brucke, T. (2003). Measuring the rate of progression of Parkinson's disease over a 5-year period with beta-CIT SPECT. Mov Disord 18 (11), 1266-1272 [105] Poewe, W. (2005). Demenz vom Lewykörper-Typ. In Oertel, W. H. (Hrsg.). Die Parkinson-Krankheit und atypische Parkinson-Syndrome. Roche, Grenzach-Wyhlen, 75-78 [106] Polymeropoulos, M. H., Higgins, J. J., Golbe, L. I., Johnson, W. G., Ide, S. E., Di Iorio, G., Sanges, G., Stenroos, E. S., Pho, L. T., Schaffer, A. A., Lazzarini, A. M., Nussbaum, R. L., Duvoisin, R. C. (1996). Mapping of a 84 gene for Parkinson's disease to chromosome 4q21-q23. Science 274 (5290), 1197-1199 [107] Przuntek, H. (1992). Early diagnosis in Parkinson's disease. J Neural Transm Suppl 38, 105-114 [108] Quattrone, A., Nicoletti, G., Messina, D., Fera, F., Condino, F., Pugliese, P., Lanza, P., Barone, P., Morgante, L., Zappia, M., Aguglia, U., Gallo, O. (2008). MR imaging index for differentiation of progressive supranuclear palsy from Parkinson disease and the Parkinson variant of multiple system atrophy. Radiology 246 (1), 214-221 [109] Raff, U., Hutchinson, M., Rojas, G. M., Huete, I. (2006). Inversion recovery MRI in idiopathic Parkinson disease is a very sensitive tool to assess neurodegeneration in the substantia nigra: preliminary investigation. Acad Radiol 13 (6), 721-727 [110] Raff, U., Rojas, G. M., Huete, I., Hutchinson, M. (2003). Computer assessment of neurodegeneration in Parkinson disease using data fusion techniques with MR images. Acad Radiol 10 (9), 1036-1044 [111] Rajput, A. H., Rozdilsky, B., Rajput, A. (1991). Accuracy of clinical diagnosis in parkinsonism--a prospective study. Can J Neurol Sci 18 (3), 275-278 [112] Ravina, B., Eidelberg, D., Ahlskog, J. E., Albin, R. L., Brooks, D. J., Carbon, M., Dhawan, V., Feigin, A., Fahn, S., Guttman, M., Gwinn-Hardy, K., McFarland, H., Innis, R., Katz, R. G., Kieburtz, K., Kish, S. J., Lange, N., Langston, J. W., Marek, K., Morin, L., Moy, C., Murphy, D., Oertel, W. H., Oliver, G., Palesch, Y., Powers, W., Seibyl, J., Sethi, K. D., Shults, C. 85 W., Sheehy, P., Stoessl, A. J., Holloway, R. (2005). The role of radiotracer imaging in Parkinson disease. Neurology 64 (2), 208-215 [113] Reimer, P., Allkemper, T., Schuierer, G., Peters, P. E. (1996). Brain imaging: reduced sensitivity of RARE-derived techniques to susceptibility effects. J Comput Assist Tomogr 20 (2), 201-205 [114] Riede, U. N, Schäfer, H. E., Werner, M. (1993). Nervensystem. In: Allgemeine und spezielle Pathologie. Thieme Verlag, Stuttgart New York, 1021-1095 [115] Rojas, G. M., Raff, U., Quintana, J. C., Huete, I., Hutchinson, M. (2007). Image fusion in neuroradiology: three clinical examples including MRI of Parkinson disease. Comput Med Imaging Graph 31 (1), 17-27 [116] Rummeny, E. (2006). Ganzkörper-MR-Tomographie. Thieme Verlag, Stuttgart New York [117] Rutledge, J. N., Hilal, S. K., Silver, A. J., Defendini, R., Fahn, S. (1987). Study of movement disorders and brain iron by MR. AJR Am J Roentgenol 149 (2), 365-379 [118] Rutledge, J. N., Schallert, T., Hall, S. (1993). Magnetic resonance imaging in parkinsonisms. Adv Neurol 60, 529-534 [119] Sasaki, M., Shibata, E., Tohyama, K., Takahashi, J., Otsuka, K., Tsuchiya, K., Takahashi, S., Ehara, S., Terayama, Y., Sakai, A. (2006). Neuromelanin magnetic resonance imaging of locus ceruleus and substantia nigra in Parkinson's disease. Neuroreport 17 (11), 1215-1218 86 [120] Sawle, G. V., Playford, E. D., Burn, D. J., Cunningham, V. J., Brooks, D. J. (1994). Separating Parkinson's disease from normality. Discriminant function analysis of fluorodopa F 18 positron emission tomography data. Arch Neurol 51 (3), 237-243 [121] Schenker, C., Meier, D., Wichmann, W., Boesiger, P., Valavanis, A. (1993). Age distribution and iron dependency of the T2 relaxation time in the globus pallidus and putamen. Neuroradiology 35 (2), 119-124 [122] Schmidt, W. J. (1994). Neurotransmitterinteraktionen in den Basalganglien - Bedeutung für die Parkinson-Symptomatik. In Fischer, P.A. (Hrsg.). Parkinson-Krankheit - Bedeutung nichtdopaminerger Funktionsstörungen. Editiones Roches, 3-13 [123] Schocke, M. F., Seppi, K., Esterhammer, R., Kremser, C., Jaschke, W., Poewe, W., Wenning, G. K. (2002). Diffusion-weighted MRI differentiates the Parkinson variant of multiple system atrophy from PD. Neurology 58 (4), 575-580 [124] Schocke, M. F., Seppi, K., Esterhammer, R., Kremser, C., Mair, K. J., Czermak, B. V., Jaschke, W., Poewe, W., Wenning, G. K. (2004). Trace of diffusion tensor differentiates the Parkinson variant of multiple system atrophy and Parkinson's disease. Neuroimage 21 (4), 1443-1451 [125] Semchuk, K. M., Love, E. J., Lee, R. G. (1993). Parkinson's disease: a test of the multifactorial etiologic hypothesis. Neurology 43 (6), 1173-1180 [126] Seppi, K., Rascol, O. (2007). Dementia with Lewy bodies and Parkinson disease with dementia: can MRI make the difference? Neurology 69 (8), 717-718 87 [127] Seppi, K., Schocke, M. F., Esterhammer, R., Kremser, C., Brenneis, C., Mueller, J., Boesch, S., Jaschke, W., Poewe, W., Wenning, G. K. (2003). Diffusion-weighted imaging discriminates progressive supranuclear palsy from PD, but not from the parkinson variant of multiple system atrophy. Neurology 60 (6), 922-927 [128] Shibata, E., Sasaki, M., Tohyama, K., Otsuka, K., Endoh, J., Terayama, Y., Sakai, A. (2008). Use of Neuromelanin-Sensitive MRI to Distinguish Schizophrenic and Depressive Patients and Healthy Individuals Based on Signal Alterations in the Substantia Nigra and Locus Ceruleus. Biol Psychiatry 64(5), 401-406 [129] Sian, J., Dexter, D. T., Lees, A. J., Daniel, S., Agid, Y., Javoy-Agid, F., Jenner, P., Marsden, C. D. (1994). Alterations in glutathione levels in Parkinson's disease and other neurodegenerative disorders affecting basal ganglia. Ann Neurol 36 (3), 348-355 [130] Sofic, E., Paulus, W., Jellinger, K., Riederer, P., Youdim, M. B. (1991). Selective increase of iron in substantia nigra zona compacta of parkinsonian brains. J Neurochem 56 (3), 978-982 [131] Solsberg, M. D., Fournier, D., Potts, D. G. (1990). MR imaging of the excised human brainstem: a correlative neuroanatomic study. AJNR Am J Neuroradiol 11 (5), 1003-1013 [132] Stern, M. B., Braffman, B. H., Skolnick, B. E., Hurtig, H. I., Grossman, R. I. (1989). Magnetic resonance imaging in Parkinson's disease and parkinsonian syndromes. Neurology 39 (11), 1524-1526 88 [133] Sutcliffe, R. L., Meara, J. R. (1995). Parkinson's disease epidemiology in the Northampton District, England, 1992. Acta Neurol Scand 92 (6), 443450 [134] Tanner, C. M., Ben-Shlomo, Y. (1999). Epidemiology of Parkinson's disease. Adv Neurol 80, 153-159 [135] Tatsch, K. (2005). Neuroprotektion: Dopamintransporter-Bildgebung als Surrogatmarker? In Oertel, W. H. (Hrsg.). Die Parkinson-Krankheit und atypische Parkinson-Syndrome. Von der Grundlagenforschung zur vernetzten Therapieforschung. Roche, Grenzach-Wyhlen 91-94 [136] Trepel, M. (1995). Neuroanatomie. Struktur und Funktion. Urban & Schwarzenberg, München Wien Baltimore, 179-186 [137] Van De Graaff, K. (2001). Human Anatomy. McGraw-Hill [138] van Royen, E., Verhoeff, N. F., Speelman, J. D., Wolters, E. C., Kuiper, M. A., Janssen, A. G. (1993). Multiple system atrophy and progressive supranuclear palsy. Diminished striatal D2 dopamine receptor activity demonstrated by 123I-IBZM single photon emission computed tomography. Arch Neurol 50 (5), 513-516 [139] Vymazal, J., Brooks, R. A., Baumgarner, C., Tran, V., Katz, D., Bulte, J. W., Bauminger, R., Di Chiro, G. (1996). The relation between brain iron and NMR relaxation times: an in vitro study. Magn Reson Med 35 (1), 5661 [140] Vymazal, J., Brooks, R. A., Patronas, N., Hajek, M., Bulte, J. W., Di Chiro, G. (1995). Magnetic resonance imaging of brain iron in health and disease. J Neurol Sci 134 Suppl, 19-26 89 [141] Vymazal, J., Brooks, R. A., Zak, O., McRill, C., Shen, C., Di Chiro, G. (1992). T1 and T2 of ferritin at different field strengths: effect on MRI. Magn Reson Med 27 (2), 368-374 [142] Vymazal, J., Hajek, M., Patronas, N., Giedd, J. N., Bulte, J. W., Baumgarner, C., Tran, V., Brooks, R. A. (1995). The quantitative relation between T1-weighted and T2-weighted MRI of normal gray matter and iron concentration. J Magn Reson Imaging 5 (5), 554-560 [143] Vymazal, J., Righini, A., Brooks, R. A., Canesi, M., Mariani, C., Leonardi, M., Pezzoli, G. (1999). T1 and T2 in the brain of healthy subjects, patients with Parkinson disease, and patients with multiple system atrophy: relation to iron content. Radiology 211 (2), 489-495 [144] Vymazal, J., Urgosik, D., Bulte, J. W. (2000). Differentiation between hemosiderin- and ferritin-bound brain iron using nuclear magnetic resonance and magnetic resonance imaging. Cell Mol Biol (Noisy-legrand) 46 (4), 835-842 [145] Vymazal, J., Zak, O., Bulte, J. W., Aisen, P., Brooks, R. A. (1996). T1 and T2 of ferritin solutions: effect of loading factor. Magn Reson Med 36 (1), 61-65 [146] Weishaupt, D. (2006). Wie funktioniert MRI? Eine Einführung in Physik und Funktionsweise der Magnetresonanzbildgebung. Springer, Berlin Heidelberg New York [147] Wenning, G. K., Geser, F., Poewe, W. (2005). Therapeutic strategies in multiple system atrophy. Mov Disord 20 Suppl 12, S67-76 90 [148] Wenning, G. K., Geser, F., Stampfer-Kountchev, M., Tison, F. (2003). Multiple system atrophy: an update. Mov Disord 18 Suppl 6, S34-42 [149] Ye, F. Q., Allen, P. S., Martin, W. R. (1996). Basal ganglia iron content in Parkinson's disease measured with magnetic resonance. Mov Disord 11 (3), 243-249 [150] Yoshikawa, K., Nakata, Y., Yamada, K., Nakagawa, M. (2004). Early pathological changes in the parkinsonian brain demonstrated by diffusion tensor MRI. J Neurol Neurosurg Psychiatry 75 (3), 481-484 [151] Youdim, M. B., Ben-Shachar, D., Riederer, P. (1991). Iron in brain function and dysfunction with emphasis on Parkinson's disease. Eur Neurol 31 Suppl 1, 34-40 [152] Zilles, K. (1994). Funktionelle Neuroanatomie. Springer, Berlin Heidelberg New York 91 8. Danksagung Mein großer Dank gilt Herrn Professor Dr. med. Odo Köster. Von der Entstehung dieser Dissertation bis zur endgültigen Fassung stand Herr Professor Köster mir in freundlicher Weise mit kritischen und wohlwollenden Anregungen stets zur Seite. Herrn Christoph Ilk gebührt mein besonderer Dank für die technische Unterstützung bei der Bedienung des MR-Scanners und des elektronischen Archivs. 9. Lebenslauf Persönliche Daten: Vor- und Zuname: Alexej Titschert Geburtstag: 21.07.1971 Geburtsort: Lünen Staatsangehörigkeit: deutsch Familienstand: verheiratet Schulbildung: 1978 – 1982 Grundschule in Lünen 1982 - 1991 Freiherr-vom-Stein-Gymnasium in Lünen, Abschluss: Abitur Studium: 1993 - 2001 Studium der Humanmedizin an der Ruhr-Universität in Bochum, Abschluss: Staatsexamen Berufstätigkeit: 06/2001 – 12/2002 Arzt im Praktikum am St. Josef-Hospital in Bochum im Institut für Diagnostische und Interventionelle Radiologie 12/2002 – 06/2006 Assistenzarzt am St. JosefHospital in Bochum im Institut für Diagnostische und Interventionelle Radiologie 10/2003 – 09/2004 Assistenzarzt am St. JosefHospital in Bochum in der Neurologischen Klinik „Klinisches Jahr“ 07/2006 – 03/2007 Facharzt für diagnostische Radiologie am St. Josef-Hospital in Bochum im Institut für Diagnostische und Interventionelle Radiologie 04/2007 – 06/2008 Facharzt in der Radiologischen Gemeinschaftspraxis am St. Josef-Hospital in Gelsenkirchen Seit 07/2008 Oberarzt am Evangelischen Krankenhaus in Mülheim im Institut für Diagnostische und Interventionelle Radiologie Weiterbildung: 2001 - 2006 Facharzt für diagnostische Radiologie; Facharztprüfung am 01.07.2006 in Münster Zivildienst: 1992 - 1993 Deutsches Rotes Kreuz in Lünen